Результат интеллектуальной деятельности: ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 2F9-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ЛИЗОСТАФИНУ И ИНГИБИРУЮЩИХ ЕГО ЛИТИЧЕСКУЮ АКТИВНОСТЬ
Вид РИД
Изобретение
Изобретение относится к биотехнологии и может быть использовано для получения моноклональных антител (МКА) к лизостафину.
Лизостафин - цинк зависимая глицил-глициновая эндопептидаза, продуцируемая клетками Staphylococcus simulans, является специфичной для бактерий вида Staphylococcus. aureus. Молекулярный вес лизостафина - 27 кД. Лизостафин разрушает клеточную стенку бактерий S. aureus. Лизостафин не токсичен и слабо иммуногенен для животных и рассматривается как перспективный компонент антибактериальных препаратов для лечения инфекций, вызываемых стафилококками, в частности для лечения эндокардитов, вызванных антибиотикоустойчивыми штаммами S. aureus. Лизостафин - единственный препарат, способный разрушать биопленки бактерий S. aureus и S. epidermidis. Лизостафин активен против всех антибиотикоустойчивых штаммов патогенных стафилококков, включая MRSA-штаммы, и по эффективности превосходит другие противостафилококковые биологические препараты - бактериофаги, бактериоцины и фаговые эндолизины.
Рекомбинантный лизостафин практически не отличается по свойствам от активной формы лизостафина из бактерий S. simulans. Все клинические штаммы S. aureus чувствительны к рекомбинантному лизостафину с МИК от 0,03 до 2 мкг/мл (Bastos М С F, Coutinho В G and Coelho M L V Lysostaphin: A Staphylococcal Bacteriolysin with Potential Clinical Applications Pharmaceuticals 2010, 3, 1139-1161).
Имеются данные о получении гибридом (A1G5A1, A2C1D10 и L1F3), моноклональные антитела которых специфичны к лизостафину и использовались для его очистки с помощью аффинной хроматографии. Известна также гибридома LTN1, продуцирующая МКА к фрагменту лизостафина между 3 и 13 аминокислотами: пептиду (THEHSAQWLN). МКА LTN1 специфически связываются с продуктом гидролиза лизостафина размером 17 кДа (Huang J., Wu H., Zhang J., Huang O. Purification of recombinant lysostaphin by monoclonal antibody affinity chromatography. [Статья на китайском языке] Sheng Wu Gong Cheng Xue Bao 2009 Jan; 25(1): 147-51).
Сведений о гибридомах-продуцентах МКА, ингибирующих литическую активность лизостафина, в доступной литературе нет.
Задача изобретения - получение штамма гибридных культивируемых клеток, продуцирующих моноклональные антитела, специфичные к лизостафину, подавляющие его антистафилакокковую активность и пригодные для количественного определения лизостафина.
Поставленная задача решается тем, что предложен новый штамм гибридных культивируемых клеток животных Mus musculus 2F9 - продуцент моноклональных антител, специфичных к лизостафину, ингибирующих его литическую активность и пригодных для его количественного определения.
Штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ - ОБОЛЕНСК», коллекционный номер - Н-29. Депозитор: Федеральное бюджетное учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ).
Штамм гибридомы получают путем иммунизации мышей линии BALB/c рекомбинантным лизостафином в течение 56 суток. На третьи сутки после последней бустер-инъекции проводят гибридизацию спленоцитов иммунных мышей (108 клеток) с клетками мышиной миеломы РЗ-Х63 Ag/8-653 (107 клеток). В качестве агента для слияния применяют полиэтиленгликоль с молекулярным весом 4000 (Merk, Германия) (Nowinski R.C, Lostrom M.E., Tam M.R., Stone M.R. and Burnette W.N. The isolation of hybrid lines producing monoclonal antibodies against the p 15 (E) protein of ceotropic murine Leukemia viruses. Virology, 1979, 93, 111-126.). После гибридизации проводят селекцию, скрининг, клонирование и криоконсервацию гибридомы.
Характеристика штамма гибридных культивируемых клеток животных Mus musculus 2F9 (гибридомы 2F9).
Морфологическая характеристика. Культура гибридных клеток состоит из слабоприкрепленных к подложке округлых клеток с размером с исходную миеломную клетку.
Культуральные свойства. Культивирование штамма гибридомы 2F9 ведут при температуре 37°C в атмосфере, содержащей 5% углекислого газа. Средой культивирования является среда DMEM или RPMI - 1640, содержащая 10% эмбриональной телячьей сыворотки, 2 мM/L-глутамина, 50 мкг/мл гентамицина. Клетки культивируют в виде стационарной суспензии в пластиковых матрацах "Costar". Пассирование клеток гибридомы проводят 2 раза в неделю с кратностью разведения 1:2 - 1:3. Посевная концентрация клеток составляет 105 в 1 мл среды. Максимальная концентрация гибридных клеток при культивировании составляет 105 на 1 мл среды. Гибридный клон не теряет способности синтеза антител при 10 пассажах in vitro (срок наблюдения).
Культивирование гибридомы в организме животного. Вид животного - инбредные мыши линии BALB/c. Доза клеток при прививке составляет 106 на одну мышь при первичном введении и 105 на одну мышь при вторичном введении. За 14 суток до введения клеток гибридомы мышам внутрибрюшинно вводят 0,5 мл 2,6,10,14-тетраметилпентодекана (пристана). Иммуноасцитическая жидкость образуется на 14-20 сутки в объеме 3-5 мл. Синтез МКА, продуцируемого гибридомой, определяют методом непрямого иммуноферментного анализа (ИФА).
Характеристика полезного продукта. Гибридома 2F9 продуцирует специфичные моноклональные антитела к лизостафину, титр которых составляет в культуральной жидкости (КЖ) 1:1000, в иммуноасцитической жидкости (ИАЖ) 1:100000. Моноклональные антитела из КЖ и ПАЖ выделяют с помощью осаждения сульфатом аммония с последующей аффинной хроматографией на белок A или G сефарозе. Гомогенность выделенных антител проверяется с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия.
Продуктивность штамма. Продукция МКА в среде культивирования составляет 20-50 мкг/мл, в асцитической жидкости - 2-4 мг/мл. Продукция МКА в культуральной жидкости сохраняется на протяжении 10 пассажей (срок наблюдения) и 5 пассажей при культивировании в виде асцитных опухолей на мышах (срок наблюдения)
Контаминация штамма. Контаминанты, включая бактерии, дрожжи, грибы, в гибридной линии не выявлены. Наличие микроплазм и вирусов в гибридоме не определяли.
Криоконсервация. Среда замораживания содержит эмбриональной телячьей сыворотки - 90%, диметилсульфоксида - 10%.
Режим криоконсервации и отогрева. Гибридные клетки вносят в криопробирки, помещают в контейнер из пенопласта с толщиной стенок не менее 1 см и оставляют на 16-24 часа в кельвинаторе при температуре - 70°C и затем опускают в жидкий азот. Размораживание проводят быстро на водяной бане при температуре 37°C. Ампулы содержат 1,0 мл криозащитной среды с концентрацией гибридных клеток 106. Жизнеспособность восстанавливаемых гибридом после криоконсервации составляет 65-75%.
Свойства полезного продукта. Гибридома 2F9 продуцирует моноклональные антитела, относящиеся к IgG1 подклассу иммуноглобулинов мыши. МКА специфичны к нативному и рекомбинантному лизостафину, имеют константу аффинности 1,72×1010 M-1 (Beatty J.D., Beatty B.G., Vlahos W.G. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay. J. Immunol. Methods, 1987, 100, 173-179.), подавляют антистафилококковую активность лизостафина и пригодны для его количественного определения.
Доказательства свойств МКА гибридомы 2F9 представлены на следующих фигурах:
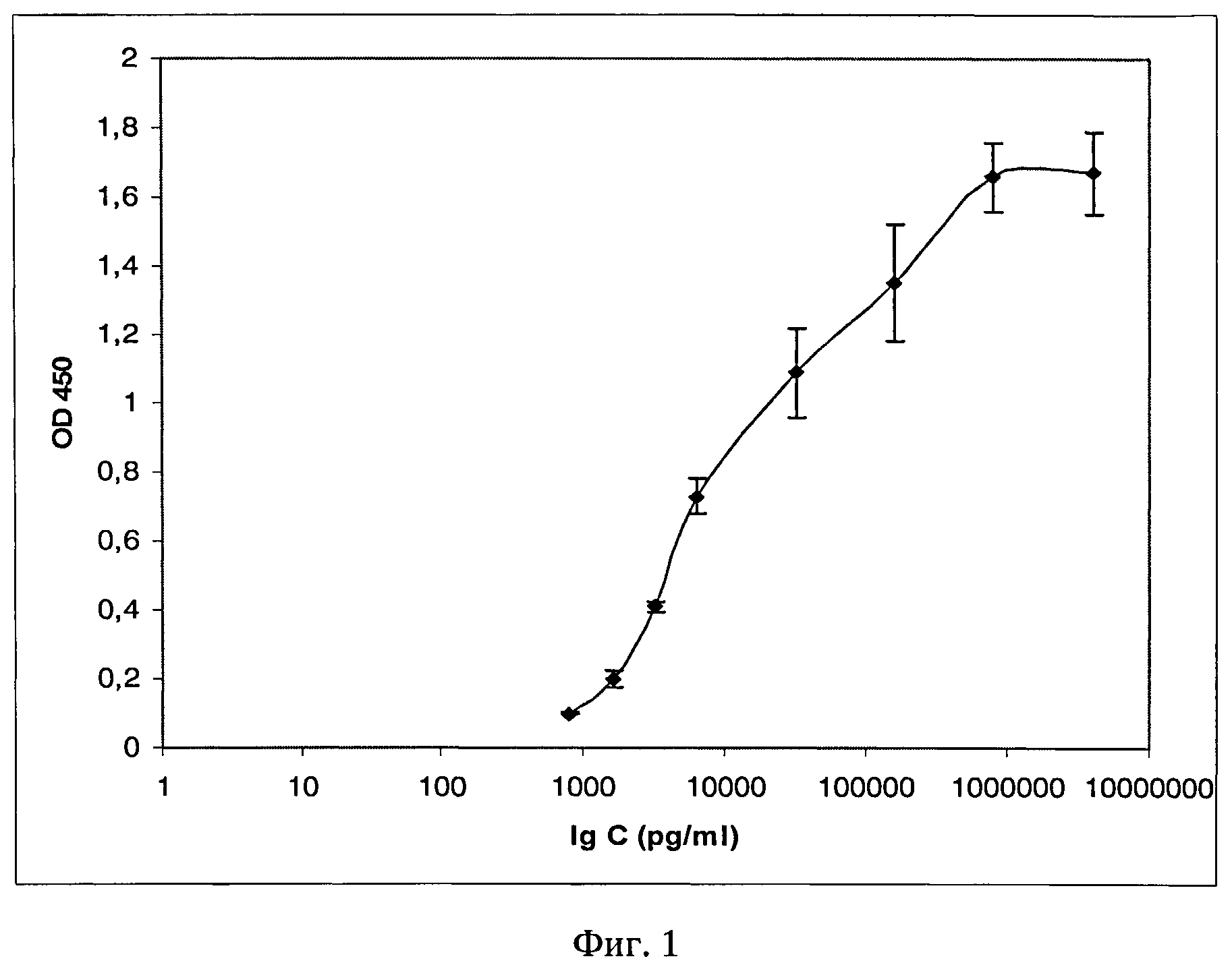
Фиг.1. Твердофазный иммуноферментный анализ для определения лизостафина в анализируемом образце с помощью моноклональных антител гибридомы 2F9.
Фиг.2. Подавление роста культуры S. aureus на плотной питательной среде лизостафином в присутствии МКА гибридом 1F5, 2F9 и 2G10.
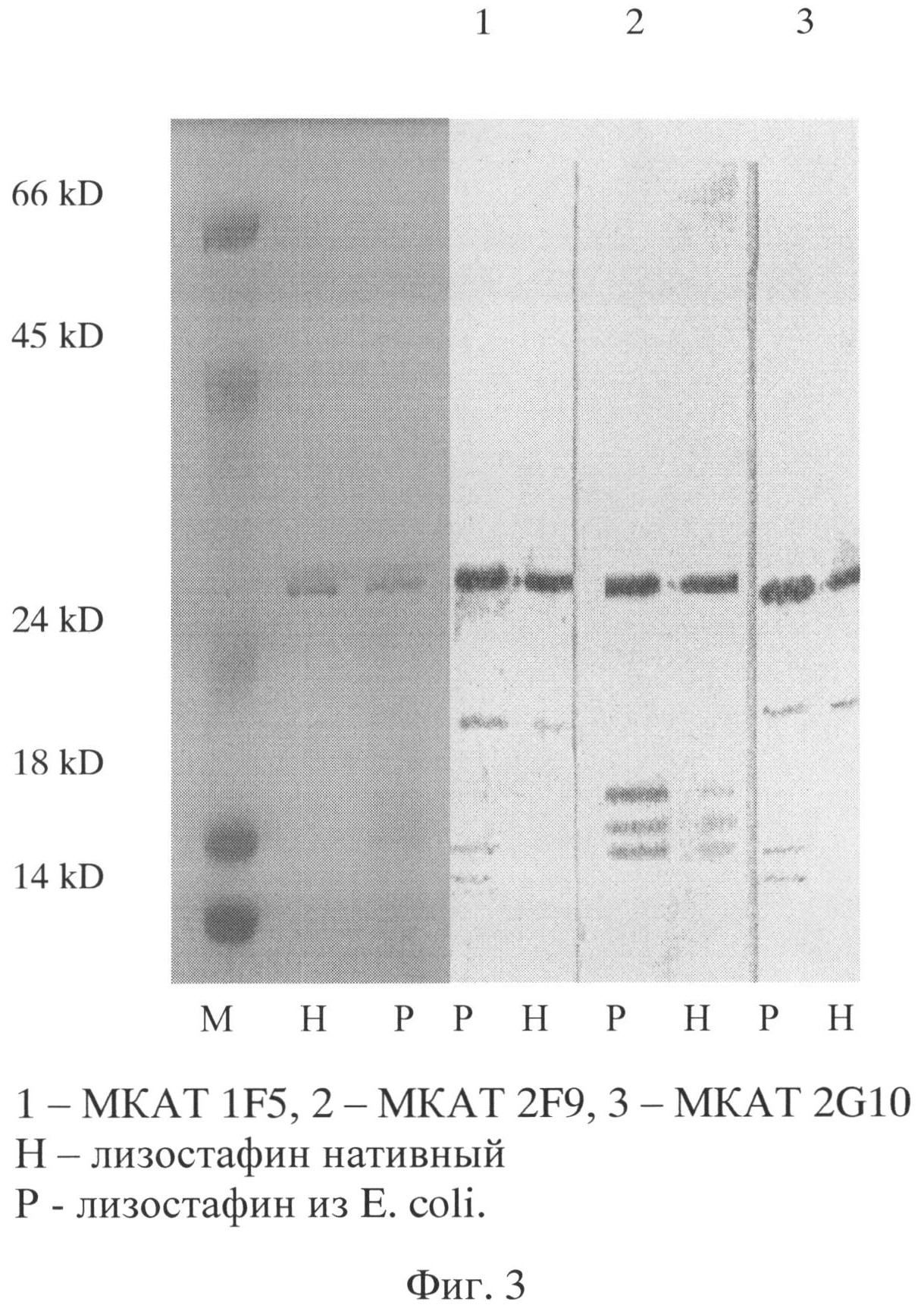
Фиг.3. Иммуноблот моноклональных антител гибридом с препаратами лизостафина.
Пример 1. Получение гибридомы 2F9.
Иммунизацация.
Мышей линии BALB/c иммунизируют препаратом рекомбинантного лизостафина по схеме:
- подкожное введение мышам 200 мкг лизостафина в 4 точки в полном адъюванте Фрейнда;
- через 28 суток повторное введение мышам 100 мкг лизостафина в 4 точки в неполном адъюванте Фрейнда;
- через 28 суток внутривенная инъекция мышам 20 мкг лизостафина в физиологическом растворе.
Кровь у иммунных мышей отбирают на третий день после инъекции лизостафина. Титры специфических антител в сыворотках животных определяют с помощью твердофазного ИФА.
Гибридизация.
Через 3 суток извлекают селезенку мыши и проводят гибридизацию 108 спленоцитов мыши с 107 клетками миеломной линии РЗ-X63-Ag8.653 в присутствии 1 мл 50% раствора полиэтиленгликоля с молекулярным весом 4000 (Merk, Германия) в течение 1 минуты.
Селекция.
После отмывки полиэтиленгликоля клетки высевают на 96-луночные планшеты на слой перитонеальных макрофагов, взятых у мышей линии BALB/c. Селекцию гибридных клеток проводят на селективной среде с содержанием гипоксантина-аминоптерина-тимидина (HAT). Через 21 сутки из среды убирают аминоптерин. В последующем культивирование проводят на среде DMEM "Sigma" с 15% эмбриональной телячьей сыворотки, 2 мМ/L-глутамина, 50 мкг/мл гентамицина.
Скрининг гибридных клонов.
Для отбора положительных гибридных клонов, продуцирующих МКА, используют твердофазный иммуноферментный метод.
Для проведения ИФА в лунки 96-луночной полистиролового планшета для иммуноферментного анализа вносят по 500 нг лизостафина, приготовленного на 0,01 М карбонатном буфере pH 9,6 в объеме 100 мкл и затем выдерживают при температуре 6°C в течение 18 ч. Лунки планшета отмывают забуференным физиологическим раствором, содержащим 0,05% Твина-20 (ЗФР-Тв). Вносят в лунки по 100 мкл 0,5% раствора бычьего сывороточного альбумина (БСА), проверенного на отсутствие пероксидазной активности и инкубируют при температуре 37°С в течение 45 мин. Три раза отмывают ЗФР-Тв и вносят в лунки супернатант культуральной жидкости в объеме 100 мкл. Панель инкубируют при температуре 37°C в течение 1 часа. После этого лунки планшета трижды отмывают раствором ЗФР-Тв и добавляют в лунки антитела против иммуноглобулинов мыши, меченные пероксидазой хрена в рабочем разведении. Планшет инкубируют при температуре 37°C в течение 40 минут, затем 5 раз отмывают лунки раствором ЗФР-Тв и добавляют в лунки по 100 мкл тетраметилбензидина. Реакцию останавливают добавлением в лунки по 50 мкл 2 М серной кислоты. Планшеты сканируют на планшетном ридере Пикон (Россия), измеряя поглощение при 450 нм.
Клонирование.
Клонирование гибридных клеток проводят методом лимитирующих разведений в 96-луночных планшетах на слое перитонеальных ммакрофагов мыши из расчета 104 клеток на лунку. Скрининг клонов проводят твердофазным ИФА, как описано выше.
Культивирование.
Клоны гибридомы культивируют при температуре 37°C в атмосфере, содержащей 5% углекислого газа. Средой культивирования является среда DMEM или RPMI - 1640, содержащая 15% эмбриональной телячьей сыворотки, 2 мM/L-глутамина, 50 мкг/мл гентамицина.
Криоконсервация.
Клоны гибридомы криоконсервируют на среде замораживания, состоящей из эмбриональной сыворотки теленка - 90% и диметилсульфоксида - 10%. Клоны гибридомы хранят в сосудах Дюара с жидким азотом.
Пример 2. Определение количества лизостафина в твердофазном иммуноферментном анализе.
Для проведения твердофазного ИФА в лунки 96-луночного полистиролового планшета для иммуноферментного анализа вносят лизостафин в концентрациях 4 мкг, 800 нг, 160 нг, 32 нг, 6,4 нг, 3,2 нг, 1,6 нг и 0,8 нг в мл 0,01 М карбонатного буфера (pH 9,6) в объеме 100 мкл и выдерживают при температуре 6°C в течение 16 часов. Последующие стадии анализа проводят аналогично стадиям, описанным для скрининга гибридных клонов. Моноклональные антитела вносят в лунки в объеме 100 мкл с концентрацией 5 мкг/мл. Отрицательный контроль - сыворотка интактной мыши в разведении 1/1000.
В ИФА моноклональные антитела гибридомы 2F9 специфически взаимодействуют с лизостафином и определяют до 0,80 нг/мл белка в анализируемом образце (фиг.1).
Пример 3. Ингибирование литической активности лизостафина в суспензии бактерий стафилококка МКА гибридомы 2F9.
Ночную агаровую культуру S. aureus суспендируют в буфере ЗФР. Бактерии инактивируют прогревом суспензии при температуре 80°С в течение 1 час. Прогретую суспензию разводят до мутности, равной оптической плотности 0,32 при длине волны 590 нм.
90 мкл культуральной жидкости гибридом 1F5 и 2F9 смешивают с 10 мкл лизостафина с концентрацией 300 мкг/мл. Смеси инкубируют в течение 1 час при температуре 37°C. После инкубации смеси вносят в 1 мл инактивированной суспензии S. aureus с оптической плотностью 0,32. Реакцию гидролиза клеток стафилококка проводят в течение 1 час при температуре 37°C. После реакции суспензию разводят ЗФР в два раза и измеряют оптическую плотность (таблица 1).
Моноклональные антитела, продуцируемые гибридомой 2F9, в отличие от МКА гибридомы 1F5 подавляют литическое действие лизостафина в инактивированной суспензии бактерий S. aureus (таблица 1).
Пример 4. Ингибрование подавления роста культуры стафилококка на плотной питательной среде лизостафином МКА гибридомы 2F9.
Ночную агаровую культуру S. aureus суспендируют в ЗФР до мутности, равной стандарту оптической плотности 10 единиц. Полученную суспензию разводят в 10 раз ЗФР и 0,2 мл разведенной суспензии равномерно наносят на питательный агар LA, залитый в чашку Петри. Толщина агара - 15 мм. 200 мкл культуральной жидкости гибридом 1F5, 2F9 и 2G10 смешивают с 20 мкл лизостафина с концентрацией 300 мкг/мл. Полученную смесь последовательно разводят двукратно культуральной жидкостью гибридом до концентрации лизостафина 15 и 7,5 мкг/мл. Смеси инкубируют в течение 1 час при температуре 37°C.После инкубации в пробирки титрования лизостафина вносят бумажные фильтры и после их смачивания наносят на агар LA с засеянной культурой стафилококка. Чашки инкубируют 18 ч при температуре 37°C.
Моноклональные антитела, продуцируемые гибридомой 2F9 в отличие от МКА гибридомы 1F5 и 2G10 подавляют бактерицидное действие лизостафина при выращивании бактерий S. aureus на плотной питательной среде (Фиг.2).
Пример 5. Иммуноблот.
Для проверки специфичности МКА гибридомы 2F9 к рекомбинантному лизостафину и лизостафину, продуцируемуму бактериями S. Simulans, проводят СДС-электрофорез белков в 10% полиакриламидном геле (ПААГ) в течение 2 часов при 220 В, 20 мА. Белки из ПААГ переносят на нитроцеллюлозную мембрану (Hybond-P) в течение 1 час при силе тока 380 мА. После завершения переноса мембрану блокируют, погружая в 1% раствор БСА в 20 мМ трис-буфер, pH 7,4 на 1 час при комнатной температуре. Для промывок мембран и приготовления растворов МКА и конъюгата антител против иммуноглобулинов G мыши с пероксидазой хрена используют 20 мМ трис-буфер, pH 7,4, содержащий 150 мМ NaCl и 0,5% твин 20. Блокированные и промытые мембраны разрезают на полосы, содержащие адсорбированные фракции препаратов лизостафина, и инкубируют каждую полосу отдельно в растворах МКА с концентрацией 1 мкг/мл в течение 1 часа при температуре 37°C. Далее, после промывки буфером полоски обрабатывают раствором антимышиных антител конъюгированных с пероксидазой хрена (Sigma) в рабочем разведении при тех же условиях, промывают буфером и окрашивают диаминобензидином с использованием 0,5 мг/мл 3.3′-диаминобензидина с 0,1 мг/мл NiCl2, 0,1 мг/мл CoCl2, 0,03% H2O2 в ЗФР pH 7,2. Реакцию останавливают промывкой дистиллированной водой.
Моноклональные антитела, продуцируемые гибридомой 2F9, по данным иммуноблота взаимодействуют с нативным и рекомбинантным лизостафином (фиг.3). Не ингибирующие литическую активность лизостафина МКА (гибридомы 1F5 и 2G10) выявляют помимо основной полосы лизостафина (27 кД) три дополнительные полосы (23, 18 и 16 кД) у рекомбинантного белка и полосу 23 кД у природного белка, а МКА 2F9 - три дополнительные полосы (21, 19 и 18 кД) как у рекомбинантного, так и у природного белка.
Таким образом, на основании представленных примеров МКА гибридомы 2F9 специфичны к лизостафину и ингибируют его литическую активность. Высокоаффинные МКА гибридомы 2F9 позволяют определять лизостафин в образцах до концентраций 0,8 нг/мл. МКА гибридомы 2F9 могут быть использованы для изучения структурно-функциональных свойств лизостафина и контроля качества препаратов на основе лизостафина.
|