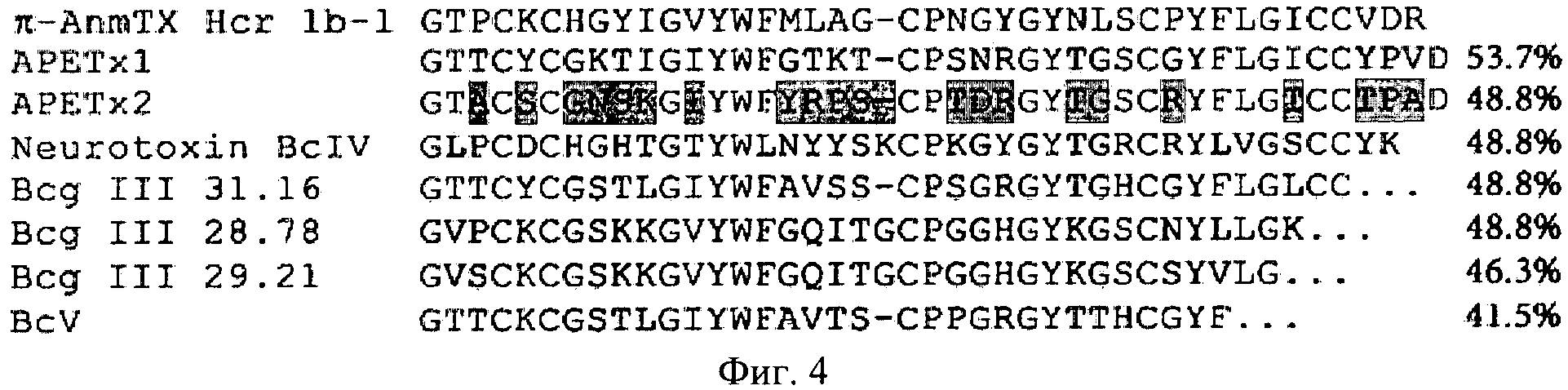Результат интеллектуальной деятельности: ПОЛИПЕПТИД ИЗ МОРСКОЙ АНЕМОНЫ HETERACtis crispa, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, обладающим анальгетическим действием за счет блокады боли, связанной с нарушением функциональной активности болевых ионных каналов и рецепторов. Данные полипептиды представляют собой перспективный инструмент исследования молекулярных механизмов функционирования каналов и рецепторов, ответственных за восприятие, обработку и передачу межклеточных сигналов, в частности болевых, что может найти применение как в научных исследованиях, так и медицине, конкретно в области нейрофармакологии, поскольку эти полипептиды служат основой для конструирования нового поколения высокоспецифичных анальгетиков.
Важную роль во многих патологических процессах играет суперсемейство протонуправляемых Nа+-каналов (ASICs), включающих разнообразные комбинации субъединиц ASIC1a, ASIC1b, ASIC2a и ASIC3 [1]. ASICs каналы экспрессируются многими типами нервных клеток, главным образом, периферическими и сенсорными нейронами центральной нервной системы (ЦНС), в том числе нейронами, чувствительными к болевым стимулам. Эти каналы выполняют важную функцию сигнальной трансдукции при изменении pH в клетке. Большинство типов ASIC каналов ответственно за ощущение боли, сопровождающейся ацидозом ткани при мышечной, сердечной, мозговой ишемии, эпилепсии, различных воспалительных и инфекционных процессах, повреждении роговицы и других патологиях [2.]. Установлено, что одну из ключевых ролей в генерации высокоинтенсивных болевых стимулов и Н+-индуцированных патологических процессов играют ASIC3 каналы [3-5].
В настоящее время набор используемых в практике активных лигандов-модуляторов ASIC3 каналов ограничен в основном амилоридными и нестероидными противовоспалительными средствами, действующими как ингибиторы [6], и нейропептидами млекопитающих FMRF амидами, активирующими ASIC3 каналы [7].
Также в клинической практике для аналгезии используют наркотические анальгетики (морфин и близкие к нему алкалоиды, опиаты) и синтетические низкомолекулярные соединения, обладающие морфиноподобными свойствами; а также ненаркотические анальгетики, включающие синтетические производные салициловой кислоты, анилина, пиразолона и других химических соединений, действующие на молекулярные мишени, отличные от ASIC3.
Общеизвестно, что применение наркотических анальгетиков приводит к привыканию и ослаблению действия, что требует увеличения дозы препарата. При использовании современных ненаркотических анальгетиков также возникают побочные явления, такие как угнетение процессов кроветворения, нефротоксическое и гепатотоксическое действие, вследствие чего необходимо разрабатывать и внедрять селективные анальгетики полипептидной природы.
Ни один из известных обезболивающих препаратов не является абсолютно специфичным при некоторых болевых состояниях, например при нейропатиях, организм больного практически нечувствителен к вышеперечисленным агентам. Важной задачей для раскрытия молекулярных механизмов восприятия боли и, в частности, вовлеченности ASIC3 каналов в патологические процессы (каналопатии различной этиологии) является поиск, получение и использование высокоспецифичных фармакологических инструментов - принципиально новых обезболивающих средств, действующих с минимальными побочными эффектами.
Огромное количество разнообразных полипептидных молекул, обладающих выраженной биологической активностью, обнаружено за последние 25 лет в ядах пресмыкающихся, насекомых, моллюсков, а также кишечнополостных [8-10]. Некоторые полипептидные компоненты ядов не оказывают токсического действия, но селективно модулируют функциональную активность различных типов нейрональных мембранных рецепторов и проявляют тем самым выраженный терапевтический эффект [11]. Принято считать, что в природных ядах можно обнаружить полипептидные биомолекулы, способные специфично модулировать любой тип ионных каналов и рецепторов, в том числе направленно ингибировать функцию передачи болевого сигнала, что может быть использовано для создания эффективных обезболивающих средств.
Так к настоящему времени уже обнаружен один полипептидный токсин из яда тарантула Psalmopoeus cambridgei, Psalmotoxin 1 (PcTx1) [12], который является высокоспецифичным и мощным ингибитором гомомерных каналов типа ASIC1a [13]. Другой полипептидный токсин, APETx2, выделенный впервые из морской анемоны Anthopleura elegantissima, селективно ингибирует гомомерные ASIC3 каналы и с меньшей селективностью - гетеромерные ASIC1a+3, ASIC1b+3 и ASIC2b+3 [4, 5]. Еще один потенциальный анальгетик был выделен и исследован из экстракта морской анемоны Heteractis crispa - полипептид APHC1, обладающий анальгетической активностью [14] благодаря способности частично блокировать ваниллоидный TRPV1-рецептор. Все эти полипептида пока не нашли практического применения.
Изобретение решает задачу расширения арсенала анальгетических лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень, а именно на протонуправляемый ионный канал ASIC3, участвующий в восприятии, обработке и передаче сигналов, связанных с изменением величины рН внеклеточной среды, в ЦНС.
Поставленная задача решается за счет структуры полипептида π-AnmTX Hcr 1b-1, имеющего следующую аминокислотную последовательность:
H2N-Gly1-Thr2-Pro3-Cys4-Lys5-Cys6-His7-Gly8-Tyr9-lle10-Gly11-Val12-Tyr13-Trp14-Phe15-Met16-Leu17-Alal8-Gly19-Cys20-Phe21-Asn22-Gly23-Tyr24-Gly25-Tyr26-Asn27-Leu28-Ser29-Cys30-Phe31-Tyr32-Phe33-Leu34-Gly35-lle36-Cys37-Cys38-Val39-Asp40-Arg41-COOH.
Заявляемый полипептид, обозначенный как π-AnmTX Hcr 1b-1 в соответствии с новой, улучшенной номенклатурой для полипептидов морских анемон [15], состоит из 41 аминокислотного остатка и может быть выделен комбинацией хроматографических методов из морской анемоны Heteractis crispa (фиг.1). Он проявляет анальгетическую активность на млекопитающих (фиг.2) и характеризуется выраженным блокирующим эффектом, оказываемым на кислото-чувствительный ASIC3 канал (фиг.3).
Полная аминокислотная последовательность π-AnmTX Her 1b-1 может быть установлена методом последовательной деградации полипептида. Последовательность, состоящая из 39 аминокислотных остатков, прочитывается деградацией полипептидной цепи по методу Эдмана, последовательность оставшихся двух С-концевых аминокислот определяется с помощью МАЛДИ масс-спектрометрического анализа полипептида, частично фрагментированного экзопротеиназой CPY.
Средняя измеренная молекулярная масса выделенного полипептида π-AnmTX Hcr 1b-1 составляет 4537 Да. Расчетная масса отличается от измеренной на 0.3 Да. Поэтому можно утверждать, что природный токсин не имеет в своем составе модифицированных аминокислотных остатков.
Аминокислотная последовательность π-AnmTX Hcr 1b-1 характеризуется лишь двумя положительно и одним отрицательно заряженными остатками, что отличает ее от APETx2 - полипептида-блокатора ASIC3 канала (фиг.4).
Сравнение аминокислотной последовательности нового полипептида π-AnmTX Hcr 1b-1 с другими известными последовательностями, с использованием алгоритма BLAST [16], приводит к обнаружению семи умеренно гомологичных последовательностей (фиг.4). Среди них три полипептидных токсина Bcg III ХХ.ХХ из морской анемоны Bunodosoma cangicum с неустановленной последовательностью нескольких С-концевых аминокислотных остатков, биологическая мишень которых пока не известна. Кроме того, последовательность π-AnmTX Hcr Her 1b-1 гомологична частичной последовательности полипептида BcV и полноразмерной последовательности паралитического полипептида BcIV из морской анемоны Bunodosoma caissarum, для которых биологическая активность также не установлена [17]. Выявлена также гомология последовательности заявляемого полипептида с двумя детально охарактеризованными токсинами APETx1 и APETx2 из морской анемоны A. elegantissima, специфично ингибирующими калиевый канал HERG и ASIC3 соответственно [18, 19]. Заявляемый полипептид π-AnmTX Hcr 1b-1 имеет не только структурное, но и функциональное сходство с APETx2. Оба полипептида оказывают ингибирующее действие на вызванный изменением рН среды ток через экспрессированные в ооцитах лягушки ASIC3 каналы.
Испытание анальгетической активности заявляемого полипептида π-AnmTX Hcr 1b-1 на модели «уксуснокислых корчей» in vivo показало, что введение препарата полипептида (в дозе 12,5 мкг/100 мкл физраствора) за час до введения кислоты приводит к снижению порога болевой чувствительности экспериментальных животных. Полипептид оказывает аналогичный анальгину анальгетический эффект (фиг.3), при этом его эффективная доза (ЭД50) в 80 раз ниже по величине, чем у анальгина, препарата сравнения. Согласно данным патента анальгетический эффект полипептида APETx2 проявляется в дозе 10 мкМ [20].
Таким образом, π-AnmTX Hcr 1b-1 является вторым природным полипептидом, оказывающим анальгетический эффект, основанный на уменьшении проводимости болевых амилоридчувствительных протонактивируемых ASIC3 каналов. Однако механизм его действия на рецептор ASIC3 отличен от механизма действия первого токсина, что позволяет надеяться на наличие большего терапевтического потенциала новой молекулы. Широкая вовлеченность ASIC3 канала в патологические процессы нейропередачи болевых Н+-индуцированных стимулов позволяет применять заявляемый полипептид в качестве нового анальгетического препарата для лечения каналопатий, связанных с ацидозом тканей, а также для выяснения топологии и молекулярных механизмов функционирования этого канала.
Изобретение иллюстрируют фиг.1-4.
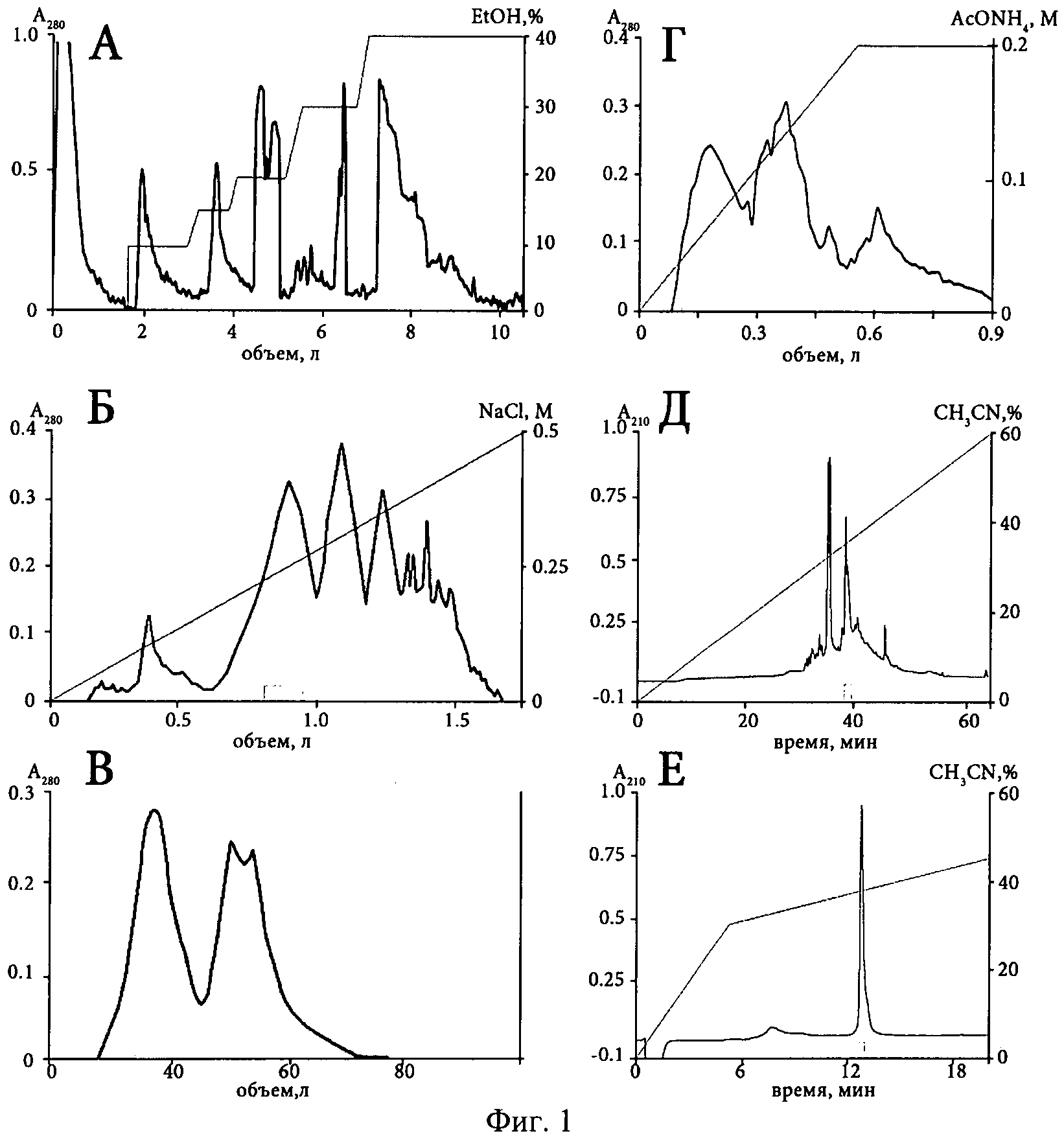
Фиг.1. Основные стадии хроматографического выделения анальгетического полипептида π-AnmTX Hcr 1b-1 из этанольного экстракта H.crispa. (А) Гидрофобная хроматография компонентов на Полихроме-1. (Б) Катионообменная хроматография белковых компонентов на колонке с Cellulose СМ-32. (В) Гель-фильтрация активной белковой фракции на колонке с Biogel Р-6. (Г) Катионообменная хроматография активного пептида на колонке с BioRex 70. Две последние стадии очистки ВЭЖХ (Д) и (Е) на обращенно-фазовой колонках Jupiter С5 и Vydac C18. Время выхода активных фракций и использованные градиенты на каждой стадии выделения обозначены на фиг.1.
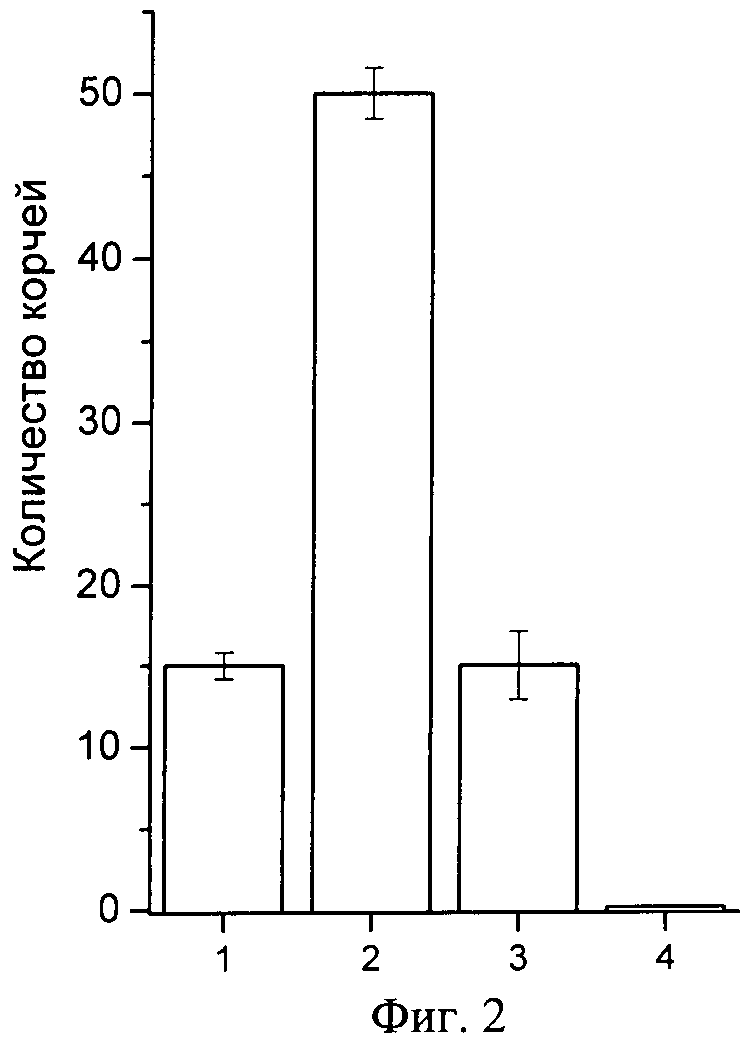
Фиг.2. Анальгетический эффект полипептида π-AnmTX Hcr 1b-1 в тесте кислотной стимуляции боли (модель «уксуснокислых корчей»). По оси абсцисс отложено количество корчей у животного за пятнадцатиминутный период времени с момента инъекции раствора уксусной кислоты. На оси ординат показаны: (1) - контрольная группа животных с предварительной инъекцией препарата сравнения, анальгина; (2) - контрольная группа животных, инъецированных 1%-ным раствором уксусной кислоты; (3) - экспериментальная группа животных, инъецированных 1%-ным раствором уксусной кислоты после предварительной инъекции полипептида π-AnmTX Hcr 1b-1; (4) - контрольная группа животных, инъецированных эквивалентным объемом физраствора. Результаты, обработанные по правилам вариационной статистики с использованием статистического пакета программы MS Office Excel 2007, представляют как средние значения, полученные из шести независимых экспериментов±среднеквадратичное отклонение. Достоверность различий вычисляют t-критерием Стьюдента, достоверным считают значение при p<0,05.
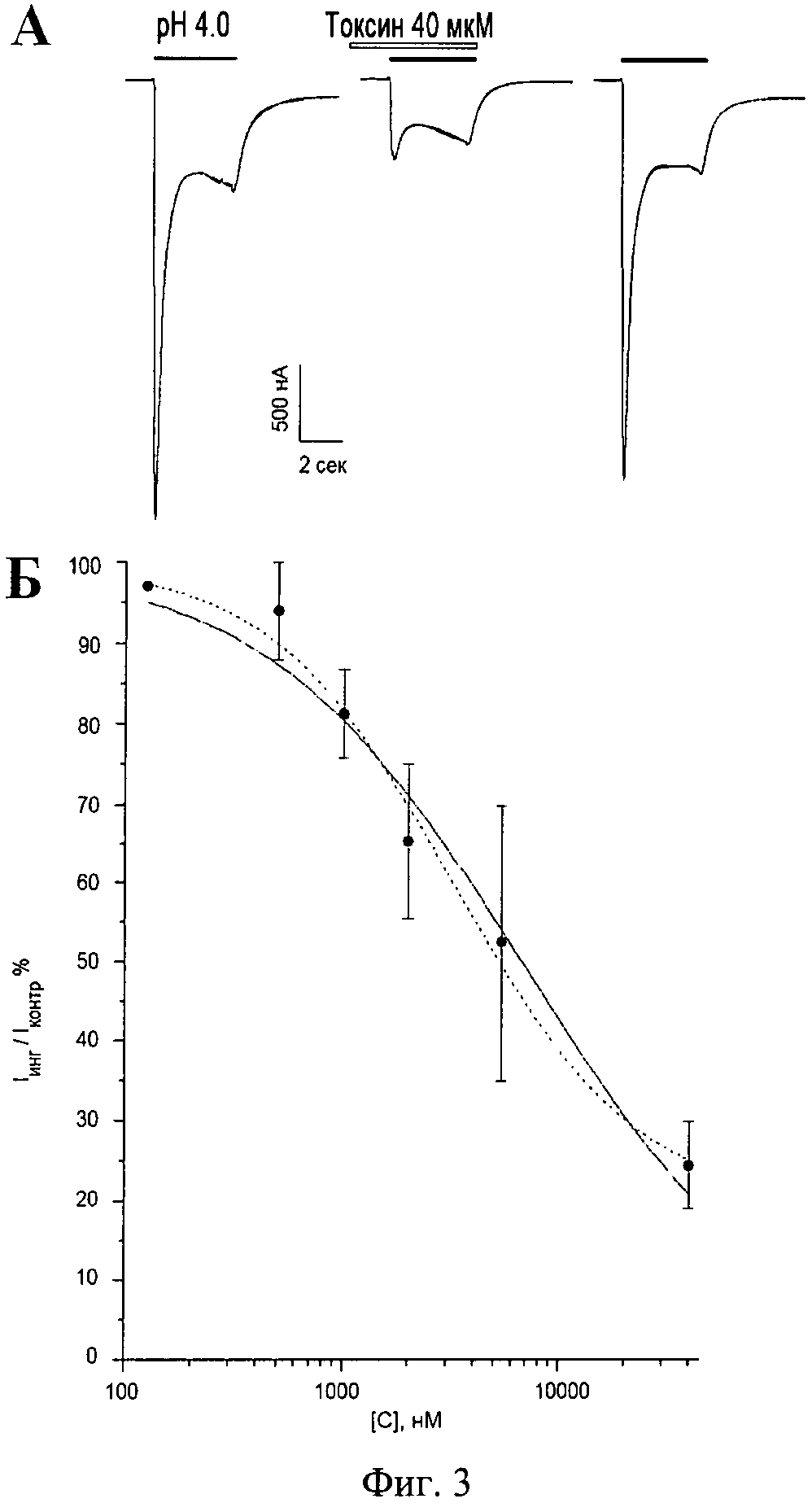
Фиг.3. Ингибирующий эффект полипептида π-AnmTX Hcr 1b-1 на ASIC3 каналы человека, экспрессированные в ооцитах лягушки X. laevis; А - Записи измеренных токов через мембрану клетки, вызываемых изменением рН буфера до значения 4.0. Измеряемые клетки фиксируют при потенциале -50 мВ, скорость потока около 1 мл/мин; Б - Кривая изменения величины пикового компонента тока по сравнению с контролем от концентрации полипептида, построенная по результатам трех независимых измерений. Обычная линия - аппроксимационная кривая при свободном значении коэффициента Хилла (nHill=0.74±0.09), прерывистая линия - при коэффициенте Хилла, равном 1.
Фиг.4. Сравнение аминокислотной последовательности π-AnmTX Hcr 1b-1 и близких структурных гомологов из морских анемон, имеющих один тип пространственной укладки пептидной цепи: Bсg III 31.16, Bcg III 28.78 и Bcg III 29.21 - токсины-модуляторы К+-каналов из B.cangicum (Р86461, Р86462 и Р86464 соответственно); BcIV, BcV - нейротоксины-модуляторы Na+-каналов из B.caissarum (Р84919 и Р86470 соответственно); APETx1 - токсин-модулятор Kv11.1-канала (HERG) (Р61541) и APETx2 - токсин-модулятор ASIC3 канала (Р61542) из A.elegantissima. Идентичные для всех приведенных последовательностей аминокислотные остатки показаны на белом фоне, серым цветом выделены несовпадающие с последовательностью π-AnmTX Hcr 1b-1, темно-серым цветом показаны различающиеся аминокислотные остатки в последовательности функционально родственного полипептидного токсина APETx2. Степень гомологии аминокислотных последовательностей полипептидов, рассчитанная программой BLAST, приведена справа.
Изобретение иллюстрируют примеры 1-5.
Пример 1. Выделение анальгетического полипептида π-AnmTX Hcr 1b-1.
Способ выделения анальгетического полипептида включает следующие стадии (см. фиг.1): (1) экстракцию полипептидов 70%-ным водным этанолом; (2) гидрофобную хроматографию полипептидов на Полихроме-1 (ХромЛаб, Россия) в статическом варианте со скоростью 1200 мл/час, позволяющую сорбировать биологически активные полипептиды морских анемон и не задерживать находящиеся в экстракте в значительных количествах ионогенные примеси и морскую соль, в ступенчатом градиенте этанола от 10 до 40% элюцией активной фракции 15%-ным этанолом; (3) активную 15%-ную фракцию разделяют на катионообменной колонке Cellulose СМ-32 (Whatman, Великобритания), уравновешенной в 0.05 М аммоний-ацетатном буфере (рН 4.5), в линейном градиенте концентрации NaCl (0-0.5 М) при скорости элюции 20 мл/мин; (4) затем компоненты активной фракции разделяют гель-фильтрацией на колонке Biogel Р-6 (Bio-Rad, США) элюцией 0.1 М аммоний-ацетатным буфером (рН 8.6) при скорости потока 8 мл/час; (5) после этого активную фракцию разделяют катионообменной хроматографией на колонке BioRex 70 (Bio-Rad, США), уравновешенной в 0.01 М аммоний-ацетатном буфере (рН 6.0) в линейном градиенте концентрации рабочего буфера (0.01-0.2 М) при скорости элюции 15 мл/час; (6) окончательную очистку полипептида осуществляют ВЭЖХ на обращенно-фазовых сорбентах Jupiter С5 (Phenomenex, США) и Vydac C18 (Grace, США) с использованием линейных градиентов концентрации ацетонитрила от 0 до 60% и от 0 до 44% (v/v), соответственно, в присутствии 0.1% ТФУ (v/v), в результате чего получают гомогенный анальгетический полипептид. Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волны 280 нм. Активность промежуточных фракций подтверждают в биологических тестах на экспериментальных животных или электрофизиологически на каналах ASIC3, экспрессированных в ооцитах лягушки.
Пример 2. Установление аминокислотной последовательности полипептида.
2.1. Алкилирование полипептида 4-винилпиридином по остаткам цистеина проводят перед определением частичной аминокислотной последовательности π-AnmTX Hcr 1b-1. Полипептид растворяют в 40 мкл раствора, содержащего 6 М гуанидингидрохлорид и 3 мМ ЭДТА, и инкубируют при 45°C в течение ночи. Затем раствор охлаждают и дегазируют в ультразвуковой бане, добавляют 2 мкл 1.4 М раствора дитиотреитола в 100 мМ трис-HCl буфере (рН 7.5) и выдерживают при 37°C в течение 4 часов. Тиольные группы цистеина алкилируют добавлением 2 мкл 10% 4-винилпиридина в метаноле в течение 15 мин при комнатной температуре в темноте. Модифицированный полипептид разводят в 300-500 мкл 0.1% ТФУ и обессоливают на обращенно-фазовой колонке Luna C18 (Phenomenex, США) 3×150 мм, применяя линейный или ступенчатый градиент концентрации ацетонитрила.
2.2. N-Концевую аминокислотную последовательность определяют по методу Эдмана на автоматическом секвенаторе белков Precise модели 492 (Applied Biosystems, США) с использованием протокола производителя.
2.3. C-Концевую аминокислотную последовательность определяют масс-спектрометрически после анализа сдвига молекулярных масс алкилированного полипептида, растворенного в 50 мМ растворе MES (рН 6.8), после инкубации в течение 0.5, 1 и 2 часов с экзопротеиназой CPY (КФ 3.4.16.5, Sigma-Aldrich, США).
2.4. Концентрацию белка в пробах определяют по спектру поглощения в 1 см кювете на спектрофотометре Hitachi U3210 (Япония).
2.5. Гомологию последовательностей полипептидов определяют, используя аминокислотные последовательности, полученные поиском из белковых баз данных по алгоритму BLAST (программа http://www.ncbi.nlm.nih-gov/). Множественное выравнивание и процент гомологии рассчитывают программой ClustalW (http://www.caos.kun.nl/cammsa/CLUSTALW/clustalw.html).
2.6. Индивидуальность и молекулярную массу очищенного полипептида и его фрагментов определяют на времяпролетном масс-спектрометре MALDI Ultraflex TOF-TOF (Bruker Daltonics, Германия) или MALDI-LR (Micromass, Великобритания), используя в качестве матричных растворов: 2,5-дигидроксибензойную кислоту (10 мг/мл в 70% CH3CN, содержащем 0.1% ТФУ) или α-циано-4-гидроксикоричную кислоту (10 мг/мл в 50% CH3CN, содержащем 0.1% ТФУ). Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США). Спектры регистрируют в режиме детекции положительных ионов в прямом или рефлекторном режимах.
Пример 3. Электрофизиологические измерения модулирующего действия полипептида.
3.1. Каналы ASIC3 получают в результате их экспрессии в мембранах ооцитов лягушки Xenopus laevis. Для этого выделенные из яичника самки ооциты обрабатывают коллагеназой типа I или типа II (Sigma-Aldrich, США) в концентрации 1 мг/мл в течение 2 часов для снятия фолликулярной оболочки. Дефолликулированные ооциты помещают в стерильную среду ND96 (NaCl 96 мМ, КСl 2 мМ, CaCl2 1.8 мМ, MgCl2 1 мМ, HEPES 5 мМ титрованный NaOH до значения рН 7.8) и выдерживают ночь при температуре 15-16°C. Инъекцию 2.5-10 нг мРНК канала ASIC3 человека (AJ272063) производят под бинокулярным микроскопом МБС-10 (Россия) с помощью микроинъектора Eppendorf 5242 (Германия).
3.2. Измерение ионных токов через ASIC3 каналы проводят при частоте 100 Гц методом двухэлектродной фиксации мембранного потенциала, используя усилитель GeneClamp 500 (Axon Instruments, США) в рабочей камере со свободным объемом 75 мкл. Измерение осуществляют через 3 дня инкубации ооцитов после инъекции мРНК в стерильной среде ND96 с добавлением 50 мкг/мл гентамицина и 5 мМ пирувата при температуре 17-19°C. Измерение тока проводят в ламинарном потоке раствора ND96 (рН 7.8) со скоростью 1 мл/мин. ASIC3 каналы активируют резким изменением рН среды от 7.8 до 4.0 за счет быстрой замены рабочего раствора в камере на раствор со значением рН 4.0, в котором в качестве буфера вместо 5 мМ HEPES применяют 10 мМ уксусную кислоту. Регистрируемый ток, вызванный закислением внеклеточной среды, состоит из быстрой (пиковой) и медленной (стационарной) компоненты и соответствует ранее опубликованным результатам экспериментов [21]. Для уменьшения неспецифического связывания с каналом навески тестируемых образцов растворяют в буферных растворах, содержащих 0.1% BSA. Аппликацию тестируемого образца начинают за 5 сек до подачи в измерительную камеру активационного буфера и продолжают в его присутствии (фиг.3A). Процент ингибирования наблюдаемых токов вычисляют как отношение пиковой амплитуды тока при аппликации токсина к усредненной амплитуде пика контрольных токов до и после аппликации токсина.
Пример 4. Тестирование анальгетической активности полипептида.
Для оценки антиноцицептивной активности препарата ингибитора используют тест, основанный на сомато-сенсорных реакциях экспериментальных животных, вызываемых химическим раздражителем. Критерием реакции на болевое раздражение является развитие произвольных сокращений брюшных мышц - "корчей", позволяющее определить периферический компонент анальгетического действия. Тестирование проводят согласно этическим требованиям к исследованиям экспериментальной боли у животных с сохранением сознания, которые были утверждены Комитетом по экспериментальным исследованиям и этическим проблемам Международной Ассоциации изучения боли.
Тестирование анальгетической активности проводят по стандартной методике стимуляции боли [22] 1%-ным раствором уксусной кислоты (тест «уксуснокислые корчи»), основанной на подсчете корчей, вызываемых внутрибрюшинной инъекцией кислоты экспериментальным животным. Внутрибрюшинное введение химического раздражителя приводит к общей активации ноцицептивной системы: местному высвобождению брадикинина, гистамина, серотонина, простагландинов и лейкотриенов, что приводит к развитию самопроизвольных сокращений брюшных мышц живота - "корчей", чередующихся с их расслаблением, которые сопровождаются вытягиванием задних конечностей и выгибанием спины.
Корчи у экспериментальных самцов белых беспородных мышей массой 20-22 г вызывают однократным внутрибрюшинным введением 100 мкл раствора 1% уксусной кислоты и регистрируют их количество в течение 15 минут с момента инъекции. Образцы тестируемых препаратов полипептида и анальгина, применяемого в качестве препарата сравнения, растворяют в стерильном физиологическом растворе и вводят животным по 100 мкл раствора внутрибрюшинно за 1 час до введения раствора уксусной кислоты. Экспериментальных мышей делят на 4 группы по 6 животных в каждой: 1-я группа - животные, инъецированные контрольным препаратом сравнения (профилактическое введение анальгина в дозе 50 мг/кг (100 мкл) за 1 час перед введением уксусной кислоты); 2-я группа - нелеченные животные (инъецированные 1%-ной уксусной кислотой (100 мкл)); 3-я группа - животные, леченные исследуемым препаратом (профилактическое введение препарата полипептида (100 мкл) за 1 час перед введением раствора 1%-ной уксусной кислоты); 4-я группа - контрольные животные, инъецированные эквивалентным объемом физиологического раствора. Регистрацию количества корчей проводят на протяжении 15 минут с момента инъекции раствора уксусной кислоты.
Анальгетический эффект определяют по уменьшению количества корчей у животного за пятнадцатиминутный интервал времени, прошедшего от момента инъекции раствора уксусной кислоты. Всасывание препарата полипептида, введенного за 1 час до инъекции кислоты, приводит к быстрому анальгетическому эффекту.
Во 2 группе нелеченных животных среднее количество корчей составляет 50. Применение анальгина и исследуемого полипептида сокращает количество корчей в группах 1 и 3 до 15. Таким образом, согласно тесту «уксуснокислых корчей», характеризующему висцеральный и воспалительный типы болей, введение препарата полипептида способствует достоверному повышению порога боли (приводит к снижению болевой чувствительности животных). Достоверный анальгетический эффект полипептида в дозе 625,0 мкг/кг проявляется в снижении количества корчей от контрольного, вызванного введением химического раздражителя, в три раза (фиг.3). При этом сравнимое с анальгином обезболивающее действие полипептида проявляется в дозе, в 80 раз меньшей дозы анальгина. Результаты обрабатывают статистически, достоверность отличий результатов контрольных и экспериментальной групп вычисляют t-критерием Стьюдента, достоверным считают значение при p<0,05.
Литература
1. Krishtal О. The ASICs: signaling molecules? Modulators? // Trends Neurosci. 2003. V.26. P.477-483.
2. Ugawa S., Ueda Т., Ishida Y., Nishigaki M., Shibata Y., Shimada S. Amiloride-blockable acid-sensing ion channels are leading acid sensors expressed in human nociceptors // J. Clin. Invest. 2002. V.110, P.1185-1190.
3. Deval E., Noel J., Lay N., Alloui A., Diochot S., Friend V., Jodar M., Lazdunski M., Lingueglia E. ASIC3, a sensor of acidic and primary inflammatory pain // Embo J. 2008. V.27, P.3047-3055.
4. Deval E., Gasull X., Noel J., Salinas M., Baron A., Diochot S., Lingueglia E. Acid-sensing ion channels (ASICs): pharmacology and implication in pain // Pharmacol. Ther. 2010. V.128, P.549-558.
5. Deval E., Noel J., Gasull X., Delaunay A., Alloui A., Friend V., Eschalier A., Lazdunski M., Lingueglia E. Acid-sensing ion channels in postoperative pain // J. Neurosci. 2011. V.31, P.6059-6066.
6. Voilley N., de Weille J., Mamet J., Lazdunski M. Nonsteroid anti-inflammatory drugs inhibit both the activity and the inflammation-induced expression of acid-sensing ion channels in nociceptors // J. Neurosci. 2001. V.21, P.8026-8033.
7. Lingueglia E., Deval E., Lazdunski M. FMRFamide-gated sodium channel and ASIC channels: a new class of ionotropic receptors for FMRFamide and related peptides // Peptides. 2006. V.27, P.1138-52.
8. Kozlov S., Malyavka A., McCutchen В., Lu A., Schepers E., Herrmann R., Grishin E. A novel strategy for the identification of toxinlike structures in spider venom // Proteins. 2005. V.59. P.131-140.
9. Василевский А.А, Козлов C.A., Гришин E.B. Молекулярное разнообразие яда пауков // Успехи биол. химии. 2009. Т.49, С.211-274.
10. Fry B.G., Roelants К., Champagne D.E., Scheib Н., Tyndall J.D., King G.F., Nevalainen T.J., Norman J.A., Lewis R.J., Norton R.S., Renjifo C., Rodriguez de la Vega R.C. The Toxicogenomic Multiverse: Convergent recruitment of proteins into animal venoms // Annu. Rev. Genomics Hum. Genet. 2009. V.10, P.483-511.
11. Dutertre S. and Lewis R.J. Use of Venom Peptides to Probe Ion Channel Structure and Function // J. Biol. Chem. 2010. V.285, N.18. P.13315-13320.
12. Escoubas P., De Weille J.R., Lecoq A., Diochot S., Waldmann R., Champigny G., Moinier D., Menez A., Lazdunski M. Isolation of a tarantula toxin specific for a class of proton-gated Na+channels // J. Biol. Chem. 2000a. V.275, P.25116-25121.
13. Chen X., Kalbacher H., Grunder S. The Tarantula Toxin Psalmotoxin 1 Inhibits Acid-sensing Ion Channel (ASIC) la by Increasing Its Apparent H+Affinity // J. Gen. Physiol. 2005. V.126. P.71-79.
14. Козлов С.Л., Андреев Я.А., Кошелев С.Г., Иванова Е.А., Лейченко Е.В., Козловская Э.Л., Гришин Е.В. Полипептид актинии, обладающий анальгетическим действием. RU 2368621 C1, 27.09.2009.
15. Kozlov S. and Grishin Е. Convenient nomenclature of cysteine-rich polypeptide toxins from sea anemones // Peptides. 2012. (in press).
16. Altschul S.F., Madden T.L., Schaffer A.A., Zhang J., Zhang Z., Miller W., Lipman D.J. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs // Nucleic Acids Res. 1997. V.25, P.3389-3402.
17. Oliveira J.S., Zaharenko A.J., Ferreira W.A.Jr., Konno K., Shida C.S., Richardson M., Lucio A.D., Beirao P.S., de Freitas J.C. BcIV, a new paralyzing peptide obtained from the venom of the sea anemone Bunodosoma caissarum. A comparison with the Na+-channel toxin Belli // Biochim. Biophys. Acta. 2006. V.1764, P.1592-1600.
18. Diochot S., Loret E., Bruhn Т., Beress L., Lazdunski M. APETxl, a new toxin from the sea anemone Anthopleura elegantissima, blocks voltage-gated human ether-a-go-go-related gene potassium channels // Mol. Pharmacol. 2003. V.64, P.59-69.
19. Diochot S., Baron A., Rash L.D., Deval E., Escoubas P., Scarzello S., Salinas M., Lazdunski M. A new sea anemone peptide, APETx2, inhibits ASIC3, a major acid-sensitive channel in sensory neurons // EMBO J. 2004. V.23, P.1516-1525.
20. Deval E., Diochot S., Lazdunski M., Lingueglia E., Noel J. Analgetic effect of peptide toxin APETx2. US 20110152197, 23.06.2011.
21. Waldmann R., Bassilana F., de Weille J., Champigny G., Heurteaux C., Lazdunski M. Molecular cloning of a non-inactivating proton-gated Na+-channel specific for sensory neurons // J. Biol. Chem. 1997. V.272, P.20975-20978.
22. Шварц Г.Я. и Сюбаев Р.Д. Методические рекомендации по экспериментальному (доклиническому) изучению новых нестероидных противовоспалительных препаратов. // Ведомости Научного центра экспертизы и госконтроля лекарственных средств МЗ РФ. 2000. №1. С.44-50.
Полипептид из морской анемоны Heteractis crispa, обладающий анальгетическим действием (π-AnmTX Her 1b-1), имеющий следующую аминокислотную последовательность:HN-Gly-Thr-Pro-Cys-Lys-Cys-His-Gly-Tyr-lle-Gly-Val-Tyr-Trp-Phe-Met-Leu-Ala-Gly-Cys-Phe-Asn-Gly-Tyr-Gly-Tyr-Asn-Leu-Ser-Cys-Phe-Tyr-Phe-Leu-Gly-lle-Cys-Cys-Val-Asp-Arg-COOH.