Результат интеллектуальной деятельности: Способ подавления роста опухолей генно-модифицированным вариантом цитокина TRAIL
Вид РИД
Изобретение
Область, к которой относится изобретение
Изобретение относится к медицине, фармацевтике, а именно к онкологии, для подавления роста колоректального рака с помощью рекомбинантного белкового препарата модифицированного варианта цитокина TRAIL DR5-B, мишенью которого является расположенный на клеточной поверхности рецептор смерти TRAIL (обозначенный в описании как DR5). DR5-B при связывании с рецептором DR5 вызывает апоптотическую гибель опухолевых клеток, не повреждая при этом нормальные клетки.
Уровень техники
Цитокин TRAIL (TNF related apoptosis inducing ligand) индуцирует апоптоз в трансформированных клеточных линиях, не оказывая воздействия на нормальные клетки. TRAIL представляет собой полипептид, состоящий из 281 аминокислотного остатка и является трансмембранным белком II типа, С-конец которого находится на внеклеточной поверхности. Установлено, что внеклеточный домен лиганда TRAIL может расщепляться металлопротеиназами и в небольших количествах присутствовать в растворимой форме в крови человека. Как и другие члены семейства фактора некроза опухоли (ФНО), белок TRAIL образует гомотримерную молекулу, которая связывается с соответствующими рецепторами смерти, инициируя каскад сигналов. Способность лиганда TRAIL индуцировать апоптоз главным образом опухолевых клеток, оказывая незначительное воздействие на нормальные клетки, делает его потенциально ценным кандидатом для применения в лечении злокачественных новообразований. Возможный спектр применения противоопухолевой терапии с использованием агонистов рецепторов смерти TRAIL очень широк, так как почти во всех типах опухолей экспрессируются рецепторы смерти TRAIL.
В настоящее время идентифицированы по меньшей мере пять рецепторов TRAIL, из которых два, а именно DR4 (рецептор смерти 4, TRAIL-R1) и DR5 (рецептор смерти 5, TRAIL-R2), обладают способностью трансдуцировать сигнал апоптоза, а три других рецептора (TRAIL-R3, TRAIL-R4 и растворимый OPG) блокируют TRAIL-опосредуемый апоптоз, в связи с чем они получили название «рецепторов -ловушек».
Несмотря на то, что рекомбинантный препарат TRAIL (лекарственное название Dulanermin) продемонстрировал высокую противоопухолевую активность в ряде экспериментальных исследований, его терапевтический эффект в клинических испытаниях ограничивался частичными ответами или стабилизацией заболевания. Таким образом, существует потребность создания специфических агонистов к DR5, которые будут с индуцировать гибель опухолевых клеток и подавлять рост опухолей для лечения соответствующих заболеваний.
К сегодняшнему дню в зарубежных лабораториях было получено несколько DR5-специфических мутантных вариантов TRAIL. Известен способ получения мутантного варианта TRAIL DR5-8 с шестью заменами аминокислотных остатков, который связывается с рецептором смерти DR5, не проявляя аффинности к рецептору смерти DR4 (Kelley F.R. et al. Receptor-selective mutants of Apo2L/TRAIL reveal a greater contribution of DR5 than DR4 to apoptosis signaling. J. Biol. Chem., 2005, Vol. 280, pp. 2205-2212). Известен другой мутантный вариант TRAIL с двумя заменами аминокислотных остатков (D269H/E195R) с пониженной аффинностью к рецептору DR4 (Van der Sloot A.M. et al. Designed tumor necrosis factor-related apoptosis-inducing ligand variants initiating apoptosis exclusively via the DR5 receptor. Proc. Natl. Acad. Sci. USA, 2006, V. 103, pp. 8634-8639). Противоопухолевая активность этого варианта, тестированная на модели ксенографта рака яичников человека А2780 у иммунодефицитных мышей, практически не отличалась от препарата TRAIL дикого типа. Тем не менее, препарат мутантного варианта TRAIL D269H/E195R совместно с цисплатином эффективнее ингибировал рост ксенографтов опухолей человека у животных. (Duiker E.W. et al. Enhanced antitumor efficacy ofa DR5specific TRAIL variant over recombinant human TRAIL in a bioluminescent ovarian cancer xenograft model. Clin. Cancer Res., 2009, Vol. 15, pp. 2048-2057).
Недостатком известных мутантных вариантов TRAIL является их высокая аффинность к рецепторам ловушкам TRAIL DcR1 и DcR2, которые не только не проводят сигнал апоптоза, но и ингибируют цитотоксическую активность цитокина. Такие мутантные варианты могут эффективнее тормозить рост только тех опухолей, в которых экспрессия рецепторов ловушек отсутствует. Однако известно, что рецепторы ловушки экспрессируются в большинстве видов опухолевых клеток. Поэтому, для повышения противоопухолевой активности TRAIL необходимо получить такие мутантные варианты TRAIL, которые селективно нацелены только на рецепторы смерти DR4 или DR5. Известен способ получения мутантных вариантов TRAIL с пониженной аффинностью к рецепторам-ловушкам (O'Leary L. et al. Decoy receptors block TRAIL sensitivity at a supracellular level: the role of stromal cells in controlling tumour TRAIL sensitivity. Oncogene. 2016. Vol. 35, pp. 1261-1270), которые эффективнее приводят опухолевые клетки к гибели, по сравнению с TRAIL дикого типа. Противоопухолевая активность этих мутантов in vivo не была исследована.
Известен также способ подавления рака толстой кишки с помощью ситетических поливалентных пептидов, не имеющих гомологию с TRAIL b связывающихся с DR5 рецептором (V. PAVET et al. "Multivalent DR5 Peptides Activate the TRAIL Death Pathway and Exert Tumoricidal Activity". Cancer Research, 2010, v. 70, no. 3, p. 1 101-1110, DOI: 10.1158/0008-5472). Однако цитотоксическая активность этих пептидов уступал TRAIL in vitro. Кроме того, в последующих публикациях (J. Beyrath et al. Synthetic ligands of death receptor 5 display a cell-selective agonistic effect at different oligomerization levels. Oncotarget. 2016 v. 4, no. 7, p. 64942-64956. doi: 10.18632/oncotarget. 10508, Chekkat N et al. Relationship between the agonist activity of synthetic ligands of TRAIL-R2 and their cell surface binding modes. Oncotarget. 2018 v. 17, no. 9, p.15566-15578. doi: 10.18632/oncotarget.24526) авторы получившие указанные пептиды показали, что в то время как TRAIL способен эффективно убивать опухолевые клетки линии Jurkat или НСТ116, поливалентные пептиды не влияют на жизнеспособность данных клеток, так как образуют слабый комплекс с рецептором DR5 на поверхности этих клеток.
Технической проблемой решаемой предлагаемым изобретением, является разработка способа противоопухолевого воздействия, основанного на TRAIL-опосредованной гибели опухолевых клеток, более эффективного, чем с использованием известных агонистов рецепторов смерти.
Техническим результатом заявляемого изобретения является новый способ подавления роста опухолей колоректального рака с помощью генно-модифицированного варианта цитокина TRAIL DR5-B с повышенной противоопухолевой активностью.
Для решения указанной технической проблемой и достижения заявленного техничекого результата предложено использование генно-модифицированного рецептор-специфичного варианта внеклеточного домена рекомбинантного белка DR5-B, содержащего 6 замен аминокислотных остатков (SEQ ID NO 1).
Ранее авторами был получен уникальный вариант TRAIL DR5-B с заменами аминокислотных остатков Y189N/R191K/Q193R/H264R/I266L/D269H в белке TRAIL, который селективно связывается лишь с одним из пяти рецепторов TRAIL, рецептором смерти DR5 (Гаспарян М.Э. и др. Способ получения мутантного белка TRAIL человека. Патент РФ №2405038 от 27.11.2010). Исследования на линиях опухолевых клеток различного происхождения показали, что мутантный вариант DR5-B значительно эффективнее индуцирует апоптоз по сравнению с TRAIL дикого типа как при самостоятельном применении, так и в комбинации с химиопрепаратами (Гаспарян М.Э. и др. Способ индукции гибели опухолевых клеток, Патент РФ №2620165, от 23.05.2017).
Противоопухолевая эффективность DR5-B in vivo показана на модели подкожного ксенографта рака толстой кишки (РТК) человека НТ116 у мышей BALB/c nu/nu. Высокоочищенный рекомбинантный белок DR5-B получен из штамма Е. coli SHuffle В как описано ранее (Яголович А.В. и др. Новый эффективный способ получения рекомбинантного противоопухолевого цитокина TRAIL и его рецептор селективного варианта DR5-B. Биохимия, 2019, том. 84, вып. 6, с. 808-818).
Исследованы два режима воздействия:
режим I - DR5-B или контрольное вещество вводили 10-кратно, в виде двух последовательных циклов ежедневных внутривенных введений, по 5 инъекций в каждом цикле, с интервалом 2 дня, общая продолжительность воздействия 12 дней;
режим II - DR5-B или контрольное вещество вводили 7-кратно, дважды в неделю, с интервалом 2 или 3 дня, общая продолжительность воздействия 12 дней.
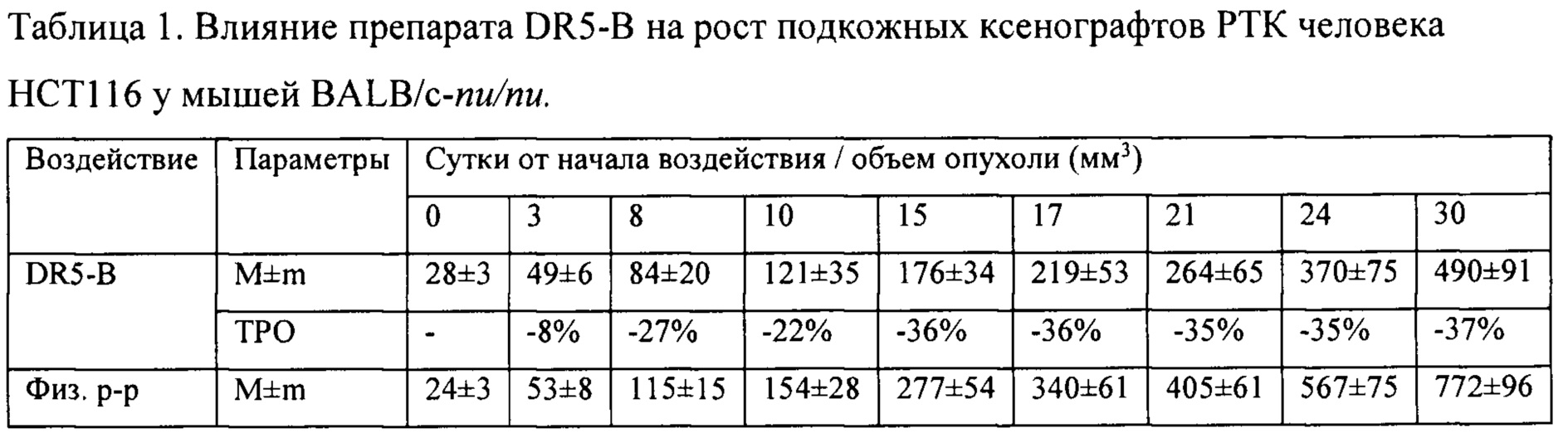
Показано, что при многократном внутривенном введении DR5-B в режиме I, в разовой дозе 10 мг/кг (суммарная доза 100 мг/кг), у мышей с ксенографтом НСТ116 наблюдается статистически достоверное ингибирование роста опухоли, по сравнению с контрольной группой животных-опухоленосителей, получавших в том же режиме инъекции физиологического раствора. Величина торможения роста опухолей (ТРО) при этом составляет 41-48%. Воспроизводимость противоопухолевого эффекта установлена в трех независимых опытах. По обобщенным результатам независимых экспериментов, многократное внутривенное введение DR5-B в разовой дозе 10 мг/кг в режиме I приводит к статистически достоверному увеличению продолжительности жизни животных.
Пролонгирование воздействия путем использования DR5-B в режиме II (разовая доза 10 мг/кг; суммарная доза 70 мг/кг) приводит к более глубокому торможению роста ксенографта НСТ116, величина ТРО достигает 50-70%. Однако существенного увеличения продолжительности терапевтического эффекта при этом не наблюдается. В целом, режимы I и II, отличающиеся длительностью интервалов между введениями препарата и продолжительностью воздействия, характеризуются сопоставимым уровнем результирующего противоопухолевого эффекта.
Установлено, что противоопухолевый эффект воздействия зависит от дозы препарата DR5-B. Оптимальная разовая доза при внутривенном введении DR5-B на модели ксенографта РТК человека НСТ116 у мышей линии BALB/c nu/nu составляет 10 мг/кг.
Показано, что DR5-B при системном введении в течении 10-ти дней в разовой дозе 10 мг/кг эффективнее подавляет рост ксенографта НСТ116, чем его немодифицированный аналог, TRAIL дикого типа.
В сравнительном исследовании показано, что ксенографты РТК человека, полученные с использованием разных клеточных линий, отличаются по чувствительности к действию DR5-B. Так, при использовании DR5-B в оптимальной дозе в режиме I наиболее чувствительным к его действию является ксенографт НСТ116, менее чувствительным -ксенографт Сасо-2. Ксенографт НТ-29 может служить моделью опухоли не чувствительной к действию DR5-B.
Изобретение иллюстрируют следующие рисунки:
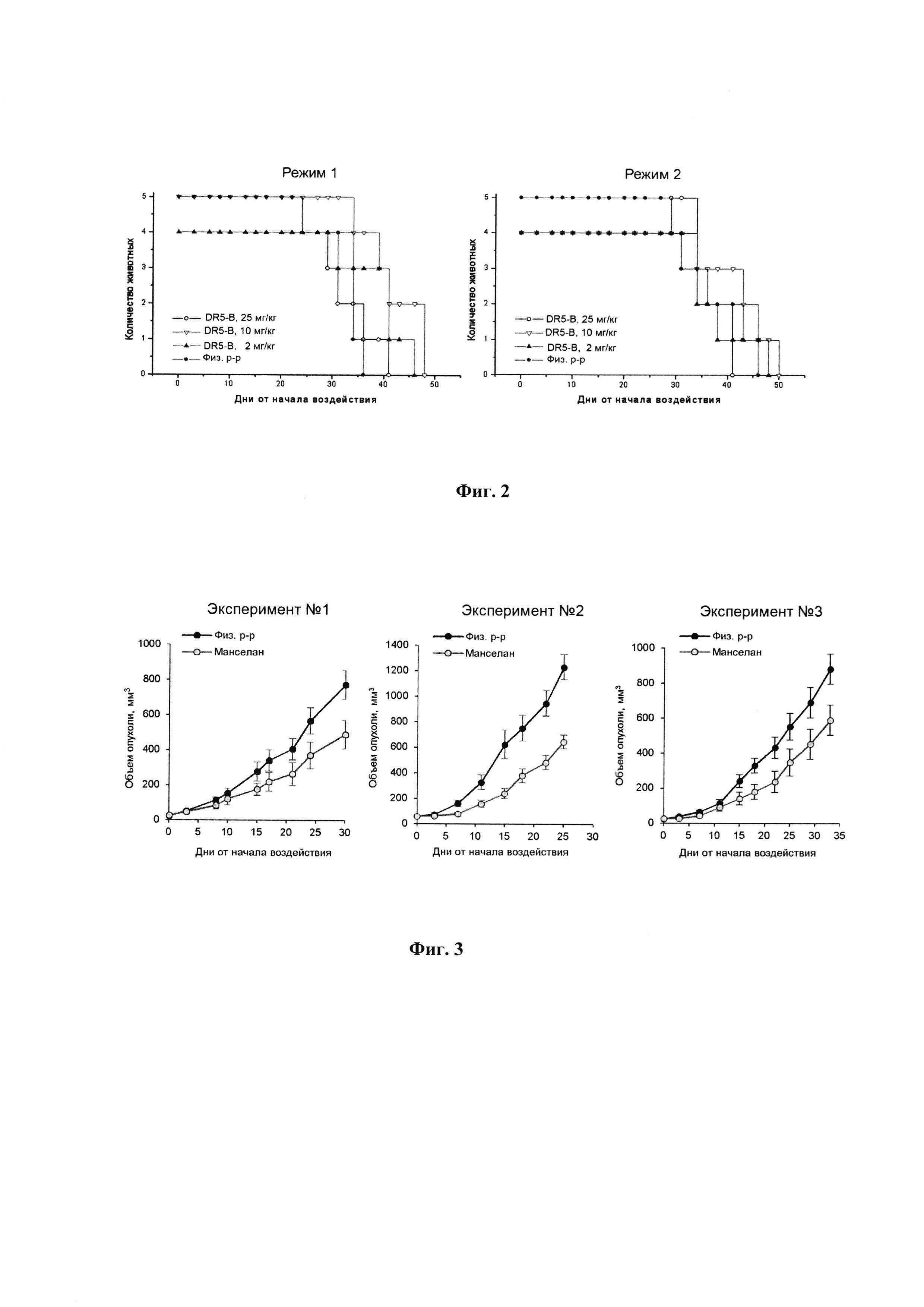
Фигура 1. Действие DR5-B на рост ксенографтов РТК человека НСТ116 у мышей BALB/c nu/nu при многократном внутривенном введении в разовых дозах 2 мг/кг, 10 мг/кг и 25 мг/кг. Режим I - 10-ти кратное введение; два цикла ежедневных инъекций, продолжительность каждого цикла - 5 дней; интервал между циклами - 2 дня; общая продолжительность воздействия 12 дней. Режим II - 7-ми кратное введение, два раза в неделю, с интервалом между инъекциями 2 или 3 дня; общая продолжительность воздействия 22 дня. Каждая экспериментальная группа состоит из 5 животных. Данные представлены в виде среднего арифметического и стандартной ошибки среднего.
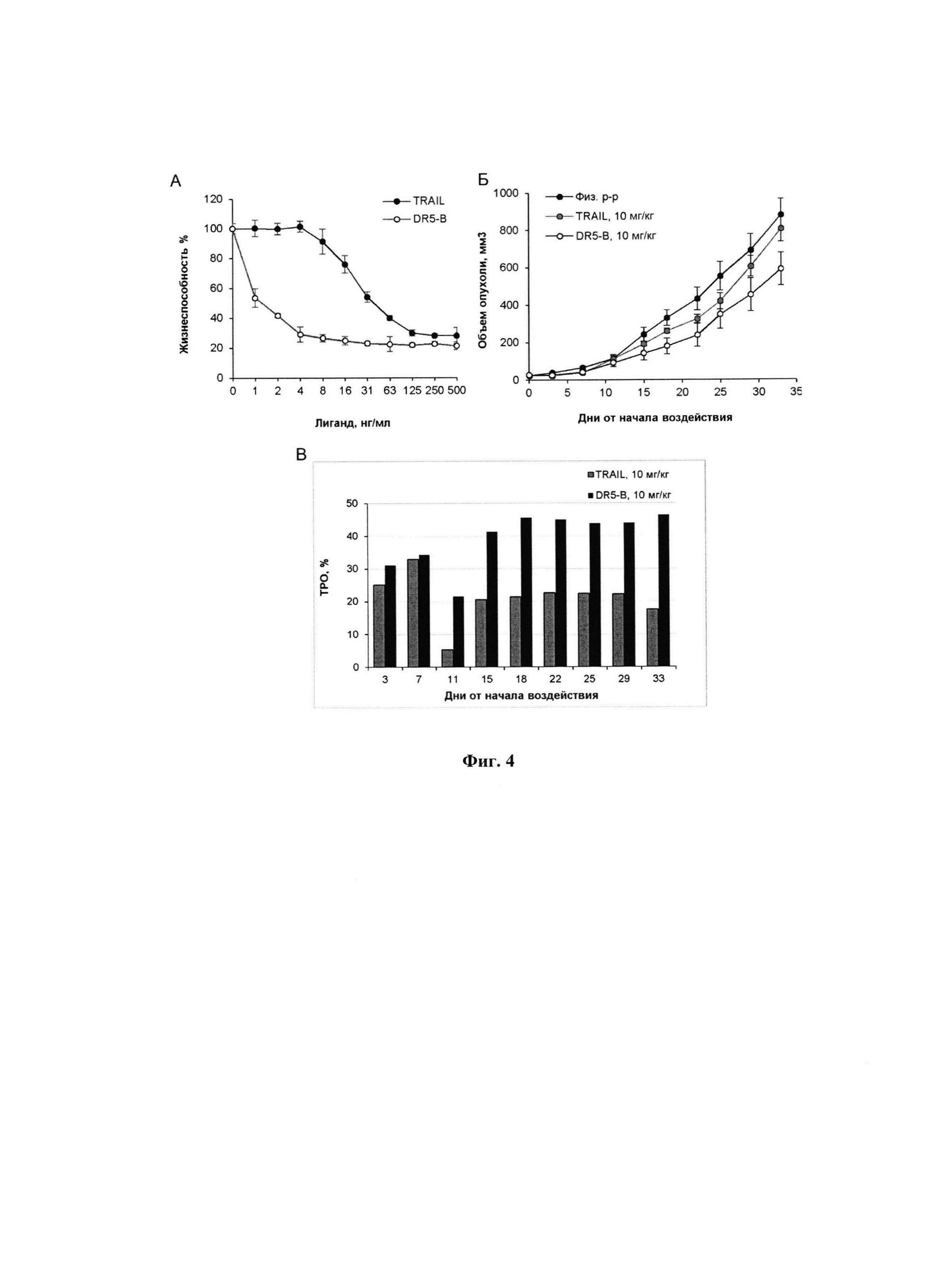
Фигура 2. Продолжительность жизни мышей BALB/c nu/nu с ксенографтами РТК человека НСТ116 при многократном внутривенном введении DR5-B при разовых дозах 2 мг/кг, 10 мг/кг и 25 мг/кг. Режим I - 10-ти кратное введение; два цикла ежедневных инъекций, продолжительность каждого цикла - 5 дней; интервал между циклами - 2 дня; общая продолжительность воздействия 12 дней. Режим II - 7-ми кратное введение, два раза в неделю, с интервалом между инъекциями 2 или 3 дня; общая продолжительность воздействия 22 дня.
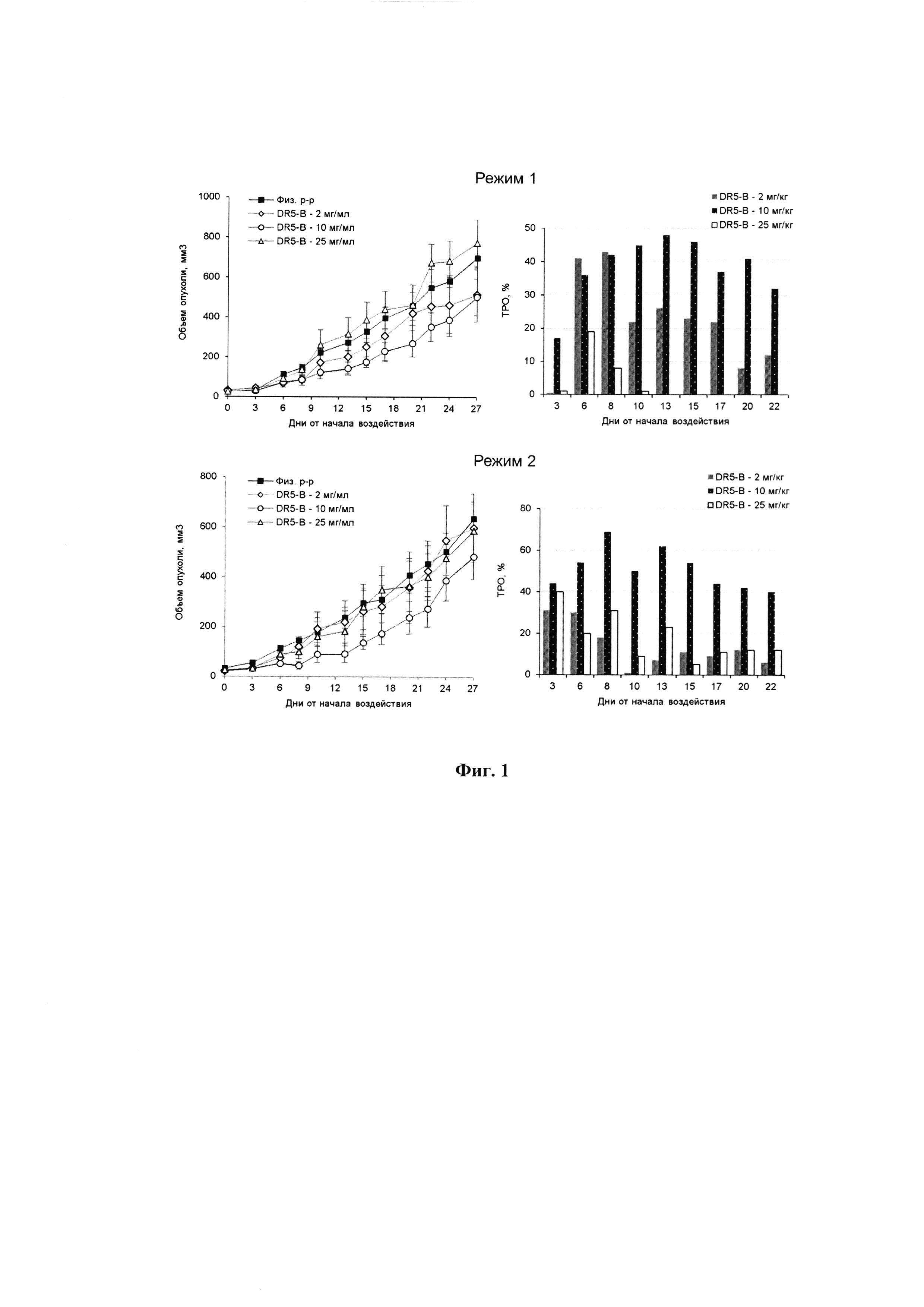
Фигура 3. Динамика роста опухоли у ксенографтов РТК человека НСТ116 у мышей BALB/c nu/nu при многократном внутривенном введении DR5-B в разовой дозе 10 мг/кг в режиме I (10-ти кратное введение; два цикла ежедневных инъекций, продолжительность каждого цикла - 5 дней; интервал между циклами - 1 день). Результаты трех независимых экспериментов. Каждая экспериментальная группа состоит из 5-6 животных. Данные представлены в виде среднего арифметического и стандартной ошибки среднего.
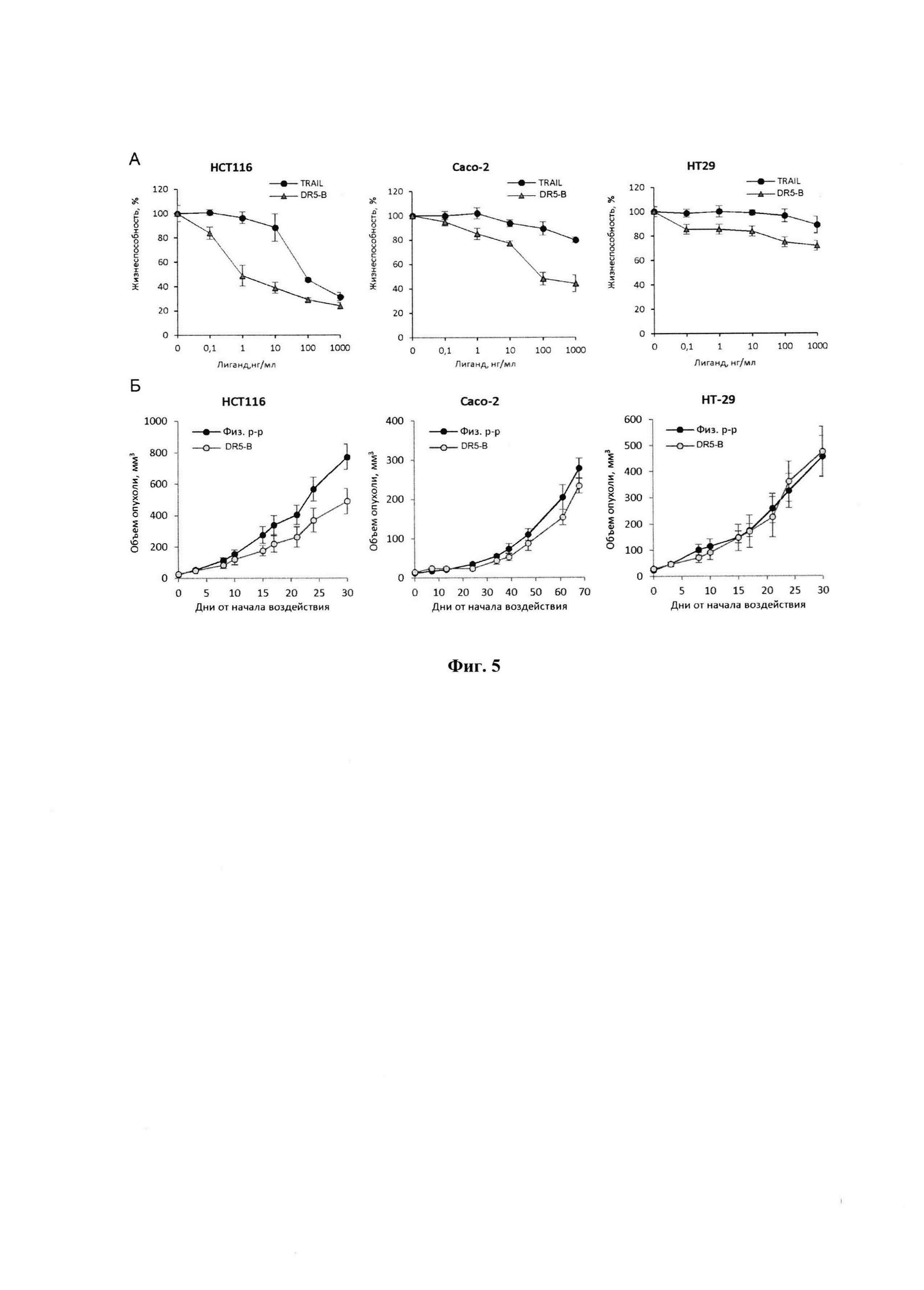
Фигура 4. А - Цитотоксическая активность TRAIL и DR5-B на клетки линии НСТ116 при 24 часовой инкубации определенная с помощью МТТ теста; Б - Динамика роста ксенографтов РТК человека НСТ116 у мышей BALB/c nu/nu при многократном внутривенном введении TRAIL и DR5-B в разовых дозах 10 мг/кг в режиме I (10-ти кратное введение; два цикла ежедневных инъекций, продолжительность каждого цикла - 5 дней; интервал между циклами - 2 дня); В - Торможение роста опухолей (ТРО, %) в группах мышей, получавших TRAIL и DR5-B, относительно контрольной группы животных, которым вводили физиологический раствор. В экспериментах in vivo каждая группа состоит из 5 животных. Данные представлены в виде среднего арифметического и стандартной ошибки среднего.
Фигура 5. А - Цитотоксическая активность TRAIL и DR5-B на опухолевых клеточных линиях РТК человека НСТ116, Сасо-2 и НТ-29. Клетки инкубировали с лигандами в указанных концентрациях в течении 24 часов, выживаемость клеток определяли с помощью МТТ теста. Б - Динамика роста опухоли у ксенографтов РТК человека НСТ116, Сасо-2 и НТ-29 у мышей BALB/c nu/nu при многократном внутривенном введении DR5-B в разовой дозе 10 мг/кг в режиме I (10-ти кратное введение; два цикла ежедневных инъекций, продолжительность каждого цикла - 5 дней; интервал между циклами - 2 дня). Данные представлены в виде среднего арифметического и стандартной ошибки среднего.
Осуществление изобретения
Осуществление заявляемого изобретения иллюстрируется приведенными ниже примерами 1-3.
Пример 1.
Влияние DR5-B на рост ксенографтов рака толстой кишки человека НСТ116 у мышей BALB/c nu/nu при многократном внутривенном введении
Для получения ксенографта использовали культивируемые клетки РТК человека линии НСТ116. Клетки культивировали в пластиковых флаконах с площадью поверхности 75 см2 (Costar, США) на среде DMEM с L-глутамином (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (ЭТС; ПанЭко, Россия) в стандартных условиях культивирования (в увлажненной атмосфере при температуре 37°С и 5% атмосферном содержании СО2).
Для прививки животным использовали клетки 8 пассажа. Непосредственно перед прививкой животным клетки снимали с флаконов раствором Версена (ПанЭко, Россия), отмывали в среде, не содержащей ЭТС, и переносили в стерильные пробирки. Осаждение клеток проводили на центрифуге "СМ-6М Elmi" при 1000 об/мин в течение 10 мин. Подсчет количества жизнеспособных клеток выполняли в камере Горяева, с добавлением к клеточной суспензии 0,4% раствора трипанового синего в объемном соотношении 1:1. На основании результатов подсчета готовили клеточную суспензию с концентрацией 8×107 клеток в 1 мл. Клетки инокулировали животным в Матригеле (BD Matrigel™ Basement Membrane Matrix, BD Biosciences). Для введения животным 50 мкл клеточной суспензии (4×106 клеток) переносили в охлажденную пробирку, содержащую 50 мкл Матригеля и после перемешивания клеточный материал (100 мкл) вводили животному подкожно, на правый бок.
Воздействие начинали на 6-й день роста ксенографта опухоли. DR5-B и контрольное вещество вводили мышам внутривенно, в хвостовую вену. Объем введения препарата животным рассчитывали на основании средней массы тела животных в группе, в соответствии с дозой препарата.
Использовали два режима воздействия:
- режим I: введение осуществляют ежедневно, в течение 10 дней (с перерывом 2 дня), в разовых дозах 2 мг/кг, 10 мг/кг и 25 мг/кг. Контрольным животным в том же режиме вводят 0,9% раствор хлористого натрия (физиологический раствор) в объеме, эквивалентном объему введения наибольшей дозы. Общая продолжительность воздействия составляет 12 дней.
- режим II: введение осуществляют два раза в неделю, с интервалами 2 или 3 дня, в разовых дозах 2 мг/кг, 10 мг/кг и 25 мг/кг. Контрольным животным в том же режиме вводят физиологический раствор в объеме, эквивалентном объему введения наибольшей дозы. Общая продолжительность воздействия составляет 22 дня.
В течение времени наблюдения проводили оценку общего состояния мышей (ежедневно), регистрировали объем подкожных образований (три раза в неделю), вес животных (раз в неделю). Размер опухоли измеряли трижды в неделю. Размер опухоли определяли путем чрезкожного измерения опухолевых образований при помощи штангенциркуля в трех взаимно перпендикулярных проекциях. Объем опухоли рассчитывали по формуле: V=d1×d2×d3 мм3, где d1, d2 и d3 - три взаимно перпендикулярных диаметра опухоли. По результатам измерения рассчитывали средний объем опухоли в каждой экспериментальной группе и величину торможения роста опухоли (ТРО):
ТРО=[(Vк-Vоп)/Vк]×100%, где
Vоп - средний объем опухоли у животных в опытной группе; Vк - средний объем опухоли у животных в контрольной группе.
При внутривенном введении животным DR5-B в разовой дозе 10 мг/кг в режиме I (суммарная доза 100 мг/кг) наблюдали статистически достоверное ингибирование роста ксенографта НСТ116. Величина ТРО в период от 8-х до 20-х суток после начала воздействия, по сравнению с группой животных, получавших в том же режиме инъекции физиологического раствора, в среднем составляла 41-48% (Фиг. 1, Режим I). При снижении разовой дозы препарата до 2 мг/кг (суммарная доза 20 мг/кг) выраженность эффекта в режиме I существенно снижалась, а повышение разовой дозы до 25 мг/кг (суммарная доза 250 мг/кг) - не оказывало ингибирующего действия на рост опухолей у животных.
При внутривенном введении DR5-B в разовой дозе 10 мг/кг в режиме II (суммарная доза 70 мг/кг) наблюдали тенденцию к более глубокому торможению роста опухоли. Величина ТРО в период от 6-х до 15-х суток после начала воздействия, по сравнению с группой животных, получавших инъекции физиологического раствора в том же режиме, достигала 50-70%. Однако увеличение общей продолжительности воздействия, по сравнению с режимом I, не приводило к существенному пролонгированию противоопухолевого эффекта (Фиг. 1, Режим II). При использовании данного режима воздействия также наблюдалась зависимость противоопухолевого эффекта от дозы DR5-B.
Многократное внутривенное введение препарата DR5-B удовлетворительно переносилось животными. Реакций на введение препарата не отмечено.
Таким образом, на модели ксенографта РТК человека НСТ116 у иммунодефицитных мышей оптимальная разовая доза DR5-B при его внутривенном введении составляет 10 мг/кг. Режимы I и II, отличающиеся длительностью интервалов между введениями DR5-B и продолжительностью воздействия, характеризуются сопоставимым уровнем результирующего противоопухолевого эффекта.
Продолжительность жизни мышей BALB/c nu/nu с ксенографтами НСТ116 в опытных и контрольных группах прослежена до конечной точки наблюдения, которая определялась состоянием животных-опухоленосителей. Условиями выполнения немедленной эвтаназии являлось: снижение веса животного более чем на 20%; увеличение поперечного размера опухоли до 18 мм; появление выраженного некроза или изъязвления на поверхности опухоли. Результаты наблюдения показывают, что продолжительность жизни мышей, получавших внутривенные инъекции DR5-B в режиме I, превышает продолжительность жизни животных в контрольной группе (Фиг. 2). По обобщенным результатам трех независимых экспериментов, средняя продолжительность жизни мышей, в группах, получавших DR5-B составила 45,2±9,6 дней со времени инокуляции опухолевых клеток, в контрольной группе животных - 34,5±7,3 дней (р=0,0016, t-критерий Стьюдента).
Наличие противоопухолевой активности DR5-B при его внутривенном введении в режиме I в разовой дозе 10 мг/кг на модели ксенографта НСТ116 подтверждено в трех независимых экспериментах, выполненных в разное время (Фиг. 3).
Таким образом, DR5-B при системном многократном введении в разовой дозе 10 мг/кг (суммарная доза 100 мг/кг) воспроизводимо приводит к умеренно выраженному, но статистически достоверному торможению роста подкожного ксенографта РТК человека НСТ116 у иммунодефицитных мышей. Величина ТРО варьирует в диапазоне 42-49% и удерживается на достигнутом уровне на протяжении не менее двух недель после окончания лечения животных.
Пример 2.
Сравнительный анализ действия TRAIL и DR5-B на клетки РТК человека НСТ116 in vitro и рост ксенографтов НСТ116 in vivo у мышей BALB/c nu/nu.
После вывода культуры из криохранения и перехода в режим наращивания клеточной массы клеточная линия НСТ116 проявляет устойчивый рост: время удвоения клеточной массы составляет около 24 часов, периодичность пересева - 2 раза в неделю, количество клеток во флаконе с площадью поверхности 75 см2 при достижении конфлюэнтного монослоя - от 11×106 до 13×106. Для исследования биологической активности препаратов линия клеток колоректальной карциномы НСТ116 культивируют в питательной среде DMEM, содержащей 10% (v/v) бычьей эмбриональной сыворотки при 37°С в атмосфере 5% СО2. Клетки переносят в стерильные 96-луночные планшеты (1×105 клеток на лунку для НСТ116 и инкубируют с препаратами TRAIL (SEQ ID NO 2) и DR5-B (SEQ ID NO 1) в течение 24 ч. Для определения жизнеспособности клеток добавляют МТТ (3-[4,5-диметилтиазол-2]-2,5-дифенил тетразолия бромид) в конечной концентрации 0,5 мг/мл и инкубируют в течение 3 ч при 37°С. Планшеты центрифугируют при 3000 об/мин («ELMI», Латвия) в течение 5 мин, удаляют надосадочную жидкость, в каждую лунку добавляют диметилсульфоксид (ДМСО) и оптическую плотность содержимого лунок измеряют с помощью планшетного спектрофотометра iMark («Bio-Rad», США) при длине волны 450 нм с вычитанием фона при 655 нм. Уровень ингибирования роста культуры (ИР) вычисляют по формуле:
ИР (%)=[(ODк-ODo)/ODк]*100%, где ODo и ODк - средняя оптическая плотность раствора формазана в опытных и контрольных лунках, соответственно.
Для расчета величины ИК50, (концентрации тестируемого вещества, при которой наблюдается 50% ингибирование роста культуры клеток in vitro) строят кривую роста зависимости ингибирования пролиферации клеточной культуры от концентрации препарата.
В результате проведенных исследований установлено, что внесение в культуральную среду DR5-B в концентрациях от 1 нг/мл до 500 нг/мл приводит к биологически значимому торможению роста культуры НСТ116. Величина максимального ингибирования пролиферации для DR5-B составляет 79%, а для TRAIL 72% (Фиг. 4). В указанных условиях величина ИК50, для DR5-B составляет 0,886±0,033 нг/мл, тогда как для TRAIL 23,004±0,3 нг/мл, что в 28,75 раз выше по сравнению с ИК50 рассчитанной для DR5-B. Таким образом, DR5-B более эффективно приводит к гибели клетки линии НСТ116, по сравнению с TRAIL.
Сравнительный анализ противоопухолевой активности TRAIL и DR5-B проводили на модели ксенографта НСТ116 у мышей BALB/c nu/nu. Методика подготовки модели и оценки результатов описаны в примере 1. Исследуемые вещества вводили животным в дозе 10 мг/кг в течении 10 дней, ежедневно с перерывом в 2 дня после пятой инъекции. Показано, что, по сравнению с TRAIL, DR5-B более эффективно подавляет рост ксенографта НСТ116 (Фиг. 4). В группе мышей-опухоленосителей, получавших DR5-B, максимальная величина ТРО варьировала в диапазоне 41-46%, а на завершающий срок наблюдения (33-й день от начала воздействия) составила 33%. В группе мышей, которым в той же дозе и в том же режиме вводили TRAIL, максимальная величина ТРО не превышала 25%, а на завершающий срок наблюдения составила 8%.
Таким образом, совокупность данных, полученных in vitro и in vivo, свидетельствует о том, что противоопухолевая активность цитокина TRAIL существенно увеличивается при внесении аминокислотных замен Y189N/R191K/Q193R/H264R/I266L/D269H, повышающих селективность белка к рецептору DR5.
Пример 3
Сравнительное исследование чувствительности клеток РТК человека НСТ116, НТ-29 и Сасо-2 in vitro и модельных опухолей НСТ116, НТ-29 и Сасо-2 in vivo к действию DR5-B.
Клетки РТК человека НСТ116, НТ-29 и Сасо-2 культивируют в пластиковых флаконах с площадью поверхности 75 см2 (Costar, США) в среде DMEM с L-глутамином (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (ЭТС; ПанЭко, Россия) в стандартных условиях культивирования (в увлажненной атмосфере при температуре 37×С и 5% атмосферном содержании CO2).
Цитотоксическую активность исследуемых веществ определяют с помощью МТТ теста, как описано в Примере 2.
Результаты тестирования in vitro показывают, что клетки НСТ116 чувствительны как к TRAIL, так и к DR5-B, однако эффективные концентрации DR5-B в 30 раз меньше, чем эффективные концентрации TRAIL (Фиг. 5А). Клетки линии Сасо-2, а также НТ-29 практически не погибают под воздействием TRAIL, тогда как DR5-B при концентрациях выше 100 нг/мл тормозит рост клеток Сасо-2 на 60%, клеток НТ-29 - на 27% (Фиг. 5А).
Исследование противоопухолевой активности DR5-B in vivo выполнено на моделях ксенотрансплантатов НСТ116, НТ-29 и Сасо-2 у мышей BALB/c nu/nu. Получение модели НСТ116 описано в Примере 1. Для получения ксенографта Сасо-2 опухолевые клетки инокулировали мышам подкожно, в Матригеле, в количестве 5×106 клеток на мышь, по той же методике. Клетки НТ-29 (3×106 клеток на мышь) инокулировали подкожно, на правый бок, в 100 мкл среды DMEM без эмбриональной телячьей сыворотки.
На моделях НСТ116 и НТ-29 воздействие начинали на 6-й день роста опухоли, на модели Сасо-2 - на 14-й день роста опухоли. DR5-B и контрольное вещество мышам вводили внутривенно, в хвостовую вену. Введение осуществляли в режиме I (см. Пример 1) двумя циклами по 5 дней каждый, с перерывом 2 дня (для НСТ116 и НТ-29) или 1 день (для Сасо-2). Разовая доза DR5-B составляла 10 мг/кг. Контрольным животным в том же режиме вводили 0,9% раствор хлористого натрия (физиологический раствор) в объеме, эквивалентном объему введения DR5-B.
Опухоли НСТ-116 и НТ29 измеряли дважды в неделю, опухоли Сасо-2 - один раз в неделю. Размер опухолей определяли, как описано в Примере 1. В течение времени наблюдения проводили оценку общего состояния мышей (ежедневно), регистрировали объем подкожных образований (два раза в неделю для НСТ116 и НТ-29; раз в 7-10 дней для Сасо-2), вес животных (раз в неделю).
Результаты оценки динамики роста ксенографтов опухолей НСТ116, НТ-29 и Сасо-2 у мышей в опытных группах, получавших курсовое лечение препаратом DR5-B, и у животных в контрольных группах, которым в том же режиме вводили физиологический раствор, представлены на Фигуре 5Б. Продолжительность наблюдения за животными с ксенографтами НСТ116 и НТ-29 от начала воздействия составляла 30 дней (после завершения курса воздействия - 18 дней). Наблюдение за животными с ксенографтами Сасо-2 от начала воздействия составляла 68 дней (после завершения курса воздействия - 57 дней).
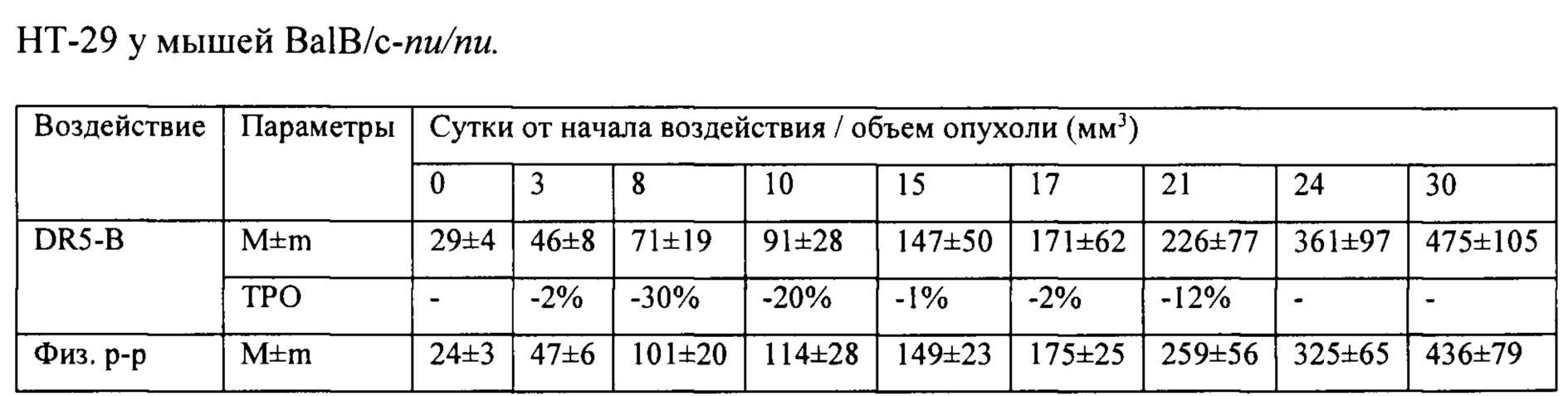
На модели ксенографта НСТ116 величина торможения роста опухоли при многократном системном введении DR5-B достигала 35-37% и стабильно удерживалась на относительно высоком уровне в период от 15-го до 30-го дня после начала воздействия (Табл. 1). В группе мышей с ксенографтом Сасо-2, получавших DR5-B, по сравнению с контрольной группой животных, отмечалась слабая тенденция к торможению роста опухоли (Фиг. 5Б). Величина ТРО не превышала 30%, причем эта тенденция на данной модели проявлялась после завершения курса воздействия и удерживалась до конца наблюдения за животными (Табл. 2).
На модели ксенографта НТ-29 наблюдалась незначительная и кратковременная задержка роста опухоли на 8-10 день после начала воздействия (ТРО 20-30%), однако в целом динамика роста опухолей в опытной и контрольной группах мышей отличались несущественно (Табл. 3).
Таким образом, из числа исследованных вариантов моделей РТК человека у иммунодефицитных мышей наиболее чувствительным к действию DR5-B в использованном режиме воздействия является ксенографт НСТ116, менее чувствительным - ксенографт Сасо-2. Ксенографт НТ-29 может служить моделью опухоли, устойчивой к действию DR5-B.
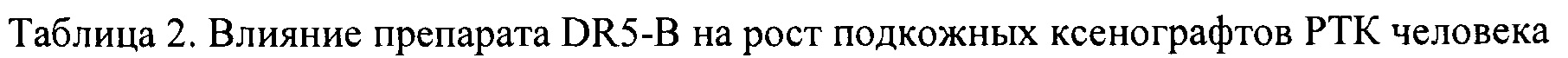
SEQ ID NO 1.
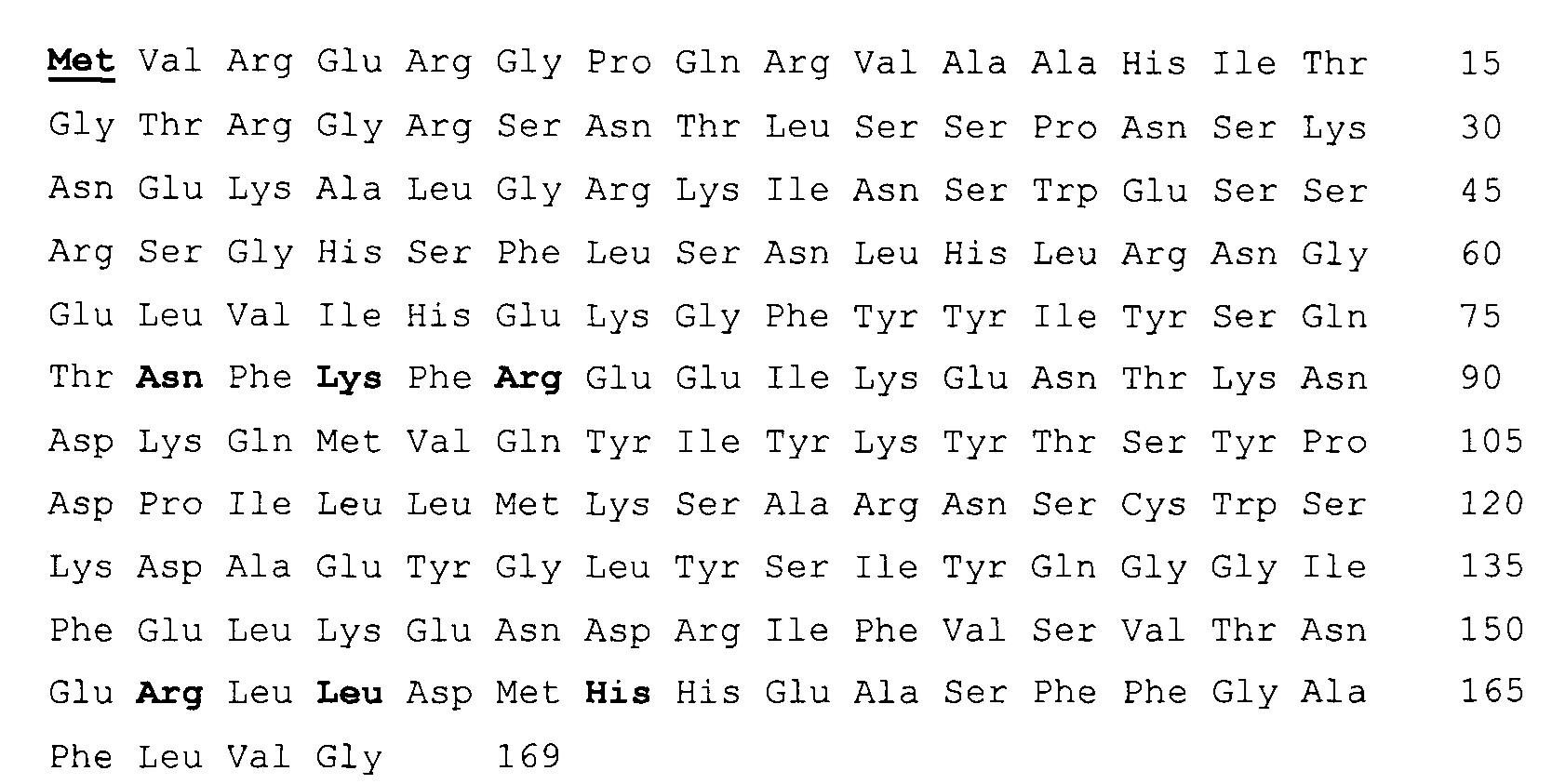
SEQ ID NO 2.