Результат интеллектуальной деятельности: ДНК-аптамер GR200, узнающий внеклеточный домен EGFR
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и медицины, а конкретно, к получению нового аптамера, узнающего EGFR и EGFR vIII, который может использоваться для узнавания рекомбинантных белков рецептора эпидермального фактора роста (EGFR) и его мутантной формы (EGFR vIII).
Аптамеры (от латинского Aptus - «соответствовать» и греческого Meros - «единица повтора») - короткие синтетические фрагменты нуклеиновых кислот (олигонуклеотиды) со сложной пространственной структурой, которая определяет их уникальные свойства избирательно связываться (как ключ с замком) с любой мишенью: будь то химическое вещество (изотоп, лекарство, токсин и проч.), полимеры (ферменты, рецепторы, факторы роста, регуляторные и структурные белки, иммуноглобулины и проч.), супрамолекулярные комплексы (например, вирусы), целые клетки (болезнетворные бактерии, злокачественные и другие дефектные клетки).
Важные преимущества аптамеров по сравнению с препаратами белковой и пептидной природы - низкая иммуногенность и возможность при развитии осложнений (например, кровотечений) блокировать их активность специфическими антидотами на основе олигонуклеотидов, комплементарных лекарственному аптамеру. Кроме того, возможность химического синтеза аптамеров позволяет добиваться высокой степени чистоты препарата, воспроизводимости партий и масштабируемости производства.
В патенте US 9316647 B2 (приоритет от 30.12.2011 года) описан аптамер к свободному EGFR, включающий следующую последовательность XGANNGNNYGANNCNN (SEQ ID NO: 55). Недостатком данного аптамера может оказаться существенное количество модификаций, которые могут отразиться на стабильности структуры в целом. Кроме того, нет данных о сродстве аптамера к мутантным формам EGFR.
В еще одном патенте US 9125930B2 (приоритет от 12.10.2010 года) описывается аптамер к EGFR, включающий следующую последовательность 5' GCCUUAGUAACGUGCUUUGAUGUCGAUUCGACAGGAGGC 3' (SEQ ID NO: 1). Недостатком является то, что данный аптамер является РНК аптамером, что сопряжено с определенными трудностями, молекулы РНК легко деградируют под воздействием разнообразных факторов, таких, как РНКазы, высокая температура, щелочная среда и т.д., что в конечном итоге может существенно сказаться на эффективности препарата.
Ближайшим аналогом изобретения является аптамер GR20, характеризующийся нуклеотидной последовательностью общей формулы 5'- ACGCACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGT-3'.
Задачей настоящего изобретения является создание высокоэффективного лиганда к рецептору эпидермального фактора роста EGFR и его мутантной форме EGFR vIII на основе ДНК-аптамера. Подразумевается, что модификация позволит увеличить уровень аффиности в несколько раз. Для последующего практического применения длина аптамера не должна превышать 50 нуклеотидов, что значительно снижает стоимость и повышает выход при синтезе, а температура плавления структуры должна быть желательно не ниже 37°С.
Решение указанной задачи заключается в том, что аптамерный ДНК олигонуклеотид, характеризующийся нуклеотидной последовательностью общей формулы 5'-ACGCACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGT-3' (GR20) был стабилизирован добавлением на концевой участок дуплекса двух стабилизирующих GC пар. Для получения стабилизированного варианта была сделана замена 44Т на 44С и были добавлены последовательности CG с 5'- и 3'-концов, что приводит к замене GT пары на более устойчивую уотсон-криковскую пару CG и к увеличению дуплекса с 8 до 10 пар нуклеотидов и его стабилизации.
Описание чертежей
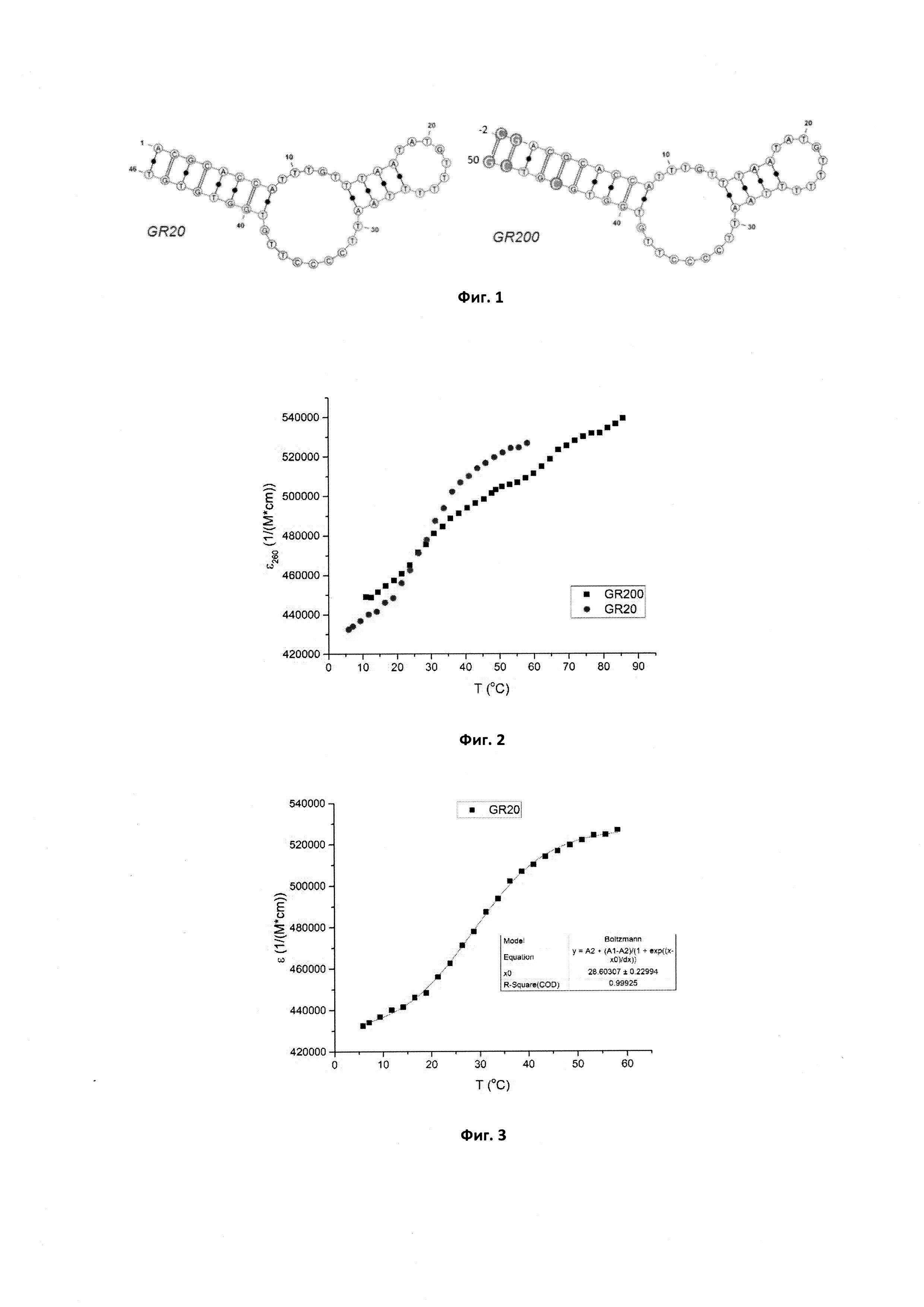
Фигура 1. Предполагаемые вторичные структуры аптамеров GR20 и GR200, предсказанные программой Mfold.
Фигура 2. Сравнение кривых плавления для исходного аптамера GR20 и для нового аптамера GR200.
Фигура 3. Кривая плавления, ее аппроксимация и значение Тпл для исходного аптамера GR20.
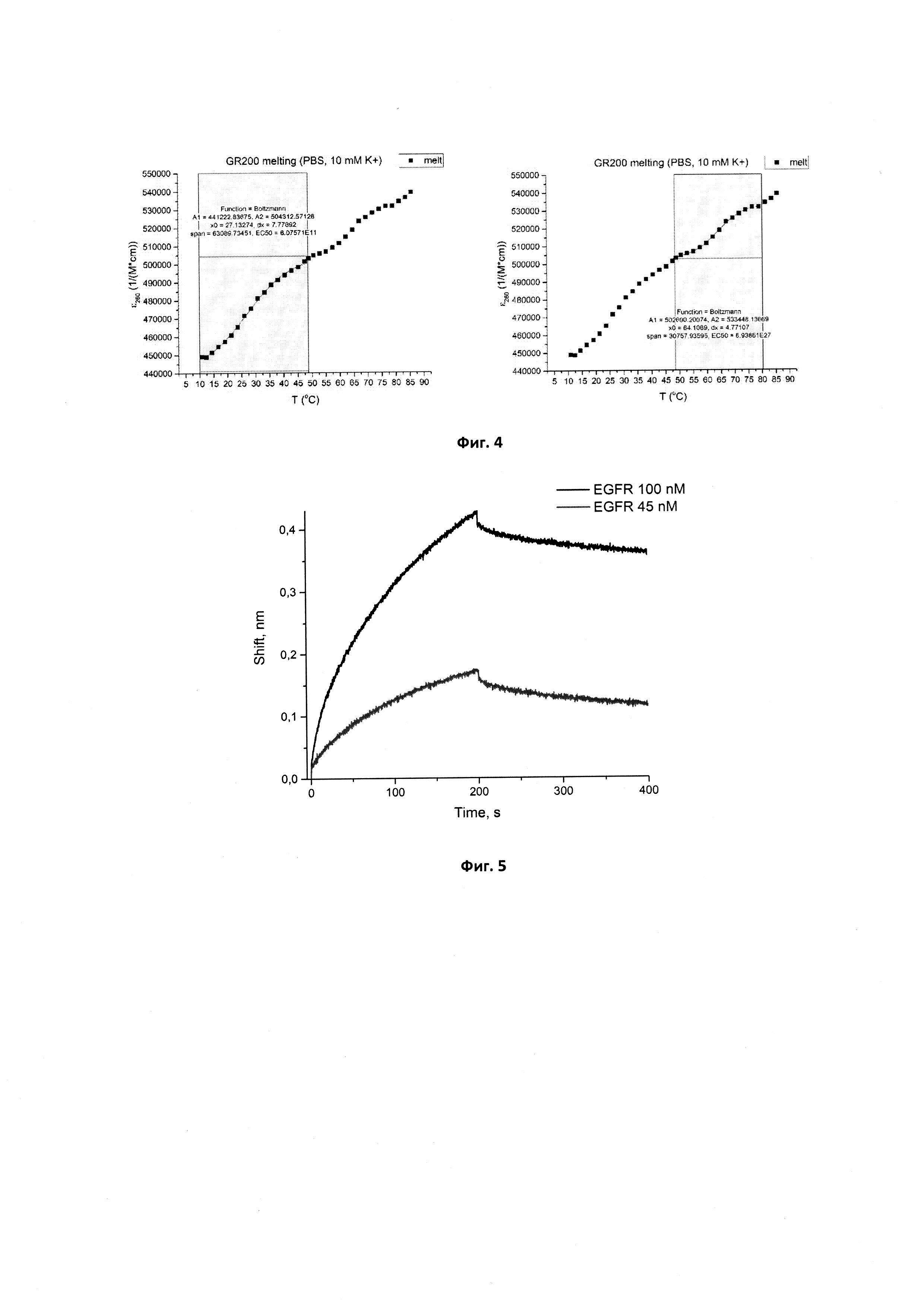
Фигура 4. Кривая плавления, ее аппроксимация на двух участках перегибов и значения Тпл для нового аптамера GR200.
Фигура 5. Сенсограммы связывания иммобилизованного аптамера GR200 с рекомбинантным белком EGFR в концентрациях 45 и 100 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
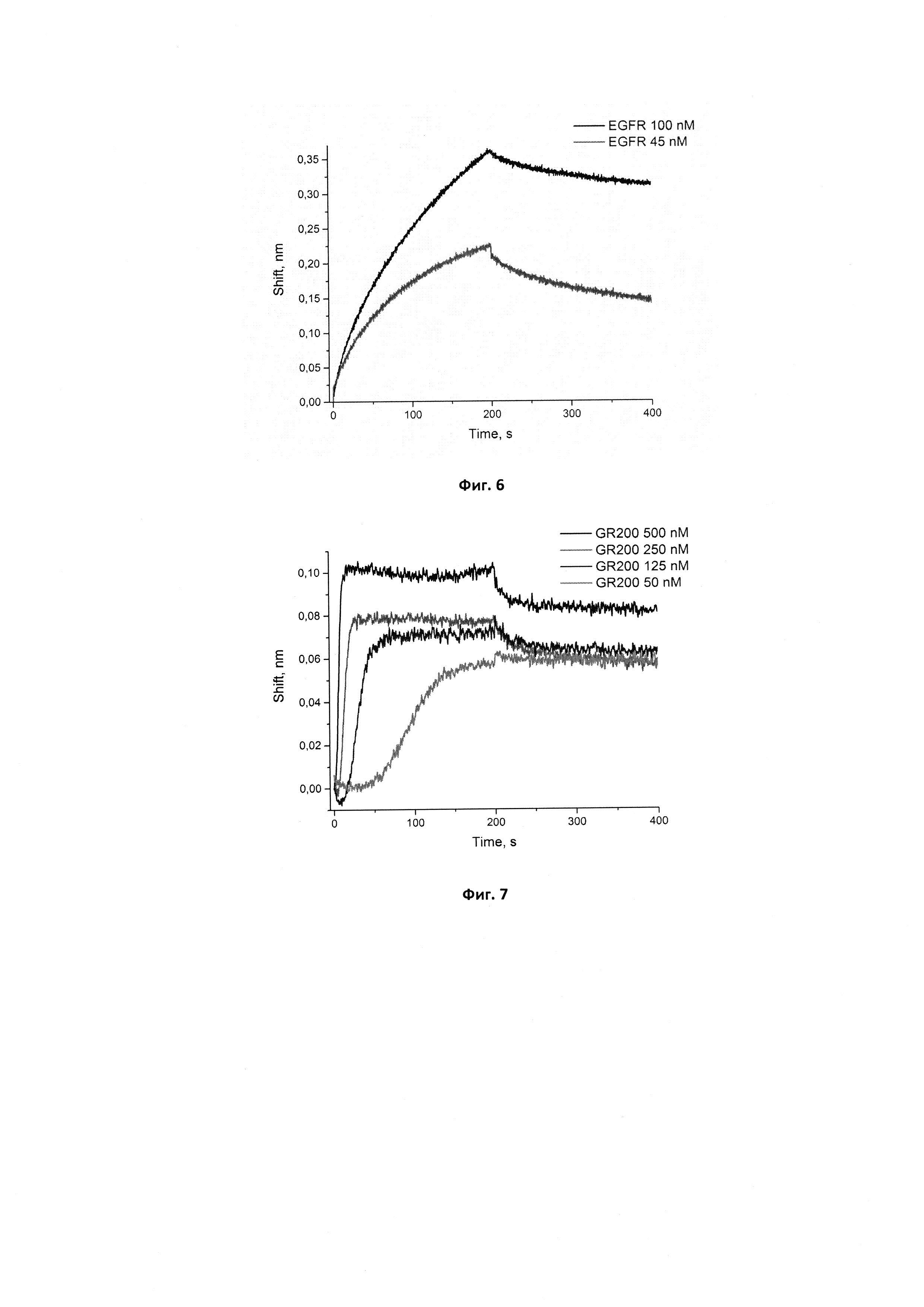
Фигура 6. Сенсограммы связывания иммобилизованного исходного аптамера GR20 с рекомбинантным белком EGFR в концентрациях 45 и 100 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
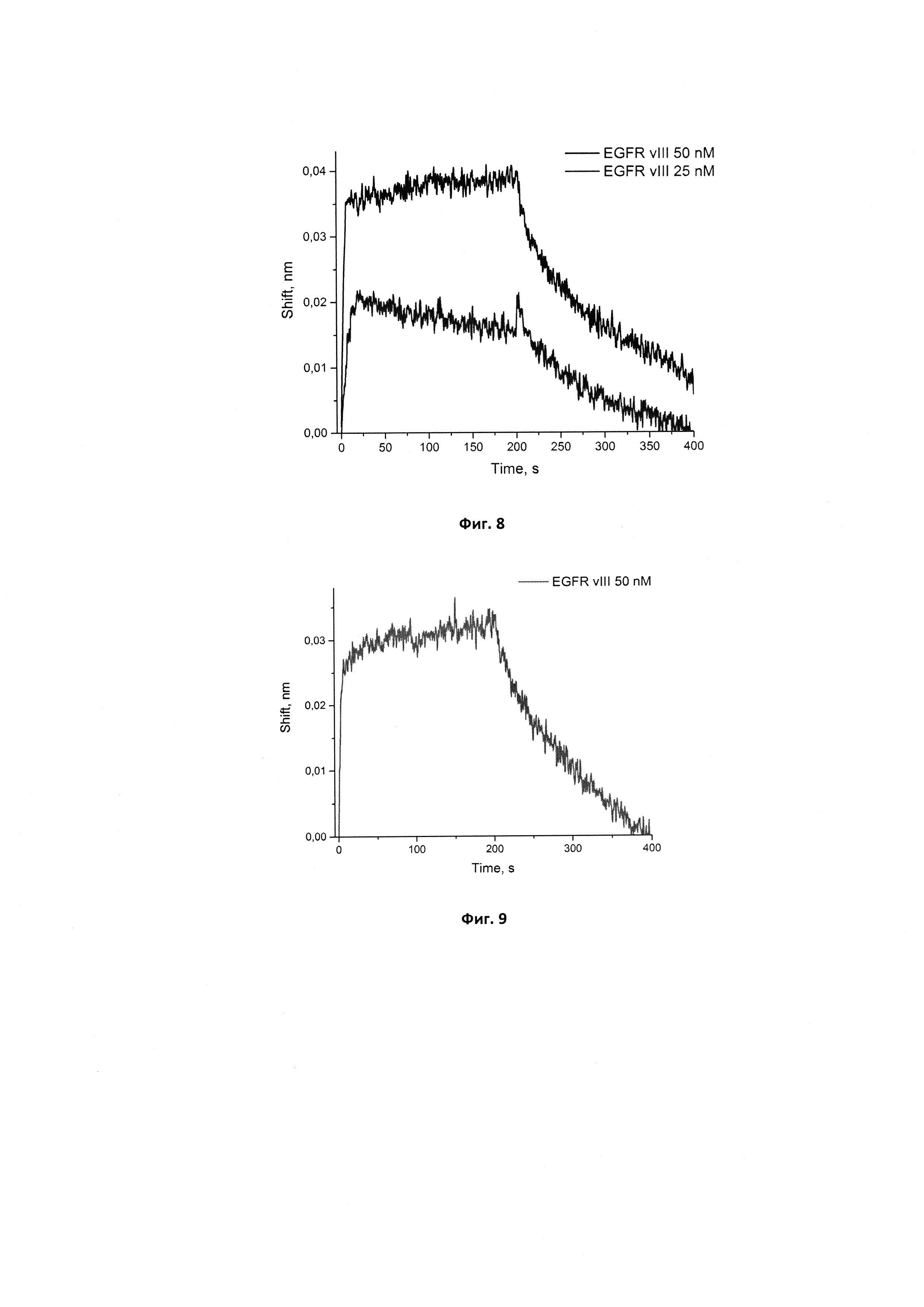
Фигура 7. Сенсограммы связывания аптамера GR200 в концентрациях 50, 125, 250, 500 нМ с иммобилизованным рекомбинантным белком EGFR. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
Фигура 8. Сенсограммы связывания иммобилизованного нового аптамера GR200 с рекомбинантной мутантной формой белка EGFR vIII в концентрациях 25 и 50 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
Фигура 9. Сенсограммы связывания иммобилизованного исходного аптамера GR20 с рекомбинантной мутантной формой белка EGFR vIII в концентрации 50 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
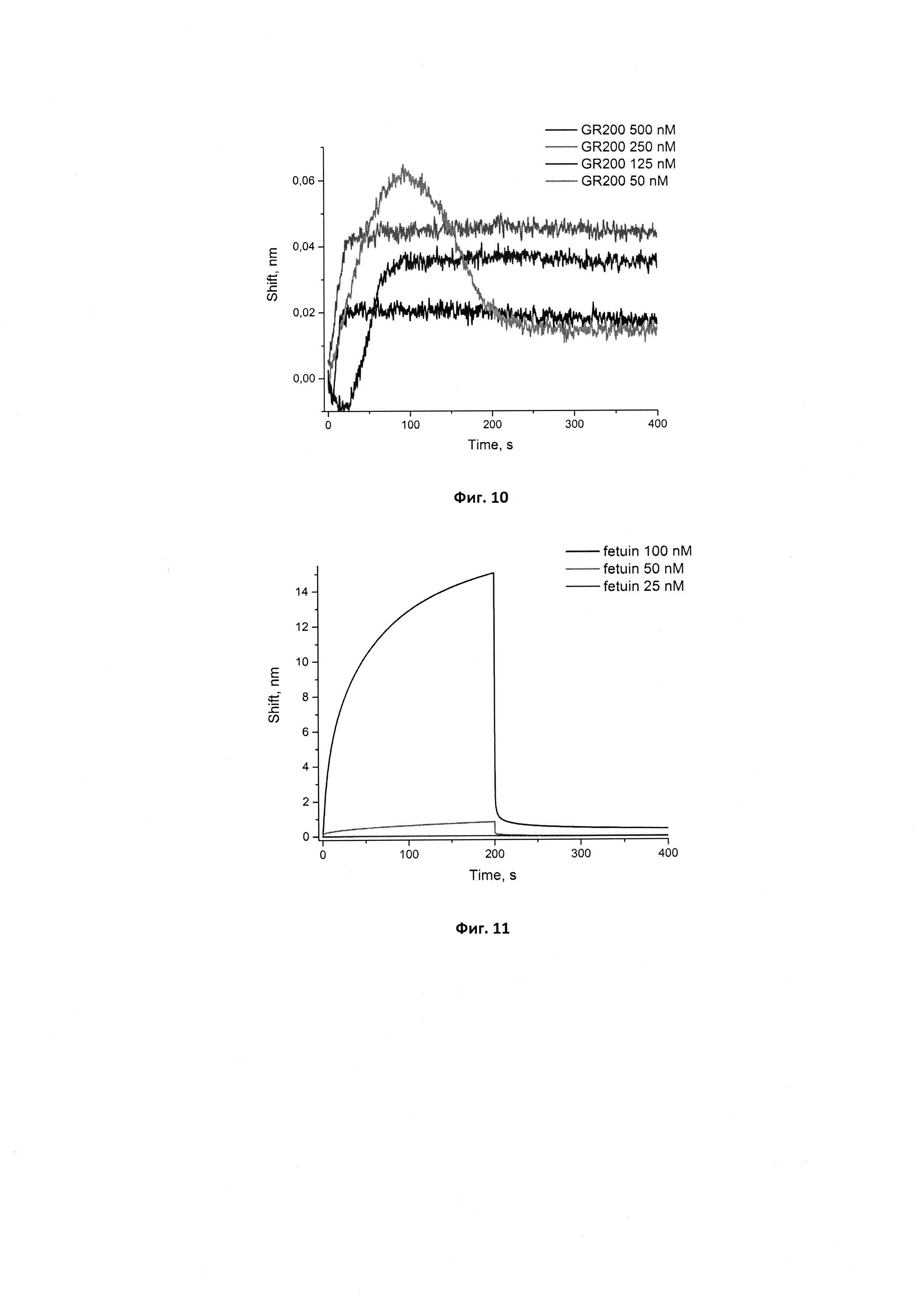
Фигура 10. Сенсограммы связывания аптамера GR200 в концентрациях 50, 125, 250, 500 нМ с иммобилизованным рекомбинантным белком EGFR. Сигнал от связывания аптамера с референсным белком (антителом С225) в аналогичных концентрациях вычтен из сенсограмм.
Фигура 11. Сенсограммы связывания иммобилизованного исходного аптамера GR20 с фетуином в концентрациях 25, 50 и 100 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
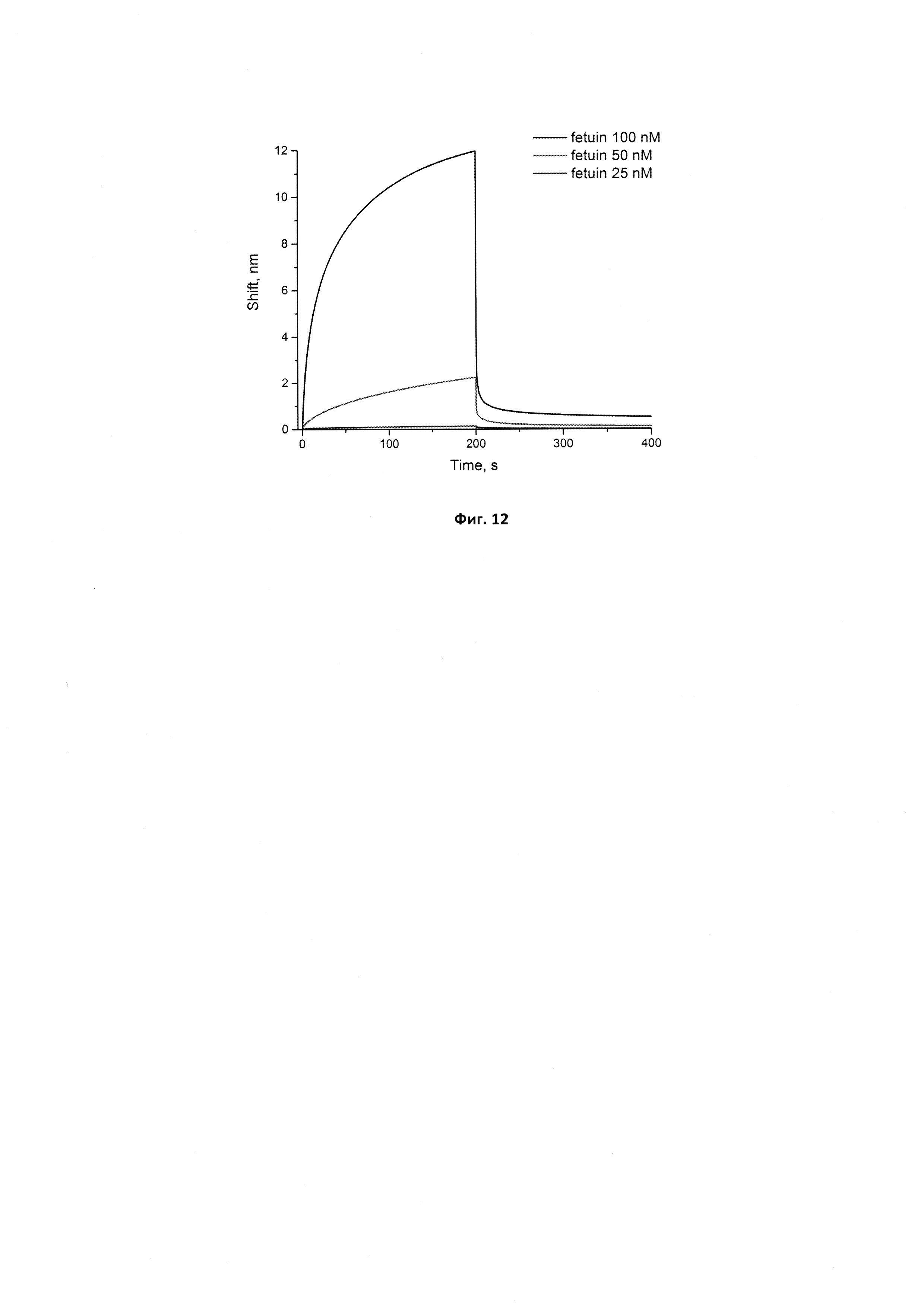
Фигура 12. Сенсограммы связывания иммобилизованного стабилизированного аптамера GR200 с фетуином в концентрациях 25, 50 и 100 нМ. Сигнал от связывания аптамера с буфером вычтен из сенсограмм.
Сущность изобретения
Разрабатываемые нами аптамеры к рецептору эпидермального фактора роста EGFR и к его мутантной форме EGFR vIII - в частности, объект патентирования, ДНК аптамер GR200 - связываются с внеклеточным доменом белка. Вторичные структуры исходного и стабилизированного аптамеров приведены на фиг. 1.
Стабилизированный аптамер GR200 узнает внеклеточный домен EGFR с аффинностью в 1,2 раза выше, чем у исходного аптамера GR20, а также связывается с мутантной версией белка EGFR vIII с такой же аффинностью как у исходного аптамера GR20. Стабилизация дуплексной части аптамера привела не только к увеличению термической стабильности, но и к улучшенному взаимодействию с белками при соблюдении требования к длине нуклеотида не выше, чем 50 нуклеотидов. Также в результате эксперимента была установлена специфичность нового ДНК-аптамера на отрицательном контроле - фетуине, белке плазмы крови, и аффинность к фетуину, которая оказалась на 1-2 порядка ниже, чем аффинность к целевым белкам EGFR и EGFR vIII.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1 Исследование термической стабильности.
Главный параметр, позволяющий оценивать термическую стабильность структуры аптамерного ДНК-олигонуклеотида - температура плавления Тпл. Исследование термической стабильности проводили при помощи метода УФ-спектроскопии. Для этого предварительно готовили 2 мкМ раствор аптамера в натрий-калий-фосфатном буфере рН 7,4 с 10 мМ К+, преформировали выдерживанием при 95°С в течение 5 минут и последующим охлаждением до 10°С. Поглощение ультрафиолетового света регистрировали при длине волны 260 нм при различных температурах от 10°С до 85°С при нагревании образца со скоростью 0,5°С в минуту. Из каждого значения поглощения образца вычитали поглощение натрий-калий-фосфатного буфера рН 7,4 с 10 мМ К+ при 260 нм. Коэффициент экстинкции ε получали путем деления значения поглощения А на концентрацию аптамера в образце. Значение температуры плавления Тпл как точки перегиба на графике кривой плавления ε=f(T) находили аппроксимацией в программе Origin.
В приведенных выше условиях температура плавления исходного аптамера GR20 составляет Тпл=28,6±0,2°С, что не удовлетворяет требованиям термической стабильности. В то же время новый аптамер GR200 денатурирует в два этапа, поскольку его кривая плавления имеет два перегиба, которые соответствуют двум значениям температуры плавления: 27,1±0,4°С и 64,1±0,3°С, что в среднем дает значение 45,7±0,7°С, которое находится выше порога в 37°С и свидетельствует о стабилизации структуры по сравнению с исходным аптамером.
Пример 2 Методики по исследованию связывания аптамеров с белками методом биослойной интерферометрии.
Связывание исходного и стабилизированного аптамеров с рекомбинантным внеклеточным доменом белка человека EGFR (R&D Systems) и с рекомбинантным внеклеточным фрагментом его мутантной формы EGFR vIII (R&D Systems) изучали методом биослойной интерферометрии. Метод биослойной интерферометрии основан на сдвиге длины волны максимума интенсивности интерференции (нм) при изменении во времени толщины сорбированного на поверхности биосенсора слоя биомолекул, полученные кривые называются сенсограммами. Из сенсограмм, полученных для разной концентрации компонентов комплекса, вычисляют кажущуюся константу диссоциации кКд - главную характеристику аффинности комплекса. Поскольку лишь специфическая сорбция позволяет определить параметры комплексообразования, данный метод требует иммобилизации одного из компонентов комплекса на поверхности биосенсора. В настоящем исследовании были осуществлены два возможных способа формирования комплекса: 1) с иммобилизацией биотинилированного аптамера на стрептавидиновый сенсор и 2) с иммобилизацией белка за концевые аминогруппы лизина на сенсор с карбоксильными группами. Все исследования методом биослойной интерферометрии проводили на приборе Octet RED96 (ForteBio Pall, USA) при температуре 25°С.
а) Иммобилизованный аптамер.
Для иммобилизации аптамера на поверхность стрептавидинового чипа SAX необходимо иметь на 5'-конце аптамерного ДНК-олигонуклеотида биотиновую метку, которая вводится методом химического синтеза. Перед иммобилизацией 2 мкМ раствор аптамера в буфере 5 мМ Трис-HCl рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия преформировали выдерживанием при 95°С в течение 5 минут и последующим охлаждением до 25°С. Аптамер иммобилизовали на сенсор в концентрации 200 нМ до достижения значения плато. Сигнал стабилизировали, отмывая нековалентно связавшиеся молекулы аптамера при помощи промывания сенсора в 5 мМ Трис-HCl буфер рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия. В этом же буфере растворяли рекомбинантные белки EGFR и EGFR vIII, чтобы получить растворы концентрацией 45 и 100 нМ или 25 и 50 нМ соответственно, и проводили их связывание с иммобилизованным аптамером для количественного определения кажущейся константы диссоциации кКд. Стадия ассоциации длилась 200 с, стадия диссоциации - 300 с. В качестве отрицательного контроля провели аналогичные эксперименты с телячьим фетуином (SigmaAldrich). Первичная обработка данных, полученных на приборе, включала в себя вычитание сигнала от взаимодействия иммобилизованного аптамера с буфером 5 мМ Трис-HCl рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия.
Каждую сенсограмму обрабатывали вручную при помощи программного обеспечения Origin (OriginLab Corporation) с целью получения данных по кинетике образования комплекса. Комплекс (АБ) аптамера (А) и белка (Б) образуется по следующей реакции:
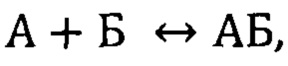
причем константа скорости прямой реакции (ассоциации) - ka, а константа скорости обратной реакции (диссоциации комплекса) kd. Из изменения сигнала на стадии ассоциации можно получить обе эти константы, а из стадии диссоциации - только константу скорости диссоциации [1]. Из соотношения величин этих констант скоростей вычислили равновесную кажущуюся константу диссоциации кКд по уравнению:
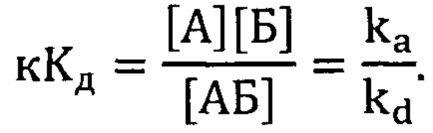
б) Иммобилизованный белок.
Для проверки симметричности образования комплекса для нового аптамера GR200 провели соответствующий опыт с иммобилизованным белком рецептором эпидермального фактора роста. В качестве референса использовали сенсоры с иммобилизованным моноклональным антителом к EGFR С225 (Merck).
Иммобилизация белков проводилась методом сочетания свободных аминогрупп белка (например, ε-аминогрупп остатков лизина) и карбоксильных групп на поверхности биосенсора AR2G. Биосенсоры активировали свежеприготовленной активирующей смесью 40 мМ гидрохлорида 3-(3-диметиламинопропил)-1-этилкарбодиимида и 10 мМ сульфо-N-гидроксисукцинимида. Затем на активированную поверхность биосенсоров иммобилизовали белки EGFR, EGFR vIII или С225, разведенные в 40 мМ натрий-калий-фосфатном буфере рН 6,43 до концентраций 1 мкг/мл, 1 мкг/мл или 5 мкг/мл соответственно. Оба белка иммобилизовали на разные биосенсоры до выхода сигнала на плато. Затем проводили деактивацию несвязавшихся карбоксильных групп биосенсора при помощи 1 М гидрохлорида этаноламина рН 8,5. Сигнал стабилизировали, отмывая нековалентно связавшиеся молекулы белка при помощи опускания сенсора в 5 мМ Трис-HCl буфер рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия. В этом же буфере преформировали 2 мкМ раствор аптамера. Для количественного определения кажущейся константы диссоциации кКд связывание с белком проводили для растворов аптамера в концентрациях 50, 125, 250, 500 нМ. Стадия ассоциации длилась 200 с, стадия диссоциации - 300 с. Для регенерации белка после стадии взаимодействия с аптамером использовали раствор 1 М гидрохлорида этаноламина рН 8,5. Первичная обработка данных, полученных на приборе, включала в себя вычитание сигнала от взаимодействия аптамера с антителом С225. каждую сенсограмму обрабатывали описанным выше способом. Во всех случаях сигнал от взаимодействия аптамера с отрицательным контролем С225 был значительно ниже сигнала от взаимодействия с EGFR или EGFR vIII.
Пример 3 Исследование связывания с рецептором эпидермального фактора роста EGFR.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового аптамера GR200, иммобилизованного на поверхности биосенсора, с белком рецептором эпидермального фактора роста EGFR, приведены на фиг. 5.
Для комплекса исходного аптамера GR20 с рекомбинантным белком EGFR ранее в нашей лаборатории была получена кажущаяся константа диссоциации кКд, равная 6±2 нМ, однако для измерений был использован методом поверхностного плазмонного резонанса на иммобилизованном белке. Для корректного сравнения исходного и нового аптамеров мы вычислили кажущиеся константы диссоциации их комплексов с рекомбинантным внеклеточным фрагментом EGFR методом биослойной интерферометрии. Для этого получили сенсограммы для взаимодействия иммобилизованного исходного аптамера GR20 с белком EGFR (фиг. 6).
В случае иммобилизации аптамера на поверхность биосенсора кКд для исходного аптамера GR20 составила 4,6±1,2 нМ, для нового аптамера GR200 - 4,0±0,2 нМ. Таким образом, методом биослойной интерферометрии установлено, что стабилизированный аптамер GR200 обладает не меньшим сродством к рекомбинантному внеклеточному фрагменту белка EGFR по сравнению с исходным аптамером GR20.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового аптамера GR200 с белком рецептором эпидермального фактора роста EGFR, иммобилизованным на поверхности биосенсора, приведены на фиг. 7.
Вычисленная кажущаяся константа диссоциации кКд для комплекса GR200-EGFR при иммобилизации белка составляет 0,92±0,19 нМ, что в 4 раза ниже константы кКд, полученной для комплекса с иммобилизованным аптамером. Это расхождение в значениях может быть связано с различиями в состоянии белка при иммобилизации на поверхность и в растворе. Тем не менее, оба значения свидетельствуют о высокой аффинности нового аптамера GR200 к белку EGFR (высокоаффинными считаются комплексы со значениями кКд около 1 нМ).
Пример 4 Исследование связывания с мутантной формой рецептора эпидермального фактора роста EGFR vIII.
Связывание стабилизированного аптамера с рекомбинантным внеклеточным доменом белка человека EGFR vIII (R&D Systems) также изучали методом биослойной интерферометрии. В настоящем исследовании комплексообразования аптамера с мутантной формой белка EGFR vIII также были осуществлены два возможных способа формирования комплекса: 1) с иммобилизацией биотинилированного аптамера на стрептавидиновый сенсор и 2) с иммобилизацией белка за концевые аминогруппы лизина на сенсор с карбоксильными группами.
Сенсограммы, полученные методом биослойной интерферометрии для вычисления кажущейся константы диссоциации комплекса нового аптамера GR200, иммобилизованным на поверхности биосенсора, с белком рецептором эпидермального фактора роста EGFR, приведены на фиг. 8.
Для сравнения исходного и нового аптамеров был проведен аналогичный эксперимент с GR20 (фиг. 9).
Для комплексов обоих аптамеров - исходного и нового - с рекомбинантным внеклеточным фрагментом EGFR vIII были вычислены кажущиеся константы диссоциации комплексов методом биослойной интерферометрии. Для исходного аптамера GR20 кКд составила 1,28±0,05 нМ, для нового аптамера GR200 - 1,24±0,17 нМ. Таким образом, методом биослойной интерферометрии установлено, что стабилизированный аптамер GR200 обладает не меньшим сродством к рекомбинантному внеклеточному фрагменту мутантной формы белка EGFR vIII по сравнению с исходным аптамером GR20.
Для проверки симметричности образования комплекса для нового аптамера GR200 провели соответствующий опыт с иммобилизованной мутантной формой рецептора эпидермального фактора роста EGFR vIII (см. фиг. 10). В качестве референса использовали сенсоры с иммобилизованным моноклональным антителом к EGFR С225.
Вычисленная кажущаяся константа диссоциации кКд для комплекса GR200-EGFR vIII составляет 0,60±0,09 нМ, что в 2 раза ниже константы кКд, полученной для комплекса с иммобилизованным аптамером. Это расхождение в значениях может быть связано с тем, что состояния белка различны при иммобилизации на поверхность и в растворе. Тем не менее, оба значения свидетельствуют о высокой аффинности нового аптамера GR200 к белку EGFRvIII (высокоаффинными считаются комплексы со значениями кКд около 1 нМ).
Пример 5 Исследование связывания с фетуином.
Для оценки специфичности нового аптамера GR200 проверили его связывание с телячьим фетуином (SigmaAldrich). Для этого сенсоры с иммобилизованными аптамерами исходным GR20 и стабилизированным GR200 опускали в растворы фетуина в 5 мМ Трис-HCl буфере рН 7,0 с добавлением 140 мМ хлорида натрия и 10 мМ хлорида калия в концентрациях 25, 50 и 100 нМ. Полученные сенсограммы представлены на рис. 11 и 12. Оба аптамера показывают сходные кажущиеся константы диссоциации в комплексе с фетуином (40±10 нМ для исходного аптамера и 60±20 для нового стабилизированного аптамера), которые значительно выше констант, полученных для аптамера с белком EGFR, что свидетельствует о специфичности исходного и нового аптамеров по отношению к белкам EGFR и EGFR vIII.
Специалистам в данной области будет понятно, что в описанные выше варианты осуществления можно вносить многочисленные изменения и/или модификации без отклонения от широкого общего объема настоящего изобретения. Таким образом, представленные варианты осуществления следует считать во всех аспектах иллюстративными, но не ограничивающими.
Список литературы:
1. O'Shannessy, D.J., Brighamburke, М., Soneson, K.K., Hensley, P., & Brooks, I. (1993). Determination of Rate and Equilibrium Binding Constants for Macromolecular Interactions Using Surface Plasmon Resonance: Use of Nonlinear Least Squares Analysis Methods. Analytical Biochemistry, 212(2), 457-468.
2. Sickmier, E.A., Kurzeja, R.J.M., Michelsen, K., Vazir, M., Yang, E., & Tasker, A.S. (2016). The Panitumumab EGFR Complex Reveals a Binding Mechanism That Overcomes Cetuximab Induced Resistance. PLOS ONE, 11(9), e0163366.
3. Felder, S. (1992). Kinetics of binding, endocytosis, and recycling of EGF receptor mutants. The Journal of Cell Biology, 117(1), 203-212.
--->
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> ДНК-аптамер GR200, узнающий внеклеточный домен EGFR
<140> 2019134984
<141> 31.10.2019
<160>
<210>
<211> 50
<212> ДНК
<213>
<400> CGACGCACCA TTTGTTTAAT ATGTTTTTTA ATTCCCCTTG TGGTGCGTCG
<---