Результат интеллектуальной деятельности: МОДИФИЦИРОВАННЫЕ АНТИТЕЛА IGG, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА БЕТА-1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка на патент заявляет преимущество предварительной заявки на патент США № 62/128149, поданной 4 марта 2015 г., которая включена в данный документ посредством ссылки во всей своей полноте.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Модифицированные антитела IgG, каждое из которых содержит первую, вторую, третью и четвертую полипептидные цепи, которые характеризуются высокой аффинностью и авидностью в отношении трансформирующего фактора роста β1 (TGFβ1), но не TGFβ2 или TGFβ3. Предлагаются композиции, содержащие модифицированные антитела IgG, и способы их применения для лечения заболеваний, в которые вовлечена активность TGFβ1.
Многие тяжелые заболевания связаны с нарушениями функционирования TGFβ-индуцированного сигнального пути. Например, считается, что повышенный уровень TGFβ в тканях является фактором развития идиопатического легочного фиброза и миокардиального фиброза. Кроме того, высокие локальные уровни TGFβ в тканях могут способствовать поддержанию жизнедеятельности и прогрессированию опухолей из некоторых типов раковых клеток. Таким образом, подавление передачи сигналов, опосредованной TGFβ, может снижать жизнеспособность таких опухолевых клеток.
Изоформы TGFβ представляют собой гомодимерные молекулы размером ~ 25 кДа со сходным структурным каркасом, в котором два мономера ковалентно связаны посредством дисульфидного мостика. Изоформы млекопитающих характеризуются идентичностью последовательностей, составляющей 70-82%, однако обладают неперекрывающимися видами активности в развитии сосудов и регуляции функции иммунных клеток. У людей были описаны три изоформы TGFβ: TGFβ1, TGFβ2 и TGFβ3 (номера доступа в Swiss Prot P01137, P08112 и P10600 соответственно). TGFβ1 и TGFβ3 запускают каскад передачи сигнала в клетке при связывании с внеклеточными доменами двух трансмембранных рецепторов, известных как рецепторы TGFβ I и II типа. TGFβ2 может связываться с рецепторами TGFβ I и II типа, а также с рецептором TGFβ III типа.
Антитела, которые могут связываться с человеческими TGFβ1, TGFβ2 и TGFβ3, были протестированы в отношении клинического применения. Например, Grütter и соавт. раскрыли GC1008, человеческое моноклональное антитело IgG4 (Mab; т. е. GC1008), в клинических исследованиях в отношении лечения злокачественных опухолей и фиброзных заболеваний. Proc. Nat'l Acad. Sci. USA 105(51): 20251-56 (2008). GC1008 представляет собой "панспецифичное" антитело, нейтрализующее TGFβ, поскольку оно может нейтрализовать все три изоформы человеческого TGFβ. Антитела, которые избирательно нейтрализуют TGFβ1, раскрыты, например, в патенте США № 6492497 и патенте США № 7151169, которые включены в данное раскрытие посредством ссылки. Метелимумаб, также известный как CAT192 (IgG4), представляет собой человеческое моноклональное антитело IgG4, которое избирательно нейтрализует TGF-β1. См., например, патент США № 6492497. Метелимумаб тестировали в отношении лечения диффузного кожного системного склероза, также известного как склеродермия, однако он продемонстрировал недостаточную эффективность.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем раскрытии предлагаются TGFβ1-связывающие модифицированные антитела IgG, которые способны избирательно связываться с человеческим TGFβ1 и нейтрализовать его. Раскрытые модифицированные антитела IgG получены из метелимумаба. VH- и VL-домены модифицированных антител IgG характеризуются аффинностью и авидностью связывания с TGFβ1 и способностью к нейтрализации TGFβ1, аналогичными таковым у метелимумаба. Во многих случаях раскрытые антитела обладают улучшенной аффинностью, авидностью и нейтрализующей способностью по сравнению с метелимумабом. В одном варианте осуществления модифицированные антитела IgG содержат две полипептидные цепи, каждая из которых содержит VL-домен, связанный с CL-доменом, и две полипептидные цепи, каждая из которых содержит VH-домен, связанный с CH1-доменом, шарнирной областью и Fc-областью.
Модифицированные антитела IgG по настоящему изобретению содержат вариабельный домен, который способен связываться с TGFβ1. В другом варианте осуществления раскрытые модифицированные антитела IgG включают в себя связывающий белок, который характеризуется Kd для человеческого TGFβ1, по меньшей мере на приблизительно 50% более низкой, чем Kd того же самого связывающего белка для человеческого TGFβ2, согласно измерениям по методу поверхностного плазмонного резонанса.
В другом варианте осуществления настоящее изобретение направлено на выделенный связывающий белок, содержащий вариабельный домен, который способен связываться с TGFβ1, где связывающий белок характеризуется Kd для человеческого TGFβ1, по меньшей мере на приблизительно 50% более низкой, чем Kd того же самого связывающего белка для человеческого TGFβ3, согласно измерениям по методу поверхностного плазмонного резонанса.
В дополнительном варианте осуществления настоящее изобретение направлено на выделенный связывающий белок, содержащий вариабельный домен, который способен связываться с TGFβ1, где связывающий белок характеризуется Kd для человеческого TGFβ1, по меньшей мере на приблизительно 50% более низкой, чем Kd того же самого связывающего белка для человеческого TGFβ2, и по меньшей мере на приблизительно 50% более низкой, чем Kd того же самого связывающего белка для человеческого TGFβ3, согласно измерениям по методу поверхностного плазмонного резонанса.
В дополнительном варианте осуществления настоящее изобретение направлено на выделенный связывающий белок, который связывается с TGFβ1, где связывающий белок содержит первую полипептидную цепь, вторую полипептидную цепь, третью полипептидную цепь и четвертую полипептидную цепь. В одном аспекте первая и вторая полипептидные цепи имеют следующую формулу в направлении от N-конца к C-концу:
(VL-домен)-(линкер 1)m-(CL-домен),
где VL-домен содержит область 1, определяющую комплементарность, вариабельного домена легкой цепи (LCDR1), область 2, определяющую комплементарность, вариабельного домена легкой цепи (LCDR2) и область 3, определяющую комплементарность, вариабельного домена легкой цепи (LCDR3), и где m равняется 1, и где линкер 1 содержит пептид, имеющий последовательность лейцин-глутаминовая кислота-изолейцин-лизин-Xp-Yq-Zr-аргинин-треонин-валин-аланин, при этом X, Y и Z независимо представляют собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и при этом каждое из p, q и r независимо представляет собой целое число от 0 до 5. В другом аспекте третья и четвертая полипептидные цепи имеют следующую формулу в направлении от N-конца к C-концу:
(VH-домен)-(линкер 2)n-(CH1-домен)-(шарнирная область)s-(Fc-область),
где VH-домен содержит область 1, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR1), область 2, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR2) и область 3, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR3); и где n равняется 0 или 1, и s равняется 0 или 1. В другом аспекте линкер 2 может содержать пептид, имеющий последовательность треонин-валин-серин-Ad-Be-Cf-серин-аланин-серин-треонин, при этом A, B и C независимо представляют собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и при этом каждое из d, e и f независимо представляет собой целое число от 0 до 5.
В одном аспекте линкер 2 может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48.
В одном аспекте HCDR1 может иметь аминокислотную последовательность SEQ ID NO: 7, HCDR2 может иметь аминокислотную последовательность SEQ ID NO: 8, и HCDR3 может иметь аминокислотную последовательность SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 15.
Каркасные области VH-домена могут быть выбраны из последовательности вариабельного домена тяжелой цепи зародышевого типа. VH-домен может быть выбран, например, из последовательностей человеческих VH-доменов, указанных под SEQ ID NO: 1 или SEQ ID NO: 2, или их варианта, имеющего модификации до пяти аминокислот включительно.
VL-домен раскрытого связывающего белка может содержать область 1, определяющую комплементарность, вариабельного домена легкой цепи (LCDR1), область 2, определяющую комплементарность, вариабельного домена легкой цепи (LCDR2) и область 3, определяющую комплементарность, вариабельного домена легкой цепи (LCDR3). В одном аспекте LCDR1 может иметь аминокислотную последовательность SEQ ID NO: 12, LCDR2 может иметь аминокислотную последовательность SEQ ID NO: 13, и LCDR3 может иметь аминокислотную последовательность SEQ ID NO: 14.
Каркасные области VL-домена могут быть выбраны из последовательности вариабельного домена лямбда- или каппа-цепи зародышевого типа. VL-домен может быть выбран, например, из последовательностей человеческих Vκ-доменов, указанных под SEQ ID NO: 3 или SEQ ID NO: 4, или их варианта, имеющего модификации до четырех аминокислот включительно. В одном варианте осуществления каждой полипептид димера может содержать VH-домен, указанный под SEQ ID NO: 1, и Vκ-домен, указанный под SEQ ID NO: 3, которые представляют собой соответственно VH- и VL-домены, присутствующие в метелимумабе.
В другом варианте осуществления Fc-область соединена с CH1-доменом с помощью шарнирной области. Шарнирная область может содержать аминокислотные последовательности, полученные из шарнирной области человеческого IgG1 или IgG4. Например, шарнирная область может содержать аминокислотную последовательность PKSCDKTHTCPPCPAPELLGGP (SEQ ID NO: 5) или ее вариант, имеющий до пяти аминокислотных модификаций включительно. В одном варианте осуществления длина шарнирной области может варьироваться от 1 до 15 аминокислот.
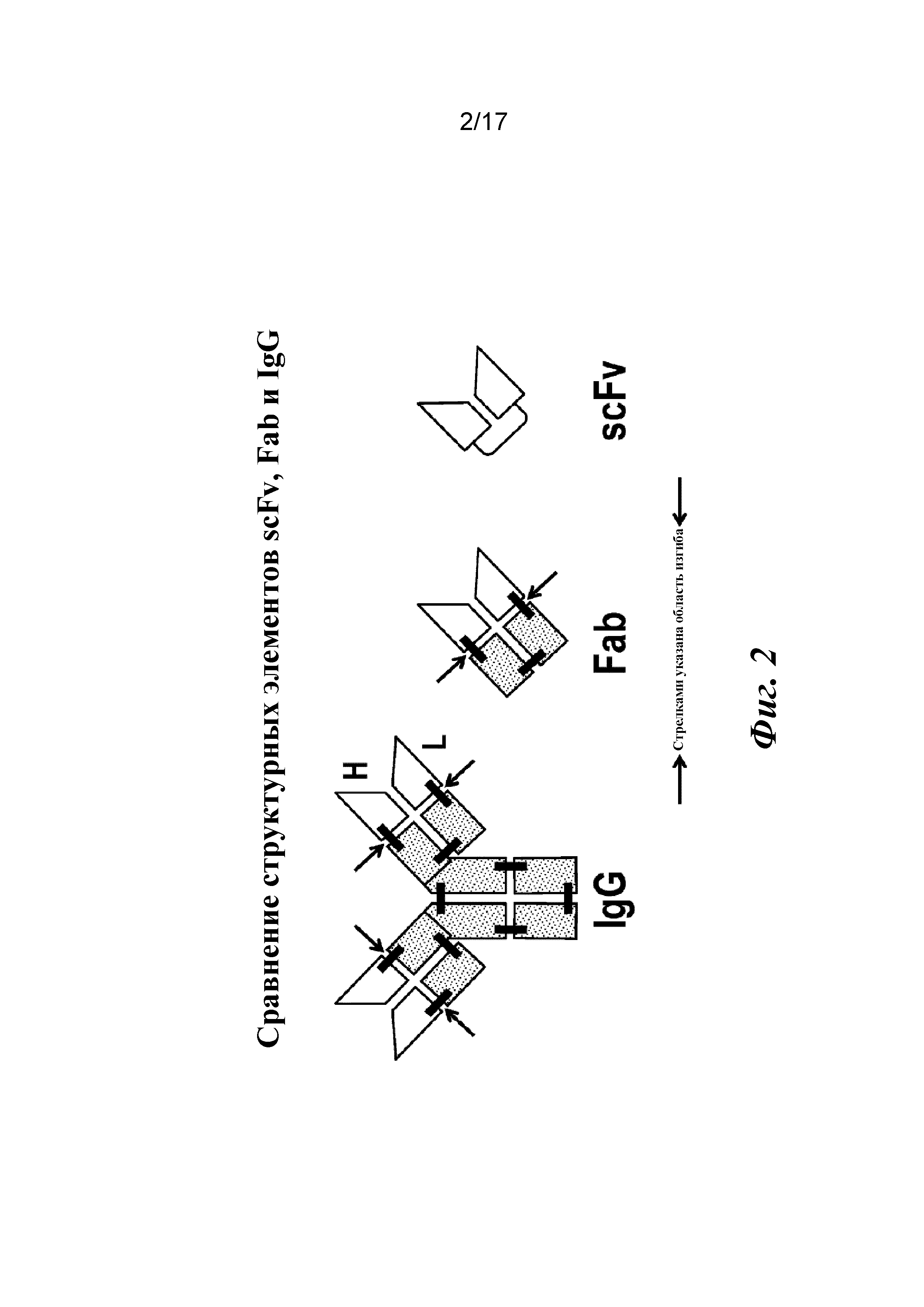
В другом варианте осуществления для улучшения аффинности связывания с TGFβ1 осуществляют сайт-направленный мутагенез областей изгиба Fab CAT192. От одной до пяти аминокислот (G, GG, GGS, GGGS и GGGGS) вставляют в область изгиба легкой цепи для повышения гибкости шарнирной области, что может потребоваться для представления функционального связывающего паратопа из двух цепей. Кондиционированные среды после трансфекции Expi293 демонстрируют хорошую экспрессию и значительное улучшение связывания с TGFβ1, определяемое с помощью Octet. Мутантные формы очищают с помощью Ni-NTA, и высокие значения аффинности связывания с TGFβ подтверждают с помощью Biacore. Мутантные формы CAT192 с 1-пятью аминокислотами, вставленными в область изгиба LC, вновь приобретают высокую аффинность связывания scFv с TGFβ1. Эти сконструированные мутантные формы со вставкой в области изгиба также сохраняют избирательность в отношении изоформ и могут выступать в качестве специфических антагонистов TGFβ1.
В другом аспекте VH-домен может содержать область 1, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR1), имеющую аминокислотную последовательность SEQ ID NO: 7, область 2, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR2), имеющую аминокислотную последовательность SEQ ID NO: 8, и область 3, определяющую комплементарность, вариабельного домена тяжелой цепи (HCDR3), имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 15.
В другом аспекте VL-домен может содержать область 1, определяющую комплементарность, вариабельного домена легкой цепи (LCDR1), имеющую аминокислотную последовательность SEQ ID NO: 12, область 2, определяющую комплементарность, вариабельного домена легкой цепи (LCDR2), имеющую аминокислотную последовательность SEQ ID NO: 13, и область 3, определяющую комплементарность, вариабельного домена легкой цепи (LCDR3), имеющую аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте линкер 1 может содержать пептид, имеющий последовательность лейцин-глутаминовая кислота-изолейцин-лизин-Xp-Yq-Zr-аргинин-треонин-валин-аланин, где X, Y и Z независимо представляют собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и каждое из p, q и r независимо представляет собой целое число от 0 до 5. В другом аспекте каждый из X, Y и Z предпочтительно представляет собой серин и глицин. В другом аспекте каждое из p, q и r равняется 1. В другом аспекте p равняется 0, и каждое из q и r равняется 1. В другом аспекте p равняется 1, и каждое из q и r равняется 0. В другом аспекте p равняется 2, и каждое из q и r равняется 1. В другом аспекте p равняется 1, и каждое из q и r равняется 2.
В одном варианте осуществления линкер 1 может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, каждая из которых представляет собой мутантную форму, полученную из SEQ ID NO: 21. В другом варианте осуществления первая полипептидная цепь содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, каждая из которых представляет собой мутантную форму, полученную из легкой цепи IgG1 CAT192 (SEQ ID NO: 38).
В другом аспекте каждый из линкера 1 и линкера 2 может независимо соответствовать описанному для линкера 1 выше. В этом аспекте линкер 2 может содержать пептид, имеющий последовательность лейцин-глутаминовая кислота-изолейцин-лизин-Ad-Be-Cf-аргинин-треонин-валин-аланин, где A, B и C независимо представляет собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и каждое из d, e и f независимо представляет собой целое число от 0 до 5. В другом аспекте каждый из А, В и С предпочтительно представляет собой серин и глицин. В другом аспекте каждое из d, e и f равняется 1. В другом аспекте d равняется 0, и каждое из e и f равняется 1. В другом аспекте d равняется 1, и каждое из e и f равняется 0. В другом аспекте d равняется 2, и каждое из e и f равняется 1. В другом аспекте d равняется 1, и каждое из e и f равняется 2.
В другом варианте осуществления линкер 2 может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, каждая из которых представляет собой мутантную форму, полученную из SEQ ID NO: 21. В другом варианте осуществления первая полипептидная цепь содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, каждая из которых представляет собой мутантную форму, полученную из легкой цепи IgG1 CAT192 (SEQ ID NO: 38).
В другом варианте осуществления раскрытый TGFβ1-связывающий Fab молекулы IgG избирательно связывается с TGFβ1, но не связывается с TGFβ2 или TGFβ3 в значительной степени.
В другом варианте осуществления раскрыт выделенный полинуклеотид, который может содержать нуклеотидную последовательность, кодирующую модифицированные антитела IgG, раскрытые в данном документе. Выделенный полинуклеотид может представлять собой кДНК, рекомбинантную ДНК или синтетическую ДНК. Клетка-хозяин может содержать выделенную нуклеиновую кислоту. Клетка-хозяин может представлять собой человеческую клетку, такую как человеческая эмбриональная клетка почки 293 (HEK293) и линии клеток, происходящие из нее, или она может представлять собой клетку яичника китайского хомячка (CHO). Способ получения модифицированных антител IgG может включать культивирование клетки-хозяина в условиях, подходящих для выработки модифицированных антител IgG. Модифицированные антитела IgG можно очищать. Степень чистоты может составлять 90%, 95%, 99%, 99,5% или более.
В определенных вариантах осуществления модифицированные антитела IgG по настоящему изобретению могут быть элементом композиции. Композиция может представлять собой фармацевтическую композицию. Фармацевтическая композиция может содержать терапевтически эффективное количество модифицированных антител IgG. Композиция может дополнительно содержать один или несколько биологически активных компонентов, наполнителей или разбавителей.
Также предлагается способ лечения заболевания или состояния, непосредственно или опосредованно обусловленного активностью TGFβ1, у человека, включающий введение фармацевтической композиции, содержащей терапевтически эффективное количество модифицированных антител IgG. Заболевание или состояние может быть выбрано из группы, состоящей из фиброзного заболевания, рака или иммуноопосредованного заболевания, например, диффузного кожного системного склероза, заболевания, характеризующегося нарушением ремоделирования костной ткани, заболевания почек и/или их комбинации. Модифицированные антитела IgG можно применять в производстве лекарственного препарата для лечения заболевания или нарушения, выбранного из группы, состоящей из фиброзного заболевания, рака или иммуноопосредованного заболевания, например, диффузного кожного системного склероза, заболевания, характеризующегося нарушением ремоделирования костной ткани, заболевания почек и/или их комбинации. Лечение заболевания или нарушения может включать нейтрализацию TGFβ1 или ингибирование передачи сигналов, опосредованной TGFβ1. Лечение заболевания или нарушения может включать ингибирование выработки фибронектина, выработки фактора роста эндотелия сосудов (VEGF), пролиферации эпителиальных клеток, пролиферации эндотелиальных клеток, пролиферации гладкомышечных клеток и/или подавления иммунитета, опосредованных TGFβ1. Лечение заболевания или нарушения может включать повышение активности естественных клеток-киллеров.
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ПРОЕКЦИЙ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Графические материалы, представленные в данном документе, приведены с целью иллюстрации и не должны использоваться для ограничения объема настоящего изобретения.
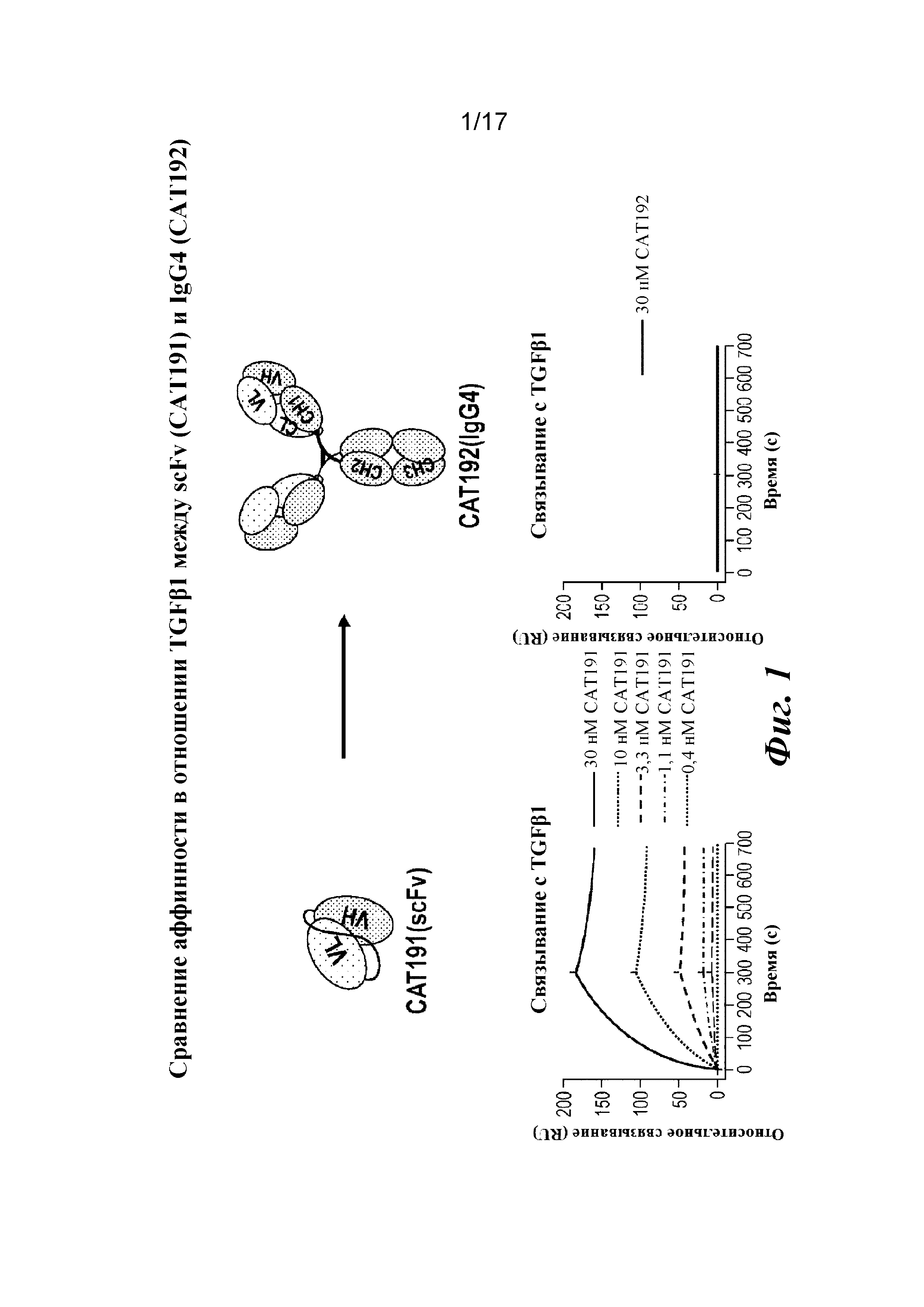
На фигуре 1 представлены результаты анализа связывания с TGFβ1 на Biacore, которые показывают утрату аффинности при превращении scFv (CAT191) в молекулу IgG4 полной длины (CAT192).
На фигуре 2 представлены структурные элементы scFv, Fab, молекулы IgG и области изгиба, которые были сконструированы для восстановления аффинности.
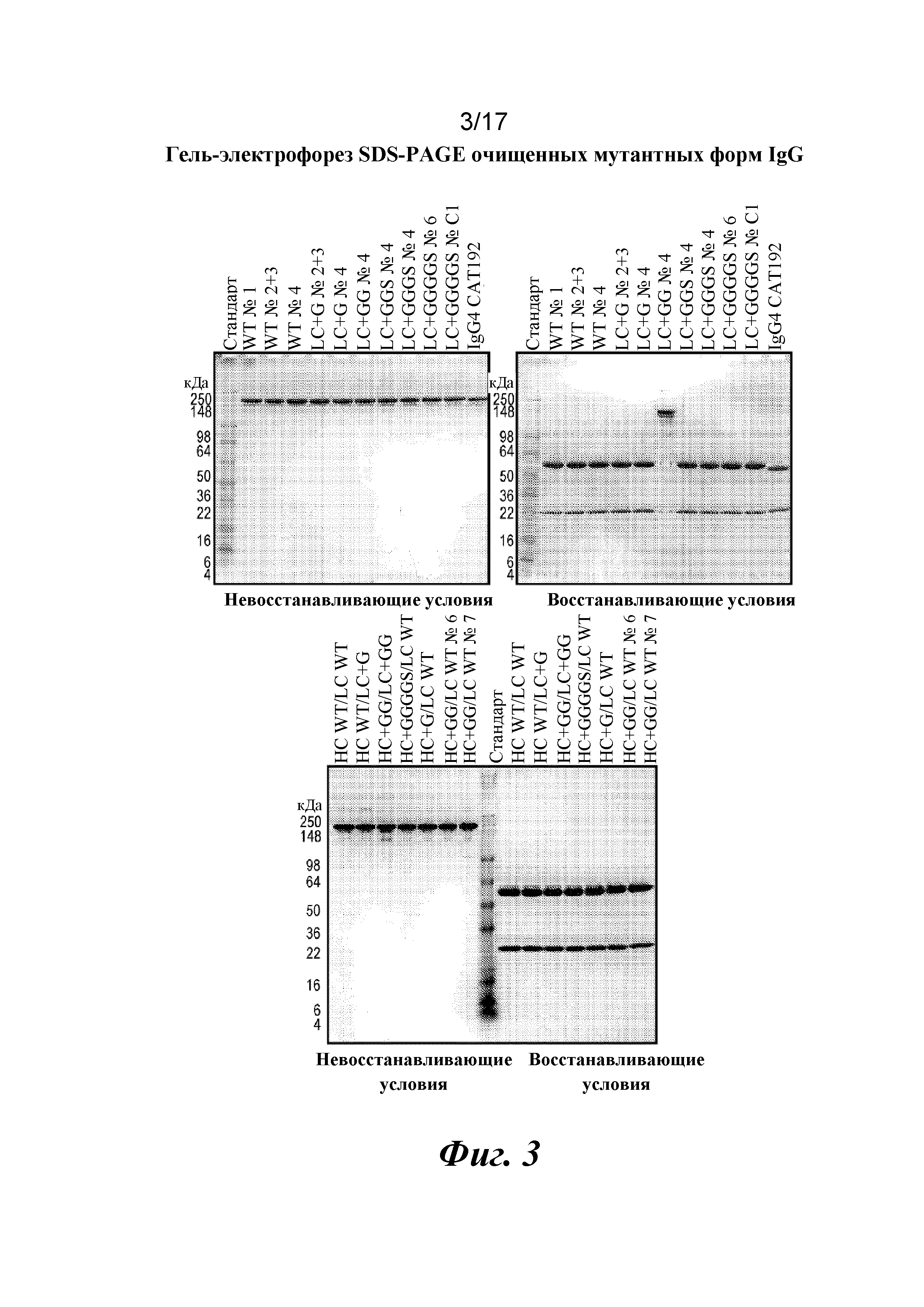
На фигуре 3 показаны результаты SDS-PAGE в геле для очищенных вариантов IgG с дополнительными аминокислотами в областях изгиба тяжелой и легкой цепей. SDS-PAGE показывает чистоту очищенных вариантов IgG в восстанавливающих и невосстанавливающих условиях.
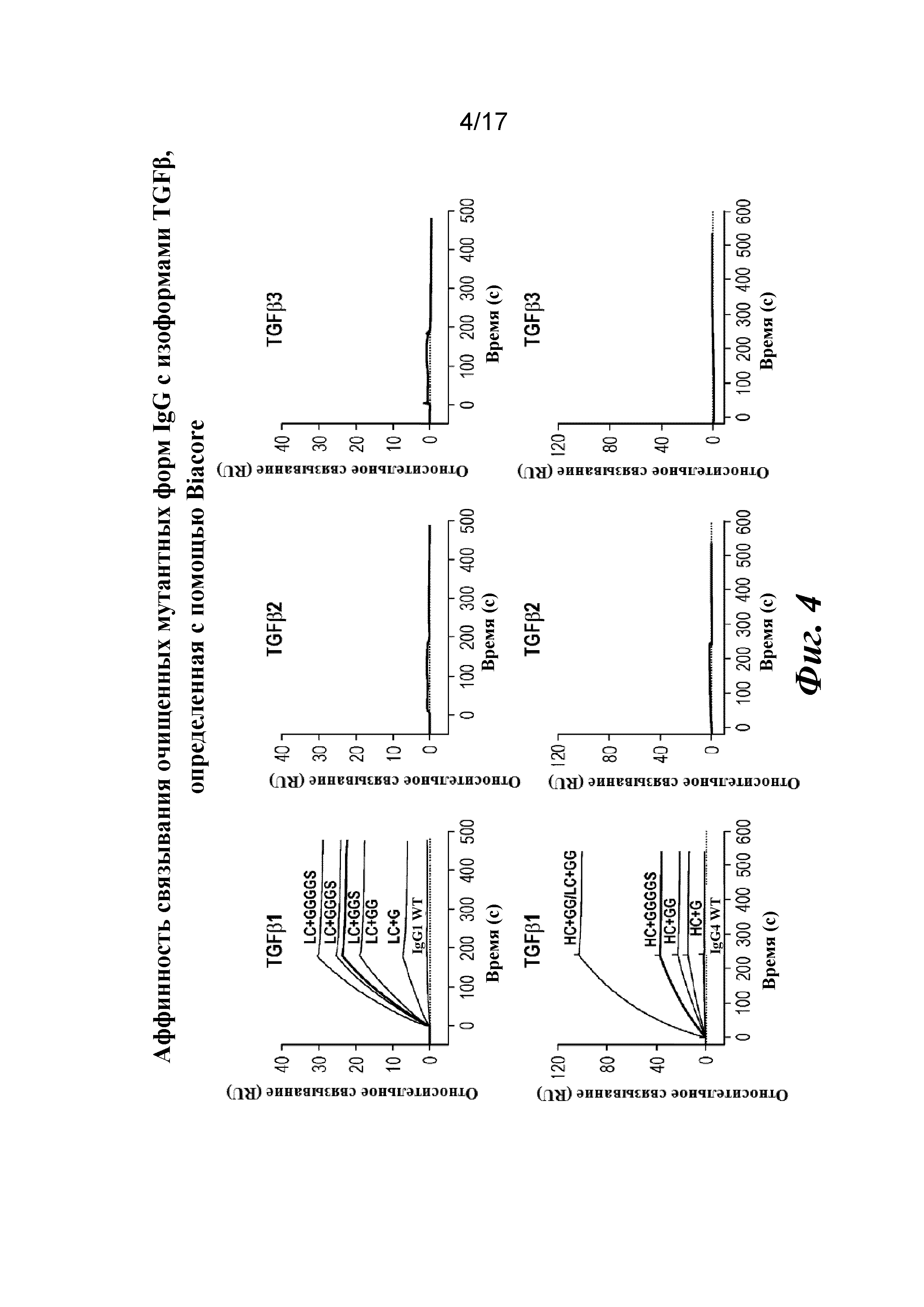
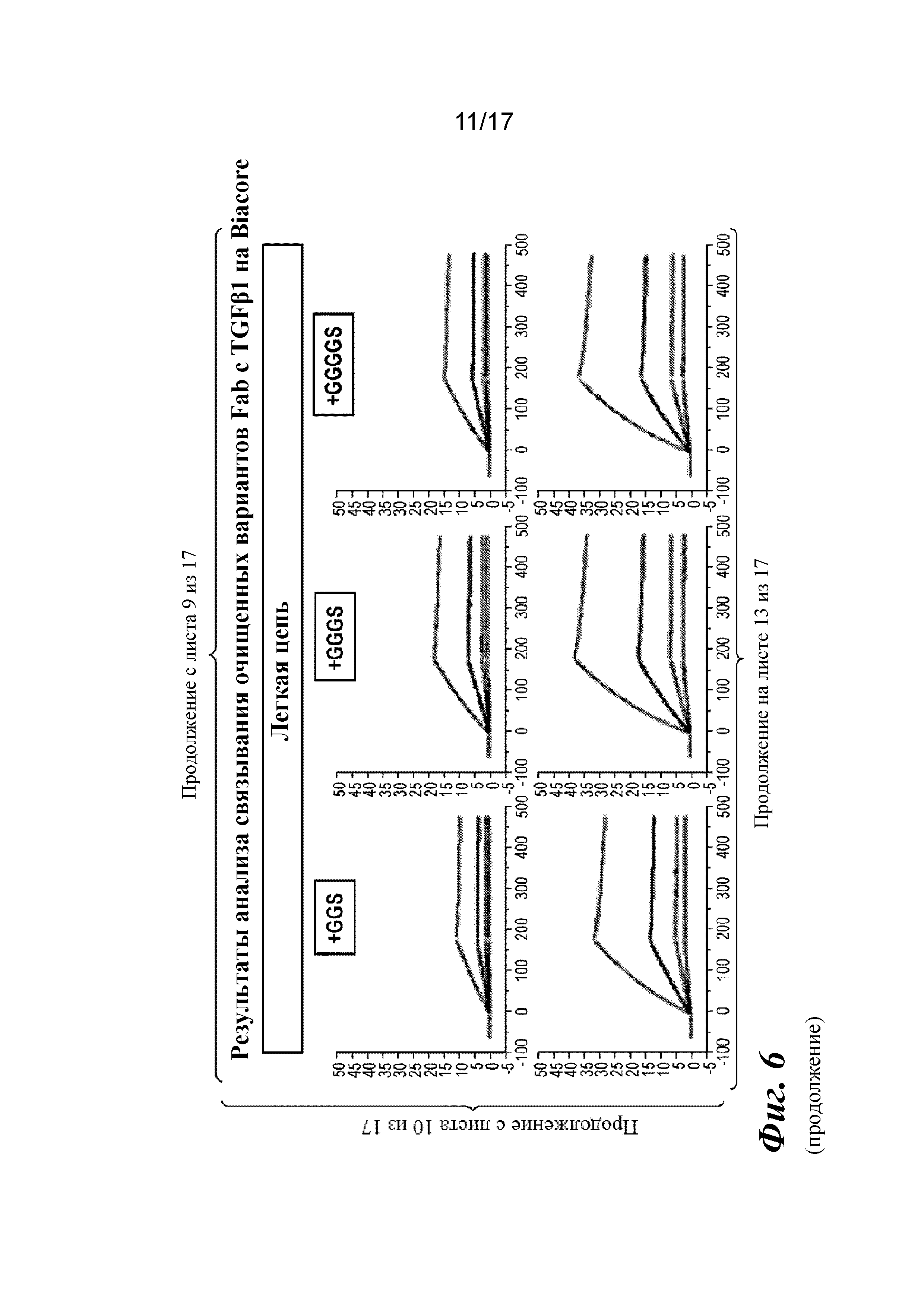
На фигуре 4 показан анализ связывания очищенных вариантов IgG с дополнительными аминокислотами в областях изгиба тяжелой и легкой цепей на Biacore. Результат анализа на Biacore демонстрирует избирательное в отношении изоформ и высокоаффинное связывание вариантов.
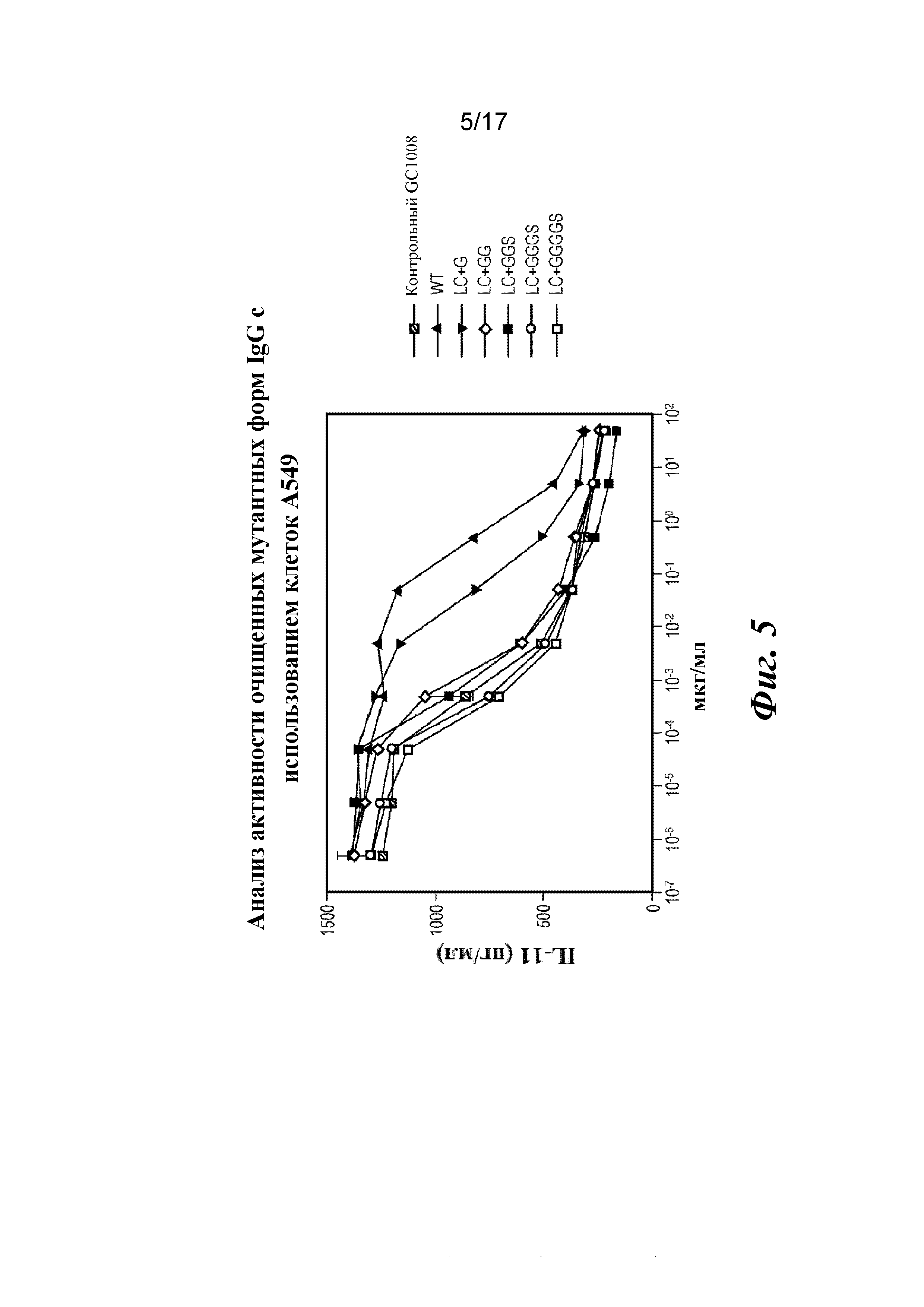
На фигуре 5 показан биологический анализ очищенных вариантов IgG с дополнительными аминокислотами в областях изгиба легкой цепи с использованием клеток А549. В анализе с использованием клеток A549 сравнивают ингибиторные эффекты различных конструкций антител в отношении выработки IL-11, стимулируемой TGFβ1, демонстрируя, что варианты со сконструированными областями изгиба являются высокоактивными в данном клеточном анализе активности.
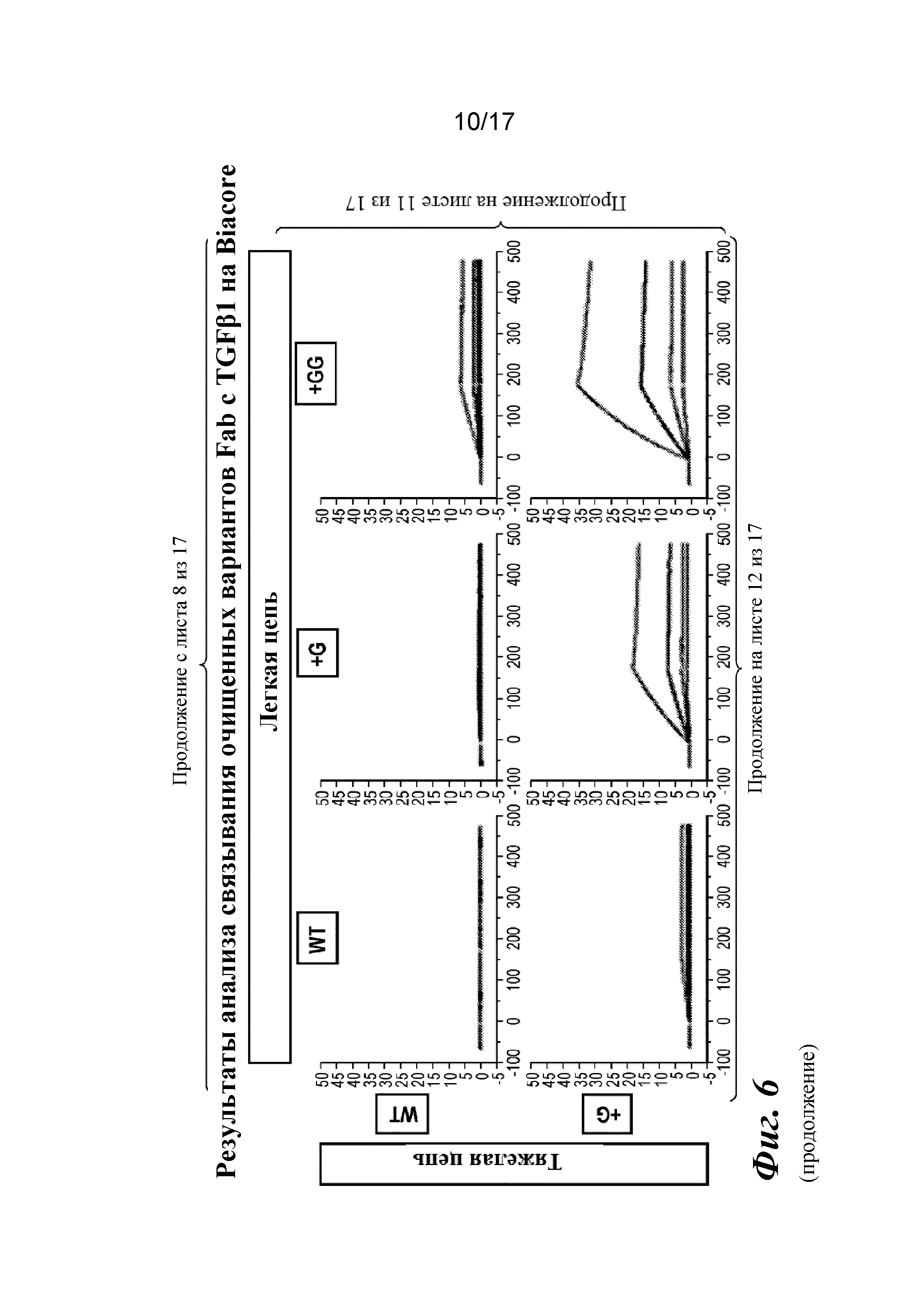
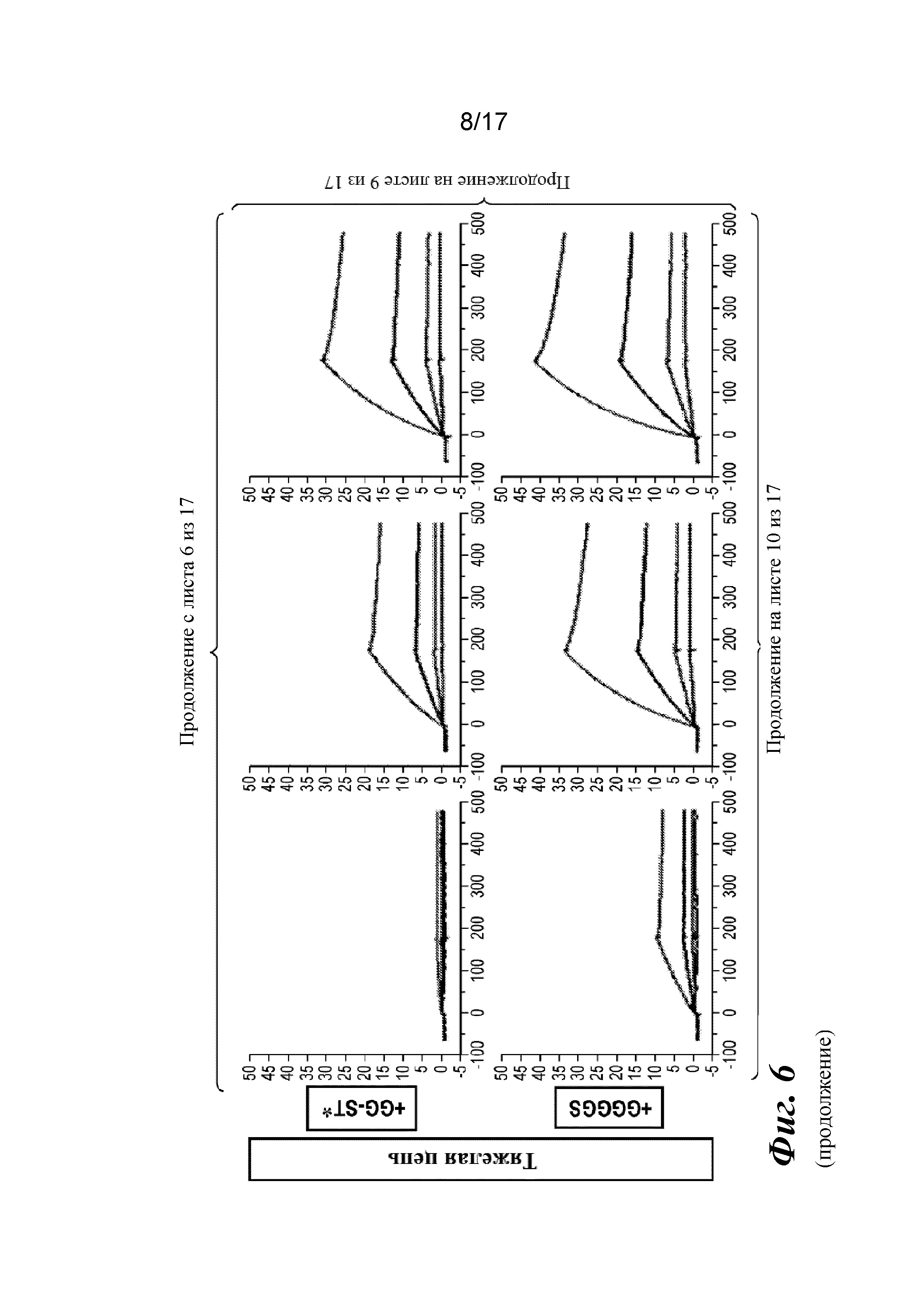
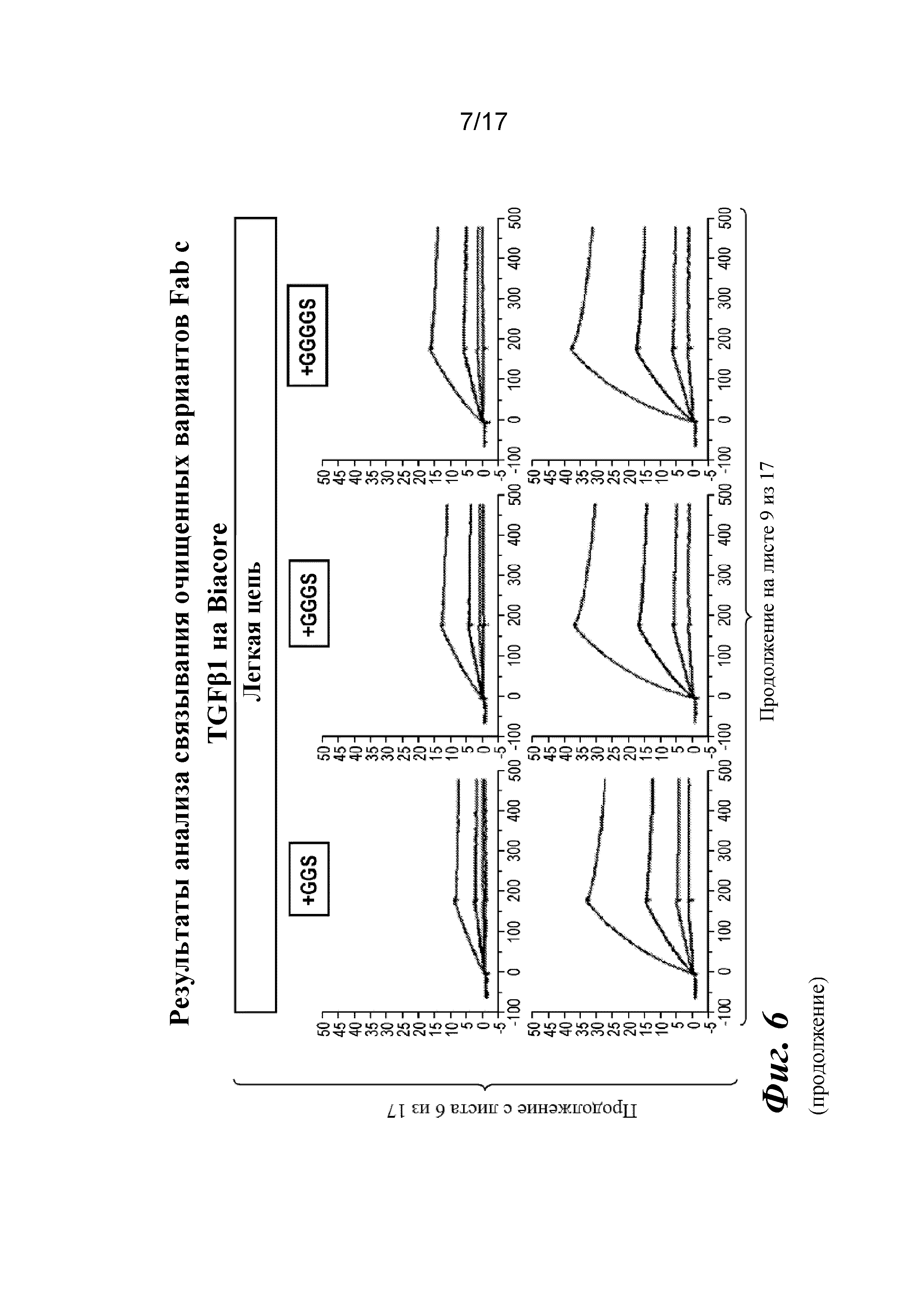
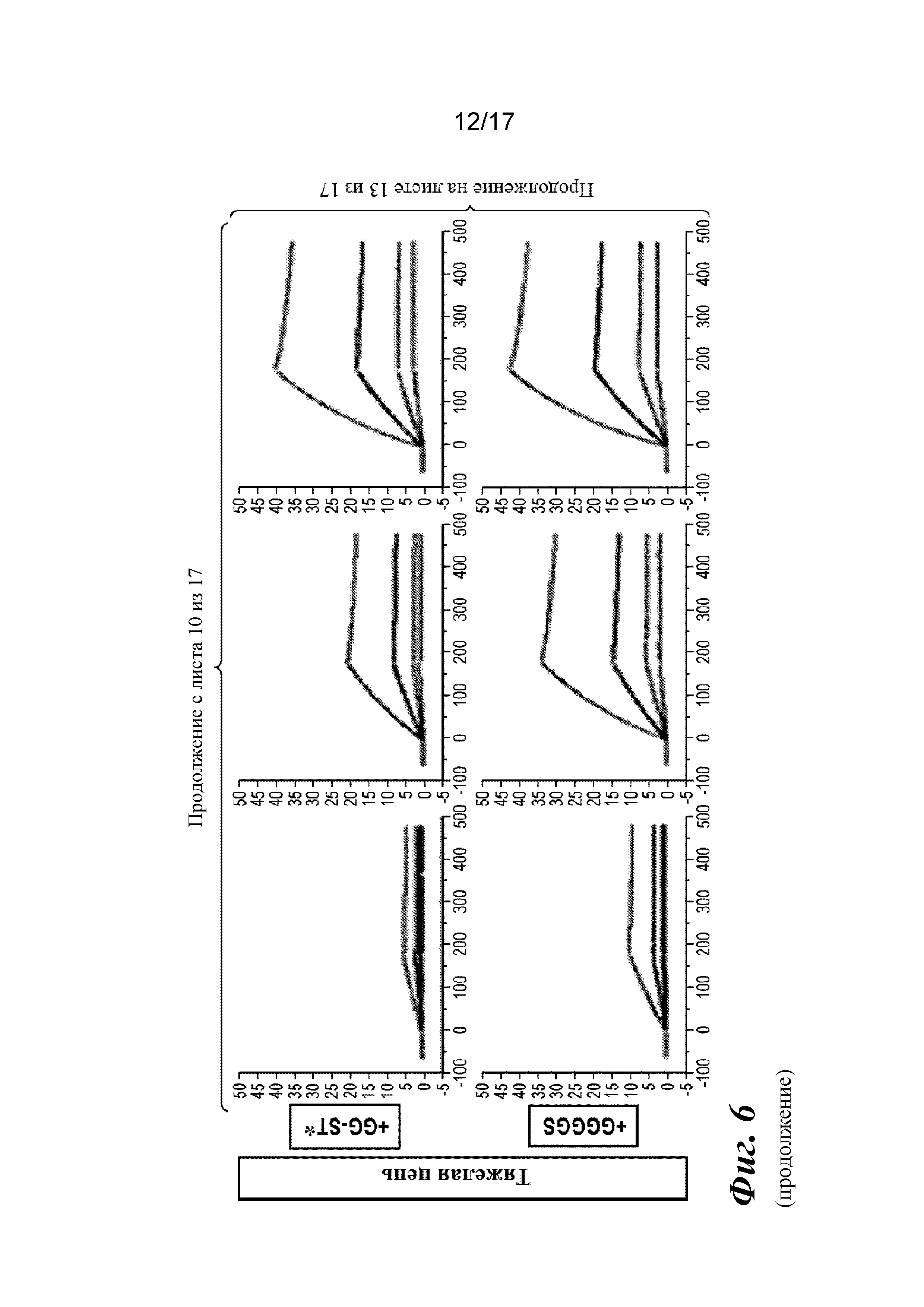
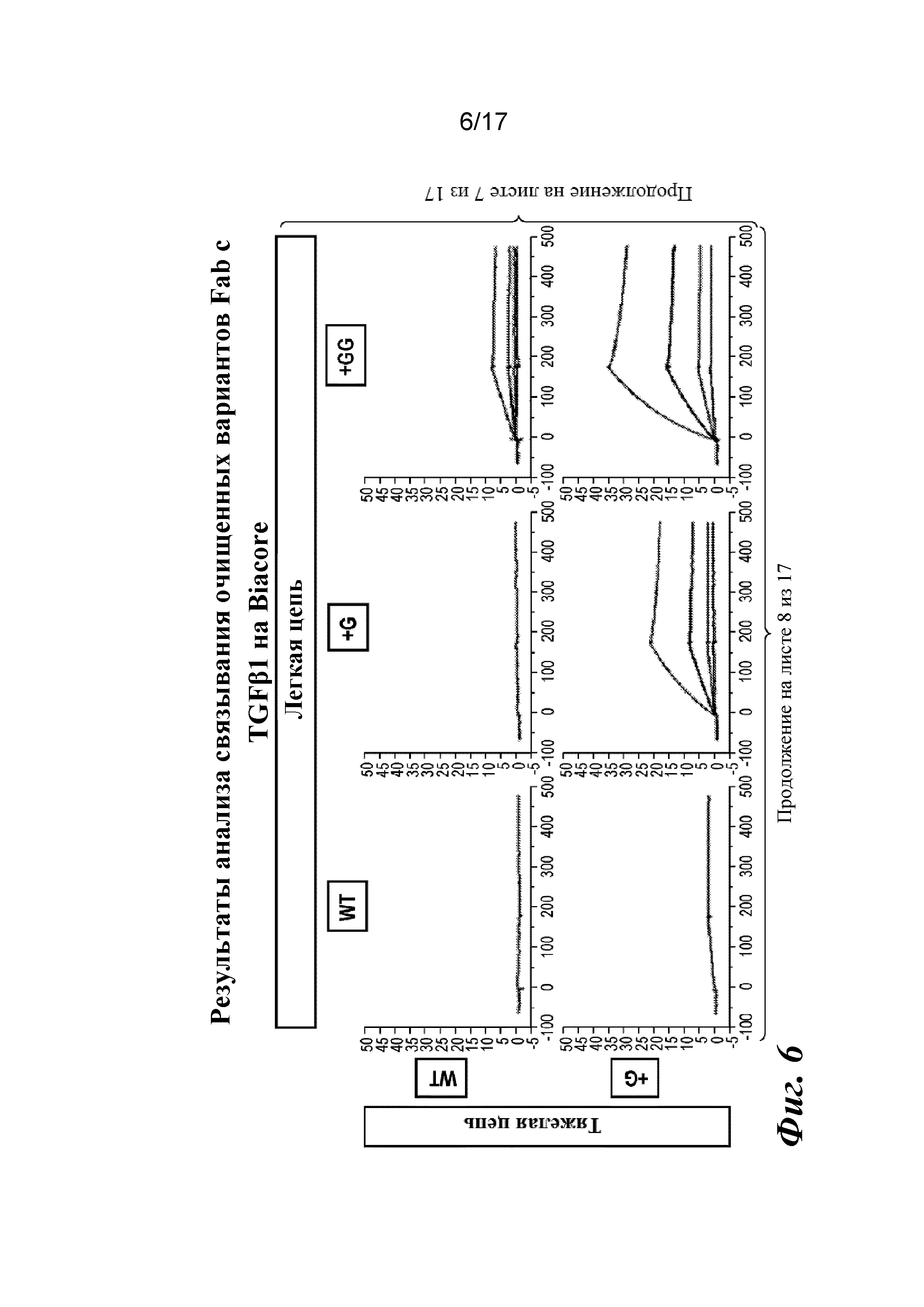
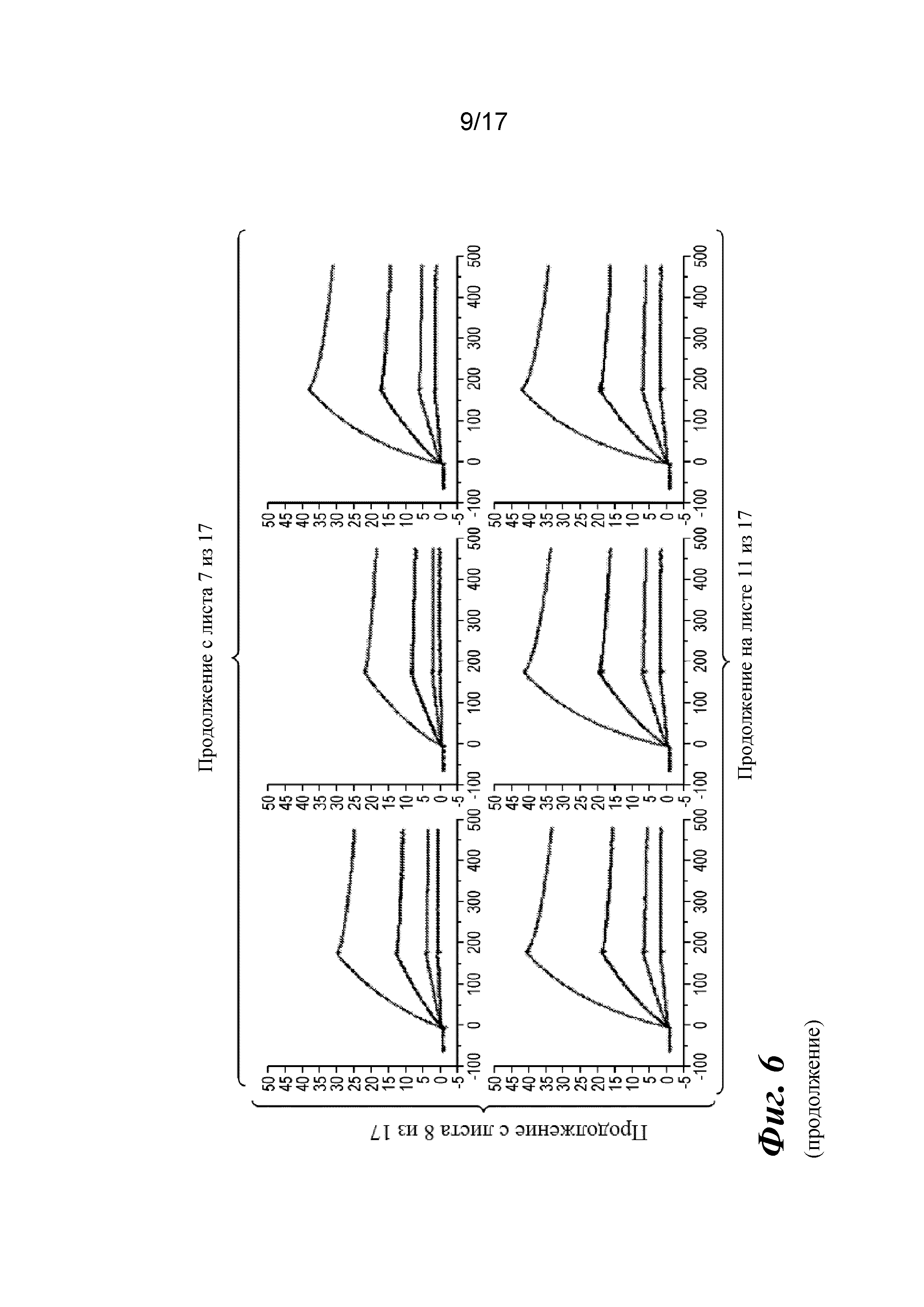
На фигуре 6 представлен анализ связывания с TGFβ1 на Biacore, который показывает, что высокая аффинность связывания вновь приобретается при вставке дополнительных аминокислот в область изгиба как тяжелой, так и легкой цепей Fab CAT192.
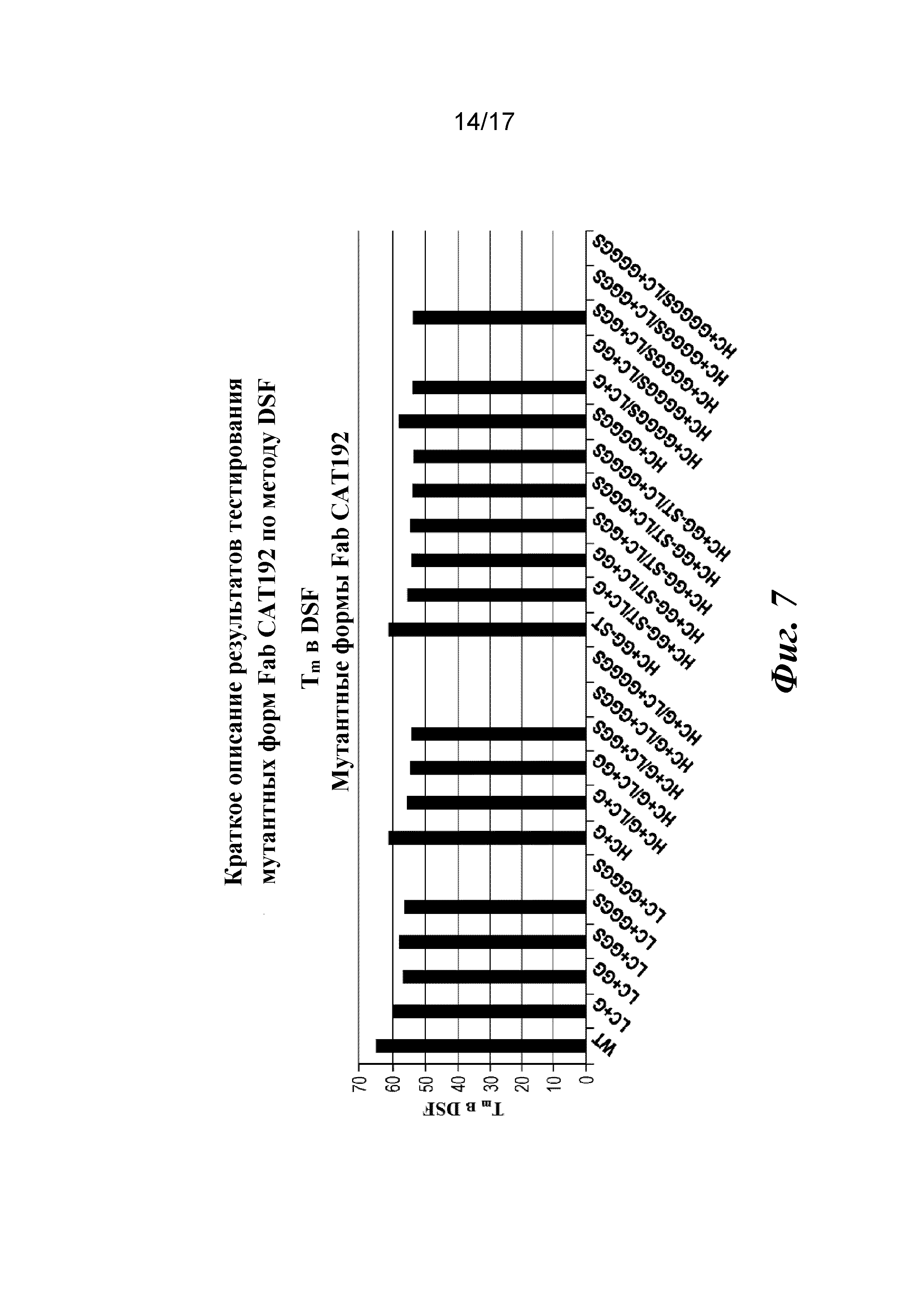
На фигуре 7 показаны результаты анализа термостабильности мутантных форм Fab CAT192 по методу дифференциальной сканирующей флуориметрии (DSF).
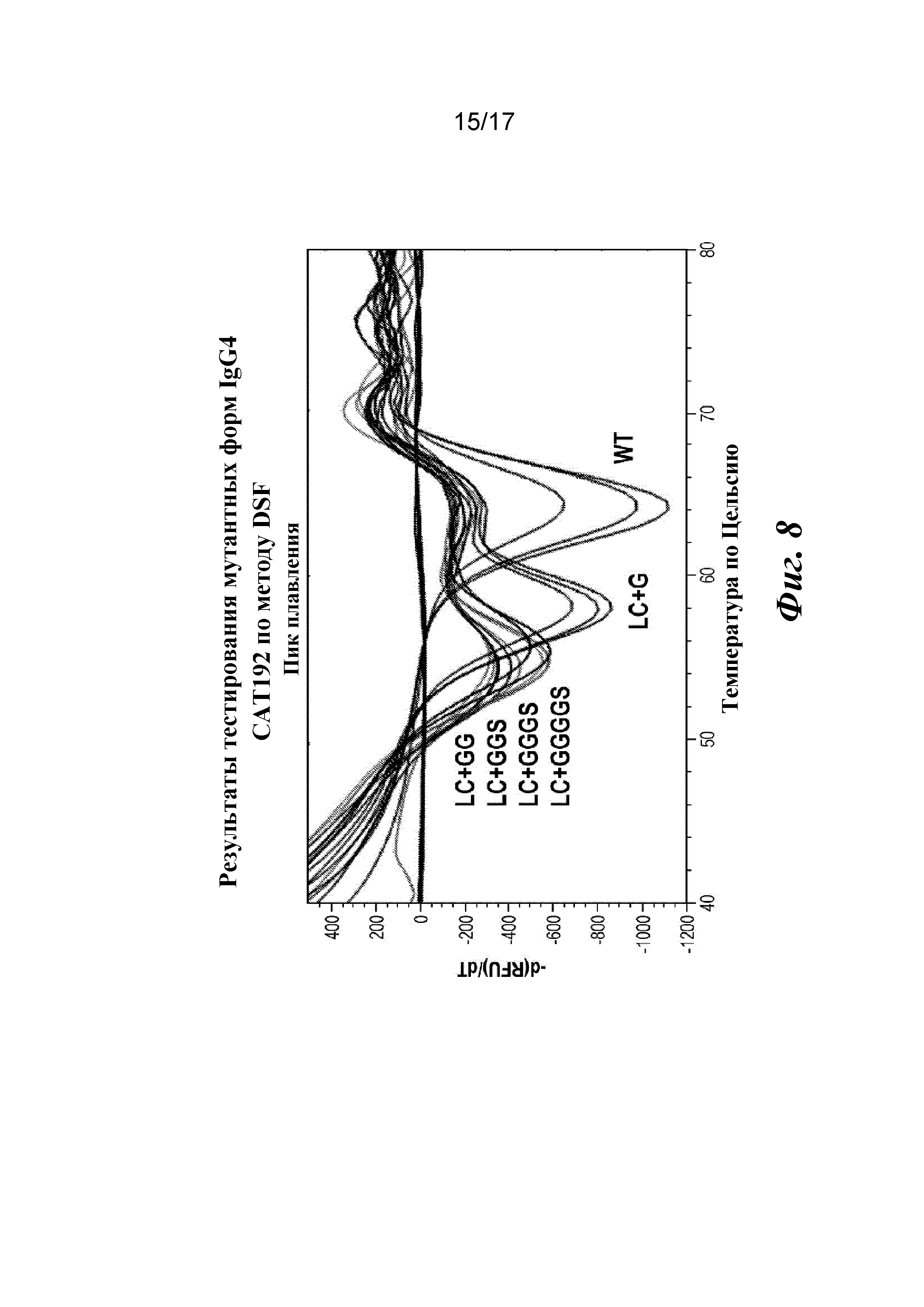
На фигуре 8 показаны результаты анализа термостабильности мутантных форм IgG4 CAT192 по методу дифференциальной сканирующей флуориметрии (DSF).
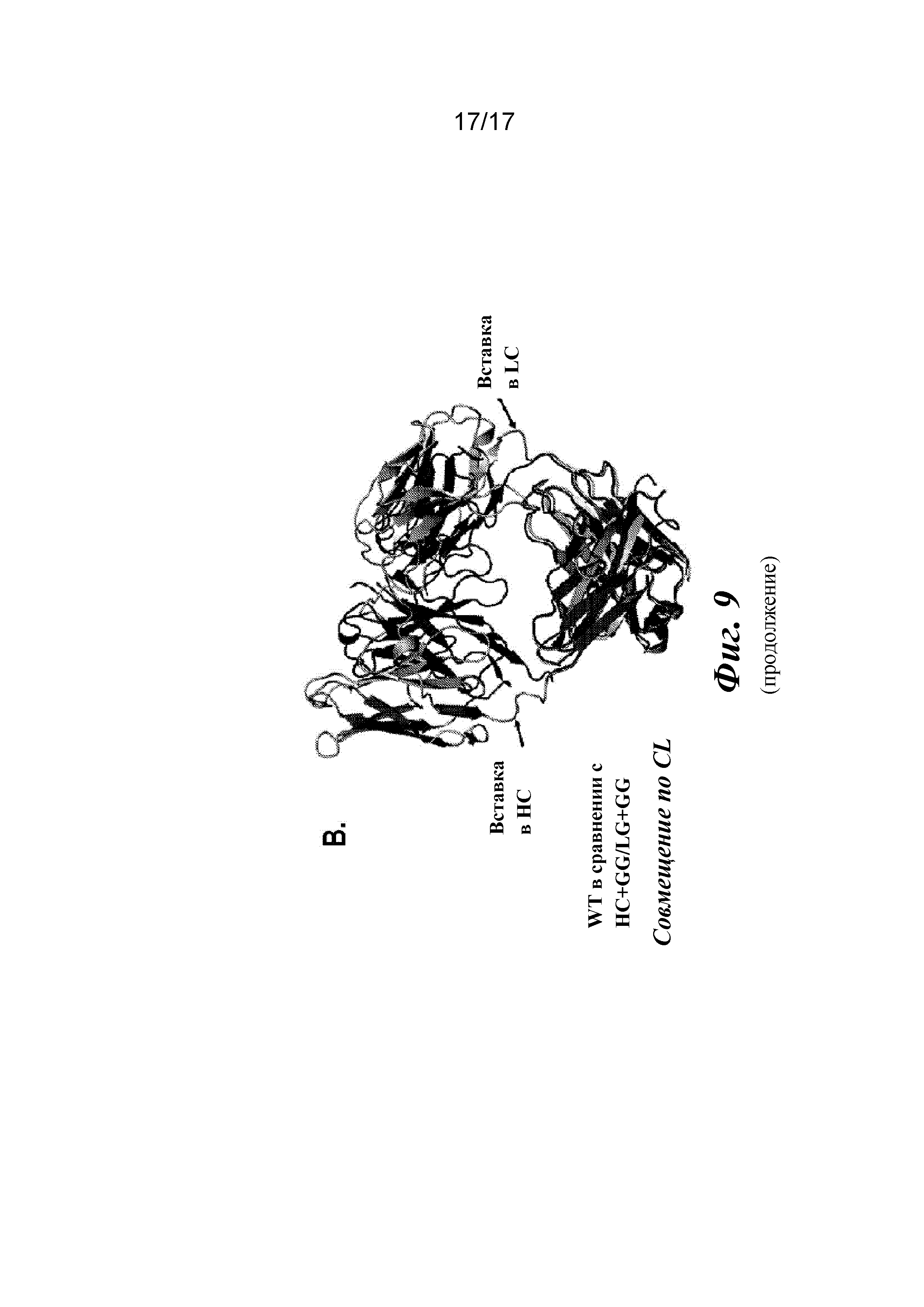
На фигуре 9 показаны кристаллические структуры, найденные для вариантов Fab CAT192.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Раскрытые модифицированные антитела IgG связываются с TGFβ1 и нейтрализуют его избирательно и с высокой аффинностью и авидностью. Модифицированные антитела IgG могут состоять из таких же VH- и VL-доменов, как и у метелимумаба. Модифицированные антитела IgG преимущественно характеризуются более высокой эффективностью нейтрализации TGFβ1, чем в случае применения вариабельных доменов в других форматах.
Как используется в данном документе, "первый элемент и/или второй элемент" означает определенное раскрытие первого или второго элемента по отдельности или первого и второго элементов в комбинации. Формы существительного единственного числа включают ссылку на формы множественного числа, если контекст четко не определяет иное.
"Выделенный" полинуклеотид (или нуклеиновая кислота) или белок удален от его природной формы и/или изменен по сравнению с ней с помощью технологий генной инженерии. "Очищенные" нуклеиновая кислота или белок могут быть фактически чистыми, например, по меньшей мере на 90% чистыми, или находиться в однородной форме.
"Избирательное связывание" или "избирательно связывающийся" с человеческим TGFβ1 означает, что связывающий белок (например, димер scFv-Fc) способен связываться с человеческим TGFβ1 с более высокой аффинностью, чем при связывании с человеческим TGFβ2 или человеческим TGFβ3, например, с константой диссоциации для человеческого TGFβ1, по меньшей мере на 50% более низкой, чем его константа диссоциации для человеческого TGFβ2 или человеческого TGFβ3, согласно измерениям по методу поверхностного плазмонного резонанса.
В одном варианте осуществления вариабельные домены модифицированных антител IgG по настоящему изобретению содержат области, определяющие комплементарность (CDR), из CDR, раскрытых в патенте США № 6492497 (например, SEQ ID NO: 11-19 в патенте США № 6492497), включенном в данный документ посредством ссылки. CDR-области перечислены ниже:
|
Неожиданно был выявлен консенсусный связывающий мотив HCDR3, имеющий следующую последовательность:
|
При этом: X1 может представлять собой любую аминокислоту (предпочтительно E или F) или отсутствовать,
X2 может представлять собой любую аминокислоту (предпочтительно S, D или P) или отсутствовать,
X3 может представлять собой любую аминокислоту (предпочтительно G, P или A) или отсутствовать,
X4 может представлять собой любую аминокислоту (предпочтительно V, Q или S) или отсутствовать,
X5 может представлять собой любую аминокислоту (предпочтительно E, Y или P) или отсутствовать,
X6 может представлять собой любую аминокислоту (предпочтительно L, S или D) или отсутствовать.
В одном варианте осуществления VH-домен раскрытых модифицированных антител содержит HCDR1, имеющую последовательность SEQ ID NO: 1: клон SL15 VH-домена человеческого IgG1 (SQN4 US6492497)
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSS
SEQ ID NO: 2: клон JT182 VH-домена человеческого IgG1 (SQN10 US6492497)
QVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTPASPDWGQGTTVTVSS
SEQ ID NO: 3: клон SL15A Vκ-домена человеческого IgG1: (SQN6 US6492497)
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIK
SEQ ID NO: 4: клон SL15S Vκ-домена человеческого IgG1: (SQN8 US6492497)
EIVLTQSPSSLSASVGDRVTITCRSSQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIK
SEQ ID NO: 5: шарнирная область человеческого IgG1
PKSCDKTHTCPPCPAPELLGGP
SEQ ID NO: 6: Fc-область человеческого IgG1
SVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 7, HCDR2, имеющую последовательность SEQ ID NO: 8, и HCDR3, имеющую последовательность, выбранную из группы, состоящей из
SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 15. Последовательности CDR могут быть отделены в любом месте каркасными областями в количестве от одной до четырех в следующем порядке от N-конца: FW1 - CDR1 - FW2 - CDR2 - FW3 - CDR3 - FW4. Каркасные области VH-домена могут быть выбраны из последовательности вариабельного домена тяжелой цепи зародышевого типа. В одном варианте осуществления последовательности FW-области могут быть выбраны из одной и той же последовательности человеческого вариабельного домена тяжелой цепи зародышевого типа. Каркасные области VL-домена могут быть выбраны из последовательности вариабельного домена лямбда- или каппа-цепи зародышевого типа, например, из одной и той же последовательности человеческого вариабельного домена лямбда- или каппа-цепи зародышевого типа. В настоящее время из уровня техники известно приблизительно 40 последовательностей вариабельных доменов тяжелых цепей зародышевого типа, а также приблизительно 40 последовательностей вариабельных доменов каппа-цепей зародышевого типа и приблизительно 30 последовательностей вариабельных доменов лямбда-цепей зародышевого типа, например, VH3, Vκ1, VH 1-69 и VH 1-e.
В другом варианте осуществления составные VH- или VL-домены можно получить путем применения последовательностей CDR, раскрытых в данном документе. Например, кристаллические структуры VH- или VL-доменов можно применять в качестве ориентира для получения составного домена с применением последовательностей CDR из одного антитела и с применением FW-областей зародышевого типа из другого антитела. Более подробную информацию можно найти в публикации заявки на патент США № 20020099179; а также в Homes and Foote, J Immunol. 1997 Mar 1;158(5):2192-201, обе из которых настоящим включены в данное раскрытие посредством ссылки.
Модифицированные антитела IgG по настоящему изобретению могут состоять из таких же VH- и VL-доменов, как и у метелимумаба, имеющих последовательности, указанные соответственно под SEQ ID NO: 1 и SEQ ID NO: 3. VH-домен может быть замещен VH-доменом, имеющим последовательности, указанные под SEQ ID NO: 2; VL-домен может быть замещен VL-доменом, имеющим последовательности, указанные под SEQ ID NO: 4. Эти VH- и VL-домены раскрыты в патенте США № 6492497 (например, SEQ ID NO: 4, 6, 8 и 10 в патенте США № 6492497), включенном в данный документ посредством ссылки.
"Вариабельный домен" (VD) относится к гипервариабельному связывающему домену иммуноглобулина или лигандсвязывающему домену рецептора, участвующему в связывании с антигеном/лигандом, как известно специалистам в данной области. Вариабельные домены обычно называют по их расположению в иммуноглобулине или происхождению; например, вариабельные домены легкой цепи иммуноглобулина (VL), вариабельные домены тяжелой цепи иммуноглобулина (VH), вариабельные домены тяжелой цепи верблюжьего иммуноглобулина (VHH).
"Вариант" вариабельного домена содержит аминокислотные добавления, замены и/или делеции по сравнению с эталонной последовательностью. "Вариант" VH- или VL-доменов может иметь до четырех таких аминокислотных модификаций включительно. Например, один из двух доменов может содержать аминокислотную замену, в то время как другой домен является немодифицированным, или оба из доменов могут содержать аминокислотные замены. Модификации, в ходе которых добавляются или удаляются аминокислотные остатки, можно выполнить на N-конце или C-конце VH- или VL-домена. Например, можно удалить N-концевой остаток VH-домена.
Для целей данного раскрытия термины "между", "от", "до" и "по меньшей мере" являются включительными. Например, целое число "от 0 до 5" означает любое целое число, равное 0 или превышающее его, но равное или меньшее 5.
В одном варианте осуществления можно производить до пяти аминокислотных замен включительно для деиммунизации модифицированных антител IgG. Деиммунизацию можно осуществлять, например, в соответствии со способом Harding et al. (2010) mAbs 2: 256-265.
Например, остатки каркасной области VH- и/или VL-доменов можно заменять для повышения стабильности модифицированных антител IgG и/или уменьшения их склонности к агрегации. Недостаточная стабильность может влиять на способность экспрессируемых модифицированных антител IgG к правильному сворачиванию при рекомбинантной экспрессии, приводя к тому, что часть экспрессируемых антител является нефункциональной. Антитела с низкой стабильностью также могут быть предрасположены к образованию потенциально иммуногенных агрегатов или могут иметь ухудшенную авидность или сохраняемость. Аминокислотные замены в каркасной области, которые, как предполагается, повышают стабильность и/или снижают склонность к агрегации VH- и/или VL-домена, например, в модифицированном антителе IgG, раскрыты, например, в WO 2007/109254. Замены в соответствующих остатках в VH- и VL-доменах по настоящему изобретению, как предполагается, аналогичным образом повышают стабильность модифицированных антител IgG и/или снижают их склонность к агрегации.
Замены, которые могут быть допустимыми, как предполагается, включают в себя те замены, в ходе которых аминокислота из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4 будет замещена соответствующей аминокислотой, которая встречается в другой последовательности человеческого VH- или VL-домена зародышевого типа. Замена аминокислоты каркасной области на аминокислоту, встречающуюся в любой из этих последовательностей зародышевого типа, может быть допустимой. Например, остаток VH-домена под SEQ ID NO: 1 можно заменить аминокислотой, присутствующей в соответствующем положении в любой последовательности VH зародышевого типа, например, последовательности зародышевого типа из DP-10 (VH 1-69) или DP-88 (VH 1-e). Соответствующие положения в этом случае определяются путем выравнивания последовательностей между различными последовательностями зародышевого типа с помощью методик выравнивания, хорошо известных из уровня техники, например, ClustalW.
Дополнительные замены, которые, как предполагается, являются допустимыми, представляют собой замены, производимые в отношении аминокислоты, большая часть боковой цепи которой подвергается воздействию растворителя, что определяется в анализе трех сокристаллических структур. Площадь поверхности остатка, доступную для растворителя, можно оценить с использованием методик, хорошо известных из уровня техники. Кроме того, предполагается, что замены аминокислот, погруженных вглубь вариабельных доменов, будут более допустимыми, если боковая цепь аминокислоты не создает стерического несоответствия с прилегающими остатками. По этой причине аминокислоты, погруженные вглубь, как правило, заменяют аминокислотами с боковыми цепями аналогичного или меньшего размера. Например, замена погруженного вглубь остатка Ile на Leu, Val, Ala или Gly, как предполагается, является допустимой. Возможное стерическое несоответствие, создаваемое заменой, можно предсказать путем анализа трех сокристаллических структур. Дополнительные замены, которые, как предполагается, являются допустимыми, представляют собой замены, при которых сохраняются существующие электростатические взаимодействия в вариабельных доменах, например, диполь-дипольные взаимодействия, взаимодействия индуцированных диполей, водородные связи или ионные связи.
Дополнительные аминокислотные замены вариабельных доменов включают в себя замены, которые, как предполагается, придают новые полезные свойства антителам или их антигенсвязывающим фрагментам. Например, предполагаемые сайты N-гликозилирования в VH- и/или VL-доменах можно удалить для предупреждения или снижения образования N-гликоформ. Аминоконцевой остаток можно заменить остатком Gln для того, чтобы вызвать пироглутамилирование, которое может уменьшить число вариантов, отличающихся зарядом. Аминокислотные замены можно применять для снижения изоэлектрической точки, в результате чего может уменьшаться, например, скорость выведения полипептидных антител IgG.
Поверхностные остатки вариабельных доменов можно заменять, например, остатками Cys или Lys, которые затем можно ковалентно модифицировать и соединить с молекулами, придающими полезные характеристики антителам или их антигенсвязывающим фрагментам, например, выявляемой меткой, токсином, нацеливающим фрагментом или белком. Например, остаток Cys можно соединить с цитотоксическим лекарственным средством с образованием конъюгата с лекарственным средством. Остатки Cys также можно соединить с молекулами, которые увеличивают период полувыведения из сыворотки крови, например, полиэтиленгликолем (PEG) или сывороточным альбумином. Такие аминокислотные модификации рассматриваются, например, в Beck et al. (2010) Nature 10: 345-52.
Выявляемые метки включают в себя радиоактивные метки, такие как 131I или 99Tc, которые можно присоединить к антителам или их антигенсвязывающим фрагментам с помощью способов, известных из уровня техники. Метки также включают в себя ферментные метки, такие как пероксидаза хрена. Метки дополнительно включают в себя химические фрагменты, такие как биотин, которые можно выявить посредством связывания со специфическим когнатным выявляемым фрагментом, например, меченым авидином. Можно присоединить другие фрагменты, которые облегчают очистку. Например, антитела или их антигенсвязывающие фрагменты можно метить His с помощью хорошо известных способов рекомбинантной модификации и экспрессии.
VL-домены модифицированных антител IgG связаны с CL-доменами с помощью линкера, называемого в данном документе линкером 1. VH-домены модифицированных антител IgG необязательно связаны с CH1-доменами с помощью второго линкера, называемого в данном документе линкером 2. Линкеры, подходящие для получения модифицированных антител IgG, хорошо известны из уровня техники. См., например, Bird et al. (1988) Science, 242: 423-426; Huston et al. (1988) Proc. Nat'l Acad. Sci. USA 85: 5879-5883. Это можно выполнить, например, путем внутрирамочного слияния кодирующих нуклеиновых кислот и экспрессии белка слияния в подходящей клетке-хозяине.
Линкер 1 может содержать пептид, соединяющий VL и CL в молекуле IgG или модифицированном варианте с повышенной гибкостью. Например, он может иметь последовательность лейцин-глутаминовая кислота-изолейцин-лизин-Xp-Yq-Zr-аргинин-треонин-валин-аланин, где X, Y и Z независимо представляют собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и каждое из p, q и r независимо представляет собой целое число от 0 до 5. Каждый из X, Y и Z предпочтительно представляет собой серин и глицин, и каждое из p, q и r равняется 1. В другом аспекте p равняется 0, и каждое из q и r равняется 1. В другом аспекте p равняется 1, и каждое из q и r равняется 0.
Линкер 2 может содержать пептид, имеющий последовательность треонин-валин-серин-Ad-Be-Cf-серин-аланин-серин-треонин, при этом A, B и C независимо представляют собой аминокислоту, выбранную из группы, состоящей из серина, глицина, аланина, валина, лейцина, изолейцина и треонина, и при этом каждое из d, e и f независимо представляет собой целое число от 0 до 5.
В другом варианте осуществления между CH1-доменом и Fc-областью модифицированных антител IgG необязательно вставлена шарнирная область. В одном аспекте шарнирная область представляет собой гибкий домен, который необязательно соединяет CH1-часть с Fc-областью. Гибкость шарнирной области в молекулах IgG может способствовать тому, что Fab-фрагменты принимают взаимное расположение с широким диапазоном углов между ними, что позволяет связываться с эпитопами, разделенными различными расстояниями. В другом аспекте подходящая шарнирная область включает в себя, например, шарнирную область человеческого IgG1, имеющую аминокислотную последовательность PKSCDKTHTCPPCPAPELLGGP (SEQ ID NO: 5). Эта последовательность соответствует части верхней шарнирной области, средней шарнирной области и N-концевой части CH2-домена человеческого IgG1, как раскрыто, например, на фиг. 4B патента США № 8048421.
В другом варианте осуществления подходящие Fc-области модифицированных антител IgG содержат две или три константные области. Fc-области могут включать в себя Fc-области из человеческого IgG1, указанные под SEQ ID NO: 6, или IgG4, указанные в CH2- и CH3-доменах под SEQ ID NO: 17. Fc-область антитела опосредует его период полувыведения из сыворотки крови и эффекторные функции, такие как комплементзависимая цитотоксичность (CDC), антителозависимая клеточная цитотоксичность (ADCC) и антителозависимый клеточный фагоцитоз (ADCP).
Модификации можно производить в шарнирной области и Fc-области для улучшения различных свойств модифицированных антител IgG. В одном варианте осуществления помимо модификаций шарнирной области можно модифицировать одну, две, три, четыре, пять или до десяти аминокислот встречающейся в природе человеческой Fc-области включительно. Например, Fc-область можно модифицировать для увеличения периода полувыведения из сыворотки крови модифицированных антител IgG. Период полувыведения IgG зависит от его pH-зависимого связывания с рецептором FcRn. FcRn, который экспрессируется на поверхности эндотелиальных клеток, связывается с IgG pH-зависимым образом и защищает его от разрушения. Например, было показано, что мутации, расположенные на границе между CH2- и CH3-доменами, увеличивают аффинность связывания с FcRn и период полувыведения IgG1 in vivo. Такие модификации рассматриваются, например, в Strohl WR., 2009. Optimization of Fc-mediated effector functions of monoclonal antibodies. Curr Opin Biotechnol. 20(6):685-91; и Vaccaro C. et al., 2005. Engineering the Fc region of immunoglobulin G to modulate in vivo antibody levels. Nat Biotechnol. 23(10):1283-8.
Другие модификации шарнирной области и/или Fc-области могут усиливать или ослаблять эффекторные функции. Четыре изотипа человеческого IgG связываются с активирующими Fcγ-рецепторами (FcγRI, FcγRIIa, FcγRIIIa), ингибирующим FcγRIIb-рецептором и первым компонентом системы комплемента (C1q) с различными значениями аффинности, что обуславливает осуществление различных эффекторных функций. Например, связывание IgG с FcγR или C1q зависит от остатков, расположенных в шарнирной области и CH2-домене IgG. Одна или несколько аминокислотных замен этих остатков могут влиять на эффекторную функцию путем модулирования взаимодействия IgG с FcγR или C1q. Известны другие замены, которые влияют на эффекторную функцию. Эти модификации рассматриваются, например, в Strohl (2009) "Optimization of Fc-mediated effector functions of monoclonal antibodies," Curr. Opin. Biotechnol. 20:685-91.
Иллюстративные модификации шарнирной области и/или Fc-области обобщены в таблице 1.
Таблица 1. Иллюстративные модификации шарнирной области и Fc-области
|
1. Hinton et al. (2004) J. Biol. Chem. 279(8):6213-16.
2. Vaccaro et al. (2005) Nature Biotechnol. 23(10):1283-88.
3. Armour et al. (1999) Eur. J. Immunol. 29(8):2613-24.
4. Shields et al. (2001) J. Biol. Chem. 276(9):6591-604.
5. Idusogie et al. (2000) J. Immunol. 164(8):4178-84.
6. Idusogie et al. (2001) J. Immunol. 166(4):2571-75.
7. Lazar et al. (2006) Proc. Nat'l Acad. Sci. USA 103(11): 4005-10.
8. Ryan et al. (2007) Mol. Cancer Ther. 6: 3009-18.
9. Datta-Mannan et al. (2007) Drug Metab. Dispos. 35: 86-94.
10. Steurer et al. (1995) J. Immunol. 155(3):1165-74.
11. Richards et al. (2008) Mol. Cancer Ther. 7(8):2517-27.
12. Labrijn et al. (2009) Nature Biotechnol. 27(8):767-71.
Кроме того, рекомбинантные аминокислотные модификации можно применять для снижения структурной однородности экспрессируемых полипептидов. Иллюстративным примером является Peters et al. (2012) J. Biol. Chem. 287(29): 24525-33, в котором раскрыты замены Cys на Ser в шарнирной области IgG4, уменьшающие гетерогенность дисульфидных связей и повышающие термостабильность Fab-домена. Аналогично, Zhang et al. (2010) Anal. Chem. 82: 1090-99 раскрывают конструирование шарнирной области IgG2 с целью ограничения перестановки дисульфидных связей и образования структурных изомеров в терапевтических путях применения. Аминокислотные модификации CH3-домена также можно применять для удаления карбоксиконцевых остатков Lys с целью снижения числа вариантов, отличающихся зарядом. Аминокислотные модификации также можно применять для улучшения фармакологической функции рекомбинантных антител или их антигенсвязывающих фрагментов. Например, аминокислотные модификации можно применять для повышения активации системы комплемента, усиления антителозависимой клеточной цитотоксичности (ADCC) посредством повышения связывания с FcγRIIIA или снижения связывания с FcγRIIIB и/или увеличения периода полувыведения из сыворотки крови посредством повышения связывания с FcRn. Такие аминокислотные модификации рассматриваются, например, в Beck et al. (2010) Nature 10: 345-52.
Нуклеиновые кислоты и способы получения модифицированных антител IgG
В дополнительном аспекте настоящего изобретения предлагаются нуклеиновые кислоты, кодирующие модифицированные антитела IgG. Выделенная нуклеиновая кислота может представлять собой, например, синтетическую ДНК, мРНК, не встречающуюся в природе, или кДНК. Примеры включают нуклеиновые кислоты, кодирующие VH- и VL-домены, указанные под SEQ ID NO: 3, 5, 7 и 9 в патенте США № 6492497. Рекомбинантная клетка-хозяин может содержать одну или несколько вышеуказанных конструкций. Способы получения модифицированных антител IgG включают обеспечение экспрессии кодирующей нуклеиновой кислоты в клетке-хозяине в условиях, подходящих для выработки модифицированных антител IgG, и извлечение антител. Способ извлечения антител может включать выделение и/или очистку антител. Способ получения может включать составление антител в виде композиции, содержащей по меньшей мере один дополнительный компонент, такой как фармацевтически приемлемый наполнитель.
Предполагается, что термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин"), используемый в данном документе, относится к клетке, в которую была введена экзогенная ДНК. Следует понимать, что такие термины предназначены для обозначения не только конкретной рассматриваемой клетки, но и потомства такой клетки. Поскольку в последующих поколениях могут иметь место определенные модификации вследствие мутации либо влияния окружающей среды, такое потомство в действительности может не быть идентичным родительской клетке, но по-прежнему включаться в объем термина "клетка-хозяин", используемого в данном документе. Клетки-хозяева предпочтительно включают в себя прокариотические и эукариотические клетки, выбранные из любого из царств живых организмов. Предпочтительные эукариотические клетки включают в себя клетки простейших, грибов, растений и животных. Клетки-хозяева наиболее предпочтительно включают в себя без ограничений линию прокариотических клеток E. coli; линии клеток млекопитающих CHO, HEK 293 и COS; линию клеток насекомых Sf9 и клетку гриба Saccharomyces cerevisiae.
Можно выбрать или сконструировать подходящие векторы, содержащие нуклеиновую кислоту, кодирующую модифицированные антитела IgG, и содержащие соответствующие регуляторные последовательности, в том числе промоторные последовательности, терминаторные последовательности, последовательности полиаденилирования, энхансерные последовательности, маркерные гены и другие последовательности, при необходимости. Векторы могут представлять собой, например, плазмиды, фаги, фагмиды, аденовирусы, AAV, лентивирусы. Из уровня техники хорошо известны методики и протоколы манипуляции с нуклеиновой кислотой, например, при получении конструкций нуклеиновых кислот, мутагенезе, секвенировании, введении ДНК в клетки и экспрессии генов.
Предполагается, что термин "вектор", используемый в данном документе, относится к молекуле нуклеиновой кислоты, способной к транспорту другой нуклеиновой кислоты, с которой она была связана. Одним типом вектора является "плазмида", которая относится к кольцевой двухнитевой петле ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, где в вирусный геном могут быть лигированы дополнительные сегменты ДНК. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальную точку начала репликации, и эписомные векторы для млекопитающих). Другие векторы (например, неэписомные векторы для млекопитающих) могут интегрироваться в геном клетки-хозяина после введения в клетку-хозяина и, таким образом, реплицируются вместе с геномом хозяина. Кроме того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы называются в данном документе "рекомбинантными векторами экспрессии" (или просто "векторами экспрессии"). Как правило, векторы экспрессии, обладающие полезностью в технологиях рекомбинантных ДНК, часто имеют форму плазмид. В настоящем описании термины "плазмида" и "вектор" можно использовать взаимозаменяемо, поскольку плазмида является наиболее широко применяемой формой вектора. Однако, предполагается, что настоящее изобретение включает и другие такие формы векторов экспрессии, такие как вирусные векторы (например, ретровирусы, дефектные по репликации, аденовирусы и аденоассоциированные вирусы), выполняющие эквивалентные функции.
Введение таких нуклеиновых кислот в клетку-хозяина можно выполнять с помощью методик, хорошо известных из уровня техники. Для эукариотических клеток подходящие методики могут включать в себя, например, трансфекцию с использованием фосфата кальция, DEAE-декстрановый метод, электропорацию, трансфекцию, опосредованную липосомами, и трансдукцию с использованием ретровирусов или других вирусов. Для бактериальных клеток подходящие методики могут включать в себя трансформацию с использованием хлорида кальция, электропорацию и трансфекцию с использованием бактериофага. После введения можно обуславливать или обеспечивать экспрессию нуклеиновой кислоты, например, путем культивирования клеток-хозяев в условиях, подходящих для экспрессии гена. В одном варианте осуществления нуклеиновая кислота по настоящему изобретению интегрируется в геном, например, хромосому, клетки-хозяина. Интеграции можно содействовать путем включения последовательностей, которые содействуют рекомбинации с геномом, в соответствии со стандартными методиками.
Хорошо известны системы клонирования и экспрессии полипептида в ряде различных клеток-хозяев. Подходящие клетки-хозяева включают в себя клетки бактерий, клетки млекопитающих, клетки растений, клетки насекомых, грибов, дрожжей и трансгенных растений и животных. Линии клеток млекопитающих, доступные в данной области техники для экспрессии гетерологичного полипептида, включают в себя клетки яичника китайского хомячка (CHO), клетки HeLa, клетки почки новорожденного хомяка, клетки меланомы мыши, клетки меланомы крысы, человеческие эмбриональные клетки почек, например, клетки HEK293, человеческие эмбриональные клетки сетчатки и многие другие. Экспрессия антител и фрагментов антител в прокариотических клетках, таких как клетки E. coli, надежно отработана в данной области техники. Для обзора см., например, Plückthun Bio/Technology 9: 545-551 (1991). Экспрессия в культивируемых эукариотических клетках также доступна специалистам в данной области, как рассматривается, например, в Andersen et al. (2002) Curr. Opin. Biotechnol. 13: 117-23.
В другом варианте осуществления раскрытые модифицированные антитела IgG могут быть гликозилированными, естественным путем либо вследствие выбора хозяина для экспрессии, например, клеток CHO, HEK293 или NSO (ECACC 85110503), или они могут быть негликозилированными, например, в случае выработки в результате экспрессии в прокариотической клетке. Гликозилирование можно также целенаправленно изменить, например, посредством ингибирования фукозилирования, с целью повышения активности ADCC получаемых в результате модифицированных антител IgG.
Способы применения антител или их антигенсвязывающих фрагментов
Модифицированные антитела IgG можно применять в способе лечения или диагностики организма человека или животного, таком как способ лечения (который может включать профилактическое лечение) заболевания или нарушения у пациента-человека, который включает введение эффективного количества для лечения пациента. Состояния, подвергаемые лечению, включают в себя любые состояния, в которых играет роль TGFβ1, например, фиброзное заболевание, рак, иммуноопосредованное заболевание и заживление ран, например, диффузный системный склероз, заболевание, характеризующееся нарушением ремоделирования костной ткани, заболевание почек и/или их комбинацию.
Было показано, что антитела, специфичные к человеческому TGFβ1, являются эффективными в животных моделях для лечения опосредованных TGFβ1 гломерулонефрита (Border et al. (1990) Nature 346: 371-374), рубцевания нервной ткани (Logan et al. (1994) Eur. J. Neurosci. 6: 355-363), рубцевания кожи (Shah et al. (1992) Lancet 339: 213-214; Shah et al. (1994) J. Cell Science 107: 1137-1157; Shah et al. (1995) J. Cell Science 108: 985-1002) и легочного фиброза (Giri et al. (1993) Thorax 48: 959-966). Кроме того, было показано, что антитела к TGFβ1, 2 и 3 являются эффективными в моделях фиброза легких, радиационно-индуцированного фиброза (патент США № 5616561), миелофиброза, ожогов, контрактуры Дюпюитрена, язв желудка и ревматоидного артрита (Wahl et al. (1993) Exp. Medicine 177: 225-230).
Модифицированные антитела IgG применимы для лечения заболевания и состояния, непосредственно или опосредованно обусловленного активностью TGFβ1. Модифицированные антитела IgG могут избирательно ингибировать активность человеческой изоформы TGFβ1 in vitro или in vivo. Виды активности изоформ TGFβ1 включают без ограничений передачу сигнала, опосредованную TGFβ, отложение внеклеточного матрикса (ECM), ингибирование пролиферации эпителиальных и эндотелиальных клеток, содействие пролиферации гладкомышечных клеток, индукцию экспрессии коллагена III типа, индукцию экспрессии TGF-β, фибронектина, VEGF и IL-11, связывание с пептидом, ассоциированным с латентностью, подавление иммунитета, индуцированное опухолью, содействие ангиогенезу, активацию миофибробластов, содействие метастазированию и ингибирование активности NK-клеток. Например, модифицированные антитела IgG применимы для лечения фокально-сегментарного гломерулосклероза (FSGS), фиброза печени (HF), острого инфаркта миокарда (AMI), идиопатического легочного фиброза (IPF), склеродермии (SSc) и синдрома Марфана.
Модифицированные антитела IgG применимы для лечения заболеваний и состояний, включающих без ограничений фиброзные заболевания (такие как гломерулонефрит, рубцевание нервной ткани, рубцевание кожи, легочный фиброз, фиброз легких, радиационно-индуцированный фиброз, фиброз печени, миелофиброз), ожоги, иммуноопосредованные заболевания, воспалительные заболевания (в том числе ревматоидный артрит), отторжение трансплантата, рак, контрактуру Дюпюитрена и язвы желудка. Модифицированные антитела IgG также применимы для лечения, предупреждения и снижения риска возникновения форм почечной недостаточности, в том числе без ограничений: диабетической нефропатии (при диабете I типа и II типа), радиационно-индуцированной нефропатии, обструктивной нефропатии, диффузного системного склероза, легочного склероза, отторжения трансплантата, наследственного заболевания почек (например, поликистозного заболевания почек, спонгиозной почки, подковообразной почки), гломерулонефрита, нефросклероза, нефрокальциноза, системной красной волчанки, синдрома Шегрена, болезни Бергера, системной или гломерулярной гипертензии, тубулоинтерстициальной нефропатии, почечного тубулярного ацидоза, туберкулеза почки и инфаркта почки. В частности, модифицированные антитела IgG применимы в комбинации с антагонистами ренин-ангиотензин-альдостероновой системы, в том числе без ограничений: ингибиторами ренина, ингибиторами ангиотензинпревращающего фермента (ACE), антагонистами рецепторов Ang II (также известными как "блокаторы рецепторов Ang II") и антагонистами альдостерона. В качестве примера, способы применения модифицированных антител IgG в комбинации с такими антагонистами указаны в WO 2004/098637.
Модифицированные антитела IgG также применимы для лечения заболеваний и состояний, ассоциированных с отложением ECM, в том числе системного склероза, послеоперационных спаек, келоидного и гипертрофического рубцевания, пролиферативной витреоретинопатии, хирургического дренирования глаукомы, повреждения роговицы, катаракты, болезни Пейрони, острого респираторного дистресс-синдрома взрослых, цирроза печени, рубцевания после инфаркта миокарда, рестеноза после ангиопластики, рубцевания после субарахноидального кровоизлияния, рассеянного склероза, фиброза после ламинэктомии, фиброза после восстановления сухожилий и других органов, рубцевания в результате удаления татуировок, билиарного цирроза (в том числе склерозирующего холангита), перикардита, плеврита, трахеостомии, проникающего повреждения центральной нервной системы, эозинофильного миалгического синдрома, рестеноза сосудов, веноокклюзионной болезни, панкреатита и псориатической артропатии.
Модифицированные антитела IgG дополнительно являются применимыми для содействия реэпителизации при таких заболеваниях и состояниях, как венозные язвы, трофические язвы (пролежни), диабетические язвы, участки после трансплантации, донорские участки после трансплантации, ссадины и ожоги, заболевания бронхиального эпителия, такие как астма, ARDS, заболевания кишечного эпителия, такие как мукозит, ассоциированный с лечением цитотоксическими препаратами, язвы пищевода (рефлюксная болезнь), язвы желудка, повреждения тонкой кишки и толстой кишки (воспалительное заболевание кишечника).
Модифицированные антитела IgG также можно применять для содействия пролиферации эндотелиальных клеток, например, при стабилизации атеросклеротических бляшек, содействии заживлению сосудистых анастомозов, или для ингибирования пролиферации гладкомышечных клеток, как, например, при заболевании артерий, рестенозе и астме.
Модифицированные антитела IgG применимы для усиления иммунного ответа на инфекции, опосредованные макрофагами. Они также применимы для уменьшения подавления иммунитета, вызываемого, например, опухолями, СПИДом или гранулематозными заболеваниями. Модифицированные антитела IgG применимы для лечения гиперпролиферативных заболеваний, таких как виды рака, в том числе без ограничений рак молочной железы, предстательной железы, яичника, желудка, почки, поджелудочной железы, ободочной и прямой кишки, кожи, легкого, шейки матки и мочевого пузыря, глиома, мезотелиома, а также различные виды лейкемии и саркомы, такие как саркома Капоши, и применимы для лечения или предупреждения рецидивирования или метастазирования таких опухолей. Модифицированные антитела IgG также применимы для ингибирования метастазирования, опосредованного циклоспорином.
В контексте противоопухолевой терапии "лечение" включает любое медицинское вмешательство, приводящее к замедлению роста опухоли или уменьшению метастазирования опухоли, а также частичной ремиссии рака с целью увеличения ожидаемой продолжительности жизни пациента.
Способы лечения включают введение модифицированного антитела IgG или фармацевтических композиций, содержащих модифицированное антитело IgG. Модифицированные антитела IgG можно применять в производстве лекарственного препарата для введения. Например, способ получения лекарственного препарата или фармацевтической композиции включает составление модифицированного антитела IgG с фармацевтически приемлемым наполнителем. Композицию можно вводить отдельно или в комбинации с другими средствами лечения одновременно либо последовательно в зависимости от состояния, подлежащего лечению.
Введение выполняют предпочтительно в "терапевтически эффективном количестве", достаточном для того, чтобы оказать благоприятный эффект на пациента. Таким благоприятным эффектом может быть по меньшей мере облегчение по меньшей мере одного симптома конкретного заболевания или состояния. Фактическое вводимое количество, а также скорость и временная динамика введения будут зависеть от природы и тяжести заболевания или состояния, подвергаемого лечению. Назначение лечения, например, решения относительно дозы и т. д., можно определить на основании доклинических и клинических исследований, план которых находится в пределах компетенции специалиста в данной области.
Точная доза будет зависеть от ряда факторов, в том числе того, предназначается ли модифицированное антитело IgG для диагностики или для лечения, размера и расположения участка, подлежащего обработке, и природы любой выявляемой метки или другой молекулы, присоединенной к модифицированному антителу IgG. Обычная доза модифицированного антитела IgG, например, может находиться в диапазоне от 100 мкг до 1 грамма для путей системного применения и от 1 мкг до 1 мг для путей местного применения. Разовую дозу для лечения взрослого пациента можно пропорционально скорректировать для детей и младенцев. Лечение можно повторять ежедневно, два раза в неделю, один раз в неделю, один раз в месяц или через другие промежутки по усмотрению врача. Лечение может быть периодическим, и период между введениями составляет приблизительно две недели или более, предпочтительно приблизительно три недели или более, более предпочтительно приблизительно четыре недели или более, или приблизительно один месяц.
В одном варианте осуществления уровни дозы, составляющие приблизительно 0,1, 0,3, 1, 3, 10, 15 мг или 20 мг раскрытых антител на кг веса тела пациента, могут быть полезными и безопасными для людей. Например, у крыс и мышей эффективная доза в острой фазе составляла 0,5-5 мг/кг. Таким образом, в случае длительного введения доз людям можно вводить 0,3-10 мг/кг на основании ожидаемого периода полувыведения, составляющего 21 день. Дозы могут быть достаточными для обеспечения эффективности и при этом достаточно низкими для облегчения оптимального введения. Например, доза, составляющая менее 50 мг, облегчает подкожное введение. Внутривенное введение можно применять в качестве пути доставки в случае тяжелых заболеваний, где могут быть необходимыми высокие дозы и длительные промежутки между введениями доз. Подкожное введение может усиливать потенциальный иммунный ответ на препарат. При локальном введении в случае локализованного заболевания можно снизить количество вводимого препарата и повысить концентрацию в месте действия, что может улучшить безопасность.
Модифицированные антитела IgG можно вводить путем инъекции, например, подкожно, внутривенно, внутриполостным путем (например, после резекции опухоли), внутриочаговым путем, внутрибрюшинно или внутримышечно. Модифицированные антитела IgG также можно доставлять путем ингаляции, или местно (например, внутриглазным, интраназальным, ректальным путем, в раны, на кожу), или перорально.
Модифицированное антитело IgG обычно будут вводить в форме фармацевтической композиции, которая может содержать по меньшей мере один компонент в дополнение к модифицированному антителу IgG. Таким образом, фармацевтические композиции могут содержать фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области. Такие материалы должны быть нетоксичными и не должны оказывать мешающее влияние на эффективность активного ингредиента. Такие материалы могут включать в себя, например, любые возможные растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание. Некоторыми примерами фармацевтически приемлемых носителей являются вода, солевой раствор, фосфатно-солевой буферный раствор, декстроза, глицерин, этанол и т. п., а также их комбинации. Во многих случаях будет предпочтительным включать в композицию изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Дополнительными примерами фармацевтически приемлемых веществ являются смачивающие средства или вспомогательные вещества, такие как эмульгирующие средства, консерванты или буферы, которые повышают сохраняемость или эффективность.
Точная природа носителя или другого материала будет зависеть от пути введения. В случае внутривенной инъекции или инъекции в участок поражения активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который является апирогенным и характеризуется подходящими pK, изотоничностью и стабильностью. Специалисты в данной области вполне в состоянии получить подходящие растворы с применением, например, изотонических основ, таких как хлорид натрия для инъекций, раствор Рингера для инъекций и лактатный раствор Рингера для инъекций. Можно включать консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Модифицированное антитело IgG можно составлять в жидких, мягких или твердых формах, таких как жидкие растворы (например, растворы для инъекций и инфузий), дисперсии или суспензии, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения, терапевтического применения, физико-химических свойств молекулы и пути доставки. Составы могут содержать наполнители или комбинацию наполнителей, например: сахара, аминокислоты и поверхностно-активные вещества. Жидкие составы могут предусматривать широкий диапазон концентраций модифицированных антител IgG и pH. Твердые составы можно получать, например, путем лиофилизации, высушивания распылением или высушивания с использованием сверхкритической флюидной технологии.
Терапевтические композиции можно составлять в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные растворы для инъекций можно получить путем включения модифицированного антитела IgG в соответствующий растворитель с одним из ингредиентов, перечисленных выше, или их комбинацией с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем включения активного соединения в стерильную основу, которая содержит основную диспергирующую среду и другие ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и сублимационная сушка, в результате которых получают порошкообразный активный ингредиент вместе с любым дополнительным желательным ингредиентом из его предварительно стерилизованного фильтрованием раствора. Надлежащую текучесть раствора можно поддерживать, например, путем применения покрытия, такого как лецитин, путем сохранения размера частиц в дисперсии или путем применения поверхностно-активных веществ. Длительного всасывания композиций для инъекций можно достичь путем включения в композицию средства, которое замедляет всасывание, например, моностеаратных солей и желатина.
В определенных вариантах осуществления активное соединение можно получить с носителем, который будет защищать модифицированное антитело IgG от быстрого высвобождения, как, например, в составе с контролируемым высвобождением, в том числе в имплантатах, трансдермальных пластырях и микроинкапсулированных системах доставки. Можно применять биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Многие способы получения таких составов запатентованы или общеизвестны для специалистов в данной области.
Способ применения модифицированного антитела IgG может включать обуславливание или обеспечивание связывания с TGFβ. Такое связывание может иметь место in vivo, например, после введения модифицированного антитела IgG пациенту, или оно может иметь место in vitro, например, в ELISA, вестерн-блоттинге, иммуноцитохимических анализах, иммунопреципитационных анализах, аффинной хроматографии или клеточных анализах, или в терапевтических способах ex vivo, например, в способах, в которых клетки или жидкости организма приводят в контакт с модифицированным антителом IgG ex vivo и затем вводят пациенту.
Предлагается набор, содержащий модифицированное антитело IgG. Модифицированное антитело IgG можно пометить с целью обеспечения его реактивности в образце, подлежащем определению. Наборы можно использовать, например, в диагностическом анализе. Набор может содержать инструкции по применению компонентов. В набор могут быть включены вспомогательные материалы для содействия в осуществлении или обеспечения осуществления такого способа.
Реактивность модифицированного антитела IgG в образце можно определять с помощью любых соответствующих средств, например, радиоиммунологического анализа (RIA). Можно смешивать радиоактивно меченный антиген с немеченым антигеном (тестовым образцом) и обеспечивать его связывание с модифицированным антителом IgG. Связанный антиген физически отделяют от несвязанного антигена, и определяют количество радиоактивного антигена, связанного с модифицированным антителом IgG. Также можно применять анализ конкурентного связывания с нерадиоактивным антигеном, используя антиген или аналог, связанный с репортерной молекулой. Репортерная молекула может представлять собой флуорохром, фосфор или краситель. Подходящие флуорохромы включают в себя флуоресцеин, родамин, фикоэритрин и техасский красный. Подходящие хромогенные красители включают в себя диаминобензидин.
Другие репортеры включают в себя макромолекулярные коллоидные частицы или материал в виде частиц, как, например, латексные гранулы, которые являются окрашенными, магнитными или парамагнитными, и биологически или химически активные средства, которые могут непосредственно или опосредованно обуславливать визуальное наблюдение выявляемых сигналов, их выявление электронными средствами или регистрацию иным способом. Эти молекулы могут представлять собой ферменты, катализирующие реакции, в ходе которых, например, проявляются или изменяются цвета или которые обуславливают изменения электрических свойств. Они могут быть возбудимыми на молекулярном уровне, так что электронные переходы между энергетическими состояниями приводят к характерным спектральным поглощениям или испусканиям. Они могут включать в себя химические объекты, применяемые совместно с биосенсорами. Можно использовать системы выявления на основе биотина/авидина или биотина/стрептавидина и щелочной фосфатазы. Сигналы, генерируемые конъюгатами антитело-репортер, можно применять для получения измеримых количественно абсолютных или относительных данных о соответствующем связывании антитела в образцах.
В настоящем изобретении также предлагается применение модифицированного антитела IgG для измерения уровней антигенов в конкурентном анализе. Модифицированное антитело IgG можно связать с репортерной молекулой таким образом, что при связывании, например, происходит физическое или оптическое изменение. Репортерная молекула может непосредственно или опосредованно генерировать выявляемые и предпочтительно измеримые сигналы. Репортерные молекулы можно связать непосредственно или опосредованно, ковалентно, например, посредством пептидной связи, или нековалентно. Модифицированное антитело IgG и белковый репортер можно связать пептидной связью и экспрессировать рекомбинантным путем в виде белка слияния.
Дополнительные аспекты и варианты осуществления настоящего изобретения будут очевидны специалистам в данной области в свете настоящего раскрытия, включающего следующее пояснение на экспериментальных примерах.
Примеры
Пример 1. Модифицированное антитело IgG4 с дополнительными аминокислотами в области изгиба легкой цепи
CAT192 представляет собой TGFβ1-специфичное антитело, однако большая часть его аффинности связывания была утрачена при превращении его из scFv в IgG4 полной длины (фигура 1). Подтип и Fc-форматы антител сами по себе не объясняют это явление, поскольку Fab как IgG1, так и IgG4 проявляли очень низкую аффинность в отношении TGFβ1. Прочное связывание scFv с TGFβ1 может объясняться высокой гибкостью, обусловленной длинным линкером (GGGGS)3, соединяющим Fv-домены тяжелой и легкой цепей. Эта высокая гибкость могла быть утрачена во время превращения scFv в Fab- или IgG-варианты. Низкая аффинность CAT192 характеризовалась очень низкой скоростью ассоциации, но также и очень медленной скоростью диссоциации. Низкая скорость ассоциации и скорость диссоциации свидетельствовала о том, что для связывания между CAT192 и TGFβ1 могло потребоваться потенциальное конформационное изменение, которое было ограничено наличием нежелательных аминокислот в CAT192(IgG4). В данном документе описаны эксперименты, разработанные для повышения гибкости/аффинности Fab- или IgG-вариантов scFv посредством добавления дополнительных аминокислот в область изгиба легкой цепи, которая связывает Fv-домен антитела с CH1-доменом. В частности, были сконструированы мутантные формы с добавлением последовательностей из одного глицинового (G), двух глициновых (GG), двух глициновых и одного серинового (GGS), трех глициновых и одного серинового (GGGS) и четырех глициновых и одного серинового (GGGGS) остатков в область изгиба легкой цепи дикого типа, как показано ниже в таблице 2, где добавленные аминокислоты подчеркнуты.
Таблица 2. Мутантные формы модифицированного IgG4 со вставкой в области изгиба легкой цепи
|
Аминокислота № 25 легкой цепи представляет собой Ala в scFv, но при превращении в IgG4 была изменена на Ser. Таким образом, дополнительную мутантную форму A25S включали в качестве контроля для тестирования того, влияет ли изменение Ala на Ser на аффинность scFv в отношении TGFβ1. Последовательности ДНК и аминокислотные последовательности CAT192 дикого типа и мутантных форм перечислены ниже.
SEQ ID NO: 38: аминокислотная последовательность LC IgG1 CAT192 дикого типа с подчеркнутой областью изгиба:
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 27: последовательность, кодирующая легкую цепь CAT192 (IgG1)
atgggctggtcctgcatcatcctgtttctggtggccacagccaccggcgtgcacagcGAGATCGTGCTGACACAGAGCCCCAGCAGCCTGTCTGCCAGCGTGGGCGACAGAGTGACCATCACCTGTAGAGCCAGCCAGGGCATCGGCGACGACCTGGGATGGTATCAGCAGAAGCCTGGCAAGGCCCCCATCCTGCTGATCTACGGCACCAGCACACTGCAGAGCGGCGTGCCCTCCAGATTTTCTGGCAGCGGCTCCGGCACCGACTTCACCCTGACCATCAACAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGTCTGCAAGACAGCAACTACCCCCTGACCTTCGGCGGAGGCACCCGGCTGGAAATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGA
CAT192LC+G (LEIKGRTVA)
Прямой 5'-ggctggaaatcaagggccgtacggtggccgc-3' (SEQ ID No. 28)
Комплементарный 5'-gcggccaccgtacggcccttgatttccagcc-3' (SEQ ID No. 29)
CAT192LC+GG. (LEIKGGRTVA)
Прямой 5'-ggctggaaatcaagggcggccgtacggtggccgc-3' (SEQ ID No. 30)
Комплементарный 5'-gcggccaccgtacggccgcccttgatttccagcc-3' (SEQ ID No. 31)
CAT192LC+GGS. (LEIKGGSRTVA)
Прямой 5'-ggctggaaatcaagggcggcagccgtacggtggccgc-3' (SEQ ID No. 32)
Комплементарный 5'-gcggccaccgtacggctgccgcccttgatttccagcc-3' (SEQ ID No. 33)
CAT192LC+GGGS. (LEIKGGGSRTVA)
Прямой 5'-ggctggaaatcaagggcggcggcagccgtacggtggccgc-3' (SEQ ID No. 34)
Комплементарный 5'-gcggccaccgtacggctgccgccgcccttgatttccagcc-3' (SEQ ID No. 35)
CAT192LC+GGGGS. (LEIKGGGGSRTVA)
Прямой 5'-ggctggaaatcaagggcggcggcggcagccgtacggtggccgc-3' (SEQ ID No. 36)
Комплементарный 5'-gcggccaccgtacggctgccgccgccgcccttgatttccagcc-3' (SEQ ID No. 37)
Пять мутантных форм LC CAT192 вместе с мутантной формой A25S и LC WT подвергали коэкспрессии с Fab HC CAT192, меченным His, с помощью системы трансфекции Expi293F (Life Technologies) в формате 24-луночного планшета (4×1 мл). Кондиционированные среды (CM) собирали через 4 дня после трансфекции, и для расчета уровня экспрессии и связывания с TGFβ1 в одном анализе использовали прибор Octet QK384. Очищенный Fab CAT192, меченный His, использовали для построения калибровочной кривой (в 2-кратных разведениях от 100 до 3,125 мкг/мл). CM для Fab CAT192 разбавляли 1:10 в разбавителе, и CM для Fab GC1008 включали в качестве положительного контроля. Связывание с биосенсорами, специфичными к Fab-CH1, измеряли в течение 2 мин. при 1000 об./мин. и температуре планшета 30°C для количественного определения и захвата. Затем сенсоры перемещали в лунки, содержащие 200 нМ TGFβ1, для оценки связывания.
Результат связывания с TGFβ1 показал, что вставка каждой дополнительной аминокислоты повышала аффинность связывания Fab CAT192 по сравнению с аналогом WT. Добавление по меньшей мере двух глициновых остатков повышало аффинность связывания до уровня, сопоставимого с таковым у антитела Fab GC1008. Мутантная форма A25S демонстрировала слабую аффинность связывания с TGFβ1, аналогичную аффинности Fab WT и очищенного рекомбинантного CAT192. Этот результат был качественным, поскольку для количества Fab, захваченного сенсорами, не была произведена нормализация по концентрации или вычитание результатов анализа буфера.
Затем варианты Fab LC CAT192 очищали с помощью наконечников PureSpeed IMAC от Rainin с целью точной оценки аффинности в отношении TGFβ1 и подтверждения специфичности в отношении изоформ с помощью поверхностного плазмонного резонанса. Кондиционированные среды для каждого образца разделяли на четыре лунки (по ~800 мкл в каждую), и в каждую из них добавляли ~ 200 мкл уравновешивающего буфера с целью использования двух наконечников для очистки на 1 мл (20 мкл смолы) для каждого образца. Образцы подвергали замене буфера на Gibco PBS с pH 7,2 с использованием фильтров Amicon Ultra после стадии элюирования для удаления имидазола. Концентрации измеряли по A280, и 3,5 мкг загружали в 4-20% трис-глициновый гель для SDS-PAGE в невосстанавливающих условиях и окрашивали кумасси для проверки чистоты. Общий выход находился в диапазоне от 12 до 42% исходного материала в CM.
Прибор Biacore T200 использовали для оценки аффинности связывания очищенных Fab CAT192 WT и с мутацией LC c TGFβ. TGFβ1, TGFβ2 и TGFβ3 (124, 125 и 112 RU) иммобилизовали на чипе CM5 серии S с помощью аминосодержащего химического вещества. Использовали широкий диапазон концентраций для учета связывающих средств как с низкой, так и с высокой аффинностью. Fab разбавляли 3-кратно от 270 до 0,37 нм в буфере HBS-EP+. Каждый образец вводили в двух повторностях. KD определяли с применением обычного диапазона концентраций с 30 нМ в качестве наивысшей концентрации. Результаты связывания на Biacore согласовывались с результатами на Octet, описанными выше, а именно, добавление аминокислот в область изгиба LC CAT192 улучшало аффинность связывания с TGFβ1. Было продемонстрировано ступенчатое улучшение при вставке каждого дополнительного остатка (фигура 6). Ни один из Fab CAT192 с мутантной LC не связывался с TGFβ2 или TGFβ3 в тех же условиях, что указывало на то, что мутантные формы сохраняли избирательность в отношении изоформ, но при этом у них значительно повышалось связывание с TGFβ1. Таким образом, мутантные формы со сконструированной областью изгиба представляли собой набор новых вариантов с избирательностью в отношении изоформ и высокой аффинностью связывания с TGFβ1.
Таблица 3. KD модифицированных Fab
|
Пример 2. Модифицированное антитело IgG4 с дополнительными аминокислотами в области изгиба тяжелой цепи
В качестве дальнейших шагов после получения молекул с мутацией в области изгиба легкой цепи, которые продемонстрировали высокоаффинное и избирательное в отношении TGFβ1 связывание, также были сконструированы мутантные формы с целью повышения гибкости/аффинности путем вставки дополнительных аминокислот в область изгиба тяжелой цепи, которая связывала Fv-домен антитела с CH1-доменом. В частности, были сконструированы мутантные формы с добавлением последовательности из одного глицинового (G), двух глициновых (GG) и четырех глициновых и серинового (GGGGS) остатков в область изгиба тяжелой цепи дикого типа, как показано ниже в таблице 4, где добавленные аминокислоты подчеркнуты.
Таблица 4. Мутантные формы модифицированного IgG4 со вставкой в области изгиба тяжелой цепи
|
HC+GG-ST представлял собой неожиданный побочный продукт процесса ПЦР-мутагенеза, в результате которого происходило добавление двух глициновых остатков в область изгиба согласно запланированному, но также и удаление двух аминокислот на конце области изгиба, как было подтверждено путем секвенирования ДНК. Эта мутантная форма имела такое же количество аминокислот в области изгиба тяжелой цепи, но другой состав аминокислот в линкерной области изгиба. Ее включали в качестве контроля для получения характеристик и сравнений аффинности.
Праймеры для CAT192 HC+G
Прямой 5'-ccaccgtgacagtgtctggcagcgccagc-3'
(SEQ ID No. 50)
Комплементарный 5'-gctggcgctgccagacactgtcacggtgg-3'
(SEQ ID No. 51)
Праймеры для CAT192 HC+GG-ST
Прямой 5'-ccaccgtgacagtgtctggcggcagcgccagc-3'
(SEQ ID No. 52)
Комплементарный 5'-gctggcgctgccgccagacactgtcacggtgg-3'
(SEQ ID No. 53)
Праймеры для CAT192 HC+GGGGS
Прямой 5'-caccaccgtgacagtgtctggcggcggcggcagcagcgccagca-3'
(SEQ ID No. 54)
Комплементарный 5'-tgctggcgctgctgccgccgccgccagacactgtcacggtggtg-3'
(SEQ ID No. 55)
Праймеры для CAT192 HC+GG
Прямой 5'- caccaccgtgacagtgtctggcggcagcgccagca -3'
(SEQ ID No. 529)
Комплементарный 5'- tgctggcgctgccgccagacactgtcacggtggtg -3'
(60)
Эти мутантные формы HC CAT192 подвергали коэкспрессии с Fab LC CAT192 с помощью системы трансфекции Expi293F (Life Technologies) в формате 24-луночного планшета (4×1 мл). Кондиционированные среды собирали через 4 дня после трансфекции и затем очищали с помощью наконечников PureSpeed IMAC от Rainin с целью точной оценки аффинности в отношении TGFβ1.
Прибор Biacore T200 использовали для оценки аффинности связывания мутантных Fab очищенного CAT192 с TGFβ, как описано в примере 1. Результаты, показанные на фигуре 6, свидетельствовали о том, что, так же как и для молекул с мутацией в области изгиба легкой цепи, добавление аминокислот в область изгиба тяжелой цепи CAT192 также улучшало аффинность связывания с TGFβ1. Например, мутантная форма HC+GGGGS CAT192 демонстрировала очень высокую аффинность связывания с TGFβ1.
Пример 3. Молекулы с сочетанной мутацией в тяжелой и легкой цепях
Молекулы CAT192 с сочетанной мутацией получали путем котрансфекции ДНК, несущими мутации в области изгиба как тяжелой, так и легкой цепей, с помощью системы трансфекции Expi293F (Life Technologies) в формате 24-луночного планшета (4×1 мл). Различные комбинации перечислены в таблице 5.
Таблица 5. Различные молекулы с сочетанной мутацией в тяжелой и легкой цепях
|
Кондиционированные среды собирали через 4 дня после трансфекции и затем очищали с помощью наконечников PureSpeed IMAC от Rainin с целью точной оценки аффинности в отношении TGFβ1.
Прибор Biacore T200 использовали для оценки аффинности связывания мутантных Fab очищенного CAT192 с TGFβ, как описано в примере 1. Результат, показанный на фигуре 3, свидетельствовал о том, что у молекул CAT192 с сочетанной мутацией восстанавливалась высокая аффинность связывания с TGFβ1. Значения аффинности связывания (KD) этих мутантных Fab перечислены в таблице 6.
Таблица 6. Аффинность связывания (KD) молекул с сочетанной мутацией в тяжелой и легкой цепях с ТGFβ1, определенная с помощью Biacore
|
Н/о=не определено
При конструировании области изгиба как тяжелой цепи, так и легкой цепи требовалось меньше вставок аминокислот. Например, молекулы с комбинацией мутаций "HC+G" и "LC+G" демонстрировали очень высокую аффинность связывания с TGFβ1.
Пример 4. Получение характеристик аффинности и активности вариантов IgG4 полной длины
Мутантные формы в формате IgG4 получали с целью определения того, можно ли вновь приобретенную аффинность, определенную с помощью Biacore, подтвердить в анализе активности с использованием клеток A549. Fab HC CAT192 клонировали в остов тяжелой цепи IgG4 S228P для сведения к минимуму образования полуантител, а клетки Expi293F затем котрансфицировали мутантной формой IgG4 CAT192 S228P со вставкой в HC и LC.
Трансфекцию в 30 мл осуществляли c мутантными формами CAT192 полной длины со вставкой в HC и LC с целью получения достаточного количества материала для биологического анализа. Клетки Expi293F трансфицировали 30 мкг ДНК (15 мкг LC+15 мкг HC). Кондиционированные среды собирали через 4 дня после трансфекции и анализировали с помощью Octet с использованием биосенсоров на основе белка A c получением уровня экспрессии, составляющего около 200 мкг/мл. CM затем очищали с помощью HP-колонок Hi-Trap с белком A с перистальтическим насосом. CM загружали в каждую колонку при 0,5 мл/мин., промывали 25 объемами колонки (CV) 50 мМ NaPi, 25 мМ NaCl c pH 7,1 (2 мл/мин.), промывали 25 CV 10 мМ сукцината натрия с pH 6,0 (2 мл/мин.) и элюировали фракциями 3×2 мл с помощью 10 мМ сукцината натрия с pH 3,75 при 1 мл/мин. (обозначенными как № 1, № 2, № 3). Элюаты, полученные при использовании белка A, нейтрализовали 0,2 M NaOH, и добавляли 0,2 M NaCl до конечной концентрации 40 мМ NaCl. Образцы затем концентрировали и подвергали замене буфера на 50 мМ NaPi, 25 мМ NaCl с pH 7,1. Эти элюаты мутантных форм IgG4 CAT192 S228P со вставкой в HC и LC, полученные при использовании белка А, затем прогоняли в 4-20% трис-глициновом геле (фигура 3) и сравнивали с помощью Biacore в отношении связывания с TGFβ1/TGFβ2/TGFβ3 (фигура 4). Результаты Biacore указывали на то, что очищенные мутантные формы IgG4 CAT192 действительно вновь приобретали способность к связыванию с TGFβ1. Ни одна из мутантных форм не связывалась с TGFβ2 или TGFβ3 (фигура 4).
Таблица 7 Аффинность связывания (KD) вариантов IgG4 полной длины с TGFβ1, определенная с помощью Biacore
|
Н/о=не определено
Затем получали характеристики мутантных форм IgG CAT192 S228P со вставкой в LC в анализе активности с использованием клеток A549 (Rapoza et al., 2006, J Immunol Methods, Vol316, pp18). Результаты (фигура 5) показали, что мутантные формы CAT192 со вставкой нейтрализовали активность TGFβ1, как демонстрировали ингибиторные эффекты мутантных форм в отношении выработки IL-11, стимулируемой TGFβ1. По-видимому, двух глициновых остатков, добавленных в область изгиба легкой цепи, было достаточно для того, чтобы CAT192 вновь приобрел эффективность, как наблюдалось в эксперименте по связыванию на Biacore.
Пример 5. Исследование термостабильности
В отношении мутантных форм со вставкой в области изгиба осуществляли дифференциальную сканирующую флуориметрию (DSF) для определения того, как дополнительные аминокислоты в шарнирной области тяжелой цепи и легкой цепи влияли на термостабильность мутантных форм Fab CAT192 со вставкой. Основным принципом DSF является то, что с повышением температуры флуоресцентный краситель связывается с гидрофобными областями белка по мере его разворачивания, что обеспечивает усиление сигнала. Этот способ можно осуществлять с ограниченным количеством образца и можно применять для достижения относительной стабильности образцов с высокой производительностью. В качестве флуоресцентного красителя применяли Sypro оранжевый. Применяемые условия представляли собой 0,1 мг/мл белка, пропорция красителя 1:4000 и общий объем 10 мкл. Результаты показали, что относительная стабильность мутантных форм Fab CAT192 со вставкой незначительно снижалась при добавлении глициновых остатков в область изгиба, при этом наименее стабильными были мутантные формы, имеющие наиболее длинное добавление (фигура 7). Значения Tm обобщены на фигуре 7. Значения Tm некоторых мутантных форм с более длинными цепями не рассчитывали ввиду их характера разворачивания. Также наблюдалось незначительное снижение при превращении некоторых молекул с мутантной легкой цепью из формата Fab в формат IgG4 (фигура 8).
Пример 6. Определение кристаллической структуры вариантов Fab CAT192
Белковые структуры Fab CAT192 WT и 3 вариантов находили для получения структурного объяснения того, как при повышении гибкости вариабельных доменов восстанавливалась высокая аффинность.
Трансфекцию в 150 мл осуществляли с мутантными формами Fab CAT192 со вставкой в HC и LC с целью получения достаточного количества материала для исследований структуры. Клетки Expi293F трансфицировали 150 мкг ДНК (75 мкг LC+75 мкг HC). Кондиционированные среды собирали через 5 дней после трансфекции. Затем CM очищали с помощью колонок His-Trap Excel, уравновешенных 20 мМ NaPi с pH 7,4, 500 мМ NaCl, 5 мМ имидазола. Белок Fab элюировали с использованием 20 мМ NaPi с pH 7,4, 500 мМ NaCl, 500 мМ имидазола и незамедлительно подвергали замене буфера на 20 мМ HEPES с pH 7,0, 50 мМ NaCl с использованием колонки для эксклюзионной хроматографии (Superdex 200 10/300). Затем Fab концентрировали до 20 мг/мл, и постановку скрининга условий кристаллизации по методу разреженных матриц проводили как при комнатной температуре, так и при 4°C. Все кристаллы, применяемые для определения структуры, получали при температуре 4°C в соотношении белка и условия кристаллизации, составляющем 1:1. Белок дикого типа и мутантные формы с более низкой аффинностью связывания кристаллизовали в пространственной группе P21 в аналогичных условиях PEG (WT: 12% PEG 8000/0,1 M какодилата натрия с pH 6/0,2 M MgCl2, HC WT/LC+G CAT192: 12% PEG 20000/0,1 M MES c pH 6,5, HC+GGGGS/LC WT CAT192: 12% PEG 20000, 0,1 M MES c pH 5,75). Мутантную форму с высокой аффинностью связывания (HC+GG/LC+GG) кристаллизовали в 2 M сульфате аммония, 0,1 M ацетате натрия pH 4,6 (пространственная группа: C2).
Варианты с низкой/умеренной аффинностью связывания и Fab-структуры дикого типа (HC+WT/LC+G и HC+GGGGS/LC+WT) были практически идентичными (фигура 9, часть A). HC WT/LC+G и HC+GGGGS/LC WT совмещались с CAT192 WT с R.M.S.D, составляющим соответственно 0,516 Å и 0,538Å. В каждой из этих структур плотность электронов в CDRH3-области отсутствовала у всех молекул в асимметричной единице. Это означало, что эта CDR была очень гибкой у мутантных форм с низкой/умеренной аффинностью связывания. В отличие от этого, мутантная форма с высокой аффинностью связывания (HC+GG/LC+GG) характеризовалась большими конформационными изменениями в вариабельных доменах по сравнению с другими Fab-структурами CAT192 (фигура 9, часть A). При том, что константные домены всех четырех Fab отлично совмещались, вариабельные домены у HC+GG/LC+GG CAT192 характеризовались значительным смещением по сравнению с другими структурами (фигура 9, часть B). Кроме того, CDR3-область HC была полностью структурированной в структуре с высокой аффинностью связывания и стабилизированной посредством взаимодействия с CDR3 LC (< 3Å). Эти четыре структуры в соответствии с результатами на Biacore свидетельствовали о том, что для восстановления высокой аффинности связывания CAT192 требовалась большая конформационная перестройка.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1: клон SL15 VH-домена человеческого IgG1 (SQN4 US6492497)
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSS
SEQ ID NO: 2: клон JT182 VH-домена человеческого IgG1 (SQN10 US6492497)
QVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTPASPDWGQGTTVTVSS
SEQ ID NO: 3: клон SL15A Vκ-домена человеческого IgG1: (SQN6 US6492497)
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIK
SEQ ID NO: 4: клон SL15S Vκ-домена человеческого IgG1: (SQN8 US6492497)
EIVLTQSPSSLSASVGDRVTITCRSSQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIK
SEQ ID NO: 5: шарнирная область человеческого IgG1
PKSCDKTHTCPPCPAPELLGGP
SEQ ID NO: 6: Fc-область человеческого IgG1
SVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID No. 7
SYGMH
SEQ ID No. 8
VISYDGSIKYYADSVKG
SEQ ID No. 9
TGEYSGYDTSGVEL
SEQ ID No. 10
TGEYSGYDTDPQYS
SEQ ID No. 11
TGFYSGYDTPASPD
SEQ ID No. 12
RASQGIGDDLG
SEQ ID No. 13
GTSTLQS
SEQ ID No. 14
LQDSNYPLT
SEQ ID No. 15
TGX1YSGYDTX2X3X4X5X6
SEQ ID NO: 16: легкая цепь CAT192 (IgG4)
EWLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 17: тяжелая цепь CAT192 (IgG4)
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
SEQ ID NO: 18: тяжелая цепь CAT192 (IgG4) S228P
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
SEQ ID NO: 19: CAT191 (scFv)
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSSSGGGSGGGGSGGGGSEIVLTQSPSSLSASVGDRVTITCRSSQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIK
SEQ ID NO: 20: человеческий TGFβ1
ALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS
SEQ ID NO: 21: область изгиба LC IgG4 CAT192 дикого типа
LEIKRTVA
SEQ ID NO: 22: мутантная область изгиба LC с 1 вставленной дополнительной аминокислотой
LEIKGRTVA
SEQ ID NO: 23: мутантная область изгиба LC с 2 вставленными дополнительными аминокислотами
LEIKGGRTVA
SEQ ID NO: 24: мутантная область изгиба LC с 3 вставленными дополнительными аминокислотами
LEIKGGSRTVA
SEQ ID NO: 25: мутантная область изгиба LC с 4 вставленными дополнительными аминокислотами
LEIKGGGSRTVA
SEQ ID NO: 26: мутантная область изгиба LC с 5 вставленными дополнительными аминокислотами
LEIKGGGGSRTVA
SEQ ID NO: 27: последовательность, кодирующая легкую цепь CAT192 (IgG1)
atgggctggtcctgcatcatcctgtttctggtggccacagccaccggcgtgcacagcGAGATCGTGCTGACACAGAGCCCCAGCAGCCTGTCTGCCAGCGTGGGCGACAGAGTGACCATCACCTGTAGAGCCAGCCAGGGCATCGGCGACGACCTGGGATGGTATCAGCAGAAGCCTGGCAAGGCCCCCATCCTGCTGATCTACGGCACCAGCACACTGCAGAGCGGCGTGCCCTCCAGATTTTCTGGCAGCGGCTCCGGCACCGACTTCACCCTGACCATCAACAGCCTGCAGCCCGAGGACTTCGCCACCTACTACTGTCTGCAAGACAGCAACTACCCCCTGACCTTCGGCGGAGGCACCCGGCTGGAAATCAAGCGTACGGTGGCCGCTCCTTCCGTGTTCATCTTCCCTCCCTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCCGTGGTGTGTCTGCTGAACAACTTCTACCCTCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAGTCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCTGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGA
SEQ ID NO: 28: CAT192LC+G (LEIKGRTVA), прямой
5'-ggctggaaatcaagggccgtacggtggccgc-3'
SEQ ID NO: 29: CAT192LC+G (LEIKGRTVA), комплементарный
5'-gcggccaccgtacggcccttgatttccagcc-3'
SEQ ID NO: 30: CAT192LC+GG (LEIKGGRTVA), прямой
5'-ggctggaaatcaagggcggccgtacggtggccgc-3'
SEQ ID NO: 31: CAT192LC+GG (LEIKGGRTVA), комплементарный
5'-gcggccaccgtacggccgcccttgatttccagcc-3'
SEQ ID NO: 32: CAT192LC+GGS (LEIKGGSRTVA), прямой
5'-ggctggaaatcaagggcggcagccgtacggtggccgc-3'
SEQ ID NO: 33: CAT192LC+GGS (LEIKGGSRTVA), комплементарный
5'-gcggccaccgtacggctgccgcccttgatttccagcc-3'
SEQ ID NO: 34: CAT192LC+GGGS (LEIKGGGSRTVA), прямой
5'-ggctggaaatcaagggcggcggcagccgtacggtggccgc-3'
SEQ ID NO: 35: CAT192LC+GGGS (LEIKGGGSRTVA), комплементарный
5'-gcggccaccgtacggctgccgccgcccttgatttccagcc-3'
SEQ ID NO: 36: CAT192LC+GGGGS (LEIKGGGGSRTVA), прямой
5'-ggctggaaatcaagggcggcggcggcagccgtacggtggccgc-3'
SEQ ID NO: 37: CAT192LC+GGGGS (LEIKGGGGSRTVA), комплементарный
5'-gcggccaccgtacggctgccgccgccgcccttgatttccagcc-3'
SEQ ID NO: 38: LC IgG1 CAT192 дикого типа
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 39: мутантная легкая цепь с 1 вставленной дополнительной аминокислотой
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKGRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 40: мутантная легкая цепь с 2 вставленными дополнительными аминокислотами
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKGGRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 41: мутантная легкая цепь с 3 вставленными дополнительными аминокислотами
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKGGSRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 42: мутантная легкая цепь с 4 вставленными дополнительными аминокислотами
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKGGGSRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 43: мутантная легкая цепь с 5 вставленными дополнительными аминокислотами
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKGGGGSRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 44: область изгиба HC IgG4 CAT192 дикого типа
TVTVSSAS
SEQ ID NO: 45: мутантная область изгиба HC с 1 вставленной дополнительной аминокислотой
TVTVSGSAS
SEQ ID NO: 46: мутантная область изгиба HC с 2 вставленными дополнительными аминокислотами
TVTVSGGSAS
SEQ ID NO: 47: мутантная область изгиба HC с 2 вставленными дополнительными аминокислотами и одной удаленной аминокислотой
TVTVSGGSA
SEQ ID NO: 48: мутантная область изгиба HC с 5 вставленными дополнительными аминокислотами
TVTVSGGGGSSAS
SEQ ID NO: 49: последовательность, кодирующая HC IgG4 CAT192 дикого типа
atgggctggtcctgcatcatcctgtttctggtggccaccgccaccggcgtgcactctgaagtgcagctggtggaatctggcggcggagtggtgcagcctggcagaagcctgagactgagctgtgccgccagcggcttcaccttcagcagctacggaatgcactgggtgcgccaggcccctggcaaagaactggaatgggtggccgtgatcagctacgacggcagcatcaagtactacgccgacagcgtgaagggccggttcaccatctcccgggacaacagcaagaacaccctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactactgtgctagaaccggcgagtacagcggctacgacaccgaccctcagtactcttggggccagggcaccaccgtgacagtgtctagcgccagcaccaagggcccaagcgtgttccctctggccccttgcagcagaagcaccagcgaatctacagccgccctgggctgcctcgtgaaggactactttcccgagcccgtgacagtgtcctggaactctggcgccctgaccagcggagtgcatacctttccagccgtgctgcagagcagcggcctgtactctctgagcagcgtcgtgactgtgcccagcagctctctgggcaccaagacctacacctgtaacgtggaccacaagcccagcaacaccaaggtggacaagagagtgcatcaccaccaccatcac
SEQ ID NO: 50: CAT192HC+G (TVTVSGSAS), прямой
5'-ccaccgtgacagtgtctggcagcgccagc-3'
SEQ ID NO: 51: CAT192HC+G (TVTVSGSAS), комплементарный
5'-gctggcgctgccagacactgtcacggtgg-3'
SEQ ID NO: 52: CAT192HC+GG-ST (TVTVSGGSA), прямой
5'-ccaccgtgacagtgtctggcggcagcgccagc-3'
SEQ ID NO: 53: CAT192HC+GG-ST (TVTVSGGSA), комплементарный
5'-gctggcgctgccgccagacactgtcacggtgg-3'
SEQ ID NO: 54: CAT192HC+GGGGS (TVTVSGGGGSSAS), прямой
5'-caccaccgtgacagtgtctggcggcggcggcagcagcgccagca-3'
SEQ ID NO: 55: CAT192HC+GGGGS (TVTVSGGGGSSAS), комплементарный
5'-tgctggcgctgctgccgccgccgccagacactgtcacggtggtg-3'
SEQ ID NO: 56: мутантная тяжелая цепь с 1 вставленной дополнительной аминокислотой
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSGSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 57: мутантная тяжелая цепь с 2 вставленными дополнительными аминокислотами и 2 удаленными аминокислотами
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSGGSAKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 58: мутантная тяжелая цепь с 5 вставленными дополнительными аминокислотами
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSGGGGSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 59: CAT192HC+GG (TVTVSGGSAS), прямой
5'- caccaccgtgacagtgtctggcggcagcgccagca-3'
SEQ ID NO: 60: CAT192HC+GG (TVTVSGGSAS), комплементарный
5'- tgctggcgctgccgccagacactgtcacggtggtg-3'
SEQ ID NO: 61: мутантная тяжелая цепь с 2 вставленными дополнительными аминокислотами
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSGGSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Qiu, Huawei
Bird, Julie
<120> МОДИФИЦИРОВАННЫЕ АНТИТЕЛА IGG, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА БЕТА-1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ
<130> 578941
<150> 62/128,149
<151> 2015-03-04
<160> 61
<170> PatentIn версия 3.5
<210> 1
<211> 123
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 2
<211> 123
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Pro Ala Ser Pro Asp
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 3
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 4
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 5
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
1 5 10 15
Glu Leu Leu Gly Gly Pro
20
<210> 6
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 7
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Ser Tyr Gly Met His
1 5
<210> 8
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 9
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Ser Gly Val Glu Leu
1 5 10
<210> 10
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
1 5 10
<210> 11
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Thr Gly Phe Tyr Ser Gly Tyr Asp Thr Pro Ala Ser Pro Asp
1 5 10
<210> 12
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Arg Ala Ser Gln Gly Ile Gly Asp Asp Leu Gly
1 5 10
<210> 13
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Gly Thr Ser Thr Leu Gln Ser
1 5
<210> 14
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Leu Gln Asp Ser Asn Tyr Pro Leu Thr
1 5
<210> 15
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> другой_признак
<222> (3)..(3)
<223> Xaa может представлять собой любую втречающуюся в природе аминокислоту
<220>
<221> другой_признак
<222> (10)..(14)
<223> Xaa может представлять собой любую втречающуюся в природе аминокислоту
<400> 15
Thr Gly Xaa Tyr Ser Gly Tyr Asp Thr Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 16
<211> 213
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Glu Trp Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
1 5 10 15
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp Leu
20 25 30
Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile Tyr
35 40 45
Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 17
<211> 450
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 18
<211> 450
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 19
<211> 245
<212> БЕЛОК
<213> Homo sapiens
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ser Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln
130 135 140
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
145 150 155 160
Cys Arg Ser Ser Gln Gly Ile Gly Asp Asp Leu Gly Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile Tyr Gly Thr Ser Thr Leu
180 185 190
Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr
210 215 220
Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu Thr Phe Gly Gly Gly Thr
225 230 235 240
Arg Leu Glu Ile Lys
245
<210> 20
<211> 112
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Ala Leu Asp Thr Asn Tyr Cys Phe Ser Ser Thr Glu Lys Asn Cys Cys
1 5 10 15
Val Arg Gln Leu Tyr Ile Asp Phe Arg Lys Asp Leu Gly Trp Lys Trp
20 25 30
Ile His Glu Pro Lys Gly Tyr His Ala Asn Phe Cys Leu Gly Pro Cys
35 40 45
Pro Tyr Ile Trp Ser Leu Asp Thr Gln Tyr Ser Lys Val Leu Ala Leu
50 55 60
Tyr Asn Gln His Asn Pro Gly Ala Ser Ala Ala Pro Cys Cys Val Pro
65 70 75 80
Gln Ala Leu Glu Pro Leu Pro Ile Val Tyr Tyr Val Gly Arg Lys Pro
85 90 95
Lys Val Glu Gln Leu Ser Asn Met Ile Val Arg Ser Cys Lys Cys Ser
100 105 110
<210> 21
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Leu Glu Ile Lys Arg Thr Val Ala
1 5
<210> 22
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 22
Leu Glu Ile Lys Gly Arg Thr Val Ala
1 5
<210> 23
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 23
Leu Glu Ile Lys Gly Gly Arg Thr Val Ala
1 5 10
<210> 24
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 24
Leu Glu Ile Lys Gly Gly Ser Arg Thr Val Ala
1 5 10
<210> 25
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Leu Glu Ile Lys Gly Gly Gly Ser Arg Thr Val Ala
1 5 10
<210> 26
<211> 13
<212> БЕЛОК
<213> Homo sapiens
<400> 26
Leu Glu Ile Lys Gly Gly Gly Gly Ser Arg Thr Val Ala
1 5 10
<210> 27
<211> 702
<212> ДНК
<213> Homo sapiens
<400> 27
atgggctggt cctgcatcat cctgtttctg gtggccacag ccaccggcgt gcacagcgag 60
atcgtgctga cacagagccc cagcagcctg tctgccagcg tgggcgacag agtgaccatc 120
acctgtagag ccagccaggg catcggcgac gacctgggat ggtatcagca gaagcctggc 180
aaggccccca tcctgctgat ctacggcacc agcacactgc agagcggcgt gccctccaga 240
ttttctggca gcggctccgg caccgacttc accctgacca tcaacagcct gcagcccgag 300
gacttcgcca cctactactg tctgcaagac agcaactacc ccctgacctt cggcggaggc 360
acccggctgg aaatcaagcg tacggtggcc gctccttccg tgttcatctt ccctccctcc 420
gacgagcagc tgaagtccgg caccgcctcc gtggtgtgtc tgctgaacaa cttctaccct 480
cgggaggcca aggtgcagtg gaaggtggac aacgccctgc agtccggcaa ctcccaggag 540
tccgtcaccg agcaggactc caaggacagc acctactccc tgtcctccac cctgaccctg 600
tccaaggccg actacgagaa gcacaaggtg tacgcctgtg aggtgaccca ccagggcctg 660
tccagccctg tgaccaagtc cttcaaccgg ggcgagtgct ga 702
<210> 28
<211> 31
<212> ДНК
<213> Homo sapiens
<400> 28
ggctggaaat caagggccgt acggtggccg c 31
<210> 29
<211> 31
<212> ДНК
<213> Homo sapiens
<400> 29
gcggccaccg tacggccctt gatttccagc c 31
<210> 30
<211> 34
<212> ДНК
<213> Homo sapiens
<400> 30
ggctggaaat caagggcggc cgtacggtgg ccgc 34
<210> 31
<211> 34
<212> ДНК
<213> Homo sapiens
<400> 31
gcggccaccg tacggccgcc cttgatttcc agcc 34
<210> 32
<211> 37
<212> ДНК
<213> Homo sapiens
<400> 32
ggctggaaat caagggcggc agccgtacgg tggccgc 37
<210> 33
<211> 37
<212> ДНК
<213> Homo sapiens
<400> 33
gcggccaccg tacggctgcc gcccttgatt tccagcc 37
<210> 34
<211> 40
<212> ДНК
<213> Homo sapiens
<400> 34
ggctggaaat caagggcggc ggcagccgta cggtggccgc 40
<210> 35
<211> 40
<212> ДНК
<213> Homo sapiens
<400> 35
gcggccaccg tacggctgcc gccgcccttg atttccagcc 40
<210> 36
<211> 43
<212> ДНК
<213> Homo sapiens
<400> 36
ggctggaaat caagggcggc ggcggcagcc gtacggtggc cgc 43
<210> 37
<211> 43
<212> ДНК
<213> Homo sapiens
<400> 37
gcggccaccg tacggctgcc gccgccgccc ttgatttcca gcc 43
<210> 38
<211> 214
<212> БЕЛОК
<213> Homo sapiens
<400> 38
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 39
<211> 215
<212> БЕЛОК
<213> Homo sapiens
<400> 39
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Gly Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 40
<211> 216
<212> БЕЛОК
<213> Homo sapiens
<400> 40
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Gly Gly Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 41
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<400> 41
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Gly Gly Ser Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 42
<211> 218
<212> БЕЛОК
<213> Homo sapiens
<400> 42
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Gly Gly Gly Ser Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 43
<211> 219
<212> БЕЛОК
<213> Homo sapiens
<400> 43
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Asp Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Ile Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Ser Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 44
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 44
Thr Val Thr Val Ser Ser Ala Ser
1 5
<210> 45
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 45
Thr Val Thr Val Ser Gly Ser Ala Ser
1 5
<210> 46
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 46
Thr Val Thr Val Ser Gly Gly Ser Ala Ser
1 5 10
<210> 47
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 47
Thr Val Thr Val Ser Gly Gly Ser Ala
1 5
<210> 48
<211> 13
<212> БЕЛОК
<213> Homo sapiens
<400> 48
Thr Val Thr Val Ser Gly Gly Gly Gly Ser Ser Ala Ser
1 5 10
<210> 49
<211> 738
<212> ДНК
<213> Homo sapiens
<400> 49
atgggctggt cctgcatcat cctgtttctg gtggccaccg ccaccggcgt gcactctgaa 60
gtgcagctgg tggaatctgg cggcggagtg gtgcagcctg gcagaagcct gagactgagc 120
tgtgccgcca gcggcttcac cttcagcagc tacggaatgc actgggtgcg ccaggcccct 180
ggcaaagaac tggaatgggt ggccgtgatc agctacgacg gcagcatcaa gtactacgcc 240
gacagcgtga agggccggtt caccatctcc cgggacaaca gcaagaacac cctgtacctg 300
cagatgaaca gcctgcgggc cgaggacacc gccgtgtact actgtgctag aaccggcgag 360
tacagcggct acgacaccga ccctcagtac tcttggggcc agggcaccac cgtgacagtg 420
tctagcgcca gcaccaaggg cccaagcgtg ttccctctgg ccccttgcag cagaagcacc 480
agcgaatcta cagccgccct gggctgcctc gtgaaggact actttcccga gcccgtgaca 540
gtgtcctgga actctggcgc cctgaccagc ggagtgcata cctttccagc cgtgctgcag 600
agcagcggcc tgtactctct gagcagcgtc gtgactgtgc ccagcagctc tctgggcacc 660
aagacctaca cctgtaacgt ggaccacaag cccagcaaca ccaaggtgga caagagagtg 720
catcaccacc accatcac 738
<210> 50
<211> 29
<212> ДНК
<213> Homo sapiens
<400> 50
ccaccgtgac agtgtctggc agcgccagc 29
<210> 51
<211> 29
<212> ДНК
<213> Homo sapiens
<400> 51
gctggcgctg ccagacactg tcacggtgg 29
<210> 52
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 52
ccaccgtgac agtgtctggc ggcagcgcca gc 32
<210> 53
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 53
gctggcgctg ccgccagaca ctgtcacggt gg 32
<210> 54
<211> 44
<212> ДНК
<213> Homo sapiens
<400> 54
caccaccgtg acagtgtctg gcggcggcgg cagcagcgcc agca 44
<210> 55
<211> 44
<212> ДНК
<213> Homo sapiens
<400> 55
tgctggcgct gctgccgccg ccgccagaca ctgtcacggt ggtg 44
<210> 56
<211> 454
<212> БЕЛОК
<213> Homo sapiens
<400> 56
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Gly Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 57
<211> 453
<212> БЕЛОК
<213> Homo sapiens
<400> 57
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Gly Gly Ser Ala Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 58
<211> 458
<212> БЕЛОК
<213> Homo sapiens
<400> 58
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Gly Gly Gly Gly Ser Ser
115 120 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
130 135 140
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
145 150 155 160
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
165 170 175
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
180 185 190
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
195 200 205
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
210 215 220
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
225 230 235 240
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
260 265 270
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
275 280 285
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
290 295 300
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
305 310 315 320
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
325 330 335
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
340 345 350
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
355 360 365
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
370 375 380
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
385 390 395 400
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
405 410 415
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
420 425 430
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
435 440 445
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 59
<211> 35
<212> ДНК
<213> Homo sapiens
<400> 59
caccaccgtg acagtgtctg gcggcagcgc cagca 35
<210> 60
<211> 35
<212> ДНК
<213> Homo sapiens
<400> 60
tgctggcgct gccgccagac actgtcacgg tggtg 35
<210> 61
<211> 455
<212> БЕЛОК
<213> Homo sapiens
<400> 61
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Glu Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Glu Tyr Ser Gly Tyr Asp Thr Asp Pro Gln Tyr Ser
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Gly Gly Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<---