Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ αβTCR
Вид РИД
Изобретение
Настоящее изобретение относится к антителу, специфическому в отношении альфа-бета Т-клеточного рецептора (αβTCR). В частности, настоящее изобретение относится к гуманизированному антителу против αβTCR, которое получают из моноклонального антитела BMA031 мыши, и к применению указанного гуманизированного антитела в иммуносупрессивной терапии.
Введение
Применение иммуносупрессоров при аутоиммунных заболеваниях и профилактике кризиса отторжения трансплантата органа подтверждено документальными доказательствами, однако этот процесс является далеко не оптимальным. Токсичность, оппортунистические инфекции, цитокиновая буря и увеличенный риск развития рака широко распространены у пациентов, подвергнутых лечению этими средствами. Использование биологических средств в этой области улучшило в некоторой мере результат лечения пациентов, при этом эти побочные эффекты остаются явными.
Применение содержащих поликлональные антитела против лимфоцитов антисывороток с целью иммуносупрессии хорошо известно. Однако получение антисывороток является трудоемким процессом, причем антисыворотки демонстрируют свойства, которые варьируют между партиями, и специфичность, которой можно достичь, используя содержащие поликлональные антитела антисыворотки, является ограниченной.
Продукция моноклональных антител с использованием гибридомной технологии была впервые описана Kohler и Milstein (Nature 256: 495-497 (1975)). По сравнению с содержащими поликлональные антитела антисыворотками моноклональные антитела (мАт) являются более специфическими и обладают постоянными свойствами. мАт чаще и успешнее всего использовались в иммуносупрессивной терапии при клинической трансплантации органов. Однако большинство мАт, используемых в качестве иммуносупрессоров для лечения аутоиммунных заболеваний и для пациентов с трансплантатами, обладает широкой иммуносупрессорной способностью, оказывая, в силу этого, нежелательное воздействие на функционирование широкого спектра иммуноцитов, предположительно не все из которых вовлечены в отторжение трансплантата.
Моноклональные антитела мыши против антигенов в виде рецепторов T-клеточной поверхности были впервые получены в 1979, используя гибридомную технологию (Kung et al. (1979) Science 206: 347-349). Из трех моноклональных антител, обнаруженных Kung et al., одно антитело, названное муромонаб-CD3 (OKT3), обладало определенной специфичностью к CD3-рецептору Т-клетки, взаимодействуя с более чем 95% периферических зрелых Т-клеток, без оказания воздействия на незрелые тимоциты. Связывание OKT3 с CD3 комплексом приводит к интернализации CD3-рецептора и утрате CD3-позитивных клеток на периферии. Успешное лечение с использованием OKT3 связано с быстрым уменьшением CD3-позитивных T-клеток со значением приблизительно 60% до менее чем 5%.
OKT3 широко использовалось для лечения пациентов, у которых происходит острое отторжение аллотрансплантата после трансплантации почки (Russell, P.S., Colvin, R.B., Cosimi, A.B. (1984) Annu. Rev. Med. 35: 63 и Cosimi, A.B., Burton, R.C., Colvin, R.B. et al. (1981) Transplantation 32: 535). Кроме того, OKT3 и кроличий комплемент использовались для удаления зрелых T-клеток из костного мозга донора для предупреждения острой гомологичной болезни (GVHD) при аллогенной трансплантации костного мозга (Prentice, H.G., Blacklock, H.A., Janossy, G. et al. (1982) Lancet 1: 700 и Blacklock, H.A., Prentice, H.G., Gilmore, M.J. et al. (1983) Exp. Hematol. 11: 37). Тогда как лечение с использованием OKT3, по-видимому, является эффективным для профилактики GVHD при аллогенной трансплантации костного мозга для лечения острого лейкоза, комбинированная in vitro/in vivo обработка/лечение с использованием OKT3 не предотвратила развития GVHD во время лечения тяжелого комбинированного иммунодефицита (Hayward, A.R. et al. (1982) Clin. Lab. Observ. 100: 665). Обработка T-клеток OKT3 вызывает несколько ответных реакций, несоответствующих иммуносупрессии, в том числе активацию T-клеток, продукцию иммуномедиаторов и T3-модуляцию. Теоретически допускают, что содержащий T3-антиген комплекс, распознаваемый CD3-мАт (например, OKT3), играет ключевую роль во время активации T-клеток. Альфа/бета T-лимфоциты распознают лиганды в форме пептид-MHC с помощью мультимерного белкового комплекса, называемого комплексом αβ T-клеточный антиген/рецептор (TCR).CD3. Эта структура состоит из непостоянного димера αβTCR, который связывается с антигенами, и трех инвариантных димеров (CD3γε, δε и ζζ), которые участвуют в поверхностном переносе TCR.CD3, его стабилизации и трансдукции сигнала. Альфа-бета T-клеточный рецептор (αβTCR) представлен на большинстве (приблизительно 95%) T-клеток и играет важную роль в активации T-клеток путем соединения с антигеном, представленным на MHC. Остальные 5% клеток являются позитивными по гамма-дельта T-клеточному рецептору (γδTCR). Популяция γδTCR-позитивных клеток играет важную роль во врожденном иммунном ответе при защите от оппортунистических инфекций бактериального, вирусного и грибкового происхождения. Гамма-дельта T-клетки не играют роли в отторжении трансплантата при трансплантации. Следовательно, направленность против популяции αβTCR-позитивных клеток и сбережение популяции γδTCR-позитивных клеток должны создать возможность для значительной терапевтической эффективности при сохранении исходной иммунной защиты от оппортунистических инфекций.
Моноклональное антитело мыши изотипа IgG2b - BMA031 (Borst et al. (Nov. 1990) Hum. Immunol. 29(3): 175-88; EP0403156) является специфическим для общей детерминанты в комплексе TCR альфа/бета/CD3 и не связывается с гамма-дельта TCR. BMA031 является в высокой степени иммуносупрессорным и способно к индукции апоптоза активированных T-клеток через механизм индуцируемой активацией гибели клеток (AICD) (Wesselborg et al. (May 1993) J. Immunol. 150(10): 4338-4345). In vitro антитело ингибирует реакцию смешанной культуры лимфоцитов, и оно продемонстрировало эффективность в предварительном клиническом испытании в профилактики отторжения трансплантата в ряде сценариев трансплантации цельных органов, а также в лечении острой гомологической болезни (aGVHD) (Kurrle et al. (Feb 1989) Transplant Proc. 21 (1): 1017-1019). BMA031 не соединяется с Fc-гамма рецепторами человека (FcγR) у большей части населения (приблизительно у 10% людей имеются FcγR, которые действительно связываются с изотипом IgG2b мыши). Как таковое, это антитело не приводит к активации T-клеток путем перекрестного связывания T-клеточного рецептора, и, следовательно, оно не вызывает активацию T-клеток или связанный с этим выброс цитокинов. В связи с этим, его профиль является наиболее предпочтительным по сравнению с таковым OKT3. Однако BMA031 является мышиным антителом и, как таковое, не подходит для многократного введения доз являющимся людьми субъектам ввиду образования антимышиных антител человека (HAMA), вызываемого у них.
Несколько гуманизированных вариантов BMA031 было описано (см. EP 0403156; также Shearman et al., (1991) J. Immunol. 147: 4366-4373). Как отмечено в EP0403156, в результате только пересадки CDR не удалось сохранить связывание с антигеном. Один клон со значительными модификациями каркасной области, EuCIV3, успешно связывался с T-клетками; однако, как отмечено в EP0403156, связывание с αβTCR не является столь же эффективным, как в случае исходного антитела BMA031, как определено с помощью анализов конкуренции с использованием проточной цитометрии. Авторы настоящего изобретения также обнаружили, что способность EuCIV3 к ингибированию in vitro иммунной реакции является значительно уменьшенной по сравнению с BMA031 (см. фиг.2). Кроме того, EuCIV3 был первоначально создан на основе IgG1 или IgG4 человека дикого типа, которая все еще продолжает связываться с FcγR. Следовательно, эти гуманизированные антитела давали возможность для активации T-клеток, их пролиферации и сопутствующего выброса цитокинов, и, как таковые, были достоверно отличны от первоначальных свойств BMA031.
Изменение степени/характера гликозилирования антител известно в данной области. Например, известно, что негликозилированные антитела могут обладать в значительной степени модифицированной функцией; см. Boyd et al. (1996) Mol. Immunol. 32: 1311-1318. Однако негликозилированные формы гуманизированного BMA031 или производные с измененными характерами гликозилирования ранее не были описаны.
Следовательно, в данной области существует потребность в гуманизированном антителе против αβTCR, способности к связыванию которого улучшены по сравнению с таковыми EUCIV3, и у которого преимущественно сохраняется способность к иммуносупрессии и не активации T-клеток BMA031.
Краткое изложение сущности изобретения
В первом аспекте изобретение относится к гуманизированному моноклональному антителу, которое содержит CDR BMA031 и у которого сохраняется аффинность BMA031 в отношении распознаваемого им антигена. В первом варианте осуществления указанное гуманизированное антитело содержит вариабельную область тяжелой цепи, содержащую CDR SEQ ID NO:7, 12 или 13, и каркасную область IGH3-23 человека SEQ ID NO:17, где остатком в положении 6 каркасной области является донорный остаток (остаток донорной последовательности); в альтернативном варианте осуществления остатком в положении 18 каркасной области является донорный остаток. Необязательно, остатками в положениях 49 и/или 69 каркасной области являются донорные остатки.
Во втором варианте осуществления гуманизированное моноклональное антитело содержит вариабельную область тяжелой цепи, содержащую CDR SEQ ID NO:15 или 16, и каркасную область IGHV1-3*01 человека SEQ ID NO:18, где одним или более остатков в положениях 38, 44 и/или 48 каркасной области является донорный остаток; в альтернативном варианте осуществления остатками в положениях 44 и 48 каркасной области являются донорные остатки.
В третьем варианте осуществления гуманизированное моноклональное антитело содержит вариабельную область легкой цепи, содержащую CDR SEQ ID NO:14, и каркасную область IGKV3-11*01 человека SEQ ID NO:19, где остатками в положениях 70 и/или 71 каркасной области являются донорные остатки. Необязательно, остатком в положении 46 является донорный остаток.
Примеры антител согласно первому варианту осуществления включают антитела, которые содержат вариабельную область тяжелой цепи, выбранную из тяжелых цепей, содержащих последовательности SEQ ID NO:7, SEQ ID NO:12 и SEQ ID NO:13, и последовательность вариабельной области легкой цепи, содержащую последовательность SEQ ID NO:14.
Примеры антител согласно второму варианту осуществления включают антитела, которые содержат вариабельную область тяжелой цепи, выбранную из тяжелых цепей, содержащих последовательности SEQ ID NO:15 и SEQ ID NO:16, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO:14. Гуманизированные антитела согласно описанным вариантам осуществления представляют собой гуманизированные варианты BMA031. Их первичные структуры отличаются от структуры гуманизированного антитела EuCIV3, которое характеризуется уменьшенным связыванием с αβTCR по сравнению с BMA031.
В списке последовательностей CDR указаны посредством аннотации или подчеркивания. Все каркасные области являются последовательностями, находящимися вне CDR, которые определены в соответствии с системой нумерации «Кабат» и являются удлиненными, в соответствующих случаях, при использовании определения CDR «IMGT». Если не указано, что остаток каркасной области изменен для приведения в соответствие с донорной последовательностью, будет обычно подразумеваться, что он является остатком акцепторной последовательности.
Гуманизированные антитела могут содержать константную область. В одном варианте осуществления константная область является человеческой.
Гуманизированные антитела настоящего изобретения можно дополнительно модифицировать посредством конструирования Fc. Иммуноглобулины склонны к перекрестному связыванию с Fcγ-рецепторами, которое может приводить к значительной активации T-клеток в случае антител против T-клеток. Во избежание перекрестного связывания с Fcγ-рецепторами антитела можно модифицировать с удалением Fc-области, например, посредством создания Fab- или Fv-фрагментов; однако усеченные иммуноглобулины лишены полезных эффекторных функций и демонстрируют более короткий период полужизни в кровотоке. Следовательно, Fc-область гуманизированного антитела можно модифицировать для предотвращения перекрестного связывания с Fcγ. Приводимые в качестве примера способы включают создание негликозилированных иммуноглобулинов, например, посредством модифицирования Fc-области в результате мутации N297Q. Иммуноглобулины, которые не связываются с Fcγ, также описаны Armour et al., (1999) Eur. J. Immunol. 29: 2613-2624. Модификация, осуществленная в IgG1, известна как модификация Δab и заключается в комбинации мутации Δa, в результате которой заменены остатки IgG в положениях 327, 330 и 331, и заменены остатки IgG2 в положениях 233-236, и мутации Δb, в результате которой делетирован остаток 236. В другом варианте осуществления может быть изменен характер гликозилирования антител по настоящему изобретению.
В одном варианте осуществления антитело содержит одну или более мутаций S298N, T299A и Y300S.
В вариантах осуществления антитело содержит две или более мутаций N297Q, S298N, T299A и Y300S. Например, обеспечивается гуманизированное антитело, содержащее множественные мутации N297Q/S298N/Y300S, S298N/T299A/Y300S или S298N/Y300S.
Во втором аспекте изобретение относится к гуманизированному моноклональному антителу, которое содержит CDR BMA031, и у которого сохраняются присущие BMA031 способности к подавлению активности Т-клеток. Указанное гуманизированное антитело предпочтительно содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:12, 13, 15 или 16, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:14.
В третьем аспекте изобретение относится к нуклеиновой кислоте, кодирующей по меньшей мере вариабельную область тяжелой цепи гуманизированного моноклонального антитела согласно предшествующим аспектам описанных вариантов осуществления. Нуклеиновая кислота может кодировать вариабельные и константные области гуманизированного антитела. Тяжелые и легкие цепи могут кодироваться различными молекулами нуклеиновых кислот или одной и той же молекулой нуклеиновой кислоты.
В соответствии с четвертым аспектом изобретение относится к клетке, которая экспрессирует нуклеиновую кислоту согласно предшествующему аспекту. Клеткой является, например, клетка, адаптированная к экспрессии молекул антител в культуре. Нуклеиновая кислота может содержать сигнальные последовательности и/или другие последовательности или модификации, которые необходимы для или которые модулируют экспрессии(ю) молекулы антитела в клетке и/или секреции(ю) молекулы антитела из клетки.
В другом варианте осуществления изобретение относится к гуманизированному антителу, описанному в предшествующих аспектах, для применения в супрессии T-клеточноопосредованного ответа у субъекта.
Например, T-клеточноопосредованный ответ может быть вовлечен в ситуацию, выбранную из трансплантации ткани, включая трансплантат цельного органа и смешанный тканевый трансплантат, пересадки ткани, рассеянного склероза и сахарного диабета типа 1.
Кроме того, другой вариант осуществления изобретение относится к способу лечения субъекта, страдающего заболеванием, в которое вовлечен аберрантный T-клеточноопосредованный ответ, включающему введение нуждающемуся в этом субъекту фармацевтически эффективной дозы антитела согласно описанным вариантам осуществления.
Таким образом, были созданы гуманизированные, неактивирующие антитела против αβTCR, не индуцирующие выброс цитокинов, которые способны к селективной модуляции αβTCR и индукции апоптоза активированных αβTCR-позитивных T-клеток. Эти антитела были созданы для применения в качестве иммуносупрессоров при T-клеточноопосредованных заболеваниях. Эти антитела были созданы посредством гуманизации мышиного антитела против αβTCR BMA031 и посредством конструирования Fc гуманизированных антител для предотвращения соединения с Fc-гамма рецепторами. У антител согласно описанным вариантам осуществления сохраняется аффинность BMA031, в отличие от гуманизированных вариантов BMA031, имеющихся в наличии в данной области. Кроме того, как установлено в in vitro исследованиях коммитирования, способности к иммуносупрессии антител согласно описанным вариантам осуществления превосходят таковые BMA031. Кроме того, в отличие от гуманизированных антител BMA031 предшествующего уровня, антитела согласно описанным вариантам осуществления не индуцируют выброс цитокинов в случае нормальных PBMC.
В соответствии с пятым аспектом изобретение относится к антителу, содержащему модифицированную Fc-область, в котором указанная модифицированная Fc включает в себя модифицированный характер гликозилирования, который уменьшает связывание с рецептором FcγR, включая одну или более мутаций S298N, T299A и Y300S.
В одном варианте осуществления антитело содержит две или более мутаций S297Q, S298N, T299A и Y300S.
В вариантах осуществления антитело содержит множественные мутации N297Q/S298N/Y300S, S298N/T299A/Y300S или S298N/Y300S.
Например, антителом может быть антитело, описанное в предшествующих аспектах настоящего изобретения.
В соответствии с шестым аспектом изобретение относится к полиспецифическому антителу, содержащему по меньшей мере тяжелую цепь первого связывающего домена, описанного в предшествующих аспектах настоящего изобретения, и второго связывающего домена, специфического в отношении опухолевоспецифического антигена.
В одном варианте осуществления первый связывающий домен включает тяжелую цепь согласно второму аспекту настоящего изобретения.
Полиспецифическое антитело может содержать множество различных конформаций; в одном варианте осуществления антитело включает scFv, направленный против TCR/CD3, и scFv, направленный против опухоли.
В одном варианте осуществления полиспецифическое антитело является биспецифическим.
Краткое описание фигур
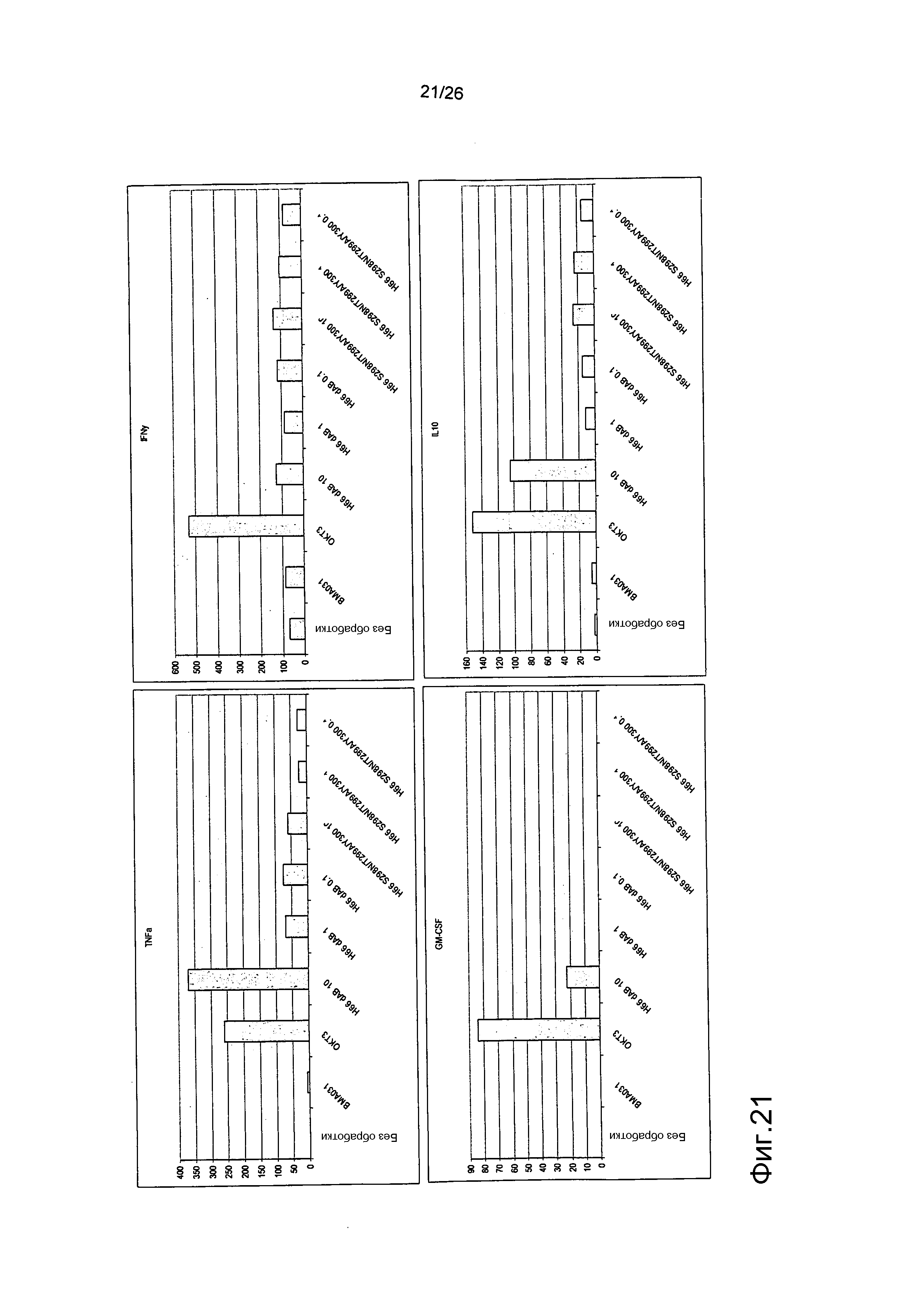
Фиг.1. BMA031 связывается с αβTCR сильнее, чем EuCIV3.
Конкуренция за связывание между PE-меченным антителом BMA031 и антителами BMA031 MoIgG2b, BMA031 HuIgG1 и EuCIV3 HuIgG1. EuCIV3 характеризуется уменьшенной эффективностью по сравнению с BMA031.
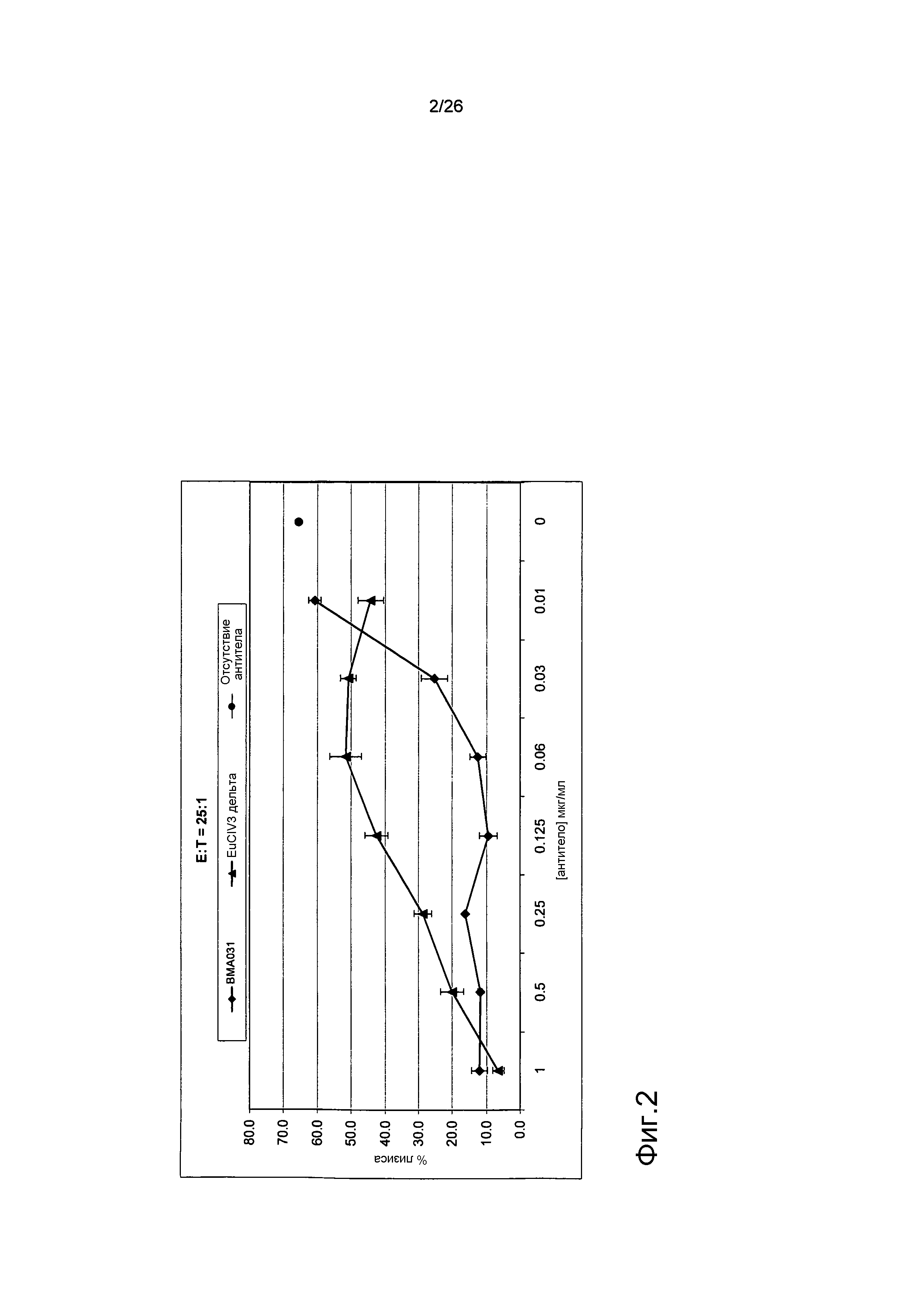
Фиг.2. EuCIV3 является менее эффективным, чем BMA031 в in vitro анализе коммитирования (IVE).
График, демонстрирующий уменьшение эффективности гуманизированного антитела EuCIV3 в биологическом анализе по сравнению с исходным антителом BMA031. CD8+ T-клетки обрабатывали антителами против αβTCR в различных концентрациях (Х-ось) и сокультивировали с аутологичными дендритными клетками, подвергнутыми инкубации со смесью CMV (ЦМВ) пептидов 495-503 (pp65) в течение нескольких дней.
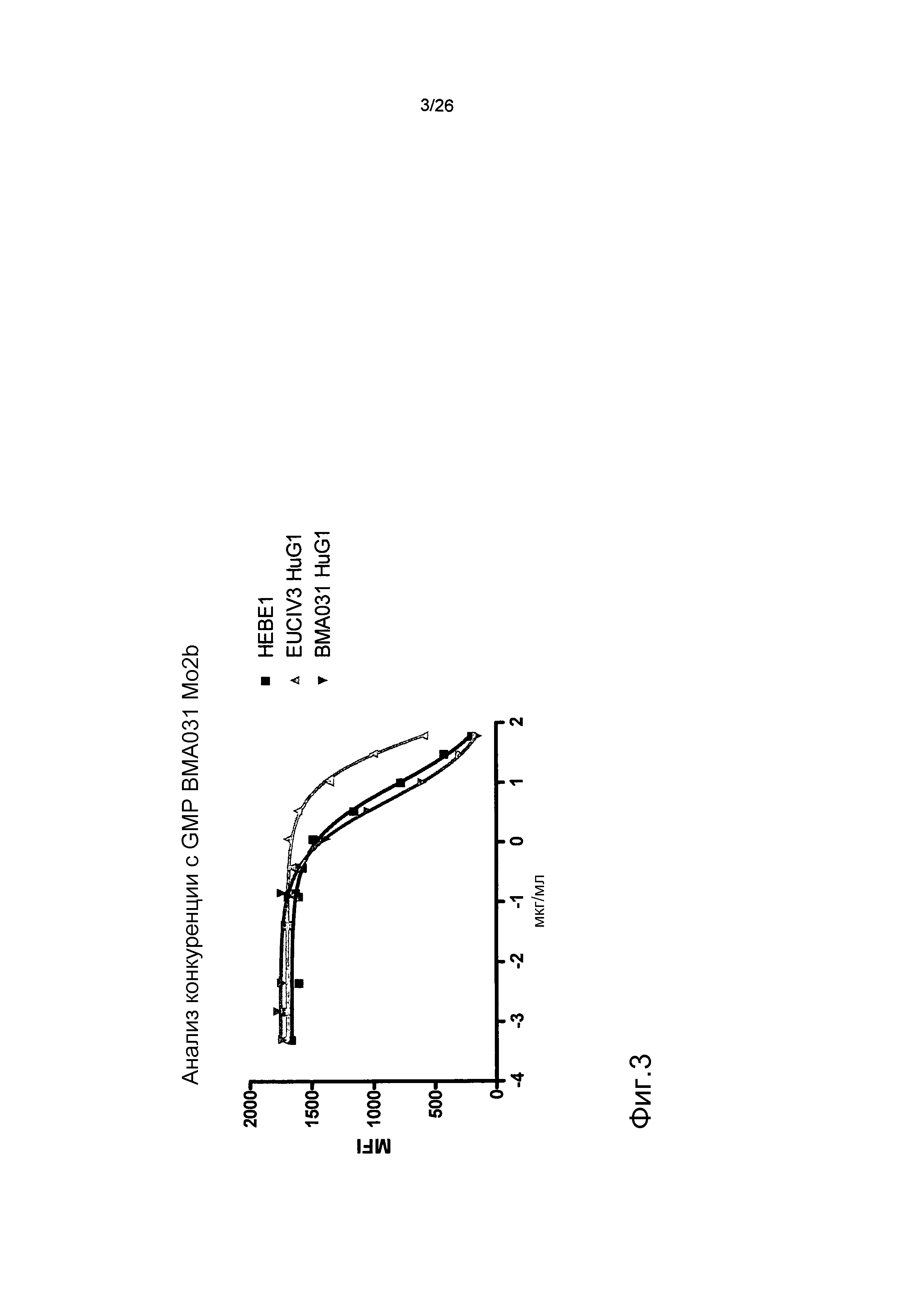
Фиг.3. HEBE1 связывается с αβTCR схоже с BMA031 в анализе конкуренции.
Конкуренция за связывание между PE-меченным антителом BMA031 и антителами BMA031 HuIgG1, HEBE1 HuIgG1 и EuCIV3 HuIgG1. EuCIV3 характеризуется уменьшенной эффективностью по сравнению с BMA031 и HEBE1.
Фиг.4. HEBE1 обладает эффективностью, схожей с эффективностью EuCIV3 в in vitro анализе коммитирования (IVE).
Анализ IVE был выполнен, как описано в связи с фиг.2.
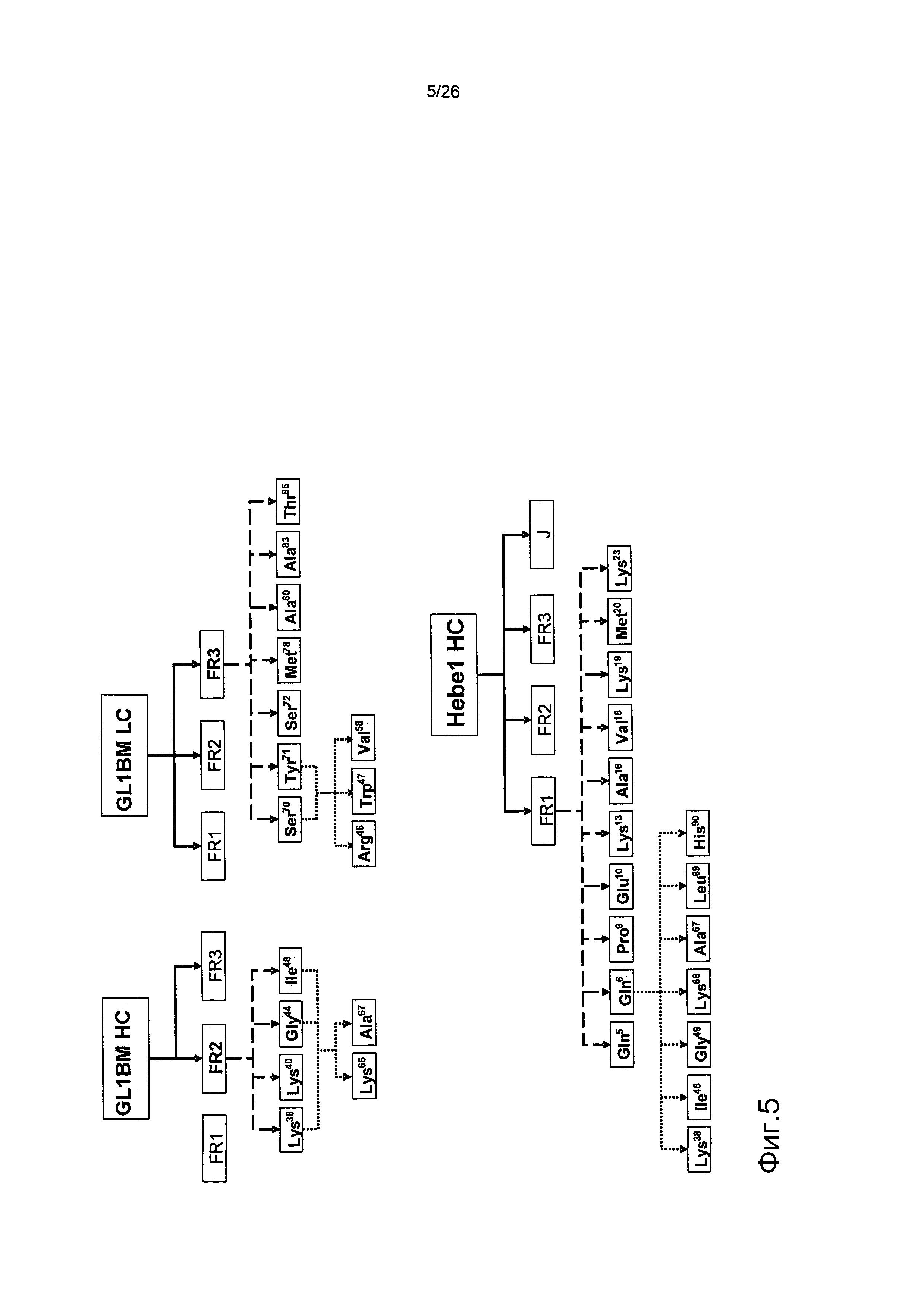
Фиг.5. Схема, демонстрирующая повторяющиеся циклы мутагенеза вариабельных доменов антител против αβTCR.
Каркасная область в затемненном прямоугольнике представляет FR-область, в которой находятся определенные мышиные остатки. Затемненные остатки в первом ряду мутаций являются мышиными аминокислотами, которые полезны для сохранения скорости диссоциации. Затемненные остатки во втором ряду мутаций являются мышиными аминокислотами, окружающими CDR-участки, которые были сохранены во время конечного процесса приближения к зародышевому типу.
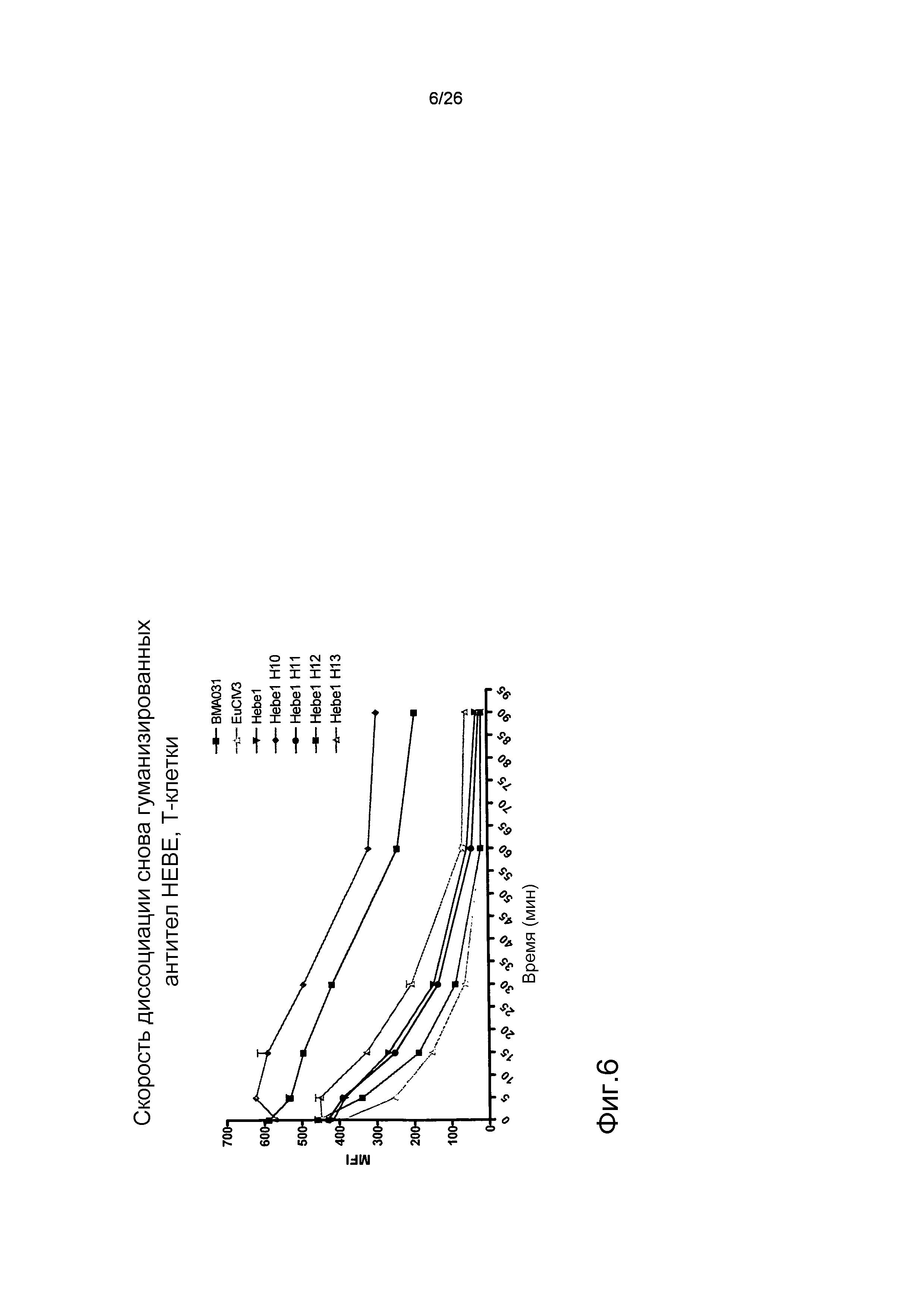
Фиг.6. Оптимизированное гуманизированное антитело имеет уменьшенную скорость диссоциации по сравнению с BMA031.
Кинетику диссоциации антител от αβTCR на T-клетках определяли с помощью проточной цитометрии. BMA031 имел меньшую скорость диссоциации по сравнению с EuCIV3 и HEBE1. В результате оптимизации связывающего домена HEBE1 авторы настоящего изобретения смогли уменьшить скорость диссоциации HEBE1.H10 по сравнению с BMA031.
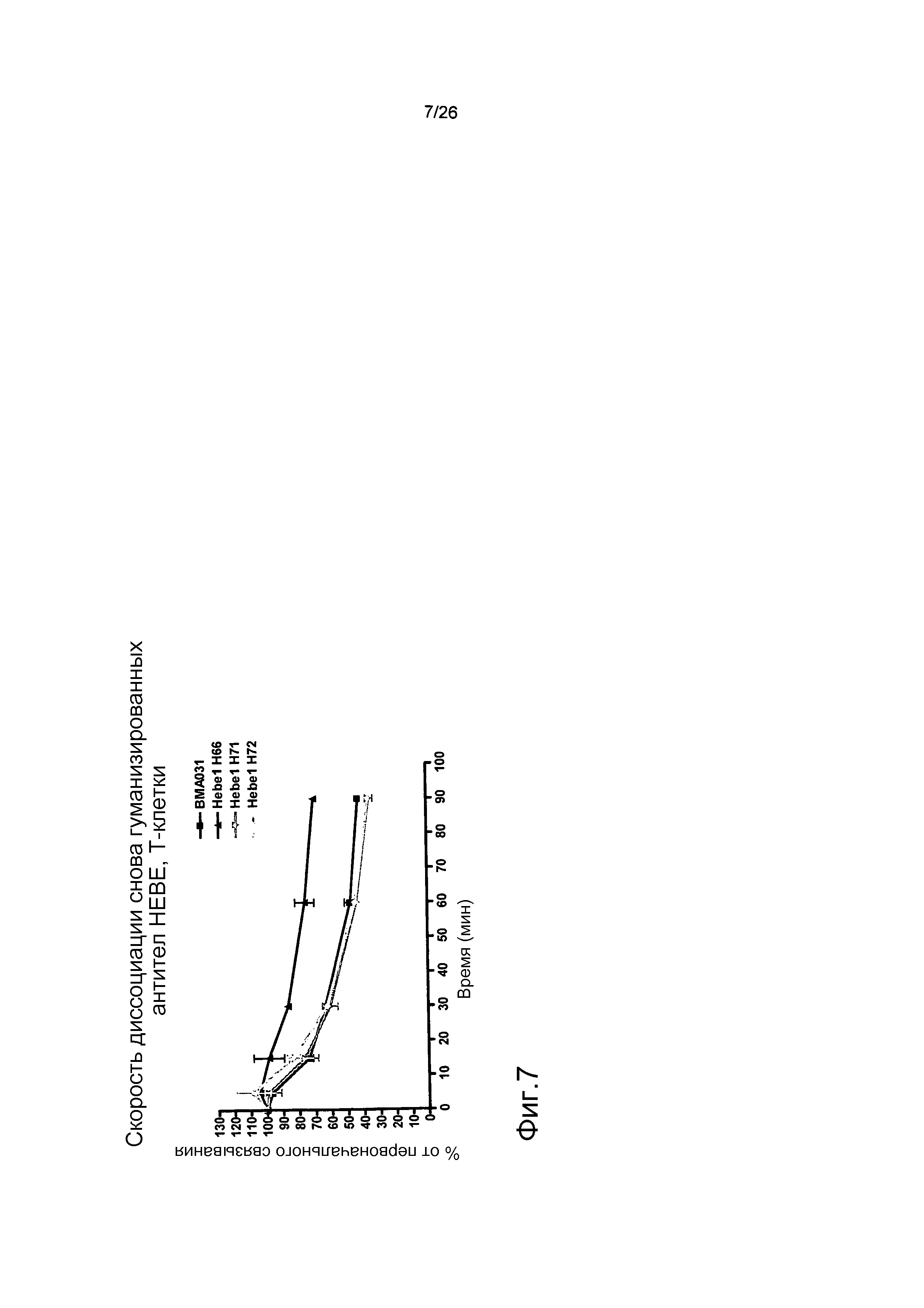
Фиг.7. Оптимизированное гуманизированное антитело имеет уменьшенную скорость диссоциации по сравнению с BMA031.
Кинетику диссоциации антител от αβTCR на T-клетках определяли с помощью проточной цитометрии. В результате оптимизации связывающего домена HEBE1 авторы настоящего изобретения смогли уменьшить скорость диссоциации HEBE1.H66 по сравнению с BMA031.
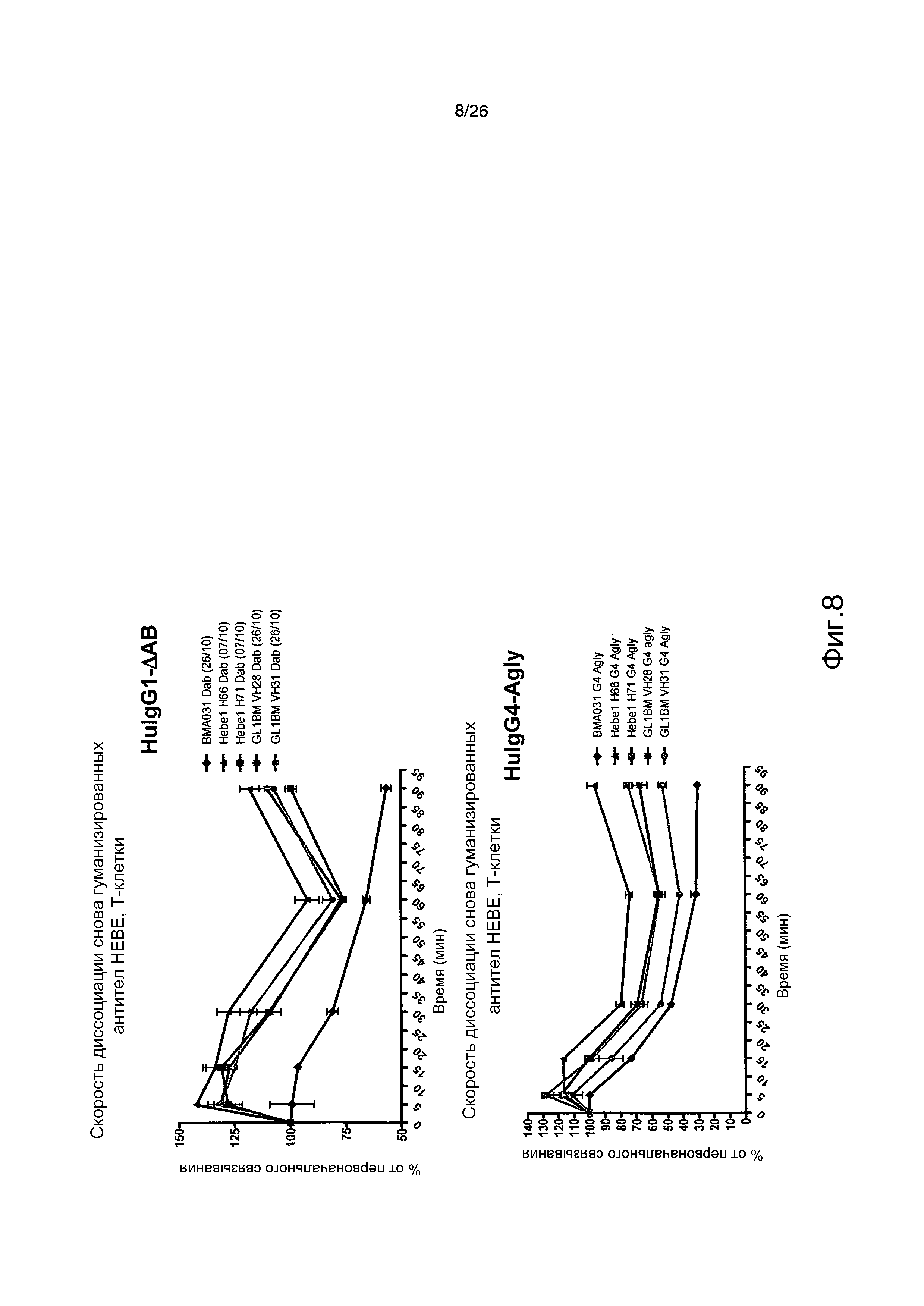
Фиг.8. Оптимизированное гуманизированное антитело имеет уменьшенную скорость диссоциации по сравнению с BMA031 и в формате Δab, и негликозилированном формате.
Кинетику диссоциации антител от αβTCR на T-клетках определяли с помощью проточной цитометрии.
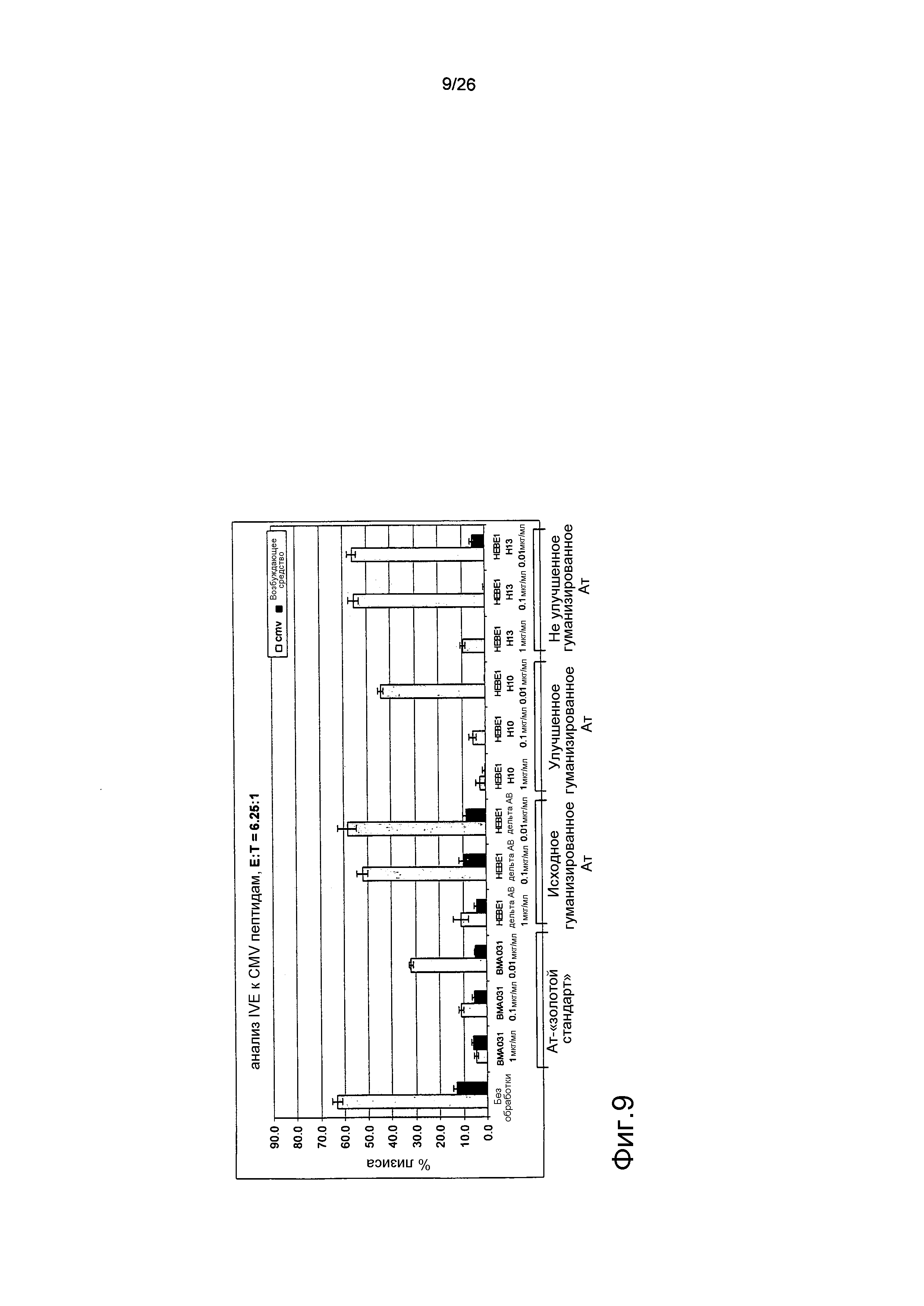
Фиг.9. Оптимизация HEBE1 приводит к функциональности, эквивалентной таковой BMA031.
Анализ IVE является анализом, описанным на фиг.4. BMA031 ингибировало коммитирование CD8+ T-клеток, поскольку они были неспособны к лизису специфических мишеней в зависимости от дозы. Исходное гуманизированное антитело, HEBE1, не было столь же эффективным, как BMA031, и было способно к ингибированию коммитирования только в наибольшей дозе (схожие результаты были отмечены при использовании второго неулучшенного гуманизированного Ат, HEBE1 H13). Дальнейшие улучшения были внесены в гуманизированное антитело, HEBE1 H10, которое обладало эффективностью, эквивалентной эффективности BMA031 в этом анализе.
Фиг.10. Данные IVE, полученные при использовании антител против αβTCR.
Антитела обоих рядов HEBE1 и GL1 BM продемонстрировали улучшения в результатах IVE при сравнении с BMA031.
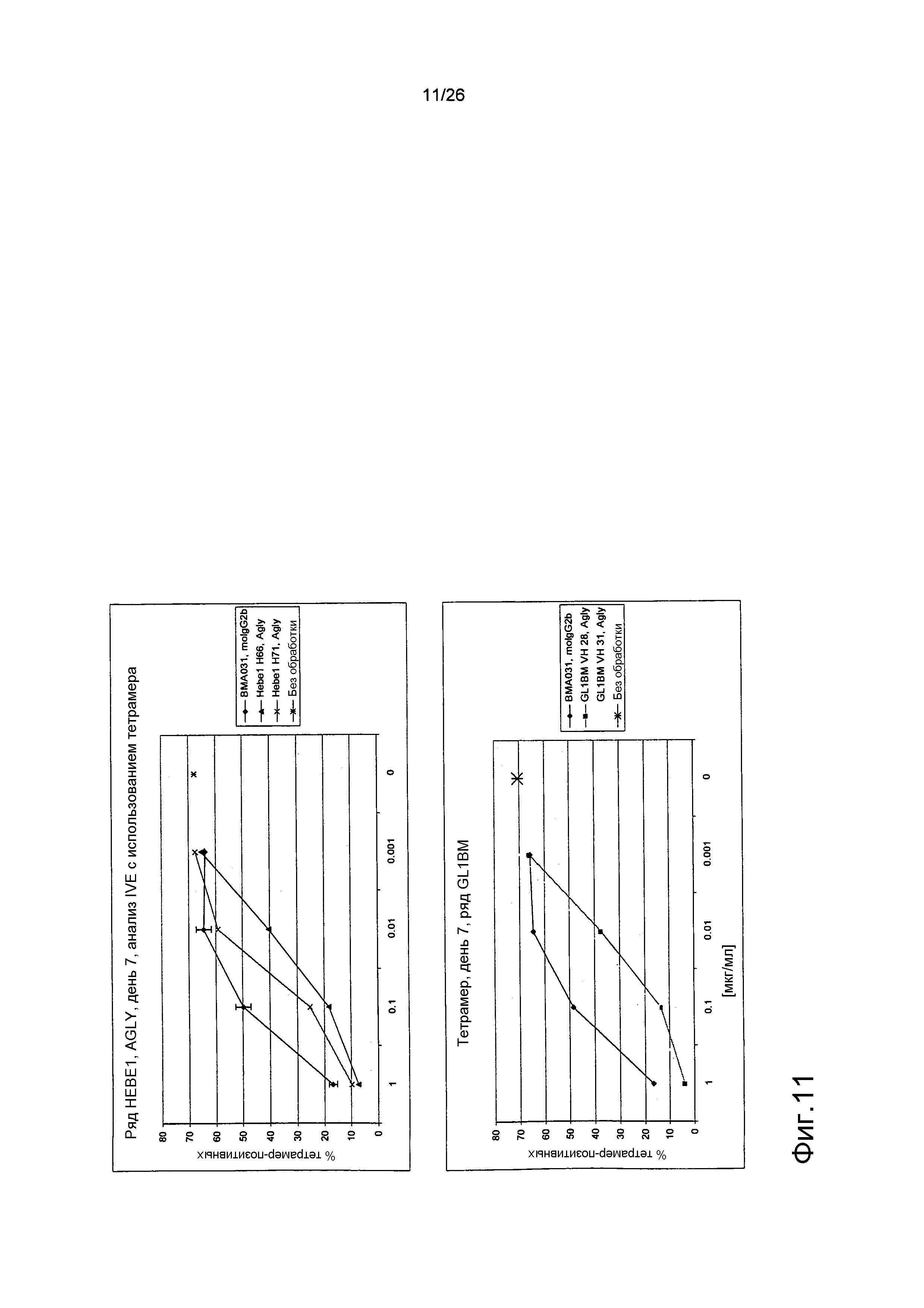
Фиг.11. Антиген-позитивные клетки из анализа IVE, определяемые по связыванию специфического в отношении антигена тетрамера.
Клетки, которые являются антиген-позитивными (т.е. были коммитированы в анализе IVE), способны к связыванию молекулы MHC-тетрамер. Когда анализ IVE проводили в присутствии антитела, которое было способно к предотвращению коммитирования T-клеток к антигену, отмечалось меньшее количество клеток, способных к связыванию с MHC-тетрамером в конце анализа.
Фиг.12. Пролиферация PBMC в присутствии антител против αβTCR, OKT3 и стимулирующих сфер.
Стимулирующая активность OKT3 не отмечалась у антител против αβTCR при этом сравнении.
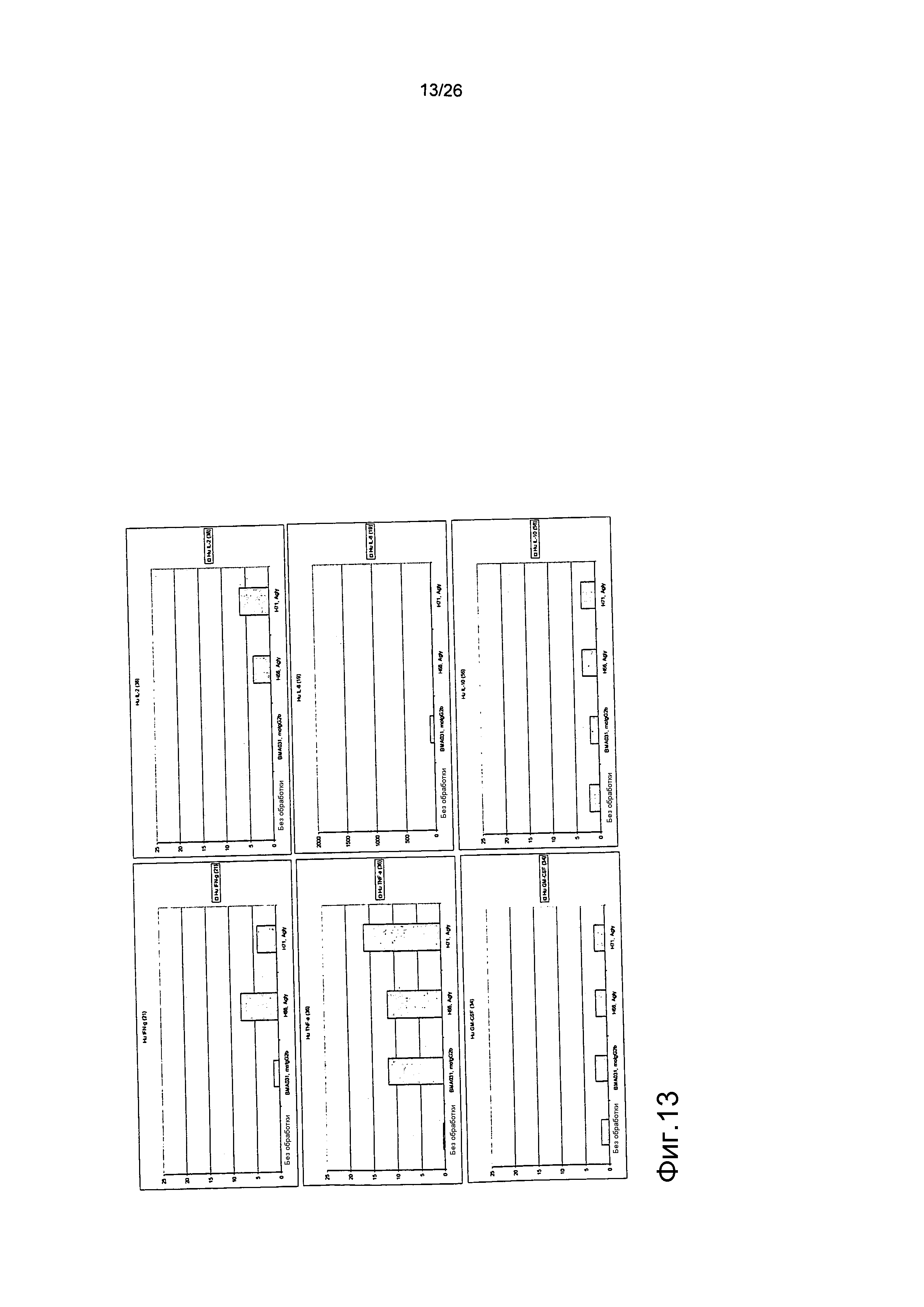
Фиг.13. Выброс цитокинов из PBMC в присутствии антител против αβPTCR.
Профиль выброса цитокинов для антител против αβTCR был схож с профилем, продемонстрированным BMA031.
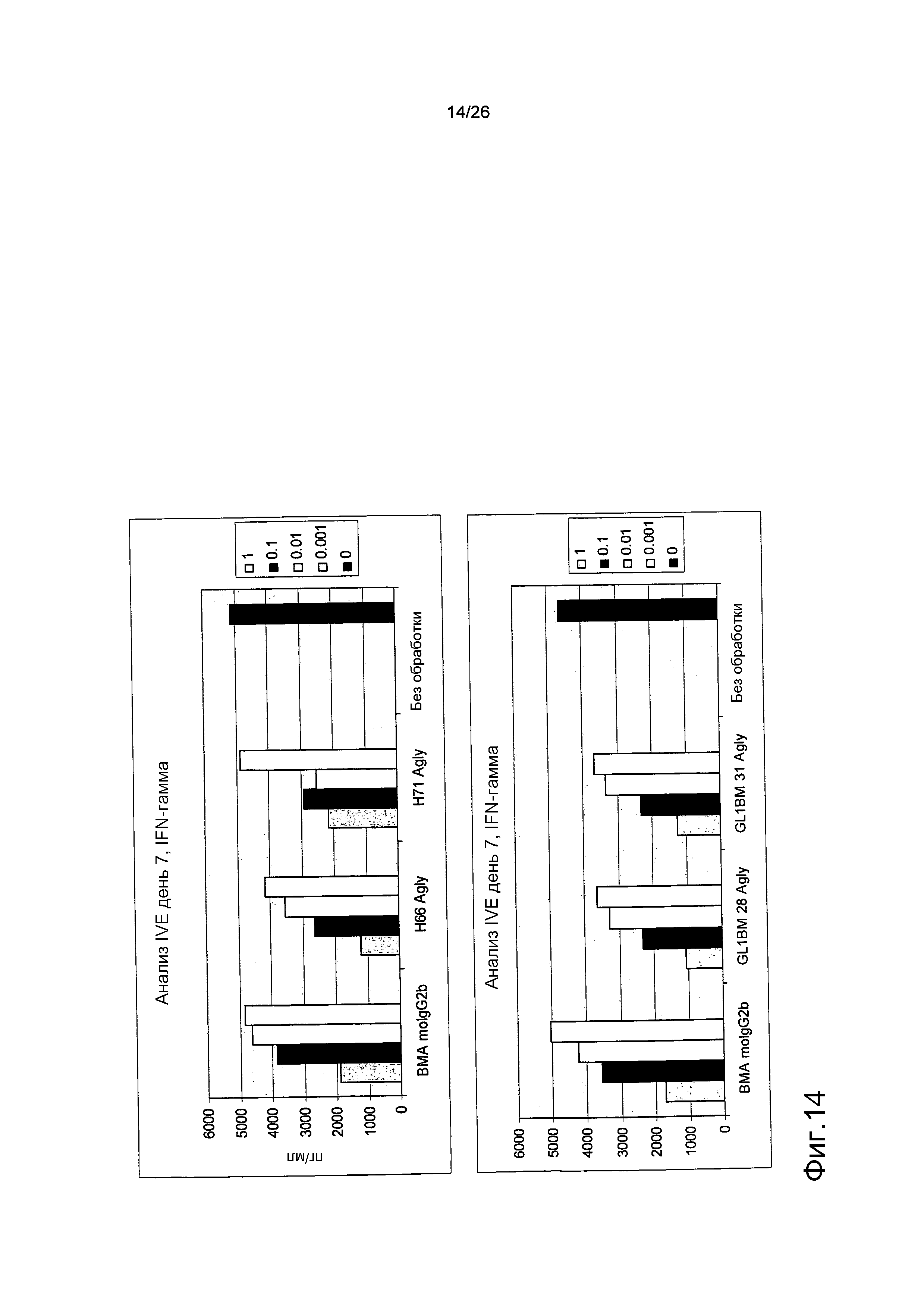
Фиг.14. Выброс IFN-гамма из T-клеток в анализе IVE.
CD8+ T-клетки обрабатывали антителами против αβTCR в различных концентрациях (см. фиг.2, Х-ось) и сокультивировали с аутологичными дендритными клетками, подвергнутыми инкубации со смесью CMV пептидов 495-503 (pp65) в течение семи дней в in vitro анализе коммитирования (IVE). В этом анализе измеряли выброс IFN-гамма.
Фиг.15. Индуцированный активацией апоптоз с помощью антител против αβTCR.
Апоптоз антиген-стимулированных CD8+ T-клеток индуцировали посредством связывания антител против αβTCR BMA031 и HEBE1 H66. Способность HEBE1 H66 к индукции апоптоза была увеличенной по сравнению с BMA031.
Фиг.16. Выделение мутантов по гликозилированию и негликозилированных антител.
Окрашенный кумасси синим гель, демонстрирующий экспрессию и очистку мутантов по гликозилированию.
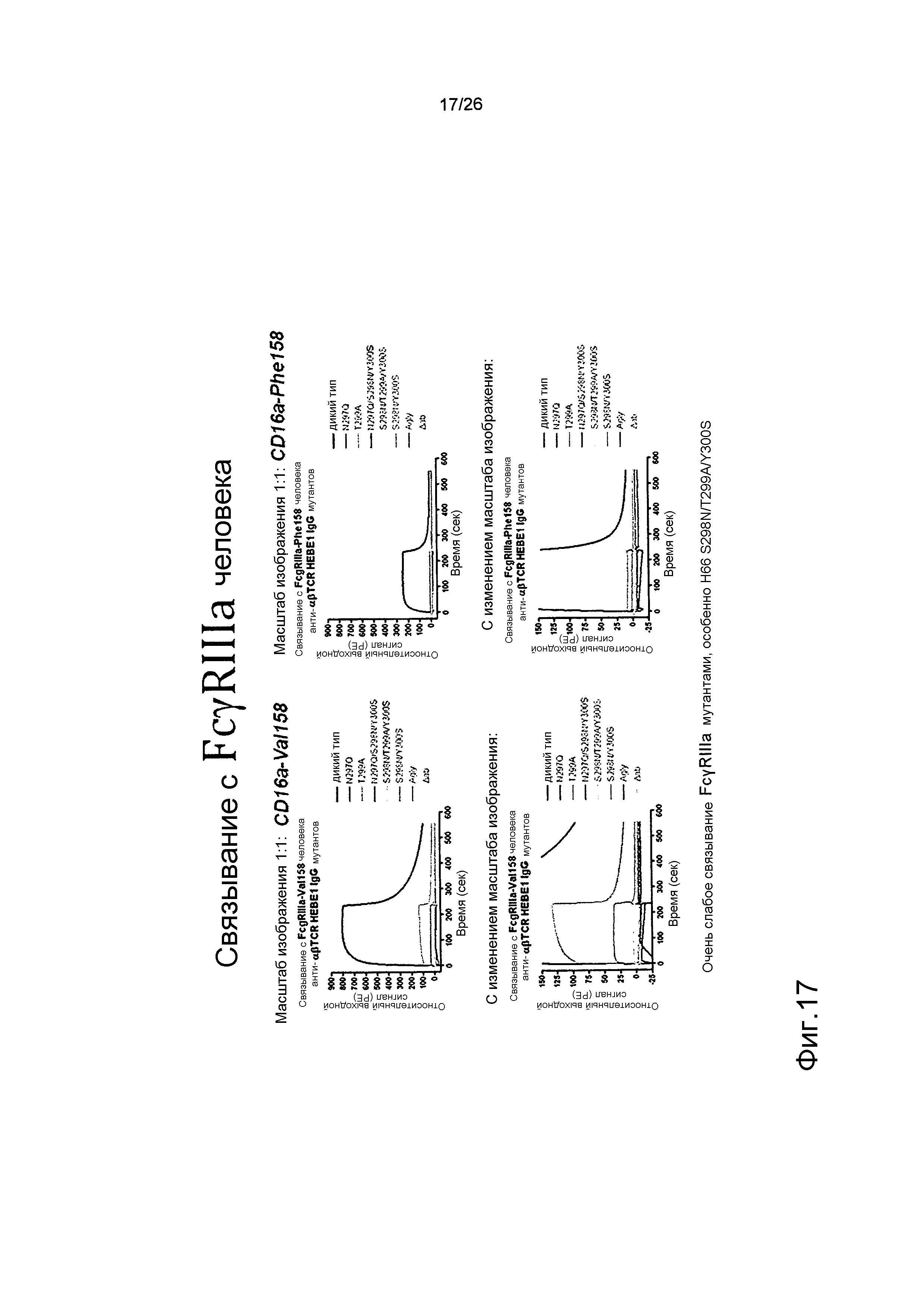
Фиг.17. Связывание мутантных антител против αβTCR с FcγRIIIa человека, используя Biacore.
Biacore использовали для оценки связывания с рекомбинантным FcγIIIa человека (V158 & F158).
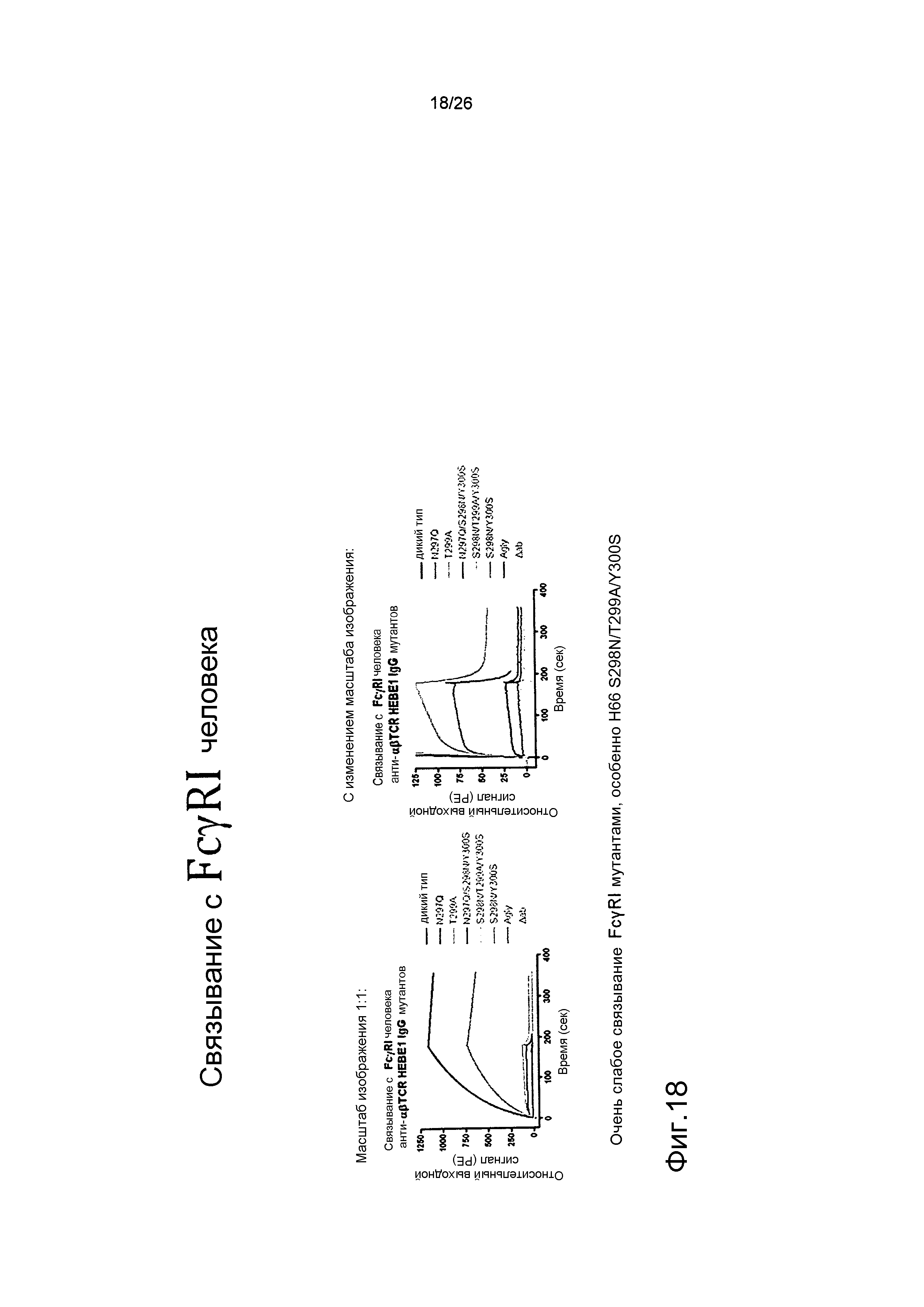
Фиг.18. Связывание мутантных антител против αβTCR с FcγRI человека, используя Biacore.
Biacore использовали для оценки связывания с рекомбинантным FcγRI человека.
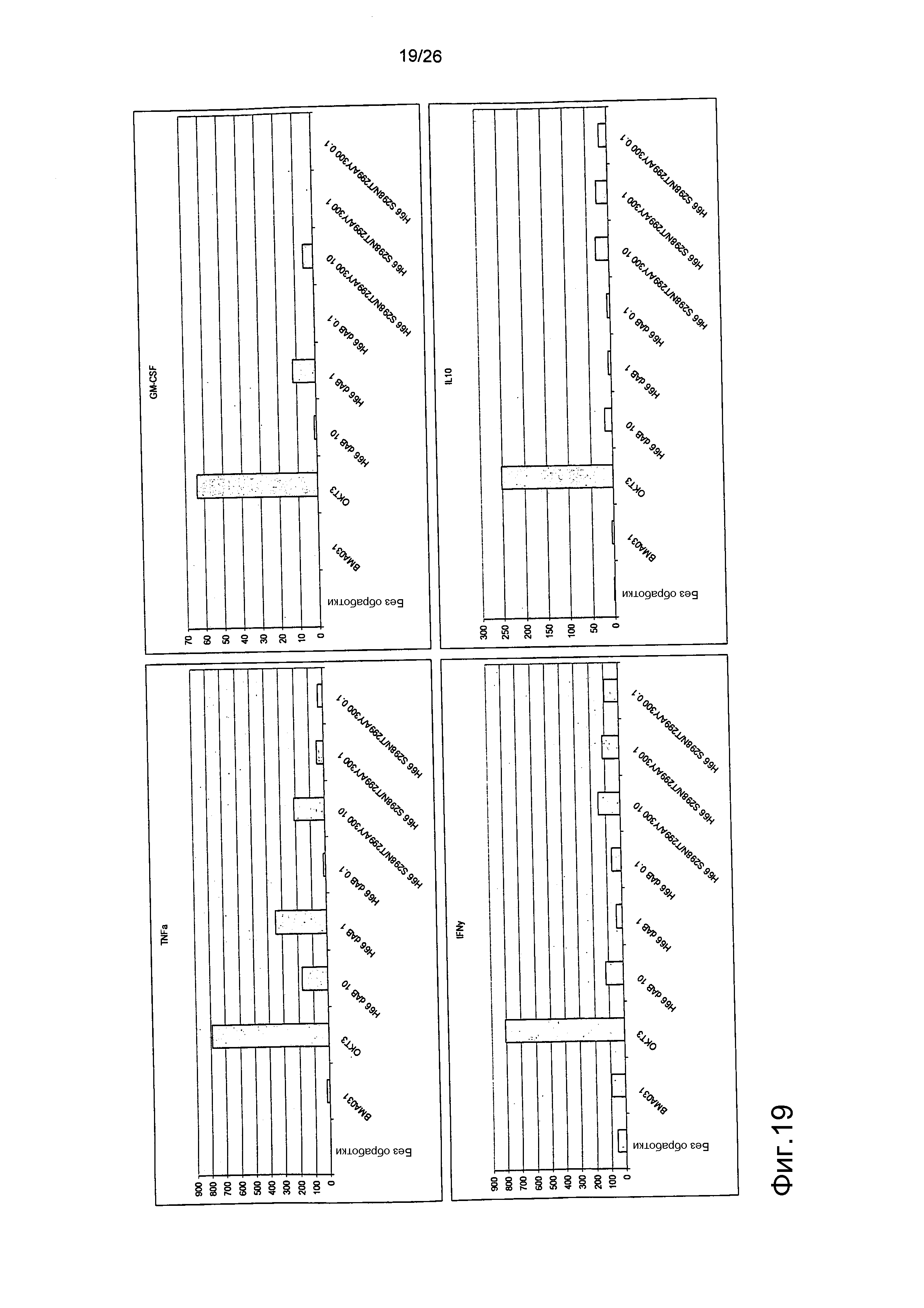
Фиг.19. Выброс цитокинов из PBMC в присутствии являющихся мутантами по гликозилированию антител против αβTCR (день 2).
Профиль выброса цитокинов TNFα, GM-CSF, IFNγ и IL10 для антител против αβTCR был схож с профилем, продемонстрированным BMA031 и H66 дельта AB.
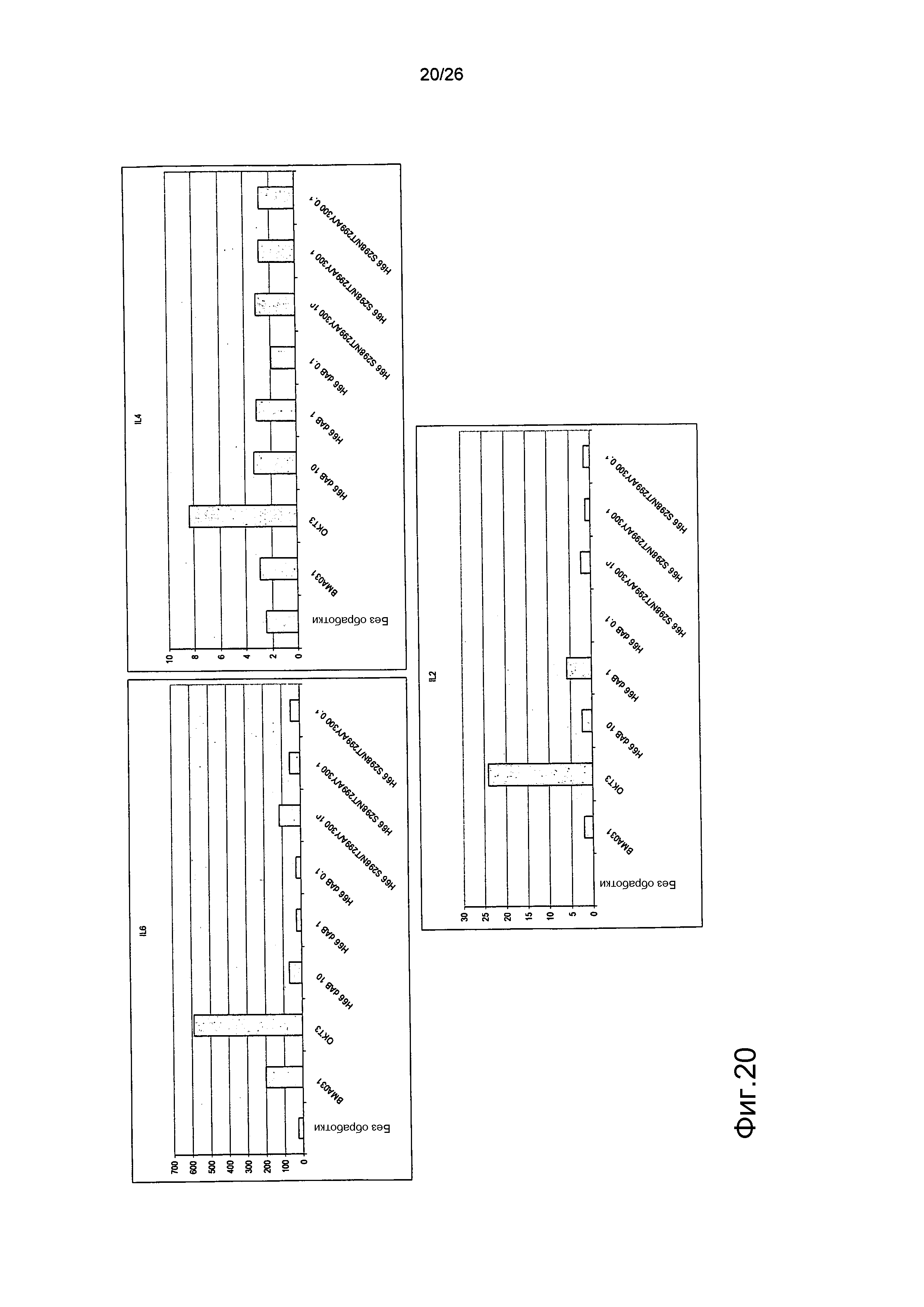
Фиг.20. Выброс цитокинов из PBMC в присутствии являющихся мутантами по гликозилированию антител против αβTCR (день 2).
Профиль выброса цитокинов IL6, IL4 и IL2 для антител против αβTCR был схож с профилем, продемонстрированным BMA031 и H66 дельта AB.
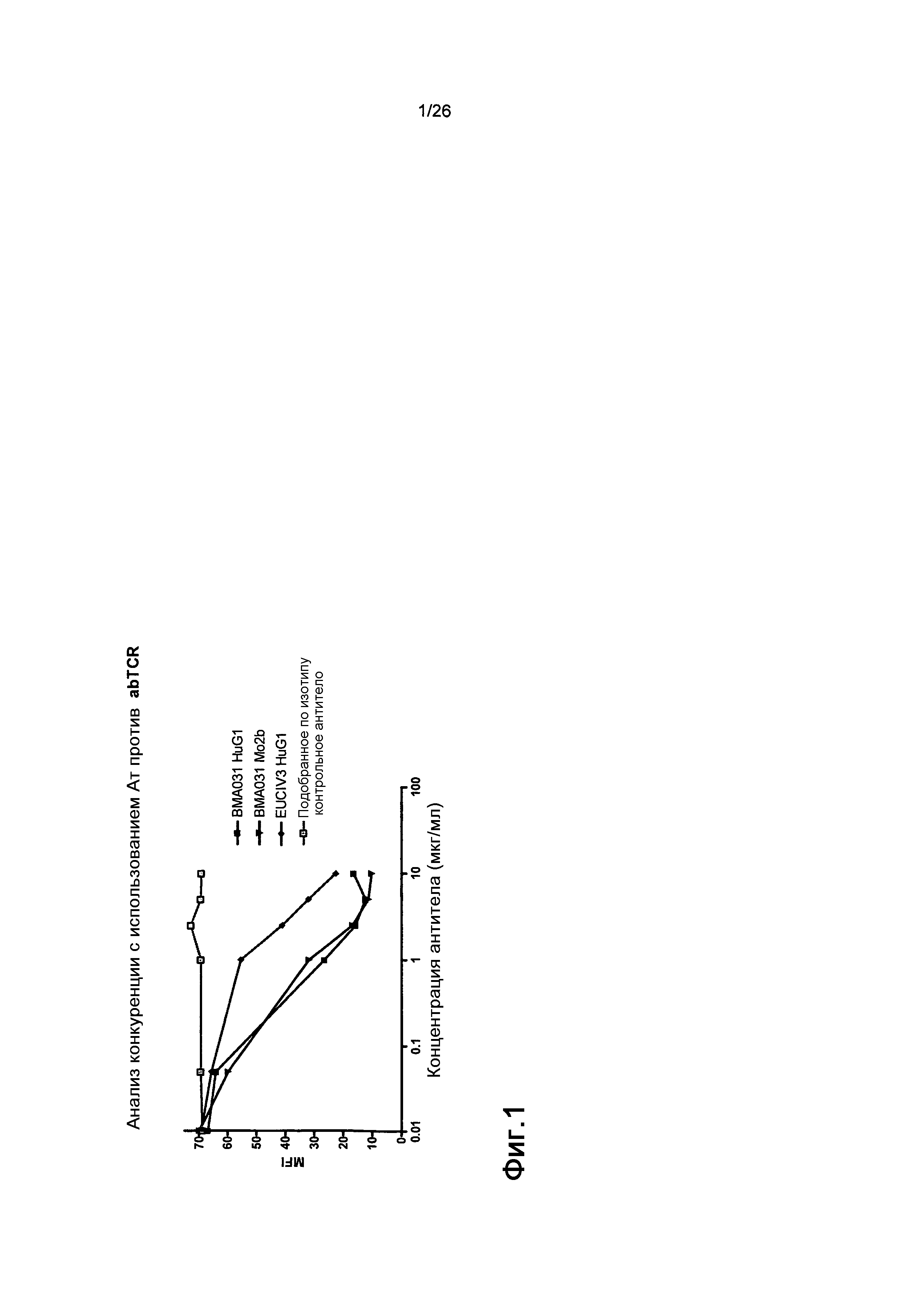
Фиг.21. Выброс цитокинов из PBMC в присутствии являющихся мутантами по гликозилированию антител против αβTCR (день 4).
Профиль выброса цитокинов TNFα, GM-CSF, IFNγ и IL10 для антител против αβTCR был схож с профилем, продемонстрированным BMA031 и H66 дельта AB.
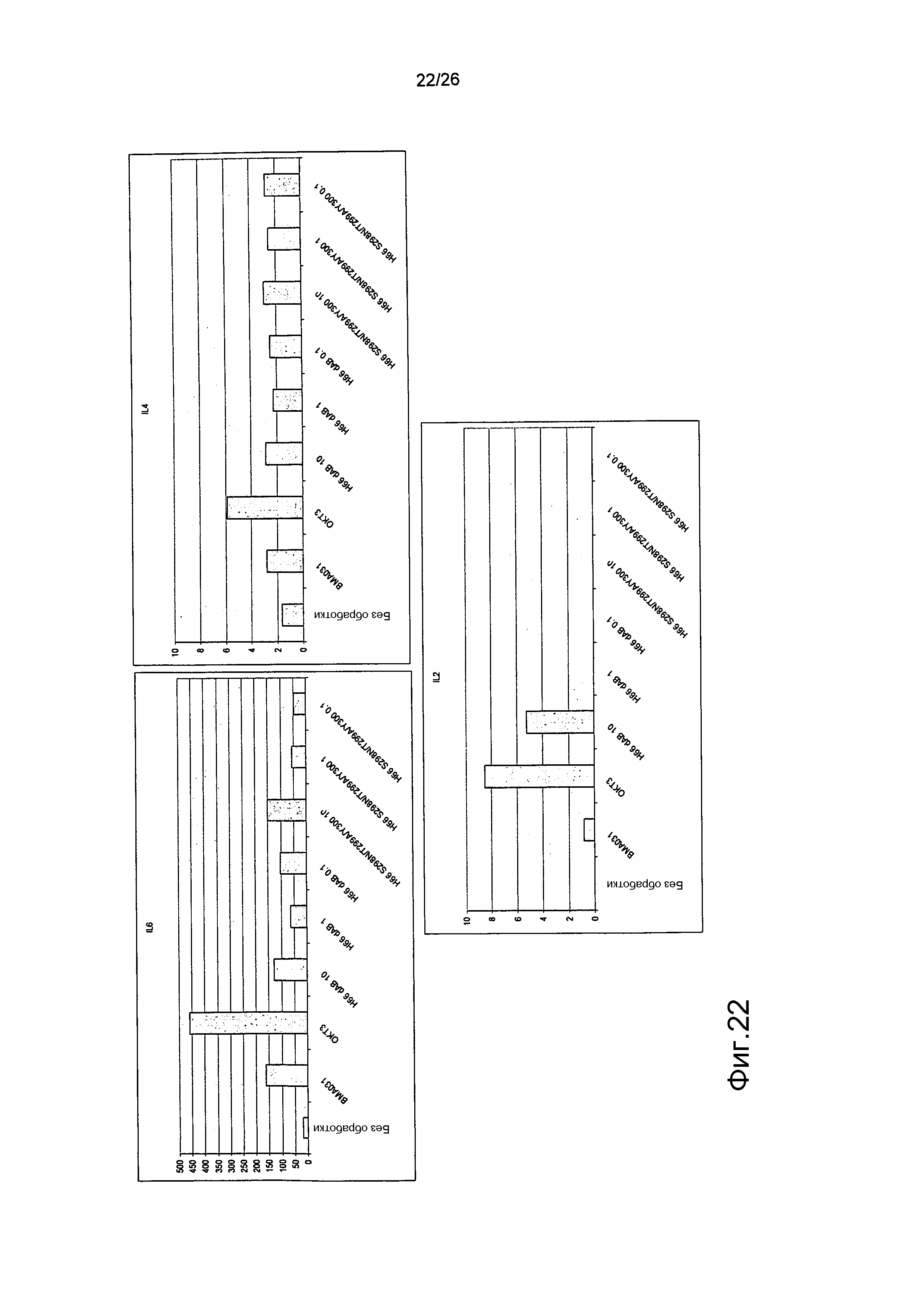
Фиг.22. Выброс цитокинов из PBMC в присутствии являющихся мутантами по гликозилированию антител против αβTCR (день 4).
Профиль выброса цитокинов IL6, IL4 и IL2 для антител против αβTCR был схож с профилем, продемонстрированным BMA031 и H66 дельта AB.
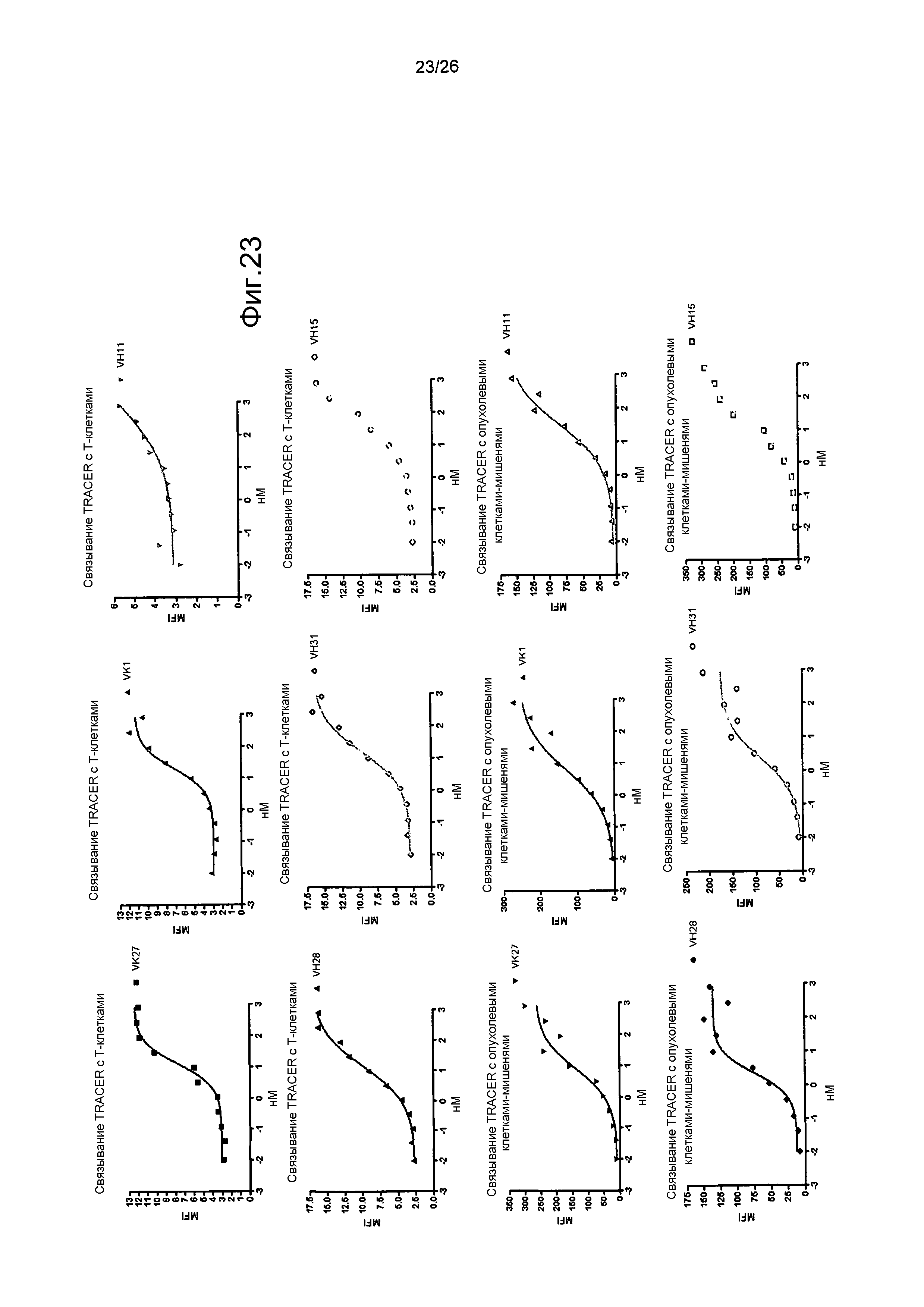
Фиг.23: Профили связывания TRACER.
Профили связывания биспецифических антител и с опухолевыми клетками-мишенями, и с T-клетками человека, определенные с помощью проточной цитометрии.
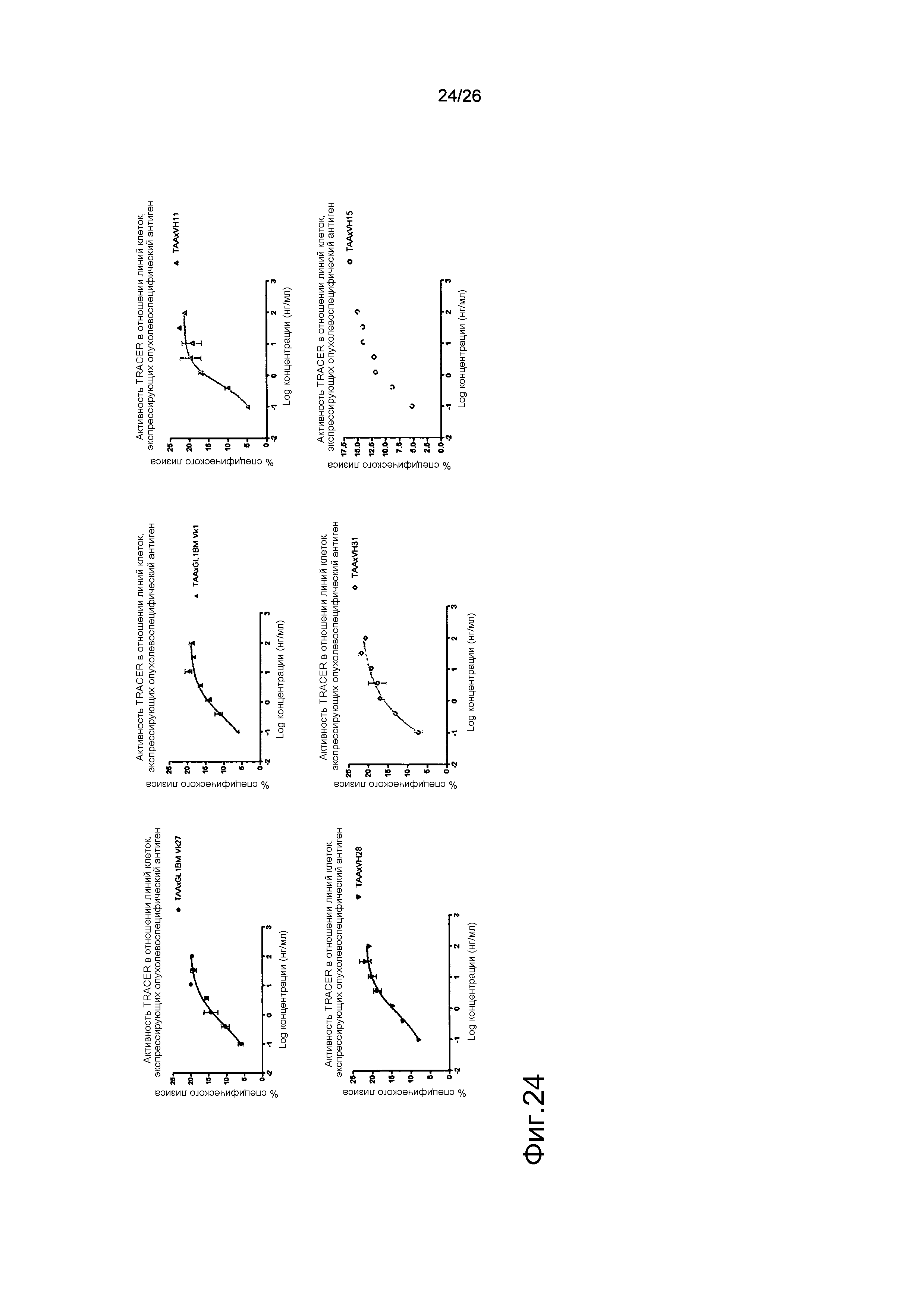
Фиг.24: Цитотоксическая активность различных плечей для рекрутинга T-клеток.
Была создана панель гуманизированных антител BMA031, и из этой панели был отобран ряд антител, которые демонстрируют цитотоксическую активность в отношении линий клеток, экспрессирующих опухолевоспецифический антиген.
Фиг.25: Профиль выброса цитокинов в случае различных плечей для рекрутинга T-клеток.
Панель TRACER с различными плечами для рекрутинга T-клеток демонстрирует схожие профили выброса цитокинов. Большое количество цитокинов выявляется после активации T-клеток в присутствии клеток-мишеней, тогда как в присутствии только не подвергнутых стимуляции PBMC человека отмечаемые уровни цитокинов значительно ниже.
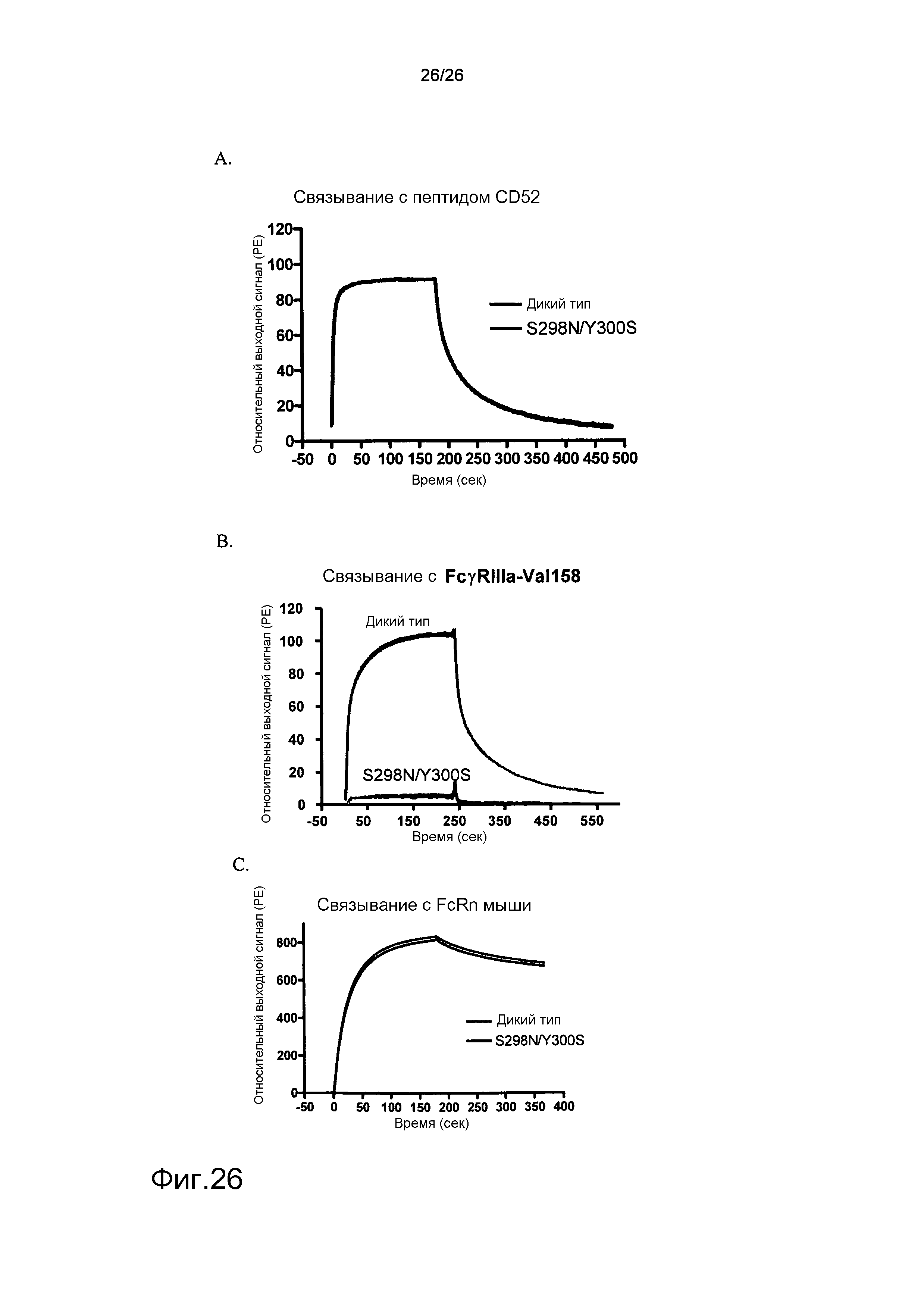
Фиг.26: Связывание мутантных антител против CD52 с FcγRIII человека, используя Biacore.
Biacore использовали для оценки связывания модифицированных антител против CD52 с рекомбинантным FcγRIII (V158) человека. Антитела против CD52, включающие мутации S298N/Y300S в Fc-домене, использовали для оценки эффекторной функции модифицированной молекулы. A: связывание с пептидом CD52. B: связывание с FcγRIII (V158). C: контрольное связывание с FcRn мыши.
Подробное описание настоящего изобретения
Кроме случаев, оговоренных особо, все технические и научные термины, использованные в данном описании, имеют такие же значения, которые обычно понятны специалисту в области, к которой относится данное изобретение. Любые способы и материалы, которые сходны с описанными в данном описании способами и материалами или эквивалентны им, могут использоваться в способах или методах настоящего изобретения. Все публикации, на которые ссылаются в данном описании, включены посредством ссылки во всей их полноте с целью описания и раскрытия методологий, реагентов и средств, сообщенных в публикациях, которые могли бы использоваться в связи с настоящим изобретением.
Способы и методологии настоящего изобретения, как правило, проводят в соответствии с общепринятыми способами, хорошо известными в данной области и описанными в различных общих и более конкретных ссылках, которые приводятся и обсуждаются на всем протяжении настоящего описания, кроме особо оговоренных случаев. См., например, Gennaro, A.R., ed. (1990) Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co.; Hardman, J.G., Limbird, L.E., and Gilman, A.G., eds. (2001) The Pharmacological Basis of Therapeutics, 10th ed., McGraw-Hill Co.; Colowick, S. et al., eds., Methods In Enzymology, Academic Press, Inc.; Weir, D.M. and Blackwell, C.C., eds. (1986) Handbook of Experimental Immunology, Vols. l-IV, Blackwell Scientific Publications; Maniatis, T. et al., eds. (1989) Molecular Cloning: A Laboratory Manual, 2nd edition, Vols. I-III, Cold Spring Harbor Laboratory Press; Ausubel, F.M. et al., eds. (1999) Short Protocols in Molecular Biology, 4th edition, John Wiley & Sons; Ream et al., eds. (1998) Molecular Biology Techniques: An Intensive Laboratory Course, Academic Press; Newton, C.R. and Graham, A., eds. (1997) PCR (Introduction to Biotechniques Series), 2nd ed., Springer-Verlag.
Гуманизированное моноклональное антитело, на которое ссылаются в данном описании, является антителом, которое состоит из каркасной области антитела человека, в которую были пересажены определяющие комплементарность участки (CDR) из нечеловеческого антитела. Могут быть также внесены изменения в человеческую акцепторную каркасную область. Методики конструирования и продукции гуманизированных антител хорошо известны в данной области и описаны, например, Cabilly et al., в патенте США 4816567; Cabilly et al., в Европейской патентной заявке № 0125023; Boss et al., в патенте США 4816397; Boss et al., в Европейской патентной заявке № 0120694; Neuberger, M.S. et al., в WO 86/01533; Neuberger, M.S. et al., в Европейской патентной заявке № 0194276 B1; Winter, в патенте США 5225539; Winter, в Европейской патентной заявке № 0239400; Padlan, E.A. et al., в Европейской патентной заявке № 0519596. Дополнительные подробности в отношении антител, гуманизированных антител, сконструированных антител человека и способов их получения можно найти в Kontermann, R. and Diibel, S. eds. (2001, 2010) Antibody Engineering, 2nd ed., Springer-Verlag, New York, NY.
Термин «антитело», кроме особо оговоренных случаев, используется для ссылки на целые антитела, а также на антигенсвязывающие фрагменты таких антител. Например, этот термин охватывает четырехцепочечные IgG молекулы, а также фрагменты антитела.
Как используется в рамках настоящего описания, термин «фрагменты антитела» относится к частям интактного полноразмерного антитела, например, которые, кроме того, описаны ниже.
Антитела могут быть любого класса, например, IgG, IgA или IgM; и любого подкласса, например, IgG1 или IgG4. Различные классы и подклассы иммуноглобулина обладают различными свойствами, которые могут быть выгодны при различных применениях. Например, антитела подкласса IgG4 характеризуются уменьшенным связыванием с Fc-рецепторами.
Специфичность, применительно к описываемым в настоящем описании антителам, означает, что заявленное антитело способно к селективному связыванию с распознаваемым им определенным антигеном, которым является комплекс αβTCR.CD3. Антитела настоящего изобретения связываются с комплексом αβTCR.CD3, представленным на поверхности клеток.
Комплекс αβTCR/CD3 человека является T-клеточным рецепторным комплексом, представленным на поверхности T-клеток. См. Kuhns ef al., (2006) Immunity 24: 133-139. На этот комплекс направлено моноклональное антитело мыши BMA031 (см. Европейскую патентную заявку № EP 0403156; SEQ ID NO:1 и 2).
Природные иммуноглобулины имеют общую основную структуру, в которой две идентичные легкие цепи (приблизительно 24 кДа) и две идентичные тяжелые цепи (приблизительно 55 или 70 кДа) образуют тетрамер. Амино-концевая часть каждой цепи известна как вариабельная (V) область, и ее можно отличить от более консервативных константных (C) областей остальной части каждой цепи. В вариабельной области легкой цепи (также называемой VL-доменом) находится C-концевая часть, известная как J-фрагмент. В вариабельной области тяжелой цепи (также называемой VH-доменом) находится D-фрагмент помимо J-фрагмента. Большая часть вариаций в аминокислотных последовательностях иммуноглобулинов локализуется в трех различных местах в V-областях, известных как гипервариабельные участки или определяющие комплементарность участки (CDR), которые непосредственно участвуют в связывании антигена. Начиная с амино-конца, эти участки обозначают как CDR1, CDR2 и CDR3, соответственно. Положения CDR фиксируются с помощью более консервативных каркасных областей (FR). Начиная с амино-конца, эти области обозначают как FR1, FR2, FR3 и FR4, соответственно. Местонахождения CDR и FR-областей и система нумерации были определены Kabat et al. (Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, U.S. Government Printing Office (1991), и его обновления, которые можно найти онлайн). Кроме того, границы CDR-участков были также определены в соответствии с номенклатурой IMGT.
Вариабельные области антител согласно описанным вариантам осуществления можно найти в SEQ ID NO:5-7 и 12-16, и их можно получить посредством гуманизации BMA031, т.е. посредством переноса CDR BMA031 в каркасную область человека. Описаны два ряда гуманизированных антител: ряд HEBE1, включающий SEQ ID NO:5-7, 12 и 13, и ряд GL1BM, включающий вариабельные области тяжелых цепей, представленные в SEQ ID NO:8, 15 и 16. В обоих случаях используемой вариабельной областью легкой цепи является та, которая представлена в SEQ ID NO:14 (GL1BM VK43).
Используемыми каркасными областями человека являются IGH3-23, в случае HEBE1 и IGHV1-3*01, и IGKV3-11*01, в случае GL1BM.
Константные области могут быть получены из константных областей любых антител человека. Гены вариабельных областей можно клонировать в экспрессионные векторы в рамке считывания с генами константных областей для экспрессии тяжелых и легких цепей иммуноглобулинов. Такие экспрессионные векторы можно трансфицировать в продуцирующие антитела клетки-хозяев для синтеза антител.
Вариабельные и константные области антител человека можно получить из баз данных, касающихся последовательностей. Например, последовательности иммуноглобулинов имеются в базе данных IMGT/LIGM (Giudicelli et al., (2006) Nucleic Acids Res. 34:(suppl. 1):D781-D784) или VBase (vbase.mrc-cpe.cam.ac.uk).
Негликозилированные антитела могут обладать в значительной степени модифицированной функцией; см. Boyd et al. (1996) Mol. Immunol. 32: 1311-1318. Модификация «дельта ab» или Δab, приведенная в данном описании, является модификацией Fc, которая описана в Armour et al., (1999) Eur. J. Immunol. 29: 2613-2624. Способы изменения гликозилирования Fc-областей антител известны в данной области и включают химические, ферментативные и мутационные способы, например, мутацию положения N297 в CH2-домене. Способы мутирования генов антител для получения негликозилированных IgG молекул описаны в Tao and Morrison (1989) J. Immunol. 143: 2595-2601.
«Нуклеиновые кислоты», приведенные в данном описании, включают молекулы ДНК, которые кодируют антитела настоящего изобретения. Предпочтительными являются экспрессионные векторы, которые подходят для экспрессии генов антител в клетке-хозяине. Экспрессионные векторы и клетки-хозяева для экспрессии генов антител известны в данной области; см., например, Morrow, K.J. Genetic Engineering & Biotechnology News (June 15, 2008) 28(12), и Backliwal, G. et al. (2008) Nucleic Acids Res. 36(15):e96-e96.
1. Антитела
Настоящее изобретение охватывает антигенсвязывающие фрагменты гуманизированных антител против αβTCR. Фрагменты антител способны к связыванию с комплексом αβTCR.CD3. Они охватывают Fab-, Fab'-, F(ab')2 и F(v)-фрагменты или отдельные вариабельные области легких или тяжелых цепей или их части. Фрагменты включают, например, Fab, Fab', F(ab')2, Fv и scFv. В их фрагментах отсутствует Fc-часть интактного антитела, они подвержены более быстрому клиренсу из кровотока и могут характеризоваться менее неспецифическим связыванием с тканями, чем интактное антитело. Эти фрагменты можно получить из интактных антител, используя хорошо известные способы, например, протеолитическое расщепление такими ферментами, как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов).
Антитела и фрагменты также охватывают одноцепочечные Fv-фрагменты (scFv), которые связываются с комплексом αβTCR.CD3. scFv включает вариабельную область тяжелой цепи антитела (VH), функционально связанную с вариабельной областью легкой цепи антитела (VL), причем вариабельная область тяжелой цепи и вариабельная область легкой цепи, вместе или по отдельности, образуют сайт связывания, который связывается с αβTCR. scFv может включать VH-область на амино-конце и VL-область на карбоксильном конце. Альтернативно, scFv может включать VL-область на амино-конце и VH-область на карбоксильном конце. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются различными генами, их можно соединить, используя методы рекомбинантных молекул, с помощью синтетического линкера, который делает возможным их создание в виде одной белковой цепи, в которой VL- и VH-области спариваются с образованием одновалентных молекул (известных как одноцепочечный Fv-фрагмент (scFv)). scFv может, кроме того, необязательно включать линкер-полипептид между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи.
Антитела и фрагменты также охватывают фрагменты-домены антител (dAb), описанные в Ward, E.S. et al. (1989) Nature 341: 544-546, которые состоят из VH-домена.
Антитела и фрагменты также охватывают антитела-тяжелые цепи (HCAb). Согласно сообщениям, эти антитела образуют антигенсвязывающие области, используя только вариабельную область тяжелой цепи, поскольку эти функциональные антитела являются димерами только тяжелых цепей (называемыми «антителами-тяжелыми цепями» или «HCAb»). Соответственно, антитела и фрагменты могут быть антителами-тяжелыми цепями (HCAb), которые специфически связываются с комплексом αβTCR.CD3.
Антитела и фрагменты также охватывают антитела, которые представляют собой SMIP или гибридные белки связывающий домен-домены иммуглобулинов, специфические в отношении комплекса αβTCR.CD3. Эти конструкции представляют собой одноцепочечные полипептиды, включающие антигенсвязывающие домены, слитые с доменами иммуноглобулинов, необходимыми для выполнения эффекторных функций антител (см. WO 2005/017148).
Антитела и фрагменты также охватывают диатела. Они представляют собой двухвалентные антитела, в которых VH и VL-домены представлены на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы сделать возможным спаривание между двумя доменами в одной и той же цепи. Это вынуждает домены спариваться с комплементарными доменами другой цепи и создает в силу этого два антигенсвязывающих сайта (см., например, WO 93/11161). Диатела могут быть биспецифическими или моноспецифическими.
Антитело или его фрагмент не вступает в перекрестную реакцию с какой-либо мишенью, отличной от комплекса αβTCR.CD3.
Антитело или его фрагмент можно модифицировать для увеличения периода его полужизни в кровотоке, например, посредством добавления молекул - таких как ПЭГ или другие водорастворимые полимеры, в том числе полимеры-полисахариды, для увеличения периода полужизни.
Антитела и их фрагменты могут быть биспецифическими. Например, биспецифические антитела могут иметь сходство с традиционными антителами (или фрагментами антител), но имеют два различных антигенсвязывающих сайта (вариабельные области). Биспецифические антитела можно получить с помощью различных методов, таких как химические методы, «полидомная» технология или методы рекомбинантных ДНК. Биспецифические антитела могут обладать специфичностями связывания по меньшей мере с двумя различными эпитопами, по меньшей мере один из которых представляет собой комплекс αβTCR.CD3. Другая специфичность может быть выбрана из любых полезных или желаемых специфичностей, включающих, например, специфичность в отношении сывороточного альбумина человека для увеличения периода полужизни in vivo.
Применение биспецифических антител в клинике для применения при онкологических заболеваниях теперь становится реальностью с применением трифункционального Catumaxomab (Removmab®), разрешенного для применения в случаях злокачественных асцитов, и биспецифического антитела Blinatumomab, в настоящее время находящегося на испытаниях фазы II для гематологических злокачественных заболеваний. Эти молекулы имеют общее связывающее плечо, которое связывается с T-клетками, и второе плечо, которое связывается с являющейся мишенью опухолевой клеткой, что приводит к T-клеточноопосредованному лизису опухоли-мишени. Также в качестве общего свойства, эти молекулы осуществляют рекрутинг T-клеток через белок CD3, находящийся на клеточной поверхности. Альтернативой рекрутингу через CD3 является использование αβ T-клеточного рецептора (αβTCR), который также представлен на поверхности клетки. Соответственно, антитела по настоящему изобретению могут использоваться для разработки противоопухолевых антител посредством объединения специфичности в отношении опухолевоспецифического антитела со специфичностью в отношении αβ T-клеточного рецептора (αβTCR).
2. Продукция антител
Аминокислотные последовательности вариабельных доменов антител, описанных в данном описании, определены в SEQ ID NO:5-7 и 12-16. Продукцию антител можно выполнить с помощью любого метода, известного в данной области, в том числе в трансгенных организмах, таких как козы (см. Pollock et al. (1999) J. Immunol. Methods 231: 147-157), куры (см. Morrow, K.J.J. (2000) Genet. Eng. News 20: 1-55), мыши (см. Pollock et al., выше) или растения (см. Doran, P.M. (2000) Curr Opinion Biotechnol. 11: 199-204, Ma. J.K-C. (1998) Nat. Med. 4: 601-606, Baez, J. et al. (2000) BioPharm. 13: 50-54, Stoger, E. et al. (2000) Plant Mol. Biol. 42: 583-590). Антитела можно получить с помощью химического синтеза или посредством экспрессии генов, кодирующих антитела, в клетках-хозяевах.
Полинуклеотид, кодирующий антитело, выделяют и встраивают в реплицируемую конструкцию или вектор, такую как плазмида, для дальнейшего воспроизведения или экспрессии в клетке-хозяине. В данной области имеются конструкции или векторы (например, экспрессионные векторы), подходящие для экспрессии гуманизированного иммуноглобулина согласно описанным вариантам осуществления. Имеется ряд векторов, включающий векторы, которые сохраняются в одной копии или множестве копий в клетке-хозяине, или которые интегрируются в хромосому(ы) клетки-хозяина. Конструкции или векторы можно ввести в подходящую клетку-хозяина, и клетки, которые экспрессируют гуманизированный иммуноглобулин, можно создать и поддерживать в культуре. Один вектор или множество векторов могут использоваться для экспрессии гуманизированного иммуноглобулина.
Полинуклеотиды, кодирующие антитело, легко выделить и секвенировать, используя общепринятые процедуры (например, олигонуклеотидные зонды). Векторы, которые могут использоваться, включают плазмиду, вирус, фаг, транспозоны, минихромосомы, из которых плазмиды являются типичным вариантом осуществления. Как правило, такие векторы, кроме того, включают сигнальную последовательность, начало репликации, один или более генов-маркеров, энхансерный элемент, промотор и последовательности терминации транскрипции, которые функционально связаны с полинуклеотидом легкой и/или тяжелой цепи для способствования экспрессии. Полинуклеотиды, кодирующие легкую и тяжелую цепи, могут быть встроены в отдельные векторы и введены (например, посредством трансформации, трансфекции, электропорации или трансдукции) в одну и ту же клетку-хозяина одновременно или последовательно, или, если желательно, как тяжелая цепь, так и легкая цепь могут быть встроены в один и тот же вектор до такого введения.
Для экспрессии в подходящей клетке-хозяине может предусматриваться промотор. Промоторы могут быть конститутивными или индуцируемыми. Например, промотор может быть функционально связан с нуклеиновой кислотой, кодирующей гуманизированный иммуноглобулин или цепь иммуноглобулина, так что он управляет экспрессией кодируемого полипептида. Имеется ряд промоторов, подходящих для прокариотических и эукариотических клеток-хозяев. Промоторы для прокариотических клеток-хозяев включают промоторы lac, tac, T3, T7 для E. coli; промоторы генов 3-фосфоглицераткиназы или других гликолитических ферментов, например, энолазы, глицеральдегид-3-фосфат-дегидрогеназы, гексокиназы, пируватдекарбоксилазы, фосфофруктокиназы, глюкозо-6-фосфатизомеразы, 3-фосфоглицератмутазы и глюкокиназы. Промоторы для эукариотических клеток-хозяев включают индуцируемые дрожжевые промоторы, такие как промоторы генов алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, металлотионеина и ферментов, ответственных за метаболизм азота или утилизацию мальтозы/галактозы; промоторы для РНК-полимеразы II, в том числе промоторы вирусов, таких как полиомавирус, вирус оспы кур и аденовирусы (например, аденовирус 2), бычий папилломавирус, вирус саркомы птиц, цитомегаловирус (в частности, промотор немедленно-раннего гена), ретровирус, вирус гепатита B, промотор гена актина, промотор вируса саркомы Рауса (RSV) и промоторы ранних или поздних генов вакуолизирующего обезьяньего вируса 40, и невирусные промоторы, такие как EF-1 альфа (Mizushima and Nagata (1990) Nucleic Acids Res. 18(17): 5322). Специалисты в данной области смогут выбрать промотор, подходящий для экспрессии гуманизированного антитела или его части.
В соответствующих случаях, например, для экспрессии в клетках высших эукариот могут быть включены дополнительные энхансерные элементы вместо или помимо тех, которые можно обнаружить находящимися в описанных выше промоторах. Подходящие энхансерные последовательности млекопитающих включают энхансерные элементы из генов глобина, эластазы, альбумина, фетопротеина, металлотионина и инсулина. Альтернативно, можно использовать энхансерный элемент из вируса эукариотических клеток, такой как энхансер из SV40, энхансер промотора раннего гена цитомегаловируса, энхансер из полиомавируса, бакуловирусный энхансер или локус мышиного IgG2a (см. WO 04/009823). Хотя такие энхансеры часто находятся в векторе 5’ от промотора, их можно также разместить где-либо в другом месте, например, внутри нетранслируемого района или 3’ от сигнала полиаденилирования. Выбор и размещение энхансера может основываться на совместимости с клеткой-хозяином, используемой для экспрессии.
Кроме того, векторы (например, экспрессионные векторы) могут включать селектируемый маркер для отбора клеток-хозяев, содержащих вектор, и, в случае реплицируемого вектора, начало репликации. Гены, кодирующие продукты, которые придают устойчивость к антибиотикам или лекарственным средствам, являются распространенными селектируемыми маркерами и могут использоваться в прокариотических клетках (например, ген f3-лактамазы (устойчивость к ампициллину), ген Tet (устойчивость к тетрациклину)) и в эукариотических клетках (например, гены устойчивости к неомицину (G418 или генетицину), gpt (микофеноловой кислоте), ампициллину или гигромицину). Гены-маркеры дигидрофолатредуктазы позволяют осуществлять отбор с использованием метотрексата в ряде клеток-хозяев. В качестве селектируемых маркеров в дрожжах часто используются гены, кодирующие продукт генов-маркеров ауксотрофии хозяина (например, LEU2, URA3, HIS3). Также предусматривается использование вирусных (например, бакуловирусных) и фаговых векторов, и векторов, которые способны интегрироваться в геном клетки-хозяина, таких как ретровирусные векторы.
В эукариотических системах сигналы полиаденилирования и терминации функционально связаны с полинуклеотидом, кодирующим антитело настоящего изобретения. Такие сигналы обычно расположены 3' от открытой рамки считывания. В системах млекопитающих неограничивающие примеры сигналов полиаденилирования/терминации включают такие, которые получены из генов гормонов роста, фактора-1 альфа элонгации и вирусных (например, SV40) генов или ретровирусных длинных концевых повторов. В дрожжевых системах неограничивающие примеры сигналов полиаденилирования/терминации включают такие, которые получены из генов фосфоглицераткиназы (PGK) и алкогольдегидрогеназы 1 (ADH). В прокариотических системах сигналы полиаденилирования обычно не требуются, и вместо них обычно используют более короткие и более точно определенные последовательности терминации. Выбор последовательностей полиаденилирования/терминации может основываться на совместимости с клеткой-хозяином, используемой для экспрессии. Помимо вышеизложенных, другие детали, которые могут использоваться для увеличения выходов, включают элементы для реконструкции хроматина, интроны и специфическое для клетки-хозяина изменение кодонов. Использование кодонов в генах антител настоящего изобретения можно изменить для подгонки к преобладанию кодонов в клетке-хозяине, чтобы увеличить выход транскрипта и/или продукта (например, Hoekema, A. et al. (1987) Mol. Cell Biol. 7(8): 2914-24). Выбор кодонов может основываться на совместимости с клеткой-хозяином, используемой для экспрессии.
Таким образом, настоящее изобретение относится к выделенным молекулам нуклеиновых кислот, которые кодируют гуманизированные иммуноглобулины или их тяжелые или легкие цепи. Настоящее изобретение также относится к выделенным молекулам нуклеиновых кислот, которые кодируют антигенсвязующую часть иммуноглобулинов и их цепей.
Антитела можно продуцировать, например, посредством экспрессии одной или более рекомбинантных нуклеиновых кислот, кодирующих антитело, в подходящей клетке-хозяине. Клетку-хозяина можно создать, используя любой подходящий способ. Например, конструкции для экспрессии (например, один или более векторов, например, вектор для экспрессии в клетке млекопитающего), описанные в данном описании, можно ввести в подходящую клетку-хозяина, и полученную в результате клетку можно поддерживать (например, в культуре, в животном, в растении) в условиях, подходящих для экспрессии конструкции(й) или вектора(ов). Клетками-хозяевами могут быть прокариотические клетки, в том числе бактериальные клетки, такие как E. coli (например, штамм DH5aTM) (Invitrogen, Carlsbad, CA), PerC6 (Crucell, Leiden, NL), B. subtilis и/или другие подходящие бактерии; эукариотические клетки, такие как клетки грибов или дрожжей (например, Pichia pastoris, Aspergillus sp., Saccharomyces cerevisiae, Schizosaccharomyces pombe, Neurospora crassa) или клетки других низших эукариот, и клетки высших эукариот, такие как клетки насекомых (например, клетки Drosophila Schnieder S2, клетки насекомых Sf9) (WO 94/126087 (O'Connor)), клетки насекомых BTI-TN-5B1-4 (High FiveTM) (Invitrogen), клетки млекопитающих (например, клетки COS, такие как COS-1 (№ доступа в ATCC CRL-1650) и COS-7 (№ доступа в ATCC CRL-1651), CHO (например, № доступа в ATCC CRL-9096), CHO DG44 (Urlaub, G. and Chasin, L.A. (1980) Proc. Natl. Acad. Sci. USA, 77(7): 4216-4220), 293 (№ доступа в ATCC CRL-1573), HeLa (№ доступа в ATCC-CCL-2), CVI (№ доступа в ATCC-CCL-70), WOP (Dailey, L., et al. (1985) J. Virol., 54: 739-749), 3T3, 293T (Pear, W.S., et al. (1993) Proc. Natl. Acad. Sci. U.S.A., 90: 8392-8396), клетки NSO, клетки SP2/0, клетки HuT 78 и т.п., или клетки растений (например, табака, Lemna (ряски) и водорослей). См., например, Ausubel, F.M. et al., eds. Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons Inc. (1993). В некоторых вариантах осуществления клетка-хозяин не является частью многоклеточного организма (например, растения или животного), например, она является изолированной клеткой-хозяином или частью культуры клеток.
Клетки-хозяева можно культивировать во вращающихся колбах, встряхиваемых колбах, роллерных флаконах, волновых реакторах (например, системе 1000 из wavebiotech.com) или системах на основе полых волокон, но для высокомасштабной продукции предпочтительно, когда используются реакционные аппараты с мешалкой или реакторы с резервуаром (например, Wave Biotech, Somerset, New Jersey США), в частности, для суспензионных культур. Реакционные аппараты с мешалкой можно приспособить для аэрирования, используя, например, барботеры, барьеры или импеллеры с малыми сдвиговыми усилиями. В случае барботажных колонок и аэролифтных реакторов можно использовать непосредственное насыщение пузырьками воздуха или кислорода. Если клетки-хозяева культивируют в бессывороточной среде для культивирования, среду можно дополнить защищающим клетки средством, таким как плюроник F-68, для помощи предотвращения повреждения клеток из-за процесса аэрирования. В зависимости от характеристик клеток-хозяев микроносители могут использоваться в качестве субстратов для роста линий заякоренных клеток, или клетки можно адаптировать к суспензионной культуре. Для культивирования клеток-хозяев, в частности клеток позвоночных-хозяев, можно использовать ряд операционных моделей, таких как периодический, подпитываемый, повторяющийся периодический процесс (см. Drapeau et al. (1994) Cytotechnology 15: 103-109), удлиненный периодический процесс или перфузионная культура. Хотя рекомбинантно трансформированные клетки млекопитающих-хозяев можно культивировать в содержащих сыворотку средах, таких как среды, включающие фетальную телячью сыворотку (FCS), предпочтительно, когда такие клетки-хозяев культивируют в бессывороточных средах, описанных в Keen et al. (1995) Cytotechnology 17: 153-163, или имеющихся в продаже средах, таких как ProCHO-CDM или UltraCHOTM (Cambrex NJ, США), дополненных, в случае необходимости, источником энергии, таким как глюкоза, и синтетическими факторами роста, такими как рекомбинантный инсулин. Для культивирования клеток-хозяев в бессывороточных средах может потребоваться их адаптация к росту в бессывороточных условиях. Одним способом адаптации является культивирование таких клеток-хозяев в содержащих сыворотку средах и многократная замена 80% среды для культивирования бессывороточными средами, так что клетки-хозяева учатся адаптироваться в бессывороточных условиях (см., например, Scharfenberg, K. et al. (1995) Animal Cell Technology: Developments Towards the 21st Century (Beuvery, E.C. et al., eds), pp.619-623, Kluwer Academic publishers).
Антитела согласно описанным вариантам осуществления могут секретироваться в среду, и их можно выделить и очистить из нее, используя множество методов, для обеспечения степени очистки, подходящей для намеченного применения. Например, в случае применения терапевтических антител для лечения являющихся людьми пациентов обычно требуется составляющая по меньшей мере 95% степень чистоты, определяемая с помощью электрофореза в SDS-ПААГ в восстанавливающих условиях, более конкретно, составляющая 98% или 99% степень чистоты, при сравнении со средами для культивирования, включающими терапевтические антитела. В первом случае, клеточный дебрис из сред для культивирования можно удалить, используя центрифугирование с последующей стадией очистки супернатанта, используя, например, микрофильтрацию, ультрафильтрацию и/или глубинное фильтрование. Альтернативно, антитело можно получить с помощью микрофильтрации, ультрафильтрации и/или глубинного фильтрования без предварительного центрифугирования. Имеется множество других методов, таких как диализ и гель-электрофорез, и хроматографические методы, такие как хроматография на гидроксиапатите (HA), аффинная хроматография (необязательно включающая систему с использованием аффинных меток, таких как полигистидин) и/или хроматография на основе гидрофобных взаимодействиях (HIC) (см. патент США 5429746). В одном варианте осуществления антитела, после различных стадий очистки, захватывают, используя аффинную хроматографию с использованием белка A или G с последующими дополнительными стадиями хроматографии, такой как ионообменная хроматография и/или хроматография на HA, анионо- или катионообменная хроматография, гель-фильтрация или преципитация сульфатом аммония. Могут также использоваться различные стадии удаления вирусов (например, нанофильтрация с использованием, например, фильтра DV-20). После этих различных стадий обеспечивается очищенный препарат, включающий по меньшей мере 10 мг/мл или больше, например, 100 мг/мл или больше антитела настоящего изобретения, и он, следовательно, образует другой вариант осуществления настоящего изобретения. Концентрацию до 100 мг/мл или больше можно получить с помощью ультрацентрифугирования. Такие препараты по существу не содержат агрегированной формы антител настоящего изобретения.
Для экспрессии фрагментов антител особенно подходящими являются бактериальные системы. Такие фрагменты локализуются внутриклеточно или в периплазме. Нерастворимые периплазматические белки можно выделить и подвергнуть рефолдингу для образования активных белков в соответствии со способами, известными специалистам в данной области, см. Sanchez et al. (1999) J. Biotechnol. 72: 13-20; Cupit, P.M. et al. (1999) Lett. Appl. Microbiol. 29: 273-277.
Настоящее изобретение также относится к клеткам, включающим нуклеиновую кислоту, например, вектор, настоящего изобретения (например, экспрессионный вектор). Например, нуклеиновую кислоту (т.е. одну или более нуклеиновых кислот), кодирующую тяжелую и легкую цепи гуманизированного иммуноглобулина согласно описанным вариантам осуществления, или конструкцию (т.е. одну или более конструкций, например, один или более вектор), включающую такую нуклеиновую кислоту(ы), можно ввести в подходящую клетку-хозяина с помощью метода, соответствующего выбранной клетке-хозяину (например, трансформации, трансфекции, электропорации, инфекции), при этом нуклеиновая кислота(ы) функционально связана или становится функционально связанной с одним или более контролирующими экспрессию элементами (например, в векторе, в конструкции, создаваемой в результате процессов в клетке, интегрируемой в геном клетки-хозяина). Клетки-хозяев можно поддерживать в условиях, подходящих для экспрессии (например, в присутствии индуктора, подходящих сред, дополненных соответствующими солями, факторами роста, антибиотиком, питательными добавками и т.д.), в результате чего продуцируется кодируемый полипептид(ы). Если желательно, кодируемое гуманизированное антитело можно выделить, например, из клеток-хозяев, среды для культивирования или молока. Этот процесс включает экспрессию в клетке-хозяине (например, клетке молочной железы) трансгенного животного или растения (например, табака) (см., например, WO 92/03918).
3. Терапевтические применения
Подавление активности T-клеток желательно в ряде ситуаций, в которых иммуносупрессия оправдана, и/или возникает аутоиммунное состояние. Соответственно, таргетинг комплекса αβTCR.CD3 требуется при лечении заболеваний, в развитие которых вовлечен несоответствующий или нежелательный иммунный ответ, таких как воспаление, аутоиммунитет и другие состояния, в развитие которых участвуют такие механизмы. В одном варианте осуществления таким заболеванием или нарушением является аутоиммунное и/или воспалительное заболевание. Примерами таких аутоиммунных и/или воспалительных заболеваний являются системная красная волчанка (SLE), ревматоидный артрит (RA) и воспалительное заболевание кишечника (IBD) (в том числе неспецифический язвенный колит (UC) и болезнь Крона (CD)), рассеянный склероз (MS), склеродерма и сахарный диабет типа 1 (T1D), и другие заболевания и нарушения, такие как PV (обыкновенная пузырчатка), псориаз, атопический дерматит, глютеновая болезнь, хроническое обструктивное заболевание легких, хронический лимфоматозный тиреоидит, болезнь Грейвса (щитовидной железы), синдром Гужеро-Шегрена, синдром Гийена-Барре, синдром Гудпасчура, болезнь Аддисона, гранулематоз Вегенера, первичный билиарный склероз, склерозирующий холангит, аутоиммунный гепатит, ревматическая полимиалгия, виброболезнь, височный артериит, гигантоклеточный артериит, аутоиммунная гемолитическая анемия, злокачественная анемия, нодозный полиартериит, болезнь Бехчета, первичный билиарный цирроз, увеит, миокардит, ревматическая атака анкилозирующий спондилит, гломерулонефрит, саркоидоз, дерматомиозит, злокачественная миастения, полимиозит, гнездная алопеция и витилиго.
В одном варианте осуществления таким заболеванием или нарушением является SLE, RA или IBD. В одном варианте осуществления таким заболеванием или нарушением является MS.
В другом варианте осуществления антитела согласно описанным вариантам осуществления используют для способствования трансплантации с помощью иммуносупресии у субъекта. Такое использованием облегчает гомологичную болезнь. Для описания существующих лечений гомологичной болезни см., например, Svennilson, Bone Marrow Transplantation (2005) 35: S65-S67, и приведенные там ссылки. Преимущественно, антитела настоящего изобретения могут использоваться в комбинации с другими имеющимися терапиями.
Что касается лечения аутоиммунных заболеваний, комбинированная терапия может включать введение антитела настоящего изобретения вместе с лекарственным средством, которое вместе с антителом составляет количество, эффективное для профилактики или лечения таких аутоиммунных заболеваний. Если таким аутоиммунным заболеванием является сахарный диабет типа 1, комбинированная терапия может включать один или более агентов, которые стимулируют рост бета-клеток поджелудочной железы или улучшают трансплантацию бета-клеток, таких как факторы роста или выживания бета-клеток или иммуномодулирующие антитела. Если указанным аутоиммунным заболеванием является ревматоидный артрит, указанная комбинированная терапия может включать один или более из метотрексата, антитела против TNF-β, гибридного белка рецептор TNF-β-Ig, антитела против IL-15 или IL-21, нестероидного противовоспалительного лекарственного средства (NSAID) или модифицирующего заболевание антиревматического лекарственного средства (DMARD). Например, дополнительным средством может быть биологическое средство, такое как анти-TNF агент (например, Enbrel®, инфликсимаб (Remicade®) и адалимумаб (Humira®) или ритуксимаб (Rituxan®). Если указанным аутоиммунным заболеванием является отторжение трансплантата гемопоэтических клеток, может вводиться фактор(ы) роста гемопоэтических клеток (такой как эритропоэтин, G-CSF, GM-CSF, IL-3, IL-11, тромбопоэтин и т.д.) или противомикробное средство(а) (такое как антибиотик, противовирусное, противогрибковое средство). Если указанным аутоиммунным заболеванием является псориаз, дополнительным средством может быть одно или более из смолы и ее производных, фототерапии, кортикостероидов, циклоспорина A, аналогов витамина D, метотрексата, ингибиторов активируемой митогеном p38 протеинкиназы (MAPK), а также биологических средств, таких как анти-TNF агенты и Rituxan®. Если указанным аутоиммунным заболеванием является воспалительное заболевание кишечника (IBD), такое как, например, болезнь Крона или неспецифический язвенный колит, дополнительным средством может быть одно или более из аминосалицилатов, кортикостероидов, иммуномодуляторов, антибиотиков или биологических средств, таких как Remicade® и Humira®. Комбинированное лечение может проводиться любым образом, который, как считает специалист в данной области, является необходимым или удобным, и применительно к этому описанию не предусматривается ограничение в отношении порядка, количества, повторения или относительного количества соединений, используемых в комбинации. Соответственно, антитела согласно описанным вариантам осуществления могут находиться в составе фармацевтических композиций для применения в терапии.
4. Фармацевтические композиции
В предпочтительном варианте осуществления изобретение относится к фармацевтической композиции, содержащей антитело по настоящему изобретению, или лиганд или лиганды, идентифицируемые методом анализа в предшествующем аспекте настоящего изобретения. Лигандами могут быть иммуноглобулины, пептиды, нуклеиновые кислоты или малые молекулы, которые обсуждаются в данном описании. Их называют, при последующем обсуждении, «соединениями».
Фармацевтической композицией по настоящему изобретению является композиция, содержащая соединение или соединения, способные к модулированию активности T-клетки, в качестве активного ингредиента. Соединение находится в форме любой фармацевтически приемлемой соли или, например, в соответствующих случаях, аналога, форме свободного основания, таутомера, оптического изомера, рацемата или их комбинации. Активные ингредиенты фармацевтической композиции, содержащей активный ингредиент по настоящему изобретению, как предусматривается, проявляют терапевтическую эффективность, например, при лечении гомологичной болезни, при введении в количестве, которое зависит от конкретного случая.
В другом варианте осуществления одно или более соединений настоящего изобретения может использоваться в комбинации с любым принятым в данной области соединением, которое, как известно, подходит для лечения конкретного симптома при лечении любого из приведенных выше состояний. Соответственно, одно или более соединений настоящего изобретения можно комбинировать с одним или более принятыми в данной области соединениями, которые, как известно, подходят для лечения указанных выше симптомов, так что субъекту может вводиться подходящая одна композиция. Схему введения доз можно регулировать для обеспечения оптимального терапевтического ответа.
Например, ежедневно можно вводить несколько разделенных доз, или доза может быть пропорционально уменьшена в случае, если этого требует терапевтическая ситуация.
Активный ингредиент можно вводить удобным путем, например, перорально, внутривенно (если он является водорастворимым), внутримышечно, подкожно, интраназально, внутрикожно или с использованием суппозиториев или путем имплантации (например, используя молекулы с замедленным высвобождением).
В зависимости от пути введения может потребоваться покрытие активного ингредиента материалом для защиты указанных ингредиентов от воздействия ферментов, кислот и других природных условий, которые могут инактивировать указанный ингредиент.
Для введения активного ингредиента способом, отличным от парентерального введения, его будут покрывать материалом или вводить вместе с материалом для предотвращения его инактивации. Например, активный ингредиент можно вводить в адъюванте, вводить вместе с ингибиторами ферментов или в липосомах. Термин «адъювант» используется в его самом широком значении и включает любое иммуностимулирующее соединение, такое как интерферон. Предусматриваемые в данном описании адъюванты включают резорцины, неионные поверхностно-активные вещества, такие как полиоксиэтиленовый эфир олеилового спирта и полиэтиленовый эфир н-гексадециловой кислоты. Ингибиторы ферментов включают трипсин поджелудочной железы.
Липосомы включают эмульсии типа «вода-в-масле-в-воде» CGF, а также традиционные липосомы.
Активный ингредиент можно также вводить парентерально или внутрибрюшинно.
Дисперсии можно также получить в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, подходящие для применения в качестве инъецируемого средства, включают стерильные водные растворы (если они являются водорастворимыми) или дисперсии и стерильные порошки для получения стерильных инъецируемых растворов или дисперсий для немедленного использования. Во всех случаях форма должна быть стерильной и должна быть текучей настолько, чтобы существовала возможность ее легкого введения посредством шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от инфицирования микроорганизмами, такими как бактерии и грибы. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси, и растительные масла. Надлежащую текучесть можно сохранять, например, посредством использования покрытия, такого как лецитин, посредством сохранения требуемого размера частиц в случае дисперсии и посредством использования поверхностно-активных веществ.
Предотвращение действия микроорганизмов можно осуществить с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. В некоторых случаях, предпочтительным может быть включение агентов для придания изотоничности, например, сахаров или хлорида натрия. Длительное всасывание инъецируемых композиций можно осуществить посредством использования в композициях агентов, замедляющих всасывание, например, моностеарата алюминия и желатина.
Стерильные инъецируемые растворы готовят посредством включения активного ингредиента в требуемом количестве в соответствующий растворитель с несколькими из других ингредиентов, перечисленных выше, если необходимо, с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят посредством включения подвергнутого стерилизации активного ингредиента в стерильный носитель, который содержит составляющую основу дисперсионную среду и требуемые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков, для получения стерильных инъецируемых растворов предпочтительными способами получения являются методы вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент, ранее подвергнутый фильтрованию с целью стерилизации раствора.
Различные другие материалы могут присутствовать в качестве покрытий или для иного модифицирования физической формы лекарственной формы. Конечно, любой материал, используемый при получении любой стандартной лекарственной формы, должен быть фармацевтически чистым и по существу нетоксичным в используемых количествах. Кроме того, активный ингредиент может быть включен в препараты и композиции с длительным высвобождением.
Как использовано в данном описании, «фармацевтически приемлемый носитель и/или разбавитель» включает любые и всякие растворители, дисперсионные среды, покровные материалы, антибактериальные и противогрибковые средства, средства для придания изотоничности и замедляющие всасывание агенты. Использование таких сред и агентов для фармацевтических активных веществ хорошо известно в данной области. Кроме случаев, когда какая-либо общепринятая среда или агент несовместима с активным ингредиентом, предусматривается их применение в терапевтических композициях. В композиции могут быть также включены дополнительные активные ингредиенты.
Особенно предпочтительным является получение композиций для парентерального введения в стандартной лекарственной форме для облегчения введения и однородности дозы. Как использовано в данном описании, стандартная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для являющихся млекопитающими субъектов, подвергаемых лечению; при этом каждая доза содержит заранее решенное количество активного материала, рассчитанное для вызова желаемого терапевтического эффекта, вместе с необходимым фармацевтическим носителем. Спецификацию новых стандартных лекарственных форм настоящего изобретения определяют (a) уникальные характеристики активного материала и конкретный терапевтический эффект, который должен быть достигнут, и (b) ограничения, присущие области смешивания такого активного материала для лечения заболевания у живых субъектов с болезненным состоянием, у которого телесное здоровье ослаблено, или она непосредственно зависит от них.
Основные активные ингредиенты смешаны для удобного и эффективного введения в эффективных количествах с подходящим фармацевтически приемлемым носителем в стандартной лекарственной форме. В случае композиций, содержащих дополнительные активные ингредиенты, дозы определяют, исходя из обычной дозы и способа введения указанных ингредиентов.
Для содействия доставке в клетки являющихся пептидами соединений, в том числе антител, пептиды можно модифицировать для увеличения их способности пересекать клеточную мембрану. Например, в патенте США 5149782 описано использование сливающих пептидов, образующих ионные каналы пептидов, мембранных пептидов, длинноцепочечных жирных кислот и других компонентов мембраны для увеличения переноса белков через клеточную мембрану. Эти и другие способы также описаны в WO 97/37016 и патенте США 5108921, которые включены в данное описание посредством ссылки.
В дальнейшем аспекте предложен активный ингредиент настоящего изобретения, определенный выше, для применения при лечении заболевания, или сам по себе, или в комбинации с общепризнанными соединениями, которые, как известно, подходят для лечения конкретного симптома. Следовательно, обеспечивается применение активного ингредиента настоящего изобретения для производства лекарственного средства для лечения заболевания, связанного с аберрантным иммунным ответом.
Кроме того, предложен способ лечения состояния, связанного с аберрантным иммунным ответом, включающий введение субъекту терапевтически эффективного количества лиганда, идентифицированного с использованием метода анализа, описанного выше.
Настоящее изобретение дополнительно описано, только с целью иллюстрации, в следующих примерах.
Сравнительный пример 1
Активность связывания и биологическая активность EuCIV3 являются уменьшенными по сравнению с активностями BMA031
Используя проточную цитометрию, авторы настоящего изобретения показали, что EuCIV3 хуже, чем BMA031 по связыванию с Т-клетками (фиг.1). В этом анализе конкуренции T-клетки инкубировали на льду в присутствии неизменной концентрации непосредственно помеченного фикоэритрином MoIgG2b-BMA031 (мышиного конкурента) и увеличивающейся концентрации антител против αβTCR. После инкубации в течение 20 минут клетки промывали, и связанное с поверхностью, непосредственно помеченное фикоэритрином MoIgG2b-BMA031 детектировали проточной цитометрией. Химерное антитело BMA031 HuIgG1 конкурирует намного эффективнее, чем EuCIV3.
Для оценки его способности к ингибированию активности T-клеток in vivo, CD8+ T-клетки обрабатывали антителами против αβTCR в различных концентрациях (см. фиг.2, Х-ось) и сокультивировали с аутологичными дендритными клетками (DC), подвергнутыми инкубации со смесью CMV пептидов 495-503 (pp65) в течение нескольких дней в in vitro анализе коммитирования (IVE).
Аферезные продукты от нормальных доноров - HLA-A2+ индивидуумов были получены из HemaCare Corp., Van Nuys, CA. PBMC выделяли центрифугированием в градиенте плотности фикола (GE Healthcare, Piscataway, NJ). CD8+ T-клетки выделяли, используя магнитные сферы (Invitrogen, Carlsbad, California) в соответствии с инструкциями производителя. Для получения аутологичных незрелых дендритных клеток PBMC ресуспендировали в RPMI 1640/5% AB сыворотки человека (Sigma), засевали в три матраса (Corning) и инкубировали в течение более чем 2 часов при 37οC/5%CO2. Прикрепленные моноциты затем ополаскивали PBS и культивировали в течение 6 дней в RPMI 1640/5% AB сыворотки человека, дополненной GM-CSF (Immunex, Seattle, WA) и IL-4 (PeproTech, Rocky Hill, NJ). До создания сокультур T-клетки/DC DC инкубировали с пептидами (10 мкг/мл) в течение 4 часов, и затем допускали их созревание. Зрелые дендритные клетки получали с помощью добавления 50 нг/мл TNF-альфа, 25 нг/мл IL-1β, 10 нг/мл IL-6, 500 нг/мл PGE-2 (PeproTech, Rocky Hill, NJ) и культивирования дендритных клеток в течение дополнительных 24 часов. Подвергнутые инкубации с пептидами DC затем добавляли к заранее выделенным CD8+ T-клеткам в соотношении T:DC, составляющем 10:1. Культуры сразу же снабжали IL-2 (100 МЕ/мл), добавляемым к культурам. Культуры дополняли IL-2 (100 МЕ/мл) в день 4. Смешанные культуры анализировали в отношении реактивности на пептиды в анализе высвобождения хрома в день 7.
На графике фиг.2 представлены данные лизиса, исходя из анализа высвобождения хрома, в котором не подвергнутые обработке T-клетки были успешно коммитированы к пептиду pp65 и были способны к лизису специфических мишеней на уровне >50%. BMA031 ингибировал коммитирование этих T-клеток, поскольку они были неспособны к лизису специфических мишеней в зависимости от дозы. Гуманизированное антитело EuCIV3 было менее эффективным, чем BMA031, и было способно к ингибированию коммитирования только в наибольшей дозе.
Пример 2
Конструирование Fc химерных антител BMA031
In vitro профиль
Был оценен in vitro профиль BMA031 в группе анализов. В таблице 1 представлен in vitro профиль BMA031. BMA031 сравнивают с OKT3 в этих анализах.
В анализе пролиферации PBMC человека культивировали с увеличивающими концентрациями терапевтического антитела в течение 72 часов, добавляли 3H-тимидин, и клетки собирали спустя 18 часов.
В случае анализа истощения T-клеток/выброса цитокинов PBMC человека культивировали с увеличивающимися концентрациями терапевтического антитела и ежедневно анализировали на предмет количества клеток и жизнеспособности (Vi-Cell, Beckman Coulter) вплоть до дня 7. Супернатанты клеток также собирали, хранили при -20°C и анализировали с использованием реагентов для анализа цитокинов 8-Plex Cytokine Panel (Bio-Rad).
BMA031 не индуцировал: (i) пролиферацию PBMC; (ii) истощение T-клеток; (iii) экспрессию CD25 или (iv) выброс цитокинов. Напротив, OKT3 действительно индуцировал все приведенные выше эффекты. BMA031 и OKT3 способны к блокированию коммитирования CD8+ клеток к пептиду в in vitro анализе коммитирования (IVE), а также способны к блокированию реакции смешанной культуры лимфоцитов (MLR). BMA031 также индуцирует апоптоз активированных T-клеток (индуцированную активацией гибель клеток; AICD).
В отличие от BMA031 химерный вариант BMA031 (HuIgG1), с константной областью IgG1 человека дикого типа, имел in vitro профиль, сходный с профилем ОКТ3 (таблица 1). Авторы настоящего изобретения постулировали, что участие FcγR является переломным в этом изменении in vitro профиля для HuIgG1 BMA031 по сравнению с BMA031 MoIgG2b. По этой причине были созданы F(ab')2-фрагменты BMA031 HuIgG1 и обнаружено, что они вновь обретают профиль BMA031 MoIgG2b. Посредством конструирования Fc авторы настоящего изобретения включили модификации, которые исключают связывание с FcγR в результате мутаций, известных как «дельта ab» (Armour et at. (1999) Eur. J. Immunol., 29: 2613-2624) и в результате создания негликозилированной формы HuIgG4 (N297Q). Антитела против αβTCR HuIgG1 дельта ab и HuIgG4 agly имели in vitro профиль, одинаковый с профилем BMA031 MolgG2b (таблица 1).
|
Пример 3
Конструирование гуманизированных антител с увеличенным связыванием
Были созданы два ряда гуманизированных вариантов BMA031, названных рядом HEBE1 IGH3-23) и рядом GL1BM (IGHV1-3*01 и IGKV3-11*01; см. VBase, vbase.mrc-cpe.cam.ac.uk). Первоначальная пересадка CDR-участков тяжелой цепи BMA031 в каркасные области IGH3-23 (см. SEQ ID NO:5 и 6) увеличила связывание антитела с αβTCR, как установлено с помощью анализа конкуренции (фиг.3); см. пример 2. Однако это увеличение не обусловило функциональное улучшение антитела, как установлено с помощью анализа IVE (фиг.4).
Пример 4
Оптимизация гуманизированных антител
Стратегия оптимизации гуманизированных антител была основана на мутагенезе и скрининге на функциональность. Оптимизацию начинали с поблочных замен аминокислотных остатков в одной из каждых четырех каркасных областей вариабельных доменов, с мышиных на человеческие остатки. Ключевые каркасные области были идентифицированы в каждом из рядов GL1BM HC, GL1BM LC и HEBE1 HC. После этой идентификации отдельные остатки в этих каркасных областях были мутированы с превращением остатков исходной мышиной последовательности в остатки зародышевого типа человека. Остатки каркасных областей, для которых идентичность с мышиной последовательностью, как было установлено, важна для сохранения биологических свойств антитела, были сохранены в виде мышиных остатков. В противном случае, остатки каркасных областей были изменены для приведения в соответствие с аминокислотной последовательностью зародышевого типа человека. Это продолжали по всей последовательности до тех пор, пока не было идентифицировано минимальное количество мышиных остатков для сохранения первоначальных способностей к связыванию. См. фиг.5. Авторы настоящего изобретения продемонстрировали, что несколько из антител из этих рядов обладают увеличенным связыванием по сравнению с BMA031, что определено по скорости диссоциации антитела от T-клеток (фиг.6, 7 и 8).
Для исследований скорости диссоциации 105 T-клеток человека инкубировали в течение 30-60 минут при комнатной температуре в 100 мкл полной среды для роста, содержащей 2 мкг/мл антител, представленных в виде HuIgG1-Δab. Клетки затем промывали, ресуспендировали в 50 мкл полной среды для роста, и добавляли 20 мкг/мл F(ab')2 HEBE1 для предотвращения повторного связывания подвергнутых диссоциации антител-кандидатов. В конце этого анализа по определению зависимости от времени клетки фиксировали, и уровень остающегося антитела HuIgG1-Δab, связанного с клеточной поверхностью, измеряли с помощью проточной цитометрии через PE-меченное козье второе антитело против HuIgG.
Авторы настоящего изобретения также продемонстрировали, что антитела эффективны в предотвращении иммунного ответа в анализе IVE (фиг.9, 10 и 11) и анализе MLR. В анализе IVE связывание тетрамера использовали в качестве количественного показателя для IVE. Процент клеток, которые были специфическими в отношении антигена, определяли посредством окрашивания T-клеток непосредственно помеченным тетрамером, который является специфичным для коммитирующего пептида. Кратко, CD8+ T-клетки в день 7 IVE окрашивали тетрамером с использованием стандартных протоколов окрашивания для проточной цитометрии и анализировали в BD FACSCalibur. Кроме того, гуманизированные антитела продемонстрировали уровни способности к пролиферации PBMC и выброса цитокинов, схожие с таковыми BMA031 (фиг.12 и 13).
Антитела также продемонстрировали способность к ингибированию выброса IFNγ из T-клеток в анализе IVE (фиг.14). Кроме того, было установлено, что ряд из этих антител обладает увеличенной способностью к вызову индуцированной активацией гибели клеток (AICD) - активированных αβTCR-позитивных T-клеток по сравнению с BMA031 (фиг.15). В анализе AICD антиген-специфические CD8+ T-клетки культивировали с терапевтическим антителом. Через 24 часа, 48 часов и 72 часов клетки окрашивали на маркеры апоптоза аннексин-V и 7-AAD. Клетки также окрашивали тетрамером для соединения апоптоза с эффектами на антиген-специфические T-клетки.
В заключение, авторы настоящего изобретения внесли значительные улучшения по сравнению с предшествующими попытками в гуманизацию BMA031. Обнаружение антител с уменьшенной скоростью диссоциации по сравнению с BMA031 является неожиданным с помощью данного процесса. Такое увеличение связывания коррелирует с увеличением эффективности в подавлении иммунного ответа, как продемонстрировано в анализе IVE (фиг.10 и 11). Специфичность антител в отношении αβTCR, уменьшенная иммуногенность в результате гуманизации, специфический апоптоз активированных T-клеток и отсутствие активации T-клеток после связывания антитела делают эти антитела отличными кандидатами для терапевтических целей.
Пример 5
Создание мутантов по Fc для уменьшения эффекторной функции
Был разработан и создан вариант Fc, где сайт гликозилирования введен в положение 298 аминокислоты Ser, рядом с природным сайтом Asn297. Гликозилирование в Asn297 было или сохранено, или вытеснено с помощью мутаций. Мутации и результаты гликозилирования представлены в таблице 2.
|
Были введены мутации в тяжелую цепь антитела против αβ T-клеточного рецептора клона #66 с помощью Quikchange, используя матрицу pENTR_LIC_IgG1. VH-домен HEBE1 Δab IgG1 #66 амплифицировали с использованием праймеров LIC и клонировали в мутированный или дикого типа pENTR_LIC_IgG1 с помощью LIC для создания полноразмерных Ат-мутантов или дикого типа. Субклонирование осуществляли с помощью двойного расщепления DraIII/XhoI, получая вставку размером ~1250 п.о. в удачных клонах. Полноразмерные мутанты затем клонировали в экспрессионный вектор, pCEP4(-E+I)Dest, посредством системы для клонирования Gateway. Подтверждение мутаций затем осуществляли секвенированием ДНК.
Две конструкции, HEBE1 Agly IgG4 и HEBE1 Δab IgG1 в pCEP4, использовали в качестве контролей при трансфекциии HEK293.
Мутанты, дикий тип и контроли (Agly и Δab) трансфицировали в клетки HEK293-EBNA в трех матрасах для экспрессии. Белки очищали из 160 мл кондиционированной среды (CM) с использованием 1-мл колонок с белком А HiTrap (GE), присоединенных к многоканальному перистальтическому насосу. Пять микрограмм каждого супернатанта анализировали в 4-20% SDS-ПААГ для электрофореза в Трис-глициновом буфере в восстанавливающих и невосстанавливающих условиях (см. фиг.16). Тяжелая цепь негликозилированных мутантов (N297Q, T299A и Agly (неправильный контроль), находится ниже (черная стрелка), что соответствует утрате гликанов в этих антителах. Однако тяжелые цепи сконструированных гликозилированных антител (NSY, STY, SY, Δab и контролей дикого типа, красные стрелки), мигрируют так же, как контроль дикого типа. Этот результат соответствует ожидаемому последствию сконструированного сайта гликозилирования в положении 298. Анализ с помощью SEC-HPLC свидетельствовал о том, что все мутанты представлены в виде мономеров.
Анализ гликозилирования с помощью ЖХ-МС
Сконструированные варианты H66 IgG1 Fc были частично восстановлены с использованием 20 мМ DTT при 37°C в течение 30 мин. Образцы анализировали с помощью капиллярной ЖХ/МС, используя капиллярную HPLC систему Agilent 1100, соединенную с гибридной системой QSTAR qq TOF (Applied Biosystem). Для анализа данных использовали байесовскую реконструкцию белка с поправкой на фон и компьютерное моделирование в Analyst QS 1.1 (Applied Biosystem). В случае ввода мутантного антитела S298N/T299A Y300S H66, один сайт гликозилирования отмечался в положении аминокислоты 298 с гликанами 2-антенарного и 3-антенарного смешанного типа, выявляемыми в качестве основных видов, а также G0F, G1F и G2F.
Связывание мутантных антител против αβTCR с FcγIIIa и FcγRI человека, используя Biacore
Biacore использовали для оценки связывания с рекомбинантным FcγIIIa (V158 и F158) и FcγRI человека. Антитело против HPC4 иммобилизовали на всех 4 проточных ячейках чипа СМ5 посредством стандартной процедуры связывания содержащих аминогруппы веществ, обеспечиваемой Biacore. Антитело против HPC4 разводили до 50 мкг/мл в 10 мМ ацетате натрия pH 5,0 для реакции связывания и вводили в течение 25 мин со скоростью 5 мкл/мин. На поверхности чипа было иммобилизовано приблизительно 12000 резонансных единиц (РЕ). Рекомбинантный FcγRIIIa-V158 и FcγRIIIa-F158 человека разводили до 0,6 мкг/мл в буфере для связывания, HBS-P с 1 мМ CaCl2 и вводили в проточные ячейки 2 и 4, соответственно, в течение 3 мин со скоростью 5 мкл/мин для улавливания 300-400 РЕ рецептора на чипе с антителом против HPC4. Для различения слабых связующих веществ, в три раза большее количество rhFcγRIIIa, чем обычно используемое в этом анализе, улавливали на поверхности с антителом против HPC4. Проточные ячейки 1 и 3 использовали в качестве базовых контролей. Каждое антитело разводили до 200 нМ в буфере для связывания и вводили во все 4 проточные ячейки в течение 4 мин, с последующей 5-мин диссоциацией в буфере. Поверхности регенерировали с помощью 10 мМ EDTA в буфере HBS-EP в течение 3 мин при введении со скоростью 20 мкл/мин.
Результаты представлены на фиг.17.
Biacore также использовали для сравнения связывания с FcγRI. Антитело против тетра-His было подвергнуто замене буфера на 10 мМ ацетат натрия pH 4,0, используя колонку для обессоливания Zeba Desalting, и разведено до 25 мкг/мл в ацетатном буфере для связывания содержащих аминогруппы веществ. Приблизительно 9000 РЕ антитела против тетра-His после 20-мин введения со скоростью 5 мкг/мл иммобилизовали в двух проточных ячейках чипа СМ5. Как и в случае предшествующего эксперимента, в десять раз большее количество FcγRI улавливали на поверхности с антителом против тетра-His для сравнения слабых связывающих веществ. Рекомбинантный FcγRI человека разводили до 10 мкг/мл в буфере для связывания HBS-EP и вводили в проточную ячейку 2 в течение 1 мин со скоростью 5 мкл/мин для улавливания ~1000 РЕ рецептора на чипе с антителом против тетра-His. Антитело в одной концентрации, 100 нМ, пропускали в течение 3 мин со скоростью 30 мкл/мин по поверхности с захваченным рецептором и контрольной поверхности. За диссоциацией следили в течение 3 мин. Поверхность регенерировали с помощью двух 30-сек введений 10 мМ глицина pH 2,5 со скоростью 20 мкл/мин.
Результаты представлены на фиг.18.
Результаты говорят об очень слабом связывании сконструированных мутантов по гликозилированию с FcγRIIIa или FcγRI. В частности, H66 S298N/T299A/Y300S характеризуется почти полностью аннулированным связыванием с обоими рецепторами. Этот мутант был выбран в качестве примера для детальной характеристики.
Характеристика стабильности, используя круговой дихроизм (CD)
Стабильность мутантного антитела S298N/T299A/Y300S контролировали с помощью эксперимента по термической денатурации с использованием дальнего ультрафиолетового CD, в котором интенсивность сигнала CD при 216 нм и 222 нм контролировали по мере увеличения температуры, которое, в конечном счете, приводит к развертыванию антитела. CD-спектры получали с использованием спектрофотометра Jasco 815 в концентрации белка, составляющей приблизительно 0,5 мг/мл, в буфере PBS в кварцевых кюветах (Hellma, Inc) с длиной оптического пути, равном 10 мм. Температуру контролировали с помощью термоэлектрического модуля Пельтье (Jasco модель AWC100) и быстро линейно увеличивали со скоростью 1οC/мин с 25°C до 89°C. Получали как сигнал CD, так и HT-напряжение. Сбор данных осуществляли из диапазона 210-260 нм с интервалами сбора, равном 0,5 нм, и температурными интервалами в 1°C. Скорость сканирования составляла 50 нм/мин, и шаг сбора данных составлял 0,5 нм. Использовали ширину полосы пропускания 2,5 нм с настройкой чувствительности по среде. Для каждого образца выполняли 4 повторных сканирования. Результаты говорят о том, что как дельта AB H66, так и мутант S298N/T299A Y300S H66 демонстрируют схожие термические характеристики и характеризуются одинаковой температурой начала деградации, составляющей приблизительно 63°C. Другими словами, мутант является настолько же стабильным, как и формат дельта AB.
См. фиг.18.
Пример 6
Функциональный анализ Fc-сконструированных мутантов
Анализы пролиферации PBMC и выброса цитокинов проводили, как изложено в примере 2. PBMC нормального донора оттаивали и обрабатывали в следующих условиях (во всех случаях в средах, содержащих комплемент):
без обработки
BMA031, moIgG2b 10 мкг/мл
OKT3, moIgG2a 10 мкг/млl
H66, huIgG1 ΔAB 10 мкг/мл, 1 мкг/мл и 0,1 мкг/мл
H66, huIgG1 S298N/T299A/Y300S 10 мкг/мл, 1 мкг/мл и 0,1 мкг/мл.
Сбор цитокинов осуществляли в день 2 (Д2) и день 4 (Д4) для анализа Bioplex (IL2, IL4, IL6, IL8, IL10, GM-CSF, IFNγ, TNFα). Клетки окрашивали в Д4 для выявления экспрессии CD4, CD8, CD25 и αβTCR.
Результаты, представленные на фиг.19-22, свидетельствуют о том, что поведение H66 S298N/T299A/Y300S схоже с поведением H66 ΔAB во всех анализах на основе клеток, демонстрируя минимальную активацию T-клеток при экспрессии CD25; связывание с αβTCR, хотя и с немного отличной от ΔАВ кинетикой; минимальный выброс цитокинов в оба момента времени Д2 и Д4; мутант фактически был лучше ΔАВ в Д4, что касается нескольких цитокинов.
Таким образом, мутация S298N/T299A/Y300S устраняла эффекторную функцию столь же эффективно, как и мутация ΔAB.
Пример 7
Биспецифические антитела
Были сконструированы биспецифические молекулы, состоящие из двух одноцепочечных Fv-фрагментов (scFv), связанных вместе с помощью короткого аминокислотного линкера, причем одно плечо способно к связыванию с опухолевой мишенью, а другое плечо способно к связыванию с T-клетками через αβTCR. Биспецифическую молекулу называют как TRACER (T cell Receptor Activated Cytotoxic EnableR).
Были созданы следующие гуманизированные конструкции из scFv против αβTCR:
GL1BΔSxVK1
GL1BMΔSxVK27
GL1BMΔSVH11xVK1
GL1BMΔSVH15xVK1
GL1BMΔSVH28xVK43
GL1BMΔSVH31xVK43
Последовательности тяжелой и легкой цепей определены в SEQ ID NO:14-16 и 20-24.
Определение характеристик этих молекул включало оценку связывания с опухолевой мишенью и T-клетками, in vitro цитотоксическую активность и профиль выброса цитокинов в присутствии и в отсутствие опухолевых клеток-мишеней.
Профиль связывания, определенный с помощью проточной цитометрии, свидетельствует о том, что биспецифические антитела против αβTCR способны к связыванию как с линией опухолевых клеток-мишеней, так и с T-клетками. См. фиг.23.
In vitro цитотоксическая активность, определенная с помощью проточной цитометрии, свидетельствует о том, что T-клетки, подвергнутые рекрутингу с помощью биспецифического антитела против αβTCR, способны к индукции T-клеточноопосредованного лизиса. См. фиг.24.
Анализ профиля выброса цитокинов показал, что при связывании обоих плеч биспецифического антитела отмечается высокий уровень выброса TH1/TH2 цитокинов из T-клеток, который не отмечается в отсутствие клеток-мишеней. В своей совокупности этот механизм действия демонстрирует профиль, схожий с профилем описанных в литературе биспецифических молекул на основе CD3.
Пример 8
Получение и характеристика сконструированного варианта Fc в антителе против CD52
Для проверки применимости ко всему описанных в данном описании мутаций Fc был также получен мутант по гликозилированию с мутациями S298N/Y300S в антителе против CD52 (клоне 2C3), чтобы выяснить, распространяется ли модуляция эффекторной функции в связи с уменьшением связывания с FcγRIII на отличный остов антитела. ДНК варианта S298N/Y300S 2C3 была получена мутагенезом Quikchange. Белок был очищен из кондиционированных сред после транзиторной трансфекции клеток HEK293. Антитело против CD52 2C3 дикого типа было продуцировано параллельно в качестве контроля. Для определения характеристик связывания с антигеном, FcγRIII, и способностей к связыванию очищенных антител использовали Biacore (см. фиг.26).
Вариант S298N/Y300S 2C3 прочно связывается с пептидом CD52, и соответствующая связыванию сенсограмма неотличима от сенсограммы для контроля дикого типа, что говорит о том, что эта мутация в Fc-домене не оказывает влияния на его связывание с антигеном (фиг.26A).
Для исследования эффекторной функции Fc рецептор FcγRIII (Val158) использовали в исследованиях связывания. Мутантное антитело и контрольное антитело дикого типа разводили до 200 нМ и вводили в проточную ячейку с FcγRIII, захваченным с помощью HPC4-метки. Связывание с FcγRIII является почти недетектируемым в случае мутанта S298N/Y300S, что означает утрату эффекторной функции в случае этого варианта (фиг.26B). Мутант также связывается с рецептором FcRn с той же аффинностью, что и контрольное антитело дикого типа, поэтому авторы настоящего изобретения не ожидают изменения периода его полужизни в кровотоке или других фармакокинетических характеристик (см. фиг.26C). Авторы настоящего изобретения делают вывод, что мутация S298N/Y300S применима ко всем антителам для уменьшения или исключения нежелательной эффекторной функции Fc, например, через соединение с Fcγ-рецепторами человека.