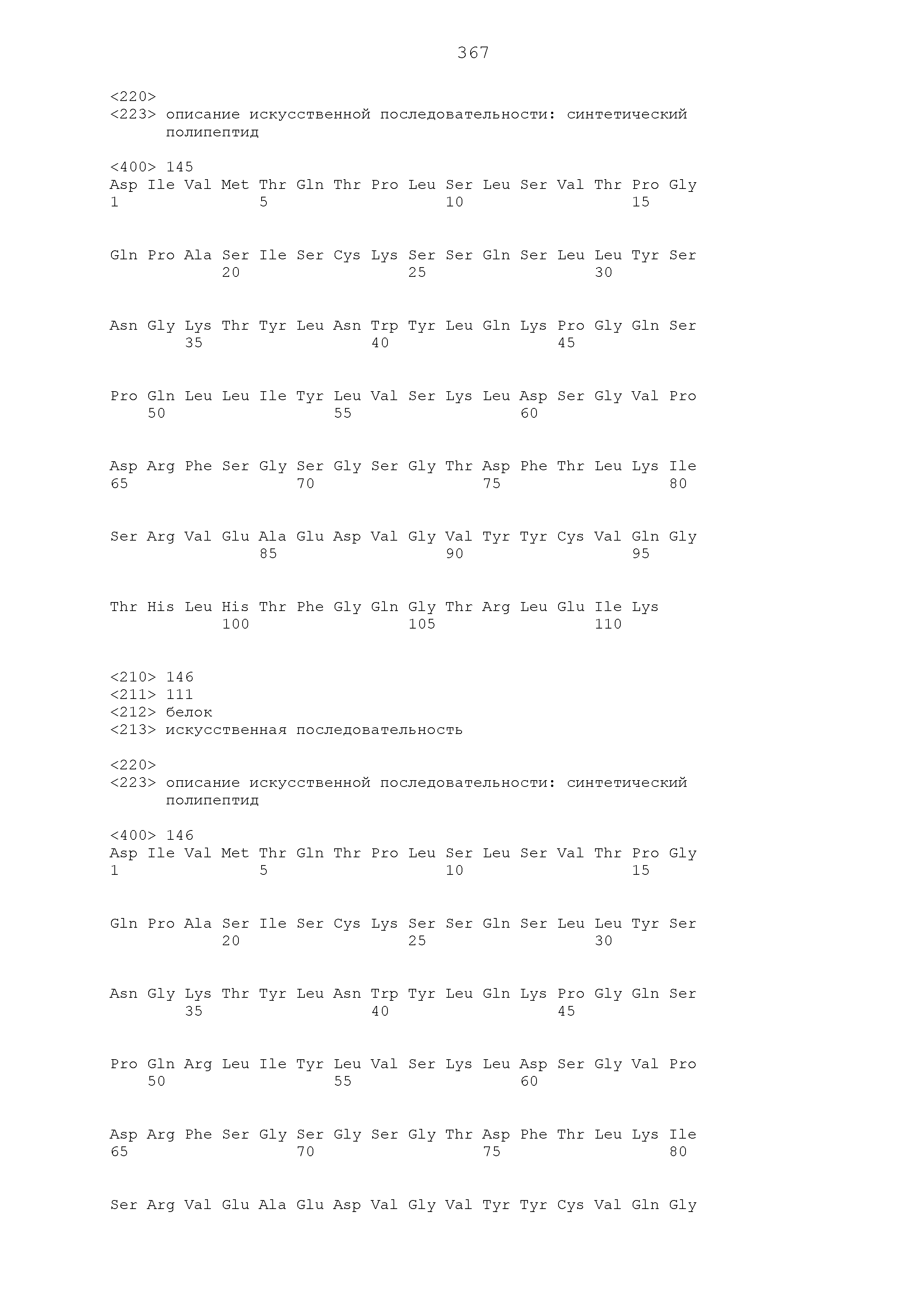Результат интеллектуальной деятельности: ИММУНОГЛОБУЛИНЫ K CD52 ЧЕЛОВЕКА
Вид РИД
Изобретение
Данная заявка заявляет на приоритетность относительно временной заявки на патент США 61/177837 от 13 мая 2009 г. описание указанной заявки включено в настоящий документ во всей своей полноте посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит Перечень Последовательностей представленную через EFS-Web и введенную сюда в виде ссылки во всей его полноте (см. в конце описания). Указанная копия ASCII созданная в июне 2010, называется 001662WO.txt и занимает объем 182208 бт.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
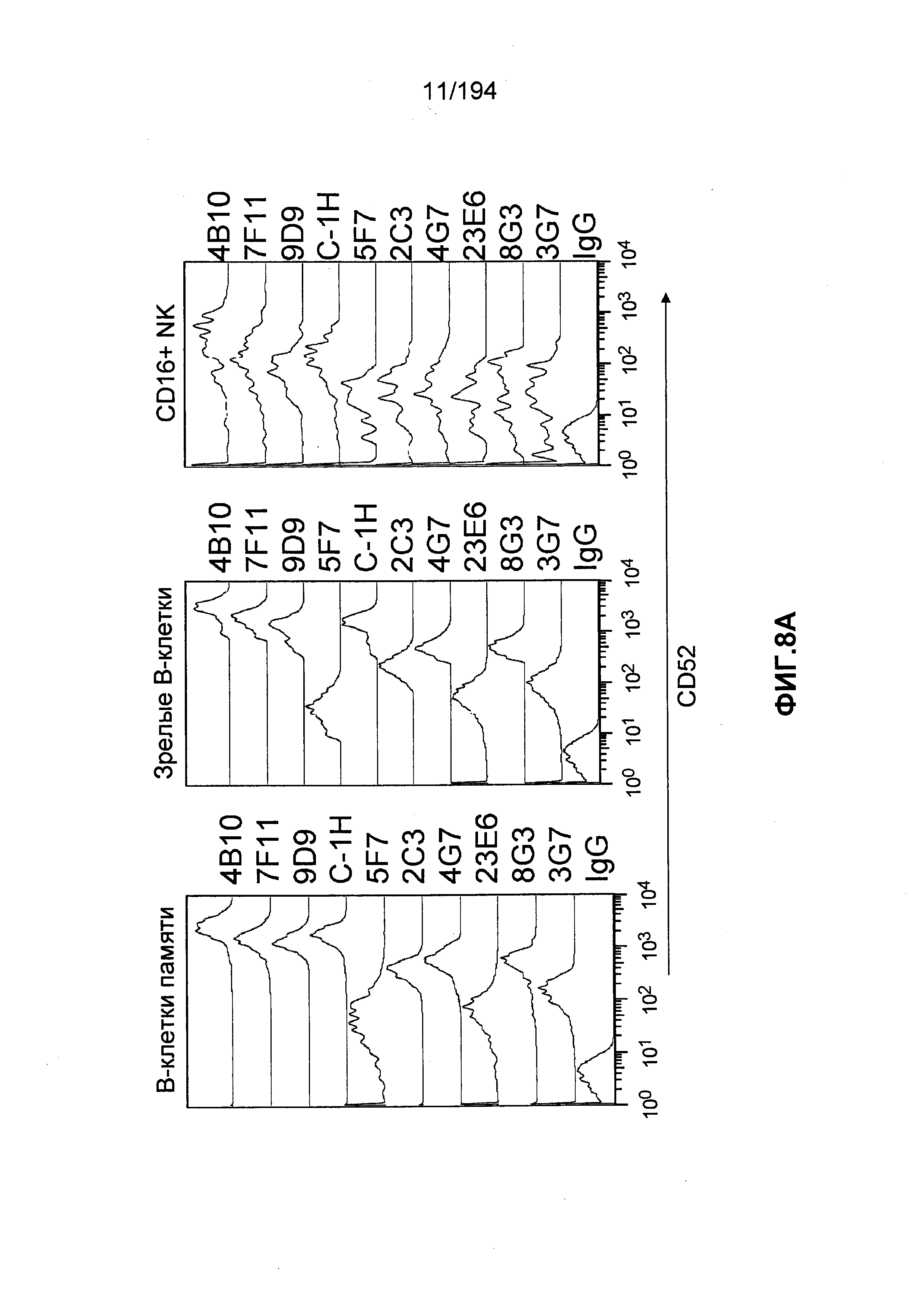
CD52 представляет собой гликозилированный, заякоренный гликозилфосфатидилинозитолом (ГФИ) белок на поверхности клетки, находящийся в большом количестве (500000 молекул/клетка) на поверхности различных здоровых и злокачественных лимфоидных клеток (например, Т- и В-клеток). См., например, Hale et. al., J Biol regul Homeost Agents 15:386-391 (2001); Huh et. al., Blood 92: Abstract 4199 (1998); Elsner et. al., Blood 88:4684-4693 (1996); Gilleece et. al., Blood 82:807-812 (1993); Rodig et. al., Clin Cancer Res 12:7174-7179 (2006); Ginaldi et. al., Leuk Res 22:185-191 (1998). CD52 экспрессируется в более меньшем количестве на миелоидных клетках, таких как моноциты, макрофаги, и дендритных клетках, и незначительная экспрессия отмечается на зрелых клетках-естественных киллерах (NK-клетках), нейтрофилах и гематологических стволовых клетках. Id. CD52 также вырабатывается эпителиальными клетками в придатках яичка и семявыносящего протока и попадает в сперму во время прохождения ее через половые пути (Hale et. al., 2001, supra; Domagala et. al., Med Sci Monit 7:325-331 (2001)). Точная биологическая функция CD52 остается неясной, но некоторые доказательства позволяют предположить, что он может быть задействован в миграции и ко-стимуляции Т-клеток (Rowan et. al., Int Immunol 7:69-77 (1995); Masuyama et. al., J Exp Med 189:979-989 (1999); Watanabe et. al., Clin Immunol 120:247-259 (2006)).
Кампат-1H® (алемтузумаб, Кампат®, МабКампат®) является гуманизированным моноклональным антителом к CD52 человека, которое проявляет сильные цитотоксические эффекты in vitro (антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ) и комплемент-зависимую цитотоксичность (КЗЦ)). Кампат® распознает антигенную детерминанту, состоящую из четырех аминокислот на карбоксильном конце зрелого белка CD52 и участка отрицательно заряженного якоря ГФИ. По причине своих значительных цитотоксических эффектов, препарат Кампат® способен приводить к снижению количества CD52-положительных клеток in vivo и утвержден для терапии первой и третьей линии для лечения хронического лимфоцитарного лейкоза (ХЛЛ). Препарат Кампат® был подвергнут оценке относительно своего использования в лечении нескольких аутоиммунных заболеваний, включая ревматоидный артрит, васкулит, миозит и болезнь Вегенера. Однако самые передовые исследования препарата Кампат® относятся к лечению рецидивирующе-ремитирующего рассеянного склероза (РС). Эти исследования выявили значительное улучшение во времени до рецидива относительно активного препарата сравнения (Ребиф® (т.е. интерферона-бета-1a)).
Существует необходимость поиска дополнительных терапевтических агентов и способов нацеливания на CD52 в качестве мишени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Гуманизированные иммуноглобулины
Изобретение описывает гуманизированные иммуноглобулины, обладающие специфичностью связывания с CD52 человека (huCD52). Они могут состоять из гипервариабельных участков (CDR) мышиных антител к CD52 человека. Гуманизированные иммуноглобулины по изобретению содержат аминокислотные последовательности, отличающиеся от последовательностей других гуманизированных иммуноглобулинов и, в частности, от последовательностей других гуманизированных иммуноглобулинов, которые образуют CDR мышиных антител к CD52 человека. Гуманизированные иммуноглобулины по изобретению отличаются от гуманизированного иммуноглобулина Кампат®. В некоторых вариантах воплощения изобретения они обладают преимуществом в сравнении с другими гуманизированными антителами, включающими CDR антитела Кампат®.
Описанные здесь иммуноглобулины могут состоять из гуманизированной тяжелой цепи и гуманизированной легкой цепи. В одном варианте воплощения изобретения гуманизированный иммуноглобулин состоит из легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 3, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 16; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 4, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 17; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 5, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 18; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 6, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 19; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 7, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 20; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 8, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 21; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 9, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 22; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 10, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 23; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 11, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 24; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 12, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 25; легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 12, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 137; или легкой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 13, и тяжелой цепи, включающей один или несколько CDR (например, все три CDR) с последовательностью SEQ ID NO: 26. CDR в представленных выше последовательностях указаны на ФИГУРАХ 2 и 3, а также в представленных в документе Таблицах 1-6.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека, состоит из легкой цепи, содержащей один или несколько CDR (например, все три), выбираемых из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48; тяжелой цепи, содержащей один или несколько CDR (например, все три), выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294; или такой легкой или такой тяжелой цепи, при этом гуманизированный иммуноглобулин не является антителом Кампат®.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека, состоит из легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13; тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137; или такой легкой или такой тяжелой цепи, при этом гуманизированный иммуноглобулин не является антителом Кампат®.
В некоторых вариантах воплощения изобретения каркасный участок гуманизированного иммуноглобулина обладает, по меньшей мере, 50% гомологичностью относительно каркасного участка иммуноглобулина, из которого получены CDR легкой цепи и CDR тяжелой цепи. Например, каркасный участок гуманизированного иммуноглобулина может быть, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98%, по меньшей мере, на 99%, или, по меньшей мере, на 100% идентичным последовательности иммуноглобулина человека клеток зародышевой линии. В одном варианте воплощения изобретения каркасный участок гуманизированного иммуноглобулина может быть получен из вариабельного участка человеческого антитела класса IgG. В другом варианте воплощения изобретения CD52 представлен человеческим CD52 дикого типа. В еще одном варианте воплощения изобретения гуманизированный иммуноглобулин может конкурировать с алемтузумабом за связывание с человеческим CD52, например, он может связываться с антигенной детерминантой, которая идентична или перекрывает антигенную детерминанту, с которой связывается алемтузумаб.
Изобретение также описывает гуманизированную легкую цепь гуманизированного иммуноглобулина по изобретению. В одном варианте воплощения изобретения гуманизированная легкая цепь состоит из одного или нескольких CDR, состоящих из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48 или их комбинации, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В другом варианте воплощения изобретения гуманизированная легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
Изобретение также описывает гуманизированную тяжелую цепь гуманизированного иммуноглобулина по изобретению. В одном варианте воплощения изобретения гуманизированная тяжелая цепь состоит из одного или нескольких CDR вариабельного домена Ig, состоящих из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294 или их комбинации, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В других вариантах воплощения изобретения гуманизированная тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
Преимущественно, гуманизированные иммуноглобулины по данному изобретению состоят из гуманизированной легкой цепи по изобретению и гуманизированной тяжелой цепи по изобретению.
В других вариантах воплощения изобретения описан гуманизированный иммуноглобулин, связывающийся с той же самой антигенной детерминантой на CD52 человека, или конкурирующий прямым или перекрестным образом с мышиным моноклональным антителом, состоящим из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретения гуманизированный иммуноглобулин связывается с антигенной детерминантой на CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
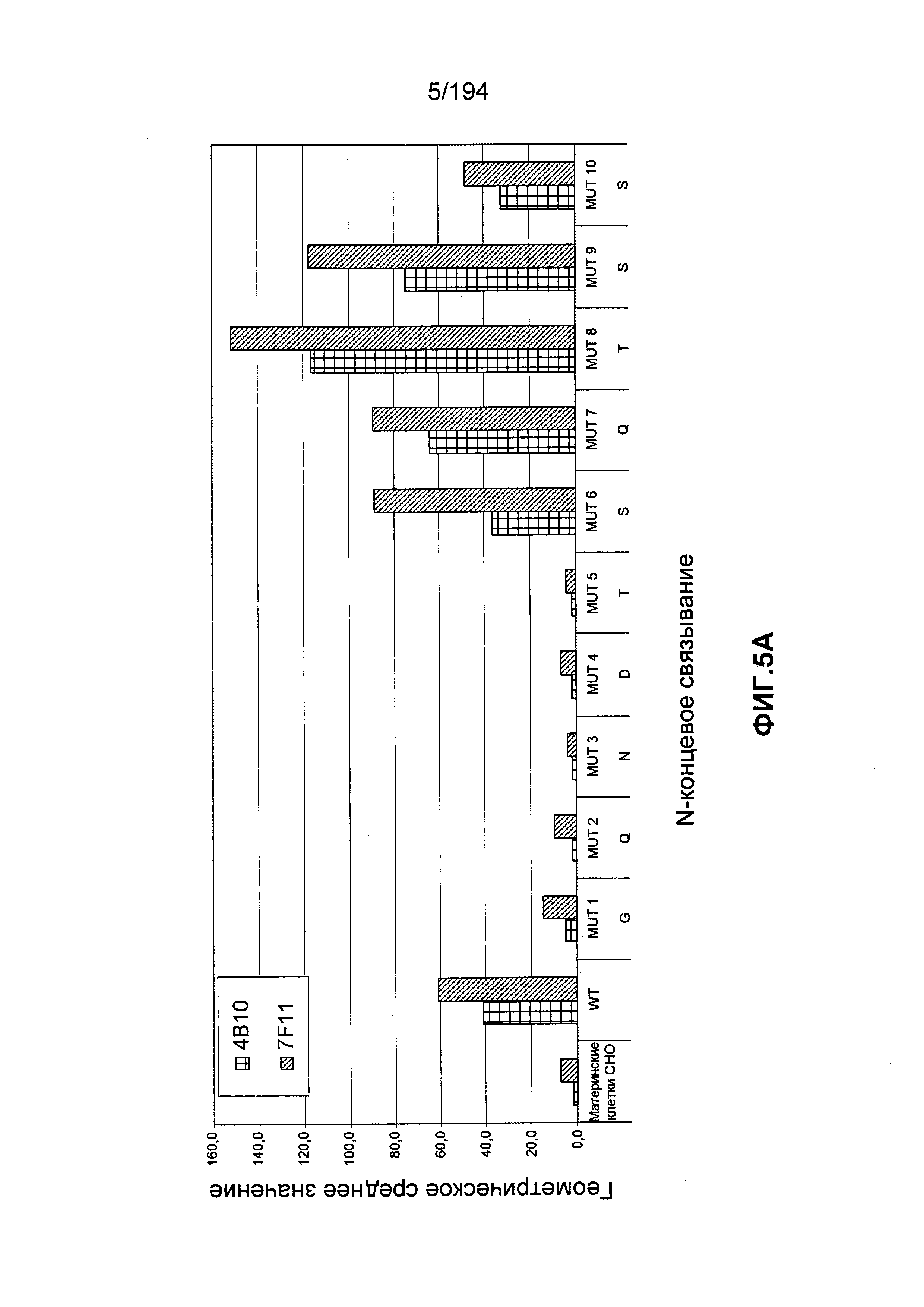
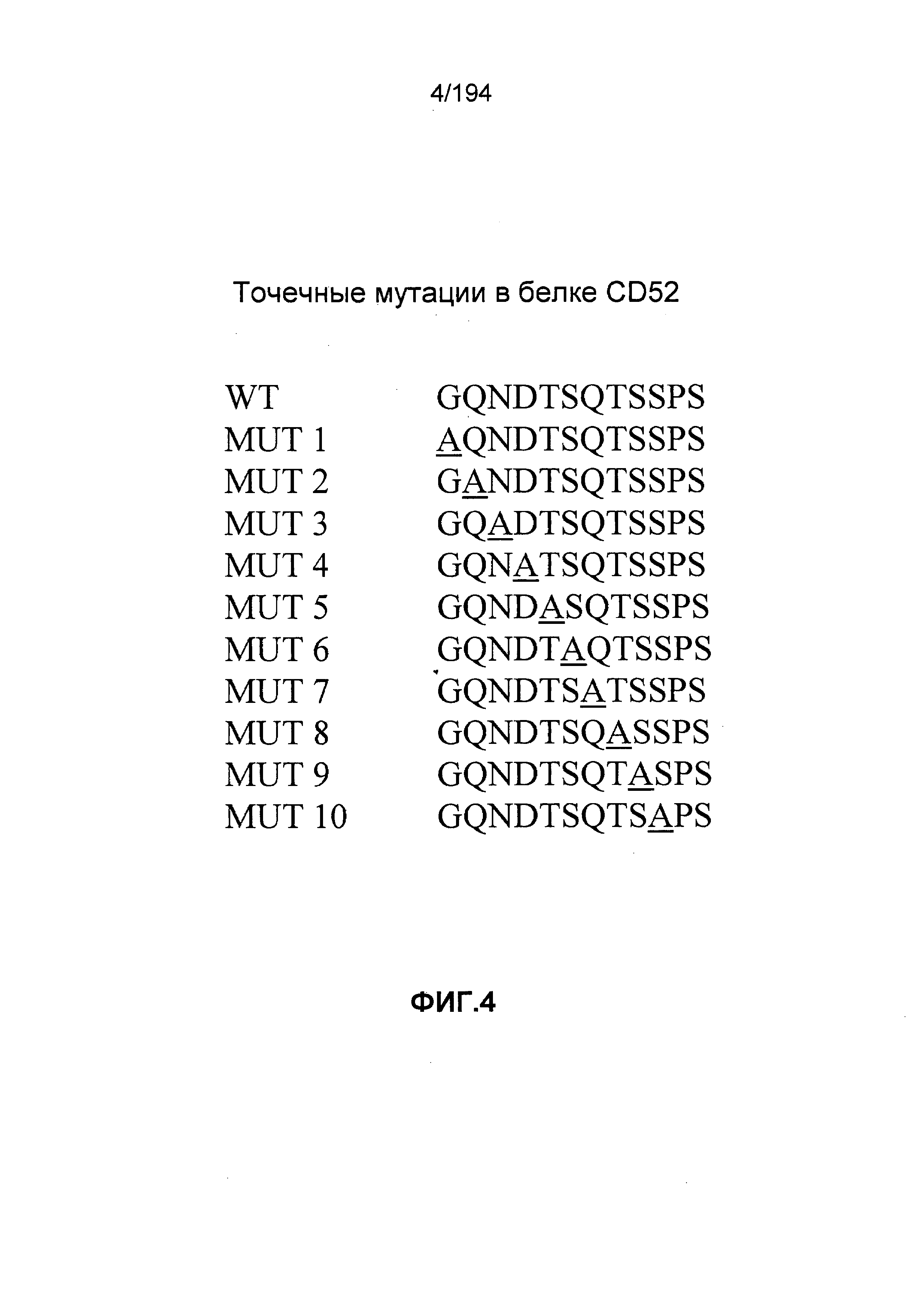
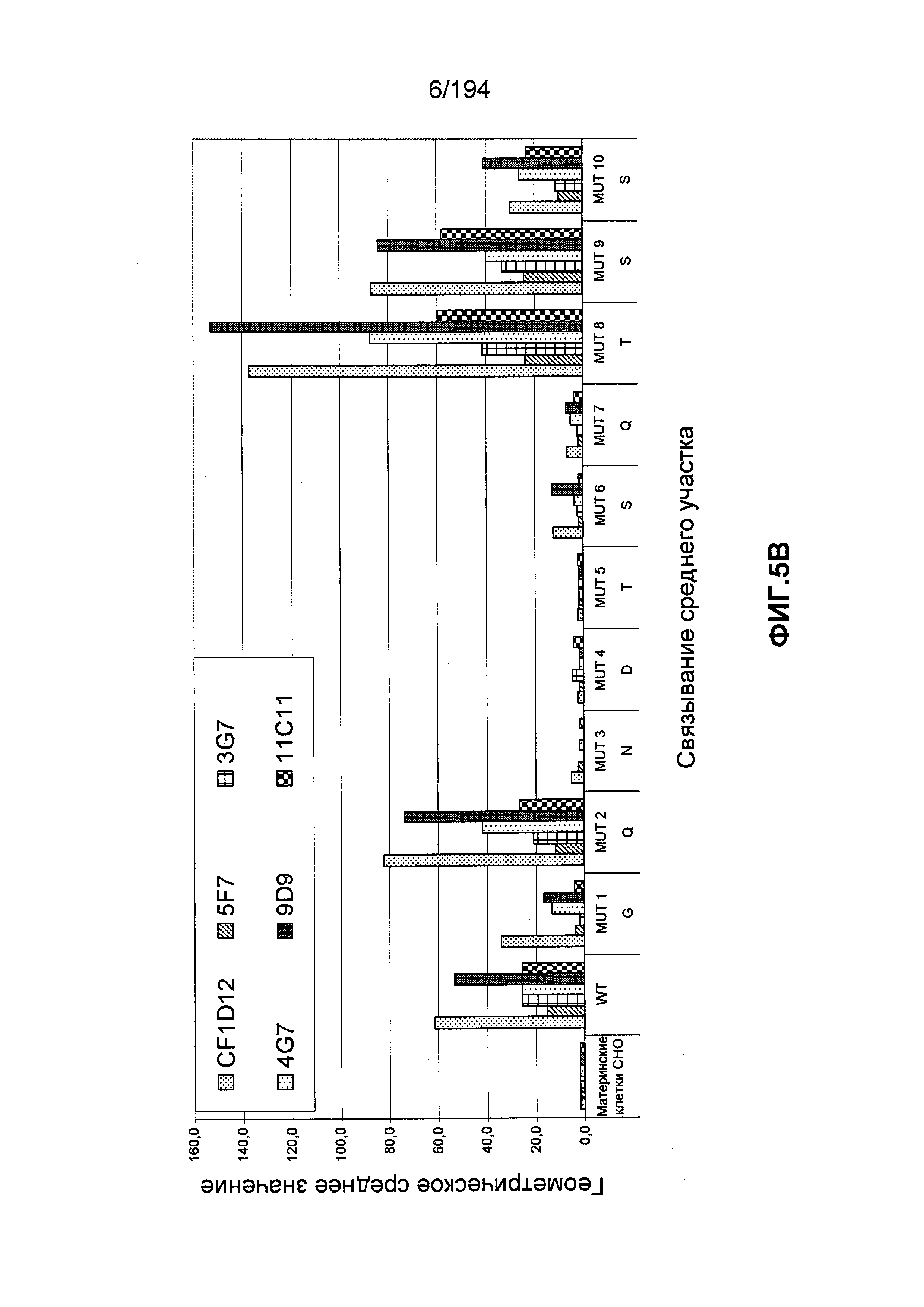
В других вариантах воплощения изобретения описан гуманизированный иммуноглобулин, который связывается с антигенной детерминантой на CD52 человека (например, SEQ ID NO: 104) и состоит, по меньшей мере, из остатка 1 последовательности зрелого CD52 человека (при этом остаток 1 является N-концом последовательности зрелого CD52 человека, т.е. N-терминальным остатком глицина [G]; см. ФИГ.4). Гуманизированный иммуноглобулин может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека (такие остатки представлены глицином [G], аспарагином [N], аспартатом [D] и треонином [T], соответственно). Гуманизированный иммуноглобулин может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека (такие остатки представлены глицином [G], глутамином [Q], аспарагином [N], аспартатом [D] и треонином [T], соответственно). В других вариантах воплощения изобретения описан гуманизированный иммуноглобулин, который связывается с антигенной детерминантой CD52 человека, состоящей, по меньшей мере, из остатков 7, 8 и 9 последовательности зрелого CD52 человека (такие остатки представлены глутамином [Q], треонином [T] и серином [S], соответственно). В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7 (Q), 8 (T) и 11 (P) последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 (D) и 11 (P) последовательности зрелого CD52 человека.
В некоторых вариантах воплощения изобретения описан гуманизированный иммуноглобулин, связывающийся с CD52 человека и состоящий из легкой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR), или тяжелой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR), или обеих тяжелой и легкой цепи. В других вариантах воплощения изобретения описан гуманизированный иммуноглобулин, связывающийся с CD52 человека и состоящий из легкой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR), или тяжелой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR), или обеих тяжелой и легкой цепи. В еще одних вариантах воплощения изобретения описан гуманизированный иммуноглобулин, связывающийся с CD52 человека и состоящий из легкой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR), или тяжелой цепи с одним или несколькими CDR, выбираемыми из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR), или обеих тяжелой и легкой цепи.
В определенных вариантах воплощения изобретения гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130. В других вариантах воплощения изобретения гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131. В других вариантах воплощения изобретения гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132.
Гуманизированные иммуноглобулины по данному изобретению отличаются от гуманизированного иммуноглобулина Кампат®.
Аминокислотные последовательности указанных выше последовательностей SEQ ID NO: 115-132 представлены ниже и основаны на аминокислотных последовательностях, указанных в Таблицах 1-6 ниже. В таких аминокислотных последовательностях «X» обозначает любую аминокислоту, а символ «/» указывает, что любая аминокислота, рядом с которой ставится такой символ, может присутствовать в указанном месте (например, K/R обозначает, что остаток лизина или аргинина присутствует в указанном положении, а F/L/V обозначает, что в указанном положении присутствует остаток фенилаланина, лейцина или валина).
Последовательности CDR-1 легкой цепи
K/RSSQSLL/V/IXS/TN/DGXS/TYLX (SEQ ID NO: 115)
K/RSSQSLL/V/IHS/TNGXS/TYLH (SEQ ID NO: 116)
RSSQSLVHTNGNS/TYLH (SEQ ID NO: 117)
Последовательности CDR-2 легкой цепи
XVSXXXS (SEQ ID NO: 118)
XVSXRXS (SEQ ID NO: 119)
MVSXRFS (SEQ ID NO: 120)
Последовательности CDR-3 легкой цепи
XQXXH/R/KF/L/V/IXX (SEQ ID NO: 121)
SQSXH/R/KF/L/V/IPX (SEQ ID NO: 122)
SQSXHVPF/P (SEQ ID NO: 123)
Последовательности CDR-1 тяжелой цепи
GFXFXXYW/YMX (SEQ ID NO: 124)
GFTFXXYW/YMX (SEQ ID NO: 125)
GFTFTDYW/YMS (SEQ ID NO: 126)
Последовательности CDR-2 тяжелой цепи
XIRXKXBXYXTXYXXSVKG (SEQ ID NO: 127)
XIRXKXNXYTTEYXXSVKG (SEQ ID NO: 128)
FIRNKANGYTTEYXXSVKG (SEQ ID NO: 129)
Последовательности CDR-3 тяжелой цепи
TXXXY/F/W (SEQ ID NO: 130)
TRYXY/F/WFDY (SEQ ID NO: 131)
TRYIF/WFDY (SEQ ID NO: 132)
Изобретение также описывает гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR); гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR); или гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR).
Изобретение также описывает гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR).
Гуманизированные легкие цепи и гуманизированные тяжелые цепи по данному изобретению отличаются от гуманизированной легкой цепи и гуманизированной тяжелой цепи гуманизированного иммуноглобулина Кампат®.
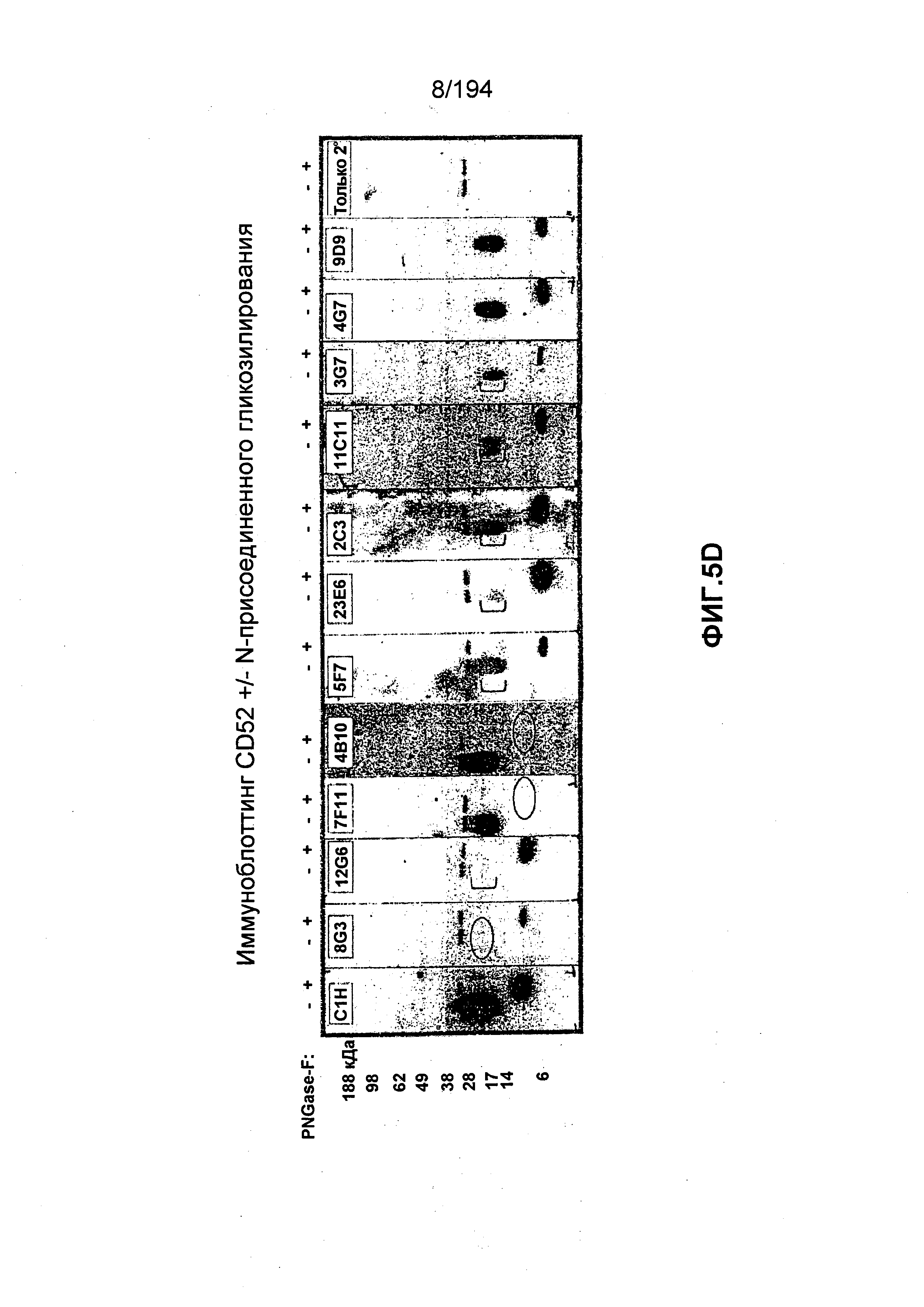
В некоторых вариантах воплощения данного изобретения гуманизированные иммуноглобулины по изобретению (независимо от того, каким образом они могут быть определены, например, независимо от того, должны ли они быть также определены относительно последовательностей одного или нескольких CDR и/или по их способности перекрестно связываться с мышиным моноклональным антителом или другим гуманизированным иммуноглобулином): (1) обладают способностью связываться с гликозилированным и дегликозилированным CD52 без видимого предпочтения; (2) обладают способностью связываться с гликозилированным CD52; (3) обладают способностью связываться с дегликозилированным CD52; или (4) обладает способностью предпочтительного связывания с дегликозилированным CD52 в сравнении с гликозилированным CD52. В определенных вариантах воплощения изобретения гуманизированные иммуноглобулины по изобретению обладают большей аффинностью связывания с гликозилированным CD52 человека в сравнении с агликозилированным или дегликозилированным CD52 человека. В определенных вариантах воплощения данного изобретения гуманизированные иммуноглобулины по данному изобретению обладают способностью специфически связываться с гликозилированным CD52 человека. Аффинность связывания с агликозилированным или дегликозилированным CD52 человека может быть определена с использованием зрелого CD52 человека, который был подвергнут дегликозилированию с использованием гликозидазы, например, с использованием эндогликозидазы PNGase-F. В определенных вариантах воплощения по данному изобретению гуманизированные иммуноглобулины по изобретению связываются с антигенной детерминантой на зрелом CD52, состоящим из N-присоединенной молекулы углевода. Такая молекула углевода представлена сиалированным, содержащим полилактозамин, тетраантеннальным N-присоединенным олигосахаридом с фукозилированным ядром (Treumann, A. et. al., (1995) J. Biol. Chem. 270:6088-6099). Такая антигенная детерминанта также может состоять из, по меньшей мере, остатка 1 последовательности зрелого CD52 человека, по меньшей мере, остатка 3 последовательности зрелого CD52 человека, по меньшей мере, остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека, или, по меньшей мере, остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения мышиные или химерные антитела по данному изобретению могут обладать любым из таких свойств связывания.
Также представлено описание изолированных молекул нуклеиновых кислот, кодирующих гуманизированный иммуноглобулин, гуманизированную легкую цепь или гуманизированную тяжелую цепь по изобретению, как это определено в тексте данной заявки. В некоторых вариантах воплощения изобретение представляет собой одну или несколько изолированных молекул, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые объединяются вместе с образованием гуманизированного иммуноглобулина, который обладает специфичностью связывания с человеческим CD52, при этом гуманизированная легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 4, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 17; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 5, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 18; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 6, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 19; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 7, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 20; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 8, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 21; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 9, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 22; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 10, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 23; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 11, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 24; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 25; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 137; или легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 13, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 26.
В некоторых вариантах воплощения изобретения описана одна или несколько изолированных молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с той же самой антигенной детерминантой на CD52 человека, что и мышиное моноклональное антитело, и состоит из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретение представлено одной или несколькими изолированными молекулами нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
В других вариантах воплощения изобретение представлено одной или несколькими изолированными молекулами нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатка 1 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 3, 4 и 5 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 2, 3, 4 и 5 зрелого CD52 человека; или гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 7, 8 и 9 зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7, 8 и 11 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 и 11 последовательности зрелого CD52 человека.
В других вариантах воплощения изобретение представлено одной или несколькими изолированными молекулами нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR).
В определенных вариантах воплощения изобретение представлено одной или несколькими изолированными молекулами нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130; легкой цепи, включающей CDR с последовательностями SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131; или легкой цепи, включающей CDR с последовательностями SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132.
Одна или несколько нуклеиновых кислот по изобретению не кодируют гуманизированный иммуноглобулин Кампат®.
В других вариантах воплощения изобретение представлено одной или несколькими изолированными молекулами нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин имеет большую аффинность связывания с гликозилированным CD52 человека, чем с агликозилированным или дегликозилированным CD52 человека, например, обладает специфичностью связывания с гликозилированным CD52 человека. Гуманизированный иммуноглобулин может связываться с антигенной детерминантой на зрелом CD52 человека, которая состоит из N-присоединенной молекулы углевода. Такая антигенная детерминанта также может состоять из, по меньшей мере, остатка 1 последовательности зрелого CD52 человека, по меньшей мере, остатка 3 последовательности зрелого CD52 человека, по меньшей мере, остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека, или, по меньшей мере, остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека.
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48 или их комбинации, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294 или их комбинации, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR); гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR); или гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR).
В других вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR).
Изобретение также описывает рекомбинантные векторы (например, векторы экспрессии, включая векторы экспрессии клеток млекопитающих), которые состоят из нуклеиновой кислоты, кодирующей гуманизированный иммуноглобулин (например, гуманизированную легкую цепь или гуманизированную тяжелую цепь), гуманизированную легкую цепь или гуманизированную тяжелую цепь по изобретению. В определенных вариантах воплощения изобретение представляет собой рекомбинантный вектор, состоящий из нуклеиновой кислоты, кодирующей гуманизированный иммуноглобулин, который состоит из легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 4, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 17; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 5, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 18; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 6, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 19; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 7, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 20; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 8, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 21; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 9, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 22; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 10, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 23; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 11, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 24; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 25; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 137; или легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 13, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 26.
В других вариантах воплощения изобретение представляет собой рекомбинантный вектор, состоящий из нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48 или их комбинации, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретение представляет собой рекомбинантный вектор, состоящий из нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294 или их комбинации, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В некоторых вариантах воплощения изобретение представляет собой рекомбинантный вектор, состоящий из молекулы нуклеиновой кислоты, или пару рекомбинантных векторов, состоящих из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с той же самой антигенной детерминантой на CD52 человека, что и мышиное моноклональное антитело, и состоит из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретение представлено рекомбинантным вектором, состоящим из молекулы нуклеиновой кислоты, или парой рекомбинантных векторов, состоящих из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, или пара рекомбинантных векторов состоит из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатка 1 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 3, 4 и 5 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 2, 3, 4 и 5 зрелого CD52 человека; или гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 7, 8 и 9 зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7, 8 и 11 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 и 11 последовательности зрелого CD52 человека.
В некоторых вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, или пара рекомбинантных векторов состоит из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR).
В определенных вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, или пара рекомбинантных векторов состоит из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130; легкой цепи, включающей CDR с последовательностями SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131; или легкой цепи, включающей CDR с последовательностями SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132.
Одна или несколько нуклеиновых кислот в рекомбинантном векторе или векторах по изобретению не кодируют гуманизированный иммуноглобулин Кампат®.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, или пара рекомбинантных векторов состоит из молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин имеет большую аффинность связывания с гликозилированным CD52 человека, чем с агликозилированным или дегликозилированным CD52 человека, например, обладает специфичностью связывания с гликозилированным CD52 человека. Гуманизированный иммуноглобулин может связываться с антигенной детерминантой на зрелом CD52 человека, которая включает N-присоединенную молекулу углевода. Такая антигенная детерминанта также может состоять из, по меньшей мере, остатка 1 последовательности зрелого CD52 человека, по меньшей мере, остатка 3 последовательности зрелого CD52 человека, по меньшей мере, остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека, или, по меньшей мере, остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека.
В других вариантах воплощения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR); гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR); или гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR), при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из молекулы нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR), при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В отдельных вариантах воплощения изобретения рекомбинантный вектор по изобретению представлен вектором экспрессии, таким как вектор экспрессии клетки млекопитающего. В определенных вариантах воплощения изобретения вектор представлен плазмидой или вектором вируса (например, вектором аденовируса или вектором аденосателлитного вируса).
Изобретение также описывает клетку-хозяина, которая включает одну или несколько нуклеиновых кислот (например, рекомбинантных), кодирующих гуманизированный иммуноглобулин (гуманизированную легкую цепь и гуманизированную тяжелую цепь), гуманизированную легкую цепь или гуманизированную тяжелую цепь по изобретению. В некоторых вариантах воплощения изобретения клетка-хозяин состоит из рекомбинантного вектора (например, вектора экспрессии, включая векторы экспрессии клетки млекопитающего) по изобретению.
В отдельных вариантах воплощения изобретения клетка-хозяин включает нуклеиновую кислоту (одну или несколько нуклеиновых кислот), кодирующую гуманизированную легкую цепь и гуманизированную тяжелую цепь, которые объединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с человеческим CD52, при этом гуманизированный иммуноглобулин состоит из легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 4, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 17; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 5, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 18; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 6, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 19; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 7, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 20; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 8, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 21; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 9, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 22; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 10, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 23; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 11, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 24; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 25; легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 137; или легкая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 13, а тяжелая цепь состоит из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 26.
В некоторых вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с той же самой антигенной детерминантой на CD52 человека, что и мышиное моноклональное антитело, и состоит из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
В других вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатка 1 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 3, 4 и 5 зрелого CD52 человека; гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 2, 3, 4 и 5 зрелого CD52 человека; или гуманизированный иммуноглобулин связывается с антигенной детерминантой, состоящей, по меньшей мере, из остатков 7,8 и 9 зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7, 8 и 11 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 и 11 последовательности зрелого CD52 человека.
В некоторых вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130 (например, всех трех указанных CDR); легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131 (например, всех трех указанных CDR); или легкой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123 (например, всех трех указанных CDR), и/или тяжелой цепи, включающей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132 (например, всех трех указанных CDR).
В некоторых вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин состоит из легкой цепи, включающей CDR с последовательностями SEQ ID NO: 115, SEQ ID NO: 118 и SEQ ID NO: 121, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 124, SEQ ID NO: 127 и SEQ ID NO: 130; легкой цепи, включающей CDR с последовательностями SEQ ID NO: 116, SEQ ID NO: 119 и SEQ ID NO: 122, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 125, SEQ ID NO: 128 и SEQ ID NO: 131; или легкой цепи, включающей CDR с последовательностями SEQ ID NO: 117, SEQ ID NO: 120 и SEQ ID NO: 123, и тяжелой цепи, включающей CDR с последовательностями SEQ ID NO: 126, SEQ ID NO: 129 и SEQ ID NO: 132.
В других вариантах воплощения изобретения клетка-хозяин включает одну или несколько молекул нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь и гуманизированную легкую цепь, которые соединяются вместе с образованием гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом гуманизированный иммуноглобулин имеет большую аффинность связывания с гликозилированным CD52 человека, чем с агликозилированным или дегликозилированным CD52 человека, например, обладает специфичностью связывания с гликозилированным CD52 человека. Гуманизированный иммуноглобулин может связываться с антигенной детерминантой на зрелом CD52 человека, которая включает N-присоединенную молекулу углевода. Такая антигенная детерминанта также может состоять из, по меньшей мере, остатка 1 последовательности зрелого CD52 человека, по меньшей мере, остатка 3 последовательности зрелого CD52 человека, по меньшей мере, остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека, или, по меньшей мере, остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека.
В некоторых вариантах воплощения изобретения клетка-хозяин включает молекулу нуклеиновой кислоты, кодирующей гуманизированную легкую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13. Гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретения клетка-хозяин включает молекулу нуклеиновой кислоты, кодирующей гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137. Гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
В некоторых вариантах воплощения изобретения клетка-хозяин включает нуклеиновую кислоту, кодирующую гуманизированную легкую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48 или их комбинации, при этом гуманизированная легкая цепь не является гуманизированной легкой цепью антитела Кампат®.
В других вариантах воплощения изобретения клетка-хозяин включает нуклеиновую кислоту, кодирующую гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294 или их комбинации, при этом гуманизированная тяжелая цепь не является гуманизированной тяжелой цепью антитела Кампат®.
Изобретение также описывает способ получения гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, и такой способ заключается в содержании клетки-хозяина (например, клетки-хозяина, которая включает одну или несколько рекомбинантных нуклеиновых кислот, кодирующих гуманизированный иммуноглобулин по изобретению (например, гуманизированную легкую цепь и гуманизированную тяжелую цепь по изобретению)) в условиях, подходящих для экспрессии гуманизированного иммуноглобулина, при этом цепи гуманизированного иммуноглобулина экспрессируются с последующей выработкой гуманизированного иммуноглобулина. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение гуманизированного иммуноглобулина. В некоторых вариантах воплощения изобретения способ дополнительно состоит из комбинирования очищенного или выделенного гуманизированного иммуноглобулина с физиологически приемлемой основой или носителем для получения фармацевтической композиции.
Изобретение также описывает способ получения гуманизированной легкой цепи, которая обладает специфичностью связывания с CD52 человека, и такой способ заключается в содержании клетки-хозяина по изобретению (например, клетки-хозяина, которая содержит одну или несколько рекомбинантных нуклеиновых кислот, кодирующих гуманизированную легкую цепь по изобретению) в условиях, подходящих для экспрессии гуманизированной легкой цепи, вследствие чего экспрессируется гуманизированная легкая цепь и вырабатывается гуманизированная легкая цепь. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение гуманизированной легкой цепи.
Изобретение также описывает способ получения гуманизированной тяжелой цепи, которая обладает специфичностью связывания с CD52 человека, и такой способ заключается в содержании клетки-хозяина по изобретению (например, клетки-хозяина, которая содержит одну или несколько рекомбинантных нуклеиновых кислот, кодирующих гуманизированную тяжелую цепь по изобретению) в условиях, подходящих для экспрессии гуманизированной тяжелой цепи, вследствие чего экспрессируется гуманизированная тяжелая цепь и вырабатывается гуманизированная тяжелая цепь. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение гуманизированной тяжелой цепи.
Изобретение дополнительно описывает фармацевтическую композицию, состоящую из гуманизированного иммуноглобулина по изобретению (например, состоящего из гуманизированной легкой цепи по изобретению и/или гуманизированной тяжелой цепи по изобретению) и физиологически приемлемой основы или носителя. В некоторых вариантах воплощения изобретения фармацевтическая композиция представлена композицией стандартной дозы.
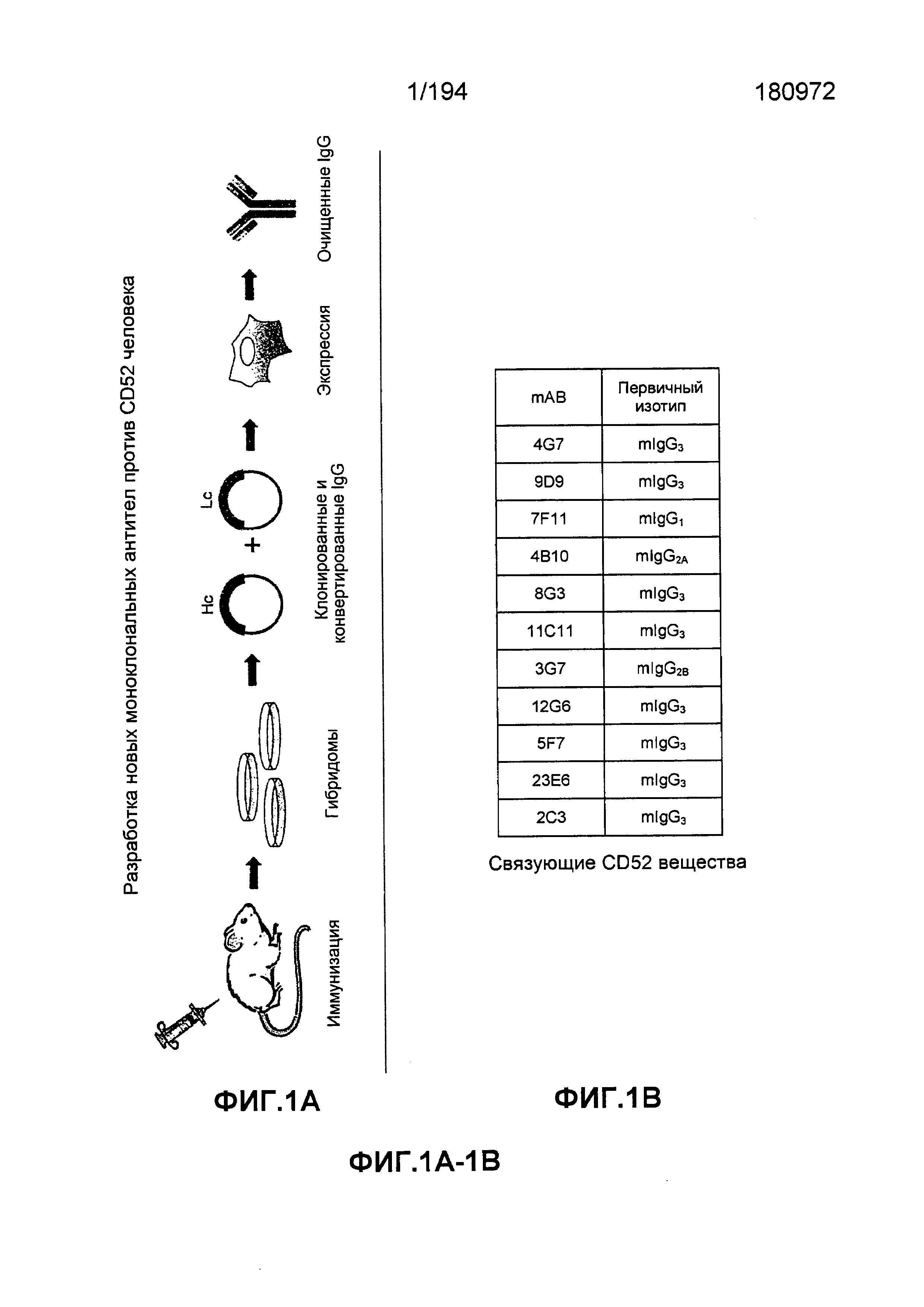
Изобретение также описывает способ получения гибридомы, секретирующей моноклональное антитело, обладающее специфичностью связывания с CD52 человека, и такой способ состоит в введении лимфоцитов мыши, трансгенной относительно CD52 человека, нетрансгенной мыши такого же или подобного штамма (например, CD1), что и трансгенные относительно CD52 мыши, что позволяет получить иммунизированную, нетрансгенную мышь. Спленоциты иммунизированной нетрансгенной мыши сливают с иммортализированными клетками, получая гибридому. Гибридома содержится в условиях, при которых она способна секретировать моноклональное антитело, обладающее специфичностью связывания с CD52 человека. В некоторых вариантах воплощения изобретения для определения гибридомы, которая секретирует моноклональное антитело, обладающее специфичностью связывания с CD52 человека, используется FACS анализ. В других вариантах воплощения изобретения штамм трансгенной мыши и штамм нетрансгенной мыши идентичны. В определенных вариантах воплощения изобретения CD52 представлен человеческим CD52 дикого типа. В некоторых вариантах воплощения изобретения CD52-трансгенная мышь и CD52-нетрансгенная мышь представлены мышами CD1. В некоторых вариантах воплощения изобретения лимфоциты, используемые для иммунизации, получают из селезенки мыши, трансгенной относительно CD52 человека. В некоторых вариантах воплощения изобретения иммортализированные клетки выбирают из группы последовательностей, включающей клетки SP2/0 Ag14 и клетки миеломы NS1. Изобретение также описывает гибридому, получаемую с использованием способов по изобретению. В некоторых случаях моноклональное антитело, секретируемое гибридомой, собирается и может быть подвергнуто дальнейшей очистке (например, быть по существу очищенным, выделенным). В других вариантах воплощения изобретения способ дополнительно состоит из определения нуклеотидной последовательности моноклонального антитела, секретируемого гибридомой.
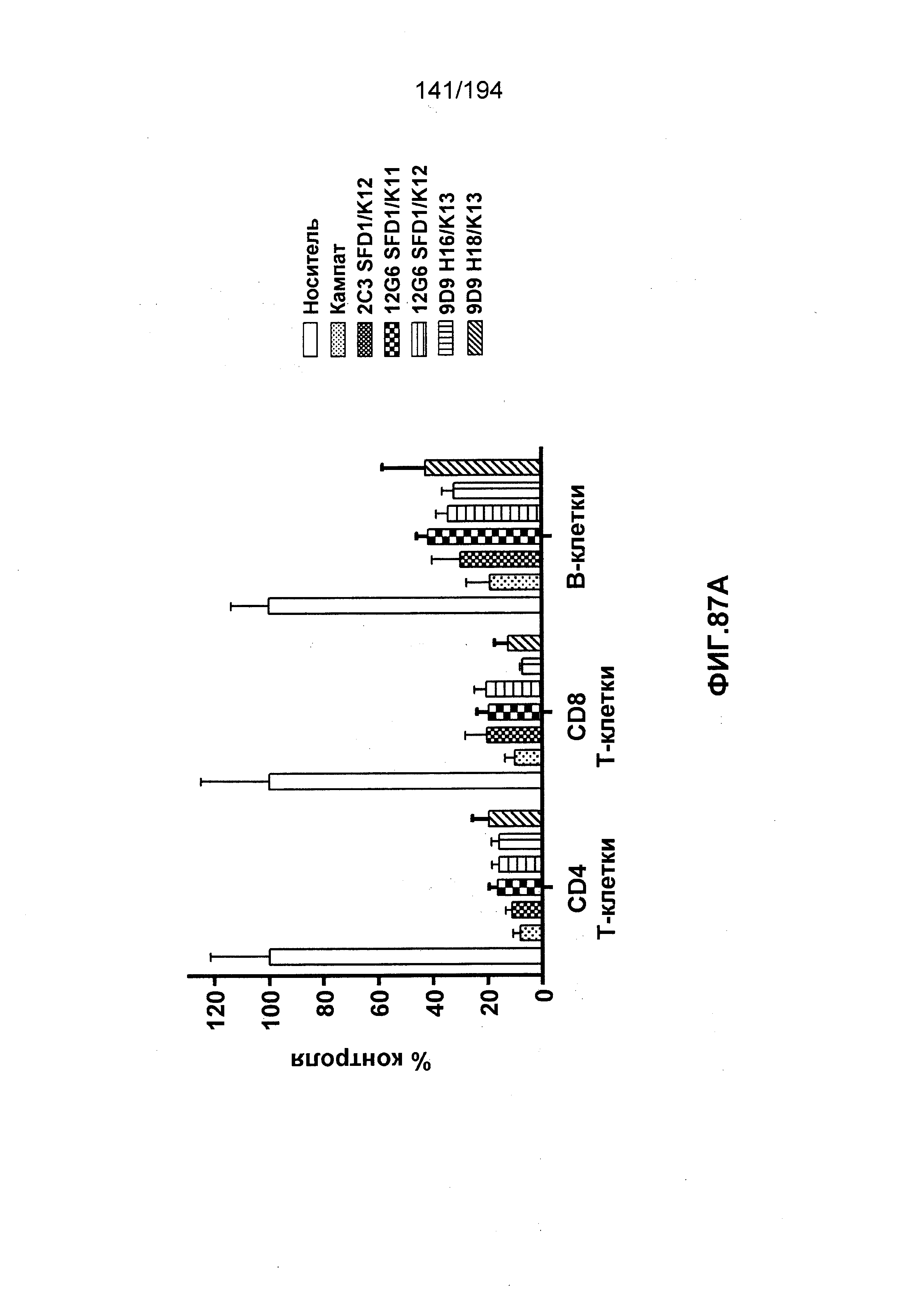
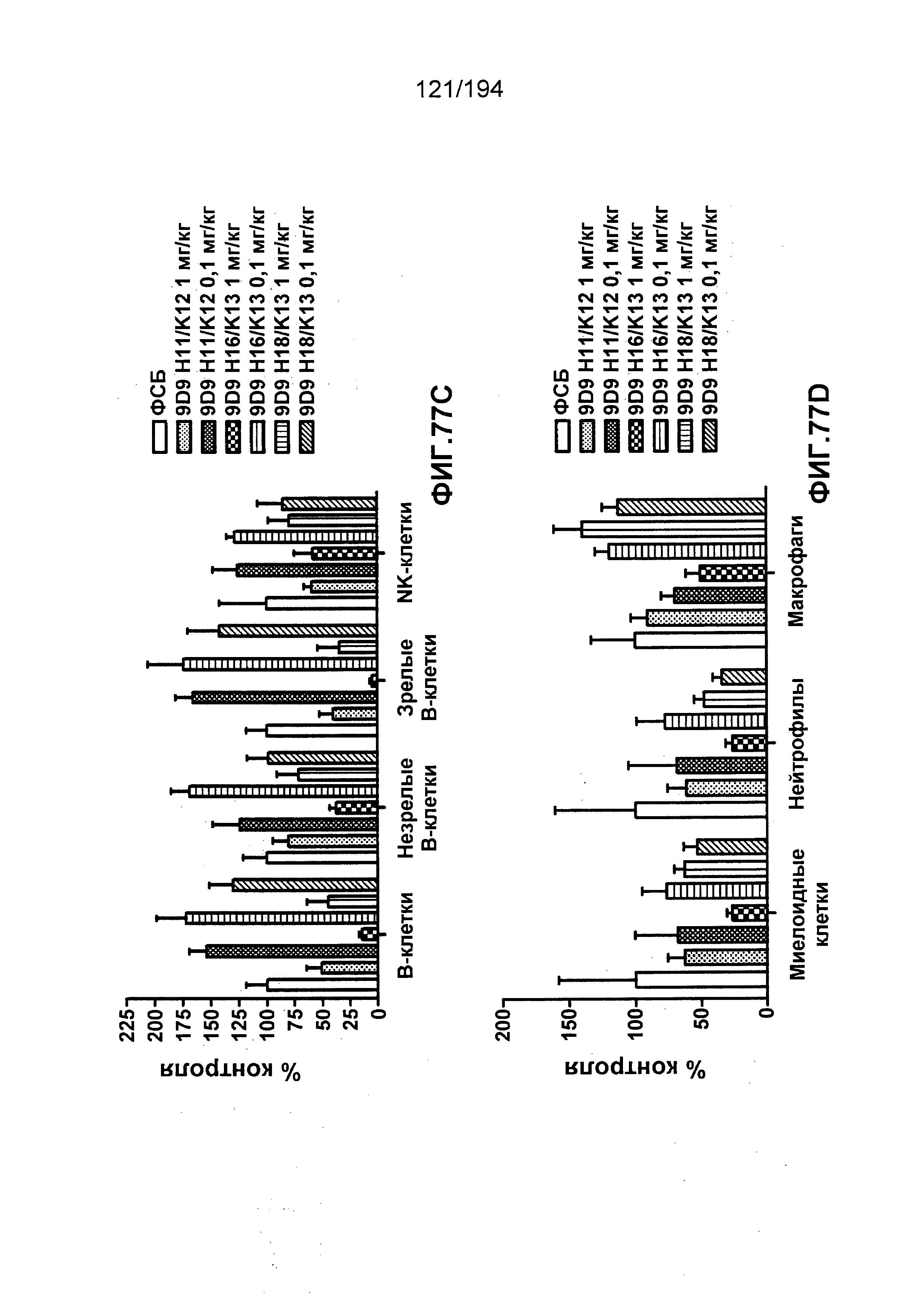
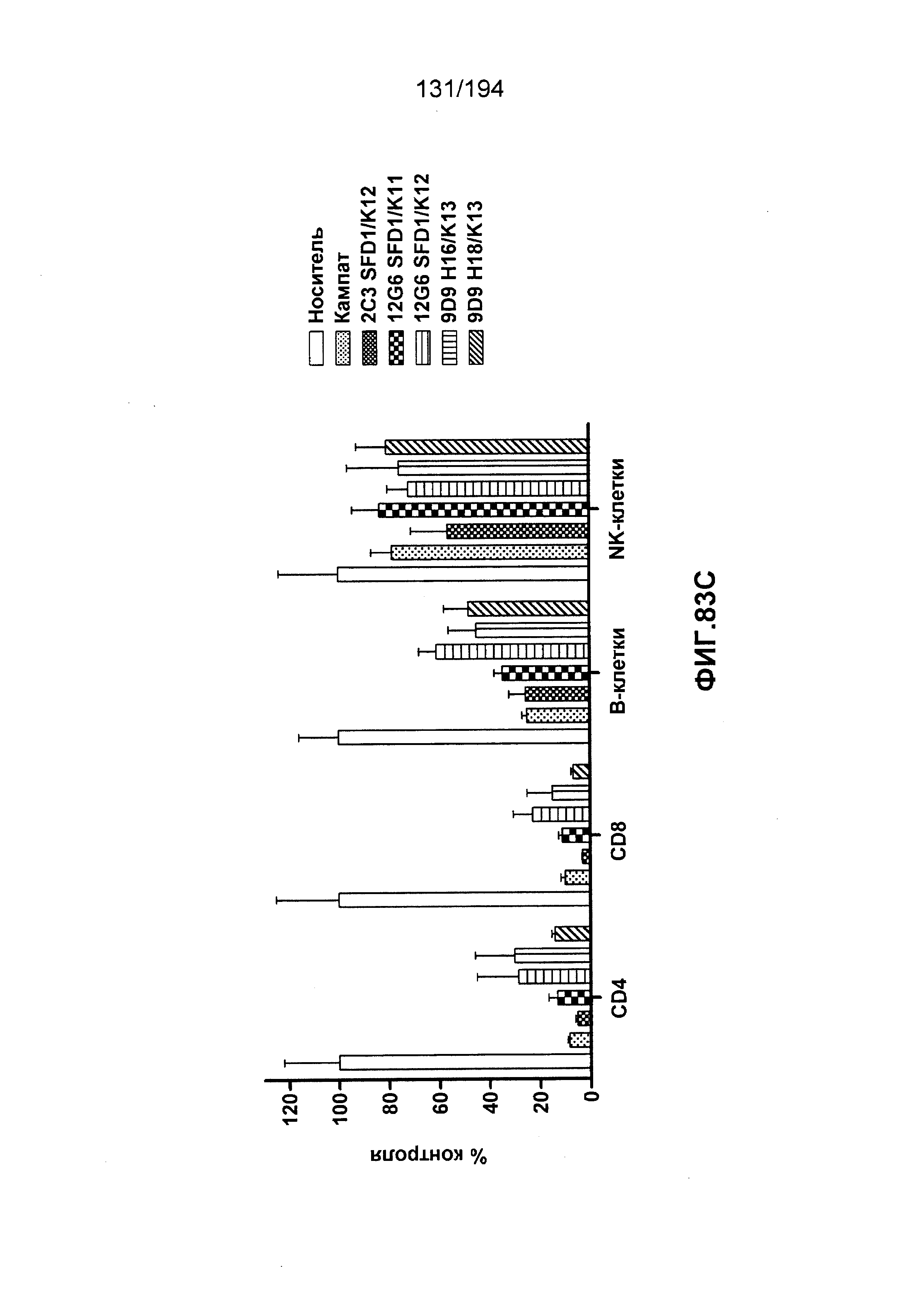
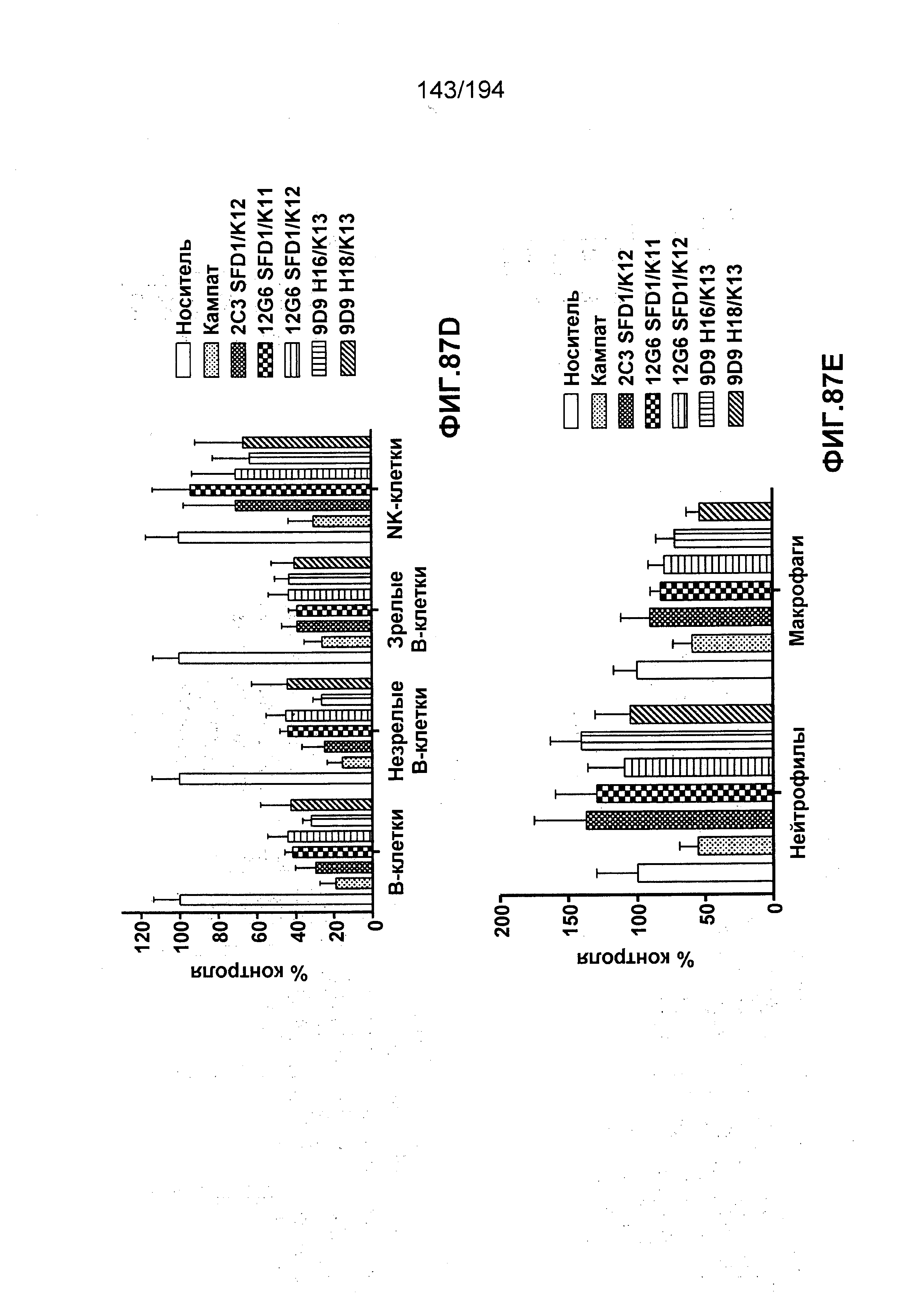
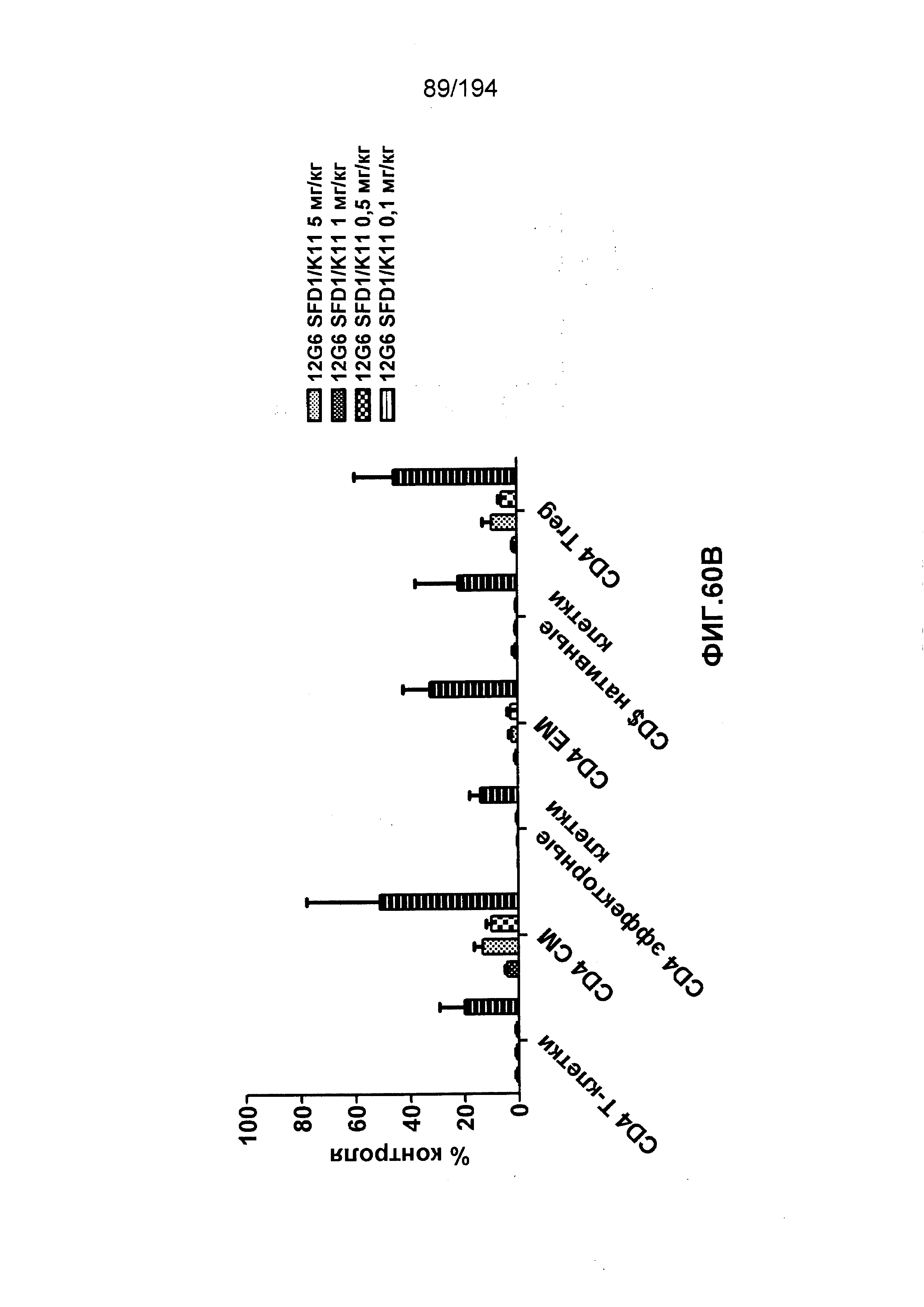
Изобретение также описывает способ лечения аутоиммунного заболевания (например, рассеянного склероза (РС), ревматоидного артрита (РА)) (см., например, Nature Reviews Drug Discovery 6: 75-92 (2007)), васкулита (см., например, Rheumatology 39:229-237 (2000)), болезнь Бехчета (ББ) (см., например, Rheumatology 42:1539-1544 (2003)), волчанки и глютеновой болезни (Vivas, S., et. al., N. Engl. J. Med., 354(23):2514-2515 (2006)), васкулита, псориаза, миозита, склеродермы, апластической анемии и колита) у пациента, нуждающегося в таком лечении, и такой способ заключается в введении пациенту эффективного количества гуманизированного иммуноглобулина по изобретению.
В другом аспекте изобретения эффективное количество гуманизированного иммуноглобулина по изобретению может быть введено в сочетании с одним или несколькими иммуносупрессивными препаратами для подготовки нуждающегося в этом пациента к трансплантации солидного органа (Agarwal et. al., Transplant Immunol., 20:6-11 (2008)) или трансплантации стволовых клеток CD34+ (Burt et. al., The Lancet, опубликовано в Интернет 30 января 2009 г.).
Изобретение также описывает способ лечения рака у пациента, нуждающегося в таком лечении, и такой способ состоит в введении пациенту эффективного количества гуманизированного иммуноглобулина по изобретению.
Изобретение также описывает способ лечения рассеянного склероза у пациента, нуждающегося в таком лечении, и такой способ состоит в введении пациенту эффективного количества гуманизированного иммуноглобулина по изобретению.
Изобретение также описывает способ лечения хронического лимфоцитарного лейкоза у пациента, нуждающегося в таком лечении, и такой способ состоит в введении пациенту эффективного количества гуманизированного иммуноглобулина по изобретению.
Введение гуманизированного иммуноглобулина по данному изобретению может состоять из введения гуманизированного иммуноглобулина per se (например, в фармацевтической композиции), введения одного или нескольких рекомбинантных векторов, кодирующих гуманизированный иммуноглобулин, или введения клетки-хозяина, которая содержит одну или несколько нуклеиновых кислот (например, один или несколько рекомбинантных векторов), кодирующих гуманизированные иммуноглобулины, и экспрессирует гуманизированный иммуноглобулин.
Изобретение также описывает способ диагностики заболевания, выбираемого из группы последовательностей, включающей аутоиммунные заболевания (например, рассеянный склероз, волчанка, васкулит), рак (например, лейкозы (например, хронический лимфоцитарный лейкоз) и лимфомы (например, неходжкинская лимфома)), трансплантаты (например, трансплантаты солидных органов (например, трансплантат почки) и трансплантаты стволовых клеток), и такой способ состоит в анализе образца пациента in vitro с использованием гуманизированного иммуноглобулина по изобретению.
Изобретение также описывает гуманизированный иммуноглобулин по изобретению (например, состоящий из гуманизированной легкой цепи по изобретению и/или гуманизированной тяжелой цепи по изобретению), рекомбинантный вектор по изобретению или клетку-хозяин по изобретению для использования в медицине, например, для использования в лечении и/или диагностике заболевания, например, для лечения описанного заболевания или расстройства, такого как аутоиммунное заболевание (например, рассеянный склероз), рак, лимфоцитарное гиперпролиферативное состояние (например, Т- или В-злокачественные новообразования, включая лейкоз, такой как В-клеточный хронический лимфоцитарный лейкоз, и лимфомы, такие как неходжкинская лимфома). См., например, Lundin, J., et. al., Blood, 101:4267-4272 (2003); Rodig, SJ., et. al., Clinical Cancer Research, 12(23):7174-7179 (2006). Изобретение также описывает использование гуманизированного иммуноглобулина, гуманизированной легкой цепи или гуманизированной тяжелой цепи по изобретению, рекомбинантного вектора по изобретению или клетку-хозяина по изобретению для производства лекарственного препарата для лечения заболевания или нарушения, описанного в данной заявке (например, аутоиммунных заболеваний (например, рассеянного склероза, волчанки, васкулита), рака (например, лейкозов (например, хронического лимфоцитарного лейкоза) и лимфом (например, неходжкинской лимфомы)), а также трансплантатов (например, трансплантата солидного органа (например, трансплантата почки) и трансплантата стволовой клетки)).
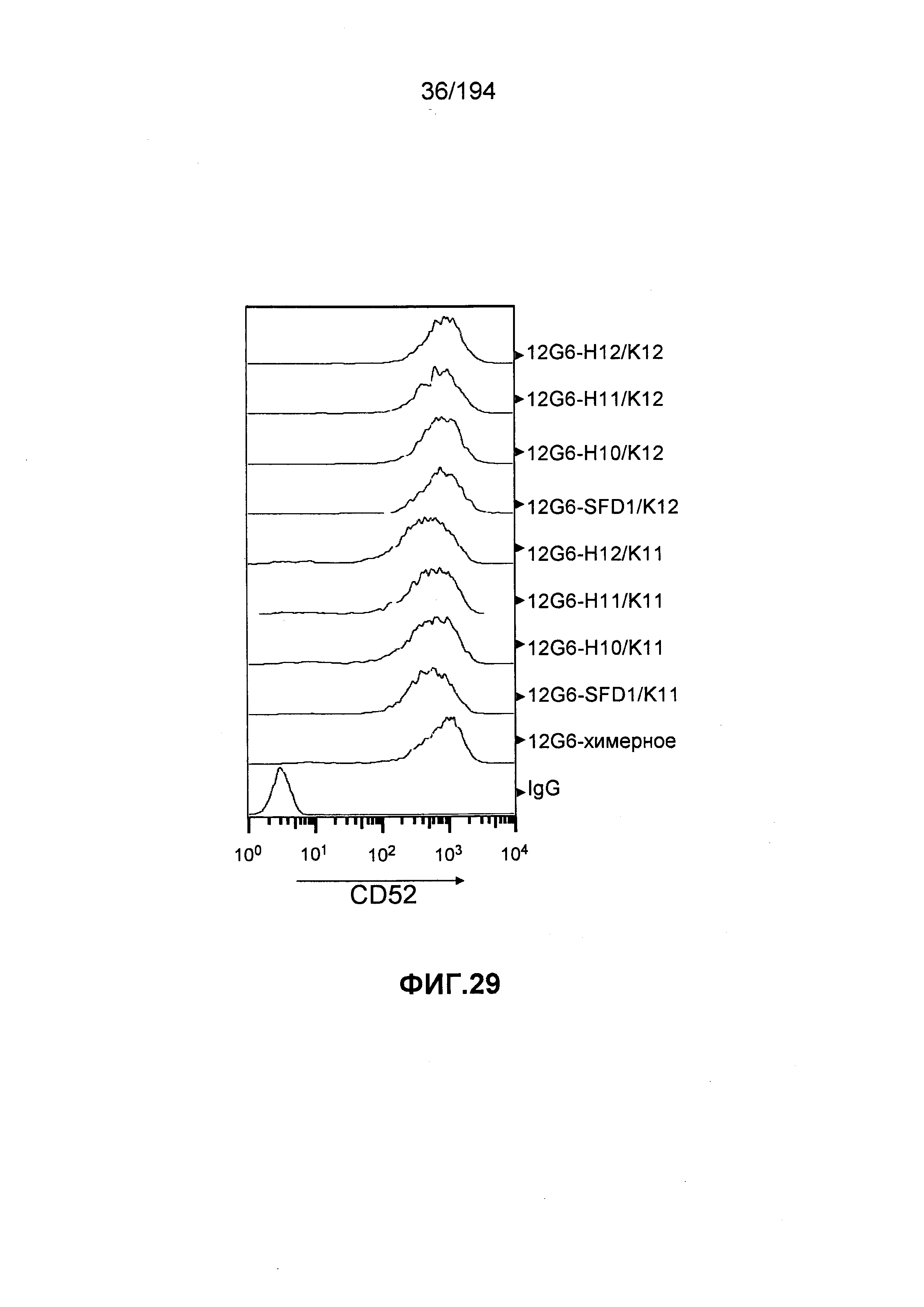
Изобретение дополнительно описывает гуманизированные антитела к CD52 человека, состоящие из каркасных участков легкой цепи человека при использовании гена человека Vk2-A18b, в котором остатки 36 (Y) и 46 (L) (нумерация по Kabat) были замещены. В некоторых вариантах воплощения изобретения остаток 36 представлен V или L и остаток 46 представлен R. Изобретение также описывает гуманизированные антитела к CD52 человека, состоящие из каркасных участков тяжелой цепи человека при использовании гена человека VH 3-23, в котором остаток 47 (W) (нумерация по Kabat) был замещен. В некоторых вариантах воплощения изобретения замещено оба остатка 47 (W) и 49 (S) (нумерация по Kabat). В некоторых вариантах воплощения изобретения остаток 47 представлен L и остаток 49 представлен S. В некоторых вариантах воплощения изобретения остаток 47 представлен L и остаток 49 представлен А.
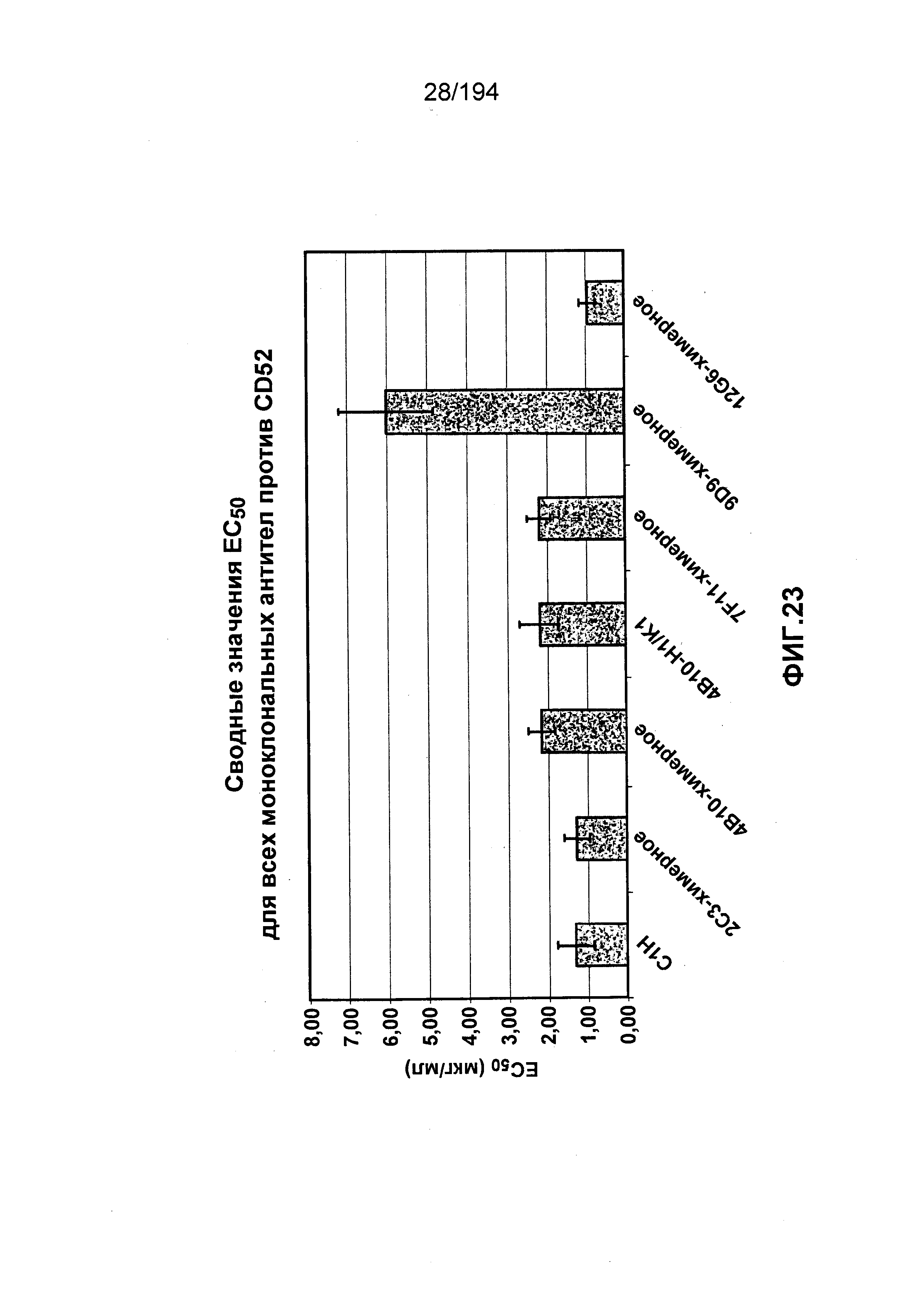
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека имеет значение EC50 (как это определено в ходе анализа связывания клеток, описанного в Примере 29), которое в два раза меньше значения EC50 для антитела Кампат-1Н®. В различных вариантах воплощения изобретения гуманизированное антитело к CD52 человека имеет значение EC50, равное 11 нМ или менее.
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека по изобретению связывается с CD52 на клетках в присутствии антител к Кампату-1H® из сыворотки пациента-человека, который был подвергнут лечению Кампатом-1H®. Таким образом, связывание гуманизированного антитела к CD52 человека по изобретению на клетках не снижается в присутствии таких антител к Кампату-1H® в сравнении со связыванием Кампата-1H® с CD52, или более снижено в присутствии таких антител к Кампату-1H® в сравнении со связыванием Кампата-1H® с CD52.
Изобретение дополнительно описывает гуманизированные антитела к CD52 человека с профилем снижения количества лимфоцитов в крови и/или селезенке описанных здесь гуманизированных антител к CD52 человека.
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека по изобретению повышает циркулирующий уровень одного или нескольких ФНО-альфа, ИЛ-6 и MCP-1 в сыворотке пациента.
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека по изобретению снижает уровни лимфоцитов у пациента в течение, по меньшей мере, 30 дней, по меньшей мере, 50 дней, по меньшей мере, 60 дней, по меньшей мере, 70 дней, по меньшей мере, 80 дней или более чем 80 дней.
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека по изобретению замедляет возникновение заболевания и/или снижает степень тяжести заболевания, как это измерено по клинической шкале на модели мышей EAE.
В некоторых вариантах воплощения изобретения гуманизированное антитело к CD52 человека по изобретению менее иммуногенно, чем Кампат-1H®, в ходе анализа иммуногенности, такого как анализ, описанный в Примере 69 или 70.
Мышиные моноклональные иммуноглобулины
Изобретение также описывает мышиные моноклональные антитела (мышиные моноклональные иммуноглобулины), обладающие специфичностью связывания с CD52 человека. В одном варианте воплощения изобретение описывает мышиное моноклональное антитело, обладающее специфичностью связывания с CD52 человека, которое состоит из легкой цепи с последовательностью SEQ ID NO: 3 и тяжелой цепи с последовательностью SEQ ID NO: 16; легкой цепи с последовательностью SEQ ID NO: 4 и тяжелой цепи с последовательностью SEQ ID NO: 17; легкой цепи с последовательностью SEQ ID NO: 5 и тяжелой цепи с последовательностью SEQ ID NO: 18; легкой цепи с последовательностью SEQ ID NO: 6 и тяжелой цепи с последовательностью SEQ ID NO: 19; легкой цепи с последовательностью SEQ ID NO: 7 и тяжелой цепи с последовательностью SEQ ID NO: 20; легкой цепи с последовательностью SEQ ID NO: 8 и тяжелой цепи с последовательностью SEQ ID NO: 21; легкой цепи с последовательностью SEQ ID NO: 9 и тяжелой цепи с последовательностью SEQ ID NO: 22; легкой цепи с последовательностью SEQ ID NO: 10 и тяжелой цепи с последовательностью SEQ ID NO: 23; легкой цепи с последовательностью SEQ ID NO: 11 и тяжелой цепи с последовательностью SEQ ID NO: 24; легкой цепи с последовательностью SEQ ID NO: 12 и тяжелой цепи с последовательностью SEQ ID NO: 25; или легкой цепи с последовательностью SEQ ID NO: 13 и тяжелой цепи с последовательностью SEQ ID NO: 26.
В одном варианте воплощения изобретения мышиное моноклональное антитело, обладающее специфичностью связывания с CD52 человека, состоит из вариабельного участка легкой цепи, выбираемой из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, или вариабельного участка тяжелой цепи, выбираемой из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26; или вариабельных участков легкой и вариабельных участков тяжелой цепи.
Изобретение также описывает легкую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
Изобретение также описывает тяжелую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
Преимущественно, мышиные моноклональные антитела по данному изобретению состоят из легкой цепи мышиного антитела по изобретению и тяжелой цепи мышиного антитела по изобретению. В одних вариантах воплощения изобретения описан мышиный моноклональный иммуноглобулин, связывающийся с той же самой антигенной детерминантой на CD52 человека, что и мышиное моноклональное антитело, состоящий из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретение описывает мышиный моноклональный иммуноглобулин, который связывается с антигенной детерминантой на CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
В других вариантах воплощения изобретения описан мышиный моноклональный иммуноглобулин, который связывается с антигенной детерминантой на CD52 человека, состоящий, по меньшей мере, из остатка 1 последовательности зрелого CD52 человека. Мышиный моноклональный иммуноглобулин может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатка 1, 3, 4 и 5 последовательности зрелого CD52 человека, может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатка 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека, или может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатка 7, 8 и 9 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7, 8 и 11 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 и 11 последовательности зрелого CD52 человека.
Изобретение также описывает выделенные молекулы нуклеиновой кислоты, которые кодируют мышиные моноклональные иммуноглобулины, легкие цепи мышиного иммуноглобулина или тяжелые цепи мышиного иммуноглобулина по изобретению. В некоторых вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты, кодирующей тяжелую цепь мышиного иммуноглобулина и легкую цепь мышиного иммуноглобулина, которые объединяются вместе для образования мышиного моноклонального иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом легкая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, или тяжелая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, или обеих таких легкой цепи и тяжелой цепи.
В некоторых вариантах воплощения изобретения выделенная нуклеиновая кислота кодирует легкую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13.
В других вариантах воплощения изобретения выделенная нуклеиновая кислота кодирует тяжелую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
Изобретение также описывает рекомбинантные векторы (например, векторы экспрессии, включая векторы экспрессии клеток млекопитающих), которые состоят из нуклеиновой кислоты, кодирующей мышиный моноклональный иммуноглобулин (например, легкую цепь мышиного иммуноглобулина или тяжелую цепь мышиного иммуноглобулина), легкую цепь мышиного иммуноглобулина или тяжелую цепь мышиного иммуноглобулина по изобретению. В некоторых вариантах воплощения изобретение представлено рекомбинантным вектором, состоящим из нуклеиновой кислоты, или парой рекомбинантных векторов, состоящих из нуклеиновых кислот, кодирующих мышиный иммуноглобулин, состоящий из вариабельного участка легкой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, или вариабельного участка тяжелой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, или обоих таких вариабельных участков легкой цепи и вариабельных участков тяжелой цепи.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из нуклеиновой кислоты, кодирующей легкую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из нуклеиновой кислоты, кодирующей тяжелую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из нуклеиновой кислоты, кодирующей легкую цепь мышиного иммуноглобулина и тяжелую цепь мышиного иммуноглобулина, при этом легкая цепь мышиного иммуноглобулина и тяжелая цепь мышиного иммуноглобулина объединяются вместе с образованием мышиного моноклонального иммуноглобулина, обладающего специфичностью связывания с CD52 человека. В одном варианте воплощения изобретения легкая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, а тяжелая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
В отдельных вариантах воплощения изобретения рекомбинантный вектор по изобретению представлен вектором экспрессии, таким как вектор экспрессии клетки млекопитающего. В определенных вариантах воплощения изобретения вектор представлен плазмидой или вектором вируса (например, вектором аденовируса или вектором аденосателлитного вируса).
Изобретение также описывает клетку-хозяина, которая состоит из одной или нескольких нуклеиновых кислот, кодирующих мышиный моноклональный иммуноглобулин (легкую цепь мышиного иммуноглобулина и тяжелую цепь мышиного иммуноглобулина), легкую цепь мышиного иммуноглобулина или тяжелую цепь мышиного иммуноглобулина по изобретению. Например, в некоторых вариантах воплощения изобретения клетка-хозяин состоит из рекомбинантного вектора (например, вектора экспрессии, вектора экспрессии клетки млекопитающего) по изобретению.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит нуклеиновую кислоту, кодирующую легкую цепь мышиного иммуноглобулина и тяжелую цепь мышиного иммуноглобулина, при этом легкая цепь мышиного иммуноглобулина и тяжелая цепь мышиного иммуноглобулина объединяются вместе с образованием мышиного моноклонального иммуноглобулина, обладающего специфичностью связывания с CD52 человека; легкая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и/или тяжелая цепь мышиного иммуноглобулина состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, или обоих вариабельных участков.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит нуклеиновую кислоту, кодирующую легкую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит нуклеиновую кислоту, кодирующую тяжелую цепь мышиного иммуноглобулина, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
Изобретение также описывает способ получения мышиного моноклонального иммуноглобулина, состоящий в содержании клетки-хозяина по изобретению (например, клетки-хозяина, содержащей одну или несколько рекомбинантных нуклеиновых кислот (например, рекомбинантных векторов), кодирующих мышиный моноклональный иммуноглобулин (например, легкую цепь мышиного иммуноглобулина и тяжелую цепь мышиного иммуноглобулина) по изобретению) в условиях, подходящих для экспрессии мышиного моноклонального иммуноглобулина, при этом экспрессируются цепи мышиного моноклонального иммуноглобулина, после чего образуется мышиный моноклональный иммуноглобулин. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение мышиного моноклонального иммуноглобулина.
Изобретение также описывает способ получения легкой цепи мышиного моноклонального иммуноглобулина, состоящий из содержания клетки-хозяина по изобретению, включающую нуклеиновую кислоту, кодирующую легкую цепь мышиного иммуноглобулина по изобретению, в условиях, подходящих для экспрессии указанной легкой цепи мышиного иммуноглобулина, в результате чего экспрессируется указанная легкая цепь. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение легкой цепи.
Изобретение также описывает способ получения тяжелой цепи мышиного моноклонального иммуноглобулина, состоящий из содержания клетки-хозяина по изобретению, включающую нуклеиновую кислоту, кодирующую тяжелую цепь мышиного иммуноглобулина по изобретению, в условиях, подходящих для экспрессии указанной тяжелой цепи мышиного иммуноглобулина, в результате чего экспрессируется указанная тяжелая цепь. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение тяжелой цепи мышиного иммуноглобулина.
Изобретение также описывает способ диагностики заболевания (например, аутоиммунные заболевания (например, рассеянный склероз, волчанку, васкулит), рак (например, лейкозы (например, хронический лимфоцитарный лейкоз) и лимфомы (например, неходжкинская лимфома)) и трансплантат (например, трансплантат солидного органа (например, трансплантат почки) и трансплантат стволовой клетки)), состоящий в оценке образца пациента in vitro с использованием мышиного моноклонального антитела по изобретению (например, Lundin, J., et. al., Blood, 101:4267-4272 (2003); Rodig, SJ, et. al., Clin. Cancer res., 12(23);7174-717179 (2006)).
Химерные иммуноглобулины
Изобретение также описывает химерные иммуноглобулины, обладающие специфичностью связывания с CD52 человека. Такие химерные иммуноглобулины могут включать вариабельные участки любого мышиного моноклонального иммуноглобулина по изобретению. В одном варианте воплощения изобретения химерный иммуноглобулин по изобретению состоит из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26.
Изобретение также описывает химерное антитело, обладающее специфичностью связывания с CD52 человека и состоящее из последовательности вариабельного участка легкой цепи, выбираемой из группы последовательностей, включающей следующее: вариабельный участок легкой цепи SEQ ID NO: 3, вариабельный участок легкой цепи SEQ ID NO: 4, вариабельный участок легкой цепи SEQ ID NO: 5, вариабельный участок легкой цепи SEQ ID NO: 6, вариабельный участок легкой цепи SEQ ID NO: 7, вариабельный участок легкой цепи SEQ ID NO: 8, вариабельный участок легкой цепи SEQ ID NO: 9, вариабельный участок легкой цепи SEQ ID NO: 10, вариабельный участок легкой цепи SEQ ID NO: 11, вариабельный участок легкой цепи SEQ ID NO: 12 и вариабельный участок легкой цепи SEQ ID NO: 13, и/или последовательности вариабельного участка тяжелой цепи, выбираемой из группы последовательностей, включающей следующее: вариабельный участок тяжелой цепи SEQ ID NO: 16, вариабельный участок тяжелой цепи SEQ ID NO: 17, вариабельный участок тяжелой цепи SEQ ID NO: 18, вариабельный участок тяжелой цепи SEQ ID NO: 19, вариабельный участок тяжелой цепи SEQ ID NO: 20, вариабельный участок тяжелой цепи SEQ ID NO: 21, вариабельный участок тяжелой цепи SEQ ID NO: 22, вариабельный участок тяжелой цепи SEQ ID NO: 23, вариабельный участок тяжелой цепи SEQ ID NO: 24, вариабельный участок тяжелой цепи SEQ ID NO: 25 и вариабельный участок тяжелой цепи SEQ ID NO: 26.
Изобретение также описывает легкую цепь химерного иммуноглобулина, состоящую из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13.
Изобретение также описывает тяжелую цепь химерного иммуноглобулина, состоящую из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
Преимущественно, химерные иммуноглобулины по данному изобретению состоят из химерной легкой цепи по изобретению и химерной тяжелой цепи по изобретению.
В одних вариантах воплощения изобретения описан химерный иммуноглобулин, связывающийся с той же самой антигенной детерминантой на CD52 человека, что и мышиное моноклональное антитело, состоящий из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26. В других вариантах воплощения изобретения химерный иммуноглобулин связывается с антигенной детерминантой на CD52 человека, которая перекрывается с антигенной детерминантой, с которой связывается мышиное моноклональное антитело.
В других вариантах воплощения изобретения описан химерный иммуноглобулин, который связывается с антигенной детерминантой на CD52 человека, состоящий, по меньшей мере, из остатка 1 последовательности зрелого CD52 человека. Химерный иммуноглобулин может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 3, 4 и 5 последовательности зрелого CD52 человека, может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатков 1, 2, 3, 4 и 5 последовательности зрелого CD52 человека, или может связываться с антигенной детерминантой, состоящей, по меньшей мере, из остатков 7, 8 и 9 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 7, 8 и 11 последовательности зрелого CD52 человека. В некоторых вариантах воплощения изобретения антигенная детерминанта состоит, по меньшей мере, из остатков 4 и 11 последовательности зрелого CD52 человека.
Изобретение также описывает выделенные молекулы нуклеиновой кислоты, которые кодируют химерные иммуноглобулины, легкие цепи химерного иммуноглобулина или тяжелые цепи химерного иммуноглобулина по изобретению. В некоторых вариантах воплощения изобретение представлено изолированной молекулой нуклеиновой кислоты (одной или несколькими молекулами нуклеиновых кислот), кодирующей тяжелую химерную цепь и легкую химерную цепь, которые объединяются вместе для образования химерного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, при этом химерная легкая цепь состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и/или химерная тяжелая цепь состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
В некоторых вариантах воплощения изобретения выделенная нуклеиновая кислота кодирует химерную легкую цепь, состоящую из вариабельного участка с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
В некоторых вариантах воплощения изобретения выделенная нуклеиновая кислота кодирует химерную тяжелую цепь, состоящую из вариабельного участка с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
Изобретение также описывает рекомбинантные векторы (например, векторы экспрессии, векторы экспрессии клеток млекопитающих), которые состоят из нуклеиновой кислоты, кодирующей химерный иммуноглобулин (химерную легкую цепь и химерную тяжелую цепь), химерную легкую цепь или химерную тяжелую цепь по изобретению. В некоторых вариантах воплощения изобретение представлено рекомбинантным вектором, состоящим из нуклеиновой кислоты (или парой рекомбинантных векторов, состоящих из нуклеиновых кислот), кодирующей химерный иммуноглобулин, состоящий из вариабельного участка легкой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, или вариабельного участка тяжелой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, или обоих таких вариабельных участков легкой цепи и вариабельных участков тяжелой цепи.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из нуклеиновой кислоты, кодирующей химерную легкую цепь, состоящую из вариабельного участка с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
В других вариантах воплощения изобретения рекомбинантный вектор состоит из нуклеиновой кислоты, кодирующей химерную тяжелую цепь, состоящую из вариабельного участка с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
В отдельных вариантах воплощения изобретения рекомбинантный вектор по изобретению представлен вектором экспрессии, таким как вектор экспрессии клетки млекопитающего. В определенных вариантах воплощения изобретения вектор представлен плазмидой или вектором вируса (например, вектором аденовируса или вектором аденосателлитного вируса).
Изобретение также описывает клетку-хозяина, включающую одну или несколько нуклеиновых кислот (например, один или несколько рекомбинантных векторов), кодирующих химерный иммуноглобулин (химерную легкую цепь и химерную тяжелую цепь), химерную легкую цепь или химерную тяжелую цепь по изобретению. Например, в некоторых вариантах воплощения изобретения клетка-хозяин состоит из рекомбинантного вектора (например, вектора экспрессии, вектора экспрессии клетки млекопитающего) по изобретению.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит рекомбинантную нуклеиновую кислоту (или пару рекомбинантных нуклеиновых кислот), кодирующую химерную легкую цепь и химерную тяжелую цепь, при этом химерная легкая цепь и химерная тяжелая цепь объединяются вместе с образованием химерного иммуноглобулина, обладающего специфичностью связывания с CD52 человека; химерная легкая цепь состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и/или химерная тяжелая цепь состоит из вариабельного участка, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит рекомбинантную нуклеиновую кислоту, кодирующую химерную легкую цепь, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13.
В некоторых вариантах воплощения изобретения клетка-хозяин содержит рекомбинантную нуклеиновую кислоту, кодирующую химерную тяжелую цепь, состоящую из вариабельного участка с последовательностью, выбираемой из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
Изобретение также описывает способ получения химерного иммуноглобулина, заключающийся в содержании клетки-хозяина по изобретению (например, клетки-хозяина, которая включает одну или несколько изолированных нуклеиновых кислот, кодирующих химерный иммуноглобулин по изобретению (например, химерную легкую цепь и химерную тяжелую цепь по изобретению)) в условиях, подходящих для экспрессии химерного иммуноглобулина, при этом цепи химерного иммуноглобулина экспрессируются с последующей выработкой химерного иммуноглобулина. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение химерного иммуноглобулина.
Изобретение также описывает способ получения химерной легкой цепи, заключающийся в содержании клетки-хозяина по изобретению (например, клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую химерную легкую цепь по изобретению) в условиях, подходящих для экспрессии указанной химерной легкой цепи с последующей экспрессией химерной легкой цепи и получением химерной легкой цепи. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение химерной легкой цепи.
Изобретение также описывает способ получения химерной тяжелой цепи, заключающийся в содержании клетки-хозяина по изобретению (например, клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую химерную тяжелую цепь по изобретению) в условиях, подходящих для экспрессии указанной химерной тяжелой цепи с последующей экспрессией химерной тяжелой цепи и получением химерной тяжелой цепи. В некоторых вариантах воплощения изобретения способ дополнительно включает очистку или выделение химерной тяжелой цепи.
Изобретение также описывает способ диагностики заболевания, выбираемого из группы, включающей аутоиммунные заболевания (например, рассеянный склероз, волчанка, васкулит), рак (например, лейкозы (например, хронический лимфоцитарный лейкоз) и лимфомы (например, неходжкинская лимфома)), трансплантаты (например, трансплантаты солидных органов (например, трансплантат почки) и трансплантаты стволовых клеток), и такой способ состоит в анализе образца пациента in vitro с использованием химерного иммуноглобулина по изобретению.
Дополнительные варианты воплощения изобретения описаны следующим образом. В одном аспекте изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий участок, при этом легкая цепь и тяжелая цепь указанного антитела состоит из трех гипервариабельных участков (CDR) с последовательностями SEQ ID NO: 3 и 16, соответственно; SEQ ID NO: 4 и 17, соответственно; SEQ ID NO: 5 и 18, соответственно; SEQ ID NO: 6 и 19, соответственно; SEQ ID NO: 7 и 20, соответственно; SEQ ID NO: 8 и 21, соответственно; SEQ ID NO: 9 и 22, соответственно; SEQ ID NO: 10 и 23, соответственно; SEQ ID NO: 11 и 24, соответственно; SEQ ID NO: 12 и 25, соответственно; SEQ ID NO: 12 и 137, соответственно; или SEQ ID NO: 13 и 26, соответственно. В некоторых вариантах воплощения изобретения описано антитело, связывающееся с такой же самой антигенной детерминантой на CD52 человека, что и указанное выше моноклональное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах воплощения изобретение описывает антитело, конкурирующее с указанным выше моноклональным антителом или антигенсвязывающим фрагментом. В некоторых вариантах воплощения изобретение описывает антитело, конкурирующее перекрестным образом с указанным выше моноклональным антителом или антигенсвязывающим фрагментом.
В некоторых вариантах воплощения изобретения любое из представленных выше антител или антигенсвязывающих фрагментов связывается с аминокислотной последовательностью, включающей SEQ ID NO: 104. В некоторых родственных вариантах воплощения изобретения связывание указанного антитела или фрагмента с последовательностью SEQ ID NO: 104 может быть снижено путем замещения аланина в одном или нескольких остатках 4, 7, 8 или 11 в последовательности SEQ ID NO: 104.
В некоторых вариантах воплощения изобретения антитело представлено гуманизированным антителом, мышиным антителом или химерным антителом. В определенных вариантах воплощения изобретения каркасные участки тяжелой цепи указанного антитела используют последовательности зародышевой линии VH3-72 или VH3-23 человека, и каркасные участки легкой цепи указанного антитела включают последовательность зародышевой линии VΚ2 A18b человека.
В некоторых вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом указанное антитело состоит из тяжелой цепи (H)-CDR1, H-CDR2, H-CDR3 и легкой цепи (L)-CDR1, L-CDR2, и L-CDR3, при этом аминокислотные последовательности таких цепей представлены SEQ ID NO: 51, 59, 69, 29, 36 и 43, соответственно; SEQ ID NO: 50, 60, 69, 29, 37 и 43, соответственно; SEQ ID NO: 50, 61, 68, 29, 38 и 43, соответственно; SEQ ID NO: 50, 61, 69, 29, 36 и 43, соответственно; SEQ ID NO: 50, 62, 69, 29, 39 и 43, соответственно; SEQ ID NO: 52, 61, 70, 30, 40 и 43, соответственно; SEQ ID NO: 53, 63, 71, 31, 36 и 44, соответственно; SEQ ID NO: 54, 64, 71, 31, 36 и 45, соответственно; SEQ ID NO: 55, 63, 72, 31, 36 и 46, соответственно; SEQ ID NO: 56, 65, 73, 32, 41 и 47, соответственно; SEQ ID NO: 56, 65, 294, 32, 41 и 47, соответственно; или SEQ ID NO: 56, 66, 74, 33, 41 и 48, соответственно.
В некоторых вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом легкая цепь и тяжелая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 3 и 16, соответственно; SEQ ID NO: 4 и 17, соответственно; SEQ ID NO: 5 и 18, соответственно; SEQ ID NO: 6 и 19, соответственно; SEQ ID NO: 7 и 20, соответственно; SEQ ID NO: 8 и 21, соответственно; SEQ ID NO: 9 и 22, соответственно; SEQ ID NO: 10 и 23, соответственно; SEQ ID NO: 11 и 24, соответственно; SEQ ID NO: 12 и 25, соответственно; или SEQ ID NO: 13 и 26, соответственно.
В некоторых вариантах воплощения изобретение описывает моноклональное антитело или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из последовательностей SEQ ID NO: 103 и 102, соответственно; SEQ ID NO: 136 и 138, соответственно; SEQ ID NO: 137 и 138, соответственно; SEQ ID NO: 139 и 147, соответственно; SEQ ID NO: 149 и 155, соответственно; SEQ ID NO: 149 и 156, соответственно; SEQ ID NO: 158 и 165, соответственно; SEQ ID NO: 158 и 166, соответственно; SEQ ID NO: 159 и 165, соответственно; SEQ ID NO: 159 и 166, соответственно; SEQ ID NO: 161 и 166, соответственно; или SEQ ID NO: 163 и 166, соответственно. В некоторых вариантах воплощения изобретения описано антитело, связывающееся с такой же самой антигенной детерминантой на CD52 человека, что и указанное выше моноклональное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах воплощения изобретение описывает антитело, конкурирующее с указанным выше моноклональным антителом или антигенсвязывающим фрагментом. В некоторых вариантах воплощения изобретение описывает антитело, конкурирующее перекрестным образом с указанным выше моноклональным антителом или антигенсвязывающим фрагментом.
В некоторых вариантах воплощения изобретение описывает моноклональное гуманизированное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 272 и 273, соответственно, без сигнальных последовательностей. В определенных вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 274 и 275, соответственно, без сигнальных последовательностей. В определенных вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 276 и 278, соответственно, без сигнальных последовательностей. В определенных вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 277 и 278, соответственно, без сигнальных последовательностей. В определенных вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 279 и 280, соответственно, без сигнальных последовательностей. В определенных вариантах воплощения изобретение описывает моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь и легкая цепь указанного антитела состоит из аминокислотных последовательностей SEQ ID NO: 281 и 282, соответственно, без сигнальных последовательностей. Изобретение также описывает антитела, связывающиеся с такой же самой антигенной детерминантой на CD52, что и одно из таких гуманизированных антител и антител, конкурирующих обычным или перекрестным образом с одним из таких гуманизированных антител. В родственных вариантах воплощения изобретения представлены композиции, состоящие из одного такого гуманизированного антитела и фармацевтически приемлемого носителя.
В некоторых вариантах воплощения изобретения описано моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом легкая цепь указанного антитела состоит из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 102, 138, 145-148, 153-157 и 164-168. В определенных вариантах воплощения изобретения описано моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом легкая цепь указанного антитела состоит из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 273, 275, 278, 280 и 282, без сигнальных последовательностей. В определенных вариантах воплощения изобретения описана легкая цепь антитела или ее фрагмент, состоящие из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 102, 138, 145-148, 153-157, 164-168, 273, 275, 278, 280 и 282, без сигнальных последовательностей (если присутствуют).
В некоторых вариантах воплощения изобретения описано моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь указанного антитела состоит из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 103, 136, 137, 139-144, 149-152 и 158-163. В определенных вариантах воплощения изобретения описано моноклональное антитело к CD52 человека или его антигенсвязывающий фрагмент, при этом тяжелая цепь указанного антитела состоит из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 272, 274, 276, 277, 279 и 281, без сигнальных последовательностей. В определенных вариантах воплощения изобретения описана тяжелая цепь антитела или ее фрагмент, состоящий из аминокислотной последовательности, выбираемой из группы последовательностей, включающей SEQ ID NO: 103, 136, 137, 139-144, 149-152, 158-163, 272, 274, 276, 277, 279 и 281, без сигнальных последовательностей (если присутствуют).
В некоторых вариантах воплощения изобретения любое из указанных выше антител может быть представлено IgG, IgM, IgA, IgD или IgE. В определенных вариантах воплощения изобретения указанный IgG представлен IgG1, IgG2, IgG3 или IgG4.
В некоторых вариантах воплощения изобретения любой из указанных выше антигенсвязывающих фрагментов может быть представлен одноцепочечным антителом, Fv, Fab, Fab', F(ab')2, Fd, одноцепочечной молекулой Fv (scFv), биспецифическим одноцепочечным димером Fv, диателом, антителом с удаленным доменом или антителом с одним доменом (dAb).
Изобретение также описывает любое из указанных выше антител или антигенсвязывающих фрагментов, при этом указанное антитело или антигенсвязывающий фрагмент снижает количество Т- или В-лимфоцитов, или лимфоцитов обоих типов; преимущественно снижает количество Т-лимфоцитов в сравнении с количеством В-лимфоцитов; повышает циркулирующие в сыворотке уровни ФНО-альфа, ИЛ-6 или MCP-1 (например, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 50%, по меньшей мере, на 100% или, по меньшей мере, на 200%); опосредует антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ) клеток, экспрессирующих CD52; опосредует комплемент-зависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52; связывается с человеческим CD52, несмотря на наличие нейтрализующих антител к алемтузумабу у пациента-человека; и/или способствует внутриклеточной передаче сигнала в Т- и/или В-клетках человека (см., например, Hederer et. al., International Immunology 12:505-616 (2000); Watanabe et. al., Clinical Immunology 120: 247-259 (2006)).
Изобретение дополнительно описывает изолированную нуклеиновую кислоту, кодирующую тяжелую цепь или ее антигенсвязывающий фрагмент, или легкую цепь или антигенсвязывающий фрагмент любого из представленных выше антител. В некоторых вариантах воплощения изобретения указанная изолированная нуклеиновая кислота состоит из нуклеотидной последовательности тяжелой цепи, выбираемой из группы последовательностей, включающей SEQ ID NO: 283, 285, 287, 288, 290 и 292, или указанной нуклеотидной последовательности без последовательности, кодирующей сигнальный пептид; нуклеотидной последовательности легкой цепи, выбираемой из группы последовательностей, включающей SEQ ID NO: 284, 286, 289, 291 и 293, или указанной нуклеотидной последовательности без последовательности, кодирующей сигнальный пептид; или обеих указанных нуклеотидной последовательности тяжелой цепи и нуклеотидной последовательности легкой цепи. В определенных вариантах воплощения изобретения указанная изолированная нуклеиновая кислота состоит из нуклеотидной последовательности тяжелой цепи и нуклеотидной последовательности легкой цепи, выбираемых из группы последовательностей, включающей SEQ ID NO: 283 и SEQ ID NO: 284, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 285 и SEQ ID NO: 286, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 287 и SEQ ID NO: 289, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 288 и SEQ ID NO: 289, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 290 и SEQ ID NO: 291, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; и SEQ ID NO: 292 и SEQ ID NO: 293, соответственно, обе без последовательностей, кодирующих сигнальные пептиды.
Изобретение также описывает использование изолированной нуклеиновой кислоты, состоящей из нуклеотидной последовательности тяжелой цепи, и изолированной нуклеиновой кислоты, состоящей из нуклеотидной последовательности легкой цепи, для производства лекарственного средства для лечения нуждающегося в этом пациента, при этом указанная нуклеотидная последовательность тяжелой цепи и нуклеотидная последовательность легкой цепи выбираются из группы последовательностей, включающей SEQ ID NO: 283 и SEQ ID NO: 284, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 285 и SEQ ID NO: 286, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 287 и SEQ ID NO: 289, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 288 и SEQ ID NO: 289, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; SEQ ID NO: 290 и SEQ ID NO: 291, соответственно, обе без последовательностей, кодирующих сигнальные пептиды; и SEQ ID NO: 292 и SEQ ID NO: 293, соответственно, обе без последовательностей, кодирующих сигнальные пептиды.
Изобретение также описывает рекомбинантный вектор, состоящий из (1) последовательности нуклеиновой кислоты, кодирующей тяжелую цепь или ее антигенсвязывающий фрагмент, (2) последовательности нуклеиновой кислоты, кодирующей легкую цепь или ее антигенсвязывающий фрагмент, или (3) обеих нуклеиновых кислот любого из представленных выше антител. Изобретение дополнительно описывает клетку-хозяина, содержащую первую последовательность нуклеиновой кислоты, кодирующей тяжелую цепь или антигенсвязывающий фрагмент указанного антитела, и указанная первая последовательность нуклеиновой кислоты функционально связана с контрольным элементом экспрессии, и второй последовательности нуклеиновой кислоты, кодирующей легкую цепь или антигенсвязывающий фрагмент указанного антитела, при этом указанная последовательность второй нуклеиновой кислоты функционально связана с контрольным элементом экспрессии. Изобретение описывает способ получения антитела к CD52 человека или его антигенсвязывающий фрагмент, заключающийся в содержании указанной клетки-хозяина в условиях, подходящих для экспрессии антитела или его фрагмента, и такой способ дополнительно состоит из этапа выделения антитела или его фрагмента.
Изобретение описывает композицию, состоящую из моноклонального антитела или его антигенсвязывающего фрагмента в соответствии с любым из пунктов формулы изобретения 1-24, а также фармацевтически приемлемую основу или носитель.
В некоторых вариантах воплощения изобретения описан способ лечения пациента, нуждающегося в таком лечении, который заключается в введении пациенту эффективного количества любого из указанных выше антител или антигенсвязывающих фрагментов, или представленной выше композиции. В определенных вариантах воплощения изобретения указанный пациент подвергается трансплантации.
В некоторых вариантах воплощения изобретения описан способ лечения аутоиммунного заболевания у пациента, нуждающегося в таком лечении, который заключается в введении пациенту эффективного количества любого из указанных выше антител или антигенсвязывающих фрагментов, или представленной выше композиции. В определенных вариантах воплощения изобретения аутоиммунное заболевание представлено, например, рассеянным склерозом, ревматоидным артритом или системной красной волчанкой.
В некоторых вариантах воплощения изобретения описан способ лечения рака у пациента, нуждающегося в таком лечении, который заключается в введении пациенту эффективного количества любого из указанных выше антител или антигенсвязывающих фрагментов, или представленной выше композиции. В определенных вариантах воплощения изобретения рак представлен, например, лимфомой, такой как неходжкинская лимфома; лейкозом, таким как В-клеточный хронический лимфоцитарный лейкоз; Т-клеточным злокачественным новообразованием, при этом антитело или его фрагмент преимущественно снижает количество Т-клеток в сравнении с количеством В-клеток; или солидной опухолью.
В некоторых вариантах воплощения изобретения любой из представленных выше способов лечения дополнительно включает введение пациенту агента-стимулятора нейтрофилов или NK-клеток. В определенных вариантах воплощения изобретения указанный агент представлен Г-КСФ или ГМ-КСФ. В некоторых вариантах воплощения изобретения любой из представленных выше способов лечения дополнительно включает введение пациенту регуляторного агента-стимулятора Т-клеток. В определенных вариантах воплощения изобретения такой агент представлен рапамицином.
В некоторых вариантах воплощения изобретения описан способ ингибирования ангиогенеза у пациента, нуждающегося в таком лечении, который заключается в введении пациенту эффективного количества любого из указанных выше антител или антигенсвязывающих фрагментов. В определенных вариантах воплощения изобретения у пациента имеется солидная опухоль. В определенных вариантах воплощения изобретения у пациента имеется неоваскуляризация. В определенных вариантах воплощения изобретения указанная неоваскуляризация отмечается в глазу.
Изобретение также описывает использование любого из указанных выше антител или их антигенсвязывающих фрагментов в производстве лекарственного препарата для лечения аутоиммунного заболевания у нуждающегося в этом пациента. Кроме того, изобретение также описывает использование любого из указанных выше антител или их антигенсвязывающих фрагментов в производстве лекарственного препарата для лечения рака у нуждающегося в этом пациента. Изобретение также описывает использование любого из указанных выше антител или их антигенсвязывающих фрагментов в производстве лекарственного препарата для лечения пациента, нуждающегося в трансплантации. Изобретение описывает использование любого из указанных выше антител или их антигенсвязывающих фрагментов в производстве лекарственного препарата для лечения неоваскуляризации у нуждающегося в этом пациента.
Изобретение также описывает использование любого из указанных выше антител или их антигенсвязывающих фрагментов в качестве лекарственного средства.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1А-1В являются схематическим представлением разработки новых моноклональных антител к CD52. Общая схема отображена на ФИГ. 1А, а названия клонов мышиных антител к CD52 человека, а также их изотипы представлены на ФИГ. 1В.
ФИГ. 2 представляет собой выравнивание аминокислотных последовательностей нескольких легких каппа цепей мышиного антитела к CD52 человека (SEQ ID NOS:1-13). Кампат-1G является крысиным моноклональным антителом, из которого получают гуманизированное антитело Кампат-1Н.
ФИГ. 3 представляет собой выравнивание аминокислотных последовательностей нескольких тяжелых цепей мышиного антитела к CD52 человека (SEQ ID NOS:14-26).
ФИГ. 4 представляет выравнивание белков CD52 дикого типа и 10 мутантных белков CD52 (SEQ ID NO: 104-114, сверху вниз).
ФИГ. 5А иллюстрирует N-терминальный связывающий профиль антител 4B10 и 7F11 (определено в ходе FACS анализа) на клетках, экспрессирующих CD52 (сканирующий аланином мутагенез).
ФИГ. 5В иллюстрирует связывающий профиль срединного фрагмента антител CF1D12, 3G7, 9D9, 5F7, 4G7 и 11C11 (определено в ходе FACS анализа) на клетках, экспрессирующих CD52 (сканирующий аланином мутагенез).
ФИГ. 5С иллюстрирует связывающий профиль антител Кампат-1H® («Кампат 1H»), 2C3, 12G6 и 23E6 (определено в ходе FACS анализа) на клетках, экспрессирующих CD52 (сканирующий аланином мутагенез).
ФИГ. 5D отображает иммуноблоттинг CD52 +/- N-концевого гликозилирования с использованием зондов - панели химерных моноклональных антител. «C1H» обозначает Кампат-1H®.
ФИГ. 6 представляет график, отображающий результаты 1,5-часового анализа КЗЦ с использованием различных химерных антител к CD52 со скринингом на 67 клетках CHO-K1 CD52. Результаты показывают, что химерные антитела 4B10 и 7F11 сопоставимы или имеют более лучшие показатели, чем Кампат-1H® («Кампат 1H»).
ФИГ. 7 представляет график, отображающий результаты 14-часового анализа АЗКЦ с использованием различных химерных антител IgG1 к CD52 со скринингом на 67 клетках CHO-K1 CD52. Результаты показывают, что химерные антитела 2C3 и 12G6 сопоставимы или имеют более лучшие показатели, чем Кампат-1H® («Кампат 1H»).
ФИГ. 8А-8С иллюстрирует сравнительное связывание различных антител к CD52 и антитела Кампат-1H® («C-1H») относительно определенных популяций лимфоцитов человека. Такие фигуры показывают иерархию способности связывания химерных антител, подвергнутых скринингу в ходе FACS анализа. Кривые в крайнем правом положении показывают наивысшую способность связывания, в то время как кривые в крайнем левом положении показывают наименьшую способность связывания.
ФИГ. 9A-9C представляют графики, иллюстрирующие уровень CD4 T-клеток (ФИГ. 9A), CD8 T-клеток (ФИГ. 9B) и CD19 B-клеток (ФИГ. 9C) в крови спустя 72 часа после введения дозы химерных антител 7F11, 8G3, 23E6, 12G6, 4B10 или 5F7, или Кампата-1H® («Cam»).
ФИГ. 10A-10C представляют графики, иллюстрирующие уровень CD4 T-клеток (ФИГ. 10A), CD8 T-клеток (ФИГ. 10B) и CD19 B-клеток (ФИГ. 10C) в селезенке спустя 72 часа после введения дозы химерных антител 7F11, 8G3, 23E6, 12G6, 4B10 или 5F7, или Кампата-1H® («Cam»).
ФИГ. 11A-11C представляют графики, иллюстрирующие уровень CD4 T-клеток (ФИГ. 11A), CD8 T-клеток (ФИГ. 11B) и CD19 B-клеток (ФИГ. 11C) в крови спустя 72 часа после введения дозы химерных антител 2C3, 9D9, 4B10, 3G7 или 11C11, или Кампата-1H® («Cam»).
ФИГ. 12 является графиком выживаемости согласно Каплану-Мейеру, иллюстрирующему процентный показатель выживших мышей после лечения химерными моноклональными антителами 7F11, 4B10 или 12G6, или Кампатом-1H® («Кампат»).
ФИГ. 13 является графиком выживаемости согласно Каплану-Мейеру, иллюстрирующему процентный показатель выживших мышей после лечения химерными моноклональными антителами 2C3, 8G3 или 23E6, или Кампатом-1H® («Кампат»).
ФИГ. 14 является графиком выживаемости согласно Каплану-Мейеру, иллюстрирующему процентный показатель выживших мышей после лечения химерными моноклональными антителами 9D9 или 4B10, или Кампатом-1H® («Кампат»).
ФИГ. 15 является графиком выживаемости согласно Каплану-Мейеру, иллюстрирующему процентный показатель выживших мышей после лечения химерными моноклональными антителами 2C3 или 11C11, или Кампатом-1H® («Кампат»).
ФИГ. 16 представляет выравнивание последовательности вариабельного участка тяжелой цепи мышиного антитела 4B10 к CD52 человека (SEQ ID NO: 96) с максимальными совпадениями последовательности человека зародышевой линии SEQ ID NO: 97) и последовательностью вариабельного участка гуманизированной тяжелой цепи (SEQ ID NO: 98). Кроме того, показано выравнивание последовательности вариабельного участка легкой цепи мышиного антитела 4B10 к CD52 человека (SEQ ID NO: 99) с максимальными совпадениями последовательности человека зародышевой линии SEQ ID NO: 100) и последовательностью вариабельного участка гуманизированной легкой цепи (SEQ ID NO: 101).
ФИГ. 17 представляет последовательности вариабельных участков гуманизированной тяжелой цепи 4B10 (SEQ ID NO: 103) и легкой цепи (SEQ ID NO: 102).
ФИГ. 18 представляет собой график, указывающий на то, что гуманизированное антитело 4B10-H1/K1 («4B10-гуманизированное») и химерное антитело 4B10 связываются эквивалентным образом с клетками, экспрессирующими CD52.
ФИГ. 19 представляет собой график, указывающий на то, что гуманизированное антитело 4B10-H1/K1 («4B10-гуманизированное») и химерное антитело 4B10 опосредуют эквивалентным образом активность АЗКЦ на клетках, экспрессирующих CD52.
ФИГ. 20 представляет собой график, указывающий на то, что гуманизированное антитело 4B10-H1/K1 («4B10-гуманизированное») и химерное антитело 4B10 опосредуют эквивалентным образом активность КЗЦ на клетках, экспрессирующих CD52.
ФИГ. 21 представляет график, иллюстрирующий фармакокинетический профиль химерных антител к CD52 (12G6, 7F11 и 4B10), Кампата-1H® («Кампат») и гуманизированного антитела к CD52 4B10-H1/K1 («4B10 гуманизированное (H1/K1)») у гетерозиготных трансгенных мышей huCD52.
ФИГ. 22A-22C представляют графики, иллюстрирующие уровень CD4 T-клеток (ФИГ. 22A), CD8 T-клеток (ФИГ. 22B) и CD19 B-клеток (ФИГ. 22C) в крови спустя 72 часа после введения дозы химерного антитела 4B10 или гуманизированного антитела 4B10-H1/K1 («4B10-Hu»), или антитела Кампат-1H® («Кампат»).
ФИГ. 23 представляет график, отображающий сводную информацию об относительной аффинности связывания моноклональных антител к CD52.
ФИГ. 24 отображает последовательности вариабельного участка гуманизированной тяжелой и легкой (каппа) цепи 7F11. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом.
ФИГ. 25 представляет гистограмму, показывающую, что химерные и гуманизированные антитела 7F11 связываются эквивалентным образом с клетками, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток.
ФИГ. 26А отображает последовательности вариабельного участка гуманизированной тяжелой цепи 2C3. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом. ФИГ. 26В отображает последовательности вариабельного участка гуманизированной легкой (каппа) цепи 2C3. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом.
ФИГ. 27А представляет гистограмму, показывающую связывание химерных и гуманизированных антител 2С3 с клетками, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток. ФИГ. 27В представляет гистограмму, указывающую, что химерные и подгруппа гуманизированных антител 2С3 связываются эквивалентным образом с клетками, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток.
ФИГ. 28А отображает последовательности вариабельного участка гуманизированной тяжелой цепи 12G6. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом. ФИГ. 28В отображает последовательности вариабельного участка гуманизированной легкой (каппа) цепи 12G6. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом.
ФИГ. 29 представляет гистограмму, указывающую, что химерные и подгруппа гуманизированных антител 12G6 связываются эквивалентным образом с клетками, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток.
ФИГ. 30А отображает последовательности вариабельного участка гуманизированной тяжелой цепи 9D9. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом. ФИГ. 30В отображает последовательности вариабельного участка гуманизированной легкой (каппа) цепи 9D9. Аминокислотные остатки, подвергнутые обратной мутации в остатки мыши, подчеркнуты, а CDR указаны жирным шрифтом.
ФИГ. 31 представляет гистограмму, указывающую, что химерные и подгруппа гуманизированных антител 9D9 связываются эквивалентным образом с клетками, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток.
ФИГ. 32А показывает кривые связывания антитела Кампат-1H® («C1H»), химерного антитела 2С3 и гуманизированного антитела 2C3-SFD1/K12 с первичными Т-клетками человека, а также Т-клетками трансгенных мышей huCD52. ФИГ. 32В показывает кривые связывания антитела Кампат-1H® («C1H»), химерного антитела 9D9 и гуманизированных антител 9D9 с первичными Т-клетками человека, а также Т-клетками трансгенных мышей huCD52. ФИГ. 32С показывает кривые связывания антитела Кампат-1H® («C1H»), химерного антитела 12G6 и гуманизированных антител 12G6 с первичными Т-клетками человека, а также Т-клетками трансгенных мышей huCD52.
ФИГ. 33 представляет таблицу, отображающую относительную эффективность связывания антитела Кампат-1H®, химерных антител 2C3 и 12G6, а также гуманизированных антител 2C3 и 12G6 с Т-клетками человека, а также Т-клетками трансгенных мышей huCD52.
ФИГ. 34 иллюстрирует сравнительные схемы связывания гуманизированного антитела Кампат-1H® к CD52, антител 2C3, 12G6 и 9D9 с определенными подгруппами популяций мононуклеарных клеток периферической крови человека в ходе анализа проточной цитометрией. Такие гистограммы показывают, что связывание гуманизированного антитела к CD52 эквивалентно таковому связыванию Кампата-1H® с различными субпопуляциями МКПК человека, экспрессирующими CD52. Ось X отображает флуоресценцию, испускаемую связанным антителом к CD52, при этом площадь каждого пика представляет общую популяцию клеток.
ФИГ. 35 представляет график, показывающий, что химерные и гуманизированные антитела 7F11 опосредуют эквивалентную активность АЗКЦ на клетках, экспрессирующих CD52.
ФИГ. 36 представляет график, показывающий, что химерные и гуманизированные антитела 7F11 опосредуют активность КЗЦ на клетках, экспрессирующих CD52.
ФИГ. 37 представляет график, показывающий, что химерные и гуманизированные антитела 2С3 опосредуют активность АЗКЦ на клетках, экспрессирующих CD52.
ФИГ. 38 представляет график, показывающий, что химерные и гуманизированные антитела 2С3 опосредуют активность КЗЦ на клетках, экспрессирующих CD52.
ФИГ. 39 представляет график, показывающий, что химерные и гуманизированные антитела 12G6 опосредуют активность АЗКЦ на клетках, экспрессирующих CD52.
ФИГ. 40 представляет график, показывающий, что химерные и гуманизированные антитела 12G6 опосредуют активность КЗЦ на клетках, экспрессирующих CD52.
ФИГ. 41 представляет график, показывающий, что химерные и гуманизированные антитела 9D9 опосредуют активность АЗКЦ на клетках, экспрессирующих CD52.
ФИГ. 42 представляет график, показывающий, что химерные и гуманизированные антитела 9D9 опосредуют активность КЗЦ на клетках, экспрессирующих CD52.
ФИГ. 43 представляет график, отображающий активность АЗКЦ гуманизированных антител к CD52 на первичных Т-клетках.
ФИГ. 44 представляет график, отображающий активность КЗЦ гуманизированных антител к CD52 на первичных Т-клетках.
ФИГ. 45 представляет график, отображающий нейтрализацию антитела Кампат-1Н, но не других антител к CD52, в ходе исследования CAMMS223 с использованием образцов сыворотки человека, содержащих нейтрализующие антитела к Кампату-1H®. Образцы сыворотки были отобраны у репрезентативного пациента (MS-1) в месяц 12 (М12) и месяц 13 (М13).
ФИГ. 46А-46Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток и нейтрофилов в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»).
ФИГ. 47А-47Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток, нейтрофилов и макрофагов в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»).
ФИГ. 48А-48Е отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»).
ФИГ. 49А-49B отображают репопуляцию циркулирующих лимфоцитов с течением времени после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10») (мг/кг).
ФИГ. 50А-50Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток и нейтрофилов в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»).
ФИГ. 51А-51Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток и нейтрофилов в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»).
ФИГ. 52A-52F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»).
ФИГ. 53A и 53В отображают репопуляцию циркулирующих лимфоцитов с течением времени после введения дозы гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2») (мг/кг).
ФИГ. 54A и 54B отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат»), химерных антител 7F11 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2.
ФИГ. 55 представляет уровень антитела Кампат-1H® («Кампат»), химерного антитела 7F11 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2 в крови с течением времени после введения дозы.
ФИГ. 56А-56Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и нейтрофилов в крови спустя 72 часа после введения дозы антител 2C3-SFD1/K12.
ФИГ. 57А-57Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и нейтрофилов в селезенке спустя 72 часа после введения дозы антител 2C3-SFD1/K12.
ФИГ. 58A-58F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 2C3-SFD1/K12 («2C3»).
ФИГ. 59 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 2C3-SFD1/K12 (мг/кг).
ФИГ. 60А-60Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток, макрофагов и нейтрофилов в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K11.
ФИГ. 61А-61Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток, макрофагов и нейтрофилов в селезенке спустя 72 часа после введения дозы антител 12G6-SFD1/K11.
ФИГ. 62A-62F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 12G6-SFD1/K11 («12G6 hu»).
ФИГ. 63 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 12G6-SFD1/K11 (мг/кг).
ФИГ. 64A-64C отображают уровень химерных антител 2C3, 2C3-SFD1/K12, 12G6, 12G6-SFD1/K11, 9D9 и 9D9-H10/K12 в крови с течением времени после введения дозы.
ФИГ. 65А-65Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток, макрофагов и нейтрофилов в крови спустя 72 часа после введения дозы антител 9D9-H10/K12 («9D9»).
ФИГ. 66А-66Е отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток, миелоидных клеток, макрофагов и нейтрофилов в селезенке спустя 72 часа после введения дозы антител 9D9-H10/K12 («9D9»).
ФИГ. 67A-67F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 9D9-H10/K12 («9D9»).
ФИГ. 68 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 9D9-H10/K12 («9D9») (мг/кг).
ФИГ. 69A-69D показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток и NK-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и антител 2C3-SFD1/K12 («2C3»), 12G6-SFD1/K11 («12G6») и 9D9-H10/K12 («9D9»).
ФИГ. 70A-70D показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток и NK-клеток в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и антител 2C3-SFD1/K12 («2C3»), 12G6-SFD1/K11 («12G6») и 9D9-H10/K12 («9D9»).
ФИГ. 71А-71F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антитела Кампат-1H® и антител 2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12.
ФИГ. 72 отображает уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток в крови спустя 72 часа после введения дозы антител 9D9-H10/K12 и 9D9-H11/K12.
ФИГ. 73 отображает уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток в селезенке спустя 72 часа после введения дозы антител 9D9-H10/K12 и 9D9-H11/K12.
ФИГ. 74А-74D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K11 («12G6 K11») и 12G6-SFD1/K12 («12G6 K12»).
ФИГ. 75А-75D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител 12G6-SFD1/K11 («12G6 K11») и 12G6-SFD1/K12 («12G6 K12»).
ФИГ. 76 отображает уровень общей популяции лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток) в крови спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 77А-77D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 78 отображает уровень общей популяции лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток) в селезенке спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 79А-79D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 80A-80F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 81A и 81В отображают уровень антител 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13 в крови с течением времени после введения дозы.
ФИГ. 82A-82F отображают уровень цитокинов в крови в течение 48 часов после введения антител Кампат-1H® («Кампат»), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 или 9D9-H18/K13.
ФИГ. 83А-83E отображают уровень общего числа лимфоцитов, CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 или 9D9-H18/K13
ФИГ. 84A-84G отображают репопуляцию циркулирующих CD4+ и CD8+ T-клеток, регуляторных Т-клеток, В-клеток, NK-клеток, нейтрофилов и макрофагов с течением времени после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
ФИГ. 85 отображает способность антител Кампат-1H® («Кампат»), 2C3-SFD1/K12 («2C3 K12»), 12G6-SFD1/K11 («12G6 K11»), 12G6-SFD1/K12 («12G6 K12»), 9D9-H16/K13 («9D9 H16») и 9D9-H18/K13 («9D9 H18»), меченных FITC, специфически связываться с популяциями клеток лимфоцитов huCD52 в селезенке.
ФИГ. 86A-86Е показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В220+ В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 87A-87Е показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В220+ В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 88А-88F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13.
ФИГ. 89A-89D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ Т-клеток, NK-клеток/миелоидных клеток в крови спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
ФИГ. 90A-90D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ Т-клеток, NK-клеток/миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
ФИГ. 91A-91D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ Т-клеток, NK-клеток/миелоидных клеток в лимфатическом узле спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
ФИГ. 92A отображает уровень экспрессии huCD52 на CD4+ T-клетках, CD8+ T-клетках, B220+ B-клетках и NK-клетках/миелоидных клетках у мышей линии huCD52-KI/KO и нетрансгенных контрольных мышей. ФИГ. 92B отображает уровень экспрессии huCD52 на CD4+ T-клетках, CD8+ T-клетках и В-клетках у трансгенных мышей линий huCD52-KI/KO и huCD52 CD1.
ФИГ. 93 отображает связывание с huCD52 антител 12G6-SFD1/K12 и 2C3-SFD1/K12, полученных из различных промышленных источников («мелкомасштабных» и «крупномасштабных») в сравнении с антителом Кампат-1H® в качестве контроля.
ФИГ. 94 отображает уровень совокупных популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток и NK-клеток) в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K12 и 2C3-SFD1/K12, полученных из различных промышленных источников («мелкомасштабных» и «крупномасштабных»).
ФИГ. 95 отображает уровни антител 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12 в крови с течением времени после введения дозы.
ФИГ. 96 демонстрирует балл по шкале EAE при введении антител 2C3-SFD1/K12 и 12G6-SFD1/K12 в ходе прогрессирования заболевания.
ФИГ. 97A и 97B отображают способность антител Кампат-1H® («Кампат»), 2C3-SFD1/K12 («2C3»), His435Ala 2C3-SFD1/K12 («H435A 2C3») и His310Ala/His435Gln 2C3-SFD1/K12 («H310A/H435Q 2C3») связываться с молекулами FcRn мыши и человека.
ФИГ. 98 отображает in vivo клиренс антител 2C3-SFD1/K12 («2C3 немодифицированное»), 2C3-SFD1/K12-модифицированное 1 («2C3-Fc мутант 1») и 2C3-SFD1/K12-модифицированное 2 («2C3-Fc мутант 2») у нетрансгенных мышей.
ФИГ. 99 отображает in vivo клиренс антител 2C3-SFD1/K12 («2C3 немодифицированное»), 2C3-SFD1/K12-модифицированное 1 («2C3-Fc мутант 1») и 2C3-SFD1/K12-модифицированное 2 («2C3-Fc мутант 2») у трансгенных мышей линии huCD52.
ФИГ. 100A и 100B отображают уровень общих популяций лимфоцитов (CD4+ T-клетки, CD8+ T-клетки, B220+ B-клетки и NK-клетки) в крови и селезенке спустя 72 часа после введения дозы антител 2C3-SFD1/K12 («2C3»), 2C3-SFD1/K12-модифицированное 1 («2C3 Fc мутант-1») и 2C3-SFD1/K12-модифицированное 2 («2C3 Fc мутант-2»).
ФИГ. 101А и 101В являются репрезентативными сенсограммами анализов Biacore T100 для определения специфичности антигенной детерминанты гуманизированного антитела 12G6-SFD1/K12 и мутантных пептидов, полученных в ходе сканирования аланином. ФИГ. 101А отображает отсутствие связывания между пептидом 12G6-SFD1/K12 и пептидом MUT 8, при этом ФИГ. 101В отображает связывание между 12G6-SFD1/K12 и пептидом MUT 9.
ФИГ. 102 отображает бета-анализ TCR V для донора BMS486. CD4+ T-клетки, «обученные» пептидной группой 986-989 антитела Кампат-1H®, характеризовались преимущественным расширением одной Vbeta (Vβ3).
ФИГ. 103 отображает бета-анализ TCR V для донора BMS928. CD4+ T-клетки, «обученные» пептидными группами 1066-67-68 и 1083-84-85 антитела 12G6-SFD1/K12, характеризовались преимущественным расширением одной Vbeta (Vβ20).
ФИГ. 104A-104J показывают оценку иммуногенности антитела Кампат-1H®. Ответы, выраженные в виде пролиферации, представлены в CPM для индивидуальных доноров A-J. Ось X отображает группы пептидов, используемых для трехкратной стимуляции аутологичных CD4+ T-клеток. Каждая группа Т-клеток была проанализирована трижды с использованием аутологичных ДК, примированных «обучающим» антигеном/пептидной группой (специфический ответ, левая полоска, белый цвет), иррелевантным DR-связывающим пептидом (средняя полоска, полосы) или средой (правая полоска, черный цвет).
ФИГ. 105A-105J отображают оценку иммуногенности 12G6-SFD1/K12. Ответы, выраженные в виде пролиферации, представлены в CPM для индивидуальных доноров A-J. Ось X отображает группы пептидов, используемых для трехкратной стимуляции аутологичных CD4+ T-клеток. Каждая группа Т-клеток была проанализирована трижды с использованием аутологичных ДК, примированных «обучающей» пептидной группой (специфический ответ, левая полоска, белый цвет), иррелевантным DR-связывающим пептидом (средняя полоска, полосы) или средой (правая полоска, черный цвет). В группах, проанализированных без контрольной среды, левая полоса (белым цветом) представляет ДК, примированные «обучающим» пептидом, а правая полоса (полосы) представляет ДК, примированные иррелевантным пептидом.
ФИГ. 106 отображает аминокислотную последовательность гуманизированной тяжелой цепи полной длины 2C3-SFD1 (SEQ ID NO: 272) и аминокислотную последовательность гуманизированной легкой цепи полной длины 2C3-K12 (SEQ ID NO: 273). Сигнальные последовательности указаны жирным шрифтом и курсивом, а CDR - подчеркнутым шрифтом.
ФИГ. 107 отображает аминокислотную последовательность гуманизированной тяжелой цепи полной длины 7F11-SFD1 (SEQ ID NO: 274) и аминокислотную последовательность гуманизированной легкой цепи полной длины 7F11-K2 (SEQ ID NO: 275). Сигнальные последовательности указаны жирным шрифтом и курсивом, а CDR - подчеркнутым шрифтом.
ФИГ. 108 отображает аминокислотные последовательности гуманизированной тяжелой цепи полной длины 9D9-H16 (SEQ ID NO: 276) и 9D9-H18 (SEQ ID NO: 277), и аминокислотную последовательность гуманизированной легкой цепи полной длины 9D9-K13 (SEQ ID NO: 278). Сигнальные последовательности указаны жирным шрифтом и курсивом, а CDR - подчеркнутым шрифтом.
ФИГ. 109 отображает аминокислотную последовательность гуманизированной тяжелой цепи полной длины 12G6-SFD1 (SEQ ID NO: 279) и аминокислотную последовательность гуманизированной легкой цепи полной длины 12G6-K12 (SEQ ID NO: 280). Сигнальные последовательности указаны жирным шрифтом и курсивом, а CDR - подчеркнутым шрифтом.
ФИГ. 110 отображает аминокислотную последовательность гуманизированной тяжелой цепи полной длины 4B10-SFD1 (SEQ ID NO: 281) и аминокислотную последовательность гуманизированной легкой цепи полной длины 4B10-K12 (SEQ ID NO: 282). Сигнальные последовательности указаны жирным шрифтом и курсивом, а CDR - подчеркнутым шрифтом.
ФИГ. 111 отображает последовательность нуклеиновой кислоты гуманизированной тяжелой цепи полной длины 2C3-SFD1 (SEQ ID NO: 283) и последовательность нуклеиновой кислоты гуманизированной легкой цепи полной длины 2C3-K12 (SEQ ID NO: 284). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ФИГ. 112 отображает последовательность нуклеиновой кислоты гуманизированной тяжелой цепи полной длины 7F11-SFD1 (SEQ ID NO: 285) и последовательность нуклеиновой кислоты гуманизированной легкой цепи полной длины 7F11-K2 (SEQ ID NO: 286). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ФИГ. 113 отображает последовательности нуклеиновой кислоты гуманизированной тяжелой цепи полной длины 9D9-H16 (SEQ ID NO: 287) и 9D9-H18 (SEQ ID NO: 288). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ФИГ. 114 отображает последовательности нуклеиновой кислоты гуманизированной легкой цепи полной длины 9D9-K13 (SEQ ID NO: 289). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ФИГ. 115 отображает последовательность нуклеиновой кислоты гуманизированной тяжелой цепи полной длины 12G6-SFD1 (SEQ ID NO: 290) и последовательность нуклеиновой кислоты гуманизированной легкой цепи полной длины 12G6-K12 (SEQ ID NO: 291). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ФИГ. 116 отображает последовательность нуклеиновой кислоты гуманизированной тяжелой цепи полной длины 4B10-SFD1 (SEQ ID NO: 292) и последовательность нуклеиновой кислоты гуманизированной легкой цепи полной длины 4B10-K12 (SEQ ID NO: 293). Сигнальные последовательности приводятся подчеркнутым шрифтом, вариабельные домены - жирным шрифтом, а константные участки - курсивом.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
CD52 представляет собой гликозилированный, заякоренный ГФИ белок, находящийся в большом количестве на поверхности клеток (примерно 5×105 антигенсвязывающих центров на клетку) и присутствующий, по меньшей мере, на 95% всех лимфоцитов периферической крови человека, а также моноцитах и макрофагах (Hale G, et. al., “The CAMPATH-1 antigen (CD52),” Tissue Antigens, 35:178-327 (1990)), но отсутствующий на гематопоэтических стволовых клетках. Данное изобретение описывает иммуноглобулины (антитела к CD52), обладающие специфичностью связывания (например, специфичностью относительно антигенной детерминанты) или избирательным связыванием с CD52 человека или его фрагментом. Такие иммуноглобулины связываются специфическим образом с CD52, но не связываются специфическим образом с молекулами, не являющимися CD52. Специфическое связывание между иммуноглобулином к CD52 и CD52 может быть определено, например, путем измерения EC50 связывания иммуноглобулина с клетками CD52+ способом проточной цитометрии. Специфическое связывание может быть определено по диапазону EC50, например, 0,5 - 10 мкг/мл. Описанные здесь иммуноглобулины могут обладать специфичностью связывания со всем или участком CD52 человека, при этом CD52 человека представляет собой изолированный и/или рекомбинантный CD52 человека, или с поверхностью клетки, экспрессирующей CD52 человека. Кроме того, иммуноглобулины могут обладать специфичностью связывания с одной или несколькими формами CD52 человека (например, гликозилированным CD52 человека; дегликозилированным CD52 человека; агликозилированным CD52 человека; и аллельными вариантами). В одном варианте воплощения изобретения иммуноглобулины обладают специфичностью связывания с встречающимися в природе, эндогенными CD52 человека или CD52 человека дикого типа. Аминокислотная последовательность CD52 человека дикого типа указана на Фигуре 4 (SEQ ID NO: 104).
Иммуноглобулины, описанные в данной заявке, могут быть очищены или выделены с использованием известных способов. «Очищенные» или «изолированные» иммуноглобулины были сепарированы из молекул (например, пептидов) от источника их происхождения (например, супернатанта клеток; в смеси, такой как, например, смесь иммуноглобулинов в библиотеке) и включают иммуноглобулины, полученные с использованием описанных здесь способов или других подходящих способов. Изолированные иммуноглобулины включают по существу чистые (значительно чистые) иммуноглобулины и иммуноглобулины, полученные в ходе химического синтеза, способов рекомбинации и их комбинации.
В частности, изобретение описывает иммуноглобулины к CD52, антигенсвязывающие фрагменты (т.е. участки) иммуноглобулинов, легкие цепи иммуноглобулинов, тяжелые цепи иммуноглобулинов, и фрагменты таких легких цепей или тяжелых цепей. Изобретение также описывает зрелые иммуноглобулины или их цепи, такие как гликозилированные иммуноглобулины. Изобретение также описывает незрелые иммуноглобулины или предшественники иммуноглобулинов (белков). Изобретение также описывает молекулы нуклеиновых кислот (например, векторы), кодирующие как зрелые, так и незрелые белки, векторы и клетки-хозяева, которые содержат такую нуклеиновую кислоту, а также способы получения зрелых и незрелых белков и способы применения иммуноглобулинов.
Иммуноглобулины по данному изобретению могут использоваться для лечения нуждающегося в этом пациента (например, пациента-человека) для снижения количества лимфоцитов у пациента и других CD52+ клеток (например, CD52+ раковых клеток), при необходимости. В контексте данного изобретения термин «снижение количества лимфоцитов» представляет собой иммуносупрессию путем снижения популяции циркулирующих лимфоцитов, например, Т-клеток и/или В-клеток, что приводит к лимфопении. Иммуноглобулины по данному изобретению также могут использоваться для ингибирования ангиогенеза, как это подробно описано ниже. Иммуноглобулины по данному изобретению также могут использоваться для увеличения количества гематопоэтических стволовых клеток, например, в ходе использования ex vivo (см., например, Lim et. al., J. Hematology & Oncology 1:19 (2008)).
Встречающиеся в природе иммуноглобулины обладают общей коровой структурой, в которой две идентичные легкие цепи (примерно 24 кД) и две идентичные тяжелые цепи (примерно 55 или 70 кД) образуют тетрамер. Аминотерминальный участок каждой цепи известен как вариабельный (V) фрагмент и отличается от более консервативных константных (С) участков оставшейся части обеих цепей. В вариабельном участке легкой цепи (также называемый доменом VL) находится С-терминальный участок, известный как J-участок. Кроме J участка, в вариабельном участке тяжелой цепи (называемым также доменом VH) существует D участок. Большинство вариаций аминокислотной последовательности в иммуноглобулинах относится к трем отдельным локациям в V участках, известным как гипервариабельные участки или определяющие комплементарность участки (CDR), которые непосредственным образом задействованы в связывании антигена. Начиная от амино-терминального конца, такие участки обозначаются как CDR1, CDR2 и CDR3, соответственно. CDR удерживаются вместе более консервативными каркасными участками (FR). Начиная от амино-терминального конца, такие участки обозначаются как FR1, FR2, FR3 и FR4, соответственно. Расположение участков CDR и FR и система нумерации была определена Kabat et. al. (Kabat, E.A., et. al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, U.S. Government Printing Office (1991), Chothia & Lesk, Canonical Structures for the Hypervariable Regions of Immunoglobulins, J. Mol. Biol., 196, 901-917 (1987), and the IMGT® numbering system (The International Immunogenetics Information System®, Lefranc, M.-P., The Immunologist 7, 132-136 (1999). Визуальная инспекция и анализ последовательности могут проводиться для идентификации границ CDR. Для данного изобретения последовательности CDR определяют путем использования системы Kabat и системы IMGT, при этом, когда CDR, определенные с использованием двух систем, не полностью перекрываются, мы включаем все остатки из последовательностей, определенных с использованием двух систем.
Иммуноглобулины человека могут подразделяться на классы и подклассы, в зависимости от изотипа тяжелой цепи. Классы включают IgG, IgM, IgA, IgD и IgE, в которых тяжелые цепи представлены типом гамма (γ), мю (μ), альфа (α), дельта (δ) или эпсилон (ε), соответственно. Подклассы включают IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2, в которых тяжелые цепи представлены типом γ1, γ2, γ3, γ4, α1 и α2, соответственно. Молекулы иммуноглобулина человека выбранного класса или подкласса могут включать каппа (κ) или лямбда (λ) легкую цепь. См., например, Cellular and Molecular Immunology, Wonsiewicz, M.J., Ed., Chapter 45, pp. 41-50, W. B. Saunders Co., Philadelphia, PA 91991); Nisonoff, A., Introduction to Molecular Immunology, 2nd Ed., Chapter 4, pp. 45-65, Sinauer Associates, Inc., Sunderland, MA (1984).
В контексте данного изобретения термины «иммуноглобулин» и «антитело», которые используются взаимозаменяемым образом, относятся к целым антителам и антигенсвязывающим фрагментам (т.е. «антигенсвязывающим участкам» - оба термина используются взаимозаменяемым образом). Антигенсвязывающие фрагменты антител могут быть представлены, например, в виде одноцепочечных антител, фрагментов Fv, фрагментов Fab, фрагментов Fab', фрагментов F(ab')2, фрагментов Fd, одноцепочечных молекул Fv (scFv), одноцепочечных биспецифических димеров Fv (PCT/US92/09665), диател, не содержащих домен антител и антител с одним доменом (dAb). См., например, Nature Biotechnology 22(9):1161-1165 (2004)). Кроме того, в контекст данного изобретения включены антигенсвязывающие молекулы, содержащие VH и/или VL. В случае VH, молекулы также могут состоять их одного или нескольких CH1, каркасного участка, CH2 и CH3. Такие одноцепочечные антитела также рассматриваются в контексте термина «антигенсвязывающий фрагмент» антитела.
Участок или фрагменты антитела могут быть получены путем ферментативного расщепления или способами рекомбинации. Например, расщепление папином или пепсином может использоваться для получения фрагментов Fab или F(ab')2, соответственно антитела также могут быть получены в виде целого ряда процессированных форм с использованием генов антител, в которых один или несколько стоп-кодонов были введены выше естественного места прекращения трансляции. Например, рекомбинантный вектор, кодирующий тяжелую цепь фрагмента F(ab')2, может быть разработан для включения последовательностей ДНК, кодирующих домен CH1 и шарнирный участок тяжелой цепи. Предпочтительные антигенсвязывающие фрагменты обладают специфичностью связывания с CD52 человека дикого типа.
В другом аспекте изобретения описан вариант антитела или его фрагмент, при этом такой указанный вариант связывается с CD52 человека специфическим образом, но отличается от эталонного антитела или его фрагмента по 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным заменам (например, в участке CDR, участке FR или константном домене). Например, вариантное антитело имеет, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 97% или, по меньшей мере, 99% идентичность относительно эталонного антитела и тяжелой цепи, вариабельного домена тяжелой цепи, легкой цепи или вариабельного домена легкой цепи.
Подобие последовательности или идентичность полипептидов, которые также указаны как идентичность последовательности, обычно измеряется с использованием программного обеспечения для анализа последовательности. Программное обеспечение для анализа белка сопоставляет подобные последовательности с использованием мер подобия, присваиваемых различным заменам, делециям и другим модификациям, включая замены консервативных аминокислот. Например, GCG содержит программу, такую как «Gap» и «Bestfit», которые могут использоваться с установленными по умолчанию параметрами для определения гомологичности последовательности или идентичности последовательности между родственными полипептидами, такими как гомологичные полипептиды от различных видов организмов или между белком дикого типа или его мутеином. См., например, GCG, версия 6.1. Последовательности полипептида также могут быть сопоставлены с использованием FASTA и рекомендуемых или установленных по умолчанию параметров программы в GCG, версия 6.1. FASTA (например, FASTA2 и FASTA3) осуществляет выравнивание и расчет процентного показателя идентичности участков с наилучшим перекрыванием между запрашиваемыми и поисковыми последовательностями (Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000)). Другой преимущественный алгоритм при сравнении последовательности по изобретению с базой данной, содержащей большое количество последовательностей от различных организмов, представлен компьютерной программой BLAST, в частности, blastp или tblastn, с использованием параметров по умолчанию. См., например, Altschul et. al., J. Mol. Biol. 215:403-410 (1990); Altschul et. al., Nucleic Acids Res. 25:3389-402 (1997) (включено в данной документ посредством ссылки).
Согласно изобретению, один тип аминокислотной замены, который может использоваться, представляет собой замену одного или нескольких остатков цистеина в антителе, которые могут быть химически реакционоспособными, другим остатком, например, не ограничиваясь, аланином или серином. В одном варианте воплощения изобретения описана замена неканонического цистеина. Замена может быть проведена в CDR или каркасном участке вариабельного домена или в константном домене антитела. В некоторых вариантах воплощения изобретения цистеин является каноническим. Другой тип аминокислотной замены, который может использоваться, представлен удалением потенциальных протеолических сайтов антитела. Такие сайты могут присутствовать в CDR или каркасном участке вариабельного домена или в константном домене антитела. Замена остатков цистеина и удаление протеолитических сайтов может снизить риск гетерогенности в антителе и, таким образом, повысить его гомогенность. Другой тип аминокислотной замены представлен элиминацией пар аспарагин-глицин, которые образуют потенциальные участки дезамидирования, путем изменения одного или обоих остатков. В другом аспекте изобретения антитело может быть деиммунизировано для снижения иммуногенности с использованием способов, описанных, например, в PCT Publication WO98/52976 and WO00/34317.
Другой тип аминокислотной замены, которая может быть использована в одном из вариантов по изобретению, представлен заменой консервативной аминокислоты. «Замена консервативной аминокислоты» представлена заменой, при которой аминокислотный остаток замещается другим аминокислотным остатком, имеющим R-группу в боковой цепи и подобные химические свойства (например, заряд или гидрофобность). В целом, замена консервативных аминокислот существенно не изменит функциональные свойства белка. В случаях, когда две или более последовательности аминокислот отличаются друг от друга по заменам консервативных аминокислот, процентный показатель идентичности последовательности или степень подобия может быть скорректирована в сторону увеличения для исправления консервативной природы замены. Средства для внесения таких корректировок хорошо известны специалисту в данной области. См., например, Pearson, Methods Mol. Biol. 243:307-31 (1994).
Примеры групп аминокислот, которые имеют боковые цепи с похожими химическими свойствами, включают 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) гидроксильно-алифатические боковые цепи: серин и треонин; 3) амидо-содержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) основные боковые цепи: лизин, аргинин и гистидин; 6) кислотные боковые цепи: аспарагиновая кислота и глутаминовая кислота; и 7) серосодержащие боковые цепи: цистеин и метионин. Преимущественные группы замены консервативных аминокислот представлены следующими: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. С другой стороны, консервативная замена является любым изменением с положительным значением в матрице логарифмического правдоподобия PAM250, описанной в Gonnet et. al., Science 256:1443-45 (1992). «Умеренно консервативная» замена является любым изменением, имеющим неотрицательное значение в матрице логарифмического правдоподобия PAM250.
В определенных вариантах воплощения изобретения аминокислотные замены в антителе или антигенсвязывающем фрагменте по изобретению приводят к следующему: (1) снижение восприимчивости к протеолизу; (2) снижение восприимчивости к окислению; (3) изменение аффинности связывания для образования белковых комплексов, например, для повышения активности АЗКЦ и КЗЦ антитела; (4) изменение или придание других физико-химических или функциональных свойств таких аналогов, но сохранение специфического связывания с CD52 человека; (5) удаление С-отрицательного лизина; и (6) добавление или удаление участков гликозилирования.
В одном аспекте изобретение описывает новый и новейший полипептид, состоящий из тяжелой или легкой цепи антитела по данному изобретению, или представленный содержащим вариабельный домен фрагментом тяжелой или легкой цепи. Такой полипептид полезен, поскольку он может выступать в качестве партнера с противоположной (тяжелой или легкой) цепью антитела с образованием CD52-связывающей молекулы.
Гуманизированные иммуноглобулины
В данной заявке описаны гуманизированные иммуноглобулины, состоящие из CDR новейших мышиных антител к CD52 человека. В одном варианте воплощения изобретения гуманизированный иммуноглобулин состоит из гуманизированной легкой цепи, имеющей аминокислотную последовательность CDR, отличающуюся от аминокислотной последовательности других гуманизированных версий антител к CDR (например, Кампат®).
Термин «гуманизированный иммуноглобулин» в контексте данного изобретения относится к иммуноглобулину, состоящему из цепей, включающих один или несколько CDR (CDR1, CDR2 и CDR3) легкой цепи и один или несколько CDR (CDR1, CDR2 и CDR3) тяжелой цепи антитела к CD52 животного происхождения, также указанного здесь как донорского антитела (например, мышиного антитела к CD52), и, по меньшей мере, фрагмента иммуноглобулина человеческого происхождения (например, каркасного участка или каркасного и константного участков, полученных из легкой и/или тяжелой цепи человеческого происхождения, таких как CDR-привитых антител с или без изменений в каркасных участках). Гуманизированный иммуноглобулин по изобретению состоит, по меньшей мере, из одного CDR, отличающегося от, по меньшей мере, одного CDR (например, от соответствующего CDR), присутствующего в антителе Кампат ®. См., например, Cabilly et. al., патент США No. 4816567; Cabilly et. al., европейский патент No. 0125023 B1; Boss et. al., патент США No. 4816397; Boss et. al., европейский патент No. 0120694 B1; Neuberger, M.S. et. al., WO 86/01533; Neuberger, M.S. et. al., европейский патент No. 0194276 B1; Winter, патент США No. 5225539; Winter, европейский патент No. 0239400 B1; Padlan, E.A. et. al., заявка на европейский патент No. 0519596 Al. См. также Ladner et. al., патент США No. 4946778; Huston, патент США No. 5476786; and Bird, R.E. et. al., Science, 242: 423-426 (1988)) относительно одноцепочечных антител. В некоторых вариантах воплощения изобретения гуманизированные иммуноглобулины представлены деиммунизированными антителами. См., например, Carr et. al., патент США No. 7264806 относительно деиммунизированных иммуноглобулинов, которые были модифицированы для снижения числа потенциальных Т-клеточных антигенных детерминант, уменьшая, таким образом, предрасположенность иммуноглобулина вызывать иммунный ответ после введения человеку.
В отдельных вариантах воплощения изобретения гуманизированный иммуноглобулин состоит из одного или нескольких CDR легкой цепи и одного или нескольких CDR тяжелой цепи одного или нескольких следующих моноклональных мышиных антител: мышиное антитело 8G3.25.3.5, мышиное антитело 4G7.F3, мышиное антитело 9D9.A2, мышиное антитело 11C11.C5, мышиное антитело 3G7.E9, мышиное антитело 5F7.1.1.4, мышиное антитело 12G6.15.1.2, мышиное антитело 23E6.2.2.1, мышиное антитело 2C3.3.8.1, мышиное антитело 7F11.1.9.7 и мышиное антитело 4B10.1.2.4.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин связывается с CD52 человека с аффинностью, подобной или превышающей аффинность антитела Кампат®. В отдельном варианте воплощения изобретения гуманизированный иммуноглобулин по данному изобретению обладает специфичностью связывания мышиного антитела к CD52 человека по изобретению (например, обладает специфичностью относительно CD52 человека, обладает такой же самой или подобной специфичностью к антигенной детерминанте) и/или обладает подобной ингибиторной функцией. Гуманизированные иммуноглобулины могут обладать специфичностью связывания и/или ингибиторной активностью мышиного антитела к CD52 человека или гуманизированного антитела к CD52 человека, описанного в тексте данной заявки, и/или специфичностью относительно антигенной детерминанты мышиного антитела к CD52 человека или описанного здесь гуманизированного антитела к CD52 человека (например, они могут конкурировать с мышиным антителом к CD52 человека или другим гуманизированным антителом к CD52 (например, Кампатом®) за связывание с CD52, и/или обладать ингибиторной функцией мышиного или гуманизированного антитела к CD52 человека). В отдельных вариантах воплощения изобретения гуманизированный иммуноглобулин обладает специфичностью связывания, специфичностью к антигенной детерминанте и/или ингибиторной активностью любого из мышиных антител 8G3, 4G7, 9D9, 11C11, 3G7, 5F7, 12G6, 23E6, 2C3, 7F11 и 4B10.
Фрагмент гуманизированного иммуноглобулина или цепи иммуноглобулина человеческого происхождения (например, каркасный участок, константный участок) может быть получен из любого подходящего иммуноглобулина человека или цепи иммуноглобулина. Например, константный участок или его фрагмент в гуманизированном или химерном антителе может быть получен из гена κ или λ легкой цепи человека, и/или гена γ (например, γ1, γ2, γ3, γ4), μ, α (например, α1, α2), δ или ε тяжелой цепи человека, включая аллельные варианты. Отдельный константный участок (например, IgG1), вариант или его фрагмент может быть выбран для придания эффекторной функции. Например, мутированный константный участок (вариант) может быть введен в иммуноглобулин или цепь иммуноглобулина для сведения к минимуму связывания с рецепторами Fc и/или способности фиксировать комплемент. (См., например, Winter et. al., GB 2,209,757 B; Morrison et. al., WO 89/07142; Morgan et. al., WO 94/29351, December 22, 1994). В одном варианте воплощения изобретения каркасный участок человека в своей структуре или последовательности не содержит какой-либо вариации или мутации. В отдельном варианте воплощения изобретения каркасный участок представлен последовательностью каркасного участка зародышевой линии, не содержащей мутаций или вариаций в своей последовательности.
В контексте данного изобретения термин «зародышевая линия» относится к нуклеотидным последовательностям и аминокислотным последовательностям генов антитела и сегментов генов в том виде, в котором они передаются от родителей потомству посредством клеток зародышевой линии. Последовательности зародышевой линии отличаются от нуклеотидных последовательностей, кодирующих антитела в зрелых В-клетках, которые были изменены в ходе рекомбинации или гипермутации в процессе созревания В-клеток. Антитело, «использующее» отдельную зародышевую линию, имеет нуклеотидную или аминокислотную последовательность, которая наиболее соответствует нуклеотидной последовательности зародышевой линии или аминокислотной последовательности. Такие антитела часто мутированы в сравнении с последовательностью зародышевой линии.
В других вариантах воплощения изобретения каркасный участок человека имеет минимальную вариацию в сравнении с последовательностью зародышевой линии в своей структуре или последовательности (например, менее чем 3, 4, 5, 6, 7, 8, 9 или 10 акцепторных остатков каркасного участка были замещены донорскими остатками каркасного участка для улучшения аффинности связывания, см. Queen et. al., патент США No. 5530101). В отдельном варианте воплощения изобретения ограниченное количество аминокислот в каркасном участке цепи гуманизированного иммуноглобулина (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) выбирают для соответствия аминокислотам в таких же самых положениях донорской последовательности (т.е. «обратно мутировавшей»), в отличие от акцепторной последовательности, для повышения аффинности антитела, состоящего из цепи гуманизированного иммуноглобулина к CD52 человека.
Каркасные участки человека (например, вариабельных участков тяжелой и/или легкой цепи) преимущественно получают из вариабельного участка антитела человека, имеющего последовательность, подобную аналогичным или эквивалентным участкам (например, вариабельных участков тяжелой и/или легкой цепи) антигенсвязывающего фрагмента донорского иммуноглобулина (мышиного антитела к CD52). Другие источники каркасных участков для фрагментов человеческого происхождения гуманизированного иммуноглобулина включают консенсусные последовательности вариабельного участка человека (см., например, Kettleborough, C. A. et. al., Protein Engineering 4:773-783 (1991); Carter et. al., WO 94/04679; Carter патент США No. 6407213). Например, участок донорской последовательности антитела (например, последовательности вариабельного участка), используемый для получения животного фрагмента, может быть сопоставлен с последовательностью человека, как это описано в Kabat, E. A. et. al. Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, U.S. Government Printing Office (1991), для выбора отдельного источника фрагментов человека гуманизированного иммуноглобулина, например, источника каркасных участков.
В одном варианте воплощения изобретения каркасные участки цепей гуманизированного иммуноглобулина получены из вариабельного участка Ig человека, обладающего, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90% или, по меньшей мере, 95% идентичностью всей последовательности относительно вариабельного участка донора животного происхождения. В отдельном варианте воплощения изобретения каркасные участки цепей гуманизированного иммуноглобулина получены из каркасного участка вариабельного участка человека, обладающего, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90% или, по меньшей мере, 95% идентичностью всей последовательности относительно каркасных участков вариабельного участка иммуноглобулина-донора животного происхождения.
В одном варианте воплощения изобретения, по меньшей мере, один из каркасных участков (FR) гуманизированного иммуноглобулина получен из одной или нескольких цепей антитела человеческого происхождения. Таким образом, FR может включать FR1 и/или FR2 и/или FR3 и/или FR4, полученные из одного или нескольких антител человеческого происхождения (например, из цепи иммуноглобулина человека, консенсусной последовательности человека).
Фрагменты иммуноглобулина для использования в данном изобретении содержат последовательности, которые идентичны или подобны иммуноглобулинам, из которых они получены, или их вариантам. Такие варианты включают мутации, отличающиеся по добавлению, делеции или замене (например, консервативным заменам) одного или нескольких остатков, например, отличающиеся по 3, 4, 5, 6, 7, 8, 9 или 10 остаткам в сравнении с исходной последовательностью в ходе одного или нескольких добавлений, делеций или замен. Как было указано выше, гуманизированный иммуноглобулин по изобретению состоит из одного или нескольких CDR из одного или нескольких мышиных антител к CD52 (донорских антител), описанных в данной заявке. Могут быть осуществлены такие изменения в каркасном участке, как замена остатка каркасного участка человеческого происхождения остатком из соответствующей позиции антитела-донора. Может быть проведено одна или несколько мутаций, включая делеции, вставки и замены одной или нескольких аминокислот в каркасном участке. При желании, мутации в каркасном участке могут быть включены в гуманизированное антитело или цепь, и сайты для мутации выбирают с использованием любого подходящего способа, например, описанного в WO 98/06248 (полное описание документа включено сюда во всей своей полноте посредством ссылки).
Специалисту в данной области следует иметь в виду, что в некоторых случаях фланкирующие остатки на одном или нескольких CDR мышиного антитела (антител) к CD52 могут способствовать, а в некоторых случаях и быть незаменимыми, прямо или косвенно функционированию антитела (например, связыванию). Таким образом, в некоторых вариантах воплощения изобретения одна или несколько фланкирующих аминокислот в одном или нескольких CDR (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 фланкирующих аминокислот) мышиного каркасного участка также включены в гуманизированный иммуноглобулин.
В некоторых вариантах воплощения изобретения каркасные участки тяжелой цепи человека в гуманизированных антителах по данному изобретению используют последовательность зародышевой линии человека VH3-72 или VH3-23. В некоторых вариантах воплощения изобретения каркасные участки легкой цепи человека в гуманизированных антителах по данному изобретению используют последовательность зародышевой линии человека Vk2-A18b. В некоторых случаях в одном или нескольких остатках участков FR могут быть включены обратные мутации, как это описано в Рабочих примерах ниже, для улучшения аффинности связывания гуманизированного антитела с CD52.
Термин «аффинность» описывает силу взаимодействия при связывании и обычно относится к общей силе связывания иммуноглобулина с CD52 человека.
В отдельном варианте воплощения изобретения иммуноглобулин обладает аффинностью связывания, измеренной как значение EC50 менее 10 мкг/мл (например, как это определено проточной цитометрией). В другом варианте воплощения изобретения иммуноглобулин обладает аффинностью связывания, измеренной как значение EC50 менее 5,0 мкг/мл или менее 1,0 мкг/мл (например, как это определено проточной цитометрией).
В некоторых вариантах воплощения изобретения иммуноглобулин связывается с CD52 человека с аффинностью (KD; KD=Koff (kd)/Kon (ka)) от 300 нМ до 1 пМ (т.е. от 3×10-7 до 1×10-12M), преимущественно от 50 нМ до 1 пМ, более преимущественно от 5 нМ до 1 пМ и еще более преимущественно от 1 нМ до 1 пМ, например, значение KD составляет 1 ×10-7 М или менее, преимущественно 1 ×10-8 М или менее, более преимущественно 1×10-9 М или менее, предпочтительно 1×10-10 М или менее и более преимущественно 1×10-11 М или 1×10-12 М или менее; и/или значение константы скорости Koff составляет от 5×10-1 с-1 до 1×10-7 с-1, преимущественно от 1×10-2 с-1 до 1×10-6 с-1, более преимущественно от 5× 10-3 с-1 до 1×10-5 с-1, например, 5×10-1 с-1 или менее, преимущественно 1×10-2 с-1 или менее, предпочтительно 1×10-3 с-1 или менее, более преимущественно 1×10-4 с-1 или менее, и еще более преимущественно 1×10-5 с-1 или менее, и более преимущественно 1×10-6 с-1 или менее, как это определено способом поверхностного плазмонного резонанса.
Как это очевидно для специалиста в данной области, для подтверждения того, что иммуноглобулины произведены в соответствии с представленными здесь и известными науке способами и обладают необходимой специфичностью (например, специфичностью связывания, специфичностью относительно антигенной детерминанты), может использоваться целый ряд способов. Например, функция связывания гуманизированного иммуноглобулина к CD52 по изобретению, обладающего специфичностью связывания с CD52 человека, может быть определена с использованием любого подходящего способа, например, анализов, позволяющих осуществлять мониторинг образования комплекса между гуманизированным иммуноглобулином и CD52 человека (например, мембранной фракции, состоящей из CD52 человека; клетки, несущей CD52 человека, такой как Т-клетка человека, В-клетка человека; клетки СНО или рекомбинантной клетки-хозяина, включающей и экспрессирующей нуклеиновую кислоту, кодирующую CD52 человека; пептид (например, синтетический пептид), имеющий аминокислотную последовательность CD52; твердый субстрат, включающий CD52 человека).
Способность иммуноглобулина по изобретению (например, гуманизированного иммуноглобулина по изобретению) связываться с одной и той же антигенной детерминантой на CD52 как отдельное мышиное, химерное или гуманизированное моноклональное антитело или связываться с антигенной детерминантой на CD52 человека, которая перекрывается с антигенной детерминантой CD52 человека, с которой связывается отдельное мышиное, химерное или гуманизированное моноклональное антитело, может быть легко определена с использованием целого ряда способов, известных науке, включая, например, анализы конкурентного связывания. Анализы могут предполагать использование меченой формы отдельного указанного антитела и измерение связывания такого меченого антитела с CD52 человека в присутствии и отсутствии иммуноглобулина по изобретению.
В контексте данного изобретения термин «антигенная детерминанта» включает любую белковую детерминанту, способную специфически связываться с иммуноглобулином. Антигенные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как боковые цепи аминокислот, углеводов или сахаров, и обычно обладают тремя специфическими пространственными структурными характеристиками, а также специфическими характеристиками заряда. Антигенная детерминанта может быть «линейной» или «конформационной». В линейной антигенной детерминанте все точки взаимодействия между белком и взаимодействующей молекулой (такой как антитело) возникают линейно вдоль первичной аминокислотной последовательности белка. В конформационной антигенной детерминанте точки взаимодействия возникают вдоль аминокислотных остатков белка, которые отделены друг от друга. Как только определена требуемая антигенная детерминанта на антигене, возможно получение антител к такой антигенной детерминанте, например, с использованием способов, описанных в данном изобретении. С другой стороны, в ходе процесса открытия получение и характеристика антител поможет выявить информацию о требуемых антигенных детерминантах. С использованием такой информации затем возможно провести конкурентный скрининг антител на предмет связывания с одной и той же антигенной детерминантой. Подход для достижения такого связывания заключается в проведении исследований конкурентного связывания для поиска антител, которые конкурентным образом связываются друг с другом, т.е. антитела конкурируют за связывание с антигеном.
В одном варианте воплощения изобретения для определения связывания исследуемого антитела с одной и той же или перекрывающейся антигенной детерминантой гуманизированного антитела по данному изобретению, осуществляют связывание антитела к CD52 по изобретению с CD52 в условиях насыщения с последующим измерением способности исследуемого антитела связываться с CD52. Если исследуемое антитело способно связываться с CD52 в то же самое время, что и эталонное антитело к CD52, то исследуемое антитело связывается с другой антигенной детерминантой, чем эталонное антитело к CD52. Однако если исследуемое антитело не способно связываться с CD52 в то же самое время, тогда исследуемое антитело связывается с той же самой антигенной детерминантой, перекрывающейся антигенной детерминантой или антигенной детерминантой, находящейся в непосредственной близости к антигенной детерминанте, связанной антителом к CD52 по изобретению. Такой эксперимент может проводиться с использованием ИФА, РИА, BIACORETM или проточной цитометрии. Для исследования способности антитела к CD52 конкурировать перекрестным образом с другим антителом к CD52, можно использоваться способ конкурентного взаимодействия, описанный выше, т.е. определение способности эталонного антитела блокировать исследуемое антитело и наоборот. В отдельном варианте воплощения изобретения эксперимент проводится с использованием анализа BIACORETM.
Количественное измерение степени связывания антигенной детерминанты также может быть полезным для характеристики антител по изобретению. Термин «количественное измерение степени связывания» относится к способу группирования антител на основе их антигенсвязывающих характеристик. Процесс количественного измерения степени связывания таких антител с высокой производительностью основывается на перекрестной конкуренции антител и описан в заявке на международный патент No. WO 03/48731. «Количественное измерение степени связывания антигенной детерминанты» может быть исследовано путем связывания немеченой формы антитела «А» к CD52 с синтетическим пептидом, соответствующим последовательности CD52 или CD52-положительных клеток. Впоследствии добавляют второе меченое антитело «В» к CD52 и производят оценку количества меченого антитела, которое связывается в сравнении с контрольным образцом, в котором клетки или синтетический пептид не были ранее подвержены воздействию антителом «А» к CD52. С другой стороны, антитела «А» и «В» к CD52 могут быть мечены различными флуорохромами или химическими препаратами, позволяющими проводить определение, и могут быть измерены с использованием количеств меченых антител с вовлечением пептида CD52 и в то же самое время с использованием прибора, способного определить метку или измерить количества обоих антител, одновременно задействующих CD52-положительные клетки в ходе проточной цитометрии. Технологии Biacore и Octet позволяют исследовать конкурентное связывание немеченых форм антител. Такое применение немеченых форм антител желательно, поскольку химическая модификация некоторых антител может снижать аффинность связывания. См. также технологию, описанную в Jia et. al., J. Immunol. Methods 288:91-98 (2004), которая может оказаться полезной для количественного определения связывания с антигенной детерминантой.
Кроме того, данное изобретение описывает фрагменты гуманизированных иммуноглобулинов, такие как легкие цепи, тяжелые цепи и фрагменты легких и тяжелых цепей. Такие фрагменты иммуноглобулинов могут быть получены из иммуноглобулинов (например, путем восстановления и/или расщепления) или выработаны или экспрессированы нуклеиновыми кислотами, кодирующими фрагмент иммуноглобулина или его цепи, обладающие необходимым свойством (например, связываться с CD52 человека, подобие последовательностей). Они могут быть получены, например, синтезом de novo соответствующего фрагмента. Гуманизированные иммуноглобулины, состоящие из необходимых фрагментов (например, антигенсвязывающий фрагмент, CDR, FR, C-участок) человеческого и животного происхождения, могут быть получены с использованием синтетических и/или рекомбинантных нуклеиновых кислот для получения векторов (например, кДНК), кодирующих требуемую гуманизированную цепь. Например, для получения фрагмента иммуноглобулина (например, фрагмента цепи) в установленное положение может быть введен один или несколько стоп-кодонов. Последовательности нуклеиновой кислоты (например, ДНК), кодирующей гуманизированные вариабельные участки, могут быть сконструированы с использованием способов мутагенеза ПЦР для изменения существующих последовательностей ДНК (см., например, Kamman, M., et. al., Nucl. Acids Res. 17:5404 (1989)). Праймеры ПЦР, кодирующие новые CDR, могут быть гибридизированы в матричную ДНК предварительно гуманизированного вариабельного участка, основанного на таком же или очень похожем вариабельном участке человека (Sato, K., et. al., Cancer Research 53:851-856 (1993)). Если в качестве матрицы невозможно использовать похожую последовательность ДНК, нуклеиновая кислота, включающая последовательность, кодирующую последовательность вариабельного участка, может быть сконструирована с использованием синтетических олигонуклеотидов (см., например, Kolbinger, F., Protein Engineering 8:971-980 (1993)). Последовательность, кодирующая сигнальный пептид, также может быть включена в нуклеиновую кислоту (например, в ходе синтеза, путем вставки в вектор). Если последовательность сигнального пептида недоступна (например, обычно отсутствует), может использоваться последовательность сигнального пептида из другого антитела (см., например, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). При использовании таких способов и способов, описанных в тексте данной заявки, или других подходящих способов могут быть легко получены варианты.
Изобретение также описывает гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека и состоящий из гуманизированной легкой цепи и гуманизированной тяжелой цепи и/или их участков. В одном варианте воплощения изобретения гуманизированный иммуноглобулин состоит из легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 4, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 17; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 5, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 18; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 6, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 19; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 7, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 20; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 8, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 21; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 9, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 22; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 10, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 23; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 11, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 24; легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 12, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 25; или легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 13, и тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 26.
В одном варианте воплощения изобретения гуманизированный иммуноглобулин по изобретению состоит из (H)-CDR1, H-CDR2, H-CDR3 тяжелой цепи и (L)-CDR1, L-CDR2, и L-CDR3 легкой цепи, при этом аминокислотные последовательности таких цепей представлены следующими: а) SEQ ID NO: 51, 59, 69, 29, 36 и 43, соответственно; б) SEQ ID NO: 50, 60, 69, 29, 37 и 43, соответственно; в) SEQ ID NO: 50, 61, 68, 29, 38 и 43, соответственно; г) SEQ ID NO: 50, 61, 69, 29, 36 и 43, соответственно; д) SEQ ID NO: 50, 62, 69, 29, 39 и 43, соответственно; е) SEQ ID NO: 52, 61, 70, 30, 40 и 43, соответственно; ж) SEQ ID NO: 53, 63, 71, 31, 36 и 44, соответственно; з) SEQ ID NO: 54, 64, 71, 31, 36 и 45, соответственно; и) SEQ ID NO: 55, 63, 72, 31, 36 и 46, соответственно; к) SEQ ID NO: 56, 65, 73, 32, 41 и 47, соответственно; л) SEQ ID NO: 56, 65, 294, 32, 41 и 47, соответственно; или м) SEQ ID NO: 56, 66, 74, 33, 41 и 48, соответственно.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин по изобретению состоит из H-CDR3 и L-CDR3, при этом последовательности таких цепей представлены следующими: а) SEQ ID NO: 69 и 43, соответственно; б) SEQ ID NO: 68 и 43, соответственно; в) SEQ ID NO: 70 и 43, соответственно; г) SEQ ID NO: 71 и 44, соответственно; д) SEQ ID NO: 71 и 45, соответственно; е) SEQ ID NO: 72 и 46, соответственно; ж) SEQ ID NO: 73 и 47, соответственно; з) SEQ ID NO: 294 и 47, соответственно; или и) SEQ ID NO: 74 и 48, соответственно.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека, состоит из легкой цепи, содержащей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48; тяжелой цепи, содержащей один или несколько CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294; или их комбинации, при этом гуманизированный иммуноглобулин не является антителом Кампат®.
В другом варианте воплощения изобретения гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека, состоит из легкой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13; тяжелой цепи, состоящей из одного или нескольких CDR (например, всех трех CDR) с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 137; при этом гуманизированный иммуноглобулин не является антителом Кампат®.
Изобретение также описывает гуманизированную легкую цепь описанного здесь гуманизированного иммуноглобулина по изобретению. В одном варианте воплощения изобретения легкая цепь гуманизированного иммуноглобулина состоит из одного или нескольких CDR, состоящих из группы последовательностей, включающей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48 или их комбинации, при этом легкая цепь гуманизированного иммуноглобулина не является гуманизированной легкой цепью антитела Кампат®. Например, гуманизированное антитело состоит из L-CDR1, L-CDR2 и L-CDR3, аминокислотные последовательности которых представлены следующими: а) SEQ ID NO: 29, 36 и 43, соответственно; б) SEQ ID NO: 29, 37 и 43, соответственно; в) SEQ ID NO: 29, 38 и 43, соответственно; г) SEQ ID NO: 29, 36 и 43, соответственно; д) SEQ ID NO: 29, 39 и 43, соответственно; е) SEQ ID NO: 30, 40 и 43, соответственно; ж) SEQ ID NO: 31, 36 и 44, соответственно; з) SEQ ID NO: 31, 36 и 45, соответственно; и) SEQ ID NO: 31, 36 и 46, соответственно; к) SEQ ID NO: 32, 41 и 47, соответственно; или л) SEQ ID NO: 33, 41 и 48, соответственно.
Изобретение также описывает гуманизированную тяжелую цепь, состоящую из одного или нескольких CDR, выбираемых из группы последовательностей, включающей SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 294 или их комбинации, при этом гуманизированная тяжелая цепь иммуноглобулина не является тяжелой цепью антитела Кампат®. Например, гуманизированное антитело состоит из H-CDR1, H-CDR2 и H-CDR3, аминокислотные последовательности которых представлены следующими: а) SEQ ID NO: 51, 59 и 69, соответственно; б) SEQ ID NO: 50, 60 и 69, соответственно; в) SEQ ID NO: 50, 61 и 68, соответственно; г) SEQ ID NO: 50, 61 и 69, соответственно; д) SEQ ID NO: 50, 62 и 69, соответственно; е) SEQ ID NO: 52, 61 и 70, соответственно; ж) SEQ ID NO: 53, 63 и 71, соответственно; з) SEQ ID NO: 54, 64 и 71, соответственно; и) SEQ ID NO: 55, 63 и 72, соответственно; к) SEQ ID NO: 56, 65 и 73, соответственно; или л) SEQ ID NO: 56, 65 и 294, соответственно; или м) SEQ ID NO: 56, 66 и 74, соответственно.
В одном варианте воплощения изобретения гуманизированное антитело по данному изобретению состоит из легкой цепи, включающей последовательность вариабельного домена (VL) с последовательностями SEQ ID NO: 102, 138, 145-148, 153-157 и 164-168. В родственном варианте воплощения изобретения гуманизированное антитело состоит из легкой цепи, чья аминокислотная последовательность представлена SEQ ID NO: 273, 275, 278, 280 и 282.
В одном варианте воплощения изобретения гуманизированное антитело по данному изобретению состоит из тяжелой цепи, включающей последовательность вариабельного домена (VH) с последовательностями SEQ ID NO: 103, 136, 137, 139-144, 149-152 и 158-163. В родственном варианте воплощения изобретения гуманизированное антитело состоит из тяжелой цепи, чья аминокислотная последовательность представлена SEQ ID NO: 272, 274, 276, 277, 279 и 281.
В некоторых вариантах воплощения изобретения гуманизированное антитело по данному изобретению состоит из VH и VL, чья аминокислотная последовательность представлена следующим:
а) SEQ ID NO: 103 и 102, соответственно (4B10-H1/K1);
б) SEQ ID NO: 136 и 138, соответственно (7F11-SFD1/K2);
в) SEQ ID NO: 137 и 138, соответственно (7F11-SFD1/K2);
г) SEQ ID NO: 139 и одна из SEQ ID NO: 145-148, соответственно (например, SEQ ID NO: 139 и 146, соответственно (2C3-SFD1/K11); и SEQ ID NO: 139 и 147, соответственно (2C3-SFD1/K12));
д) SEQ ID NO: 140 и одна из SEQ ID NO: 145-148, соответственно;
е) SEQ ID NO: 141 и одна из SEQ ID NO: 145-148, соответственно;
ж) SEQ ID NO: 142 и одна из SEQ ID NO: 145-148, соответственно;
з) SEQ ID NO: 143 и одна из SEQ ID NO: 145-148, соответственно;
и) SEQ ID NO: 144 и одна из SEQ ID NO: 145-148, соответственно;
к) SEQ ID NO: 149 и одна из SEQ ID NO: 153-157, соответственно (например, SEQ ID NO: 149 и 155, соответственно (12G6-SFD1/K11); SEQ ID NO: 149 и 156, соответственно (12G6-SFD1/K11); и SEQ ID NO: 149 и 157, соответственно (12G6-SFD1/K13));
л) SEQ ID NO: 150 и одна из SEQ ID NO: 153-157, соответственно;
м) SEQ ID NO: 151 и одна из SEQ ID NO: 153-157, соответственно;
н) SEQ ID NO: 152 и одна из SEQ ID NO: 153-157, соответственно;
о) SEQ ID NO: 158 и одна из SEQ ID NO: 164-168, соответственно (например, SEQ ID NO: 158 и 165, соответственно (9D9-H10/K12); и SEQ ID NO: 158 и 166, соответственно (9D9-H10/K13));
п) SEQ ID NO: 159 и одна из SEQ ID NO: 164-168, соответственно (например, SEQ ID NO: 159 и 165, соответственно (9D9-H11/K12); и SEQ ID NO: 159 и 166, соответственно (9D9-H11/K13));
р) SEQ ID NO: 160 и одна из SEQ ID NO: 164-168, соответственно;
с) SEQ ID NO: 161 и одна из SEQ ID NO: 164-168, соответственно (например, SEQ ID NO: 161 и 166, соответственно (9D9-H16/K13));
т) SEQ ID NO: 162 и одна из SEQ ID NO: 164-168, соответственно; или
у) SEQ ID NO: 163 и одна из SEQ ID NO: 164-168, соответственно (например, SEQ ID NO: 163 и 166, соответственно (9D9-H18/K13)).
Антитела, приведенные в скобках, описываются ниже по тексту в рабочих примерах.
В одном варианте воплощения изобретения гуманизированное антитело по данному изобретению состоит из легкой цепи (LC) и тяжелой цепи (HC), аминокислотная последовательность которых состоит из а) SEQ ID NO: 273 и 272, соответственно; б) SEQ ID NO: 275 и 274, соответственно; в) SEQ ID NO: 278 и 276, соответственно; г) SEQ ID NO: 278 и 277, соответственно; д) SEQ ID NO: 280 и 279, соответственно; или е) SEQ ID NO: 282 и 281, соответственно.
Данное изобретение также описывает антитела к CD52 человека (за исключением любых известных ранее антител), которые связываются с одной и той же антигенной детерминантой или конкурирует перекрестным образом с представленным здесь антителом. Такие антитела могут быть представлены, например, гуманизированными, химерными или мышиными антителами. Например, изобретение описывает антитела к CD52 человека, которые связываются с той же самой антигенной детерминантой или конкурируют обычным или перекрестным образом с одним из мышиных антител 8G3, 4F7, 9D9, 11C11, 3G7, 5F7, 12G6, 23E6, 2C3, 7F11 и 4B10, и гуманизированными и химерными версиями таких мышиных антител. Способность антитела связываться с одной и той же антигенной детерминантой или конкурировать обычным или перекрестным образом с эталонным антителом может быть определена в соответствии с представленным выше описанием. Например, нами было обнаружено, что антигенная детерминанта CD52, связанная гуманизированными антителами 2C3-SFD1/K12 и 12G6-SFD1/K12, включает остатки 7, 8 и 11 в последовательности SEQ ID NO: 104, и что антигенная детерминанта, связанная гуманизированным антителом 9D9-H16/K13, включает остатки 4 и 11 с последовательностью SEQ ID NO: 104. Таким образом, в некоторых вариантах воплощения изобретения описаны антитела к CD52, связывающиеся с одной и той же антигенной детерминантой или конкурирующие прямым или перекрестным образом с такими гуманизированными антителами.
При необходимости, например, в диагностических целях или в целях анализа (например, визуализации, позволяющей, например, проведение мониторинга) гуманизированный иммуноглобулин (например, его антигенсвязывающий фрагмент) может состоять из определяемой метки. Подходящие определяемые метки и способы для мечения гуманизированного иммуноглобулина или его антигенсвязывающих фрагментов хорошо известны науке. Подходящие определяемые метки включают, например, радиоизотоп (например, индий-111, технеций-99m или йод-131), позитрон-излучающие метки (например, фтор-19), парамагнитные ионы (например, гадолиний (III), марганец (II)), эпитопные метки (тэги), метки аффинности (например, биотин, авидин), спиновые метки, фермент, флуоресцирующую группу или хемилюминесцентную группу. Если метки не используются, образование комплекса (например, между гуманизированным иммуноглобулином и CD52 человека) может быть определено путем поверхностного плазмонного резонанса, ИФА, FACS или других подходящих способов.
Антитела к CD52, используемые в изобретении, также могут быть конъюгированы посредством, например, химических реакций или генетических модификаций, в другие молекулы (например, пэгилированные молекулы), которые улучшают фармакокинетику антител, например, время полужизни. В некоторых вариантах воплощения изобретения антитела к CD52, используемые в таком изобретении, могут быть связаны с подходящим цитокином посредством, например, химической конъюгации или генетических модификаций (например, присоединение кодирующей последовательности цитокина в каркас кодирующей антитело последовательности, создавая, таким образом, белок слияния антитело:цитокин).
Изобретение также описывает иммуноконъюгаты, в которых гуманизированный иммуноглобулин (например, его антигенсвязывающие фрагменты) по изобретению соединен с другим терапевтическим агентом, таким как биоактивное соединение (например, цитокины, суперантигены, цитотоксические агенты и токсины). Например, гуманизированный иммуноглобулин, обладающий специфичностью связывания с CD52 человека (например, его антигенсвязывающий фрагмент), может быть соединен с биологическим белком, молекулой растительного или бактериального происхождения (или ее производным), антителом к интерлейкину-2 или антителами к дифтерийному токсину.
Мышиные моноклональные иммуноглобулины
Как это описано в тексте данной заявки, были получены мышиные моноклональные иммуноглобулины, обладающие специфичностью связывания с CD52 человека. Гуманизированные и химерные антитела по данному изобретению могут быть получены из мышиных моноклональных антител по данному изобретению. В некоторых вариантах воплощения изобретения гуманизированные и химерные антитела к CD52 по изобретению состоят из последовательностей, взятых из мышиного моноклонального антитела по изобретению, таких как одна или нескольких последовательностей CDR. Мышиный моноклональный иммуноглобулин по данному изобретению состоит из легкой цепи и тяжелой цепи, обладающих аминокислотными последовательностями CDR, которые отличаются от аминокислотных последовательностей известных мышиных моноклональных антител к CD52 (например, из CF1D12).
В контексте данного изобретения термин «мышиный моноклональный иммуноглобулин» относится к иммуноглобулину, содержащему CDR легкой цепи (L-CDR1, L-CDR2 и L-CDR3) и CDR тяжелой цепи (H-CDR1, H-CDR2 и H-CDR3) мышиного антитела к CD52 человека, а также каркасные и константные участки мышиного происхождения. Мышиные моноклональные иммуноглобулины являются гомогенными антителами с единственной специфичностью и получены, например, путем использования технологии гибридомы или способов рекомбинации.
Изобретение описывает мышиные моноклональные иммуноглобулины, описанные в данной заявке, включая антигенсвязывающие фрагменты (т.е. участки) мышиных моноклональных иммуноглобулинов, легкие цепи мышиных моноклональных иммуноглобулинов, тяжелые цепи мышиных моноклональных иммуноглобулинов и фрагменты таких тяжелых и легких цепей. В отдельном варианте воплощения изобретения мышиное моноклональное антитело представлено мышиным антителом 8G3.25.3.5 (также называется GENZ 8G3.25.3.5 или 8G3), мышиным антителом GMA 4G7.F3 (также называется 4G7.F3 или 4G7), мышиным антителом GMA 9D9.A2 (также называется 9D9.A2 или 9D9), мышиным антителом GMA 11C11.C5 (также называется 11C11.C5 или 11C11), мышиным антителом GMA 3G7.E9 (также называется 3G7.E9 или 3G7), мышиным антителом 5F7.1.1.4 (также называется GENZ 5F7.1.1.4 или 5F7), мышиным антителом 12G6.15.1.2 (также называется GENZ 12G6.15.1.2 или 2G6), мышиным антителом 23E6.2.2.1 (также называется GENZ 23E6.2.2.1 или 23E6), мышиным антителом 2C3.3.8.1 (также называется GENZ 2C3.3.8.1 или 2C3), мышиным антителом 7F11.1.9.7 (также называется GENZ 7F11.1.9.7 или 7F11), или мышиным антителом 4B10.1.2.4 (также называется GENZ 4B10.1.2.4 или 4B10). Изобретение описывает зрелый мышиный моноклональный иммуноглобулин, такой как мышиный моноклональный иммуноглобулин, с последующей обработкой для удаления сигнальных пептидов тяжелой и легкой цепей и/или описывает гликозилированный иммуноглобулин. Изобретение также описывает незрелый белок или белок-предшественник, такой как легкая цепь мышиного иммуноглобулина или тяжелая цепь мышиного иммуноглобулина, состоящий из сигнального пептида. Изобретение также описывает молекулы нуклеиновых кислот (например, векторы), кодирующих как зрелые, так и незрелые белки, клетки-хозяева, которые содержат такую нуклеиновую кислоту, а также способы получения зрелых и незрелых белков.
Функция связывания мышиного моноклонального иммуноглобулина, обладающего специфичностью связывания с CD52 человека, может быть определена с использованием любого подходящего способа, например, анализов, позволяющих осуществлять мониторинг образования комплекса между мышиным моноклональным иммуноглобулином и CD52 человека (например, мембранной фракции, состоящей из CD52 человека; клетки, несущей CD52 человека, такой как Т-клетка человека, В-клетка человека; клетки СНО или рекомбинантной клетки-хозяина, включающей и экспрессирующей нуклеиновую кислоту, кодирующую CD52 человека; пептид (например, синтетический пептид), имеющий аминокислотную последовательность CD52)).
Кроме того, данное изобретение описывает фрагменты мышиных иммуноглобулинов, такие как легкие цепи, тяжелые цепи и фрагменты легких и тяжелых цепей. Такие фрагменты иммуноглобулинов могут быть получены и экспрессированы из иммуноглобулинов (например, путем восстановления и/или расщепления) или выработаны или экспрессированы нуклеиновыми кислотами, кодирующими фрагмент иммуноглобулина или его цепи, обладающие необходимым свойством (например, связываться с CD52 человека, подобие последовательностей). Они могут быть получены, например, синтез de novo фрагмента мышиных моноклональных иммуноглобулинов, состоящих из требуемых фрагментов (например, антигенсвязывающий участок, CDR, FR и/или С-фрагмент мышиного происхождения может быть осуществлен с использованием синтетических и/или рекомбинантных нуклеиновых кислот для получения векторов (например, кДНК), кодирующих необходимую цепь моноклонального иммуноглобулина). Для получения фрагмента цепи в необходимое положение может быть введено один или несколько стоп-кодонов. Последовательность, кодирующая сигнальный пептид, также может быть включена в нуклеиновую кислоту (например, в ходе синтеза, путем вставки в вектор). Если природная последовательность сигнального пептида недоступна, может использоваться последовательность сигнального пептида из другого антитела (см., например, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). При использовании таких способов и способов, описанных в тексте данной заявки, или других подходящих способов могут быть легко получены варианты.
В одном варианте воплощения изобретения мышиное моноклональное антитело по данному изобретению состоит из легкой цепи с последовательностью SEQ ID NO: 3 и тяжелой цепи с последовательностью SEQ ID NO: 16; легкой цепи с последовательностью SEQ ID NO: 4 и тяжелой цепи с последовательностью SEQ ID NO: 17; легкой цепи с последовательностью SEQ ID NO: 5 и тяжелой цепи с последовательностью SEQ ID NO: 18; легкой цепи с последовательностью SEQ ID NO: 6 и тяжелой цепи с последовательностью SEQ ID NO: 19; легкой цепи с последовательностью SEQ ID NO: 7 и тяжелой цепи с последовательностью SEQ ID NO: 20; легкой цепи с последовательностью SEQ ID NO: 8 и тяжелой цепи с последовательностью SEQ ID NO: 21; легкой цепи с последовательностью SEQ ID NO: 9 и тяжелой цепи с последовательностью SEQ ID NO: 22; легкой цепи с последовательностью SEQ ID NO: 10 и тяжелой цепи с последовательностью SEQ ID NO: 23; легкой цепи с последовательностью SEQ ID NO: 11 и тяжелой цепи с последовательностью SEQ ID NO: 24; легкой цепи с последовательностью SEQ ID NO: 12 и тяжелой цепи с последовательностью SEQ ID NO: 25; или легкой цепи с последовательностью SEQ ID NO: 13 и тяжелой цепи с последовательностью SEQ ID NO: 26.
В другом варианте воплощения изобретения также описано мышиное моноклональное антитело, обладающее специфичностью связывания с CD52 человека и состоящее из вариабельного участка легкой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, и вариабельного участка тяжелой цепи, выбираемого из группы последовательностей, включающей SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
При необходимости, например, в диагностических целях или в целях анализа (например, визуализации), мышиный моноклональный иммуноглобулин (например, его антигенсвязывающий фрагмент) может состоять из определяемой метки. Подходящие определяемые метки и способы для мечения мышиного моноклонального иммуноглобулина хорошо известны науке. Подходящие определяемые метки включают, например, радиоизотоп (например, индий-111, технеций-99m или йод-131), позитрон-излучающие метки (например, фтор-19), парамагнитные ионы (например, гадолиний (III), марганец (II)), эпитопные метки (тэги), метки аффинности (например, биотин, авидин), спиновые метки, фермент, флуоресцирующую группу или хемилюминесцентную группу. Если метки не используются, образование комплекса (например, между мышиным моноклональным иммуноглобулином и CD52) может быть определено путем поверхностного плазмонного резонанса или других подходящих способов. Все подходящие способы и процедуры, описанные выше для гуманизированных антител по данному изобретению, также могут использоваться.
Химерные иммуноглобулины
Как это описано в тексте данной заявки, были получены химерные иммуноглобулины, обладающие специфичностью связывания с CD52 человека. Химерный иммуноглобулин состоит из химерной легкой цепи и/или химерной тяжелой цепи, имеющих аминокислотные последовательности, которые отличаются от аминокислотной последовательности известных химерных антител, обладающих специфичностью связывания с CD52 человека.
В контексте данного изобретения термин «химерный иммуноглобулин» относится к рекомбинантному белку, который состоит из вариабельных доменов, включая гипервариабельные участки (CDR), антитела, полученного у одного вида, преимущественно мышиного моноклонального антитела к CD52 человека, в то время как константные домены молекулы антитела получены от другого вида, например, из антитела человека.
Изобретение описывает представленные здесь химерные иммуноглобулины, включая антигенсвязывающие фрагменты (т.е. участки) химерных иммуноглобулинов, химерные легкие цепи и химерные тяжелые цепи химерных иммуноглобулинов и фрагменты таких химерных легких и тяжелых цепей. Изобретение описывает зрелый химерный иммуноглобулин, такой как химерный иммуноглобулин, с последующей обработкой для удаления сигнальных пептидов тяжелой и легкой цепей и/или описывает гликозилированный иммуноглобулин. Изобретение также описывает незрелый белок или белок-предшественник, такой как химерная тяжелая цепь, состоящая из сигнального пептида. Изобретение также описывает молекулы нуклеиновых кислот (например, векторы), кодирующие как зрелые, так и незрелые белки, клетки-хозяева, которые содержат такую нуклеиновую кислоту, а также способы получения зрелых и незрелых белков.
Функция связывания химерного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, может быть определена с использованием любого подходящего способа, например, анализов, позволяющих осуществлять мониторинг образования комплекса между химерным иммуноглобулином и CD52 человека (например, мембранной фракции, состоящей из CD52 человека; клетки, несущей CD52 человека, такой как Т-клетка человека, В-клетка человека; клетки СНО или рекомбинантной клетки-хозяина, включающей и экспрессирующей нуклеиновую кислоту, кодирующую CD52 человека; пептид (например, синтетический пептид), имеющий аминокислотную последовательность CD52).
Кроме того, данное изобретение описывает фрагменты химерных иммуноглобулинов, такие как легкие цепи, тяжелые цепи и фрагменты легких и тяжелых цепей. Такие фрагменты иммуноглобулинов могут быть получены и экспрессированы из иммуноглобулинов (например, путем восстановления и/или расщепления) или выработаны или экспрессированы нуклеиновыми кислотами, кодирующими фрагмент иммуноглобулина или его цепи, обладающие необходимым свойством (например, связываться с CD52 человека, подобие последовательностей). Они могут быть получены, например, синтезом de novo соответствующего фрагмента. Химерные иммуноглобулины, состоящие из необходимых фрагментов (например, антигенсвязывающий фрагмент, CDR, FR, C-участок) человеческого и животного происхождения могут быть получены с использованием синтетических и/или рекомбинантных нуклеиновых кислот для получения векторов (например, кДНК), кодирующих требуемую химерную цепь. Для получения фрагмента цепи в необходимое положение может быть введено один или несколько стоп-кодонов. Последовательность, кодирующая сигнальный пептид, также может быть включена в нуклеиновую кислоту (например, в ходе синтеза, путем вставки в вектор). Если природная последовательность сигнального пептида недоступна (например, обычно отсутствует), может использоваться последовательность сигнального пептида из другого антитела (см., например, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). При использовании таких способов и способов, описанных в тексте данной заявки, или других подходящих способов могут быть легко получены варианты.
В одном варианте воплощения изобретения химерный иммуноглобулин по изобретению состоит из вариабельного участка легкой цепи с последовательностью SEQ ID NO: 3 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 16; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 4 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 17; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 5 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 18; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 6 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 19; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 7 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 20; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 8 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 21; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 9 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 22; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 10 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 23; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 11 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 24; вариабельного участка легкой цепи с последовательностью SEQ ID NO: 12 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 25; или вариабельного участка легкой цепи с последовательностью SEQ ID NO: 13 и вариабельного участка тяжелой цепи с последовательностью SEQ ID NO: 26.
Изобретение также описывает химерное антитело, обладающее специфичностью связывания с CD52 человека и состоящее из последовательности вариабельного участка легкой цепи, выбираемой из группы последовательностей, включающей следующее: вариабельный участок легкой цепи SEQ ID NO: 3, вариабельный участок легкой цепи SEQ ID NO: 4, вариабельный участок легкой цепи SEQ ID NO: 5, вариабельный участок легкой цепи SEQ ID NO: 6, вариабельный участок легкой цепи SEQ ID NO: 7, вариабельный участок легкой цепи SEQ ID NO: 8, вариабельный участок легкой цепи SEQ ID NO: 9, вариабельный участок легкой цепи SEQ ID NO: 10, вариабельный участок легкой цепи SEQ ID NO: 11, вариабельный участок легкой цепи SEQ ID NO: 12 и вариабельный участок легкой цепи SEQ ID NO: 13, и последовательности вариабельного участка тяжелой цепи, выбираемой из группы последовательностей, включающей следующее: вариабельный участок тяжелой цепи SEQ ID NO: 16, вариабельный участок тяжелой цепи SEQ ID NO: 17, вариабельный участок тяжелой цепи SEQ ID NO: 18, вариабельный участок тяжелой цепи SEQ ID NO: 19, вариабельный участок тяжелой цепи SEQ ID NO: 20, вариабельный участок тяжелой цепи SEQ ID NO: 21, вариабельный участок тяжелой цепи SEQ ID NO: 22, вариабельный участок тяжелой цепи SEQ ID NO: 23, вариабельный участок тяжелой цепи SEQ ID NO: 24, вариабельный участок тяжелой цепи SEQ ID NO: 25 и вариабельный участок тяжелой цепи SEQ ID NO: 26.
Изобретение также описывает легкую цепь химерного иммуноглобулина, состоящую из вариабельного участка с последовательностью SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
Изобретение также описывает тяжелую цепь химерного иммуноглобулина, состоящую из вариабельного участка с последовательностью SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
При необходимости, например, в диагностических целях или в целях анализа (например, визуализации), химерный иммуноглобулин (например, его антигенсвязывающий фрагмент) может состоять из определяемой метки. Подходящие определяемые метки и способы для мечения химерного иммуноглобулина хорошо известны науке. Подходящие определяемые метки включают, например, радиоизотоп (например, индий-111, технеций-99m или йод-131), позитрон-излучающие метки (например, фтор-19), парамагнитные ионы (например, гадолиний (III), марганец (II)), эпитопные метки (тэги), метки аффинности (например, биотин, авидин), спиновые метки, фермент, флуоресцирующую группу или хемилюминесцентную группу. Если метки не используются, образование комплекса (например, между химерным иммуноглобулином и CD52 человека) может быть определено путем поверхностного плазмонного резонанса или других подходящих способов. Все подходящие способы и процедуры, описанные выше для гуманизированных антител по данному изобретению, также могут использоваться.
Нуклеиновые кислоты и рекомбинантные векторы
Данное изобретение также описывает выделенные (изолированные) и/или рекомбинантные (включая, например, по существу чистые) нуклеиновые кислоты, состоящие из последовательностей, которые кодируют гуманизированный иммуноглобулин, гуманизированную легкую цепь, гуманизированную тяжелую цепь, мышиный моноклональный иммуноглобулин, легкую цепь мышиного иммуноглобулина, тяжелую цепь мышиного иммуноглобулина, химерный иммуноглобулин, химерную легкую цепь или химерную тяжелую цепь по данному изобретению.
В контексте данного изобретения термин «изолированные (выделенные» или «очищенные» нуклеиновые кислоты представлены нуклеиновыми кислотами, которые были отделены от нуклеиновых кислот геномной ДНК или РНК клетки из источника происхождения (например, поскольку они существуют в клетках или в виде смеси нуклеиновых кислот, такой как библиотека), и включают нуклеиновые кислоты, полученные с использованием описанных здесь способов или других подходящих способов, включая по существу чистые нуклеиновые кислоты, нуклеиновые кислоты, полученные в ходе химического синтеза, в ходе комбинаций биологических и химических способов, и рекомбинантные нуклеиновые кислоты, которые были выделены (см., например, Daugherty, B.L. et. al., Nucleic Acids Res., 19(9): 2471-2476 (1991); Lewis, A.P. and J.S. Crowe, Gene, 101: 297-302 (1991)).
Нуклеиновые кислоты, указанные здесь как «рекомбинантные», представлены нуклеиновыми кислотами, которые были получены с использованием способов рекомбинации ДНК, включая нуклеиновые кислоты, которые получены в ходе процедур, основывающихся на способе искусственной рекомбинации, таком как полимеразная цепная реакция (ПЦР) и/или клонирование в вектор с использованием рестриктаз. «Рекомбинантные» нуклеиновые кислоты представлены кислотами, полученными в ходе событий рекомбинации, возникших в естественных клеточных механизмах, но отобранными для дальнейшего введения в клетки нуклеиновыми кислотами для возможности осуществления и вероятного осуществления необходимого явления рекомбинации.
Более специфически, данное изобретение также описывает изолированные и/или рекомбинантные нуклеиновые кислоты, состоящие из нуклеотидной последовательности, кодирующей гуманизированный иммуноглобулин, мышиный иммуноглобулин или химерный иммуноглобулин, обладающий специфичностью связывания с CD52 человека (например, гуманизированный иммуноглобулин по данному изобретению, в котором фрагмент животного происхождения (например, CDR) получен из мышиного моноклонального антитела к CD52; или химерный иммуноглобулин по данному изобретению, в котором фрагмент животного происхождения (например, VH и VL) получен из мышиного моноклонального антитела к CD52), или фрагмент (например, антигенсвязывающий фрагмент) (например, тяжелая или легкая цепь).
Нуклеиновые кислоты по данному изобретению могут использоваться для получения гуманизированных иммуноглобулинов, обладающих специфичностью связывания с CD52 человека, мышиных иммуноглобулинов, обладающих специфичностью связывания с CD52 человека, и химерных иммуноглобулинов, обладающих специфичностью связывания с CD52 человека. Например, нуклеиновая кислота (например, ДНК (такая как кДНК) или РНК) или одна или несколько нуклеиновых кислот, кодирующих гуманизированный иммуноглобулин, мышиный иммуноглобулин или химерный иммуноглобулин по данному изобретению, могут быть встроены в подходящий вектор (например, рекомбинантный вектор) для дальнейшей манипуляции с последовательностями или для получения кодируемых иммуноглобулинов в подходящей клетке-хозяине.
Также описаны векторы (например, векторы экспрессии), подходящие для экспрессии гуманизированного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, мышиного иммуноглобулина, обладающего специфичностью связывания с CD52 человека, или химерного иммуноглобулина, обладающего специфичностью связывания с CD52 человека. Представлен целый ряд векторов, включая векторы, которые содержатся в виде единственной копии или множественных копий в клетке-хозяине, или которые были интегрированы в хромосому(ы) клетки-хозяина. Векторы могут быть введены в подходящую клетку-хозяин, и клетки, экспрессирующие гуманизированный иммуноглобулин, мышиный иммуноглобулин или химерный иммуноглобулин по данному изобретению, могут быть получены и содержаться в культуре. Для экспрессии гуманизированного иммуноглобулина, мышиного иммуноглобулина или химерного иммуноглобулина, обладающих специфичностью связывания с CD52 человека, может использоваться один вектор или несколько векторов.
Подходящие векторы экспрессии, например, векторы экспрессии клеток млекопитающих, также могут содержать целый ряд компонентов, включая, но не ограничиваясь, один или несколько компонентов экспрессии: точку начала репликации; селектируемый маркер гена; один или несколько элементов контроля экспрессии, таких как контрольный элемент транскрипции (например, промотор, энхансер, терминатор), и/или один или несколько сигналов трансляции; сигнальную последовательность или лидерную последовательность для нацеливания на мембрану или секреции. В векторе последовательность сигнального пептида может быть предоставлена самим вектором или получена из другого источника. Например, для управления экспрессией могут использоваться сигналы транскрипции и/или трансляции иммуноглобулина.
Для экспрессии в подходящей клетке-хозяине может использоваться промотор. Промоторы могут быть конститутивными или индуцируемыми. Например, промотор может быть функционально связан с нуклеиновой кислотой, кодирующей гуманизированный иммуноглобулин или цепь иммуноглобулина, таким образом, он контролирует экспрессию кодируемого полипептида. Представлен целый ряд подходящих промоторов для прокариотических (например, lac, tac, T3, T7 промоторы для E. coli) и эукариотических (например, алкогольдегидрогеназа дрожжей (ADH1), SV40, CMV) клеток-хозяев. Специалист в данной области сможет выбрать соответствующий промотор для экспрессии антитела к CD52 или его фрагмента по изобретению.
Кроме того, векторы (например, векторы экспрессии) обычно состоят из селектируемого маркера для селекции клеток-хозяев, несущих вектор, и, в случае реплицируемого вектора, точки начала репликации Гены, кодирующие продукты, обладающие устойчивостью к антибиотикам или препаратам, являются обычными избираемыми (селектируемыми) маркерами и могут использоваться в прокариотических (например, ген β-лактамазы (устойчивость к ампициллину), ген Tet (устойчивость к тетрациклину)) и эукариотических клетках (например, неомицин (G418 или генетицин), gpt (микофеноловая кислота), гены устойчивости к ампициллину или гигромицину). Гены-маркеры дигидрофолатредуктазы позволяют производить селекцию с использованием метотрексата у целого ряда хозяев. Гены, кодирующие генный продукт в виде ауксотрофных маркеров в хозяевах (например, LEU2, URA3, HIS3 ), часто используются в качестве селектируемых маркеров в дрожжах. Использование вирусных (например, бакуловируса) или фаговых векторов и векторов, способных интегрироваться в геном клетки-хозяина, таких как векторов ретровирусов, также предусмотрено.
Таким образом, изобретение описывает изолированные молекулы нуклеиновых кислот, кодирующих гуманизированный иммуноглобулин, гуманизированную легкую цепь, гуманизированную тяжелую цепь, мышиный иммуноглобулин, легкую цепь мышиного иммуноглобулина, тяжелую цепь мышиного иммуноглобулина, химерный иммуноглобулин, легкую цепь химерного иммуноглобулина или тяжелую цепь химерного иммуноглобулина по данному изобретению. Изобретение также описывает изолированные молекулы нуклеиновых кислот, кодирующих антигенсвязывающие фрагменты иммуноглобулинов и их цепи. Полипептидные последовательности, кодируемые нуклеиновыми кислотами по данному изобретению, описаны выше и в представленных ниже Примерах.
В некоторых вариантах воплощения изобретения нуклеиновая кислота и вектор по данному изобретению кодируют тяжелую цепь (или ее антигенсвязывающий фрагмент) или легкую цепь (или ее антигенсвязывающий фрагмент) по данному изобретению. Клетка-хозяин, включающая нуклеиновую кислоту, кодирующую тяжелую цепь, и нуклеиновую кислоту, кодирующую легкую цепь, может использоваться для получения антитела, состоящего из тяжелой и легкой цепи (или антигенсвязывающего фрагмента антитела). Нуклеиновая кислота, кодирующая тяжелую цепь, и нуклеиновая кислота, кодирующая легкую цепь, могут располагаться на разных векторах экспрессии. Они также могут располагаться на одном векторе экспрессии при одинаковом или разном контроле экспрессии. См., например, Cabilly патент США No. 6331415; Fang патент США No. 7662623.
Способ получения иммуноглобулинов, обладающих специфичностью относительно CD52 человека
Другой аспект изобретения описывает способ получения антитела к CD52 человека по данному изобретению. Антитело по данному изобретению может быть получено, например, путем экспрессии одной или нескольких рекомбинантных нуклеиновых кислот, кодирующих антитело в подходящей клетке-хозяине. Клетка-хозяин может быть получена с использованием любого подходящего способа. Например, описанные здесь векторы экспрессии (например, один или несколько векторов, например, вектор экспрессии клеток млекопитающих) могут быть введены в подходящую клетку-хозяин, и полученная клетка может содержаться (например, в культуре, в животном, в растении) в условиях, подходящих для экспрессии вектора(ов). Подходящие клетки-хозяева могут быть прокариотическими, включая бактериальные клетки, такие как E. coli (например, штамм DH5α™ (Invitrogen, Carlsbad, CA)), B. subtilis и/или другие подходящие бактерии; эукариотические клетки, такие как клетки грибов или дрожжей (например, Pichia pastoris, Aspergillus sp., Saccharomyces cerevisiae, Schizosaccharomyces pombe, Neurospora crassa), или клетки других низших эукариотов, и клетки высших эукариотов, таких как клетки насекомых (например, клетки Drosophila Schnieder S2, клетки насекомых Sf9 (WO 94/26087 (O'Connor), клетки насекомых TN5B1-4 (HIGH 5) (Invitrogen), млекопитающих (например, клетки COS, такие как COS-1 (ATCC Accession No. CRL-1650) и COS-7 (ATCC Accession No. CRL-1651), CHO (например, ATCC Accession No. CRL-9096), CHO DG44 (Urlaub, G. and Chasin, LA., Proc. Natl. Acac. Sci. USA, 77(7):4216-4220 (1980)), 293 (ATCC Accession No. CRL-1573), HeLa (ATCC Accession No. CCL-2), CV1 (ATCC Accession No. CCL-70), WOP (Dailey, L., et. al., J. Virol., 54:739-749 (1985)), 3T3, 293T (Pear, W. S., et. al., Proc. Natl. Acad. Sci. U.S.A., 90:8392-8396 (1993)), клетки NS0, клетки SP2/0, клетки HuT 78 и т.п.)) или растений (например, табака, ряски и водорослей). (См., например, Ausubel, F.M. et. al., eds. Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons Inc. (1993)). В некоторых вариантах воплощения изобретения клетка-хозяин не является частью многоклеточного организма (например, растений или животного), например, она представлена изолированной клеткой-хозяином или является частью клеточной культуры.
Данное изобретение также описывает клетки, состоящие из нуклеиновой кислоты, например, вектора, по изобретению (например, вектора экспрессии). Например, нуклеиновая кислота (т.е. одна или несколько нуклеиновых кислот), кодирующая тяжелые и легкие цепи гуманизированного иммуноглобулина, тяжелые и легкие цепи мышиного иммуноглобулина или тяжелые и легкие цепи химерного иммуноглобулина, указанный иммуноглобулин со специфичностью связывания с CD52 человека, или вектор (т.е. один или несколько векторов), состоящий из нуклеиновой кислоты, могут быть введены в подходящую клетку-хозяин с использованием способа, подходящего для выбранной клетки-хозяина (например, путем трансформации, трансфекции, электропорации, инфекции), при этом такая нуклеиновая кислота(ы) оказывается(ются) функционально связанной(нными) с одним или несколькими элементами контроля экспрессии (например, в векторе, созданном в ходе клеточных процессов, интегрированном в геном клетки-хозяина). Клетки-хозяева могут содержаться в условиях, подходящих для экспрессии (например, в присутствии индуктора, подходящей среды, дополненной соответствующими солями, факторами роста, антибиотиками, питательными добавками и т.д.), при этом вырабатываются кодируемые полипептиды. В случае необходимости, кодируемый белок (например, гуманизированный иммуноглобулин, мышиный иммуноглобулин, химерный иммуноглобулин) может быть выделен, например, из клетки-хозяина, питательной среды или молока. Такой процесс включает экспрессию в клетке-хозяине (например, клетки железы млекопитающего) трансгенного растения или животного (например, табака) (см., например, WO 92/03918).
Белки слияния могут быть получены таким образом, что фрагмент иммуноглобулина (например, гуманизированного иммуноглобулина; гуманизированной цепи) будет находиться в N-терминальном положении, С-терминальном положении или внутри белка слияния. Например, некоторые варианты воплощения изобретения могут быть получены путем вставки нуклеиновой кислоты, кодирующей последовательность(и) иммуноглобулина, в соответствующий вектор экспрессии, такой как вектор рЕТ (например, pET-15b, Novagen), фаговый вектор (например, pCANTAB 5 E, Pharmacia) или другой вектор (например, вектор белка слияния А pRIT2T, Pharmacia). Полученный вектор может быть введен в подходящую клетку-хозяин для экспрессии. После экспрессии, некоторые белки слияния могут быть выделены или очищены из лизата клеток путем подходящей аффинной матрицы (см., например, Current Protocols in Molecular Biology (Ausubel, F.M. et. al., Eds., Vol. 2, Suppl. 26, pp. 16.4.1-16.7.8 (1991)).
Изобретение описывает клетку-хозяина, которая состоит из рекомбинантной нуклеиновой кислоты(от), кодирующей представленный здесь иммуноглобулин (например, гуманизированный иммуноглобулин, гуманизированную легкую цепь или гуманизированную тяжелую цепь, мышиный иммуноглобулин, мышиную легкую цепь или мышиную тяжелую цепь, химерный иммуноглобулин, химерную легкую цепь или химерную тяжелую цепь по изобретению.). Изобретение также описывает клетку-хозяина, которая состоит из рекомбинантной нуклеиновой кислоты(т), кодирующей антигенсвязывающий участок иммуноглобулина или его цепей. В некоторых вариантах воплощения изобретения клетка-хозяин состоит из рекомбинантного вектора (например, вектора экспрессии, включая векторы экспрессии клетки млекопитающего) по изобретению, как это описано в тексте данной заявки.
Изобретение также описывает способ получения иммуноглобулина или полипептидной цепи иммуноглобулина по изобретению. В одном варианте воплощения изобретения способ заключается в содержании клетки-хозяина по изобретению, как это описано в данной заявке (например, клетки-хозяина, состоящей из одной или нескольких изолированных нуклеиновых кислот, кодирующих иммуноглобулин или полипептидную цепь (например, легкую цепь и тяжелую цепь, только легкую цепь или только тяжелую цепь по изобретению)), в условиях, подходящих для экспрессии иммуноглобулина или цепи полипептида. Например, клетка-хозяин может быть культивирована на субстрате или суспензии. В некоторых вариантах воплощения изобретения способ дополнительно включает этап очистки или выделения или изоляции иммуноглобулина или полипептидной цепи.
Изобретение дополнительно описывает способ получения иммуноглобулинов с использованием фагового дисплея. Например, библиотека фагового дисплея нативного антитела к антигену CD52 может быть подвергнута сортировке. С другой стороны, может использоваться способ получения иммуноглобулинов путем направленной селекции (публикация заявки на патент США US 2006-0251658 A1). Может быть создана пользовательская библиотека, построенная для, например, фиксированной тяжелой цепи (и/или легкой цепи) участка CDR3 известного антитела к CD52. Участки CDR1 и CDR2 тяжелой и легкой цепей могут быть получены из нативного репертуара (Osburn et. al., Methods, 36:61-68 (2005)). В одном варианте воплощения изобретения ScFv к CD52 могут быть получены из библиотек ScFv нативного антитела, которые используются для получения химерных антител мыши-человека с необходимыми свойствами связывания. Такие библиотеки могут быть подвергнуты скринингу на предмет наличия антител с необходимыми свойствами связывания. Могут использоваться фаговые библиотеки ScFv. Например, ScFv, которые распознают CD52 человека, могут быть выделены из библиотек CD52 с направленной селекцией с последующей серией повторных циклов селекции на рекомбинантном CD52 человека, как это по существу описано Vaughan et. al. (1996). Кратко это можно описать следующим образом: после инкубации с библиотекой, иммобилизированный антиген, который предварительно соединен с парамагнитными гранулами и связан фагом, может быть восстановлен путем разделения в магнитном поле, при этом несвязанный фаг вымывается. Затем связанный фаг может быть восстановлен, как это описано Vaughan et. al. (1996), и процесс селекции может быть повторен.
В отдельном варианте воплощения изобретения библиотека создается из всего вариабельного домена тяжелой цепи мышиного антитела к CD52, слитого в формате единой цепи в репертуар вариабельных участков нативной легкой цепи человека. После селекции, идентифицируют пул вариабельных участков легкой цепи человека, который дополняет вариабельный участок тяжелой цепи мышиного антитела. Затем библиотеку создают из репертуара вариабельных участков легкой цепи человека, выбранных ранее и слитых в формате единой цепи с вариабельным участком химерной легкой цепи, состоящей из нативных участков CDR1 и CDR2 человека и фиксированного участка CDR3 из вариабельного домена тяжелой цепи мышиного антитела к CD52. После селекции связующих компонентов CD52, выбирают наилучшие связывающие клоны. Пять из 6 участков CDR могут иметь человеческое происхождение, в то время как CDR-3 вариабельного участка тяжелой цепи может быть идентичен CDR3 вариабельного домена тяжелой цепи мыши.
Селекции могут проводиться с использованием CD52, соединенного с амином DYNABEADS M-270 (Dynal) в соответствии с рекомендациями производителя. С другой стороны, селекция с использованием биотинилированного CD52, может осуществляться с применением специфического реагента - первичного амина сукцинимидил-6-(биотинамидо) гексаноата с соблюдением инструкций производителя (EZ link NHS LC Biotin, Pierce).
Результаты селекции могут быть подвергнуты тестированию в виде периплазматических препаратов с высокопроизводительным скринингом, основываясь на анализах конкурентного связывания, которые измеряют способность scFv, присутствующих в периплазматическом препарате, конкурировать за связывание с CD52.
Образцы, способные конкурировать в ходе высокопродуктивного скрининга, могут быть подвергнуты ДНК-секвенированию, как это описано Vaughan et. al. (1996) и Osburn et. al. (1996). Затем клоны будут экспрессироваться и очищаться как scFv или IgG и подвергнуты анализу на предмет своей способности связываться с CD52, нейтрализовать CD52 или обладать комбинированными свойствами, например, с использованием анализов, таких как анализ антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ) и анализа комплемент-зависимой цитотоксичности (КЗЦ). Очищенные препараты scFv впоследствии могут быть приготовлены в соответствии с описанием, представленным в Примере 3 WO 01/66754. Концентрации белка в очищенных препаратах scFv определяли с использованием способа BCA (Pierce). Подобные подходы могут использоваться для скрининга оптимального партнера (противоположной цепи) фиксированной тяжелой или легкой цепи иммуноглобулина (или VH или VL).
В отдельном варианте воплощения изобретения описан способ получения гибридомы, секретирующей моноклональное антитело, обладающее специфичностью связывания с CD52 человека, и такой способ состоит из введения лимфоцитов мыши, трансгенной относительно CD52 человека, нетрансгенной мыши такого или подобного штамма (например, CD1), что и трансгенные относительно CD52 мыши, что позволяет получить иммунизированную, нетрансгенную мышь. Спленоциты иммунизированной нетрансгенной мыши контактируют с иммортализированными клетками, что позволяет получить слитые клетки, и такие слитые клетки содержатся в условиях, при которых получают гибридомы, секретирующие моноклональное антитело, обладающее специфичностью связывания с CD52 человека.
Иммуноглобулины, содержащие молекулу токсина или токсин
Изобретение также описывает иммуноглобулины, состоящие из молекулы токсина или токсина. Подходящие молекулы токсина состоят из токсина (например, поверхностно активного токсина, цитотоксина). Молекула токсина или токсин может быть связана или конъюгирована с иммуноглобулином с использованием любого подходящего способа. Например, молекула токсина или токсин может быть ковалентно связана с иммуноглобулином непосредственным образом или посредством соответствующего линкера. Соответствующие линкеры могут включать нерасщепляемые или расщепляемые линкеры, например, расщепляемые под воздействием рН линкеры или линкеры, которые состоят из сайта расщепления клеточным ферментом (например, клеточными эстеразами, клеточными протеазами, такими как катепсин В). Такие расщепляемые линкеры могут использоваться для получения иммуноглобулина, высвобождающего молекулу токсина или токсин после интернализации иммуноглобулина.
Может применяться целый ряд способов связывания или конъюгации молекулы токсина или токсина с иммуноглобулином. Отдельный выбранный способ будет зависеть от молекулы токсина или токсина, а также иммуноглобулина, который необходимо связать или конъюгировать. В случае необходимости, линкеры, содержащие терминальные функциональные группы, могут использоваться для связывания иммуноглобулина и молекулы токсина или токсина. Как правило, конъюгация сопровождается реакцией молекулы токсина или токсина, содержащего реакционоспособную функциональную группу (или модифицированного для включения реакционоспособной функциональной группы), с линкером или непосредственно с иммуноглобулином. Ковалентные связи образуются путем реакции молекулы токсина или токсина, содержащего (или модифицированного для включения) химическую молекулу или функциональную группу, которая, при соответствующих условиях, может реагировать со второй химической группой, образуя, таким образом, ковалентную связь. В случае необходимости, к иммуноглобулину или линкеру может быть присоединена подходящая реакционоспособная химическая группа с использованием любого подходящего способа. (См., например, Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996).) Науке известно много подходящих реакционоспособных химических групп и комбинацией, например, аминная группа может реагировать с электрофильной группой, такой как тозилат, мезилат, галоген (хлор, бром, фтор, йод), N-сукцинимидиловые эфиры (NHS) и т.п. Тиолы могут реагировать с малеимидом, йодоацетилом, акрилолилом, пиридилдисульфидами, 5-тиол-2-нитрибензойная кислота-тиолом (TNB-тиол) и т.п. Альдегидная функциональная группа может быть соединена с амино- или гидразид-содержащими молекулами, и азидная группа может реагировать с тривалентной фосфорной группой с образованием фосфорамидата или фосфоримидных соединений. Подходящие способы для введения активных групп в молекулы известны науке (см., например, Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996)).
Подходящие молекулы токсина и токсины включают, например, майтансиноид (например, майтансинол, например, DM1, DM4), таксан, калихимицин, дуокармицин или их производные. Майтансиноид может быть представлен, например, майтансинолом или аналогом майтансинола. Примеры аналогов майтансинола включают соединения с модифицированным ароматическим кольцом (например, C-19-дехлор, C-20-деметокси, C-20-ацилокси) и соединения с модификациями в других положениях (например, C-9-CH, C-14-алкоксиметил, C-14-гидроксиметил или ацелоксиметил, C-15-гидрокси/ацилокси, C-15-метокси, C-18-N-деметил, 4,5-дезокси). Майтансинол и аналоги майтансинола описаны, например, в патенте США No. 5208020 и 6333410 (содержание включено сюда во всей полноте посредством ссылки). Майтансинол может быть соединен с антителами и фрагментами антител с использованием, например, N-сукцинимидил 3-(2-пиридилдитио)пропионата (также известного как N-сукцинимидил 4-(2-пиридилдитио)пентаноат (или SPP)), 4-сукцинимидил-оксикарбонил-α-(2-пиридилдитио)-толуола (SMPT), N-сукцинимидил-3-(2-пиридилдитио)бутирата (SDPB), 2-иминотиолана или S-ацетилсукцинилового ангидрида. Таксан может быть представлен, например, таксолом, таксотером или новым таксаном (см., например, WO 01/38318). Калихимицин может быть представлен, например, комплексом бром-калихимицин (например, альфа-, бета- или гамма-бром комплексом), комплексом йод-калихимицин (например, альфа-, бета- или гамма-йод комплексом) или их аналогами и имитаторами. Комплексы бром-калихимицин включают I1-BR, I2-BR, I3-BR, I4-BR, J1-BR, J2-BR и K1-BR. Комплексы йод-калихимицин включают I1-I, I2-I, I3-I, J1-I, J2-I, L1-I и K1-BR. Калихимицин и мутанты, аналоги и имитаторы описаны, например, в патентах США No. 4970198; 5264586; 5550246; 5712374 и 5714586 (содержимое всех патентов включено сюда во всей своей полноте посредством ссылки). Аналоги дуокармицина (например, KW-2189, DC88, DC89 CBI-TMI и их производные) описаны, например, в патенте США No. 5070092, патенте США No. 5187186, патенте США No. 5641780, патенте США No. 5641780, патенте США No. 4923990, и патенте США No. 5101038 (содержимое всех патентов включено сюда во всей своей полноте посредством ссылки).
Примеры других токсинов включают, но не ограничиваются, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацила декарбазин), алкилирующие агенты (например, мехлорэтамин, тиотепа хлорамбуцил, CC-1065 (см. патенты США No. 5475092, 5585499, 5846545), мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин C и цис-дихлордиамин платины (II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее - дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее - актиномицин), блеомицин, митрамицин, митомицин, пуромицина антрамицин (AMC)), дуокармицины и его аналоги или производные, антимитотические агенты (например, винкристин, винбластин, таксол, ауристатины (например, ауристатин Е) и майтансиноиды, включая их аналоги или гомологи).
Токсин также может быть представлен поверхностно активным токсином, например, токсином, приводящим к образованию свободных радикалов (например, молекулы токсина, содержащие селен), или молекулой, содержащей радионуклид. Подходящие молекулы, содержащие радионуклиды, включают, например, молекулы, содержащие радиоактивный йод (131I или 125I), иттрий (90Y), лютеций (177Lu), актиний (225Ac), празеодим, астатин (211At), рений (186Re), висмут (212Bi или 213Bi), индий (111In), технеций (99mTc), фосфор (32P), родий (188Rh), серу (35S), углерод (14C), тритий (3H), хром (51Cr), хлор (36Cl), кобальт (57Co или 58Co), железо (59Fe), селен (75Se) или галлий (67Ga).
Токсин может быть представлен белком, полипептидом или пептидом, может быть получен из бактериальных источников, например, дифтерийный токсин, экзотоксин pseudomonas (PE) и белки растений, например, А цепь рицина (RTA), белки, инактивирующие рибосому (RIP), гелонин, антивирусный белок лаконоса, сапорин и додекандрон могут использоваться в качестве токсинов.
Антисмысловые соединения нуклеиновых кислот, разработанные для связывания, инактивации, способствованию распада или предотвращения выработки мРНК, ответственной за выработку отдельного белка-мишени, также могут использоваться в качестве токсина. Антисмысловые соединения включают антисмысловую РНК или ДНК, одно- или двухцепочечные, олигонуклеотиды или их аналоги, которые могут специфическим образом гибридизировать в отдельные виды мРНК и предотвращать транскрипцию и/или процессинг РНК, видов мРНК и/или трансляцию кодируемого полипептида, и, таким образом, влиять на снижение количества соответствующего кодируемого полипептида. Ching, et. al., Proc. Natl. Acad. Sci. U.S.A. 86: 10006-10010 (1989); Broder, et. al., Ann. Int. Med. 113: 604-618 (1990); Loreau, et. al., FEBS Letters 274: 53-56 (1990). Подходящие антисмысловые лекарственные препараты включают, например, Veglin TM (VasGene) и OGX-011 (Oncogenix).
Токсины также могут быть представлены фотоактивными агентами. Подходящие фотоактивные агенты включают материалы, основанные на порфирине, такие как порфимер натрия, зеленые порфирины, хлорин Е6, производное гематопорфирина, фталоцианины, этиопурпурины, тексафрин и т.п.
Токсин может быть представлен антителом или фрагментом антитела, который связывается с внутриклеточной мишенью. Такие антитела или фрагменты антител могут быть направлены относительно определенных субклеточных компартментов или мишеней. Например, антитела или фрагменты антител могут связываться с внутриклеточной мишенью, выбираемой из erbB2, EGFR, BCR-ABL, p21Ras, Caspase3, Caspase7, Bcl-2, p53, Cyclin E, ATF-1/CREB, HPV16 E7, HP1, коллагеназ IV типа, катепсина L, а также других мишеней, представленных в Kontermann, R.E., Methods, 34:163-170 (2004) (включено в данный документ во всей своей полноте посредством ссылки).
Терапевтические способы и композиции
Антитела по данному изобретению используются в ходе иммунной супрессии и иммунной абляции. Антитела направлены на CD52-экспрессирующие клетки (например, Т- и В-клетки) и снижают (или «уменьшают, как это используется в контексте данного изобретения) популяцию таких клеток у нуждающегося в этом субъекта. Снижение количества лимфоцитов может быть полезным при лечении целого ряда заболеваний и состояний, таких как воспаление, аутоиммунные заболевания и рак (например, лимфоцитарное (В- или Т-клеточное) злокачественное новообразование). См., например, Reiff, A., Hematology, 10(2):79-93 (2005). Примеры заболеваний и состояний, которые могут быть подвергнуты лечению с использованием антител или антигенсвязывающих фрагментов по данному изобретению, включают, без ограничения, рассеянный склероз, волчанку, ревматоидный артрит, заболевание трансплантат против хозяина (ЗТПХ), воспалительные заболевания кишечника, васкулит, болезнь Бехчета, грануломатоз Вегенера, синдром Шегрена, увеит, псориаз, склеродерму, полимиозит, диабет I типа (аутоиммунный), аутоиммунные цитопении (например, аутоиммунная нейтропения, рефрактерная и обусловленная переливанием крови ИЭЦА, лейкоз и лимфомы, такие как неходжкинская лимфома с генерализованной лимфаденопатией и В-клеточный хронический лимфоцитарный лейкоз).
Таким образом, аспекты данного изобретения представляют собой способы для снижения количества лимфоцитов, а также для лечения воспаления, аутоиммунного заболевания или рака путем введения эффективного количества антитела по изобретению нуждающемуся в этом субъекту (например, пациенту-человеку, страдающему аутоиммунным заболеванием, раком крови, или пациенту, подвергнутому трансплантации). Антитело также может быть введено в профилактических целях для предотвращения возникновения воспаления или рецидива аутоиммунного заболевания или рака. Например, антитело по данному изобретению может быть введено как часть подготовительного режима для подготовки пациента к трансплантации (например, трансплантации стволовых клеток, инфузии аутологичных или аллогенных Т-клеток или трансплантации солидного органа).
Некоторые антитела к CD52 по данному изобретению преимущественно направлены на определенные популяции CD52+ клеток. Одно из возможных пояснений заключается в том, что антигенные детерминанты, с которыми связываются такие антитела, включают одну или несколько углеводных групп на белке CD52, и такие углеводные группы могут быть более превалирующими на CD52, экспрессируемыми одним типом клеток в сравнении с другим. Например, исследователями было обнаружено, что антитело 7F11, 5F7, 3G7 и 11C11 подавляет количество Т-клеток в большей степени, чем В-клеток. Таким образом, гуманизированные и химерные версии таких антител могут использоваться для лечения Т-клеточных злокачественных новообразований с более легкими иммуносупрессирующими побочными эффектами.
Принимая во внимание, что антитела по данному изобретению направлены на CD52-экспрессирующие клетки, антитела также могут использоваться для снижения количества CD52+ клеток, кроме Т-клеток и В-клеток. Например, исследования показали, что сосудистые лейкоциты (VLC) и Tie2+ моноциты - миелоидные клетки, экспрессирующие высокие уровни CD52 -, способствуют ангиогенезу опухоли и устойчивости опухоли к лечению антителами к ФРЭС. Pulaski et. al., J. Translational Med. 7:49 (2009). Таким образом, антитела к CD52 по данному изобретению могут использоваться для ингибирования ангиогенеза опухоли путем нацеливания на VLC и Tie2+ моноциты. Для этой цели антитела к CD52 могут вводиться систематически или локально в месте неоваскуляризации, например, месте нахождения опухоли. Лечение антителом к CD52 может использоваться в сочетании со стандартным лечением рака, таким как химиотерапия, операции или облучение, или вместе с другой направленной терапией, такой как терапия антителами к ФРЭС. Терапия антителом к CD52 может использоваться для лечения, например, рака молочной железы, рака легкого, глиомы, колоректального рака и любых других показаний для применения антител к ФРЭС. Терапия антителом к CD52 также может использоваться при других состояниях неоваскуляризации, включая неонкологические состояния неоваскуляризации.
Антитела по данному изобретению могут вводиться индивидууму (например, человеку) в виде монотерапии или в сочетании с другим агентом (например, иммуносупрессантом) в ходе комбинированной терапии. Антитело может вводиться до, в течение или после введения дополнительного агента. В некоторых вариантах воплощения изобретения дополнительный агент представлен, например, противовоспалительным соединением, таким как сульфасалазин, другим нестероидным противовоспалительным соединением или стероидным противовоспалительным соединением. В некоторых вариантах воплощения изобретения дополнительный агент представлен другим антителом, снижающим количество лимфоцитов, таким как другое антитело к CD52, антитело к CD20, антитело к BAFF, антитело к BAFF-R и т.п. В некоторых вариантах воплощения изобретения дополнительный агент представлен, например, цитокином (например, ИЛ-7), антителом к рецептору цитокина или растворимым рецептором, что позволяет изменять, манипулировать и/или повышать восстановительный процесс, возникающий после снижения количества лимфоцитов, опосредованный антителом к CD52 (см., например, Sportes et. al., “”Cytokine Therapies: Ann. N.Y. Acad. Sci. 1182:28-38 (2009)). В другом варианте воплощения изобретения миметик синтетического пептида может вводиться в сочетании с иммуноглобулином по данному изобретению.
Исследования показали, что снижение количества лимфоцитов алемтузумабом опосредовано нейтрофилами и NK-клетками (Hu et. al., Immunology 128:260-270 (2009). Таким образом, в варианте воплощения изобретения, описывающем комбинированную терапию, агент, стимулирующий нейтрофилы и NK-клетки, может быть введен пациенту до, во время или после терапии антителом к CD52 как дополнение к терапии антителом. Стимуляция нейтрофилов и/или NK-клеток включает, без ограничения, (1) повышение скорости деления таких клеток; (2) повышение экспрессии клеточной поверхностью рецепторов Fc, соответствующих изотипу антитела к CD52 (например, FcγRIIIa и FcγRIIIb, FcγRII, FcγRI и FcαRI); (3) мобилизацию и увеличение количества циркулирующих клеток; (4) доставку клеток к сайтам-мишеням (например, местам расположения опухоли, воспаления или повреждения ткани); (5) повышение цитотоксической активности таких клеток. Примеры агентов, стимулирующих нейтрофилы и/или NK-клетки, включают, например, гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ) (например, ЛЕЙКИН® или сарграмостим и молграмостим); гранулоцитарный колониестимулирующий фактор (Г-КСФ) (например, НЕУПОГЕН® или филграстим, пэгилированный филграстим и ленограстим); интерферон-гамма (например, АКТИММУН®); антагонисты рецептора хемокина CXC 4 (CXCR4) (например, МОЗОБИЛ™ или плериксафор); и агонисты рецептора хемокина 2 CXC (CXCR2). Количество нейтрофилов у пациента может подвергаться периодическому мониторингу для обеспечения оптимальной эффективности лечения. Количество нейтрофилов у пациента также может быть измерено перед началом лечения антителом к CD52. Количество стимулятора может быть скорректировано на основе числа нейтрофилов у пациента. Если у пациента количество нейтрофилов ниже нормального значения, может использоваться более высокая доза стимулятора. В течение периодов нейтропении, которые могут быть вызваны лечением антителом к CD52, для максимального усиления эффекта антитела к CD52 может использоваться более высокая доза стимулятора нейтрофилов.
Принимая во внимание, что стимуляция нейтрофилов и/или NK-клеток улучшает эффективность терапии антителом к CD520, такой вариант воплощения изобретения с комбинированной терапией позволяет применять меньшее количество антитела для пациента при одновременном поддержании подобной эффективности лечения. Использование меньшего количества антитела к CD52 при сохранении эффективности лечения поможет снизить побочные эффекты антитела к CD52, которые включают иммунный ответ у пациента против введенных антител, а также выработку вторичного аутоиммунитета (аутоиммунитета, который усиливается во время или после лечения антителом к CD52). Такой вариант воплощения изобретения с комбинированной терапией также полезен для применения в онкологии, например, если у пациента имеется нейтропения.
В другом варианте воплощения изобретения с комбинированной терапией предполагается использование стимуляторов регуляторных Т-клеток для усиления терапии антителом к CD52. Полученные нами данные показывают, что антитела к CD52 снижают количество регуляторных CD4+CD25+FoxP3+ Т-клеток в большей степени в сравнении с другими CD4+ T-клетками. Регуляторные Т-клетки (также известные как «Treg» или супрессорные Т-клетки) представлены клетками, способными ингибировать пролиферацию и/или функцию других лимфоидных клеток посредством контакт-зависимых или контакт-независимых (например, выработка цитокинов) механизмов. Было описано несколько типов регуляторных Т-клеток, включая γδ T-клетки, Т-клетки-естественные киллеры (NKT-клетки), CD8+T-клетки, CD4+T-клетки и двойные отрицательные CD4-CD8-T-клетки. См., например, Bachet. al., Immunol, 3:189-98 (2003). Регуляторные CD4+CD25+FoxP3+ T-клетки были названы «естественными» регуляторными Т-клетками; они экспрессируют CD4, CD25 и фактор транскрипции семейства forkhead FoxP3 (forkhead box p3). Таким образом, в данном варианте воплощения изобретения, описывающего комбинированную терапию, предусмотрено введение агента, стимулирующего регуляторные CD4+CD25+FoxP3+ T-клетки, до, во время или после терапии антителом к CD52 для изменения композиции иммунной системы с последующим снижением количества лимфоцитов. Например, агент может активировать такие Т-клетки, стабилизировать и/или расширять популяцию клеток, мобилизировать и повышать циркуляцию клеток, и/или перемещать клетки к сайтам-мишеням. Примеры таких агентов включают рапамицин, активный или латентный ФРТ- β (например, ФРТ-β1, ФРТ-β2, ФРТ-β3, ФРТ-β4 и ФРТ-β5), ИЛ-10, ИЛ-4, ИФН-α, витамин D3, дексаметазон и микофенолата мофетил (см., например, Barrat et. al., J. Exp. Med. 195:603-616 (2002); Gregori et. al., J Immunol. 167: 1945-1953 (2001); Battaglia et. al., Blood 105: 4743-4748 (2005); Battaglia et. al., J. Immunol. 177:8338-8347 (2006)).
В данном изобретении эффективное количество антитела к CD52 для лечения заболевания представлено количеством, помогающим проводить лечение субъекта для достижения одной или нескольких требуемых клинических конечных точек. Например, для лечения волчанки (проявления включают системную красную волчанку, волчаночный нефрит, кожную красную волчанку, волчанку ЦНС, проявления со стороны сердечнососудистой системы, проявления со стороны легких, проявления со стороны печени, проявления со стороны гематологических показателей, проявления со стороны желудочно-кишечного тракта, проявления со стороны скелетно-мышечной системы, красную волчанку новорожденных, системную красную волчанку детей, индуцируемую препаратами системную красную волчанку, антифосфолипидный синдром и синдромы недостаточности комплемента, приводящие к симптомам волчанки; см., например, Robert G. Lahita, Editor, Systemic Lupus Erythematosus, 4th Ed., Elsevier Academic Press, 2004) клинические конечные точки могут быть измерены путем мониторинга пораженной системы органов (например, гематурия и/или протеинурия при волчаночном нефрите) и/или может использоваться индекс активности заболевания, который предоставляет составной показатель степени тяжести для нескольких систем органов (например, BILAG, SLAM, SLEDAI, ECLAM). См., например, Mandl et. al., “Monitoring patients with systemic lupus erythematosus” in Systemic Lupus Erythematosus, 4th edition, pp. 619-631, R.G. Lahita, Editor, Elsevier Academic Press, (2004).
В другом примере аутоиммунного заболевания диагностика рассеянного склероза (включая возвратно-ремитирующий, вторичный прогрессирующий, первичный прогрессирующий и прогрессирующий рецидивирующий рассеянный склероз ((Lublin et. al., Neurology 46 (4), 907-11 (1996)) может быть проведена, например, с использованием истории симптомов и неврологического обследования с помощью тестов, таких как магнитно-резонансная томография (МРТ), спинномозговая пункция, тесты с вызванным потенциалом и лабораторные анализы образцов крови. При РС цель лечения заключается в снижении частоты и степени тяжести рецидивов, предотвращении недееспособности, возникающей при прогрессировании заболевания, и способствовании восстановлению тканей (Compston and Coles, 2008). Таким образом, количество антитела к CD52, помогающее достигнуть клинической конечной точки, соответствующей такой цели, является эффективным количеством антитела для лечения.
Для сведения к минимуму иммуногенности, предпочтительно использование гуманизированного антитела для лечения пациента-человека в терапевтических способах и композициях по данному изобретению. В случаях, когда в повторном введении нет необходимости, пациенту-человеку также может оказаться подходящим введение химерного антитела мыши-человека по данному изобретению.
Антитела по данному изобретению могут использоваться для лечения индивидуума, который ранее был подвергнут лечению антителом Кампат-1H®, и у которого развились нейтрализирующие антитела к Кампату-1H® (например, индивидуума, рефрактерного относительно Кампата-1H®). Например, возможно лечение индивидуума, имеющего аутоиммунное заболевание (например, рассеянный склероз, волчанка, васкулит) и/или рак (например, лейкоз (например, хронический лимфоцитарный лейкоз), лимфома (например, неходжкинская лимфома)), который ранее был подвергнут лечению Кампатом-1H® (например, одним или несколькими курсами лечения Кампатом-1H®) и у которого развились нейтрализующие антитела к Кампату-1H®, которые снижают эффективность дальнейшего лечения Кампатом-1H®. Нами было показано, что гуманизированные антитела по данному изобретению (например, гуманизированные антитела 2C3, 12G6 и 9D9) могут связываться с CD52 человека независимо от наличия нейтрализующих антител к алемтузумабу. В другом варианте воплощения изобретения лечению может быть подвергнут индивидуум, который стал рефрактерным к лечению отдельным описанным здесь гуманизированным антителом, с использованием одного или другого описанного здесь гуманизированного антитела.
Антитело по данному изобретению может быть введено в виде однократной дозы или многократных доз в любой временной точке, кажущейся соответствующей специалисту в области здравоохранения. Доза может быть определена с использованием известных науке способов и может зависеть, например, от возраста, чувствительности, переносимости и общего самочувствия индивидуума. Может использоваться целый ряд способов введения, включая, но не ограничиваясь, парентеральное (например, внутривенное, интраартериальное, внутримышечное, интратекальное, интраперитонеальное, подкожные инъекции), пероральное (например, с пищей), местное, локальное, ингаляцию (например, интрабронхиальная, интраназальная или пероральная ингаляция, интраназальные капли) или ректальное, в зависимости от подвергнутого лечению заболевания или состояния. Парентеральное введение может быть одним из преимущественных типов введения.
В одном варианте воплощения изобретения антитела по изобретению вводят пациенту с использованием того же самого режима приема доз, что и для антитела Кампат-1H® (например, режима приема доз Кампата-1H® при хроническом лимфоцитарном лейкозе). В другом варианте воплощения изобретения антитело по изобретению вводят пациенту, страдающему аутоиммунным заболеванием (например, рассеянным склерозом (РС)), в виде режима, состоящего из введения первого цикла антитела с, по меньшей мере, одним последующим циклом антитела, при этом каждый цикл лечения состоит из 1-5 доз, вводимых в течение последовательных дней, и каждый цикл лечения отделен от следующего цикла, по меньшей мере, 1-24 месяцами (например, 12 месяцами). Например, в одном варианте воплощения изобретения пациент с рассеянным склерозом подвергается лечению первым циклом терапии антителом, состоящим из 5 ежедневных доз антитела, с, по меньшей мере, последующим одним циклом лечения антителом, проводимым спустя 12 месяцев после первого цикла и состоящим из 3 доз антитела, вводимых в ходе последовательных дней. В другом варианте воплощения изобретения пациент с РС подвергается повторному лечению при возникновении признаков повторной активности РС (см., например, WO 2008/031626 (описание включено сюда во всей своей полноте посредством ссылки)). В некоторых вариантах воплощения изобретения может оказаться необходимым введение более частых курсов лечения (например, каждые четыре месяца, каждые шесть месяцев), если у пациентов с более прогрессирующими формами РС или более прогрессирующими формами других аутоиммунных заболеваний (такого как васкулит; см., например, Walsh et. al., Ann Rheum Dis 67:1322-1327 (2008)) отмечается ранний рецидив спустя последний курс лечения. Доказательство возобновленной активности РС может быть определено на основе профессиональной оценки лечащего врача с использованием любых способов, доступных такому врачу. Для диагностики возобновленной активности РС в настоящее время имеется целый ряд способов, включая, без ограничения, клинические способы (рецидив или прогрессирование неврологической недееспособности) или магнитно-резонансную томографию (МРТ) головного мозга или спинного мозга. Как это хорошо понимают практикующие доктора, активность заболевания, определенная посредством МРТ, может быть выражена в виде возникновения новых поражений головного или спинного мозга на Т1 (обогащенных и необогащенных)- или Т2-взвешенных изображениях или в виде увеличения объема таких поражений. Поскольку способы диагностики РС постоянно совершенствуются, ожидается, что в будущем появятся дополнительные способы определения возобновленной активности РС (например, соотношение переноса намагниченности или МР-спектроскопия). Отдельный используемый способ диагностики, используемый для определения возобновленной активности РС, не является ограничением для заявленного изобретения. В определенных вариантах воплощения изобретения повторные МРТ выполняют при фиксированных интервалах после цикла лечения для определения необходимости в повторном лечении любого отдельного пациента и оптимальной временной точки повторного лечения такого пациента. В целом, повторное лечение желательно проводить перед возникновением повторных клинических признаков заболевания.
Лекарственная форма будет различной в зависимости от выбранного пути введения (например, раствор, эмульсия). Соответствующая для введения композиция, включающая антитело, может быть приготовлена в физиологически приемлемом носителе или основе. Композиция может состоять из нескольких доз или включать однократную дозу. Для растворов или эмульсий подходящие носители или основы включают, например, водные или спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференную среду. Парентеральные носители могут включать раствор натрия хлорида, декстрозу Рингера, декстрозу и натрия хлорид, содержащий лактат раствор Рингера или жирные масла. Внутривенные носители могут включать различные добавки, консерванты или жидкостные, питательные или электролитные компенсаторы (см. Remington's Pharmaceutical Sciences, 17th Edition, Mack Publishing Co., PA, 1985). Для ингаляции соединение может быть растворено и загружено в подходящий диспенсер для введения (например, в атомизатор, небулайзер или аэрозольный дозатор под давлением).
Диагностические способы и композиции
Иммуноглобулины по данному изобретению также могут быть полезны для целого ряда процессов в исследованиях и диагностике. Например, они могут использоваться для определения, выделения и/или очистки CD52 человека или его вариантов (например, способом аффинной очистки или другими подходящими способами, например, проточной цитометрией, например, для таких клеток, как лимфоциты, в суспензии) и для изучения структуры CD52 человека (например, конформации) и его функции. Для in vitro применения, когда иммуногенность антитела не имеет значения, мышиные и химерные антитела по данному изобретению будут полезны в качестве добавки к гуманизированным антителам.
Иммуноглобулины по данному изобретению могут использоваться в диагностических целях (например, in vitro, ex vivo). Например, гуманизированные иммуноглобулины по данному изобретению могут использоваться для определения и/или измерения уровня CD52 человека в образце (например, на клетках, экспрессирующих CD52 человека в тканях или жидкостях организма, таких как воспалительный экссудат, кровь, сыворотка, жидкость кишечника, ткани, содержащие CD52 человека). Образец (например, ткань и/или жидкость организма) может быть получен у индивидуума, а описанный здесь иммуноглобулин может использоваться в подходящем иммунологическом способе для определения и/или измерения экспрессии CD52 человека, включая способы, такие как проточная цитометрия (например, для клеток в суспензии, таких как лимфоциты), твердофазный иммуноферментный анализ (ИФА), включая анализы хемилюминесценции, радиоммуноанализ и иммуногистологический анализ.
В одном варианте воплощения изобретения описан способ определения CD52 человека в образце, состоящий из контакта образца с иммуноглобулином по данному изобретению в условиях, подходящих для специфического связывания иммуноглобулина с CD52 человека, и определения образовавшихся комплексов антитело-CD52. При применении способа описанные здесь иммуноглобулины могут использоваться для анализа здоровых и воспаленных тканей (например, человека) на предмет реакционной способности и/или экспрессии CD52 (например, иммуногистологическим анализом) для определения взаимосвязи между, например, болезнью воспаленного кишечника (БВК), аутоиммунными заболеваниями (такими как рассеянный склероз и волчанка), раком (таким как неходжкинская лимфома и хронический лимфоцитарный лейкоз) или другими клиническими состояниями и повышенной экспрессией CD52 человека (например, в пораженных тканях). Таким образом, иммуноглобулины по данному изобретению обеспечивают иммунологические способы оценки присутствия CD52 человека в здоровых и воспаленных тканях, посредством чего может быть определено присутствие заболевания, прогрессирование заболевания и/или эффективность терапии антителом к CD52 в лечении заболевания, например, воспалительного заболевания.
Кроме того, иммуноглобулины могут использоваться для исследования тканей после лечения терапевтическим антителом, снижающим количество CD52, для оценки эффективности такого лечения, а также для определения снижения экспрессии CD52 (Rawstrom et. al., Br. J. Heam., 107:148-153 (1999)).
Если иное не определено, все используемые здесь технические и научные термины имеют такое же самое значение, что и используемое обычно значение специалистом в области науки, к которой принадлежит изобретение. Типичные способы и материалы описаны ниже, однако на практике или при тестировании данного изобретения могут использоваться способы или материалы, подобные или эквивалентные таковым, описанным в тексте данной заявки. Все указанные здесь публикации и другие ссылки включены во всей своей полноте посредством ссылки. В случае конфликта, данная заявка, включая определения, имеет преимущество. Несмотря на целый ряд процитированных здесь документов, такое цитирование не представляет собой признание того, что любой из таких документов является частью общих знаний в данной области. По тексту данной заявки и формулы изобретения термин «состоит» или вариации такого термина, такие как «включающий» или «состоящий», будут подразумевать включение заявленных целых чисел или групп целых чисел, но не исключение любого целого числа или групп целых чисел. Материалы, способы и примеры являются лишь иллюстративными и не являются ограничивающими.
ПРИМЕРЫ
Пример 1: Получение мышиных антител к CD52 человека
Мышиные антитела к CD52 человека в представленных ниже примерах были получены путем иммунизации штамма мыши CD1 спленоцитами из трансгенных мышей к CD52 человека с использованием теневых CD1 (ФИГ. 1А), при этом отображение CD52 человека на поверхности В- и Т-клеток трансгенных мышей было подтверждено проточной цитометрией. Принимая во внимание, что трансгенные мыши имеют такой же самый теневой фенотип (CD1), что и иммунизированные мыши, спленоциты из трансгенных мышей, представляющие CD52 человека на клеточной поверхности в качестве уникального, чужеродного антигена в нативном формате, и иммунизированные трансгенные мыши вырабатывали иммунный ответ к антителу преимущественно относительно CD52 человека.
Для сбора спленоцитов у трансгенных к CD52 человека мышей, мыши были подвергнуты эвтаназии, была извлечена селезенка, после чего были приготовлены суспензии клеток путем пропускания через шприц. Затем мыши CD1 были иммунизированы собранными клетками селезенки, положительными относительно CD52 человека, в количестве 5×106 клеток на 100 мкл/мышь с или без полного адъюванта Фрейда путем интраперитонеальной (и/п) инъекции. Мышам вводили две ревакцинирующие дозы каждые две недели после первой иммунизации клетками селезенки трансгенных мышей, положительных на CD52 человека, в количестве 5×106 клеток в 100 мкл/мышь с/без полного адъюванта Фрейда и/п.
У каждой мыши была отобрана кровь из глаза в объеме 100-200 мкл/мышь в пробирки сепаратора с желтой пробкой перед иммунизацией для определения начального уровня реакционоспособности и спустя неделю после каждого цикла иммунизации для определения начального уровня реакционоспособности, а также спустя неделю после каждого цикла иммунизации для определения специфического иммунного ответа к CD52 человека. Мыши с повышенными уровнями реакционоспособности CD52 человека (измерено FACS с использованием клеток CHO K1, полученных способом рекомбинации для экспрессии белка CD52 человека, за исключением материнских клеток СНО К1) были умерщвлены, после чего была отобрана их кровь и селезенка в стерильных условиях для получения гибридом. Гибридомы были получены с использованием несекретирующей линии клеток миеломы мыши SP2/0 Ag14 или клеток миеломы NS1 в качестве партнеров слияния спустя 3-4 дня после иммунизации. Слившиеся клетки помещали в полноценную питательную среду, содержащую гипоксантин, аминоптерин и тимидин для получения гибридом. После скрининга большей части супернатантов гибридомы, было отобрано несколько клонов, продуцирующих специфические антитела к CD52 человека, которые затем были субклонированы для получения клональной популяции. Клоны гибридомы, продуцирующие антитела к CD52, были увеличены для дальнейшей разработки.
Пример 2: ПЦР-анализ тяжелых и легких цепей мышиных антител к CD52 человека
Путем тестирования супернатантов гибридомы на присутствие реакционной способности CD52 человека, был идентифицирован целый ряд мышиных моноклональных антител к CD52 человека (ФИГ. 1В). Были отобраны отдельные клоны, а вариабельные последовательности тяжелой и легкой цепей мыши были идентифицированы путем ПЦР клонирования и секвенирования. Последовательности легкой цепи представлены на ФИГ. 2 в сравнении с YTH 34.5 HL (т.е. Кампат IG каппа (крыса) и реагентное антитело CF1D12 (CF1D12 каппа) (Invitrogen Life Science Technologies). Подобным образом, последовательности тяжелых цепей представлены на ФИГ. 3 в сравнении с YTH 34.5 HL и реагентным антителом CF1D12.
В целом было идентифицировано 10 уникальных вариабельных последовательностей легкой цепи и 11 уникальных вариабельных последовательностей тяжелой цепи. При рассмотрении Кампата® и CF1D12, 7 уникальных участков CDR-1 (Таблица 1), 8 уникальных участков CDR-2 (Таблица 2) и 7 уникальных участков CDR-3 (Таблица 3) были идентифицированы в легких цепях антител к CD52 человека.
|
|
|
При рассмотрении Кампата® и CF1D12, в целом в тяжелых цепях антител к CD52 человека было идентифицировано 8 уникальных участков CDR-1 (Таблица 4), 10 уникальных участков CDR-2 (Таблица 5) и 8 уникальных участков CDR-3 (Таблица 6).
|
|
|
|
Взаимосвязь специфических участков CDR легкой и тяжелой цепей в 13 различных антителах к CD52 человека представлена в Таблице 7.
|
|
Клоны 8G3.25.3.5, 4G7.F3, 9D9.A2, 11C11.C5, 3G7.E9, 5F7.1.1.4, 12G6.15.1.2, 23E6.2.2.1, 2C3.3.8.1, 7F11.1.9.7 и 4B10.1.2.4 далее по тексту указывают как 8G3, 4G7, 9D9, 11C11, 3G7, 5F7, 12G6, 23E6, 2C3, 7F11 и 4B10, соответственно.
|
Пример 3: Клонирование генов вариабельного участка мышиного IgG из клеток гибридомы мыши для получения мышиного/человеческого химерного антитела IgG1
Активно пролиферирующие и секретирующие антитело клетки гибридомы использовали для выделения РНК с применением реагента Тризол (Gibco/BRL) при соблюдении предлагаемого производителем протокола. РНК была подвергнута количественному анализу путем измерения OD с использованием Nanodrop, и целостность РНК была определена путем анализа такой РНК на геле или путем использования биоанализатора. Вся РНК была обратно транскрибирована в кДНК, и вариабельные участки тяжелой и легкой цепей были амплифицированы в ходе полимеразной цепной реакции (ПЦР). кДНК была получена с использованием обратной транскриптазы BD Sprint PowerScript (Clontech) и праймера Oligo(dT) при 0,5 мкг/мкл (Invitrogen Cat# Y01212), и обратных праймеров (расположенных на константных участках в тяжелой и легкой цепях), перечисленных ниже по порядку, при 10 мкМ и соблюдении протокола производителя. В частности, использовали праймеры, пронумерованные 3 (SEQ ID NO: 77), 11 (SEQ ID NO: 85), 19 (SEQ ID NO: 93), 20 (SEQ ID NO: 94) и 21 (SEQ ID NO: 95). ПЦР амплификацию вариабельных участков тяжелой и легкой цепи проводили с использованием кДНК, полученной в соответствии с представленным выше описанием. 1 мкл кДНК смешивали с прямым праймером и обратными праймерами при 10 мкМ каждый для тяжелой и легкой цепей и смешивали со смесью для ПЦР (Invitrogen) в присутствии 2 мкл MgCl2 при 25 мМ. Программа ПЦР проводилась по следующим этапам: 1) 95°C в течение 2 минут; 2) 95°C в течение 30 секунд; 3) 56°C в течение 30 секунд; 4) 68°C в течение 45 секунд; 5) повтор этапов 2-4 25 раз; 6) 68°C в течение 10 минут и выдерживание при 16°C. Продукт ПЦР был проанализирован на 2% геле на присутствие продукта последовательности вариабельного участка размером примерно 300-400 пар нуклеотидных оснований, и соответствующие полосы были клонированы в набор для клонирования pCR2.1-TOPO TA (Invitrogen) с соблюдением инструкций производителя, после чего клонирование и последовательности были подтверждены с использованием праймеров М13. Праймеры, используемые для обратного транскрибирования и ПЦР амплификации последовательностей легкой цепи и тяжелой цепи, представлены следующими:
Праймеры легкой цепи
1) Lead-ML kappa = 5' ATGGGCWTCAARATGRARWCWCAT 3' (Прямой праймер в лидерной последовательности) (SEQ ID NO: 75)
2) FR1-ML kappa = 5' GAYATTGTGMTRACMCARKMTCAA 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 76)
3) ML kappa const = 5' ACTGGATGGTGGGAAGATGGA 3'(Обратный праймер в константном участке) (SEQ ID NO: 77)
4) VK-MK = 5' GAYATTGTGMTSACMCARWCTMCA 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 78)
5) MKC-Const = 5' GGATACAGTTGGTGCAGCATC 3' (Обратный праймер в константном участке) (SEQ ID NO: 79)
Праймеры тяжелой цепи
6) MH-SP-ALT1 = 5' ATGRASTTSKGGYTMARCTKGRTT 3' (Прямой праймер в лидерной последовательности) (SEQ ID NO: 80)
7) MH-SP-ALT2 = 5' ATGRAATGSASCTGGGTYWTYCTCT 3' (Прямой праймер в лидерной последовательности) (SEQ ID NO: 81)
8) MH-FR1 = 5' SAGGTSMARCTGCAGSAGTCT 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 82)
9) MH-FR1-1 = 5' SAGGTGMAGCTCSWRSARYCSGGG 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 83)
10) MH-J2 = 5' TGAGGAGACTGTGAGAGTGGTGCC 3' (Обратный праймер в J участке) (SEQ ID NO: 84)
11) MH-gamma-const = 5' AYCTCCACACACAGGRRCCAGTGGATAGAC 3' (Обратный праймер в константном участке) (SEQ ID NO: 85)
12) VH MH1 = 5' SARGTNMAGCTGSAGSAGTC 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 86)
13) VH MH2 = 5' SARGTNMAGCTGSAGSAGTCWGG 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 87)
14) VH MH3 = 5' CAGGTTACTCTGAAAGWGTSTG 3' (Прямой праймер в каркасном участке 1) (SEQ ID NO: 88)
15) VH MH4 = 5' GAGGTCCARCTGCAACARTC 3'(Прямой праймер в каркасном участке 1) (SEQ ID NO: 89)
16) VH MH5 = 5' CAGGTCCAACTVCAGCARCC 3'(Прямой праймер в каркасном участке 1) (SEQ ID NO: 90)
17) VH MH6 = 5' GAGGTGAASSTGGTGGAATC 3'(Прямой праймер в каркасном участке 1) (SEQ ID NO: 91)
18) VH MH7 = 5' GATGTGAACTTGGAAGTGTC 3'(Прямой праймер в каркасном участке 1) (SEQ ID NO: 92)
19) IgG1 = 5' ATAGACAGATGGGGGTGTCGTTTTGGC 3' (Обратный праймер в константном участке CH1 IgG1 мыши) (SEQ ID NO: 93)
20) IgG2A = 5' CTTGACCAGGCATCCTAGAGTCA 3' (Обратный праймер в константном участке CH1 IgG2A мыши) (SEQ ID NO: 94)
21) IgG2B = 5' AGGGGCCAGTGGATAGAGTGATGG 3' (Обратный праймер в константном участке CH1 IgG2B мыши) (SEQ ID NO: 95)
Дегенеративные праймеры приводят к определенной дегенерации на 5'-конце каркасного участка 1 тяжелой и легкой цепей. Консенсусная ДНК последовательность от нескольких независимых клонов вариабельного участка тяжелой цепи и клонов вариабельного участка легкой цепи использовалась для получения аминокислотной последовательности.
Функциональные химерные антитела к CD52 были получены путем соединения вариабельных участков тяжелой цепи и легкой цепи в ДНК, кодирующую константный участок тяжелой цепи IgG1 человека (последовательность идентична таковой последовательности в Кампате-1H®) и константный участок легкой каппа-цепи человека (последовательность идентична таковой последовательности в Кампате-1H®), соответственно. Для получения вектора легкой цепи pCEP4 (Invitrogen), кодирующего легкую цепь антитела к CD52, вариабельная последовательность легкой цепи была подвергнута ПЦР амплификации и рекомбинации путем лигаза-независимого клонирования в вектор легкой цепи pCEP4 LIC для включения сигнальной каппа-последовательности тяжелой цепи на 5'-конце и константного участка легкой цепи на 3'-конце. Подобным образом, для получения вектора тяжелой цепи pCEP4, последовательность вариабельного участка тяжелой цепи была рекомбинирована путем лигаза-независимого клонирования в вектор тяжелой цепи pCEP4 LIC для включения сигнальной каппа-последовательности человека на 5'-конце и константного участка тяжелой цепи, включающего CH1, шарнирный участок, CH2 и CH3, на 3'-конце. Аминокислотные последовательности константного участка тяжелой и легкой цепей идентичны последовательностям константных участков, присутствующих в антителе Кампат-1Н.
Краткое описание: вектор pCEP4 LIC был расщеплен BfuA1 (New England Biolabs-NEB) в соответствующем буфере с соблюдением рекомендаций производителя, и после полного расщепления вектор был очищен с использованием набора для очистки PureLink PCR Purification Kit (Invitrogen). Затем линеаризированная плазмида была подвергнута воздействию Т4 ДНК-полимеразы (New England Biolabs) для получения одноцепочечных концов, которые использовали для клонирования фрагмента вариабельного участка. Специфический вектор pCEP4 LIC тяжелой цепи использовали для клонирования вариабельного участка тяжелой цепи, и специфический вектор pCEP4 LIC легкой цепи использовали для клонирования вариабельного участка легкой цепи. Вставка вариабельного участка была получена в ходе ПЦР с использованием плазмиды, содержащей вариабельный участок тяжелой цепи pCR2.1-TOPO, или плазмиды, содержащей вариабельный участок легкой цепи pCR2.1-TOPO, в качестве матрицы, а также праймеров, содержащих специфическую последовательность вариабельной цепи и «липкие» концы вектора. ДНК-полимераза VENT (New England Biolabs) использовалась для ПЦР-амплификации вставки. ПЦР-амплифицированная вставка была очищена через гель и подвергнута воздействию Т4 ДНК-полимеразы для получения одноцепочечных концов. Полученные вектора для тяжелой цепи и легкой цепи и соответствующие вставочные фрагменты вариабельного участка были скомбинированы и инкубированы при комнатной температуре в течение 10 минут, а затем использовали для трансформации клеток TOPO10 (Invitrogen), после чего были выращены ампициллин-устойчивые колонии, и последовательность была верифицирована. Клоны тяжелой цепи pCEP4 и легкой цепи pCEP4, имеющие правильную последовательность тяжелой цепи и легкой цепи, вставленные в каркасный участок, были амплифицированы и использованы для получения белка. Вектор тяжелой цепи был ко-трансфицирован с использованием соответствующего вектора легкой цепи в соотношении 1:1 в клетки HEK293 (Invitrogen) с использованием катионного липида ЛипофектаминTM 2000 (Invitrogen). Кондиционированная среда была собрана спустя три дня после трансфицирования, и химерное антитело было очищено с использованием хроматографии с белком А. Для такого способа хроматографии, к белку А была добавлена среда с последующим промыванием 50 объемами колонки ФСБ. Химерное антитело было элюировано с использованием 5 объемов колонки 12,5 мМ лимонной кислоты при рН 3,0. Значение рН элюированного антитела было нейтрализировано путем добавления 0,5 М HEPES. Буфер был подвергнут обмену в ФСБ с использованием гель-фильтрационной колонки PD-10.
Пример 4: Анализ специфичности антигенной детерминанты химерных моноклональных антител к CD52 человека
Специфичность антигенной детерминанты клонов определяли путем оценки способности химерных антител связываться с панелью клеточных линий, полученных в ходе рекомбинации для экспрессии мутантов CD52 человека (ФИГ. 4), полученных путем сканирующего аланином мутагенеза. Замена первых 10 аминокислот во внеклеточном участке CD52 из 12 аминокислот проводили в кДНК CD52 человека с использованием вектора экспрессии pcDNA3.1 (Invitrogen) и набора для сайт-направленного мутагенеза STRATAGENE QUIKCHANGE II XL. Вектор pcDNA3.1, кодирующий дикий тип или мутантную последовательность CD52, был подвергнут верификации последовательности и трансфицирован в клетки СНО с использованием ЛипофектаминаTM и путем отбора в среде, содержащей G418, для получения клеточных линий СНО, экспрессирующих CD52 дикого типа или аланиновый мутант. Специфическое связывание химерных антител к CD52 человека с антигенной детерминантой определяли путем измерения связывания антител с клетками, экспрессирующими CD52 дикого типа и мутанта (анализ FACS). Анализ FACS проводили путем определения связывания химерных антител к CD52 с использованием ФЭ-конъюгированного вторичного антитела козы к CD52 человека (Jackson ImmunoResearch Labs). ФИГ. 5А-5С отображают среднюю интенсивность флуоресценции (MFI) моноклональных антител к CD52 относительно клеточных линий, экспрессирующих CD52 дикого типа и мутанта. Даже если CD52 очень короткий, содержит 12 аминокислот и представлен ГФИ-заякоренным белком, результаты FACS-анализа четко показывают на существование трех групп антител: (1) N-терминальная группа связывания (такая как 4B10); (2) срединная группа связывания (такая как 4G7, 9D9 и 11C1) и (3) C-терминальная группа связывания (такая как 23E6, 12G6 и 2C3). Специфичность моноклональных антител к CD52 человека относительно антигенной детерминанты (идентифицировано по сокращенным названиям, представленным в конце Примера 2) обобщена в Таблице 8.
|
CD52 является чрезвычайно малым антигеном, но состоит из относительно большой, гидрофильной N-присоединенной молекулы гликана, а также гидрофобного ГФИ-якоря. Для исследования вероятности того, что сахара могут составлять всю или часть антигенной детерминанты, распознаваемой антителами к CD52, образцы CD52, подвергнутые аффинной очистке и полученные из клеток СНО-CD52, были подвергнуты воздействию эндогликозидазы, PNGase-F для полного удаления N-присоединенных сахаров из антигена. Подвергнутые обработке и псевдо-обработке контрольные образцы затем были проанализированы способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, блоттинг-анализу с использованием мембраны из поливинилиденфторида (PVDF, Invitrogen); затем в образцы было внесено по 3 мкг/мл отдельных химерных моноклональных антител к CD52, вслед за тем были проведены стандартные процедуры вестерн-блоттинга с использованием расширенного хемилюминесцентного определения. Блоты с антителом Кампат-1H® (C1H) и только вторичным антителом (только 2°) исследовали в качестве положительного и отрицательного контроля, соответственно, и затем анализировали с использованием каждого моноклонального антитела (ФИГ. 5D). Результаты выявили различные предпочтения при связывании среди антител относительно гликозилированного и дегликозилированного CD52. Такая характеристика позволила категоризировать одиннадцать антител на четыре типа групп связывания:
1. Антитела, связывающиеся без какого-либо очевидного предпочтения с гликозилированным CD52 в сравнении с дегликозилированным CD52 (4G7, 9D9)
2. Антитела, связывающиеся специфическим образом с гликозилированным CD52 (7F11, 4B10)
3. Антитела, связывающиеся специфическим образом с дегликозилированным CD52 (8G3)
4. Антитела, связывающиеся специфическим образом с дегликозилированным CD52 в сравнении с гликозилированным CD52 (12G6, 5F7, 23E6, 2C3, 11C11, 3G7)
Пример 5: Активность КЗЦ химерных антител к CD52
Анализ комплементзависимой цитотоксичности (КЗЦ) проводился в соответствии с представленным ниже описанием. Краткое описание: клетки СНО К1, полученные путем рекомбинации для экспрессии белка CD52 (CHO-CD52), использовали в качестве клеток-мишеней, и такие клетки были мечены Na2 51CrO4 (New England Nuclear, Boston, MA) при 37°C в течение 1-2 часов. Клетки были промыты, ресуспендированы в среде X-Vivo и смешаны с антителами к CD52 человека до финальной концентрации 2,2 мкг/мл. В экспериментальные лунки был добавлен комплемент человека (Sigma) до финальной концентрации 10%. После инкубации в течение 1-5 часов, 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(число импульсов в минуту для образца (c.p.m.) - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100.
В ходе анализа КЗЦ с комплементом человека использовали двенадцать различных химерных антител к CD52 (вариабельный участок мыши и константный участок IgG1 человека) и клетки СНО-CD52. Гуманизированное антитело Кампат-1H® использовали в качестве положительного контроля. Отрицательный контроль был представлен Кампатом-1H® null (не связывающийся с клетками минимальный мутант антитела Кампат-1H® - двухточечные мутации в петле Н2 тяжелой цепи участка CDR2 (K52bD и K53D; Gilliland LK et. al., Journal of Immunology, 162:3663-3671 (1999)). Результаты показывают, что химерные антитела способны опосредовать КЗЦ гибель клеток, экспрессирующих CD52. Некоторые химерные антитела опосредовали робастный эквивалент гибели или показатель гибели, превосходящий таковой показатель для Кампата® (ФИГ. 6).
Пример 6: Активность АЗКЦ химерных антител к CD52
Анализ антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ) проводился в соответствии с представленным ниже описанием. Краткое описание: клетки СНО К1, полученные путем рекомбинации для экспрессии белка CD52 (CHO-CD52), использовали в качестве клеток-мишеней, и такие клетки были мечены Na2 51CrO4 (New England Nuclear, Boston, MA) при 37°C в течение 1-2 часов. Клетки были промыты, ресуспендированы в среде X-Vivo и смешаны с антителами к CD52 человека до финальной концентрации 1,1 мкг/мл. МКПК человека использовали в качестве эффекторных клеток, которые были добавлены в соотношении 1:100 мишень:эффекторная клетка. После инкубации в течение 6 часов (ночь), 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(c.p.m.образца - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100.
В ходе анализа АЗКЦ с МКПК в качестве эффекторных клеток использовали двенадцать различных химерных антител к CD52 (вариабельный участок мыши и константный участок IgG1 человека). Гуманизированное антитело Кампат-1H® использовали в качестве положительного контроля. Отрицательный контроль был представлен Кампатом-1H® null (не связывающийся с клетками минимальный мутант антитела Кампат-1H® - двухточечные мутации в петле Н2 тяжелой цепи участка CDR2 (K52bD и K53D; Gilliland, 1999, см. выше). Результаты показывают, что химерные антитела способны опосредовать АЗКЦ гибель клеток, экспрессирующих CD52. Некоторые химерные антитела опосредовали робастный эквивалент гибели или показатель гибели, превосходящий таковой показатель для Кампата-1H® (ФИГ. 7).
Пример 7: Оценка связывания химерных антител к CD52 с определенной популяцией лимфоцитов
Следующие антитела, конъюгированные с флуорохромом, использовали для проточного цитометрического анализа: антитело к CD3-FITC, антитело к CD27-PE, антитело к CD62L-PE Cy5, антитело к CD56- PE Cy7, антитело к CD16-APC Cy7 (BD Biosciences, San Diego, CA), антитело к CD45RA-ECD (Beckman Coulter), антитело к CD19-Pacific Blue, антитело к CD4-APC Cy5.5 и антитело к CD8 pacific orange (Invitrogen, CA). Все мышиные химерные антитела к CD52, а также гуманизированное антитело Кампат-1H® были конъюгированы с Alexa fluor 647 (BD Pharmingen). Здоровые мононуклеарные клетки периферической крови человека были получены из криоконсервированной лейкоцитарной пленки или из мононуклеарных клеток, сепарированных из крови здоровых доноров, предоставленных коммерческими поставщиками (Bioreclamation, NY, USA). Для обогащения мононуклеарных клеток, периферическая кровь человека была разведена в соотношении 1:1 стерильным забуференным физиологическим раствором (ФСБ) и осторожно распределена по фиколлу-паку (GE Healthcare Bio-Sciences, Uppsala, Sweden) с последующим центрифугированием в течение 30 минут при комнатной температуре. Межфазный слой мононуклеарных клеток был отобран и промыт в ФСБ, содержащем 5% фетальной бычьей сыворотки (буфер FACS). Примесные красные кровяные клетки (ККК) были лизированы с помощью раствора для лизиса ККК (Sigma, St. Louis, MO, USA). Клетки были ресуспендированы в холодном буфере FACS, и остатки клеток были удалены с использованием фильтра 40 мкм. Для оценки способности связывания 9 химерных антител к CD52 человека (4B10, 7F11, 9D9, 5F7, 2C3, 4G7, 23E6, 8G3, 3G7) в сравнении с Кампатом-1H® было проведено десять цветных анализов способом проточной цитометрии.
Краткое описание: репликаты 1×106 МКПК в буфере FACS были инкубированы с коктейлем предварительно титрованных разведений антител к CD3, CD27, CD45RA, CD62L, CD56, CD19, CD8, CD4, CD16 вместе с одним из 9 химерных антител к CD52 человека (4B10, 7F11, 9D9, 5F7, 2C3, 4G7, 23E6, 8G3, 3G7) в течение 30 минут при температуре 4°C. Клетки были промыты и фиксированы в ФСБ, содержащем 1% параформальдегида. 100000 явлений окрашенных клеток были зафиксированы на BD LSR-II (BD Biosciences, San Jose, CA), и данные были проанализированы с использованием программного обеспечения FlowJo, версия 7.2 (Tree Star, Inc, Oregan, USA). Среди В- и Т-лимфоцитов было найдено множество подгрупп с отличительными фенотипическими характеристиками, и было показано, что CD52 экспрессируется на всех лимфоцитах человека. Для идентификации подгрупп лимфоцитов, а также для оценки подобий и различий в характеристиках связывания антител к CD52 с CD52 на поверхности клеток отдельных подгрупп было проведено десять цветных анализов проточной цитометрии. С использованием комбинации маркеров, впервые в лимфоцитарной популяции было выявлено 11 фенотипически различных клеточных популяций, соответствующих линиям клеток В, Т и NK-клеток. Затем была оценена интенсивность окрашивания, соответствующая способности антител к CD52 определять экспрессию CD52. Гистограммы (ФИГ. 8А-8С) показывают сравнение уровня определения CD52 с каждым антителом для отдельных популяций лимфоцитов. Данные показывают, что антитела обладают существенными различиями в связывании с CD52. Уровень определения 4B10, 9D9, 7F11 и Кампата-1H® сопоставимы, однако 4B10 постоянно обладают наивысшим уровнем определения, чем другие антитела, включая Кампат-1H®, практически на всех подгруппах исследуемых клеток. С другой стороны, уровень определения CD52 с использованием антител 3G7, 4G7, 8G3 и 23E6 существенно ниже. Результаты отображают иерархию в антителах относительно их способности распознавать CD52 на различных популяциях клеток, при этом значение для 4В10 максимальное, а значение для 3G7 минимальное. Интересно, что такие различия менее очевидны для эффектора CD4 и более очевидны для подгруппы NK-клеток, на которых CD52 экспрессируется при относительно низких уровнях. Вариации характеристик связывания показывают, что свойства химерных антител не только существенно отличаются от Кампата-1H®, но также отображают различия в свойствах между антителами.
Пример 8: Анализ химерных антител к CD52 у трансгенных мышей к CD52 человека (7F11, 8G3, 23E6, 12G6, 4B10 и 5F7)
Мышам, трансгенным по CD52 человека, вводили Кампат® или химерные антитела к CD52 (7F11, 8G3, 23E6, 12G6, 4B10 и 5F7) для изучения уровня снижения количества лимфоцитов. Мышам интраперитонеально вводили Кампат® или химерные антитела к CD52 в объеме 100 мкл в дозе 1 мг/кг. Спустя три дня мыши были умерщвлены, а кровь и селезенка были отобраны для определения уровня снижения количества В- и Т-клеток. Проточная цитометрия использовалась для оценки абсолютного количества общих клеток Т-хелперов, цитотоксических Т-клеток и В-клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Такие популяции лимфоцитов были определены по их поверхностной экспрессии следующих белковых антигенов: экспрессия CD4 указывает на наличие популяции Т-хелперов, экспрессия CD8 указывает на наличие популяции цитотоксических Т-клеток, и экспрессия CD19 указывает на наличие всех популяций зрелых В-клеток. Значительный уровень снижения количества Т- и В-клеток отмечался для антител 12G6 и 4B10, что было сопоставимо со снижением количества таких клеток, отмечаемых для Кампата®. Лечение Кампатом®, химерным антителом 12G6 или химерным антителом 4B10 существенно снижает количество Т- и В-клеток в крови и селезенке у мышей, подвергнутых лечению при таком уровне дозы. Химерные антитела 7F11 и 5F7 приводили к значительному снижению уровня Т-клеток в крови и селезенке, но были менее эффективны в снижении количества В-клеток в обоих компартментах. Лечение антителом к 23E6 приводило к умеренному снижению количества клеток при данной дозе, в то время как при лечении антителом 8G3 с более низкой аффинностью снижение количества клеток было незначительным или отсутствовало.
Фиг. 9А-9С показывают уровень CD4 T-клеток, CD8 T-клеток и CD19 B-клеток в крови спустя 72 часа после введения дозы химерных антител. Фиг. 10А-10С показывают уровень CD4 T-клеток, CD8 T-клеток и CD19 B-клеток в селезенке спустя 72 часа после введения дозы химерных антител.
Пример 9: Анализ химерных антител к CD52 у трансгенных мышей к CD52 человека (2C3, 3G7, 4B10, 9D9 и 11C11)
Мышам, трансгенным по CD52 человека, вводили Кампат® или химерные антитела к CD52 (2C3, 3G7, 4B10, 9D9 и 11C11) для изучения уровня снижения количества лимфоцитов. Мышам внутривенно вводили Кампат® или химерные антитела к CD52 в объеме 100 мкл в дозе 1 мг/кг. Спустя три дня мыши были умерщвлены, а кровь и селезенка были отобраны для определения уровня снижения количества В- и Т-клеток. Проточная цитометрия использовалась для оценки абсолютного количества общих клеток Т-хелперов, цитотоксических Т-клеток и В-клеток, присутствующих в циркулирующей периферической крови трансгенных мышей huCD52. Такие популяции лимфоцитов были определены по их поверхностной экспрессии следующих белковых антигенов: экспрессия CD4 указывает на наличие популяции Т-хелперов, экспрессия CD8 указывает на наличие популяции цитотоксических Т-клеток, и экспрессия CD19 указывает на наличие всех популяций зрелых В-клеток. Значительный уровень снижения количества Т- и В-клеток отмечался для нескольких антител в крови и селезенке. Снижение активности 2C3 и 9D9 было сопоставимо с таковым снижением, отмечаемым для Кампата®, при котором отмечалось существенное снижение уровней CD4 и CD8 T-клеток, а также CD19 B-клеток. Лечение с использованием химерного антитела 4B10 также приводило к существенному снижению числа лимфоцитов в крови трансгенных мышей. В то время как лечение химерным антителом 3G7 или 11C11 существенно снижало количество Т-клеток в крови, уровень присутствующих В-клеток не существенно изменялся под воздействием такой дозы.
Фиг. 11А-11С показывают уровень CD4 T-клеток, CD8 T-клеток и CD19 B-клеток в крови спустя 72 часа после введения дозы химерных антител.
Пример 10: Анализ эффективности антител к CD52 (7F11, 4B10 и 12G6)
Сорока мышам SCID (n=8 в каждой группе) было введено 1×106 B104 опухолевых клеток в объеме 100 мкл в правый бок. На 11 день после введения опухолевых клеток, было начато лечение Кампатом® или химерными антителами 7F11, 4B10 или 12G6. Антитела вводили один раз в неделю в дозе 10 мкг/кг путем интраперитонеальной инъекции в течение оставшегося времени эксперимента. У всех мышей в не подвергнутой лечению группе отмечалось прогрессивное развитие растущих опухолей, требующих умерщвления животных с медианой выживаемости 29 дней. Лечение антителом Кампат® приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутой лечению группой (медиана выживаемости (МВ)) 50 дней и p<0,0001). Лечение химерными антителами к CD52 также приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутыми лечению мышами (p<0,0001 для 7F11 и 4B10 и p=0,0020 для 12G6). Основываясь на показателях выживаемости, активность антител 7F11 и 4B10 превышает активность Кампата® (63% выживаемость для 7F11 и 75% выживаемость для 4B10 в сравнении с 50% выживаемостью для Кампата®). ФИГ. 12 отображает процент выживаемость мышей после лечения.
Пример 11: Анализ эффективности антител к CD52 (2C3, 8G3 и 23E6)
Сорока мышам SCID (n=8 в каждой группе) было введено 1×106 B104 опухолевых клеток в объеме 100 мкл в правый бок. На 11 день после введения опухолевых клеток, было начато лечение Кампатом® или химерными антителами 2C3, 8G3 или 23E6. Антитела вводили один раз в неделю в дозе 10 мкг/кг путем интраперитонеальной инъекции в течение оставшегося времени эксперимента. У всех мышей в не подвергнутой лечению группе отмечалось прогрессивное развитие растущих опухолей, требующих умерщвления животных с медианой выживаемости 26 дней. Лечение Кампатом®, антителами 23E6 и 2C3 приводило к статически значимому повышению выживаемости (p=0,0025, p=0,0007 и p=0.0002, соответственно). ФИГ. 13 отображает процент выживаемость мышей после лечения.
Пример 12: Анализ эффективности химерных антител к CD52 на модели ксенотрансплантатов опухоли (9D9 и 4B10)
Сорока мышам SCID (n=8 в каждой группе) было введено 1×106 B104 опухолевых клеток в объеме 100 мкл в правый бок. На 11 день после введения опухолевых клеток, было начато лечение Кампатом® или химерными антителами 9D9 или 4B10. Антитела вводили один раз в неделю в дозе 10 мкг/кг путем интраперитонеальной инъекции в течение оставшегося времени эксперимента. У всех мышей в не подвергнутой лечению группе отмечалось прогрессивное развитие растущих опухолей, требующих умерщвления животных с медианой выживаемости 27 дней. Лечение антителом Кампат® приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутой лечению группой (медиана выживаемости не достигнута и p<0,0001). Лечение химерными антителами к CD52 также приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутыми лечению мышами (p<0,0001 для 9D9 и 4B10). Статистический анализ кривых выживаемости выявил, что в данном эксперименте химерное антитело обладало активностью, сопоставимой с активностью Кампата® (p=0,0675) ФИГ. 14 отображает процент выживаемость мышей после лечения.
Пример 13: Анализ эффективности химерных антител к CD52 на модели ксенотрансплантатов опухоли (2C3 и 11C11)
Сорока мышам SCID (n=8 в каждой группе) было введено 1×106 B104 опухолевых клеток в объеме 100 мкл в правый бок. На 11 день после введения опухолевых клеток, было начато лечение Кампатом® или химерными антителами 2C3 или 11C11. Антитела вводили один раз в неделю в дозе 10 мкг/кг путем интраперитонеальной инъекции в течение оставшегося времени эксперимента. У всех мышей в не подвергнутой лечению группе отмечалось прогрессивное развитие растущих опухолей, требующих умерщвления животных с медианой выживаемости 32 дня. Лечение антителом Кампат® приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутой лечению группой (медиана выживаемости не достигнута и p<0,0001). Лечение химерными антителами к CD52 также приводило к статистически значимому повышению выживаемости в сравнении с не подвергнутыми лечению мышами (p<0,0001 для 2C3 и p=0,0004 для 11C11). Статистический анализ кривых выживаемости выявил, что химерные антитела 2C3 и 11C11 обладали активностью, сопоставимой с активностью Кампата® (p=0,3173 для 2C3 и p=0.9703 для 11C11). ФИГ. 15 отображает процент выживаемости мышей после лечения Кампатом®, химерным антителом 2C3 или химерным антителом 11C11.
Пример 14: Получение и анализ гуманизированного антитела 4B10 к CD52
Гуманизированное антитело 4B10 к CD52 было получено с использованием прививания участков CDR из мышиного антитела 4B10 в каркасный фрагмент вариабельного участка антитела человека. Последовательности тяжелой цепи и легкой цепи мышиного 4B10 были проанализированы с использованием основанного на веб-технологиях выравнивания последовательностей для идентификации каркасной последовательности тяжелой цепи и легкой цепи зародышевого центра человека, которые будут служить в качестве подходящего акцептора для привитого CDR (ФИГ. 16). Остатки, определяющие участки CDR по Kabat и IMGT®, были совмещены с каркасными участками человека, имеющими высокий показатель идентичности последовательности, для получения последовательностей гуманизированной легкой цепи и тяжелой цепи. Для идентификации наиболее подходящей акцепторной последовательности проводилась визуальная инспекция и анализ наложенных последовательностей тяжелой цепи и легкой цепи 4В10. Из всех последовательностей зародышевого центра, имеющих высокую степень подобия, последовательность зародышевого центра VH3-72 для тяжелой цепи и VK2-A18b для легкой цепи (последовательности зародышевой линии человека представлены на веб-сайте, описанном в публикации Tomlinson, IM, et. al., EMBO J., 14(18):4628-4638 (1995); Cook, GP., et. al., Nature Genetics, 7:162-168 (1994)) были выбраны по своей высокой степени гомологичности, подобию последовательности каркасным участкам мыши и минимальному разрушению структуры петли CDR в качестве акцепторной последовательности CDR. Последовательности CDR1, 2 и 3 тяжелой цепи и легкой цепи для 4В10 были привиты в каркасные участки человека VH3-72 и VK2-A18b, соответственно, для получения последовательностей гуманизированных тяжелой цепи и легкой цепи для 4В10 (представлено на ФИГ. 17; ФИГ. 110).
Пример 15: Оценка активности связывания химерных и гуманизированных моноклональных антител 4В10
Химерные и гуманизированные антитела 4В10 были получены и очищены в соответствии с описанием, представленным в Примере 3, и проанализированы на предмет своей способности связываться с линией В-клеток В104, которые эндогенно экспрессируют CD52, способом FACS-анализа. Краткое описание: клетки 2×105 B104 были инкубированы с антителом (0,02 мкг/мл до 16,7 мкг/мл) в ФСБ, содержащем 5% фетальной бычьей сыворотки и 5% сыворотки козы. Связанное антитело определяли с использованием FITC-меченого вторичного антитела козы к человеку, что позволяет определить химерные или гуманизированные антитела к CD52. Меченые клетки были проанализированы с использованием системы FACSCalibur (Becton Dickinson). ФИГ. 18 отображает кратное повышение геометрического среднего значения интенсивности флуоресценции каждого образца, нормализированного (разделенного) к 2°-образцу. На оси X указано 11 различных концентраций (12я точка на оси Х только вторична) гуманизированного и химерного антитела, используемого в анализе, а на оси Y указано кратное повышение геометрического среднего значения флуоресценции. Результаты показывают, что гуманизированное антитело 4В10 связывалось также хорошо или немного лучше, чем химерное антитело 4В10, с клетками, экспрессирующими CD52.
Пример 16: Оценка активности АЗКЦ химерных и гуманизированных моноклональных антител 4В10
Гуманизированные и химерные антитела 4В10 были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводился в соответствии с описанием, представленным выше в Примере 6. Краткое описание: клетки СНО К1, полученные путем рекомбинации для экспрессии белка CD52 (CHO-CD52), использовали в качестве клеток-мишеней, и такие клетки были мечены Na2 51CrO4 (New England Nuclear, Boston, MA) при 37°C в течение 1-2 часов. Клетки были промыты, ресуспендированы в среде RPMI 1640 с 10% ФТС и смешаны с химерными и гуманизированными антителами 4В10 при различных концентрациях, варьирующих от 10 мкг/мл до 0,01 мкг/мл. МКПК человека использовали в качестве эффекторных клеток, которые были добавлены в соотношении 1:50 мишень:эффекторная клетка. После инкубации в течение 6 часов (ночь), 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(c.p.m. образца - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100.
ФИГ. 19 иллюстрирует концентрации контрольного, химерного и гуманизированного антител 4В10, используемых в анализе (ось Х), в то время как на оси Y представлен % специфической гибели. Результаты показывают, что гуманизированное антитело 4В10 опосредовало эквивалентную или немного большую гибель в ходе АЗКЦ, чем химерное антитело 4В10. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 17: Оценка активности КЗЦ химерных и гуманизированных моноклональных антител 4В10
Гуманизированные и химерные антитела 4В10 были проанализированы на предмет своей способности опосредовать цитотоксический эффект на клетки В104, которые эндогенно экспрессируют CD52, в присутствии комплемента человека. Набор CellTiter Glo (Promega) использовался для определения живых клеток, оставшихся в ходе анализа. Краткое описание: клетки В104 (клетки-мишени) были распределены в количестве 2,5×104/лунка по планшету на 96 лунок, и были смешаны с химерным или гуманизированным антителом 4В10 при различных концентрациях, варьирующих от 1 мкг/мл до 25 мкг/мл, и комплементом человека до финальной концентрации 10%. Комплемент без антитела и антитело без комплемента использовали в качестве контроля для определения теневого фенотипа. Спустя три часа инкубации при 37°C, планшеты были центрифугированы в течение 3 минут при 1500 об/мин, и живые клетки, присутствующие в осадке, определяли с использованием анализа CellTiter Glo. Планшеты были считаны на аппарате Envision. ФИГ. 20 отображает живые клетки, присутствующие в анализе (как это измерено с использованием анализа CellTiter Glo). При повышающихся концентрациях гуманизированного и химерного антитела 4В10 отмечается снижение количества живых клеток. Такие результаты позволяют предположить, что гуманизированное антитело обладает такой же самой или лучшей активностью относительно КЗЦ-опосредованной гибели В104 клеток в сравнении с химерным антителом 4В10.
Пример 18: Анализ фармакокинетического профиля химерных и гуманизированных антител к CD52 у CD52-трансгенных мышей (антитела 12G6, 7F11, химерное и гуманизированное антитело 4B10)
Мышам, трансгенным по CD52 человека, вводили Кампат®, 12G6, 7F11 или химерное и гуманизированное антитело 4В10 к CD52 для изучения уровня снижения количества лимфоцитов. Мышам внутривенно вводили одно из указанных антител в объеме 100 мкл и дозе 1 мг/кг. Для анализа ответа на антитела, 100 мкл отобранной посредством пункции крови из ретроорбитального сплетения помещали в пробирки для отделения сыворотки на момент 2 часов, 1, 2, 4, 7 и 10 дней после введения антитела. ИФА использовался для определения уровня циркулирующего IgG1 в каждом образце сыворотки. Основываясь на циркулирующих уровнях антитела, разница между Кампатом®, 7F11 и химерными и гуманизированными формами 4В10 была незначительной или отсутствующей. Антитело 12G6 обладало более низкими значениями Cmax после введения, что указывает на то, что такое антитело может распадаться более быстро. ФИГ. 21 отображает фармакокинетический профиль антител Кампат®, 12G6 (химерное), 7F11 (химерное), 4B10 (химерное) и 4B10 (гуманизированное).
Пример 19: Анализ активности в снижении количества клеток химерных и гуманизированных антител к CD52 у CD52-трансгенных мышей (химерное и гуманизированное антитело 4B10)
Мышам, трансгенным по CD52 человека, вводили Кампат® или химерное или гуманизированное антитело 4В10 CD52 человека для изучения уровня снижения количества лимфоцитов. Мышам внутривенно вводили Кампат® или химерное или гуманизированное антитело 4В10 к CD52 человека в объеме 100 мкл в дозе 0,1 мг/кг. Спустя три дня мыши были умерщвлены, а кровь и селезенка были отобраны для определения уровня снижения количества В- и Т-клеток. Проточная цитометрия использовалась для оценки абсолютного количества общих клеток Т-хелперов, цитотоксических Т-клеток и В-клеток, присутствующих в циркулирующей периферической крови трансгенных мышей huCD52. Такие популяции лимфоцитов были определены по поверхностной экспрессии следующих белковых антигенов: экспрессия CD4 указывает на наличие популяции Т-хелперов, экспрессия CD8 указывает на наличие популяции цитотоксических Т-клеток, и экспрессия CD19 указывает на наличие всех популяций зрелых В-клеток. Сравнение активности снижать количество клеток в селезенке выявило отсутствие разницы в уровне Т-клеток, количество которых было понижено после введения Кампата® или химерных или гуманизированных форм 4В10. По причине использования низкой дозы, в селезенке отмечался только умеренный уровень снижения В-клеток. Для каждого отдельного животного было установлено, что гуманизированное антитело 4В10 обладает хорошей или немного лучшей активностью в опосредовании снижения количества лимфоцитов, чем Кампат®. ФИГ. 22А-22С показывают уровень CD4 T-клеток, CD8 T-клеток и CD19 B-клеток в крови спустя 72 часа после введения дозы химерных и гуманизированных антител.
Пример 20: Относительная эффективность связывания антител к CD52 человека
Значения EC50 выбранных антител к CD52 оценивали с использованием клеток СНО, полученных в ходе рекомбинации для экспрессии CD52. Клетки CHO-CD52 были трипсинизированы в 0,25% трипсина, собраны и промыты ФСБ/5% ФБС. Затем клетки были распределены по круглодонному 96-луночному планшету в количестве 1E5 клеток на лунку. Окрашивание первичным антителом проводилось с 12-кратным серийным разведением (1:2) каждого химерного антитела к CD52, начиная от 50 мкг/мл. Затем использовался конъюгированный с FITC фрагмент антитела козы FAB2 к Fc-гамма человека в концентрации 10 мкг/мл (Jackson 109-096-098). Клетки были промыты 3 раза в сильно охлажденном ФСБ/5% ФБС до и после каждой инкубации. Клетки были фиксированы в ФСБ, содержащем 2% параформальдегид без метанола, и проанализированы с использованием проточной цитометрии. Данные проточной цитометрии были проанализированы с использованием программного обеспечения Graph pad Prizm для определения значения EC50 с 95% доверительным интервалом.
Данные связывания (ФИГ. 23) указывают, что новые антитела к CD52 не только обладают другой специфичностью относительно антигенных детерминант, как указано ранее, но также обладают другими характеристиками связывания, что представлено в таблице ниже. Кампат-1H® и химерные антитела 7F11, 4B10, 2C3 и 12G6 обладали относительно подобными значениями EC50, варьирующими от 0,5 до 2,5 мкг/мл. Химерное антитело 9D9 обладало немного отличающимися характеристиками связывания со значением EC50 примерно от 5 до 7 мкг/мл. Гуманизированное антитело 4В10 обладало подобными характеристиками связывания, что и химерное антитело 4В10, что указывает на то, что гуманизированное антитело сохраняет свои характеристики связывания, присущие химерному антителу 4В10.
|
Пример 21: Гуманизация клона 7F11 антитела к CD52
Гуманизация клона 7F11 антитела к CD52 человека проводилась путем прививания участков CDR из мышиного антитела 7F11 к каркасному участку вариабельного участка антитела человека, как это описано в Примере 14 для гуманизации антитела 4В10. Последовательности CDR-1, CDR-2 и CDR-3 тяжелой цепи и легкой цепи 7F11 были привиты в каркасные участки человека VH3-72 и VK2 A18b, соответственно. Последовательности человека JH6 (WGQGTTVTVSS: SEQ ID NO: 133) и JK2 (FGQGTKLEIK: SEQ ID NO: 134) отбирали в качестве С-терминальных пептидов для гуманизированных тяжелой и легкой цепей, соответственно, для получения последовательностей вариабельного участка гуманизированной тяжелой цепи (7F11-SFD1 и 7F11-SFD2) и гуманизированной легкой цепи (7F11-VK2) для 7F11 (ФИГ. 24). Две последовательности вариабельного участка гуманизированной тяжелой цепи (7F11-SFD1 и 7F11-SFD2) отличаются по одному аминокислотному остатку в участке CDR-3. Версия 7F11-SFD1 содержит треонин в положении 93 (указано в соответствии с системой нумерации по Kabat), в то время как версия 7F11-SFD2 в этом же положении содержит аланин. Положение 93 на ФИГ. 24 подчеркнуто для 7F11-SFD1 и 7F11-SFD2.
ФИГ. 107 отображает аминокислотную последовательность тяжелой цепи полной длины 7F11-SFD1 (SEQ ID NO: 274) и аминокислотную последовательность легкой цепи полной длины 7F11-K2 (SEQ ID NO: 275).
Пример 22: Оценка активности связывания химерных и гуманизированных моноклональных антител 7F11
Химерные и гуманизированные антитела 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2) были получены и очищены с использованием способов, описанных в Примере 3, и проанализированы на предмет их способности связываться с CD52, экспрессируемого на поверхности клеток CHO-CD52 (клетки СНО, полученные способом рекомбинации для экспрессии CD52 человека), в ходе проточной цитометрии. Краткое описание: клетки 2×105 CHO-CD52 были инкубированы с антителом в количестве 10 мкг/мл в ФСБ, содержащем 5% фетальной бычьей сыворотки и 5% сыворотки козы. Связанное антитело определяли с использованием FITC-меченого вторичного антитела козы к человеку, что позволяет определить химерные или гуманизированные антитела к CD52. Меченые клетки были проанализированы с использованием системы FACSCalibur (Becton Dickinson), и данные были проанализированы с использованием программного обеспечения FlowJo, версия 7.2 (Tree Star, Inc, Oregon, USA). Гистограмма на ФИГ. 25 сравнивает уровни CD52, определенные с использованием химерных и гуманизированных антител 7F11. Результаты показывают, что гуманизированное антитело 7F11 связывалось также хорошо или немного лучше, чем химерное антитело 7F11, с клетками, экспрессирующими CD52.
Пример 23: Гуманизация клона 2C3 антитела к CD52
Гуманизация клона 2C3 антитела к CD52 человека проводилась путем прививания участков CDR из мышиного антитела 2C3 к каркасному участку вариабельного участка антитела человека, как это описано в Примере 14 для гуманизации антитела 4В10. Последовательности CDR-1, CDR-2 и CDR-3 тяжелой цепи и легкой цепи 2C3 были привиты в каркасные участки человека VH3-72 и VK2 A18b, соответственно. Последовательности человека JH6 (WGQGTTVTVSS: SEQ ID NO: 133) и JK5 (FGQGTRLEIK: SEQ ID NO: 135) отбирали в качестве С-терминальных пептидов для гуманизированных тяжелой и легкой цепей, соответственно, для получения последовательностей вариабельного участка гуманизированной тяжелой цепи (2C3-SFD1) и легкой цепи (2C3-VK1) для 2C3 (ФИГ. 26А и В). В отличие от гуманизированных клонов 4B10 и 7F11, аффинность связывания для CDR-привитого гуманизированного антитела 2С3 была существенно снижена. Аффинность связывания была восстановлена путем введения обратных мутаций в CDR-привитую структуру с целью ограничения количества обратных мутаций к минимуму для максимального возможного сохранения антитела с восстановленной «человеческой» формой, снизив, таким образом, вероятность иммуногенности. Однократные или множественные обратные мутации были введены в последовательности вариабельных участков гуманизированных тяжелой и легкой цепей. Положения обратных мутаций (в соответствии с системой нумерации по Kabat) указаны в Таблице 10 и Таблице 11 ниже. Антитела, полученные с помощью таких обратных мутаций, были проанализированы на предмет восстановления своей аффинности связывания. Варианты легкой цепи (2C3-VK1(L46R), также обозначаемый как 2C3-VK11; 2C3-VK1(Y36L-L46R), также обозначаемый как 2C3-VK12; и 2C3-VK1(M4I-A19V-Y36L-Q45K-L46R), также обозначаемый как 2C3-VK13) и 5 вариантов тяжелой цепи (2C3-SFD1(L78V), также обозначаемый как 2C3-VH12; 2C3-SFD1(G49A), также обозначаемый как 2C3-VH15; 2C3-SFD1(G49A-L78V), также обозначаемый как 2C3-VH16; 2C3-SFD1(L18M-G49A-L78V), также обозначаемый как 2C3-VH17; и 2C3-SFD1(L18M-G42E-G49A-L78V), также обозначаемый как 2C3-VH19) были получены с использованием стандартных способов молекулярной биологии. Аминокислотные последовательности для последовательности 2C3-SFD1 вариабельного участка CDR-привитой тяжелой цепи и обратные мутанты 2C3-VH12, 2C3-VH15, 2C3-VH16, 2C3-VH17 и 2C3-VH19 приводятся на ФИГ. 26А, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом. Подобным образом, для последовательностей тяжелой цепи: последовательность 2C3-VK1 CDR-привитого вариабельного участка и обратные мутанты 2C3-VK11, 2C3-VK12 и 2C3-VK13 приводятся на ФИГ. 26В, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом.
ФИГ. 106 отображает аминокислотную последовательность тяжелой цепи полной длины 2C3-SFD1 (SEQ ID NO: 272) и аминокислотную последовательность легкой цепи полной длины 2C3-K12 (SEQ ID NO: 273).
|
|
Пример 24: Оценка активности связывания химерных и гуманизированных моноклональных антител 2С3
Химерные и гуманизированные антитела 2С3 были получены и очищены с использованием способов, описанных в Примере 3. Ряд гуманизированных антител, полученных путем соединения вариантов тяжелой цепи с вариантами легкой цепи, и соответствующее химерное антитело были проанализированы проточной цитометрией на предмет своей способности связываться с CD52, экспрессируемым на поверхности клеток СНО-CD52, с использованием способов, описанных в Примере 22. Данные связывания позволяют предположить, что клоны, полученные путем соединения вариантов тяжелой цепи и вариантов легкой цепи 2C3-VK1 или 2C3-VK11, снижали способность связывания, в то время как клоны, полученные путем соединения вариантов тяжелой цепи с 2C3-VK12 или 2C3-VK13, обладали связыванием, эквивалентным или превосходящим показатель связывания химерного антитела 2С3. Репрезентативная гистограмма выбранных клонов (ФИГ. 27А) сравнивает уровни CD52, определенные по химерному и гуманизированным антителам 2С3. Связывание 2C3-SFD1/K1 существенно снижено в сравнении с соответствующим химерным антителом. Введение единственного мышиного остатка в положение 46 (лейцина или аргинина) в легкой цепи (что приводит к образованию 2C3-VK11) не привело к восстановлению способности связывания при соединении с тяжелой цепью 2C3-SFD1 для получения антитела 2C3-SFD1/K11. Кроме того, связывание не было восстановлено в результате введения трех обратных мутаций в тяжелую цепь (что приводит к образованию 2C3-VH17) для получения антитела 2C3-H17/K11. Однако связывание было полностью восстановлено при соединении тяжелой цепи 2C3-SFD1 с 2C3-VK12, включающей две обратные мутации, для получения антитела 2C3-SFD1/K12, что позволяет предположить, что специфические обратные мутации необходимы для восстановления авидности связывания. ФИГ. 27В показывает гистограмму выбранных гуманизированных клонов, демонстрирующих связывание, эквивалентное таковому химерного антитела 2С3. Такие результаты показывают, что обратная мутация двух аминокислотных остатков в легкой цепи 2C3-VK12 была достаточной для полного восстановления авидности антитела. Изменения в остатках 36 (Y в L) и 46 (L в R) были способны восстановить связывание при соединении практически со всеми вариантами тяжелой цепи. Таким образом, гуманизированный клон 2С3, характеризующийся восстановленным связыванием с минимальными остатками каркасного участка, полученными из оригинального мышиного антитела, представлен 2C3-SFD1/K12.
Пример 25: Гуманизация клона 12G6 антитела к CD52
Гуманизация клона 12G6 антитела к CD52 человека проводилась путем прививания участков CDR из мышиного антитела 12G6 к каркасному участку вариабельного участка антитела человека, как это описано в Примере 14 для гуманизации антитела 4В10. Последовательности CDR-1, CDR-2 и CDR-3 тяжелой цепи и легкой цепи 12G6 были привиты в каркасные участки человека VH3-72 и VK2 A18b, соответственно. Последовательности человека JH6 (WGQGTTVTVSS: SEQ ID NO: 133) и JK2 (FGQGTKLEIK: SEQ ID NO: 134) отбирали в качестве С-терминальных пептидов для гуманизированных тяжелой и легкой цепей, соответственно, для получения последовательностей вариабельного участка гуманизированной тяжелой цепи (12G6-SFD1) и легкой цепи (12G6-VK1) для 12G6 (ФИГ. 28А и 28В). Когда вариабельный участок тяжелой цепи 12G6-SFD1 и вариабельный участок легкой цепи 12G6-VK1 были скомбинированы в гуманизированное антитело 12G6-SFD1/K1, аффинность связывания с CD52 была в большей мере восстановлена. Аффинность связывания была восстановлена путем введения обратных мутаций в CDR-привитую структуру. Однократные или множественные обратные мутации были введены в последовательности вариабельных участков гуманизированных тяжелой и легкой цепей. Положения таких обратных мутаций (в соответствии с системой нумерации по Kabat) указаны в Таблице 12 и Таблице 13 ниже. Антитела, полученные с помощью таких обратных мутаций, были проанализированы на предмет восстановления их аффинности связывания. Четыре варианта легкой цепи ((12G6-VK1(Y36V), также указываемый как 12G6-VK10; 12G6-VK1(Y36V-Q45K-L46R), также указываемый как 12G6-VK11; 12G6-VK1(Y36V-L46R), также указываемый как 12G6-VK12; и 12G6-VK1(L46R), также указываемый как 12G6-VK13)) и три варианта тяжелой цепи ((12G6-SFD1(L78V), также указываемый как 12G6-VH10; 12G6-SFD1(G49A), также указываемый как 12G6-VH11; и 12G6-SFD1(G49A-L78V), также указываемый как 12G6-VH12)) были получены с использованием стандартных способов молекулярной биологии. Аминокислотные последовательности для CDR-привитой последовательности вариабельного участка тяжелой цепи 12G6-SFD1 и обратные мутанты 12G6-VH10, 12G6-VH11 и 12G6-VH12 приводятся на ФИГ. 28А, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом. Подобным образом, для последовательностей легкой цепи: последовательность 12G6-VK1 CDR-привитого вариабельного участка и обратные мутанты 12G6-VK10, 12G6-VK11, 12G6-VK12 и 12G6-VK13 приводятся на ФИГ. 28В, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом.
ФИГ. 109 отображает аминокислотную последовательность тяжелой цепи полной длины 12G6-SFD1 (SEQ ID NO: 279) и аминокислотную последовательность легкой цепи полной длины 12G6-K12 (SEQ ID NO: 280).
|
|
Пример 26: Оценка активности связывания химерных и гуманизированных моноклональных антител 12G6
Химерные и гуманизированные антитела 12G6 были получены и очищены с использованием способов, описанных в Примере 3. Ряд гуманизированных антител, полученных путем соединения вариантов тяжелой цепи с вариантами легкой цепи, и соответствующее химерное антитело были проанализированы проточной цитометрией на предмет своей способности связываться с CD52, экспрессируемым на поверхности клеток СНО-CD52, с использованием способов, описанных в Примере 22. Данные связывания позволяют предположить, что клоны, полученные путем соединения вариантов тяжелой цепи и вариантов легкой цепи 12G6-VK1, 12G6-VK10 или 12G6-VK13, снижали способность связывания, в то время как клоны, полученные путем соединения вариантов тяжелой цепи с 12G6-VK11 или 12G6-VK12, обладали связыванием, эквивалентным или превосходящим показатель связывания химерного антитела 12G6. Репрезентативная гистограмма выбранных клонов (ФИГ. 29) сравнивает уровни CD52, определенные по химерному и гуманизированным антителам 12G6. Такие результаты показывают, что обратная мутация двух аминокислотных остатков в вариабельном участке легкой цепи 12G6 (клон 2C3-VK12) была достаточной для полного восстановления специфичности антитела. Изменения в остатках 36 (Y в L) и 46 (L в R) (нумерация по Kabat) были способны восстановить связывание при соединении практически со всеми вариантами тяжелой цепи. Таким образом, гуманизированный клон 12G6, характеризующийся восстановленным связыванием с минимальными остатками каркасного участка, полученными из оригинального мышиного антитела, представлен 12G6-SFD1/K12.
Пример 27: Гуманизация клона 9D9 антитела к CD52
Гуманизация клона 9D9 антитела к CD52 человека проводилась путем прививания участков CDR из мышиного антитела 9D9 к каркасному участку вариабельного участка антитела человека, как это описано в Примере 14 для гуманизации антитела 4В10. Последовательности CDR-1, CDR-2 и CDR-3 тяжелой цепи и легкой цепи 9D9 были привиты в каркасные участки человека VH3-23 и VK2 A18b, соответственно. Последовательности человека JH6 (WGQGTTVTVSS: SEQ ID NO: 133) и JK2 (FGQGTKLEIK: SEQ ID NO: 134) отбирали в качестве С-терминальных пептидов для гуманизированных тяжелой и легкой цепей, соответственно, для получения последовательностей вариабельного участка гуманизированной тяжелой цепи (9D9-VH10) и легкой цепи (9D9-VK2) (ФИГ. 30А и 30В). Когда тяжелая цепь 9D9-VH10 и легкая цепь 9D9-VK2 были соединены в гуманизированное антитело 9D9-H10/K2, аффинность связывания относительно CD52 была существенно снижена. Аффинность связывания была восстановлена путем введения обратных мутаций в CDR-привитую структуру. Однократные или множественные обратные мутации были введены в последовательности вариабельных участков гуманизированных тяжелой и легкой цепей. Положения обратных мутаций (в соответствии с системой нумерации по Kabat) указаны в Таблице 14 и Таблице 15 ниже. Антитела, полученные с помощью таких обратных мутаций, были проанализированы на предмет восстановления их аффинности связывания. Четыре варианта легкой цепи (9D9-VK2(Y36L-Q45K-L46R), также указывается как 9D9-VK12; 9D9-VK2(Y36L-L46R), также указывается как 9D9-VK13; 9D9-VK2(L46R), также указывается как 9D9-VK14; и 9D9-VK2(Q45K-L46R), также указывается как 9D9-VK15) и пять вариантов тяжелой цепи (9D9-VH10(W47L-V48T-S49A-N76S-L78V), также указывается как 9D9-VH11; 9D9-VH10(W47L-V48T-S49A), также указывается как 9D9-VH15; 9D9-VH10(W47L), также указывается как 9D9-VH16; 9D9-VH10(W47L-V48T), также указывается как 9D9-VH17; и 9D9-VH10(W47L-S49A), также указывается как 9D9-VH18) были получены с использованием стандартных способов молекулярной биологии. Аминокислотные последовательности для последовательности 9D9-VH10 вариабельного участка CDR-привитой тяжелой цепи и обратные мутанты 9D9-VH11, 9D9-VH15, 9D9-VH16, 9D9-VH17 и 9D9-VH18 приводятся на ФИГ. 30А, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом. Подобным образом, для последовательностей тяжелой цепи: последовательность 9D9-VK2 CDR-привитого вариабельного участка и обратные мутанты 9D9-VK12, 9D9-VK13, 9D9-VK14 и 9D9-VK15 приводятся на ФИГ. 30В, при этом подвергнутые обратной мутации аминокислоты указаны подчеркнутым шрифтом, а CDR - жирным шрифтом.
ФИГ. 108 отображает аминокислотную последовательности тяжелой цепи полной длины 9D9-H16 (SEQ ID NO: 276) и 9D9-H18 (SEQ ID NO: 277), и аминокислотную последовательность легкой цепи полной длины 9D9-K13 (SEQ ID NO: 278).
|
|
Пример 28: Оценка активности связывания химерных и гуманизированных моноклональных антител 9D9
Химерные и гуманизированные антитела 9D9 были получены и очищены с использованием способов, описанных в Примере 3. Ряд гуманизированных антител, полученных путем соединения вариантов тяжелой цепи с вариантами легкой цепи, и соответствующее химерное антитело были проанализированы проточной цитометрией на предмет своей способности связываться с CD52, экспрессируемым на поверхности клеток СНО-CD52 (клетки СНО были получены рекомбинантным способом для экспрессии CD52 человека), с использованием способов, описанных в Примере 22. Данные связывания позволяют предположить, что клоны, полученные путем соединения вариантов тяжелой цепи с вариантами легкой цепи 9D9-VK2, 9D9-VK14 или 9D9-VK15, обладают пониженной способностью связываться, в то время как клоны, полученные путем соединения вариантов легкой цепи 9D9-VK12 или 9D9-VK13 с вариантами тяжелой цепи с обратной мутацией 9D9-VH11, 9D9-VH15, 9D9-VH16 и 9D9-VH18 обладали показателями связывания, эквивалентными или превышающими таковые соответствующего химерного антитела 9D9. Когда варианты легкой цепи 9D9-VK12 и 9D9-VK13 соединяли с исходной CDR-привитой тяжелой цепью 9D9-VH10 или обратно мутированной последовательностью 9D9-VH17, связывание было значительно снижено, что позволяет предположить, что гуманизированные клоны 9D9 с последовательностями тяжелой и легкой цепей были разработаны с обратными мутациями для восстановления способности связывания. Репрезентативная гистограмма выбранных клонов (ФИГ. 31) сравнивает уровни CD52, определенные по химерному и гуманизированным антителам 9D9. Такие результаты показывают, что обратная мутация двух аминокислотных остатков (например, Y в L в положении 36 и L в R в положении 46) в вариабельном участке легкой цепи 9D9 (клон 9D9-VK13) была необходимой для восстановления специфичности антитела при соединения с тяжелыми цепями, которые были мутированы в одном положении (например, W в L в положении 47) или двух положениях (например, W в L в положении 47 и S в A в положении 49). Таким образом, гуманизированный клон 9D9, характеризующийся восстановленным связыванием с минимальными остатками каркасного участка, полученными из оригинального мышиного антитела, представлен 9D9-H16/K13 и 9D9-H18/K13.
Пример 29: Определение относительной эффективности связывания гуманизированных антител к CD52 человека
Значения EC50 химерных и гуманизированных антител к CD52 были оценены с использованием CD4+ T-клеток, выделенных из МКПК здорового донора, полученных из коммерческих источников (Bioreclamation, NY, USA). CD4+ T-клетки были выделены путем отрицательной селекции с использованием набора EasySep (Stem Cell Technologies). CD4+ T-клетки, выделенные из ткани селезенки трансгенных мышей huCD52 по CD1, также использовали (Stem Cell Technologies) в соответствии со способами, описанными выше в Примере 20 для клеток CHO-CD52. Краткое описание: CD4+ T-клетки человека были выделены из 50 мл периферической крови здоровых добровольцев (Bioreclamation), и CD4+ T-клетки были выделены из ткани селезенки трансгенных мышей huCD52. Клетки были промыты ФСБ/5% ФБС и распределены по 96-луночному круглодонному планшету в количестве 1×105/лунку. Окрашивание первичным антителом проводилось с 8-кратным серийным разведением (1:3) каждого химерного и гуманизированного антитела к CD52, начиная от 100 мкг/мл. Затем использовался конъюгированный с FITC фрагмент антитела козы F(ab')2 к Fc-гамма человека в концентрации 10 мкг/мл (Jackson 109-096-098). Клетки были промыты 3 раза в сильно охлажденном ФСБ/5% ФБС до и после каждой инкубации. Клетки были фиксированы в ФСБ, содержащем 2% параформальдегид без метанола, и проанализированы с использованием проточной цитометрии. Данные проточной цитометрии были проанализированы с использованием программного обеспечения GraphPad Prism для определения значения EC50 с 95% доверительным интервалом. Основываясь на связывании антител к CD52 с CD4+ T-клетками, выделенными из МКПК человека, и CD4+ T-клетками, выделенными из ткани селезенки трансгенных мышей по CD52 человека, были получены кривые связывания (ФИГ. 32А, 32В, 32С), и были рассчитаны значения EC50, представленные на ФИГ. 33. Все антитела обладали подобными характеристиками связывания с CD4+ T-клетками человека и CD4+ T-клетками, изолированными из мышей, трансгенных по CD52 человека. Данные связывания показывают, что гуманизированные антитела обладают эквивалентными или улучшенными показателями аффинности связывания в сравнении с их исходными химерными антителами, что позволяет предположить, что аффинность связывания после гуманизации сохраняется или повышается. Гуманизированные антитела 2C3 и 12G6 обладают, по меньшей мере, в два раза меньшими значениями EC50, чем антитело Кампат-1H®, что было определено в ходе такого анализа связывания клеток.
Пример 30: Оценка связывания гуманизированных антител к CD52 с определенной популяцией лимфоцитов
Кампат-1H® (C1H) и гуманизированные антитела 2C3 (2C3-SFD1/K12), 9D9 (9D9-H16/ K13 и 9D9-H18/K13) и 12G6 (12G6-SFD1/K11, 12G6-SFD1/K12) были подвергнуты анализу на предмет своего связывания с различными подгруппами МКПК, полученных у здоровых доноров, с использованием способов, описанных в Примере 7 для химерных антител к CD52. Для анализа способом проточной цитометрии использовался ряд антител, конъюгированных с флуорохромом. Антитела к CD27-PE, CD19, CD11c-PE Cy5, CD56, CD123-PE Cy7, CD16-APC Cy7 и CD4-APC были получены от BD Biosciences (San Diego, CA), в то время как антитела к CD54RA-ECD и HLA-DR-ECD были получены от Beckman Coulter. Антитела к CD3-Pacific Blue, CD8, CD14-Pacific Orange и CD4-APC cy5.5 были получены от Invitrogen (CA). Все гуманизированные антитела к CD52 человека (9D9-H18/K13, 9D9-H16/K13, 12G6-SFD1/K11, 12G6-SFD1/K12 и 2C3-SFD1/K12), а также Кампат-1H®, были конъюгированы с FITC. Здоровые мононуклеарные клетки периферической крови человека были получены из криоконсервированной лейкоцитарной пленки или из мононуклеарных клеток, сепарированных из крови здоровых доноров, предоставленных коммерческими поставщиками (Bioreclamation, NY, USA), как это описано выше в Примере 7. Для обогащения мононуклеарных клеток, периферическая кровь человека была разведена в соотношении 1:1 стерильным забуференным физиологическим раствором (ФСБ) и осторожно распределена по фиколлу-паку (GE Healthcare Bio-Sciences, Uppsala, Sweden) с последующим центрифугированием в течение 30 минут при комнатной температуре. Межфазный слой мононуклеарных клеток был отобран и промыт в ФСБ, содержащем 5% фетальной бычьей сыворотки (буфер FACS). Примесные красные кровяные клетки (ККК) были лизированы с помощью раствора для лизиса ККК (Sigma, St. Louis, MO, USA). Клетки были ресуспендированы в холодном буфере FACS, и остатки клеток были удалены с использованием фильтра 40 мкм. Многоцветовая проточная цитометрия проводилась для оценки способности связывания гуманизированных антител к CD52 человека (2C3-SFD1/K12), 9D9 (9D9-H16/K13 и 9D9-H18/K13) и 12G6 (12G6-SFD1/K11 и 12G6-SFD1/K12) в сравнении с Кампатом-1H®.
Краткое описание: репликаты 1×106 МКПК в буфере FACS инкубировали с коктейлем предварительно титрованных разведений антител для исследования лимфоцитов или миелоидных клеток. Лимфоцитарный коктейль состоял из антител к CD3, CD27, CD45RA, CD56, CD19, CD8, CD4 и CD16. Коктейль антител для определения миелоидных популяций включал антитела к HLA-DR, CD11c, CD123, CD4 и CD14. В каждом из коктейлей одно из антител к CD52 было включено в концентрации 10 мкг/мл. Клетки окрашивали в течение 30 минут при температуре 4oC и затем промывали и фиксировали в ФСБ, содержащем 1% параформальдегида. 100000 явлений окрашенных клеток были зафиксированы на BD LSR-II (BD Biosciences, San Jose, CA), и данные были проанализированы с использованием программного обеспечения FlowJo, версия 7.2 (Tree Star, Inc, Oregan, USA). Среди В- и Т-лимфоцитов было найдено множество подгрупп с отличительными фенотипическими характеристиками, и было показано, что CD52 экспрессируется на всех лимфоцитах человека. Для идентификации подгрупп лимфоцитов, а также для оценки подобий и различий в характеристиках связывания гуманизированных антител к CD52 с CD52 на поверхности клеток отдельных подгрупп был проведен мультицветовой анализ проточной цитометрии. Путем использования комбинации маркеров, впервые были определены фенотипически различные клеточные популяции, соответствующие В-, Т-, NK- и антиген-представляющих клеточных линий. Интенсивность окрашивания, соответствующая способности гуманизированных антител к CD52 выявлять экспрессию CD52 на каждой из определенных клеточных популяциях, была оценена и сопоставлена с таковыми параметрами Кампата-1H®. Гистограммы (ФИГ. 34) сравнивают уровень CD52, определенного по каждому антителу для отдельных популяций. Результаты показывают, что все гуманизированные антитела к CD52 связываются с CD52 на клеточной поверхности в похожей степени. Кроме того, между Кампатом-1H® и гуманизированными антителами к CD52 не отмечалось каких-либо различий относительно уровня определения CD52 на поверхности клеток. Анализ проводился с участием шести разных доноров. На ФИГ. 34 приводятся репрезентативные данные, полученные с использованием клеток одного донора. Похожая схема связывания наблюдалась и для клеток от других доноров.
Пример 31: Оценка активности АЗКЦ химерных и гуманизированных моноклональных антител 7F11
Гуманизированные и химерные антитела 7F11 были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводился в соответствии с описанием, представленным выше в Примере 6. Краткое описание: клетки СНО К1, полученные путем рекомбинации для экспрессии белка CD52 (CHO-CD52), применяли в качестве клеток-мишеней. Клетки-мишени были мечены Na2 51CrO4 (New England Nuclear, Boston, MA) при 37oC в течение 2-3 часов. Клетки были промыты, ресуспендированы в среде RPMI 1640 с 10% ФТС и смешаны с контрольным антителом IgG, химерным антителом 7F11 или гуманизированным антителом 7F11 (7F11-SFD1/K2 или 7F11-SFD2/K2) при различных концентрациях, варьирующих от 5 мкг/мл до 0,01 мкг/мл. NK-клетки человека, выделенные из МКПК с использованием набора для изоляции NK-клеток (Stem Cell Technologies), применяли в качестве эффекторных клеток, и такие клетки были добавлены в соотношении 1:5 (клетка-мишень:эффекторная клетка). После инкубации в течение 2-6 часов, 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(c.p.m.образца - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100. ФИГ. 35 иллюстрирует концентрации контрольного IgG, химерного антитела 7F11 и гуманизированного антитела 7F11, используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что гуманизированные антитела 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2) опосредуют эквивалентную или немного лучшую активность АЗКЦ в сравнении с химерным антителом 7F11. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 32: Оценка активности КЗЦ химерных и гуманизированных моноклональных антител 7F11
Гуманизированные и химерные антитела 7F11 были проанализированы на предмет своей способности опосредовать комплементзависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52. Анализ КЗЦ проводили с использованием способов, описанных в Примере 5 для химерных антител к CD52. Краткое описание: клетки СНО К1, полученные путем рекомбинации для экспрессии белка CD52 (CHO-CD52), использовали в качестве клеток-мишеней, и такие клетки были мечены Na2 51CrO4 (New England Nuclear, Boston, MA) при 37°C в течение 2-3 часов. Клетки были промыты, ресуспендированы в среде RPMI 1640 и смешаны с контрольным антителом IgG, химерным антителом 7F11 или гуманизированным антителом 7F11 (7F11-SFD1/K2 или 7F11-SFD2/K2) при различных концентрациях, варьирующих от 20 мкг/мл до 500 нг/мл. В экспериментальные лунки был добавлен комплемент человека (Sigma) до финальной концентрации 10%. После инкубации в течение 1-5 часов, 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(число импульсов в минуту для образца (c.p.m.) - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100. ФИГ. 36 иллюстрирует концентрации контрольного IgG, химерного антитела 7F11 и гуманизированных антител 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что химерное антитело 7F11 и гуманизированное антитело 7F11-SFD1/K2 опосредовали эквивалентную гибель, в то время как гуманизированное антитело 7F11-SFD2/K2 опосредовало значительную лучшую активность КЗЦ в сравнении с химерным антителом 7F11. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 33: Оценка активности АЗКЦ химерных и гуманизированных моноклональных антител 2С3
Гуманизированные и химерные антитела 2С3 были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводился в соответствии с описанием, представленным выше в Примере 6, с небольшими модификациями. Краткое описание: Т-клетки, выделенные из МКПК здорового донора с использованием набора для изоляции CD4+ T-клеток (Stem Cell Technologies), применяли в качестве клеток-мишеней. Клетки-мишени были мечены в течение ночи Na2 51CrO4 (New England Nuclear, Boston, MA) при 37oC. Клетки были промыты, ресуспендированы в среде RPMI 1640 с 10% ФТС и смешаны с контрольным антителом IgG, химерным антителом 2С3 или гуманизированным антителом 2С3 (2C3-SFD1/K12) при различных концентрациях, варьирующих от 10 мкг/мл до 100 пг/мл. NK-клетки человека, выделенные из МКПК с использованием набора для изоляции NK-клеток (Stem Cell Technologies), применяли в качестве эффекторных клеток, и такие клетки были добавлены в соотношении 1:5 (клетка-мишень:эффекторная клетка). После инкубации в течение 2-6 часов, 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(c.p.m.образца - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100. ФИГ. 37 иллюстрирует концентрации контрольного IgG, химерного антитела 2С3 и гуманизированного антитела 2С3 (2C3-SFD1/K12), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что гуманизированное антитело 2C3-SFD1/K12 опосредовало активность АЗКЦ, эквивалентную таковой активности химерного антитела 2С3. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 34: Оценка активности КЗЦ химерных и гуманизированных моноклональных антител 2С3
Гуманизированные и химерные антитела 2С3 были проанализированы на предмет своей способности опосредовать комплементзависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52. Анализ КЗЦ проводился в соответствии с описанием, представленным выше в Примере 5, с небольшими модификациями. Краткое описание: Т-клетки, выделенные из МКПК здорового донора, использовали в качестве клеток-мишеней, которые были мечены в течение ночи Na2 51CrO4 (New England Nuclear, Boston, MA) при 37oC. После мечения в течение ночи, клетки были промыты, ресуспендированы в среде RPMI 1640 с 10% ФТС и смешаны с контрольным антителом IgG, химерным антителом 2С3 или гуманизированным антителом 2С3 (2C3-SFD1/K12) при различных концентрациях, варьирующих от 10 мкг/мл до 10 нг/мл. В экспериментальные лунки был добавлен комплемент человека (Sigma) до финальной концентрации 10%. После инкубации в течение 1-5 часов, 25 мкл не содержащего клеток супернатанта было собрано из каждой лунки и подвергнуто анализу в сцинтилляторе MICROBETA TRILUX (Wallac, Gaithersburg, MD). Количество спонтанно выпущенного 51Cr было получено путем инкубации клеток-мишеней в среде. Спонтанное высвобождение из клеток-мишеней обычно было менее чем 20%. Общее количество поглощенного 51Cr определяли путем добавления 1% Тритона Х-100 в дистиллированной воде, и процентный показатель лизиса был рассчитан следующим образом: [(число импульсов в минуту для образца (c.p.m.) - спонтанное c.p.m.)/(общее c.p.m. - спонтанное c.p.m.)]×100. ФИГ. 38 иллюстрирует концентрации контрольного IgG, химерного антитела 2С3 и гуманизированного антитела 2С3 (2C3-SFD1/K12), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что химерное антитело 2С3 и гуманизированное антитело 2С3 (2C3-SFD1/K12) опосредовали лизис в эквивалентной степени. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 35: Оценка активности АЗКЦ химерных и гуманизированных моноклональных антител 12G6
Гуманизированные и химерные антитела 12G6 были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 31. ФИГ. 39 иллюстрирует концентрации контрольного IgG, химерного антитела 12G6 и гуманизированных антител 12G6 (12G6-SFD1/K11 или 12G6-SFD1/K12), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что гуманизированные антитела 12G6-SFD1/K11 и 12G6-SFD1/K12 опосредовали эквивалентную активность АЗКЦ в сравнении с химерным антителом 12G6. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 36: Оценка активности КЗЦ химерных и гуманизированных моноклональных антител 12G6
Гуманизированные и химерные антитела 12G6 были проанализированы на предмет своей способности опосредовать комплемент-зависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52. Анализ КЗЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 32. ФИГ. 40 иллюстрирует концентрации контрольного IgG, химерного антитела 12G6 и гуманизированных антител 12G6 (12G6-SFD1/K11 и 12G6-SFD1/K12), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что химерное антитело 12G6 опосредует эквивалентный лизис в сравнении с гуманизированными антителами 12G6 (12G6-SFD1/K11 и 12G6-SFD1/K12). Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 37: Оценка активности АЗКЦ химерных и гуманизированных моноклональных антител 9D9
Гуманизированные и химерные антитела 9D9 были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 31. ФИГ. 41 иллюстрирует концентрации контрольного IgG, химерного антитела 9D9 и гуманизированных антител 9D9 (9D9-H10/K13, 9D9-H11/K13, 9D9-H16/K13 и 9D9-H18/K13), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что химерные и гуманизированные антитела 9D9 (за исключением 9D9-H10/K13) опосредовали эквивалентную АЗКЦ активность. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 38: Оценка активности КЗЦ химерных и гуманизированных моноклональных антител 9D9
Гуманизированные и химерные антитела 9D9 были проанализированы на предмет своей способности опосредовать комплемент-зависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52. Анализ КЗЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 32. ФИГ. 42 иллюстрирует концентрации контрольного IgG, химерного антитела 9D9 и гуманизированных антител 9D9 (9D9-H10/K13, 9D9-H11/K13, 9D9-H16/K13 и 9D9-H18/K13), используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что химерное антитело 9D9 опосредует эквивалентный лизис в сравнении с гуманизированными антителами 9D9 (за исключением 9D9-H10/K13). Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 39: Оценка активности АЗКЦ Кампата-1H® и гуманизированных антител к CD52 на первичных Т-клетках
Кампат-1H® и гуманизированные антитела были проанализированы на предмет своей способности опосредовать гибель клеток, экспрессирующих CD52, посредством АЗКЦ. Анализ АЗКЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 31. ФИГ. 43 иллюстрирует концентрации контрольного IgG, Кампата-1H® и гуманизированных антител 2C3-SFD1/K12, 9D9-H16/K13, 9D9-H18/K13, 12G6-SFD1/K11 и 12G6-SFD1/K12, используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что указанные выше гуманизированные антитела 2C3, 9D9 и 12G6 опосредовали гибель, вызванную АЗКЦ, эквивалентную таковой гибели, опосредуемой Кампатом-1H®, в концентрациях более 10 нг/мл. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 40: Оценка активности КЗЦ Кампата-1H® и гуманизированных антител к CD52 на первичных Т-клетках
Кампат-1H® и гуманизированные антитела были проанализированы на предмет своей способности опосредовать комплементзависимую цитотоксичность (КЗЦ) клеток, экспрессирующих CD52. Анализ КЗЦ проводили с использованием анализа высвобождения хрома и Т-клеток, выделенных из МКПК здорового донора и применяемых в качестве клеток-мишеней, как это описано выше в Примере 32. ФИГ. 44 иллюстрирует концентрации контрольного IgG, Кампата-1H® и гуманизированных антител 2C3-SFD1/K12, 9D9-H16/K13, 9D9-H18/K13, 12G6-SFD1/K11 и 12G6-SFD1/K12, используемых в анализе (ось Х), в сравнении с % специфического лизиса (ось Y). Результаты показывают, что гуманизированные антитела 2C3 и 12G6 опосредовали гибель, вызванную КЗЦ, эквивалентную Кампату-1H®, в то время как гуманизированные антитела 9D9 обладали значительно пониженной активностью КЗЦ, подобно активности их химерных антител. Контрольный изотип IgG1 характеризовался только низкими уровнями фоновой гибели при исследуемых концентрациях.
Пример 41: Оценка нейтрализующей способности сывороточных образцов, содержащих нейтрализующие антитела к Кампату-1H®, для блокирования активности гуманизированных антител 2C3, 12G6 и 9D9 к CD52
Для оценки способности гуманизированных антител связываться с клетками, экспрессирующими CD52, в присутствии нейтрализующих антител к Кампату-1H®, антитела к CD52 (Кампат-1H®, 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12) реагировали с образцами сыворотки человека, содержащими антитела к Кампату-1H®, вслед за чем оценивалось связывание антитела к CD52 с клетками Раджи, экспрессирующими CD52. В анализе использовали образцы сыворотки, полученные у пациентов, страдающих возвратно-ремитирующим рассеянным склерозом и участвующих в исследовании CAMMS223 (The CAMMS223 Trial Investigators, “Alemtuzumab vs. interferon Beta-1a in early multiple sclerosis,” N Engl J Med 359:1786-1801 (2008)). Повторное введение антитела Кампат-1H® приводило к возникновению ответа в виде образования антител к Кампату-1H® у большинства пациентов. На 12 месяце титр антитела к Кампату-1H у большинства пациентов очень низкий и существенно повышается после введения второго цикла Кампата-1H®, приводя к образованию высокого титра антитела к Кампату-1H® в сыворотке на 13 месяце. Анализы нейтрализации антитела к CD52 проводили с использованием сывороточных образцов на месяце 12 и месяце 13, полученных у разных пациентов с РС (MS-1 до MS-5), которые были подвергнуты лечению Кампатом-1H® по протоколу CAMMS223. Конъюгированные с FITC антитела к CD52 (Кампат-1H®, 2C3-SFD1/K12, 12G6-SFD1/K12 и 9D9-H16/K13 (применяли в Примере 30, где было показано связывание с клетками, экспрессирующими CD52)) использовали для окрашивания клеток Раджи, экспрессирующих CD52, в присутствии или отсутствии серий разведений сыворотки, полученной у пациентов, подвергнутых лечению Кампатом-1Н. Краткое описание: образцы сыворотки пациента с РС (месяц 12 и месяц 13) были приготовлены в 6-кратных серийных разведениях и инкубировали с 10 мкг/мл антител к CD52, конъюгированных с FITC (Кампат-1H®, 2C3-SFD1/K12, 12G6-SFD1/K12 и 9D9-H16/K13) в течение 1 часа при 37 oC. Клетки Раджи были промыты окрашивающим буфером, содержащим сбалансированный солевой раствор Хенкса, 5% ФБС и 0,1% азида, и затем распределены по 96-луночному круглодонному планшету в количестве 1×105 клеток/лунка. Клетки были блокированы 10 мкг/мл Fc фрагмента IgG человека в течение 30 минут на льду в окрашивающем буфере. Затем клетки были промыты окрашивающим буфером и ресуспендированы в 100 мкл смеси антитело-сыворотка, как это описано выше. Спустя 30 минут пребывания на льду, клетки были промыты и фиксированы с использованием BD Cytofix, и клетки, к которым было присоединено меченное FITC антитело, были проанализированы с использованием системы FACSCalibur (Becton Dickinson), после чего данные были проанализированы с использованием программного обеспечения FlowJo, версия 7.2 (Tree Star, Inc, Oregon, USA). Связывание конъюгированных с FITC антител к CD52 в присутствии нейтрализующих антител к Кампату-1H® в сыворотке было проанализировано способом проточной цитометрии, и % связывания относительно контроля как мера ингибирования был рассчитан как (среднекратный прирост с сывороткой/среднекратный прирост контроля (без сыворотки))×100. Репрезентативные данные для одного из доноров (MS-1) представлены на ФИГ. 45. Ось Х обозначает фактор разведения сыворотки, и ось Y обозначает % контрольного связывания как меру нейтрализующей активности антитела. Данные четко показывают, что образцы сыворотки на месяц 12 не обладают каким-либо ингибирующим эффектом на Кампат-1H® или другие антитела к CD52, что указывает на небольшое количество или отсутствие блокирующих антител к Кампату-1H® в сыворотке. Образцы сыворотки на месяц 13 опосредовали полное ингибирование связывания Кампата-1H® даже при разведении сыворотки 1:1000, но не опосредовали ингибирование гуманизированных антител к CD52 2C3, 12G6 и 9D9 даже при более высокой исследуемой концентрации (разведение 1:24). У двух из пяти пациентов титры нейтрализующих антител к Кампату-1H® составили >1:1000, в то время как у трех остальных пациентов титры нейтрализующих антител к Кампату-1H® составили примерно 1:100. Даже несмотря на то, что сыворотка двух пациентов (месяц 13) содержала относительно высокие титры нейтрализующего антитела (>1:1000) к Кампату-1H®, такая сыворотка не ингибировала связывание гуманизированных антител 2C3-SFD1/K12, 12G6-SFD1/K12 и 9D9-H16 /K13, указывая на то, что реактивность антитела к Кампату-1H® у пациентов, подвергнутых лечению Кампатом-1H®, не блокировала связывания таких гуманизированных антител к CD52, присутствующим на поверхности клетки.
Пример 42: Анализ снижения количества и репопуляции антител к CD52 у трансгенных мышей huCD52 (4B10-H1/K1)
Активность Кампата-1H® и гуманизированных антител к CD52 (4B10-H1/K1) снижать количество клеток при разных уровнях доз исследовали на трансгенных мышах huCD52. Мышам внутривенно вводили 0,1, 0,5, 1,0 или 5,0 мг/кг каждого антитела. Спустя два часа после введения дозы была отобрана сыворотка для исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Подгруппа мышей (N=5) была оставлена в живых для мониторинга репопуляционной кинетики. Снижения количества клеток было наибольшим в компартменте Т-клеток, при этом наибольшим образом было снижено количество CD4+ T-клеток, затем CD8+ T-клеток, B-клеток, NK-клеток и других миелоидных клеток. В компартменте CD4+ T-клеток количество нативных CD4+ T-клеток было снижено наибольшим образом, затем центральных CD4+ Т-клеток памяти (CM), эффекторных CD4+ Т-клеток памяти (EM) и регуляторных CD4+ Т-клеток (Treg). Похожая схема отмечалась для CD8+ T-клеток (нативные>CM>EM). И наоборот, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. Сравнение мышей, подвергнутых лечению Кампатом-1H®, с мышами, подвергнутыми лечению 4B10-H1/K1, выявило подобие количества клеток в крови и селезенке для каждой исследуемой дозы.
Анализ цитокинов сыворотки выявил дозозависимое увеличение для ФНО-α, ИЛ-6 и MCP-1. Циркулирующий уровень таких цитокинов оставался повышенным в сравнении с не подвергнутыми лечению мышами при использовании доз 0,5 мг/кг и 0,1 мг/кг. Небольшое повышение также отмечалось для ИЛ-10 в группе лечения Кампатом-1H® с использованием трех наивысших доз, и только для наивысшей дозы в группе лечения гуманизированным антителом 4B10-H1/K1. Каких-либо существенных повышений уровня циркулирующих ИЛ-12 или ИФН-g (не показано) не было отмечено.
К 50-60 дням после введения дозы, за исключением группы введения дозы 1,0 мг/кг, уровень лимфоцитов во всех группах доз с лечением Кампатом-1H® повысился до уровня не подвергнутых лечению мышей. В группе введения дозы 1,0 мг/кг уровень лимфоцитов вернулся к нормальному значению на 80 день после введения дозы. Похожая репопуляционная кинетика отмечалась также для мышей, подвергнутых лечению гуманизированным антителом 4B10-H1/K1. Уровень лимфоцитов повысился до значения уровня контроля к 50 дню после введения дозы у всех групп, подвергнутых лечению 4B10-H1/K1, за исключением группы введения 0,5 мг/кг. Уровни циркулирующих лимфоцитов в группе введения дозы 0,5 мг/кг оставались сниженными в ходе всего периода мониторинга. Проводился мониторинг репопуляции общего количества лимфоцитов в крови.
ФИГ. 46А-46Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»). ФИГ. 47А-47Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»). ФИГ. 48А-48Е отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»). ФИГ. 49А-49В отображают репопуляцию циркулирующих лимфоцитов с течением времени после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 4B10-H1/K1 («4B10»).
Пример 43: Анализ снижения количества и репопуляции антител к CD52 у трансгенных мышей huCD52 (7F11-SFD1/K2 и 7F11-SFD2/K2)
Активность гуманизированных антител (7F11-SFD1/K2 и 7F11-SFD2/K2) при разных уровнях доз снижать количество клеток исследовали с использованием трансгенных мышей huCD52. Мышам внутривенно вводили 0,1, 0,5, 1,0 или 5,0 мг/кг каждого антитела. Спустя два часа после введения дозы была отобрана сыворотка для исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Подгруппа мышей (N=5) была оставлена в живых для мониторинга репопуляционной кинетики. Введение каждого гуманизированного антитела 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2) во всех дозах приводило к снижению значительного количества Т-клеток и В-клеток в крови. Такие данные также показывают, что количество Т- и В-клеток из разных субпопуляций было снижено в разной степени, в зависимости от дозы используемого антитела. Количество нативных Т-клеток (CD4 и CD8) было снижено наибольшим образом в сравнении с популяциями других клеток (включая клетки памяти и клетки Treg), количество которых было снижено в меньшей степени. В компартменте В-клеток, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. В селезенке отмечалось дозозависимое снижение количества клеток, при этом существенное снижение количества лимфоцитов отмечалось при уровнях доз 5 мг/кг и 1 мг/кг. Подобно образцам крови, количество нативных Т-клеток было снижено в большей степени, чем клеток памяти. При использовании каждого гуманизированного клона 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2), количество В-клеток было снижено в меньшей степени, чем количество Т-клеток. Снижение количества не отмечалось для NK-клеток или нейтрофилов в крови или селезенке при любых вводимых дозах. Анализ цитокинов сыворотки выявил дозозависимое увеличение для ФНО-α и ИЛ-6. Уровень таких цитокинов оставался повышенным в сравнении с не подвергнутыми лечению мышами при использовании доз 0,5 мг/кг и 0,1 мг/кг. Также отмечалось дозозависимое повышение уровня циркулирующего MCP-1.
На 30 день после введения дозы уровни лимфоцитов в группах приема доз 0,5 мг/кг и 0,1 мг/кг повысились до уровней не подвергнутых лечению мышей. В группах введения доз 1,0 мг/кг и 5,0 мг/кг уровни лимфоцитов вернулись к уровню нормы на 50 и 80 дни, соответственно, при использовании клона 7F11-SFD1/K2, на 80 день для групп ведения доз 1,0 мг/кг и 5,0 мг/кг при использовании клона 7F11-SFD2/K2. Проводился мониторинг репопуляции общего количества лимфоцитов в крови.
ФИГ. 50А-50Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»). ФИГ. 51А-51Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»). ФИГ. 52A-52F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»). ФИГ. 53A-53В отображают репопуляцию циркулирующих лимфоцитов с течением времени после введения дозы гуманизированных антител 7F11-SFD1/K2 («7F11 SFD1») и 7F11-SFD2/K2 («7F11 SFD2»).
Пример 44: Анализ гуманизированных антител 7F11 к CD52 у трансгенных мышей (7F11-SFD1/K2 и 7F11-SFD2/K2)
Активность химерных антител 7F11 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2 в снижении количества клеток в сравнении с Кампатом-1H® изучалась на трансгенных мышах huCD52. Мышам внутривенно вводили 1,0 мг/кг каждого антитела. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Введение Кампата-1H® приводило к значительному снижению количества В- и Т-клеток в крови и селезенке. Несмотря на то, что в крови отмечалось существенное снижение уровня Т-клеток при использовании химерных и гуманизированных антител (7F11-SFD1/K2 и 7F11-SFD2/K2), количество B-клеток было снижено в меньшей степени. Такое наблюдение также было очевидно в селезенке, где отмечалось значительное снижение количества Т-клеток, однако умеренное снижение количества В-клеток отмечалось только для антител 7F11 (7F11-SFD1/K2 и 7F11-SFD2/K2).
ФИГ. 54A-54B отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат»), химерных антител 7F11 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2.
Пример 45: Анализ ФК профилей антител к CD52 у трансгенных мышей CD52 (7F11-SFD1/K2 и 7F11-SFD2/K2)
Для обеспечения того, что процесс гуманизации не приводит к изменению в скорости клиренса антитела, фармакокинетический профиль химерного антитела 7F11 к CD52 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2 к CD52 был определен с использованием трансгенных мышей huCD52. Мышам внутривенно вводили антитела в дозе 5 мг/кг, и в разных временных точках, начиная спустя два часа после введения дозы, была собрана кровь. Циркулирующие уровни каждого антитела были оценены с использованием ИФА антитела к IgG. Для каждого гуманизированного клона отмечалась незначительная разница в значении Cmax, отмечаемая спустя 2 часа после введения дозы. Скорость клиренса для химерного антитела 7F11 и гуманизированного антитела 7F11-SFD1/K2 and 7F11-SFD2/K2 была подобна таковой скорости Кампата-1H® в течение всего эксперимента, указывая на то, что процесс гуманизации не существенно изменяет фармакокинетический профиль антител.
ФИГ. 55 представляет уровень антитела Кампат-1H® («Кампат»), химерного антитела 7F11 и гуманизированных антител 7F11-SFD1/K2 и 7F11-SFD2/K2 в крови с течением времени после введения дозы.
Пример 46: Анализ снижения количества и репопуляции антител к CD52 у трансгенных мышей huCD52 (2C3-SFD1/K12)
Активность клона 2C3-SFD1/K12 в снижении количества клеток при разных уровнях доз исследовалась у трансгенных мышей huCD52. Мышам внутривенно вводили 0,1, 0,5, 1,0 или 5,0 мг/кг антитела. Спустя два часа после введения дозы была отобрана сыворотка для потенциального исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Подгруппа мышей (N=5) была оставлена в живых для мониторинга репопуляционной кинетики. Введение 2C3-SFD1/K12 в дозах 5 мг/кг, 1 мг/кг и 0,5 мг/кг приводило к значительному снижению количества Т- и В-клеток в крови. Варьирующий уровень снижения количества лимфоцитов отмечался в крови при дозе 0,1 мг/кг, при этом количество CD4+ T-клеток и В-клеток было снижено в большей степени, чем CD8+ T-клеток. Такие данные также показывают, что количество Т- и В-клеток из разных субпопуляций было снижено в разной степени, в зависимости от дозы используемого антитела. Количество нативных Т-клеток (CD4 и CD8) было снижено наибольшим образом в сравнении с популяциями других клеток (включая клетки памяти и клетки Treg), количество которых было снижено в меньшей степени. В компартменте В-клеток, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. В селезенке отмечалось дозозависимое снижение количества клеток, при этом существенное снижение количества лимфоцитов отмечалось при уровнях доз 5 мг/кг и 1 мг/кг. Подобно Кампату-1H®, количество нативных Т-клеток было снижено в большей степени, чем клеток памяти. Снижение количества отмечалось для NK-клеток и нейтрофилов в крови, однако в селезенке при любой введенной дозе снижение количества было небольшим или отсутствовало. Анализ цитокинов сыворотки показал дозозависимое повышение ФНО-α и ИЛ-6 при дозе 5 мг/кг, что индуцировало наивысший уровень каждого цитокина. Уровни, сопоставимые с не подвергнутыми лечению мышами, отмечались при уровнях доз 0,5 мг/кг и 0,1 мг/кг для ФНО-α и 0,1 мг/кг для ИЛ-6. Также отмечалось дозозависимое повышение уровня циркулирующего MCP-1.
На 30 день после введения дозы уровни лимфоцитов в группах приема доз 0,1 мг/кг и 0,5 мг/кг повысились до уровней не подвергнутых лечению мышей. В группах введения дозы 1,0 мг/кг и 5,0 мг/кг уровень лимфоцитов вернулся к нормальному значению на 80 день после введения дозы. Проводился мониторинг репопуляции общего количества лимфоцитов в крови.
ФИГ. 56А-56Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антител 2C3-SFD1/K12. ФИГ. 57А-57Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в селезенке спустя 72 часа после введения дозы антител 2C3-SFD1/K12. ФИГ. 58A-58F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 2C3-SFD1/K12. ФИГ. 59 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 2C3-SFD1/K12.
Пример 47: Анализ снижения количества и репопуляции антител к CD52 у трансгенных мышей huCD52 (12G6-SFD1/K11)
Активность клона 12G6-SFD1/K11 в снижении количества клеток при разных уровнях доз исследовалась у трансгенных мышей huCD52. Мышам внутривенно вводили 0,1, 0,5, 1,0 или 5,0 мг/кг антитела. Спустя два часа после введения дозы была отобрана сыворотка для потенциального исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Подгруппа мышей (N=5) была оставлена в живых для мониторинга репопуляционной кинетики. Введение 12G6-SFD1/K11 в дозах 5 мг/кг, 1 мг/кг и 0,5 мг/кг приводило к значительному снижению количества Т- и В-клеток в крови. Варьирующий уровень снижения количества лимфоцитов отмечался в крови при дозе 0,1 мг/кг, при этом количество CD4+ T-клеток и В-клеток было снижено в большей степени, чем CD8+ T-клеток. Такие данные также показывают, что количество Т- и В-клеток из разных субпопуляций было снижено в разной степени, в зависимости от дозы используемого антитела. Количество нативных Т-клеток (CD4 и CD8) было снижено наибольшим образом в сравнении с популяциями других клеток (включая клетки памяти и клетки Treg), количество которых было снижено в меньшей степени. В компартменте В-клеток, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. В селезенке отмечалось дозозависимое снижение количества клеток, при этом существенное снижение количества лимфоцитов отмечалось при уровнях доз 5 мг/кг и 1 мг/кг. Подобно Кампату-1H®, количество нативных Т-клеток было снижено в большей степени, чем клеток памяти. Снижение количества отмечалось для NK-клеток и нейтрофилов в крови, однако в селезенке при любой введенной дозе снижение количества было небольшим или отсутствовало. Анализ цитокинов сыворотки показал дозозависимое повышение ФНО-α и ИЛ-6 при дозе 5 мг/кг, что индуцировало наивысший уровень каждого цитокина. Уровни, сопоставимые с не подвергнутыми лечению мышами, отмечались при уровнях доз 0,5 мг/кг и 0,1 мг/кг для ФНО-α и 0,1 мг/кг для ИЛ-6. Также отмечалось дозозависимое повышение уровня циркулирующего MCP-1.
К 30 дню после введения дозы уровень лимфоцитов повысился до уровней не подвергнутых лечению мышей. В группах введения дозы 1,0 мг/кг и 5,0 мг/кг уровень лимфоцитов вернулся к нормальному значению на 80 день после введения дозы. Проводился мониторинг репопуляции общего количества лимфоцитов в крови.
ФИГ. 60А-60Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K11. ФИГ. 61А-61Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в селезенке спустя 72 часа после введения дозы антител 12G6-SFD1/K11. ФИГ. 62A-62F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 12G6-SFD1/K11 («12G6 hu»). ФИГ. 63 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 12G6-SFD1/K11.
Пример 48: Анализ ФК профилей антител к CD52 у трансгенных мышей CD52 (2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12)
Фармакокинетические профили антител к CD52 были определены у трансгенных мышей huCD52. Данный эксперимент сравнивал гуманизированные и химерные формы антител для обеспечения того, что процесс гуманизации не изменяет скорость клиренса антител. Сравнение включало химерные антитела 2C3, 12G6 и 9D9 и гуманизированные антитела 2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12. Мышам внутривенно вводили антитела в дозе 5 мг/кг, и в разных временных точках, начиная спустя два часа после введения дозы, была собрана кровь. Циркулирующие уровни каждого антитела были оценены с использованием ИФА антитела к IgG. Для каждых проанализированных пар химерного/гуманизированного антител отмечалась незначительная разница в значении Cmax, отмечаемая спустя 2 часа после введения дозы. Для антител 2C3 и 12G6 значение Cmax гуманизированной версии (т.е. 2C3-SFD1/K12 и 12G6-SFD1/K11) было незначительно выше, в то время как значение Cmax для пары 9D9 было немного выше. Скорость клиренса пар антител была похожей в течение всего хода эксперимента, указывая на то, что процесс гуманизации не существенно изменяет фармакокинетический профиль антител.
ФИГ. 64A-64C отображают уровень химерных антител 2C3, 2C3-SFD1/K12, 12G6, 12G6-SFD1/K11, 9D9 и 9D9-H10/K12 в крови с течением времени после введения дозы.
Пример 49: Анализ снижения количества и репопуляции антител к CD52 у трансгенных мышей huCD52 (9D9-H10/K12)
Активность клона 9D9-H10/K12 в снижении количества клеток при разных уровнях доз исследовалась у трансгенных мышей huCD52. Мышам внутривенно вводили 0,1, 0,5, 1,0 или 5,0 мг/кг антитела. Спустя два часа после введения дозы была отобрана сыворотка для потенциального исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши (N=5) для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Подгруппа мышей (N=5) была оставлена в живых для мониторинга репопуляционной кинетики. Введение 9D9-H10/K12 в дозах 5 мг/кг, 1 мг/кг и 0,5 мг/кг приводило к значительному снижению количества Т- и В-клеток в крови. Только при дозе 0,1 мг/кг отмечалось снижение количества лимфоцитов в крови. Такие данные также показывают, что количество Т- и В-клеток из разных субпопуляций было снижено в разной степени, в зависимости от дозы используемого антитела. Количество нативных Т-клеток (CD4 и CD8) было снижено наибольшим образом в сравнении с популяциями других клеток (включая клетки памяти и клетки Treg), количество которых было снижено в меньшей степени. В компартменте В-клеток, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. В селезенке значительное снижение таких клеток отмечалось только при дозах 5 мг/кг и 1 мг/кг. Подобно Кампату-1H®, количество нативных Т-клеток было снижено в большей степени, чем клеток памяти. Снижение количества отмечалось для NK-клеток и нейтрофилов в крови, однако в селезенке при любой введенной дозе снижение количества было небольшим или отсутствовало. Анализ цитокинов сыворотки не выявил какого-либо существенного повышения ФНО-α или ИЛ-6 при любом уровне проанализированных доз. Также отмечалось дозозависимое повышение уровня циркулирующего MCP-1.
Репопуляция по данному эксперименту была прекращена преждевременно, когда 50-80% лимфоцитов были репопуляризированы (в зависимости от дозы). Репопуляция лимфоцитов отслеживалась на основе общего числа лимфоцитов, а не на основе Т- и В-клеток.
ФИГ. 65А-65Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в крови спустя 72 часа после введения дозы антител 9D9-H10/K12 («9D9»). ФИГ. 66А-66Е отображают уровень CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток в селезенке спустя 72 часа после введения дозы антител 9D9-H10/K12 («9D9»). ФИГ. 67A-67F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 9D9-H10/K12 («9D9»). ФИГ. 68 отображает репопуляцию циркулирующих лимфоцитов с течением времени после введения антител 9D9-H10/K12 («9D9»).
Пример 50: Анализ снижения количества клеток и репопуляции антител к CD52 у трансгенных мышей huCD52 (2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12)
Активность Кампата-1H® и гуманизированных клонов 2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12 при разных уровнях доз в снижении количества клеток исследовалась с использованием трансгенных мышей huCD52. Мышам внутривенно вводили 0,1 или 1,0 мг/кг антитела. Спустя два часа после введения дозы была отобрана сыворотка для потенциального исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Все гуманизированные антитела (2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12) опосредовали снижение количества лимфоцитов в селезенке и крови при сравнении с животными, подвергнутыми лечению ФСБ. Снижение количества было более робастным в крови, чем в селезенке, для всех антител, и такое снижение количества было дозозависимым в обеих тканях. Снижение количества было более заметным в CD4 и CD8+ T-клетках, и менее заметным - в компартменте В-клеток. Снижение количества различных В- и Т-субпопуляций отмечалось в разной степени. Количество нативных Т-клеток (CD4 и CD8) было снижено наибольшим образом в сравнении с популяциями других клеток (включая клетки памяти и клетки Treg), количество которых было снижено в меньшей степени. В компартменте В-клеток, количество зрелых В-клеток было снижено в большей степени, чем количество незрелых В-клеток. Анализ цитокинов сыворотки выявил существенное повышение уровня ИЛ-6, MCP-1 и ФНО-α спустя 2 часа после введения доз. Увеличение количества отмечалось для всех антител, включая Кампат-1H®, и было дозозависимым (т.е. более высокие уровни цитокинов были отмечены для дозы 1,0 мг/кг, чем для дозы 0,1 мг/кг). В сравнении с Кампатом-1H®, антитела 2C3-SFD1/K12 и 12G6-SFD1/K11 индуцировали похожие уровни ИЛ-6, в то время как 9D9-H10/K12 индуцировали ИЛ-6 со значительно пониженной степенью. Для MCP-1, антитело 12G6-SFD1/K11 индуцировало более низкие уровни, и антитела 12G6-SFD1/K11 и 9D9-H10/K12 снижали уровни ФНО-α в сравнении с Кампатом-1H®.
ФИГ. 69A-69D показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В-клеток) и CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток/NK-клеток в крови спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и антител 2C3-SFD1/K12 («2C3»), 12G6-SFD1/K11 («12G6») и 9D9-H10/K12 («9D9»). ФИГ. 70A-70D показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В-клеток) и CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток/NK-клеток в селезенке спустя 72 часа после введения дозы антитела Кампат-1H® («Кампат») и антител 2C3-SFD1/K12 («2C3»), 12G6-SFD1/K11 («12G6») и 9D9-H10/K12 («9D9»). ФИГ. 71А-71F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антитела Кампат-1H® и антител 2C3-SFD1/K12, 12G6-SFD1/K11 и 9D9-H10/K12.
Пример 51: Прямое сравнение гуманизированных клонов 9D9 к huCD52 у трансгенных мышей (9D9 H10/K12 и 9D9 H11/K12)
Активность двух клонов гуманизированных антител 9D9 к CD52 (9D9-H10/K12 и 9D9-H11/K12) снижать количество клеток исследовалась у трансгенных мышей huCD52. Мышам внутривенно вводили 0,1 или 1,0 мг/кг антитела. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и NK-клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Лечение любым антителом приводило к похожему снижению количества лимфоцитов в крови и селезенке, при этом снижение количества лимфоцитов в крови было более робастным. Кроме того, количество CD4 и CD8+ T-клеток было большим, чем В-клеток и NK-клеток в обеих тканях. В то время как снижение количества клеток клоном 9D9-H10/K12 было менее робастным, чем снижение количества клеток клоном 9D9-H11/K12, разница не имела статистической разницы.
ФИГ. 72 отображает уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток в крови спустя 72 часа после введения дозы антител 9D9-H10/K12 и 9D9-H11/K12. ФИГ. 73 отображает уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток, NK-клеток в селезенке спустя 72 часа после введения дозы антител 9D9-H10/K12 и 9D9-H11/K12.
Пример 52: Прямое сравнение гуманизированных клонов 12G6 к huCD52 у трансгенных мышей (12G6-SFD1/K11 и 12G6-SFD1-K12)
Активность двух клонов гуманизированных антител 12G6 к CD52 (12G6-SFD1/K11 и 12G6-SFD1/K12) снижать количество клеток исследовалась у трансгенных мышей huCD52. Мышам внутривенно вводили 0,1 или 1,0 мг/кг антитела. Спустя два часа после введения дозы была отобрана сыворотка для потенциального исследования уровня циркулирующих цитокинов. Спустя три дня после введения дозы, мыши были умерщвлены, а кровь и селезенка были отобраны у каждой мыши для определения степени снижения количества клеток с использованием анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Введение антитела 12G6-SFD1/K11 или антитела 12G6-SFD1/K12 приводило к значительному снижению уровня лимфоцитов в крови. В активности двух клонов снижать количество лимфоцитов разница была небольшой или отсутствовала. Схема снижения количества лимфоцитов была такова, что количество нативных CD4 и CD8+ T-клеток было снижено в большей степени, чем количество Т-клеток памяти или Treg клеток. Количество клеток из миелоидной популяции было снижено в меньшей степени вне зависимости от клона (12G6-SFD1/K11 или 12G6-SFD1/K12) или дозы. Анализ цитокинов сыворотки для данного эксперимента не проводился.
ФИГ. 74А-74D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K11 («12G6 K11») и 12G6-SFD1/K12 («12G6 K12»). ФИГ. 75А-75D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител 12G6-SFD1/K11 («12G6 K11») и 12G6-SFD1/K12 («12G6 K12»).
Пример 53: Прямое сравнение гуманизированных клонов 9D9 к huCD52 у трансгенных мышей (9D9 H11/K12, 9D9 H16/K13 и 9D9 H18/K13)
Активность трех гуманизированных антител 9D9 (9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13) в снижении количества антител было сопоставлено с использованием трансгенных мышей huCD52. Трансгенные мыши относительно CD52 человека были подвергнуты лечению с использованием ФСБ в качестве контрольного носителя, или таким мышам было введено 1 мг/кг или 0,1 мг/кг каждого антитела. Спустя два часа после введения дозы была отобрана сыворотка для исследования уровня циркулирующих цитокинов. Спустя три дня, мыши были умерщвлены, вслед за чем была отобрана периферическая кровь и селезенка, которые анализировали в ходе анализа проточной цитометрии. Образцы были проанализированы для определения относительного числа всех субпопуляций клеток Т-хелперов (CD4+), цитотоксических Т-клеток (CD8+), В-клеток (B220+) и миелоидных клеток, присутствующих в циркулирующей периферической крови или селезенке трансгенных мышей huCD52. Кроме того, был проведен анализ подгрупп Т- и В-клеток для определения общего эффекта снижения количества клеток. Все антитела 9D9 (9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13) опосредовали снижение количества лимфоцитов и популяций миелоидных клеток в крови и селезенке в равной степени. Более робастное снижение количества лимфоцитов и миелоидных клеток отмечалось в крови, чем в селезенке. Сравнение активности клонов 9D9 (9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13) относительно снижения количества клеток показало, что 9D9-H16/K13 приводил к более робастному снижению количества клеток, затем 9D9-H18/K13 и 9D9-H11/K12. Это было более очевидно для лимфоцитов в селезенке в дозе 1 мг/кг, при которой лечение 9D9-H16/K13 приводило к снижению количества клеток в большей степени, чем другие клоны (9D9-H18/K13 и 9D9-H11/K12). Кроме того, схема снижения количества клеток была таковой, что количество нативных CD4 и CD8+ T-клеток было снижено в большей степени, чем Т-клетки памяти или Treg клетки, и популяции В-клеток были снижены в большей степени при использовании 9D9-H16/K13. Популяции миелоидных клеток были менее подвергнуты влиянию лечением антителами к CD52 вне зависимости от клона антитела (9D9-H11/K12, 9D9-H16/K13 или 9D9-H18/K13) или дозы. Из проанализированных цитокинов, повышение отмечалось для ИЛ-6, ФНО-α и MCP-1. После введения, для всех клонов 9D9 (9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13) в дозе 0,1 мг/кг и 1,0 мг/кг отмечались похожие циркулирующие уровни ИЛ-6 и MCP-1. Небольшие отличия отмечались для циркулирующих уровней ФНО-α, при которых введение клона 9D9-H16/K13 приводило к умеренному повышению в дозе 1,0 мг/кг.
ФИГ. 76 отображает уровень общей популяции лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток) в крови спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 77А-77D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 78 отображает уровень общей популяции лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и B220+ B-клеток) в селезенке спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 79А-79D отображают уровень CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 80A-80F отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител 9D9-H11/K12, 9D9-H16/K13 и 9D9-H18/K13.
Пример 54: Анализ ФК профиля антител к CD52 из семейств 2C3, 12G6 и 9D9 у трансгенных мышей CD52
Фармакокинетические профили гуманизированных антител 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13 определяли у трансгенных мышей huCD52. Мышам внутривенно вводили антитела в дозе 1 мг/кг, и в разных временных точках, начиная спустя два часа после введения дозы, была собрана кровь. Циркулирующие уровни каждого антитела были оценены с использованием ИФА антитела к Ig. Циркулирующие периоды полужизни были следующими: 2C3-SFD1/K12 79,0±23,9 часов, 12G6-SFD1/K11 49,0±14,4 часов, 12G6-SFD1/K12 75,1±28,5 часов, 9D9-H16/K13 59,8 + 26,6 часов и 9D9-H18/K13 42,2 + 15,7 часов.
В целом, в ходе таких исследований отмечали значительную вариабельность между животными. Терминальный период полувыведения антител 2C3-SFD1/K12 и 12G6-SFD1/K12 были подобными, в то время как период полувыведения антитела 12G6-SFD1/K11 был короче, но не существенно отличался. Клиренс был большим для 2C3-SFD1/K12, затем для 12G6-SFD1/K11 и 12G6-SFD1/K12. Два вида лечения 12G6 зеркально отражали друг друга для большинства измеренных временных точек, в то время как 2C3-SFD1/K12 характеризовался меньшим воздействием и более быстрым клиренсом. Все измеренные фармакокинетические параметры 9D9-H16/K13 и 9D9-H18/K13 были достаточно похожими.
ФИГ. 81A-81В отображают уровень антител 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13 в крови с течением времени после введения дозы.
|
Пример 55: Оценка цитокиновой бури в ответ на лечение антителами к CD52
Высвобождение цитокинов сыворотки после лечения антителами к CD52 было изучено с использованием трансгенных мышей huCD52. Животные были подвергнуты лечению 1 мг/кг Кампата-1H®, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 или 9D9-H18/K13. Одна группа животных была подвергнута лечению 5 мг/кг 2C3-SFD1/K12 с учетом предыдущих результатов, указывающих, что введение 2C3-SFD1/K12 может приводить к меньшему снижению количества клеток в сравнении с другими антителами, что позволило нормализировать группы на основе дозы, необходимой для достижения подобных уровней снижения количества клеток. У всех групп спустя 1, 2, 4, 24 и 48 часов после лечения была отобрана кровь с дальнейшим проведением анализа CBA на предмет воспалительных цитокинов. Все группы также были умерщвлены на 3 день после лечения, и селезенка была проанализирована на предмет снижения количества лимфоцитов способом проточной цитометрии. Лечение каждым из антител приводило к снижению различных клеток-мишеней, подобно тому, как это отмечалось для Кампата-1H®. Это было также справедливо для 2C3-SFD1/K12, доза которого 5 мг/кг использовалась для вызова подобного снижения количества клеток. Для 12G6-SFD1/K12 и 9D9-H16/K13 отмечалась определенная вариабельность в способности снижать количество клеток, в большинстве своем по причине повторного отбора крови у животных для получения сыворотки для анализов цитокинов. Однако экспрессия цитокинов была снижена для антител из семейства 12G6 (12G6-SFD1/K11 и 12G6-SFD1/K12) и 9D9 (9D9-H16/K13 и 9D9-H18/K13). Это было более заметно по высвобождению ИЛ-6, MCP-1 и ФНО-α в ранних временных точках (спустя 1 и 2 часа).
ФИГ. 82A-82F отображают уровень цитокинов в крови в течение 48 часов после введения антител Кампат-1H® («Кампат»), 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 или 9D9-H18/K13. ФИГ. 83А-83Е отображают уровень общего числа лимфоцитов, CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 или 9D9-H18/K13
Пример 56: Оценка репопуляционной кинетики в крови трансгенных мышей по CD52 после лечения антителами к CD52
Репопуляционную кинетику нескольких линий клеток в крови оценивали после введения гуманизированных антител CD52 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12. Мышам внутривенно вводили каждое антитело в дозе 2 мг/кг для обеспечения робастного уровня снижения количества клеток. Для анализа способом проточной цитометрии в различных временных точках проводили отбор крови для определения уровня циркулирующих лимфоцитов в крови, включая CD4+ и CD8+ T-клетки, регуляторные T-клетки, B-клетки, NK-клетки, нейтрофилы и макрофаги. Какой-либо разницы в первичной активности снижения количества клеток для каждого антитела отмечено не было, что было подтверждено на 3 день после введения. В течение первого месяца и каждые две недели впоследствии у мышей отбирали кровь для мониторинга кинетики репопуляции. Кинетика репопуляции лимфоцитов была подобна таковой для любого антитела к CD52 (2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12) в сравнении с Кампатом-1H®. К 57 дню количество В-клеток в крови вернулось к исходному значению, в то время как количество Т-клеток достигло исходного значения к 84 дню. К 116 дню количество CD8+ T-клеток не вернулось к контрольным значениям, однако похожая репопуляционная кинетика для всех других типов клеток, подвергнутых мониторингу, отмечалась при использовании каждого антитела к CD52 (2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12) и Кампата-1H®.
ФИГ. 84A-84G отображают репопуляцию циркулирующих CD4+ и CD8+ T-клеток, регуляторных Т-клеток, В-клеток, NK-клеток, нейтрофилов и макрофагов с течением времени после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
Пример 57: Оценка экспрессии CD52 у трансгенных мышей по CD52 с использованием антител к CD52
Экспрессию huCD52 оценивали с использованием гуманизированных антител к CD52 для определения возможности присутствия одинаковой схемы окрашивания популяций зрелых и растущих клеток у трансгенных мышей huCD52. Антитела 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13 были конъюгированы с FITC для использования в окрашивании в ходе проточной цитометрии. Были собраны образцы тканей у трансгенных мышей huCD52, и такие образцы были подвергнуты окрашиванию. Антитела 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13 окрашивали лимфоциты, экспрессирующие huCD52, из селезенки трансгенных мышей подобно Кампату-1H®. Схема окрашивания была репрезентативной для популяций лимфоцитов и субпопуляций, находящихся в других лимфоидных органах, таких как тимус и костный мозг.
ФИГ. 85 отображает способность антител Кампат-1H®, 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13, меченных FITC, специфически связываться с популяциями клеток лимфоцитов huCD52 в селезенке.
Пример 58: Прямое сравнение лечения однократной дозой антитела к huCD52 у трансгенных мышей huCD52
Активность нескольких гуманизированных антител к CD52 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13) снижать количество клеток была подвергнута сравнению у трансгенных мышей huCD52. Мышам внутривенно вводили антитела в дозе 1 мг/кг. Спустя 2 часа после введения дозы была взята сыворотка для проведения анализа цитокинов. Три дня спустя, мыши были умерщвлены, после чего была взята кровь и селезенка для сравнения уровня снижения количества лимфоцитов. При использовании всех антител к CD52 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13) отмечались существенные уровни снижения количества В- и Т-клеток, и такие уровни были сопоставимы с уровнями, наблюдаемыми после введения Кампата-1H®. Анализ субпопуляций также не выявил какой-либо значительной разницы в уровне снижения количества клеток каждым антителом (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13) в крови или селезенке. После введения Кампата-1H® отмечалось отличительное повышение циркулирующих уровней ИЛ-6 и ФНО-α. Несмотря на то, что введение каждого из антител к CD52 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13) приводило к значительному снижению уровня ФНО-α в сравнении с Кампатом-1H®, уровни ИЛ-6 были похожими.
ФИГ. 86A-86Е показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В220+ В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в крови спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 87A-87Е показывают уровень общих популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток и В220+ В-клеток) и CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток/NK-клеток и миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13. ФИГ. 88А-88С отображают уровни циркулирующих цитокинов спустя 2 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 и 9D9-H18/K13.
Пример 59: Глубокое снижение количества лимфоцитов у трансгенных мышей huCD52 после введения однократной дозы антител к huCD52
Расширенный анализ снижения количества клеток проводили с использованием трансгенных мышей huCD52, а также антител CD52 (2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12). Мышам (N=4) внутривенно вводили однократную дозу каждого антитела в дозе 1 мг/кг. Спустя три дня, мыши были умерщвлены, и кровь, селезенка, лимфатические узлы и тимус были отобраны для сравнения уровня снижения количества лимфоцитов с использованием многоцветной проточной цитометрии. При использовании всех антител к CD52 (2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12) отмечались существенные уровни снижения количества В- и Т-клеток, и такие уровни были сопоставимы с уровнями, наблюдаемыми после введения Кампата-1H® в каждой исследуемой ткани. Анализ субпопуляций также не выявил каких-либо существенных различий в снижении количества клеток в крови или селезенке при использовании каждого антитела. Значительные уровни снижения количества лимфоцитов также отмечались в лимфатических узлах мышей. Однако отмечалась небольшая вариабельность в активности антитела, особенно при рассмотрении субпопуляций центральных Т-клеток памяти и эффекторных Т-клеток памяти. По техническим причинам, касающимся LSR-II и красителя CD8, тимус не мог быть подвергнут анализу.
ФИГ. 89A-89D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ Т-клеток, NK-клеток/миелоидных клеток в крови спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12. ФИГ. 90A-90D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ В-клеток, NK-клеток/миелоидных клеток в селезенке спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12. ФИГ. 91A-91D отображают уровень CD4+ Т-клеток, CD8+ T-клеток, В220+ Т-клеток и NK-клеток/миелоидных клеток в лимфатическом узле спустя 72 часа после введения дозы антител Кампат-1H® («Кампат»), 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12.
Пример 60: Создание и оценка трансгенных мышей huCD52 Knock-in/Knock-out (KI/KO) на фоне C57BL/6
Новая мышиная knock-in/knock-out модель к CD52 человека была создана на фоне C57Bl/6. Для создания таких мышей, последовательность гена CD52 мыши была заменена последовательностью гена CD52 человека. Намеченная стратегия позволила осуществить замену мышиной последовательности последовательностью человека при сохранении экзон-интронной структуры. Маркер селекции использовался для идентификации потомства, содержащего последовательность нового гена. Финальный аллель был создан путем удаления маркера селекции, оставив только последовательность гена CD52 человека.
Основная характеристика мышиной модели huCD52 KI/KO включала определение уровня экспрессии CD52 на лимфоцитах. Кровь трансгенных мышей huCD52-KI/KO (N=4) и мышей C57BL/6 (N=2) была окрашена для выявления экспрессии hCD52, и ряд молекул/клеток CD52 был пронумерован с использованием анализа антитела к человеку Simply Cellular (Bang's labs). Окрашивание клеток периферической крови трансгенных мышей huCD52-KI/KO выявило, что экспрессия huCD52 очень высокая для большинства лимфоцитов таких животных. Уровни экспрессии были подобны таковым, отмечаемым в популяциях CD4, CD8 и B-клеток человека. Уровни экспрессии на NK-клетках и макрофагах были ниже, чем уровни, отмечаемые для Т-клеток и В-клеток. Повышенный уровень экспрессии huCD52 определяли на нейтрофилах таких мышей, в отличие от пониженного уровня экспрессии на нейтрофилах человека или подобных клеток, полученных у оригинальной линии трансгенных мышей на фоне CD-1. Похожие уровни экспрессии CD52 отмечали на Т- и В-клетках, полученных у оригинальных трансгенных мышей huCD52 CD1 и мышей huCD52 KI/KI.
ФИГ. 92A отображает уровень экспрессии huCD52 на CD4+ T-клетках, CD8+ T-клетках, B220+ B-клетках и NK-клетках/миелоидных клетках у мышей линии huCD52-KI/KO и нетрансгенных контрольных мышей. ФИГ. 92B отображает уровень экспрессии huCD52 на CD4+ T-клетках, CD8+ T-клетках и В-клетках у трансгенных мышей линий huCD52-KI/KO и huCD52 CD1.
Пример 61: Прямое сравнение параметров снижения количества клеток между мелкомасштабными и крупномасштабными партиями 12G6 и 2C3
Трансгенным мышам huCD52 KI/KO вводили дозу 12G6-SFD1/K12 или 2C3-SFD1/K12 для определения активности в снижении количества антител. Кроме того, активность исследовали с использованием антител, полученных из двух разных источников (крупномасштабных и мелкомасштабных партий) у Genzyme. Мышам внутривенно вводили каждое антитело в дозе 1 мг/кг. Спустя три дня после инъекции, мыши были умерщвлены, и их кровь была отобрана для анализа способом проточной цитометрии для определения уровней циркулирующих CD4+ и CD8+ T-клеток, B-клеток, NK-клеток, нейтрофилов и макрофагов. Какой-либо существенной разницы между снижением количества CD4 Т-клеток, CD8 T-клеток, B-клеток и NK-клеток антителами из мелкомасштабной и крупномасштабной партий отмечено не было.
Различные партии антител 12G6-SFD1/K12 и 2C3-SFD1/K12 также были оценены анализом проточной цитометрии для сравнения интенсивности окрашивания спленоцитов трансгенных мышей huCD52-KI/KO. Как оказалось, оба антитела 12G6-SFD1/K12 и 2C3-SFD1/K12 распознавали CD52 человека в той же самой степени, что и Кампат-1H® при использовании изолированных спленоцитов. Кроме того, какая-либо разница в уровне распознавания между антителами из двух источников (мелкомасштабной и крупномасштабной партий) отсутствовала.
ФИГ. 93А-93В отображает связывание с huCD52 антител 12G6-SFD1/K12 и 2C3-SFD1/K12 (из различных промышленных источников) в сравнении с антителом Кампат-1H® в качестве контроля. ФИГ. 94 отображает уровень совокупных популяций лимфоцитов (CD4+ T-клеток, CD8+ T-клеток, B220+ B-клеток) в крови спустя 72 часа после введения дозы антител 12G6-SFD1/K12 и 2C3-SFD1/K12, полученных из различных промышленных источников.
Пример 62: Анализ ФК профиля антител к CD52 у трансгенных мышей huCD52-KI/KO
Фармакокинетические профили гуманизированных антител 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12 определяли у трансгенных мышей huCD52 KI/KO. Мышам внутривенно вводили антитела в дозе 1 мг/кг, и в разных временных точках, начиная спустя два часа после введения дозы, была собрана кровь. Циркулирующие уровни каждого антитела были оценены с использованием ИФА антитела к Ig. Общая скорость клиренса была подобной для каждого гуманизированного антитела к CD52 (2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12), при этом 2C3-SFD1/K12 обладало более быстрой кинетикой, в то время как 12G6-SFD1/K12 присутствовало в сыворотке в течение наиболее длительного периода времени.
ФИГ. 95А-95В отображает уровни антител 2C3-SFD1/K12, 9D9-H16/K13 и 12G6-SFD1/K12 в крови с течением времени после введения дозы.
Пример 63: Оценка предварительного лечения 12G6 и 2C3 ЭАУЭ у трансгенных мышей huCD52-KI/KO
Эффективность лечения антителом к CD52 в снижении общей частоты возникновения заболевания и степени тяжести экспериментального аутоиммунного энцефаломиелита (ЭАУЭ) оценивали с использованием мышей huCD52 KI/KO. Мыши huCD52-KI/KO были подвергнуты курсу лечения 2C3-SFD1/K12 или 12G6-SFD1/K12 на дни 5 до -1. ЭАУЭ (модель рассеянного склероза) был индуцирован путем иммунизации пептидом MOG35-55, эмульгированном в CFA, а также лечением коклюшным токсином на дни 0 и 2. У мышей, подвергнутых лечению носителем, к 10 дню после инъекции отмечали признаки паралича, которые развились в тяжелое прогрессирующее заболевание. В отличие от этого, предварительное лечение мышей антителом 2C3-SFD1/K12 или 12G6-SFD1/K12 задерживало развитие заболевания и снижало общую степень тяжести заболевания.
ФИГ. 96 демонстрирует балл по шкале EAE при введении антител 2C3-SFD1/K12 и 12G6-SFD1/K12 в ходе прогрессирования заболевания.
Пример 64: Модификация Fc антител для изменения фармакокинетического профиля антител к CD52
Изменения в участке Fc антител 1) влияют на биологическую активность антитела посредством изменения взаимодействия с рецепторами Fc и/или 2) изменяют фармакокинетический профиль антитела путем изменения взаимодействия с неонатальным рецептором FcRn. Молекула FcRn экспрессируется на эндотелии сосудов и считается основным местом утилизации IgG. FcRn связывается с участком антитела Fc, который затем становится интернализированным в пределах клетки. Антитела, обладающие высокоаффинными взаимодействиями с FcRn, будут рециклированы обратно на поверхность клетки и выпущены обратно в кровоток. Антитела, обладающие меньшими аффинными взаимодействиями, диссоциируют в клетке и, в конце концов, распадаются. Сайт-направленный мутагенез для повышения взаимодействия с FcRn, приводит к образованию антитела, которое может удерживаться в кровотоке в течение более продолжительных периодов времени в сравнении с немодифицированным антителом. И наоборот, мутации в участке Fc антитела, которые снижают связывание с FcRn, укорачивают время полужизни антитела в кровотоке. Мутации, которые были описаны для снижения связывания с FcRn и приводящие к укорочению времени полужизни в кровотоке, включают единичную мутацию His435Ala и двойную мутацию His310Ala/His435Gln (см., например, Kim et. al., “Mapping the site on human IgG for binding of the MHC class I-related receptor, FcRn,” Eur. J. Immunol., 29:2819-2825 (1999) and Kenanova et. al., “Tailoring the Pharmacokinetics and Positron Emission Tomography Imaging Properties of Anti-Carcinoembryonic Antigen Single-Chain Fv-Fc Antibody Fragments,” Cancer. Res. 65(2):622-631 (2005)).
Антитело 2C3-SFD1/K12 было мутировано для получения антител His435Ala 2C3-SFD1/K12 («2C3-SFD1/K12-модифицированное 1») и His310Ala/His435Gln 2C3-SFD1/K12 («2C3-SFD1/K12-модифицированное 2») с измененными ФК профилями. Для подтверждения пониженного связывания с молекулами FcRn мыши и человека, был проведен анализ Biacore. Антитела Кампат-1H® и 2C3-SFD1/K12 связываются с молекулами FcRn мыши и человека с похожими кинетическими параметрами. В отличие от этого, антитела His435Ala 2C3-SFD1/K12 связываются с FcRn мыши в меньшей степени и не связываются с FcRn человека. Антитела His310Ala/His435Gln 2C3-SFD1/K12 не связываются ни с FcRn мыши, ни с FcRn человека, что указывает на то, что введения одиночной или двойной мутации в участок Fc 2C3-SFD1/K12 значительно влияет на связывание с FcRn мыши и человека.
ФИГ. 97A-97B отображают способность антител Кампат-1H® («Кампат»), 2C3-SFD1/K12 («2C3»), His435Ala 2C3-SFD1/K12 («H435A 2C3») и His310Ala/His435Gln 2C3-SFD1/K12 («H310A/H435Q 2C3») связываться с молекулами FcRn мыши и человека.
Пример 65: Оценка периода полужизни антител к CD52 с модифицированным Fc после внутривенного введения мышам C57Bl/6
Модификации Fc были введены в остове 2C3-SFD1/K12 для получения 2C3-SFD1/K12-модифицированного 1 и 2C3-SFD1/K12-модифицированного 2 антител, которые обладают пониженным связыванием с рецептором FcRn, ответственным за присутствие антител в кровотоке. Фармакокинетический профиль был определен для антитела 2C3-SFD1/K12, а также для 2C3-SFD1/K12-модифицированного 1 и 2C3-SFD1/K12-модифицированного 2 антител с пониженным связыванием с FcRn. Для оценки ФК профиля в отсутствие антигена-мишени (2C3-SFD1/K12 связывается с CD52 человека, но не реагирует перекрестным образом с CD52 мыши) использовали мышей C57BL/6. Мышам внутривенно вводили антитела в дозе 1 мг/кг. При разных временных точках у мышей была отобрана кровь для анализа уровня циркулирующего IgG1 человека в сыворотке мыши способом ИФА. 2C3-SFD1/K12-модифицированное 1 и 2C3-SFD1/K12-модифицированное 2 антитела выводились из крови более быстро, чем антитело 2C3-SFD1/K12. 2C3-SFD1/K12 имело время полужизни 403 часа, в то время как 2C3-SFD1/K12-модифицированное 1 антитело имело время полужизни 51 час и 2C3-SFD1/K12-модифицированное 2 антитело имело время полужизни 8 часов. ФК профили 2C3-SFD1/K12 и 2C3-SFD1/K12-модифицированного-1 антител соответствовали 1-компартментной модели с только одной фазой элиминации. В отличие от этого, профили 2C3-SFD1/K12-модифицированного-2 антитела соответствовали 2-компартментной модели с двумя отдельными фазами элиминации (указаны в таблице как альфа и бета). Первая фаза длилась до 48 часов после введения дозы (альфа), а вторая фаза (бета, также называется терминальной фазой элиминации) начиналась спустя 48 часов после введения дозы.
ФИГ. 98 отображает in vivo клиренс антител 2C3-SFD1/K12 («2C3 немодифицированное»), 2C3-SFD1/K12-модифицированное 1 («2C3-Fc мутант 1») и 2C3-SFD1/K12-модифицированное 2 («2C3-Fc мутант 2») у нетрансгенных мышей.
|
|
Пример 66: Оценка периода полужизни антител к CD52 с модифицированным Fc после внутривенного введения гетерозиготным мышам huCD52
Фармакокинетический профиль был определен для антитела 2C3-SFD1/K12, а также для 2C3-SFD1/K12-модифицированного 1 и 2C3-SFD1/K12-модифицированного 2 антител с пониженным связыванием с FcRn in vitro. Трансгенные мыши huCD52 использовались для оценки ФК профиля в присутствии антигена-мишени антитела 2C3-SFD1/K12. Мышам внутривенно вводили антитела в дозе 1 мг/кг. При разных временных точках у мышей была отобрана кровь для определения уровня циркулирующего IgG1 человека в сыворотке мыши способом ИФА. 2C3-SFD1/K12-модифицированное 1 и 2C3-SFD1/K12-модифицированное 2 антитела выводились из крови более быстро, чем антитело 2C3-SFD1/K12. 2C3-SFD1/K12 имело время полужизни 64 часа, в то время как 2C3-SFD1/K12-модифицированное 1 антитело имело время полужизни 32 часа и 2C3-SFD1/K12-модифицированное 2 антитело имело время полужизни 6,5 часов.
ФИГ. 99 отображает in vivo клиренс антител 2C3-SFD1/K12 («2C3»), 2C3-SFD1/K12-модифицированное 1 («2C3-Fc мутант 1») и 2C3-SFD1/K12-модифицированное 2 («2C3-Fc мутант 2») у трансгенных мышей линии huCD52.
|
|
Пример 67: Оценка in vivo снижения количества клеток после внутривенного введения антител к CD52 с модифицированным Fc гетерозиготным трансгенным мышам huCD52
Активность в снижении количества клеток для антител 2C3-SFD1/K12, 2C3-SFD1/K12-модифицированное 1 и 2C3-SFD1/K12-модифицированное 2 определяли с использованием трансгенных мышей huCD52. Мыши были подвергнуты лечению 1 мг/кг 2C3-SFD1/K12, 2C3-SFD1/K12-модифицированным 1 или 2C3-SFD1/K12-модифицированным 2 антителами, а спустя 72 часа были проанализированы на предмет наличия CD4 T-клеток, CD8+ T-клеток, B-клеток и NK-клеток. Введение антител 2C3-SFD1/K12-модифицированное 1 или 2C3-SFD1/K12-модифицированное 2 приводило к снижению количества клеток в крови и селезенке в сравнении с введением антител 2C3-SFD1/K12. Кроме того, 2C3-SFD1/K12-модифицированное 1 антитело приводило к большему снижению количества клеток в крови и селезенке, чем 2C3-SFD1/K12-модифицированное 2.
ФИГ. 100A-100B отображают уровень общих популяций лимфоцитов (CD4+ T-клетки, CD8+ T-клетки, B220+ B-клетки и NK-клетки) в крови и селезенке спустя 72 часа после введения дозы антител 2C3-SFD1/K12 («2C3»), 2C3-SFD1/K12-модифицированное 1 («2C3 Fc мутант-1») и 2C3-SFD1/K12-модифицированное 2 («2C3 Fc мутант-2»).
Пример 68: Детальная специфичность гуманизированных антител к CD52 относительно антигенных детерминант
Детальную специфичность относительно антигенных детерминант гуманизированных антител 12G6-SFD1/K12, 2C3-SFD1/K12 и 9D9-H16/K13 определяли с использованием прибора Biacore T100. В качестве контроля специфичность к антигенной детерминанте клона 097 (очищенное антитело к CD52 человека, Biolegend) оценивали с применением таких же самых способов. Специфичность к антигенной детерминанте клона 097 уже была охарактеризована ранее с использованием пептидного ИФА (Hale G, “Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein,” Immunotechnology, 1:175-187 (1995)). В таком анализе Biacore T100 антитела были непосредственным образом иммобилизированы на сенсорных чипах из карбоксиметилдекстрана Biacore CM5 Series S (GE #BR-1006-68) с использованием аминного связывания. Поверхность карбоксиметилдекстрана была активирована с использованием смеси 1:1 0,1М N-гидросисукцинимида (NHS) и 0,4M N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорида (EDC), что позволило поверхности связать реакционоспособные аминные группы антител. Принимая во внимание, что антитела IgM стремятся иметь более высокий уровень неспецифического связывания при сравнении с IgG, также было исследовано связывание мышиного контрольного изотипа IgMκ (mIgMκ) (клон Biolegend #MM-30). После иммобилизации антитела, поверхность реакционоспособного сенсорного чипа была «погашена» с использованием 1М этаноламина гидрохлорида/NaOH pH 8,5. Одна проточная ячейка на каждом чипе была представлена холостой эталонной поверхностью, а последующие проточные ячейки были иммобилизированные 10000 RE антитела.
Была синтезирована целая серия аланин-сканирующих мутантных пептидов, состоящих из последовательности CD52 человека (MUT 1 - MUT 12 (SEQ ID NOS: 169-180, соответственно), Таблица 21) (см., например, Hale G, “Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein,” Immunotechnology, 1:175-187 (1995)). Связывание антитела с такими мутантными пептидами CD52 и пептидами дикого типа человека были исследовано при концентрациях 500 нМ, 100 нМ, 50 нМ и 0 нМ. Пептиды разводили в рабочем буфере анализа HBS-EP+ (10 мМ HEPES, 150 мМ NaCl, 0,05% сурфактанта P20, 3 мМ ЭДТА, pH 7,4). Были включены дупликаты образцов 100 нМ. В качестве контроля IgM также была включена легкая (каппа) цепь специфического крысиного антитела к IgM мыши (Southern Biotech Clone #1B4B1). Температура камеры для анализа образцов прибора Т100 и температура анализа была установлена на 4°C и 25°C, соответственно. Образцы пептида CD52 человека вводили в течение пяти минут при скорости потока 50 мкл/мин для измерения ассоциации, и промыты HBS-EP+ в течение пяти минут при скорости потока 50 мкл/мин для измерения диссоциации. Поверхность антитела была освобождена от любого оставшегося связанного пептида с использованием шестидесяти повторных инъекций 10 мМ глицин-HCl pH 2,0 при скорости потока 50 мкл/мин. Анализ проводили с использованием программного обеспечения Biacore T100 Kinetics Evaluation v2.0 (GE Healthcare). Данные были аппроксимированы к модели 1:1 с использованием эталонной проточной ячейки и за вычетом концентрации (вычетом двойного эталона). Репрезентативные сенсограммы отрицательного ((-), MUT 8) и положительного ((+), MUT 9) распознавания пептидной антигенной детерминанты антителом 12G6-SFD1/K12 представлены на ФИГ. 101А и ФИГ. 101В, соответственно. Компилированные данные связывания пептида обобщены в Таблице 21.
Охарактеризованная ранее специфичность связывания клона 097 (Hale G, “Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein,” Immunotechnology, 1:175-187 (1995)) была определена путем покрытия планшетов ИФА пептидами, содержащими шесть остатков С-терминального конца CD52 человека, с последующим измерением связывания антитела с фиксированным пептидом. Каждый остаток был замещен всеми 20 аминокислотами. Принимая во внимание, что пептиды были присоединены к твердой поверхности в ходе ИФА, эффекты авидности могли иметь большее влияние на такой анализ, чем на описанный здесь анализ Biacore T100, для которого используют антитело, фиксированное на поверхности, вдоль которой пропускают пептид. В ходе исследования ИФА было обнаружено, что замены аланина в положениях 11 и 12 (остатками дикого типа пролином и серином, соответственно) зрелой формы CD52 человека снижали сильное связывание клона 097 с пептидом. В данном исследовании Biacore T100 было обнаружено, что замена аланина в положениях 11 и 12 (а также в положениях 7, 8, 9 и 10) приводила к отсутствию связывания клона 097. Гипотетические эффекты авидности ИФА являются, вероятно, причиной того, что картографированная антигенная детерминанта клона 097 меньше, чем такая детерминанта, определенная путем ИФА, как это описано в представленном здесь анализе Biacore T100.
Связывание гуманизированных антител 2C3-SFD1/K12 и 12G6-SFD1/K12 с пептидной последовательностью CD52 человека чувствительно к заменам аланина в положениях 7, 8 и 11, и связывание гуманизированного антитела 9D9-H16/K13 чувствительно к заменам аланина в положениях 4 и 11. Такая определенная специфичность относительно антигенной детерминанты перекрывается с результатами, отмечаемыми в Примере 4 (обобщены в Таблице 8). Небольшая вариабельность между результатами не ожидается, поскольку способ Biacore T100 использовался для измерения связывания в данном случае и значительно отличался от способа, используемого в Примере 4. В отличие от данного случая, в Примере 4 полученные путем рекомбинации клетки СНО использовали для экспрессии CD52 дикого типа человека или аланинзамещенных мутантов CD52 человека. Экспрессируемый в таких клетках млекопитающих CD52 человека может быть гликозилирован, что окажет влияние на связывание. Это не относится к CD52 человека, используемого в анализе Biacore T100.
|
Пример 69: Оценка ответа CD4+ T-клетками, индуцируемого Кампатом-1H® или 12G6-SFD1/K12
Пролиферативный ответ CD4+ T-клеток оценивали после повторной in vitro стимуляции аутологичными дендритными клетками (ДК), предварительно нагруженными набором перекрывающихся 15-мерных пептидов, состоящих из последовательностей из вариабельных участков Кампата-1H® или гуманизированного антитела 12G6-SFD1/K12. В таких экспериментах использовали Т-клетки и ДК здоровых доноров-людей. Результаты измеряли путем количественного анализа введения меченного тритием тимидина в пролиферирующие CD4+ T-клетки человека в ответ на антиген-представляющие клетки (АПК), возбужденные аутологичным пептидом.
Получение клеток: МКПК были выделены из продукта афереза здорового донора-человека, полученного от BioMed Supplies (Carlsbad, CA). Скрининг на гаплотип HLA (ЧЛА) крови донора был проведен Key Biologics, LLC (Memphis, TN) (Таблица 22). МКПК были изолированы с использованием градиента плотности Ficoll-Paque PLUS (GE Healthcare) и серии промываний фосфатно-солевым буфером (ФСБ, Invitrogen, Carlsbad, CA). CD4+ T-клетки были выделены из МКПК с использованием грануло-положительного набора для изоляции Dynal CD4+ (Invitrogen) с соблюдением рекомендуемого протокола производителя. Выделенные CD4+ T-клетки были заморожены в среде для замораживания и выделения клеток из культуры Recovery Cell Culture Freezing Media (Invitrogen) и хранили в жидком азоте. Дендритные клетки (ДК) были индуцированы из МКПК путем распределения прилипающих клеток с использованием ГМ-КСФ (Leukine, Bayer, Leverkusin, Germany) и ИЛ-4 (Peprotech, Rocky Hill, NJ) в течение шести дней. Среда, дополненная ГМ-КСФ и ИЛ-4, была заменена на день 4. ДК впоследствии были выделены из пробирок и заморожены в среде для заморозки, затем перенесены в резервуары для хранения в жидком азоте.
|
Пептид: Пептиды, содержащие вариабельные участки тяжелой и легкой цепей Кампата-1H® и 12G6-SFD1/K12, были синтезированы с использованием автоматического синтезатора пептидов Rainin Symphony и стандарта Fmoc-chemistry на смоле CLEAR (Peptides International, Louisville, KY). Аминокислоты (EMD Biosciences, San Diego, CA or Anaspec, San Jose, Ca) были ортогонально защищены группами трет-бутоксикарбонил (BOC), трет-бутил (tBu), 2,2,4,6,7-пентаметилдигидро-бензофуран-5-сульфонил (Pbf) или тритил (Trt). Связывание было выполнено с использованием аминокислоты/HCTU/HOBt/DIEA/смолы с молярным соотношением 6:6:3:12:1. Раствор 20% пиперидина и 2,5% 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU) в ДМФ использовался для удаления Fmoc от N-конца в ходе каждого цикла. Снятие защиты/отщепление от смолы проводилось с использованием коктейля из 15 мл/0,1М смолы с соотношением о/о 2,5% воды/2,5%TIS/5% анизол/90% трифторуксусная кислота в течение 3 часов. Супернатант был осажден в диэтиловом эфире (-80°C) и был центрифугирован при 3000 об/мин в течение 10 минут. Эфир был слит, и осадок был снова промыт. Затем незрелый пептид был лиофилизирован. Аналитическую ВЭЖХ (XBridge C18 4.5 x 100mm, Waters Corp., Milford, MA) и масс-спектрометрию MALDI-TOF (Synapt, Waters Corp., Milford, MA) использовали для верификации последовательностей и оценки чистоты. Все реагенты имели степень чистоты для ВЭЖХ (EMD Biosciences, San Diego, Ca or Sigma Aldrich, St. Louis, MO). Лиофилизированные пептиды были ресуспендированы в 100% ДМСО (Sigma). Сорок три пептидов Кампата-1H® были скомбинированы в 11 линейных групп, каждая группа содержала 3 или 4 пептида (Таблица 23: снизу вверх, пептиды легкой цепи обозначены SEQ ID NO: 187-206 и пептиды тяжелой цепи обозначены SEQ ID NO: 207-229). Сорок два пептида 12G6-SFD1/K12 были скомбинированы в 8 линейных групп, каждая группа содержала 5 или 6 пептидов (Таблица 24: снизу вверх, пептиды легкой цепи обозначены SEQ ID NO: 230-250 и пептиды тяжелой цепи обозначены SEQ ID NO: 251-271).
|
|
Стимуляция in vitro
Примирование антигеном и созревание ДК: Перед лечением пептидами ДК были оттаяны, промыты и распределены в RPMI (Invitrogen, Carlsbad, CA), дополненной 5% сыворотки человека (HS, Sigma, St. Louis, MO), 1% пенициллина-стрептомицина (Invitrogen, Carlsbad, CA), 100 нг/мл ГМ-КСФ и 20 нг/мл ИЛ-4. ДК были распределены в количестве 2×105 клеток/мл в 4 мл среды по 6-луночному планшету с культурой ткани, после чего оставили на 1 час при температуре 37oC для адгезии. После того, как клетки слиплись, в лунки, содержащие ДК, было добавлено по 10 мкг/мл (всего 40 мкг) каждого пептида, что коррелировало с 120 мкг или 160 мкг общего количества пептидов, добавленных в каждую лунку (3-пептидных или 4-пептидных групп Кампата-1H®), или 200 мкг или 240 мкг общего количества пептидов, добавленных в каждую лунку (5-пептидных или 6-пептидных групп 12G6-SFD1/K12). 40 мкг связывающей антигенной детерминанты pan-DR (PADRE) было добавлено в одну лунку с ДК, и такая лунка считалась положительным контролем, поскольку отмечалось связывание с большинством молекул HLA-DR (Alexander J, et. al., “Development of high potency universal DR-restricted helper epitopes by modification of high affinity DR-blocking peptides,” Immunity, 1:751-761 (1994)). Подобным образом, 40 мкг каждого из трех пептидов столбнячного анатоксина, связывающегося с HLA-DR (DTIMMEPPYCKGLDIYYKA (SEQ ID NO: 183), SAMLTNLIIFGPGPVLNKNEV (SEQ ID NO: 184) и NNFTVSFWLRVPKVSASHLE (SEQ ID NO: 185)), было добавлено в одну лунку с ДК. Таким образом, инактивированный теплом аденовирус использовали в качестве положительного источника антигена, и такой аденовирус был добавлен в одну лунку с ДК в количестве 1 мкг/мл. Наконец, одна группа ДК оставалась не примированной антигеном и служила в качестве «нулевой обученной» группы. ДК, примированные различными антигенами, инкубировали в течение, по меньшей мере, трех часов при температуре 37oC. Затем ДК были подвергнуты воздействию «созревающим коктейлем цитокинов», содержащим 50 нг/мл ФНО-α, 10 нг/мл ИЛ-6, 25 нг/мл ИЛ-1 бета (Peprotech, Rocky Hill, NJ) и 500 нг/мл PGE-2 (Sigma Aldrich, St. Louis, MO). Затем ДК, примированным антигенами, дали созреть в течение ночи при температуре 37oC.
Получение ко-культуры: После нагрузки пептидами и созревания, ДК были промыты дважды в ФСБ, вслед за чем было внесено 4 мл RPMI с дополнением 10% HS. Аутологичным CD4+ T-клетками дали оттаять, затем такие клетки ресуспендировали в RPMI с добавлением 10% HS, пенициллина и стрептомицина в количестве 2 ×106 клеток/мл. Затем ДК были культивированы с нативными CD4+ T-клетками в соотношении Т-клетка:ДК 10:1 (8×106 T-клеток:8×105 ДК) в 8 мл среды. После этого, ко-культура была инкубирована при температуре 37oC в течение 7 дней. Спустя примерно 72 часа после инициации совместного культивирования, к клеткам было добавлено 25 МЕ рекомбинантного ИЛ-2 (Peprotech, Rocky Hill, NJ), и впоследствии 25 МЕ рекомбинантного ИЛ-2 в свежей среде каждые 3-4 дня.
Повторная стимуляция ко-культуры: На день 7 (Stim #2) и день 14 (Stim #3) ко-культуры были повторно стимулированы с соблюдением указанной выше процедуры.
Анализ пролиферации : ДК были распределены, примированы антигеном и выращены до созревания в соответствии с представленным выше описанием в количестве 5×105 клеток/мл в 1 мл среды по 24-луночному планшету с низкой степенью связывания для облегчения последующего трансфера клеток в U-образные планшеты для анализа. Иррелевантный HLA_DR-связывающий пептид CS 378-398 (пептидная последовательность DIEKKIAKMEKASSVFNVVNS (SEQ ID NO: 186)) использовался в качестве отрицательного контроля (Alexander J, et. al., “Development of high potency universal DR-restricted helper epitopes by modification of high affinity DR-blocking peptides,” Immunity, 1:751-761 (1994)). Спустя 24 часа созревания ДК, клетки были отсоединены от планшетов с использованием промывания ледяным ФСБ. ДК были внесены в 96-луночные U-образные планшеты вместе с антиген-стимулированными Т-клетками в соотношении Т-клетки:ДК 1:1 (2,5×104 ДК/лунка). Каждая группа Т-клеток была проанализирована трижды вместе с ДК, примированными «обучающими» пептидами (специфический ответ), и ДК, примированными иррелевантным пептидом (неспецифический ответ), а также только Т-клетками и только ДК (контроль). Анализ продолжался в течение 72 часов перед добавления 1 μCi меченного тритием тимидина на лунку (Perkin Elmer, Waltham, MA). Клетки были собраны на коллекторе для 96-луночных планшетов (Perkin Elmer), и количество введенного меченного тритием тимидина было количественно измерено путем определения CPM на счетчике Wallac Microbeta Trilux (Perkin Elmer). Индекс стимуляции рассчитывался путем деления значения специфического CPM на значение неспецифического CPM.
Применение Vbeta Т-клеточных рецепторов (TCR): Любые CD4+ T-клетки, оставшиеся после проведения анализа пролиферации, были заморожены для окончательного определения экспрессии Vbeta цепи рецептора Т-клеток. Клетки были оттаяны и окрашены 24 конъюгированными членами семейства Vbeta, распознающими антитела, в течение 30 минут с соблюдением указаний производителя, приведенных в наборе IOTest Beta Mark Kit (Beckman Coulter, France). После промывания ФСБ и ресуспендирования в 1% формальдегиде, клетки были проанализированы с использованием FACScalibur (Becton Dickinson, Franklin Lakes, NJ). Был рассчитан процент клеток, экспрессирующих каждую из определенных Vbeta цепей, и данные обобщены на ФИГ. 102 и ФИГ. 103.
Оценка иммуногенности Кампата-1H®
Оценка иммуногенности пептидов Кампат-1H® была произведена в соответствии с представленным выше описанием с использованием МКПК от десяти здоровых доноров (предоставлено BioMedSupply (BMS)). Сводные данные по ответам, определяемым по индексу стимуляции, указаны в Таблице 25А. Каждый донор указан в одном столбце, и каждый ряд содержит группу пептидов, используемых для стимуляции CD4+ T-клеток. Индекс стимуляции (ИС) определяется путем деления значения специфического иммунного ответа на «обучающую» группу пептидов на значение иррелевантного ответа. Значения ИС<2,0 не представлены. Данные пролиферации для каждого из десяти доноров обобщены в Таблице 25А и представлены на ФИГ. 104A-J. У шести доноров отмечался индекс ингибирования, превышающий 2,0, и в результате этого такие доноры были названы «ответившими на Кампат-1H®». «Обученные» CD4+ T-клетки от одного из ответивших (BMS352) характеризовались специфическим иммунным ответом при анализе с использованием двух разных пептидных групп. Седьмой донор BMS486 также был классифицирован как «ответивший». У этого донора индекс стимуляции 1,7 был отмечен для легкой цепи пептидной группы 986-989. При оценке повышенной экспрессии Vbeta в культурах «обученных» Т-клеток у такого донора, было показано, что «обученные» Т-клетки 986-989 характеризовались повышенной экспрессией отдельных Vbeta, Vβ3 (Фигура 102). Избыточная экспрессия отдельных Vbeta и специфический пролиферативный ответ показали, что BMS486 был ответившим на Кампат-1H®. У трех не ответивших доноров (BMS200, BMS154 и BMS167) данные пролиферации или гиперэкспрессии Vbeta отсутствовали, что указывало на отсутствие возникновения пептид-специфического иммунного ответа. Данные для Кампата-1H® были количественно определены как 70% (7/10) количества ответивших на лечение. Общее количество групп пептидов, вызвавших иммунный ответ, составило восемь. Три из таких восьми групп иммуногенных пептидов вызывали сильный ответ у соответствующих доноров с индексами стимуляции 3,0 или выше (Таблица 26).
|
Пример 70: Оценка ответа CD4+ T-клетками, индуцируемого 12G6-SFD1/K12
Оценку иммуногенности и анализ Vbeta вариабельного участка 12G6-SFD1/K12 проводили в соответствии с описанием, представленным в Примере 69 для Кампата-1H®, с использованием клеток от десяти здоровых доноров. Данные пролиферации для каждого из десяти доноров обобщены в Таблице 25В и представлены на ФИГ. 105A-J. Два из таких десяти доноров использовались в оценке Кампата-1H®, описанной выше (BMS486 и BMS484), в то время как оставшиеся восемь доноров были тестированы только с пептидами 12G6-SFD1/K12. У одного донора (BMS484) отмечался ответ на три группы пептидов, и такой донор был классифицирован как «ответивший на 12G6-SFD1/K12» (Таблица 25В). Два донора (BMS927 и BMS928) ответили на одну группу пептидов, и, следовательно, такие доноры были классифицированы как ответившие. У донора BMS928 отмечался небольшой индекс стимуляции, равный 2,0, относительно группы, содержащей пептиды тяжелой цепи 1066, 1067, 1068, 1083, 1084 и 1085. Такой ответ был подтвержден путем анализа пролиферативных Т-клеток для использования Vbeta. Т-клетки ответившего донора BMS928 характеризовались гиперэкспрессией одиночных Vbeta, Vβ20 (ФИГ. 103). У донора BMS927 отмечался индекс стимуляции 2,5 относительно Т-клеток в одной группе пептидов с легкой цепью. Анализ Vbeta Т-клеток ответившего донора BMS927 не выявил отдельной гиперэкспрессии Vbeta в сравнении с фоном. Однако такой донор оставался в категории «ответивших», поскольку набор Vbeta представлял только 70% всего возможного применения Vbeta. Показатель иммуногенности 12G6-SFD1/K12 у таких 10 доноров составил 30% (3/10), что менее половины такового показателя для ответивших на Кампат-1H® (70%). В целом ответ отмечался у пяти групп пептидов, в то время как ни у одного такого пептида индекс стимуляции не превышал 3,0 (Таблица 26).
|
Заключение
Пептиды, коррелирующие с вариабельными участками тяжелой и легкой цепи гуманизированного моноклонального антитела 12G6-SFD1/K12 к CD52, индуцировали более слабый иммунный ответ у десяти доноров (30)%, чем пептиды, коррелирующие с вариабельными участками тяжелой и легкой цепи Кампата-1H® (70%). Иммунный ответ на основе CD4+ T-клеток в результате воздействия 12G6-SFD1/K12 также имел меньшую степень, чем иммунные ответы, вызванные Кампатом-1H®.
Представленная ниже таблица содержит идентификационные номера последовательностей, используемых в данном изобретении.
|
Описания всех патентов, опубликованных заявок и процитированные здесь ссылки представлены во всей своей полноте в тексте данной заявки посредством ссылки.
В то время как данное изобретение было показано отдельным образом и описано с ссылками на примеры вариантов воплощения изобретения, специалист в данной области должен понимать, что различные изменения в форме и деталях могут быть осуществлены без уменьшения объема изобретения, охватываемого прилагаемой формулой изобретения.