Результат интеллектуальной деятельности: СПОСОБ ПРОВЕДЕНИЯ ПРЕНАТАЛЬНОЙ И ПОСТНАТАЛЬНОЙ ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ ЧИСЛОВЫХ ХРОМОСОМНЫХ АНОМАЛИЙ У ЭМБРИОНОВ ЧЕЛОВЕКА И ДНК-МИКРОЧИП НА ОСНОВЕ ПОЛНОХРОМНЫХ ДНК-ЗОНДОВ
Вид РИД
Изобретение
Изобретение относится к области молекулярной генетики и репродуктивной медицины, к способам проведения пренатальной и постанатальной генетической диагностики числовых хромосомных аномалий у эмбрионов человека и ДНК-микрочипам для их осуществления.
Демографические исследования показали, что в среднем шансы произвести жизнеспособное потомство у женщины в пределах одного менструального цикла не превышают 25% (Edmonds et al., 1982). Вместе с тем, около 15% клинически распознаваемых беременностей спонтанно прерывается в течение первого триместра (Carr, 1983). Кроме того, в последние годы во всем мире наблюдается прогрессивное увеличение числа бесплодных супружеских пар. Хромосомные нарушения являются одной из основных причин низкой частоты имплантации эмбрионов, перенесенных в циклах экстракорпорального оплодотворения (ЭКО), а также высокой частоты спонтанных выкидышей (Чиряева и др., 2007). По разным данным от 50 до 60% спонтанных абортусов имеют анеуплоидии (Eiben et al., 1990; Баранов, Кузнецова, 2003). Для решения этих проблем в настоящее время проводят пренатальную и преимплантационную генетическую диагностику, которая позволяет отобрать эмбрионы с нормальным кариотипом для переноса в циклах экстракорпорального оплодотворения, а также выявить у развивающегося плода такие тяжелые генетические заболевания как синдром Дауна, синдром Эдвардса, синдром Шерешевского-Тернера. Отбор эмбрионов без хромосомных нарушений позволяет увеличить показатели эффективности ЭКО на 10-25%, в частности в группе женщин старше 35 лет (Lee et al., 2014). С этой целью проводится преимплантационный генетический скрининг (ПГС). Проведение ПГС во многих случаях является необходимым условием для повышения шансов на успешное завершение циклов ВРТ, так как он позволяет повысить показатели ВРТ до 65% и выше (Verlinsky et al., 2005).
В настоящее время в центрах ЭКО для диагностики анеуплоидий широко используется технология array CGH (микроматричная сравнительная геномная гибридизация), так как она в кратчайшие сроки позволяет получить исчерпывающую информацию о кариотипе эмбриона. Применение ДНК-микрочипов актуально и для пренатальной генетической диагностики. В исследованиях, посвященных анализу эффективности использования array CGH в данной области, была показана более высокая способность выявления хромосомных нарушений в сравнении со стандартным кариотипированием (от 1 до 5% в зависимости от причины направления пациента) (Lichtenbelt et al., 2011). Помимо этого, ДНК-микрочипы дают возможность снизить субъективность анализа, облегчить консультирование пациентов и уменьшить сроки проведения диагностики, так как исключается обязательный этап культивирования амниоцитов (Bi et al., 2008).
Известны разработки, позволяющие анализировать соматические мутации в генах, ответственных за развитие раковых опухолей, и выявлять структурные перестройки генома опухолевых клеток (химерных генов) (№2609641 от 02.02.2017; №2639513 от 21.12.2017; №2549682 от 27.04.2015). Помимо этого, в базе ФИПС представлены устройства, относящиеся к диагностике в области медицины, криминалистики и тестирования генетически модифицированных объектов в продуктах (№69866 от 10.01.2008). Аналогами представленного изобретения являются ДНК-микрочипы, позволяющие выявлять хромосомные аберрации в образцах ДНК человека. В их числе: Affymetrix, США (№5445934 от 29.08.1995; №5837832 от 17.11.1998); Agilent, США (№6171797 от 09.01.2001; №7247337 от 24.07.2007); RHS, Австралия. Известен способ химической иммобилизации ДНК-зондов на поверхности стекла при изготовлении микрочипов, предложенный M.J. Hessner с коллегами (Hessner et al., 2004).
Наиболее близким является изобретение «Метод детекции хромосомных аномалий и микрочип» («Detection method for chromosome abnormality and microarray chip», патент №US 2007/0048742 A1). Изобретение предоставляет собой ДНК-микрочип для пренатального и постнатального скрининга отдельных генетических нарушений, а именно: синдрома Дауна, синдрома Патау, синдрома Эдвардса, синдрома Тернера, синдрома Клайнфельтера, ATR-16, CATlA, синдрома Кошачьего крика, синдрома Дижорджа и др. Принцип выявления хромосомных аномалий с помощью данного изобретения включает несколько этапов:
1. Подготовка ДНК-микрочипа для обнаружения хромосомных аномалий.
2. Образец геномной ДНК маркируется первым маркировочным материалом, контрольная ДНК маркируется вторым маркировочным материалом.
3. Гибридизация меченой ДНК и ДНК-зонда, содержащегося в споте.
4. Оценка степени гибридизации геномной ДНК образца и контрольной ДНК на основе на основе анализа двоичного логарифма результата сравнения показателей интенсивности свечения первого и второго маркировочного материала.
В качестве основы используется стеклянная подложка размером 25×75×1 мм, которая обработана аминосиланом. ДНК-микрочип включает один или по меньшей мере два зонда, иммобилизованных в одном месте. На ДНК-микрочипе представлены фрагменты геномной ДНК, полученные из 1440 ВАС-клонов. ДНК-микрочип содержит 12 подмассивов, где каждый подмассив включает в себя 360 (30×12) слотов. ДНК-зонд в споте представляет собой фрагмент ДНК человека, выделенной из ВАС-клонов (искусственной бактериальной хромосомы), соответствующий одному хромосомному локусу и включающий повторяющиеся последовательности в количестве более 85%. Размер ДНК-зонда варьирует от 20 до 100 п.о., концентрация ДНК-зонда в споте 0,02 до 0,100 нг. В качестве флуоресценых красителей для мечения могут быть использованы Су3, Су5, Alexa Fluor 350, Alexa Fluor 430, Alexa Fluor 488, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 594, Alexa Fluor 658, Цианин-3, Цианин-5, флуоресцеин, техасский красный, FITC, родамин.
Для очистки меченой флуоресцентными красителями ДНК используется переосаждение ДНК с Cot-1 ДНК, 3М цитратом натрия и холодным 100% этанолом. Перед проведением гибридизации в гибридизационный раствор добавляют 10 ед. ДНК спермы лосося. Смесь денатурируют при 70°С, затем переносят на лед. После чего 40 мкл смеси наносят на ДНК-микрочип и оставляют на 30 мин при комнатной температуре. Затем ДНК-микрочип дважды промывают в дистиллированной воде и изопропаноле. 44 мкл фиолетового раствора, содержащего тестируемую и контрольную ДНК, денатурируют при 70°С в течение 15 мин, а затем наносят на ДНК-микрочип, который оставляют в инкубаторе при 37°С на 1 час. На ДНК-микрочип наносят гибридизационную смесь, накрывают предметное стекло покровным, размером 20×40 мм. Гибридизацию проводят в инкубаторе, при 37°С и влажности 100% в течение 48-72 часов. Для отмывки ДНК-микрочипа от гибридизационной смеси используют следующие растворы: раствор (рН 7,3) 46 D; раствор 46, содержащий 2×SSC и 0,1% SDS; 100 мл PN-буфера (рН 8,0) смешанного с раствором, содержащим 0,2 М NaHPO (рН 9,0) и 0,2 М NaH2PO (рН 4,3); 100 мл дистиллированной воды и 200 мкл NP40; 2×SSC; батарея спиртов (70%, 85% и 100%). Перед сканированием предметное стекло высушивается. Для сканирования используется анализатор (MACVIEWER, 25, А661200). Спектры сканирования Су3 и Су5. Отсканированное изображение анализируется в программе ВАС Chip Analyser (Macrogen). Микрочип показывает базовые значения T/R log2 для 1440 ВАС-клонов, в равной степени содержащих все аутосомные хромосомы (1 до 22) и половые хромосомы (X и Y) в соответствии с порядком хромосом. Значение T/R рассчитывают путем деления интенсивности флуоресценции (Су3) образца на интенсивности флуоресценции свечения (Су5) контроля, где значение 0, если интенсивности флуоресцентных красителей одинаковы; значение >0,2, если интенсивность образца выше, чем у контроля; и значение <0,2, если интенсивность контроля сильнее, чем образец. На основании среднего показателя соотношения T/R для каждого фрагмента ДНК рассчитывается log2.
Известный ДНК-микрочип имеет высокое разрешение за счет большого числа используемых ДНК-зондов. Однако при этом существенно осложняется интерпретация получаемых результатов. Соответственно, повышаются требования к квалификации персонала, который будет работать с данным ДНК-микрочипом. Недостатком, также, является длительность анализа, которая составляет от двух до трех суток. Кроме того, для сканирования ДНК-микрочипа используется только анализатор MACVIEWER (25, А661200), который практически не встречается на базе Российских диагностических лабораторий. Также, в состав ДНК-зондов не включены позитивные и негативные контроли, что может осложнить контроль качества гибридизации, а также интерпретацию полученных результатов. Таким образом, использование известного ДНК-микрочипа отличается высокой стоимостью обусловленной использованием большого количества ДНК-зондов, требует специфического диагностического оборудования при изготовлении и в процессе съема данных и анализа.
Новый технический результат - разработка способа генетической диагностики числовых хромосомных аномалий у эмбрионов человека и ДНК-микрочипа для его осуществления, позволяющих упростить интерпретацию получаемых в результате анализа ДНК-микрочипа результатов, использовать более доступное оборудование, сократить временные и финансовые затраты на создание ДНК-микрочипа при сохранении необходимой и достаточной точности и информативности диагностики.
Для достижения нового технического результата в ДНК-микрочипе на основе полнохромосомныхных ДНК-зондов для проведения пренатальной и постнатальной генетической диагностики числовых хромосомных аномалий у эмбрионов человека, содержащем твердый носитель, на рабочей зоне которого расположены споты с ДНК-зондами, в состав которых входят зонды, комплементарные диагностируемым маркерам, подложка, выполненная из стекла и покрыта полилизином, также дополнительно в состав слотов входят зонды для положительного и отрицательного контролей, при этом, ДНК-зонды представлены по меньшей мере в двух повторностях и сгруппированы в отдельную зону прямоугольной формы, причем вторая повторность ДНК-зондов является перевернутой на 180 градусов относительно вертикальной оси копией первой повторности, на углах прямоугольника расположены позитивные и негативные контроли, представленные геномной ДНК человека и ДНК фага λ, либо геномной ДНК дрожжей, размер ДНК-зонда варьирует от 100 до 1000 п.о., средняя длина составляет 500 п.о., концентрация ДНК-зондов составляет 100 нг/мкл, концентрация ДНК-зонда в споте от 5 до 20 нг, ДНК-зонды растворены в буфере ТЕ, при ручной печати диаметр слотов может варьировать в пределах от 50 до 100 мкм, расстояние между спотами составляет 100-200 мкм, при печати с помощью миниплоттера диаметр спотов может варьировать в пределах 10 до 50 мкм., при этом, расстояние между спотами составляет 100-200 мкм, в качестве флуоресценых красителей для мечения могут быть использованы Су3, Су5, Sulfo-Су3, Sulfo-Cy5.5.
Также, для постнатальной генетической диагностики на подложке ДНК-микрочипа дискретно нанесены полнохромосомные ДНК-зонды, комплементарные последовательностям 24 хромосом человека
Также, для пренатального генетического скрининга подложка ДНК-микрочипа включает 5 дискретно нанесенных полнохромосомных ДНК-зондов, соответствующих пяти хромосомам человека: хромосомы 13, 18, 21, X, Y.
Описание конструкции ДНК-микрочипа:
ДНК-микрочип представляет собой подложку, в качестве которой используют предметное стекло по ГОСТ 9284-75 размером 25×75×1 мм с биополимерным покрытием (полилизин), обеспечивающим прочное связывание ДНК-зондов с поверхностью подложки.
ДНК-микрочип для преимплантационного генетического тестирования (ПГТ-А, ПГС) включает в себя 24 дискретно нанесенных полнохромосомных ДНК-зонда, соответствующих всем хромосомам человека, представленных по меньшей мере в двух повторностях и сгруппированных в отдельную зону прямоугольной формы. Вторая повторность ДНК-зондов является перевернутой на 180 градусов копией первой повторности относительно вертикальной оси. На углах прямоугольника расположены позитивные (геномная ДНК человека) и негативные (ДНК фага λ, геномная ДНК дрожжей) контроли.
ДНК-микрочип для пренатального генетического скрининга может включать в себя только 5 дискретно нанесенных полнохромосомных ДНК-зондов, соответствующих пяти хромосомам человека (хромосомы 13, 18, 21, X, Y), ДНК-микрочип для пренатального генетического скрининга позволяет выявлять отдельные генетические нарушения: синдром Дауна, синдром Патау, синдром Эдвардса, синдром Шерешевского-Тернера, синдром Клайнфельтера.
Каждый спот на ДНК-микрочипе представляет собой библиотеку зондов к репрезентативным последовательностям ДНК целой хромосомы. ДНК-зонды получают путем микродиссекции хромосомного материала человека с последующей ПЦР с вырожденным праймером. Размер ДНК-зонда варьирует от 100 до 1000 п.о., средняя длина составляет 500 п.о. Концентрация ДНК-зондов составляет 100 нг/мкл. Концентрация ДНК-зонда в споте от 5 до 20 нг. ДНК-зонды растворены в буфере ТЕ (Трис-HCl, ЭДТА). Иммобилизация ДНК-зондов на стеклянной подложке производится с помощью УФ-излучения при энергии - 200 мДж/см2, а также с помощью температурной обработки (80°С). При ручной печати диаметр слотов может варьировать в пределах от 50 до 100 мкм, в среднем составляет 70 мкм. Расстояние между спотами составляет 100-200 мкм. При печати с помощью миниплоттера диаметр слотов может варьировать в пределах 10 до 50 мкм. Расстояние между спотами составляет 100-200 мкм. В качестве флуоресценых красителей для мечения могут быть использованы Су3, Су5, Sulfo-Су3, Sulfo-Cy5.5.
Также новый технический результат достигается способом диагностики числовых хромосомных аномалий у эмбрионов человека, включающем подготовку ДНК-микрочипа, маркировку образца геномной ДНК, гибридизацию меченой ДНК и ДНК-зонда, содержащегося в споте, оценку степени гибридизации геномной ДНК образца и контрольной ДНК на основе анализа двоичного логарифма результата сравнения показателей интенсивности свечения первого и второго маркировочного материала, в котором полнохромосомные ДНК-зонды получают посредством сбора хромосомного материала отдельных метафазных хромосом с помощью оптического микроскопа с механическим микроманипулятором, и дальнейшей амплификацией с помощью реакции ПЦР с вырожденным праймером, при этом, для получения препаратов метафазных хромосом используют Т-лимфоциты периферической крови здорового индивида мужского пола, процедуру фиксации и окраски хромосом производят по стандартному протоколу (Соколова 2012), для амплификации ДНК хромосом используют двухэтапную ПЦР с вырожденным праймером (DOP-праймер 6-MW), эффективность реакции ПЦР проверяют с помощью электрофореза в 1% агарозном геле (оценивают размер полученных фрагментов ДНК), специфичность полученных ДНК-зондов проверяют с помощью метода FISH на метафазных хромосомах человека, далее осуществляют очистку и растворение ДНК-зонда, для ПЦР-продуктов проводят гель-фильтрацию с сефадексом, после чего ДНК высушивают с помощью концентратора, в качестве растворителя для ДНК-зонда используют буфер ТЕ (Трис-HCl, ЭДТА), концентрация ДНК-зонда составляет 100 нг/мкл, далее получают одноцепочечную ДНК, для чего в спотах ДНК-зонды подвергают предварительной денатурации при 98°С, а затем переносятся на лед, далее производят печать ДНК-микрочипа на подложке, далее проводят регидратацию ДНК-зондов на подложке, для чего подложку стороной, на которую был нанесен ДНК-зонд в течение 15 секунд удерживают над водяной баней вниз стороной со спотами при температуре воды около 75°С, после чего переворачивают и помещают на термостолик, нагретый до температуры 80°С на 10 сек до полного высыхания, далее стеклянную подложку с нанесенными на нее ДНК-зондами подвергают облучению ультрафиолетом в течение 10 мин на расстоянии 5 см от бактерицидного облучателя после этого ДНК-микрочип инкубируют на термостолике при 80°С в течение 2 часов, после этого проводят удаление не связавшейся с подложкой ДНК путем погружения в растворы 20×SSC, 2×SSC и деионизованную воду, в каждом растворе удерживают в течение 2 минут, а затем отмывают с помощью многократного погружения в раствор, далее осуществляют денатурацию ДНК в споте путем инкубации в 70% формамиде при температуре 80°С в течение 2 мин, после чего ДНК-микрочип ополаскивают деионизованной водой и помещают на лед на 1 мин, далее осуществляют гибридизацию и отмывку ДНК-микрочипа, при этом в качестве исследуемого образца используют геномную ДНК человека с показателями качества 260/280 и 260/230 не менее 1,7, либо ДНК человека после полногеномной амплификации, в качестве контрольного образца используют ДНК индивидов мужского пола с нормальным кариотипом, мечение тестируемой и контрольной ДНК флуоресцентными красителями Су5 и Су3, соответственно, производят с помощью набора Oligo aCGH/ChiP-onChip Hybridization Kit (Agilent Technologies, США) в соответствии со стандартным протоколом производителя, очистку меченой ДНК проводят с помощью гель-фильтрации в колонках с сефадексом, меченую ДНК - тестируемую и контрольную - смешивают в эквивалентных количествах, для супрессии диспергированных повторяющихся последовательностей ДНК в геноме производят предварительный отжиг ДНК проб в присутствии 50-кратного избытка ДНК из фракции повторяющихся последовательностей (C0t-1 ДНК человека) (СибХромоТех, Россия), полученный раствор высушивают с помощью концентратора, а затем растворяют в гибридизационной смеси, содержащей 2×Hi-RPM Hybridization Buffer (Agilent Technologies, США) и 10X aCGH blocking buffer (Agilent Technologies, США), после чего ДНК с гибридизационной смесью переносят на ДНК-микрочип, накрывают покровным стеклом (24×32), которое заклеивают резиновым клеем, гибридизацию проводят во влажной гибридизационной камере в течение 24 часов при 67°С, после окончания гибридизации ДНК-микрочип погружают в раствор 4×SSC, покровное стекло снимают, производят отмывку в растворе 2×SSC, затем в растворе 0,2×SSC, затем многократно отмывают в деионизованной воде, анализ результатов гибридизации проводят с использованием лазерного сканера и соответствующего программного обеспечения, на основании среднего показателя соотношения R/G для каждого фрагмента ДНК рассчитывают log2. Получаемое значение равно 0, если интенсивности флуоресцентных красителей одинаковы; значение ≥0,53, если интенсивность свечения образца выше, чем у контроля при числе копий хромосом в тестируемом образце выше по сравнению с контрольным и значение ≤-0,9, если интенсивность свечения контроля выше, чем у образца, если число копий хромосом в тестируемом образце ниже по сравнению с контрольным.
ДНК-микрочип получают следующим образом.
1. Получение ДНК-зондов. Полнохромосомные ДНК-зонды получают посредством сбора хромосомного материала отдельных метафазных хромосом с помощью оптического микроскопа с механическим микроманипулятором, и дальнейшей амплификацией с помощью реакции ПЦР с вырожденным праймером. Для получения препаратов метафазных хромосом используют Т-лимфоциты периферической крови здорового индивида мужского пола. Процедуру фиксации и окраски хромосом производят по стандартному протоколу (Соколова и др., 2012). Для амплификации ДНК хромосом используют двухэтапную ПЦР с вырожденным праймером (DOP-праймер 6-MW). Эффективность реакции ПЦР проверяют с помощью электрофореза в 1% агарозном геле (фрагменты ДНК размером около 100-1000 п.о.). Специфичность полученных ДНК-зондов проверяют с помощью метода FISH на метафазных хромосомах человека.
2. Очистка и растворение ДНК-зонда. Для ПЦР-продуктов проводят гель-фильтрацию с сефадексом, после чего ДНК высушивают с помощью концентратора. Оптимальным растворителем для ДНК-зонда является буфер ТЕ (Трис-HCl, ЭДТА), как с точки зрения интенсивности зеленого сигнала в спотах, так и с точки зрения распределения сигнала в зеленом спектре. Оптимальная концентрация ДНК-зонда составляет 100 нг/мкл и позволяет получить слоты с достаточным для гибридизации количеством ДНК, но не приводящим к «засвечиванию» изображения при сканировании.
3. Печать ДНК-микрочипа (нанесение ДНК-зонда на стеклянную подложку). Печать ДНК-микрочипа производят на стеклянной подложке (предметном стекле размером 25×75×1 мм по ГОСТ 9284-75) с адгезивным покрытием, обеспечивающим прочное связывание ДНК-зондов. Для печати ДНК-микрочипа необходимо, чтобы поверхность стекла была гидрофобной. Стекла, покрытые Poly-L-lysine (полилизином) предварительно обезжиривают. Для получения одноцепочечной ДНК в спотах ДНК-зонды подвергают предварительной денатурации при 98°С, а затем переносятся на лед. ДНК-зонды могут быть нанесены на стеклянную подложку с адгезивным покрытием вручную с помощью стеклянной иглы, например, G-1000, 1×90 мм (Narishige Co., Ltd., Japan), либо методом контактной печати с помощью миниплоттера.
4. Регидратация ДНК-зондов на стеклянной подложке. Предметные стекла стороной, на которую был нанесен ДНК-зонд в течение 15 сек удерживают над водяной баней вниз стороной со спотами. Температура воды должна быть около 75°С, что позволяет равномерно и быстро увлажнить поверхность стекла. После чего стекла переворачивают и помещают на термостолик, нагретый до температуры 80°С на 10 сек до полного высыхания.
5. Облучение ультрафиолетом для образования сшивок между ДНК и адгезивным покрытием. Стеклянная подложка с нанесенными на нее ДНК-зондами подвергают облучению ультрафиолетом в течение 10 мин на расстоянии 5 см от бактерицидного облучателя (тип ОБНП 1×15-01, 220 В, 50 Гц, 75 Вт, поверхностная плотность потока на расстоянии 1 м: 0,3 Вт/м2) (Генерис, Россия). После этого ДНК-микрочип инкубируют на термостолике при 80°С в течение 2 часов.
6. Удаление несвязавшейся с подложкой ДНК. Для этой цели используют растворы 20×SSC, 2×SSC и деионизованную воду. В каждом растворе прототип ДНК-микрочипа находится в течение 2 мин, после чего отмывается с помощью многократного погружения в каждый раствор. Данный подход позволяет с высокой эффективностью снижать фоновое свечение у получаемых ДНК-микрочипов.
7. Денатурация ДНК в споте, позволяющая разрушить связи между цепочками ДНК. Денатурация ДНК производится с помощью инкубации в 70% формамиде при температуре 80°С в течение 2 мин. После этого ДНК-микрочип многократно ополаскивается деионизованной водой и помещается на лед на 1 мин.
Диагностику с помощью предлагаемого ДНК-микрочипа осуществляют следующим образом:
8. Гибридизация и отмывка ДНК-микрочипа. В качестве исследуемого образца может быть использована геномная ДНК человека с показателями качества 260/280 и 260/230 не менее 1,7, либо ДНК человека после полногеномной амплификации. В качестве контрольного образца может быть использована ДНК индивидов мужского пола с нормальным кариотипом. Мечение тестируемой и контрольной ДНК флуоресцентными красителями Су5 и Су3, соответственно, производят с помощью набора Oligo aCGH/ChiP-onChip Hybridization Kit (Agilent Technologies, США) в соответствии со стандартным протоколом производителя. Очистку меченой ДНК проводят с помощью гель-фильтрации в колонках с сефадексом. Меченую ДНК - тестируемую и контрольную - смешивают в эквивалентных количествах. Для супрессии диспергированных повторяющихся последовательностей ДНК в геноме производят предварительный отжиг ДНК проб в присутствии 50-кратного избытка ДНК из фракции повторяющихся последовательностей (C0t-1 ДНК человека) (СибХромоТех, Россия). Полученный раствор высушивают с помощью концентратора. Основным компонентом гибридизационной смеси является 2×Hi-RPM Hybridization Buffer (Agilent Technologies, США) - 10-15 мкл на 1 образец. Для блокировки неспецифического свечения при сканировании лазерным сканером в состав гибридизационной смеси входит 10x aCGH blocking buffer (Agilent Technologies, США) - 5 мкл на 1 образец. В высушенный ДНК-зонд, состоящий из контрольной, тестируемой ДНК и C0t-1 ДНК человека добавляют 15 мкл гибридизационной смеси. После чего ДНК с гибридизационной смесью переносят на ДНК-микрочип, накрывают покровным стеклом. Для герметичности покровное стекло заклеивается. Гибридизация ДНК-зондов на ДНК-микрочип проводят во влажной гибридизационной камере в течение 24 часов при 67°С. После окончания гибридизации ДНК-микрочип погружают в раствор 4×SSC, покровное стекло с клеем аккуратно снимают. Затем производят отмывку в растворе 2×SSC, затем отмывку в растворе 0,2×SSC. После чего следуют отмывки в деионизованной воде.
9. Анализ результатов гибридизации проводят с использованием лазерного сканера и соответствующего программного обеспечения. Спектры сканирования - Су3 и Су5. Полученное изображение открывают в программе ImageJ. Средние показатели интенсивности свечения красного (R) и зеленого (G) сигнала заносят в таблицу в программе Excel (Microsoft, США). Значение R/G рассчитывают путем деления интенсивности флуоресценции (Су5) образца на флуоресценцию интенсивность свечения (Су3) контроля. На основании среднего показателя соотношения R/G для каждого фрагмента ДНК рассчитывают log2. Получаемое значение равно 0, если интенсивности флуоресцентных красителей одинаковы; значение ≥0,53, если интенсивность свечения образца выше, чем у контроля (число копий хромосом в тестируемом образце выше по сравнению с контрольным); и значение ≤-0,9, если интенсивность свечения контроля выше, чем у образца (число копий хромосом в тестируемом образце ниже по сравнению с контрольным).
Оборудование для осуществления способа: флуоресцентный микроскоп, ПЦР-амплификтор, водяная баня, лазерный сканер, термостолик, миниплоттер.
Примеры осуществления.
Пример 1. Выявление числовых хромосомных нарушений в клетках трофэктодермы бластоцисты с помощью ДНК-микрочипа, содержащего полнохромосомные ДНК-зонды на 24 хромосомы человека. В качестве исследуемого образца использовали ДНК после полногеномной амплификации методом ПЦР или MDA. В качестве контрольного образца использовали ДНК индивидов мужского пола с нормальным кариотипом. Мечение тестируемой и контрольной ДНК флуоресцентными красителями Су5 и Су3, соответственно, производили с помощью набора Oligo aCGH/ChiP-onChip Hybridization Kit (Agilent Technologies, США) в соответствии со стандартным протоколом производителя. Тестируемый образец метили флуоресцентными красителем Су5, а контрольный - Су3. Очистку меченой ДНК проводили с помощью гель-фильтрации в колонках с сефадексом, либо колонками SureTag DNA Labeling Kit Purification Columns (Agilent Technologies, США). После мечения тестируемую и контрольную ДНК в эквивалентных количествах смешивали. Для супрессии диспергированных повторяющихся последовательностей ДНК в геноме производили предварительный отжиг ДНК проб в присутствии 50-кратного избытка ДНК из фракции повторяющихся последовательностей (C0t-1 ДНК человека) (СибХромоТех, Россия). Полученный раствор высушивали с помощью концентратора. Готовили гибридизационную смесь: 15 мкл 2×Hi-RPM Hybridization Buffer (Agilent Technologies, США), 5 мкл 10X aCGH blocking buffer (Agilent Technologies, США). В высушенный ДНК-зонд, состоящий из контрольной, тестируемой ДНК и C0t-1 ДНК человека добавляли 15 мкл полученной гибридизационной смеси. После чего ДНК с гибридизационной смесью переносили на ДНК-микрочип, накрывали покровным стеклом (24×32). Для герметичности покровное стекло заклеивали резиновым клеем. Гибридизацию ДНК-зондов на ДНК-микрочип проводили во влажной гибридизационной камере в течение 24 часов при 67°С. После окончания гибридизации ДНК-микрочип погружали в раствор 4×SSC, покровное стекло с клеем аккуратно снимали. Затем производили отмывку в растворе 2×SSC в течение 5 мин, затем отмывку в растворе 0,2×SSC в течение 2 мин, при этом ДНК-микрочип многократно погружали в раствор. После чего проводили две отмывки в деионизованной воде по 2 мин. Перед помещением в сканер ДНК-микрочип высушивали. Анализ результатов гибридизации проводили с использованием лазерного сканера и соответствующего программного обеспечения. Полученное изображение открывалось в программе ImageJ: File-Open. С помощью инструмента Elliptical selections выделяли один спот, затем во вкладке Analyze-Tools-выбирали опцию Color Histogram. В окне Results появлялись средние показатели интенсивности свечения красного (R) и зеленого (G) сигнала, которые переносили в таблицу в программе Excel (Microsoft, США) (пример - Табл. 1 Результаты анализа интенсивности свечения зеленого и красного сигналов в спотах, содержащих 24 полнохромосомных ДНК-зонда, позитивный и негативные контроли). Значение R/G рассчитывали путем деления интенсивности флуоресценции образца (спектр Су5) на интенсивность свечения флуоресценции контроля (спектр Су3). На основании среднего показателя соотношения R/G для каждого фрагмента ДНК рассчитывали log2 (Таблица 1). Анализ с помощью данного ДНК-микрочипа занял около 40 ч.

На основании результатов, представленных в таблице 1, можно было сделать заключение, что исследуемый образец ДНК, полученный из клеток трофэктодермы, был мужского пола и имел трисомию хромосомы 16 и моносомию хромосомы 22. Молекулярный кариотип образца: arr(16)×3,(22)×1,(X,Y)×1.
Пример 2. Выявление числовых хромосомные нарушений с помощью ДНК-микрочипа, содержащего полнохромосомные ДНК-зонды на 5 хромосом человека - 13, 18, 21, X и Y. Данный микрочип позволяет исключить синдромы Дауна, Эдвардса, Патау, синдромы, связанные с нарушением числа половых хромосом (например, синдром Шерешевского-Тернера, синдром Клайнфельтера).
В качестве тестируемого образца использовали ДНК плода, выделенную из ворсин хориона, полученных при проведении инвазивной пренатальной диагностики. Процедуру мечения и гибридизации ДНК-библиотек тестируемого и контрольного образца на ДНК-микрочип, а также процедуру отмывки ДНК-микрочипа после гибридизации выполняли согласно описанию в Примере 1. Анализ результатов гибридизации проводили с использованием лазерного сканера и соответствующего программного обеспечения. Полученное изображение открывали в программе ImageJ: File-Open. С помощью инструмента Elliptical selections выделяли один спот, затем во вкладке Analyze-Tools-выбирали опцию Color Histogram. В окне Results появлялись средние показатели интенсивности свечения красного (R) и зеленого (G) сигнала, которые переносили в таблицу в программе Excel (Microsoft, США). Значение R/G рассчитывали путем деления интенсивности флуоресценции образца (спектр Су5) на интенсивность свечения флуоресценции контроля (спектр Су3). На основании среднего показателя соотношения R/G для каждого фрагмента ДНК рассчитывали log2 (Таблица 2 Результаты анализа интенсивности свечения зеленого и красного сигналов в спотах, содержащих полнохромосомные ДНК-зонды на хромосомы 13, 18, 21, X и Y, позитивный и негативные контроли). Анализ с помощью данного ДНК-микрочипа занял около 40 ч.

На основании результатов, представленных в таблице 2, можно было сделать заключение, о том, что исследуемый образец является образцом ДНК плода женского пола и имеет трисомию хромосомы 18, что является причиной развития синдрома Эдвардса. Молекулярный кариотип образца: arr(18)×3, (Х)×2.
Таким образом, применение предлагаемого ДНК-микрочипа на основе полнохромосомных ДНК-зондов позволяет выявить числовые хромосомные нарушения и определить пол в образцах ДНК человека.
Разрешающая способность предлагаемого ДНК-микрочипа - целая хромосома. Технология проведения анализа - сравнительная геномная гибридизация. Стекла с иммобилизованными ДНК-зондами хранят при комнатной температуре до их использования. Максимальный срок хранения 6 мес.
Конструкция ДНК-микрочипа, технические условия его получения и проведения диагностики с его помощью были определены на основе результатов проведения собственных научных исследований.
При этом были использованы следующие репрезентативные объемы выборки:
1. Для выбора оптимальной концентрации ДНК-зонда, содержащегося в споте, было проанализировано 12 прототипов ДНК-микрочипа, каждый из которых содержал 16 слотов. На основании предварительных экспериментов были выбраны 4 конечные концентрации ДНК-зонда: 15 нг/мкл, 150 нг/мкл, 1500 нг/мкл и 3000 нг/мкл.
2. Для определения оптимального времени облучения ультрафиолетом было проанализировано 3 прототипа ДНК-микрочипа, каждый из которых содержал 16 слотов. Прототипы ДНК-микрочипа были облучены ультрафиолетом на расстоянии 5 см от бактерицидного облучателя (тип ОБНП 1×15-01, 220 В, 50 Гц, 75 Вт, поверхностная плотность потока на расстоянии 1 м: 0,3 Вт/м2) (Генерис, Россия) в течение 1 мин / 5 мин / 10 мин.
3. Для определения оптимального времени температурной обработки было проанализировано 3 прототипа ДНК-микрочипа, каждый из которых содержал 16 спотов. Прототипы ДНК-микрочипов инкубировали при температуре 80°С в течение 30 мин / 1 час / 2 часа / 3 часа.
4. Для выбора оптимального растворителя для ДНК-зондов было протестировано 4 разных растворителя: деионизованная вода, 3×SSC (20×SSC: 175 г NaCl, 88 г Na3C6H5O7*2H2O на 1 л mQ H2O), ТЕ (1 мМ Трис-HCl с рН 8.0, ЭДТА 0,1 мМ, NaN3 (азид натрия) 0,01%, Твин 20 0,05%), 3% DMSO/1,5 М betaine. При этом было проанализировано 12 ДНК-микрочипов, каждый из которых содержал 16 спотов.
5. Для подбора оптимального времени регидратации ДНК-зондов в спотах было проанализировано 9 прототипов ДНК-микрочипа, каждый из которых содержал 16 спотов. Прототипы ДНК-микрочипа удерживались над водяной баней в течение 5 сек / 10-15 сек / 20 сек удерживались над водяной баней стороной со спотами.
6. Для сравнения эффективности работы предметных стекол с полилизиновым покрытием (Thermo Fisher Scientific, США) и предметных стекол, покрытых 0,01% водным раствором полилизина (Sigma-Aldrich, США), было пронализировано 10 прототипов ДНК-микрочипа, каждый из которых содержал 10 спотов.
7. Для оценки эффективности использования блокирующего буфера с целью снижения фонового свечения было проанализировано 10 прототипов ДНК-микрочипа после гибридизации без блокирующего буфера и 10 прототипов ДНК-микрочипа после гибридизации с блокирующим буфером 10Х aCGH blocking buffer (Agilent Technologies, США).
Оптимальными для проведения способа являются следующие технические параметры: концентрация ДНК-зонда 100 нг/мкл, облучение ультрафиолетом в течение 10 мин на расстоянии 5 см от бактерицидного облучателя (тип ОБНП 1×15-01, 220 В, 50 Гц, 75 Вт, поверхностная плотность потока на расстоянии 1 м: 0,3 Вт/м2) (Генерис, Россия), температурная обработка при 80°С в течение 2 часов, расворитель для ДНК-зонда - ТЕ (1 мМ Трис-HCl с рН 8.0, ЭДТА 0,1 мМ, NaN3 0,01%, Твин 20 0,05%), регидратация ДНК-зондов на стеклянной подложке проводится в течение 15 сек над водяной баней при температуре воды 75°С, полилизиновое покрытие на стеклянной подлодке фирмы Thermo Fisher Scientific (США), использование 10Х aCGH blocking buffer (Agilent Technologies, США) при проведении гибидизации.
Краткое описание чертежей.
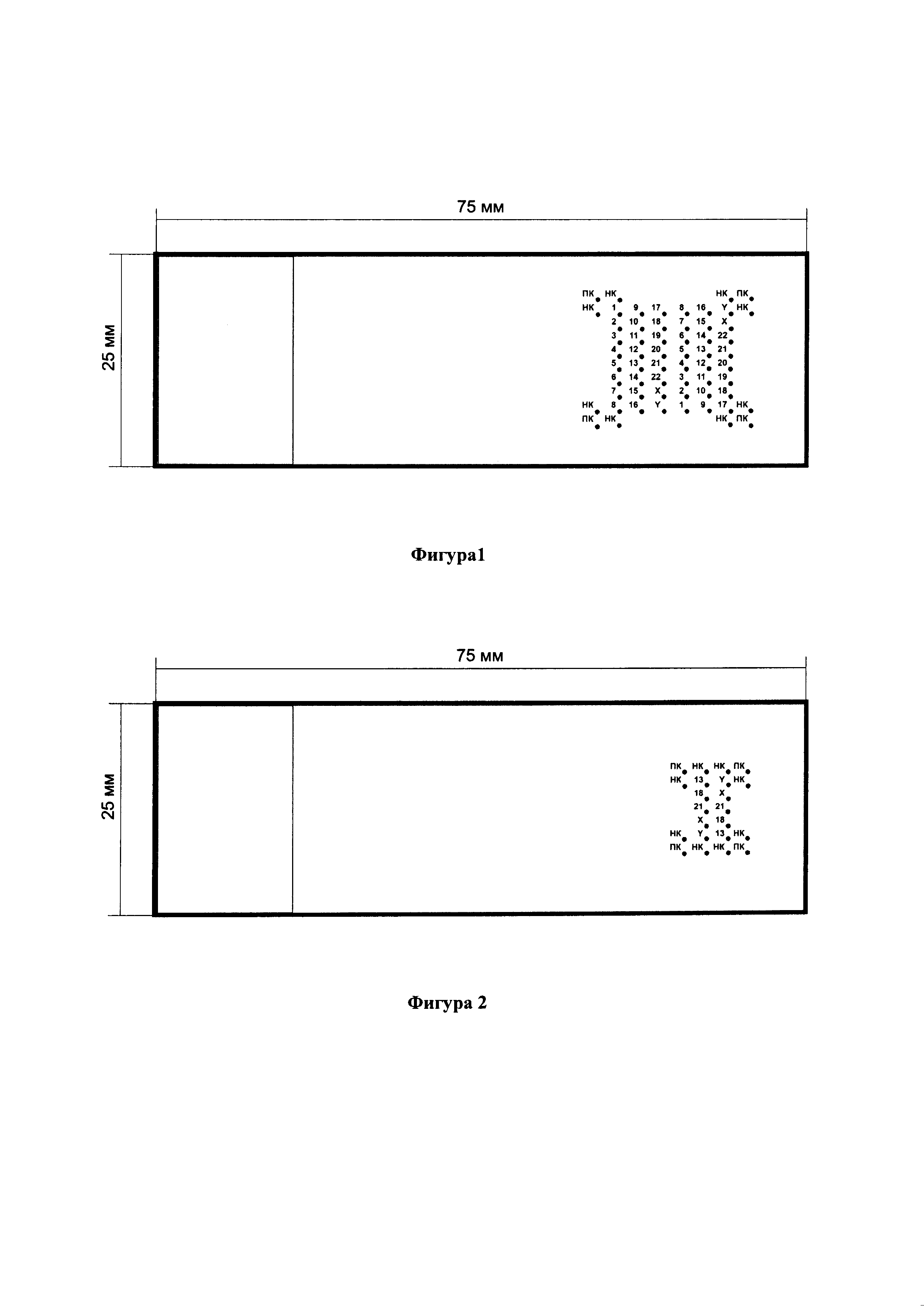
На Фиг. 1 представлена схема расположения ДНК-зондов на ДНК-микрочипе, предназначенном для проведения постнатальной генетической диагностики который включает 24 полнохромосомных ДНК-зонда на все хромосомы человека (в двух повторностях), а также позитивный (ПК - геномная ДНК человека) и два негативных контроля (НК1 - ДНК фага λ, НК2 - геномная ДНК дрожжей) на углах массива спотов. Цифрами и буквами обозначены номера и названия хромосом. ПК, НК1 и НК2 - позитивный и негативные контроли, соответственно.
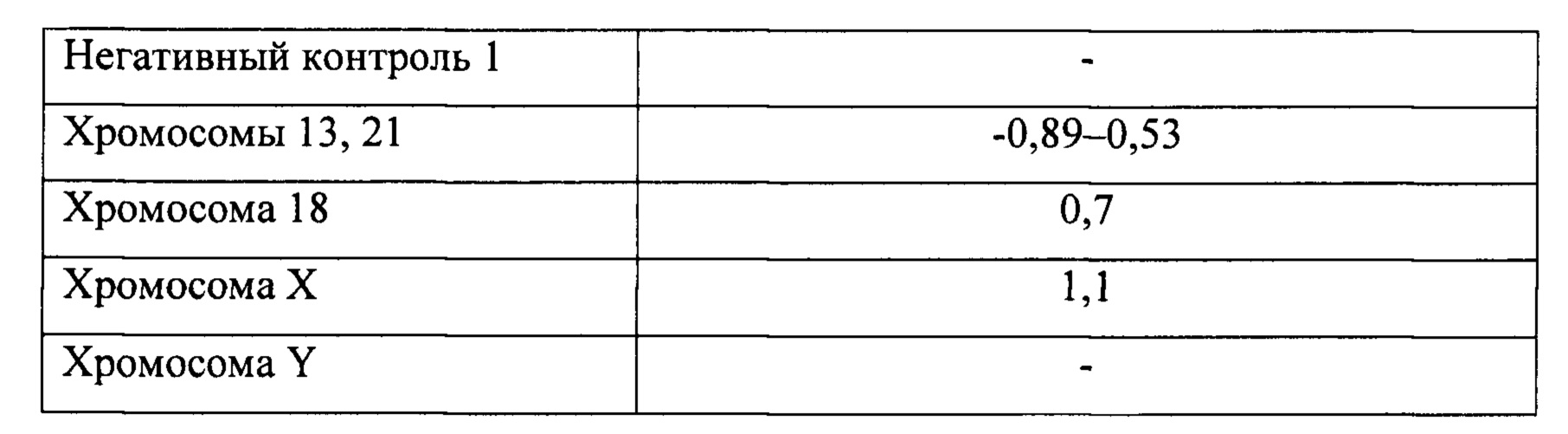
На Фиг. 2 представлена возможная схема расположения ДНК-зондов на ДНК-микрочипе, предназначенном для пренатальной генетической диагностики, который включает 5 полнохромосомных ДНК-зондов на хромосомы 13, 18, 21, X и Y (в двух повторностях), а также позитивный (ПК - геномная ДНК человека) и два негативных контроля (НК1 - ДНК фага λ, НК2 - геномная ДНК дрожжей) на углах массива спотов. Цифрами и буквами обозначены номера и названия хромосом. ПК, НК1 и НК2 - позитивный и негативные контроли, соответственно.
Таким образом, разработанные ДНК-микрочип и технология его использования имеет ряд преимуществ по сравнению с известным аналогом. ДНК-микрочип на основе полнохромосомных ДНК-зондов имеет низкое разрешение, равное целой хромосоме. В результате чего ДНК-микрочип позволяет получить однозначные результаты, что снижает требования к квалификации персонала, который будет работать с данным ДНК-микрочипом. Для анализа результатов используется программное обеспечение, находящееся в открытом доступе. Значительным преимуществом использования настоящего ДНК-микрочипа является скорость анализа, что крайне актуально для проведения пренатального скрининга. ДНК-микрочип позволяет выполнять диагностику в пределах 40 часов. Предлагаемый ДНК-микрочип предъявляет минимальные требования к используемому оборудованию (адаптирован под имеющуюся в РФ приборную базу). Для сканирования ДНК-микрочипа подойдут сканеры для микрочипов (ScanRI Microarray Scanner, Perkin Elmer; ProScanArray HT, Perkin Elmer; ClearScan, BlueGnome; InnoScan, Arrayit; SureScan, Agilent), которые есть в наличии в крупных диагностических центрах практически в каждом субъекте РФ. Стоимость производства ДНК-микрочипа по сравнению с аналогом ниже, за счет меньшего количества ДНК-зондов, наносимых на ДНК-микрочип, и отсутствия необходимости использования ВАС-клонов. В состав ДНК-зондов включены позитивные и негативные контроли, которые позволяют оценить качество гибридизации.
Источники информации, принятые во внимание при составлении описания:
1. Баранов B.C., Кузнецова Т.В. Пренатальная диагностика в акушерстве: современное состояние, методы, перспективы. - СПб.: Изд-во Н-Л (ООО). - 2003.
2. ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия. Введен 01.01.1977.
3. Соколова Т.А., Котловский Ю.В., Дубынина Е.В. и др. Цитогенетическая диагностика при онкогематологических заболеваниях // Международный журнал прикладных и фундаментальных исследований. - 2012. - №. 6. - С. 26-26.
4. Чиряева О.Г., Петрова Л.И., Садик Н.А. и др. Цитогенетический анализ хориона при неразвивающейся беременности // Журнал акушерства и женских болезней. - 2007. - Т. 56. - №1.
5. Пат. 2609641, Российская Федерация, МПК C12N 15/00, С07Н 21/04. Способ анализа соматических мутаций в химерном гене BCR/ABL с использованием ОТ-ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) / Иконникова А.Ю., Наседкина Т.В., Заседателев А.С.; заявитель и патентообладатель Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук (ИМБ РАН). - 2015152196; заявл. 07.12.2015; опубл. 02.02.2017, Бюл. №4.
6. Пат. 2639513, Российская Федерация, МПК C12N 15/00. Способ выявления структурных перестроек генома опухолевых клеток (химерных генов), определяющих выбор терапии и прогноз при острых лейкозах у детей, с использованием ОТ-ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) / Иконникова А.Ю., Фесенко Д.О., Каратеева А.В., Заседателев А.С., Наседкина Т.В.; заявитель и патентообладатель Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук (ИМБ РАН). - 2016147542; заявл. 05.12.2016; опубл. 21.12.2017, Бюл. №36.
7. Пат. 2549682, Российская Федерация, МПК C12Q 1/68. Способ анализа соматических мутаций в гене PI3K с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) / Барский В.Е., Наседкина Т.В., Емельянова М.А., Абрамов И.С., Паньков С.В.; заявитель и патентообладатель Общество с ограниченной ответственностью "БИОЧИП-ИМБ". - 2013146765/10; заявл. 21.10.2013; опубл. 27.04.2015 Бюл. №12.
8. Пат. 69866, Российская Федерация, МПК C12Q 1/68. Биочип / Грановский И.Э., Белецкий И.П., Шляпникова Е.А., Шляпников Ю.М., Гаврюшкин А.В., Бирюков СВ.; Грановский И.Э., Белецкий И.П., Шляпникова Е.А., Шляпников Ю.М., Гаврюшкин А.В., Бирюков С.В. - 2007134195/22; заявл. 14.09.2007; опубл. 10.01.2008.
9. Bi W., Breman А.М., Venable S.F. et al. Rapid prenatal diagnosis using uncultured amniocytes and oligonucleotide array CGH // Prenatal Diagnosis: Published in Affiliation With the International Society for Prenatal Diagnosis. - 2008. - V. 28. - №. 10. - P. 943-949.
10. Carr D.H. Cytogenetics of human reproductive wastage // Issues and Reviews in Teratology. -1983. - №l. - P. 33-72.
11. Cheung V.G., Morley M., Aguilar F. et al. Making and reading microarrays // Nature Genet. (Suppl.). - V. 21. - №1s. - P. 15-19.
12. Edmonds D.K., Lindsay K.S., Miller J.F. et al. Early embryonic mortality in women // Fertility and sterility. - 1982. - V. 38. - №4. - P. 447-153.
13. Eiben В., Bartles I., Bahr-Porsch S. et al. Cytogenetic analysis of 750 spontaneous abortions with the direct-preparation method of chorionic villi and its implications for studying genetic causes of pregnancy wastage // Am. J. Hum. Genet. - 1990. - V. 47. - P. 656-663.
14. Hessner M.J., Meyer L., Tackes J., et al. Immobilized probe and glass surface chemistry as variables in microarray fabrication // BMC genomics. - 2004. - V. 5. - №. 1. - P. 53.
15. Lee E., Illingworth P., Wilton L. et al. The clinical effectiveness of preimplantation genetic diagnosis for aneuploidy in all 24 chromosomes (PGD-A): systematic review // Hum. Reprod. - 2014. - V. 30. - №2. - P. 473-183.
16. Lichtenbelt K.D., Knoers N., Schuring-Blom G.H. From karyotyping to array-CGH in prenatal diagnosis // Cytogenetic and genome research. - 2011. - V. 135. - №3-4 - 241-250.
17. Verlinsky Y., Tur-Kaspa I., Cieslak J. et al. Preimplantation testing for chromosomal disorders improves reproductive outcome of poor-prognosis patients // Reproductive biomedicine online. - 2005. - V. 11. - №2. - P. 219-225.
18. Patent Number 5445934, The United States of America (USA), IPC. C12Q 1/68, G01N 33/543. Array of oligonucleotides on a solid substrate / Fodor S.P.A., Pirrung M.C, Read J.L., Stryer L.; assignee Affymax Technologies N.V., Curacao, Netherlands Antilles. - 954646; filed: 30.09.1992; date of Patent: 29.08.1995.
19. Patent Number 5837832, The United States of America (USA), IPC. C07B 61/00, C07H 21/00, C12Q 1/68. Arrays of nucleic acid probes on biological chips / Chee M., Cronin M.T., Fodor S.P.A., Huang X.X., Hubbell E.A., Lipshutz R.J., Lobban P.E., Morris MD.S., Sheldon EX.; assignee Affymetrix Inc., Santa Clara, Calif. - 441887; filed: 16.05.1995; date of Patent: 17.11.1998.
20. Patent Number 7247337, The United States of America (USA), IPC. A61L 33/00, B05D 3/00. Method and apparatus for microarray fabrication / Leproust E.M., Reddy L., Perbost M.G.M; assignee Agilent Technologies, Inc. - 10322280; filed: 16.12.2002; date of Patent: 24.07.2007.
21. Patent Number 6171797, The United States of America (USA), IPC. C07H 21/02, C12Q 1/38, C07B 61/00, C07H 21/04, C12P 19/34, C07H 21/00, C40B 40/04, C40B 40/06, G01N 33/543. Methods of making polymeric arrays / Perbost M.G.M.; assignee Agilent Technologies Inc. -09421952; filed: 20.10.1999; date of Patent: 09.01.2001.
22. Patent Number 2007/0048742 Al, The United States of America (USA), IPC. CI2Q 1/6. Detection method for chromosome abnormality and microarray chip / Jason-Jongho Kang, Eun-Hee Oh, Hyun-Woong Kang, Ji-Hyun Lee, Chang-Joon Bae, Jong-Ho Lee, Seoul (KR); Jeong-Sun Seo, Seoul (KR); assignee CHRISTIE, PARKER & HALE, LLP. - 11/211,185; 23.08.2005; date of Patent: 01.03.2007.
Приложение
Фигура l. Схема расположения ДНК-зондов на ДНК-микрочипе, который включает 24 полнохромосомных ДНК-зонда на все хромосомы человека (в двух повторностях), а также позитивный (ПК - геномная ДНК человека) и два негативных контроля (НК - ДНК фага λ / геномная ДНК дрожжей) на углах массива спотов.
Фигура 2. Схема расположения ДНК-зондов на ДНК-микрочипе, который включает 5 полнохромосомных ДНК-зондов на хромосомы 13, 18, 21, X, Y (в двух повторностях), а также позитивный (ПК - геномная ДНК человека) и два негативных контроля (НК - ДНК фага λ / геномная ДНК дрожжей) на углах массива спотов.