Результат интеллектуальной деятельности: Моноклональное антитело к БТШ70
Вид РИД
Изобретение
Изобретение относится к биотехнологии и иммунологии. Представлено моноклональное антитело против неодетерминанты белка теплового шока 70 (БТШ70), которая образуется при взаимодействии БТШ70 с поверхностью цитоплазматической мембраны опухолевой клетки. Антитело может быть использовано для создания нового лекарственного препарата для тераностики опухолей.
При разработке лекарственных средств нового поколения приоритет имеют препараты для «таргетной» терапии. Наиболее интересными и перспективными объектами в этой области фармакологии являются терапевтические антитела, которые прямо взаимодействуют с молекулой-патогеном, нейтрализуя его действие. В настоящее время разработано большое количество нейтрализующих антител, которые используются для лечения аутоиммунных, инфекционных заболеваний и отдельных видов рака [Ribatti D. From the discovery of monoclonal antibodies to their therapeutic application: An historical reappraisal // Immunology Letters 2014, 161: 96-99; Shepard H.M., Phillips G.L., Thanos C., Feldmann M. Developments in therapy with monoclonal antibodies and related proteins // Clin Med (Lond). 2017; 17(3): 220-232].
Семейство белков теплового шока 70 (БТШ70) - семейство повсеместно присутствующих белков, которые выполняют функции шаперонов. БТШ70, иначе называемый БТШ1А1, представляет собой стресс-индуцируемый белок, который сверхэкспрессируется как в цитоплазме, так и на цитоплазматической мембране опухолевых, апоптотических и подвергнутых стрессу клеток, но слабо представлен (почти отсутствует) на мембране изотипических и нормальных клеток [Stangl S., Gehrmann М., Riegger J., Kuhs K., Riederer I., Sievert W., Hube K., Mocikat R., Dressel R., Kremmer E., Pockley A.G., Friedrich L., Vigh L., Skerra A., Multhoff G. Targeting membrane heat shock protein 70 (Hsp70) on tumors by cmHsp70.1 antibody // PNAS USA, 2011, 108(2): 733-738]. Считается, что увеличение уровня БТШ70 в опухолевой клетке, в том числе и на ее поверхности, является признаком агрессивности опухоли, связано с резистентностью опухоли к химио- и радиотерапии и с ее способностью к метастазированию, а также защищает опухолевые клетки от апоптотической гибели. Показано также, что экспонированые на плазматической мембране опухолевых клеток молекулы БТШ70 структурно отличаются как от свободных БТШ70, так и от связанных с мембранами нормальных клеток [Tamura Y, Tsuboi N, Sato N, Kikuchi K. 70 kDa heat shock cognate protein is a transformation-associated antigen and a possible target for the host's anti-tumor immunity // J Immunol. 1993; 151(10): 5516-5524]. Следовательно, БТШ70 на мембране опухолевой клетки может служить перспективной мишенью для диагностики и таргетной терапии рака, осуществляемых с помощью специально полученных неоэпитоп-специфических анти-БТШ70 антител, конъюгированных с цитостатиком, радионуклидом или репортерной меткой [Shevtsov М, Huile G, Multhoff G. Membrane heat shock protein 70: a theranostic target for cancer therapy // Philos Trans R Soc Lond В Biol Sci. 2017; 373(1738): 20160526].
В связи с этим, получение моноклональных антител, избирательно распознающих только детерминанты, характерные для встроенного в мембрану опухолевой клетки БТШ70, является актуальной задачей, решение которой приведет к получению уникального инструмента для тераностики опухолей [Fujita Y, Nakanishi Т, Miyamoto Y, Hiramatsu M, Mabuchi H, Miyamoto A, Shimizu A, Takubo T, Tanigawa N. Proteomics-based identification of autoantibody against heat shock protein 70 as a diagnostic marker in esophageal squamous cell carcinoma // Cancer Lett. 2008; 263(2): 280-290; Gehrmann M, Specht HM, Bayer С, Brandstetter M, Chizzali В, Duma M, Breuninger S, Hube K, Lehnerer S, van Phi V, Sage E, Schmid ТЕ, Sedelmayr M, Schilling D, Sievert W, Stangl S, Multhoff G1. Hsp70 - a biomarker for tumor detection and monitoring of outcome of radiation therapy in patients with squamous cell carcinoma of the head and neck // Radiat Oncol. 2014; 9: 131].
Известные коммерческие антитела, такие как SPA-820 (Stressgen), H553220-clone7 (BD Pharmingen), клон H5147 BRM-22 (Sigma), 0A500 поликлональный (Dako), MS-482 клон W27 (NeoMarkers), МА3-006 и MA3-009, которые связываются с нативным БТШ70, не распознают неодетерминанту этого белка, образующуюся на мембране опухолевой клетки, что не позволяет рассматривать их возможное использование в качестве лекарственных препаратов или основы для создания лекарственных форм.
Известны моноклональные антитела [RU 2380413, RU 2381271], которые связываются с БТШ70, экспонированным на поверхности клеток. Однако, эти антитела распознают как БТШ70, связанный с мембраной живых клеток, так и свободный растворимый БТШ70.
Известно моноклональное антитело cmHsp70.1 (MultiImmune, Germany), распознающее последовательность TKDNNLLGRFELSG С-концевого домена БТШ70, представленную в связанном с мембраной опухолевых клеток БТШ70 [Stangl S, Gehrmann М, Riegger J, et al. Targeting membrane heat-shock protein 70 (Hsp70) on tumors by cmHsp70.1 antibody. Proc Natl Acad Sci USA. 2010; 108(2): 733-738; ЕР1706423]. Однако оно распознает как БТШ70, связанный с мембраной опухолевых клеток, так и свободный растворимый БТШ70 [Stangl S., Gehrmann М., Riegger J., Kuhs K., Riederer I., Sievert W., Hube K., Mocikat R., Dressel R., Kremmer E., Pockley A.G., Friedrich L., Vigh L., Skerra A., Multhoff G. Targeting membrane heat shock protein 70 (Hsp70) on tumors by cmHsp70.1 antibody // PNAS USA, 2011, 108(2): 733-738].
Задачей, на решение которой направлено настоящее изобретение, является расширение арсенала моноклональных антител к БТШ70, пригодных для клинического применения в тераностике опухолей, а также создание моноклонального антитела, которое связывается с БТШ70 на поверхности цитоплазматической мембраны опухолевой клетки и обладает низкой аффинностью к свободному нативному БТШ70.
Задача решена тем, что в настоящем изобретении получено новое моноклональное антитело (MAT) 8D1, распознающее БТШ70, связанный с мембраной опухолевой клетки, при этом оно обладает слабой аффинностью к нативному (растворимому) БТШ70. Полученное антитело изотипа IgG1 связывается с опухолевыми клетками, имеет низкую аффинность к свободному растворимому БТШ70, - константа диссоциации комплекса 8D1-БТШ70 в растворе Кd=2,25⋅10-5 M, а также обладает выраженным противоопухолевым эффектом в опыте на животной модели.
Моноклональное антитело 8D1 содержит гипервариабельные участки (CDR) вариабельной области легкой цепи по SEQ ID NO: 1-3 и гипервариабельные участки вариабельной области тяжелой цепи по SEQ ID NO: 4-6. Сравнение последовательностей участков CDR с последовательностями известных антител к БТШ70 показало отсутствие гомологии с аналогичными участками известных антител.
Технология получения антитела включала в себя иммунизацию животных антигеном, представляющим собой рекомбинантный белок БТШ70, сорбированный на Octyl Si 100 Polyol 5 nm (Serva, Германия). В качестве антигенов для отбора позитивных продуцентов моноклональных антител при постановке ИФА использовали БТШ70, адсорбированный на поверхности планшетов (в этом случае антиген претерпевал конформационные изменения, сходные с иммуногеном). Для исключения продуцентов антител, распознающих нативный (растворимый) БТШ70, использовали иммуноглобулины козы к иммуноглобулинам мыши, адсорбированные на пластиковой поверхности планшетов. Далее планшеты с адсорбированными антителами инкубировали с супернатантами культивируемых клонов гибридных клеток, затем с нативным БТШ70, который детектировали поликлональными антителами кролика к БТШ70, меченых пероксидазой хрена. Позитивные клоны отбраковывали.
Полученное MAT 8D1 может быть использовано для получения химерных и гуманизированных антител и адресной доставки с их помощью метки или цитотоксических веществ к опухолевой клетке [Yabbarov N.G., Posypanova G.А., Е.A. Vorontsov Е.А., О.N. Popova О.N., and Е.S. Severin Е.S. Targeted Delivery of Doxorubicin: Drag Delivery System Based on РАМАМ Dendrimers // Biochemistry (Moscow), 2013, 78(8): 884-894].
Изобретение иллюстрируется следующими графическими материалами:
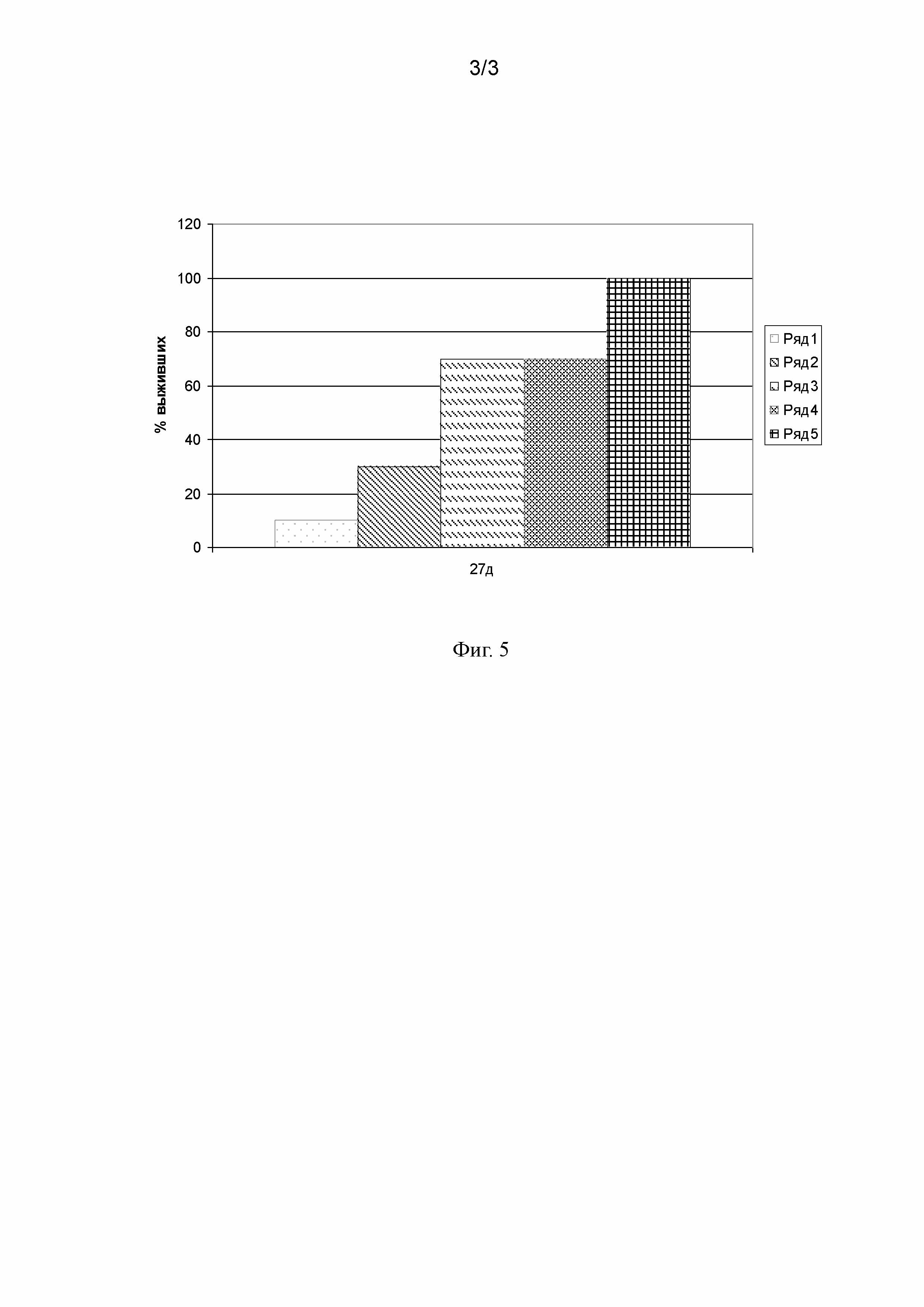
На Фиг. 1 представлена гистограмма проточной цитометрии связывания антитела 8D1 с клетками линии А549 (карцинома легкого человека). По оси абсцисс - интенсивность флюоресценции антител 8D1, меченных ФИТЦ, выраженная в условных единицах MFI, по оси ординат - число клеток.
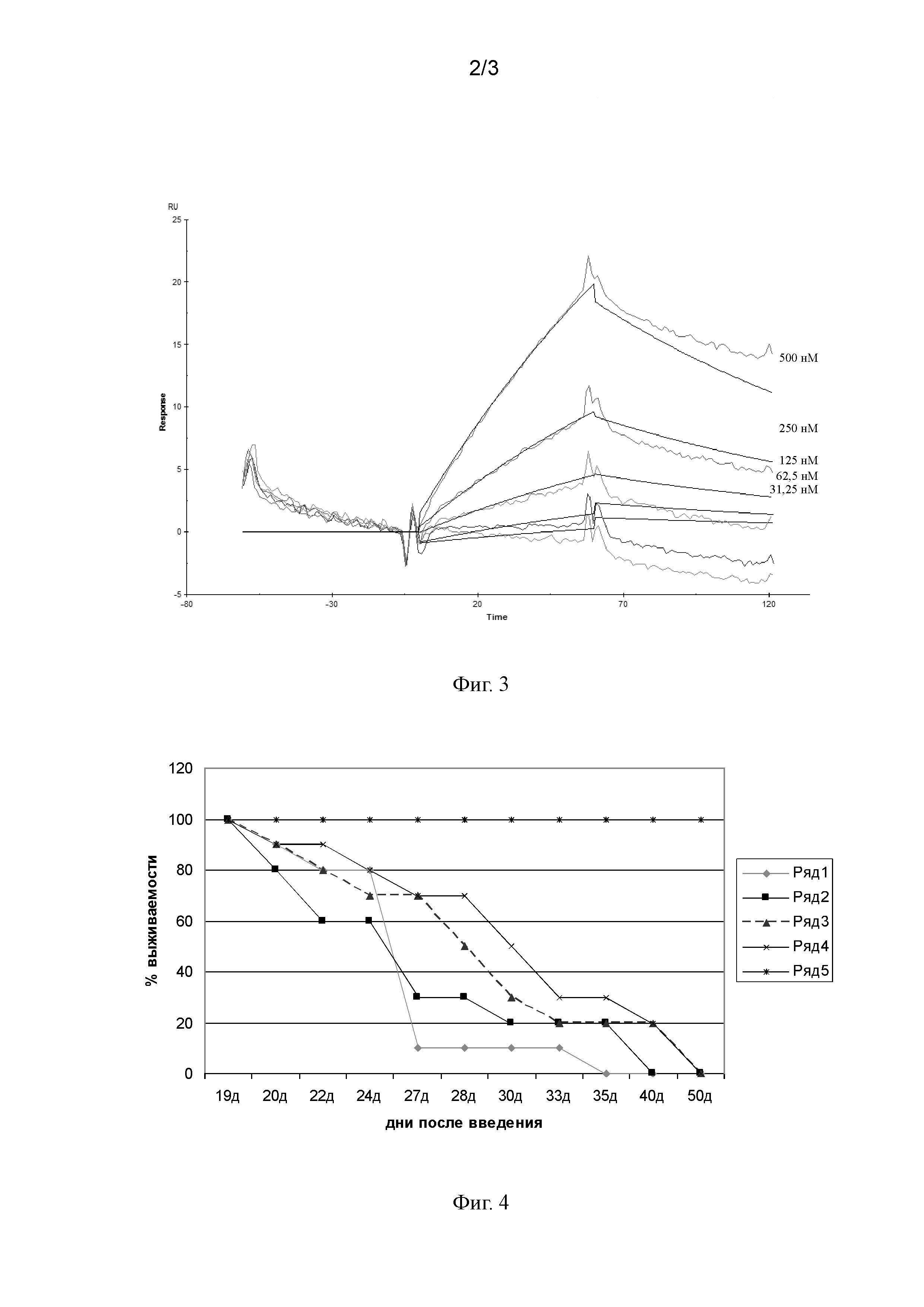
На Фиг. 2 представлена гистограмма проточной цитометрии связывания антитела 8D1 с клетками линии миеломы мыши Sp2/0. По оси абсцисс - интенсивность флюоресценции антител 8D1, меченных ФИТЦ, выраженная в условных единицах MFI, по оси ординат - число клеток.
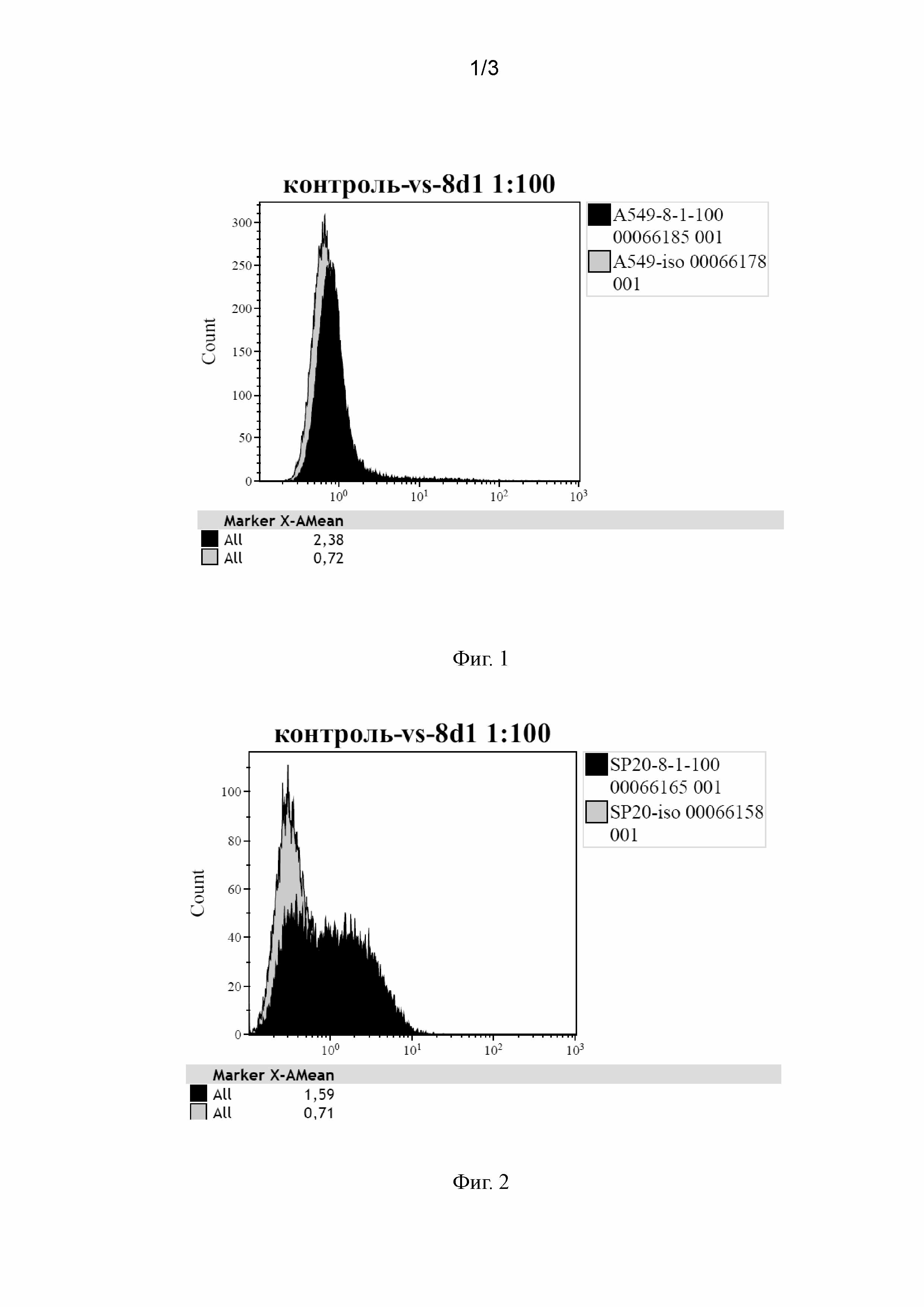
На Фиг. 3 представлены сенсограммы связывания БТШ70 в диапазоне концентрации 31,25-500 нМ с иммобилизованным на поверхности чипа СМ5 MAT 8D1. По оси абсцисс время в секундах, по оси ординат ответ (RU).
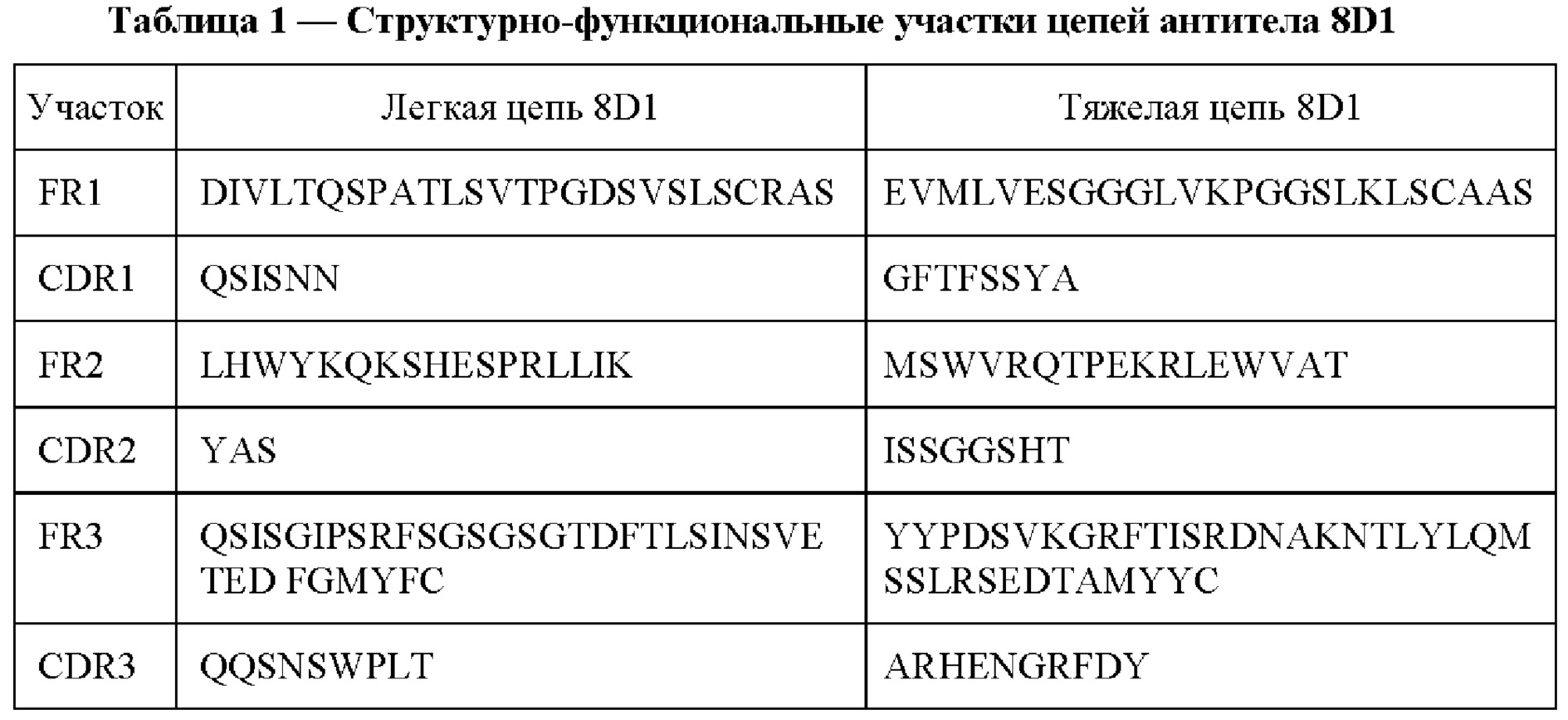
На Фиг. 4 представлены кривые выживаемости животных после прививки клеток миеломы Sp2/0 при применении MAT 8D1 в качестве терапевтического средства:
ряд 1 - мыши после введения миеломы Sp2/0
ряд 2 - мыши после введения миеломы Sp2/0 и 8D1 подкожно
ряд 3 - мыши после введения миеломы Sp2/0 и 8D1 внутрибрюшинно
ряд 4 - мыши после введения миеломы Sp2/0, опсонизированной 8D1
ряд 5 - мыши после введения 8D1
На Фиг. 5 представлена гистограмма процента выживших животных на 27-й день после прививки клеток миеломы Sp2/0 при применении MAT 8D1 в качестве терапевтического средства:
ряд 1 - мыши после введения миеломы Sp2/0
ряд 2 - мыши после введения миеломы Sp2/0 и 8D1 подкожно
ряд 3 - мыши после введения миеломы Sp2/0 и 8D1 внутрибрюшинно
ряд 4 - мыши после введения миеломы Sp2/0, опсонизированной 8D1
ряд 5 - мыши после введения 8D1
Изобретение поясняется следующими примерами.
Пример 1. Подготовка белка БТШ70.
Белок БТШ70 для иммунизации мышей сорбировали на матрицу Octyl Si100 Polyol 5 nm (Serva, Германия) для придания белку конформационной структуры, отличной от нативной в растворе.
Пример 2. Иммунизация мышей и скрининг гибридомы.
Мышей линии Balb/c иммунизировали БТШ70, модифицированным как описано в Примере 1, эмульгированным в полном адъюванте Фрейнда (ПАФ), в дозе 10 мкг на мышь в подошвенный апоневроз задних конечностей. Через 4 недели животным вводили 10 мкг этого же антигена, эмульгированного в неполном адъюванте Фрейнда (НАФ), внутрибрюшинно. На четвертый день после инъекции животных умерщвляли цервикальной дислокацией и выделяли спленоциты. Полученные клетки смешивали с клетками миеломы SP 2/0 в соотношении 1:2 и инкубировали в 50% растворе полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да в объеме 0,7 мл 1,5 мин при комнатной температуре при постоянном перемешивании на Вортексе. К полученной суспензии последовательно, порциями по 0,7 мл, с интервалом 1 мин добавляли культуральную среду RPMI-1640 до достижения конечного объема 7 мл. После слияния клетки дважды осаждали центрифугированием с заменой культуральной среды и высевали в 96-луночные культуральные планшеты 5⋅104 клеток миеломы на лунку, в которые предварительно были внесены суточные перитонеальные макрофаги (5⋅103 клеток на лунку). Селекцию гибридом проводили в среде RPMI-1640 с добавлением 20% сыворотки плодов коров, содержащей 10-4 М гипоксантина, 4⋅10-7 М аминоптерина и 1,6⋅10-5 М тимидина.
Первичный отбор позитивных клонов проводили по связыванию моноклональных антител, секретируемых гибридомами, с БТШ70 с использованием твердофазного ИФА. Для этого в лунки полистирольных планшетов для ИФА (Corning) вносили БТШ70 в концентрации 5 мкг/мл в 20 мМ боратном буфере с рН 8,0, содержащем 0,15 М NaCl и выдерживали в течение 20 часов во влажной камере для того, чтобы БТШ70 адсорбировался на пластиковой поверхности планшетов. По окончании адсорбции планшеты отмывали промывочным буфером (20 мМ боратный буфер с рН 8,0, содержащий 0,15 M NaCl и 0,05% Tween-20). Затем в каждую лунку вносили по 100 мкл промывочного буфера и по 50 мкл образцов культуральной жидкости, содержащих МАТ. Планшеты инкубировали при 37°С 1 час при перемешивании. По окончании инкубации проводили отмывку не связавшихся с антигеном антител промывочным буфером и вносили в лунки раствор конъюгированных с пероксидазой хрена иммуноглобулинов козы к иммуноглобулинам мыши (Sigma-Aldrich) согласно инструкции производителя. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА, Москва).
Для исключения клонов, продуцирующих антитела, распознающие нативный БТШ70, проводили дополнительный скрининг. С этой целью выявленные положительные клоны проверяли в эксперименте по связыванию антигена в растворе. Для этого в лунки полистирольных планшетов (Corning) вносили иммуноглобулины козы к иммуноглобулинам мыши в концентрации 5 мкг/мл в 20 мМ боратном буфере с рН 8,0, содержащем 0,15 М NaCl, выдерживали для сорбции в течение 20 часов во влажной камере. Затем в каждую лунку вносили по 100 мкл промывочного буфера и по 50 мкл образцов культуральной жидкости от клеток отобранных клонов. Планшеты инкубировали при 37°С 1 час при перемешивании. По окончании инкубации проводили отмывку не связавшихся антител промывочным буфером и вносили в лунки нативный БТШ70 в концентрации 1 мкг/мл. Планшеты инкубировали 1 час при перемешивании при 37°С. По окончании инкубации проводили отмывку не связавшегося антигена промывочным буфером и вносили в лунки конъюгированные с пероксидазой хрена кроличьи поликлональные антитела к БТШ70 в концентрации 0,1 мкг/мл. Планшеты инкубировали в течение 1 часа при 37°С и перемешивании, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА), по интенсивности окраски оценивали способность антител связывать антиген в растворе. Позитивные клоны отбраковывали. Клоны, продуцирующие антитела, которые слабо реагировали с растворенной формой БТШ70, отбирали для дальнейшего анализа константы связывания/диссоциации антител с БТШ70 методом плазмонного резонанса.
В результате проведенного скрининга и определения константы диссоциации был отобран клон 8D1, продуцирующий специфические антитела к модифицированному БТШ70, имеющие слабый аффинитет к БТШ70 в растворе. Антитела были наработаны в асцитах мышей, выделены на белок А-сефарозе и подвергнуты дальнейшим исследованиям.
Пример 3. Анализ связывания антител 8D1 с клетками опухолевых линий.
Анализ связывания антител 8D1 с клетками опухолевых линий производили методом проточной цитофлуоримерии. На Фиг. 1 и 2 представлены гистограммы связывания MAT 8D1 с БТШ70, экспрессированным на мембранах опухолевых клеток линий А549 (карцинома легкого человека) и Sp2/0 (миелома мыши), которые демонстрируют эффективность связывания антител с опухольмембрансвязанным БТШ70. Результаты, приведенные на Фиг. 1 и 2, свидетельствуют о том, что тестируемые антитела специфически связались с антигенными детерминантами на поверхности исследуемых клеток.
Пример 4. Определение константы диссоциации MAT 8D1 со свободным БТШ70 методом поверхностного плазмонного резонанса.
Были проведены измерения равновесной константы диссоциации и ассоциации антитела 8D1 со свободным рекомбинантным БТШ70 в растворе. Измерения проводили с помощью метода поверхностного плазмонного резонанса (SPR) при температуре 25°C с использованием чипов с карбоксиметилированным декстраном (СМ5) на приборе Biacore X100 с двойной проточной ячейкой (GE-Healthcare, США). Чип активировали эквимолярной смесью N-этил-N'-диметиламинопропилкарбодиимида и N-гидроксисукцинимида (0,2 М), затем со скоростью 5 мкл/мин в течение 18 мин инъецировали раствор вторичных (антивидовых) антител против IgG мыши (5 мкг/мл) в 10 мМ натрий-ацетатном буферном растворе, рН 5,0. Затем свободные группы чипа блокировали 1 М этаноламином, рН 8,5. Итоговый уровень иммобилизации вторичных (антивидовых) антител составил 4890 резонансных единиц (RU), что соответствует 4,9 нг антител на 1 мм2 поверхности чипа.
Для оценки аффинности возрастающие концентрации аналита (БТШ70) инъецировали со скоростью 10 мкл/мин над чипом после инъекции MAT 8D1 и промывки буферным раствором 150 мМ NaCl, 10 мМ Hepes-NaOH, рН 7,5, 0,05% полиоксиэтиленсорбитан (HBS-P+). Каждый эксперимент состоял из 6 стадий:
1) инъекция HBS-P+ в течение 1 мин;
2) инъекция MAT 8D1 в течение 3 мин;
3) промывка HBS-P+ в течение 2 мин;
4) инъекция БТШ70 в течение 1 мин;
5) стадия диссоциации в течение 5 мин (промывка HBS-P+ без БТШ70);
6) регенерация с помощью 3 М хлорида магния в течение 2 мин.
Часть проточной ячейки без иммобилизованных вторичных (антивидовых) антител против IgG мыши использовалась как контрольная для определения неспецифического связывания MAT 8D1 и БТШ70 с чипом (<2% от Rmax). В итоге для каждой концентрации БТШ70 контрольная кривая связывания вычиталась из соответствующей кривой связывания с иммобилизованными вторичными (антивидовыми) антителами. Равновесная константа диссоциации Kd комплекса антитела с БТШ70 определена по зависимости установившегося значения ответа (RU) от концентрации БТШ70. Полученные данные соответствовали уравнению Ленгмюра для модели одноцентрового связывания.
Полученная величина равновесной константы диссоциации комплекса антитела 8D1 со свободным рекомбинантным БТШ70 в растворе Кd была равна 2,25⋅10-5 М, что свидетельствует о низкой аффинности связывания, т.к. Kd комплексов антиген-антитело обычно характеризуются величиной порядка 10-8-10-11 М [Варфоломеев С.Д., Гуревич К.Г. Биокинетика: практический курс, ФАИР-ПРЕСС, М., 1999].
Пример 5. Определение нуклеотидной последовательности генов легкой и тяжелой цепей MAT 8D1.
Для определения аминокислотной последовательности антитела 8D1 была использована методология, которая включала выделение матричной рибонуклеиновой кислоты (мРНК) соответствующей гибридомы, получение на ее основе комплементарной дезоксирибонуклеиновой кислоты (кДНК), амплификацию фрагментов кДНК, кодирующих вариабельные участки антител, с помощью метода полимеразной цепной реакции (ПЦР), клонирование фрагментов, кодирующих вариабельные части тяжелой и легкой цепи моноклонального антитела в плазмидные векторы для банкирования и наработки плазмидной ДНК в препаративных количествах, секвенирование по Сэнгеру продуктов и анализ структуры аминокислотной последовательности антитела.
Функциональный и структурный анализ вариабельных фрагментов легкой и тяжелой цепи исследуемого антитела проводили с помощью инструмента IMGT/V-QUEST и базы данных www.imgt.org.
Анализ аминокислотных последовательностей позволил выделить структурно-функциональные элементы: опорные участки (FR) и участки, определяющие комплементарность (CDR) вариабельных частей легкой и тяжелой цепей антитела 8D1, которые приведены в таблице 1.
Пример 6. Противоопухолевое действие MAT 8D1
С целью оценки противоопухолевого действия антитела 8D1 мышам линии Balb/DBA перитонеально вводили клетки миеломы Sp2/0 из культуры в количестве 1⋅106 клеток на мышь в объеме 1 мл. Мышей после инъекции опухоли разбивали на группы по 20 животных в группе. Двум разным группам животных сразу после инъекции опухолевых клеток и далее с частотой раз в два дня вводили MAT 8D1 подкожно или внутрибрюшинно в количестве 0,5 мг/мышь в объеме 0,1 мл. Отдельной группе вводили клетки миеломы, которые предварительно были проинкубированы с MAT 8D1 (опсонизированы) из расчета 10 мг антител на 1⋅106 клеток в течение 1 часа при 37°С, этой группе антитела не вводили. Формировали также две контрольные группы, в одну из которых входили интактные животные, а другую составляли особи, которым антитело не вводилось.
Эффективность действия MAT 8D1 оценивалась по выживаемости животных. Результаты эксперимента представлены на Фиг. 4 и 5. На 10-12 день у животных начинали визуально наблюдаться и пальпироваться узелки солидных опухолей в месте инъекции, а также и по всей перитонеальной полости. На 19-20 день погибли первые животные. С 24 по 27 день происходил массовый падеж животных с введенной миеломой без лечения. На 27-й день опыта при подкожном введении MAT 8D1 выживаемость возросла в 3 раза, при внутрибрюшинном - в 7 раз, общий срок жизни мышей увеличился на 5 и 15 дней соответственно.
Полученные данные свидетельствуют о том, что MAT 8D1 обладают выраженным противоопухолевым эффектом, который может объясняться тем, что образованный комплекс «8D1 - опухолевая клетка» может быть подвергнут атаке комплементом сыворотки, с последующей гибелью клетки.
Заявитель просит рассмотреть представленные материалы заявки «Моноклональное антитело к БТШ70» на предмет выдачи патента РФ на изобретение.