Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ТЕТРАОКСИДА ДИАЗОТА
Вид РИД
Изобретение
Изобретение относится к технологии неорганических веществ, а именно - к технологии получения жидкого тетраоксида диазота (N2O4), который широко применяется в химической промышленности для получения нитритов, нитратов, в малотоннажных производствах органических и неорганических веществ, а также в ракетной технике в качестве окислителя ракетного горючего. Предлагаемый способ предполагает получение тетраоксида диазота из азотной кислоты.
Тетраоксид диазота (азотный тетраоксид, AT, амил) - сжиженный диоксид азота, состоящий преимущественно из димера N2O4. Температура кипения при атмосферном давлении +21,15°С, кристаллизации -11°С. Диоксид азота практически мгновенно димеризуется, образуя равновесную смесь с тетраоксидом диазота [Encyclopedia of chemical technology, vol. 15, p. 858, 3-Edition]:
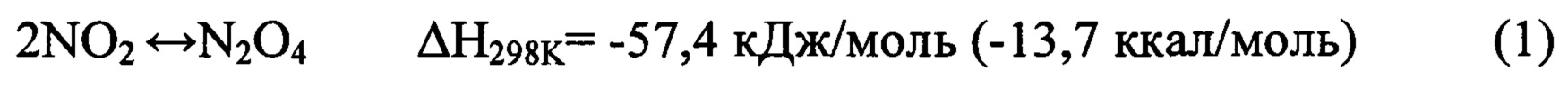
В нормальных условиях тетраоксид диазота (ТДА) находится в равновесии с диоксидом азота, при нагревании полностью диссоциирует до диоксида азота.
Состав смеси зависит от температуры и давления. С увеличением температуры равновесие смещается в сторону диоксида азота - вещество окрашивается в бурый цвет. При 140°С ТДА практически полностью диссоциирует:
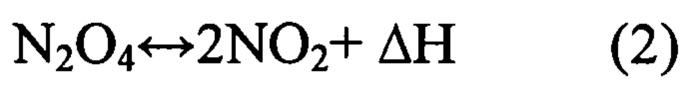
При увеличении давления при постоянной температуре степень диссоциации N2O4 уменьшается. При нормальном давлении и температуре 40°С в равновесной смеси содержание NO2 составляет около 31%.
Смесь в жидком состоянии в основном состоит из димера N2O4, а охлажденная до температуры от минус 11°С и ниже представляет собой практически чистый димер [https://dic.academic.ru/dic.nsf/ruwiki/1193706].
Способ получения тетраоксида диазота описан в монографии [Ю.В. Карякин, И.И. Ангелов. Чистые химические вещества. М.: изд. Химия, 1974]. Это лабораторный способ получения ТДА термическим разложением сухого кристаллического нитрата свинца при температуре свыше 270°C с последующим охлаждением и конденсацией ТДА. Данный способ позволяет получать жидкий ТДА в количествах от сотен грамм до нескольких десятков килограммов. Использование термического разложения нитрата свинца в промышленных масштабах по экономическим и экологическим причинам не целесообразно. По этому способу на тонну ТДА образуется более 2,5 т токсичных свинцовых отходов.
В промышленных масштабах ТДА является промежуточным продуктом производства азотной кислоты в многоступенчатом технологическом процессе каталитического окисления аммиака воздухом. Для обеспечения потребностей ракетно-космической отрасли ТДА извлекают из технологических потоков производства азотной кислоты. Технологический процесс описан в технической литературе [Справочник азотчика под редакцией Е.Я. Мельникова, изд. 2, М.: изд. Химия, 1987] и состоит из следующих стадий:
1. Каталитическое окисление аммиака воздухом на платиновых катализаторах при температуре 850-920°C с образованием нитрозных газов, содержащих 10-11% (об.) смесь оксида азота (NO) с диоксидом азота (NO2), 33-35% (об.) паров воды и 54-57% (об.) азота.
2. Трехступенчатое охлаждение нитрозных газов от 920°С до 30°С в специальных теплообменных устройствах, включая котел-утилизатор.
3. Сепарация жидкой реакционной воды, образовавшейся при окислении аммиака, из охлажденного потока нитрозных газов с последующим отводом ее в виде разбавленной азотной кислоты, образующейся вследствие взаимодействия диоксида азота с охлажденной жидкой водой.
4. Окисление воздухом оксида азота, содержащегося в нитрозных газах, до образования диоксида азота и концентрированной (сверхазеатропной) азотной кислоты.
5. Абсорбция диоксида азота азотной кислотой из нитрозных газов с получением нитроолеума - раствора ТДА в азотной кислоте.
5 Ректификационное разделение нитроолеума с получением азотной кислоты и ТДА-сырца.
6. Ректификационная очистка ТДА с получением товарного продукта.
7. Ректификационное выделение товарной азотной кислоты.
8. Очистка отходящих газов на всех стадиях производства от оксидов азота перед их выбросом в атмосферу.
Такой промышленный процесс получения ТДА экономически обоснован при одновременном крупнотоннажном производстве азотной кислоты, ежегодный мировой объем производства которой составляет сотни миллионов тонн.
Производство ТДА для его использования в ракетной технике на основе процесса каталитического окисления аммиака имеет ряд существенных недостатков, а именно:
- использование в высокотемпературном процессе сжигания аммиака драгметаллов (платины и ее сплавов), с неизбежной потерей последних;
- многостадийность процесса и, как следствие этого, сложное аппаратурное оформление технологического процесса;
- образование больших количеств азотной кислоты - 2,35-2,50 т на 1 т ТДА.
В ряде патентов сообщается об усовершенствовании общепринятой в мировой технологической практике технологии получения ТДА совместно с азотной кислотой.
В патенте [Пат. Китая 103693630, МПК С01В 21/36, оп. 02.04.2014] проводят усовершенствование традиционной технологии сжигания аммиака, с использованием концентрированной серной кислоты на стадии укрепления разбавленной азотной кислоты с выделением ТДА. Недостатком является то, что к вышеуказанным недостаткам традиционной технологии добавляется образование отхода в виде разбавленной серной кислоты, для обезвоживания которой требуется большой расход энергии, что также усложняет очистку газовых выбросов от аэрозолей серной кислоты.
Сообщается [Пат. Китая 102774819, МПК С01В 21/36, оп. 14.11.2012] об оптимизации процесса абсорбционно-десорбционного выделения ТДА в традиционной технологии с использованием высокотемпературного процесса сжигания аммиака со всеми присущей этой технологии недостатками.
Известен [Пат. РФ 2547752, МПК С01В 21/36, оп. 18.12.2012] способ, принятый за прототип, включающий традиционную технологию высокотемпературного каталитического сжигания аммиака. Способ включает стадию сжатия аммиака при давлении не менее 0,4 МПа (абс.) с последующим доокислением остаточного оксида азота (NO) до диоксида азота (NO2) и с накоплением ТДА-сырца, содержащего помимо жидкой ТДА и азотную кислоту HNO3, путем охлаждения потока газовой смеси до температуры не ниже минус 10°С; стадию ректификации ТДА-сырца с регулированием флегмового числа в ректификационной колонне в пределах 1..2; стадию промывки в контактном противотоке хвостовых газов с неконцентрированной азотной кислотой и укреплением последней до 50-58%; стадию укрепления вводимой неконцентрированной кислоты с концентрацией 50-58% в колонне укрепления кислоты до сверхазеотропной 80-85%-ной азотной кислоты путем накопления в средней зоне мультислоя жидкости избытка ТДА по сравнению со стехиометрическим соотношением, необходимым для прохождения реакции кислотообразования противоточным взаимодействием массовых потоков, с подачей кислорода в нижнюю зону, введения в среднюю зону мультислоя жидкости смеси ТДА с концентрированной азотной кислотой, поддержания давления от 0,7 до 0,9 МПа (абс.) и трех уровней температур в трех зонах по высоте колонны; охлаждение потока газовой смеси, содержащей очищенные диоксид азота (NO2) и ТДА от паров азотной кислоты, до температуры не ниже минус 10°С, обеспечивающей конденсацию паров ТДА и димеризацию газообразного диоксида азота (NO2) в жидкий ТДА.
Однако при этом сохраняются основные недостатки технологии получения ТДА, а именно:
- использование высокотемпературного процесса сжигания аммиака;
- использование драгметаллов (платины и ее сплавов) с их неизбежной потерей;
- многостадийность процесса и, как следствие этого, сложное аппаратурное оформление технологического процесса в целом;
- образование больших количеств разбавленной и концентрированной азотной кислоты. Этот известный способ включает охлаждение потока газовой смеси, содержащей очищенные диоксид азота (NO2) и тетраоксид диазота от паров азотной кислоты, до температуры не ниже минус 10°С, обеспечивающей конденсацию паров тетраоксида диазота (N2O4) и димеризацию газообразного диоксида азота (NO2) в жидкий тетраоксид диазота (N2O4).
Целью предлагаемого изобретения является разработка безотходного способа производства тетраоксида диазота из азотной кислоты со значительным сокращением стадий производства, и как следствие этого - упрощение аппаратурного оформления процесса, позволяющее исключить значительную часть дорогостоящего оборудования.
Технический результат при использовании предлагаемого способа - возможность осуществления разложения водных растворов азотной кислоты в широком интервале концентраций (от 55% до 99%) и выделение ТДА из продуктов разложения азотной кислоты. Способ позволяет упростить технологию и снизить энергозатраты на ее проведение за счет сокращения стадий процесса.
Сущность изобретения состоит в том, что разработан способ получения тетраоксида диазота из азотной кислоты путем ее термического разложения с последующим разделением тетраоксида диазота и азотной кислоты, с охлаждением, конденсацией и ректификационной очисткой тетраксида диазота, отличающийся тем, что водный раствор азотной кислоты с концентрацией 55-99% в течение 0,2-1,5 с, подвергают термическому разложению при температуре 250-350°С, затем продукты разложения подвергают охлаждению со скоростью 180-250°С/с, выделяют тетраоксид диазота, а образующуюся азотную кислоту возвращают в цикл.
Термическое разложение азотной кислоты проводят предпочтительно при температуре 300°С, а время пребывания в реакторе термического разложения предпочтительно 1,0 с. Скорость охлаждения парогазовых продуктов разложения HNO3 в скоростном холодильнике предпочтительно 200°С/с.
Процесс получения ТДА по предлагаемому способу состоит из следующих стадий:
1 Испарение 55-99% азотной кислоты и разложение ее паров в проточном реакторе при температуре от 250 до 350°С, предпочтительно при 300°С.
2 Охлаждение газообразных продуктов разложения (паров воды, оксидов азота и кислорода) в высокоскоростном теплообменнике (холодильнике) со скоростью 180-250°С/с, с конденсацией паров воды до температуры не ниже 45°С, с сохранением оксидов азота и кислорода в газовой фазе.
3 Отделение жидкой воды от газовой фазы, содержащей смесь диоксида азота и пары ТДА.
4 Конденсация смеси оксидов азота путем их охлаждения при температуре от минус 5°С до минус 9°C с получением ТДА - сырца.
5 Ректификационная очистка ТДА с получением товарного ТДА.
6 Абсорбционная очистка от оксидов азота отходящих газов перед их выбросом в атмосферу.
7 Ректификационное укрепление разбавленных растворов азотной кислоты, образующихся на всех стадиях производства, с последующим возвратом азотной кислоты на стадию разложения.
Особенностью проведения процесса предлагаемого способа является то, что охлаждение газообразных продуктов разложения (паров воды, оксидов азота и кислорода) проводят в высокоскоростном теплообменнике со скоростью 200°С/с.
В предлагаемом способе образуются:
- на стадии 1 парогазовая смесь, содержащая пары воды, оксид азота (II) и кислород,
- на стадии 2:
• в жидкой фазе: 3-20% раствор азотной кислоты, который после ректификационного укрепления до 65% направляется в начало процесса - на 1 стадию;
• в газовой фазе: оксид азота, диоксид азота и пары ТДА, образующиеся в результате процесса окисления остаточным кислородом при охлаждении парогазовой смеси.
- на стадии 4 - жидкий ТДА - сырец, сконденсировавшийся в результате охлаждения потока на 2 стадии и содержащий 5-10% азотной кислоты;
- на стадии 5 - очищенный товарный ТДА, образующийся при ректификации ТДА-сырца;
- на стадии 6 - очищенные газовые выбросы от всех аппаратов производства, содержащие пары воды, остаточный кислород и оксиды азота с концентрацией на срезе трубы не более 80 мг/м3. Очистка газовых выбросов осуществляется абсорбцией оксидов азота в абсорбционной колонне, орошаемой водой.
- на стадии 7 - азеотропная (67%) азотная кислота, которая возвращается на 1 стадию производства.
Основными преимуществами предлагаемого способа, по сравнению с известными, являются: отсутствие выбросов загрязненных отходящих газов и сброса сточных вод, загрязняющих природную среду, а так же исключение из технологического процесса получения ТДА следующих технологических стадий и соответствующего им оборудования:
- хранение и использование аммиака, включая систему его дозирования;
- окисление аммиака в каталитическом реакторе с использованием платины и ее сплавов;
- утилизация тепла из высокотемпературного потока нитрозных газов в котлах-утилизаторах;
- сорбция оксидов азота концентрированной азотной кислоты для абсорбционно-десорбционного выделения тетраоксида диазота из нитрозных газов;
- получение азотной кислоты в качестве товарного продукта.
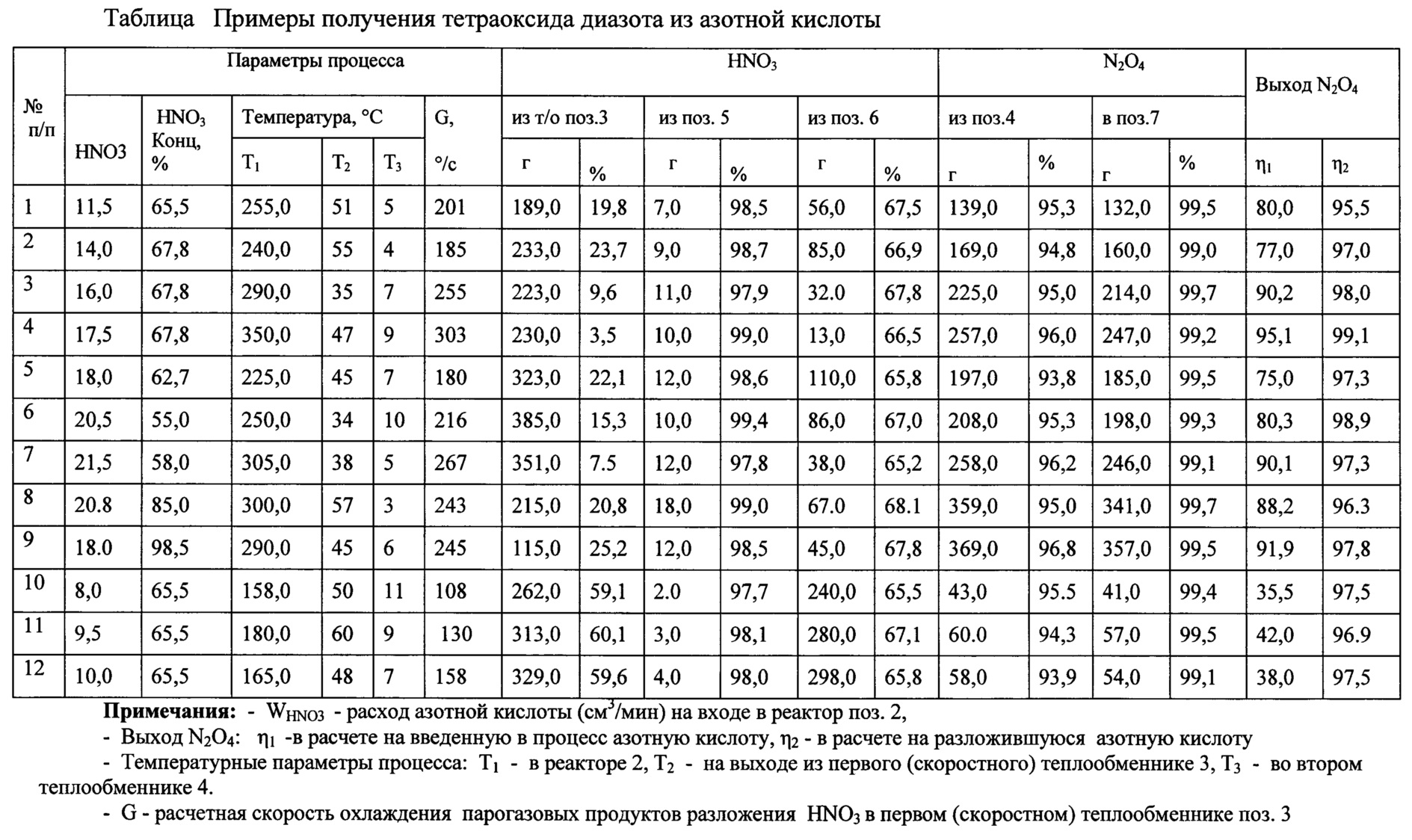
Общая схема способа получения представлена на чертеже, где
поз. 1 - расходная емкость
поз. 2 - проточный реактор
поз. 3 - теплообменник,
поз. 4 - сепаратор,
поз. 5 - холодильник,
поз. 6 - приемная емкость,
поз. 7- колонна ректификационная для ТДА-сырца,
поз. 8 - приемная емкость для чистого ТДА,
поз. 9 - ректификационная колонна для азеотропной азотной кислоты,
Процесс проводят следующим образом:
В проточный реактор поз. 2 непрерывно подают 12-20 мл/мин (17-28 г/мин) 65% азотной кислоты из расходной емкости поз. 1. Реактор 2 выполнен в виде спиральной стальной трубки диаметром 14 мм (dвнутр. - 10 мм) и длиной 3250 мм, диаметр витка 150 мм, число витков - 7. В реакторе 2 поддерживается температура с помощью электронагревателя мощностью N=1 квт, размещенного по внешней поверхности реактора. В реакторе 2 при 250-350°С происходит испарение и разложение азотной кислоты с образованием оксидов азота, кислорода и паров воды. Время пребывания в реакторе 2 составляет 0,2-1,5 с. Продукты термического разложения азотной кислоты из реактора 2 направляются в высокоскоростной теплообменник поз. 3, в котором реакционные пары и газы охлаждаются водой до 45°С со скоростью 180-250°С/с.
В теплообменнике 3 конденсируется вода и разбавленная азотная кислота, а оксиды азота и кислород остаются в газовой фазе.
Теплообменник 3 изготовлен из стальной трубки диаметром 10 мм, длиной 2 метра в виде змеевика, диаметр витка змеевика 100 мм, число витков - 6. Теплообменник 3 помещен в цилиндрический кожух, охлаждаемый изнутри водой.
Образующаяся в результате охлаждения газо-жидкостная смесь разделяется в сепараторе поз. 4. Жидкая фаза - вода и разбавленная азотная кислота - собирается в нижней части сепаратора, а газообразные продукты реакции - оксиды азота направляются в холодильник поз. 5, охлаждаемый хладоагентом до минус 5-10°С.
При этой температуре происходит конденсация паров с образованием жидкого тетраоксида диазота, который содержит 5-8% азотной кислоты.
ТДА собирают в емкости поз. 6 и далее направляют на очистку в ректификационную колонну поз. 7.
Чистый жидкий тетраоксид диазота собирают в емкости поз. 8. Концентрированную азотную кислоту из кубовой части колонны поз. 7 направляют в начало процесса через сборник поз. 1.
Разбавленную азотную кислоту из высокоскоростного теплообменника 3, собранную в сепараторе 4, периодически направляют на укрепление в ректификационную колонну поз. 9. В кубовой части колоны получают азеотропную (65-67%) азотную кислоту, направляемую в начало процесса через сборник поз. 1. Время цикла в опытах - 0,5 часа.
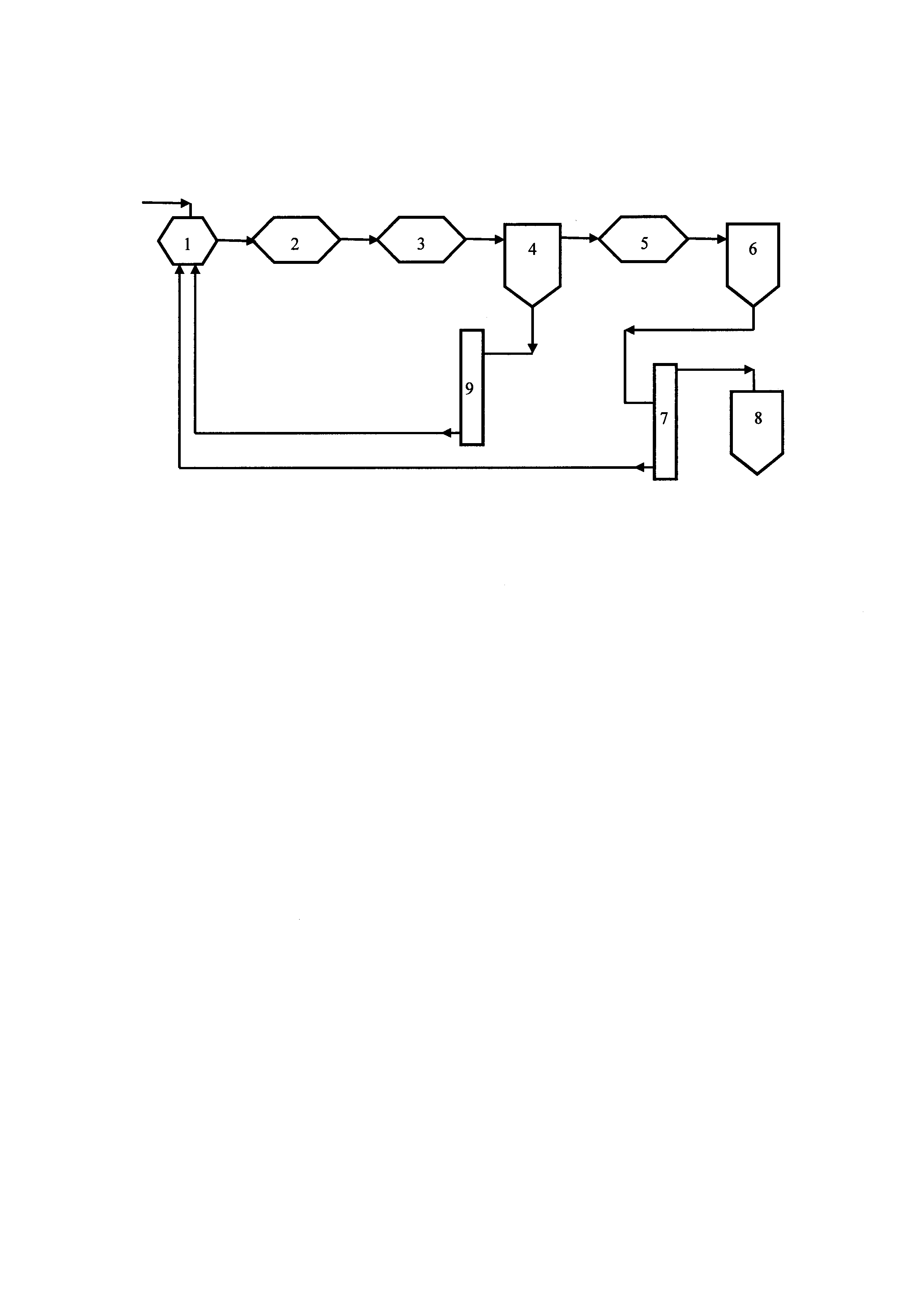
Результаты опытов термического разложения азотной кислоты, представленные в таблице, показывают, что тетраоксид диазота может быть получен с суммарным выходом 95-99% при термическом разложении водных растворов азотной кислоты концентрацией 55-98,5% в интервале температур 250°С-350°С, с последующей ступенчатой конденсацией газообразных продуктов реакции - паров воды, азотной кислоты и оксидов азота. Температура продуктов реакции на выходе из скоростного теплообменника 3 (первой ступени конденсации), в котором происходит конденсация воды и непрореагировавшей азотной кислоты, должна быть не менее 45°С.
Конденсация тетраоксида диазота происходит во второй ступени охлаждения в холодильнике 5 при температуре не ниже минус 10°С, дальнейшее снижение температуры может привести к нежелательной кристаллизации ТДА.
Разработанный способ получения ТДА позволяет возвращать в начало процесса непрореагировавшую или вновь образующуюся азотную кислоту после ее укрепления известным способом.
В таблице приведены два значения выхода ТДА: η1 - выход ТДА за один проход без учета возврата азотной кислоты в цикл, η2 - выход ТДА с учетом возврата азотной кислоты в цикл, который достигает уровня 95-99%. Существенными параметрами процесса, определяющими оптимальный выход ТДА за один проход (η1), являются температура в реакторе и скорость охлаждения горячих продуктов реакции в скоростном теплообменнике. При температуре в реакторе 250-350°С и скорости охлаждения газов в скоростном теплообменнике 180-250°С/с выход ТДА составляет 95-99%.