Результат интеллектуальной деятельности: БИСПЕЦИФИЧНЫЕ МОЛЕКУЛЫ, ИММУНОРЕАКТИВНЫЕ С ИММУННЫМИ ЭФФЕКТОРНЫМИ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ АКТИВИРУЮЩИЙ РЕЦЕПТОР
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки:
[0001] По настоящей заявке испрашивается приоритет заявки на патент США № 61/783195 (от 14 марта 2013 г., на рассмотрении), которая включена в настоящее описание ссылкой в полном объеме.
Ссылка на список последовательностей:
[0002] Заявка включает один или более списков последовательностей согласно 37 C.F.R. 1.821 et seq., которые раскрыты как в бумажном формате, так и на машинно-читаемом носителе, и эти бумажные и машинно-читаемые форматы включены в настоящее описание ссылкой в полном объеме.
Уровень техники:
Область техники:
[0003] Настоящее изобретение относится к биспецифичным молекулам, которые способны к локализации иммунной эффекторной клетки, которая экспрессирует активирующий рецептор для вирусно-инфицированной клетки, с тем, чтобы посредством этого облегчить уничтожение вирусно-инфицированной клетки. В предпочтительном варианте осуществления, такая локализация осуществляется с использованием биспецифичных молекул, которые иммунореактивны как к активирующему рецептору иммунной эффекторной клетки, так и к эпитопу антигена, экспрессированного с помощью клетки, инфицированной вирусом. Настоящее изобретение дополнительно относится к применению таких биспецифичных молекул в лечении латентных вирусных инфекций, стойких вирусных инфекций и неактивных вирусных инфекций, и к применению таких биспецифичных молекул в способах уничтожения клеток, содержащих вирусный геном, или клеток, экспрессирующих вирусный белок. Изобретение конкретно относится к биспецифичным молекулам, которые связываются с (1) эпитопом активирующего рецептора иммунной эффекторной клетки (2) с эпитопом антигена, экспрессированного с помощью клетки, инфицированной вирусом, где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичных молекул, и к таким биспецифичным молекулами, которые способны опосредовать и, более предпочтительно, усиливать активацию и направленное воздействие иммунных эффекторных клеток на клетку, инфицированную вирусом, так что активированные иммунные эффекторные клетки уничтожают клетку, инфицированную вирусом.
Описание родственного уровня техники
I. Вирусные инфекционные заболевания
[0004] В последние несколько десятилетий наблюдается возрождение интереса к терапевтическому потенциалу антител, и антитела стали одним из лидирующих классов лекарственных средств, полученных биотехнологически (Chan, C.E. et al. (2009) “The Use Of Antibodies In The Treatment Of Infectious Diseases,” Singapore Med. J. 50(7):663-666). Почти 200 лекарственных средств на основе антител были апробированы для применения или находятся на стадии разработки.
[0005] Такие лекарственные средства дают конкретное обещание для лечения инфекционных заболеваний и, наиболее существенно, для лечения вирусных инфекционных заболеваний. Многие патогены продемонстрировали заметную способность приобретать устойчивость к соответствующим противомикробным лекарственным средствам (например, метициллин-устойчивые Staphylococcus aureus, устойчивые к сильнодействующим лекарственным средствам Mycobacterium tuberculosis и устойчивые к противомикробным средствам Plasmodium falciparum). Другие патогены, такие как HIV, вирус гриппа etc. в настоящее время не могут быть удовлетворительно излечимы с использованием обычных лекарственных средств (см., Beigel, J. et al. (2008) “Current And Future Antiviral Therapy Of Severe Seasonal And Avian Influenza,” Antiviral Res. 78(1):91-102). Кроме того, такие лекарственные средства демонстрируют значительные побочные эффекты. В отличие от обычных лекарственных средств, антитела обладают двумя свойствами, которые делают их очень привлекательными в качестве терапевтических агентов. Во-первых, так как антитела представляют собой эндогенные белки, нативные для организма, то они демонстрируют низкую токсичность. Во-вторых, они демонстрируют высокую специфичность, которая дает возможность направленного воздействия на инфицированные клетки.
[0006] Однако настоящая иммунотерапия обладает некоторыми недостатками (Chan, C.E. et al. (2009) “The Use Of Antibodies In The Treatment Of Infectious Diseases,” Singapore Med. J. 50(7):663-666). Клиренс вирусной инфекции обычно ассоциирован с адаптивным иммунитетом, опосредованным Т-клетками. CD8+ T-клетки действуют путем уничтожения вирусно-инфицированных клеток, предотвращая таким образом вирусную репликацию и уменьшая вирусную нагрузку. Кроме того, антитела могут стимулировать уничтожение инфицированных клеток, экспрессирующих вирусные белки на своей поверхности посредством активации натуральных киллерных (NK) клеток, которые опосредуют ADCC, дополнительно к их свойствам вирусной нейтрализации. Хотя было продемонстрировано, что антитела способны нейтрализовать множество вирусных патогенов in vitro, степень, до которой антитело-опосредованный иммунитет может достигать клиренса вируса in vivo, остается неясной. Таким образом, нейтрализующие терапевтические антитела, как правило, вводятся не для опосредования клиренса, а для подавления вирусной репликации и виремии, и дают иммунной системе хозяина время для развития эффективного ответа для клиренса вируса. В этом отношении, исследования показали, что способность антител уменьшать вирусную нагрузку коррелирует с устойчивостью вводимого антитела в сыворотке, и что уровень вирусного антигена в итоге восстанавливается после того, как уровень антитела в сыворотке снижается после прекращения терапии (Galun, E. et al. (2002) “Clinical Evaluation (Phase I) Of A Combination Of Two Human Monoclonal Antibodies To HBV: Safety And Antiviral Properties,” Hepatology 35:673-679; Heijtink, R.A. et al. (2001) “Administration Of A Human Monoclonal Antibody (TUVIRUMAB) To Chronic Hepatitis B Patients Pre-Treated With Lamivudine: Monitoring Of Serum TUVIRUMAB In Immune Complexes,” J. Med. Virol. 64:427-434). Кроме того, исследования с использованием HIV показали, что регулярное введение терапевтических антител может приводить к развитию ускользающих мутантов (Chan, C.E. et al. (2009) “The Use Of Antibodies In The Treatment Of Infectious Diseases,” Singapore Med. J. 50(7):663-666). В одном исследовании комбинация трех нейтрализующих HIV антител широкого профиля, вводимая в течение периода в 12 недель, достигла замедления вирусной отдачи после прекращения противовирусного лечения относительно контроля. Однако уровень вируса в итоге восстановился, не смотря на продолжительное введение трех антител, с повышенной устойчивостью к одному из трех вводимых антител (Trkola, A. et al. (2005) “Delay Of HIV-1 Rebound After Cessation Of Antiretroviral Therapy Through Passive Transfer Of Human Neutralizing Antibodies,” Nat. Med. 11:615-622).
II. Активация иммунной системы
[0007] CD4+ T-лимфоциты - основные организаторы большинства иммунных и аутоиммунных ответов млекопитающих (Dong, C. et al. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1):39-48). Было обнаружено, что активация CD4+ хелперных T-клеток опосредована через ко-стимулирующие взаимодействия между Антиген-Презентирующими Клетками и наивными CD4+ T-лимфоцитами. Требуются два взаимодействия (Viglietta, V. et al. (2007) “Modulating Co-Stimulation,” Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) “Checkpoint Blockade in Cancer Immunotherapy,” Adv. Immunol. 90:297-339). В первом взаимодействии Антиген-презентирующая Клетка должна презентировать соответствующий антиген-мишень, связанный с главным комплексом гистосовместимости клетки, так чтобы он мог связываться с T-клеточным Рецептором (“TCR”) наивного CD4+ T-лимфоцита. Во втором взаимодействии лиганд Антиген-презентирующей Клетки должен связываться с CD28-рецептором CD4+ T-лимфоцита (Dong, C. et al. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1):39-48; Lindley, P.S. et al. (2009) “The Clinical Utility Of Inhibiting CD28-Mediated Costimulation,” Immunol. Rev. 229:307-321). CD4+ хелперные T-клетки, испытавшие оба стимулирующих сигнала, затем способны отвечать на цитокины (такие как интерлейкин-2 и интерлейкин-12) для развития в Th1-клетки. Такие клетки продуцируют интерферон-гамма (IFN-γ) и фактор некроза опухоли альфа (TNF-α), которые опосредуют воспалительные ответы на клетки-мишени, экспрессирующие антиген-мишень. Также происходит B-клеточная активация и пролиферация, приводящая к продуцированию антитела, специфичного к антигену-мишени (Bernard, A. et al. (2005) “T and B Cell Cooperation: A Dance of Life and Death,” Transplantation 79:S8-S11). В отсутствии обоих ко-стимулирующих сигналов во время вовлечения TCR, T-клетки вступают в функциональное состояние неотвечаемости в отношении клональной толерантности (Khawli, L.A. et al. (2008) “Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors,” Exper. Pharmacol. 181:291-328). В патологических состояниях Th1-клетки являются ключевыми игроками различных органо-специфичных аутоиммунных заболеваний, таких как диабет типа I, ревматоидный артрит и рассеянный склероз (Dong, C. et al. (2003) “Immune Regulation by Novel Costimulatory Molecules,” Immunolog. Res. 28(1):39-48).
III. Терапевтические антитела
[0008] Дополнительно к их известным применениям в диагностике, было показано, что антитела используются в качестве терапевтических агентов. Например, иммунотерапия или применение антител для терапевтических целей использовались в последние годы для лечения инфекционного заболевания. Пассивная иммунотерапия включает применение моноклональных антител для лечения инфекции (см., например, Ian Gust, A.O. (Epub 2012 Feb 21) “Role Of Passive Immunotherapies In Managing Infectious Outbreaks,” Biologicals 40(3):196-199; Wang, D. et al. (2011) “Palivizumab For Immunoprophylaxis Of Respiratory Syncytial Virus (RSV) Bronchiolitis In High-Risk Infants And Young Children: A Systematic Review And Additional Economic Modelling Of Subgroup Analyses,” Health Technol. Assess. 15(5):iii-iv, 1-124; Rosenberg, H.F. et al. (2012) “Inflammatory Responses To Respiratory Syncytial Virus (RSV) Infection And The Development Of Immunomodulatory Pharmacotherapeutics,” Curr. Med. Chem. 19(10):1424-1431). Эти антитела могут обладать наследственной терапевтической биологической активностью как с помощью прямого связывания с инфекционными агентами (например, с вирусами, бактериями, грибами и т.д.), так и с помощью их способности связываться с клетками-хозяевами, которые были инфицированы такими агентами и которые экспрессировали агент-специфичные антигены на их клеточных поверхностях. Эти агенты могут вводиться индивидуально или совместно с другими анти-инфекционными агентами (например, антибиотиками, противовоспалительными агентами, анти-гипертермическими агентами и т.д.). Паливизумаб, апробированный для лечения бронхиолита, вызванного респираторно-синцитиальным вирусом (RSV), и тефибазумаб (в клинических испытаниях для лечения инфекций S. aureus) представляют собой примеры таких терапевтических средств. Альтернативно, антитела могут использоваться для получения антительных конъюгатов, в которых антитело связано с токсическим агентом и направляет этот агент к опухоли с помощью специфичного связывания с опухолью. Гемтузумаб озогамицин представляет собой пример одобренного антительного конъюгата, используемого для лечения лейкоза у людей.
[0009] Раскрыты моноклональные антитела, которые связываются с вирусно-инфицированными клетками и обладают потенциальными применениями для диагностики и терапии (см., например, US 8313746; US 7507797; US 2012/0283438; US 2012/0128669; US 2012/0093834; US 2011/0319871; US 2011/0212076; US 2011/0076268; US 2011/0033389; US 2010/0040635; US 2010/0040601; US 2009/0162353; EP 1670826; WO 2011/085289; Oleksiewicz, M.B. et al. (Epub 2012 Jun 13) “Anti-Bacterial Monoclonal Antibodies: Back To The Future?” Arch. Biochem. Biophys. 526(2):124-131; Huang, J.X. et al. (Epub 2012 Jun 4) “Development Of Anti-Infectives Using Phage Display: Biological Agents Against Bacteria, Viruses, And Parasites,” Antimicrob. Agents Chemother. 56(9):4569-4582; Ian Gust, A.O. (Epub 2012 Feb 21) “Role Of Passive Immunotherapies In Managing Infectious Outbreaks,” Biologicals 40(3):196-199; Geevarghese, B. et al. (Epub 2012 Feb 3) “Antibodies For Prevention And Treatment Of Respiratory Syncytial Virus Infections In Children,” Antivir. Ther. 17(1 Pt B):201-211; Rosenberg, H.F. et al. (2012) “Inflammatory Responses To Respiratory Syncytial Virus (RSV) Infection And The Development Of Immunomodulatory Pharmacotherapeutics,” Curr. Med. Chem. 19(10):1424-1431; Nossal, G.J. (2011) “Vaccines Of The Future,” Vaccine 29 Suppl 4:D111-115; Froude, J.W. et al. (2011) “Antibodies For Biodefense,” MAbs 3(6):517-527; Ter Meulen, J. (2011) “Monoclonal Antibodies In Infectious Diseases: Clinical Pipeline In 2011,” Infect. Dis. Clin. North Am. 25(4):789-802; Yamada, T. (2011) “Therapeutic Monoclonal Antibodies,” Keio J. Med. 60(2):37-46; Berry, J.D. et al. (2011) “Antibodies In Infectious Diseases: Polyclonals, Monoclonals And Niche Biotechnology,” Nature Biotechnol. 28(5):489-501; Whaley, K.J. et al. (2011) “Emerging Antibody Products And Nicotiana Manufacturing,” Hum. Vaccin. 7(3):349-356; Beasley, D.W. (2011) “Vaccines And Immunotherapeutics For The Prevention And Treatment Of Infections With West Nile Virus,” Immunotherapy 3(2):269-285; Wang, D. et al. (2011) “Palivizumab For Immunoprophylaxis Of Respiratory Syncytial Virus (RSV) Bronchiolitis In High-Risk Infants And Young Children: A Systematic Review And Additional Economic Modelling Of Subgroup Analyses,” Health Technol. Assess. 15(5):iii-iv, 1-124; Li, L. et al. (2010) “Immunotherapy For Prion Diseases: Opportunities And Obstacles,” Immunotherapy 2(2):269-282; Niebecker, R. et al. (2010) “Safety Of Therapeutic Monoclonal Antibodies,” Curr. Drug. Saf. 5(4):275-286; Hansel, T.T. et al. (2010) “The Safety And Side Effects Of Monoclonal Antibodies,” Nat. Rev. Drug Discov. 9(4):325-338; Chan, C.E. et al. (2009) “The Use Of Antibodies In The Treatment Of Infectious Diseases,” Singapore Med. J. 50(7):663-673; Beigel, J. et al. (2008) “Current And Future Antiviral Therapy Of Severe Seasonal And Avian Influenza,” Antiviral Res. 78(1):91-102; Huber, M. et al. (2008) “Antibodies For HIV Treatment And Prevention: Window Of Opportunity?” Curr. Top. Microbiol. Immunol. 317:39-66; ter Meulen, J. (2007) “Monoclonal Antibodies For Prophylaxis And Therapy Of Infectious Diseases,” Expert Opin. Emerg. Drugs. 12(4):525-540).
[0010] Идеальное терапевтическое и/или диагностическое антитело будет специфично к антигену, присутствующему на инфицированной клетке, но при этом отсутствующему или присутствующему на низком уровне на клетках любой нормальной ткани. Обнаружение, характеризация и выделение нового антитела, способного связываться с антигеном, присутствующим на инфицированных клетках, то есть специфично ассоциированным с инфекционным заболеванием и конкретно с вирусным заболеванием, могло бы найти множество различных применений. Во-первых, антитело будет обладать биологической активностью против таких клеток и будет способно вовлекать ответ иммунной системы, чтобы посредством этого лечить заболевание. Антитело могло бы вводиться в качестве индивидуального терапевтического средства или в комбинации с текущими терапиями или использоваться для получения иммуноконъюгатов, связанных с токсическими агентами. Антитело с такой же специфичностью, но с низкой или с отсутствующей биологической активностью при индивидуальном введении также могло бы использоваться так, что антитело могло бы использоваться для получения конъюгата с радиоактивным изотопом, токсином или с химиотерапевтическим агентом или с липосомой, содержащей химиотерапевтический агент, причем конъюгированная форма является биологически активной благодаря антителу, направляющему токсин к антиген-содержащим клеткам.
[0011] Один из аспектов, целесообразных для идеального терапевтического и/или диагностического антитела, представляет собой открытие и характеризацию новых антител, способных опосредовать и, конкретно, усиливать активацию иммунной системы против инфицированных клеток (и особенно против вирусно-инфицированных клеток), которые ассоциированы с любым из множества вирусных заболеваний.
[0012] Несмотря на все предыдущие преимущества, сохраняется необходимость в получении улучшенных композиций, способных связываться с клетками, инфицированными вирусом, и облегчать или опосредовать иммунный ответ против вирусно-инфицированных клеток. Кроме того, сохраняется необходимость получения улучшенных композиций, способных детектировать такие вирусно-инфицированные клетки. Целью этого изобретения является идентификация таких композиций. Другой целью является получение новых соединений для применения в детекции антигенов, экспрессированных на поверхности вирусно-инфицированных клеток.
[0013] Как подробно описано ниже, настоящее изобретение относится к биспецифичным молекулам, которые связываются с (1) эпитопом активирующего рецептора иммунной эффекторной клетки и (2) с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом, и такие биспецифичные молекулы способны опосредовать и, более предпочтительно, усиливать активацию и направленное воздействие иммунных эффекторных клеток на вирусно-инфицированные клетки, экспрессирующие эпитоп, так что активированные иммунные эффекторные клетки уничтожают вирусно-инфицированные клетки.
Краткое описание чертежей:
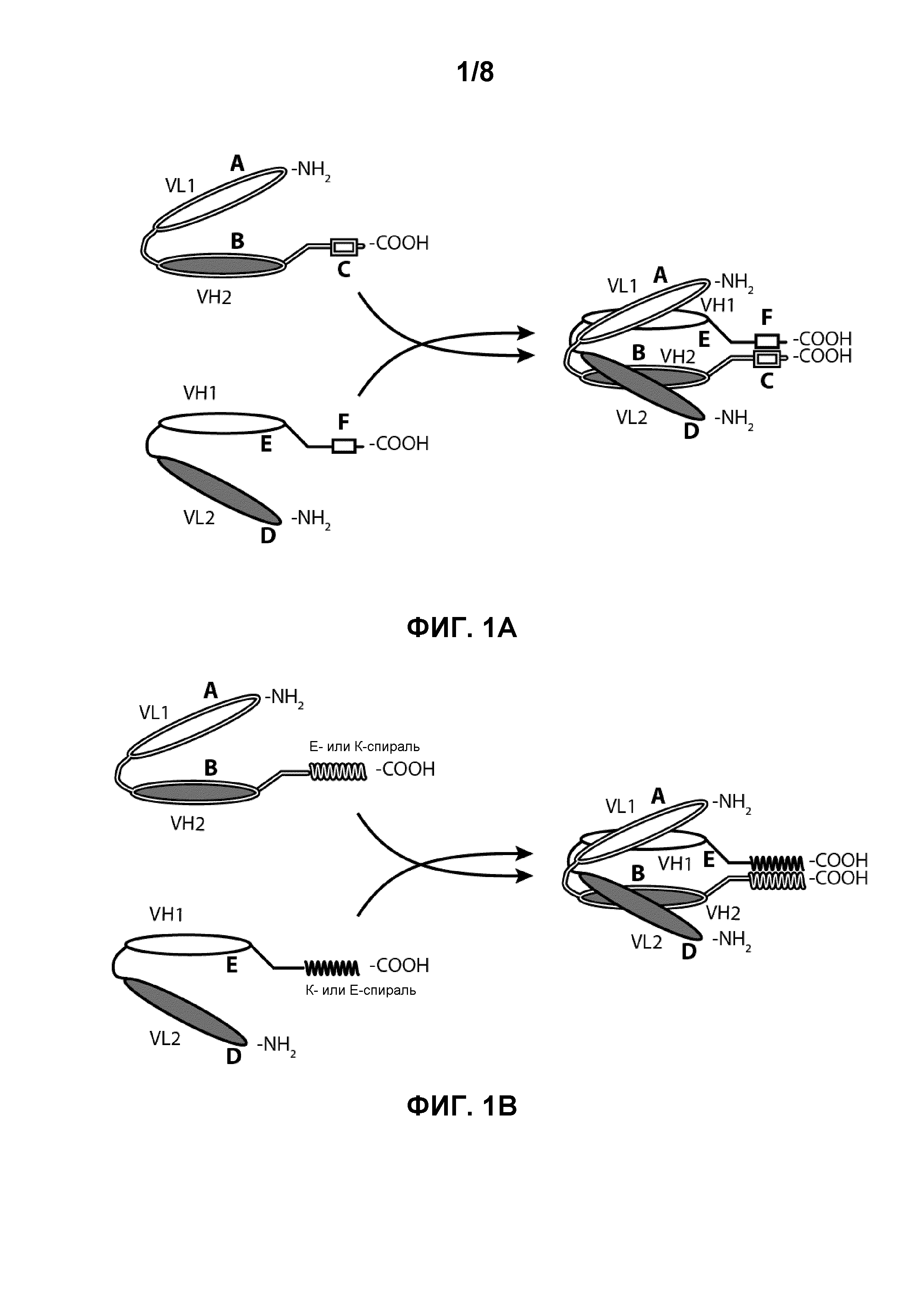
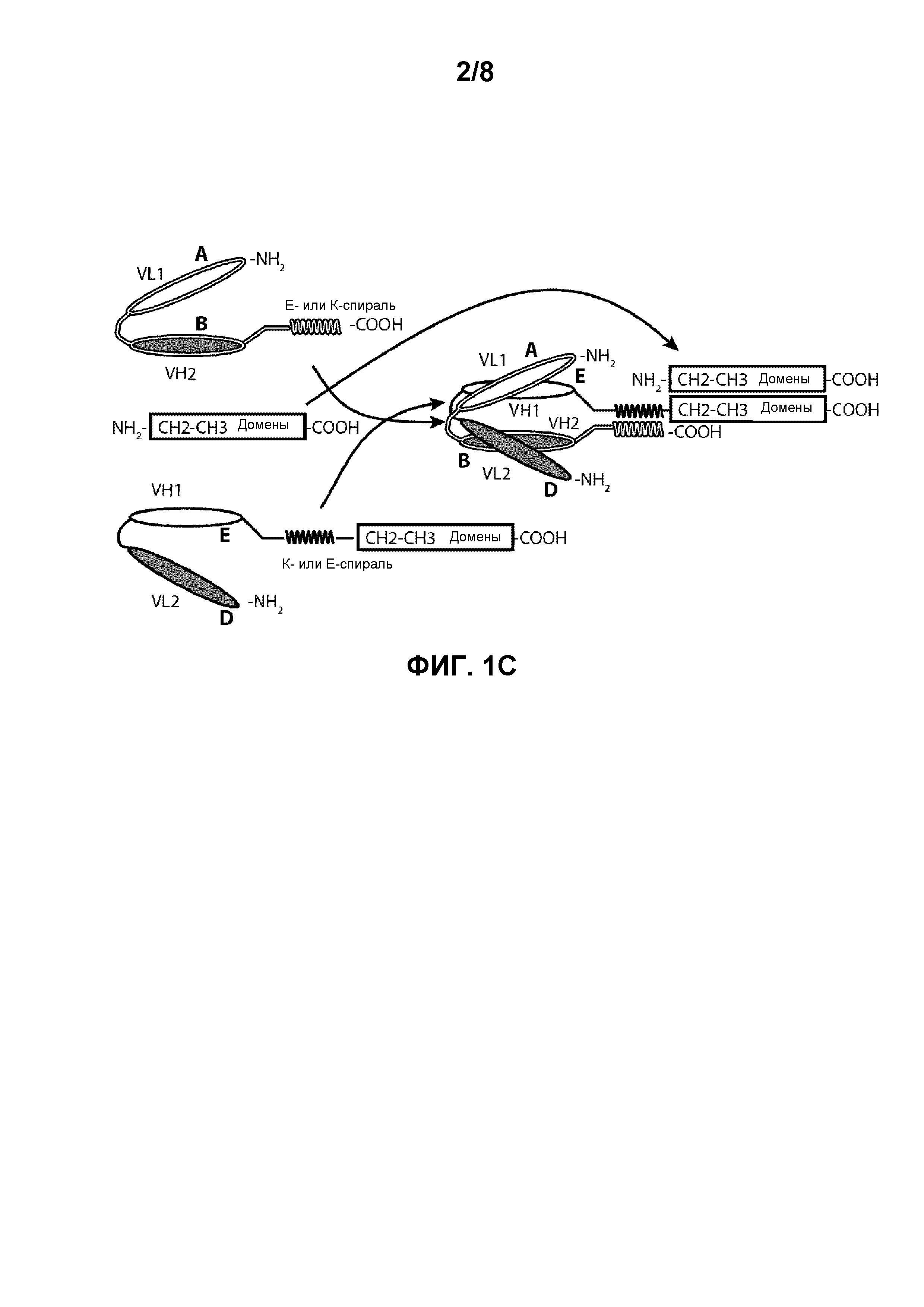
[0014] Фигуры 1A-1C иллюстрируют структуры и домены биспецифичных молекул по настоящему изобретению. Фигура 1A изображает биспецифичное диатело из двух полипептидных цепей, содержащее эпитопсвязывающие домены A-D и дополнительные домены E и F. Фигура 1B изображает биспецифичное диатело из двух полипептидных цепей, содержащее E-спиральный и K-спиральный домены. Фигура 1C изображает биспецифичное диатело из трех полипептидных цепей, содержащее Fc-домен, которое образуется через ассоциацию двух доменов CH2-CH3.
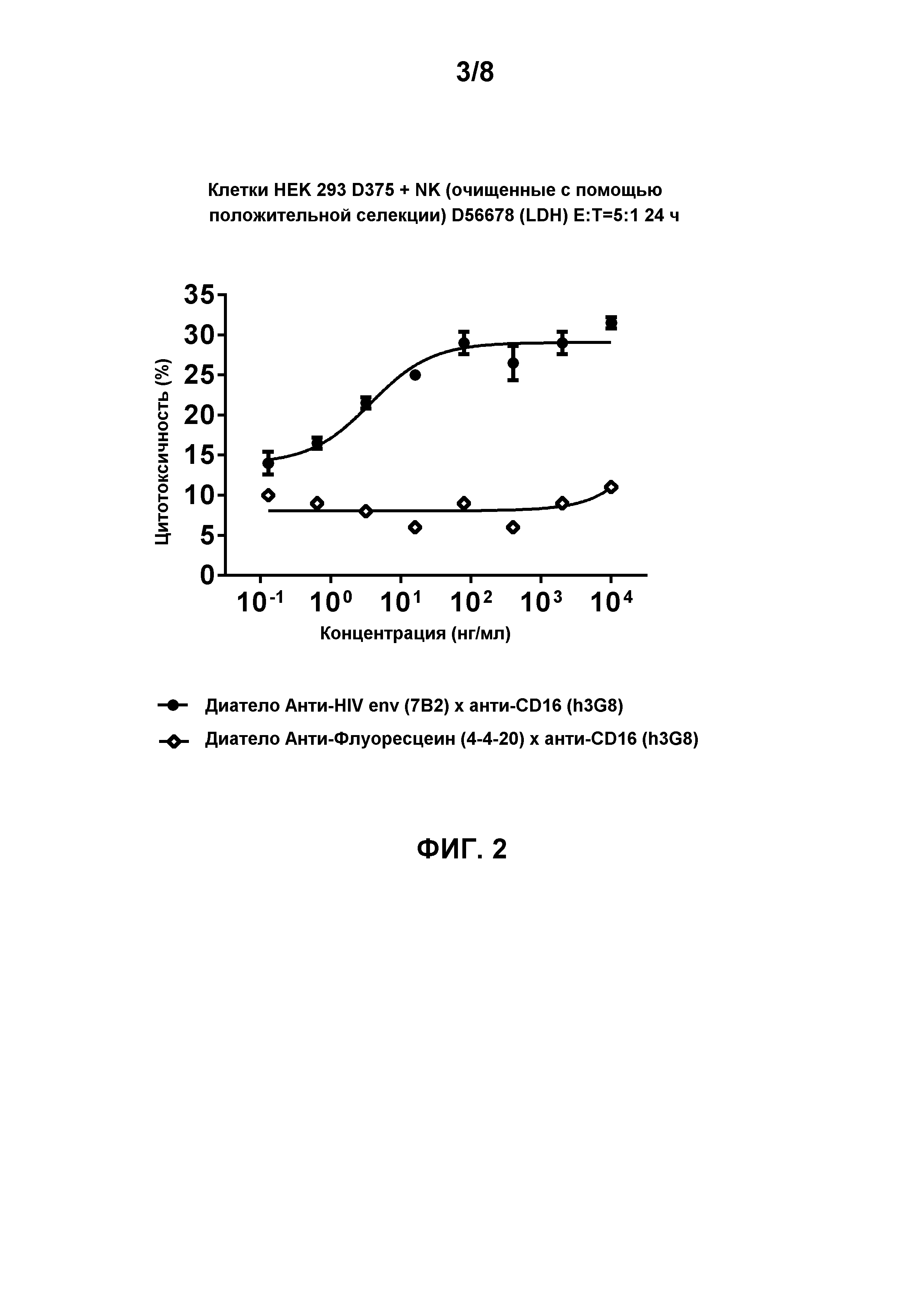
[0015] Фигура 2 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим эпитопсвязывающие домены антитела h3G8 к CD16 и эпитопсвязывающие домены антитела 7B2 к HIV env на gp140-экспрессирующих клетках HEK 293 D375 (92Th023, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) с соотношением Эффектор:Мишень 5:1. Натуральные киллерные (NK) клетки очищали с использованием положительной селекции (D56678 (LDH)). Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела 7B2 к HIV env, использовали в качестве контроля.
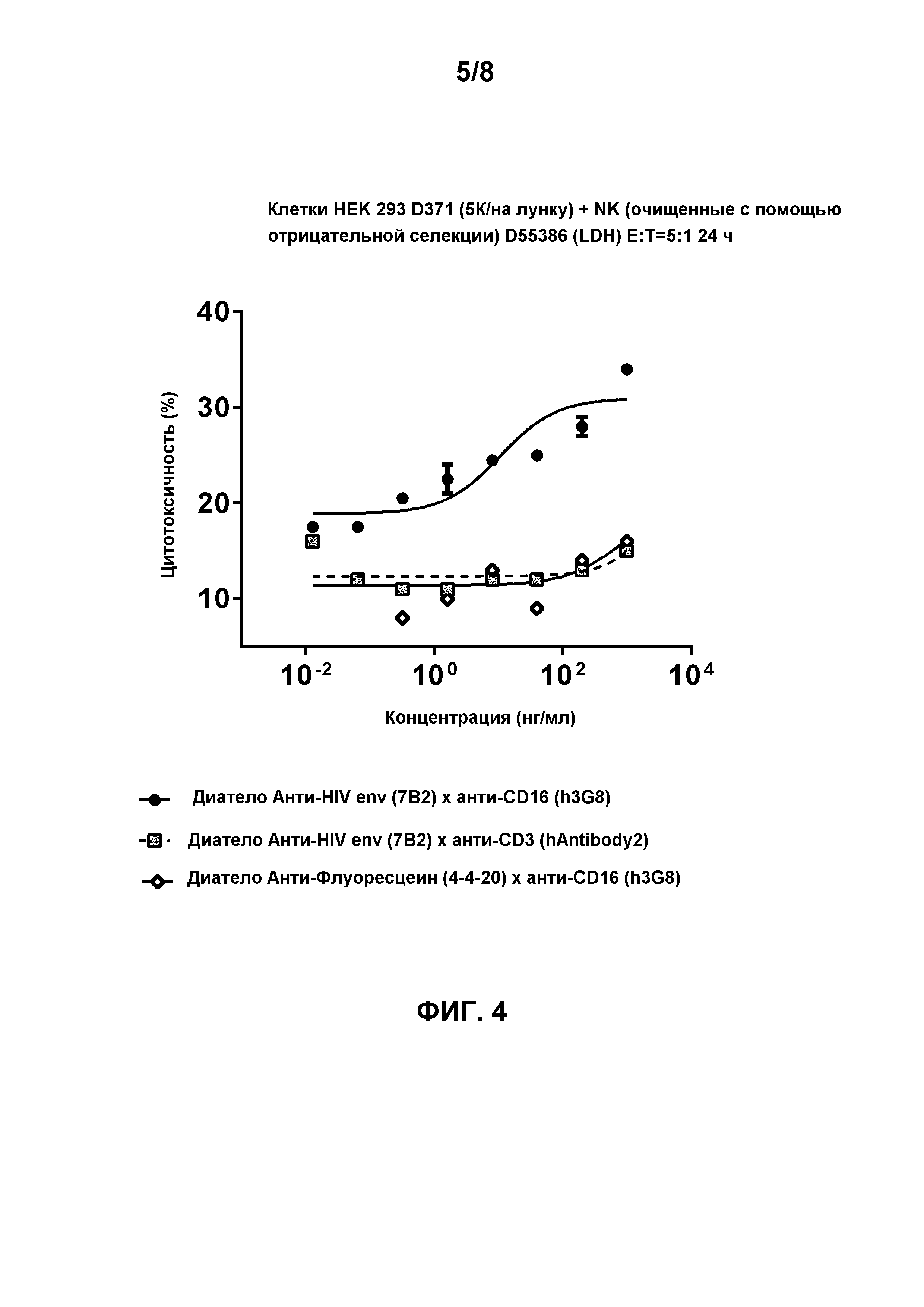
[0016] Фигура 3 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим эпитопсвязывающие домены антитела h3G8 к CD16 и эпитопсвязывающие домены антитела 7B2 к HIV env на gp140-экспрессирующих клетках HEK 293 D375 (92Th023, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) с соотношением Эффектор:Мишень 5:1. Натуральные киллерные (NK) клетки очищали с помощью отрицательной селекции (D55386 (LDH)). Как ожидалось (так как NK-клетки лишены CD3), биспецифичное диатело, содержащее эпитопсвязывающие домены антитела hAntibody 2 к CD3 и эпитопсвязывающие домены антитела 7B2 к HIV env, не способно демонстрировать цитотоксическую активность лимфоцитов. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела h3G8 к CD16, использовали в качестве контроля.
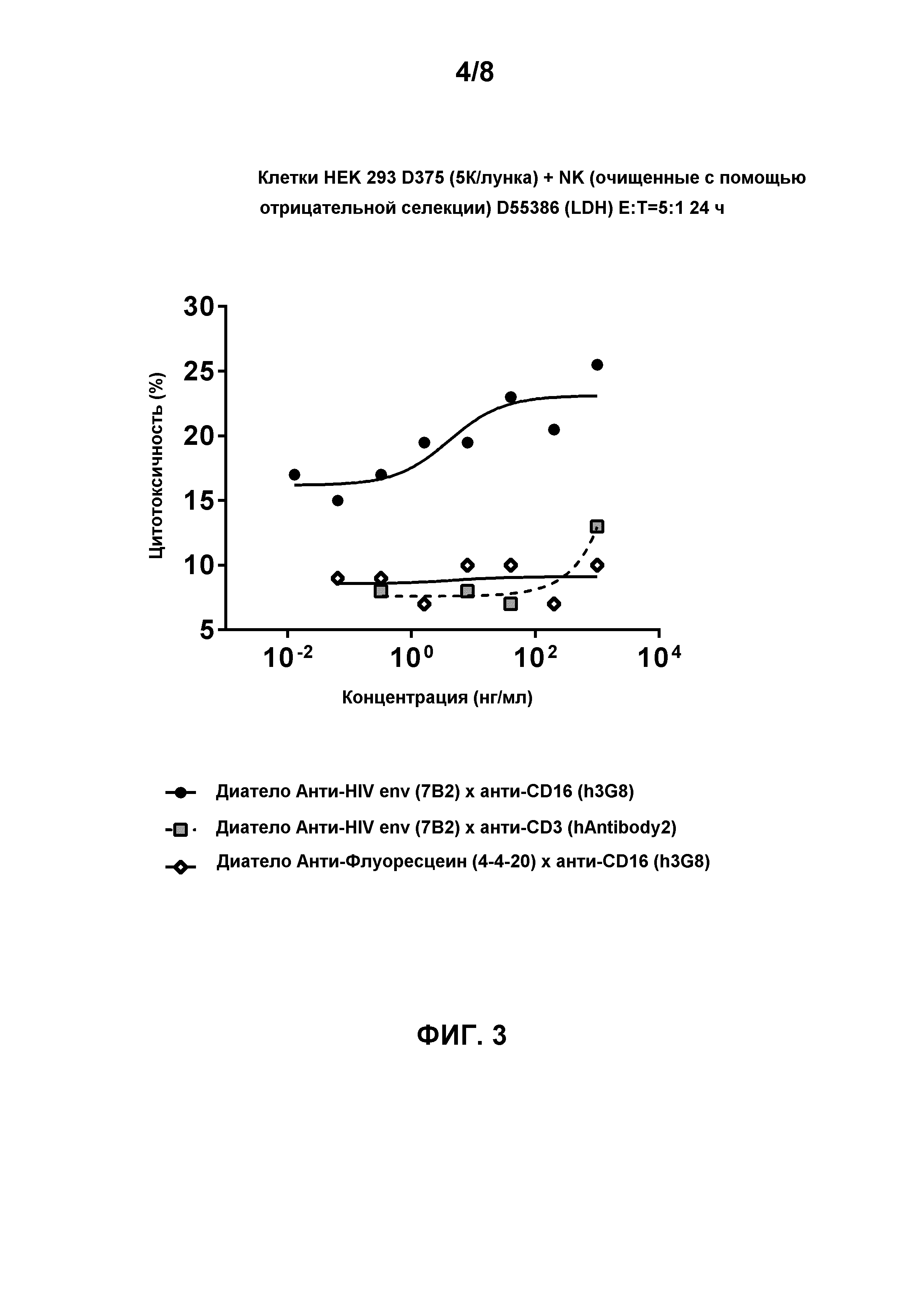
[0017] Фигура 4 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим эпитопсвязывающие домены антитела h3G8 к CD16 и эпитопсвязывающие домены антитела 7B2 к HIV env на gp140-экспрессирующих клетках HEK 293 D371 (CM244, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) с соотношением Эффектор:Мишень 5:1. Натуральные киллерные (NK) клетки очищали с помощью отрицательной селекции (D55386 (LDH)). Как ожидалось (так как NK-клетки лишены CD3), биспецифичное диатело, содержащее эпитопсвязывающие домены антитела hAntibody 2 к CD3 и эпитопсвязывающие домены антитела 7B2 к HIV env, не способно демонстрировать цитотоксическую активность лимфоцитов. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела h3G8 к CD16, использовали в качестве контроля.
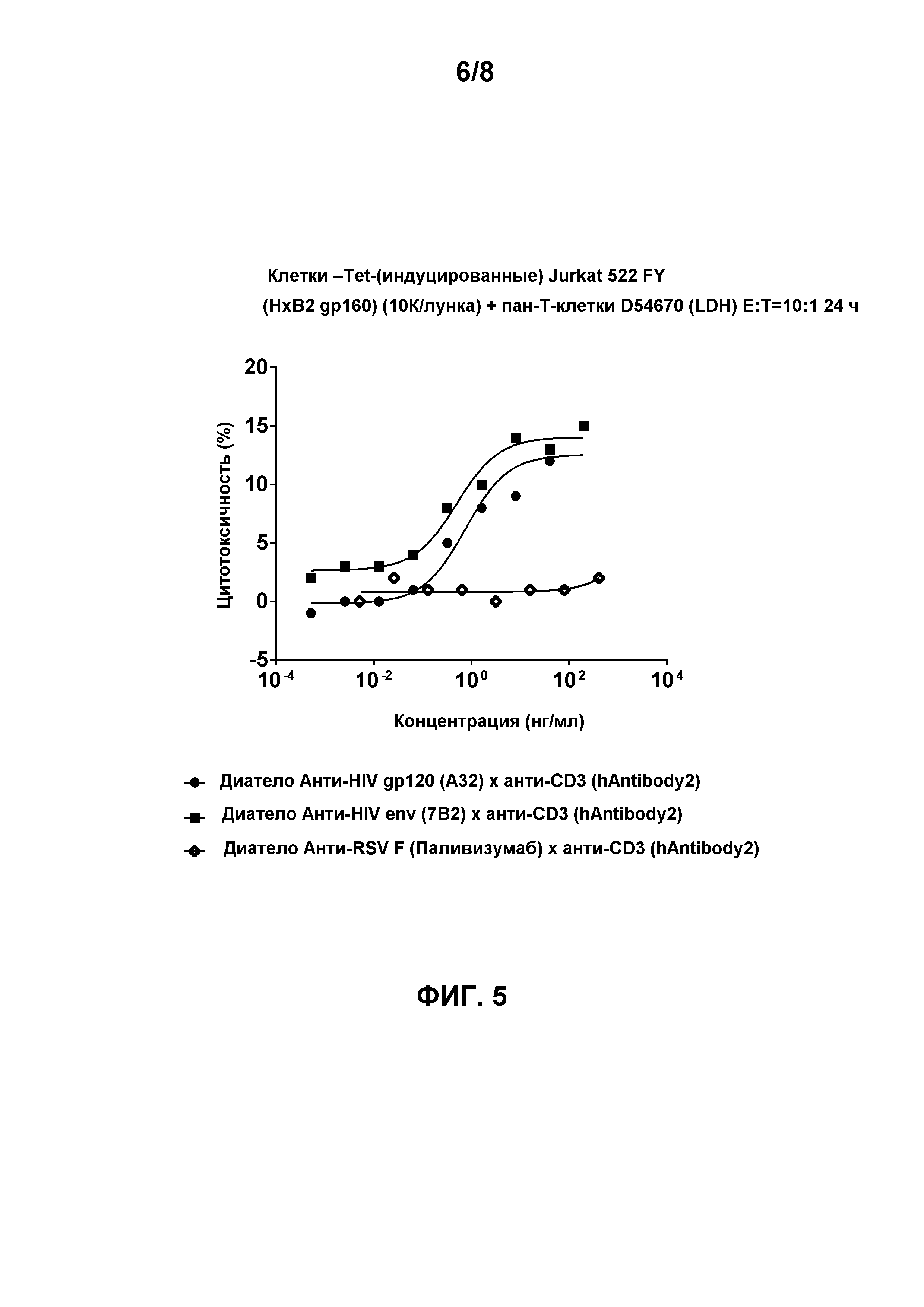
[0018] Фигура 5 демонстрирует способность биспецифичных диател, содержащих эпитопсвязывающие домены антитела hAntibody 2 к CD3 и либо эпитопсвязывающие домены антитела A32 к HIV gp120, либо эпитопсвязывающие домены антитела 7B2 к HIV env, для облегчения перенацеленного CD8-опосредованного уничтожения HIV env-экспрессирующих клеток Jurkat 522 FY в присутствии общих T-клеток (D54670). Клетки инкубировали в течение 24 часов. Соотношение Эффектор:Мишень составило 5:1. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела Паливизумаб к RSV F и эпитопсвязывающие домены антитела hAntibody 2 к CD3, использовали в качестве контроля.
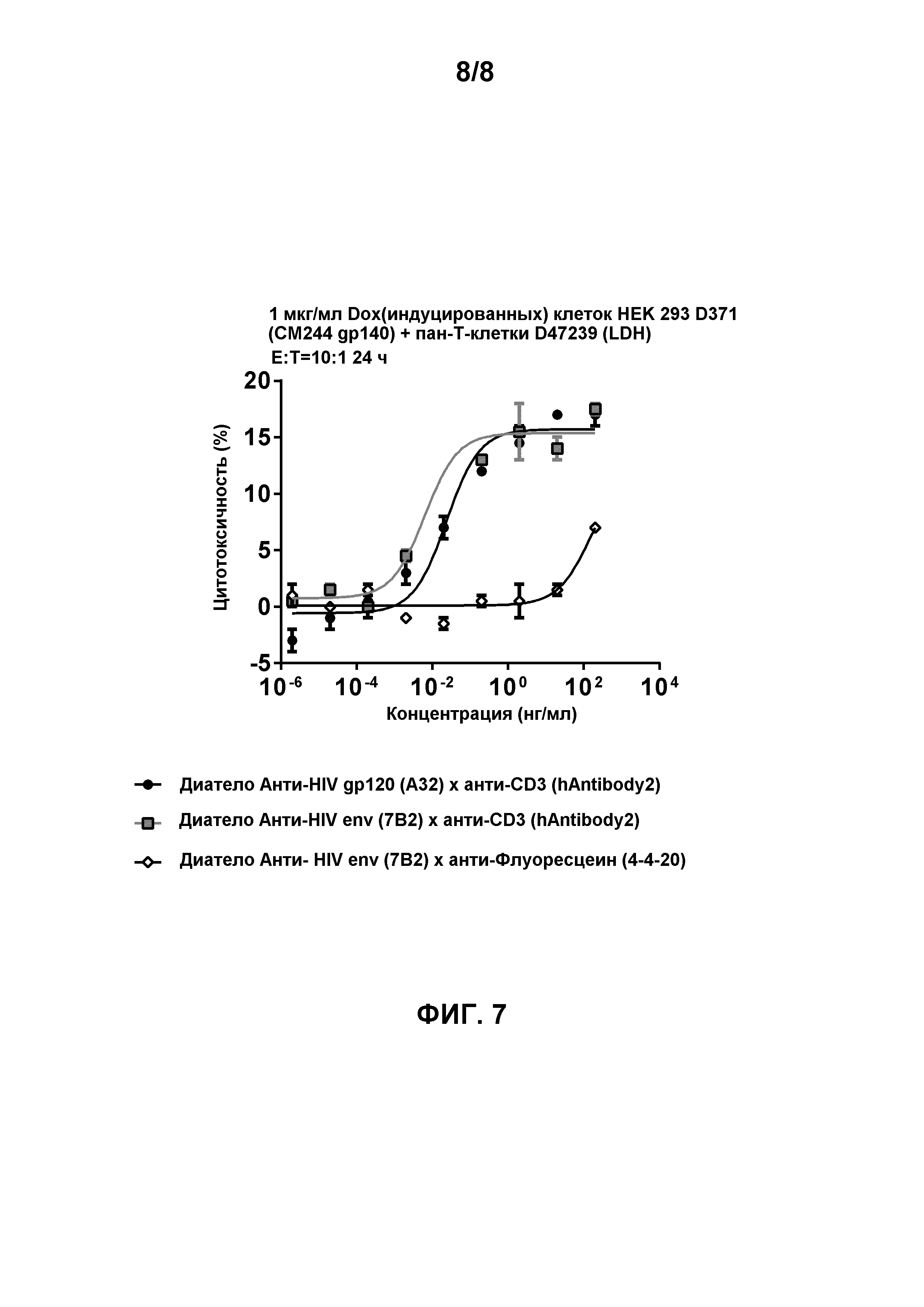
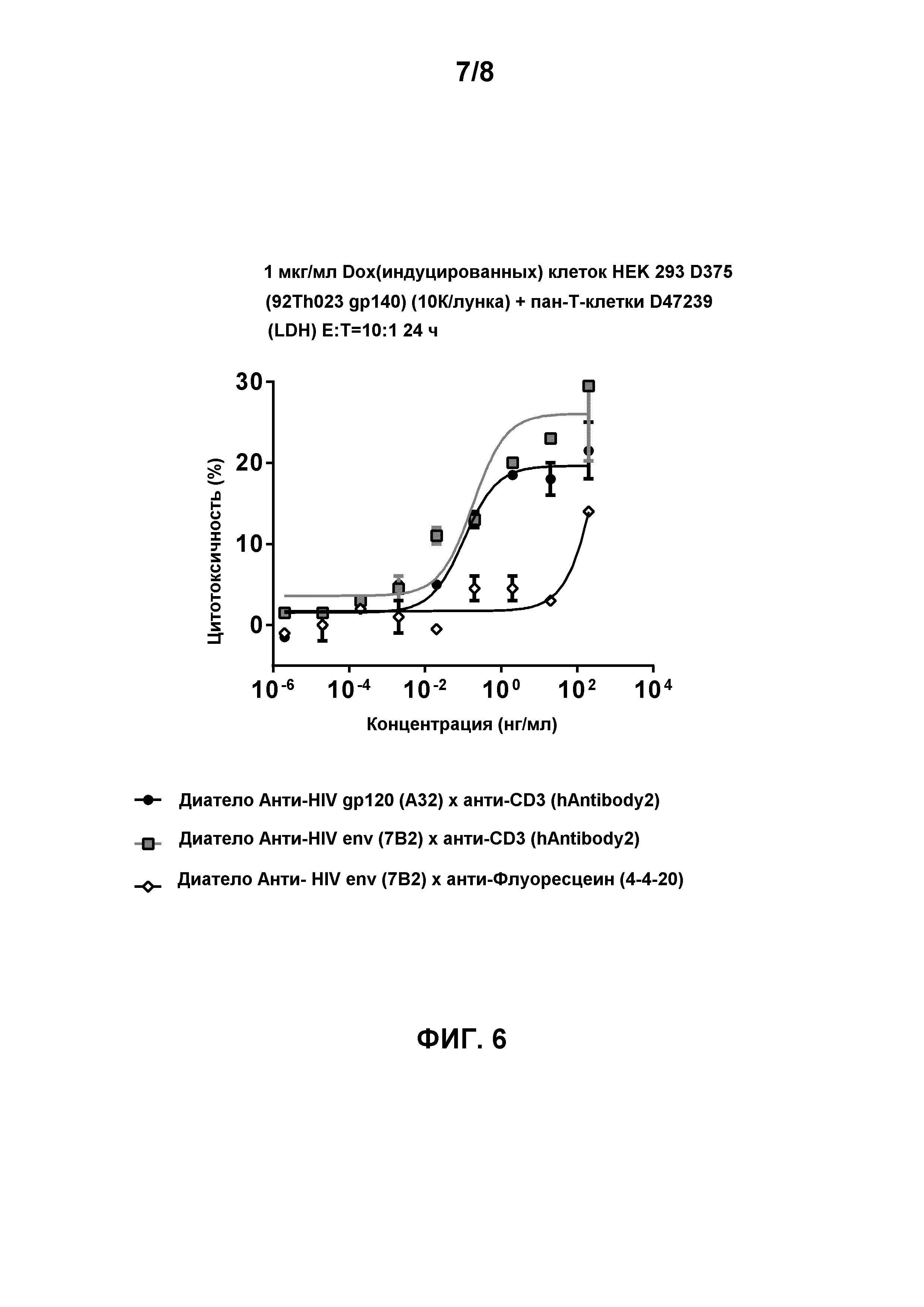
[0019] Фигура 6 демонстрирует способность биспецифичных диател, содержащих эпитопсвязывающие домены антитела hAntibody 2 к CD3 и либо эпитопсвязывающие домены антитела A32 к HIV gp120, либо эпитопсвязывающие домены антитела 7B2 к HIV env, для облегчения перенацеленного CD8-опосредованного уничтожения HIV gp140-экспрессирующих клеток HEK 293 D375 (92Th023 gp140) через 24 часа инкубации в присутствии общих T-клеток (D47239) с соотношением Эффектор:Мишень 10:1. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 7B2 к HIV env и эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину, использовали в качестве контроля.
[0020] Фигура 7 демонстрирует способность биспецифичных диател, содержащих эпитопсвязывающие домены антитела hAntibody 2 к CD3 и либо эпитопсвязывающие домены антитела A32 к HIV gp120, либо эпитопсвязывающие домены антитела 7B2 к HIV env, для облегчения перенацеленного CD8-опосредованного уничтожения HIV gp140-экспрессирующих клеток HEK 293 D371 (CM244, подтип AE, R5-тропные) в присутствии общих T-клеток (D47239). Соотношение Эффектор:Мишень составило 10:1. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 7B2 к HIV env и эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину, использовали в качестве контроля.
Сущность изобретения:
[0021] Настоящее изобретение относится к биспецифичным молекулам, которые способны к локализации иммунной эффекторной клетки, которая экспрессирует активирующий рецептор для вирусно-инфицированной клетки, с тем чтобы посредством этого облегчить уничтожение вирусно-инфицированной клетки. В предпочтительном варианте осуществления, такая локализация осуществляется с использованием биспецифичных молекул, которые иммунореактивны как в отношении активирующего рецептора иммунной эффекторной клетки, так и в отношении эпитопа антигена, экспрессированного с помощью клетки, инфицированной вирусом. Настоящее изобретение дополнительно относится к применению таких биспецифичных молекул в лечении латентных вирусных инфекций, стойких вирусных инфекций и неактивных вирусных инфекций, и к применению таких биспецифичных молекул в способах уничтожения клеток, содержащих вирусный геном, или клеток, экспрессирующих вирусный белок. Изобретение конкретно относится к биспецифичным молекулам, которые связываются с (1) эпитопом активирующего рецептора иммунной эффекторной клетки (2) с эпитопом антигена, экспрессированного с помощью клетки, инфицированной вирусом, где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичных молекул, и к таким биспецифичным молекулами, которые способны опосредовать и, более предпочтительно, усиливать активацию и направленное воздействие иммунных эффекторных клеток на клетку, инфицированную вирусом, так что активированные иммунные эффекторные клетки уничтожают клетку, инфицированную вирусом.
[0022] Подробно, изобретение относится к биспецифичной молекуле, содержащей:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с эпитопом белка, экспрессированного на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует активирующий рецептор, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0023] Изобретение дополнительно относится к варианту такой биспецифичной молекулы, где первый эпитопсвязывающий домен связывается с активирующим рецептором эффекторной клетки.
[0024] Изобретение дополнительно относится к любым вышеописанным биспецифичным молекулам, где эффекторная клетка представляет собой T-клетку, CD4+ T-клетку, CD8+ T-клетку, натуральную киллерную клетку, макрофаг, гранулоцит или дендритную клетку.
[0025] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где вирус представляет собой вирус Эпштейна-Барра, простой вирус герпеса типа 1, простой вирус герпеса типа 2, цитомегаловирус, вирус иммунодефицита человека, вирус гепатита B, вирус гепатита C, вирус папилломы человека или вирус гриппа.
[0026] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где клетка латентно инфицирована вирусом.
[0027] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген, экспрессированный клеткой, инфицированной вирусом, выбирают из группы, состоящей из LMP-1, LMP-2, белка M2 вируса гриппа, белка env HIV, HPV E6 и HPV E7.
[0028] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке и не детектируется на вирусе с помощью биспецифичной молекулы.
[0029] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где эпитоп на эффекторной клетке представляет собой CD3-эпитоп, CD4-эпитоп, CD8-эпитоп, CD2-эпитоп, CD16-эпитоп или NKG2D-эпитоп.
[0030] Изобретение дополнительно относится к любой из вышеописанных молекул, где первый антиген-связывающий домен представляет собой антиген-связывающий домен из CD3-антитела, CD4-антитела, CD8-антитела, CD2-антитела, CD16-антитела или NKG2D-антитела.
[0031] Изобретение дополнительно относится к вышеописанным биспецифичным молекулам, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке на уровне, который по меньшей мере в 2 раза выше, чем уровень, если он есть, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0032] Изобретение дополнительно относится к вышеописанным биспецифичным молекулам, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке на уровне, который по меньшей мере в 5 раз выше, чем уровень, если он есть, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0033] Изобретение дополнительно относится к вышеописанным биспецифичным молекулам, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке на уровне, который по меньшей мере в 10 раз выше, чем уровень, если он есть, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0034] Изобретение дополнительно относится к вышеописанным биспецифичным молекулам, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке на уровне, который по меньшей мере в 100 раз выше, чем уровень, если он есть, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0035] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который выше, чем уровень, на котором антиген детектируется с помощью биспецифичной молекулы на клетке, которая не инфицирована вирусом.
[0036] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который по меньшей мере в 2 раза выше, чем уровень, на котором антиген детектируется с помощью биспецифичной молекулы на клетке, которая не инфицирована вирусом.
[0037] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который по меньшей мере в 5 раз выше, чем уровень, на котором антиген детектируется с помощью биспецифичной молекулы на клетке, которая не инфицирована вирусом.
[0038] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который по меньшей мере в 10 раз выше, чем уровень, на котором антиген детектируется с помощью биспецифичной молекулы на клетке, которая не инфицирована вирусом.
[0039] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который по меньшей мере в 100 раз выше, чем уровень, на котором антиген детектируется с помощью биспецифичной молекулы на клетке, которая не инфицирована вирусом.
[0040] Изобретение дополнительно относится к любой из вышеописанных биспецифичных молекул, где антиген, экспрессированный клеткой, инфицированной вирусом, детектируемо присутствует на клетке и не детектируется на клетке, не инфицированной вирусом, с помощью биспецифичной молекулы.
[0041] Изобретение дополнительно относится к фармацевтической композиции, содержащей биспецифичную молекулу и фармацевтически приемлемый носитель, причем биспецифичная молекула содержит:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с эпитопом белка, экспрессированного на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует активирующий рецептор эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0042] Изобретение дополнительно относится к варианту такой фармацевтической композиции, где первый эпитопсвязывающий домен связывается с активирующим рецептором эффекторной клетки.
[0043] Изобретение дополнительно относится к способу лечения латентной вирусной инфекции у индивидуума, включающему стадию введения индивидууму терапевтически эффективного количества биспецифичной молекулы, причем биспецифичная молекула содержит:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с белком, экспрессированным на поверхности иммунной эффекторной клетки, где указанная иммунная эффекторная клетка экспрессирует эпитоп активирующего рецептора эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0044] Изобретение дополнительно относится к варианту такого способа, где первый эпитопсвязывающий домен биспецифичной молекулы связывается с активирующим рецептором эффекторной клетки.
[0045] Изобретение дополнительно относится к способу лечения стойкой вирусной инфекции у индивидуума, включающему стадию введения индивидууму терапевтически эффективного количества биспецифичной молекулы, причем биспецифичная молекула содержит:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с белком, экспрессированным на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует эпитоп активирующего рецептора эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0046] Изобретение дополнительно относится к варианту такого способа, где первый эпитопсвязывающий домен биспецифичной молекулы связывается с активирующим рецептором эффекторной клетки.
[0047] Изобретение дополнительно относится к способам лечения неактивной вирусной инфекции у индивидуума, включающим стадию введения терапевтически эффективного количества биспецифичной молекулы индивидууму, причем биспецифичная молекула содержит:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с белком, экспрессированным на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует эпитоп активирующего рецептора эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0048] Изобретение дополнительно относится к варианту такого способа, где первый эпитопсвязывающий домен биспецифичной молекулы связывается с активирующим рецептором эффекторной клетки.
[0049] Изобретение дополнительно относится к способам уничтожения клетки, содержащей вирусный геном, причем способ включает стадию контакта клетки с биспецифичной молекулой, причем биспецифичная молекула включает:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с белком, экспрессированным на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует эпитоп активирующего рецептора эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0050] Изобретение дополнительно относится к варианту такого способа, где первый эпитопсвязывающий домен биспецифичной молекулы связывается с активирующим рецептором эффекторной клетки.
[0051] Изобретение дополнительно относится к способам уничтожения клетки, экспрессирующей вирусный геном, причем способ включает стадию контакта клетки с биспецифичной молекулой, причем биспецифичная молекула включает:
(A) первый эпитопсвязывающий домен, способный к иммуноспецифичому связыванию с белком, экспрессированным на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует эпитоп активирующего рецептора эффекторной клетки, и
(B) второй эпитопсвязывающий домен, способный к иммуноспецифичному связыванию с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[0052] Изобретение дополнительно относится к варианту такого способа, где первый эпитопсвязывающий домен биспецифичной молекулы связывается с активирующим рецептором эффекторной клетки.
Подробное описание изобретения:
[0053] Настоящее изобретение относится к биспецифичным молекулам, которые способны к локализации иммунной эффекторной клетки, которая экспрессирует активирующий рецептор для вирусно-инфицированной клетки, с тем чтобы посредством этого облегчить уничтожение вирусно-инфицированной клетки. В предпочтительном варианте осуществления, такая локализация осуществляется с использованием биспецифичных молекул, которые иммунореактивны как в отношении активирующего рецептора иммунной эффекторной клетки, так и в отношении эпитопа антигена, экспрессированного с помощью клетки, инфицированной вирусом. Настоящее изобретение дополнительно относится к применению таких биспецифичных молекул в лечении латентных вирусных инфекций, стойких вирусных инфекций и неактивных вирусных инфекций, и к применению таких биспецифичных молекул в способах уничтожения клеток, содержащих вирусный геном, или клеток, экспрессирующих вирусный белок. Изобретение конкретно относится к биспецифичным молекулам, которые связываются с (1) эпитопом активирующего рецептора иммунной эффекторной клетки (2) с эпитопом антигена, экспрессированного с помощью клетки, инфицированной вирусом, где антиген детектируемо присутствует на клетке, инфицированной вирусом, на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичных молекул, и к таким биспецифичным молекулами, которые способны опосредовать и, более предпочтительно, усиливать активацию и направленное воздействие иммунных эффекторных клеток на клетку, инфицированную вирусом, так что активированные иммунные эффекторные клетки уничтожают клетку, инфицированную вирусом.
[0054] Способность таких биспецифичных молекул связываться и с активирующим рецептором иммунной эффекторной клетки, и с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом, дает возможность таким биспецифичным молекулам использоваться в лечении активных вирусных инфекций, латентных вирусных инфекций, стойких вирусных инфекций и неактивных вирусных инфекций.
I. Общие Методы
[0055] До тех пор, пока не указано иное, в практическом использовании настоящего изобретения будут применяться стандартные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалисту в данной области. Такие методы полностью объясняются в таких публикациях, как Molecular Cloning: A Laboratory Manual, Third Edition (Sambrook et al. Eds., 2001) Cold Spring Harbor Press, Cold Spring Harbor, NY; Oligonucleotide Synthesis: Methods and Applications (Methods in Molecular Biology), Herdewijn, P., Ed., Humana Press, Totowa, NJ; Oligonucleotide Synthesis (Gait, M.J., Ed., 1984); Methods in Molecular Biology, Humana Press, Totowa, NJ; Cell Biology: A Laboratory Notebook (Cellis, J.E., Ed., 1998) Academic Press, New York, NY; Animal Cell Culture (Freshney, R.I., Ed., 1987); Introduction to Cell and Tissue Culture (Mather, J.P. and Roberts, P.E., Eds., 1998) Plenum Press, New York, NY; Cell and Tissue Culture: Laboratory Procedures (Doyle, A. et al., Eds., 1993-8) John Wiley and Sons, Hoboken, NJ; Methods in Enzymology (Academic Press, Inc.) New York, NY; Weir's Handbook of Experimental Immunology (Herzenberg, L.A. et al. Eds. 1997) Wiley-Blackwell Publishers, New York, NY; Gene Transfer Vectors for Mammalian Cells (Miller, J.M. et al. Eds., 1987) Cold Spring Harbor Press, Cold Spring Harbor, NY; Current Protocols in Molecular Biology (Ausubel, F.M. et al., Eds., 1987) Greene Pub. Associates, New York, NY; PCR: The Polymerase Chain Reaction, (Mullis, K. et al., Eds., 1994) Birkhäuser, Boston MA; Current Protocols in Immunology (Coligan, J.E. et al., eds., 1991) John Wiley and Sons, Hoboken, NJ; Short Protocols in Molecular Biology (John Wiley and Sons, 1999) Hoboken, NJ; Immunobiology 7 (Janeway, C.A. et al. 2007) Garland Science, London, UK; Antibodies (P. Finch, 1997) Stride Publications, Devoran, UK; Antibodies: A Practical Approach (D. Catty., ed., 1989) Oxford University Press, USA, New York NY); Monoclonal Antibodies: A Practical Approach (Shepherd, P. et al. Eds., 2000) Oxford University Press, USA, New York NY; Using Antibodies: A Laboratory Manual (Harlow, E. et al. Eds., 1998) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; The Antibodies (Zanetti, M. et al. Eds. 1995) Harwood Academic Publishers, London, UK); и DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology, Eighth Edition, DeVita, V. et al. Eds. 2008, Lippincott Williams & Wilkins, Philadelphia, PA.
II. Определения
[0056] При использовании в данном документе, “антитело” представляет собой иммуноглобулиновую молекулу, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид, и т.д., через, по меньшей мере, один сайт распознавания антигена, локализованный в вариабельной области иммуноглобулиновой молекулы. При использовании в данном документе, термин охватывает не только интактные поликлональные или моноклональные молекулы, но также их мутанты, природные варианты, химерные белки, содержащие часть антитела с сайтом распознавания антигена требуемой специфичности, гуманизированные антитела и химерные антитела, и любую из других модифицированных конфигураций иммуноглобулиновой молекулы, которая содержит сайт распознавания антигена требуемой специфичности. По тексту данной заявки нумерация аминокислотных остатков легкой и тяжелой цепи антител соответствует индексу EU как в Kabat et al. (1992) Sequences of Proteins of Immunological Interest, National Institutes of Health Publication No. 91-3242. При использовании в данном документе, “антиген-связывающий фрагмент антитела” представляет собой часть антитела, которая обладает, по меньшей мере, одним сайтом распознавания антигена. При использовании в данном документе, термин охватывает фрагменты (такие как Fab, Fab', F(ab')2 Fv), и одноцепочечный фрагмент (scFv).
[0057] Термин “моноклональное антитело” относится к гомогенной антительной популяции, где моноклональное антитело состоит из аминокислот (природных и искусственных), которые вовлечены в селективное связывание антигена. Моноклональные антитела высоко специфичны, будучи направленными против единственного антигенного сайта. Термин “моноклональное антитело” охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2 Fv), одноцепочечные фрагменты (scFv), их мутанты, химерные белки, содержащие часть антитела, гуманизированные моноклональные антитела, химерные моноклональные антитела, и любую другую модифицированную конфигурацию иммуноглобулиновой молекулы, которая содержит сайт распознавания антигена требуемой специфичности и способна связываться с антигеном. Не предназначено для ограничения то, что касается источника антитела или способа, которым оно было получено (например, с помощью гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенных животных, и т.д.). Термин включает цельные иммуноглобулины, а также фрагменты и т.д., описанные выше под определение “антитело”.
[0058] Термин “химерное антитело” относится к химерной молекуле, как правило, полученной с использованием рекомбинантных методов, имеющей вариабельную область, выделенную из иммуноглобулина вида, отличного от человека, а оставшаяся иммуноглобулиновая структура молекулы базируется на структуре и/или последовательности человеческого иммуноглобулина.
[0059] Термин “гуманизированное антитело” относится к молекуле, как правило, полученной с использованием рекомбинантных методов, имеющей антиген-связывающий сайт, выделенный из иммуноглобулина вида, отличного от человека, а оставшаяся иммуноглобулиновая структура молекулы базируется на структуре и/или последовательности человеческого иммуноглобулина. Антиген-связывающий сайт может содержать либо полные вариабельные домены, сшитые с константными доменами, либо гипервариабельные области (CDR), пересаженные на подходящие каркасные области в вариабельных доменах. Антиген-связывающие сайты могут быть дикого типа или могут быть модифицированными с помощью одной или нескольких аминокислотных остатков. Это исключает константную область в качестве иммуногена у человеческих индивидуумов, но возможность иммунного ответа на чужеродную вариабельную область остается (LoBuglio, A.F. et al. (1989) “Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response,” Proc. Natl. Acad. Sci. (U.S.A.) 86:4220-4224). Другой способ фокусируется не только на получении выделенных из человека константных областях, но и на модификации вариабельных областей, а также на их структурной перестройке настолько близкой к человеческой форме, насколько это возможно. Известно, что вариабельные области обеих - тяжелой и легкой цепей, содержат три гипервариабельные области (CDR), которые варьируются в ответ на рассматриваемые антигены и определяют способность связывания, они фланкированы четырьмя каркасными областями (FR), которые относительно консервативны в данном виде и которые предположительно обеспечивают каркасную структуру CDR. Когда не человеческие антитела получают по отношению к конкретному антигену, то вариабельные области могут быть “реструктурированы” или “гуманизированы” путем пересадки CDR, выделенных из не человеческого антитела, на FR, присутствующих человеческом антителе, которое подвергается модификации. Заявка данного способа для различных антител была опубликована Sato, K. et al. (1993) Cancer Res 53:851-856. Riechmann, L. et al. (1988) “Reshaping Human Antibodies for Therapy,” Nature 332:323-327; Verhoeyen, M. et al. (1988) “Reshaping Human Antibodies: Grafting An Antilysozyme Activity,” Science 239:1534-1536; Kettleborough, C. A. et al. (1991) “Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting: The Importance Of Framework Residues On Loop Conformation,” Protein Engineering 4:773-3783; Maeda, H. et al. (1991) “Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity,” Human Antibodies Hybridoma 2:124-134; Gorman, S. D. et al. (1991) “Reshaping A Therapeutic CD4 Antibody,” Proc. Natl. Acad. Sci. (U.S.A.) 88:4181-4185; Tempest, P.R. et al. (1991) “Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo,” Bio/Technology 9:266-271; Co, M. S. et al. (1991) “Humanized Antibodies For Antiviral Therapy,” Proc. Natl. Acad. Sci. (U.S.A.) 88:2869-2873; Carter, P. et al. (1992) “Humanization Of An Anti-p185her2 Antibody For Human Cancer Therapy,” Proc. Natl. Acad. Sci. (U.S.A.) 89:4285-4289; и Co, M.S. et al. (1992) “Chimeric And Humanized Antibodies With Specificity For The CD33 Antigen,” J. Immunol. 148:1149-1154. В некоторых воплощениях, гуманизированные антитела сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиных антител). В других воплощениях гуманизированные антитела содержат одну или несколько CDR (одну, две, три, четыре, пять или шесть), которые изменяются в отношении исходного антитела, которые также определяют одну или несколько CDR “выделенных из” одной или нескольких CDR из исходного антитела.
[0060] Термин “BiTE” (биспецифичные T-клеточные активаторы) относится к одноцепочечной полипептидной молекуле, содержащей два антиген-связывающих домена, один из которых связывается с T-клеточным антигеном, а второй связывается с антигеном, присутствующим на поверхности клетки-мишени (WO 05/061547; Baeuerle, P et al. (2008) “BiTE: A New Class Of Antibodies That Recruit T Cells,” Drugs of the Future 33: 137-147; Bargou, et al. 2008) “Tumor Regression in Cancer Patients by Very Low Doses of a T Cell-Engaging Antibody,” Science 321: 974-977).
[0061] Термин “диатело” относится к молекуле, которая содержит, по меньшей мере, две полипептидные цепи, которые предпочтительно ассоциированы посредством ковалентного взаимодействия с образованием, по меньшей мере, двух эпитопсвязывающих сайтов, которые могут распознавать одинаковые или различные эпитопы. Каждая из полипептидных цепей диатела содержит вариабельную область легкой цепи иммуноглобулина, но эти области не взаимодействуют с образованием эпитопсвязывающего сайта. Наоборот, вариабельная область тяжелой цепи иммуноглобулина одной (например, первой) из полипептидных цепей диатела взаимодействует с вариабельной областью легкой цепи иммуноглобулина другой (например, второй) полипептидной цепью диатела с образованием эпитопсвязывающего сайта. Аналогично, вариабельная область легкой цепи иммуноглобулина одной (например, первой) из полипептидных цепей диатела взаимодействует с вариабельной областью тяжелой цепи иммуноглобулина другой (например, второй) полипептидной цепью диатела с образованием эпитопсвязывающего сайта. Диатела могут быть моноспецифичными, биспецифичными, триспецифичными и т.д., таким образом, будучи способными одновременно связываться с одним, двумя, тремя или более различными эпитопами (которые могут принадлежать одному или различным антигенам). Диатела дополнительно могут быть моновалентными, бивалентными, тривалентными, тетравалентными, пентавалентными, гексавалентными и т.д., будучи таким образом способными связываться одновременно с одной, двумя, тремя, четырьмя, пятью, шестью или более молекулами. Эти два свойства диател (т.e., степень специфичности и валентность могут объединяться, например, с получением биспецифичных антител (т.e., способных связываться с двумя эпитопами), которые являются тетравалентными (т.e., способны связываться с четырьмя наборами эпитопов), и т.д. Молекулы диател раскрыты в PCT Публикациях WO 2006/113665, WO 2008/157379 и WO 2010/080538.
[0062] При использовании в данном документе, говорят, что антитело или полипептид “специфично” связывается с областью другой молекулы (т.e., эпитопом), если оно реагирует или ассоциирует более часто, более быстро с большей продолжительностью и/или с большей аффинностью с этим эпитопом относительно альтернативных эпитопов. Например, антитело, которое специфично связывается с вирусным эпитопом, представляет собой антитело, которое связывается с этим вирусным эпитопом с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими вирусными эпитопами или с не вирусными эпитопами. Также понятно при чтении данного определения, что например антитело (или компонент или эпитоп), которое специфично связывается с первой мишенью, может или не может специфично или предпочтительно связываться со второй мишенью. Как таковое, “специфичное связывание” не требует необходимого (хотя оно может включать) исключительного связывания. Как правило, но не необходимо, ссылка на связывание означает “специфичное” связывание.
[0063] При использовании в данном документе, термин “иммунологически активный” в отношении эпитопа или “остающийся иммунологически активным” относится к способности антитела (например, противовирусного антитела или антитела, которое связывается с активирующим рецептором иммунной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор) связываться с эпитопом при различных условиях, например, после того, как эпитоп был подвергнут восстанавливающим и денатурирующим условиям.
[0064] Различные биологические функции ассоциированы с противовирусными антителами, с антителами, которые связываются с активирующим рецептором иммунной клетки, или с антителами, которые связываются с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор, включая в частности одно или несколько условий из следующих: способность специфично связываться с таким вирусным эпитопом или с таким активирующим рецептором (и конкретно такие молекулы, которые экспрессируются на поверхности человеческих клеток или клеток млекопитающего, но не человека); способность конкурентно ингибировать предпочтительное связывание известного противовирусного антитела или известного антитела, способного связываться с активирующим рецептором иммунной клетки, включая способность предпочтительного связывания с тем же эпитопом, с которым предпочтительно связывается исходное антитело; способность связываться с участком вирусного белка, содержащим такой эпитоп, или с участком такого активирующего рецептора иммунной клетки, который экспонирован на поверхности живой клетки in vitro или in vivo; способность связываться с участком вирусного белка, содержащим такой эпитоп, или с участком такого активирующего рецептора иммунной клетки, который экспонирован на поверхности живой клетки, такой клетки, как, в частности, экспрессирующей вирусный белок, содержащий такой эпитоп или такой активирующий рецептор на своей поверхности; и/или способность доставки терапевтического агента или детектируемого маркера в клетки, экспрессирующие такие молекулы на своей поверхности. Как обсуждалось в данном документе, полипептиды (включая антитела) по изобретению могут иметь любую из этих характеристик, при условии, что они демонстрируют активность по отношению к иммунным эффекторным клеткам, которые экспрессируют активирующий рецептор, или к вирусно-инфицированной клетке.
[0065] При использовании в данном документе, термин “агент” относится к биологическому, фармацевтическому или к химическому соединению. Частные примеры включают простую или сложную органическую или неорганическую молекулу, пептид, белок, олигонуклеотид, антитело, антительное производное, антительный фрагмент, витаминное производное, углевод, токсин или химиотерапевтическое соединение. Различные соединения могут быть синтезированы, например, низкомолекулярные соединения и олигомеры (например, олигопептиды и олигонуклеотиды), и синтетические органические соединения на основе различных коровых структур. Кроме того, различные натуральные источники могут обеспечивать соединения для скрининга, такие как растительные или животные экстракты и тому подобные.
[0066] Агенты, которые применяются в способах по изобретению, могут быть случайно или рационально выбраны или могут быть сконструированы. При использовании в данном документе, говорят, что агент выбран случайно, когда агент выбирают без предварительного рассмотрения или изучения конкретных аминокислотных или других химических компонентов, вовлеченных в ассоциацию молекулы с ее нативными партнерами по связыванию или с известными антителами. Примером случайно выбранного агента является агент, который идентифицирован посредством использования и скрининга химической библиотеки или пептидной комбинаторной библиотеки.
[0067] При использовании в данном документе, говорят, что агент выбран рационально, когда агент выбирают на неслучайно основе, которая принимает во внимание последовательность сайта-мишени и/или его конформацию в связи с функцией агента. Данное изобретение также охватывает агенты, которые функционируют в сайтах взаимодействия между таким активирующим рецептором и его нативным партнером по связыванию, хотя другие лиганды и их взаимодействующие сайты также охвачены рамками данного изобретения, либо которые уже известны, либо идентифицированы позже. Агенты могут быть рационально выбраны или рационально сконструированы путем применения пептидных последовательностей, которые имеют структуру контактных сайтов рецептора/лиганда и/или комплекса рецептор-антитело. Например, рационально выбранный пептидный агент может представлять собой пептид, чья аминокислотная последовательность идентична эпитопу, появляющемуся на вирусном белке или на активирующем рецепторе иммунной клетки, который экспонируется на поверхности живой клетки в ее нативном окружении. Такой агент будет уменьшать или блокировать ассоциацию вирусного белка или активирующего рецептора с антителом, или ассоциацию такого вирусного белка или активирующего рецептора с его нативным лигандом, если необходимо, путем связывания с антителом или с нативным лигандом.
[0068] При использовании в данном документе, подразумевается, что термин “меченый”, в отношении антитела, охватывает прямое мечение антитела путем соединения (т.е., физического связывания) детектируемого вещества, такого как радиоактивный агент или флуорофор (например, фикоэритрин (PE) или флуоресцеин изотиоцианат (также известный как флюороизотиоцианат или FITC)) к антителу, а также косвенное мечение зонда или антитела путем реакции с детектируемым веществом.
[0069] При использовании в данном документе, термин “ассоциация”, по отношению к антителу, включает ковалентное и нековалентное присоединение или связывание агента (например, химиотерапевтического агента) с антителом. Антитело может быть ассоциировано с агентом (например, с химиотерапевтическим агентом) путем прямого связывания или косвенного связывания посредством присоединения на обычной платформе, так что антитело направляет локализацию агента к инфицированной клетке, с которой антитело связывается и где антитело и агент, по существу, не диссоциируют при физиологических условиях, так что агент не направляется к той же инфицированной клетке, с которой связывается антитело, или так, что эффективность агента не уменьшается.
[0070] Термин "биологический образец" охватывает множество типов образцов, полученных из домашних животных, и которые могут быть применены в диагностическом или мониторинговом анализе. Определение охватывает слюну, кровь и другие жидкие образцы биологического происхождения, твердые тканевые образцы, такие как биоптаты или тканевые культуры или клетки, полученные из них и их потомство, например, клетки, полученные из тканевого образца индивидуума, предрасположенного или имеющего вирусную инфекцию. Определение также включает образцы, которые были изменены каким-либо образом после их получения, например, обработкой реагентами, солюбилизацией или обогащением определенными компонентами, такими как белки или полинуклеотиды, или включением в полутвердый или в твердый матрикс для целей изготовления срезов. Термин "биологический образец" охватывает клинический образец, а также включает клетки в культуре, клеточные надосадочные жидкости, клеточные лизаты, сыворотку, плазму, биологическую жидкость и тканевые образцы.
[0071] Термин “клетка-хозяин” включает индивидуальную клетку или клеточную культуру, которая может представлять собой или является реципиентом вектора(ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство единственной клетки-хозяина, и потомство необязательно может быть полностью идентичным (по морфологии или комплементарно геномной ДНК) с исходной родительской клеткой благодаря естественной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) по настоящему изобретению.
[0072] При использовании в данном документе, термин “задержка развития инфекции” означает отсрочку, торможение, замедление, задержку, стабилизацию и/или отложенное развитие такой инфекции. Данная задержка может иметь вариации по продолжительности времени в зависимости от истории развития инфекции и/или от индивидуума, который подвергается лечению. Специалисту в данной области очевидно, что достаточная или значительная задержка может охватывать в сущности предотвращение, при котором у индивидуума не развивается инфекция.
[0073] При использовании в данном документе, “эффективное количество” фармацевтической композиции в одном варианте осуществления представляет собой количество, достаточное для эффективных полезных или желаемых результатах, включающих, в частности, клинические результаты, такие как уменьшение симптомов инфекции, появляющееся в результате ослабления заболевания, (например, уменьшение вирусной нагрузки, лихорадки, боли, сепсиса и т.д.), повышение качества жизни тех, кто страдает от заболевания, снижение дозы других лекарственных средств, требующихся для лечения заболевания, усиление эффекта другого лекарственного средства, как например, посредством направленного воздействия и/или интернализации, замедление прогрессии заболевания и/или пролонгация выживаемости индивидуумов. Эффективное количество может вводиться посредством одного или нескольких введений. Для целей настоящего изобретения эффективное количество лекарственного средства, соединения или фарамцевтической композиции представляет собой количество, достаточное для уменьшения пролиферации (или эффекта) вирусного присутствия и для уменьшения и/или задержки развития вирусного заболевания либо прямо, либо косвенно. В некоторых воплощениях, эффективное количество лекарственного средства, соединения или фармацевтической композиции может или не может достигаться совместно с другим лекарственным средством, соединением или с фармацевтической композицией. Таким образом, “эффективное количество” может рассматриваться в контексте введения одного или нескольких химиотерапевтических агентов, и единственный агент может рассматриваться, как принимаемый в эффективном количестве совместно с одним или несколькими другими агентами, если может быть достигнут или достигается целевой результат. Если требуются индивидуальные вариации, то определение оптимальных интервалов эффективных количеств каждого компонента известно специалисту в данной области. Типичные дозировки для введения антитела включают одну или несколько однократных доз от 0,1-до 100 мг/на кг массы тела. Предпочтительные дозировки включают 1-100 мг/на кг массы тела. Наиболее предпочтительные дозировки включают 10 мг/на кг массы тела - 100 мг/на кг массы тела. Типичные дозы для введения биспецифичных молекул (например, диатела и BiTE) включают одну или несколько однократных доз 0,0001 мг/на кг массы тела - 100 мг/на кг массы тела. Предпочтительно, вводимая дозировка составляет от 0,0001 мг/на кг массы тела - 20 мг/на кг массы тела, 0,0001 мг/на кг массы тела - 10 мг/на кг массы тела, 0,0001 мг/на кг массы тела - 5 мг/на кг массы тела, 0,0001 мг/на кг массы тела - 2 мг/на кг массы тела, 0,0001 мг/на кг массы тела - 1 мг/на кг массы тела, или 0,0001 мг/на кг массы тела - 0,75 мг/на кг массы тела.
[0074] При использовании в данном документе, говорят, что молекула нуклеиновой кислоты или агент, антитело, композиция или клетка и т.д. является “выделенной”, когда молекула нуклеиновой кислоты, агент, антитело, композиция или клетка и т.д. по существу отделены от контаминантных молекул нуклеиновой кислоты, антител, агентов, композиций или клеток и т.д., естественно присутствующих в их исходном источнике.
[0075] Термин “индивидуум” относится к позвоночному животному, предпочтительно, к млекопитающему. Млекопитающие включают, в частности, людей, сельскохозяйственных животных, спортивных животных, домашних питомцев, приматов, мышей и крыс. В наиболее предпочтительном варианте осуществления, термин индивидуум обозначает человека.
[0076] Термины “полипептид”, “олигопептид”, “пептид” и “белок” используются в данном документе взаимозаменяемо для обозначения полимеров аминокислот любой длины, но особенно длиной выше, чем 5, 10, 15, 20 или 25 аминокислотных остатков. Полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты и он может прерываться не аминокислотными компонентами. Термины также охватывают аминокислотный полимер, который был модифицирован естественно или путем вмешательства; например, с образованием дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгация с компонентом мечения. Также в определение включены, например, полипептиды, содержащие один или несколько аналогов аминокислот (включающих, например, искусственные аминокислоты и т.д.), а также другие модификации, известные в данной области. Понятно, что так как полипептиды по данному изобретению базируются на антителах, то полипептиды могут существовать в виде одиночных цепей или в виде ассоциированных цепей.
[0077] Также рамками изобретения охвачены пептидомиметики биспецифичных молекул, описанных в данном документе. Такие пептидомиметики включают пептиды, где, по меньшей мере, один аминокислотный остаток заменен на аминокислотный остаток, который не является обычным встречающимся в природе, такой как D-изомер аминокислоты или N-алкилированные образцы аминокислот. В других воплощениях пептидомиметики конструируются путем замены, по меньшей мере, одной амидной связи (-C(=O)-NH-) в пептидном агонисте, антагонисте или модуляторе на изостеру амида. Подходящие изостеры амидов включают: -CH2-NH-, -CH2-S-, -CH2-S(O)-, -CH2-S(O)2-, -CH2-CH2-, -CH=CH- (E или Z форма), -C(=O)-CH2-, -CH(CN)-NH-, -C(OH)-CH2- и -O-C(=O)-NH-. Амидные связи в пептидном агонисте, антагонисте или в модуляторе, которые являются подходящими кандидатами для замены на изостеры амидов, включают связи, которые могут гидролизоваться с помощью эндогенных эстераз или протеаз предназначенного объекта обработки пептидного агониста, антагониста или модулятора.
[0078] При использовании в данном документе, термин “по существу чистый” относится к материалу, который, по меньшей мере, на 50% является чистым (т.e., свободен от контоминантов), более предпочтительно, по меньшей мере, на 90% чистым, более предпочтительно, по меньшей мере, на 95% чистым, более предпочтительно, по меньшей мере, на 98% чистым, более предпочтительно, по меньшей мере, на 99% чистым, и наиболее предпочтительно является чистым, выше, чем на 99%.
[0079] При использовании в данном документе, термин “токсин” относится к любому веществу, которое вызывает побочный ответ внутри клетки. Например, токсин, направленный на инфицированную клетку, будет обладать побочным, иногда вредным эффектом на инфицированную клетку. Примеры токсинов включают, в частности, радиоактивные изотопы, калихеамицин и майтанзиноиды.
[0080] При использовании в данном документе, термины “лечение (treatment)” или “излечение (treating)” означают способ получения полезного или желаемого результата, включающего предпочтительно полезный или желаемый клинический результат. Такие полезные или желаемые клинические результаты включают, в частности, один или несколько из следующих: уменьшение пролиферации (или нарушение) инфицированных клеток или других больных клеток, уменьшение симптомов, вызванных заболеванием, повышение качества жизни тех, кто страдает заболеванием, уменьшение дозы других лекарственных средств, требующихся для лечения заболевания, задержка прогрессии заболевания и/или пролонгация выживаемости реципиентов в виде домашних животных.
[0081] При использовании в данном документе, термин “вирусно-инфицированный” относится к клетке, которая была инфицирована вирусом и особенно аденовирусом, адено-ассоциированным вирусом, Вирусом B (вирусом герпеса I макаки), вирусом BK, буньявирусом, вирусом чикунгунья, вирусом Коксаки, коронавирусом, цитомегаловирусом, восточным лошадиным энцефалитом, вирусом эболы, энтеровирусом, вирусом Эпштейна-Барра, хантавирусом, вирусом гепатита A, вирусом гепатита B, вирусом гепатита C, вирусом гепатита D, вирусом гепатита E, вирусом простого герпеса 1, вирусом простого герпеса 2, человеческим пенящими вирусами, человеческим вирусом герпеса 3, человеческим вирусом герпеса 5, человеческим вирусом герпеса 6, человеческим вирусом герпеса 7, человеческим вирусом иммунодефицита, вирусом папилломы человека, человеческим β-лимфотропным вирусом, человеческим вирусом I T-клеточного лейкоза, человеческим вирусом II T-клеточного лейкоза, вирусом гриппа, вирусом JC, JEV, вирусом герпеса, ассоциированным с саркомой Каппоши, Ласса-вирусом, вирусом лимфоцитарного хориоменингита, вирусом Марбурга, вирусом кори, вирусом свинки, вирусом Нипаха, норовирусом, вирусом Норволк, ортореовирусом, вирусом парагриппа, парвовирусом, полиовирусом, вирусом бешенства, реовирусом, респираторно-синцитиальным вирусом, риновирусом, вирусом Рифт-Валли, ротавирусом, вирусом краснухи, вирусом энцефалита Сент Луис, мажорным вирусом оспы, минорным вирусом оспы, вирусом варицелла-зостер, вирусом западного Нила, западным лошадиным вирусом энцефалита, или вирусом желтой лихорадки
III. Методы получения Антител и Полипептидов
[0082] Методы получения моноклональных антител известны в данной области. Один из методов, который может применяться, это метод Kohler, G. et al. (1975) “Continuous Cultures Of Fused Cells Secreting Antibody Of Predefined Specificity,” Nature 256:495-497 или его модификация. Как правило, моноклональные антитела вырабатываются у мышей, крыс или кроликов. Антитела продуцируются с помощью иммунизированных мышей, крыс или кроликов с иммуногенным количеством клеток, клеточных экстрактов или препаратов белков, которые содержат целевой вирусный эпитоп или целевой активирующий рецептор (например, FcγRIIA, FcγRIIA, FcγRIIC, CD3, TCR, CD4, CD2, CD16, и NKG2D, и т.д.) иммунной эффекторной клетки, или белка, присутствующего на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор иммунной клетки, который представляет интерес. Иммуноген может представлять собой, в частности, первичные клетки, культивируемые клеточные линии, злокачественные клетки, нуклеиновые кислоты или ткани. Клетки, используемые для иммунизации, могут культивироваться в течение некоторого периода времени (например, по меньшей мере в течение 24 часов) перед их использованием в качестве иммуногена. Клетки могут использоваться в качестве иммуногенов сами по себе или в комбинации с не денатурирующим адъювантом, таким как Ribi. Как правило, клетки должны поддерживаться интактными и предпочтительно жизнеспособными при использовании в качестве иммуногенов. Интактные клетки могут давать возможность антигенам лучше детектироваться иммунизированным животным, чем поврежденные клетки. Использование денатурирующих или агрессивных адъювантов, например, адъюванта Фрейнда может повреждать клетки и таким образом, не поощряется. Иммуноген может вводиться множество раз с периодическими интервалами, такими как раз в неделю, или может вводиться так, чтобы поддерживать жизнеспособность у животного (например, в рекомбинантной ткани).
[0083] В одном варианте осуществления, моноклональные антитела, которые связываются с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор, получают с использованием клеток-хозяев, которые сверх-экспрессируют такие молекулы.
[0084] Для мониторинга антительного ответа небольшой биологический образец (например, крови) может быть получен из пациента-человека или, более предпочтительно, из млекопитающего, но не человека, и может быть протестирован антительный титр против иммуногена. Селезенка и/или несколько крупных лимфатических узлов такого млекопитающего, но не человека, могут быть удалены и диссоциированы на одиночные клетки. Если целесообразно, клетки селезенки могут скринироваться (после удаления не специфично прикрепленных клеток) путем нанесения клеточной суспензии на чашку или на лунку, покрытую антигеном. B-клетки, экспрессирующие мембранносвязанный иммуноглобулин, специфичный к антигену, будут связываться с чашкой, и не будут смываться с остатком суспензии. Полученные в результате B-клетки, или все диссоциированные клетки селезенки могут быть слиты с клетками миеломы (например, X63-Ag8.653 и клетки из Института SaIk, Центра Распределения Клеток, San Diego, CA). Полиэтиленгликоль (PEG) может использоваться для слияния клеток селезенки или лимфоцитов с клетками миеломы с образованием гибридомы. Гибридому затем культивируют в селективной среде (например, гипоксантин-, аминоптерин-, тимидин-содержащей среде, по другому известной как “среда HAT”). Полученные в результате гибридомы затем высевают на чашку с помощью метода лимитирующего разведения и анализируют на предмет продуцирования антител, которые специфично связываются с иммуногеном, с использованием например, FACS (сортировки флуоресцентно-активированных клеток) или иммуногистохимического (IHC) скрининга. Отобранные гибридомы, секретирующие моноклональное антитело, затем культивируют либо in vitro (например, в культуральных флаконах или в ферментерах с системой полых волокон), либо in vivo (например, как асциты у мышей).
[0085] В качестве альтернативы метода слияния клеток для продуцирования моноклональных антител объекта изобретения могут использоваться В-клетки, иммортализованные вирусом Эпштейна-Барра (EBV). Гибридомы наращивают и субклонируют, если целесообразно, и надосадочные жидкости анализируют на предмет анти-иммуногенной активности с помощью подходящих аналитических процедур (например, FACS, IHC, радиоиммуноанализ, иммуноферментный анализ, иммунофлюоресцентный анализ, и т.д.).
[0086] В другой альтернативе существующие моноклональные антитела и любые другие эквивалентные антитела, которые иммуноспецифичны к целевому вирусному эпитопу или к целевому активирующему рецептору иммунной эффекторной клетки или к белку, присутствующему на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор, могут быть секвенированы и получены рекомбинантно с помощью методов, известных в данной области. В одном варианте осуществления, такое антитело секвенируют и полинуклеотидную последовательность затем клонируют в вектор для экспрессии или наработки. Последовательность, кодирующая антитело, представляющее интерес, может содержаться в векторе в клетке-хозяине, и клетка-хозяин может затем нарабатываться и замораживаться для будущего применения.
[0087] Полинуклеотидная последовательность таких антител может использоваться для генетических манипуляций с получением биспецифичных молекул по изобретению, а также химерного антитела, гуманизированного антитела или канинизированного антитела для улучшения аффинности или других характеристик антитела. Общий принцип гуманизации или канинизации антитела включает сохранение основной последовательности антиген-связывающего участка антитела, при перестановке не человеческого и не собачьего остатка антитела на человеческие или собачьи антительные последовательности. Есть четыре общие стадии гуманизации или канинизации моноклонального антитела. Вот они: (1) определение нуклеотидной и предполагаемой аминокислотной последовательности исходных вариабельных доменов легкой и тяжелой цепи, (2) дизайн гуманизированного антитела или канинизированного антитела, т.е., решение, каркасный участок какого антитела использовать во время процесса гуманизации или канинизации, (3) методологии/методы фактической гуманизации или канинизации и (4) трансфекция и экспрессия гуманизированного антитела. См., например, Патенты США № 4816567; 5807715; 5866692; и 6331415.
[0088] Фрагменты одноцепочечных вариабельных областей (“scFv”) получают путем соединения вариабельных областей легкой и/или тяжелой цепи путем использования короткого линкерного пептида. Bird et al. (1988) (“Single-Chain Antigen-Binding Proteins,” Science 242:423-426) описывает пример линкерных пептидов, которые соединяют приблизительно 3,5 нм между C-концом одной вариабельной области и N-концом другой вариабельной области. Линкеры других последовательностей были созданы и использовались (Bird et al. (1988) “Single-Chain Antigen-Binding Proteins,” Science 242:423-426). Линкеры могут, в свою очередь, быть модифицированы для получения дополнительных функций, как например, путем присоединения лекарственных средств или присоединение к твердым подложкам. Одноцепочечные варианты могут быть получены или рекомбинантно, или синтетически. Для синтетического получения scFv, могут использоваться автоматические синтезаторы. Для рекомбинантного получения scFv, подходящая плазмида, содержащая полинуклеотид, который кодирует scFv, может быть введена в подходящие клетки-хозяева, либо в эукариотические клетки, такие как дрожжевые, растительные, клетки насекомых или клетки млекопитающих, либо в прокариотические клетки, такие как E. coli. Полинуклеотиды, кодирующие scFv, представляющий интерес, могут быть получены с помощью стандартных манипуляций, таких как лигирование полинуклеотидов. Полученный в результате scFv может быть выделенным с использованием стандартных методов очистки белка, известных в данной области.
[0089] Изобретение включает модификации для биспецифичных молекул по изобретению, которые не оказывают значительного влияния на их свойства и варианты, которые обладают повышенной или пониженной активностью. Модификация полипептидов представляет собой стандартную практику данной области техники и не нуждается в подробном описании в данном документе. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, с одной или несколькими делециями или вставками аминокислот, которые не несут значительного вредного изменения функциональной активности, или включают применение химических аналогов. Аминокислотные остатки, которые могут быть консервативно заменены на другие, включают, в частности: глицин/аланин; валин/изолейцин/лейцин; аспарагин/глутамин; аспарагиновая кислота/глутаминовая кислота; серин/треонин; лизин/аргинин; и фенилаланин/тирозин. Эти полипептиды также включают гликозилированные и не гликозилированные полипептиды, а также полипептиды с другими пост-трансляционными модификациями, такими как, например, гликозилирование с различными сахарами, ацетилирование и фосфорилирование. Предпочтительно, аминокислотные замены будут консервативными, т.е., замененная аминокислота будет обладать сходными химическими свойствами, как у исходной аминокислоты. Такие консервативные замены известны в данной области, и их примеры представлены выше. Аминокислотные модификации могут варьироваться от изменения или модификации одной или нескольких аминокислот до полной перестройки области, такой как вариабельная область. Изменения в вариабельной области могут изменять аффинность связывания и/или специфичность. Другие методы модификаций включают использование методов синтеза, известных в данной области, включающих, в частности, ферментативные способы, окислительный обмен и хелатирование. Модификации могут использоваться, например, для присоединения меток для иммуноанализа, такого как присоединение радиоактивных компонентов для иммуноанализа. Модифицированные полипептиды получают с использованием процедур, установленных в данной области, и они могут быть скринированы с использованием стандартных анализов, известных в данной области.
[0090] Изобретение также охватывает сшитые белки, содержащие один или несколько фрагментов или областей из полипептидов и антител по изобретению. В одном варианте осуществления, предлагается химерный полипептид, который содержит, по меньшей мере, 10 непрерывно расположенных аминокислот вариабельной области легкой цепи и, по меньшей мере, 10 аминокислот вариабельной области тяжелой цепи. В другом варианте осуществления, химерный полипептид содержит гетерологичную константную область иммуноглобулина. В другом варианте осуществления, химерный полипептид содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела, полученного из публично доступной гибридомы. Для целей изобретения химерный белок антитела содержит один или несколько полипептидных доменов, которые специфично связываются с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки, или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор и другую аминокислотную последовательность, с которой он не связан в нативной молекуле, например, гетерологичную последовательность или гомологичную последовательность из другой области.
[0091] Антитело против вирусных белков, антитело к активирующему рецептору или антитело к белку, присутствующему на поверхности иммунной эффекторной клетки, которая экспрессирует такой полипептид активирующего рецептора, и другие агонисты, антагонисты и модуляторы могут быть созданы с помощью методов, известных в данной области, например, синтетически или рекомбинантно. Один способ получения таких пептидных агонистов, антагонистов и модуляторов включает химический синтез полипептида с последующей обработкой в окислительных условиях, подходящих для получения нативной конформации, то есть корректных дисульфидных связей. Это может быть осуществлено с использованием методов, хорошо известных специалистам в данной области (см., например, Kelley, R. F. et al. (1990) In: Genetic Engineering Principles and Methods, Setlow, J.K. Ed., Plenum Press, N.Y., vol. 12, pp 1-19; Stewart, J.M et al. (1984) Solid Phase Peptide Synthesis, Pierce Chemical Co., Rockford, IL; см., также Патенты США № 4105603; 3972859; 3842067; и 3862925).
[0092] Полипептиды по изобретению могут быть стандартно получены с использованием твердофазного пептидного синтеза (Merrifield, B. (1986) “Solid Phase Synthesis,” Science 232(4748):341-347; Houghten, R.A. (1985) “General Method For The Rapid Solid-Phase Synthesis Of Large Numbers Of Peptides: Specificity Of Antigen-Antibody Interaction At The Level Of Individual Amino Acids,” Proc. Natl. Acad. Sci. (U.S.A.) 82(15):5131-5135; Ganesan, A. (2006) “Solid-Phase Synthesis In The Twenty-First Century,” Mini Rev. Med. Chem. 6(1):3-10).
[0093] В альтернативном варианте осуществления, антитела могут быть получены рекомбинантно или могут быть экспрессированы с использованием любого метода, известного в данной области. Антитела могут быть получены рекомбинантно путем сначала выделения антител, полученных из животных-хозяев, получения последовательности гена и путем использования последовательности гена для рекомбинантной экспрессии антитела в клетках-хозяевах (например, в клетках CHO). Другой метод может применяться для экспрессии антительной последовательности в растениях (например, в табаке) или в трансгенном молоке. Раскрыты подходящие методы рекомбинантной экспрессии антител в растениях или в молоке (см., например, Peeters et al. (2001) “Production Of Antibodies And Antibody Fragments In Plants,” Vaccine 19:2756; Lonberg, N. et al. (1995) “Human Antibodies From Transgenic Mice,” Int. Rev. Immunol 13:65-93; и Pollock et al. (1999) “Transgenic Milk As A Method For The Production Of Recombinant Antibodies,” J. Immunol Methods 231:147-157). Подходящие методы получения производных антител, например, гуманизированных, одноцепочечных и т.д. известны в данной области. В другой альтернативе, антитела могут быть получены рекомбинантно с помощью технологии фагового дисплея (см., например, Патенты США № 5565332; 5580717; 5733743; 6265150; и Winter, G. et al. (1994) “Making Antibodies By Phage Display Technology,” Annu. Rev. Immunol. 12.433-455).
[0094] Антитела или белки, представляющие интерес, могут быть подвергнуты секвенированию с помощью деградации Эдмана, которая хорошо известна специалистам в данной области. Информация о пептиде, полученная из масс-спектрометрии или деградации Эдмана, может использоваться для дизайна зондов или праймеров, которые используются для клонирования белка, представляющего интерес.
[0095] Альтернативный метод клонирования белка, представляющего интерес, осуществляют с помощью “пэннинга” с использованием белков или их участков для клеток, экспрессирующих антитело или белок, представляющий интерес. Процедура “пэннинга” может быть проведена путем получения библиотеки кДНК из тканей или клеток, которые экспрессируют или сверх-экспрессируют целевые кДНК во втором типе клеток, и путем скрининга трансфецированных клеток второго типа на предмет специфичного связывания с целевым белком. Подробные описания методов, используемых в клонировании генов млекопитающих, кодирующих белки клеточной поверхности, с помощью “пэннинга”, можно обнаружить в данной области техники (см., например, Aruffo, A. et al. (1987) “Molecular Cloning Of A CD28 cDNA By A High-Efficiency COS Cell Expression System,” Proc. Natl. Acad. Sci. (U.S.A.) 84:8573-8577 и Stephan, J. et al. (1999) “Selective Cloning Of Cell Surface Proteins Involved In Organ Development: Epithelial Glycoprotein Is Involved In Normal Epithelial Differentiation,” Endocrinol. 140:5841-5854).
[0096] кДНК, кодирующая антитела, и другие пептидные агонисты, антагонисты и модуляторы могут быть получены с помощью обратной транскрипции мРНК из конкретного типа клеток согласно стандартным методам данной области. Конкретно, мРНК может быть выделена с использованием различных литических ферментов или химических растворов согласно процедурам, представленным в Sambrook et al. выше, или выделена с помощью коммерчески доступных смол, связывающих нуклеиновые кислоты, согласно прилагаемым инструкциям, которые предоставляются производителями (например, Qiagen, Invitrogen, Promega). Синтезированные кДНК затем вводят в экспрессирующий вектор для продуцирования антитела или белка, представляющего интерес, в клетках второго типа. Подразумевается, что экспрессирующий вектор должен быть способен реплицироваться в клетках-хозяевах либо в виде эписом, либо в виде интегрированной части хромосомной ДНК. Подходящие экспрессирующие векторы включают, в частности, плазмиды, вирусные векторы, включающие аденовирусы, адено-ассоциированные вирусы, ретровирусы и космиды.
[0097] Векторы, содержащие интересующие полинуклеотиды, могут быть введены в клетку-хозяин любым из множества соответствующих средств, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию; и инфекцию (например, когда вектор является инфицирующим агентом, таким как вирус вакцинии). Выбор векторов для введения или полинуклеотидов часто будет зависеть от особенностей клетки-хозяина.
[0098] Любая клетка-хозяин, способная к сверх-экспрессии гетерологичной ДНК, может использоваться для целей выделения генов, кодирующих антитело, полипептид или белок, представляющий интерес. Частные примеры подходящих клеток-хозяев млекопитающих включают, в частности, клетки COS, HeLa, и CHO. Предпочтительно, клетки-хозяева экспрессируют кДНК на уровне примерно в 5 раз выше, более предпочтительно, в 10 раз выше, более предпочтительно, в 20 раз выше, более предпочтительно, в 50 раз выше, более предпочтительно, в 100 раз выше, чем уровень в клетках-хозяевах соответствующего эндогенного антитела или белка, представляющего интерес. Скрининг клеток-хозяев на предмет специфичного связывания с целевым белком предпочтительно осуществляют с помощью иммуноанализа или FACS. Таким путем может быть идентифицирована клетка, сверх-экспрессирующая антитело или белок, представляющий интерес.
[0099] Также доступны различные методы, которые могут применяться для продуцирования пептидных агонистов, антагонистов или модуляторов, которые кодируют вставки, делеции или замены в аминокислотной последовательности полученного в результате белка относительно молекулы родительского пептидного агониста, антагониста или модулятора.
[00100] Изобретение включает полипептиды, содержащие аминокислотную последовательность антител по данному изобретению. Полипептиды по данному изобретению могут быть получены с помощью процедур, известных в данной области. Полипептиды могут быть получены с помощью протеолитической или другой деградации антител, с помощью рекомбинантных методов (т.e., одиночные или химерные полипептиды), как описано выше, или с помощью химического синтеза. Полипептиды или антитела, особенно более короткие полипептиды примерно до 50 аминокислот стандартно получают с помощью химического синтез. Методы химического синтеза известны в данной области и являются коммерчески доступными. Например, такой полипептид может быть получен с помощью автоматического полипептидного синтезатора с применением твердофазного метода.
IV. Методы Скрининга Полипептидов и Моноклональных Антител
[00101] Некоторые методы могут использоваться для скрининга полипептидов и моноклональных антител, которые связываются с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор. Понятно, что “связывание” относится к соответствующему биологическому или иммунологическому специфичному связыванию и не относится к не специфичному связыванию, которое может иметь место, например, когда иммуноглобулин используется в очень высоких концентрациях по отношению к специфичной мишени. В одном варианте осуществления, моноклональные антитела скринируются на предмет связывания с целевыми беками или эпитопами с использованием стандартных методов скрининга. Таким образом, могут быть получены моноклональные антитела. Предпочтительные гибридомы по настоящему изобретению, которые продуцируют антитела, направленные против активирующего рецептора иммунной эффекторной клетки, представляют собой такие, которые продуцируют антитела против активирующих рецепторов: CD3, TCR, CD4, CD2, CD16 и NKG2D.
[00102] Могут быть идентифицированы дополнительные моноклональные антитела, которые связываются с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор. Для этой цели моноклональные антитела скринируют на предмет их дифференциальной способности связываться с такими эпитопами или белками, но не с другими эпитопами или белками. Один из способов, который может применяться для скрининга, представляет собой иммуногистохимию (IHC). Стандартные иммуногистохимические методы известны специалистам в данной области. См., например, Animal Cell Culture Methods (J.P. Mather and D. Barnes, eds., Academic Press, NY, Vol. 57, Ch. 18 and 19, pp. 314-350, 1998). Биологические образцы (например, ткани) могут быть получены из биопсий, аутопсий или некропсий. Для того, чтобы выяснить присутствует ли эпитоп только на поверхности иммунной эффекторной клетки, антитела, которые связываются с потенциальными эпитопами, могут использоваться для детектирования иммунных эффекторных клеток. Ткань может погружаться в твердое или полутвердое вещество, которое предотвращает разрушение во время замораживания (например, агарозный гель или OCT), и затем секционируется для окрашивания. Ткани из различных органов и на различных стадиях могут использоваться для скрининга моноклональных антител. Примеры тканей, которые могут использоваться для целей скрининга, включают, в частности, яичники, молочную железу, легкое, предстательную железу, толстую кишку, почку, кожу, щитовидную железу, мозг, сердце, печень, желудок, нервную ткань, кровеносные сосуды, кость, верхний пищеварительный тракт и поджелудочную железу.
[00103] Любая из нескольких различных систем детектирования может использоваться для детектирования связывания антител с тканевыми срезами. Как правило, иммуногистохимия включает связывание первичного антитела с тканью, и затем генерируют вторичное антитело, реактивного против образца из первичного антитела, и конъюгируют с детектируемым маркером (например, с пероксидазой хрена, HRP, или с диаминобензидином, DAB). Другой альтернативный метод, который может использоваться, представляет собой метод polyMICA™ (polyclonal Mirror Image Complementary Antibodies; The Binding Site Limited, Birmingham, UK; Mangham, D.C. et al. (1999) “A Novel Immunohistochemical Detection System Using Mirror Image Complementary Antibodies (MICA),” Histopathology 35(2):129-33). Метод PolyMICA™ может использоваться для тестирования связывания первичных антител с нормальной и инфекционной тканью. Некоторые типы детектирующих наборов polyMICA™ коммерчески доступны: Продукт No. HK004.D представляет собой детектирующий набор polyMICA™, который использует хромоген DAB; Продукт No. HK004.A представляет собой детектирующий набор polyMICA™, который использует хромоген AEC. Альтернативно, первичное антитело может непосредственно метиться с использованием детектируемого маркера.
[00104] Первая стадия в скрининге IHC для отбора подходящего антитела представляет собой связывание первичного антитела, полученного из мыши (например, антитела к активирующему рецептору), с одним или с несколькими иммуногенами (например, с клетками или с образцами тканей). В одном варианте осуществления, образец ткани представляет собой среды замороженной ткани из различных органов. Клетки и образцы тканей могут сдержать либо инфицированные клетки или не инфицированные клетки.
[00105] Замороженные ткани могут быть получены, секционированы с фиксацией или без, и IHC осуществляют с помощью любого из ряда методов, известных специалисту в данной области (см., например, Stephan et al. (1999) “Distribution And Function Of The Adhesion Molecule BEN During Rat Development,” Dev. Biol. 212:264-277 и Stephan et al. (1999) “Selective Cloning Of Cell Surface Proteins Involved In Organ Development: Epithelial Glycoprotein Is Involved In Normal Epithelial Differentiation,” Endocrinology 140:5841-5854).
V. Методы и Характеризация Антител по Настоящему Изобретению
[00106] Любой из нескольких методов может использоваться для характеризации антител по настоящему изобретению. Один из методов представляет собой идентификацию эпитопа, с которым связывается антитело. Картирование эпитопов коммерчески доступно из различных источников, например, Pepscan Systems (Lelystad, The Netherlands). Картирование эпитопов может использоваться для определения последовательности, с которой связывается антитело. Эпитоп может быть линейным эпитопом, т.e., содержится в одном прямом фрагменте аминокислот, или он может быть конформационным эпитопом, образованным трехмерным взаимодействием аминокислот, которые необязательно содержатся в одном прямом фрагменте.
[00107] Пептиды различной длины (например, длиной предпочтительно, по меньшей мере, 4-6 аминокислот) могут быть выделены и синтезированы (например, рекомбинантно) и использованы для анализов связывания с антителом. Эпитоп, с которым связывается антитело, может определяться в систематическом скрининге путем использования перекрывающихся пептидов, выделенных из внеклеточной последовательности, и определения связывания с антителом.
[00108] Еще один метод, который может использоваться для характеризации антитела по настоящему изобретению, представляет собой использование конкурентных анализов с другими антителами, которые, как известно, связываются с тем же антигеном, т.e., для определения связываются ли антитела с тем же эпитопом, что и другие антитела. Примеры коммерчески доступных антител к целевому вирусному эпитопу или к целевому активирующему рецептору иммунной эффекторной клетки или к белку, присутствующему на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор, могут быть доступны и могут быть идентифицированы с использованием анализов связывания, рассмотренных в данном документе. Конкурентные анализы хорошо известны специалистам в данной области, и такие процедуры и иллюстрирующие данные подробно описаны далее в Примерах. Антитела могут быть дополнительно охарактеризованы с помощью тканей, типа вируса или типа иммунной клетки, с которыми они связываются.
[00109] Как обсуждалось выше, некоторые аспекты антител по настоящему изобретению относятся к их способности связываться с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор. Такие антитела могут быть легко идентифицированы путем скрининга среди человеческих антител, реактивных с эффекторными клетками, или среди антител, которые связываются с целевыми вирусными частицами. Частные примеры таких антител, которые связываются с целевым активирующим рецептором иммунной эффекторной клетки, включают антитела OKT3, M291, YTH12.5 к CD3, антитело 1 к CD3 и антитело 2 к CD3; антитело BMA031 к TCR; антитело TRX2 к CD8; антитело TRX1 к CD4; антитело Lo-CD2a к CD2 (ATCC регистрационный номер No: 11423); антитело 3G8 и A9 к CD16; антитело KYK 2.0 к NKG2D.
VI. Предпочтительные Композиции по Настоящему Изобретению
[00110] Настоящее изобретение охватывает композиции, включающие фармацевтические композиции, содержащие биспецифичные молекулы по изобретению, полипептиды, выделенные из таких биспецифичных молекул, полинуклеотиды, включающие последовательности, кодирующие такие биспецифичные молекулы или полипептиды, и другие агенты, как описано в данном документе.
[00111] Что касается антител, которые связываются с целевым вирусным эпитопом, то предпочтительные антитела включают такие, которые связываются с эпитопами аденовируса, адено-ассоциированного вируса, вируса B (вируса герпеса I макаки), вируса BK, буньявируса, вируса чикунгунья, вируса cocksackie, коронавируса (например, белок M и т.д.), цитомегаловируса, восточным лошадиным энцефалитом, вируса эболы, энтеровируса, вируса Эпштейна-Барра (например, LMP-1, LMP-2 и т.д.), хантавируса, вируса гепатита A, вируса гепатита B, вируса гепатита C, вируса гепатита D, вируса гепатита E, вируса простого герпеса 1, вируса простого герпеса 2, человеческого пенящими вирусами, человеческого вируса герпеса 3, человеческого вируса герпеса 5, человеческого вируса герпеса 6, человеческого вируса герпеса 7, человеческого вируса иммунодефицита (например, env, и т.д.), вируса папилломы человека (например, E6, E7, и т.д.), человеческого β-лимфотропным вируса, человеческого вируса I T-клеточного лейкоза, человеческого вируса II T-клеточного лейкоза, вируса гриппа (например, M2 белок, и т.д.), вируса JC, JEV, вируса герпеса, ассоциированным с саркомой Каппоши, Ласса-вируса, вируса лимфоцитарного хориоменингита, вируса Марбурга, вируса кори, вируса свинки, вируса Нипаха, норовируса, вируса Норволк, ортореовируса, вируса парагриппа, парвовируса, полиовируса, вируса бешенства, реовируса, респираторно-синцитиальным вируса (например, M белок, и т.д.), риновируса, вируса Рифт-Валли, ротавируса, вируса краснухи, вируса энцефалита Сент Луис, мажорным вируса оспы, минорным вируса оспы, вируса варицелла-зостер, вируса западного Нила, западным лошадиным вируса энцефалита, или вируса желтой лихорадки. Такие антитела являются коммерчески доступными из широкого спектра источников или могут быть получены с помощью иммунизации мышей или других животных (включая для получения моноклональных антител) с помощью таких вирусов.
[00112] Что касается антител, которые связываются с целевым активирующим рецептором иммунной эффекторной клетки, то предпочтительные антитела включают антитела OKT3, M291, YTH12.5 к CD3, антитело 1 к CD3 и антитело 2 к CD3; антитело BMA031 к TCR; антитело TRX2 к CD8; антитело TRX1 к CD4; антитело Lo-CD2a к CD2 (ATCC регистрационный номер No: 11423); антитело 3G8 и A9 к CD16; антитело KYK 2.0 к NKG2D. Аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи этих антител представлены ниже. Специалисты в данной области, таким образом, смогут сконструировать биспецифичные молекулы, содержащие такие CDR, а также антитела и их производные, включающие их гуманизированные производные, способные связываться с эпитопами, распознаваемыми этими антителами.
Антитела к CD3
OKT3
Вариабельная область легкой цепи OKT3 (SEQ ID NO:1) (CDR показаны подчеркиванием):
QIVLTQSPAI MSASPGEKVT MTCSASSSVS YMNWYQQKSG TSPKRWIYDT
SKLASGVPAH FRGSGSGTSY SLTISGMEAE DAATYYCQQW SSNPFTFGSG
TKLEINR
Вариабельная область тяжелой цепи OKT3 (SEQ ID NO:2) (CDR показаны подчеркиванием):
QVQLQQSGAE LARPGASVKM SCKASGYTFT RYTMHWVKQR PGQGLEWIGY
INPSRGYTNY NQKFKDKATL TTDKSSSTAY MQLSSLTSED SAVYYCARYY
DDHYCLDYWG QGTTLTVSSA KTTAPSVYPL APVCGDTTGS SVTLGCLVKG
YFPEPVTLTW NSGSLSSGVH TFPAVLQSDL YTLSSSVTVT SS
M291
Вариабельная область легкой цепи M291 (SEQ ID NO:3) (CDR показаны подчеркиванием):
DIVLTQSPAI MSASPGEKVT MTCSASSSVS YMNWYQQKSG TSPKRWTYDT
SKLASGVPAR FSGSGSGTSY SLTISSMEAE DADTYYCQQW SSNPPTFGSG
TKLEIK
Вариабельная область тяжелой цепи M291 (SEQ ID NO:4) (CDR показаны подчеркиванием):
QVQLQQSGAE LARPGASVKM SCKASGYTFI SYTMHWVKQR PGQGLEWIGY
INPRSGYTHY NQKLKDKATL TADKSSSSAY MQLSSLTSED SAVYYCARSA
YYDYDGFAYW GQGTLVTVSA
YTH12.5
Вариабельная область легкой цепи YTH12.5 (SEQ ID NO:5) (CDR показаны подчеркиванием):
MGWSCIILFL VATATGVHSD IQLTQPNSVS TSLGSTVKLS CTLSSGNIEN
NYVHWYQLYE GRSPTTMIYD DDKRPDGVPD RFSGSIDRSS NSAFLTIHNV
AIEDEAIYFC HSYVSSFNVF GGGTKLTVLR
Вариабельная область тяжелой цепи YTH12.51 (SEQ ID NO:6) (CDR показаны подчеркиванием):
MGWSCIILFL VATATGVHSE VQLLESGGGL VQPGGSLRLS CAASGFTFSS
FPMAWVRQAP GKGLEWVSTI STSGGRTYYR DSVKGRFTIS RDNSKNTLYL
QMNSLRAEDT AVYYCAKFRQ YSGGFDYWGQ GTLVTVSS
Антитело 1 к CD3
Вариабельная область легкой цепи антитела 1 к CD3 (SEQ ID NO:7) (CDR показаны подчеркиванием):
QVVLTQSPAI MSAFPGEKVT MTCSASSSVS YMNWYQQKSG TSPKRWIYDS
SKLASGVPAR FSGSGSGTSY SLTISSMETE DAATYYCQQW SRNPPTFGGG
TKLQITR
Вариабельная область тяжелой цепи антитела 1 к CD3 (SEQ ID NO:8) (CDR показаны подчеркиванием):
QVQLQQSGAE LARPGASVKM SCKASGYTFT RSTMHWVKQR PGQGLEWIGY
INPSSAYTNY NQKFKDKATL TADKSSSTAY MQLSSLTSED SAVYYCASPQ
VHYDYNGFPY WGQGTLVTVS S
Антитело 2 к CD3
Вариабельная область легкой цепи антитела 2 к CD3 (SEQ ID NO:9) (CDR показаны подчеркиванием):
QAVVTQESAL TTSPGETVTL TCRSSTGAVT TSNYANWVQE KPDHLFTGLI
GGTNKRAPGV PARFSGSLIG DKAALTITGA QTEDEAIYFC ALWYSNLWVF
GGGTKLTVLG
Вариабельная область тяжелой цепи антитела 2 к CD3 (SEQ ID NO:10) (CDR показаны подчеркиванием):
EVQLVESGGG LVQPKGSLKL SCAASGFTFN TYAMNWVRQA PGKGLEWVAR
IRSKYNNYAT YYADSVKDRF TISRDDSQSI LYLQMNNLKT EDTAMYYCVR
HGNFGNSYVS WFAYWGQGTL VTVSA
Антитела к TCR
BMA031
Вариабельная область легкой цепи BMA031 (SEQ ID NO:11) (CDR показаны подчеркиванием):
QIVLTQSPAI MSASPGEKVT MTCSATSSVS YMHWYQQKSG TSPKRWIYDT
SKLASGVPAR FSGSGSGTSY SLTISSMEAE DAATYYCQQW SSNPLTFGAG
TKLELK
Вариабельная область тяжелой цепи BMA031 (SEQ ID NO:12) (CDR показаны подчеркиванием):
EVQLQQSGPE LVKPGASVKM SCKASGYKFT SYVMHWVKQK PGQGLEWIGY
INPYNDVTKY NEKFKGKATL TSDKSSSTAY MELSSLTSED SAVHYCARGS
YYDYDGFVYW GQGTLVTVSA
Антитела к CD8
TRX2
Вариабельная область легкой цепи TRX2 (SEQ ID NO:13) (CDR показаны подчеркиванием):
DIQMTQSPSS LSASVGDRVT ITCKGSQDIN NYLAWYQQKP GKAPKLLIYN
TDILHTGVPS RFSGSGSGTD FTFTISSLQP EDIATYYCYQ YNNGYTFGQG
TKVEIK
Вариабельная область тяжелой цепи TRX2 (SEQ ID NO:14) (CDR показаны подчеркиванием):
QVQLVESGGG VVQPGRSLRL SCAASGFTFS DFGMNWVRQA PGKGLEWVAL
IYYDGSNKFY ADSVKGRFTI SRDNSKNTLY LQMNSLRAED TAVYYCAKPH
YDGYYHFFDS WGQGTLVTVSS
Антитела к CD4
TRX1
Вариабельная область легкой цепи TRX1 (SEQ ID NO:15) (CDR показаны подчеркиванием):
DIVMTQSPDS LAVSLGERAT INCKASQSVD YDGDSYMNWY QQKPGQPPKL
LIYVASNLES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSLQDPP
TFGGGTKVEI KR
Вариабельная область тяжелой цепи TRX1 (SEQ ID NO:16) (CDR показаны подчеркиванием):
QVQLVQSGAE VKKPGASVKV SCKASGYTFT AYVISWVRQA PGQGLEWMGE
IYPGSGSSYY NEKFKGRVTM TRDTSTSTVY MELSSLRSED TAVYYCARSG
DGSRFVYWGQ GTLVTVSS
Антитела к CD2
Lo-CD2a (ATCC регистрационный номер No: 11423)
Вариабельная область легкой цепи Lo-CD2a (SEQ ID NO:17) (CDR показаны подчеркиванием):
DVVLTQTPPT LLATIGQSVS ISCRSSQSLL HSSGNTYLNW LLQRTGQSPQ
PLIYLVSKLE SGVPNRFSGS GSGTDFTLKI SGVEAEDLGV YYCMQFTHYP
YTFGAGTKLE LK
Вариабельная область тяжелой цепи Lo-CD2a (SEQ ID NO:18) (CDR показаны подчеркиванием):
EVQLQQSGPE LQRPGASVKL SCKASGYIFT EYYMYWVKQR PKQGLELVGR
IDPEDGSIDY VEKFKKKATL TADTSSNTAY MQLSSLTSED TATYFCARGK
FNYRFAYWGQ GTLVTVSS
Антитела к CD16
3G8
Вариабельная область легкой цепи 3G8 (SEQ ID NO:19) (CDR показаны подчеркиванием):
DTVLTQSPAS LAVSLGQRAT ISCKASQSVD FDGDSFMNWY QQKPGQPPKL
LIYTTSNLES GIPARFSASG SGTDFTLNIH PVEEEDTATY YCQQSNEDPY
TFGGGTKLEI K
Вариабельная область тяжелой цепи 3G8 (SEQ ID NO:20) (CDR показаны подчеркиванием):
QVTLKESGPG ILQPSQTLSL TCSFSGFSLR TSGMGVGWIR QPSGKGLEWL
AHIWWDDDKR YNPALKSRLT ISKDTSSNQV FLKIASVDTA DTATYYCAQI
NPAWFAYWGQ GTLVTVSA
A9
Вариабельная область легкой цепи A9 (SEQ ID NO:21) (CDR показаны подчеркиванием):
DIQAVVTQES ALTTSPGETV TLTCRSNTGT VTTSNYANWV QEKPDHLFTG
LIGHTNNRAP GVPARFSGSL IGDKAALTIT GAQTEDEAIY FCALWYNNHW
VFGGGTKLTVL
Вариабельная область тяжелой цепи A9 (SEQ ID NO:22) (CDR показаны подчеркиванием):
QVQLQQSGAE LVRPGTSVKI SCKASGYTFT NYWLGWVKQR PGHGLEWIGD
IYPGGGYTNY NEKFKGKATV TADTSSRTAY VQVRSLTSED SAVYFCARSA
SWYFDVWGAR TTVTVSS
Антитела к NKG2D
KYK 1.0
Вариабельная область легкой цепи KYK 1.0 (SEQ ID NO:23) (CDR показаны подчеркиванием):
QPVLTQPSSV SVAPGETARI PCGGDDIETK SVHWYQQKPG QAPVLVIYDD
DDRPSGIPER FFGSNSGNTA TLSISRVEAG DEADYYCQVW DDNNDEWVFG
GGTQLTVL
Вариабельная область тяжелой цепи KYK 1.0 (SEQ ID NO:24) (CDR показаны подчеркиванием):
EVQLVESGGG VVQPGGSLRL SCAASGFTFS SYGMHWVRQA PGKGLEWVAF
IRYDGSNKYY ADSVKGRFTI SRDNSKNTKY LQMNSLRAED TAVYYCAKDR
FGYYLDYWGQ GTLVTVSS
KYK 2.0
Вариабельная область легкой цепи KYK 2.0 (SEQ ID NO:25) (CDR показаны подчеркиванием):
QSALTQPASV SGSPGQSITI SCSGSSSNIG NNAVNWYQQL PGKAPKLLIY
YDDLLPSGVS DRFSGSKSGT SAFLAISGLQ SEDEADYYCA AWDDSLNGPV
FGGGTKLTVL
Вариабельная область тяжелой цепи KYK 2.0 (SEQ ID NO:26) (CDR показаны подчеркиванием):
QVQLVESGGG LVKPGGSLRL SCAASGFTFS SYGMHWVRQA PGKGLEWVAF
IRYDGSNKYY ADSVKGRFTI SRDNSKNTLY LQMNSLRAED TAVYYCAKDR
GLGDGTYFDY WGQGTTVTVS S
[00113] В изобретении предлагаются конъюгаты любого антитела, агониста или антагониста, которые связываются с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор.
[00114] Эти конъюгаты, включающие агонисты, антагонисты или модуляторы, ковалентно связанные с макромолекулой, такой как любой нерастворимый, твердый матрикс подложки, использовались в процедурах диагностики, скрининга или очистки, описанных в данном документе. Подходящие матриксные материалы включают любое вещество, которое является химически инертным, обладает высокой пористостью и имеет большое количество функциональных групп, способных образовывать ковалентные связи с пептидными лигандами. Примеры матриксных материалов и процедур для получения конъгатов матрикс-лиганд описаны в Dean et al. (Eds) Affinity Chromatography: A Practical Approach, IRL Press (1985); Lowe, “An Introduction to Affinity Chromatography”, in Work et al. (Eds) Laboratory Techniques in Biochemistry and Molecular Biology, Vol. 7, Part II, North-Holland (1979); Porath et al., “Biospecific Affinity Chromatography”, in Neurath, H. et al. (Eds), The Proteins, 3rd ed., Vol. 1, pp. 95-178 (1975); и Schott, H. Affinity Chromatography, Marcel Dekker, Inc. NY (1984).
[00115] Антитело, агонист или антагонист, которые связываются с целевым вирусным эпитопом или с целевым активирующим рецептором иммунной эффекторной клетки или с белком, присутствующим на поверхности иммунной эффекторной клетки, которая экспрессирует такой активирующий рецептор, дополнительно идентифицируют и характеризуют с помощью способности специфично связываться с молекулами, которые экспрессируются на поверхностях человеческих клеток и/или клеток домашнего животного, и необязательно с помощью любого (одного или нескольких) из следующих критериев:
(a) способность конкурентно ингибировать предпочтительное связывание известного антитела с таким эпитопом или белком, включая способность предпочтительного связывания с тем же эпитопом, с которым связывается исходное антитела;
(b) способность связываться с частью такого эпитопа или белка, который экспонирован на поверхностях живых человеческих клеток или клеток млекопитающих, но не человека, in vitro или in vivo;
(c) способность доставки химиотерапевтического агента с человеческой клеткой и/или с клеткой млекопитающего, но не человека, которая экспрессирует такой эпитоп или белок на своей поверхности; и/или
(f) способность доставки терапевтического агента или детектируемого маркера в человеческую клетку и/или в клетку млекопитающего, но не человека, которая экспрессирует такой эпитоп или белок на своей поверхности.
[00116] В изобретении также предлагаются полипептиды, содержащие аминокислотную последовательность антител по изобретению. В некоторых воплощениях, полипептид содержит одну или несколько вариабельных областей легкой цепи и/или тяжелой цепи антитела. В некоторых воплощениях, полипептид содержит одну или несколько CDR легкой цепи и/или тяжелой цепи антитела. В некоторых воплощениях, полипептид содержит три CDR легкой цепи и/или тяжелой цепи антитела. В некоторых воплощениях, полипептид содержит аминокислотную последовательность антитела, которое содержит следующее: по меньшей мере, 5 непрерывно расположенных аминокислот последовательности исходного антитела, по меньшей мере, 8 непрерывно расположенных аминокислот, по меньшей мере, примерно 10 непрерывно расположенных аминокислот, по меньшей мере, примерно 15 непрерывно расположенных аминокислот, по меньшей мере, примерно 20 непрерывно расположенных аминокислот, по меньшей мере, примерно 25 непрерывно расположенных аминокислот, по меньшей мере, примерно 30 непрерывно расположенных аминокислот, где, по меньшей мере, 3 из аминокислот взяты из вариабельной области антитела. В одном варианте осуществления, вариабельная область взята из легкой цепи исходного антитела. В другом варианте осуществления, вариабельная область взята из тяжелой цепи антитела. В другом варианте осуществления, 5 (или более) непрерывно расположенных аминокислот взяты из гипервариабельной области (CDR) антитела.
VII. Биспецифичные Диатела (Реагенты с Перестройкой Двойной Аффинности)
[00117] Как обсуждалось выше, настоящее изобретение охватывает “молекулы биспецифичных антител (реагент с перестройкой двойственной аффинности), которые содержат, по меньшей мере, две полипептидные цепи, которые образуют, по меньшей мере, два эпитопсвязывающих сайта, по меньшей мере, один из которых специфично связывается с эпитопом белка, экспрессированного на поверхности иммунной эффекторной клетки, где иммунная эффекторная клетка экспрессирует активирующий рецептор эффекторной клетки, и, по меньшей мере, один из которых специфично связывается с эпитопом антигена, экспрессированного клеткой, инфицированной вирусом; где антиген детектируемо присутствует на клетке, инфицированной вирусом на уровне, который выше, чем уровень, на котором антиген детектируется на вирусе с помощью биспецифичной молекулы.
[00118] В предпочтительных воплощениях (Фигура 1A), первая полипептидная цепь диатела содержит:
(i) домен (A), содержащий область связывания вариабельного домена легкой цепи первого иммуноглобулина(VL1), специфичного к эпитопу (1);
(ii) домен (B), содержащий область связывания вариабельного домена тяжелой цепи второго иммуноглобулина(VH1), специфичного к эпитопу (2); и
(iii) домен (C).
[00119] Вторая полипептидная цепь такого диатела содержит:
(i) домен (D), содержащий область связывания вариабельного домена легкой цепи второго иммуноглобулина(VL2), специфичного к эпитопу (2);
(ii) домен (E), содержащий область связывания вариабельного домена тяжелой цепи первого иммуноглобулина(VH1), специфичного к эпитопу (1); и
(iii) домен (F).
[00120] Эпитоп (1) выше может относиться к эпитопу вирусного белка, а эпитоп (2) относится к эпитопу активирующего рецептора или к эпитопу белка, экспрессированного на поверхности иммунной эффекторной клетки, которая экспрессирует активирующий рецептор. Альтернативно, Эпитоп (1) выше может относиться к эпитопу активирующего рецептора или к эпитопу белка, экспрессированного на поверхности иммунной эффекторной клетки, которая экспрессирует активирующий рецептор, и эпитоп (2) к эпитопу вирусного белка.
[00121] Домены (A) и (B) диатела не ассоциированы друг с другом с образованием эпитопсвязывающего сайта. Аналогично, домены (D) и (E) диатела не ассоциированы друг с другом с образованием эпитопсвязывающего сайта. Наоборот домены (A) и (E) диатела ассоциированы с образованием сайта связывания, который связывается с эпитопом (1); а домены (B) и (D) указанного диатела ассоциированы с образованием сайта связывания, который связывается с указанным эпитопом (2). Домены (C) и (F) ковалентно ассоциированы вместе. Методы образования молекул диатела и специфичные ориентации доменов диатела раскрыто в Патентных Публикациях США № 2010/0174053, US 2009/0060910 и US 2007/0004909.
[00122] Каждая полипептидная цепь молекулы диатела содержит VL-домен и VH-домен, которые ковалентно связаны, так что домены ограничены от самосборки. Взаимодействие двух из полипептидных цепей будет продуцировать две пары VL-VH с образованием двух эпитопсвязывающих сайтов, т.e., бивалентной молекулы. Ни VH-домен, или VL-домен не ограничивается никаким положением внутри полипептидной цепи, т.e., ограниченные по амино- (N) или карбокси-концу (C), не являются доменами, которые ограничены их относительными положениями друг по отношению к другу, т.e., VL-домен может быть N-концевым по отношению к VH-домену и наоборот; однако, предпочтительно, что VL-домен может быть N-концевым по отношению к VH-домену. Единственное ограничение заключается в том, что комплементарная полипептидная цепь доступна с целью образования функциональных диател. В случае, где VL- и VH-домены выделены из одного и того же антитела, две комплементарные полипептидные цепи могут быть идентичными. Например, в случае, где домены связывания выделены из антитела, специфичного к эпитопу A (т.e., домен связывания образован из VLA-VHA взаимодействия), причем каждый полипептид будет содержать VHA и VLA. Гомодимеризация двух полипептидных цепей антитела будет приводить к образованию двух VLA-VHA сайтов связывания, приводящих к получению бивалентного моноспецифичного антитела (Фигура 1A). В случае, где VL- и VH-домены выделены из антител, специфичных к различным антигенам, образование функционального биспецифичного диатела требует взаимодействия двух различных полипептидных цепей, т.e., образования гетеродимера. Например, для биспецифичного диатела одна полипептидная цепь будет содержать VLA и VLB; причем гомодимеризация указанной цепи будет приводить в результате к образованию двух VLA-VHB сайтов связывания, либо к отсутствию связывания, либо к не предсказуемому связыванию. Напротив, в случае, где две различные полипептидные цепи свободны от взаимодействия, например, в рекомбинантной экспрессирующей системе, причем одна содержит VLA и VHB, а другая содержит VLB и VHA, причем два различных сайта связывания будут образовывать: VLA-VHA и VLB-VHB. Для всех пар полипептидных цепей диатела вероятность ошибок выравнивания или ошибок связывания двух цепей является возможной, т.e., взаимодействие доменов VL-VL или VH-VH; однако очистка функциональных диател легко осуществляется на основе иммуноспецифичности корректно димеризованного сайта связывания с использованием любой аффинности на основе метода, известного в данной области или приведенного в качестве примера в данном документе, например, аффинной хроматографии.
[00123] Одна или несколько полипептидных цепей диатела необязательно может содержать Fc-домен или его часть (например, CH2-домен или CH3-домен). Fc-домен или его часть могут быть выделены из любого изотипа или аллотипа иммуноглобулина, включающего в частности IgA, IgD, IgG, IgE и IgM. В предпочтительных воплощениях Fc-домен (или его часть) выделена из IgG. В конкретных воплощениях, изотип IgG представляет собой IgG1, IgG2, IgG3 или IgG4 или их аллотип. В одном варианте осуществления, молекула диатела содержит Fc-домен, который содержит CH2-домен и CH3-домен, независимо выбранный из любого изотипа иммуноглобулинов (т.е. Fc-домен, содержащий CH2-домен, выделенный из IgG, и CH3-домен, выделенный из IgE, или CH2-домен, выделенный из IgG1, и CH3-домен, выделенный из IgG2, и т.д.). Fc-домен может быть сконструирован в полипептидную цепь, содержащую молекулу диатела по изобретению в любом положении относительно других доменов или участков указанной полипептидной цепи (например, Fc-домен или его часть может быть С-концевым по отношению к обоим VL- и VH-доменам полипептида цепи; может быть N-концевым по отношению к обоим VL- и VH-доменам; или может быть N-концевым к одному домену и С-концевым по отношению к другому (т.е., между двумя доменами полипептидной цепи)).
[00124] Fc-домены в полипептидных цепях молекул диатела предпочтительно димеризуются с образованием в результате молекулы диатела, которая демонстрирует иммуноглобулино-подобные свойства, например, Fc-FcγR, взаимодействия. Fc-содержащие диатела могут представлять собой димеры, например, состоят из двух полипептидных цепей, каждая из которых содержит VH-домен, VL-домен и Fc-домен. Димеризация указанных полипептидных цепей приводит в результате к получению бивалентного диатела, содержащего Fc-домен, не смотря на структуру, отличную от структуры не модифицированного бивалентного антитела. Такие молекулы диател будут демонстрировать измененные фенотипы относительно иммуноглобулина дикого типа, например, измененный период полужизни в сыворотке, свойства связывания и т.д. В других воплощениях, молекулы диатела, содержащие Fc-домены, могут представлять собой тетрамеры. Такие тетрамеры содержат две 'более тяжелые' полипептидные цепи, т.е., полипептидная цепь, содержащая VL-, VH- и Fc-домен, и две 'более легкие' полипептидные цепи, т.е., полипептидная цепь, содержащая VL и VH. Более легкие и более тяжелые цепи взаимодействуют с образованием мономера, и указанные мономеры взаимодействуют посредством их непарных Fc-доменов с образованием Ig-подобной молекулы. Такое Ig-подобное диатело является тетравалентным и может быть моноспецифиным, биспецифичным или тетраспецифичным.
[00125] Образование тетраспецифичной молекулы диатела, как описано выше, требует взаимодействия четырех различных полипептидных цепей. Такие взаимодействия трудно достичь с высокой эффективностью внутри одноклеточной системы рекомбинантного продуцирования благодаря множеству вариантов потенциальных ошибочных пар. Одно из решений для повышения вероятности ошибочного спаривания заключается в конструкции мутаций типа “выступ-во-впадину” в целевых парах полипептидных цепей. Такие мутации благоприятствуют гетеродимеризации по отношению к гомодимеризации. Например, в отношении Fc-Fc-взаимодействий, аминокислотная замена (предпочтительно, замена на аминокислоту, содержащую объемную боковую группу, образующую 'выступ', например, триптофан), может вводиться в CH2- или CH3-домены, так что стерическое препятствие будет предотвращаться с помощью аналогично мутированного домена и будет обязывать мутированный домен спариваться с доменом, в котором была создана комплементарная или соответствующая мутация т.е., 'впадина' (например, замена на глицин). Такие наборы мутаций могут быть созданы в любой паре полипептидов, содержащих молекулы диател, и дополнительно созданы в любой части полипептидных цепей указанной пары. Методы белковой инженерии для благоприятной гетеродимеризации по отношению к гомодимеризации хорошо известны в данной области, особенно в том, что касается инженерии иммуноглобулиновых молекул, и охвачены в данном документе (см. например, Ridgway et al. (1996) “'Knobs-Into-Holes' Engineering Of Antibody CH3 Domains For Heavy Chain Heterodimerization,” Protein Engr. 9:617-621, Atwell et al. (1997) “Stable Heterodimers From Remodeling The Domain Interface Of A Homodimer Using A Phage Display Library,” J. Mol. Biol. 270: 26-35, и Xie et al. (2005) “A New Format Of Bispecific Antibody: Highly Efficient Heterodimerization, Expression And Tumor Cell Lysis,” J. Immunol. Methods 296:95-101; каждая из которых включена в настоящее описание ссылкой в полном объеме.
[00126] Изобретение также охватывает молекулы диател, содержащие вариант Fc-домена или домена шарнир-Fc (или их часть), которые содержат, по меньшей мере, одну аминокислотную модификацию (например, замену, вставку, делецию) относительно сравнимого Fc-домена дикого типа или домена шарнир-Fc (или их части). Молекулы, содержащие варианты Fc-доменов или доменов шарнир-Fc (или их часть) (например, антитела), обычно имеют измененные фенотипы относительно молекул, содержащих Fc-домены дикого типа или домен шарнир-Fc или их части. Вариант фенотипа может экспрессироваться с измененным периодом полужизни в сыворотке, с измененной стабильностью, измененной восприимчивостью к клеточным ферментам или с измененной эффекторной функцией, как проанализировано в NK-зависимом или в макрофаг-зависимом анализе. Модификации Fc-домена, идентифицированные как изменяющие эффекторную функцию, раскрыты выше. Большое количество замен в Fc-домене человеческого IgG1, которые повышают связывание с активирующими рецепторами (например, FcγRIIA (CD16A) и снижают связывание с ингибирующими рецепторами (например, FcγRIIB (CD32B), известны в данной области и описаны в Stavenhagen, J.B. et al. (2007) “Fc Optimization Of Therapeutic Antibodies Enhances Their Ability To Kill Tumor Cells In Vitro And Controls Tumor Expansion In Vivo Via Low-Affinity Activating Fcgamma Receptors,” Cancer Res. 57(18):8882-8890. Типичные варианты Fc-доменов человеческого IgG1 с пониженным связыванием с CD32B и/или с повышенным связыванием с CD16A содержат замены F243L, R929P, Y300L, V305I или P296L. Эти аминокислотные замены могут присутствовать в Fc-домене человеческого IgG1 в любой комбинации. В одном варианте осуществления, вариант Fc-домена человеческого IgG1 содержит замену F243L, R929P и Y300L. В другом варианте осуществления, вариант Fc-домена человеческого IgG1 содержит замену F243L, R929P, Y300L, V305I и P296L. В другом варианте осуществления, вариант Fc-домена человеческого IgG1 содержит замену N297Q, поскольку данная мутация ликвидирует FcR-связывание.
[00127] Настоящее изобретение также охватывает молекулы, содержащие шарнирный домен. Шарнирный домен может быть выделен из любого изотипа или аллотипа иммуноглобулина, включая IgA, IgD, IgG, IgE и IgM. В предпочтительных воплощениях, шарнирный домен выделен из IgG, где изотип IgG представляет собой IgG1, IgG2, IgG3 или IgG4, или его аллотип. Указанный шарнирный домен может быть встроен в полипептидную цепь, содержащую молекулу диатела вместе с Fc-доменом, так что молекула диатела содержит домен шарнир-Fc. В некоторых воплощениях, шарнирный домен и Fc-домен независимо выбирают из изотипа иммуноглобулина, известного в данной области или приведенного в качестве примера в данном документе. В других воплощениях, шарнирный домен и Fc-домен разделены, по меньшей мере, одним другим доменом полипептидной цепи, например, VL-доменом. Шарнирный домен или необязательно домен шарнир-Fc может встраиваться в полипептид по изобретению в любое положение относительно других доменов или участков указанной полипептидной цепи. В некоторых воплощениях, полипептидная цепь по изобретению содержит шарнирный домен, который находится на C-конце полипептидной цепи, где указанная полипептидная цепь не содержит Fc-домен. Еще в других воплощениях, полипептидная цепь по изобретению содержит домен шарнир-Fc, который находится на C-конце полипептидной цепи. В следующих воплощениях, полипептидная цепь по изобретению содержит домен шарнир-Fc, который находится на N-конце полипептидной цепи.
[00128] Каждый домен из полипептидной цепи диатела, т.е., VL-, VH- и Fc-домен могут быть разделены пептидным линкером. Пептидный линкер могут составлять 0, 1, 2, 3, 4, 5, 6, 7, 8 или 9 аминокислот. В некоторых воплощениях аминокислотная последовательность линкера представляет собой GGGSGGGG (SEQ ID NO:27), которая кодируется последовательностью нуклеиновой кислоты ggaggcggat ccggaggcgg aggc (SEQ ID NO:28). Полипептидные цепи молекулы диатела могут быть сконструированы так, что они содержат, по меньшей мере, один остаток цистеина, который будет взаимодействовать с соответствующим остатком цистеина на второй полипептидной цепи диатела с образованием межцепной дисульфидной связи. Такие межцепные дисульфидные связи служат для стабилизации молекулы диатела, улучшая таким образом экспрессию и извлечение в рекомбинантных системах, приводя в результате к получению стабильного и однородного состава и к улучшению стабильности выделенного и/или очищенного продукта in vivo. Остаток цистеина может вводиться в виде одиночной аминокислоты или в виде части более крупной аминокислотной последовательности, например, шарнирного домена, в любой участок полипептидной цепи. В конкретном варианте осуществления, остаток цистеина может конструироваться так, что он находится на C-конце полипептидной цепи. В некоторых воплощениях, остаток цистеина вводят в полипептидную цепь внутри аминокислотной последовательности LGGC (SEQ ID NO:29). В конкретном варианте осуществления, C-конец полипептидных цепей, содержащих молекулу диатела по изобретению, содержит аминокислотную последовательность LGGC (SEQ ID NO:29). В другом варианте осуществления, остаток цистеина вводят в полипептид внутри аминокислотной последовательности, содержащей шарнирный домен, например, EPKSCDKTHTCPP (SEQ ID NO:30) или ESKYGPPCPS (SEQ ID NO:31). В конкретном варианте осуществления, C-конец полипептидной цепи молекулы диатела по изобретению содержит аминокислотную последовательность шарнирного домена IgG, например, SEQ ID NO:29 или SEQ ID NO:31. В другом варианте осуществления, C-конец полипептидной цепи молекулы диатела по изобретению содержит аминокислотную последовательность VEPKSC (SEQ ID NO:32), которая может кодироваться нуклеотидной последовательностью gttgagccca aatcttgt (SEQ ID NO:33). В других воплощениях, остаток цистеина вводится в полипептидную цепь внутри аминокислотной последовательности LGGCFNRGEC (SEQ ID NO:34), которая может кодироваться нуклеотидной последовательностью ctgggaggct gcttcaacag gggagagtgt (SEQ ID NO:35). В конкретном варианте осуществления, C-конец полипептидной цепи, содержащей диатело по изобретению, содержит аминокислотную последовательность LGGCFNRGEC (SEQ ID NO:34). Еще в одном варианте осуществления, остаток цистеина вводят в полипептидную цепь внутри аминокислотной последовательности FNRGEC (SEQ ID NO:36), которая может кодироваться нуклеотидной последовательностью ttcaacaggg gagagtgt (SEQ ID NO:37). В конкретном варианте осуществления, C-конец полипептидной цепи, содержащей диатело по изобретению, содержит аминокислотную последовательность FNRGEC (SEQ ID NO:36).
[00129] В некоторых воплощениях, молекула диатела содержит, по меньшей мере, две полипептидные цепи, каждая из которых содержит аминокислотную последовательность LGGC (SEQ ID NO:29), которые ковалентно связаны дисульфидной связью между остатками цистеина в LGGC (SEQ ID NO:29). В некоторых воплощениях, молекула диатела содержит, по меньшей мере, две полипептидные цепи, каждая из которых содержит аминокислотную последовательность GGCGGG (SEQ ID NO:38), которые ковалентно связаны дисульфидной связью между остатками цистеина в GGCGGG (SEQ ID NO:38). В другом конкретном варианте осуществления, молекула диатела содержит, по меньшей мере, две полипептидные цепи, одна из которых содержит последовательность FNRGEC (SEQ ID NO:36), в то время как другая содержит шарнирный домен (содержащий, по меньшей мере, один остаток цистеина), где указанные, по меньшей мере, две полипептидные цепи ковалентно связаны с помощью дисульфидной связи между остатком цистеина в FNRGEC (SEQ ID NO:36) и остатком цистеина в шарнирном домене. В конкретных аспектах, остаток цистеина, ответственный за дисульфидную связь, локализованный в шарнирном домене, представляет собой Cys-128 (согласно нумерации по Kabat EU; локализован в шарнирном домене немодифицированной интактной тяжелой цепи IgG), и соответствующий остаток цистеина представляет собой Cys-214 (согласно нумерации по Kabat EU; локализован на C-конце немодифицированной интактной легкой цепи IgG) (Elkabetz et al. (2005) “Cysteines In CH1 Underlie Retention Of Unassembled Ig Heavy Chains,” J. Biol. Chem. 280:14402-14412). Еще в других воплощениях, по меньшей мере, один остаток цистеина сконструирован так, что он находится на N-конце аминокислотной цепи. Еще в одном варианте осуществления, по меньшей мере, один остаток цистеина сконструирован так, что он находится в линкерном участке полипептидной цепи молекулы диатела. В следующем варианте осуществления, VH- или VL-домен сконструирован так, что он содержит, по меньшей мере, одну аминокислотную модификацию относительно родительского VH- или VL-домена, так что указанная аминокислотная модификация содержит замену родительской аминокислоты на цистеин.
[00130] Еще в одном аспекте данного воплощения, Домен (C) первой полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:32), выделенную из шарнирного домена человеческого IgG, и которая может кодироваться нуклеотидной последовательностью gttgagccca aatcttgt (SEQ ID NO:33). В другом аспекте данного воплощения, Домен (F) второй полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:32). В некоторых аспектах данного воплощения, Домен (C) первой полипептидной цепи содержит C-концевые 6 аминокислот человеческой легкой цепи каппа, FNRGEC (SEQ ID NO:36); и Домен (F) второй полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:32) или шарнирный домен. В некоторых аспектах данного воплощения, Домен (F) второй полипептидной цепи содержит C-концевые 6 аминокислот человеческой легкой цепи каппа, FNRGEC (SEQ ID NO:36); и Домен (C) второй полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:32) или шарнирный домен.
[00131] Из вышесказанного понятно, что индивидуальные полипептиды биспецифичного диатела могут образовывать два вида гомодимеров и один вид гетеродимеров. В одном варианте осуществления настоящего изобретения, заряженный полипептид может быть добавлен к C-концу одного, двух или более предпочтительно, обоих полипептидов диател. Путем отбора заряженных полипептидов противоположного заряда для индивидуальных полипептидов биспецифичного диатела, включение таких заряженных полипептидов благоприятствует образованию гетеродимеров и ослабляет образование гомодимеров. Предпочтительно, положительно заряженный полипептид будет иметь существенное содержание аргинина, глутамина, гистидина и/или лизинв (или смеси таких аминокислот), и отрицательно заряженный полипептид будет иметь существенное содержание аспартата или глутатамата (или смесь таких аминокислот). Положительно заряженные полипептиды, имеющие существенное содержание лизина, и отрицательно заряженные полипептиды, имеющие существенное содержание глутамата, особенно предпочтительны. С целью максимизировать электростатическое притяжение между такими противоположно заряженными полипептидами, предпочтительно применять полипептиды, способные спонтанно принимать спиральную конформацию.
[00132] Таким образом, в предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться к одному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела (Фигура 1B). Конкретная предпочтительная E-спираль будет иметь последовательность: (EVAALEK)4 [т.e. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK]. Конкретная предпочтительная K-спираль будет иметь последовательность: (KVAALKE)4 [т.е. (SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
[00133] Предпочтительный полипептид диатела, обладающий такой E-спиралью, будет иметь общую последовательность: [VL-домен]-[GGGSGGGG]-[VH-домен]-[(EVAALEK)4]-GGGNS, где VL представляет собой вариабельный домен легкой цепи Ig диатела, GGGSGGGG представляет собой SEQ ID NO:27, VH представляет собой вариабельный домен тяжелой цепи Ig диатела, (EVAALEK)4 представляет собой SEQ ID NO:39, и GGGNS представляет собой SEQ ID NO:41. Предпочтительный полипептид диатела, обладающий такой K-спиралью, будет иметь общую последовательность: [VL-Домен]-[GGGSGGGG]-[VH-Домен]-[(KVAALKE)4]-GGGNS, где VL представляет собой вариабельный домен Ig легкой цепи диатела, GGGSGGGG представляет собой SEQ ID NO:25, VH представляет собой вариабельный домен Ig тяжелой цепи диатела, (KVAALKE)4 представляет собой SEQ ID NO:40, и GGGNS представляет собой SEQ ID NO:41.
[00134] В следующем варианте осуществления, Fc-области могут быть связаны с E- и/или K-спиралями E-спиральных или K-спиральных диател. Способствующий разделению между Fc-областями VH-домен Fc-содержащего диатела целесообразен в случаях, где менее разделенное расположение таких доменов приводит к уменьшенному взаимодействию между такими доменами и их свзывающими лигандами или по-другому препятствует сборке диатела. Хотя могут применяться разделители любой аминокислотной последовательности, предпочтительно применять разделители,
которые образуют структуру α спиралей, для максимального распространения и проекции Fc-домена от вариабельных доменов. Так как вышеописанные спиральные полипептиды противоположного заряда дополнительно функционируют для стимулирования образования гетеродимера, то такие молекулы представляют собой особенно предпочтительные разделители. Такие спираль-содержащие молекулы Fc-диател обеспечивают полезные свойства, аналогичные Fc-диателам, включая улучшенный период полужизни в сыворотке и вовлечение эффекторной функции. Вышеописанные E-спиральные и K-спиральные полипептиды являются особенно предпочтительными для этих целей. Таким образом, в предпочтительном варианте осуществления, E-спиральное Fc-содержащее диатело будет иметь общую последовательность: [VL-Домен]-[GGGSGGGG]-[VH-Домен]-[(EVAALEK)4]-GGG-Fc-домен, начиная с D234 (нумерация по Kabat), где VL представляет собой Ig-домен вариабельной области легкой цепи диатела, GGGSGGGG представляет собой SEQ ID NO:27, VH представляет собой Ig-домен вариабельной области тяжелой цепи диатела и (EVAALEK)4 представляет собой SEQ ID NO:39. Аналогично, в предпочтительном варианте осуществления, K-спиральное Fc-содержащее диатело будет иметь общую последовательность: [VL-Домен]-[GGGSGGGG]-[VH-Домен]-[(KVAALKE)4]-GGG-Fc-домен, начиная с D234 (нумерация по Kabat), где VL представляет собой Ig-домен вариабельной области легкой цепи диатела, GGGSGGGG представляет собой SEQ ID NO:27, VH представляет собой Ig-домен вариабельной области тяжелой цепи диатела и (KVAALKE)4 представляет собой SEQ ID NO:40.
[00135] Как указано выше, спираль-содержащая молекула диатела или спираль-содержащая Fc-содержащая молекула диатела может содержать только один такой спиральный разделитель, или она может содержать более чем один такой разделитель (например, два разделителя, предпочтительно противоположного заряда, один из которых связан с каждым из VH-доменов полипептидов диатела). Путем связывания Fc-области с такой разделительной молекулой(ами), способность получения бивалентных, тетравалентных и т.д. вариантов молекул Fc-диатела с помощью обмена цепей повышается. Таким образом, могут быть получены молекулы Fc-диатела, которые образуют мономеры или димеры в зависимости от того связан ли Fc-домен с одним или с обоими VH-доменами диатела.
[00136] Таким образом, изобретение включает диатело, состоящее из трех полипептидных цепей, проиллюстрированных на Фигуре 1C. Первая полипептидная цепь содержит (от N-конца к C-концу):
(i) домен (A), содержащий область связывания вариабельного домена легкой цепи первого иммуноглобулина(VL1), специфичного к эпитопу (1);
(ii) домен (B), содержащий область связывания вариабельного домена тяжелой цепи творого иммуноглобулина(VH1), специфичного к эпитопу (2); и
(iii) E-спираль или K-спираль.
[00137] Вторая полипептидная цепь содержит (от N-конца к C-концу):
(i) домен (D), содержащий область связывания вариабельного домена легкой цепи второго иммуноглобулина(VL2), специфичного к эпитопу (2);
(ii) домен (E), содержащий область связывания вариабельного домена тяжелой цепи первого иммуноглобулина(VH1), специфичного к эпитопу (1); и
(iii) K-спираль (если первый полипептид содержит E-спираль) или E-спираль (если первый полипептид содержит K-спираль).
Вторая полипептидная цепь дополнительно содержит CH2-CH3-участок Fc-области, которая может быть N-концевой к Домену D, или C-концевой к Домену E.
[00138] Третья полипептидная цепь содержит CH2-CH3-участок Fc-области.
[00139] Эпитоп (1) выше относится к эпитопу вирусного белка, а эпитоп (2) относится к эпитопу активирующего рецептора или к эпитопу белка, экспрессированного на поверхности иммунной эффекторной клетки, которая экспрессирует активирующий рецептор. Альтернативно, Эпитоп (1) выше относится к эпитопу активирующего рецептора или к эпитопу белка, экспрессированного на поверхности иммунной эффекторной клетки, которая экспрессирует активирующий рецептор, и эпитоп (2) к эпитопу вирусного белка.
[00140] В предпочтительном варианте осуществления вторая полипептидная цепь будет содержать мутацию «выступа» (T366W) и замены аланина в положениях 234 и 235. В таком предпочтительном варианте осуществления третья полипептидная цепь будет содержать мутацию впадины (T366S, L368A, и Y407V) и замену H435R для удаления способности связывания с Протеином A. Присутствие таких мутаций "выступа" и "впадины" благоприятствует гетеродимеризации между соответствующими областями CH2-CH3 второй и третьей полипептидных цепей.
[00141] Биспецифичные молекулы по настоящему изобретению могут одновременно связываться с двумя разделенными и обособленными эпитопами. В предпочтительных воплощениях, по меньшей мере, один эпитопсвязывающий сайт является специфичным к детерминанте, экспрессирванной на иммунной эффекторной клетке (например, CD3, CD16, CD32, CD64, T-клеточный рецептор, NKG2D, и т.д.), которые экспрессируются на T-лимфоцитах, натуральных киллерных клетках (NK) или на других мононуклеарах. В одном варианте осуществления, молекула диатела связывается с детерминантой эффекторной клетки, а также активирует указанную эффекторную клетку. В этом отношении, биспецифичные молекулы по изобретению могут демонстрировать Ig-подобную функциональность независимо от того содержат ли они дополнительно Fc-домен (например, как анализировали в любом известном анализе эффекторной функции, известном в данной области или приведенном в качестве примера в данном документе (например, анализ ADCC). В некоторых воплощениях, биспецифичное диатело по изобретению связывается с обоими - с вирусным эпитопом и с детерминантой эффекторной клетки, активируя при этом указанную клетку.
[00142] Изобретение дополнительно охватывает включение искусственных аминокислот для получения диател по изобретению. Такие методы известны специалистам в данной области, такие как с применением естественного биосинтетического аппарата для возможности включения искусственных аминокислот в белки, см., например, Wang et al. (2002) “Expanding The Genetic Code,” Chem. Comm. 1: 1-11; Wang et al. (2001) “Expanding The Genetic Code Of Escherichia coli,” Science, 292: 498-500; van Hest et al. (2001) “Protein-Based Materials, Toward A New Level Of Structural Control," Chem. Comm. 19: 1897-1904, каждая из которых включена в настоящее описание ссылкой в полном объеме. Альтернативные стратегии фокусируются на ферментах, ответственных за биосинтез аминоацил-тРНК, см., например, Tang et al. (2001) “Biosynthesis Of A Highly Stable Coiled-Coil Protein Containing Hexafluoroleucine In An Engineered Bacterial Host,” J. Am. Chem. Soc. 123(44): 11089-11090; Kiick et al. (2001) “Identification Of An Expanded Set Of Translationally Active Methionine Analogues In Escherichia coli,” FEBS Lett. 502(1-2):25-30; каждая из которых включена в настоящее описание ссылкой в полном объеме. В некоторых воплощениях, изобретение охватывает методы модификации VL-, VH- или Fc-домена молекулы по изобретению путем добавления или делеции сайта гликозилирования. Методы модификации углеводов белков хорошо известны в данной области и охвачены изобретением, см., например, Патент США № 6218149; EP 0 359 096 B1; Публикация США № 2002/0028486; WO 03/035835;. Публикация США № 2003/0115614; Патент США № 6218149; Патент № 6472511; каждый из которых включен в настоящее описание ссылкой в полном объеме.
VIII. Методы Использования Биспецифичных Молекул по Настоящему Изобретению
[00143] Биспецифичные молекулы по настоящему изобретению могут использоваться для терапевтических целей для человека и/или млекопитающих животных, но не человека, испытывающих вирусное заболевание или имеющих риск его развития. Терапия с использованием таких биспецифичных молекул может включать образование комплексов как in vitro, так и in vivo, как описано выше. В одном варианте осуществления, такие биспецифичные молекулы могут связываться с вирусами, ассоциированными с таким заболеванием, и уменьшать их пролиферацию. Понятно, что биспецифичную молекулу вводят в концентрации, которая стимулирует связывание при физиологических (например, in vivo) условиях. В другом варианте осуществления, такие биспецифичные молекулы могут использоваться для иммунотерапии, направленной на вирусно-инфицированные клетки (или клетки с риском такой инфекции) различных тканей, таких как толстая кишка, легкое, молочная железа, предстательная железа, яичники, поджелудочная железа, почка и т.д. В другом варианте осуществления, такие биспецифичные молекулы индивидуально могут связываться с вирусно-инфицированными клетками и уменьшать их деление. В другом варианте осуществления, такие биспецифичные молекулы могут связываться с вирусно-инфицированными клетками и замедлять их рост. Еще в одном варианте осуществления, индивидуум с злокачественным заболеванием или с инфекционным заболеванием получает паллиативное лечение с использованием таких биспецифичных молекул. Паллиативное лечение таких индивидуумов включает излечение или уменьшение вредных симптомов злокачественного заболевания или инфекционного заболевания, или ятрогенных симптомов, возникших в результате других терапий, предписанных для этого заболевания, при этом без прямого воздействия на прогрессию заболевания. Это включает терапии для облегчения боли, парентеральное питание, сексуальные проблемы, психологические заболевания, депрессию, страх, психиатрические расстройства, тошноту, рвоту и т.д. В одном варианте осуществления, молекулы по настоящему изобретению вводят терапевтически или профилактически пациентам (например, HIV+ пациентам или пациентам с злокачественным заболеванием) для воздействия на вторичные вирусные инфекции (отличные от HIV или злокачественного заболевания), которые появляются или могут появиться у таких индивидуумов.
[00144] Различные составы биспецифичных молекул по изобретению могут использоваться для введения. В некоторых воплощениях, биспецифичные молекулы или их фрагменты могут вводиться в чистом виде. Дополнительно к фармакологически активному агенту композиции по настоящему изобретению могут содержать подходящие фармацевтически приемлемые носители, содержащие эксципиенты и вспомогательные вещества, которые хорошо известны в данной области и являются относительно инертными веществами, которые облегчают введение фармакологически эффективного вещества, или которые облегчают процессирование активных соединений в препараты, которые могут использоваться фармацевтически для доставки к месту действия. Например, эксципиент может придавать форму или консистенцию или может действовать в качестве разбавителя. Подходящие эксципиенты включают, в частности, стабилизирующие агенты, увлажнители и эмульгирующие агенты, соли для вариации осмоляльности, инкапсулирующие агенты, буферы и усилители проникновения через кожу.
[00145] Подходящие составы для парентерального введения включают водные растворы активных соединений в водорастворимой форме, например, водорастворимые соли. Кроме того, может вводиться суспензия активных соединений, подходящая для масляных инъекций. Подходящие лиофильные растворители или носители включают жирные масла, например, кунжутное масло, или синтетические эфиры жирных кислот, например этилолеат или триглицериды. Суспензии для водных инъекций могут содержать вещества, которые повышают вязкость суспензии и включают, например, натрий карбоксиметилцеллюлозу, сорбит и /или декстран. Необязательно суспензия также может содержать стабилизаторы. Липосомы также могут использоваться для инкапсулирования агента для доставки в клетку.
[00146] Фармацевтический состав для системного введения согласно изобретению может быть составлен для энтерального, парентерального или местного введения. Действительно, все три типа составов могут использоваться одновременно для достижения системного введения активного ингредиента. Эксципиенты, а также составы для парентеральной и не парентеральной доставки лекарственного средства представлены в Remington: The Science And Practice Of Pharmacy, 21st Edition, Lippincott Williams & Wilkins Publishing (2005). Подходящие составы для перорального введения включают твердые или мягкие желатиновые капсулы, пилюли, таблетки, включающие покрытые таблетки, эликсиры, суспензии, сиропы или ингаляционные смеси и их формы с контролируемым высвобождением. Как правило, эти агенты составлены для введения с помощью инъекции (например, внутрибрюшинно, внутривенно, подкожно, внутримышечно и т.д., хотя также могут использоваться другие формы введения (например, перорально, в слизистые оболочки и т.д.). Соответственно, биспецифичные молекулы предпочтительно объединяются с фармацевтически приемлемыми носителями, такими как солевой раствор, раствор Рингера, раствор декстрозы и тому подобные.
[00147] Эмпирические предположения, такие как биологический период полужизни, как правило, будут способствовать определению дозировки. Частота введения может определяться и регулироваться в течение курса терапии и основывается на снижении количества вирусно-инфицированных клеток, поддержании снижения инфицированных клеток, снижении пролиферации инфицированных клеток или задержке развития инфекции. Альтернативно, могут подходить составы с поддерживаемым непрерывным высвобождением биспецифичных молекул. Различные составы и устройства для достижения поддерживаемого непрерывного высвобождения известны в данной области.
[00148] В одном варианте осуществления, дозировки для биспецифичных молекул могут определяться эмпирически для индивидуумов, которые получали одно или несколько введений. Индивидуумы получают постепенно нарастающие дозировки биспецифичных молекул. Для оценки эффективности биспецифичных молекул затем может использоваться маркер специфического вирусного болезненного состояния. Это включает прямые измерения вирусной нагрузки, косвенное измерение вирусной нагрузки с помощью иммуноанализа, другие методы визуализации; улучшение в состоянии здоровья по оценкам с помощью таких измерений, измерение косвенного вирусного маркера, например, снижение боли или паралича; улучшение речи, зрения, дыхания или другой неспособности, ассоциированной с инфекцией; повышение аппетита; или повышение качества жизни по измерения с помощью принятых тестов или пролонгация выживаемости. Специалисту в данной области будет очевидно, что дозировка будет варьироваться в зависимости от индивидуума, типа вируса, стадии заболевания и от последней и сопутствующей используемой терапии.
[00149] Другие составы включают подходящие формы доставки, известные в данной области, включающие в частности носители, такие как липосомы. См., например, Mahato et al. (1997) “Cationic Lipid-Based Gene Delivery Systems: Pharmaceutical Perspectives,” Pharm. Res. 14:853-859. Липосомные препараты включают в частности цитофектины, мультиламеллярные везикулы и моноламеллярные везикулы.
[00150] Описав в общем изобретение, тоже самое будет легко понятно посредством ссылок на следующие Примеры, которые относятся к биспецифичным молекулам, которые связываются с эпитопами вируса Эпштейна-Барра или вируса папилломы человека. Такие Примеры представлены посредством иллюстрации и не предназначены для ограничения настоящего изобретения до тех пор, пока не указано иначе.
Пример 1
Конструкция Биспецифичных Молекул для Латентного EBV
[00151] Биспецифичные молекулы, специфичные для человеческих T-клеток и вируса Эпштейна-Барра (CD3 × LMP-1 и TCR × LMP-2), могут быть получены в виде перенацеливающей молекулы с двойственной аффинностью (диатело). Такие биспецифичные молекулы обладают способностью к локализации T-клетки (путем связывания такой T-клетки с CD3-областью CD3-связывающей биспецифичной молекулы или с TCR-областью TCR-связывающей биспецифичной молекулы) в место локализации клетки, латентно инфицированной EBV и экспрессирующей LMP-1 или LMP-2 (соответственно) (путем связывания такой клетки с LMP-1- или LMP-2-связывающей областью биспецифичных молекул). Локализованная T-клетка может затем опосредовать уничтожение клетки, латентно инфицированной EBV в процессе, называемом “перенацеленное” уничтожение. Антитела, которые связываются с LMP-1 или LMP-2, известны в данной области (Fang, C.Y. et al. (2004) “Construction And Characterization Of Monoclonal Antibodies Specific To Epstein-Barr Virus Latent Membrane Protein 1,” J. Immunol. Methods 287(1-2):21-30; Fruehling, S. et al. (1996) “Identification Of Latent Membrane Protein 2A (LMP2A) Domains Essential For The LMP2A Dominant-Negative Effect On B-Lymphocyte Surface Immunoglobulin Signal Transduction,” J Virol. 70:6216-6226; Fruehling, S. et al. (1998) “Tyrosine 112 Of Latent Membrane Protein 2A Is Essential For Protein Tyrosine Kinase Loading And Regulation Of Epstein-Barr Virus Latency,” J. Virol. 72:7796-7806) и могут быть получены из Acris Antibodies (San Diego, CA), GenWay (San Diego, CA), и из других источников.
[00152] CD3 × LMP-1 биспецифичная молекула может быть сконструирована так, что она содержит анти-CD3 вариабельный домен антитела 2 к CD3 и анти-LMP-1 вариабельные домены антитела HHV-4 (Acris Antibodies). TCR × LMP-2 биспецифичные молекулы могут быть сконструированы так, что они содержат анти-TCR вариабельный домен антитела BMA031 и анти-LMP-2 вариабельные домены антитела 14B7 (mybiosource(dot)com).
[00153] Связывание биспецифичной молекулы с LMP-1-экспрессирующими клетками и с CD3-положительными T-клетками может измеряться с помощью тИФА. С целью демонстрации способности биспецифичной молекулы опосредовать перенацеленное уничтожение EBV-инфицированных клеток, вышеописанная биспецифичная молекула CD3 × LMP-1 или CD2 × LMP-2 может инкубироваться в различных концентрациях с клетками-мишенями и с эффекторными клетками (человеческие PBMC), например, с соотношением эффектора к мишени 20:1. Цитотоксичность может быть определена с использованием, например, анализа LDH. Результаты демонстрируют способность биспецифичной молекулы CD3 × LMP-1 и биспецифичной молекулы CD3 × LMP-2 опосредовать перенацеленное уничтожение EBV-инфицированных клеток с использованием человеческих PBMC.
Пример 2
Лечение Латентной Инфекции EBV
[00154] B-клетки памяти в состоянии покоя представляют сайт персистенции EBV внутри тела. (Babcock, G.J. et al. “Epstein-Barr Virus-Infected Resting Memory B Cells, Not Proliferating Lymphoblasts, Accumulate In The Peripheral Blood Of Immunosuppressed Patients,” J. Exp. Med. 190(4):567-576). У нормальных EBV-инфицированных взрослых от 1 до 50 B-клеток на миллион в кровотоке инфицированы EBV, и количество латентно инфицированных клеток у индивидуума остается стабильным в течение лет.
[00155] Почти из 100 вирусных генов, которые экспрессируются во время репликации, только 10 экспрессируются в латентно инфицированных B-клетках in vitro, включая LMP-1 и LMP-2.
[00156] С помощью заметного ограничения экспрессии вирусных генов во время латентного периода, EBV уменьшает количество экспрессированных вирусных белков, ограничивая таким образом “экспонирование” инфицированных клеток цитотоксическим T-клеткам хозяина.
[00157] Пациенту с латентной инфекцией EBV вводят биспецифичную молекулу CD3 × LMP-1. Биспецифичная молекула связывается с LMP-1, обнаруженным на поверхности инфицированных клеток, привлекает T-клетки к инфицированным клеткам и активирует T-клетки. Активированные T-клетки уничтожают EBV-инфицированные клетки, исключая таким образом EBV-инфекцию у пациента.
Пример 3
Конструкция Биспецифичных Молекул для HPV
[00158] Биспецифичные молекулы, специфичные для человеческих T-клеток и вируса папилломы человека E6 (CD3 × HPV E6/MHC) может быть получена в виде перенацеливающей молекулы с двойственной аффинностью (диатело). Антитела, которые связываются с человеческим вирусом папилломы E6, известны в данной области (Phaeton, R. et al. (2010) “Radioimmunotherapy With An Antibody To The HPV16 E6 Oncoprotein Is Effective In An Experimental Cervical Tumor Expressing Low Levels Of E6,” Cancer Biol. Ther. 10(10):1041-1047; Lagrange, M. et al. (2005) “Binding Of Human Papillomavirus 16 E6 To P53 And E6AP Is Impaired By Monoclonal Antibodies Directed Against The Second Zinc-Binding Domain Of E6,” J. Gen. Virol. 86(Pt 4):1001-1007; Wlazlo, A.P. et al. (2001) “Generation And Characterization Of Monoclonal Antibodies Against The E6 And E7 Oncoproteins Of HPV,” Hybridoma 20(4):257-263) и могут быть получены из Acris Antibodies (San Diego, CA), GenWay (San Diego, CA), mybiosource(dot)com и из других источников.
[00159] Такая биспецифичная молекула обладает способностью локализовать T-клетку (путем связывания такой T-клетки с CD3-областью CD3-связывающей биспецифичной молекулы) к месту локализации клетки, инфицированной HPV, экспрессирующей E6 и презентирующей фрагмент белка E6 в контексте клеточной системы MHC класса I (путем связывания такой клетки с HPV E6/MHC-связывающей областью биспецифичных молекул). Локализованная T-клетка может затем опосредовать уничтожение клетки, латентно инфицированной EBV в процессе, называемом “перенацеленное” уничтожение.
[00160] CD3 × HPV E6/MHC биспецифичная молекула может быть сконструирована так, что она будет иметь, например, анти-CD3 вариабельный домен OKT3 и анти-HPV E6/MHC вариабельные домены антитела 29-10267 (mybiosource(dot)com).
[00161] Связывание биспецифичной молекулы с HPV E6/MHC и с CD3-положительными T-клетками может измеряться с помощью тИФА. С целью демонстрации способности биспецифичной молекулы опосредовать перенацеленное уничтожение HPV-инфицированных клеток, вышеописанная биспецифичная молекула CD3 × HPV E6/MHC может инкубироваться в различных концентрациях с клетками-мишенями и с эффекторными клетками (человеческие PBMC), например, с соотношением эффектора к мишени 20:1. Цитотоксичность может быть определена с помощью анализа LDH. Результаты демонстрируют способность биспецифичной молекулы CD3 × HPV E6/MHC опосредовать перенацеленное уничтожение HPV-инфицированных клеток с использованием человеческих PBMC.
Пример 4
Биспецифичные Молекулы, Содержащие Fc-Область, Опосредуют Мощное Перенацеленное Т-клеточное Уничтожение
[00162] Биспецифичная молекула может быть сконструирована так, что она будет иметь анти-CD3 вариабельный домен и домен, который связывается с вирусным антигеном и который дополнительно содержит Fc-область. Такая молекула может быть сконструирована путем экспрессии трех полипептидных цепей в одной клетке. Первая полипептидная цепь будет содержать, например, вариабельный домен легкой цепи антитела к CD3, короткий линкер, вариабельный домен тяжелой цепи для антитела, которое связывается с вирусным антигеном (например, HPV E6/MHC), и E-спиральный домен. Вторая полипептидная цепь будет содержать, например, вариабельный домен легкой цепи антитела к HPV E6/MHC, короткий линкер, вариабельный домен тяжелой цепи антитела к CD3, K-спиральный домен и, наконец, CH2- и CH3-домен IgG Fc. Третья полипептидная цепь будет содержать, например, CH2- и CH3-домен IgG Fc.
[00163] E- и K-спирали гарантируют, что цепь 1 гетеродимеризуется с цепью 2. Для гарантии того, что цепь 2 не гомодимеризуется по доменам CH2 и CH3, последовательность модифицируют для включения "выступа" в положение 366 (T366W модификация) (см., Патенты США № 5731168; 5807706; 5821333; 7429652; 7642228; 7695936; и 821680). Для нарушения Fc-области, остатки аланина включают в положения 234 и 235 (см., Патент США № 5624821). Для акцептирования "выступа", созданного в Fc-области цепи 2, делают три замены в цепи 3 для создания "впадины" (T366S, L368A и Y407V). Модификация в положении 435 (H435R) используется для предотвращения гомодимеров цепи 3 в результате связывания с Протеином A, добавляемого при очистке биспецифичной молекулы. Любые гомодимеры цепи 3 могут быть очищены из продукта с помощью эксклюзионной хроматографии.
[00164] Векторы, кодирующие три цепи, трансфицировали в клетки CHO. После подходящей селекции клетки культивировали в среде в течение 7 дней. Культуральную среду и клетки собирали. Биспецифичную молекулу очищали с помощью метода хроматографии, хорошо известного в данной области, и демонстрировали, что она способна к одновременному связыванию с обоими: с CD3, экспрессированным на поверхности иммунных эффекторных клеток, и с HPV E6/MHC, экспрессированным на поверхности HPV-инфицированной клетки, облегчая таким образом смерть такой HPV-инфицированной клетки.
Пример 5
Конструкция Биспецифичной Молекулы анти-CD16 × анти-HIV env
Конструкция Биспецифичной Молекулы анти-Флуоресцеин × анти-HIV env
[00165] В качестве дополнительного примера биспецифичных молекул по настоящему изобретению, молекулу биспецифичного диатела получали так, чтобы она состояла из двух полипептидных цепей, ковалентно связанных друг с другом, чтобы образовывался первый эпитопсвязывающий сайт для CD16 и второй эпитопсвязывающий сайт для белка HIV env.
[00166] Первая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела 7B2 к HIV env (GenBank Регистрационный номер No. AFQ31503; Buchacher, A. et al. (1994) “Generation Of Human Monoclonal Antibodies Against HIV-1 Proteins; Electrofusion And Epstein-Barr Virus Transformation For Peripheral Blood Lymphocyte Immortalization,” AIDS Res. Hum. Retroviruses 10(4):359-369; Shen, R. (2010) “GP41-Specific Antibody Blocks Cell-Free HIV Type 1 Transcytosis Through Human Rectal Mucosa And Model Colonic Epithelium,” J. Immunol. 184(7):3648-3655) или антитело, которое конкурирует с антителом 7B2 за связывание, или антитело, которое связывается с белком env HIV;
(II) вариабельный домен тяжелой цепи антитела h3G8 (WO 2012/162068; Патент США № 7351803) или антитела, которое конкурирует с антителом 3G8 за связывание, или антитела, которое связывается с CD16 (FcγRIIIA); и
(III) домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39) или домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40).
[00167] Вторая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела h3G8 (WO 2012/162068; Патент США № 7351803) или такого антитела, которое конкурирует с антителом 3G8 за связывание, или такого антитело, которое связывается с CD16 (FcγRIIIA); и
(II) вариабельный домен тяжелой цепи такого антитела 7B2 или такого антитела, которое конкурирует с антителом 7B2 за связывание, или такого антитела, которое связывается с белком env HIV; и
(III) домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40) или домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39).
[00168] В предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться к одному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела.
[00169] Предпочтительно, первая полипептидная цепь такого диатела имеет аминокислотную последовательность(SEQ ID NO:42) (CDR подчеркнуты):
DIVMTQSPDS LAVSPGERAT IHCKSSQTLL YSSNNRHSIA WYQQRPGQPP KLLLYWASMR LSGVPDRFSG SGSGTDFTLT INNLQAEDVA IYYCHQYSSH PPTFGHGTRV EIKGGGSGGG GQVTLRESGP ALVKPTQTLT LTCTFSGFSL STSGMGVGWI RQPPGKALEW LAHIWWDDDK RYNPALKSRL TISKDTSKNQ VVLTMTNMDP VDTATYYCAQ INPAWFAYWG QGTLVTVSSG GCGGGEVAAL EKEVAALEKE VAALEKEVAAL EK,
где остатки 1-113 представляют собой вариабельный домен легкой цепи антитела 7B2 (Регистрационный номер GenBank No. AFQ31503) (CDR остатки представлены подчеркиванием), остатки 114-121 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 122-239 представляют собой вариабельный домен тяжелой цепи антитела h3G8 (CDR остатки представлены подчеркиванием), остатки 240-245 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 246-277 представляют собой E-спираль (EVAALEK)4 [т.е. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK].
[00170] Предпочтительно, вторая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:43) (CDR подчеркнуты):
DIVMTQSPDS LAVSLGERAT INCKASQSVD FDGDSFMNWY QQKPGQPPKL
LIYTTSNLES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSNEDPY TFGQGTKLEI KGGGSGGGGQ VQLVQSGGGV FKPGGSLRLS CEASGFTFTE YYMTWVRQAP GKGLEWLAYI SKNGEYSKYS PSSNGRFTIS RDNAKNSVFL QLDRLSADDT AVYYCARADG LTYFSELLQY IFDLWGQGAR VTVSSGGCGG GKVAALKEKV AALKEKVAAL KEKVAALKE,
где остатки 1-111 представляют собой вариабельный домен легкой цепи антитела h3G8 (CDR остатки представлены подчеркиванием), остатки 112-119 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 120-245 представляют собой вариабельный домен тяжелой цепи антитела 7B2 (регистрационный номер GenBank No. AFQ31502) (CDR остатки представлены подчеркиванием), остатки 246-251 представляют собой линкер GGCGGG (SEQ ID NO:38), и остатки 252-279 представляют собой K-спираль (KVAALKE)4 [т.e., SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
[00171] Биспецифичное диатело также получали так, чтобы оно содержало вариабельный домен легкой цепи и вариабельный домен тяжелой цепи вышеописанного антитела h3G8 к CD16 (FcγRIIIA), и вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антитела 4-4-20 к флуоресцеину (Gruber, M. et al. (1994) “Efficient Tumor Cell Lysis Mediated By A Bispecific Single Chain Antibody Expressed In Escherichia coli,” J. Immunol. 152(11):5368-5374; Bedzyk, W.D. et al. (1989) “Comparison Of Variable Region Primary Structures Within An Anti-Fluorescein Idiotype Family,” J. Biol. Chem. 264(3): 1565-1569). Аминокислотные последовательности двух полипептидных цепей контрольного антитела представляют собой:
[00172] SEQ ID NO:44 (первая полипептидная цепь контрольного диатела; VL h3G8 VH 4-4-20) (CDR подчеркнуты):
DIVMTQSPDS LAVSLGERAT INCKASQSVD FDGDSFMNWY QQKPGQPPKL LIYTTSNLES GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSNEDPY TFGQGTKLEI KGGGSGGGGE VKLDETGGGL VQPGRPMKLS CVASGFTFSD YWMNWVRQSP EKGLEWVAQI RNKPYNYETY YSDSVKGRFT ISRDDSKSSV YLQMNNLRVE DMGIYYCTGS YYGMDYWGQG TSVTVSSGGC GGGEVAALEK EVAALEKEVA ALEKEVAALE KGGGNS,
где остатки 1-111 представляют собой вариабельный домен легкой цепи антитела h3G8, остатки 112-119 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 120-237 представляют собой вариабельный домен тяжелой цепи антитела 4-4-20, остатки 238-243 представляют собой линкер GGCGGG (SEQ ID NO:38), остатки 244-271 представляют собой E-спираль (EVAALEK)4 [т.е. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK], и остатки 272-276 представляют собой линкер GGGNS (SEQ ID NO:41); и
[00173] SEQ ID NO:45 (вторая полипептидная цепь контрольного антитела; VL 4-4-20 VH h3G8) (CDR подчеркнуты):
DVVMTQTPFS LPVSLGDQAS ISCRSSQSLV HSNGNTYLRW YLQKPGQSPK VLIYKVSNRF SGVPDRFSGS GSGTDFTLKI SRVEAEDLGV YFCSQSTHVP WTFGGGTKLE IKGGGSGGGG QVTLRESGPA LVKPTQTLTL TCTFSGFSLS TSGMGVGWIR QPPGKALEWL AHIWWDDDKR YNPALKSRLT ISKDTSKNQV VLTMTNMDPV DTATYYCAQI NPAWFAYWGQ GTLVTVSSGG CGGGKVAALK EKVAALKEKV AALKEKVAAL KEGGGNSGGG DYKDDDDKGG GSNS,
где остатки 1-112 представляют собой вариабельный домен легкой цепи антитела 4-4-20, остатки 113-120 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 121-238 представляют собой вариабельный домен тяжелой цепи антитела h3G8, остатки 239-244 представляют собой линкер GGCGGG (SEQ ID NO:38), остатки 245-272 представляют собой K-спираль (KVAALKE)4 [т.е., SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE], остатки 273-277 представляют собой линкер GGGNS (SEQ ID NO:41) и остатки 278-294 представляют собой FLAG-метку (Munro, S. et al. (1984) “Use Of Peptide Tagging To Detect Proteins Expressed From Cloned Genes: Deletion Mapping Functional Domains Of Drosophila hsp 70,” EMBO J. 3(13):3087-3093).
Пример 6
Оценка Цитотоксической Активности Лимфоцитов, опосредованная Биспецифичными Молекулами CD16 × HIV env
[00174] Исходная стадия в HIV-1-инфекции происходит при связывании белка клеточной поверхности CD4 с тримерными оболочечными гликопротеинами HIV-1 (Env), с гетеродимером трансмембранного гликопротеина (gp41) и поверхностного гликопротеина (gp120). Конформационные изменения, инициированные в тримерном Env при связывании с CD4, приводят к слиянию вирусной и клеточной мембран и к доставке вирусного ядра в инфицированные клетки (Harris, A. et al. (2011) “Trimeric HIV-1 Glycoprotein Gp140 Immunogens And Native HIV-1 Envelope Glycoproteins Display The Same Closed And Open Quaternary Molecular Architectures,” Proc. Natl. Acad. Sci. (U.S.A.) 108(28):11440-11445). Гликопротеины 120 и gp41 исходно синтезируются в виде индивидуального полипептида gp160, который затем расщепляется с получением комплекса нековалентно ассоциированных gp120/gp41. Эктодомен Env представляет собой гетеродимер с массой приблизительно 140 кДа, состоящий из полного компонента gp120 и приблизительно 20 кДа gp41 (Harris, A. et al. (2011) “Trimeric HIV-1 Glycoprotein Gp140 Immunogens And Native HIV-1 Envelope Glycoproteins Display The Same Closed And Open Quaternary Molecular Architectures,” Proc. Natl. Acad. Sci. (U.S.A.) 108(28):11440-11445).
[00175] Человеческие эмбриональные почечные клетки HEK 293 D375 (92Th023, подтип AE, R5-тропные) экспрессируют белок HIV gp140. В качестве следующего примера применения биспецифичных молекул по настоящему изобретению, вышеописанное биспецифичное диатело анти-CD16 × анти-HIV env оценивали на предмет его способности опосредовать цитотоксическую активность лимфоцитов в отношении клеток HEK 293 D375 в присутствии натуральных киллерных клеток. Вышеописанное биспецифичное диатело анти-флуоресцеин × анти-HIV env использовали в качестве контроля.
[00176] Результаты данного исследования представлены на Фигуре 2. Фигура 2 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим эпитопсвязывающие домены антитела h3G8 к CD16 и эпитопсвязывающие домены антитела 7B2 к HIV env на gp140-экспрессирующих клетках HEK 293 D375 (92Th023, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) с соотношением Эффектор:Мишень 5:1. Натуральные киллерные (NK) клетки очищали с использованием положительной селекции (D56678 (LDH)). Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела 7B2 к HIV env, использовали в качестве контроля. Результаты демонстрируют, что биспецифичное диатело анти-CD16 × анти-HIV env опосредует цитотоксическую активность лимфоцитов, тогда как контрольное диатело - нет.
[00177] Фигура 3 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим эпитопсвязывающие домены антитела h3G8 к CD16 и эпитопсвязывающие домены антитела 7B2 к HIV env на gp140-экспрессирующих клетках HEK 293 D375 (92Th023, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) с соотношением Эффектор : Мишень 5:1. Натуральные киллерные (NK) клетки очищали с помощью отрицательной селекции (D55386 (LDH)). Как ожидалось (так как NK-клетки лишены CD3), биспецифичное диатело, содержащее эпитопсвязывающие домены антитела hAntibody 2 к CD3 и эпитопсвязывающие домены антитела 7B2 к HIV env, не способно демонстрировать цитотоксическую активность лимфоцитов. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела h3G8 к CD16, использовали в качестве контроля. Результаты снова демонстрируют, что биспецифичное диатело анти-CD16 × анти-HIV env опосредовали цитотоксическую активность лимфоцитов, тогда как вышеописанное контрольное диатело и биспецифичное диатело CD16 × CD3 - нет.
[00178] Фигура 4 демонстрирует результаты аналогичного эксперимента, проведенного с использованием клеток HEK 293 D371 (CM244, подтип AE, R5-тропные), которые экспрессируют HIV gp140. Фигура 4 демонстрирует цитотоксическую активность лимфоцитов, опосредованную биспецифичным диателом, содержащим анти-CD16 эпитопсвязывающие домены антитела h3G8 и анти-HIV env эпитопсвязывающие домены антитела 7B2 на HIV gp140-экспрессирующих клетках HEK 293 D371 (CM244, подтип AE, R5-тропные) через 24 часа инкубации в присутствии натурального киллера (NK) в соотношении Эффектор:Мишень 5:1. Натуральные киллерные (NK) клетки очищали с помощью отрицательной селекции (D55386 (LDH)). Как ожидалось (так как NK-клетки лишены CD3), биспецифичное диатело, содержащее эпитопсвязывающие домены антитела hAntibody 2 к CD3 и эпитопсвязывающие домены антитела 7B2 к HIV env, не способно демонстрировать цитотоксическую активность лимфоцитов. Биспецифичное диатело, содержащее эпитопсвязывающие домены антитела 4-4-20 к флуоресцеину и эпитопсвязывающие домены антитела h3G8 к CD16, использовали в качестве контроля. Результаты демонстрируют, что биспецифичное диатело анти-CD16 × анти-HIV env опосредует цитотоксическую активность лимфоцитов, тогда как вышеописанное контрольное диатело - нет.
Пример 7
Конструкция Биспецифичной Молекулы Анти-CD3 × анти-HIV gp120
Конструкция Биспецифичной Молекулы Анти-CD3 × анти-HIV env
Конструкция Биспецифичной Молекулы Анти-CD3 × анти-RSV F-белок
Конструкция Биспецифичной Молекулы анти-Флуоресцеин × анти-HIV env
[00179] В качестве дополнительного примера биспецифичных молекул по настоящему изобретению, молекулы биспецифичных диател получали так, чтобы они состояли из двух полипептидных цепей, ковалентно связанных друг с другом, чтобы образовывался первый эпитопсвязывающий сайт для CD3 и второй эпитопсвязывающий сайт, специфичный либо для белка HIV gp120, белка HIV env или антигенного сайта А белка RSV F.
Биспецифичная Молекула Анти-CD3 × анти-HIV gp120
[00180] Первая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела A32 к HIV gp120 (Ferrari, G. et al. (2011) “An HIV-1 gp120 Envelope Human Monoclonal Antibody That Recognizes a C1 Conformational Epitope Mediates Potent Antibody-Dependent Cellular Cytotoxicity (ADCC) Activity and Defines a Common ADCC Epitope in Human HIV-1 Serum,” J. Virol. 85(14):7029-7036), или антитела, которое конкурирует с антителом A32 за связывание или антитела, которое связывается с белков gp120 HIV;
(II) вариабельный домен тяжелой цепи гуманизированного антитела 2 к CD3 (“hAntibody 2”) или антитела, которое конкурирует с антителом 2 к CD3 за связывание, или антитела, которое связывается с CD3; и
(III) домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39) или домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40).
[00181] Вторая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи гуманизированного Антитела 2 к CD3 (“hAntibody 2”) или такого антитела, которое конкурирует с антителом 2 к CD3 за связывание, или такого антитела, которое связывается с CD3;
(II) вариабельный домен тяжелой цепи такого антитела A32 или такого антитела, которое конкурирует с антителом A32 за связывание, или такого антитела, которое связывается с белком gp120 HIV; и
(III) домен K-спирали (т.е., (KVAALKE)4;. KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40) или домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39).
[00182] В предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться к одному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела.
[00183] Предпочтительно, первая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:46) (CDR подчеркнуты):
QSALTQPPSA SGSPGQSVTI SCTGTSSDVG GYNYVSWYQH HPGKAPKLII SEVNNRPSGV PDRFSGSKSG NTASLTVSGL QAEDEAEYYC SSYTDIHNFV FGGGTKLTVL GGGSGGGGEV QLVESGGGLV QPGGSLRLSC AASGFTFSTY AMNWVRQAPG KGLEWVGRIR SKYNNYATYY ADSVKGRFTI SRDDSKNSLY LQMNSLKTED TAVYYCVRHG NFGNSYVSWF AYWGQGTLVT VSSGGCGGGE VAALEKEVAA LEKEVAALEK EVAALEK,
где остатки 1-110 представляют собой вариабельный домен легкой цепи антитела A32 (CDR остатки показаны подчеркиванием), остатки 111-118 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 119-243 представляют собой вариабельный домен тяжелой цепи гуманизированного Антитела 2 к CD3 (“hAntibody 2; CDR показаны подчеркиванием), остатки 247-252 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 253-280 представляют собой E-спираль (EVAALEK)4 [т.е. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK].
[00184] Предпочтительно, вторая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:47) (CDR подчеркнуты):
QAVVTQEPSL TVSPGGTVTL TCRSSTGAVT TSNYANWVQQ KPGQAPRGLI GGTNKRAPWT PARFSGSLLG GKAALTITGA QAEDEADYYC ALWYSNLWVF GGGTKLTVLG GGGSGGGGQV QLQESGPGLV KPSQTLSLSC TVSGGSSSSG AHYWSWIRQY PGKGLEWIGY IHYSGNTYYN PSLKSRITIS QHTSENQFSL KLNSVTVADT AVYYCARGTR LRTLRNAFDI WGQGTLVTVS SGGCGGGKVA ALKEKVAALK EKVAALKEKV AALKE,
где остатки 1-110 представляют собой вариабельный домен легкой цепи антитела 2 к CD3 (CDR остатки показаны подчеркиванием), остатки 111-118 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 119-241 представляют собой вариабельный домен тяжелой цепи антитела А32 (CDR показаны подчеркиванием), остатки 242-247 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 248-275 представляют собой К-спираль (KVAALKE)4 [т.е. (SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
Биспецифичная Молекула Анти-CD3 × анти-HIV env
[00185] Первая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела 7B2 (регистрационный номер GenBank No. AFQ31503; Buchacher, A. et al. (1994) “Generation Of Human Monoclonal Antibodies Against HIV-1 Proteins; Electrofusion And Epstein-Barr Virus Transformation For Peripheral Blood Lymphocyte Immortalization,” AIDS Res. Hum. Retroviruses 10(4):359-369; Shen, R. (2010) “GP41-Specific Antibody Blocks Cell-Free HIV Type 1 Transcytosis Through Human Rectal Mucosa And Model Colonic Epithelium,” J. Immunol. 184(7):3648-3655) или антитела, которое конкурирует с антителом 7B2 за связывание, или антитела, которое связывается с белком env HIV; и
(II) вариабельный домен тяжелой цепи гуманизированного антитела 2 к CD3 (“hAntibody 2”) или антитела, которое конкурирует с антителом 2 к CD3 за связывание, или антитела, которое связывается с CD3; и
(III) домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39) или домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40).
[00186] Вторая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи гуманизированного Антитела 2 к CD3 (“hAntibody 2”) или такого антитела, которое конкурирует с антителом 2 к CD3 за связывание, или такого антитела, которое связывается с CD3;
(II) вариабельный домен тяжелой цепи такого антитела 7B2 или такого антитела, которое конкурирует с антителом 7B2 за связывание, или такого антитела, которое связывается с белком env HIV; и
(III) домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40) или домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39).
[00187] В предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться к одному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела.
[00188] Предпочтительно, первая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:48) (CDR подчеркнуты):
DIVMTQSPDS LAVSPGERAT IHCKSSQTLL YSSNNRHSIA WYQQRPGQPP KLLLYWASMR LSGVPDRFSG SGSGTDFTLT INNLQAEDVA IYYCHQYSSH PPTFGHGTRV EIKGGGSGGG GEVQLVESGG GLVQPGGSLR LSCAASGFTF STYAMNWVRQ APGKGLEWVG RIRSKYNNYA TYYADSVKGR FTISRDDSKN SLYLQMNSLK TEDTAVYYCV RHGNFGNSYV SWFAYWGQGT LVTVSSGGCG GGEVAALEKE VAALEKEVAA LEKEVAALEK,
где остатки 1-113 представляют собой вариабельный домен легкой цепи антитела 7B2 (Регистрационный номер GenBank No. AFQ31503) (CDR остатки представлены подчеркиванием), остатки 114-121 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 122-246 представляют собой вариабельный домен тяжелой цепи гуманизированного Антитела h2 к CD3 (“hAntibody 2", CDR остатки представлены подчеркиванием), остатки 247-252 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 253-280 представляют собой E-спираль (EVAALEK)4 [т.е. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK].
[00189] Предпочтительно, вторая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:49) (CDR подчеркнуты):
QAVVTQEPSL TVSPGGTVTL TCRSSTGAVT TSNYANWVQQ KPGQAPRGLI GGTNKRAPWT PARFSGSLLG GKAALTITGA QAEDEADYYC ALWYSNLWVF GGGTKLTVLG GGGSGGGGQV QLVQSGGGVF KPGGSLRLSC EASGFTFTEY YMTWVRQAPG KGLEWLAYIS KNGEYSKYSP SSNGRFTISR DNAKNSVFLQ LDRLSADDTA VYYCARADGL TYFSELLQYI FDLWGQGARV TVSSGGCGGG KVAALKEKVA ALKEKVAALK EKVAALKE,
где остатки 1-110 представляют собой вариабельный домен легкой цепи антитела 2 к CD3 (CDR остатки представлены подчеркиванием), остатки 111-118 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 119-244 представляют собой вариабельный домен тяжелой цепи антитела 7B2 (регистрационный номер GenBank No. AFQ31502) (CDR остатки представлены подчеркиванием), остатки 245-250 представляют собой линкер GGCGGG (SEQ ID NO:38), и остатки 251-278 представляют собой K-спираль (KVAALKE)4 [т.e., SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
Биспецифичная Молекула Анти-CD3 × анти-RSV F-белок
[00190] Первая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи гуманизированного антитела 2 к CD3 (“hAntibody 2”) или антитела, которое конкурирует с антителом 2 к CD3 за связывание, или антитела, которое связывается с CD3; и
(II) вариабельный домен тяжелой цепи антитела к RSV F, Palivizumab (Beeler, J.A. et al. (1989) “Neutralization Epitopes Of The F Glycoprotein Of Respiratory Syncytial Virus: Effect Of Mutation Upon Fusion Function,” J. Virol. 63(7):2941-2950; Arbiza, J. et al. (1992) “Characterization Of Two Antigenic Sites Recognized By Neutralizing Monoclonal Antibodies Directed Against The Fusion Glycoprotein Of Human Respiratory Syncytial Virus,” J. Gen. Virol. 73(9):2225-2234; Shadman, K.A. et al. (2011) “A Review Of Palivizumab And Emerging Therapies For Respiratory Syncytial Virus,” Expert Opin. Biol. Ther. 11(11):1455-1467; Wang, D. et al. (2011) “Palivizumab For Immunoprophylaxis Of Respiratory Syncytial Virus (RSV) Bronchiolitis In High-Risk Infants And Young Children: A Systematic Review And Additional Economic Modelling Of Subgroup Analyses,” Health Technol. Assess. 15(5):iii-iv, 1-124. doi: 10.3310/hta15050) или антитела, которое конкурирует с Палвизумаб за связывание, или антитела, которое связывается с антигенным сайтом A белка RSV F;
(III) домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39) или домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40).
[00191] Вторая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела Палвизумаб к RSV F, или такого антитела, которое конкурирует с Палвизумаб за связывание, или такого антитела, которое связывается с антигенным сайтом A белка RSV F; и
(II) вариабельный домен тяжелой цепи гуманизированного антитела 2 к CD3 (“hAntibody 2”), или такого антитела, которое конкурирует с антителом 2 к CD3, или такого антитела, которое связывается с CD3;
(III) домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40) или домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39).
[00192] В предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться к одному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела.
[00193] Предпочтительно, первая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:50) (CDR подчеркнуты):
QAVVTQEPSL TVSPGGTVTL TCRSSTGAVT TSNYANWVQQ KPGQAPRGLI GGTNKRAPWT PARFSGSLLG GKAALTITGA QAEDEADYYC ALWYSNLWVF GGGTKLTVLG GGGSGGGGQV TLRESGPALV KPTQTLTLTC TFSGFSLSTS GMSVGWIRQP PGKALEWLAD IWWDDKKDYN PSLKSRLTIS KDTSKNQVVL KVTNMDPADT ATYYCARSMI TNWYFDVWGA GTTVTVSSGG CGGGEVAALE KEVAALEKEV AALEKEVAAL EK,
где остатки 1-110 представляют собой вариабельный домен легкой цепи антитела 2 к CD3 (CDR остатки показаны подчеркиванием), остатки 111-118 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 119-238 представляют собой вариабельный домен тяжелой цепи антитела к RSV F (CDR показаны подчеркиванием), остатки 239-244 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 245-272 представляют собой Е-спираль (EVAALEK)4 [т.e. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK].
[00194] Предпочтительно, вторая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:51) (CDR подчеркнуты):
DIQMTQSPST LSASVGDRVT ITCRASQSVG YMHWYQQKPG KAPKLLIYDT SKLASGVPSR FSGSGSGTEF TLTISSLQPD DFATYYCFQG SGYPFTFGGG TKLEIKGGGS GGGGEVQLVE SGGGLVQPGG SLRLSCAASG FTFSTYAMNW VRQAPGKGLE WVGRIRSKYN NYATYYADSV KGRFTISRDD SKNSLYLQMN SLKTEDTAVY YCVRHGNFGN SYVSWFAYWG QGTLVTVSSG GCGGGKVAAL KEKVAALKEK VAALKEKVAA LKE,
где остатки 1-106 представляют собой вариабельный домен легкой цепи антитела Палвизумаб к RSV F (CDR остатки показаныподчеркиванием), остатки 107-114 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 115-239 представляют собой вариабельный домен тяжелой цепи гуманизированного Антитела 2 к CD3 (“hAntibody 2; CDR показаны подчеркиванием), остатки 240-245 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 246-273 представляют собой К-спираль (KVAALKE)4 [т.e., SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
Биспецифичная Молекула Анти-Флуоресцеин × анти-HIV env
[00195] Первая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела 7B2 или антитела, которое конкурирует с антителом 7B2 за связывание, или такого антитела, которое связывается с белком env HIV;
(II) вариабельный домен тяжелой цепи антитела к флуоресцеину или антитела, которое конкурирует с антителом 4-4-20 к флуоресцеину или антитела, которое связывается с флуоресцеином; и
(III) домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39) или домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40).
[00196] Вторая полипептидная цепь биспецифичного диатела предпочтительно содержит:
(I) вариабельный домен легкой цепи антитела к флуоресцеину 4-4-20 или антитела, которое конкурирует с антителом 4-4-20 за связывание или такого антитела, которое связывается с флуоресцеином;
(II) вариабельный домен тяжелой цепи антитела 7B2 или такого антитела, которое конкурирует с антителом 7B2 за связывание, или такого антитела, которое связывается с белком env HIV; и
(III) домен K-спирали (т.е., (KVAALKE)4; KVAALKEKVAALKEKVAALKEKVAALKE; SEQ ID NO:40) или домен E-спирали (т.е., (EVAALEK)4; EVAALEKEVAALEKEVAALEKEVAALEK; SEQ ID NO:39).
[00197] В предпочтительном варианте осуществления, отрицательно заряженная “E-спираль” будет присоединяться кодному из полипептидов, используемых для образования биспецифичного диатела, и положительно заряженная “K-спираль” будет присоединяться ко второму из полипептидов диатела.
[00198] Предпочтительно, первая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:52) (CDR подчеркнуты):
DIVMTQSPDS LAVSPGERAT IHCKSSQTLL YSSNNRHSIA WYQQRPGQPP KLLLYWASMR LSGVPDRFSG SGSGTDFTLT INNLQAEDVA IYYCHQYSSH PPTFGHGTRV EIKGGGSGGG GEVKLDETGG GLVQPGRPMK LSCVASGFTF SDYWMNWVRQ SPEKGLEWVA QIRNKPYNYE TYYSDSVKGR FTISRDDSKS SVYLQMNNLR VEDMGIYYCT GSYYGMDYWG QGTSVTVSSG GCGGGEVAAL EKEVAALEKE VAALEKEVAA LEK,
где остатки 1-113 представляют собой вариабельный домен легкой цепи антитела 7B2 (Регистрационный номер GenBank No. AFQ31503) (CDR остатки представлены подчеркиванием), остатки 114-121 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 122-239 представляют собой вариабельный домен тяжелой цепи антитела 4-4-20, остатки 240-245 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 246-277 представляют собой E-спираль (EVAALEK)4 [т.е. (SEQ ID NO:39) EVAALEKEVAALEKEVAALEKEVAALEK].
[00199] Предпочтительно, вторая полипептидная цепь такого диатела имеет аминокислотную последовательность (SEQ ID NO:53) (CDR подчеркнуты):
DVVMTQTPFS LPVSLGDQAS ISCRSSQSLV HSNGNTYLRW YLQKPGQSPK VLIYKVSNRF SGVPDRFSGS GSGTDFTLKI SRVEAEDLGV YFCSQSTHVP WTFGGGTKLE IKGGGSGGGG QVQLVQSGGG VFKPGGSLRL SCEASGFTFT EYYMTWVRQA PGKGLEWLAY ISKNGEYSKY SPSSNGRFTI SRDNAKNSVF LQLDRLSADD TAVYYCARAD GLTYFSELLQ YIFDLWGQGA RVTVSSGGCG GGKVAALKEK VAALKEKVAA LKEKVAALKE,
где остатки 1-112 представляют собой вариабельный домен легкой цепи антитела 4-4-20, остатки 113-120 представляют собой линкер GGGSGGGG (SEQ ID NO:27), остатки 121-246 представляют собой вариабельный домен тяжелой цепи антитела 7В2 (CDR показаны подчеркиванием), остатки 247-252 представляют собой линкер GGCGGG (SEQ ID NO:38) и остатки 253-280 представляют собой К-
спираль (KVAALKE)4 [т.е. (SEQ ID NO:40) KVAALKEKVAALKEKVAALKEKVAALKE].
Пример 8
Перенацеленное CD8-Опосредованное Уничтожение HIV env-Экспрессирующих Клеток
[00200] В качестве дополнительного примера применения биспецифичных молекул по настоящему изобретению, вышеописанные биспецифичные молекулы анти-CD3 × анти-HIV gp120 и анти-CD3 × анти-HIV env оценивали на предмет их способности облегчать перенацеленное CD8-опосредованное уничтожение HIV env-экспрессирующих клеток в присутствии T-клеток.
[00201] Вышеописанные биспецифичные молекулы анти-флуоресцеин × анти-HIV env и анти-CD3 × анти-RSV F-белок использовали в качестве контролей.
[00202] В одном таком исследовании, клетки Jurkat 522 FY (HxB2 gp160) инкубировали в присутствии тетрациклина с целью индуцирования у них экспрессии HIV gp160. Клетки инкубировали в течение 24 часа в присутствии пан-Т-клеток (D54670) (с соотношением Эффектор:Мишень 10:1) и одной из вышеописанных биспецифичных молекул. Оценивали цитотоксичность биспецифичной молекулы. Результат демонстрирует, что биспецифичные молекулы анти-CD3 × анти-HIV gp120 и анти-CD3 × анти-HIV env обе были способны вызывать CD8-опосредованную цитотоксичность, тогда как контрольное диатело анти-CD3 × анти-RSV F-белок не имело такой способности (Фигура 5).
[00203] Во втором исследовании, клетки HEK 293 D375 (92Th023, подтип AE, R5-тропные) инкубировали в присутствии доксициклина с целью индуцирования у них экспрессии HIV gp140. Клетки инкубировали в течение 24 часа в присутствии пан-Т-клеток (D47239) (с соотношением Эффектор:Мишень 10:1) и одной из вышеописанных биспецифичных молекул. Оценивали цитотоксичность биспецифичной молекулы. Результаты демонстрируют, что биспецифичные молекулы анти-CD3 × анти-HIV gp120 и анти-CD3 × анти-HIV env обе были способны вызывать CD8-опосредованную цитотоксичность, тогда как контрольное диатело анти-HIV env × анти-флуоресцеин не имело такой способности (Фигура 6).
[00204] В третьем исследовании, клетки HEK 293 D371 (CM244, подтип AE, R5-тропные) инкубировали в присутствии доксициклина с целью индуцирования у них экспрессии HIV gp140. Клетки инкубировали в течение 24 часа в присутствии пан-Т-клеток (D47239)(с соотношением Эффектор:Мишень 10:1) и одной из вышеописанных биспецифичных молекул. Оценивали цитотоксичность биспецифичной молекулы. Результаты снова продемонстрировали, что биспецифичные молекулы анти-CD3 × анти-HIV gp120 и анти-CD3 × анти-HIV env обе были способны вызывать CD8-опосредованную цитотоксичность, тогда как контрольное диатело анти-HIV env x анти-флуоресцеин не имело такой способности, за исключением условий с насыщением антитела (Фигура 7).
[00205] В Таблице 1 суммированы данные о наблюдаемой CD8-опосредованной цитотоксичности, полученные с использованием биспецифичной молекулы анти-CD3 × анти-HIV gp120 или с использованием биспецифичной молекулы анти-CD3 × анти-HIV env.
|
[00206] Все публикации и патенты, упомянутые в данном описании, включены в настоящее описание посредством ссылки в той же степени, как если бы каждая индивидуальная публикация или патентная заявка были специально и индивидуально указаны как включенные ссылкой в полном объеме. Хотя изобретение было описано в связи с его конкретными воплощениями, следует понимать, что оно способно к дополнительным модификациям, и подразумевается, что данная заявка охватывает любые вариации, применения или адаптации изобретения, следующие, как правило, принципам изобретения, и включая такие отклонения от настоящего описания, поскольку они попадают под известную или общепринятую практику в данной области, к которой относится изобретение, и это может применяться по отношению к существенным признакам, представленным здесь ранее.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MacroGenics, Inc.
Koenig, Scott
<120> БИСПЕЦИФИЧНЫЕ МОЛЕКУЛЫ, ИММУНОРЕАКТИВНЫЕ С ИММУННЫМИ
ЭФФЕКТОРНЫМИ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ АКТИВИРУЮЩИЙ РЕЦЕПТОР
<130> 1301.0079I
<150> US 61/783,195
<151> 2013-03-14
<160> 53
<170> PatentIn version 3.5
<210> 1
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> Вариабельная область легкой цепи OKT3 (Мышиное антитело к CD3)
<400> 1
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn Arg
100 105
<210> 2
<211> 192
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<223> вариабельная область тяжелой цепи OKT3 (Мышиное антитело к CD3)
<400> 2
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser
180 185 190
<210> 3
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи М291 (Гуманизированное антитело к CD3)
<400> 3
Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Thr Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Asp Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 4
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи М291 (Гуманизированное антитело к CD3)
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ile Ser Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Arg Ser Gly Tyr Thr His Tyr Asn Gln Lys Leu
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Ser Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ala Tyr Tyr Asp Tyr Asp Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 5
<211> 130
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> MISC_FEATURE
<222> (1)..(130)
<223> вариабельная область легкой цепи YTH12.5 (Крысиное антитело к CD3)
<400> 5
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Ile Gln Leu Thr Gln Pro Asn Ser Val Ser Thr Ser
20 25 30
Leu Gly Ser Thr Val Lys Leu Ser Cys Thr Leu Ser Ser Gly Asn Ile
35 40 45
Glu Asn Asn Tyr Val His Trp Tyr Gln Leu Tyr Glu Gly Arg Ser Pro
50 55 60
Thr Thr Met Ile Tyr Asp Asp Asp Lys Arg Pro Asp Gly Val Pro Asp
65 70 75 80
Arg Phe Ser Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Phe Leu Thr
85 90 95
Ile His Asn Val Ala Ile Glu Asp Glu Ala Ile Tyr Phe Cys His Ser
100 105 110
Tyr Val Ser Ser Phe Asn Val Phe Gly Gly Gly Thr Lys Leu Thr Val
115 120 125
Leu Arg
130
<210> 6
<211> 138
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(138)
<223> вариабельная область тяжелой цепи XR31 (Мышиное антитело к CD3)
<400> 6
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Ser Phe Pro Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Thr Ile Ser Thr Ser Gly Gly Arg Thr Tyr Tyr Arg
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Lys Phe Arg Gln Tyr Ser Gly Gly Phe Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135
<210> 7
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> Вариабельная область легкой цепи мышиного антитела 1 к CD3
<400> 7
Gln Val Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Phe Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Ser Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Thr Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Arg Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Gln Ile Thr Arg
100 105
<210> 8
<211> 121
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> Вариабельная область тяжелой цепи мышиного антитела 1 к CD3
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(110)
<223> Вариабельная область легкой цепи мышиного антитела 2 к CD3
<400> 9
Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro Gly Glu
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe Thr Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 10
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(125)
<223> Вариабельная область тяжелой цепи мышиного антитела 2 к CD3
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120 125
<210> 11
<211> 106
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> вариабельная область легкой цепи антитела BMA031 к TCR
<400> 11
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Thr Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 12
<211> 120
<212> БЕЛОК
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(120)
<223> вариабельная область тяжелой цепи антитела BMA031 к TCR
<400> 12
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Lys Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val His Tyr Cys
85 90 95
Ala Arg Gly Ser Tyr Tyr Asp Tyr Asp Gly Phe Val Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 13
<211> 106
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(106)
<223> вариабельная область легкой цепи антитела TRX2 к CD8
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Gly Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Thr Asp Ile Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Tyr Gln Tyr Asn Asn Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 14
<211> 121
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> вариабельная область тяжелой цепи антитела TRX2 к CD8
<400> 14
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Tyr Tyr Asp Gly Ser Asn Lys Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro His Tyr Asp Gly Tyr Tyr His Phe Phe Asp Ser Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 15
<211> 112
<212> БЕЛОК
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(112)
<223> вариабельная область легкой цепи антитела TRX1 к CD4
<400> 15
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Val Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Leu
85 90 95
Gln Asp Pro Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
<210> 16
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> вариабельная область тяжелой цепи антитела TRX1 к CD4
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ala Tyr
20 25 30
Val Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Tyr Pro Gly Ser Gly Ser Ser Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Gly Asp Gly Ser Arg Phe Val Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 17
<211> 112
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(112)
<223> вариабельная область легкой цепи антитела LoCD2a к CD2a
<400> 17
Asp Val Val Leu Thr Gln Thr Pro Pro Thr Leu Leu Ala Thr Ile Gly
1 5 10 15
Gln Ser Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Asn Trp Leu Leu Gln Arg Thr Gly Gln Ser
35 40 45
Pro Gln Pro Leu Ile Tyr Leu Val Ser Lys Leu Glu Ser Gly Val Pro
50 55 60
Asn Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Met Gln Phe
85 90 95
Thr His Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 18
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> вариабельная область тяжелой цепи антитела LoCD2a к CD2a
<400> 18
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Gln Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Glu Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Lys Gln Gly Leu Glu Leu Val
35 40 45
Gly Arg Ile Asp Pro Glu Asp Gly Ser Ile Asp Tyr Val Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Lys Phe Asn Tyr Arg Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 19
<211> 111
<212> БЕЛОК
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(111)
<223> вариабельная область легкой цепи антитела 3G8 к CD16
<400> 19
Asp Thr Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Ala Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> вариабельная область тяжелой цепи антитела 3G8 к CD16
<400> 20
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Arg Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Gln Ile Asn Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 21
<211> 111
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(111)
<223> вариабельная область легкой цепи антитела А9 к CD16
<400> 21
Asp Ile Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro
1 5 10 15
Gly Glu Thr Val Thr Leu Thr Cys Arg Ser Asn Thr Gly Thr Val Thr
20 25 30
Thr Ser Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe
35 40 45
Thr Gly Leu Ile Gly His Thr Asn Asn Arg Ala Pro Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr
65 70 75 80
Gly Ala Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr
85 90 95
Asn Asn His Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 22
<211> 117
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(117)
<223> вариабельная область тяжелой цепи антитела А9 к CD16
<400> 22
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Gly Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ala Asp Thr Ser Ser Arg Thr Ala Tyr
65 70 75 80
Val Gln Val Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Ala Ser Trp Tyr Phe Asp Val Trp Gly Ala Arg Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 108
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(108)
<223> вариабельная область легкой цепи антитела KYK 1.0 к NKG2D
<400> 23
Gln Pro Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Glu
1 5 10 15
Thr Ala Arg Ile Pro Cys Gly Gly Asp Asp Ile Glu Thr Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Asp Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Phe Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Ser Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asp Asn Asn Asp Glu
85 90 95
Trp Val Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 24
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(118)
<223> вариабельная область тяжелой цепи антитела KYK 1.0 к NKG2D
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Lys Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Phe Gly Tyr Tyr Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 25
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(110)
<223> вариабельная область легкой цепи антитела KYK 2.0 к NKG2D
<400> 25
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Phe Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 26
<211> 121
<212> БЕЛОК
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(121)
<223> вариабельная область тяжелой цепи антитела KYK 2.0 к NKG2D
<400> 26
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Gly Leu Gly Asp Gly Thr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 27
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 27
Gly Gly Gly Ser Gly Gly Gly Gly
1 5
<210> 28
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотид, кодирующий пептидный линкер GGGSGGGG
<400> 28
ggaggcggat ccggaggcgg aggc 24
<210> 29
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий пептид
<400> 29
Leu Gly Gly Cys
1
<210> 30
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий шарнирный домен
<400> 30
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
1 5 10
<210> 31
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий шарнирный домен
<400> 31
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser
1 5 10
<210> 32
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий пептид
<400> 32
Val Glu Pro Lys Ser Cys
1 5
<210> 33
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотид, кодирующий цистеин-содержащий пептид VEPKSC
<400> 33
gttgagccca aatcttgt 18
<210> 34
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий пептид
<400> 34
Leu Gly Gly Cys Phe Asn Arg Gly Glu Cys
1 5 10
<210> 35
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотид, кодирующий цистеин-содержащий пептид LGGCFNRGEC
<400> 35
ctgggaggct gcttcaacag gggagagtgt 30
<210> 36
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий пептид
<400> 36
Phe Asn Arg Gly Glu Cys
1 5
<210> 37
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотид, кодирующий цистеин-содержащий пептид FNRGEC
<400> 37
ttcaacaggg gagagtgt 18
<210> 38
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеин-содержащий пептид
<400> 38
Gly Gly Cys Gly Gly Gly
1 5
<210> 39
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> E-спираль
<400> 39
Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
1 5 10 15
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
20 25
<210> 40
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> K-спираль
<400> 40
Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val
1 5 10 15
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
20 25
<210> 41
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептидный линкер
<400> 41
Gly Gly Gly Asn Ser
1 5
<210> 42
<211> 273
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело 7В2 к HIV env х Антитело h3G8 к CD16
<400> 42
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile His Cys Lys Ser Ser Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Asn Arg His Ser Ile Ala Trp Tyr Gln Gln Arg Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Met Arg Leu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Leu Gln Ala Glu Asp Val Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Ser Ser His Pro Pro Thr Phe Gly His Gly Thr Arg Val Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Gln Val Thr Leu Arg Glu Ser
115 120 125
Gly Pro Ala Leu Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr
130 135 140
Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Val Gly Trp Ile
145 150 155 160
Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala His Ile Trp Trp
165 170 175
Asp Asp Asp Lys Arg Tyr Asn Pro Ala Leu Lys Ser Arg Leu Thr Ile
180 185 190
Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr Met Thr Asn Met
195 200 205
Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Gln Ile Asn Pro Ala
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys
<210> 43
<211> 279
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело 7В2 к HIV env х Антитело h3G8 к CD16
<400> 43
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly Gly
115 120 125
Gly Val Phe Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser
130 135 140
Gly Phe Thr Phe Thr Glu Tyr Tyr Met Thr Trp Val Arg Gln Ala Pro
145 150 155 160
Gly Lys Gly Leu Glu Trp Leu Ala Tyr Ile Ser Lys Asn Gly Glu Tyr
165 170 175
Ser Lys Tyr Ser Pro Ser Ser Asn Gly Arg Phe Thr Ile Ser Arg Asp
180 185 190
Asn Ala Lys Asn Ser Val Phe Leu Gln Leu Asp Arg Leu Ser Ala Asp
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Asp Gly Leu Thr Tyr Phe
210 215 220
Ser Glu Leu Leu Gln Tyr Ile Phe Asp Leu Trp Gly Gln Gly Ala Arg
225 230 235 240
Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala Leu
245 250 255
Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
Lys Val Ala Ala Leu Lys Glu
275
<210> 44
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело 4-4-20 к Флцоресцеину х Антитело h3G8 к CD16
<400> 44
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Asp Phe Asp
20 25 30
Gly Asp Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Thr Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Glu Val Lys Leu Asp Glu Thr Gly Gly
115 120 125
Gly Leu Val Gln Pro Gly Arg Pro Met Lys Leu Ser Cys Val Ala Ser
130 135 140
Gly Phe Thr Phe Ser Asp Tyr Trp Met Asn Trp Val Arg Gln Ser Pro
145 150 155 160
Glu Lys Gly Leu Glu Trp Val Ala Gln Ile Arg Asn Lys Pro Tyr Asn
165 170 175
Tyr Glu Thr Tyr Tyr Ser Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
180 185 190
Arg Asp Asp Ser Lys Ser Ser Val Tyr Leu Gln Met Asn Asn Leu Arg
195 200 205
Val Glu Asp Met Gly Ile Tyr Tyr Cys Thr Gly Ser Tyr Tyr Gly Met
210 215 220
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Cys
225 230 235 240
Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
245 250 255
Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Gly
260 265 270
Gly Gly Asn Ser
275
<210> 45
<211> 294
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело 4-4-20 к Флцоресцеину х Антитело h3G8 к CD16
<400> 45
Asp Val Val Met Thr Gln Thr Pro Phe Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Arg Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Val Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Gln Val Thr Leu Arg Glu Ser Gly
115 120 125
Pro Ala Leu Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe
130 135 140
Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Val Gly Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala His Ile Trp Trp Asp
165 170 175
Asp Asp Lys Arg Tyr Asn Pro Ala Leu Lys Ser Arg Leu Thr Ile Ser
180 185 190
Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr Met Thr Asn Met Asp
195 200 205
Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Gln Ile Asn Pro Ala Trp
210 215 220
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu
245 250 255
Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
Gly Gly Gly Asn Ser Gly Gly Gly Asp Tyr Lys Asp Asp Asp Asp Lys
275 280 285
Gly Gly Gly Ser Asn Ser
290
<210> 46
<211> 277
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело 7B2 к HIV env х Антитело 2 к CD3
<400> 46
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln His His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Ser Glu Val Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Glu Tyr Tyr Cys Ser Ser Tyr Thr Asp Ile
85 90 95
His Asn Phe Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly
115 120 125
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
130 135 140
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
165 170 175
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
180 185 190
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
195 200 205
Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn
210 215 220
Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys
245 250 255
Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
260 265 270
Ala Ala Leu Glu Lys
275
<210> 47
<211> 275
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело 7B2 к HIV env х Антитело 2 к CD3
<400> 47
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Gln Glu Ser Gly Pro Gly
115 120 125
Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Ser Cys Thr Val Ser Gly
130 135 140
Gly Ser Ser Ser Ser Gly Ala His Tyr Trp Ser Trp Ile Arg Gln Tyr
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile His Tyr Ser Gly Asn
165 170 175
Thr Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Ile Thr Ile Ser Gln His
180 185 190
Thr Ser Glu Asn Gln Phe Ser Leu Lys Leu Asn Ser Val Thr Val Ala
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Thr Arg Leu Arg Thr Leu
210 215 220
Arg Asn Ala Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val
245 250 255
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala
260 265 270
Leu Lys Glu
275
<210> 48
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело 7B2 к HIV env х Антитело 2 к CD3
<400> 48
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile His Cys Lys Ser Ser Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Asn Arg His Ser Ile Ala Trp Tyr Gln Gln Arg Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Met Arg Leu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Leu Gln Ala Glu Asp Val Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Ser Ser His Pro Pro Thr Phe Gly His Gly Thr Arg Val Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys
275 280
<210> 49
<211> 278
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело 7B2 к HIV env х Антитело 2 к CD3
<400> 49
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly Gly Gly
115 120 125
Val Phe Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly
130 135 140
Phe Thr Phe Thr Glu Tyr Tyr Met Thr Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Lys Gly Leu Glu Trp Leu Ala Tyr Ile Ser Lys Asn Gly Glu Tyr Ser
165 170 175
Lys Tyr Ser Pro Ser Ser Asn Gly Arg Phe Thr Ile Ser Arg Asp Asn
180 185 190
Ala Lys Asn Ser Val Phe Leu Gln Leu Asp Arg Leu Ser Ala Asp Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Arg Ala Asp Gly Leu Thr Tyr Phe Ser
210 215 220
Glu Leu Leu Gln Tyr Ile Phe Asp Leu Trp Gly Gln Gly Ala Arg Val
225 230 235 240
Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala Leu Lys
245 250 255
Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys
260 265 270
Val Ala Ala Leu Lys Glu
275
<210> 50
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело Палвизумаб к RSV F х Антитело 2 к CD3
<400> 50
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Thr Leu Arg Glu Ser Gly Pro Ala
115 120 125
Leu Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly
130 135 140
Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Pro
145 150 155 160
Pro Gly Lys Ala Leu Glu Trp Leu Ala Asp Ile Trp Trp Asp Asp Lys
165 170 175
Lys Asp Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Thr Ser Lys Asn Gln Val Val Leu Lys Val Thr Asn Met Asp Pro Ala
195 200 205
Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Ser Met Ile Thr Asn Trp Tyr
210 215 220
Phe Asp Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
<210> 51
<211> 273
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело Палвизумаб к RSV F х Антитело 2 к CD3
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Gly Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gly Tyr Pro Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala
245 250 255
Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys
260 265 270
Glu
<210> 52
<211> 273
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь Биспецифичного Диатела Антитело 4-4-20 к Флуоресцеину х Антитело 7В2 к HIV env
<400> 52
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile His Cys Lys Ser Ser Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Asn Arg His Ser Ile Ala Trp Tyr Gln Gln Arg Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Met Arg Leu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Leu Gln Ala Glu Asp Val Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Ser Ser His Pro Pro Thr Phe Gly His Gly Thr Arg Val Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Lys Leu Asp Glu Thr
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Arg Pro Met Lys Leu Ser Cys Val
130 135 140
Ala Ser Gly Phe Thr Phe Ser Asp Tyr Trp Met Asn Trp Val Arg Gln
145 150 155 160
Ser Pro Glu Lys Gly Leu Glu Trp Val Ala Gln Ile Arg Asn Lys Pro
165 170 175
Tyr Asn Tyr Glu Thr Tyr Tyr Ser Asp Ser Val Lys Gly Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Ser Ser Val Tyr Leu Gln Met Asn Asn
195 200 205
Leu Arg Val Glu Asp Met Gly Ile Tyr Tyr Cys Thr Gly Ser Tyr Tyr
210 215 220
Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys
<210> 53
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь Биспецифичного Диатела Антитело 4-4-20 к Флуоресцеину х Антитело 7В2 к HIV env
<400> 53
Asp Val Val Met Thr Gln Thr Pro Phe Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Arg Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Val Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly
115 120 125
Gly Gly Val Phe Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala
130 135 140
Ser Gly Phe Thr Phe Thr Glu Tyr Tyr Met Thr Trp Val Arg Gln Ala
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Ala Tyr Ile Ser Lys Asn Gly Glu
165 170 175
Tyr Ser Lys Tyr Ser Pro Ser Ser Asn Gly Arg Phe Thr Ile Ser Arg
180 185 190
Asp Asn Ala Lys Asn Ser Val Phe Leu Gln Leu Asp Arg Leu Ser Ala
195 200 205
Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Asp Gly Leu Thr Tyr
210 215 220
Phe Ser Glu Leu Leu Gln Tyr Ile Phe Asp Leu Trp Gly Gln Gly Ala
225 230 235 240
Arg Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala
245 250 255
Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys
260 265 270
Glu Lys Val Ala Ala Leu Lys Glu
275 280
31
1
<---