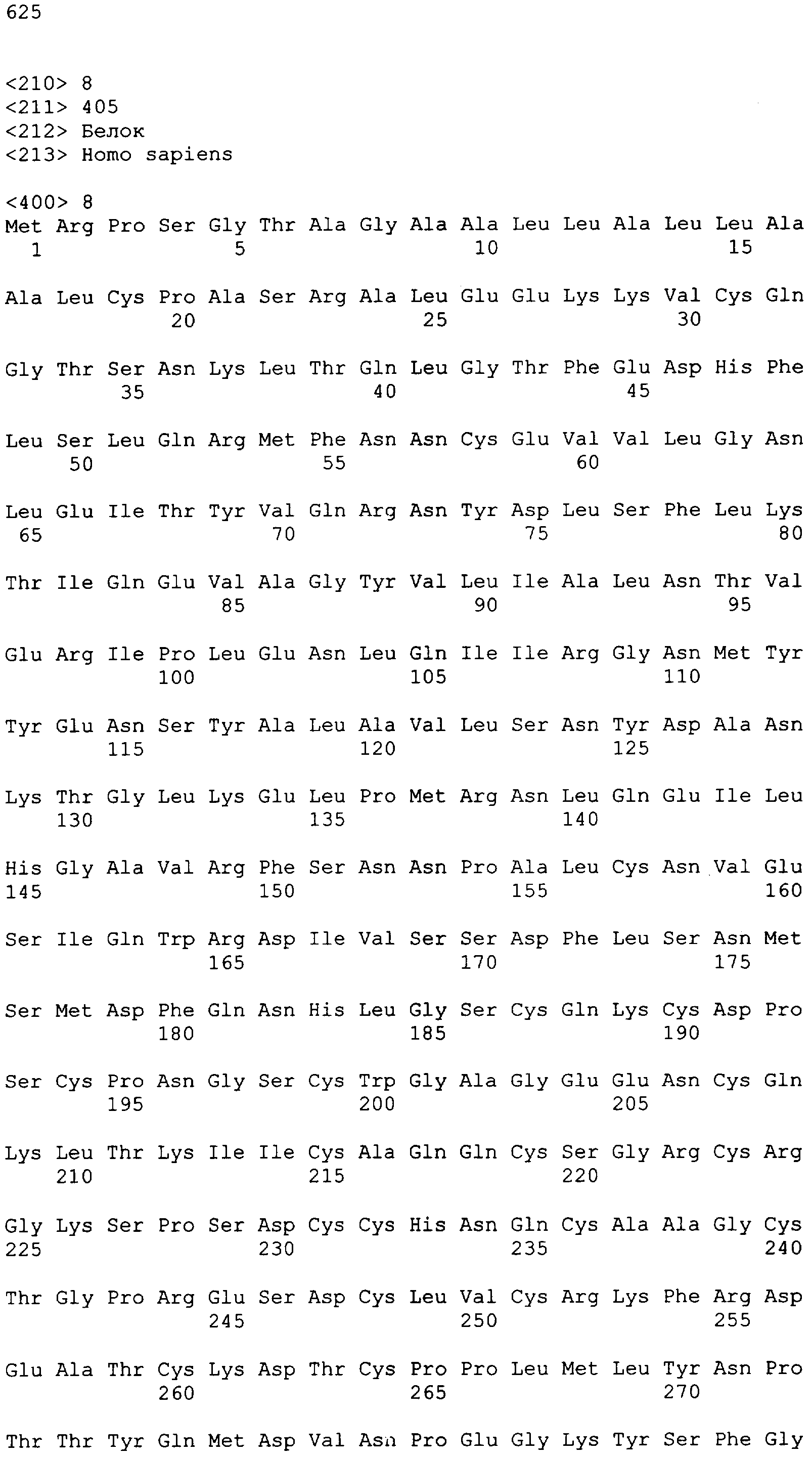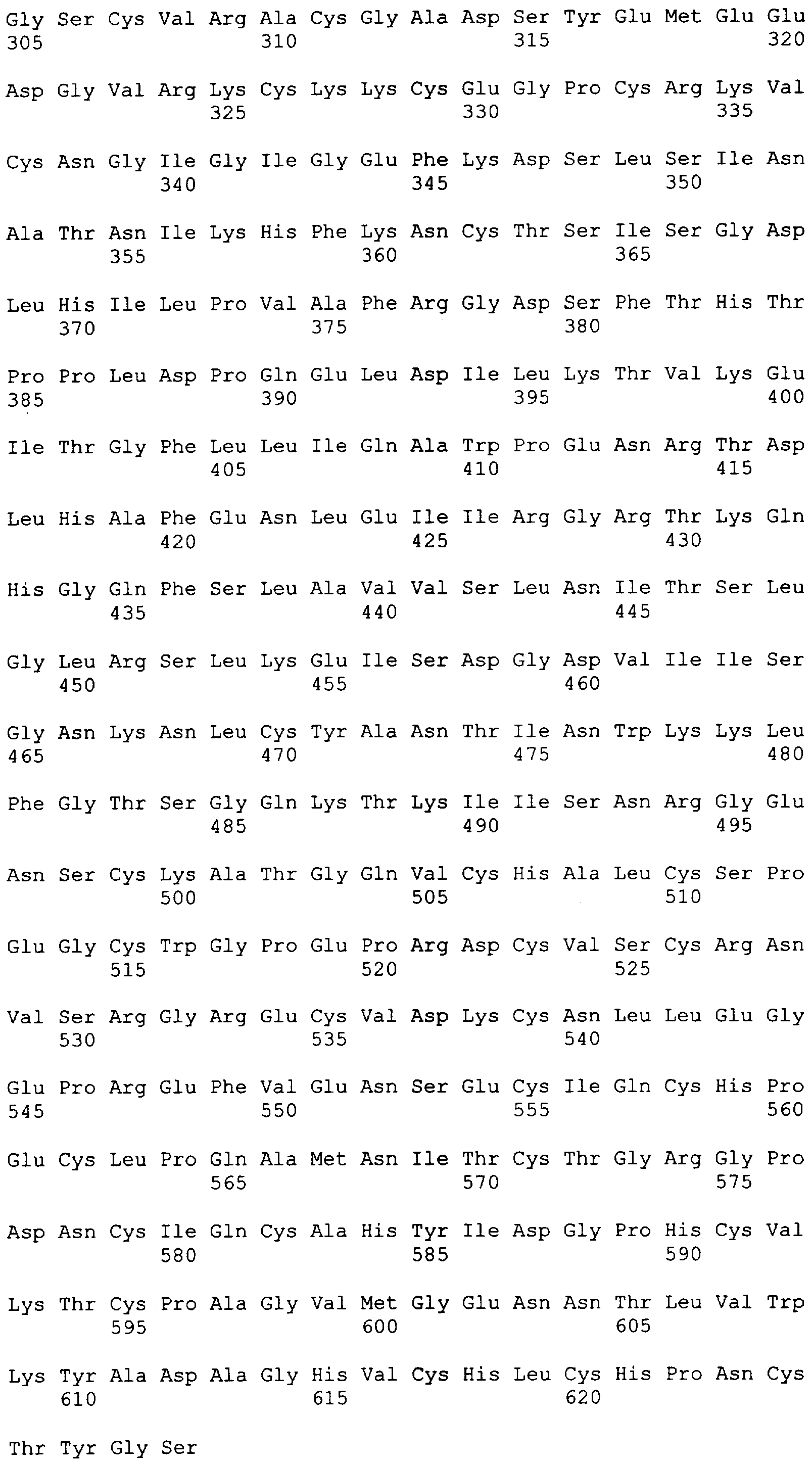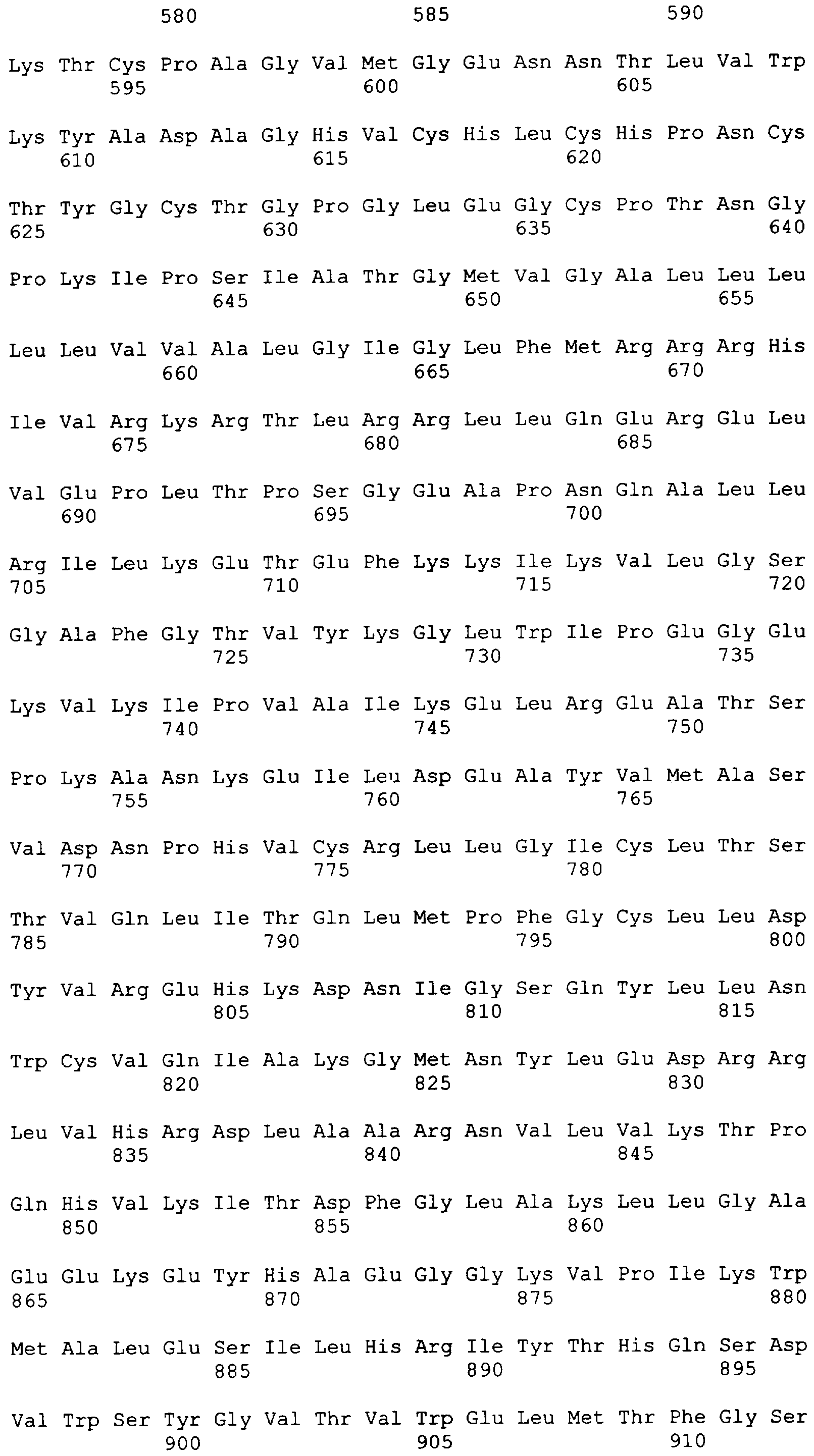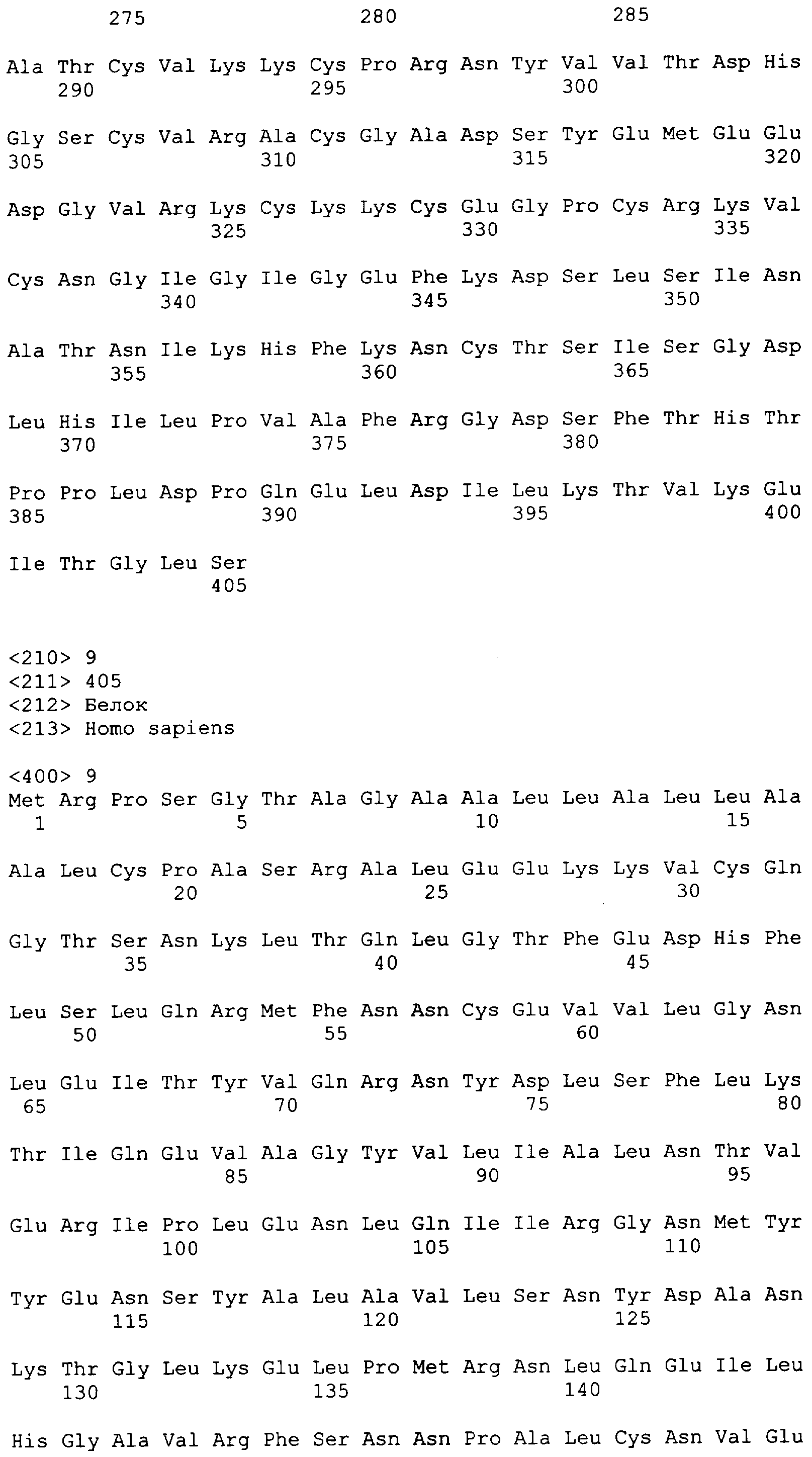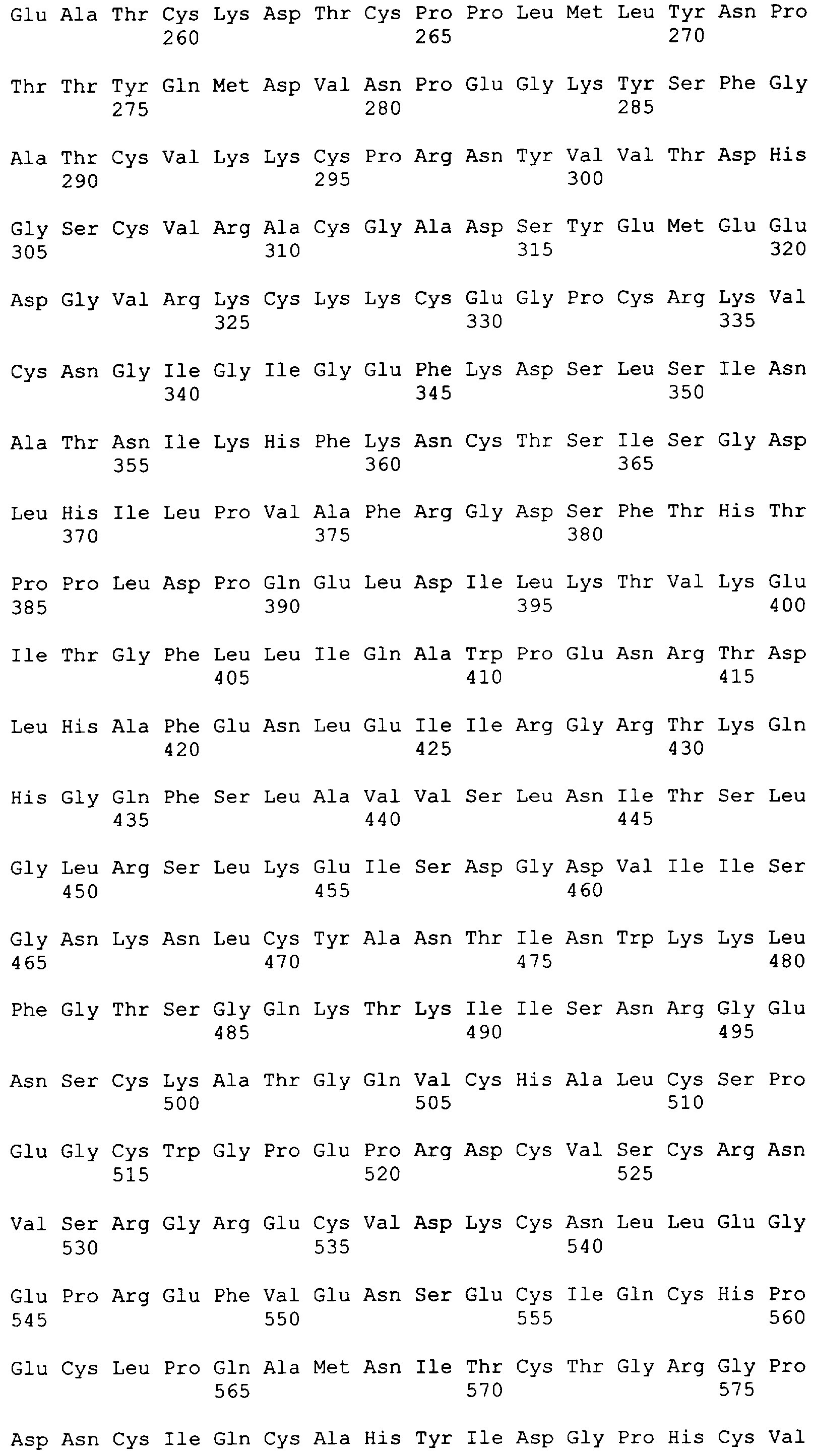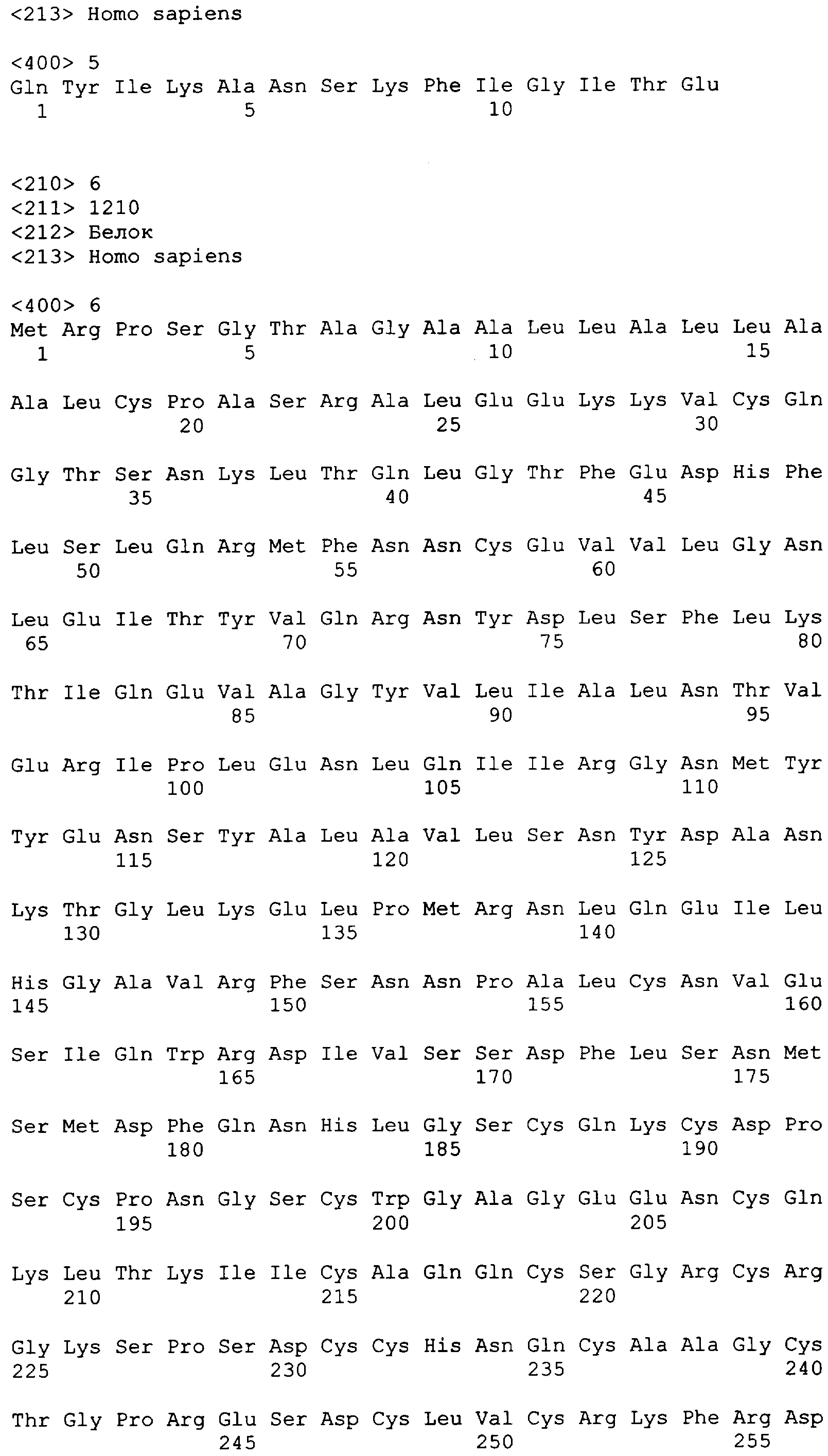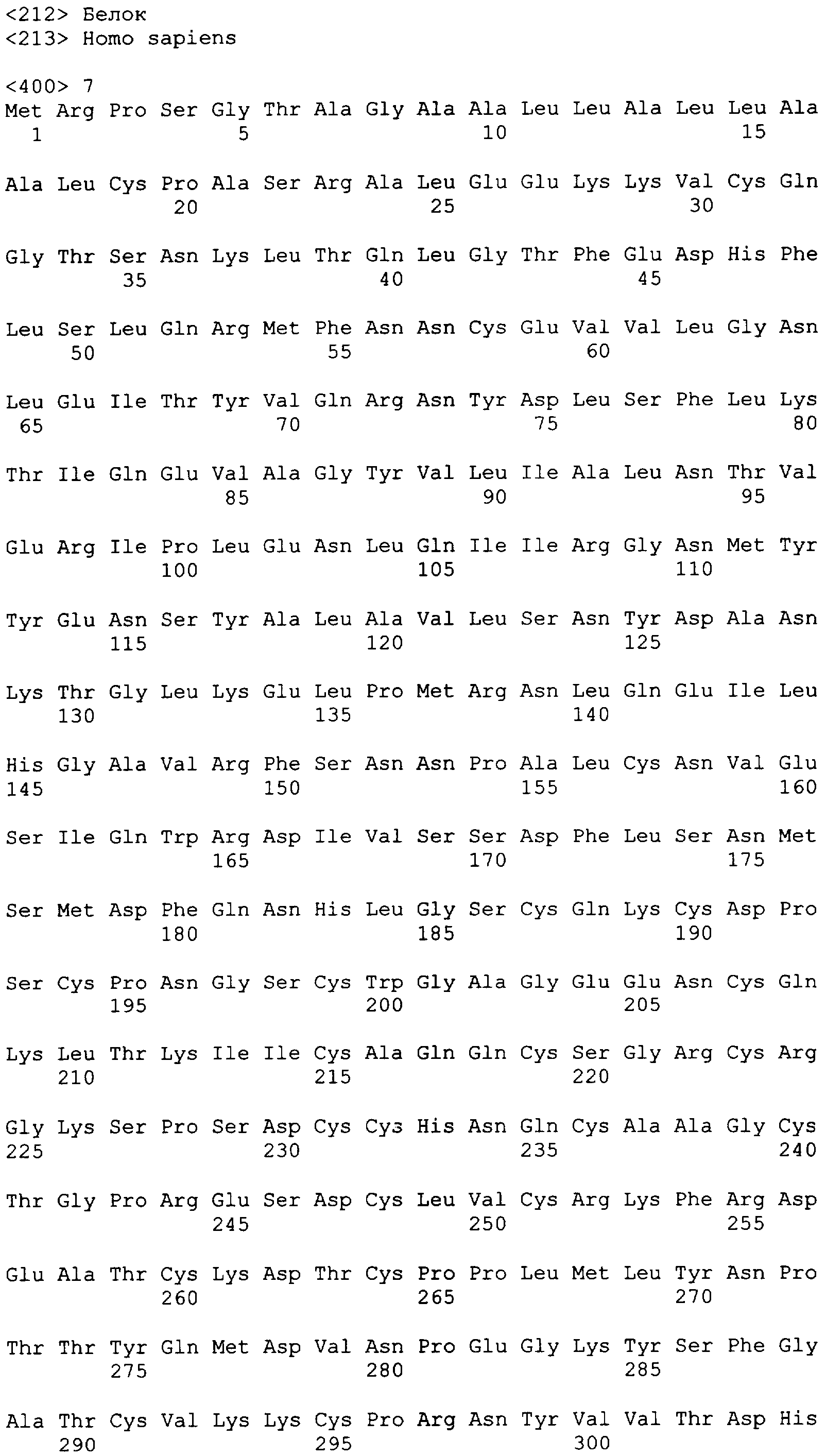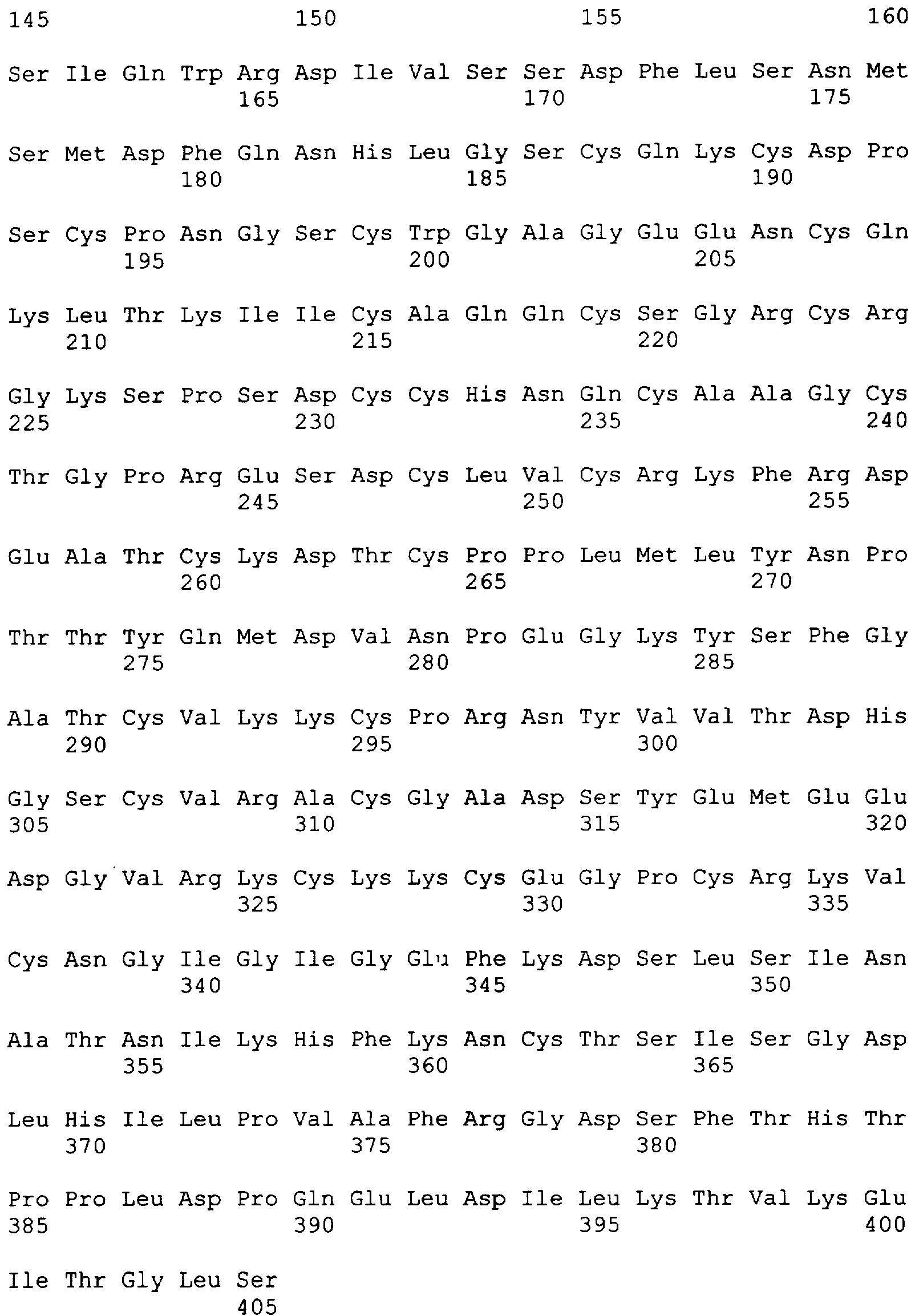Результат интеллектуальной деятельности: СОВМЕСТНАЯ ХИМИОТЕРАПИЯ И ИММУНОТЕРАПИЯ
Вид РИД
Изобретение
Настоящее изобретение выполнено при поддержке правительства США в рамках гранта Национального института здоровья №R01 CA097222. Таким образом, правительство США сохраняет определения права на настоящее изобретение.
По настоящей заявке испрашивается приоритет предварительной заявки США 60/732741, поданной 2 ноября 2005 года, полное содержание которой в точности включено в настоящий документ.
ТЕХНИЧЕСКАЯ ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунотерапии злокачественных опухолей. В частности, оно относится к усилению ответа на опухолевые вакцины.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Несмотря на агрессивные хирургические резекции, высокодозную сфокусированную лучевую терапию и химиотерапию, с момента постановки диагноза пациенты с МГБ (мультиформная глиобластома) имеют среднюю продолжительность жизни менее 15 месяцев (Stupp et al., Optimal role of temozolomide in the treatment of malignant gliomas. Curr Neurol Neurosci Rep. май 2005 года; 5(3): 198-206). Неудачи терапии, по меньшей мере частично, можно объяснить относительно узким терапевтическим индексом, таким, что попытки увеличить дозировки приводят к системной или неврологической токсичности, ограничивающей количество дозы. Применение иммунотерапии считается перспективным для возможного лечения указанных опухолей, но до недавнего времени немногие показали ее клиническую эффективность. Несколько клинических испытаний с выбранными пациентами, относящихся к вакцинации пациентов с глиомой дендритными клетками (ДК), а также кислотосодержащими пептидами (Ashkenazi et al., A selective impairment of the IL-2 system in lymphocytes of patients with glioblastomas: increased level of soluble IL-2R and reduced protein tyrosine phosphorylation. Neuroimmunomodulation. 1997; Kolenko et al., Tumor-induced suppression of T-lymphocyte proliferation coincides with inhibition of Jak3 expression and IL-2 receptor signaling: role of soluble products from human renal cell carcinomas. J Immunol. 15 сентября 1997 года; 159(6): 3057-67; Liau et al., Dendritic cell vaccination in glioblastoma patients induces systemic and intracranial T-cell responses modulated by the local central nervous system tumor microenvironment. Clin Cancer Res. 1 августа 2005 года; 11(15): 5515-25) или антиген-специфичными пептидами (Heimberger AB, Archer GE, et al., Dendritic cells pulsed with a tumor-specific peptide induce long-lasting immunity and are effective against murine intracerebral melanoma. Neurosurgery. январь 2002 года; 50(1): 158-64; рассмотрение 164-6), продемонстрировали перспективность использования посредством увеличения периода средней выживаемости от 20 до 31 месяца. Кроме того, в недавно завершенной II фазе клинического испытания, использовавшего аниген-специфический иммуннотерапевтический подход, время до прогрессии заболевания (ВДП) у пациентов с МГБ было отсрочено на 15 месяцев, что отличалось при сопоставлении со стандартным ведением пациента, включающим лучевую терапию и темозоломид, ВДП которого составило 7 месяцев (Stupp et al., 2005, выше), и средняя выживаемость была 29 месяцев (Heimberger et al., J Transl Med. 19 октября 2005 года; 3:38 The natural history of EGFR и EGFRvIII in glioblastoma patients). В совокупности, несмотря на характерную для пациентов со злокачественной глиомой иммуносупрессию, указанные иммунотерапевтические испытания предполагают, что эффективный иммунный ответ получить можно. Однако существует мнение не лечить пациентов с МГБ некоторыми видами химиотерапии, если имеется недавно назначенное стандартное ведение пациента и общий неблагоприятный прогноз.
В данной области существует необходимость создания улучшенных способов лечения опухолей в целом и глиобластомы в частности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Способ предусматривает лечение опухоли у субъекта. Субъекту вводили эффективное для лечения количество пептида EGFRvIII и эффективное для лечения количество химиотерапевтического средства, вызывающее лимфопению.
В соответствии с другим вариантом осуществления способ предусматривает лечение опухоли у субъекта. Субъекту, имеющему опухоль, вводили эффективное для лечения количество пептида EGFRvIII, конъюгированного с KLH. В качестве адъюванта также вводили гранулоцит-моноцит-колониестимулирующий фактор (GM-CSF) в эффективном количестве одновременно с пептидом EGFRvIII. Субъекту также вводили эффективное для лечения количество алкилирующего агента.
В соответствии с еще одним другим вариантом осуществления способ предусматривает лечение опухоли у субъекта. Субъекту вводили эффективное для лечения количество противоопухолевой вакцины и эффективное для лечения количество темозоломида или его фармацевтически пригодной соли.
В соответствии с еще одним другим вариантом осуществления способ предусматривает лечение опухоли у субъекта. Субъекту вводили эффективное для лечения количество противоопухолевой вакцины и эффективное для лечения количество химиотерапевтического средства, которое вызывает лимфопению.
Указанные и другие варианты осуществления, которые будут очевидны специалистам в данной области, при понимании характеристик изобретения предусматривают технологии с дополнительными способами лечения устойчивых к терапии опухолей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Считается, что одновременное применение химиотерапии и иммунотерапии является противопоказанным вследствие опасения, что лимфопения, вызванная химиотерапией, может устранить терапевтический эффект иммунотерапии. Показано, что темозоломид является эффективным химиотерапевтическим средством для пациентов со злокачественными глиомами, и лишение пациентов с глиобластомой (МГБ) указанного лекарственного средства с целью лечения иммунотерапией является предметом дискуссий. Несмотря на общепринятое мнение, заявители показывают, что и химиотерапию, и иммунотерапию можно проводить одновременно без снижения эффектов иммунотерапии. Более того, темозоломид, вызывающий лимфопению, фактически может быть синергистом для пептидной вакцины. Несмотря на то, что заявители не хотят ограничивать себя конкретной теорией, относящейся к механизму действия, обнаруженное синергетическое действие может быть следствием ингибирования Treg-клеток или неудачного возмещения Treg-клеток, которое обеспечивает увеличение эффекторных CD8+ T-клеток. Также могут быть вовлечены другие механизмы.
"EGFRvIII" или "мутация III рецептора эпидермального фактора роста" является известной формой мутации рецептора эпидермального фактора роста. Смотрите, например, патент США №6503503; смотрите также патенты США №№6900221, 6673602, 6479286 и 6129915. Указанная мутация, которая приводит к синтезу белка vIII, как правило, характеризуется постоянной и опухоль-специфической делецией внутри рамки считывания размером 801 пара нуклеотидов во внеклеточном домене, которая разбивает кодон и приводит к появлению нового глицина в месте соединения.
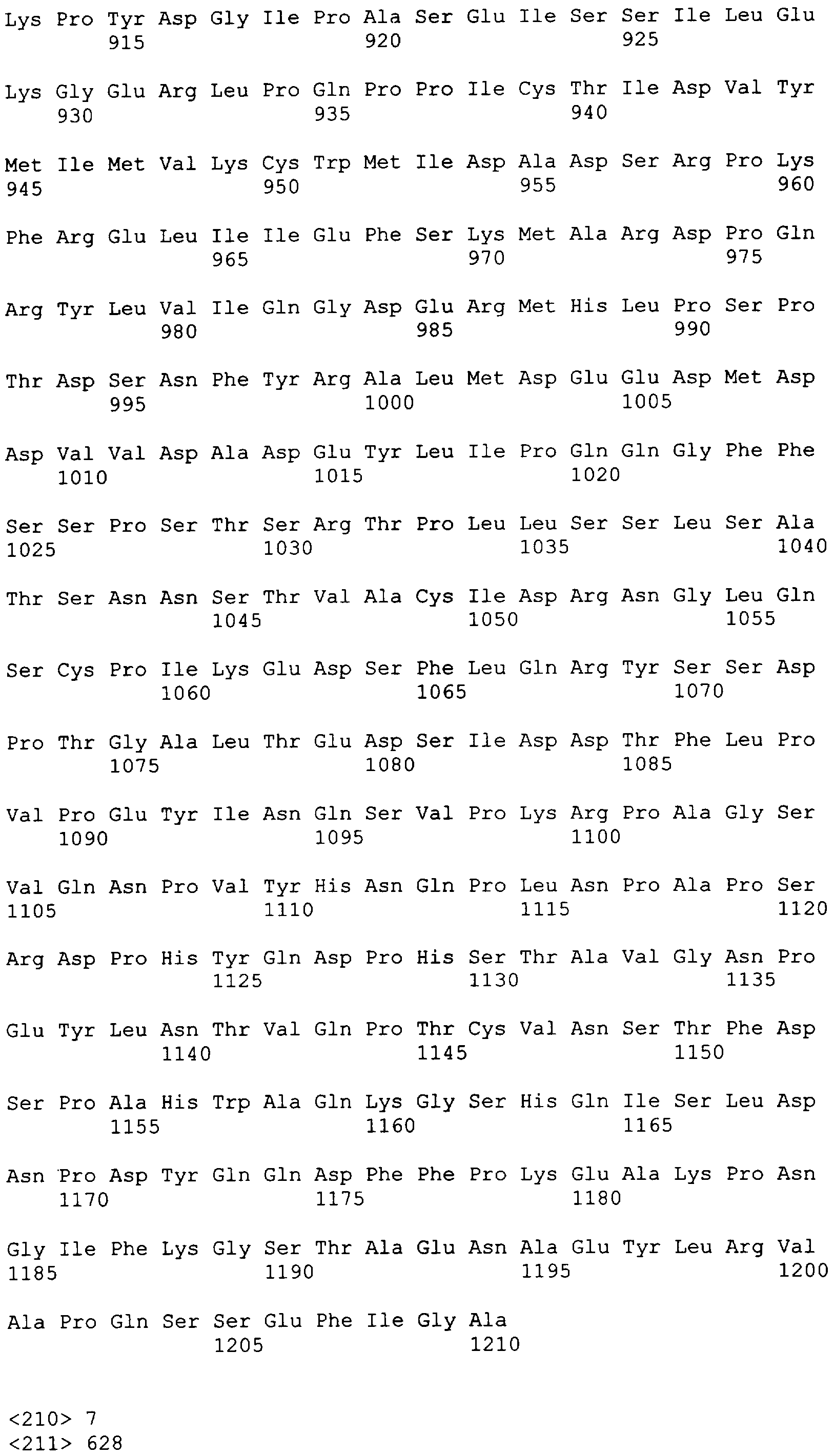
"Пептид EGFRvIII", который применяют в настоящем документе, относится к пептиду с подходящей длиной, например, по меньшей мере 10 или 12 аминокислот, и до 16, 20 или 30 аминокислот или более, который содержит место мутационного сплайсинга соответствующего белка EGFRvIII. Примеры включают в качестве неограничивающих примеров: H-LEEKKGNYVVTDHS-OH или "PEP-3". Пептид EGFRvIII может быть получен из (или соответствовать последовательности) EGFRvIII любого вида млекопитающего, но предпочтительно человека. В частности, последовательности дикого типа EGFR представлены в SEQ ID NO: 6-9.
"Белок-носитель", который применяют в настоящем документе, относится к белку, который не обладает высокой гомологией к белку, показанному у видов, получающих композицию по изобретению, и не вызывает иммунный ответ. Белок обладает высокой гомологией, если он по меньшей мере на 75% идентичен, более предпочтительно, по меньшей мере на 85% идентичен или по меньшей мере на 90% идентичен белку, что определяется посредством любого известного математического алгоритма, применяемого для сравнения двух аминокислотных последовательностей (смотрите, например, Karlin и Altschul, 1990, Proc. Natl. Acad. Sci. USA 87: 2264-2268; Karlin и Altschul, 1993, Proc. Natl. Acad. Sci. USA 90: 5873-5877; Torellis и Robotti, 1994, Comput Appl. Biosci. 10: 3-5; и Pearson и Lipman, 1988, Proc. Natl. Acad. Sci. 85: 2444-8). Предпочтительно, уровень идентичности двух аминокислотных последовательностей определяют посредством поиска в BLAST protein при использовании программы XBLAST, счет=50, длина слова=3. Примеры гетерологичных белков-носителей включают в качестве неограничивающих примеров KLH, PhoE, mLT, TraT или gD из вируса BhV-1. Смотрите, например, патент США №6887472. Такие белки-носители можно конъюгировать или связывать непосредственно с опухолевым антигеном или посредством промежуточного линкерного сегмента, таким как цепь одной или нескольких (например, 2, 4, 6) промежуточных аминокислот (например, промежуточный радикал CYS) согласно известным способам.
"KLH" или "гемоцианин лимфы улитки" является известным белком-носителем, с которым можно конъюгировать другой белок согласно известным способам. Смотрите, например, патент США №6911204.
"Адъювант", который применяют в настоящем документе, относится к любому из соединений различного класса, который усиливает терапевтическую эффективность вакцины, которую вводят одновременно с адъювантом. В некоторых вариантах осуществления адъювант является гемапоэтическим фактором роста, таким как GM- CSF. Стандартные примеры адъювантов включают в качестве неограничивающих примеров гидроксид, фосфат или оксид алюминия, на основе эмульсии типа масло-в-воде или вода-в-масле, например, миерального масла, такого как Bayol Fo или Marcol 52TM, или растительного масла, таких как ацетат витамина E, сапонины, BCG, M. vaccae, столбнячный анатоксин, дифтерийный анатоксин, Bordetella pertussis, интерлейкин 2, интерлейкин 12, интерлейкин 4, интерлейкин 7, полный адъювант Фрейнда, неполный адъювант Фрейнда и неспецифический адъювант. Смотрите, например, патент США №6699483.
"Гемапоэтические факторы роста" или "HGF" известны. Смотрите, например, патент США №6863885. В основном, HGF являются гликопротеиновыми цитокинами, которые регулируют пролиферацию и дифференцировку гемапоэтических клеток-предшественников. Гемапоэтические факторы роста, которые предполагают использовать в настоящем изобретении, могут быть выбраны из группы G-CSF (гранулоцит-колониестимулирующий фактор), SCF (фактор стволовых клеток), GM-CSF (гранулоцит-моноцит-колониестимулирующий фактор), IL-1 (интерлейкин 1), IL-3, IL-6, IL-8, IL-11, IL-12, LIF (лейкемический ингибирующий фактор), FGF-β (фактор роста фибробластов β), FLT3 или их сочетание. Указанные факторы роста можно купить (например, R&D Systems, Minneapolis, MN) или изготовить следующими способами, как правило, известными в данной области и описанными в публикациях, посвященных указанным факторам. Дополнительно, гемапоэтический фактор роста может быть модифицированной формой фактора или химерным белком гемапоэтических факторов роста, выбранных из группы G-CSF, SCF, GM-CSF, IL-1, IL-3, IL-6, IL-8, IL-11, IL-12, LIF, FGF-β и FLT3. HGF включают модифицированные факторы роста (например, в результате мутации) и химерные белки, которые получают в соответствии с известными в данной области способами. Смотрите, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989. В частности, предпочтительны гемапоэтические факторы роста, стимулирующие макрофаги, такие как GM-CSF. Их можно использовать в качестве адъювантов.
"Дистанционную лучевую терапию" можно выполнять посредством облучения жесткими рентгеновскими лучами в место опухоли пациента. Луч генерируют вне пациента и направляют в место опухоли. Никаких радиационных источников в тело пациента не помещают. Это можно использовать в сочетании с любыми другими стадиями лечения по изобретению.
Термин "лечение", применяемый в настоящем документе, относится к любому типу лечения или предупреждения, которое обеспечивает положительный эффект у пациента, пораженного заболеванием или имеющим риск развития заболевания, включая улучшение состояния субъекта (например, одного или нескольких симптомов), отсрочивание прогрессии заболевания, отсрочивание появления симптомов или медленное прогрессирование симптомов и т.д. Поэтому термин "лечение" также включает профилактическое лечение субъекта для предотвращения появления симптомов.
Применяемые в настоящем документе, "лечение" и "предотвращение" не означают, что подразумевается выздоровление или полное устранение симптомов. Скорее, они относятся к любому типу лечения, которое обеспечивает положительный эффект у пациента, пораженного заболеванием, включая улучшение состояния субъекта (например, одного или нескольких симптомов), отсрочивание прогрессии заболевания и т.д.
"Количество, эффективное для лечения", применяемое в настоящем документе, означает количество антитела, достаточное чтобы вызвать желаемый эффект у пациента, пораженного злокачественной опухолью, такой как глиобластома, включая улучшение состояния субъекта (например, одного или нескольких симптомов), отсрочивание прогрессии заболевания и т.д.
Субъекты, нуждающиеся в лечении способами, описываемыми в настоящем документе, включают субъектов, пораженных глиобластомой или астроцитомой, а также субъектов, пораженных другими солидными опухолями или эпителиальными опухолями, такими как опухоли легкого, толстой кишки, молочной железы, мозга, печени, предстательной железы, селезенки, мышечной ткани, яичников, поджелудочной железы, головы и шеи, кожи (включая меланому) и т.д. Субъекты, нуждающиеся в лечении способами, в частности, включают субъектов, пораженных опухолями, такими как опухоль мозга, в которой экспрессируется EGFRvIII. Опухоль может быть первичной опухолью, метастатической опухолью или рецидивной опухолью. Субъекты, которые проходят лечение способами по изобретению, в частности, включают субъектов, пораженных опухолями, в которых экспрессируется EGFRvIII, включая глиомы, фибросаркомы, остеосаркомы, меланому, опухоль Вильмса, карциному толстой кишки, карциномы молочной железы и легкого и сквамозные карциномы. Субъекты, которые проходят лечение способами по изобретению, наиболее предпочтительно, включают субъектов, пораженных опухолями мозга или эпителиальными опухолями, такими как глиобластомы, в частности, мультиформная глиобластома и кистозная астроцитома.
Настоящее изобретение, главным образом, относится к лечению людей, включая мужчин и женщин и новорожденных, младенцев, подростков, молодых людей, взрослых и пожилых, но изобретение можно также применять у животных, в частности, у млекопитающих, таких как мыши, крысы, собаки, кошки, домашний скот и лошади для ветеринарных целей, и скрининга лекарственных средств, и в целях получения лекарственных средств.
Фармацевтические композиции по изобретению можно приготовить в соответствии с известными технологиями. В основном, действующее вещество включено в фармацевтически пригодный носитель. Можно использовать большинство водных носителей, например, вода, водный буфер, 0,9% физиологический раствор, 0,3% глицин, гиалуроновая кислота и т.п. Указанные композиции могут быть стерилизованы стандартными, хорошо известными способами стерилизации или стерильно отфильтрованы. Полученные водные растворы можно упаковать для применения или в лиофилизированной форме, или в лиофилизированной форме вместе со стерильным раствором, смешивая перед введением. Композиции могут включать фармацевтически подходящие вспомогательные средства, которые требуются для поддержания физиологических условий, такие как буферные средства, средства, контролирующие осмос, увлажняющие средства и т.п., например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламиновая соль олеиновой кислоты и т.д.
Композиции и способы по изобретению могут включать введение одного или нескольких соадъвантов. Пригодные соадъюванты включают в качестве неограничивающих примеров: (1) соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д.; (2) эмульсионные составы масло-вода (с наличием или отсутствием других определенных иммуностимулирующих средств, таких как мурамил-пептиды (смотрите ниже) или компоненты клеточной стенки бактерий), такие как, например, (a) MF59 (публикация PCT № WO 90/14837), содержащих 5% сквален, 0,5% Tween 80 и 0,5% Span 85, сформированные в субмикронные частицы, (b) SAF, содержащий 10% сквален, 0,4% Tween 80, 5% поверхностно-активный полимер L121 и thr-MDP (смотрите ниже), или микродисперсированные в субмикронную эмульсию или взболтанные для получения эмульсии с частицами большего размера, и (c) адъювантная система RibiTM (RAS), (Ribi Immunochem, Hamilton, MT.), содержащая 2% сквален, 0,2% Tween 80 и один или несколько компонентов клеточной стенки бактерий из группы, состоящей из монофосфоролипида A (MPL), трегалозы димиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (DetoxTM) (для дополнительного обсуждения пригодных субмикронных эмульсий масло-вода для применения по настоящему документу смотрите публикацию PCT № WO 99/30739, опубликована 24 января 1999 года); (3) можно использовать адъюванты сапонина, такие как StimulonTM (Cambridge Bioscience, Worcester, MA) или частицы, полученные на его основе, такие как ISCOM (иммуностимулирующие комплексы); (4) полный адъювант Фрейнда (CF A) и неполный адъювант Фрейнда (IF A); (5) цитокины, такие как интерлейкины (IL-1, IL-2 и т.д.), макрофаг-колониестимулирующий фактор (M-CSF), фактор некроза опухоли (TNF) и т.д.; (6) нейтрализованные мутантные соединения бактериального ADP-рибозилирующего токсина, такого как холерный токсин (CT), токсин коклюша (PT) или термостабильного анатоксина E. coli (LT), в частности, LT-K63 (где лизин замещает природную аминокислоту в положении 63), LT-R72 (где аргинин замещает природную аминокислоту в положении 72), CT-SI09 (где серин замещает природную аминокислоту в положении 109), адъюванты, полученные из молекул семейства CpG, CpG динуклеотидов и синтетических олигонуклеотидов, которые включают последовательности CpG (смотрите, например, Krieg et al., Nature, 374:546 (1995) и Davis et al, J. Immunol., 160:870-876 (1998)) и PT-K9/GI29 (где лизин замещает природную аминокислоту в положении 9 и глицин замещает природную аминокислоту в положении 129) (смотрите, например, публикации PCT №№ W093/13202 и W092/19265); (7) другие средства, которые действуют как иммуностимулирующие агенты для усиления эффективности композиции, смотрите, например, патент США №6534064; и (8) другие лиганды для Toll-подобных рецепторов в дополнение к адъювантам CpG и RIBI, такие как бактериальный флагеллин (эффективный адъювант для CD4+ T-клеток; смотрите IJ Immunol. 169: 3914-9 (октябрь 2002 года).
Активные лекарственные средства можно вводить посредством любого соответствующего медицинского способа, например, стандартным внутривенным или внутриартериальным введением, инъекцией в цереброспинальную жидкость. В определенных случаях, предпочтительным является подкожное, внутриполостное, интратекальное или прямое введение в опухоль или в артерию, кровоснабжающую опухоль. Если опухоль или ее часть ранее была удалена хирургически, лекарственные средства вводят в место опухоли (и, в частности, в ограниченную полость или "полость резекции" на месте опухоли) посредством прямой инъекции или через предварительно имплантированные резервуары.
Дозировка лекарственных средств будет зависеть, кроме того, от состояния субъекта, в частности, от категории или типа злокачественной опухоли, которую лечат, пути введения, природы применяемого терапевтического средства и чувствительности опухоли к конкретному терапевтическому средству.
В основном, доза опухолевого антигена или вакцины, такого как EGFRvIII, включающих любой белок-носитель или конъюгированный с ним пептид, составляет от 10, 100 или 500 мкг до 2 или 3 мг на субъекта, для каждой дозы. Дозы можно вводить как единичные случаи, необязательно включая последующую или "усиленную" дозы (например, одну, две или три последующие дозы или "усиленные" дозы, вводимые с интервалами от одной до трех недель). Заметим, что, при желании, дозы могут быть разделены, как, например, при введении в различные инъекционные места для уменьшения побочных действий, таких как местные реакции. Если состав содержит и опухолевый антиген, связанный (или "конъюгированный") с белком-носителем, и опухолевый антиген, свободный от белка-носителя, суммированная доза может включать и количество связанного свободного антигена, и белка-носителя.
В основном, доза адъюванта, такого как GM-CSF, вводимая по той же схеме или различной схеме с дозой опухолевого антигена, будет составлять также от 10 или 20 мкг до 500 мкг, или 1 или 2 мг на субъект. Если адъювант вводят по той же схеме, его можно использовать в том же носителе, что и опухолевый антиген. Если адъювант не совмещен в одном носителе, то его дозу необходимо только вводить близко по времени с дозой опухолевого антигена для усиления их действия (например, в течение одного или двух часов; на протяжении одного дня и т.д.).
Алкилирующие средства, применяемые в настоящем изобретении, включают (но не ограничены) 1,3-бис(2-хлорэтил)-1-нитромочевину (BCNU) и производные тетразина, в частности, производные [3H]-имидазо[5,1-d]-1,2,3,5-тетразин-4-она, такие как темозоломид и его аналоги (включая фармацевтически пригодные соли и его пролекарственные средства). Такие соединения известны. Смотрите, например, патенты США №№6096724; 6844434 и 5260291. Примеры алкилирующих средств, применяемых в настоящем изобретении, включают алкилирующие средства [3H]-имидазо[5,1-d]-1,2,3,5-тетразин-4-она, в частности, те, что описываются общей формулой:
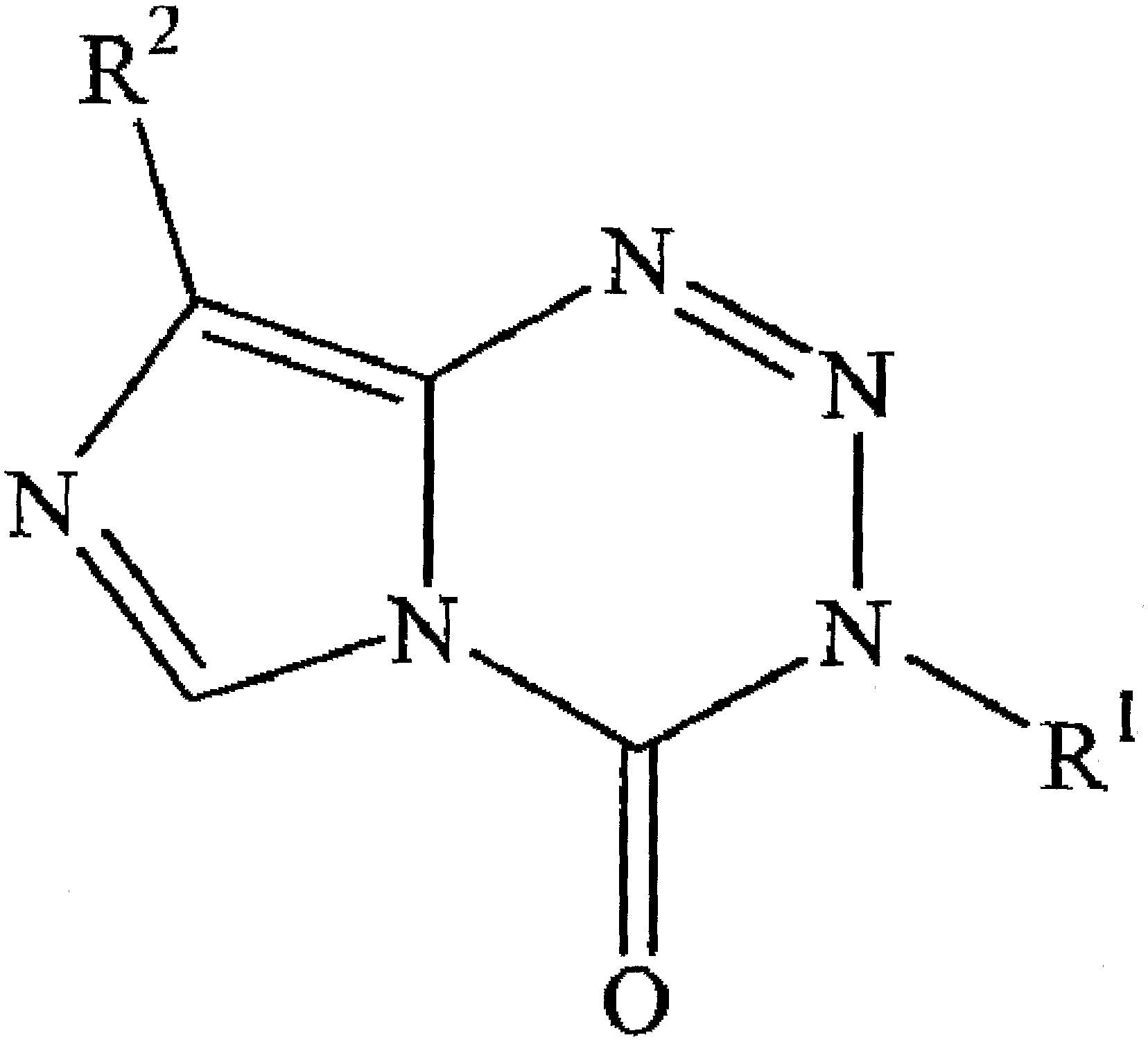
где R1 представляет собой атом водорода или линейные или разветвленные алкильные, алкенильные или алкинильные группы, содержащие до 6 атомов углерода, каждая такая группа незамещена или замещена заместителями от одного до трех, выбранных из атомов галогенов (т.е. брома, йода или, предпочтительно, хлора или фтора), линейных или разветвленных алкокси- (например, метокси-), алкилтио-, алкилсульфинильных и алкилсульфонильных групп, содержащих до 4 атомов углерода, и, необязательно, замещенных фенильными группами, или R1 представляет собой циклоалкильную группу, и R2 представляет собой карбамоильную группу, которая может нести атом азота одной или двух групп, выбранных из линейных или разветвленных алкильных и алкенильных групп, каждая содержащая до 4 атомов углерода, и циклоалкильных групп, например, метилкарбамоильная или диметилкарбамоильная группа. Если R1 представляет собой алкильную, алкенильную или алкинильную группу, замещенную двумя или тремя атомами галогена, вышеуказанные атомы галогена могут быть одинаковыми или разными. Если R1 означает алкильную, алкенильную или алкинильную группу, замещенную одним, двумя или тремя необязательно замещенными фенильными группами, необязательные заместители фенильного радикала(ов) могут быть выбраны, например, из алкокси- и алкильных групп, содержащих до 4 атомов углерода (например, метокси- и/или метильная группа(ы)) и нитрогруппу; R1 может представлять собой, например, бензильную или п-метоксибензильную группу. Циклоалкильные группы в рамках определения R1 и R2 содержат от 3 до 8, предпочтительно 6, атомов углерода. Соединения могут быть представлены в качестве солей или пролекарств, в частности, солей щелочных металлов, если R1 является водородом. Смотрите, например, патент США №5260291.
Темозоломид, в пероральной лекарственной форме в виде капсул 5 мг, 20 мг, 100 мг и 250 мг, является коммерчески доступным, как TEMODARTM от Schering Corporation, Kenilworth NJ 07033 USA.
Алкилирующие средства можно изготовить в фармацевтически пригодных составах подобным способом, как описано выше, в том же или в другом составе, который содержит опухолевую вакцину, например, пептид EGFRvIII.
В предпочтительном варианте осуществления алкилирующее средство вводят в цикле суточных доз в течение 3, 4, 5, 6 или 7 последовательных суток. Подходящая суточная доза может быть от 50, 100 или 150 мг/м2/доза до 200, 250 или 300 мг/м2/доза. Указанный цикл можно повторять, например, каждые две, три, четыре или пять недель, в целом до 6, 8 или 10 циклов. Первую дозу в первом цикле алкилирующего средства можно вводить в любое подходящее время. В некоторых вариантах осуществления первую дозу алкилирующего средства вводят до двух или четырех недель перед введением терапевтического антитела; в некоторых вариантах осуществления первую дозу алкилирующего средства вводят по меньшей мере две, четыре или шесть недель, за которым следует введение терапевтического антитела. Могут быть включены дополнительные схемы ведения, если субъекту проводят дополнительное терапевтическое лечение, такое как дистанционная лучевая терапия.
Необязательно, субъект также может получать дистанционную лучевую терапию. Например, дистанционную лучевую терапию можно применять для опухолей мозга, таких как глиобластома. Дистанционная лучевая терапия является общеизвестной и может быть выполнена в соответствии с известными технологиями. Луч можно получать любыми пригодными способами, включая медицинские линейные ускорители и дистанционные лучевые установки с источником кобальт-60. Источник радиации можно вмонтировать в подставку, которая вращается вокруг пациента, чтобы область мишени внутри пациента облучали с различных сторон. Перед облучением лечение, как правило, планируют на компьютере с применением алгоритмов, которые моделируют лучи и позволяют медицинскому персоналу планировать лучевую терапию. Различные вариации дистанционной лучевой терапии, которые можно использовать для применения в настоящем изобретении, будут хорошо понятны специалистам в данной области. Смотрите, например, патенты США №№6882702; 6879659; 6865253; 6863704; 6826254; 6792074; 6714620 и 5528650.
Дистанционную лучевую терапию предпочтительно проводят в серии сеансов в соответствии с известными способами, с сеансами, предпочтительно начатыми через две-четыре недели после введения терапевтического антитела. Например, дистанционную лучевую терапию можно проводить 3, 4, 5, 6 или 7 дней в неделю, в течение периода четырех, пяти, шести или семи недель, в суточной дозе 0,5 или 1 Гр, до 2 или 3 Гр, до тех пор, пока не достигнут суммарной планируемой дозы (например, 30 или 40 Гр, до 50 или 60 Гр).
Доставляемая доза может быть в области, включающей границы нормальной ткани вокруг опухоли (например, ~1, 2 или 3 см границы во всех направлениях) или, если опухоль или ее часть ранее была хирургически удалена, вокруг места опухоли.
Если применяют дистанционную лучевую терапию, пациент может получать дополнительную схему введения химиотерапевтического средства, отличную от той, что описана выше, в некоторой сниженной дозе, в течение курса радиотерапии. Например, пациент может получать суточные дозы химиотерапевтического средства, например, алкилирующего средства в количестве от 25 или 50 мг/м2/доза до 100 или 125 мг/м2/доза ежедневно в течение курса дистанционной лучевой терапии.
Примеры опухолевых антигенов, которые можно использовать в качестве противоопухолевых вакцин, включают, в качестве неограничивающих примеров, циклинзависимую киназу 4; β-катенин; каспазу-8; MAGE-1; MAGE-3; тирозиназу; поверхностный Ig идиотип; рецептор Her-2/neu; MUC-1; HPV E6 и E7; CD5 идиотип CAMPATH-1, CD20; поверхностный клеточный гликопротеин CEA, муцин-1; поверхностный клеточный карбогидрат Lewisx; CA-125; рецептор эпидермального фактора роста; p185HER2; IL-2R; FAP-α; тенасцин; и металлопротеиназы. EGFRvIII является типичным опухолеспецифичным антигеном. Клетки, которые экспрессируют указанные антигены, также можно использовать в качестве вакцин. Предпочтительно, клетки убивают перед введением. Клетки можно разделить по фракциям, чтобы использовать в качестве вакцины фракцию, обогащенную опухолевым антигеном. Указанные антигены являются просто примерами и не претендуют быть единственными среди множества применяемых антигенов, известных в данной области или которые можно использовать.
Множество доклинических модельных систем показали, что истощение субпопуляций иммунных клеток может аннулировать эффективность некоторых типов достижений иммунотерапии (Heimberger et al., 2003), свидетельствуя, что химиотерапия, проводимая в течение действующих стадий иммунотерапии, может снижать эффективность. Однако, это не исключает применение указанных средств совместно, если соответствующим образом рассчитать время для минимизации указанного выше действия. Кроме того, хотя заявители не хотят ограничивать себя любой конкретной теорией, относящейся к механизму действия, истощение определенных эффекторных клеток, таких как Treg, может быть достаточно хорошим результатом химиотерапии, принося больший иммунотерапевтический эффект, или может поддерживать необходимый профиль цитокинов для адекватного контроля опухоли.
Описанное выше раскрывает настоящее изобретение в целом. Все ссылки, описываемые в настоящем документе, однозначно включены в качестве ссылки. Более полное понимание можно получить посредством ссылки на следующие определенные примеры, которые представлены в настоящем документе единственно с целью иллюстрации и не претендуют ограничить объем изобретения.
ПРИМЕР 1
Для проверки гипотезы, что химиотерапию и иммунотерапию можно проводить одновременно, пациенты, имеющие в первый раз поставленный диагноз МГБ, получали лечение с использованием стандартной терапии темозоломидом, в течение которой также вводили пептидную вакцину, направленную на эпидермальный фактор роста variant III (EGFRvIII) (Heimberger et al., 2006). Амплификация гена рецептора эпидермального фактора роста (EGFR), которая приводит к EGFR, трансмембранного тирозинкиназного рецептора (Ekstrand et al., 1991) ассоциирована с мутантным геном EGFR, EGFRvIII (Wikstrand et al., 1997). Предыдущие работы показали, что амплификация EGFR происходит во всех МГБ, экспрессирующих EGFRvIII (Heimberger et al., 2005), и МГБ, не имеющие амплифицированного EGFR, не имеют положительной реакции на EGFRvIII (Aldape et al., 2004).
В мае 2005 года 51-летний европейский мужчина был обследован со следующими жалобами на постоянные утренние головные боли в течение трех недель, не связанные с рвотой. На снимке ядерно-магнитного резонанса (ЯМР) обнаружили многодолевое неравномерно увеличенное изменение, размерами 6,6×5,3×4,3 в переднем сегменте правой височной доли. Сильвиева борозда была изогнута кверху, и имелось смещение срединных структур на 6 мм. Пациенту провели полную тотальную резекцию, с гистологическим исследованием, показавшим двухфазную глиобластому и злокачественную саркому. Указанные детали были подтверждены положительной иммуногистохимией в компоненте глиобластомы глиального фибриллярного кислого белка (GFAP) и избыточной продукцией ретикулина в компоненте саркомы. Трехцветное окрашивание подтвердило двухфазную природу опухоли. Иммуногистохимическое окрашивание антител EGFR-528 и EGFRvIII было положительным (Heimberger et al., 2005), с окрашиванием EGFRvIII, показывающим высокую диффузную реактивность, в то время как окрашивание EGFR-528 было более фокальным. PTEN был высоко положителен, и реактивность p53 присутствовала в более 30% опухолевых ядер. Ген репарации ДНК метилгуанинметилтрансфераза (MGMT) был метилирован (Hegi et al., 2005).
После операции пациенту провели стандартную дистанционную лучевую терапию в объеме 6000 сГр в 30 фракциях. Одновременно с лучевой терапией вводили темозоломид 75 мг/м2 (Stupp et al., 2005). На снимке ЯМР, сделанном после завершения лучевой терапии, изменений не выявлено и не показано прогрессирования. Затем пациенту провели лейкаферез для получения достаточного количества клеток для целей иммунологического мониторирования. Пациент получал три подкожных (i.d.) инъекции PEPvIII-3 (LEEKKGNYVVTDHC), конъюгированного с гемоцианином лимфы улитки (KLH), в соотношении 1:1 (масс./масс.) (PEPvIII-KLH) (500 мкг/иммунизация) с гранулоцит-моноцит-колониестимулирующим фактором (GM-CSF) (142 мкг/иммунизация) каждые две недели с интервалом в 6 недель (фаза индукции). В дальнейшем, ему выполнили второй лейкаферез для целей иммунологического мониторирования. На этой стадии пациент начал поддерживающие циклы темозоломида 150 мг/м2 в сутки 1-5. Начиная с 19 суток каждого цикла, через день проводили полный анализ крови, пока не наступило восстановление количества белых клеток крови с наименьшего уровня. В точке наименьшего уровня пациент стал получать вакцину i.d., как правило, на 23 сутки (диапазон=19-25) его 28-дневного цикла.
ПРИМЕР 2
Гиперчувствительность замедленного типа (ГЗТ), тестируемая к общим антигенам кожной пробы и компонентам вакцины оценивали перед началом вакцинации, после третьей вакцины и ежемесячно в течение его поддерживающего цикла на 26 сутки. Перед началом вакцинации и после завершения лучевой терапии и одновременной терапии темозоломидом, пациент был чувствителен только к Candida и не имел реакций ГЗТ к компонентам вакцины, PEPvIII или KLH. Однако, после третьей вакцинации пациент стал чувствительным к компоненту вакцины KLH. После десятой вакцинации и в течение совместного получения темозоломида, он стал чувствительным к компоненту вакцины PEPvIII. Для сравнения, среди пациентов, получавших вакцину без циклов темозоломида (n=22), менее 15% когда-либо отвечали на компонент PEPvIII. После самого последнего контрольного обследования и ведения 14-й вакцины, пациент имел видимое уплотнение (16×15 мм) в месте проведения ГЗТ PEPvIII. Это может свидетельствовать о том, что темозоломид отрицательно не влияет на развитие реакции ГЗТ у данного конкретного пациента.
ПРИМЕР 3
Для определения, вызывает ли PEPvIII специфический гуморальный ответ, сыворотку крови получали от пациента ежемесячно и хранили при -20°С перед анализом посредством набора PEPvIII-Dynabead®. PEPvIII или внеклеточный домен EGFRvIII (EGFRvIII-ECD) ковалентно связывали с магнитными микросферами, которые ловили специфические антитела из сыворотки пациента (Invitrogen, Carlsbad, CA) по инструкциям производителя. Все образцы сыворотки первоначально разводили в соотношении 1:10 с фосфатно-солевым буфером (PBS)+0,5% бычий сывороточный альбумин (BSA) и исследовали в триплете. Для определения специфичности, дополнительный набор образцов преинкубировали в течение 15 минут с 500 нг пептида PEPvIII для блокирования любых анти-PEPvIII, которые могли бы связаться с PEPvIII, конъюгированными с Dynabead. Стандарты химерного антитела человек-мышь анти-PEPvIII (81-0,11 нг/мл) прогоняли с каждым исследованием наравне с положительным (образец пациента ACT4) и отрицательным (сыворотка здорового донора) контролями. Проточный цитометр был стандартизирован микробусинами PE-FACS и не реагировал на PEPvIII Dynabead. Перед введением вакцины, гуморального ответа к EGFRvIII отмечено не было. После вакцинации, было значительное увеличение IgG к EGFRvIII по значениям флюоресцентной интенсивности (MFI) из 13, и гуморальный ответ сохранялся, несмотря на введение темозоломида.
ПРИМЕР 4
Для определения, индуцирует ли PEPvIII CD8+ цитотоксический ответ, мононуклеарные клетки периферической крови (PBMC) пациентов от каждого лейкафереза и ежемесячные PBMC стимулировали одновременно столбнячным анатоксином, (QYIKANSKFIGITE) (SEQ ID NO: 5) (10 мкг/мл) (положительный контроль), PEP-1 (HDTVYCVKGNKELE) (SEQ ID NO: 4) (10 мкг/мл) (отрицательный контроль), PEPvIII (10 мкг/мл) (компонент вакцины) или KLH (10 мкг/мл) (компонент вакцины). Отрицательный контроль включал нестимулированные клетки. Для каждого условия, включая секрецию γ-интерферона (IFN), использовали соответствующие изотипные контроли. Все лунки инкубировали в течение 6 часов при 37°С с GolgiplugTM (Pharmingen, San Diego, CA), белковым транспортным ингибитором, который блокирует внутриклеточные транспортные процессы. После инкубации, клетки промывали и блокировали неспецифическое связывание посредством очищенных анти-CD16 антител (Pharmingen) и сыворотки кролика (Pharmingen). Клетки прокрашивали на наличие поверхностных маркеров (CD3, CD4, CD8) посредством инкубирования с подходящим флуоресцинизотиоцианатом и аллофикоцианином, окрашенными флюоресцентно мечеными первичными антителами, или изотипными контролями (Pharmingen). Клетки затем фиксировали с Cytofix/Cytoperm (BD Biosciences, San Jose, CA) и затем инкубировали с фикоэритрин-мечеными антителами против γ-IFN или изотипного контроля. После окрашивания клетки промывали и минимум 1×105 живых выбранных клеток анализировали проточной цитометрией на проточном цитометре FACSCalibur посредством программного обеспечения Cellquest (BD Immunocytometry systems, San Jose, CA). Перед введением вакцины, пациент имел минимальный ответ на нестимулированные контроли и с отрицательным контролем PEP-1. После вакцинации и в течение введения темозоломида, было показано увеличение продукции PEPvIII-специфических γ-IFN-продуцирующих CD8+ T-клеток.
ПРИМЕР 5
Для оценки ответа различных популяций T-клеток в течение цикла темозоломида (5/21 схема) и одновременно вводимой вакцины (19 сутки в настоящем примере), заявители получали периферическую кровь на 0, 3, 5, 12, 19, 23, 25 и 26 сутки. Посредством анализа проточной цитометрии, заявители изучали процент субпопуляций CD8+ T-клеток и CD4+CD25+FoxP3+ регуляторных T-клеток в течение цикла иммунотерапии. Все флюоресцентно меченные моноклональные антитела (mAb) (PerCP-Cy5,5-CD3, FITC-CD8, APC-CD4 и PE-CD25) приобретали в BD Biosciences, за исключением FITC-меченых mAb FoxP3, изготовленных eBioscience. Поверхностное и внутриклеточное окрашивание периферических клеток крови выполняли в соответствии с процедурами, предлагаемыми изготовителями. Результаты анализировали посредством проточного цитометра FACSCalibur с применением программного обеспечения Cellquest Pro (BD Biosciences). В отличие от снижения субпопуляций CD8+ T-клеток, Treg-популяция стала увеличиваться после введения в течение 3 суток темозоломида и достигала максимума на 12 сутки (0,9% от общего числа CD4+ T-клеток). Treg затем начали снижаться до наступления 23 суток, после чего число CD8+ T-клеток стало возрастать. В конце курса и популяции CD8+ T-клеток и Treg-популяции вернулись к уровням до лечения. В результате вакцинации возросло количество CD8+ цитотокических T-клеток в течение периода относительного снижения Treg-клеток.
ПРИМЕР 6
За последние 15 месяцев пациент прошел полный физический осмотр и ЯМР головного мозга с двухмесячными интервалами. Его тест остается стабильным и снимки ЯМР не показывают какого-либо свидетельства рецидивирования. Он работает все время без снижения эффективности и имеет 100% статус Карнофского (KPS) и 30/30 баллов теста минимального психического состояния. Его неврологический статус полностью нормальный.
Данный отчет свидетельствует, что совместное введение химиотерапии и иммунотерапии возможно, если временной график исследования тщательно мониторируют. В описанном случае, существуют несколько открытий, которые свидетельствуют, что совместное введение темозоломида не влияет на эффективность вакцины PEPvIII-KLH. Во-первых, пациент еще не показал прогрессирования за 15 месяцев контрольных обследований. Это было среднее TTP для пациентов (n=22), которые получали только терапию вакциной. Таким образом, не выявлено, что клиническая эффективность изменяется по сравнению с пациентами, которые не получали совместно вводимый темозоломид. Пациент обнаружил ГЗТ ответ на компонент вакцины PEPvIII, даже получая темозоломид, в то время как только 15% пациентов, получающих только вакцину, продемонстрировали данный тип ответа. Кроме того, область ГЗТ реактивности PEPvIII продолжала увеличиваться с последующими вакцинациями. В-третьих, специфический ответ IgG на PEPvIII был получен после 3-й вакцинации и поддерживался, пока совместно вводили темозоломид. В-четвертых, индуцированные PEP-3 специфические T-клетки, продуцирующие CD3+CD8+γ-IFN, не показывали снижения в течение циклов совместно вводимого темозоломида, а показали увеличение в течение совместно вводимого темозоломида. Наконец, заявители изучали популяции CD8+ T-клеток и популяций Treg в течение одного лечебного цикла и обнаружили, что появилось увеличение ответа T-эффекторных (CD8+ T-клеток) с относительным снижением Treg. Таким образом, совместное введение темозоломида и вакцины не показывает снижения индуцированного иммунного ответа, при условиях, которые были описаны.
Применение истощения лимфоцитов для увеличения иммунного ответа описывали и у мышиных модельных систем (Berenson et al., 1975; Cheever et al., 1980; North, 1982), и у человеческих пациентов со злокачественными опухолями (Dudley et al., 2002; Dudley et al., 2005). Предполагали множество механизмов, ответственных за увеличение противоопухолевого ответа. Истощение лимфоцитов может устранять конкуренцию на поверхности антигенпредставляющих клеток (Kedl et al., 2000), усиливать способность цитокинов, таких как IL-7 и IL-15, которые усиливают активность T-клеток (Gattinoni et al., 2005) и снижают иммунные ингибиторы Treg (Anthony et al., 2005). Химиотерапия может также потенциально усиливать иммунный ответ посредством увеличения иммунного прайминга и презентации (Nowak et al., 2002), усиления антигенной экспрессии (Aquino et al., 1998) и увеличивания мишеней для иммунной эрадикации (Ciusani et al., 2002). Если вакцинацию проводить в период минимального уровня темозоломида, заявители предположили, что может быть усиление эффекторного ответа. Указанный эффекторный ответ может быть вторичным вследствие отставания в восстановлении Treg, таким образом, позволяя увеличивать клонотопическую экспансию, что может быть обнаружено, с другой стороны, без темозоломида. Это было хорошо продемонстрировано в течение мониторирования цикла химиоиммунотерапии у конкретного пациента. Задерживание репарации Treg относительно эффекторных T-клеток предсказуемо проявляется в нормальной физиологической роли клеточного иммунного ответа. С целью поддерживания иммунного ответа возможно необходимо, чтобы T-эффекторы начинали активироваться, пролиферировать и добиваться их ответа. Если им не препятствовать гомеостатическими механизмами, такими как Treg, то T-клеточная пролиферация возможно возрастет, не снижая активности. Таким образом, задержка Treg может выработать эффективный иммунный ответ и возможно отрицательное модулирование и регулирование данного ответа.
В заключение, данный случай позволяет предположить, что совместное введение химиотерапии и иммунотерапии может не оказывать вредного действия.
Ссылки
Описание каждой указанной ссылки в точности включено в настоящем документе.
Hatano, M., J. Eguchi, et al. (2005). "EphA2 as a glioma-associated antigen: a novel target for glioma vaccines". Neoplasia 7(8): 717-22.
Liu, G., J. S. Yu, et al. (2004). "AIM-2: a novel tumor antigen is expressed and presented by human glioma cells." J Immunother 27(3): 220-6.
Liu, M., B. Dai, et al. (2006). "FoxM1B is overexpressed in human gliobastomas and critically regulates the tumorigenicity of glioma cells". Can Res 66(7): 3593-3602.
Xie, D., Y. X. Zeng, et al. (2006). "Expression of cytoplasmic and nuclear survivin in primary and secondary human glioblastoma". Br J Cancer 94(1): 108-114.