Результат интеллектуальной деятельности: УЛУЧШЕННЫЕ СПОСОБЫ ЛЕЧЕНИЯ ВАСКУЛЯРИЗИРОВАННЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Вид РИД
Изобретение
Настоящая заявка включает в себя один или несколько Перечней последовательностей согласно 37 C.F.R. 1.821 et seq., которые раскрыты как на бумажном, так и на машиночитаемом носителях, и при этом раскрытия в бумажном и машиночитаемом форматах полностью включены в настоящий документ посредством ссылки.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к терапевтическим композициям для лечения васкуляризированных злокачественных опухолей, особенно глиобластомы. В частности, настоящее изобретение относится к композициям, которые содержат молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении В7-Н3, и молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептора, VEGFR). Настоящее изобретение дополнительно относится к применению таких композиций в лечении таких злокачественных опухолей, и в частности, в лечении глиобластомы.
Предшествующий уровень техники настоящего изобретения
I. Суперсемейство В7 и В7-Н3
Рост и метастазирование опухолей зависит в большой степени от их способности ускользать от иммунологического надзора организма и преодолевать его иммунные защиты. Большинство опухолей экспрессируют антигены, которые могут быть распознаны с различной степенью иммунной системой организма, но во многих случаях развивается неадекватный иммунный ответ вследствие неэффективной активации эффекторных Т-клеток (Khawli, L.A. et al. (2008) "Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors" Exper. Pharmacol. 181: 291-328).
CD4+ Т-лимфоциты представляют собой главных организаторов большинства иммунных и аутоиммунных ответов млекопитающего (Dong, С. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules" Immunolog. Res. 28(1): 39-48). Было обнаружено, что активация CD4+ хелперных Т-клеток была опосредована костимулирующими взаимодействиями между антигенпрезентирующими клетками и наивными CD4+ Т-лимфоцитами. Необходимы два взаимодействия (Viglietta, V. et al. (2007) "Modulating Co-Stimulation," Neurotherapeutics 4: 666-675; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy" Adv. Immunol. 90:297-339). В первом взаимодействии антигенпрезентирующая клетка должна представить релевантный целевой антиген, связанный с главным комплексом гистосовместимости клетки так, чтобы он мог связаться с Т-клеточным рецептором ("TCR") наивного CD4+ Т-лимфоцита. Во втором взаимодействии лиганд антигенпрезентирующей клетки должен связаться с CD28 рецептором CD4+ Т-лимфоцита (Dong, С. et al. (2003) "Immune Regulation by Novel Costimulatory Molecules" Immunolog. Res. 28(1): 39-48; Lindley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Costimulation," Immunol. Rev. 229: 307-321). CD4+ хелперные Т-клетки, испытывающие действие обоих стимулирующих сигналов, после этого способны отвечать на цитокины (такие как интерлейкин-2 и интерлейкин-12 для развития в клетки Th1). Такие клетки производят интерферон-гамма (IFN-γ) и фактор некроза опухоли-альфа (TNF-α), которые опосредуют воспалительные ответы на целевые клетки, экспрессирующие целевой антиген. Также происходит B-клеточная активация и пролиферация, приводящие к продукции антител, специфических в отношении целевого антигена (Bernard, A. et al. (2005) "Т and В Cell Cooperation: A Dance of Life and Death" Transplantation 79: S8-S11). При отсутствии обоих костимулирующих сигналов во время мобилизации TCR Т-клетки входят в состояние функциональной неотвечаемости, которое называется клональная толерантность (Khawli, L.A. et al. (2008) "Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors," Exper. Pharmacol. 181: 291-328). В патологических состояниях клетки Th1 представляют собой ключевых игроков различных органоспецифических аутоиммунных заболеваний, таких как сахарный диабет I типа, ревматоидный артрит и рассеянный склероз (Dong, С.et al. (2003) "Immune Regulation by Novel Costimulatory Molecules" Immunolog. Res. 28(1): 39-48).
Исследования в отношении лигандов рецептора CD28 привели к определению характеристик набора родственных молекул, известных как суперсемейство В7 (Coyle, A.J. et al. (2001) "The Expanding B7 Superfamily: Increasing Complexity In Costimulatory Signals Regulating T Cell Function" Nature Immunol. 2(3): 203-209; Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily" Nature Rev. Immunol. 2:116-126; Greenwald, R.J. et al. (2005) "The B7 Family Revisited," Ann. Rev. Immunol. 23: 515-548; Collins, M. et al. (2005) "The B7 Family Of Immune-Regulatory Ligands," Genome Biol. 6: 223.1-223.7; Loke, P. et al. (2004) "Emerging Mechanisms Of Immune Regulation: The Extended B7 Family And Regulatory T Cells." Arthritis Res. Ther. 6: 208-214; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy" Adv. Immunol. 90: 297-339; Flies, D.B. et al. (2007) "The New B7s: Playing a Pivotal Role in Tumor Immunity" J. Immunother. 30(3): 251-260; Agarwal, A. et al. (2008) "The Role Of Positive Costimulatory Molecules In Transplantation And Tolerance" Curr. Opin. Organ Transplant. 13: 366-372; Lenschow, D.J. et al. (1996) "CD28/B7 System of TCell Costimulation" Ann. Rev. Immunol. 14: 233-258; Wang, S. et al. (2004) "Co-Signaling Molecules Of The B7-CD28 Family In Positive And Negative Regulation Of T Lymphocyte Responses," Microbes Infect. 6: 759-766). В настоящее время существуют семь известных представителей семейства: В7.1 (CD80), В7.2 (CD86), лиганд индуцируемого костимулятора (ICOS-L), лиганд 1 программируемой смерти (PD-L1), лиганд 2 программируемой смерти (PD-L2), В7-Н3 и В7-Н4 (Collins, М. et al. (2005) "The B7Family Of Immune-Regulatory Ligands," Genome Biol. 6: 223.1-223.7).
Представители семейства B7 представляют собой представителей суперсемейства иммуноглобулинов с иммуноглобулин-V-подобным и иммуноглобулин- С-подобным доменом (например, IgV-IgC) (Sharpe, А.Н. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2: 116-126). Каждый из доменов IgV и IgC представителей В7-семейства кодируется единственными экзонами с дополнительными экзонами, кодирующими лидерные последовательности, трансмембранные и цитоплазматические домены. Цитоплазматические домены являются короткими в диапазоне 19-62 аминокислотных остатков в длину и могут кодироваться множественными экзонами (Collins, М. et al. (2005) "The В7 Family Of Immune-Regulatory Ligands," Genome Biol. 6: 223.1-223.7). B7-H3 является уникальным в том, что главная встречающаяся у человека форма содержит два внеклеточных тандемных домена IgV-IgC (т.е. IgV-IgC-IgV-IgC) (Collins, М. et al. (2005) "The B7 Family Of Immune-Regulatory Ligands," Genome Biol. 6: 223.1-223.7). Предполагают, что представители семейства В7 образуют расположенные вплотную друг к другу, нековалентные гомодимеры на клеточной поверхности, и такие димеры были обнаружены в отношении В7-1 (CD80) и В7-2 (CD86).
В7-1 (CD80) и В7-2 (CD86) проявляют двойную специфичность в отношении стимулирующего рецептора CD28 и ингибирующего рецептора CTLA-4 (CD 152) (Sharpe, А.Н. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2: 116-126).
Несмотря на то, что изначально считали, что существуют только домены 2Ig (IgV-IgC) (Chapoval, A. et al. (2001) "В7-Н3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production," Nature Immunol. 2: 269-274; Sun, M. et al. (2002) "Characterization of Mouse and Human B7-H3 Genes," J. Immunol. 168: 6294-6297), был идентифицирован вариант 4 внеклеточного домена иммуноглобулина ("4Ig-B7-H3"), и, как было обнаружено, он является более распространенной формой белка человека (Sharpe, А.Н. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2: 116-126). Между этими двумя формами не обнаружили функционального отличия, поскольку природная мышиная форма (2Ig) и форма 4Ig человека проявляют сходную функцию (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Молекула 4Ig-B7-H3 ингибирует опосредованный клетками-натуральными киллерами лизис злокачественных клеток (Castriconi, R. et al. "Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell- Mediated Lysis," Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645). Обнаружили, что B7-H3 (форма 2Ig) человека стимулирует Т-клеточную активацию и продукцию IFN-γ путем связывания с предполагаемым рецептором на активированных Т-клетках (Chapoval, A. et al. (2001) "В7-Н3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production," Nature Immunol. 2: 269-274; Xu, H. et al. (2009) "MicroRNA miR-29 Modulates Expression of Immunoinhibitory Molecule B7-H3: Potential Implications for Immune Based Therapy of Human Solid Tumors," Cancer Res. 69(15): 5275-6281). Как B7-H4, так и B7-H1 являются сильными ингибиторами иммунной функции, будучи экспрессированными на опухолевых клетках (Flies, D.B. et al. (2007) "The New B7s: Playing a Pivotal Role in Tumor Immunity," J. Immunother. 30(3): 251-260).
Механизм действия B7-H3 является сложным, так как белок опосредует как Т- клеточную костимуляцию, так и коингибирование (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278; Martin-Orozco, N. et al. (2007) "Inhibitory Costimulation And Anti-Tumor Immunity," Semin. Cancer Biol. 17(4): 288-298; Subudhi, S.K. et al. (2005) "The Balance Of Immune Responses: Costimulation Verse Coinhibition" J. Mol. Med. 83: 193-202). B7-H3 связывается с (TREM)-подобным транскриптом 2 (TLT-2) и костимулирует Т-клеточную активацию, но также связывается с до сих пор неидентифицированньгм(и) рецептором(ами), чтобы опосредовать коингибирование Т-клеток. Кроме того, В7-Н3, посредством взаимодействий с неизвестным(и) рецептором(ами), представляет собой ингибитор для клеток-натуральных киллеров и остеобластных клеток (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278). Ингибирование может осуществляться посредством взаимодействий с представителями основных сигнальных путей, через которые Т-клеточный рецептор (TCR) регулирует генную транскрипцию (например, факторы NFTA, NF-κВ или АР-1).
В7-Н3 костимулирует CD4+ и CD8+ Т-клеточную пролиферацию. В7-Н3 также стимулирует продукцию IFN-γ и литическую активность CD8+ (Chapoval, A. et al. (2001) "В7-Н3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production" Nature Immunol. 2: 269-274; Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2:116-126). Тем не менее, белок также, возможно, действует посредством факторов NFAT (ядерный фактор для активированных Т-клеток), NF-κВ (ядерный фактор каппа В), и АР-1 (белок-активатор 1) для ингибирования Т-клеточной активации (Yi. K.Н. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4," Immunol. Rev. 229: 145-151). Также считают, что B7-H3 ингибирует Th1, Th2 или Th17 in vivo (Prasad, D.V. et al. (2004) "Murine B7-H3 Is A Negative Regulator Of T Cells" J. Immunol. 173:2500-2506; Fukushima, A. et al. (2007) "B7-H3 Regulates The Development Of Experimental Allergic Conjunctivitis In Mice, "Immunol. Lett. 113:52-57; Yi. K.H. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4" Immunol. Rev. 229: 145-151). Несколько независимых исследований показали, что злокачественные опухолевые клетки человека проявляют выраженное увеличение экспрессии белка В7-Н3, и что эта увеличенная экспрессия была ассоциирована с повышенной тяжестью заболевания (Zang, X. et al. (2007) "The B7 Family And Cancer Therapy: Costimulation And Coinhibition" Clin. Cancer Res. 13: 5271-5279), позволяя предположить, что B7-H3 используется опухолями в качестве пути ускользания от иммунологического надзора (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277- 10278).
Молекулы, которые блокируют способность молекулы В7 связываться с Т-клеточным рецептором (например, CD28), ингибируют иммунную систему, и, они были предложены в качестве видов лечения для аутоиммунного заболевания (Linsley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Co-Stimulation" Immunolog. Rev. 229:307-321). Клетки нейробластомы, экспрессирующие 4Ig-B7-H3, которые обрабатывали с помощью к антител 4Ig-B7-H3, были более восприимчивы к действию NK-клеток. Тем не менее, не ясно, может ли указанная активность быть объясняться только антителами к форме 4Ig-B7-H3, поскольку все описанные в статье антитела, возникшие против 4Ig-B7-H3, также связывались с 2Ig-подобной формой В7Н3 (Steinberger, P. et al. (2004) "Molecular Characterization of Human 4Ig-B7-H3, a Member of the B7 Family with Four Ig-Like Domains" J. Immunol. 172(4): 2352-2359 и Castriconi et al. (2004) "Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis," Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645).
B7-H3 не экспрессируется на дремлющих В- или Т-клетках, моноцитах или дендритных клетках, но он индуцируется на дендритных клетках под действием IFN-γ и на моноцитах под действием GM-CSF (Sharpe, А.Н. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2: 116-126). Рецептор(ы), который(е) связывается(ются) с В7-Н3, не был(и) полностью охарактеризованы. В ранней работе предположили, что нет необходимости в том, чтобы один такой рецептор быстро и транзиторно положительно регулировался на Т-клетках после активации (Loke, P. et al. (2004) "Emerging Mechanisms Of Immune Regulation: The Extended B7 Family And Regulatory T Cells." Arthritis Res. Ther. 6: 208-214). Недавно показали, что рецептор (TREM)-подобного транскрипта 2 (TLT-2, или TREML2) (King, R.G. et al. (2006) "Trem-Like Transcript 2 Is Expressed On Cells Of The Myeloid/Granuloid And В Lymphoid Lineage And Is Up-Regulated In Response To Inflammation," J. Immunol. 176: 6012-6021; Klesney-Tait, J. et al. (2006) "The TREM Receptor Family And Signal Integration," Nat. Immunol. 7: 1266-1273; Yi. K.H. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4," Immunol. Rev. 229: 145-151), который экспрессируется на миелоидных клетках, способен связываться с В7-Н3 и, тем самым, костимулировать активацию, в частности, CD8+ Т-клеток (Zang, X. et al. (2003) "В7х: A Widely Expressed В7 Family Member That Inhibits T Cell Activation," Proc. Natl. Acad. Sci. (U.S.A.) 100: 10388-10392; Hashiguchi, M. et al. (2008) "Triggering Receptor Expressed On Myeloid Cell-Like Transcript 2 (TLT-2) Is A Counter-Receptor For B7-H3 AndEnhances TCell Responses," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10495-10500; Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278).
В дополнение к их экспрессии на клетках нейробластомы, также известно, что B7-H3 человека экспрессируется на других разнообразных злокачественных клетках (например, клетках злокачественных опухолей желудка, яичника и немелкоклеточного рака легкого). Экспрессия белка В7-Н3 была иммуногистохимически обнаружена в опухолевых клеточных линиях (Chapoval, A. et al. (2001) "В7-Н3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production" Nature Immunol. 2: 269-274; Saatian, B. et al. (2004) "Expression Of Genes For B7-H3 And Other T Cell Ligands By Nasal Epithelial Cells During Differentiation And Activation," Amer. J. Physiol. Lung Cell. Mol. Physiol. 287: L217-L225; Castriconi et al. (2004) "Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis," Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645); Sun, M. et al. (2002) "Characterization of Mouse and Human B7-H3 Genes," J. Immunol. 168: 6294-6297). Экспрессия иРНК была обнаружена в клетках сердца, почки, яичек, легкого, печени, поджелудочной железы, предстательной железы, толстой кишки и остеобластах (Collins, М. et al. (2005) "The В7 Family Of Immune-Regulatory Ligands" Genome Biol. 6: 223.1-223.7). На уровне белка B7- Н3 был обнаружен в печени, легком, мочевом пузыре, яичке, предстательной железе, молочной железе, плаценте и лимфоидных органах человека (Hofmeyer, K. et al. (2008) "The Contrasting Role Of B7-H3," Proc. Natl. Acad. Sci. (U.S.A.) 105(30): 10277-10278).
II. VEGF и VEGFR
Факторы роста эндотелия сосудов (VEGF) относятся к семейству супергенов факторов роста тромбоцитов и играют центральные роли в регуляции ангиогенеза и лимфангиогенеза. Семейство VEGF делят на пять представителей, характеризующихся гомодимерной структурой: VEGF-A, VEGF-B, VEGF-C, VEGFD и плацентарный фактор роста (P1GF) (Takahashi, S. (2011) "Vascular Endothelial Growth Factor (VEGF), VEGF Receptors And Their Inhibitors For Antiangiogenic Tumor Therapy," Biol. Pharm. Bull. 34(12): 1785-1788; Sullivan, L.A. (2010) "The VEGF Family In Cancer And Antibody-Based Strategies For Their Inhibition," mAbs 2:2: 165-175). Указанные пептиды кодируются отдельными генами. Кроме того, VEGF-А существует в четырех изоформах. VEGF121, VEGF 165, VEGF 189 и VEGF206 создаются с помощью альтернативного сплайсинга иРНК (Houck, K.A. et al. (1991) "The Vascular Endothelial Growth Factor Family: Identification Of A Fourth Molecular Species And Characterization Of Alternative Splicing Of RNA," Mol. Endocrinol. 5(12): 1806-1814; Tischer, E. et al. (1991) "The Human Gene for Vascular Endothelial Growth Factor" J. Biol. Chem. 266:11947-11954). VEGF-A, как правило, называют VEGF, поскольку VEGF-A является ключевым регулятором онтогенетического васкулогенеза, ангиогенеза и дифференцировки предшественников эндотелиальных клеток. Среди изоформ VEGF-A VEGF 165 является преобладающей с точки зрения количества и биологической активности. VEGF165 избыточно экспрессируется в разнообразных опухолях человека, и избыточная экспрессия коррелирует с прогрессированием, инвазией и метастазированием опухолей (Maeda, K. et al. (1996) "Prognostic Value Of Vascular Endothelial Growth Factor Expression In Gastric Carcinoma," Cancer 77: 858-863; Ishigami, S.I. et al. (1998) "Predictive Value Of Vascular Endothelial Growth Factor (VEGF) In Metastasis And Prognosis Of Human Colorectal Cancer," Br. J. Cancer 78: 1379-1384; Kaya, M. et al. (2000) "Vascular Endothelial Growth Factor Expression In Untreated Osteosarcoma Is Predictive Of Pulmonary Metastasis And Poor Prognosis" Clin. Cancer Res. 6: 572-577).
VEGF-А связывается с двумя рецепторами тирозинкиназы (ТK), VEGFR-1 (Flt-1) и VEGFR-2 (KDR/Flk-1), и регулирует пролиферацию, миграцию эндотелиальных клеток, проницаемость сосудов, секрецию и другие эндотелиальные функции. VEGFR-2 проявляет сильную ТK активность по отношению к проангиогенным сигналам, тогда как растворимый VEGFR-1 (sFlt-1) функционирует в качестве эндогенного ингибитора VEGF (Shibuya, М. (2013) "Vascular Endothelial Growth Factor And Its Receptor System: Physiological Functions In Angiogenesis And Pathological Roles In Various Diseases," J. Biochem. 153(1): 13-19; Koch, S. et al. (2011) "Signal Transduction By Vascular Endothelial Growth Factor Receptors," Biochem. J. 437: 169-183; Sullivan, L.A. (2010) "The VEGF Family In Cancer And Antibody-Based Strategies For Their Inhibition," mAbs 2:2: 165-175; Takahashi, S. (2011) "Vascular Endothelial Growth Factor (VEGF), VEGF Receptors And Their Inhibitors For Antiangiogenic Tumor Therapy," Biol. Pharm. Bull. 34(12): 1785-1788).
III. Иммунотерапия
В дополнение к их известным применениям в диагностировании, было показано, что антитела являются применимыми в качестве терапевтических средств. Например, иммунотерапию или применение антител для терапевтических целей использовали в последние годы для лечения злокачественной опухоли. Пассивная иммунотерапия предусматривает применение моноклональных антител в лечении злокачественных опухолей (см. например, DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology, Eighth Edition (2008), DeVita, V. et al. Eds., Lippincott Williams & Wilkins, Philadelphia, PA, pp.537-547, 2979-2990). Указанные антитела могут характеризоваться присущей им терапевтической биологической активностью как за счет прямого ингибирования роста или выживаемости опухолевых клеток, так и за счет их способности к мобилизации активности клеток-натуральных киллеров иммунной системы организма. Указанные средства можно вводить отдельно или совместно с лучевой терапией или химиотерапевтическими средствами. Ритуксимаб и трастузумаб, одобренные для лечения неходжкинской лимфомы и злокачественной опухоли молочной железы, соответственно, представляют собой примеры таких терапевтических средств. Альтернативно, антитела можно использовать для получения конъюгатов с антителами, в которых антитело соединено с токсическим средством и направляет указанное средство к опухоли путем специфического связывания с опухолью. Гемтузумаб озогамицин представляет собой пример одобренного конъюгата с антителом, используемого для лечения лейкоза.
Были раскрыты моноклональные антитела, которые связываются со злокачественными клетками и характеризуются потенциальными применениями для диагностики и терапии (см., например, следующие патентные заявки, в которых раскрыты среди прочего некоторые молекулярные массы целевых белков: патент США №6054561 (200 кДа с-erbB-2 (Her2) и другие неизвестные антигены размером 40-200 кДа) и патент США №5656444 (50 кДа и 55 кДа онкофетальный белок)). Примеры антител в клинических испытаниях и/или одобренных для лечения солидных опухолей, включают в себя следующее: трастузумаб (антиген: 180 кДа, HER2/neu), эдреколомаб (антиген: 40-50 кДа, Ер-САМ), антитело к жировым глобулам молока человека (HMFG1) (антиген > 200 кДа, HMW муцин), цетуксимаб (антигены: 150 кДа и 170 кДа, рецептор EGF), алемтузумаб (антиген: 21-28 кДа, CD52) и ритуксимаб (антиген: 35 кДа, CD20).
Антигенные мишени трастузумаба (рецептора Her-2), который используют для лечения злокачественной опухоли молочной железы, и цетуксимаба (рецептора EGF), который находится на стадии клинических испытаний для лечения некоторых злокачественных опухолей, присутствуют на некотором обнаруживаемом уровне на большом количестве нормальных взрослых тканей человека, включая в себя кожу, толстую кишку, легкое, яичник, печень и поджелудочную железу. Предел безопасности в использовании указанных терапевтических средств возможно обеспечить путем проведения различия в уровнях экспрессии антигенов или в доступе к сайтам или активности антитела на указанных сайтах.
Другой тип иммунотерапии представляет собой активную иммунотерапию, или вакцинацию, с помощью антигена, присутствующего на конкретной(ых) злокачественной(ых) опухоли(ях) или ДНК-конструкта, который управляет экспрессией антигена, который затем вызывает иммунный ответ у индивидуума, т.е. чтобы стимулировать организм индивидуума активно производить антитела против своей собственной злокачественной опухоли. Активная иммунизация не использовалась так часто, как пассивная иммунотерапия или иммунотоксины.
Были предложены некоторые модели прогрессирования заболевания (включая в себя злокачественную опухоль). Теории лежат в диапазоне от этиологической роли единственного инфекционного/трансформирующего события до постепенного развития в возрастающей степени "подобного заболеванию" или "подобного злокачественной опухоли" типа ткани, приводящей в итоге к типу ткани с полностью патогенным или злокачественным потенциалом. Некоторые спорят с тем, что при злокачественной опухоли, например, единственное мутационное событие является достаточным, чтобы вызвать злокачественную опухоль, тогда как другие оспаривают то, что последовательные изменения также являются необходимыми. Некоторые указывают на то, что увеличивающаяся мутационная нагрузка и степень злокачественности опухоли являются необходимыми как для начала, так и для прогрессирования новообразования через непрерывную последовательность событий мутации-селекции на клеточном уровне. Некоторые злокачественные мишени обнаружены только в опухолевых тканях, тогда как другие присутствуют в нормальных тканях и положительно регулируются и/или избыточно экспрессируются в опухолевых тканях. В таких ситуациях некоторые исследователи предполагают, что избыточная экспрессия связана с приобретением злокачественности, тогда как другие полагают, что избыточная экспрессия является только маркером тенденции на пути к усиливающемуся болезненному состоянию.
В некоторых случаях было показано, что злокачественные мишени, такие как онкобелки, экспрессируемые или избыточно экспрессируемые в опухолях, присутствуют в течение эмбрионального развития и развития плода и служат в качестве регулятора роста и дифференцировки. Некоторые исследователи обнаружили, что экспрессия указанных онкобелков в течение эмбрионального развития и развития плода, как оказалось, ограничена конкретными тканями, а также ограничена конкретными стадиями развития. Напротив, было показано, что экспрессия указанных онкобелков у взрослого связана с избыточной экспрессией при росте опухоли и/или дисфункции белков-опухолевых супрессоров.
Идеальное диагностическое и/или терапевтическое антитело будет являться специфическим в отношении антигена, присутствующего на большом количестве злокачественных опухолей, но отсутствующего или присутствующего только в небольшом содержании в любой нормальной ткани. Обнаружение, определение характеристик и выделение нового антитела, способного связываться с антигеном, который специфически ассоциирован со злокачественной(ыми) опухолью(ями), будет применимо во многих аспектах. Во-первых, антитело будет характеризоваться биологической активностью по отношению к таким злокачественным клеткам и будет способно мобилизовать ответ иммунной системы, чтобы таким образом лечить заболевание. Антитело можно вводить в качестве терапевтического средства отдельно или в комбинации с современными способами лечения или использовать для получения иммуноконъюгатов, соединенных с токсическими средствами. Антитело с такой же специфичностью, но с низкой или отсутствующей биологической активностью, при введении отдельно также может являться применимым, причем антитело можно использовать для получения иммуноконъюгата с радиоактивным изотопом, токсином или химиотерапевтическим средством или липосомой, содержащей химиотерапевтическое средство, при этом конъюгированная форма является биологически активной за счет антитела, направляющего токсин к антигенсодержащим клетками.
Как обсуждалось выше, были описаны антитела и другие молекулы, которые специфически связываются с В7-Н3 (см., патенты США №№7527969; 7368554; 7358354 и 7279567; патентные публикации США №№ US 20090087416; US 20090022747; US 20090018315; US 2008116219; US 20080081346; US 20050202536; US 20030103963; US 20020168762; публикации согласно РСТ №№ WO 2008/116219; WO 2006/016276; WO 2004/093894; WO 04/001381; WO 2002/32375; WO 2002/10187 и WO 2001/094413; европейский патент № ЕР 1292619B; Modak, S. et al. (March 1999) "Disialoganglioside GD2 And Antigen 8H9: Potential Targets For Antibody-Based Immunotherapy Against Desmoplastic Small Round Cell Tumor (DSRCT) And Rhabdomyosarcoma (RMS)" Proceedings Of The American Association For Cancer Research Annual Meeting, Vol.40: 474 (90th Annual Meeting Of The American Association For Cancer Research; Philadelphia, Pennsylvania, US; April 10-14, 1999; Modak, S. et al. (March 2000) "Radioimmunotargeting To Human Rhabdomyosarcoma Using Monoclonal Antibody 8H9," Proc. Am. Assoc. Cancer Res. 41: 724; Modak, S. et al. (2001) "Monoclonal Antibody 8H9 Targets A Novel Cell Surface Antigen Expressed By A Wide Spectrum Of Human Solid Tumors," Cancer Res. 61(10): 4048-4054; Steinberger, P. et al. (2004) "Molecular Characterization of Human 4Ig-B7-H3, a Member of the B7 Family with Four Ig-Like Domains," J. Immunol. 172(4):2352-2359; Xu, H. et al. (2009) "MicroRNA miR-29 Modulates Expression of Immunoinhibitory Molecule B7-H3: Potential Implications for Immune Based Therapy of Human Solid Tumors," Cancer Res. 69(15): 5275-6281).
IV. Глиобластома
Глиобластомы представляют собой наиболее распространенную первичную опухоль центральной нервной системы (ЦНС) и представляют собой самые летальные злокачественные опухоли человека (Mrugala, М.М. (2013) "Advances And Challenges In The Treatment Of Glioblastoma: A Clinician's Perspective" Discov. Med. 15(83): 221-230; Steiner, H.-H. et al. (2004) "Autocrine Pathways Of The Vascular Endothelial Growth Factor (VEGF) In Glioblastoma Multiforme: Clinical Relevance Of Radiation-Induced Increase Of VEGF Levels," J. Neuro-Oncol. 66:129-138). Эффективная терапия для пациентов со злокачественной глиомой остается труднодостижимой, при этом средняя выживаемость составляет менее 15 месяцев после стандартной терапии с операцией, облучением и введением темозоломида (Reardon, D.A. et al. (2008) "Glioblastoma Multiforme: An Emerging Paradigm Of Anti-VEGF Therapy," Expert Opin. Biol. Ther. 8(4): 541-553). Отсутствует эффективная терапия после рецидива (Simpson, L. et al. (2006) "Recurrent Glioblastoma Multiforme: Advances In Treatment And Promising Drug Candidates," Expert Rev. Anticancer Ther. 6(11): 1593-607).
Применение антител к VEGF (бевацизумаб, например, Авастин® (Avastin®)) исследовали в качестве терапии глиобластомы (Gerstner, E.R. et al. (2012) "Antiangiogenic Therapy For Glioblastoma" Cancer J. 18(1): 45-50; Pellegatta, S. et al. (2011) "Brain Cancer Immunoediting: Novel Examples Provided By Immunotherapy Of Malignant Gliomas," Expert Rev. Anticancer Ther. 11(11): 1759-1774; Laigle-Donadey, F. et al. (2009) "Association Of Radiotherapy And Chemotherapy-Targeted Therapies In Glioblastomas," Bull. Cancer. 96(3): 291-297; Reardon, D.A. et al. (2008) "Glioblastoma Multiforme: An Emerging Paradigm Of Anti-VEGF Therapy," Expert Opin. Biol. Ther. 8(4):541-553; Narita, Y. (2013) "Drug Review: Safety And Efficacy Of Bevacizumab For Glioblastoma And Other Brain Tumors," Jpn. J. Clin. Oncol. 43(6):587-595). Бевацизумаб (Авастин®) описан в патентных публикациях США №№ US 20020032315 A1, US 20030190317 A1, US 20050112126 A1, US 20070059302 A1, US 20070059312 A1, US 20070196374 A1, US 20070248610 A1, US 20080187534 A1, US 20080226629 A1, US 20110052575 A1, US 20110081342 A1, US 20130058927 A1; патентах США №№6884879; 7060269; 7169901; 7297334; 7365166; 7375193; патентах Канады №№2286330 и 2145985 и международной патентной публикации согласно РСТ № WO 1998/045331; Baca, М. et al. (1997) "Antibody Humanization Using Monovalent Phage Display," J. Biol. Chem. 272(16): 10678-10684; Presta, L.G. et al. (1997) "Humanization Of An Anti-Vascular Endothelial Growth Factor Monoclonal Antibody For The Therapy Of Solid Tumors And Other Disorders," Cancer Res. 57(20): 4593-4599; причем каждый из указанных документов полностью включен в настоящий документ посредством ссылки.
К сожалению, рецидивирующие глиобластомы (rGBM) неизбежно рецидивируют после начального ответа на направленную против VEGF терапию (di Tomaso, Е. et al. (2011) "Glioblastoma Recurrence after Cediranib Therapy in Patients: Lack of "Rebound" Revascularization as Mode of Escape," Cancer Res. 71: 19-28.
Таким образом, несмотря на все предыдущие достижения, остается потребность в улучшенных композициях для лечения васкуляризированных злокачественных опухолей, и в частности глиобластомы. Настоящее изобретение относится к таким композициям и к их применению в лечении глиобластомы и других злокачественных опухолей, характеризующихся васкуляризацией.
Краткое раскрытие настоящего изобретения
Настоящее изобретение относится к терапевтическим композициям для лечения васкуляризированных злокачественных опухолей, в частности глиобластомы. Более конкретно, настоящее изобретение относится к композициям, которые содержат молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении В7-Н3, и молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептора, VEGFR). Настоящее изобретение дополнительно относится к применению таких композиций в лечении таких злокачественных опухолей, и в частности, в лечении глиобластомы.
Более конкретно, согласно настоящему изобретению предусмотрен способ лечения васкуляризированной злокачественной опухоли, предусматривающий введение нуждающемуся в этом пациенту-реципиенту молекулы, характеризующейся связывающей способностью, которая является специфической в отношении В7-Н3, и молекулы, характеризующейся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности или его рецептора, которые стимулируют опухолевый ангиогенез.
Конкретно, настоящее изобретение относится к варианту осуществления такого способа, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении В7-Н3, представляет собой следующее:
(A) антитело к В7-Н3;
(B) связывающий В7-Н3 фрагмент (А); или
(C) диатело, которое связывается с В7-Н3.
Конкретно, настоящее изобретение относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности или его рецептора, которые стимулируют опухолевый ангиогенез, представляют собой:
(A) антитело к VEGF или антагонист VEGF; или
(B) антитело к VEGFR или антагонист VEGFR.
Конкретно, настоящее изобретение относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении В7-Н3:
A. конкурирует за связывание с В7-Н3 с антителами BRCA84D, BRCA69D или PRCA157; или
B. имеет три CDR тяжелой цепи и три CDR легкой цепи антитела BRCA84D, антитела BRCA69D или антитела PRCA157.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности или его рецептора, которые стимулируют опухолевый ангиогенез:
A. конкурирует за связывание с VEGF с бевацизумабом; или
B. имеет три CDR тяжелой цепи и три CDR легкой цепи бевацизумаба.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении В7-H3, представляет собой антитело к В7-Н3, характеризующееся следующим:
(A) вариабельный домен легкой цепи, который содержит CDR1, CDR2 и CDR3 легкой цепи BRCA84D;
(B) вариабельный домен тяжелой цепи, который содержит CDR1 CDR2 и CDR3 тяжелой цепи BRCA84D; и
(C) область Fc, которая содержит замены: L235V, F243L, R292P, Y300L и P396L.
Настоящее изобретение относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении В7-Н3, представляет собой гуманизированное антитело к В7-Н3, которое содержит:
(А) вариабельную легкую цепь, имеющую аминокислотную последовательность hBRCA84D-2 VL (SEQ ID NO:69); и
(В) вариабельную легкую цепь, имеющую аминокислотную последовательность hBRCA84D-2 VH (SEQ ID NO:79);
и молекула, характеризующаяся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности или его рецептора, которые стимулируют опухолевый ангиогенез, представляет собой бевацизумаб.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором молекулу, характеризующуюся связывающей В7-Н3 способностью, и молекулу, характеризующуюся связывающей VEGF способностью, вводят пациенту и две молекулы вводят одновременно.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором вторую из вводимых молекул, вводят пациенту не позднее 5 периодов полужизни после введения первой из молекул.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором васкуляризированной злокачественная опухоль представляет собой глиобластому.
Настоящее изобретение дополнительно относится к варианту осуществления таких способов, при котором молекула, характеризующаяся связывающей способностью, которая является специфической в отношении В7-Н3, и молекула, характеризующаяся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности или его рецептора, которые стимулируют опухолевый ангиогенез, представляют собой одну и ту же молекулу, причем молекула представляет собой биспецифическое антитело или биспецифическое диатело.
Краткое описание графических материалов
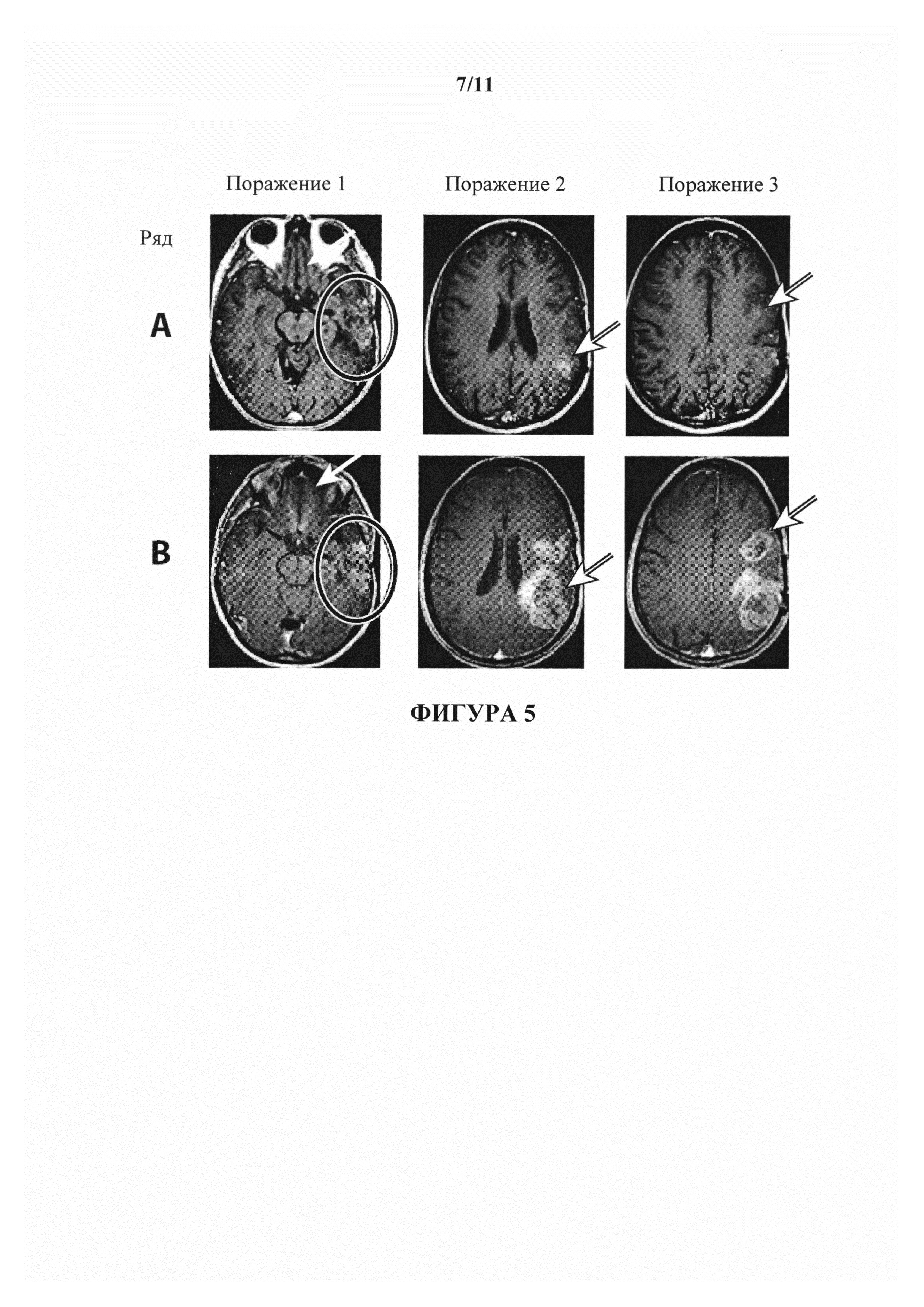
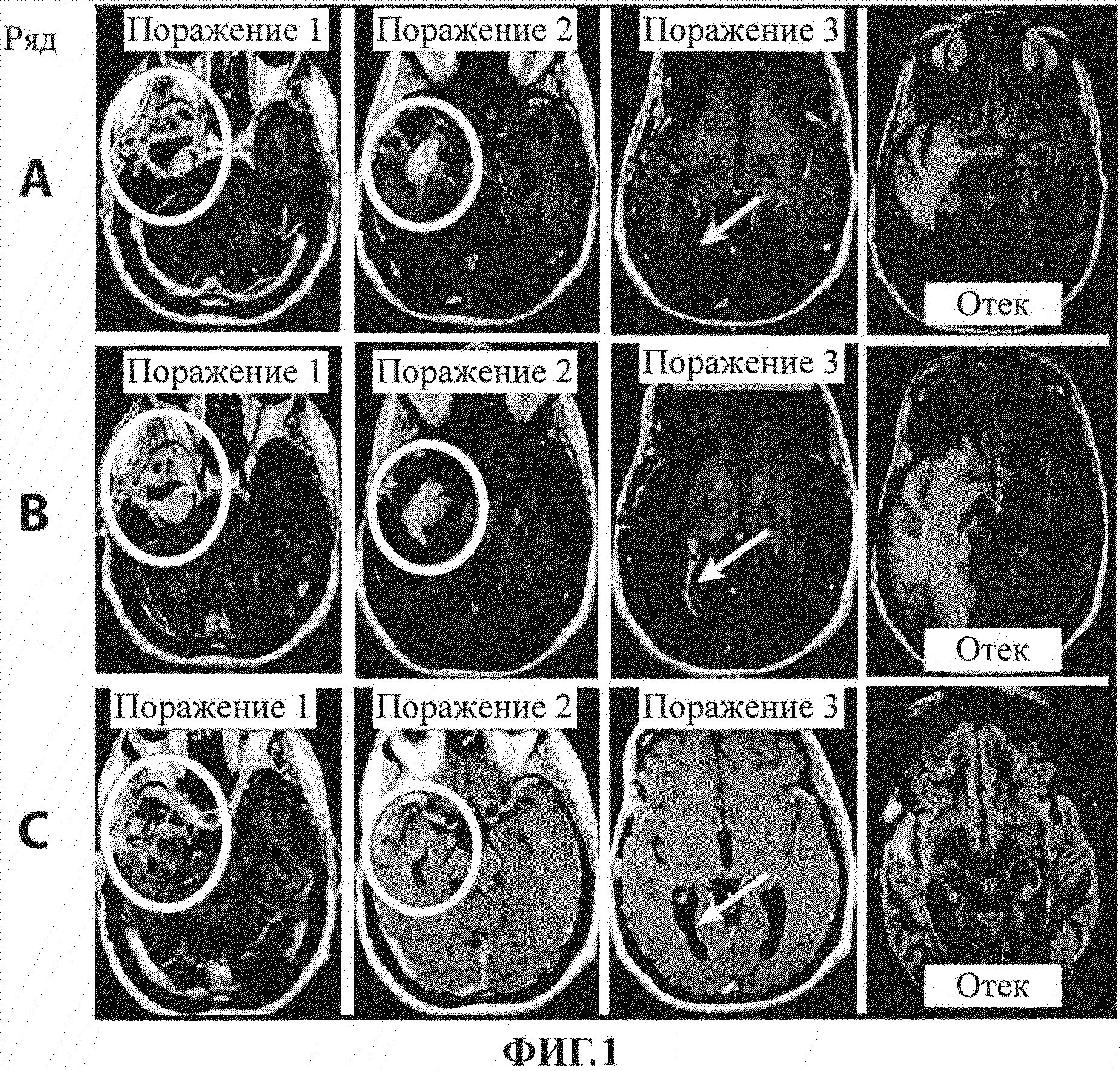
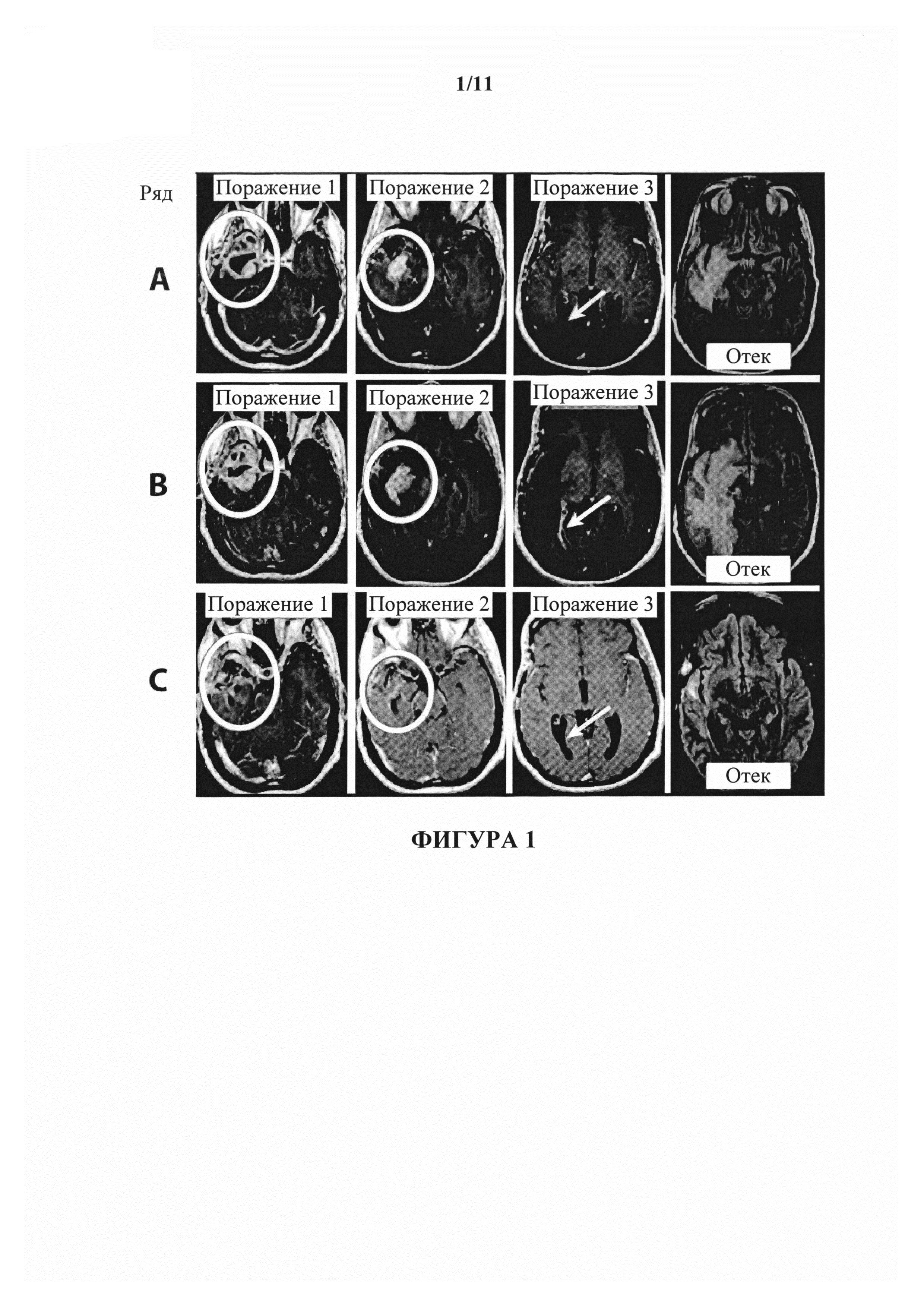
На фигуре 1 показаны изображения, полученные путем сканирования с помощью магнитной резонансной томографии (МРТ), пациента NF с глиобластомой. Первая, вторая и третья колонки представляют собой, соответственно, изображения МРТ первого, второго и третьего наблюдаемого поражения. В ряду А показан статус поражений пациента на исходном уровне. В ряду В показан статус поражений пациента перед началом второго запланированного цикла введения антитела к В7-Н3. В ряду С показан статус поражений пациента после 3 доз бевацизумаба и одной дозы CCNU.
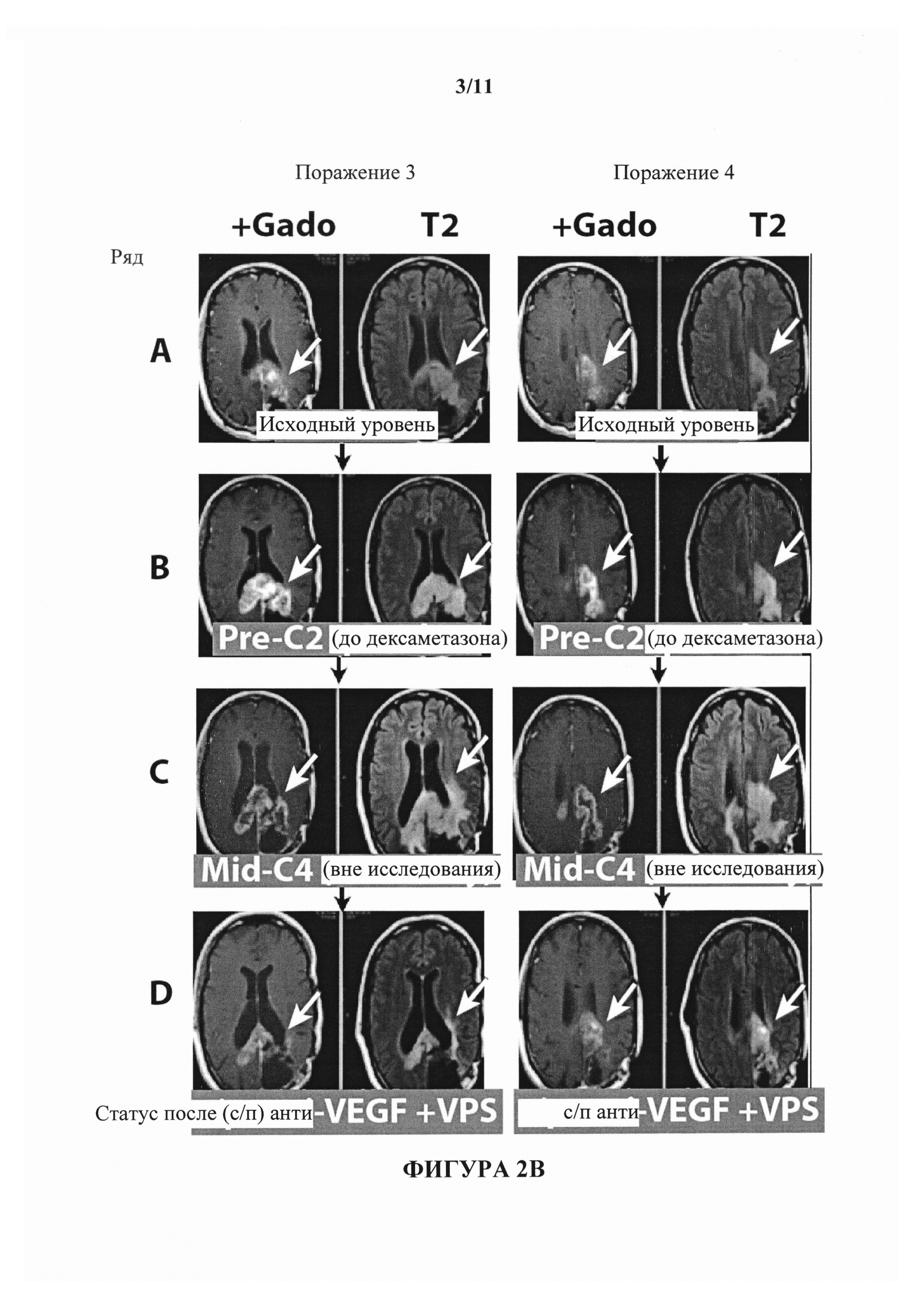
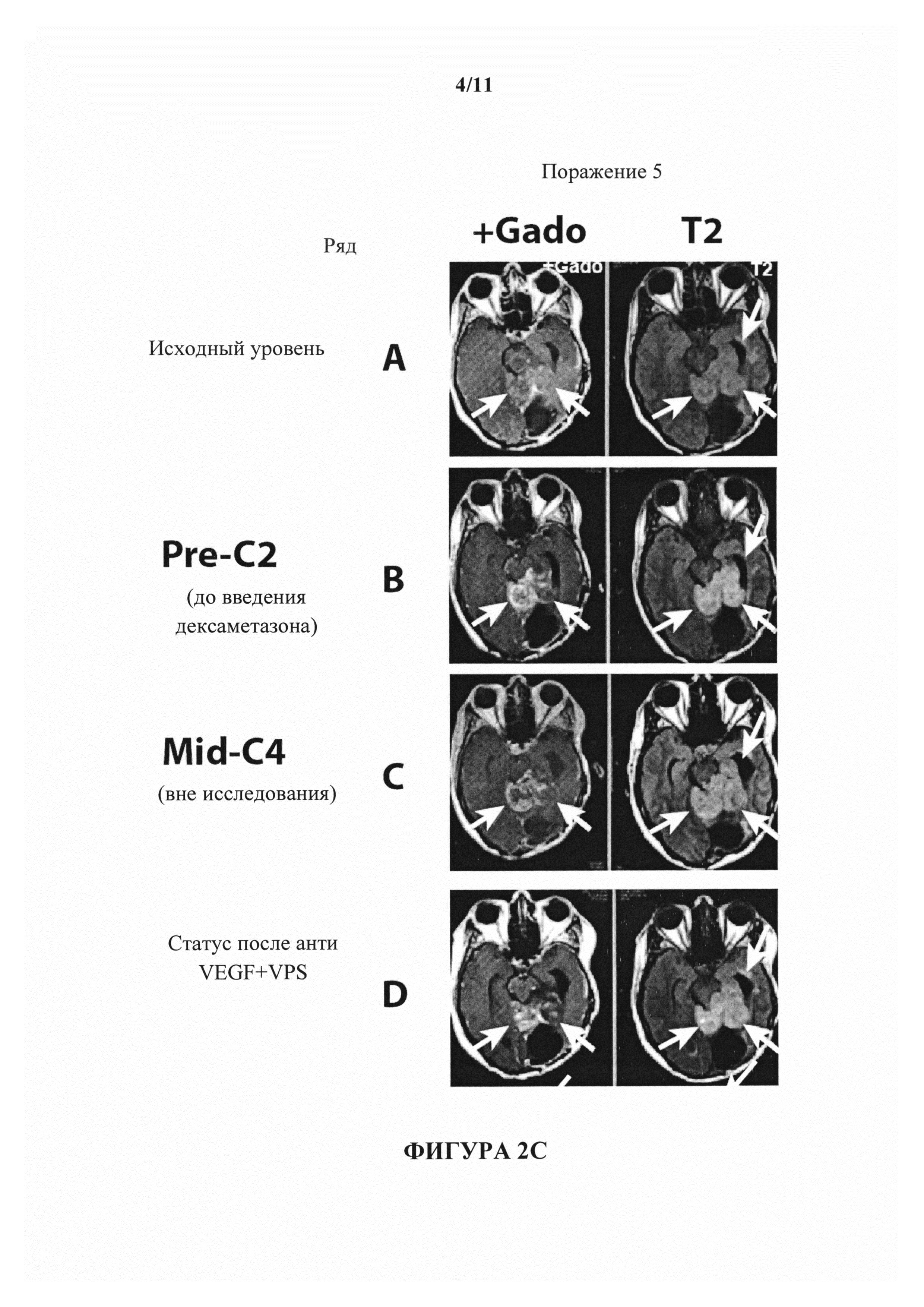
На фигурах 2А-2С показаны изображения МРТ пациента MR с глиобластомой. Первая, вторая, третья и четвертая колонки представляют собой, соответственно, изображения МРТ первого, второго и третьего и четвертого наблюдаемого поражения. В ряду А показан статус поражений пациента на исходном уровне. В ряду В показан статус поражений пациента перед началом второго запланированного цикла введения антитела к В7-Н3. В ряду С показано состояние поражений 1-5 в момент времени, когда была остановлена терапия с помощью антитела к В7-Н3. Статус после введения бевацизумаба показан в ряду D на фигурах.
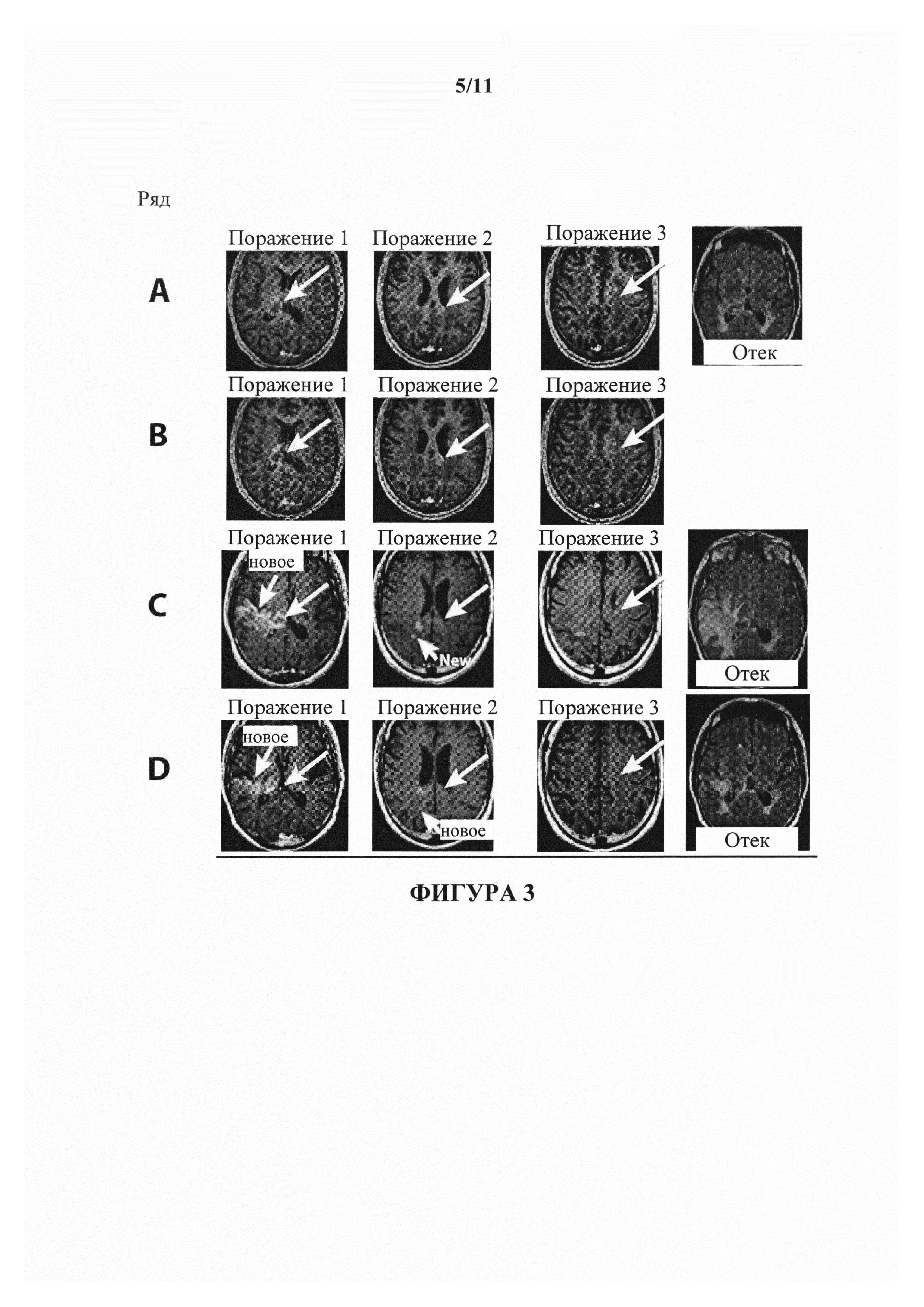
На фигуре 3 показаны изображения МРТ пациента с глиобластомой GC. В ряду А показан статус поражений пациента на исходном уровне. В ряду В (изображения, полученные перед началом цикла 6) показано, что поражения являлись стабильными в течение 5-6 циклов введения антитела к В7-Н3, с возможным минимальным ответом. В ряду С (изображения, полученные в конце цикла 6) показаны признаки прогрессирующего заболевания, включая в себя появление новых поражений. Пациент испытывал снижение когнитивных способностей, а также в головном мозге пациента отмечали отек (ряд С, четвертая колонка). В ряду D показаны изображения МРТ, полученные после 2 доз бевацизумаба. Как видно, обнаружили, что поражения и отек уменьшались в размере и степени. Когнитивные способности согласно полученным наблюдениям улучшались, но не выходили на исходный уровень.
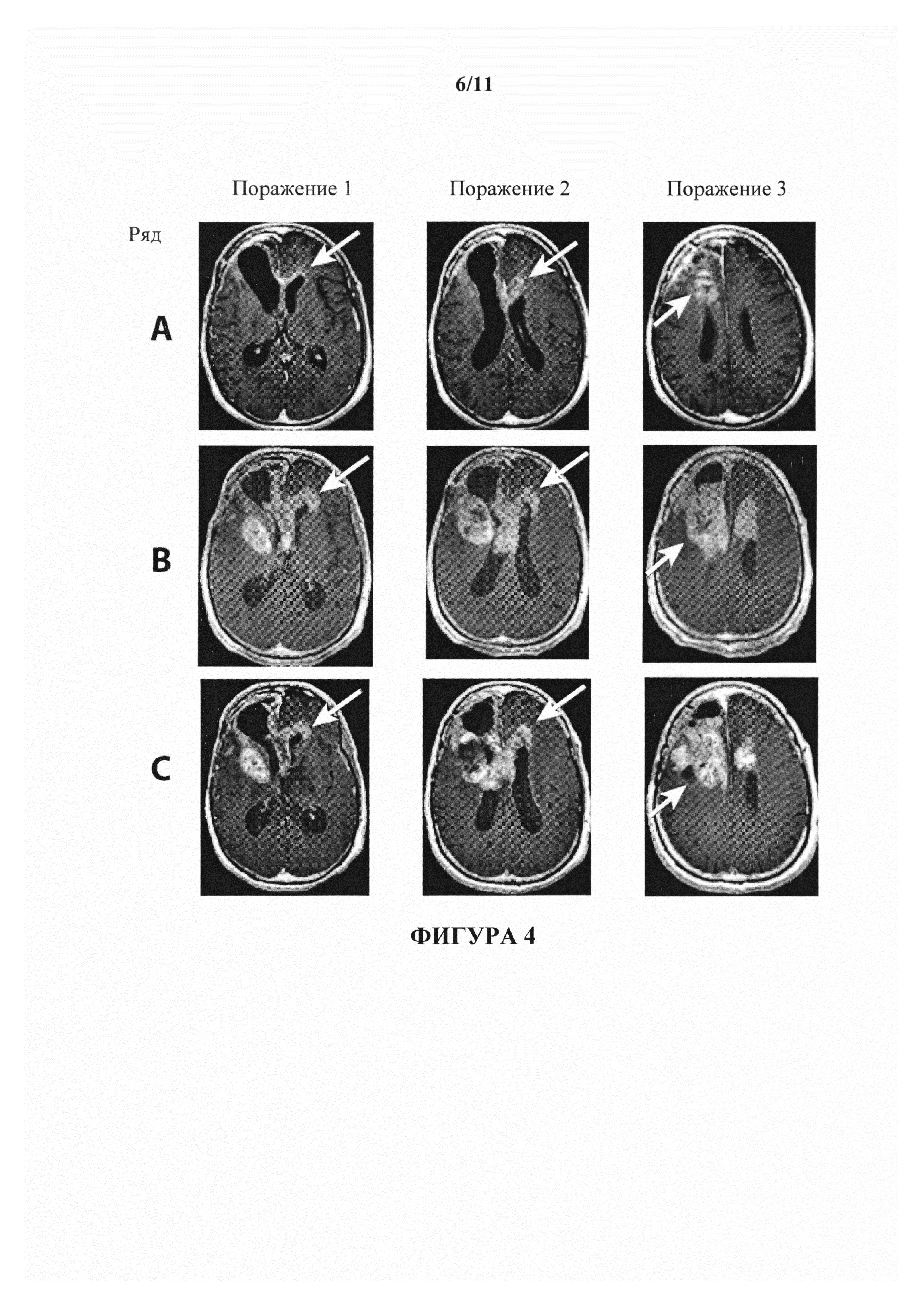
На фигуре 4 показаны изображения МРТ пациента с глиобластомой DK. В ряду А показан статус поражений пациента на исходном уровне. В ряду В (изображения, полученные в середине цикла 2) показано прогрессирование и псевдопрогрессирование заболевания. В ряду С (изображения, полученные после введения 2 доз бевацизумаба) показан слабовыраженный ответ, при котором когнитивные способности и походка слегка улучшались.
На фигуре 5 показаны изображения МРТ пациента с глиобластомой JK. В ряду А показан статус поражений пациента на исходном уровне. В ряду В (изображения, полученные перед циклом 2) показано прогрессирование и псевдопрогрессирование заболевания.
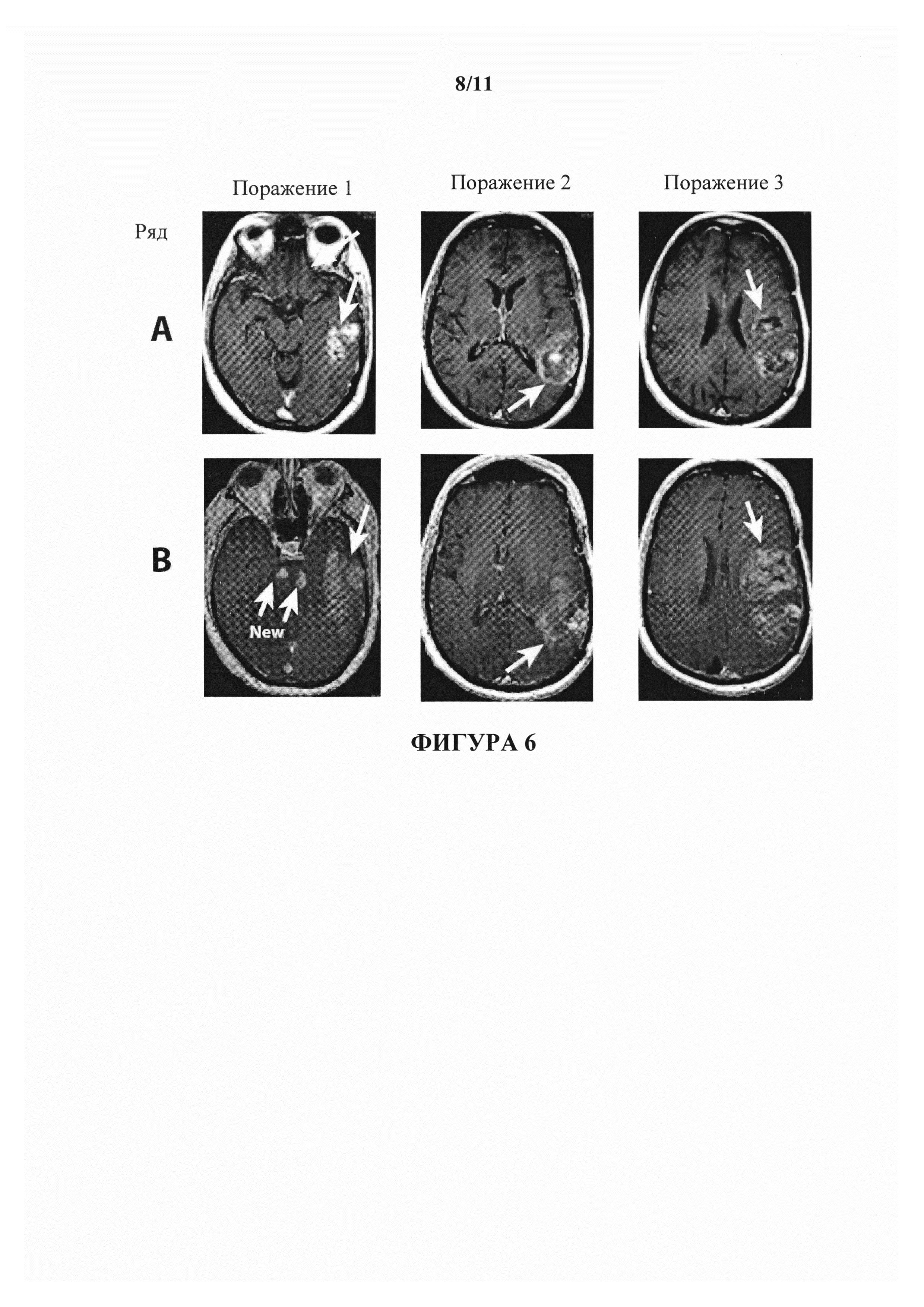
На фигуре 6 показаны изображения МРТ пациента с глиобластомой DW. В ряду А показан статус поражений пациента на исходном уровне. В ряду В (изображения, полученные перед циклом 2) показано прогрессирование заболевания.
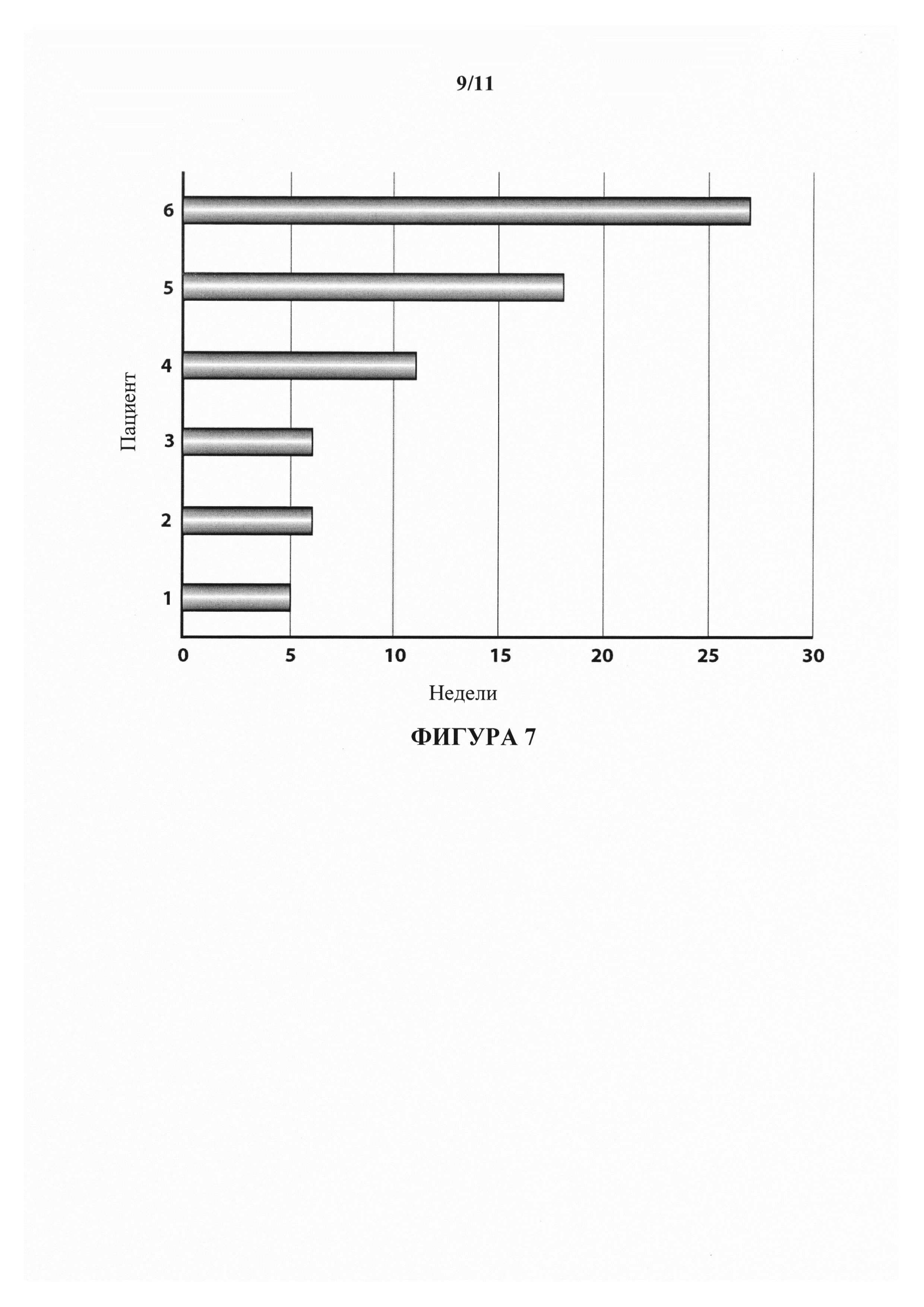
На фигуре 7 показано время проведения исследования для 6 получающих лечение пациентов.
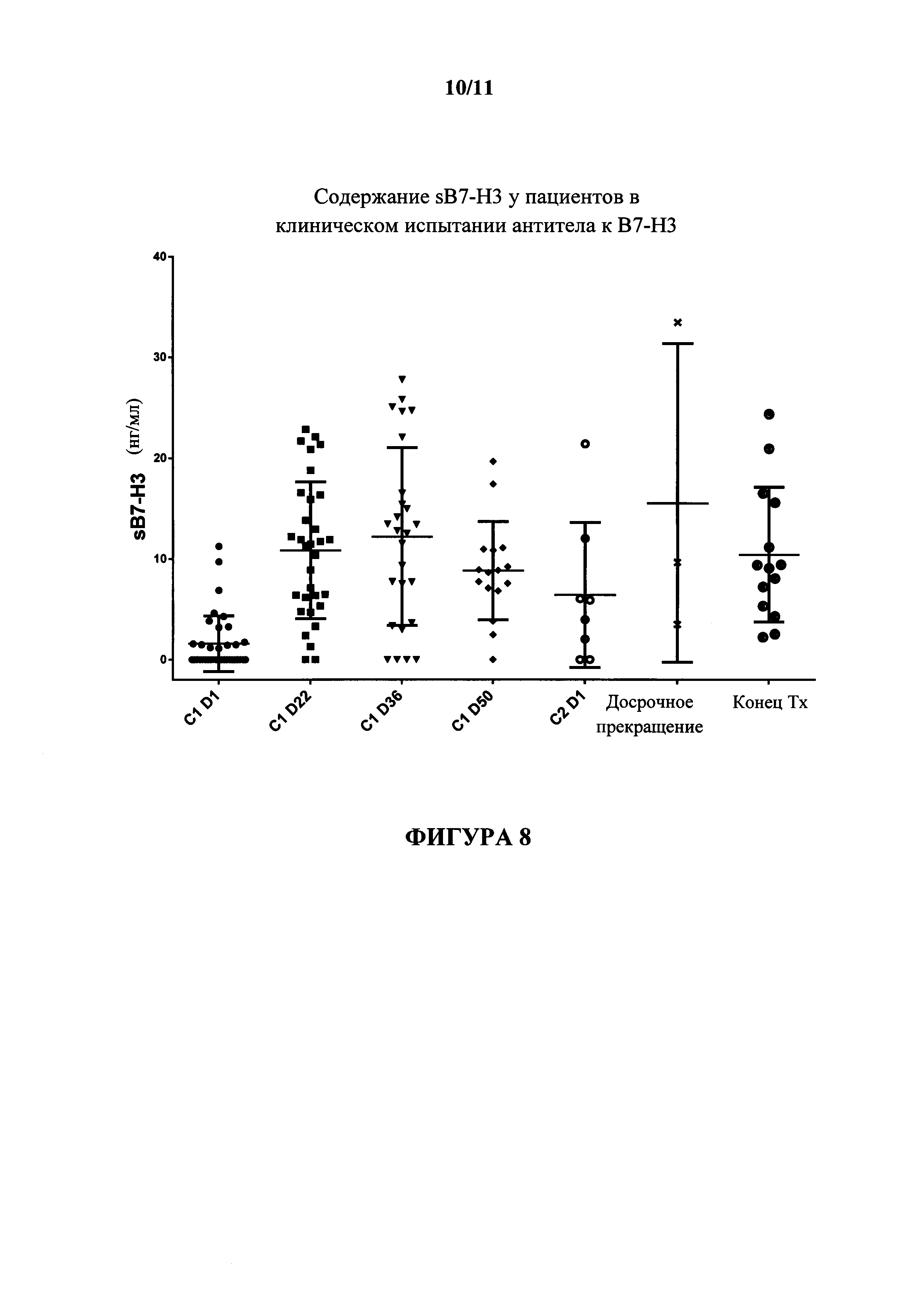
На фигуре 8 показано содержание sB7-H3 у всех пациентов, получающих антитело к В7-Н3 в различные циклы (С) и дни (D) лечения.
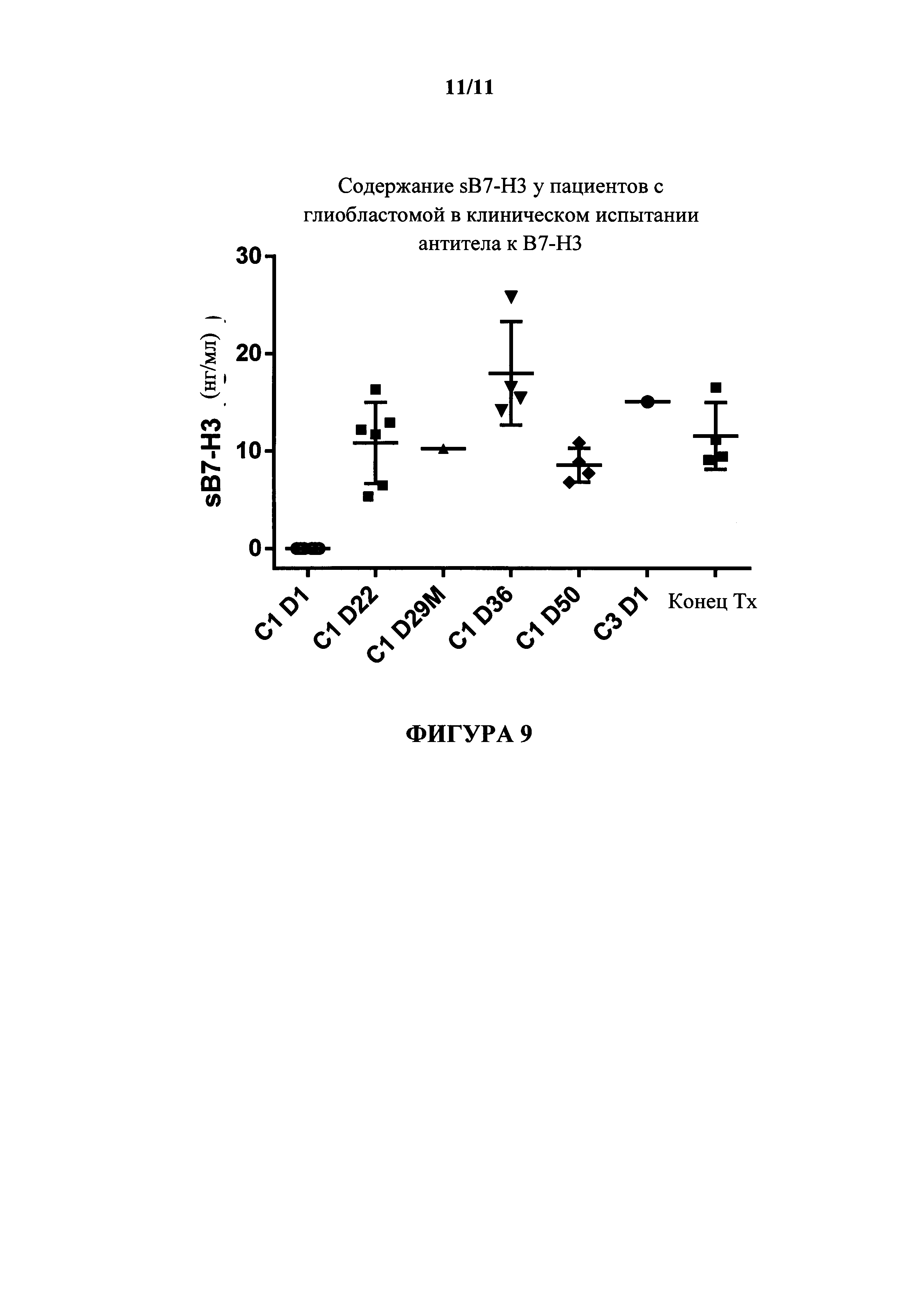
На фигуре 9 показано содержание sB7-H3 у пациентов с глиобластомой, получающих антитело к В7-Н3 в различные циклы (С) и дни (D) лечения.
Подробное раскрытие настоящего изобретения
Настоящее изобретение относится к терапевтическим композициям для лечения васкуляризированных злокачественных опухолей, особенно глиобластомы. В частности, настоящее изобретение относится к композициям, которые содержат молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении В7-H3, и молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептора, VEGFR). Настоящее изобретение дополнительно относится к применению таких композиций в лечении таких злокачественных опухолей, и в частности, в лечении глиобластомы.
Согласно настоящему изобретению В7-Н3-специфическая связывающая способность способна к связыванию с молекулами В7-H3, которые присутствуют на поверхности злокачественных клеток, и в частности, злокачественных клеток глиобластомы, и к облегчению или опосредованию иммунного ответа в отношении таких клеток посредством такого связывания. Связывающая способность, которая является специфической в отношении фактора клеточной поверхности (или рецептора), вовлеченного в стимуляцию опухолевого ангиогенеза (т.е. "активность против опухолевого ангиогенеза"), способна к связыванию с таким фактором (или рецептором) так, чтобы снижать или подавлять, посредством такого связывания, ангиогенез, опосредованный взаимодействием между таким фактором и таким рецептором. Согласно первому варианту осуществления В7-Н3-специфическая связывающая способность и связывающая способность, которая является специфической в отношении фактора клеточной поверхности (или рецептора), вовлеченного в стимуляцию опухолевого ангиогенеза, присутствуют на различных молекулах, таких как, например, антитело к В7-Н3 и антитело к фактору ангиогенеза, или связывающий В7-Н3 фрагмент и связывающий фактор ангиогеназа фрагмент таких антител. Согласно второму аспекту настоящего изобретения такими связывающими аффинностями будет обладать одна молекула (такая как биспецифическое антитело, диатело, BiTE® или другие их одноцепочечные или многоцепочечные варианты, которые способны к одновременному связыванию как с В7-H3, так и с фактором ангиогенеза или его рецептором. Настоящее изобретение относится к применению таких композиций в лечении злокачественной опухоли, и в частности, в лечении глиобластомы.
I. Общие техники
При осуществлении на практике настоящего изобретения будут использовать, если не указано иное, общепринятые техники молекулярной биологии (включая в себя рекомбинантные техники), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалиста в настоящей области техники. Такие техники полностью объяснены в литературе, такой как: Molecular Cloning: A Laboratory Manual, Third Edition (Sambrook et al. Eds., 2001) Cold Spring Harbor Press, Cold Spring Harbor, NY; Oligonucleotide Synthesis: Methods and Applications (Methods in Molecular Biology), Herdewijn, P., Ed., Humana Press, Totowa, NJ; Oligonucleotide Synthesis (Gait, M.J., Ed., 1984); Methods in Molecular Biology, Humana Press, Totowa, NJ; Cell Biology: A Laboratory Notebook (Cellis, J.E., Ed., 1998) Academic Press, New York, NY; Animal Cell Culture (Freshney, R.I., Ed., 1987); Introduction to Cell and Tissue Culture (Mather, J.P. and Roberts, P.E., Eds., 1998) Plenum Press, New York, NY; Cell and Tissue Culture: Laboratory Procedures (Doyle, A. et al, Eds., 1993-8) John Wiley and Sons, Hoboken, NJ; Methods in Enzymology (Academic Press, Inc.) New York, NY; Weir's Handbook of Experimental Immunology (Herzenberg, L.A. et al. Eds. 1997) Wiley-Blackwell Publishers, New York, NY; Gene Transfer Vectors for Mammalian Cells (Miller, J.M. et al. Eds., 1987) Cold Spring Harbor Press, Cold Spring Harbor, NY; Current Protocols in Molecular Biology (Ausubel, F.M. et al, Eds., 1987) Greene Pub. Associates, New York, NY; PCR: The Polymerase Chain Reaction, (Mullis, K. et al, Eds., 1994)  , Boston MA; Current Protocols in Immunology (Coligan, J.E. et al, eds., 1991) John Wiley and Sons, Hoboken, NJ; Short Protocols in Molecular Biology (John Wiley and Sons, 1999) Hoboken, NJ; Immunobiology 7 (Janeway, C.A. et al. 2007) Garland Science, London, UK; Antibodies (P. Finch, 1997) Stride Publications, Devoran, UK; Antibodies: A Practical Approach (D. Catty., ed., 1989) Oxford University Press, USA, New York NY); Monoclonal Antibodies: A Practical Approach (Shepherd, P. et al. Eds., 2000) Oxford University Press, USA, New York NY; Using Antibodies: A Laboratory Manual (Harlow, E. et al. Eds., 1998) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; The Antibodies (Zanetti, M. et al. Eds. 1995) Harwood Academic Publishers, London, UK); and DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology, Eighth Edition, DeVita, V. et al. Eds. 2008, Lippincott Williams & Wilkins, Philadelphia, PA.
, Boston MA; Current Protocols in Immunology (Coligan, J.E. et al, eds., 1991) John Wiley and Sons, Hoboken, NJ; Short Protocols in Molecular Biology (John Wiley and Sons, 1999) Hoboken, NJ; Immunobiology 7 (Janeway, C.A. et al. 2007) Garland Science, London, UK; Antibodies (P. Finch, 1997) Stride Publications, Devoran, UK; Antibodies: A Practical Approach (D. Catty., ed., 1989) Oxford University Press, USA, New York NY); Monoclonal Antibodies: A Practical Approach (Shepherd, P. et al. Eds., 2000) Oxford University Press, USA, New York NY; Using Antibodies: A Laboratory Manual (Harlow, E. et al. Eds., 1998) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; The Antibodies (Zanetti, M. et al. Eds. 1995) Harwood Academic Publishers, London, UK); and DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology, Eighth Edition, DeVita, V. et al. Eds. 2008, Lippincott Williams & Wilkins, Philadelphia, PA.
II. Определения
Используемый в настоящем документе термин "антитело" представляет собой молекулу иммуноглобулина, способную к специфическому связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного антигенраспознающего сайта, расположенного в вариабельной области молекулы иммуноглобулина. Используемый в настоящем документе термин предусматривает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2 Fv), их одноцепочечные фрагменты (ScFv), мутанты, встречающиеся в природе варианты, слитые белки, содержащие часть антитела с антигенраспознающим сайтом требуемой специфичности, гуманизированные антитела, химерные антитела, "BiTE," молекулы "DART™" и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенраспознающий сайт требуемой специфичности.
Термин "BiTE" (биспецифические "мобилизаторы" Т-клеток) относится к молекуле одной полипептидной цепи, которая характеризуется двумя антигенсвязывающими доменами, один из которых связывается с Т-клеточным антигеном, и второй из которых связывается с антигеном, присутствующим на поверхности мишени (международная патентная публикация № WO 05/061547; Baeuerle, Р et al. (2008) "BiTE®: A New Class Of Antibodies That Recruit T Cells," Drugs of the Future 33: 137-147; Bargou, et al. 2008) "Tumor Regression in Cancer Patients by Very Low Doses of a T Cell-Engaging Antibody," Science 321: 974-977).
Термин "DART™" (переориентирующийся реагент с двойной аффинностью) относится к молекуле иммуноглобулина, которая содержит по меньшей мере две полипептидных цепи, которые ассоциируются (главным образом, посредством ковалентного взаимодействия) с образованием по меньшей мере двух сайтов связывания с эпитопом, которые могут распознавать один и тот же или различные эпитопы. Каждая из полипептидных цепей DART™ содержит вариабельную область легкой цепи иммуноглобулина и вариабельную область тяжелой цепи иммуноглобулина, но указанные области не взаимодействуют с образованием сайта связывания с эпитопом. Вместо этого, вариабельная область тяжелой цепи иммуноглобулина одной (например, первой) из полипептидных цепей DART™ взаимодействует с вариабельной областью легкой цепи иммуноглобулина другой (например, второй) полипептидной цепи DART™ с образованием сайта связывания с эпитопом. Аналогично, вариабельная область легкой цепи иммуноглобулина одной (например, первого) из полипептидных цепей DART™ взаимодействует с вариабельной областью тяжелой цепи иммуноглобулина другой (например, второй) полипептидной цепи DART™ с образованием сайта связывания с эпитопом. DART™ могут являться моноспецифическими, биспецифическими, триспецифическими и т.д., таким образом, являясь способными одновременно связываться с одним, двумя, тремя или более различными эпитопами (которые могут относится с одному и тому же эпитому или к различным эпитопам). DART™ дополнительно могут являться моновалентными, бивалентными, тривалентными, тетравалентными, пентавалентными, гексавалентными и т.д., таким образом, являясь способными одновременно связываться с одним, двумя, тремя, четырьмя, пятью, шестью или более молекулами. Указанные два признака DART™ (т.е. степень специфичности и валентность) можно комбинировать, например, с получением биспецифических антител (т.е. способных к связыванию двух эпитопов), которые являются тетравалентными (т.е. способными к связыванию четырех наборов эпитопов) и т.д. Молекулы DART™ раскрыты в публикации согласно РСТ №№ WO 2006/113665, WO 2008/157379 и WO 2010/080538.
Термин "моноклональное антитело" относится к гомогенной популяции антител, причем моноклональное антитело составлено из аминокислот (встречающихся в природе и не встречающихся в природе), которые вовлечены в селективное связывание антигена. Моноклональные антитела являются высоко специфическими, будучи направленными против единственного антигенного сайта. Термин "моноклональное антитело" предусматривает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), их одноцепочечные фрагменты (ScFv), мутанты, слитые белки, содержащие часть антитела, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенраспознающий сайт требуемой специфичности и способность связываться с антигеном. Предусмотрено, что нет ограничений в отношении источника антитела или способа его получения (например, с помощью гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенных животных и т.д.). Термин включает в себя целые иммуноглобулины, а также фрагменты и т.д., описанные выше под определением "антитело".
Термин "гуманизированное антитело" относится к химерной молекуле, как правило, полученной с использованием рекомбинантных техник, характеризующейся антигенсвязывающим сайтом, происходящим из иммуноглобулина от не являющегося человеком вида, и оставшейся иммуноглобулиновой структурой молекулы, основанной на структуре и/или последовательности иммуноглобулина человека. Антигенсвязывающий сайт может содержать либо полные вариабельные домены, слитые с константными доменами, либо только определяющие комплементарность области (CDR), привитые на соответствующие каркасные области в вариабельных доменах. Антигенсвязывающие сайты могут быть дикого типа или модифицированы с помощью одной или нескольких аминокислотных замен. Это устраняет константную область в качестве иммуногена у индивидуумов-людей, но возможность иммунного ответа на чужеродную вариабельную область остается (LoBuglio, A.F. et al. (1989) "Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response," Proc. Natl. Acad. Sci. (U.S.A.) 86: 4220-4224). Другой подход сфокусирован не только на обеспечении происходящих от человека константных областей, но также на модификации вариабельных областей так, чтобы реконструировать их насколько возможно ближе к характерной для человека форме. Известно, что вариабельные области как тяжелой, так и легкой цепей содержат три определяющих комплементарность области (CDR), которые изменяются в ответ на исследуемые антигены и определяют связывающую способность, фланкированные четырьмя каркасными областями (FR), которые являются относительно консервативными в данном виде и которые предположительно обеспечивают каркас для CDR. При получении не относящихся к человеку антител в отношении конкретного антигена вариабельные области можно "реконструировать" или "гуманизировать", прививая CDR, происходящие от не относящегося к человеку антитела к FR, присутствующим в человеческом антителе, подлежащем модификации. Применение указанного подхода к различным антителам было описано Sato, K. et al. (1993) "Reshaping A Human Antibody To Inhibit The Interleukin 6-Dependent Tumor Cell Growth" Cancer Res 53: 851-856. Riechmann, L. et al. (1988) "Reshaping Human Antibodies for Therapy," Nature 332: 323-327; Verhoeyen, M. et al. (1988) "Reshaping Human Antibodies: Grafting An Antilysozyme Activity" Science 239: 1534-1536; Kettleborough, C.A. et al. (1991) "Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting: The Importance Of Framework Residues On Loop Conformation" Protein Engineering 4: 773-3783; Maeda, H. et al. (1991) "Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity," Human Antibodies Hybridoma 2: 124-134; Gorman, S. D. et al. (1991) "Reshaping A Therapeutic CD4 Antibody," Proc. Natl. Acad. Sci. (U.S.A.) 88: 4181-4185; Tempest, P.R. et al. (1991) "Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo," Bio/Technology 9: 266-271; Co, M. S. et al. (1991) "Humanized Antibodies For Antiviral Therapy," Proc. Natl. Acad. Sci. (U.S.A.) 88: 2869-2873; Carter, P. et al. (1992) "Humanization Of An Anti-p185her2 Antibody For Human Cancer Therapy" Proc. Natl. Acad. Sci. (U.S.A.) 89: 4285-4289; and Co, M.S. et al. (1992) "Chimeric And Humanized Antibodies With Specificity For The CD33 Antigen," J. Immunol. 148:1149-1154. Согласно некоторым вариантам осуществления гуманизированные антитела сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиных антител). Согласно другим вариантам осуществления гуманизированные антитела содержат одну или несколько CDR (одну, две, три, четыре, пять или шесть), которые изменены по отношению к исходному антителу, которые также называются одна или несколько CDR, "происходящих из" одной или нескольких CDR из исходного антитела.
Как используют в настоящем документе, об антителе или полипептиде говорят, что он "специфически" связывается с областью другой молекулы (т.е. эпитопом), если он реагирует или ассоциируется чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с указанным эпитопом относительно альтернативных эпитопов. Например, антитело, которое специфически связывается с эпитопом В7-H3, представляет собой антитело, которое связывается с таким эпитопом В7-Н3 с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими эпитопами В7-Н3 или с не относящимся В7-Н3 эпитопом. Аналогично, антитело, которое специфически связывается с эпитопом VEGF или VEGFR, связывается с таким эпитопом с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими эпитопами VEGF или VEGFR или с не относящимся к VEGF или VEGFR эпитопом. Кроме того, под настоящим определением следует понимать, что, например, антитело (или фрагмент или эпитоп), который специфически связывается с первой мишенью, может специфически или предпочтительно связываться со второй мишенью или не связываться с ней. В связи с этим, "специфическое связывание" не обязательно требует (хотя оно может включать в себя) исключительное связывание. Как правило, но не обязательно, ссылка на связывание означает "специфическое" связывание.
Используемый в настоящем документ термин "иммунологически активный" в ссылке на эпитоп, являющийся или "остающийся иммунологически активным", относится к способности антитела (например, антитела к В7-Н3 или антитела к VEGF или VEGFR) связываться с эпитопом при различных условиях, например, после того, как эпитоп был подвергнут восстановительным и денатурирующим условиям.
Различные биологические функции могут быть связаны с антителами к В7-H3, включая в себя без ограничения одну или несколько из следующего: способность специфически связываться с В7-Н3 (и в частности, с молекулами В7-H3, которые экспрессируются на поверхностях злокачественных клеток, включая в себя без ограничения злокачественные клетки почки, предстательной железы или легкого); способность конкурентно ингибировать предпочтительное связывание известного антитела к В7-Н3 с В7-H3, включая в себя способность предпочтительно связываться с тем же эпитопом В7-H3, с которым предпочтительно связывается исходное антитело; способность связываться с частью В7-H3, которая представлена на поверхности живой клетки in vitro или in vivo; способность связываться с частью В7-H3, которая представлена на поверхности живых злокачественных клеток, таких как без ограничения злокачественные клетки предстательной железы, легкого или почки; способность доставлять химиотерапевтическое средство к злокачественным опухолевым клеткам (таким как злокачественные клетки почки, предстательной железы или легкого), экспрессирующим В7-Н3 на своей поверхности; и/или способность доставлять терапевтическое средство или обнаруживаемый маркер в злокачественные клетки, экспрессирующие В7-Н3 на своей поверхности. Аналогично, различные биологические функции могут быть связаны с антителами к VEGF или к VEGFR, включая в себя без ограничения одну или несколько из следующего: способность препятствовать связыванию VEGF с VEGFR (и в частности, молекулами VEGFR, которые экспрессируются на поверхностях клеток; способность конкурентно ингибировать предпочтительное связывание известного антитела к VEGF или к VEGFR с VEGF или VEGFR, включая в себя способность предпочтительно связываться с тем же эпитопом, с которым предпочтительно связывается исходное антитело; способность связываться с частью VEGFR, которая представлена на поверхности живой клетки in vitro или in vivo; и/или способность доставлять химиотерапевтическое средство к экспрессирующим VEGFR клеткам. Полипептиды (включая в себя антитела) согласно настоящему изобретению могут обладать любой одной или несколькими указанными характеристиками.
"Эквивалентное антитело к В7-Н3" или " эквивалентный полипептид к В7-Н3" относится к антителу или полипептиду, характеризующимся одной или несколькими биологическими функциями, связанными с антителом к В7-H3, такими как, например, специфичность связывания. "Эквивалентное антитело к VEGF" или "эквивалентный полипептид к VEGF" относится к антителу или полипептиду, характеризующимся одной или несколькими биологическими функциями, связанными с антителом к VEGF, такими как, например, способность препятствовать связыванию VEGF с VEGFR.
Используемый в настоящем документе термин "средство" относится к биологическому, фармацевтическому или химическому соединению. Не ограничивающие примеры включают в себя простую или сложную органическую или неорганическую молекулу, пептид, белок, олигонуклеотид, антитело, производное антитела, фрагмент антитела, производное витамина, углевод, токсин или химиотерапевтическое соединение. Можно синтезировать различные соединения, например, низкомолекулярные молекулы и олигомеры (например, олигопептиды и олигонуклеотиды), и синтетические органические соединения на основе различных сердцевинных структур. Кроме того, различные природные источники могут обеспечить соединения для скрининга, такие как растительные или животные экстракты и подобное.
Средства, которые используют в способах согласно настоящему изобретению, можно выбрать случайным образом или выбрать или сконструировать рационально. Как используют в настоящем документе, о средстве говорят как о выбранном случайным образом, если средство выбрано без предварительного рассмотрения или получения информации в отношении специфических аминокислотных или других химических фрагментов, вовлеченных в ассоциацию молекулы с его нативным(и) партнером(ами) по связыванию или известными антителами. Пример случайно выбранного средства представляет собой средство, которое идентифицировано посредством применения и скрининга химической библиотеки или пептидной комбинаторной библиотеки.
Как используют в настоящем документе, о средстве говорят как о рационально выбранном или сконструированном, если средство выбрано не случайным образом, принимая во внимание последовательность целевого сайта и/или его конформацию в сочетании с действием средства. В отношении средств к В7-Н3 в настоящее время считают, что существуют по меньшей мере три эпитопа на В7-H3, против которых могут возникнуть антитела, и, следовательно, по меньшей мере три сайта действия для средств, которые блокируют взаимодействие В7-Н3/анти-В7-Н3. Согласно настоящему изобретению также предусмотрены средства, которые действуют на сайтах взаимодействия между В7-Н3 и его нативным партнером по связыванию, хотя другие лиганды и их активные В7-Н3-инерактивные сайты также предусмотрены в пределах объема настоящего изобретения, независимо от того, известны ли они в настоящее время или будут идентифицированы позже. Средства можно выбрать рационально или сконструировать рационально с использованием пептидных последовательностей, которые составляют сайты контакта комплекса рецептор/лиганд и/или В7-Н3/антитело к В7-Н3. Например, рационально выбранное пептидное средство может представлять собой пептид, чья аминокислотная последовательность является идентичной эпитопу, находящемуся на В7-H3, так как он представлен на поверхности живой клетки в своем нативном окружении. Такое средство будет снижать или блокировать ассоциацию антитела к В7-Н3 с В7-Н3 или ассоциацию В7-Н3 с его нативным лигандом в соответствующих случаях путем связывания с антителом к В7-Н3 или с нативным лигандом.
Предусмотрено, что используемый в настоящем документе термин "меченый" в отношении антитела включает в себя прямое мечение антитела путем соединения (т.е. физической связи) обнаруживаемого вещества, такого как радиоактивное средство или флуорофор (например, фикоэритрин (РЕ) или флуоресцеин изотиоцианат (также известный как фторизотиоцианат или FITC)), с антителом, а также непрямое мечение зонда или антитела за счет химической активности с обнаруживаемым веществом.
Используемый в настоящем документе термин "ассоциация" в отношении антитела включает в себя ковалентное и нековалентное прикрепление или связывание средства (например, химиотерапевтического средства) с антителом. Антитело может быть ассоциировано со средством (например, химиотерапевтическим средством) путем прямого связывания или непрямого связывания посредством прикрепления к общей платформе так, чтобы антитело направляло локализацию средства к злокачественной опухолевой клетке, с которой связывается антитело, и при этом антитело и средство по существу не диссоциируются при физиологических условиях так, чтобы средство не было нацелено на ту же злокачественную опухолевую клетку, с которой связывается антитело, или так чтобы эффективность средства не снижалась.
Термин "биологический образец" предусматривает разнообразные типы образцов, полученных от индивидуума, и их можно использовать в диагностическом или мониторинговом исследовании. Определение предусматривает слюну, кровь и другие жидкие образцы биологического происхождения, образцы твердых тканей, такие как биоптат или тканевые культуры или клетки, полученные из них, и их потомство, например, клетки, полученные из образца ткани, собранного от индивидуума, у которого подозревают наличие злокачественной опухоли, согласно предпочтительным вариантам осуществления из ткани яичника, легкого, предстательной железы, поджелудочной железы, толстой кишки и молочной железы. Определение также включает в себя образцы, которые подвергли манипуляции любым путем после их получения, например, путем обработки реагентами, солюбилизации или обогащения в отношении определенных компонентов, таких как белки или полинуклеотиды, или заливки в полутвердую или твердую матрицу для целей получения срезов. Термин "биологический образец" предусматривает клинический образец, и также включает в себя клетки в культуре, клеточные супернатанты, клеточные лизаты, сыворотку, плазму, биологическую жидкость и тканевые образцы.
Термин "клетка-хозяин" включает в себя индивидуальную клетку или клеточную культуру, которая может являться или стала реципиентом вектора(ов) для встраивания полинуклеотидных вставок. Клетки-хозяева включают в себя потомство отдельной клетки-хозяина, и потомство не обязательно должно быть полностью идентичным (в отношении морфологии или комплементарности геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации. Клетка-хозяин включает в себя клетки, трансфектированные in vivo полинуклеотидом(ами) согласно настоящему изобретению.
Используемый в настоящем документе термин "замедление развития метастазирования" означает задерживать, препятствовать, замедлять, тормозить, стабилизировать и/или отсрочить развитие метастазирования. Эта задержка может характеризоваться изменяющейся продолжительностью по времени в зависимости от истории злокачественной опухоли и/или подлежащего лечению индивидуума. Как очевидно специалисту в настоящей области техники, достаточная или значительная задержка может в действительности включать в себя профилактику, при которой у индивидуума не развивается метастазирование.
Используемый в настоящем документе термин "эффективное количество" фармацевтической композиции, согласно одному варианту осуществления представляет собой количество, достаточное для осуществления благоприятных или требуемых результатов, включая в себя без ограничения клинические результаты, такие как сокращение размера опухоли (в контексте злокачественной опухоли, например, злокачественной опухоли молочной железы или предстательной железы), замедление роста злокачественных опухолевых клеток, задержка развития метастазирования, уменьшение симптомов, являющихся результатом заболевания, увеличение качества жизни страдающих от заболевания, уменьшение дозы других лекарственных средств, требуемых для лечения заболевания, усиление эффекта другого лекарственного средства, например, путем нацеленного воздействия и/или инернализации, задержка прогрессирования заболевания и/или увеличение продолжительности выживаемости индивидуумов. Эффективное количество можно вводить за одно или несколько введений. Для целей настоящего изобретения эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для снижения пролиферации (или разрушения) злокачественных опухолевых клеток и для снижения и/или задержки развития или роста метастаз злокачественных опухолевых клеток, либо напрямую, либо опосредовано. Согласно некоторым вариантам осуществления эффективное количество лекарственного средства, соединения или фармацевтической композиции может быть достигнуть или не достигнуто совместно с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективное количество" можно рассматривать в контексте введения одного или нескольких химиотерапевтических средств, и отдельное средство можно рассматривать для введения в эффективном количестве, если в сочетании с одним или несколькими другими средствами требуемый результат может быть достигнут или достигается. В связи с тем, что потребности индивидуумов меняются, определение оптимальных диапазонов эффективных количеств каждого компонента находится в пределах компетенции специалиста в настоящей области техники. Типичные дозировки обсуждают ниже.
Как используют в настоящем документе, молекула нуклеиновой кислоты молекула или средство, антитело, композиция или клетка и т.д. считаются "выделенными", если указанная молекула нуклеиновой кислоты, средство, антитело, композиция или клетка и т.д. по существу отделены от являющихся примесью молекул нуклеиновой кислоты, антител, средств, композиций или клеток и т.д., присутствующих в природе в их источнике происхождения.
Термин "индивидуум" относится к позвоночному животному, предпочтительно млекопитающему. Млекопитающие включают в себя без ограничения людей, сельскохозяйственных животных, спортивных животных, домашних животных, приматов, мышей и крыс. Согласно наиболее предпочтительному варианту осуществления термин индивидуум обозначает человека.
Термины "полипептид", "олигопептид", "пептид" и "белок" в настоящем документе используют взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может являться неразветвленным или разветвленным, он может содержать модифицированные аминокислоты и может прерываться не аминокислотами. Термины также предусматривают аминокислотный полимер, который был модифицирован естественным образом или путем вмешательства; например, путем образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгация с компонентом-меткой. Также в пределах определения предусмотрены, например, полипептиды, содержащие один или несколько аналогов аминокислоты (включая в себя, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в настоящей области техники. Следует понимать, что поскольку полипептиды согласно настоящему изобретению основаны на антителе, полипептиды могут существовать в виде отдельных цепей или ассоциированных цепей.
Также в пределах объема настоящего изобретения предусмотрены пептидомиметики агонистов, антагонистов и модуляторов пептида В7-Н3 (включая в себя антитела к В7-Н3), описанных в настоящем документе. Такие пептидомиметики включают в себя пептиды, в которых по меньшей мере один аминокислотный остаток замещен аминокислотным остатком, который не распространен в природе, таким как изомер D аминокислоты или N-алкилированные виды аминокислоты. Согласно другим вариантам осуществления пептидомиметики конструируют путем замещения по меньшей мере одной амидной связи (-C(=O)-NH-) в агонисте, антагонисте или модуляторах пептида В7-Н3 амидной изостерой. Подходящие амидные изостеры включают в себя -CH2-NH-, -CH2-S-, -CH2-S(O)-, -CH2-S(O)2-, -СН2-СН2-, -СН=СН- (Е или Z форма), -C(=O)-CH2-, -CH(CN)-NH-, -С(ОН)-СН2- и -O-C(=O)-NH-. Амидные связи в агонисте, антагонисте или модуляторе пептида В7-H3, которые являются подходящими кандидатами для замещения амидными изостерами, включают в себя связи, которые являются гидролизуемыми с помощью эндогенных эстераз или протеаз предусмотренного субъекта для лечения агонистом, антагонистом или модулятором пептида В7-Н3.
Используемый в настоящем документе термин "по существу чистый" относится к материалу, который является по меньшей мере на 50% чистым (т.е. не содержащим примеси), более предпочтительно по меньшей мере на 90% чистым, более предпочтительно по меньшей мере на 95% чистым, более предпочтительно по меньшей мере на 98% чистым, более предпочтительно по меньшей мере на 99% чистым и наиболее предпочтительно больше чем на 99% чистым.
Используемый в настоящем документе термин "токсин" относится к любому веществу, которое оказывает неблагоприятный ответ в пределах клетки. Например, токсин, направленный на злокачественную опухолевую клетку, будет оказывать неблагоприятное, иногда вредное действие на злокачественную опухолевую клетку. Примеры токсинов включают в себя без ограничения таксан, майтансиноид, ауристатин (например, монометил ауристатин (ММАЕ), монометил ауристатин F (MMAF), ауристатин Е (АЕ) и т.д.) (такие как средства, раскрытые в патентах США №№5208020; 5416064; 6333410; 6340701; 6372738; 6436931; 6441163; 6596757; 7276497; 7585857 или 7851432), калихеамицин, антрациклин (например, доксорубицин), аналог СС-1065, доцетаксел; катепсин В или Е; рицин, гелонин, экзотоксин Pseudomonas, дифтерийный токсин и рибонуклеаза; радиоактивно меченые антитела (например, конъюгированный с тиуксетаном или меченный токсическим радиоактивным изотопом (например, 90Y; 131I, 177Lu, 186Re, 188Re, 211At, 212Bi, 213Bi, 225Ac и т.д.).
Используемые в настоящем документе термины "лечение" или "осуществление лечения" обозначает подход в получении благоприятного или требуемого результата, включая в себя и предпочтительно благоприятный или требуемый клинический результат. Такие благоприятные или требуемые клинические результаты включают в себя без ограничения один или несколько из следующих: снижение пролиферации (или разрушение) злокачественных опухолевых клеток или другие болезненных клеток, снижение метастазирования злокачественных опухолевых клеток, обнаруженных в злокачественных опухолях, сокращение размера опухоли, уменьшение симптомов, являющихся результатом заболевания, увеличение качества жизни страдающих от заболевания, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, задержка прогрессирования заболевания и/или увеличение продолжительности выживаемости индивидуумов.
Предусмотрено, что используемый в настоящем документе термин "злокачественная опухоль" включает в себя злокачественные опухоли, характеризующиеся присутствием злокачественной опухолевой клетки, выбранной из группы, состоящей из клетки следующего: опухоль надпочечника, ассоциированная со СПИДом злокачественная опухоль, альвеолярная саркома мягких тканей, астроцитарная опухоль, злокачественная опухоль мочевого пузыря (плоскоклеточная карцинома и переходноклеточная карцинома), злокачественная опухоль кости (адамантинома, аневризматические костные кисты, остеохондрома, остеосаркома), злокачественная опухоль головного мозга и спинного мозга, метастазирующая опухоль головного мозга, злокачественная опухоль молочной железы, опухоли каротидного тельца, злокачественная опухоль шейки матки, хондросаркома, хордома, хромофобная почечноклеточная карцинома, светлоклеточная карцинома, злокачественная опухоль толстой кишки, злокачественная опухоль толстой и прямой кишки, кожная доброкачественная фиброзная гистиоцитома, десмопластическая мелкокруглоклеточная опухоль, эпендимома, опухоль Юинга, внескелетная миксоидная хондросаркома, несовершенный костный фиброгенез, фиброзная дисплазия кости, злокачественная опухоль желчного пузыря или желчных протоков, злокачественная опухоль желудка, гестационная трофобластическая болезнь, герминогенная опухоль, глиобластома, злокачественная опухоль головы и шеи, гепатоклеточная карцинома, опухоль островков поджелудочной железы, саркома Калоши, злокачественная опухоль почки (нефробластома, папиллярный тип почечноклеточной карциномы), лейкоз, липома/доброкачественная липоматозная опухоль, липосаркома/злокачественная липоматозная опухоль, злокачественная опухоль печени (гепатобластома, гепатоклеточная карцинома), лимфома, злокачественная опухоль легкого, медуллобластома, меланома, менингиома, множественные эндокринные неоплазии, множественная миелома, миелодиспластический синдром, нейробластома, нейроэндокринные опухоли, злокачественная опухоль яичника, злокачественная опухоль поджелудочной железы, папиллярная карцинома щитовидной железы, опухоль паращитовидной железы, злокачественная опухоль детского возраста, опухоль периферических нервных стволов, феохромоцитома, опухоль гипофиза, злокачественная опухоль предстательной железы, постериорная увеальная меланома, редкое гематологическое нарушение, метастазирующая злокачественная опухоль почки, рабдоидная опухоль, рабдомиосаркома, саркома, злокачественная опухоль кожи, саркома мягких тканей, плоскоклеточная злокачественная опухоль, злокачественная опухоль желудка, синовиальная саркома, злокачественная опухоль яичка, карцинома тимуса, тимома, метастазирующая злокачественная опухоль щитовидной железы и злокачественная опухоль матки (карцинома шейки матки, карцинома эндометрия и лейомиома).
III. В7-Н3 и антитела к В7-Н3
Настоящее изобретение предусматривает композиции, включая в себя фармацевтические композиции, содержащие антитела к В7-H3, полипептиды, происходящие из антител к В7-H3, полинуклеотиды, содержащие последовательность, кодирующую антитела к В7-H3, и другие средства, описанные в настоящем документе. Используемые в настоящем документе композиции дополнительно содержат одно или несколько антител, полипептидов и/или белков, которые связываются с В7-H3, агонисты, антагонисты, модуляторы В7-H3, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител, полипептидов и белков, которые связываются с В7-Н3.
Согласно настоящему изобретению дополнительно предусмотрены конъюгаты любого агониста, антагониста или модулятора пептида В7-Н3 и дополнительные химические структуры, которые поддерживают предусмотренную функцию или функции конкретного агониста, антагониста или модулятора пептида В7-Н3.
Указанные конъюгаты включают в себя агонист, антагонист или модулятор пептида В7-H3, ковалентно связанный с макромолекулой, такой как любая нерастворимая, твердая подложка-матрица, используемая в процедурах диагностики, скрининга или очистки, обсуждаемых в настоящем документе. Подходящие материалы матрицы включают в себя любое вещество, которое является химически инертным, характеризуется высокой пористостью и характеризуется большим количеством функциональных групп, способных образовывать ковалентные связи с пептидными лигандами. Примеры материалов матриц и процедур для получения конъюгатов матрица-лиганд описаны в Dean et al. (Eds) Affinity Chromatography: A Practical Approach, IRL Press (1985); Lowe, "An Introduction to Affinity Chromatography", in Work et al. (eds) Laboratory Techniques in Biochemistry and Molecular Biology, Vol.7, Part II, North-Holland (1979); Porath et al., "Biospecific Affinity Chromatography", in Neurath, H. et al. (eds), The Proteins, 3rd ed., Vol.1, pp.95-178 (1975); and Schott, H. Affinity Chromatography, Macel Dekker, Inc. NY (1984).
Также в настоящем документе предусмотрены конъюгаты агониста, антагониста или модулятора пептида В7-Н3 и любого репортерного фрагмента, используемого в диагностических процедурах, обсуждаемых в настоящем документе. Средства, полипептиды и белки - агонисты, антагонисты или модуляторы пептида В7-Н3 согласно настоящему изобретению, включая в себя антитела к В7-H3, дополнительно идентифицируют и характеризуют с помощью любого (одного или нескольких) из следующих критериев:
(а) способность специфически связываться с В7-Н3 (и в частности, с молекулами В7-H3, которые экспрессируются на поверхностях злокачественных клеток, включая в себя без ограничения злокачественные клетки почки, предстательной железы или легкого);
(b) способность конкурентно ингибировать предпочтительное связывание известного антитела к В7-Н3 с В7-H3, включая в себя способность предпочтительно связываться с тем же эпитопом В7-H3, с которым предпочтительно связывается исходное антитело;
(c) способность связываться с частью В7-H3, которая представлена на поверхности живой клетки in vitro или in vivo;
(d) способность связываться с частью В7-H3, которая представлена на поверхности живых злокачественных клеток, которые экспрессируют В7-Н3;
(e) способность доставлять химиотерапевтическое средство к злокачественным опухолевым клеткам (таким как злокачественные клетки почки, предстательной железы или легкого), экспрессирующим В7-Н3 на своей поверхности; и/или
(f) способность доставлять терапевтическое средство или обнаруживаемый маркер в злокачественные клетки (такие как без ограничения злокачественные клетки предстательной железы), экспрессирующие В7-Н3 на своей поверхности.
Предпочтительное антитело согласно настоящему изобретению будет проявлять отличительное ИГХ-окрашивание опухолевой ткани по сравнению с нормальной, незлокачественной тканью, и, более того, его можно будет использовать в исследовании эффективности антител на моделях с использованием приматов (и в частности, яванского макака). Предпочтительные антитела согласно настоящему изобретению дополнительно будут проявлять требуемые уровни аффинности и антигенной специфичности. Предпочтительные антитела согласно настоящему изобретению дополнительно будут проявлять требуемые уровни иммуномодулирующей активности и клеточной интернализации.
Согласно некоторым вариантам осуществления антитело согласно настоящему изобретению представляет собой антитело, которое получают с помощью гибридомы BRCA84D, BRCA69D или PRCA157 или их потомства. Настоящее изобретение также предусматривает различные составы антител, полученных с помощью указанных гибридом, и эквивалентны антитела или полипептидные фрагменты (например, Fab, Fab', F(ab')2 Fv, Fc и т.д.), химерные антитела, их одноцепочечные фрагменты (scFv), мутанты, слитые белки, содержащие часть антитела, гуманизированные антитела и любую другие модифицированную конфигурацию любого из указанных или эквивалентных антител, которая содержит распознающий антиген (В7-Н3) сайт требуемой специфичности. Согласно настоящему изобретению также предусмотрены антитела человека, проявляющие одну или несколько биологических характеристик представителя семейства анти-В7-Н3. Эквивалентные антитела семейства анти-В7-Н3 (включая в себя гуманизированные антитела и антитела человека), полипептидные фрагменты и полипептиды, содержащие любой из указанных фрагментов, идентифицируют и характеризуют с помощью любого (одного или нескольких) из пяти критериев, описанных выше. Мышиные и иллюстративные гуманизированные последовательности вариабельного домена антитела к В7-Н3 представлены в международной патентной публикации согласно РСТ № WO 2008/066691. Такие последовательности представлены для иллюстрации, а не ограничения, и различные последовательности, а также фрагменты и варианты представленных последовательностей, предусмотрены в пределах объема настоящего изобретения.
А. В7-Н3
Используемый в настоящем документе термин "В7-Н3" относится к представителю семейства В7 белков человека, мембранному белку I типа с Ig-подобными доменами, также известному как CD276. Термин "2Ig-B7-H3" обозначает форму В7-H3, которая содержит только два Ig-подобных домена; термин "4Ig-B7-H3" обозначает форму В7-H3, которая содержит четыре Ig-подобных домена (см., Sun, М. et al. (2002) "Characterization of Mouse and Human B7-H3 Genes," J. Immunol. 168: 6294-6297; Steinberger et al. (2004), "Molecular Characterization Of Human 4Ig-B7-H3, A Member Of The B7 Family With Four Ig-Like Domains" J. Immunol. 2004, 172(4): 2352-2359 and Castriconi et al. (2004) "Identification Of 4Ig-B7-H3 As A Neuroblastoma-Associated Molecule That Exerts A Protective Role From An NK Cell-Mediated Lysis," Proc. Natl. Acad. Sci. (U.S.A.) 101(34): 12640-12645). Антиген "TES7" (международная патентная публикация № WO 2008/066691) представляет собой антиген, обладающий характеристиками, общими с 4Ig-B7-H3. Соответственно, антитела, которые специфически связываются с TES7, связываются с 4Ig-B7-H3. Антиген TES7 может характеризоваться наличием больше одного различного эпитопа, и эпитопы могут являться нелинейными. Некоторые антитела к В7-H3, как известно, связываются с нелинейными эпитопами, включая в себя некоторые, присутствующие только на изоформе 4Ig-B7-H3. В настоящее время считают, что TES7 может избыточно экспрессироваться в определенных злокачественных клетках по сравнению с их эквивалентами в нормальных тканях.
Аминокислотная последовательность формы "2Ig" B7-H3 человека представляет собой (SEQ ID NO:1):

Последовательность кДНК, кодирующая форму "2Ig" B7-H3 человека, представляет собой (SEQ ID NO:2):

Аминокислотная последовательность формы "2Ig" В7-Н3 человека (SEQ ID NO:1) (показана жирным шрифтом и подчеркнута ниже) полностью заключена в пределах формы "4Ig" В7-Н3 человека (SEQ ID NO:3):

Последовательность кДНК, кодирующая форму "4Ig" В7-Н3 человека
представляет собой (SEQ ID NO:4); остатки, кодирующие форму "2Ig" В&-Н3 показаны
жирным шрифтом и почеркнуты:


Процедуру "пэннинга" можно провести путем получения библиотеки кДНК из тканей или клеток, которые экспрессируют В7-H3, избыточной экспрессии кДНК в во втором типе клеток и скрининга трансфектированных клеток второго типа клеток в отношении специфического связывания с В7-Н3. Подробные описания способов, используемых в клонировании генов млекопитающих, кодирующих белки клеточной поверхности с помощью "пэннинга", можно найти в настоящей области техники (см., например, Aruffo, A. et al. (1987) "Molecular Cloning Of A CD28 cDNA By A High-Efficiency COS Cell Expression System" Proc. Natl. Acad. Sci. (U.S.A.) 84: 8573-8577 и Stephan, J. et al. (1999) "Selective Cloning Of Cell Surface Proteins Involved In Organ Development: Epithelial Glycoprotein Is Involved In Normal Epithelial Differentiation," Endocrinol. 140: 5841-5854).
кДНК, кодирующие антитела к В7-H3, и другие агонисты, антагонисты и модуляторы пептида В7-Н3 можно получить с помощью обратной транскрипции иРНК из конкретного типа клеток согласно стандартным способам, известным в настоящей области техники. Конкретно, иРНК можно выделить с использованием различных литических ферментов или химических растворов согласно процедурам, представленным в Sambrook с соавт. выше, или экстрагировать с помощью коммерчески доступных связывающихся с нуклеиновыми кислотами смол согласно прилагаемым инструкциям, предоставленным производителями (например, Qiagen, Invitrogen, Promega). Синтезированные кДНК затем вводят в экспрессионный вектор с получением представляющего интерес антитела или белка в клетках второго типа. Подразумевается, что экспрессионный вектор должен являться реплицируемым в клетках-хозяевах либо в виде эписомы, либо в виде интегральной части хромосомной ДНК. Подходящие экспрессионные векторы включают в себя без ограничения плазмиды, вирусные векторы, включая в себя аденовирусы, аденоассоциированные вирусы, ретровирусы и космиды.
Векторы, содержащие представляющие интерес полинуклеотиды, можно ввести в клетку-хозяина с помощью любого из ряда подходящих средств, включая в себя электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; баллистической трансфекции; липофекции и инфицирования (например, если вектор представляет собой инфекционный агент, такой как вирус осповакцины). Выбор введения векторов или полинуклеотидов будет зачастую зависеть от признаков клетки-хозяина.
Любые клетки-хозяева, способные избыточно экспрессировать гетерологичные ДНК, можно использовать с целью выделения генов, кодирующих представляющее интерес антитело, полипептид или белок. Не ограничивающие примеры подходящих клеток-хозяев млекопитающего включают в себя без ограничения клетки COS, HeLa и СНО. Клетки-хозяева предпочтительно экспрессируют кДНК на уровне, составляющем приблизительно в 5 раз выше, более предпочтительно в 10 раз выше, даже более предпочтительно в 20 раз выше, чем уровень соответствующего представляющего интерес эндогенного антитела или белка, если таковой присутствует, в клетках-хозяевах. Скрининг клеток-хозяев в отношении специфического связывания с В7-Н3 осуществляют с помощью иммуноанализа или FACS. Можно идентифицировать клетку, избыточно экспрессирующую представляющее интерес антитело или белок.
Агонисты, антагонисты, и другие модуляторы функции В7-Н3 полностью включены в пределах объема настоящего изобретения. Указанные агонисты, антагонисты и модуляторы представляют собой полипептиды, которые содержат один или несколько сайтов антигенных детерминант В7-H3, или содержат один или несколько фрагментов таких сайтов, варианты таких сайтов или пептидомиметики таких сайтов. Указанные агонистические, антагонистические и модулирующие В7-Н3 соединения предусмотрены в неразветвленной или циклизированной форме, и необязательно содержат по меньшей мере один аминокислотный остаток, который не встречается в природе или по меньшей мере одна амидная изостера. Указанные соединения могут являться гликозилированными.
Более конкретно, используемый в настоящем документе термин "модулятор B7-H3 " обозначает любое соединение, которое (1) способно разрывать или блокировать взаимодействие между В7-Н3 человека и его нативными лигандами или антителом к В7- Н3; (2) способно связываться с В7-Н3 человека и его нативными лигандами или антителом к В7-Н3; (3) содержит антигенный сайт, который можно использовать в получении антител, способных связываться с В7-Н3 человека и его нативными лигандами или антителом к В7-Н3; (4) содержит антигенный сайт, который можно использовать в скрининге антител, способных связываться с человека В7-Н3 и его нативными лигандами или антителом к В7-Н3; (5) содержит антигенный сайт, который можно использовать в получении антител, способных разрывать или блокировать взаимодействие между В7-Н3 человека и его нативными лигандами или антителом к В7-Н3; (6) содержит антигенный сайт, который можно использовать в скрининге антител, способных разрывать или блокировать взаимодействие между В7-Н3 человека и его нативными лигандами или антителом к В7-Н3. Модуляторы В7-Н3 могут представлять собой "агонисты В7-Н3" или "антагонисты В7-Н3" в зависимости от того, усиливает ли их активность Т-клеточную активацию или ингибирует Т-клеточную активацию, соответственно.
Агонисты, антагонисты и модуляторы В7-Н3 включают в себя варианты В7-H3, антагонисты, пептидомиметики и никомолекулярные молекулы пептида В7-H3, антитела к В7-Н3 и иммуноглобулиновые варианты, аминокислотные варианты В7-Н3 человека, включая в себя варианты с аминокислотной заменой, делецией и добавлением или любой их комбинацией, и химерные иммуноглобулины. Агонисты, антагонисты и модуляторы В7-Н3 согласно настоящему изобретению основаны на идентификации доменов В7-H3, вовлеченных в связывание В7-Н3 человека с его нативными лигандами или антителами к В7-Н3. Таким образом, согласно настоящему изобретению предусмотрены агонисты, антагонисты и модуляторы В7-Н3 с молекулярными структурами, которые дублируют или имитируют один или несколько доменов связывания с В7-Н3 в В7-Н3 человека.
Используемый в настоящем документе термин "вариант В7-Н3" обозначает любой аминокислотный вариант В7-Н3 человека, включая в себя варианты с аминокислотной заменой, делецией и добавлением или любой их комбинацией. Определение предусматривает химерные молекулы, такие как химеры В7-Н3 человека/не относящийся к человеку и другие гибридные молекулы. Также в определение включен любой фрагмент молекула варианта В7-H3, который содержит вариантную(ые) или гибридную(ые) область(и) молекулы.
В. Антитела к В7-Н3
Несколько способов можно использовать для скрининга полипептидов и моноклональных антител, которые связываются с В7-Н3. Следует понимать, что "связывание" относится к биологически или иммунологически релевантному специфическому связыванию и не относится к неспецифическому связыванию, которое может происходить, например, если иммуноглобулин используют в очень высокой концентрации против неспецифической мишени. Согласно одному варианту осуществления моноклональные антитела подвергают скринингу в отношении связывания с В7-Н3 с использованием стандартных техник скрининга. Таким способом получали моноклональное антитело к В7-Н3. Способы получения таких антител описаны в патентной публикации США №2013/0149236 и международной патентной публикации WO 2011/109400.
Согласно настоящему изобретению также предусмотрены полипептиды, содержащие аминокислотную последовательность антител согласно настоящему изобретению. Согласно некоторым вариантам осуществления полипептид содержит одну или несколько вариабельных областей легкой цепи и/или тяжелой цепи антитела. Согласно некоторым вариантам осуществления полипептид содержит одну или несколько CDR легкой цепи и/или тяжелой цепи антитела. Согласно некоторым вариантам осуществления полипептид содержит три CDR легкой цепи и/или тяжелой цепи антитела. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность антитела, которая характеризуется любым из следующего: по меньшей мере 5 смежных аминокислот последовательности исходного антитела, по меньшей мере 8 смежных аминокислот, по меньшей мере приблизительно 10 смежных аминокислот, по меньшей мере приблизительно 15 смежных аминокислот, по меньшей мере приблизительно 20 смежных аминокислот, по меньшей мере приблизительно 25 смежных аминокислот, по меньшей мере приблизительно 30 смежных аминокислот, причем по меньшей мере 3 из аминокислот происходят из вариабельной области антитела. Согласно одному варианту осуществления вариабельная область происходит из легкой цепи исходного антитела. Согласно другому варианту осуществления вариабельная область происходит из тяжелой цепи антитела. Согласно другому варианту осуществления 5 (или больше) смежных аминокислот происходят из определяющей комплементарность области (CDR) антитела.
Предпочтительное антитела к В7-Н3 согласно настоящему изобретению представляют собой BRCA84D, BRCA69D и PRCA157, причем все указанные антитела представляют собой мышиные антитела, реакционноспособные в отношении молекулы В7-Н3 человека. Аминокислотные и кодирующие полинуклеотидные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи BRCA84D, BRCA69D и PRCA157 показаны ниже вместе с соответственными доменами CDR1, CDR2 и CDR3 каждой такой цепи. Следовательно, специалисты в настоящей области техники смогут сконструировать антитела, характеризующиеся такими CDR, а также их производные, способные связываться с эпитопами, распознанными с помощью BRCA84D, BRCA69D и PRCA157.
1. Последовательности BRCA69D
(а) Последовательности легкой цепи BRCA69D
Аминокислотная последовательность вариабельной легкой цепи BRCA69D (SEQ ID NO:5):

Полинуклеотид последовательность, кодирующая BRCA69D вариабельную легкую цепь (SEQ ID NO:6).

CDR1 вариабельной легкой цепи BRCA69D (SEQ ID NO:7): RASQDISNYLN
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной легкой
цепи BRCA69D (SEQ ID NO:8): agggcaagtc aggacattag taattattta aac
CDR2 вариабельной легкой цепи BRCA69D (SEQ ID NO:9): YTSRLHS
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной легкой цепи BRCA69D (SEQ ID NO:10): tacacatcac gattacactc а
CDR3 вариабельной области легкой цепи BRCA69D (SEQ ID NO:11): QQGNTLPPT
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной легкой цепи BRCA69D (SEQ ID NO:12): caacagggta atacgcttcc tccgacg
(b) Последовательности тяжелой цепи BRCA69D
Аминокислотная последовательность вариабельной тяжелой цепи BRCA69D (SEQ ID NO: 13):
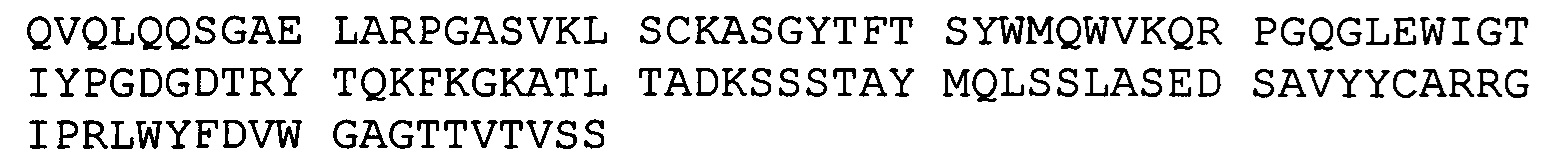
Полинуклеотидная последовательность, кодирующая вариабельную тяжелую цепь BRCA69D (SEQ ID NO: 14):

CDR1 вариабельной тяжелой цепи BRCA69D (SEQ ID NO:15): SYWMQ
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной тяжелой цепи BRCA69D (SEQ ID NO:16): agctactgga tgcag
CDR2 вариабельной тяжелой цепи BRCA69D (SEQ ID NO: 17): TIYPGDGDTR YTQKFKG
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной тяжелой цепи BRCA69D (SEQ ID NO:18): actatttatc ctggagatgg tgatactagg tacactcag aagttcaagg gc
CDR3 вариабельной тяжелой цепи BRCA69D (SEQ ID NO: 19): RGIPRLWYFD V
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной тяжелой цепи BRCA69D (SEQ ID NO:20): agagggattc cacggctttg gtacttcgat gtc
2. Последовательности PRCA157
(а) Последовательности легкой цепи PRCA157
Аминокислотная последовательность вариабельной легкой цепи PRCA157 (SEQ ID NO:21):
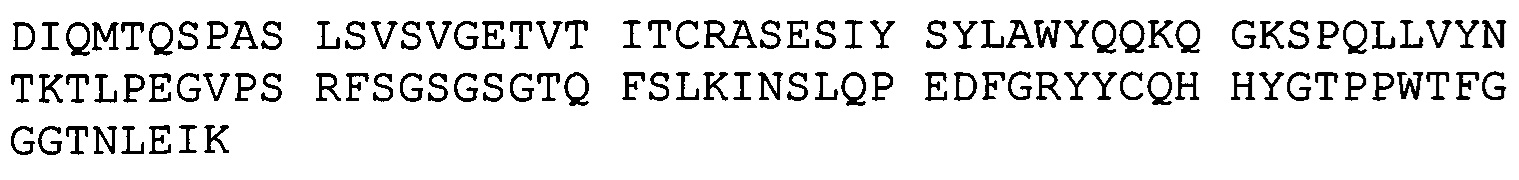
Полинуклеотидная последовательность, кодирующая вариабельную легкую цепь PRCA157 (SEQ ID NO:22):

CDR1 вариабельной легкой цепи PRCA157 (SEQ ID NO:23): RASESIYSYLA
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной легкой цепи PRCA157 (SEQ ID NO:24): cgagcaagtg agagtattta cagttattta gca
CDR2 вариабельной области легкой цепи PRCA157 (SEQ ID NO:25): NTKTLPE
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной легкой цепи PRCA157 (SEQ ID NO:26): aatacaaaaa ccttaccaga g
CDR3 вариабельной области легкой цепи PRCA157 (SEQ ID NO:27): QHHYGTPPW
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной легкой цепи PRCA157 (SEQ ID NO:28): caacatcatt atggtactcc tccgtgg
(b) Последовательности тяжелой цепи PRCA157
Аминокислотная последовательность вариабельной тяжелой цепи PRC А157 (SEQ ID NO:29):
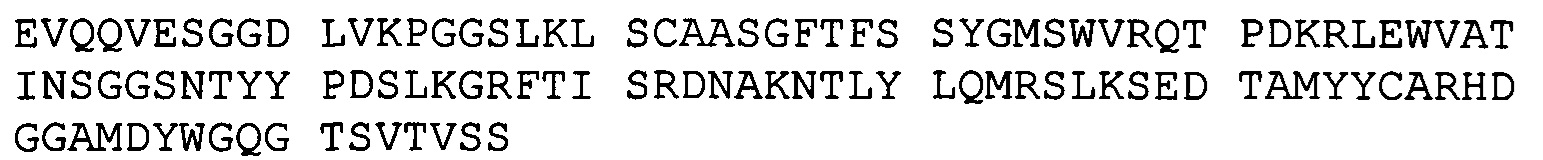
Полинуклеотидная последовательность, кодирующая вариабельную тяжелую цепь PRCA157 (SEQ ID NO:30):

CDR1 вариабельной тяжелой цепи PRCА157 (SEQ ID NO:31): SYGMS
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной тяжелой цепи PRCA157 (SEQ ID NO:32): tcctatggca tgtct
CDR2 вариабельной тяжелой цепи PRC А157 (SEQ ID NO:33): VATINSGGSN TYYPDSLKG
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной тяжелой цепи PRCA157 (SEQ ID NO:34): gtcgcaacca ttaatagtgg tggaagtaac acctactatc cagacagttt gaagggg
CDR3 вариабельной тяжелой цепи PRCA157 (SEQ ID NO:35): HDGGAMDY
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной тяжелой цепи PRCA157 (SEQ ID NO:36): catgacgggg gagctatgga ctac
2. Последовательности BRCA84D
(a) Последовательности легкой цепи BRCA84D
Аминокислотная последовательность вариабельной легкой цепи BRCA84D (SEQ ID NO:37):
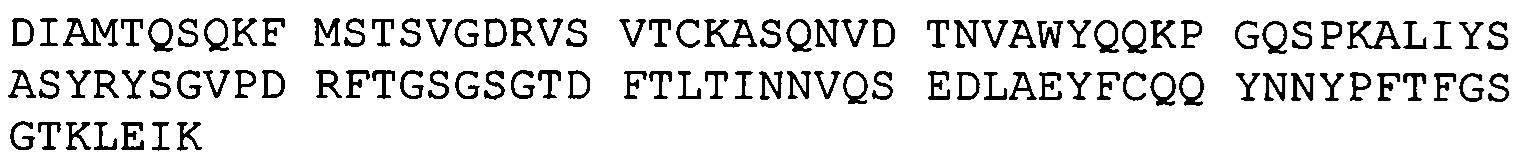
Полинуклеотидная последовательность, кодирующая вариабельную легкую цепь BRCA84D (SEQ ID NO:38):

CDR1 вариабельной легкой цепи BRCA84D (SEQ ID NO:39): KASQNVDTNVA
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной легкой цепи BRCA84D (SEQ ID NO:40): aaggccagtc agaatgtgga tactaatgta gcc
CDR2 вариабельной легкой цепи BRCA84D (SEQ ID NO:41): SASYRYS
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной легкой цепи BRCA84D (SEQ ID NO:42): tcggcatcct accggtacag t
CDR3 вариабельной легкой цепи BRCA84D (SEQ ID NO:43): QQYNNYPFT
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной легкой цепи BRCA84D (SEQ ID NO:44): cagcaatata acaactatcc attcacg
(b) Последовательности тяжелой цепи BRCA84D
Аминокислотная последовательность вариабельной тяжелой цепи BRCA84D (SEQ ID NO:45):
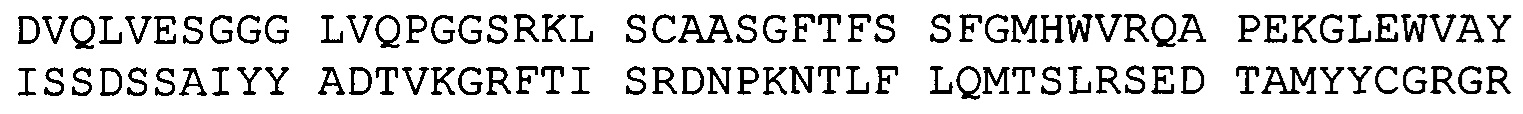
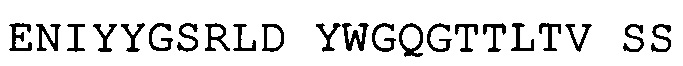
Полинуклеотидная последовательность, кодирующая вариабельной тяжелой цепи BRCA84D (SEQ ID NO:46):

CDR1 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:47): FGMH
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:48): tttggaatgcac
CDR2 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:49): YISSDSSAIYYADTVK
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:50): tacattagta gtgacagtag tgccatctac tatgcagaca cagtgaag
CDR3 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:51): GRENIYYGSRLDY
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной тяжелой цепи BRCA84D (SEQ ID NO:52): gggagggaaa acatttacta cggtagtagg cttgactac
Моноклональное антитело BRCA84D было гуманизировано для получения антител (обобщенно обозначенных в настоящем документе как "hBRCA84D"), обеспечивающих улучшенный терапевтический потенциал в отношении человека. Последовательности вариабельной легкой цепи и вариабельной тяжелой цепи и их соответствующие аминокислотные и полинуклеотидные последовательности полученного гуманизированного антитела (обозначенного в настоящем документе как "hBRCA84D-1") представлены ниже:
Вариабельная легкая цепь гуманизированного BRCA84D-1 (SEQ ID NO:53):
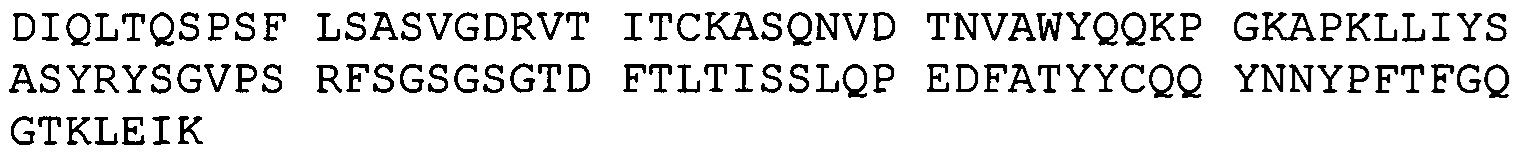
Полинуклеотидная последовательность, кодирующая вариабельную легкую цепь гуманизированного BRCA84D-1 (SEQ ID NO:54):
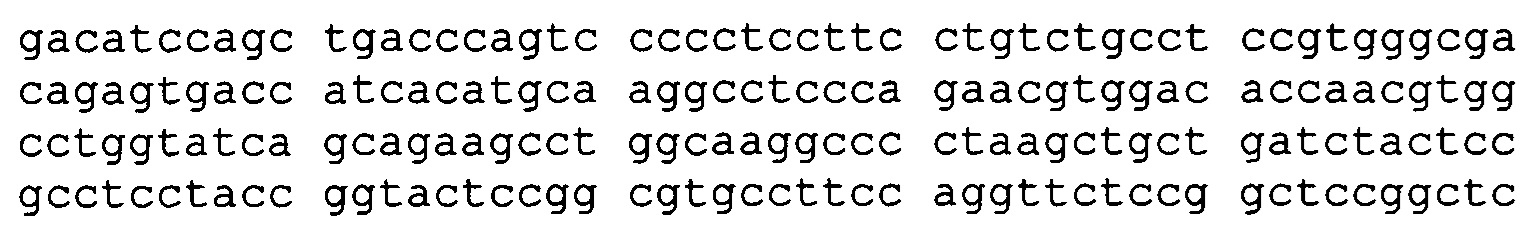
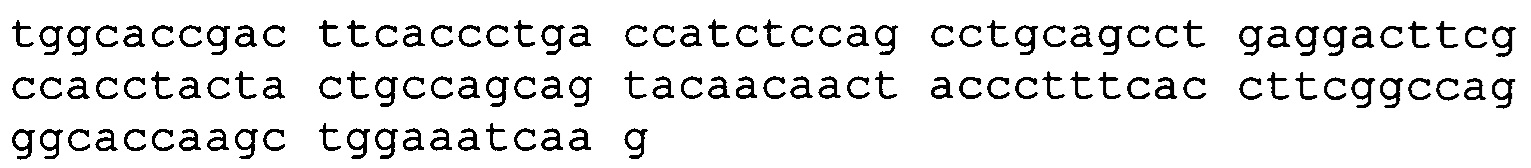
CDR1 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:55): KASQNVDTNVA
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:56): aaggccagtc agaatgtgga tactaatgta gcc
CDR2 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:57): SASYRYS
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:58): tcggcatcct accggtacag t
CDR3 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:59): QQYNNYPFT
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной легкой цепи гуманизированного BRCA84D-1 (SEQ ID NO:60): cagcaatata acaactatcc attcacg
Аминокислотная последовательность вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:61):
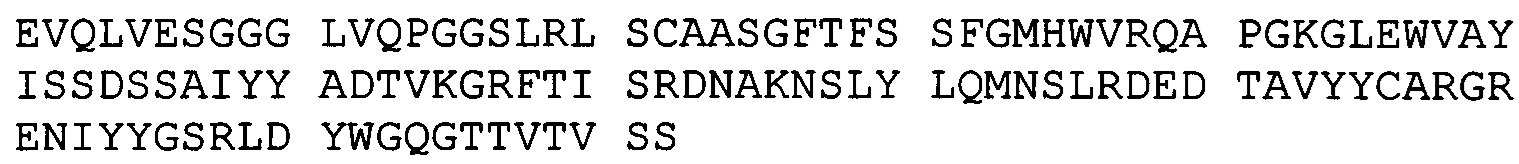
Полинуклеотидная последовательность, кодирующая вариабельную тяжелую цепь гуманизированного BRCA84D-1 (SEQ ID NO:62):

CDR1 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:63): FGMH
Полинуклеотидная последовательность, кодирующая CDR1 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:64): tttggaatgcac
CDR2 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:65): YISSDSSAIYYADTVK
Полинуклеотидная последовательность, кодирующая CDR2 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:66): tacattagta gtgacagtag tgccatctac tatgcagaca cagtgaag
CDR3 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:67): greniyygsrldy
Полинуклеотидная последовательность, кодирующая CDR3 вариабельной тяжелой цепи гуманизированного BRCA84D-1 (SEQ ID NO:68): gggagggaaa acatttacta cggtagtagg cttgactac
Для получения видов hBRCA84D, которые проявляют улучшенную аффинность в отношении В7-Н3 человека, полинуклеотиды, кодирующие легкие или тяжелые цепи hBRCA84D-1 (т.е. hBRCA84D-1VL или hBRCA84D-1VH, соответственно) подвергали мутагенезу и мутированные производные легкой цепи hBRCA84D-1, hBRCA84D-2VL, hBRCA84D-3VL, hBRCA84D-4VL, hBRCA84D-5VL и hBRCA84D-6VL, и мутированные производные тяжелой цепи hBRCA84D-1, hBRCA84D-2VH, hBRCA84D-3VH и hBRCA84D-4VH, выделяли и определяли их характеристики. Аминокислотные и полинуклеотидные последовательности вариабельных легких и тяжелых цепей указанных антител представлены ниже:
Аминокислотная последовательность hBRCA84D-2VL (SEQ ID NO:69):
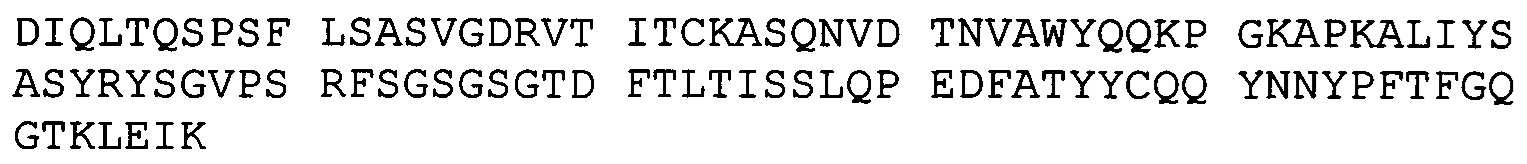
Полинуклеотид, кодирующий hBRCA84D-2VL (SEQ ID NO:70):

Аминокислотная последовательность hBRCA84D-3VL (SEQ ID NO:71):
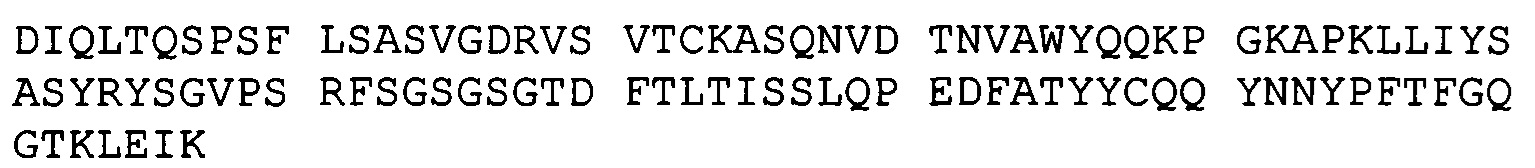
Полинуклеотид, кодирующий hBRCA84D-3VL (SEQ ID NO:72):

Аминокислотная последовательность hBRCA84D-4VL (SEQ ID NO:73):

Полинуклеотид, кодирующий hBRCA84D-4VL (SEQ ID NO:74):

Аминокислотная последовательность hBRCA84D-5VL (SEQ ID NO:75):

Полинуклеотид, кодирующий hBRCA84D-5VL (SEQ ID NO:76):

Аминокислотная последовательность hBRCA84D-6VL (SEQ ID NO:77):

Полинуклеотид, кодирующий hBRCA84D-6VL (SEQ ID NO:78):

Аминокислотная последовательность hBRCA84D-2VH (SEQ ID NO:79):

Полинуклеотид, кодирующий hBRCA84D-2VH (SEQ ID NO:80):

Аминокислотная последовательность hBRCA84D-3VH (SEQ ID NO:81):
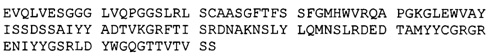
Полинуклеотид, кодирующий hBRCA84D-3VH (SEQ ID NO:82):

Аминокислотная последовательность hBRCA84D-4VH (SEQ ID NO:83):
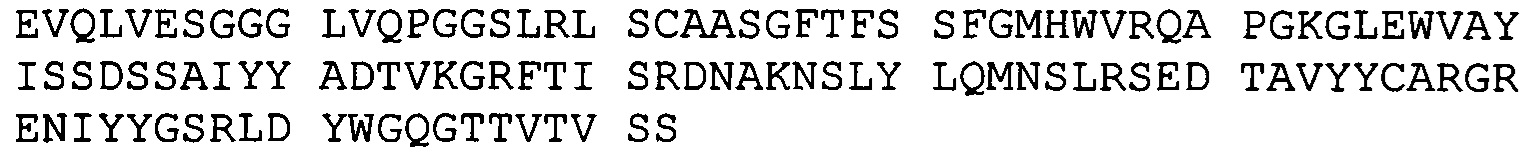
Полинуклеотид, кодирующий hBRCA84D-4VH (SEQ ID NO:84):

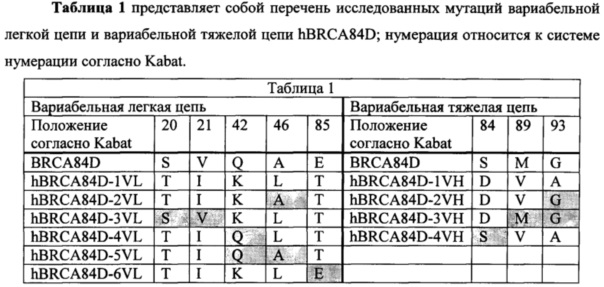
Относительные аффинности связывания производных легкой цепи hBRCA84D, hBRCA84D-3VL, hBRCA84D-4VL и hBRCA84D-5VL, в отношении В7-Н3 человека определяли путем образования антител, содержащих указанные вариабельные области легкой цепи и химерную тяжелую цепь BRCA84D-1VH. Обнаружили, что BRCA84D- 5VL (K42Q, L46A) характеризовался самой высокой аффинностью связывания из исследованных hBRCA84D-VL. Следовательно, BRCA84D-5VL использовали в качестве легкой цепи для исследования относительных аффинностей связывания тяжелых цепей hBRCA84D, hBRCA84D-1VH, hBRCA84D-2VH, hBRCA84D-3VH и hBRCA84D-4VH, в отношении В7-Н3 человека. Обнаружили, что hBRCA84D-2VH (A93G) характеризовался самой высокой аффинностью связывания из исследованных hBRCA84D-VH.
Аминокислотные и кодирующие полинуклеотидные последовательности химерного BRCA84D-1 представляют собой следующие:
Аминокислотная последовательность легкой цепи chBRCA84D (SEQ ID NO:85):

Полинуклеотид, кодирующий легкую цепь chBRCA84D (SEQ ID NO:86):

Аминокислотная последовательность тяжелой цепи chBRCA84D (SEQ ID NO:87):

Полинуклеотид, кодирующий тяжелую цепь chBRCA84D (SEQ ID NO:88):


VEGF и VEGFR и антитела к VEGF и к VEGFR
A. VEGF и VEGFR
Используемый в настоящем документе термин "VEGF" относится к фактору А роста эндотелия сосудов (Leung, D.W. et al. (1989) "Vascular Endothelial Growth Factor Is A Secreted Angiogenic Mitogen," Science 246(4935): 1306-1309). VEGF существует в многочисленных изоформах, отражающих альтернативное использование промотора, альтернативный сплайсинг и альтернативную инициацию. Изначально открытую форму в настоящее время обозначают как изоформа 162 (SEQ ID NO:89):

и она кодируется последовательностью кДНК (SEQ ID NO:90):

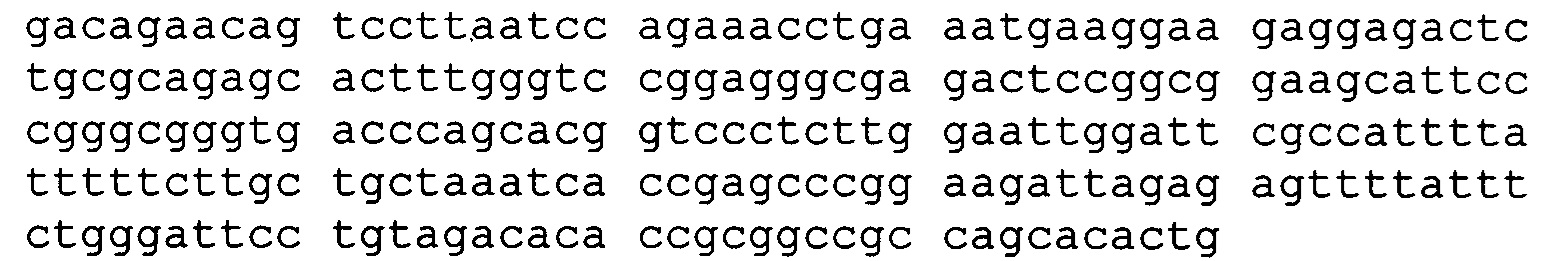
Изоформу VEGF 206 (Houck, K.A. et al. (1991) "The Vascular Endothelial Growth Factor Family: Identification Of A Fourth Molecular Species And Characterization Of Alternative Splicing Of RNA," Mol. Endocrinol. 5(12): 1806-1814) выбрали в качестве канонической последовательности (SEQ ID NO:91):

Как указано выше, были описаны три рецептора VEGF: VEGFR-1 (Flt-1), VEGFR- 2 (Flk-1/KDR) и VEGFR-3 (Flt-4). Только VEGFR-1 и VEGFR-2 способны связываться с VEGF-A (Shibuya, М. (2013) "Vascular Endothelial Growth Factor And Its Receptor System: Physiological Functions In Angiogenesis And Pathological Roles In Various Diseases," J. Biochem. 153(1): 13-19; Koch, S. et al. (2011) "Signal Transduction By Vascular Endothelial Growth Factor Receptors," Biochem. J. 437: 169-183).
Аминокислотная последовательность VEGFR-1 представляет собой (SEQ ID NO:92):

Аминокислотная последовательность VEGFR-2 представляет собой (SEQ ID NO:93):

В. Антитела к VEGF и к VEGFR
Как указано выше, антитела к VEGF рассматривали в лечении глиобластом. VEGR и его рецептор дополнительно рассматривали в отношении различных других типов васкуляризированных злокачественных опухолей, таких как злокачественная опухоль молочной железы, глиобластома, карцинома шейки матки, метастазирующая злокачественная опухоль толстой и прямой кишки, злокачественная опухоль желудка, гепотоклеточная карцинома, лейкоз, злокачественная опухоль легкого, метастазирующая меланома, васкуляризированная злокачественная опухоль поджелудочной железы и метастазирующая злокачественная опухоль предстательной железы (Roberts, Е. et al. (2013) "The Role of Vascular Endothelial Growth Factor in Metastatic Prostate Cancer to the Skeleton," Prostate Cancer 2013:418340; Vici, P. et al. (2014) "Emerging Biological Treatments for Uterine Cervical Carcinoma," J. Cancer 5(2): 86- 97; Dietvorst, M.H. et al. (2013) "Current and Novel Treatment Options for Metastatic Colorectal Cancer: Emphasis on Aflibercept," Biol. Ther. 3: 25-33; Moeini, A. et al. (2012) "Emerging Signaling Pathways in Hepatocellular Carcinoma," Liver Cancer 1(2): 83-93; Cesca, M. et al. (2013) "Tumor Delivery of Chemotherapy Combined with Inhibitors of Angiogenesis and Vascular Targeting Agents" Front Oncol. 3:259: 1-7; Pavlidis, E.T. et al. (2013) "Role Of Bevacizumab In Colorectal Cancer Growth And Its Adverse Effects: A Review" World J. Gastroenterol. 19(31): 5051-5060; Welti, J. et al. (2013) "Recent Molecular Discoveries In Angiogenesis And Antiangiogenic Therapies In Cancer," J. Clin. Invest. 123(8):3190-3200; Eveno, C. et al. (2012) "VEGF Levels And The Angiogenic Potential Of The Microenvironment Can Affect Surgical Strategy For Colorectal Liver Metastasis," Cell. Adh. Migr. 6(6):569-573; Miyake, T.M. et al. (2013) "Contemporary Use Of Bevacizumab In Ovarian Cancer," Expert Opin. Biol. Ther. 13(2): 283-294; Plate, K.H. et al. (2012) "Tumor Angiogenesis And Anti-Angiogenic Therapy In Malignant Gliomas Revisited," Acta Neuropathol. 124(6): 763-775; Liu, L. et al. (2012) "Prognostic Value Of Vascular Endothelia Growth Factor Expression In Resected Gastric Cancer" Asian Рас. J. Cancer Prev. 13(7): 3089-3097; Kim, K.B. (2013) "Is There A Role For Targeting Vascular Endothelial Growth Factor/Receptor Axis In The Treatment Of Patients With Metastatic Melanoma?" Cancer 119(3): 477-480; Kubota, Y. (2012) "Tumor Angiogenesis And Anti-Angiogenic Therapy" Keio J. Med. 61(2): 47-56; Wicki, A. et al. (2012) "Targeted Therapies In Breast Cancer" Swiss Med. Wkly. 142: w13550: 1-7; Parente Lamelas, I. et al. (2012) "Directed Therapies In Lung Cancer: New Hope?" Arch. Bronconeumol. 48(10): 367-371; Saintigny, P. et al. (2012) "Recent Advances In Non-Small Cell Lung Cancer Biology And Clinical Management" Discov. Med. 13(71): 287-297; Stevenson, C.E. et al. (2012) "Bevacizumab And Breast Cancer: What Does The Future Hold?" Future Oncol. 8(4): 403-414; Aggarwal, C. et al. (2012) "Antiangiogenic Agents In The Management Of Non-Small Cell Lung Cancer: Where Do We Stand Now And Where Are We Headed?," Cancer Biol. Ther. 13(5): 247-263).
Особенно предпочтительным является гуманизированное антитело к VEGF (бевацизумаб), продаваемый как Авастин® (Genentech US, Inc.). Бевацизумаб (Авастин®) описан в патентных публикациях США №№2002/0032315, 2003/0190317, 2005/0112126, 2007/0059302, 2007/0059312, 2007/0196374, 2007/0248610, 2008/0187531, 2008/0226629, 2011/0052575, 2011/0081342, 2013/0058927; патентах США№№6884879; 7060269; 7169901; 7297334; 7365166; 7375193; патентах Канады №№2286330 и 2145985; и международной патентной публикации согласно РСТ №WO 1998/045331; Baca, М. et al. (1997) "Antibody Humanization Using Monovalent Phage Display," J. Biol. Chem. 272(16): 10678-10684; Presta, L.G. et al. (1997) "Humanization Of An Anti-Vascular Endothelial Growth Factor Monoclonal Antibody For The Therapy Of Solid Tumors And Other Disorders" Cancer Res. 57(20): 4593-4599; причем каждый из указанных документов полностью включен в настоящий документ посредством ссылки.
Аминокислотная последовательность легкой цепи бевацизумаба представляет собой (SEQ ID NO:94):

Аминокислотная последовательность тяжелой цепи бевацизумаба представляет собой (SEQ ID NO:95):

Особенно предпочтительное антитело к VEGFR представляет собой рамуцирумаб (гуманизированное нейтрализующее моноклональное антитело к VEGFR-2 человека) (Yang, Y. et al. (2013) "Anti-VEGF- And Anti-VEGF Receptor-Induced Vascular Alteration In Mouse Healthy Tissues," Proc. Natl. Acad. Sci. (U.S.A.) 110(29): 12018-12023; Anonymous (2013) "Ramucirumab Takes Steps Forward In Gastric Cancer," Cancer Discov. 3(12):OF4; Aprile, G. et al. (2013) "Critical Appraisal Of Ramucirumab (IMC-1121B) For Cancer Treatment: From Benchside To Clinical Use," Drugs 73(18): 2003-2015; Ramucirumab Monotherapy For Previously Treated Advanced Gastric Or Gastro-Oesophageal Junction Adenocarcinoma (REGARD): An International, Randomised, Multicentre, Placebo-Controlled, Phase 3 Trial; Fuchs, C.S. et al. (2014) "Ramucirumab Monotherapy For Previously Treated Advanced Gastric Or Gastro-Oesophageal Junction Adenocarcinoma (REGARD): An International, Randomised, Multicentre, Placebo-Controlled, Phase 3 Trial," Lancet 383(9911): 31-39; Clarke, J.M. et al. (2013) "Targeted Inhibition Of VEGF Receptor 2: An Update On Ramucirumab," Expert Opin. Biol. Ther. 13(8): 1187-1196; Wadhwa, R. et al. (2013) "Ramucirumab: a novel antiangiogenic agent," Future Oncol. 9(6): 789-795).
Другие антитела к VEGFR включают в себя крысиное нейтрализующее моноклональное антитело к VEGFR-1 мыши (MF-1) и крысиное нейтрализующее моноклональное антитело к VEGFR-2 мыши (DC101) (Xue, Y. et al. (2008) "Anti-VEGF Agents Confer Survival Advantages To Tumor-Bearing Mice By Improving Cancer-Associated Systemic Syndrome," Proc. Natl. Acad. Sci. (U.S.A.) 105(47): 18513-18518; Zhang, D. et al. (2011) "Anti-Angiogenic Agents Significantly Improve Survival In Tumor-Bearing Mice By Increasing Tolerance To Chemotherapy-Induced Toxicity," Proc. Natl. Acad. Sci. (U.S.A.) 108(10): 4117-4122; Cao, R. et al. (2010) "VEGFR1-Mediated Pericyte Ablation Links VEGF AndPlgfTo Cancer-Associated Retinopathy," Proc. Natl. Acad. Sci. (U.S.A.) 107(2): 856-861).
Альтернативно, настоящее изобретение предусматривает применение антагониста VEGFR (например, афлиберцепт (белок-ловушка для VEGF), растворимый слитый белок внеклеточного домен VEGFR-1 и VEGFR-2 (Dietvorst, М.Н. et al. (2013) "Current and Novel Treatment Options for Metastatic Colorectal Cancer: Emphasis on Aflibercept," Biol. Ther. 3: 25-33; Moradi, A. et al. (2013) "Vascular Endothelial Growth Factor Trap-Eye (Aflibercept) For The Management Of Diabetic Macular Edema," World J. Diabetes. 4(6): 303-309; Ventrice, P. et al. (2013) "Anti-vascular endothelial growth factor drugs safety and efficacy in ophthalmic diseases," J. Pharmacol. Pharmacother. 4(Suppll): S38- S42; Sophie, R. et al. (2012) "Aflibercept: a Potent Vascular Endothelial Growth Factor Antagonist for Neovascular Age-Related Macular Degeneration and Other Retinal Vascular Diseases," Biol. Ther. 2:3:1-22) или пан-ингибитор тирозинкиназы VEGFR, цедираниб (AstraZeneca) (Dietrich, J. et al. (2009) "Cediranib: Profile Of A Novel Anti-Angiogenic Agent In Patients With Glioblastoma," Expert Opin. Investig. Drugs. 18(10): 1549-1557).
Сконструированные на основе Fc антитела
В традиционной иммунной функции взаимодействие комплексов антитело- антиген с клетками иммунной системы дает в результате широкий спектр ответов, находящихся в диапазоне от эффекторных функций, таких как антителозависимая цитотоксичность, дегрануляция тучных клеток и фагоцитоз, до иммуномодулирующих сигналов, таких как регулирующие пролиферацию лимфоцитов и секрецию антител. Все из указанных взаимодействий начинаются посредством связывания Fc-домена антител или иммунных комплексов со специализированными рецепторами клеточной поверхности на гемопоэтических клетках. Разнообразие клеточных ответов, запускаемых антителами и иммунными комплексами является результатом структурной гетерогенности трех рецепторов Fc: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD 16). FcγRI (CD64), FcγRIIA (CD32A) и FcγRIII (CD16) представляют собой активирующие (т.е. усиливающие иммунную систему) рецепторы; FcγRIIB (CD32B) представляет собой ингибирующий (т.е. ослабляющий иммунную систему) рецептор. Аминокислотная последовательность области Fc IgG1 показана ниже (как SEQ ID NO:96, нумерация согласно Kabat et al, Sequence of Proteins of Immunological Interest, 5th Ed. Public Health Service, NIH, MD (1991), полностью включенной в настоящий документ посредством ссылки, и в настоящем документе далее носит название "Kabat EU") (SEQ ID NO:96):

Остатки 230-341 представляют собой область СН2 Fc. Остатки 342-447 представляют собой область СН3 Fc.
Согласно настоящему изобретению предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза (такие как антитело к VEGF или к VEGFR), которые содержат вариантную область Fc, характеризующуюся одной или несколькими аминокислотными модификациями (например, заменами, делециями, вставками) в одной или нескольких частях, причем указанные модификации увеличивают аффинность и авидность вариантной области Fc в отношении FcγR (включая в себя активирующие и ингибирующие FcγR). Согласно некоторым вариантам осуществления указанная одна или несколько аминокислотных модификаций увеличивают аффинность вариантной области Fc в отношении FcγRIIIA и/или FcγRIIA. Согласно другому варианту осуществления вариантная область Fc дополнительно специфически связывается с FcγRIIB с более низкой аффинностью, чем область Fc связывается с сопоставимым исходным антителом (т.е. антителом, характеризующимися такой же аминокислотной последовательностью, что и антитело согласно настоящему изобретению за исключением одной или нескольких аминокислотных модификаций в области Fc). Согласно некоторым вариантам осуществления такие модификации увеличивают аффинность вариантной области Fc в отношении FcγRIIIA и/или FcγRIIA, а также усиливают аффинность вариантной области Fc в отношении FcγRIIB относительно исходного антитела. Согласно другим вариантам осуществления указанная одна или несколько аминокислотных модификаций увеличивают аффинность вариантной области Fc в отношении FcγRIIIA и/или FcγRIIA, но не изменяют аффинность вариантных областей Fc в отношении FcγRIIB относительно области Fc исходного антитела. Согласно другому варианту осуществления указанная одна или несколько аминокислотных модификаций усиливают аффинность вариантной области Fc в отношении FcγRIIIA и FcγRIIA, но снижают аффинность в отношении FcγRIIB относительно исходного антитела. Увеличенная аффинность и/или авидность дает в результате обнаруживаемое связывание с FcγR или связанную с FcγR активность в клетках, которые экспрессируют низкие уровни FcγR, если в клетках нельзя обнаружить связывающую активность исходной молекулы (без модифицированной области Fc). Согласно другим вариантам осуществления модифицированная молекула проявляет обнаруживаемое связывание в клетках, которые экспрессируют целевые антигены не- FcγR рецептора с плотностью, составляющей 30000-20000 молекул/клетка, с плотностью, составляющей 20000-10000 молекул/клетка, с плотностью, составляющей 10000-5000 молекул/клетка, с плотностью, составляющей 5000-1000 молекул/клетка, с плотностью, составляющей 1000-200 молекул/клетка, или с плотностью, составляющей 200 молекул/клетка или меньше (но по меньшей мере 10, 50,100 или 150 молекул/клетка).
Согласно другому варианту осуществления указанная одна или несколько модификаций в аминокислотах области Fc снижают аффинность и авидность антитела в отношении одного или нескольких рецепторов FcγR. Согласно конкретному варианту осуществления настоящее изобретение предусматривает антитела, содержащие вариантную область Fc, причем указанная вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию относительно области Fc дикого типа, причем вариантная область Fc связывается только с одним FcγR, причем указанный FcγR представляет собой FcγRIIIA. Согласно другому конкретному варианту осуществления настоящее изобретение предусматривает антитела, содержащие вариантную область Fc, причем указанная вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию относительно области Fc дикого типа, причем вариантная область Fc связывается только с одним FcγR, причем указанный FcγR представляет собой FcγRIIA.
Характеристики связывающих свойств вышеописанных антител к В7-Н3 и/или антител против опухолевого ангиогенеза согласно настоящему изобретению предпочтительно определяют с помощью in vitro функциональных анализов для определения одной или нескольких медиаторных эффекторных клеточных функций FcγR. Аффинности и связывающие свойства молекул, например, антител согласно настоящему изобретению в отношении FcγR можно определить с использованием in vitro анализов (биохимических или иммунобиологических анализов), известных в настоящей области техники для определения взаимодействий антитело-антиген или Fc-FcγR, т.е. специфического связывания антигена с антителом или специфического связывания области Fc с FcγR, соответственно, включая в себя без ограничения анализ ELISA, поверхностный плазмонный резонанс, анализы иммунопреципитации. Согласно наиболее предпочтительным вариантам осуществления молекулы согласно настоящему изобретению характеризуются сходными связывающими свойствами в in vivo моделях (таких как модели, описанные и раскрытые в настоящем документе) со связывающими свойствами в in vitro анализах. Тем не менее, настоящее изобретение не исключает молекулы согласно настоящему изобретению, которые не проявляют требуемый фенотип в in vitro анализах, но проявляют требуемый фенотип in vivo.
Согласно некоторым вариантам осуществления описанные выше антитела к B7-H3 и/или антитела против опухолевого ангиогенеза согласно настоящему изобретению, содержащие вариантную область Fc, содержат по меньшей мере одну аминокислотную модификацию (например, обладающие 1, 2, 3, 4, 5, 6, 7, 8, 9 или больше аминокислотными модификациями) в домене CH3 области Fc, которую определяют как удлинение, начиная с аминокислот 342-447. Согласно другим вариантам осуществления молекулы согласно настоящему изобретению, содержащие вариантную область Fc, содержат по меньшей мере одну аминокислотную модификацию (например, обладающие 1, 2, 3, 4, 5, 6, 7, 8, 9 или больше аминокислотными модификациями) в домене СН2 области Fc, которую определяют как удлинение, начиная с аминокислот 231-341. Согласно некоторым вариантам осуществления молекулы согласно настоящему изобретению содержат по меньшей мере две аминокислотных модификации (например, обладающие 2, 3, 4, 5, 6, 7, 8, 9 или больше аминокислотными модификациями), причем по меньшей мере одна такая модификация находится в области CH3 и по меньшей мере одна такая модификация находится в области СН2. Согласно настоящему изобретению дополнительно предусмотрена аминокислотная модификация в шарнирной области. Согласно конкретному варианту осуществления настоящее изобретение предусматривает аминокислотную модификацию в домене СН1 области Fc, которую определяют как удлинение, начиная с аминокислот 216-230.
Согласно особенно предпочтительным вариантам осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, причем указанный вариант обеспечивает или характеризуется увеличенной активностью ADCC и/или увеличенным связыванием с FcγRIIA (CD32A) согласно измерению с использованием способов, известных специалисту в настоящей области техники и проиллюстрированных в настоящем документе. Анализы ADCC, использованные согласно способам настоящего изобретения, могут являться NK-зависимыми или макрофаг-зависимыми.
Согласно особенно предпочтительным вариантам осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, содержащие вариантную область Fc, причем указанный вариант обеспечивает или характеризуется увеличенной активностью ADCC и/или увеличенным связыванием с FcγRIIIA (CD 16А) согласно измерению с использованием способов, известных специалисту в настоящей области техники и проиллюстрированных в настоящем документе. Анализы ADCC, использованные согласно способам настоящего изобретения, могут являться NK-зависимыми или макрофаг-зависимыми.
Варианты Fc согласно настоящему изобретению можно комбинировать с другими модификациями Fc, такими как раскрытые в патентах США №№7632497; 7521542; 7425619; 7416727; 7371826; 7355008; 7335742; 7332581; 7183387; 7122637 и 6737056; в международных патентных публикациях согласно РСТ №№WO 2008/105886; WO 2008/002933; WO 2007/021841; WO 2007/106707; WO 06/088494; WO 05/115452; WO 05/110474; WO 04/1032269 и WO 04/063351; и в Presta, L.G. et al. (2002) "Engineering therapeutic antibodies for improved function" Biochem. Soc. Trans. 30(4): 487-490; Shields, R.L. et al. (2002) "Lack offucose on human IgG1 N-linked oligosaccharide improves binding to human Fcgamma RIII and antibody-dependent cellular toxicity," J. Biol. Chem. 26;277(30): 26733-26740 and Shields, R.L. et al. (2001) "High Resolution Mapping Of The Binding Site On Human IgG1 For Fc gamma RI, Fc gamma RII, Fc gamma RIII, And FcRn And Design Of IgG1 Variants With Improved Binding To The Fc gamma R," J. Biol. Chem. 276(9): 6591-6604). Согласно настоящему изобретению предусмотрена комбинация варианта Fc согласно настоящему изобретению с другими модификациями Fc для обеспечения модифицированного антитела аддитивными, синергетическими или новыми свойствами. Варианты Fc согласно настоящему изобретению предпочтительно усиливают фенотип модификации, с которой их комбинируют. Например, если вариант Fc согласно настоящему изобретению комбинируют с мутантом, который, как известно, связывается с FcγRIIIA с более высокой аффинностью, чем сопоставимая область Fc дикого типа; комбинация с мутантом согласно настоящему изобретению дает в результате большую кратность усиления аффинности FcγRIIIA.
Согласно настоящему изобретению предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, причем вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию (например, обладающая 1, 2, 3, 4, 5, 6, 7, 8, 9 или больше аминокислотными модификациями) относительно области Fc дикого типа так, что молекула характеризуется усиленной эффекторной функцией относительно молекулы, содержащей область Fc дикого типа, при условии, что вариантная область Fc не содержит или не представляет собой только замену на любом одном или нескольких из положений 243, 255, 256, 258, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 300, 301, 303, 305, 307, 309, 312, 320, 322, 326, 329, 330, 332, 331, 333, 334, 335, 337, 338, 339, 340, 359, 360, 373, 376,416, 419, 430, 434, 435, 437, 438, 439. Согласно конкретному варианту осуществления настоящее изобретение предусматривает такие антитела, содержащие вариантную область Fc, причем вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию (например, обладающая 1, 2, 3, 4, 5, 6, 7, 8, 9 или больше аминокислотными модификациями) относительно области Fc дикого типа так, что молекула связывается с FcγR с измененной аффинностью относительно молекулы, содержащей область Fc дикого типа, при условии, что вариантная область Fc не содержит или не представляет собой только замену на любом одном или нескольких из положений 243, 255, 258, 267, 269, 270, 276, 278, 280, 283, 285, 289, 292, 293, 294, 295, 296, 300, 303, 305, 307, 309, 320, 322, 329, 332, 331, 337, 338, 340, 373, 376, 416, 419, 434, 435, 437, 438, 439 и не содержит аланин в любом из положений 256, 290, 298, 312, 326, 333, 334, 359, 360 или 430; аспарагин в положении 268; глутамин в положении 272; глутамин, серии или аспарагиновую кислоту в положении 286; серии в положении 290; метионин в положении 301; метионин, глутамин, глутаминовую кислоту или аргинин в положении 320; глутаминовую кислоту в положении 322; аспарагин, серии, глутаминовую кислоту или аспарагиновую кислоту в положении 326; лизин в положении 330; глутамин в положении 334; глутаминовую кислоту в положении 334; метионин в положении 334; гистидин в положении 334; валин в положении 334; лейцин в положении 334; глутамин в положении 335; лизин в положении 335; или треонин в положении 339.
Согласно настоящему изобретению также предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, причем вариантная область Fc не содержит или не представляет собой только замену на любом одном или нескольких из положений 268, 269, 270, 272, 276, 278, 283, 285, 286, 289, 292, 293, 301, 303, 305, 307, 309, 320, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 416, 419, 430, 434, 435, 437, 438 или 439 и не содержит гистидин, глутамин или тирозин в положении 280; серии, глицин, треонин или тирозин в положении 290, аспарагин в положении 294, лизин в положении 295; пролин в положении 296; пролин, аспарагин, аспарагиновую кислоту или валин в положении 298; или лейцин или изолейцин в положении 300. Согласно другому варианту осуществления настоящее изобретение предусматривает такие антитела, содержащие вариантную область Fc, причем вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию относительно области Fc дикого типа так, что молекула связывается с FcγR со сниженной аффинностью относительно молекулы, содержащей область Fc дикого типа, при условии, что вариантная область Fc не содержит или не представляет собой только замену на любом одном или нескольких из положений 243, 252, 254, 265, 268, 269, 270, 278, 289, 292, 293, 294, 295, 296, 298, 300, 301, 303, 322, 324, 327, 329, 333, 335, 338, 340, 373, 376, 382, 388, 389, 414, 416, 419, 434, 435, 437, 438 или 439. Согласно другому варианту осуществления настоящее изобретение предусматривает такие антитела, содержащие вариантную область Fc, причем вариантная область Fc содержит по меньшей мере одну аминокислотную модификацию относительно области Fc дикого типа так, что молекула связывается с FcγR с усиленной аффинностью относительно молекулы, содержащей область Fc дикого типа, при условии, что вариантная область Fc не содержит или не представляет собой только замену на любом одном или нескольких из положений 280, 283, 285, 286, 290, 294, 295, 298, 300, 301, 305, 307, 309, 312, 315, 331, 333, 334, 337, 340, 360, 378, 398 или 430.
Согласно настоящему изобретению также предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, причем вариантная область Fc не включает в себя или не представляет собой только замену на любом одном или нескольких из положений 330, 243, 247, 298, 241, 240, 244, 263, 262, 235, 269 или 328 и не содержит лейцин в положении 243, аспарагин в положении 298, лейцин в положении 241 и изолейцин или аланин в положении 240, гистидин в положении 244, валин в положении 330 или изолейцин в положении 328.
Согласно настоящему изобретению, в частности, предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc с усиленной эффекторной функцией и/или измененными аффинностями в отношении активирующих и/или ингибирующих рецепторов, причем вариантная область Fc содержит: (а) любую 1, 2, 3, 4, 5 или 6 следующих замен: S239D, S298A, A330L, I332E, Е333А или K334A; или (b) любую из комбинаций замен: (1) S298A, Е333А и K334A; (2) S239D и I332E; или (3) S239D, A330L и I332E.
Согласно настоящему изобретению, в частности, предусмотрены такие антитела, которые содержат вариантную область Fc с усиленной эффекторной функцией и/или измененными аффинностями в отношении активирующих и/или ингибирующих рецепторов, причем вариантная область Fc содержит замену:
(1) в положении 288 на аспарагин, в положении 330 на серии и в положении 396 на лейцин;
(2) в положении 334 на глутаминовую кислоту, в положении 359 на аспарагин и в положении 366 на серии;
(3) в положении 316 на аспарагиновую кислоту, в положении 378 на валин и в положении 399 на глутаминовую кислоту;
(4) в положении 247 на лейцин и замену в положении 421 на лизин;
(5) в положении 392 на треонин и в положении 396 на лейцин;
(6) в положении 221 на глутаминовую кислоту, в положении 270 на глутаминовую кислоту, в положении 308 на аланин, в положении 311 на гистидин, в положении 396 на лейцин и в положении 402 на аспарагиновую кислоту;
(7) в положении 419 на гистидин и замену в положении 396 на лейцин;
(8) в положении 240 на аланин и в положении 396 на лейцин;
(9) в положении 410 на гистидин и в положении 396 на лейцин;
(10) в положении 243 на лейцин, в положении 305 на изолейцин, в положении 378 на аспарагиновую кислоту, в положении 404 на серии и в положении 396 на лейцин;
(11) в положении 255 на изолейцин и в положении 396 на лейцин;
(12) в положении 370 на глутаминовую кислоту и в положении 396 на лейцин;
(13) в положении 270 на глутаминовую кислоту;
или
(14) любую комбинацию вышеупомянутых (1)-(12) замен.
Согласно конкретному варианту осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, которая содержит замену: F243L, R292P и Y300L. Согласно дополнительному конкретному варианту осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, которая содержит замену: L235V, F243L, R292P, Y300L и P396L. Согласно дополнительному конкретному варианту осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, которая содержит замену F243L, R292P, Y300L, V305I и P396L.
Согласно дополнительному конкретному варианту осуществления настоящее изобретение предусматривает антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc, которая содержит замену в положении 396 на лейцин, в положении 270 на глутаминовую кислоту и в положении 243 на лейцин. Согласно другому конкретному варианту осуществления молекула дополнительно содержит одну или несколько аминокислотных модификаций, таких как аминокислотные модификации, раскрытые в настоящем документе.
Согласно настоящему изобретению, в частности, предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc с усиленной эффекторной функцией и/или измененными аффинностями в отношении активирующих и/или ингибирующих рецепторы, которые содержат аминокислотную модификацию в одном или нескольких из следующих положений: 119, 125, 132, 133, 141, 142, 147, 149, 162, 166, 185, 192, 202, 205, 210, 214, 215, 216, 217, 218, 219, 221, 222, 223, 224, 225, 227, 229, 231, 232, 233, 235, 240, 241, 242, 243, 244, 246, 247, 248, 250, 251, 252, 253, 254, 255, 256, 258, 261, 262, 263, 268, 269, 270, 272, 274, 275, 276, 279, 280, 281, 282, 284, 287, 288, 289, 290, 291, 292, 293, 295, 298, 301, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 315, 316, 317, 318, 319, 320, 323, 326, 327, 328, 330, 333, 334, 335, 337, 339, 340, 343, 344, 345, 347, 348, 352, 353, 354, 355, 358, 359, 360, 361, 362, 365, 366, 367, 369, 370, 371, 372, 375, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 404, 406, 407, 408, 409, 410, 411, 412, 414, 415, 416, 417, 419, 420, 421, 422, 423, 424, 427, 428, 431, 433, 435, 436, 438, 440, 441, 442, 443, 446 или 447. Такие мутации предпочтительно приводят в результате к молекулам, которым была предоставлена эффекторная клеточно-опосредованная функция, и необязательно которые характеризуются измененной аффинностью в отношении FcγR согласно определению с использованием способов, раскрытых и проиллюстрированных в настоящем документе и известных специалисту в настоящей области техники.
Согласно настоящему изобретению, в частности, предусмотрены антитела к В7-Н3 и/или антитела против опухолевого ангиогенеза, которые содержат вариантную область Fc с измененной эффекторной функцией и/или измененными аффинностями в отношении активирующих и/или ингибирующих рецепторов, которые содержат следующее:
(I) аминокислотная модификация в одном или нескольких из следующих положений: 235, 240, 241, 243, 244, 247, 262, 263, 269, 298, 328 или 330, и более предпочтительно одну или несколько из следующих модификаций: V240A, V240I, F241L, F243L, Р244Н, S298N, L328I, A330V; причем такие антитела проявляют измененную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация;
(II) аминокислотная модификация в одном или нескольких из следующих положений: 268, 269, 270, 272, 276, 278, 283, 285, 286, 289, 292, 293, 301, 303, 305, 307, 309, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 416, 419, 430, 434, 435, 437, 438 или 439, и более предпочтительно одну или несколько из следующих модификаций: D280H, D280Q, D280Y, K290G, K290S, K290T, K290Y, E294N, Q295K, Y296P, S298D, S298N, S298P, S298V, Y300I, Y300L; причем такие антитела проявляют измененную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация;
(III) аминокислотная модификация в одном или нескольких из следующих положений: 255, 256, 258, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 300, 301, 303, 305, 307, 309, 312, 320, 322, 326, 329, 330, 332, 331, 333, 334, 335, 337, 338, 339, 340, 359, 360, 373, 376, 416, 419, 430, 434, 435, 437, 438, 439, и более предпочтительно одну или несколько из следующих модификаций: Т256А, H268N, E272Q, N286D, N286Q, N286S, K290A, K290S, S298A, R301M, D312A, K320E, K320M, K320Q, K320R, K322E, K326A, K326D, K326E, K326N, K326S, A330K, А339Т, Е333А, K334A, K334E, K334H, K334L, K334M, K334Q, K334V, Т335К, T335Q, Т359А, K360A, Е430А; причем такие антитела проявляют измененную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация;
(IV) аминокислотная модификация в одном или нескольких из следующих положений: 252, 254, 265, 268, 269, 270, 278, 289, 292, 293, 294, 295, 296, 298, 300, 301, 303, 322, 324, 327, 329, 333, 335, 338, 340, 373, 376, 382, 388, 389, 414, 416, 419, 434, 435, 437, 438 или 439; причем такие антитела проявляют сниженную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация;
(V) an аминокислотная модификация в одном или нескольких из следующих положений: 280, 283, 285, 286, 290, 294, 295, 298, 300, 301, 305, 307, 309, 312, 315, 331, 333, 334, 337, 340, 360, 378, 398 или 430; причем такие антитела проявляют усиленную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация;
или
(VI) аминокислотная модификация в одном или нескольких из следующих положений: R255A, Т256А, Е258А, S267A, Н268А, H268N, Е272А, E272Q, N276A, D280A, Е283А, Н285А, N286A, N286D, N286Q, N286S, K290A, K290S, R301M, K320E, K320M, K320Q, K320R, K322E, K326A, K326D, K326E, K326S, A330K, Р331А, T335Q, S337A, Е430А; причем такие антитела проявляют усиленную эффекторную функцию относительно антител, характеризующихся областью Fc дикого типа, в которой отсутствует такая модификация.
Согласно другим вариантам осуществления настоящее изобретение предусматривает применение любого варианта Fc, известного в настоящей области техники, таких как те, которые раскрыты в Jefferis, B.J. et al. (2002) "Interaction Sites On Human IgG-Fc For Fcgamma R: Current Models," Immunol. Lett. 82: 57-65; Presta, L.G. et al. (2002) "Engineering Therapeutic Antibodies For Improved Function," Biochem. Soc. Trans. 30: 487-90; Idusogie, E.E. et al. (2001) "Engineered Antibodies With Increased Activity To Recruit Complement," J. Immunol. 166: 2571-75; Shields, R.L. et al. (2001) "High Resolution Mapping Of The Binding Site On Human IgG1 For Fc Gamma RI, Fc Gamma RII, Fc Gamma RIII, And FcRn And Design Of IgG1 Variants With Improved Binding To The Fc gamma R," J. Biol. Chem. 276: 6591-6604; Idusogie, E.E. et al. (2000) "Mapping Of The C1q Binding Site On Rituxan, A Chimeric Antibody With A Human IgG Fc," J. Immunol. 164: 4178-84; Reddy, M.P. et al. (2000) "Elimination Of Fc Receptor-Dependent Effector Functions Of A Modified IgG4 Monoclonal Antibody To Human CD4," J. Immunol. 164: 1925-1933; Xu, D. et al. (2000) "In Vitro Characterization of Five Humanized OKT3 Effector Function Variant Antibodies," Cell. Immunol. 200: 16-26; Armour, K.L. et al. (1999) "Recombinant human IgG Molecules Lacking Fcgamma Receptor I Binding And Monocyte Triggering Activities" Eur. J. Immunol. 29: 2613-24; Jefferis, R. et al. (1996) "Modulation Of Fc(Gamma)R And Human Complement Activation By IgG3-Core Oligosaccharide Interactions," Immunol. Lett. 54: 101-04; Lund, J. et al. (1996) "Multiple Interactions Of IgG With Its Core Oligosaccharide Can Modulate Recognition By Complement And Human Fc Gamma Receptor I And Influence The Synthesis Of Its Oligosaccharide Chains," J. Immunol. 157: 4963-4969; Hutchins et al. (1995) "Improved Biodistribution, Tumor Targeting, And Reduced Immunogenicity In Mice With A Gamma 4 Variant Of Campath-1H," Proc. Natl. Acad. Sci. (U.S.A.) 92: 11980-84; Jefferis, R. et al. (1995) "Recognition Sites On Human IgG For Fc Gamma Receptors: The Role Of Glycosylation," Immunol. Lett. 44: 111-17; Lund, J. et al. (1995) "Oligosaccharide-Protein Interactions In IgG Can Modulate Recognition By Fc Gamma Receptors," FASEB J. 9: 115-19; Alegre, M.L. et al. (1994) "A Non-Activating "Humanized" Anti-CDS Monoclonal Antibody Retains Immunosuppressive Properties In Vivo," Transplantation 57: 1537-1543; Lund et al. (1992) "Multiple Binding Sites On The CH2 Domain Of IgG For Mouse Fc Gamma RII," Mol. Immunol. 29: 53-59; Lund et al. (1991) "Human Fc Gamma RI And Fc Gamma RII Interact With Distinct But Overlapping Sites On Human IgG," J. Immunol. 147: 2657-2662; Duncan, A.R. et al. (1988) "Localization Of The Binding Site For The Human High-Affinity Fc Receptor On IgG," Nature 332:563-564; патенты США №№5624821; 5885573; 6194551; 7276586 и 7317091; и международные патентные публикации согласно РСТ №№ WO 00/42072 и WO 99/58572.
Согласно настоящему изобретению предусмотрены молекулы, содержащие вариантные области Fc, состоящие из или содержащие любую из мутаций, перечисленных в таблице 2 ниже.
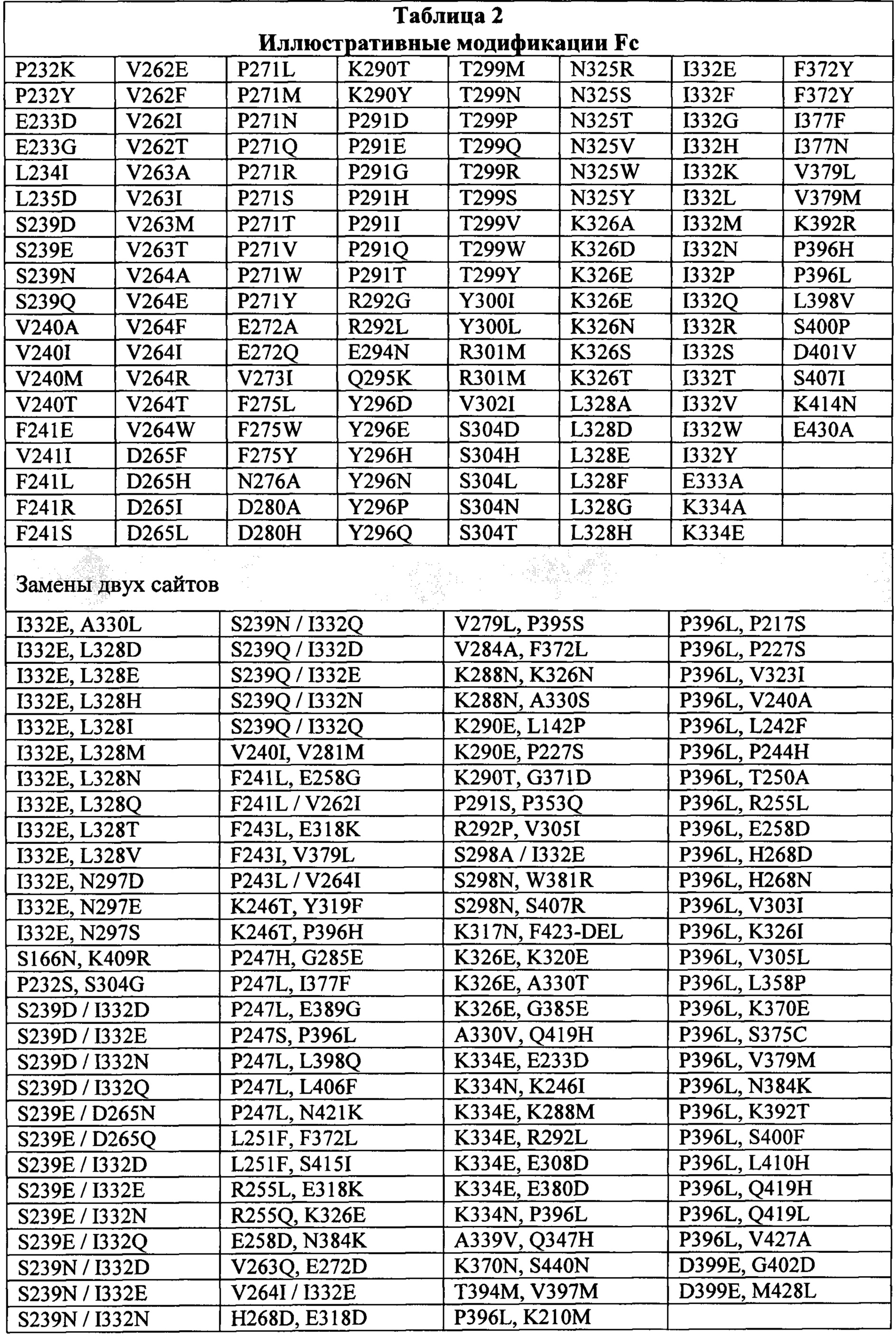

Согласно конкретным вариантам осуществления вариантная область Fc таких антител к В7-Н3 и/или антител против опухолевого ангиогенеза содержит:
(1) лейцин в положении 247, лизин в положении 421 и глутаминовую кислоту в положении 270;
(2) треонин в положении 392, лейцин в положении 396, глутаминовую кислоту в положении 270 и лейцин в положении 243;
(3) гистидин в положении 419, лейцин в положении 396 и глутаминовую кислоту в положении 270;
(4) гистидин в положении 419, лейцин в положении 396, глутаминовую кислоту в положении 270 и лейцин в положении 243;
(5) аланин в положении 240, лейцин в положении 396 и глутаминовую кислоту в положении 270;
(6) лизин в положении 255 и лейцин в положении 396;
(7) лизин в положении 255, лейцин в положении 396 и глутаминовую кислоту в положении 270;
(8) лизин в положении 255, лейцин в положении 396, глутаминовую кислоту в положении 270 и лизин в положении 300;
(9) лизин в положении 255, лейцин в положении 396, глутаминовую кислоту в положении 270 и глицин в положении 292;
(10) лизин в положении 255, лейцин в положении 396, глутаминовую кислоту в положении 270 и лейцин в положении 243;
(11) глутаминовую кислоту в положении 370, лейцин в положении 396 и глутаминовую кислоту в положении 270;
(12) глутаминовую кислоту в положении 270, аспарагиновую кислоту в положении 316 и глицин в положении 416;
(13) лейцин в положении 243, пролин в положении 292, изолейцин в положении 305 и лейцин в положении 396;
(14) лейцин в положении 243, глутаминовую кислоту в положении 270, аспарагин в положении 392 и лейцин в положении 396;
(15) лейцин в положении 243, лейцин в положении 255, глутаминовую кислоту в положении 270 и лейцин в положении 396;
(16) глутамин в положении 297;
или
(17) любую комбинацию вышеупомянутых (1)-(16) замен.
Согласно некоторым вариантам осуществления молекулы согласно настоящему изобретению дополнительно содержат один или несколько сайтов гликозилирования так, что один или несколько углеводных фрагментов ковалентно прикрепляются к молекуле. Предпочтительным является то, что молекулы согласно настоящему изобретению с одним или несколькими сайтами гликозилирования и/или одной или несколькими модификациями в области Fc обеспечивают или характеризуются усиленной антителоопосредованной эффекторной функцией, например, усиленной активностью ADCC, по сравнению с исходным антителом. Согласно некоторым вариантам осуществления настоящее изобретение дополнительно предусматривает молекулы, содержащие одну или несколько модификаций аминокислот, которые, как известно, прямо или опосредованно взаимодействуют с углеводным фрагментом антитела, включая в себя без ограничения аминокислоты в положениях 241, 243, 244, 245, 245, 249, 256, 258, 260, 262, 264, 265, 296, 299 и 301. Аминокислоты, которые прямо или опосредованно взаимодействуют с углеводным фрагментом антитела, известны в настоящей области техники, см., например, Jefferis et al, 1995 Immunology Letters, 44: 111-7, которая полностью включена в настоящий документ посредством ссылки.
Согласно другому варианту осуществления настоящее изобретение предусматривает молекулы, которые были модифицированы для введения одного или нескольких сайтов гликозилирования в один или несколько сайтов молекул, предпочтительно, не изменяя функциональность молекул, например, активность связывания с целевым антигеном или FcγR. Сайты гликозилирования можно ввести в вариабельную и/или константную область молекул согласно настоящему изобретению. Используемый в настоящем документе термин "сайты гликозилирования" включает в себя любую конкретную аминокислотную последовательность в антителе, к которой будет специфически и ковалентно прикрепляться олигосахарид (т.е. углеводы, содержащие два или больше простых сахара, связанным вместе). Олигосахаридные боковые цепи, как правило, соединены с каркасом антитела посредством или N-, или О-связей. N-связанное гликозилирование относится к прикрепление олигосахаридного фрагмента к боковой цепи остатка аспарагина. О-связанное гликозилирование относится к прикреплению олигосахаридного фрагмента к гидроксиаминокислоте, например, серину, треонину. Молекулы согласно настоящему изобретению могут содержать один или несколько сайтов гликозилирования, включая в себя N-связанные и О-связанные сайты гликозилирования. Любой сайт гликозилирования для N-связанного или О- связанного гликозилирования, известный в настоящей области техники, можно использовать согласно настоящему изобретению. Иллюстративный N-связанный сайт гликозилирования, который является применимым согласно способам настоящего изобретения, представляет собой аминокислотную последовательность: Asn-X-Thr/Ser, причем X может представлять собой любую аминокислоту, и Thr/Ser обозначает треонин или серии. Такой сайт или сайты можно ввести в молекулу согласно настоящему изобретению с использованием способов, хорошо известных в настоящей области техники, к которой принадлежит настоящее изобретение (см. например, In vitro Mutagenesis, Recombinant DNA: A Short Course, J. D. Watson, et al. W.H. Freeman and Company, New York, 1983, chapter 8, pp.106-116, которая полностью включена в настоящий документ посредством ссылки. Иллюстративный способ введения сайта гликозилирования в молекулу согласно настоящему изобретению может предусматривать следующее: модификация или мутация аминокислотной последовательности молекулы так, чтобы получить требуемую последовательность Asn-X-Thr/Ser.
Согласно некоторым вариантам осуществления настоящее изобретение предусматривает способы модификации углеводного содержимого молекулы согласно настоящему изобретению путем добавления или делеции сайта гликозилирования. Способы модификации углеводного содержимого антител хорошо известны в настоящей области техники и предусмотрены в пределах настоящего изобретения, см., например, патент США№6218149; европейский патент № ЕР 0359096 В1; патентную публикацию США №US 2002/0028486; международную патентную публикацию WO 03/035835; патентную публикацию США №US 2003/0115614; патент США №6218149; патент США №6472511; причем все документы полностью включены в настоящий документ посредством ссылки. Согласно другим вариантам осуществления настоящее изобретение предусматривает способы модификации углеводного содержимого молекулы согласно настоящему изобретению путем делеции одного или нескольких эндогенных углеводных фрагментов молекулы. Согласно конкретному варианту осуществления настоящее изобретение предусматривает сдвиг сайта гликозилирования области Fc антитела путем модификации положений, смежных с 297. Согласно конкретному варианту осуществления настоящее изобретение предусматривает модификацию положения 296 так, чтобы положение 296, а не положение 297 было гликозилировано.
Эффекторную функцию также можно модифицировать с помощью таких техник, как введение одного или нескольких остатков цистеина в Fc область, тем самым обеспечивая возможность образования дисульфидной связи между цепями в указанной области, что приводит в результате к созданию гомодимерного антитела, которое может характеризоваться улучшенной способностью к интернализации и/или увеличенным комплемент-опосредованным уничтожением клеток и ADCC (Caron, Р.С. et al. (1992) "Engineered Humanized Dimeric Forms Of IgG Are More Effective Antibodies" J. Exp. Med. 176: 1191-1195; Shopes, B. (1992) "A Genetically Engineered Human IgG Mutant With Enhanced Cytolytic Activity" J. Immunol. 148(9): 2918-2922. Гомодимерные антитела с усиленной противоопухолевой активностью также можно получить с использованием гетеробифункциональных перекрестных линкеров согласно описанию в Wolff, Е.А. et al. (1993) "Monoclonal Antibody Homodimers: Enhanced Antitumor Activity In Nude Mice" Cancer Research 53: 2560-2565. Альтернативно, можно сконструировать антитело, которое характеризуется двойными областями Fc и благодаря этому может характеризоваться усиленными способностями к опосредованному комплементом лизису и ADCC (Stevenson, G.T. et al. (1989) "A Chimeric Antibody With Dual Fc Regions (bisFabFc) Prepared By Manipulations At The IgG Hinge," Anti-Cancer Drug Design 3: 219- 230).
Диатела к B7-H3/против опухолевого ангиогенеза
Как обсуждалось выше, настоящее изобретение дополнительно предусматривает молекулы диатела (особенно, "DART™" (переориентирующийся реагент с двойной аффинностью)), которые содержат по меньшей мере две ковалентно связанные полипептидных цепи, которые образуют по меньшей мере два сайта связывания с эпитопом, один из которых специфически связывается с В7-H3, а второй из которых связывается с фактором клеточной поверхности (или его рецептором), который вовлечен в стимуляцию опухолевого ангиогенеза. Наиболее предпочтительно, такие диатела будут связываться с В7-Н3 и VEGF или с В7-Н3 и VEGFR.
Согласно предпочтительным вариантам осуществления первая полипептид цепь диатела содержит:
(i) домен (А), содержащий связывающую область вариабельного домена легкой цепи первого иммуноглобулина (VL1), специфическую в отношении эпитопа В7-Н3;
(ii) домен (В), содержащий связывающую область вариабельного домена тяжелой цепи второго иммуноглобулина (VH2), специфическую в отношении эпитопа или VEGF, или VEGFR; и
(iii) необязательно, домен (С).
Вторая полипептидная цепь такого диатела содержит:
(i) домен (D), содержащий связывающую область вариабельного домена легкой цепи второго иммуноглобулина (VL2), специфическую в отношении такого эпитопа или VEGF, или эпитопа VEGFR;
(ii) домен (Е), содержащий связывающую область вариабельного домена тяжелой цепи первого иммуноглобулина (VH1), специфическую в отношении такого эпитопа В7-Н3;и
(iii) необязательно, домен (F).
Вариабельные домены первой и второй полипептидных цепей могут альтернативно меняться местами так, что первая полипептидная цепь диатела содержит:
(i) домен (А), содержащий связывающую область вариабельного домена легкой цепи второго иммуноглобулина (VL2), специфическую в отношении такого эпитопа или VEGF, или эпитопа VEGFR;
(ii) домен (В), содержащий связывающую область вариабельного домена тяжелой цепи первого иммуноглобулина (VH1), специфическую в отношении такого эпитопа В7- Н3;и
(iii) необязательно, домен (С);
и вторая полипептидная цепь такого диатела содержит:
(i) домен (D), содержащий связывающую область вариабельного домена легкой цепи первого иммуноглобулина (VL1), специфическую в отношении эпитопа В7-Н3;
(ii) домен (Е), содержащий связывающую область вариабельного домена тяжелой цепи второго иммуноглобулина (VH2), специфическую в отношении эпитопа или VEGF, или VEGFR; и
(iii) необязательно, домен (F).
Домены (А) и (В) диатело не ассоциируются друг с другом с образованием сайта связывания с эпитопом. Аналогично, домены (D) и (Е) диатела не ассоциируются друг с другом с образованием сайта связывания с эпитопом. Напротив, домены (А) и (Е) диатела ассоциируются с образованием сайта связывания, который связывается с эпитопом В7-H3, и домены (В) и (D) диатела ассоциируются с образованием сайта связывания, который связывается с эпитопом VEGF или VEGFR.
Ни домен VH, ни домен VL любой полипептидной цепи не ограничен каким-либо положением в пределах полипептидной цепи, т.е. не ограничен амино (N) или карбокси (С) концом, а также не представляют собой домены, ограниченные в своих относительных положениях друг другом, т.е. домен VL может являться N-концевым по отношению к домену VH и наоборота. Единственным ограничением является то, что комплементарная полипептидная цепь является доступной для образования функционального диатела.
Если они присутствуют, домены (С) и (F) ковалентно соединены друг с другом. Домены (С) и (F) могут представлять собой домен Fc или его часть (например, домен СН2 или домен CH3). Домен Fc или его часть может происходить из любого изотипа или аллотипа иммуноглобулина, включая в себя без ограничения IgA, IgD, IgG, IgE и IgM. Согласно предпочтительным вариантам осуществления домен Fc (или его часть) происходит из IgG. Согласно конкретным вариантам осуществления изотип IgG представляет собой IgG1, IgG2, IgG3 или IgG4 или их аллотип. Согласно одному варианту осуществления молекула диатела содержит домен Fc, причем домен Fc содержит домен СН2 и домен СН3, независимо выбранный из любого изотипа иммуноглобулина (т.е. домен Fc содержит домен СН2, происходящий из IgG, и домен СН3, происходящий из IgE, или домен СН2, происходящий из IgG1, и домен СН3, происходящий из IgG2 и т.д.). Домен Fc можно сконструировать в полипептидную цепь, содержащую молекулу диатела согласно настоящему изобретению в любом положении относительные других доменов или частей указанной полипептидной цепи (например, домен Fc или его часть могут являться C-концевыми относительно как доменов VL, так и доменов VH полипептида цепи; могут являться N-концевыми относительно как доменов VL, так и доменов VH; или могут являться N-концевыми относительно одного домена и C-концевыми относительно другого (т.е. между двумя доменами полипептидной цепи)).
Домены Fc в полипептидных цепях молекул диатела предпочтительно димеризуются, приводя в результате к образованию молекулы диатела, которая проявляет иммуноглобулиноподобные свойства, например, взаимодействия Fc-FcγR. Содержащие Fc диатела могут представлять собой димеры, например, состоящие из двух полипептидных цепей, каждая из которых содержит домен VH, домен VL и домен Fc. Димеризация указанных полипептидных цепей дает в результате к бивалентное диатело, содержащее домен Fc, несмотря на то, что структура отличается от таковой у немодифицированного бивалентного антитела. Такие молекулы диатела будут проявлять измененные фенотипы относительно иммуноглобулина дикого типа, например, измененный период полужизни в сыворотке, свойства связывания и т.д. Согласно другим вариантам осуществления молекулы диатела, содержащие домены Fc, могут представлять собой тетрамеры. Такие тетрамеры содержат две 'более тяжелых' полипептидных цепи, т.е. полипептидную цепь, содержащую домен VL, VH и Fc, и две 'более легких' полипептидных цепи, т.е. полипептидную цепь, содержащую VL и VH. Более тяжелые и более легкие цепи взаимодействуют с образованием мономера, и указанные мономеры взаимодействуют через свои неспаренные домены Fc с образованием Ig-подобной молекулы. Такое Ig-подобное диатело является тетравалентным.
Образование молекулы тетраспецифического диатела, как описано ранее, требует взаимодействия четырех отличающихся полипептидных цепей. Такие взаимодействия являются трудными в осуществлении с эффективностью в пределах отдельной клеточной системы рекомбинантной продукции вследствие того, что многие варианты потенциальной цепи образуют пары ошибочно. Одно из решений по снижению вероятности ошибочного спаривания является конструирование мутация типа "выступы- во-впадины" в требуемых парах полипептидных цепей. Такие мутации обеспечивают преобладание гетеродимеризации по сравнению с гомодимеризацией. Например, в отношении взаимодействий Fc-Fc аминокислотную замену (предпочтительно замену на аминокислоту, содержащую объемную боковую группу, образующую 'выступ', например, триптофан) можно ввести в домен СН2 или СН3 так, чтобы стерическая помеха препятствовала взаимодействию с аналогично мутированным доменом и заставляла мутированный домен образовывать пару с доменом, в котором комплементарная, или принимающая мутация была сконструирована, т.е. 'впадина' (например, замена на глицин). Такие наборы мутаций можно сконструировать в любой паре полипептидов, содержащих молекулу диатела, и дополнительно сконструировать в любой части полипептидных цепей указанной пары. Способы конструирования белков для обеспечения преобладания гетеродимеризации по сравнению с гомодимеризацией хорошо известны в настоящей области техники, в частности, в отношении конструирования иммуноглобулиноподобных молекул, и предусмотрены в настоящем документе (см., например, Ridgway et al. (1996) "'Knobs-Into-Holes' Engineering Of Antibody CHS Domains For Heavy Chain Heterodimerization," Protein Engr. 9: 617-621, Atwell et al. (1997) "Stable Heterodimers From Remodeling The Domain Interface Of A Homodimer Using A Phage Display Library, " J. Mol. Biol. 270: 26-35, и Xie et al. (2005) "A New Format Of Bispecific Antibody: Highly Efficient Heterodimerization, Expression And Tumor Cell Lysis," J. Immunol. Methods 296: 95-101; причем каждый документ полностью включен в настоящий документ посредством ссылки.
Согласно настоящему изобретению также предусмотрены молекулы диатела, содержащие вариантные домены Fc или вариантные домены шарнир-Fc (или их часть), причем вариантный домен Fc содержит по меньшей мере одну аминокислотную модификацию (например, замену, вставку, делецию) относительно сопоставимого домена Fc или домена шарнир-Fc дикого типа (или их части). Молекулы, содержащие вариантные домены Fc или домены шарнир-Fc (или их часть) (например, антитела), как правило, характеризуются измененными фенотипами относительно молекул, содержащих домены Fc или домены шарнир-Fc или их части дикого типа. Вариантный фенотип может выражаться как измененный период полужизни в сыворотке, измененная стабильность, измененная чувствительность к клеточным ферментам или измененная эффекторная функция согласно исследованиям в NK-зависимом или макрофаг-зависимом анализе. Модификации домена Fc, идентифицированные как изменяющие эффекторную функцию, раскрыты выше.
Согласно настоящему изобретению также предусмотрены молекулы, содержащие шарнирный домен. Шарнирный домен происходит из любого изотипа или аллотипа иммуноглобулина, включая в себя IgA, IgD, IgG, IgE и IgM. Согласно предпочтительным вариантам осуществления шарнирный домен происходит из IgG, причем изотип IgG представляет собой IgG1, IgG2, IgG3 или IgG4 или их аллотип.Указанный шарнирный домен может быть сконструирован в полипептидную цепь, содержащую молекулу диатела, вместе с доменом Fc так, чтобы молекула диатела содержала домен шарнир-Fc. Согласно определенным вариантам осуществления шарнирный домен и домен Fc независимо выбраны из любого изотипа иммуноглобулина, известного в настоящей области техники или проиллюстрированного в настоящем документе. Согласно другим вариантам осуществления шарнирный домен и домен Fc отделены по меньшей мере одним другим доменом полипептидной цепи, например, доменом VL. Шарнирный домен или необязательно домен шарнир-Fc могут быть сконструированы в полипептид согласно настоящему изобретению в любом положении относительно других доменов или частей указанной полипептидной цепи. Согласно определенным вариантам осуществления полипептидная цепь согласно настоящему изобретению содержит шарнирный домен, причем шарнирный домен находится на С-конце полипептидной цепи, причем указанная полипептидная цепь не содержит домен Fc. Согласно другим вариантам осуществления полипептидная цепь согласно настоящему изобретению содержит домен шарнир-Fc, причем домен шарнир-Fc находится на С-конце полипептидной цепи. Согласно дополнительным вариантам осуществления полипептидная цепь согласно настоящему изобретению содержит домен шарнир-Fc, причем домен шарнир-Fc находится на N-конце полипептидной цепи.
Каждый домен полипептидной цепи диатела, т.е. домен VL, VH и Fc, может быть отделен пептидным линкером. Пептидный линкер может составлять 0, 1, 2, 3, 4, 5, 6, 7, 8, или 9 аминокислот в длину. Согласно определенным вариантам осуществления аминокислотная последовательность линкера представляет собой GGGSGGGG (SEQ ID NO:97), кодируемая последовательностью нуклеиновой кислоты ggaggcggat ccggaggcgg aggc (SEQ ID NO:98). Полипептидные цепи молекулы диатела могут быть сконструированы так, чтобы содержать по меньшей мере один остаток цистеина, который будет взаимодействовать с эквивалентным остатком цистеина на второй полипептидной цепи диатела с образованием межцепочечной дисульфидной связи. Такие межцепочечные дисульфидные связи служат для стабилизации молекулы диатела, тем самым улучшая экспрессию и выделение в рекомбинантных системах, давая в результате стабильный и однородный состав и улучшая стабильность выделенного и/или очищенного продукта in vivo. Остаток цистеина можно ввести в качестве единственной аминокислоты или как часть большей аминокислотной последовательности, например, шарнирного домена, в любую часть полипептидной цепи. Согласно конкретному варианту осуществления остаток цистеина можно сконструировать так, чтобы он оказался на С-конце полипептидной цепи. Согласно некоторым вариантам осуществления остаток цистеина вводят в полипептидную цепь в пределах аминокислотной последовательности: LGGC (SEQ ID NO:99). Согласно конкретному варианту осуществления С-конец полипептидных цепей, содержащих молекулы диатела согласно настоящему изобретению, содержит аминокислотную последовательность LGGC (SEQ ID NO:99). Согласно другому варианту осуществления остаток цистеина вводят в полипептид в пределах аминокислотной последовательности, содержащей шарнирный домен, например, EPKSCDKTHTCPP (SEQ ID NO:100) или ESKYGPPCPS (SEQ ID NO:101). Согласно конкретному варианту осуществления С-конец полипептидной цепи молекулы диатела согласно настоящему изобретению содержит аминокислотную последовательность шарнирного домена IgG, например, SEQ ID NO:100 или SEQ ID NO:101. Согласно другому варианту осуществления С-конец полипептидной цепи молекулы диатела согласно настоящему изобретению содержит аминокислотную последовательность VEPKSC (SEQ ID NO:102), которая может кодироваться нуклеотидной последовательностью gttgagccca aatcttgt (SEQ ID NO:103). Согласно другим вариантам осуществления остаток цистеина вводят в полипептидную цепь в пределах аминокислотной последовательности LGGCFNRGEC (SEQ ID NO:104), которая может кодироваться нуклеотидной последовательностью ctgggaggct gcttcaacag gggagagtgt (SEQ ID NO:105). Согласно конкретному варианту осуществления С-конец полипептидной цепи, содержащей диатело согласно настоящему изобретению, содержит аминокислотную последовательность LGGCFNRGEC (SEQ ID NO:104). Согласно другим вариантам осуществления остаток цистеина вводят в полипептидную цепь в пределах аминокислотной последовательности FNRGEC (SEQ ID NO:106), которая может кодироваться нуклеотидной последовательностью ttcaacaggg gagagtgt (SEQ ID NO:107). Согласно конкретному варианту осуществления С-конец полипептидной цепи, содержащей диатело согласно настоящему изобретению, содержит аминокислотную последовательность FNRGEC (SEQ ID NO:106).
Согласно определенным вариантам осуществления молекула диатела содержит по меньшей мере две полипептидных цепи, каждая из которых содержит аминокислотную последовательность LGGC (SEQ ID NO:99), и они ковалентно соединены с помощью дисульфидной связи между остатками цистеина в последовательностях LGGC (SEQ ID NO:99). Согласно другому конкретному варианту осуществления молекула диатела содержит по меньшей мере две полипептидных цепи, одна из которых содержит последовательность FNRGEC (SEQ ID NO:106), тогда как другая содержит шарнирный домен (содержащий по меньшей мере один остаток цистеина), причем указанные по меньшей мере две полипептидных цепи ковалентно соединены с помощью дисульфидной связи между остатком цистеина в FNRGEC (SEQ ID NO:106) и остатком цистеина в шарнирном домене. Согласно конкретным аспектам остаток цистеина, отвечающий за дисульфидную связь, расположенный в шарнирном домене, представляет собой Cys-128 (пронумерованный согласно нумерации Kabat EU; расположенный в шарнирном домене немодифицированной, интактной тяжелой цепи IgG) и эквивалентный остаток цистеина представляет собой Cys-214 (пронумерованный согласно нумерации Kabat EU; расположенный на С-конце немодифицированной, интактной легкой цепи IgG) (Elkabetz et al. (2005) "Cysteines In CHI Underlie Retention Of Unassembled Ig Heavy Chains," J. Biol. Chem. 280: 14402-14412). Согласно другим вариантам осуществления по меньшей мере один остаток цистеина сконструирован так, чтобы находиться на N-конце аминокислотной цепи. Согласно другим вариантам осуществления по меньшей мере один остаток цистеина сконструирован так, чтобы находиться в линкерной части полипептидной цепи молекулы диатела. Согласно дополнительным вариантам осуществления домен VH или VL сконструирован так, чтобы содержать по меньшей мере одну аминокислотную модификацию относительно исходного домена VH или VL так, чтобы указанная аминокислотная модификация содержала замену исходной аминокислоты на цистеин.
Согласно другому аспекту настоящего варианта осуществления домен (С) первой полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:102), происходящую из шарнирного домена IgG человека, и которая может кодироваться нуклеотидной последовательностью gttgagccca aatcttgt (SEQ ID NO:103). Согласно другому аспекту настоящего варианта осуществления домен (F) второй полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:102). Согласно определенным аспектам настоящего варианта осуществления домен (С) первой полипептидной цепи содержит 6 C-концевых аминокислот каппа-легкой цепи человека, FNRGEC (SEQ ID NO:106); и домен (F) второй полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:102) или шарнирный домен. Согласно другим аспектам настоящего варианта осуществления домен (F) второй полипептидной цепи содержит 6 C-концевых аминокислот каппа-легкой цепи человека, FNRGEC (SEQ ID NO:106); и домен (С) первой полипептидной цепи содержит аминокислотную последовательность VEPKSC (SEQ ID NO:102) или шарнирный домен.
Ввиду описанного выше, будет понятно, что индивидуальные полипептиды биспецифического диатела могут образовывать два вида гомодимеров и один вид гетеродимера. Согласно одному варианту осуществления настоящего изобретения заряженный полипептид можно добавить к С-концу одного или более предпочтительно обоих полипептидов диатела. Путем выбора заряженных полипептидов противоположного заряда для индивидуальных полипептидов биспецифического диатела, включение таких заряженных полипептидов обеспечивает преимущественное образование гетеродимеров и уменьшает образование гомодимеров. Предпочтительно, что положительно заряженный полипептид будет содержать значительное содержание аргинина, глутамина, гистидина и/или лизина (или смеси таких аминокислот), и отрицательно заряженный полипептид будет содержать значительное содержание аспартата или глутамата (или смесь таких аминокислот). Положительно заряженные полипептиды, содержащие значительное содержание лизина, и отрицательно заряженные полипептиды, содержащие значительное содержание глутамата, являются особенно предпочтительными. Для того, чтобы сделать электрическое притяжение между такими противоположно заряженными полипептидами максимальным, предпочтительное использовать полипептиды, способные спонтанно приобретать спиральную конформацию.
Таким образом, согласно предпочтительному варианту осуществления положительно заряженная "Е-спираль" будет присоединена к одному из полипептидов, используемых для образования биспецифического диатела, и отрицательно заряженная "К-спираль" будет присоединена ко второму из полипептидов диатела. Особенно предпочтительная Е-спираль будет характеризоваться последовательностью: (EVAALEK)4 [т.е. (SEQ ID NO:108) EVAALEKEVAALEKEVAALEKEVAALEK]. Особенно предпочтительная К-спираль будет характеризоваться последовательностью: (KVAALKE)4 [т.е. (SEQ ID NO:109) KVAALKEKVAALKEKVAALKEKVAALKE].
Предпочтительный полипептид диатела, обладающий такой Е-спиралью, будет характеризоваться общей последовательностью: [домен VL]-[GGGSGGGG]-[домен VH]-[(EVAALEK)4]-GGGNS, где VL представляет собой вариабельный домен легкой цепи Ig диатела, GGGSGGGG представляет собой SEQ ID NO:97, VH представляет собой вариабельный домен тяжелой цепи Ig диатела, (EVAALEK)4 представляет собой SEQ ID NO:108, и GGGNS представляет собой SEQ ID NO:110. Предпочтительный полипептид диатела, обладающий такой K-спиралью, будет характеризоваться общей последовательностью: [домен VL]-[GGGSGGGG]-[домен VH]-[(KVAALKE)4]- GGGNS, где VL представляет собой вариабельный домен легкой цепи Ig диатела, GGGSGGGG представляет собой SEQ ID NO:97, VH представляет собой вариабельный домен тяжелой цепи Ig диатела, (KVAALKE)4 представляет собой SEQ ID NO:109, и GGGNS представляет собой SEQ ID NO:110.
Согласно дополнительному варианту осуществления Fc-области могут быть соединены с Е- и/или K-спиралями или Е- и/или K-спиральными диателами. Содействие в разделении между областями Fc и доменом VH диатела содержащего Fc диатела является желательным в случаях, в которых менее отдельное расположение таких доменов приводит к ослабленному взаимодействию между такими доменами и их связывающими лигандами или иным образом препятствует сборке диатела. Хотя можно использовать разделители любой аминокислотной последовательности, предпочтительно использовать разделитель, который образует α-закрученную спираль с тем, чтобы максимально отдалить и перенести домен Fc от вариабельных доменов. Поскольку вышеописанные спиральные полипептиды противоположного заряда дополнительно функционируют для стимуляции образования гетеродимера, такие молекулы являются особенно предпочтительными разделителями. Такие содержащие спираль молекулы Fc-диатела обеспечивают преимущества, сходные с теми, которые характерны для Fc-диател, включая в себя улучшенный период полужизни в сыворотке и активацию эффекторных функций. Вышеописанные E-спиральные и K-спиральные полипептиды являются особенно предпочтительными по этой причине. Таким образом, согласно предпочтительному варианту осуществления E-спиральное содержащее Fc диатело будет характеризоваться общей последовательностью: [домен VL]-[GGGSGGGG]-[домен VH]-[(EVAALEK)4]-GGG-домен Fc, начинаясь с D234 (нумерация согласно Kabat), где VL представляет собой вариабельный домен легкой цепи Ig диатела, GGGSGGGG представляет собой SEQ ID NO:97, VH представляет собой вариабельный домен тяжелой цепи Ig диатела, и (EVAALEK)4 представляет собой SEQ ID NO:108. Аналогично, согласно предпочтительному варианту осуществления K-спиральное содержащее Fc диатело будет характеризоваться общей последовательностью: [домен VL]-[GGGSGGGG]-[домен VH]-[(KVAALKE)4]-GGG-домен Fc, начинаясь с D234 (нумерация согласно Kabat), где VL представляет собой вариабельный домен легкой цепи Ig диатела, GGGSGGGG представляет собой SEQ ID NO:97, VH представляет собой вариабельный домен тяжелой цепи Ig диатела, и (KVAALKE)4 представляет собой SEQ ID NO:109.
Как указано выше, содержащая спираль молекула диатело или содержащая спираль Fc-содержащая молекула диатела может содержать только один такой спиральный разделитель, или она может содержать больше одного такого разделителя (например, два разделителя, предпочтительно противоположного заряда, из которых один соединен с каждым из домена VH полипептидов диатела). Путем связывания области Fc с такой(ими) молекулой(ами) разделителя усиливается способность образовывать бивалентные, тетравалентные и т.д. версии молекул Fc-диатела путем перестановки цепей. Таким образом, можно получить молекулы Fc-диатела, которые образуют мономеры или димеры в зависимости от того, связан ли домен Fc с одним или обоими доменами VH диатела.
Терапевтические способы
Антитела (или диатела), которые специфически связываются с В7-Н3 или фактором клеточной поверхности (или его рецептором), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептором, VEGFR), можно использовать для терапевтических целей в отношении индивидуумов со злокачественной опухолью или другими заболеваниями. Согласно одному варианту осуществления молекула(ы), обеспечивающая(ие) такие активности связывания, вводят одновременно. Предусмотрено, что используемое в настоящем документе такое "одновременное" введение обозначает следующее:
А. введение одной фармацевтической композиции, которая содержит как молекулу, характеризующуюся связывающей способностью, специфической в отношении В7-H3, и молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептора, VEGFR). Такие молекулы могут представлять собой одну и ту же молекулу (например, диатело, или могут отличаться (например, антитело к В7-Н3 или его антигенсвязывающий фрагмент и антитело к VEGF или его антигенсвязывающий фрагмент; или
В. отдельное введение двух или больше фармацевтических композиций, одна композиция из который содержит молекулу, характеризующуюся связывающей способностью, специфической в отношении В7-H3, и другая композиция из которых содержит молекулу, характеризующуюся связывающей способностью, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептора, VEGFR), причем вторую вводимую композицию вводят в пределах 1 биологического периода полужизни после введения первой вводимой молекулы или в пределах 2, 3, 4, 5, 6, 7, 8, 9 или 10 периодов полужизни после введения первой вводимой композиции. Бевацизумаб характеризуется расчетным периодом полужизни, составляющим приблизительно 20 дней. Расчетный период полужизни гуманизированного антитела к В7-Н3 составляет 2-3 недели.
Согласно второму варианту осуществления используют две отдельных молекулы и молекулы вводят "последовательно" (например, антитело к VEGF вводят и в позднее вводят антитело к В7-Н3 или наоборот). При таком последовательном введении вторую вводимую композицию вводят по меньшей мере через 10 периодов полужизни после введения первой вводимой композиции.
Терапия с помощью таких молекул может предусматривать образование комплексов как in vitro, так и in vivo. Согласно одному варианту осуществления моноклональное антитело к В7-Н3 и моноклональное антитело к VEGF (особенно его химерные или гуманизированные варианты) можно использовать для иммунотерапии, направленной на васкуляризированные опухолевые клетки различных тканей, и в частности, такие злокачественные опухолевые клетки, как злокачественная опухоль молочной железы, глиобластома, карцинома шейки матки, метастазирующая злокачественная опухоль толстой и прямой кишки, злокачественная опухоль желудка, гепатоклеточная карцинома, лейкоз, злокачественная опухоль легкого, метастазирующая меланома, васкуляризированная злокачественная опухоль поджелудочной железы и метастазирующая злокачественная опухоль предстательной железы. Такая иммунотерапия, например, может являться достаточной для снижения деления клеток в контексте злокачественных опухолевых клеток, задержки развития (например, появления и степени) метастазирования или обеспечения паллиативного лечения в отношении злокачественной опухоли. Паллиативное лечение индивидуума со злокачественной опухолью предусматривает лечение или уменьшение неблагоприятных симптомов заболевания или ятрогенных симптомов, являющихся результатом других видов лечения, вводимых в отношении заболевания, без прямого воздействия на прогрессирование злокачественной опухоли. Оно включает в себя виды лечения для облегчения боли, приема пищи, проблем сексуального характера, психологического стресса, депрессии, утомляемости, психиатрических нарушений, тошноты, рвоты и т.д.
Следует понимать, что антитело вводят в концентрации, которая стимулирует связывание при физиологических (например, in vivo) условиях. Антитела (или диатела) можно вводить совместно с дополнительными средствами, которые усиливают или управляют собственным иммунным ответом индивидуума, такими как средство, которое усиливает ADCC.
Согласно другому варианту осуществления одно или несколько таких антител или диател можно конъюгировать или связывать с радиоактивной молекулой, токсином (например, калихеамицином), химиотерапевтической молекулой, липосомами или другими везикулами, содержащими химиотерапевтические соединения и вводимые индивидууму, нуждающемуся в таком лечения для нацеливания указанных соединений на злокачественную опухолевую клетку, содержащую антиген, распознаваемый антителом, и, таким образом, устраняя злокачественные опухолевые или подвергнутые заболеванию клетки. Не ограничиваясь какой-либо конкретной теорией, антитело (например, антитело к В7-Н3) интернализуется клеткой, несущей В7-Н3 на своей поверхности, таким образом, доставляя конъюгированный фрагмент к клетке с индукцией терапевтического эффекта, и антитело (или диатело), которое специфически связывается с фактором клеточной поверхности (или его рецептором), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептором, VEGFR) ингибирует васкуляризацию опухоли.
Согласно другому варианту осуществления такие антитела или диателам можно использовать в качестве адъювантной терапии во время хирургического удаления опухоли для задержки, подавления или предотвращения развития метастазирования. Антитело также можно вводить перед операцией (неоадъювантная терапия) для снижения размера опухоли, и, таким образом, обеспечивая возможность проведения операции или упрощая ее, сохраняя ткань во время операции и/или уменьшая какой-либо полученный в результате физический недостаток.
Дозировка согласно клеточному циклу предусмотрена в практике настоящего изобретения. Согласно таким вариантам осуществления химиотерапевтическое средство используют для синхронизации клеточного цикла опухоли или других целевых подверженных заболеванию клеток на заданной стадии. Впоследствии производят введение антител согласно настоящему изобретению (отдельно или вместе с дополнительными терапевтическими фрагментами). Согласно альтернативным вариантам осуществления антитело к В7-Н3 используют для синхронизации клеточного цикла и снижения клеточного деления перед введением второго цикла лечения; во втором цикле могут вводить антитело к В7-Н3 и антитело (или диатело), которое специфически связывается с фактором клеточной поверхности (или его рецептором), который вовлечен в стимуляцию опухолевого ангиогенеза (особенно VEGF или его рецептором, VEGFR), отдельно или вместе с дополнительным терапевтическим фрагментом.
Химиотерапевтические средства включают в себя радиоактивные молекулы, токсины, также носящие название цитотоксины или цитотоксические средства, которые включают в себя любое средство, которое является вредным для жизнеспособности злокачественных опухолевых клеток, средства и липосомы или другие носители, содержащие химиотерапевтические соединения. Примеры подходящих химиотерапевтических средств включают в себя без ограничения следующее: 1-дегидротестостерон, 5-фторурацил декарбазин, 6-меркаптопурин, 6-тиогуанин, актиномицин D, адриамицин, алдеслейкин, алкилирующие средства, аллопуринол натрия, алтретамин, амифостин, анастразол, антрамицин (АМС)), антимитотически средства, цис-дихлордиамин платины (II) (DDP) цисплатин), диаминодихлорплатина, антрациклины, антибиотики, антиметаболииты, аспарагиназа, BCG живой (интравезикальный), бетаметазон натрия фосфат и бетаметазон ацетат, бикалутамид, блеомицин сульфат, бусульфан, лейковорин кальция, калихеамицин, капецитабин, карбоплатин, ломустин (CCNU), кармустин (BSNU), хлорамбуцил, цисплатин, кладрибин, колхицин, конъюгированные эстрогены, циклофосфамид, циклотосфамид, цитарабин, цитохалазин В, цитоксан, дакарбазин, дактиномицин, дактиномицин (ранее актиномицин), даунорубицин HCL, даунорубицин цитрат, денилейкин дифтитокс, дексразоксан, дибромманнит, дигидроксиантрациндион, доцетаксел, доласетрон мезилат, доксорубицин HCL, дронабинол, L-аспарагиназа Е. coli, эментин, эпоэтин альфа, L-аспарагиназа Erwinia, эстерифицированные эстрогены, эстрадиол, эстрамустин фосфат натрия, этидия бромид, этинилэстрадиол, этидронат, этопозид цитроворум-фактор, этопозид фосфат, филграстим, флоксуридин, флуконазол, флударабин фосфат, фторпиримидин-иринотекан, фторпиримидин-оксалиплатин, фторурацил, флутамид, фолиниевая кислота, гемцитабин HCL, глюкокортикоиды, госерелин ацетат, грамицидин D, гранисетрон HCL, гидроксимочевина, идарубицин HCL, ифосфамид, интерферон альфа-2b, иринотекан HCL, летрозол, лейковорин кальция, лейпролид ацетат, левамизол HCL, лидокаин, ломустин, майтансиноид, мехлорэтамин HCL, медроксипрогестерон ацетат, мегестрол ацетат, мелфалан HCL, меркаптипурин, месна, метотрексат, метилтестостерон, митрамицин, митомицин С, митотан, митоксантрон, нилутамид, октреотид ацетат, ондансетрон HCL, паклитаксел, памидронат динатрия, пентостатин, пилокарпин HCL, плимицин, полифепросан 20 (с имплантатом кармустина), порфимер натрия, прокаин, прокарбазин HCL, пропранолол, ритуксимаб, сарграмостим, стрептозотоцин, тамоксифен, таксол, тенипозид, тенопозид, тестолактон, тетракаин, тиоэпа хлорамбуцил, тиогуанин, тиотепа, топотекан HCL, торемифен цитрат, трастузумаб, третиноин, валрубицин, винбластин сульфат, винкристин сульфат и винорелбин тартрат.Применение одного или нескольких из следующего: фторпиримидин-иринотекан или фторпиримидин-оксалиплатин, темозоломид, прокарбазин, кармустин (BCNU), ломустин (CCNU), винкристин, PVC (прокарбазин, ломустин и винкристин), иринотекан, цисплатин, карбоплатин, метотрексат, этопозид, блеомицин, винбластин, актиномицин (дактиномицин), циклофосфамид и ифосфамид, является особенно предпочтительным.
Согласно предпочтительному варианту осуществления цитотоксин является особенно эффективным в отношении делящихся или быстро делящихся клеток так, что неделящиеся клетки относительно не подвергаются токсическим эффектам.
Антитела согласно настоящему изобретению могут быть интернализованы в подверженные заболеванию клетки или клетки карциномы, с которыми они связываются, и, следовательно, являются особенно применимыми для терапевтических применений, например, доставки в клетки токсинов, которые необходимо подвергнуть интернализации для осуществления ними неблагоприятной активности. Примеры таких токсинов включают в себя без ограничения сапонин, калихеамицин, ауристатин и майтансиноид.
Антитела или полипептиды согласно настоящему изобретению можно соединять (включая в себя конъюгировать или связывать) с радиоактивной молекулой, токсином или другими терапевтическими средствами или с липосомами или другими везикулами, содержащими терапевтические средства, ковалентно или нековалентно, прямо или опосредованно. Антитело можно связать с радиоактивной молекулой, токсином или химиотерапевтической молекулой в любом положении в антителе при условии, что антитело будет способно связываться со своей мишенью.
Токсин или химиотерапевтическое средство можно вводить одновременно (до, после или во время введения) или сочетанно (например, будучи ковалентно связанным) с подходящим моноклональным антителом или прямо, или опосредованно (например, через линкерную группу, или, альтернативно, через связывающую молекулу с соответствующими сайтами прикрепления, такую как молекула-платформа, описанная в патенте США №5552391). Токсин и химиотерапевтическое средство согласно настоящему изобретению можно соединять напрямую с конкретными белки нацеленного действия с использованием способов, известных в настоящей области техники. Например, прямая реакция между средством и антителом возможна, если каждый из них обладает заместителем, способным реагировать с другим. Например, нуклеофильная группа, такая как амино- или сульфгидрильная группа, на одном может являться способной реагировать с карбонил-содержащей группой, такой как ангидрид или галогенангидрид, или с алкильной группой, содержащей хорошую уходящую группу (например, галогенид) на другом.
Антитела или полипептиды также можно связывать с химиотерапевтическим средством посредством микроносителя. Термин "микроноситель" относится к биоразлагаемой или не являющейся биоразлагаемой частице, которая является нерастворимой в воде и которая характеризуется размером, составляющим меньше чем приблизительно 150 мкм, 120 мкм или 100 мкм, более типично меньше чем приблизительно 50-60 мкм, предпочтительно меньше чем приблизительно 10, 5, 2,5, 2 или 1,5 мкм. Микроносители включают в себя "наноносители", который представляют собой микроносители с размером, составляющим меньше чем приблизительно 1 мкм, предпочтительно меньше чем приблизительно 500 нм. Такие частицы известны в настоящей области техники. Твердофазные микроносители могут представлять собой частицы, образованные из биосовместимых встречающихся в природе полимеров, синтетических полимеров или синтетических сополимеров, которые могут включать в себя или исключать микроносители, образованные из агарозы или поперечно-сшитой агарозы, а также другие биоразлагаемые материалы, известные в настоящей области техники. Биоразлагаемые твердофазные микроносители могут быть образованы из полимеров, которые разлагаются (например, полимер молочной кислоты, полимер гликолевой кислоты и их сополимеры) или подвергаются эрозии (например, полимер сложных ортоэфиров, такие как 3,9-диэтилиден-2,4,8,10-тетраоксаспиро[5.5]ундекан (DETOSU) или полимер ангидридов, такие как полиангидриды себациновой кислоты) при физиологических условиях организма млекопитающего. Микроносители также могут находиться в жидкой фазе (например, на основе масла или липида), такие как липосомы, искомы (стимулирующие иммунитет комплексы, которые представляют собой стабильные комплексы холестерина и фосфолипида, адъювант-активного сапонина) без антигена, или капли или мицеллы, обнаруженные в эмульсиях масло-в-воде или вода-в-масле, при условии, что жидкофазные микроносители являются биоразлагаемыми. Биоразлагаемые жидкофазные микроносители, как правило, включены в состав биоразлагаемого масла, ряд которых известен в настоящей области техники, включая в себя сквален и растительные масла. Микроносители, как правило, сферической формы, но микроносители, которые отклоняются от сферической формы также являются приемлемыми (например, эллипсоидной, палочкообразной формы и т.д.). Благодаря своей нерастворимой природе (по отношению к воде) микроносители можно отфильтровать из воды и водных (на основе воды) растворов.
Конъюгаты антитела или полипептида согласно настоящему изобретению могут включать в себя бифункциональный линкер, который содержит как группу, способную соединяться с токсическим средством или химиотерапевтическим средством, так и группу, способную соединяться с антителом. Линкер может функционировать в качестве спейсера для обеспечения дистанции между антителом и средством во избежание препятствий для осуществления связывающих способностей. Линкер может являться отщепляемым или неотщепляемыме. Линкер также может служить для увеличения химической реакционной способности заместителя на средстве или антителе и, таким образом, увеличения эффективности соединения. Увеличение химической реакционной способности также облегчать применение средств или функциональных группы на средствах, которое в противном случае не было возможным. Бифункциональный линкер можно присоединить к антителу с помощью средств, которые известны в настоящей области техники. Например, линкер, содержащий активный сложноэфирный фрагмент, такой как сложный эфир N-гидроксисукцинимида, можно использовать для соединения с остатками лизина в антителе через амидную связь. Согласно другому примеру линкер, содержащий нуклеофильный амин или остаток гидразина, можно соединить с альдегидными группами, полученными с помощью гликолитического окисления углеводных остатков антитела. В дополнение к указанным прямым способам соединения линкер можно соединить опосредованно с антителом посредством промежуточного носителя, такого как аминодекстран. Согласно указанным вариантам осуществления модифицированная связь осуществляется или через лизин, углевод, или промежуточный носитель. Согласно одному варианту осуществления линкер соединяют сайт-селективно со свободными тиольными остатками в белке. Фрагменты, которые являются подходящими для селективного соединения с тиольными группами на белках, хорошо известны в настоящей области техники. Примеры включают в себя дисульфидные соединения, α-галокарбонильные и α-галокарбоксильные соединения и малеимиды. Если присутствует нуклеофильная аминная функциональная группа в той же молекуле, что и α-галокарбонильная или α-галокарбоксильная группа, существует вероятность циклизации посредством внутримолекулярного алкилирования амина. Способы для предотвращения этой проблемы хорошо известны специалисту в настоящей области техники, например, путем получения молекул, в которых аминные и α-гало функциональные группы отделены с помощью негибких групп, таких как арильные группы или транс-алкены, которые делают нежелательную циклизацию стереохимически непредпочтительной. См., например, патент США №6441163 в отношении получения конъюгатов майтансиноидов и антитела посредством дисульфидного фрагмента.
Один из отщепляемых линкеров, которые можно использовать для получения конъюгатов антитела с лекарственным средством, представляет собой кислотолабильный линкер на основе цис-аконитовой кислоты, который использует преимущества кислого окружения различных внутриклеточных компартментов, таких как эндосом, встречающихся во время рецептор-опосредованного эндоцитоза, и лизосом. См., например, Shen, W.C. et al. (1981) ("cis-Aconityl Spacer Between Daunomycin And Macromolecular Carriers: A Model Of pH-Sensitive Linkage Releasing Drug From A Lysosomotropic Conjugate" Biochem. Biophys. Res. Comtnun. 102: 1048-1054 (1981)) в отношении получения конъюгатов даунорубицина с макромолекулярными носителями; Yang et al. (1988) ("Pharmacokinetics And Mechanism Of Action Of A Doxorubicin- Monoclonal Antibody 9.2.27 Conjugate Directed To A Human Melanoma Proteoglycan" J. Natl. Cane. Inst. 80: 1154-1159) в отношении получения конъюгатов даунорубицина с антителом против меланомы; Dillman et al. (1988) ("Superiority Of An Acid-Labile Daunorubicin-Monoclonal Antibody Immunoconjugate Compared To Free Drug," Cancer Res. 48: 6097-6102) в отношении использования кислотолабильного линкера сходным образом для получения конъюгатов даунорубицина с антителом к Т-клеткам; и Trouet et al. (1982) "A Covalent Linkage Between Daunorubicin And Proteins That Is Stable In Serum And Reversible By Lysosomal Hydrolases, As Required For A Lysosomotropic Drug-Carrier Conjugate: In Vitro And In Vivo Studies," Proc. Natl. Acad. Sci. (U.S.A.) 79: 626-629) в отношении связывания даунорубицина с антителом посредством плеча пептидного спейсера.
Антитело (или полипептид) согласно настоящему изобретению можно конъюгировать (связать) с радиоактивной молекулой или токсином с помощью любого способа, известного в настоящей области техники. В отношении обсуждения способов мечения антитела радиоактивным изотопом (см., Cancer Therapy with Monoclonal Antibodies, D.M. Goldenberg (Ed.) CRC Press, Boca Raton, 1995). Подходящие токсины включают в себя таксаны, майтансиноиды, ауристатины (например, монометил ауристатин (ММАЕ), монометил ауристатин F (MMAF), ауристатин Е (АЕ) и т.д.) (такие как те, которые раскрыты в патентах США №№5208020; 5416064; 6333410; 6340701; 6372738; 6436931; 6441163; 6596757; 7276497; 7585857 или 7851432), калихеамицин, антрациклины (например, доксорубицин), аналог СС-1065, доцетаксел; катепсин В или Е; рицин, гелонин, экзотоксин Pseudomonas, дифтерийный токсин и рибонуклеаза; тиуксетан или токсический радиоактивный изотоп (такой как 90Y; 131I, 177Lu, 186Re, 188Re, 211At, 212Bi, 213Bi, 225Ac и т.д.).
Альтернативно, антитело можно конъюгировать со вторым антителом с образованием гетероконъюгата антитела, описанного в патенте США №4676980. Образование поперечно-связанных антител может нацелить иммунную систему на конкретные типы клеток, например, злокачественные опухолевые или подверженные заболеванию клетки, экспрессирующие В7-Н3.
Согласно другому варианту осуществления любая из связывающих В7-Н3 композиций, описанных в настоящем документе, может связываться с экспрессирующими В7-Н3 злокачественными опухолевыми клетками и индуцировать активный иммунный ответ против злокачественных опухолевых клеток, экспрессирующий В7-Н3. В некоторых случаях активный иммунный ответ может вызывать гибель злокачественных опухолевых клеток (например, связывание антитела со злокачественными клетками, индуцирующее апоптотическую гибель клеток), или ингибировать рост (например, блокировать протекание клеточного цикла) злокачественных опухолевых клеток. В других случаях любое их новых антител, описанных в настоящем документе, может связываться со злокачественными опухолевыми клетками и антитело-зависимая T-клеточная цитотоксичность (ADCC) может устранять злокачественные опухолевые клетки, с которыми связывается антитело к В7-Н3. Соответственно, согласно настоящему изобретению предусмотрены способы стимуляции иммунного ответа, предусматривающие введение любой из композиций, описанных в настоящем документе.
В некоторых случаях связывание антитела также может активировать как клеточные, так и гуморальные иммунные ответы и мобилизовать большее количество клеток-натуральных киллеров или увеличивать продукцию цитокинов (например, IL-2, IFN-гамма, IL-12, TNF-альфа, TNF-бета и т.д.), что дополнительно активирует иммунную систему индивидуума на разрушение злокачественных опухолевых клеток. Согласно другому варианту осуществления антитела к В7-Н3 могут связываться со злокачественными опухолевыми клетками, и макрофаги или другая фагоцитирующая клетка может опсонизировать злокачественные опухолевые клетки.
Различные составы антител или их фрагментов или диател можно использовать для введения. Согласно некоторым вариантам осуществления такие молекулы можно вводить в чистом виде. В дополнение к фармакологически активному средству композиции согласно настоящему изобретению могут содержать подходящие фармацевтически приемлемые носители, содержащие вспомогательные вещества и добавки, которые хорошо известны в настоящей области техники и представляют собой относительно инертные вещества, которые облегчают введение фармакологически эффективного вещества или которые облегчают обработку активных соединений в препараты, которые можно использовать фармацевтически для доставки к месту действия. Например, вспомогательное вещество может придавать форму или однородность или действовать как разбавитель. Подходящие вспомогательные вещества включают в себя без ограничения стабилизирующие средства, смачивающие и эмульгирующие средства, соли для изменения осмолярности, инкапсулирующие средства, буферы и усилители проникновения через кожу.
Подходящие составы для парентерального введения включают в себя водные растворы активных соединений в растворимой в воде форме, например, в форме растворимых в воде солей. Кроме того, можно вводить суспензии активных соединений, должным образом подходящие для масляных инъекционных суспензий. Подходящие липофильные растворители или инертные носители включают в себя жирные масла, например, кунжутное масло, или синтетические сложные эфиры жирных масел, например, этилолеат или триглицериды. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии и включают в себя, например, карбоксиметилцеллюлозу натрия, сорбит и/или декстран. Необязательно суспензия также может содержать стабилизаторы. Липосомы также можно использовать для инкапсулирования средства для доставки в клетку.
Фармацевтический состав для системного введения согласно настоящему изобретению можно составить для энтерального, парентерального или местного введения. Фактически, все три типа состава можно использовать одновременно для достижения системного введения активного ингредиента. Вспомогательные вещества, а также составы для парентеральной и не парентеральной доставки лекарственных средств представлены в Remington: The Science And Practice Of Pharmacy, 21st Edition, Lippincott Williams & Wilkins Publishing (2005). Подходящие составы для перорального введения включают в себя твердые или мягкие желатиновые капсулы, пилюли, таблетки, включая в себя таблетки с оболочкой, эликсиры, суспензии, сиропы или ингаляции и их формы контролируемого высвобождения. Как правило, указанные средства вводят в состав для введения с помощью инъекции (например, интраперитонеально, внутривенно, подкожно, внутримышечно и т.д.), хотя можно использовать другие формы введения (например, пероральное, мукозальное и т.д.). Соответственно, антитела к В7-Н3 предпочтительно комбинируют с фармацевтически приемлемыми инертными носителями, такими как изотонический солевой раствор, раствор Рингера, раствор декстрозы и подобное.
Точная доза, подлежащая применению в составах согласно настоящему изобретению, будет зависеть от пути введения и серьезности состояния, и решение в отношении нее должен принимать лечащий врач на основании обстоятельств каждого пациента, и ее можно определить с помощью стандартных клинических техник. Эффективные дозы (т.е. дозы, достаточные, чтобы являться эффективными в лечении, профилактике или уменьшении интенсивности одного или нескольких симптомов, связанных с нарушением) можно экстраполировать из кривых зависимости реакции от дозы, полученных из тест-систем in vitro или на животных моделях. Конкретный режим введения доз, т.е. доза, время введения и повторное введение, таким образом, будет зависеть от конкретного индивидуума и медицинской истории указанного индивидуума, а также пути введения. Дозировка и частота введения молекул согласно настоящему изобретению может быть снижена или изменена путем усиления их поглощения и/или проникновения в ткань, например, с помощью липидизации.
Дозировка таких молекул, вводимая пациенту, как правило, составляет по меньшей мере приблизительно 0,01 мкг/кг массы тела, по меньшей мере приблизительно 0,05 мкг/кг массы тела, по меньшей мере приблизительно 0,1 мкг/кг массы тела, по меньшей мере приблизительно 0,2 мкг/кг массы тела, по меньшей мере приблизительно 0,5 мкг/кг массы тела, по меньшей мере приблизительно 1 мкг/кг массы тела, по меньшей мере приблизительно 2 мкг/кг массы тела, по меньшей мере приблизительно 3 мкг/кг массы тела, по меньшей мере приблизительно 5 мкг/кг массы тела, по меньшей мере приблизительно 10 мкг/кг массы тела, по меньшей мере приблизительно 20 мкг/кг массы тела, по меньшей мере приблизительно 30 мкг/кг массы тела, по меньшей мере приблизительно 50 мкг/кг массы тела, по меньшей мере приблизительно 100 мкг/кг массы тела, по меньшей мере приблизительно 250 мкг/кг массы тела, по меньшей мере приблизительно 750 мкг/кг массы тела, по меньшей мере приблизительно 1,5 мг/кг массы тела, по меньшей мере приблизительно 3 мг/кг массы тела, по меньшей мере приблизительно 5 мг/кг массы тела или по меньшей мере приблизительно 10 мг/кг массы тела. Рассчитанную дозу будут вводить на основании массы тела пациента в начале лечения. Значительное (≥10%) изменение массы тела от исходного значения или установленное плато массы тела должно служить причиной перерасчета дозы
Эмпирические соображения, такие как период полужизни, как правило, будут вносить вклад в определение дозировки. Антитела, которые являются совместимыми с иммунной системой человека, такие как гуманизированные антитела или полностью человеческие антитела, можно использовать для увеличения продолжительности периода полужизни антитела и для предотвращения того, чтобы антитело подвергалось атаке иммунной системы хозяина. Частоту введения можно определить и отрегулировать в течение курса терапии, и она основана на снижении количества злокачественных опухолевых клеток, поддержании сокращения злокачественных опухолевых клеток, снижении пролиферации злокачественных опухолевых клеток или задержке развития метастазирования. Альтернативно, составы антител к В7-Н3 с длительным непрерывным высвобождением могут являться подходящими. Различные составы и устройства для достижения длительного высвобождения известны в настоящей области техники.
Хотя, как обсуждалось выше, различные пути дозировки и введения можно использовать для обеспечения пациентов-реципиентов терапией с помощью антитела к В7-H3, следующий путь дозировки и введения являются предпочтительным. Антитело к В7-Н3 (предпочтительно гуманизированное, если оно подлежит введению субъектам - людям) предпочтительно вводят с помощью внутривенной (в/в) инфузии в 1, 8, 15 и 22 дни исследования (день 50) цикла 1. Дополнительное антитело к В7-Н3 вводят в последующие циклы для удовлетворяющих критериям исследования пациентов в 1, 8 и 15 дни исследования каждого последующего 28-дневного цикла. В/в инфузию предпочтительно доставляют в течение периода, составляющего 120 минут, если пациент не проявляет признаков или симптомов реакции на инфузию. Возникновение реакции на инфузию будет делать необходимым снижение скорости, прерывание или прекращение инфузии. Предпочтительным является то, что антитело к В7-Н3 не вводят в виде внутривенно струйно или болюсно и что не используют встроенный фильтр или не полиолефиновые пакеты для в/в инфузии. Антитело не должно смешиваться или быть разбавлено другими лекарственными средствами. Могут возникать реакции на инфузию или аллергические реакции. Рекомендованы премедикации для предотвращения реакций на инфузию и меры предосторожности в отношении анафилаксии должны быть предприняты в течение введения антитела. Поддерживающие средства могут включать в себя без ограничения следующее: эпинефрин, антигистамины, кортикостероиды, в/в жидкости, повышающие кровяное давление факторы, кислород, бронходилататоры, дифенгидрамин и ацетаминофен. Должен быть в наличии в/в изотонический солевой раствор, ацетаминофен и лекарственные средства неотложной помощи, включая в себя эпинефрин подкожно (0,3-0,5 мг (0,3-0,5 мл 1:1000 раствора)), дифенгидрамин (25-50 мг в/в) и декадрон (10 мг в/в струйно или его эквивалент) для лечения реакций гиперчувствительности. Если развиваются симптомы лихорадки или озноба, инфузию лекарственного средства необходимо остановить и ввести ацетаминофен и дифенгидрамин гидрохлорид.
Хотя, как обсуждалось выше, различные пути дозировки и введения можно использовать для обеспечения пациентов-реципиентов терапией с помощью антитела к VEGF, следующий путь дозировки и введения являются предпочтительным. Антитело к VEGF (бевацизумаб) предпочтительно вводят с помощью внутривенной (в/в) инфузии. Бевацизумаб предпочтительно не вводят внутривенно струйно или болюсно. Лечение с помощью бевацизумаба не должно начинаться раньше по меньшей мере 28 дней после основной операции, и только после полного заживления раны после хирургического удаления. Первую в/в инфузию предпочтительно доставляют в течение периода, составляющего 90 минут, если пациент не проявляет признаков или симптомов реакции на инфузию. Возникновение реакции на инфузию будет делать необходимым снижение скорости, прерывание или прекращение инфузии. Если начальная инфузия является переносимой, вторую в/в инфузию предпочтительно доставляют в течение периода, составляющего 60 минут. Последующие инфузии можно доставлять в течение периода, составляющего 30 минут, если инфузия в течение 60 минут является переносимой. Пациентам следует продолжать лечение, пока заболевание прогрессирует или не возникает неприемлемая токсичность. Рекомендованные дозировки составляют: 5 мг/кг массы тела или 10 мг/кг массы тела каждые 2 недели при использовании в комбинации с внутривенной основанной на 5-FU химиотерапии; 5 мг/кг массы тела при использовании в комбинации с болюсом IFL (иринотекан, лейковорин (фолиниевая кислота) и фторурацил); 10 мг/кг массы тела при использовании в комбинации с FOLFOX4 (лейковорин (фолиниевая кислота), фторурацил (5-FU), оксалиплатин (Элоксатин®, или Eloxatin®); 15 мг/кг массы тела каждые 3 недели в комбинации с карбоплатином и паклитакселом. Композицию предпочтительно вводят в дозе, составляющей 5 мг/кг массы тела каждые 2 недели или 7,5 мг/кг массы тела каждые 3 недели при использовании в комбинации с режимом химиотерапии на основе фторпиримидин- иринотекана или фторпиримидин-оксалиплатина у пациентов, у которых наблюдался прогресс на содержащем бевацизумаб режиме первой линии. Для лечения глиобластомы рекомендуемая дозировка составляет 10 мг/кг каждые 2 недели.
Согласно одному варианту осуществления дозировки антител можно определить эмпирически у индивидуумов, которым произвели одно или несколько введений. Индивидуумам вводят повышающиеся дозировки антитела. Для оценки эффективности антител к В7-Н3 можно исследовать маркеры специфического злокачественного болезненного состояния. Они включают в себя прямые измерения размера опухоли посредством пальпации или визуального осмотра, непрямое измерение размера опухоли с помощью рентгеновской или других техник получения изображений; улучшение согласно оценке с помощью прямой биопсии опухоли и микроскопического исследования образца опухоли; измерение непрямого опухолевого маркера (например, PSA для злокачественной опухоли предстательной железы), уменьшение боли или парализованности; улучшенную речь, зрение, дыхание или другого физического ограничения, связанного с опухолью; увеличенный аппетит; или увеличение качества жизни согласно измерениям с помощью принятых тестов или увеличение продолжительности выживаемости. Специалисту в настоящей области техники очевидно, что дозировка будет варьировать в зависимости от индивидуума, типа злокачественной опухоли, стадии злокачественной опухоли, от того, начала ли злокачественная опухоль метастазировать в другое место в организме индивидуума и предыдущих и одновременно используемых видов лечения.
Другие составы включают в себя подходящие формы доставки, известные в настоящей области техники, включая в себя без ограничения такие носители, как липосомы. См., например, Mahato et al. (1997) "Cationic Lipid-Based Gene Delivery Systems: Pharmaceutical Perspectives," Pharm. Res. 14: 853-859. Липосомные препараты включают в себя без ограничения цитофектины, многослойные везикулы и однослойные везикулы.
Согласно некоторым вариантам осуществления может присутствовать больше одного антитела. Антитела могут являться моноклональными или поликлональными. Такие композиции могут содержать по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять различных антител, которые являются реакционно способными в отношении карцином, аденокарцином, сарком или аденосарком. Антитело к В7-Н3 можно смешивать с одним или несколькими антителами, реакционно способными в отношении карцином, аденокарцином, сарком или аденосарком в органах, включая в себя без ограничения яичник, молочную железу, легкое, предстательную железу, толстую кишку, почку, кожу, щитовидную железу, кость, верхний отдел пищеварительного тракта и поджелудочную железу. Согласно одному варианту осуществления используют смесь различных антител к В7-Н3. Смесь антител, как ее зачастую обозначают в настоящей области техники, может являться особенно применимой в лечении более широкого спектра популяции индивидуумов.
Способы введения
Композиции согласно настоящему изобретению можно предоставить для лечения, профилактики и уменьшения интенсивности одного или нескольких симптомов, связанных с заболеванием, нарушением или инфекцией, путем введения субъекту эффективного количества фармацевтической композиции согласно настоящему изобретению. Согласно предпочтительному аспекту такие композиции являются по существу очищенными (т.е. по существу не содержат веществ, которые ограничивают их эффект или производят нежелательные побочные эффекты). Согласно конкретному варианту осуществления субъект представляет собой животное, предпочтительно млекопитающее, такое как не являющееся приматом (например, корова, лошадь, кошка собака, грызун и т.д.) или примат (например, низшая обезьяна, такая как, яванский макак; человек и т.д.). Согласно предпочтительному варианту осуществления субъект представляет собой человека.
Известны различные системы доставки и их можно использовать для введения композиций согласно настоящему изобретению, например, инкапсуляция в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать антитело или слитый белок, рецептор-опосредованный эндоцитоз (см., например, Wu et al. (1987) "Receptor-Mediated In Vitro Gene Transformation By A Soluble DNA Carrier System," J. Biol. Chem. 262: 4429-4432), конструирование нуклеиновой кислоты как части ретровирусного или другого вектора и т.д.
Способы введения молекул согласно настоящему изобретению включают в себя без ограничения парентеральное введение (например, интрадермальное, внутримышечное, интраперитонеальное, внутривенное и подкожное), эпидуральное и мукозальное (например, интраназальное и пероральное). Согласно конкретному варианту осуществления молекулы согласно настоящему изобретению вводят внутримышечно, внутривенно или подкожно. Композиции можно вводить с помощью любого удобного пути, например, с помощью инфузии или болюсной инъекции, путем абсорбции через эпителиальные или слизистые оболочки (например, слизистую ротовой полости, ректальную и слизистую оболочку кишки и т.д.) и можно вводить вместе с другими биологически активными средствами. Введение может являться системным или локальным. Кроме того, также можно использовать пульмонарное введение, например, путем применения ингалятора или небулайзера и состава с аэрозольным средством. См., например, патенты США №№6019968; 5985320; 5985309; 5934272; 5874064; 5855913; 5290540 и 4880078; и международные патентные публикации согласно РСТ №№WO 92/19244; WO 97/32572; WO 97/44013; WO 98/31346; и WO 99/66903, причем каждый документ полностью включен в настоящий документ посредством ссылки.
Согласно настоящему изобретению также предусмотрено, что фармацевтические композиции согласно настоящему изобретению упакованы в герметичный контейнер, такой как ампула или саше, с указанием количества таких молекул. Согласно одному варианту осуществления антитела, фрагменты антител или диатела таких фармацевтических композиций поставляют в виде сухого стерилизованного лиофилизированного порошка или безводного концентрата в герметичном контейнере, и его можно развести, например, водой или изотоническим солевым раствором до подходящей концентрации для введения субъекту. Предпочтительно молекулы согласно настоящему изобретению поставляют в виде сухого стерилизованного лиофилизированного порошка в герметичном контейнере с дозировкой для однократного введения, составляющей по меньшей мере 5 мкг, более предпочтительно по меньшей мере 10 мкг, по меньшей мере 15 мкг, по меньшей мере 25 мкг, по меньшей мере 50 мкг, по меньшей мере 100 мкг или по меньшей мере 200 мкг.
Лиофилизированные молекулы согласно настоящему изобретению необходимо хранить при 2-8°С в их изначальном контейнере и молекулы следует вводить в пределах 12 часов, предпочтительно в пределах 6 часов, в пределах 5 часов, в пределах 3 часов или в пределах 1 часа после разведения. Согласно альтернативному варианту осуществления такие молекулы согласно настоящему изобретению поставляют в жидкой форме в герметичном контейнере с указанием количества и концентрации молекулы, слитого белка или конъюгированной молекулы. Предпочтительно жидкую форму таких биспецифических моновалентных диател или биспецифических моновалентных Fc-диател поставляют в герметичном контейнере, в котором молекулы присутствуют в концентрации, составляющей по меньшей мере 1 мкг/мл, более предпочтительно по меньшей мере 2,5 мкг/мл, по меньшей мере 5 мкг/мл, по меньшей мере 10 мкг/мл, по меньшей мере 50 мкг/мл или по меньшей мере 100 мкг/мл.
Согласно конкретному варианту осуществления может быть желательным ввести фармацевтические композиции согласно настоящему изобретению локально в область, нуждающуюся в лечении; это может быть достигнуто, в качестве примера, а не для ограничения, с помощью местной инфузии, инъекции или посредством имплантата, причем указанный имплантат изготовлен из пористого, непористого или гелеобразного материала, включая в себя мембраны, такие как сиаластические мембраны, или волокна. Предпочтительно при введении молекулы согласно настоящему изобретению необходимо уделить особое внимание применению материалов, к которым молекула не абсорбируется.
Согласно другому варианту осуществления композиции можно доставить в везикуле, в частности липосоме (см. Langer (1990) "New Methods Of Drug Delivery," Science 249: 1527-1533); Treat et al, в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); Lopez- Berestein, pp.3 17-327; см. в общем там же).
Согласно другому варианту осуществления композиции можно доставить в системе контролируемого или длительного высвобождения. Любую технику, известную специалисту в настоящей области техники, можно использовать для получения составов длительного высвобождения, содержащих одну или несколько молекул согласно настоящему изобретению. См., например, патент США №4526938; международную патентную публикацию согласно РСТ № WO 91/05548; международную патентную публикацию согласно РСТ № WO 96/20698; Ning et al. (1996) "Intratumoral Radioimmunotheraphy Of A Human Colon Cancer Xenograft Using A Sustained-Release Gel," Radiotherapy & Oncology 39:179-189, Song et al. (1995) "Antibody Mediated Lung Targeting Of Long-Circulating Emulsions," PDA Journal of Pharmaceutical Science & Technology 50: 372-397; Cleek et al. (1997) "Biodegradable Polymeric Carriers For A bFGF Antibody For Cardiovascular Application," Pro. Int'l. Symp.Control. Rel. Bioact. Mater. 24: 853-854; и Lam et al. (1997) "Microencapsulation Of Recombinant Humanized Monoclonal Antibody For Local Delivery," Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24: 759-760, причем каждый из документов полностью включен в настоящий документ посредством ссылки. Согласно одному варианту осуществления насос можно использовать в системе контролируемого высвобождения (см. Langer, supra; Sefton, (1987) "Implantable Pumps, " CRC Crit. Rev. Biomed. Eng. 14: 201-240; Buchwald et al. (1980) "Long-Term, Continuous Intravenous Heparin Administration By An Implantable Infusion Pump In Ambulatory Patients With Recurrent Venous Thrombosis," Surgery 88: 507-516; и Saudek et al. (1989) "A Preliminary Trial Of The Programmable Implantable Medication System For Insulin Delivery," N. Engl. J. Med. 321: 574-579). Согласно другому варианту осуществления полимерные материалы можно использовать для достижения контролируемого высвобождения антител (см. например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Levy et al. (1985) "Inhibition Of Calcification Of Bioprosthetic Heart Valves By Local Controlled-Release Diphosphonate," Science 228:190-192; During et al. (1989) "Controlled Release Of Dopamine From A Polymeric Brain Implant: In Vivo Characterization," Ann. Neurol. 25: 351-356; Howard et al. (1989) "Intracerebral Drug Delivery In Rats With Lesion-Induced Memory Deficits, " J. Neurosurg. 7(1): 105-112); патент США №5679377; патент США №5916597; патент США №5912015; патент США №5989463; патент США №5128326; международная патентная публикация согласно РСТ № WO 99/15154; и международная патентная публикация согласно РСТ WO 99/20253). Примеры полимеров, используемых в составах длительного высвобождения, включают в себя без ограничения следующее: полимер 2-гидроксиэтилметакрилата, полимер метилметакрилата, полимер акриловой кислоты, сополимер этилена и винилацетата, полимер метакриловой кислоты, полигликолиды (PLG), полиангидриды, полимер N-винилпирролидона, полимер винилового спирта, полиакриламид, полиэтиленгликоль, полилактиды (PLA), сополимеры лактида и гликолида (PLGA) и сложные полиортоэфиры. Согласно другому варианту осуществления систему контролируемого высвобождения можно поместить вблизи терапевтической мишени (например, легких), таким образом, потребуется только часть системной дозы (см., например, Goodson, в Medical Applications of Controlled Release, ранее, vol. 2, pp.115-138 (1984)). Согласно другому варианту осуществления полимерные композиции, применимые в качестве имплантатов контролируемого высвобождения, используют согласно Dunn et al. (см. Патент США №5945155). Указанный конкретный способ основан на терапевтическом эффекте in situ контролируемого высвобождения биоактивного материала из полимерной системы. Имплантация, как правило, может происходить где-либо в пределах организма пациента, нуждающегося в терапевтическом лечении. Согласно другому варианту осуществления используют неполимерную систему длительной доставки, посредством чего неполимерный имплантат в организме субъекта используют в качестве системы доставки лекарственного средства. При имплантации в организм органический растворитель имплантата будет рассеиваться, диспергироваться или вымываться из композиции в окружающую тканевую жидкость, и неполимерный материал будет постепенно коагулировать или осаждаться с образованием твердой, микропористой матрицы (см. патент США №5888533).
Системы контролируемого высвобождения обсуждаются в обзоре Langer (1990, "New Methods Of Drug Delivery," Science 249:1527-1533). Любую технику, известную специалисту в настоящей области техники, можно использовать для получения составов длительного высвобождения, содержащих одно или несколько терапевтических средств согласно настоящему изобретению. См., например, патент США №4526938; международные патентные публикации №№ WO 91/05548 и WO 96/20698; Ning et al. (1996) "Intratumoral Radioimmunotheraphy Of A Human Colon Cancer Xenograft Using A Sustained-Release Gel," Radiotherapy & Oncology 39: 179-189, Song et al. (1995) "Antibody Mediated Lung Targeting Of Long-Circulating Emulsions, "PDA Journal of Pharmaceutical Science & Technology 50:372-397; Cleek et al. (1997) "Biodegradable Polymeric Carriers For A bFGF Antibody For Cardiovascular Application, " Pro. Int'l. Symp. Control. Rel. Bioact. Mater. 24: 853-854; и Lam et al. (1997) "Microencapsulation Of Recombinant Humanized Monoclonal Antibody For Local Delivery," Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24: 759-760, причем каждый из документов полностью включен в настоящий документ посредством ссылки.
Лечение субъекта может предусматривать однократное лечение или предпочтительно может предусматривать серию введений. Согласно предпочтительному примеру субъект получает лечение с помощью молекул согласно настоящему изобретению один раз в неделю в течение приблизительно 1-10 недель, предпочтительно 2-8 недель, более предпочтительно приблизительно 3-7 недель и даже более предпочтительно в течение приблизительно 4, 5 или 6 недель. Согласно другим вариантам осуществления фармацевтические композиции согласно настоящему изобретению вводят один раз в день, два раза в день или три раза в день. Согласно другим вариантам осуществления фармацевтические композиции вводят один раз в неделю, два раза в неделю, один раз в две недели, один раз в месяц, один раз в шесть недель, один раз в два месяца, дважды в год или один раз в год. Кроме того, следует понимать, что эффективная дозировка молекул, используемых для лечения, может увеличиваться или уменьшаться в течение курса конкретного лечения.
Описанное в общих чертах настоящее изобретение станет более понятным посредством ссылки на следующие примеры, которые представлены для иллюстрации и не предусмотрено, что они являются ограничивающими настоящее изобретение, если не указано иное.
Пример 1
Лечение рецидивирующей мультиформной глиобластомы (GBM) с помощью антитела к В7-Н3 и антитела к VEGF
Чтобы продемонстрировать способность комбинированной терапии, предусматривающей средства, которые обеспечивают связывающую способность, которая является специфической в отношении В7-H3, и вторую связывающую способность, которая является специфической в отношении фактора клеточной поверхности (или его рецептора), который вовлечен в стимуляцию опухолевого ангиогенеза, пациенты, страдающие от мультиформной глиобластомы (GBM) получали лечение с помощью гуманизированного антитела к В7-Н3 и бевацизумаба (Авастин®).
Обзор: Шесть пациентов (4 мужчин и 2 женщин) возрастом в диапазоне 26-68 лет получали лечение. У четырех пациентов наблюдался их третий рецидив злокачественной опухоли, у одного пациента наблюдался второй рецидив злокачественной опухоли и у одного пациента наблюдался первый рецидив злокачественной опухоли. Четыре пациента получали бевацизумаб. Один пациент получал альтернативную терапию с помощью антитела к VEGF, и один пациент ранее не подвергался терапии с помощью антитела к VEGF. Один пациент находился на высокой дозе дексаметазона (8 мг/день) в начале исследования; один пациент находился на заместительной дозе преднизона (5 мг/день) в отношении вторичной недостаточности коры надпочечников; и оставшиеся четыре пациенты не получали стероиды. Лечение с помощью антитела разработали так, что оно включало в себя один или несколько 50-дневных циклов, в которые антитело вводили в 1, 8, 15 и 22 дни. Профили пациентов представлены в таблице 3.
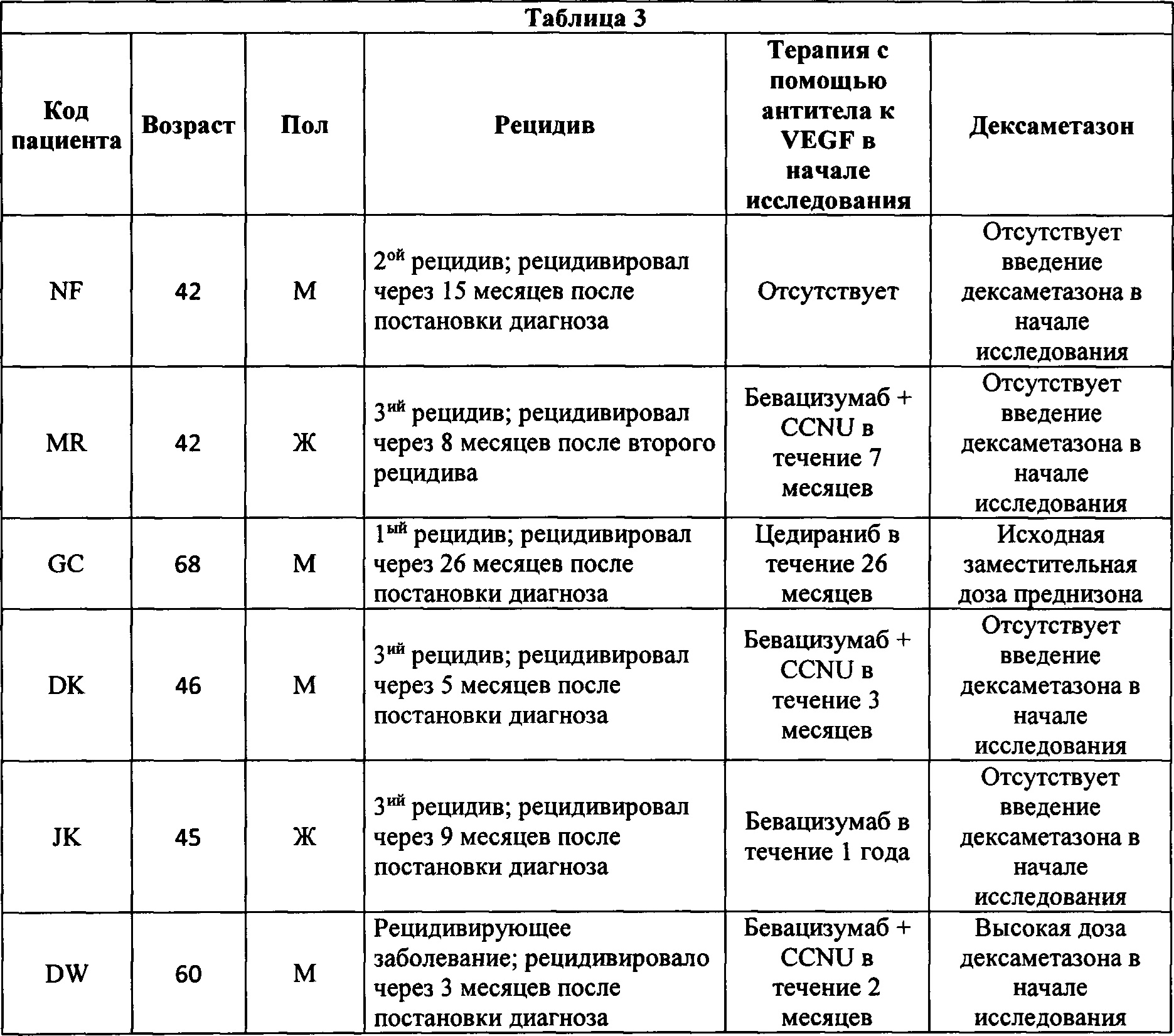
Пациент NF
На фигуре 1 показано клиническое прогрессирование пациента NF. Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 3 поражения. Начальный цикл гуманизированного антитела к В7-Н3 вводили в начале исследования. Ряд А показан статус поражений пациента на исходном уровне (следует отметить, что для поражения 3 стрелка в ряду А указывает на место, где поражение наблюдается в ряду В на фигуре; нет видимого поражения 3 в ряду А фигуры). В ряду В показан статус поражений пациента перед началом второго запланированного цикла введения антитела к В7-Н3. В ряду В выявили, что три поражения, как оказалось, характеризуются увеличенным размером (явление, известное как "псевдопрогрессирование"). Одновременно с таким псевдопрогрессированием пациент испытывал увеличенный отек в головном мозге (четвертая колонка), головные боли и увеличенные судорожные приступы. Терапию с помощью антитела к В7-Н3 останавливали и пациенту вводили 3 дозы бевацизумаба и одну дозу CCNU (ряд С).
Существенно то, что вводимое антитело к В7-Н3 характеризовалось биологическим периодом полужизни, составляющим 2-3 недели. Таким образом, во время анализа МРТ ряда С содержание бевацизумаба у пациента снижалось до приблизительно 25% от максимального. Как показано в ряду С фигуры 1, наблюдалось сильное снижение размера поражения и отека наряду с ослаблением головных болей и судорожных приступов у пациента.
Данные интерпретируют как показатель того, что комбинированное лечение бевацизумабом и антителом к В7-Н3 действовали синергетически с улучшением состояния пациента. После 1 цикла лечения с помощью антитела к В7-Н3 наблюдалось значительное увеличение в усилении состояния поражения наряду с головными болями и усиленными судорожными приступами. Тем не менее, после получения 3 доз бевацизумаба + CCNU наблюдалось заметное снижение всех показателей, полученных с помощью МРТ. Пациент являлся клинически стабильным в течение более чем 10 месяцев после последней дозы антитела к В7-Н3. Общая выживаемость пациента составляет больше чем 2 года, 7 месяцев от даты постановки диагноза.
Пациент MR
На фигурах 2А-2С показано клиническое прогрессирование пациента MR. Пациент MR проявлял вторичную глиобластому и обладал глиобластомой, характеризующейся наличием мутанта IDH1 (Ichimura, K. et al. (2009) "IDH1 Mutations Are Present In The Majority Of Common Adult Gliomas But Rare In Primary Glioblastomas," Neuro. Oncol. 11(4): 341-347). Характерная черта глиобластомы, ассоциированной с мутацией IDH1, состоит в том, что такие опухоли нельзя усилить с помощью контраста (Carillo, J.A. et al. (2012) "Relationship between Tumor Enhancement, Edema, IDH1 Mutational Status, MGMT Promoter Methylation, and Survival in Glioblastoma," Amer. J. Neuroradiol. 10.3174/ajnr.A2950, pages 1-7).
Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 5 поражений. Полученные с помощью МРТ-сканирования изображения поражений 1-4 показаны на фигурах 2А-2В; полученные с помощью МРТ- сканирования изображения поражения 5 показаны на фигуре 2С. Для оценки поражений пациента MR изображение с помощью МРТ-сканирования получали в присутствии контрастного средства, гадолиния (фигуры 2А-2С, "GADO") со взвешиванием Т2 и без него (фигуры 2А-2С, Т2). Следует понимать, что сигнал в изображениях МРТ является высоким (светлым) или низким (темным) в зависимости ль используемой последовательности импульсов и типа ткани в представляющей интерес области получения изображения. Признаки, оказавшиеся светлыми на Т2-взвешенном изображении, включают в себя увеличенное содержание воды, как при отеке или воспалении. Признаки, оказавшиеся темными на Т2-взвешенном изображении, включают в себя кальцификацию, фиброзную ткань, обогащенную белком жидкость и феномен при потере сигнала. Опухоли пациента MR содержали как усиливающие контраст, так и не усиливающие контраст (Т2 светлые) компоненты.
В начальном цикле гуманизированное антитело к В7-Н3 вводили на исходном уровне. После начала второго цикла дексаметазон вводили пациенту (2 мг два раза в день). В середине цикла 3 терапию с помощью антитела к В7-Н3 останавливали и пациенту вводили 1 дозу бевацизумаба и вентрикулоперитонеальный шунт (VPS). В организме пациента содержалось существенное количество антитела к В7-Н3 во время введения бевацизумаба.
На фигурах 2А-2С, в ряду А показан статус поражений пациента на исходном уровне. В ряду В показан статус поражений пациента перед началом второго запланированного цикла введения антитела к В7-Н3. В ряду В фигур 2А-2 В выявили, что поражения 1-4 увеличились в размере и что увеличился отек в головном мозге (четвертая колонка). Данные интерпретируют как демонстрирующие псевдопрогрессирование. В ряду С фигур 2А-2В выявили состояние поражений 1-4 во время остановки терапии с помощью атитела к В7-Н3. Пациенту затем вводили 1 дозу бевацизумаба и вентрикулоперитонеальный шунт. Статус после введения бевацизумаба показан в ряду D фигур. Как показано в ряду D фигур 2А-2В наблюдалось сильное снижение размера поражения и отека для поражений 1-4.
Как показано на фигуре 2С, поражение 5 пациента не отвечало на терапию. В ряду А показан статус поражения 5 на исходном уровне. В ряду В показан статус поражения 5 перед началом второго запланированного цикла введения антитела к В7-Н3. В ряду С выявили состояние поражения 5 во время остановки терапии с помощью антитела к В7-Н3. Статус после введения бевацизумаба показан в ряду D. Как типично для IDH-мутантных глиом (см. нижнюю правую стрелку), у большинства опухолей состояние никогда ранее не усиливалось. Большинство опухолей развивали заметное усиление под действием антитела к В7-Н3 (цикл 2). Размер опухоли оставался от стабильного до сниженного после 1 дозы бевацизумаба. Поражение 5 (нижняя правая стрелка) никогда не усиливалось в большей степени с помощью терапии антителом к В7-Н3 и устойчиво росло в течение курса лечения. Рост поражения 5 охватывал левый желудочек (см. верхняя правая стрелка), и пациент нуждался в шунте VP. Умственные способности и походка пациента улучшались.
Данные на фигурах 2А-2С интерпретировали как показатель того, что комбинированное лечение бевацизумабом и антителом к В7-Н3 действовало синергетически с улучшением состояния пациента по отношению к поражениям 1-4, но что поражение 5 продолжало стабильно расти в течение курса лечения без какого-либо эффекта лечения. Поражения 1-4 развивали заметное усиление после 1 цикла (ранее не наблюдалось большего усиления, поскольку они относятся к типичным IDH1- мутантным глиомам). Лечебный эффект являлся симптоматическим; пациент испытывал снижение неврологического статуса (атаксии и утрата кратковременной памяти) в исследовании после отмены терапии. После 1 дозы бевацизумаба большая часть опухоли являлась стабильной до слегка уменьшенной по сравнению с исходным уровнем (см., например, поражение 2). Лечебный эффект, таким образом, фактически вызывал сокращение опухоли; гетерогенность опухоли приводила к смешанному ответу.
В настоящее время пациент испытывает неврологического улучшение по сравнению с клиническим крайним состоянием через 5 месяцев после последней дозы антитела к В7-Н3. Пациент являлся клинически стабильным в течение больше чем 10 месяцев после последней дозы антитела к В7-Н3. Общая выживаемость пациента составляет больше чем 3 года, 5 месяцев от даты постановки диагноза.
Пациент GC
На фигуре 4 показано клиническое прогрессирование пациента GC. Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 3 поражения. Начальный цикл гуманизированного антитела к В7-Н3 вводили в начале исследования. После цикла 1 наблюдалось заметно увеличенное усиление снижения умственных способностей и походки.
В ряду А показан статус поражений пациента в начале исследования. В ряду В (изображения, полученные перед началом цикла 6) показано, что поражения являлись стабильными в течение 5-6 циклов введения антитела к В7-Н3 с возможным минимальным ответом. В ряду С (изображения, полученные в конце цикла 6) показаны признаки прогрессирующего заболевания, включая в себя возникновение новых поражений. Пациент испытывал снижение когнитивных способностей, и в головном мозге пациента был обнаружен отек (ряд С, четвертая колонка). В ряду D показаны МРТ-изображения, полученные после 2 доз бевацизумаба. Как видно, поражения и отек снижались в размере и степени. Умственные способности согласно наблюдениям улучшались, но не достигали исходного уровня.
Данные на фигуре 4 интерпретировали как показатель того, что комбинированное лечение с помощью бевацизумаба и антитела к В7-Н3 действовало синергетически с улучшением состояния пациента по отношению к наблюдаемым поражениям. Пациент отвечал на лечение с помощью бевацизумаба после лечения с помощью антитела к В7-H3, на что указывает факт того, что предыдущие целевые поражения были меньше после лечения бевацизумабом, чем перед лечением с помощью антитела к В7-Н3. Общая выживаемость пациента составляет более 3 лет с даты постановки диагноза.
Пациент DK
На фигуре 4 показано клиническое прогрессирование пациента DK. Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 3 поражения. Начальный цикл гуманизированного антитела к В7-Н3 вводили в начале исследования. В первый день цикла 2 (C2D1) лечение изменяли, чтобы включить в него введение дексаметазона (2 мг дважды в день). В ряду А показан статус поражений пациента в начале исследования. В ряду В (изображения, полученные в середине цикла 2) показано прогрессирование и псевдопрогрессирование заболевания. В ряду С (изображения, полученные после введения 2 доз бевацизумаба, показывают слабовыраженный ответ, со слабым улучшением умственных способностей и походки.)
Данные фигуры 4 интерпретируют как показатели как псевдопрогрессирования, так и прогрессирования, а также как показатели того, что комбинированное лечение с помощью бевацизумаба и антитела к В7-Н3 обеспечивает слабовыраженный ответ и действовало синергетически с улучшением состояния пациента в отношении наблюдаемых поражений. Пациент отвечал на лечение с помощью бевацизумаба после лечения с помощью антитела к В7-H3, на что указывает факт того, что предыдущие целевые поражения были меньше после лечения бевацизумабом, чем перед лечением с помощью антитела к В7-Н3.
Пациент испытывал ухудшение состояния здоровья в хосписе через 10 недели после последней дозы антитела к В7-Н3. Общая выживаемость пациента составляет больше чем 1 год, 10 месяцев с даты постановки диагноза.
Пациент JK
На фигуре 5 показано клиническое прогрессирование пациента JK. Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 3 поражения. Начальный цикл гуманизированного антитела к В7-Н3 вводили в начале исследования. После цикла 1 лечение изменяли, чтобы включить в него введение дексаметазона (2 мг дважды в день). Наблюдали слабовыраженное снижение двигательных возможностей языка и правой руки. В ряду А показан статус поражений пациента в начале исследования. В ряду В (изображения, полученные перед циклом 2) показано прогрессирование и псевдопрогрессирование заболевания. После введения бевацизумаба и CCNU × 1 месяц пациент показал стабильные двигательные способности языка и правой руки. Ожидается дополнительное МРТ-изображение.
Пациент DW
На фигуре 6 показано клиническое прогрессирование пациента DW. Полученные с помощью МРТ-сканирования изображения головного мозга пациента выявили 3 поражения. Начальный цикл гуманизированного антитела к В7-Н3 вводили в начале исследования. В ряду А показан статус поражений пациента в начале исследования. После цикл 1 наблюдали прогрессирование заболевания с тяжелым снижением двигательных способностей языка, правой руки и ноги. Пациент получал 1 дозу бевацизумаба, но продолжал испытывать тяжелое снижение двигательных способностей языка, правой руки и ноги. В ряду В (изображения, полученные перед началом цикла 2) показано прогрессирование заболевания. Пациент заболел через 5 недель после последней дозы антитела к В7-Н3 (общая выживаемость составила 14 месяцев после постановки диагноза). Пациент не проявил никакого клинического ответа на бевацизумаб после лечения с помощью антитела к В7-Н3. Отсутствие ответа, возможно, обусловлено высоким изначальным уровнем стероидов или, в особенности, особенно рефрактерностью заболевания.
В заключении, данные показывают, что наблюдается эффект лечения (увеличенное усиление) (псевдопрогрессирование). Эффект лечения, вероятно, связан с ответом опухоли и с наблюдаемыми неврологическими симптомами, которые могут являться не полностью обратимыми. Бевацизумаб, вероятно, действует синергетически или, возможно, снижает эффект лечения. Высокая исходная доза дексаметазона, вероятно, приводит к резистентности. Лечение с помощью антитела к В7-Н3 переносилось хорошо. На фигуре 7 показано время исследования для 6 получивших лечение пациентов.
Пример 2
Оценка пациентов, получающих антитело к В7-Н3
В курсе текущего клинического испытания для оценки эффективности терапии с помощью антитела к В7-Н3 в лечении злокачественной опухоли измеряли содержания растворимого В7-Н3 ("sB7-H3") у пациентов-реципиентов. Содержания sB7-H3 у пациентов-реципиентов перед лечением являлось нулевым.
Как показано на фигуре 8 (все пациенты) и фигуре 9 (пациенты с глиобластомой) содержание sB7-H3 у пациентов-реципиентов увеличивалось в течение первого цикла лечения, в итоге снижаясь с продолжением лечения. Это увеличение может отражать гибель (и разрушение) опухолевых клеток или отщепление и высвобождение мембраносвязанного В7-Н3 в качестве следствия терапии. Высвобождение sB7-H3 у пациентов-реципиентов представляет собой маркер прогрессирующего заболевания.
Все публикации и патенты, упомянутые в настоящем описании изобретения включены в настоящий документ посредством ссылки в той же степени, как если бы было указано, что каждая отдельная публикация или патентная заявка были специально и индивидуально полностью включена посредством ссылки. Наряду с тем, что настоящее изобретение было описано в связи с конкретными вариантами его осуществления, следует понимать, что возможны дополнительно модификации, и предусмотрено, что настоящая заявка охватывает любые вариации, применения или адаптации согласно настоящему изобретению согласно, в общем, принципам настоящего изобретения и включая в себя такие отклонения от настоящего раскрытия, которые находятся в пределах известной или общепринятой практики в пределах области техники, к которой принадлежит настоящее изобретение, и которые могут применяться к основным признакам, изложенным выше в настоящем документе.