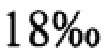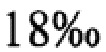Результат интеллектуальной деятельности: СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ RHODOMONAS SALINA
Вид РИД
Изобретение
Изобретение относится к биотехнологии и предназначено для получения биомассы микроводоросли Rhodomonas salina с ценными пищевыми качествами для использования в марикультуре.
Криптофитовая водоросль Rhodomonas salina в настоящее время широко используется в аквакультуре, пищевой и косметической промышленности. Она является основным и наиболее полноценным кормом при выращивании в питомниках личинок, молоди и производителей промысловых моллюсков - устриц, гребешков, клемм, мидий. Она обеспечивают зоопланктон витаминами, жирными кислотами, пигментами, которые передаются через цепи питания. При выращивании в питомнике личинок и молоди двустворчатых моллюсков - период метаморфоза является наиболее уязвимым местом, т.к. в это время может наблюдаться максимальный отход [Zhang et al., 2013]. Включение в состав рациона микроводоросли R. salina способствует значительному увеличению их темпа роста и выживаемости. Липиды и белки составляют более 80% энергетического запаса двустворчатых моллюсков в период метаморфоза. Накопление липидов во время онтогенеза, способствует росту личинок и успешному завершению метаморфоза. Поэтому микроводоросль R. salina является одним из оптимальных кормовых объектов при выращивании в питомнике двустворчатых моллюсков и копепод. Микроводоросль R. salina также перспективный объект для производства фикоэритрина, который может использоваться в качестве натурального красителя пищевых продуктов и косметических средств [Chaloub et al., 2015]. Клетки водоросли R. salina подвижные с двумя жгутиками и одним хлоропластом. Средний размер клеток составлял: ширина 7±0.35 мкм, длина 12±0.58 мкм, объем - 527±0.43 мкм3. Они легко заглатываются личинками двустворчатых моллюсков (мидий и устриц) и быстро перевариваются. Питательная ценность микроводоросли обусловлена высоким содержанием липидов до 41%, которые накапливаются на стационарной фазе роста; белка - 29%) и углеводов - 30%). Условия культивирования водоросли оказывают существенное влияние на скорость роста, накопление биомассы, содержание белка, углеводов, липидов.
Известен способ культивирования R. salina, в качестве корма для копепод [Minh Vu Thi Thuy et al., 2016]. Водоросль культивируют в полунепрерывном режиме при температуре 20°С и солености  в трубчатых биореакторах с добавлением CO2. Максимальная удельная скорость роста R. salina составляет 0,84±0,17 сут-1, а плотность клеток 2,2⋅106 кл.⋅мл-1. Недостатком известного способа является культивирование микроводоросли в полунепрерывном режиме, который предусматривает максимальное накопление белка, а не липидов - с высоким содержанием ПНЖК. Концентрация клеток 2,2⋅106 кл.⋅мл-1, при таком режиме культивирования, достаточна низкая и, соответственно, доля липидов в ней будет невысокой, это предполагает культивирование водоросли в больших объемах, чтобы удовлетворить пищевые потребности двустворчатых моллюсков.
в трубчатых биореакторах с добавлением CO2. Максимальная удельная скорость роста R. salina составляет 0,84±0,17 сут-1, а плотность клеток 2,2⋅106 кл.⋅мл-1. Недостатком известного способа является культивирование микроводоросли в полунепрерывном режиме, который предусматривает максимальное накопление белка, а не липидов - с высоким содержанием ПНЖК. Концентрация клеток 2,2⋅106 кл.⋅мл-1, при таком режиме культивирования, достаточна низкая и, соответственно, доля липидов в ней будет невысокой, это предполагает культивирование водоросли в больших объемах, чтобы удовлетворить пищевые потребности двустворчатых моллюсков.
Известен способ культивирования микроводоросли Rhodomonas sp., используемой в аквакультуре в качестве корма при коммерческом выращивании беспозвоночных [Fabiola Lafarga-De la Cruz et al., 2006]. Культивирование водоросли осуществляется в течение 7 дней при разной интенсивности света (52, 68, 103 и 142 μмоль фотона⋅м-2⋅с-1) и трех концентрациях нитратов и фосфатов (661 и 29; 882 и 39; 1323 и 58,5 мкМ NaNO3 и NaH2PO4, соответственно). Рост водоросли в большей степени коррелировал с концентрацией нитратов и фосфатов в питательной среде, чем с интенсивностью света. При низкой концентрации биогенов рост Rhodomonas sp.начал замедляться уже на 2 сутки культивирования. Максимальную плотность культуры 1,53±0,07⋅106 кл.⋅мл-1, получают на 7 сутки на среде с максимальным содержанием биогенов и при высокой интенсивности света.
Известен способ культивирования микроводоросли R. salina, как сырья для получения фикоэритрина - натурального красителя для пищевых продуктах и добавки к косметическим средствам [Chaloub R.M et al., 2015]. Исследовано влияние температуры, интенсивности света, концентрации нитратов на удельную скорость роста, получение биомассы и содержание фикоэритрина. Водоросль культивировали на питательной в среде F/2 при освещенности 15, 50 и 150 μмоль фотонов⋅м-2⋅с-1 и температуре 20, 26 и 32°С. Установлено, что повышение температуры приводило к уменьшению максимальной скорости роста. А увеличение интенсивности света от 15 до 150 μмоль фотонов⋅м-2⋅с-1 (≈ от 1,1 до 11 клк) способствовало увеличению скорости роста. Максимальная концентрация клеток ≈1⋅106 кл.⋅мл-1 получена при температуре 26°С и освещенности 150 μмоль фотонов⋅м-2⋅с-1. В тоже время фикоэритрин в клетках водоросли накапливался при самой низкой интенсивности света 15 μмоль фотонов⋅м-2⋅с-1 и температуре 26°С. Накопление билипротеина стимулировалось 25%-ным увеличением концентрации нитратов в культуральной среде. Недостатком данного способа является культивирование микроводоросли на питательной среде F/2, обедненной по многим биогенным элементам, поэтому авторам приходилось увеличивать концентрацию нитратов на 25%. Получить большую биомассу водоросли на такой питательной среде не предоставляется возможным.
Задачей изобретения Способ культивирования микроводоросли Rhodomonas salina является оптимизация условий культивирования для увеличения выхода биомассы водоросли.
Техническим результатом изобретения является получение полноценного корма и в достаточном количестве для личинок и спата моллюсков, выращиваемых в питомнике.
Для достижения заявленного технического результата в Способе культивирования микроводоросли Rhodomonas salina, включающем культивирование водоросли в культиваторах на питательной среде при температуре и освещенности и получение биомассы, были предусмотрены изменения, относящиеся к тому, что что водоросли культивируют в течение 7-8 сут. методом накопительной культуры при температуре 24±1°С в условиях круглосуточного освещения с освещенностью 10 кЛк, при непрерывном барботировании воздухом. В качестве питательной среды используют среду Конвея, модифицированную путем увеличения концентрации железа в 2 раза, приготовленную на основе стерильной морской воды соленостью 18‰ с добавлением следующих макроэлементов, г/л: NaNO3 - 100,0; NaH2PO4 ⋅ 2H2O - 20,0; FeCl3 ⋅ 6H2O - 5,2; Na2ЭДТА - 45,0; H3BO3 - 33,6; MnCl2 ⋅ 4 H2O - 0,36 и микроэлементов, г/100 мл: ZnCl2 - 2,1; CoCl2 ⋅ 6 H2O - 2,0; CuSO4 ⋅ 5 H2O - 2,0; (NH4)6Mo7O24 ⋅ 4 H2O - 0,9; Н2О дист. - 100,0.
Новым в заявляемом изобретении является подбор оптимальных условий культивирования, позволяющих получать биомассу микроводоросли Rhodomonas salina для использования в качестве полноценного корма и в достаточном количестве.
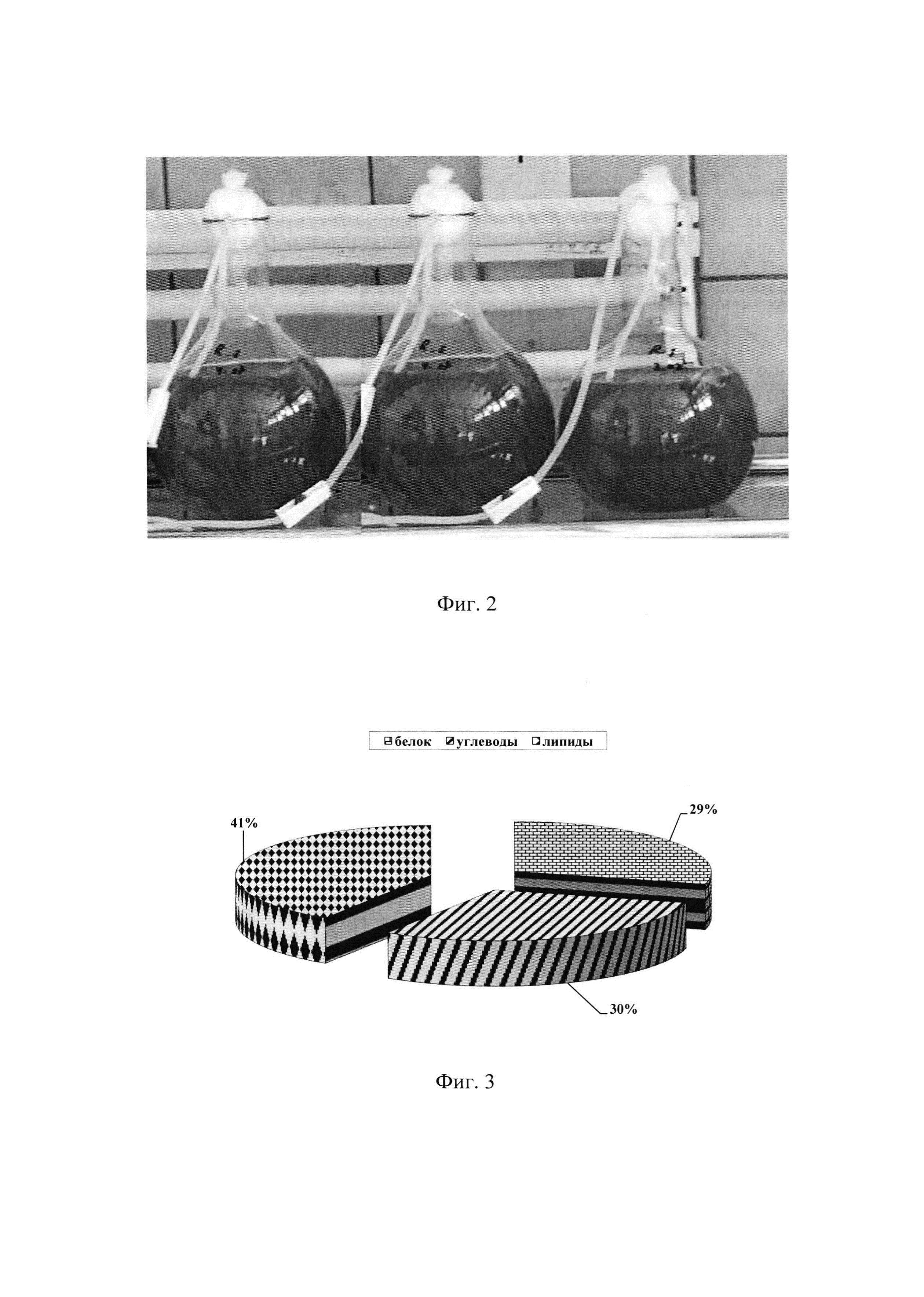
Изобретение поясняется иллюстрациями: Фиг. 1 - Динамика роста микроводоросли Rhodomonas salina при разных значениях температуры; Таблица 1. - Параметры роста микроводоросли Rhodomonas salina при разных значениях температуры; Таблица 2. - Параметры роста микроводоросли Rhodomonas salina при разной освещенности; Фиг. 2 -Культивирование микроводоросли Rhodomonas salina в накопительном режиме. Фиг. 3 - Биохимический состав микроводоросли Rhodomonas salina при накопительном режиме культивирования.
Для выбора оптимальных условий культивирования, микроводоросль выращивали в накопительном режиме на модифицированной питательной среде Конвея при температуре: 20±1°С, 24±1°С и 28±1°С, круглосуточной освещенности поверхности культиваторов: 1 кЛк, 5 кЛк, 10 кЛк и 15 кЛк и непрерывном барботировании воздухом с помощью микрокомпрессора. В качестве культиваторов использовали круглые плоскодонные колбы (V=2 л). Круглосуточное освещение поверхности колб обеспечивали лампами Philips TLD 36 W/965.
При разных температурных режимах культивирования (Фиг. 1) наиболее интенсивный рост микроводоросли наблюдался при 24°С. Максимальная концентрация клеток 5.43⋅106 кл.⋅мл-1 была получена на 7-й день культивирования. При температуре 20 и 28°С максимальные концентрации были значительно ниже и составляли соответственно 3.28⋅106 и 3.72⋅106 кл.⋅мл-1. Максимальный среднесуточный прирост отмечен при температуре 24°С - 0.79⋅106 кл.⋅мл-1сут-1. При температуре 20°С и 28°С прирост был ниже и составил соответственно 0.27⋅106 кл.⋅мл-1сут-1 и 0.39⋅106 кл.⋅мл-1⋅сут-1. Удельная скорость роста при температуре 24°С была в 3 и 2 раза выше чем при 20°С и 28°С соответственно (табл. 1). Следовательно, температура 24±1°С является оптимальной для роста R. salina в контролируемых условиях.
Культивирование R. salina при освещенности 1, 5, 10 и 15 кЛк и оптимальной температуре: максимальные биомассы водоросли получены на 8-9-е сутки при освещенности 10 и 15 кЛк, составлявшие 3.74±0.28 и 3.52±0.21 г⋅л-1, соответственно. Существенных различий в показателях роста R. salina при освещенности 10 и 15 кЛк (μ=0.69±0.04 и 0.64±0.02 сут-1, соответственно) не наблюдалось. Рост был ограничен самой низкой освещенностью 1 кЛк (μ=0.33±0.03 сут-1), при которой максимальная биомасса составила 1.41 г⋅л-1 (табл. 2). При увеличении освещенности рабочей поверхности культиваторов от 1 до 5 кЛк концентрация клеток водоросли и биомасса увеличивались в 2 раза, но были значительно ниже, чем при 10 и 15 кЛк (Фиг. 2). Следовательно, освещенность 10 кЛк можно считать оптимальной при культивировании R. salina в накопительном режиме.
Пищевая ценность микроводоросли, как кормового объекта двустворчатых моллюсков определяется содержанием в ней белка, углеводов и липидов. При накопительном режиме культивирования и оптимальных условиях (24°С, 10 кЛк), максимальное количество белка - 29% получено на экспоненциальной фазе роста, а липидов - 41% на стационарной фазе (Фиг. 3). Липиды и белки составляют более 80% энергетического запаса двустворчатых моллюсков в период метаморфоза [Videla et al., 1998]. Накопление липидов во время онтогенеза, способствует росту личинок и успешному завершению метаморфоза [ et al., 1989; Tremblay et al., 2007]. При определении кормовой ценности водорослей важно знать качественный и количественный состав липидов, причем качество липидов важнее, чем их количество. Качество липидов определяется содержанием полиненасыщенных жирных кислот (ПНЖК). Микроводоросль R. salina содержит докозапентаеновую и доказагесаеновую кислоты, незаменимые для морских организмов. При высоком содержании липидов, полученных нами при накопительном культивировании R. salina, соответственно доля ПНЖК также увеличивается.
et al., 1989; Tremblay et al., 2007]. При определении кормовой ценности водорослей важно знать качественный и количественный состав липидов, причем качество липидов важнее, чем их количество. Качество липидов определяется содержанием полиненасыщенных жирных кислот (ПНЖК). Микроводоросль R. salina содержит докозапентаеновую и доказагесаеновую кислоты, незаменимые для морских организмов. При высоком содержании липидов, полученных нами при накопительном культивировании R. salina, соответственно доля ПНЖК также увеличивается.
Таким образом, оптимальными условиями культивирования микроводоросли R. salina являются: температура 24±1°С, модифицированная питательная среда Конвея, круглосуточное освещение 10 кЛк и непрерывное барботирование воздухом. При накопительном режиме культивирования максимальная биомасса 3.74 г⋅л-1 получена на 8 сутки выращивания. На стационарной фазе роста водоросль R. salina содержит максимальное количество липидов 41%, что позволяет включать ее в состав корма для личинок и спата двустворчатых моллюсков, выращиваемых питомнике.
Пример.
В питомнике ИМБИ РАН криптофитовую водоросль R. salina культивировали в конических плоскодонных колбах (V=2 л) в накопительном режиме на модифицированной питательной среде Конвея. За основу взяли сбалансированную по макроэлементам питательную среду Конвея, г/л: NaNO3 - 100,0; NaH2PO4 ⋅ 2H2O - 20,0; FeCl3 ⋅ 6 H2O - 2,6; Na2ЭДТА - 45,0; H3BO3 - 33,6; MnCl2 ⋅ 4 H2O - 0,36 и микроэлементов, г/100 мл: ZnCl2 - 2,1; CoCl2 ⋅ 6 H2O - 2,0; CuSO4 ⋅ 5 H2O - 2,0; (NH4)6Mo7O24 ⋅ 4 H2O - 0,9; H2O дист. - 100,0.
При оптимальных условиях культивирования водоросли (температура, освещенность) биогены полностью используются на рост и накопление биомассы. Поэтому при добавлении R. salina в выростные баки с личинками гигантской устрицы химический состав морской воды не может оказывать негативного действия на рост личинок.
Модифицированную питательную среду Конвея готовили на стерильной морской воде соленостью  с добавлением следующих макроэлементов, г/л: NaNO3 - 100,0; NaH2PO4 ⋅ 2H2O - 20,0; FeCl3 ⋅ 6 H2O - 5,2; Nа2ЭДТА - 45,0; Н3ВО3 - 33,6; MnCl2 ⋅ 4 H2O - 0,36 и микроэлементов, г/100 мл: ZnCl2 - 2,1; CoCl2 ⋅ 6 H2O - 2,0; CuSO4 ⋅ 5 H2O - 2,0; (NH4)6Mo7O24 ⋅ 4 H2O - 0,9; H2O дист. - 100,0.
с добавлением следующих макроэлементов, г/л: NaNO3 - 100,0; NaH2PO4 ⋅ 2H2O - 20,0; FeCl3 ⋅ 6 H2O - 5,2; Nа2ЭДТА - 45,0; Н3ВО3 - 33,6; MnCl2 ⋅ 4 H2O - 0,36 и микроэлементов, г/100 мл: ZnCl2 - 2,1; CoCl2 ⋅ 6 H2O - 2,0; CuSO4 ⋅ 5 H2O - 2,0; (NH4)6Mo7O24 ⋅ 4 H2O - 0,9; H2O дист. - 100,0.
Содержание железа в питательной среде увеличили в 2 раза. Железо занимает промежуточное положение между макро- микроэлементами. Потребность водорослей в железе ниже, чем в азоте и фосфоре, но выше, чем в других микроэлементах. В процессе фотосинтеза железо выполняет важную регуляторную роль, входя в состав многих ферментов. Недостаток железа в питательных средах вызывает значительное уменьшение продуктивности микроводорослей вследствие угнетения фотосинтетической активности, при этом замедляется деление клеток и уменьшается количество хлорофилла.
Водоросль культивировали при оптимальных условиях: температура 24°С, круглосуточное освещение с освещенностью 10 кЛк и круглосуточная аэрация воздухом. Максимальные численность клеток 7.10⋅106 кл.⋅мл-1 и биомасса 3.74±0.28 г⋅л-1 (сырой вес) были получены на 8 сутки. При переходе водоросли на стационарную фазу роста содержание липидов увеличивалось до 41%. На этом этапе культивирования микроводоросль R. salina включали в рацион личинок гигантской устрицы.
При выращивании личинок гигантской устрицы Crassostrea gigas в питомнике ИМБИ РАН микроводоросль R. salina включали в рацион на 14-е сут. выращивания. Размер личинок составлял - 190-200 мкм, и они способны были заглатывать клетки водоросли размером 7×12 мкм. Личинки находились в четырех емкостях объемом по 100 л в профильтрованной морской воде с постоянной аэрацией и ежедневной подачей корма при температуре воды 24°С. Плотность посадки личинок составляла от 2,5 тыс. лич.⋅л-1 до 7,2 тыс. лич.⋅л-1. В емкость с личинками с максимальной плотностью посадки (опыт) в состав корма включили еще R. salina концентрацией 100⋅103кл⋅мл-1. Уже через сутки среднее значение высоты раковины личинок в опыте было достоверно выше: 242,2±16,8 и 201,6±25,4 мкм соответственно. В последующие двое суток темп роста личинок гигантской устрицы в опыте составил 46,2 мкм⋅сут-1, тогда как без добавления R. salina - 25,2 мкм⋅сут-1. На 19-е сутки выращивания все личинки в опыте перешли в стадию педивелигера и осели на субстраты. В контроле оседание личинок произошло только на 23 сутки выращивания.
Следовательно, криптофитовая микроводоросль R. salina по качественному составу является хорошим кормовым объектом для личинок и спата двустворчатых моллюсков. Включение ее в рацион на поздних стадиях развития личинок мидий и устриц, выращиваемых в контролируемых условиях, способствует увеличению их темпа роста и выживаемости и сокращению продолжительности выращивания.
Источники информации, принятые во внимание:
1. Chaloub R.M., Motta N.M.S, Araujo S.P., Aguiar P.F., Silva A.F. Combined effects of irradiance, temperature and nitrate concentration on phycoerythrin content in the microalga Rhodomonas salina sp. (Cryptophyceae) // Alg. Res. 2015. Vol. 8. P. 89-94
2. Fabiola Lafarga-De la Cruz, Enrique Valenzuela-Espinoza, Roberto  Charles C. Treesc, Eduardo
Charles C. Treesc, Eduardo  Filiberto
Filiberto  Nutrient uptake, chlorophyll a and carbon fixation by Rhodomonas sp. (Cryptophyceae) cultured at different irradiance and nutrient concentrations. // Aquacultural Engineering. 2006. Vol. 35. №1. P. 51-60.
Nutrient uptake, chlorophyll a and carbon fixation by Rhodomonas sp. (Cryptophyceae) cultured at different irradiance and nutrient concentrations. // Aquacultural Engineering. 2006. Vol. 35. №1. P. 51-60.
3.  M.J.,
M.J.,  A., Ferreiro M.J., Blanco J., Planas M., Campos J.M., Labarta, U. Biomass production and variation on the biochemical profile (total protein, carbohydrates, RNA, lipids and fatty acids) of seven species of marine microalgae // Aquaculture. 1989. Vol. 83. P. 17-38.
A., Ferreiro M.J., Blanco J., Planas M., Campos J.M., Labarta, U. Biomass production and variation on the biochemical profile (total protein, carbohydrates, RNA, lipids and fatty acids) of seven species of marine microalgae // Aquaculture. 1989. Vol. 83. P. 17-38.
4. Minh Vu Thi Thuy, Claire  Thomas Allan Rayner et al. Optimization of photosynthesis, growth, and biochemical composition of the Rhodomonas salina: an established diet for live feed copepods in aquaculture // J. App. Phycol. 2016. V. 28, №3. P. 1485-1500.
Thomas Allan Rayner et al. Optimization of photosynthesis, growth, and biochemical composition of the Rhodomonas salina: an established diet for live feed copepods in aquaculture // J. App. Phycol. 2016. V. 28, №3. P. 1485-1500.
5. Tremblay R., Cartier S., Miner P., Pernet F.,  C., Moal J., Muzellec M., Mazuret M, Samain J. Effect of Rhodomonas salina addition to a standard hatchery diet during the early ontogeny of the scallop Pecten maximus II Aquaculture. 2007. Vol. 262, №. 2-4. P. 410-418.
C., Moal J., Muzellec M., Mazuret M, Samain J. Effect of Rhodomonas salina addition to a standard hatchery diet during the early ontogeny of the scallop Pecten maximus II Aquaculture. 2007. Vol. 262, №. 2-4. P. 410-418.
6. Videla J.A., Chaparro O.R., Thompson R.J., Concha I.I. Role of biochemical energy reserves in the metamorphosis and early juvenile development of the oyster Ostrea chilensis. II Mar. Biol. 1998. Vol. 132. P. 635-640.
7. Zhang J., Wu C, Pellegrini D., Romano G., Esposito F., Ianora A. Effects of different monoalgal diets on egg production, hatching success and apoptosis induction in a Mediterranean population of the calanoid copepod Acartia tonsa (Dana) // Aquaculture. 2013. Vol. 400-401. P. 65-72.