Результат интеллектуальной деятельности: НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ ВИРУСА ЗАПАДНОГО НИЛА 1 ГЕНОТИПА
Вид РИД
Изобретение
Изобретение относится к биотехнологии, молекулярной биологии и может быть использовано для идентификации вируса Западного Нила 1 генотипа West Nile virus lineage 1 в пробах биологического материала и клеточных культурах специалистами клинической лабораторной диагностики, службы Роспотребнадзора и в научных исследованиях.
Вирус Западного Нила (ВЗН, West Nile virus) принадлежит к семейству Flaviviridae, роду Flavivirus, антигенному комплексу вирусов японского энцефалита (Japanese encephalitis virus group). По принятой в Российской Федерации классификации патогенных биологических агентов ВЗН относят к вирусам II группы патогенности.
ВЗН является возбудителем природно-очаговой арбовирусной инфекции с трансмиссивным механизмом передачи, называемой лихорадкой Западного Нила (ЛЗН). Клинические проявления ЛЗН варьируют от гриппоподобного синдрома до развития тяжелых осложнений в форме менингита и менингоэнцефалита. Летальность при ЛЗН, в зависимости от иммунного статуса заболевших, составляет от 4 до 10%. С 1999 года лабораторно подтвержденные случаи ЛЗН на территории России регистрируют ежегодно. Ареалы ВЗН занимают огромные территории в пределах экваториального, тропического и умеренного климатических поясов в Африке, Европе, Америке, Азии и Австралии. В России ареал распространения ВЗН охватывает территории юга европейской части, регионы Сибири и Дальнего Востока.
По современным данным штаммы ВЗН разделены на 9 генотипов (генетических линий). В России достоверно зарегистрирована циркуляция 1, 2 и 4 генотипов ВЗН, имеющих разное эпидемическое значение. Так, штаммы ВЗН генотипов 1 и 2 являются высокопатогенными для человека, а патогенность ВЗН 4 генотипа для млекопитающих пока не установлена. Имеются данные, что инфицирование некоторыми штаммами ВЗН субгенотипа 1а, приводит к появлению более тяжелых нейроинвазивных форм ЛЗН. Это, по-видимому, свидетельствует о более высокой вирулентности некоторых штаммов ВЗН субгенотипа 1а по сравнению со штаммами субгенотипа 1b и генотипа 2.
Генотипирование - комплексный анализ уникального для каждого живого организма генотипа на основе изучения его генома. Циркуляция разных генетических линий вируса на территории Российской Федерации диктует необходимость разработки и совершенствования диагностических методов и тест-систем для выявления и дифференциации штаммов возбудителя лихорадки Западного Нила.
Одним из перспективных подходов выявления генотипа ВЗН в пробах биологического материала с высокой чувствительностью и специфичностью является использование полимеразной цепной реакции с обратной транскрипцией в реальном времени (ОТ-ПЦР). ОТ-ПЦР является прямым методом выявления РНК ВЗН. В основе метода ОТ-ПЦР лежит последовательное осуществление двух процессов: реакции обратной транскрипции и полимеразной цепной реакции. Реакция обратной транскрипции представляет собой синтез цепи комплементарной ДНК (кДНК) по матрице РНК посредством фермента ревертазы. Метод ПНР заключается в амплификации целевых участков полученной кДНК посредством фермента ДНК-полимеразы и праймеров, фланкирующих участки уникальных кДНК-мишеней, существующих только у определенных генотипов вируса.
Для эффективного проведения ОТ-ПЦР необходимы праймеры - синтетические олигонуклеотиды определенного размера, специфичные для каждого генотипа возбудителя. Праймеры комплементарны последовательностям ДНК специфичного фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК протекает только между ними. В результате ПНР происходит многократное увеличение числа копий (амплификация) специфичного участка гена, катализируемое ферментом ДНК-полимеразой.
При детекции продуктов амплификации использование специальных флуоресцентных меток позволяет отказаться от стадии электрофореза, что не только сокращает время проведения анализа, но и снижает риск контаминации продуктами ПЦР и, соответственно, нивелирует ложноположительные результаты. Поскольку регистрация результатов проводится непосредственно в процессе реакции амплификации, весь анализ можно проводить в двух зонах лаборатории силами одного сотрудника. Этот подход позволяет проводить автоматическую интерпретацию полученных результатов и снимает проблему субъективной оценки электрофореграмм.
Известен способ обнаружения вируса лихорадки Западного Нила, предусматривающий проведение реакции обратной транскрипции с РНК вируса и последующей двойной амплификацией (патент РФ №2199589 от 27.02.2003 г.), а также набор олигонуклеотидных праймеров и зондов для идентификации вируса клещевого энцефалита, вируса лихорадки Западного Нила, боррелий и риккетсий методом мультиплексной ПЦР в режиме реального времени (патент РФ №2629604 от 30.08.2017 г.). Однако предложенные в данных патентах олигонуклеотиды не позволяют определять генотип ВЗН.
В настоящее время известны зарегистрированные на территории РФ коммерческие наборы реагентов для обнаружения РНК ВЗН в биологическом материале: «АмплиСенс WNV-FL» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия), «ОМ-скрин ЛЗН/ЛДР-РВ» (ЗАО «Синтол» Россия), «ГенНил-РЭФ» (ФКУЗ РосНИПЧИ «Микроб» Роспотребнадзора, Россия). Данные наборы реагентов обладают достаточной чувствительностью и специфичностью, однако с их помощью возможно только выявление генетического материала ВЗН без дифференциации его генетических линий.
Разработаны олигонуклеотидные праймеры для идентификации 1a, 1b, 2 и 4 генотипов ВЗН методом секвенирования фрагментов генома [Жуков, К.В. Эпидемиологическая характеристика лихорадки Западного Нила и молекулярно-генетические особенности изолятов, циркулирующих на территории Волгоградской области: диссертация кандидата медицинских наук: 14.02.02 / Жуков Кирилл Вадимович. - Волгоград, 2013. - 133 с.]. Для определения полногеномной нуклеотидной последовательности штаммов ВЗН 1 генотипа методом секвенирования по Сенгеру известны специфичные праймеры, предложенные Прилиповым А.Г. [Прилипов, А.Г. Генетическая характеристика штаммов вируса Западного Нила: диссертация доктора биологических наук: 03.01.03 / 03.02.02 / Прилипов Алексей Геннадьевич. - М., 2015. - 213 с.]. Однако способ генотипирования основанный на секвенировании может быть реализован только для образцов с высокой концентрацией вирусной РНК. Большинство клинических образцов имеет низкую вирусную нагрузку, что снижает эффективность применения секвенирования для определения генотипа ВЗН в нативном материале.
Наиболее близким аналогом является подход одновременного выявления и дифференциации вируса Западного Нила 1 и 2 генотипов, а также вируса Усуту, методом количественной мультиплексной ОТ-ПЦР в режиме реального времени с применением технологии «TaqMan» [Javier Del Amo et al. A novel quantitative multiplex real-time RT-PCR for the simultaneous detection and differentiation of West Nile virus lineages 1 and 2, and of Usutu virus // J. Virol. Methods. 189 (2013) 321-327]. Однако в данной работе дифференциацию осуществляли только с помощью зондов, а для получения ампликонов использовали универсальную пару праймеров для обоих генотипов ВЗН, что может снижать специфичность реакции.
Целью настоящего изобретения является разработка набора специфичных олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации вируса Западного Нила 1 генотипа методом полимеразной цепной реакции с обратной транскрипцией и гибридизационно-флуоресцентным учетом результатов.
Цель достигается созданием набора олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации вируса Западного Нила 1 генотипа методом полимеразной цепной реакции с обратной транскрипцией и гибридизационно-флуоресцентным учетом результатов, комплементарных фрагментам гена полипротеина вируса Западного Нила 1 генотипа, обладающих активностью прямого и обратного праймеров, и зонда, сконструированного по типу «молекулярного маяка», обеспечивающего флуоресцентную детекцию продукта амплификации размером 152 п.н. в реальном времени, имеющих следующую структуру:
Где:
FAM - карбоксифлуоресцеин, флуоресцентный краситель, длина волны поглощения которого составляет 492 нм, а длина волны флуоресценции - 520 нм;
BHQ1 - гаситель флуоресценции с диапазоном гашения 480-580 нм.
Характеристика олигонуклеотидных праймеров, зонда и кДНК мишени для идентификации вируса Западного Нила 1 генотипа
Основываясь на данных, представленных в генетической базе GenBank NCBI (National Center for Biotechnology Information, США), для идентификации ВЗН 1 генотипа методом полимеразной цепной реакции с обратной транскрипцией были подобраны праймеры, обозначенные WNV-ltype-F/WNV-ltype-R, комплементарные фрагменту гена полипротеина ВЗН (flavivirus polyprotein gene). Расчетная длина специфичного фрагмента, фланкируемого разработанными праймерами, составила 152 п.н.
Для детекции продуктов ОТ-ПЦР в режиме реального времени был сконструирован зонд формата «молекулярный маяк», обозначенный WNV-ltype-P, на концах которого расположены флуорофор и гаситель флуоресценции. Подобная структура зонда обеспечивает максимальный эффект тушения и низкую фоновую флуоресценцию, поскольку молекулы флуорофора и гасителя сближены в пространстве.
Апробацию разработанного набора олигонуклеотидов осуществляли с использованием проб биологического материала, инфицированного ВЗН 1, 2 и 4 генотипов. Пробы были получены из Референс-центра по мониторингу за возбудителем лихорадки Западного Нила, функционирующего на базе ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора. Генотип ВЗН во всех использованных образцах дополнительно подтверждали методом секвенирования. В качестве положительного контроля использовали РНК ВЗН 1 генотипа.
Для обнаружения ВЗН 1 генотипа методом ОТ-ПЦР в реальном времени оценена возможность использования сконструированного набора праймеров и зонда при анализе различного клинического материала - кровь, сыворотка крови, моча, ткани головного мозга, а также суспензий комаров. Показано, что в реакции амплификации возбудитель детектировали во всех образцах биологического материала, инфицированных ВЗН 1 генотипа.
Примеры конкретного выполнения Пример 1. Методика конструирования набора олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации кДНК ВЗН 1 генотипа методом ОТ-ПЦР и гибридизационно-флуоресцентным учетом результатов.
На основе множественного выравнивания in silico полногеномных нуклеотидных последовательностей различных штаммов ВЗН 1 генотипа, депонированных в генетических базах данных (GenBank, EMBL, DDBJ) для конструирования прямого WNV-ltype-F и обратного WNV-ltype-R праймеров, предназначенных для идентификации вируса Западного Нила 1 генотипа, была выбрана последовательность гена, кодирующего полипротеин ВЗН (flavivirus polyprotein gene), длина которой составляет 10302 нуклеотида (GenBank NCBI, GeneID: 5714902). Размер каждого из разработанных специфичных праймеров (WNV-ltype-F и WNV-ltype-R) составил 18 нуклеотидов. Расчетная длина фрагмента кДНК ВЗН, фланкируемого предлагаемыми праймерами - 152 п. н.
При использовании компьютерной программы PerlPrimer v 1.1.21 была проанализирована структура выбранной пары праймеров WNV-ltype-F/WNV-ltype-R (образование димеров, шпилек и других вторичных структур) и показана их теоретическая пригодность для успешной инициации реакции амплификации.
Для флуоресцентной детекции продуктов ОТ-ПЦР в режиме реального времени сконструирован специфичный флуоресцентно-меченый олигонуклеотидный зонд, обозначенный WNV-ltype-P, размером 29 нуклеотидов, который гибридизуется на участке ампликона между прямым WNV-ltype-F и обратным WNV-ltype-R праймерами. Комплементарные концевые последовательности зонда образуют «шпильку» по принципу «молекулярного маяка». В качестве метки использовали флуорофор FAM на 5'-конце зонда и гаситель флуоресценции BHQ1- на 3' конце. В онлайн-режиме с использованием программы Mfold на интернет-сайте http://unafold.rna.albany.edu оценивали вторичную структуру и термодинамические параметры разработанного зонда.
Характеристика сконструированных олигонуклеотидных праймеров и зонда для выявления кДНК вируса Западного Нила 1 генотипа представлена в таблице 1.
Сконструированные праймеры и зонд были проанализированы с помощью компьютерной программы BLAST на web-сервере Национального Центра Биотехнологической Информации (NCBI) (http://www.ncbi.nlm.nih.gov/BLAST/) для установления гомологии между ними и нуклеотидными последовательностями близкородственных вирусов и гетерологичных микроорганизмов, присутствующих в базах данных (GenBank, EMBL, DDBJ). На момент проведения компьютерного анализа, гомологии выявлено не было.
Пример 2. Амплификация и детекция специфичных фрагментов кДНК ВЗН с помощью разработанного набора праймеров WNV-ltype-F/WNV-ltype-R и флуоресцентно-меченого зонда WNV-ltype-P для идентификации вируса Западного Нила 1 генотипа методом ОТ-ПЦР в режиме реального времени.
Работу с образцами биологического материала проводили согласно требованиям СП 1.3.3118-13 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)» и МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Выделение РНК ВЗН из биологических образцов осуществляли с помощью наборов реагентов «РИБО-золь-С» и «РИБО-преп» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия) в соответствии с инструкциями к наборам.
Для проведения ОТ-ПЦР в режиме реального времени готовили реакционную смесь, в состав которой помимо анализируемой РНК ВЗН, входили: разработанные праймеры WNV-ltype-F/WNV-ltype-R и флуоресцентно-меченый зонд WNV-ltype-P, а также дезоксирибонуклеозид-трифосфаты, буферный раствор, раствор хлорида магния, фермент ревертаза MMlv и фермент Taq-F-ДНК-полимераза. В качестве отрицательного контроля в пробирку вместо образца вносили равный объем дистиллированной воды. В качестве положительного контроля использовали РНК ВЗН 1 генотипа.
Обратную транскрипцию и ПЦР проводили в одной пробирке. Объем реакционной смеси составлял 25 мкл.
Условия проведения реакции: этап обратной транскрипции при 50°С - 30 мин; этап предварительной денатурации при 95°С - 15 мин; первое циклирование (5 повторений) - денатурация при 95°С - 5 с; отжиг праймеров при 56°С - 25 с; элонгация цепи при 72°С - 15 с; второе циклирование (40 повторений) - денатурация при 95°С - 5 с; отжиг праймеров при 56°С - 25 с; элонгация цепи при 72°С - 15 с. Детекцию накопления продуктов реакции осуществляли по каналу Green на этапе второго циклирования при температуре 56°С.
Анализ продуктов ОТ-ПЦР осуществляли в режиме реального времени на амплификаторе «Rotor-Gene Q» («QIAGEN», Германия). Регистрацию результатов проводили в табличной и графической форме с помощью программного обеспечения к прибору. Результаты оценивали по наличию или отсутствию пересечения кривой накопления флуоресценции с пороговой линией, что определяется значением порогового цикла «Ct - cycle threshold)) в соответствующей графе в таблице результатов. Положительными считали образцы, для которых значение порогового цикла не превышало 33 на этапе второго циклирования.
Пример 3. Определение специфичности реакции амплификации с помощью разработанного набора олигонуклеотидных праймеров WNV-ltype-F/WNV-ltype-R и флуоресцентно-меченого зонда WNV-ltype-P для идентификации вируса Западного Нила 1 генотипа методом ОТ-ПЦР в режиме реального времени.
Специфичность ОТ-ПЦР с разработанными праймерами и зондом оценивали при исследовании образцов РНК, выделенных из проб биологического материала, инфицированных вирусом Западного Нила 1, 2 и 4 генотипов. В качестве биологического материала, инфицированного ВЗН 1 генотипа, использовали клинические образцы (4 пробы суспензий головного мозга, 1 пробу цельной крови, 1 пробу сыворотки крови) и 1 пробу суспензии комаров Culex pipiens. Образцами биологического материала, инфицированного ВЗН 2 генотипа, являлись клинические образцы (2 пробы суспензий головного мозга, 2 пробы цельной крови, 1 проба сыворотки крови, 1 проба мочи) и 1 проба суспензии комаров Culex pipiens. В качестве образцов биологического материала, инфицированного ВЗН 4 генотипа использовали 7 проб суспензий комаров Uranotaenia unguiculata. Генотип ВЗН во всех использованных образцах был подтвержден методом секвенирования.
Пробоподготовку и постановку реакции ОТ-ПЦР осуществляли, как описано в примере 2. При тестировании исследуемых образцов с использованием разработанного набора олигонуклеотидных праймеров WNV-ltype-F/WNV-ltype-R и зонда WNV-ltype-P положительный результат ОТ-ПЦР в режиме реального времени был получен для всех проб, инфицированных вирусом Западного Нила 1 генотипа. С образцами биологического материала, инфицированными вирусом Западного Нила генотипов 2 и 4, в реакции ОТ-ПЦР с разработанным набором праймеров WNV-ltype-F/WNV-ltype-R и зонда WNV-ltype-P получен отрицательный результат в 100% случаев.
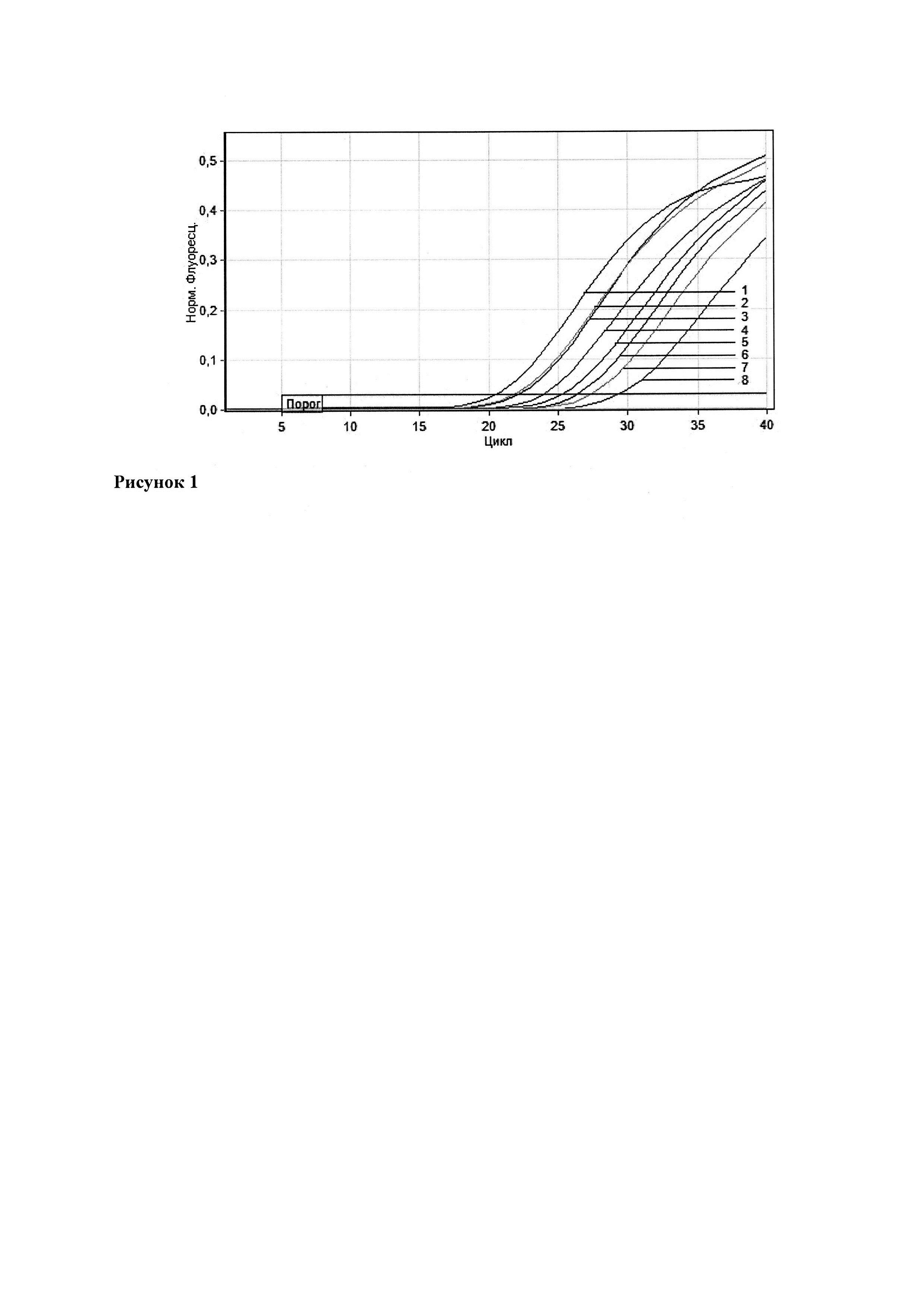
На рисунке 1 представлен график кривых нарастания флуоресценции, полученный при исследовании проб биологического материала методом ОТ-ПЦР в реальном времени с помощью сконструированного набора олигонуклеотидных праймеров WNV-ltype-F/WNV-ltype-R и флуоресцентно-меченого зонда WNV-ltype-P. Цифрами 1-7 обозначены пробы, инфицированные ВЗН 1 генотипа (1-4 - пробы суспензий головного мозга, 5 - проба цельной крови, 6 - проба сыворотки крови, 7 - проба суспензии комаров Culex pipiens). Цифрой 8 отмечен положительный контроль. Отрицательный контроль, а также пробы, инфицированные ВЗН 2 и 4 генотипов, располагаются ниже пороговой линии.
Таким образом, разработанный набор олигонуклеотидных праймеров WNV-ltype-F/WNV-ltype-R и флуоресцентно-меченого зонда WNV-ltype-P позволяет в короткий срок с высокой специфичностью выявлять вирус Западного Нила 1 генотипа в биологическом материале и может быть использован при проведении эпидемиологического надзора за лихорадкой Западного Нила.