Результат интеллектуальной деятельности: НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ ДНК ВОЗБУДИТЕЛЕЙ БРУЦЕЛЛЕЗА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕАЛЬНОМ ВРЕМЕНИ "ОМ-СКРИН-БРУЦЕЛЛЕЗ-РВ"
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности к медицинской диагностике, и может быть использовано в учреждениях медицины и здравоохранения, в лабораториях Центров гигиены и эпидемиологии и противочумных учреждениях Роспотребнадзора, в эпидемиологических службах, а также в стационарных и мобильных лабораториях специализированных учреждений других министерств и ведомств, в том числе Министерства обороны, для поддержки диагностики специфической патологии (бруцеллез) при исследовании материала от больного (подозрительного на заболевание) и индикации патогенных биологических агентов (ПБА) в объектах окружающей среды; как ускоренного предварительного теста при выполнении биологического метода исследования и идентификации. подозрительных культур; для эпидемиологического мониторинга.
В течение последних лет бруцеллез приобрел особую актуальность для ряда территорий Российской Федерации, традиционно занятых в сфере животноводства. Эпидемиологическая значимость бруцеллеза определяется разнообразием возбудителей и путей передачи инфекции, полиморфизмом клинических проявлений и склонностью к хроническому течению заболеваний, часто приводящих к инвалидизации, высоким удельным весом профессиональной патологии, непосредственной связью с животными или продуктами животного происхождения. В Российской Федерации в последние 5 лет ежегодно регистрируется до 500 случаев впервые выявленного бруцеллеза среди людей. Наиболее неблагополучными являются Северо-Кавказский, Южный и Сибирский федеральные округа.
Очевидно, что в подобных условиях особенно остро стоит проблема идентификации патогенных для человека видов бруцелл и их дифференциации от других представителей рода Brucella.
В настоящее время идентификация и дифференциация возбудителей бруцеллеза осуществляется согласно методическим указаниям МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика бруцеллеза людей» и МУК 4.2.3010-12 «Порядок организации и проведения лабораторной диагностики бруцеллеза для лабораторий территориального, регионального и федерального уровней». Лабораторная диагностика проводится в несколько этапов с помощью бактериологического, биологического, серологического, аллергологического и молекулярно-биологического методов.
Эффективность бактериологического метода зависит от качества питательных сред, концентрации возбудителя в исследуемом материале, степени контаминации последнего посторонней микрофлорой и времени, прошедшего с момента заражения. Срок бактериологического исследования составляет от 15 до 30 дней, а при постановке биологической пробы он увеличивается вдвое (МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика бруцеллеза людей»).
Диагностическая ценность серологических методов снижается из-за перекрестных реакций между Brucella abortus и Yersinia enterocolitica, серовариант 0:9, родами Pasteurella, Vibrio и другими бактериями. Положительные результаты отмечают при серологическом исследовании здоровых животных, вакцинированных против бруцеллеза (Гайдара Б., Желудков М.М., Чернышева М.И. Оценка эффективности лабораторной диагностики бруцеллеза / Журн. микробиол. 1994, №4, с. 55-58; Cerri D., Ebani V.V., Pedrini A., Bassi S., Bey R.F., Andreani E., Farina R. Evaluation of tests employed in serological diagnosis of brucellosis caused by Brucella ovis / New Microbiol. 2000, Vol. 23, N. 3, p. 281-288).
На сегодняшний день в открытой литературе описано - несколько различных подходов к идентификации бруцелл методом полимеразной цепной реакции (ПЦР). Так, Redkar et al. разработали способ идентификации В.abortus, B.melitensis, и B.suis biovar 1 методом полимеразной цепной реакции в реальном времени (ПЦР-РВ), основанный на выявлении последовательностей IS711, находящихся в различных областях геномов соответствующих возбудителей (R. Redkar, S. Rose, В. Bricker, and V DelVecchio. Real-time detection of Brucella abortus, Brucella melitensis, and Brucella suis. / Mol. Cell. 2001. N. 15, p. 43-52). William S. Probert et al. разработали мультиплексный формат данного теста с целью возможности выявления всех трех видов в одной реакции (William S. Probert, Kimmi N. Schrader, Nhi Y. Khuong et al. Real-Time Multiplex PCR Assay for Detection of Brucella spp., B.abortus, and B.melitensis / J. of Clin. Microbiol. 2004, Vol. 42, N. 3, p. 1290-1293). Seong Guk Kim et al. в 2007 г. разработали тест-систему для идентификации микроорганизмов рода Brucella, основанную на амплификации фрагмента гена gap, кодирующего глицеральдегид-3-фосфатдегидрогеназу, с детекцией результатов ПЦР-РВ (Seong Guk Kim, Yeong Hwan Kim, Myeong Ju Chae et. al. Real-time PCR Assay Based Glyceraldehydes 3-Phosphate Gene for Identification of Brucella sp. / J. of Animal and Veterinary Advances 2010, Vol. 9, N. 17, p. 2315-2320). Следует отметить также исследования Jonas M.Winchell et. al., которые на основании семи различий в нуклеотидных последовательностях бруцелл разработали способ идентификации представителей рода Brucella методом ПЦР-РВ в комплексе с анализом кривых плавления с высокой разрешающей способностью (Jonas M. Winchell et. al. Rapid Identification and Discrimination of Brucella Isolates by Use of Real-time PCR and High-Resolution Melt Analysis / J. of Clin. Microbiol. 2010, Vol. 48, N. 3, p. 697-702).
Известно несколько запатентованных наборов диагностических средств для идентификации и дифференциации бруцелл методом ПЦР-РВ (United States Patent 7,494,773, «Nucleotide sequences specific to Brucella and methods for the detection of Brucella» (данный патент представляет 6 специфических участков генома бруцелл и 6 пар соответствующих олигонуклеотидных праймеров и ДНК-зондов, пригодных для специфического обнаружения бруцелл в различных пробах); KR 20090100950 (A), «Method for detection brucellosis using real time PCR» (метод основан на специфической амплификации фрагмента ДНК В.abortus и специфической детекции флуоресценции, что позволяет выявлять в пробах ДНК В.abortus); Deutsches Patent DE 10261468 (A1), «Test kit for detecting Brucella species, potential biological warfare agents, in the environment, comprises primers for specific amplification, optionally also hybridization probe» (данная тест-система позволяет выявлять в пробах воды, воздуха, почвы методом ПЦР-РВ фрагмент гена, кодирующего поверхностный белок клеточной мембраны у B.melitensis и В.abortus.); CN 103981261, «Method for detection and differential diagnosis or Brucella in aerosol» (метод позволяет выявлять микроорганизмы рода Brucella в пробах аэрозоля); KR 1020120131830, «Primer set for distinguising 10 brucella species and a distinguishing method using the same» (набор из 18 праймеров, позволяющий дифференцировать все 10 видов бруцелл, признанных в настоящее время).
Известен способ лабораторной диагностики бруцеллезной инфекции у людей (Патент России №2001121392/14, опублик. 10.05.2003). Способ обеспечивает повышение чувствительности и достоверности лабораторной диагностики бруцеллезной инфекции у людей с применением селективного концентрирования проб на магноиммуносорбентах, и последующим генотестированием их методом ПЦР. Использование в анализе бруцеллезных магноиммуносорбентов приводит к увеличению специфичности и чувствительности определения.
Наиболее близким к заявляемому нами изобретению является «PCR kit for simultaneously detecting Brucella abortus, Brucella melitensis, Brucella suis and Brucella canis as well as preparation method and using method thereof», CN 103409520. Данный набор позволяет в пробах окружающей среды методом ПЦР с использованием четырех пар специфических праймеров выявлять Brucella abortus, Brucella melitensis, Brucella suis и Brucella canis.
Общим с заявляемой тест-системой является специфическая идентификация эпидемиологически значимых видов бруцелл (Brucella abortus, Brucella melitensis, Brucella suis и Brucella canis), а также использование метода полимеразной цепной реакции. Преимуществом заявляемого изобретения является формат проведения полимеразной цепной реакции в реальном времени, что сокращает время, необходимое для проведения анализа, и существенно упрощает обработку результатов исследований.
Признаками, отличающими предлагаемое изобретение от перечисленных аналогов, являются специфические компоненты реакции, методические подходы и нуклеотидные последовательности праймеров, приведенные в перечне последовательностей.
Задачей заявляемого изобретения является достоверное обнаружение в пробах объектов окружающей среды, в бактериальных культурах, в патологическом материале ДНК микроорганизмов рода Brucella с одновременной идентификацией эпидемиологически значимых видов В.abortus, В.suis, В.canis, B.melitensis, а также повышение технологичности и экспрессности процесса лабораторной диагностики бруцеллеза за счет исключения использования сложных и трудоемких диагностических тестов, сокращения общего числа необходимых последовательных процедур при проведении анализа и уменьшения вероятности внутрилабораторной контаминации.
Техническим результатом заявляемого изобретения является создание набора реагентов: праймеров и флуоресцентно-меченых зондов, позволяющих в реакции амплификации достоверно выявлять специфические геномные участки микроорганизмов рода Brucella с одновременной идентификацией эпидемиологически значимых видов В.abortus, В.suis, В.canis, B.melitensis.
Указанный технический результат достигается разработкой набора специфических олигонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для выявления и идентификации ДНК возбудителей бруцеллеза методом полимеразной цепной реакции в реальном времени, имеющих представленную ниже (и в приложении к заявке) структуру нуклеотидных последовательностей:
для выявления родовой принадлежности бруцелл:
SEQ ID NO 1 (прямой праймер Br.spp_up): tcgagccaggctgtggtttc;
SEQ ID NO 2 (обратный праймер Br.spp_low): tcaccaagctttcgggcggtg;
SEQ ID NO 3 (флуоресцентный зонд Br.spp_FAM): (FAM)-gcagaagcttgcacagcg-(BHQ1);
для выявления Brucella abortus:
SEQ ID NO 4 (праймер Br_1_1_wt block 1): ggcttggaaagcagaatcttgca;
SEQ ID NO 5 (флуоресцентный зонд Br1_1_aR6G): (R6G)-aagcagaatcttgcacagcg-(BHQ2);
для выявления Brucella suis:
SEQ ID NO 6 (прямой праймер Br_suis_F): aggcatgacaagtctttcct;
SEQ ID NO 7 (обратный праймер Br_suis_R): accttcatgtcttttgcggtaa;
SEQ ID NO 8 (флуоресцентный зонд Br_suis_ROX): (ROX)-aggagccttcgtccgg-(BHQ2);
для выявления Brucella canis:
SEQ ID NO 9 (прямой праймер Br_3_F: aacggaaaaaggtatctcca;
SEQ ID NO 10 (обратный праймер Br_3_R: aacatggctttcggcgtctgc;
SEQ ID NO 11 (флуоресцентный зонд Br_3_cR6G): (R6G)-accgatcaacatcgctttcgg-(BHQ2);
для выявления Brucella melitensis:
SEQ ID NO 12 (прямой праймер Br2_F): accaccaccagtccgatagtta;
SEQ ID NO 13 (обратный праймер Br2_R): acgacgctttcaaggaaaccatc;
SEQ ID NO 14 (флуоресцентный зонд Br2_1_mROX): (ROX)-aggagccttcgtccgg-(BHQ2);
для внутреннего положительного контроля:
SEQ ID NO 15 (прямой праймер IPC_up4): agaactcgtagcgctagctgtag;
SEQ ID NO 16 (обратный праймер IPC_low2): cgtagaactagctgtagcgct;
SEQ ID NO 17 (флуоресцентный зонд IPC_up_Cy5): (Cy5)-agcggctcctacttctgcagggg-(BHQ2).
Примечание - BHQ1, BHQ2 - присоединенные к 5'-концевому нуклеотиду темновые гасители флуоресценции; FAM, R6G, ROX, Су5 флуоресцентные красители, присоединенный к 3'-концевому нуклеотиду.
Кроме того, в состав набора реагентов включены: разбавитель, положительный контрольный образец, отрицательный контрольный образец, внутренний положительный контроль выделения.
Характеристика набора праймеров и участка амплифицируемой геномной ДНК рода Brucella. Предлагаемые к патентованию в составе набора реагентов праймеры фланкируют фрагмент (127 п.н.) родоспецифичного гена abc, кодирующиего ABC транспортер АТФ-связывающего белка YJJK бруцелл. Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной ДНК Brucella abortus. Предлагаемые к патентованию в составе набора реагентов праймеры фланкируют фрагмент (64 п.н.) родоспецифичного гена abc, кодирующиего ABC транспортер АТФ-связывающего белка YJJK бруцелл и содержащего специфичный только для Brucella abortus единичный нуклеотидный полиморфизм SNP(A). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной ДНК Brucella suis. Предлагаемые к патентованию в составе набора реагентов праймеры фланкируют фрагмент (139 п.н.) гена ундекапренил-фосфат α-N-ацетилглюкозаминил-трансферазы бруцелл. Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной ДНК Brucella canis. Предлагаемые к патентованию в составе набора реагентов праймеры фланкируют фрагмент (132 п.н.) гена, кодирующего белок BCAN_B0380 у бруцелл. Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной ДНК Brucella melitensis. Предлагаемые к патентованию в составе набора реагентов праймеры фланкируют фрагмент (99 п.н.) гена пермеазы системы транспорта сульфата бруцелл cysw, содержащего специфичный только для Brucella melitensis единичный нуклеотидный полиморфизм SNP(G). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Состав заявляемого набора реагентов приведен в таблице 1.
Реакционная смесь в стрипованных микропробирках (лиофилизованная), РС-Бру1, расфасована в микропробирки в стрипах объемом 0,2 мл, упакованные в непрозрачный полиэтиленовый пакет Zip-Lock размером 9×12 см, состав: эквимолярная смесь дезоксинуклеозидтрифосфатов, пять олигонуклеотидных праймеров, четыре флуоресцентных зонда, фермент Taq ДНК-полимераза, синтетическая ДНК внутреннего положительного контроля (ВПК), трегалоза. Также данная смесь включает IRD14 ROX.
Реакционная смесь в стрипованных микропробирках (лиофилизованная), РС-Бру2, расфасована в микропробирки в стрипах объемом 0,2 мл, упакованные в непрозрачный полиэтиленовый пакет Zip-Lock размером 9×12 см, состав: эквимолярная смесь дезоксинуклеозидтрифосфатов, шесть олигонуклеотидных праймеров, четыре флуоресцентных зонда, фермент Taq ДНК-полимераза, синтетическая ДНК внутреннего положительного контроля (ВПК), трегалоза.
Разбавитель РБ, расфасован в две пробирки из полипропилена объемом 1,5 мл с завинчивающейся крышкой, упакованные в полиэтиленовый пакет Zip-Lock размером 4×7 см, состав: ПЦР-буфер, хлорид магния, глицерол, вода для ПЦР.
Положительный контрольный образец (лиофилизованный), ПКО, расфасован в три пробирки из полипропилена объемом 0,5 мл с завинчивающейся крышкой, упакованные в полиэтиленовый пакет Zip-Lock размером 6×7 см, состав: смесь пяти рекомбинантных плазмид pGem-T, содержащих встроенные специфические последовательности ДНК: фрагмент родоспецифичного для Brucella spp. гена abc, кодирующего ABC транспортер АТФ-связывающего белка YJJK; фрагмент гена abc, содержащий видоспецифичный в отношении Brucella abortus SNP(A); фрагмент гена ундекапренил-фосфат α-N-ацетилглюкозаминилтрансферазы, специфичный для Brucella suis; фрагмент гена, кодирующего белок BCAN_B0380, специфичный в отношении Brucella canis; фрагмент гена cysw, содержащий видоспецифичный в отношении Brucella melitensis SNP(G).
Отрицательный контрольный образец, ОКО, расфасован в пробирку из полипропилена объемом 1,5 мл с завинчивающейся крышкой, упакованную в полиэтиленовый пакет Zip-Lock размером 4×7 см, состав: ТЕ буфер.
Внутренний положительный контроль выделения, ВПК, (лиофилизованный), расфасован в пробирку из полипропилена объемом 0,5 мл с завинчивающейся крышкой, упакованную в полиэтиленовый пакет Zip-Lock размером 4×7 см, состав: рекомбинантая плазмида pTgt2 со встроенным специфическим фрагментом ДНК.
Методика получения положительных контрольных образцов.
Положительные контрольные образцы были получены методом клонирования. Компетентные клетки E.coli линии ТОР 10 (Invitrogen, США) были трансформированы рекомбинантными плазмидами pGem-T (Invitrogen, США), несущими родо- или видоспецифическую вставку искусственно синтезированных фрагментов ДНК соответствующих видов бруцелл.
Конструирование внутреннего контрольного образца.
В качестве внутреннего контрольного образца была использована рекомбинантная плазмида pTgt2 со встроенным специфическим фрагментом ДНК (конечная концентрация при разведении составляет 100 копий⋅мкл-1). Внутренний положительный контроль выделения позволяет компенсировать ингибирование и контролировать процессы пробоподготовки и амплификации, что обеспечивает более точное определение ДНК в каждом анализируемом образце.
Апробация набора реагентов.
Апробация набора реагентов была осуществлена на базе филиала ФГБУ «48 ЦНИИ» Минобороны России (г. Киров) с использованием водных суспензий агаровых культур штаммов возбудителей бруцеллеза из Государственной коллекции микроорганизмов I-II групп патогенности. Постановку ПЦР-РВ проводили в соответствии с разработанной инструкцией по применению набора реагентов на приборе АНК-32М производства ИАП РАН (г. Санкт-Петербург, Россия).
Инактивация материала.
Обеззараживание материала проводили согласно методическим указаниям по организации работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащем микроорганизмы I-IV групп патогенности (МУ 1.3.2569-09).
Выделение ДНК.
Для выделения ДНК из инактивированных бактериальных суспензий использовали набор для выделения ДНК «М-Сорб» (ЗАО «Синтол», Россия). Полученные препараты ДНК использовали для проведения анализа методом ПЦР-РВ.
Проведение полимеразной цепной реакции в реальном времени.
Реакцию амплификации для каждого образца проводили одновременно по двум реакционным смесям (РС-Бру1 и РС-Бру2) из состава набора реагентов, следующего состава:
Реакционная смесь РС-БруГ. эквимолярная смесь дезоксинуклеозидтрифосфатов (дНТФ) в количестве 8,8 нмоль; праймер Br.spp_up в количестве 7,5 пмоль; праймер Br.spp_low в количестве 7,5 пмоль; флуоресцентный зонд Br.spp(FAM) в количестве 4,0 пмоль; праймер Br_1_1_wt block1 в количестве 7,5 пмоль; флуоресцентный зонд Br1_1_a(R6G) в количестве 4,0 пмоль; праймер Br_suis_F в количестве 7,5 пмоль; праймер Br_suis_R в количестве 7,5 пмоль; флуоресцентный зонд Br_suis(ROX) в количестве 4,0 пмоль; праймер IPC_up4 в количестве 4,0 пмоль; праймер IPC_low2 в количестве 4,0 пмоль; флуоресцентный зонд IPC_up_Cy5 в количестве 1,5 пмоль; фермент Taq ДНК-полимераза, 5 ед.; ВПК, рекомбинантная плазмида pTgt2 со встроенным специфическим фрагментом ДНК; трегалоза, 5%. Также данная смесь включает IRD14 ROX.
Реакционная смесь РС-Бру2: эквимолярная смесь дезоксинуклеозидтрифосфатов (дНТФ) в количестве 8,8 нмоль; праймер Br.spp_up в количестве 7,5 пмоль; праймер Br.spp_low в количестве 7,5 пмоль; флуоресцентный зонд Br.spp(FAM) в количестве 4,0 пмоль; праймер Br2_F в количестве 7,5 пмоль; праймер Br2_R в количестве 7,5 пмоль; флуоресцентный зонд Br_3_c(R6G) в количестве 4,0 пмоль; праймер Br_3_F в количестве 7,5 пмоль; праймер Br_3_R в количестве 7,5 пмоль; флуоресцентный зонд Br2_1_m(ROX) в количестве 4,0 пмоль; праймер IPC_up4 в количестве 4,0 пмоль; праймер IPC_low2 в количестве 4,0 пмоль; флуоресцентный зонд IPC_up_Cy5 в количестве 1,5 пмоль; фермент Taq ДНК-полимераза, 5 ед.; ВПК, рекомбинантная плазмида pTgt2 со встроенным специфическим фрагментом ДНК; трегалоза, 5%.
К каждой реакционной смеси добавляли по 15 мкл разбавителя (10×ПЦР-буфер; хлорид магния, 25 мМ; глицерол, 50%; азид натрия 0,01%; вода для ПЦР) и 20 мкл исследуемого образца.
Постановку ПЦР осуществляли с использованием амплификатора АНК-32М в соответствии с инструкцией по эксплуатации прибора. Оптимальные температурно-временные режимы проведения ПЦР с учетом термодинамических характеристик праймеров и ДНК-зондов из состава набора реагентов для АНК-32М представлены в таблице 2.

Детекцию интенсивности флуоресценции проводили по каналам соответствующим красителям FAM, R6G, ROX, Су5 (либо их спектральным аналогам) со следующими характеристиками - λмакс.возб./λмакс.эм. (№1 - 490 нм/520 нм, №2 - 525 нм/550 нм, №3 - 550 нм/580 нм, №4 - 630 нм/665 нм). Результаты оценивали по наличию (отсутствию) флуоресценции.
Оценка полученных результатов
Интерпретацию результатов анализа проводили согласно таблице 3.
Результаты анализа представлены в таблице 3.
Изобретение иллюстрируется следующими графическими материалами (табл. 1-5, фиг. 1-4) и примерами (1-3).
Таблица 1. Состав набора реагентов «ОМ-Скрин-Бруцеллез-РВ»;
Таблица 2. Температурно-временной режим амплификации;
Таблица 3. Интерпретация результатов анализа с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ»
Таблица 4. Результаты оценки аналитической специфичности набора реагентов «ОМ-Скрин-Бруцеллез-РВ» с применением музейных тест-штаммов микроорганизмов;
Таблица 5. Результаты оценки воспроизводимости набора реагентов «ОМ-Скрин-Бруцеллез-РВ»;
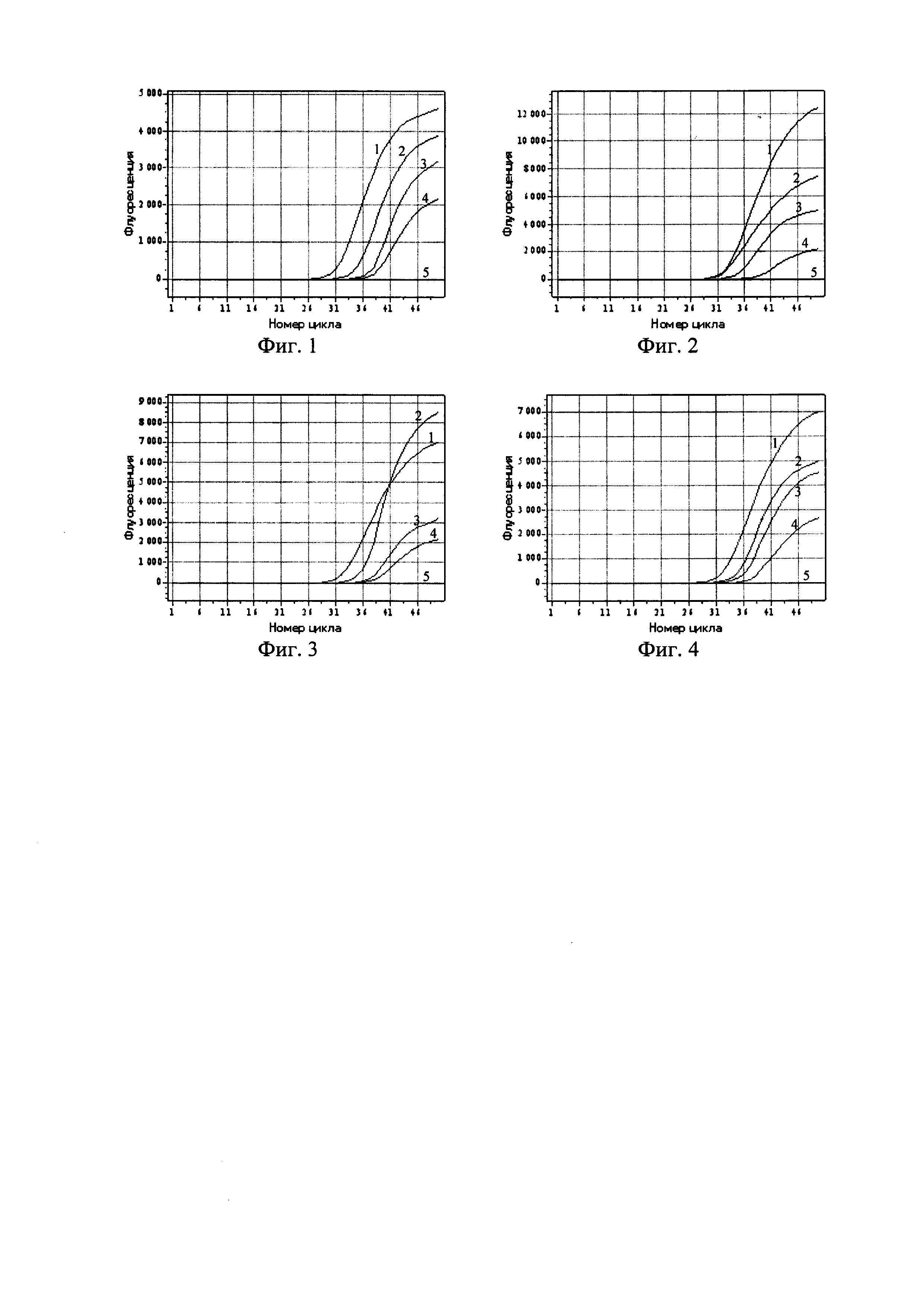
Фигура 1. Кинетические кривые ПЦР в реальном времени с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ» для образцов, содержащих: 1-3 - ДНК, выделенные из бактериальных суспензий штамма 19ВА В.abortus с концентрациями 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3; 4 - положительный контрольный образец (ПКО из состава набора реагентов); 5 - отрицательный контрольный образец (ОКО из состава набора реагентов).
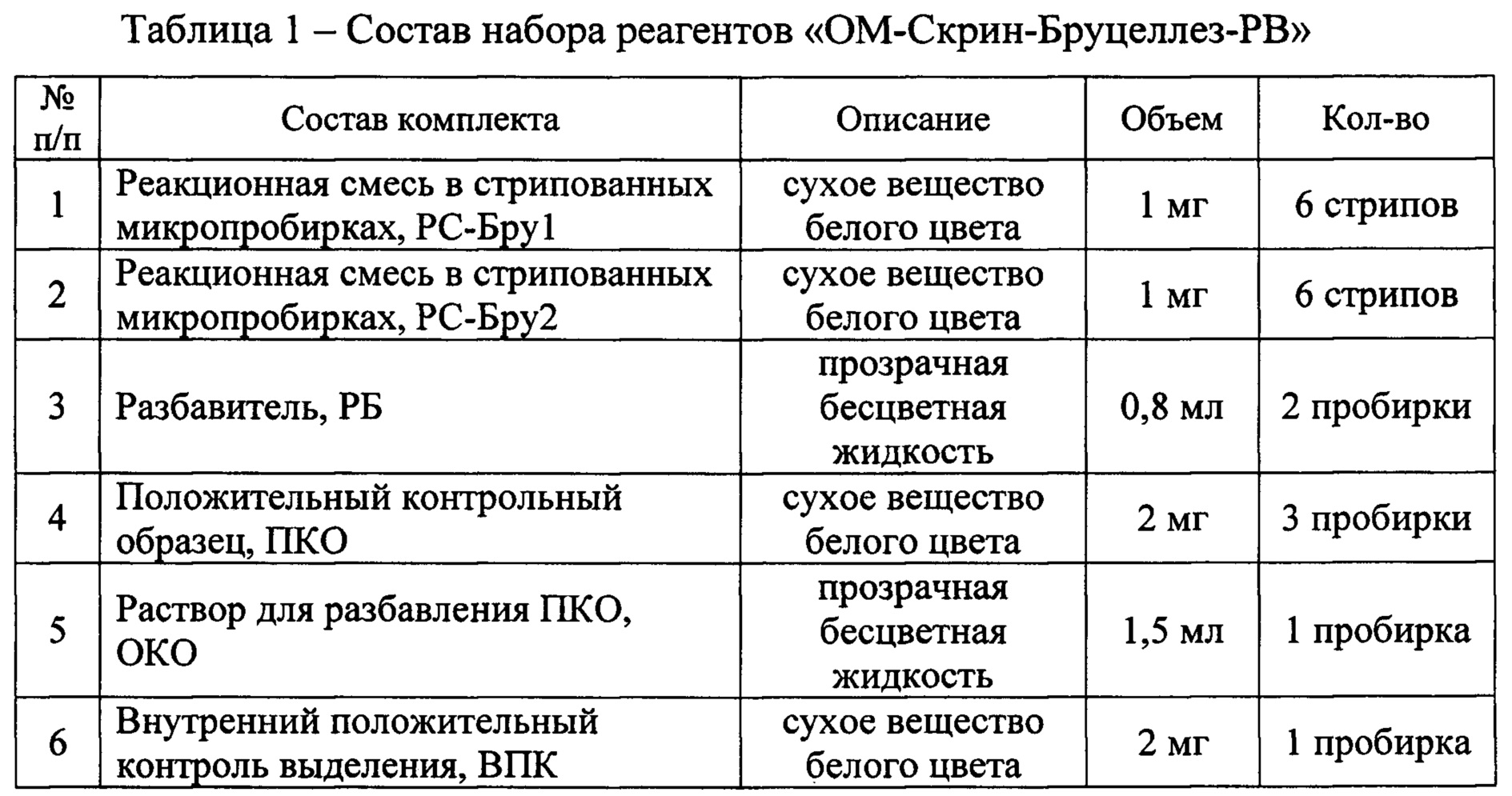
Фигура 2. Кинетические кривые ПЦР в реальном времени с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ» для образцов, содержащих: 1-3 - ДНК, выделенные из бактериальных суспензий штамма 40 В.suis с концентрациями 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3; 4 - положительный контрольный образец (ПКО из состава набора реагентов); 5 - отрицательный контрольный образец (ОКО из состава набора реагентов).
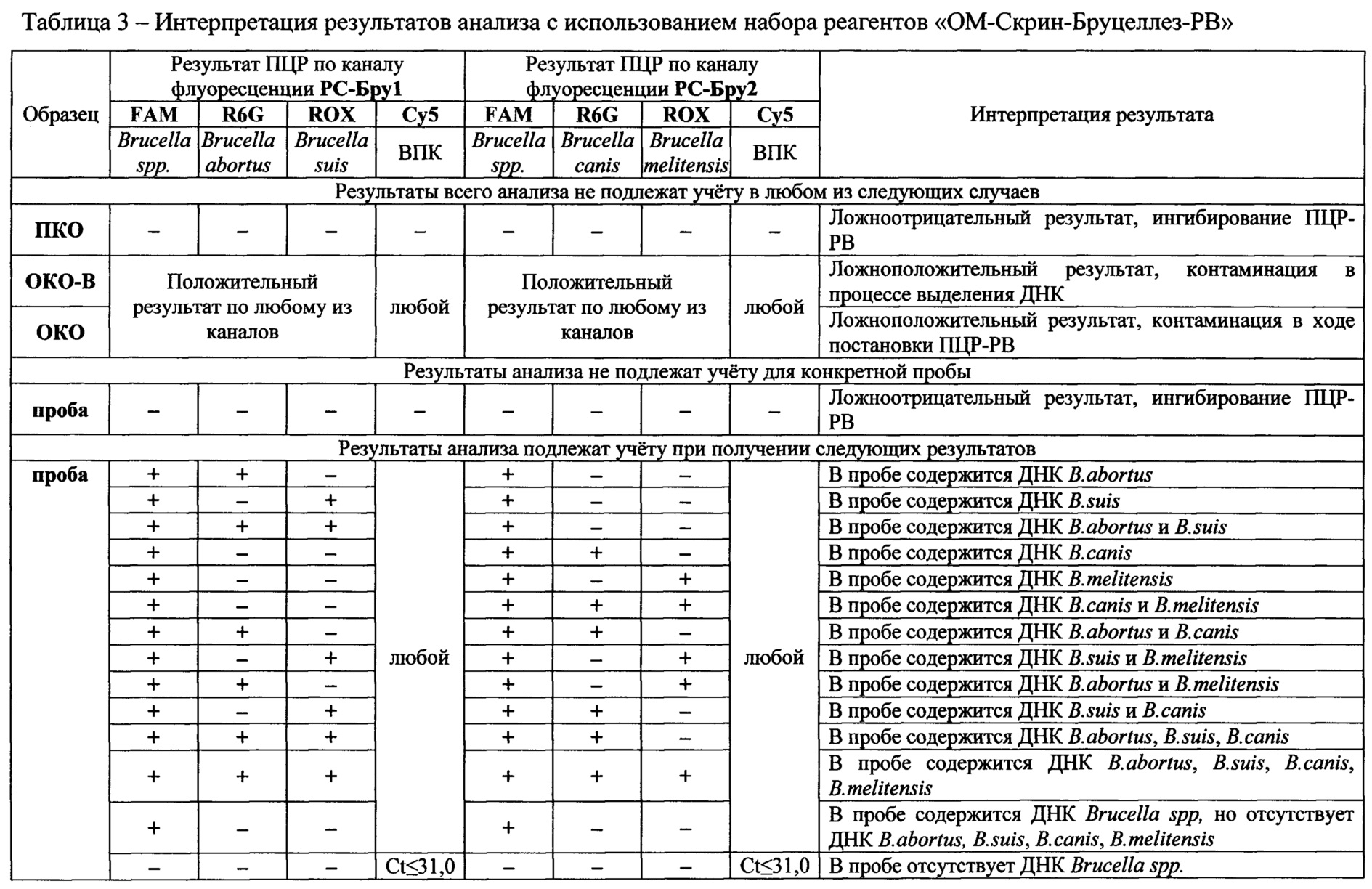
Фигура 3. Кинетические кривые ПЦР в реальном времени с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ» для образцов, содержащих: 1-3 - ДНК, выделенные из бактериальных суспензий штамма Rev-1 B.melitensis с концентрациями 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3; 4 - положительный контрольный образец (ПКО из состава набора реагентов); 5 - отрицательный контрольный образец (ОКО из состава набора реагентов).
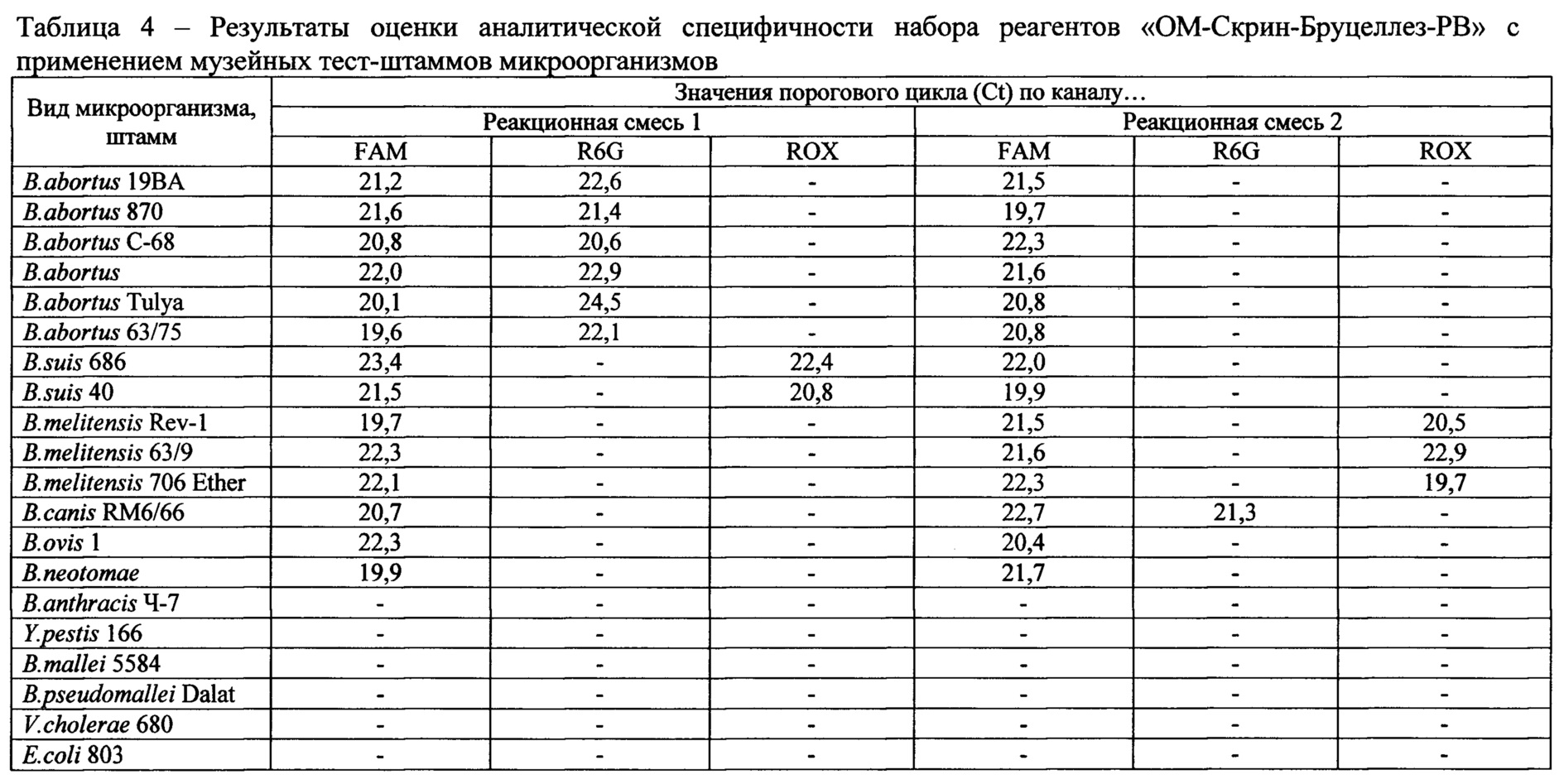
Фигура 4. Кинетические кривые ПЦР в реальном времени с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ» для образцов, содержащих: 1-3 - ДНК, выделенные из бактериальных суспензий штамма RM6/66 B.canis с концентрациями 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3; 4 -положительный контрольный образец (ПКО из состава набора реагентов); 5 -отрицательный контрольный образец (ОКО из состава набора реагентов).
Пример 1
В эксперименте по оценке аналитической чувствительности (предела обнаружения) набора реагентов методом ПЦР-РВ были проанализированы препараты ДНК, выделенные из водных суспензий агаровых культур штаммов 19BA B.abortus, 40 В.suis, Rev-1 B.melitensis, RM6/66 B.canis с концентрациями 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3. Результаты анализа представлены на фиг. 1-4.
В результате проведенной оценки установлено, что аналитическая чувствительность набора реагентов «ОМ-Скрин-Бруцеллез-РВ» не превышает 1,0⋅103 м.к.⋅см-3 исследуемой пробы.
Пример 2
Для экспериментального исследования аналитической специфичности набора реагентов использовали препараты ДНК, выделенные из водных суспензий агаровых культур штаммов возбудителей бруцеллеза: 19ВА, 870, С-68, Tulya, 63/75 B.abortus, 686, 40 В.suis, Rev-1, 63/9, 706 Ether B.melitensis, 1 B.ovis, RM6/66 B.canis, B.neotomae и гетерологичных видов микроорганизмов (штаммы 4-7 B.anthracis, 166 Y.pestis, 5584 B.mallei, Dalat B.pseudomallei, 680 V.cholerae, 803 E.coli) в концентрации 1,0⋅105 м.к.⋅см-3.
Критерием специфичности служило наличие соответствующего флуоресцентного сигнала по каналам FAM, R6G и ROX при анализе препаратов ДНК возбудителей бруцеллеза и отсутствие сигнала по данным каналам при анализе ДНК гетерологичных видов микроорганизмов.
Анализ проводили в трех повторностях с использованием критерия «единственного различия» - аналит обнаружен/аналит не обнаружен.
Критерий, согласно которому набор реагентов считали выдержавшим испытания на аналитическую специфичность: истинно положительный результат в отношении ДНК возбудителей бруцеллеза при истинно отрицательном результате в отношении остальных аналитов.
Результаты представлены в таблице 4, ложноположитеяьные и ложноотрицательные результаты отсутствовали.
Данные экспериментального исследования, представленные в таблице 4, свидетельствуют, что набор реагентов «ОМ-Скрин-Бруцеллез-РВ» обладает видовой специфичностью в отношении возбудителей бруцеллеза. Аналиты похожей структуры не выявляются.
Пример 3
Оценку воспроизводимости результатов ПЦР-РВ с использованием набора реагентов «ОМ-Скрин-Бруцеллез-РВ» проводили с препаратами ДНК, выделенными из водных суспензий агаровых культур штаммов 19BA B.abortus, 40 В.suis, Rev-1 B.melitensis, RM6/66 B.canis в концентрациях 5⋅103, 1⋅103, 5⋅102 м.к.⋅см-3. Расчет воспроизводимости результата ПЦР-РВ производили на основании анализа 50 проб. Результаты оценки воспроизводимости набора реагентов «ОМ-Скрин-Бруцеллез-РВ» представлены в таблице 5.

Данные, представленные в таблице 5, свидетельствуют, что набор реагентов «ОМ-Скрин-Бруцеллез-РВ» позволяет выявлять возбудителей бруцеллеза с воспроизводимостью не менее 98%.
Таким образом, из вышеизложенного следует, что достигнут заявляемый технический результат, а именно: разработан набор реагентов, включающий олигонуклеотидные праймеры и флюоресцентно-меченые ДНК-зонды, позволяющий достоверно выявлять специфические геномные участки микроорганизмов рода Brucella с одновременной идентификацией эпидемиологически значимых видов B.abortus, В.suis, B.canis, B.melitensis в образцах различного происхождения методом полимеразной цепной реакции в режиме реального времени.
Перечень последовательностей
Специфические олигонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды, предназначенные для выявления и идентификации ДНК возбудителей бруцеллеза методом полимеразной цепной реакции в реальном времени, имеют представленную ниже структуру нуклеотидных последовательностей:
для выявления родовой принадлежности бруцелл:
SEQ ID NO 1 (прямой праймер Br.spp_up): tcgagccaggctgtggtttc;
SEQ ID NO 2 (обратный праймер Br.spp_low): tcaccaagctttcgggcggtg;
SEQ ID NO 3 (флуоресцентный зонд Br.spp_FAM): (FAM)-gcagaagcttgcacagcg-(BHQ 1);
для выявления Brucella abortus:
SEQ ID NO 4 (праймер Br_1_1_wt block1): ggcttggaaagcagaatcttgca;
SEQ ID NO 5 (флуоресцентный зонд Br1_1_aR6G): (R6G)-aagcagaatcttgcacagcg-(BHQ2);
для выявления Brucella suis:
SEQ ID NO 6 (прямой праймер Br_suis_F): aggcatgacaagtctttcct;
SEQ ID NO 7 (обратный праймер Br_suis_R): accttcatgtcttttgcggtaa;
SEQ ID NO 8 (флуоресцентный зонд Br_suis_ROX): (ROX)-aggagccttcgtccgg-(BHQ2);
для выявления Brucella canis:
SEQ ID NO 9 (прямой праймер Br_3_F: aacggaaaaaggtatctcca;
SEQ ID NO 10 (обратный праймер Br_3_R: aacatggctttcggcgtctgc;
SEQ ID NO 11 (флуоресцентный зонд Br_3_cR6G): (R6G)-accgatcaacatcgctttcgg-(BHQ2);
для выявления Brucella melitensis:
SEQ ID NO 12 (прямой праймер Br2_F): accaccaccagtccgatagtta;
SEQ ID NO 13 (обратный праймер Br2_R): acgacgctttcaaggaaaccatc;
SEQ ID NO 14 (флуоресцентный зонд Br2_1_mROX): (ROX)-aggagccttcgtccgg-(BHQ2);
для внутреннего положительного контроля:
SEQ ID NO 15 (прямой праймер IPC_up4): agaactcgtagcgctagctgtag;
SEQ ID NO 16 (обратный праймер IPC_low2): cgtagaactagctgtagcgct;
SEQ ID NO 17 (флуоресцентный зонд IPC_up_Cy5): (Cy5)-agcggctcctacttctgcagggg-(BHQ2).
Примечание - BHQ1, BHQ2 - присоединенные к 5'-концевому нуклеотиду темновые гасители флуоресценции; FAM, R6G, ROX, Су5 флуоресцентные красители, присоединенный к 3'-концевому нуклеотиду.
Набор реагентов для выявления и идентификации ДНК возбудителей бруцеллеза методом полимеразной цепной реакции в реальном времени «ОМ-Скрин-Бруцеллез-РВ» представляет собой набор синтетических олигонуклеотидов в стрипованных микропробирках, включающий в себя специфические праймеры и зонды, имеющие следующую структуру: для выявления родовой принадлежности бруцелл - прямой праймер Br.spp_up tcgagccaggctgtggtttc, обратный праймер Br.spp_low tcaccaagctttcgggcggtg, флуоресцентный зонд Br.spp(FAM) (FAM)-gcagaagcttgcacagcg-(BHQ1); для выявления Brucella abortus - праймер Br_1_1_wt blok1 ggcttggaaagcagaatcttgca, флуоресцентный зонд Br1_1_a(R6G) (R6G)-aagcagaatcttgcacagcg-(BHQ2); для выявления Brucella suis - прямой праймер Br_suis_F aggcatgacaagtctttcct, обратный праймер Br_suis_R accttcatgtcttttgcggtaa, флуоресцентный зонд Br_suis(ROX) (ROX)-aggagccttcgtccgg-(BHQ2); для выявления Brucella canis - прямой праймер Br_3_F aacggaaaaaggtatctcca, обратный праймер Br_3_R aacatggctttcggcgtctgc, флуоресцентный зонд Br_3_c(R6G) (R6G)-accgatcaacatcgctttcgg-(BHQ2); для внутреннего положительного контроля - прямой праймер IPC_up4 agaactcgtagcgctagctgtag, обратный праймер IPC_low2 cgtagaactagctgtagcgct, флуоресцентный зонд IPC_up_Cy5 (Су5)-agcggctcctacttctgcagggg-(BHQ2), а также разбавитель, положительный контрольный образец, отрицательный контрольный образец, внутренний положительный контроль выделения.