Результат интеллектуальной деятельности: СПОСОБ УСКОРЕННОЙ ДЕЦЕЛЛЮЛЯРИЗАЦИИ БИОЛОГИЧЕСКОЙ ТКАНИ ИЛИ ОРГАНА
Вид РИД
Изобретение
Область техники
Изобретение относится к области биологии и медицины, в частности, области регенеративной медицины и тканевой инженерии, и может быть использовано для экспрессного получения экстрацеллюлярных матриксов органов и тканей, применяемых в реконструктивной хирургии для замены и протезирования объема пораженных органов и тканей.
Уровень техники
Экстрацеллюлярный матрикс используется в тканевой инженерии органов и тканей в качестве клеточного носителя, для образования искусственной клеточной ниши. Экстрацеллюлярный матрикс представляет собой основу соединительной ткани и может быть получен способом децеллюляризации. Проблема получения децеллюляризированного экстарцеллюлярного матрикса связана со сложностью подбора подходящих методов и времени экспозиции, которые сохранят механические и биологические свойства матрикса, и при этом приведут к деградации донорских клеток и остатков химических детергентов, которые применяли в процессе децеллюляризации. Известные способы децеллюляризации предполагают последовательную многоэтапную обработку растворами детергентов и/или ферментов [Zhou P., et al. (2016). Decellularization and recellularization of rat livers with hepatocytes and endothelial progenitor cells. Artificial organs, 40(3), E25-E38; Mazza G., et al. (2015). Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation. Scientific reports, 5, 13079; Maghsoudlou P., et al. (2013). A decellularization methodology for the production of a natural acellular intestinal matrix. Journal of Visualized Experiments, (80), e50658] и различаются по длительности воздействия и концентрациям реагентов, в качестве которых используют такие растворы, как додецилсульфат натрия, Тритон Х-100, дезоксихолат натрия, гипертонический раствор NaCl с концентрацией более 0,9%. Как правило, обрабатываемую ткань в процессе децеллюляризации помещают в емкость с реагентом, при этом реагент постоянно перемешивают в течение достаточно длительного времени.
Известен способ децеллюляризации пищевода экспериментальных животных для создания биоинженерной конструкции [Патент на изобретение RU 2662554], заключающийся в децеллюляризации детергентами и энзимами в следующей последовательности: деионизированной водой в течение 1,5 ч, затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002 М Na-EDTA в течение 70 мин, фосфатный буфер - в течение 15 мин, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 70 мин, завершают децеллюляризацию промывкой от децеллюляризирующих растворов и дезинфекцией матрикса в 10% растворе хлоргексидина биглюконата в фосфатном буфере со сменой раствора и направления перфузии каждые 5 ч.
Известен способ децеллюляризации сердца крысы [Патент на изобретение RU 2550286], который заключается в перфузии через аорту очищенной водой, фосфатно-буферным солевым раствором, детергентами и ферментами: растворами, содержащими 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-EDTA, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием и отмывку каркаса фосфатным буфером с добавлением 1% пенициллина-стрептомицина с общей продолжительностью 28 часов.
Известные способы децеллюляризации обладают недостатками, заключающимися в том, что подвергаемая децеллюляризации ткань находится в течение длительного времени в реакционной зоне, в которой не исключаются серьезные структурные повреждения экстрацеллюлярного матрикса, а клеточные элементы не удаляются полностью.
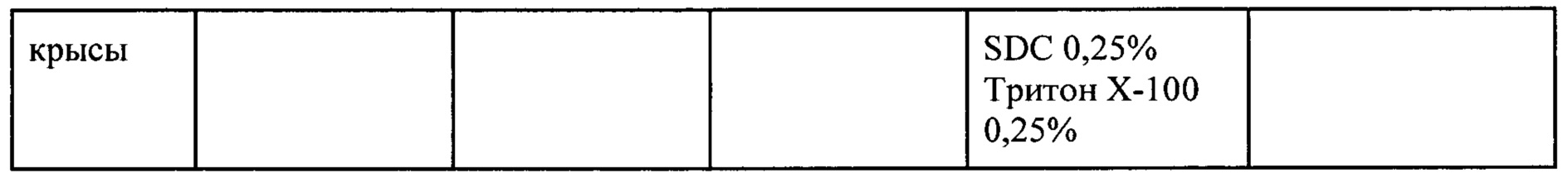
За ближайший аналог принят «Способ получения децеллюляризированных матриксов паренхиматозных органов лабораторных животных» [Патент на изобретение RU 2653489], заключающийся в получении децеллюляризированных матриксов почек кролика или крыс с помощью метода детергентно-ферментативной децеллюляризации с использованием высокопроизводительной системы перфузии в течение 5 этапов, а именно: отмывание органов от резидуальной крови 1X PBS с гепарином в течение 1 часа; перфузию паренхимы почки кролика гипотоническим буфером состава 10 mM HEPES натриевая соль, 1 mM Mg2SO4*6H2O, 0,4% KCL в течение 5-6 часов или почки крысы 1X Tris EDTA в 0,1 М PBS без кальция и магния; перфузию паренхимы органов раствором, содержащим ионные (0,25% додецилсульфат натрия SDS, 0,25% дезоксихолат натрия (SDC)) и неионные (Triton Х-100 0,25% для почки кролика, 0,1% SDS, 0,1% SDC и 0,25% TNX для крысиной почки) детергенты в течение 24 часов; последовательную перфузию органов растворами детергентов в возрастающих концентрациях в течение 16 часов - для кроличьей почки 0,3% SDS, SD и TNX, 0,4%; 0,4% SDS, SD и TNX; для почки крысы - 0,25% SDS, SD и TNX; 0,3 SDS, SD и TNX с последующим отмыванием органов от следовых количеств детергента 1X PBS в течение 1,5 часов.
Недостатком известного способа является длительность процесса децеллюляризации, в связи с недостаточно высокой концентрацией детергентов, что может приводить к потере микроархитектоники экстрацеллюлярного матрикса.
Раскрытие изобретения
Технической проблемой, на решение которой направлено настоящее изобретения, является разработка способа ускоренной децеллюляризации различных органов и тканей, обеспечивающего при этом сохранение их целостности и ультраструктуры для последующей иммобилизации на децеллюляризированном матриксе клеток реципиента.
Техническим результатом изобретения является уменьшение времени децеллюляризации органов и тканей при сохранении их целостности и ультраструктуры.
Технический результат достигается за счет разработки способа децеллюляризации биологической ткани или органа, включающего удаление клеточных элементов путем промывки биологической ткани или органа раствором, содержащим трис(гидроксиметил)аминометан, натрия хлорид, додецилсульфат натрия, дезоксихолат натрия, Тритон Х-100, и деионизированную воду при следующем содержании компонентов, масс. %:
|
При этом биологическую ткань или орган выбирают из группы, состоящей из печени, кровеносного сосуда, трахеи, легкого, сердца, кишечника, желудка и желчного протока.
Заявляемый способ децеллюляризации отличается от аналогов комбинацией, концентрацией, последовательностью и длительностью применения децеллюляризующих агентов.
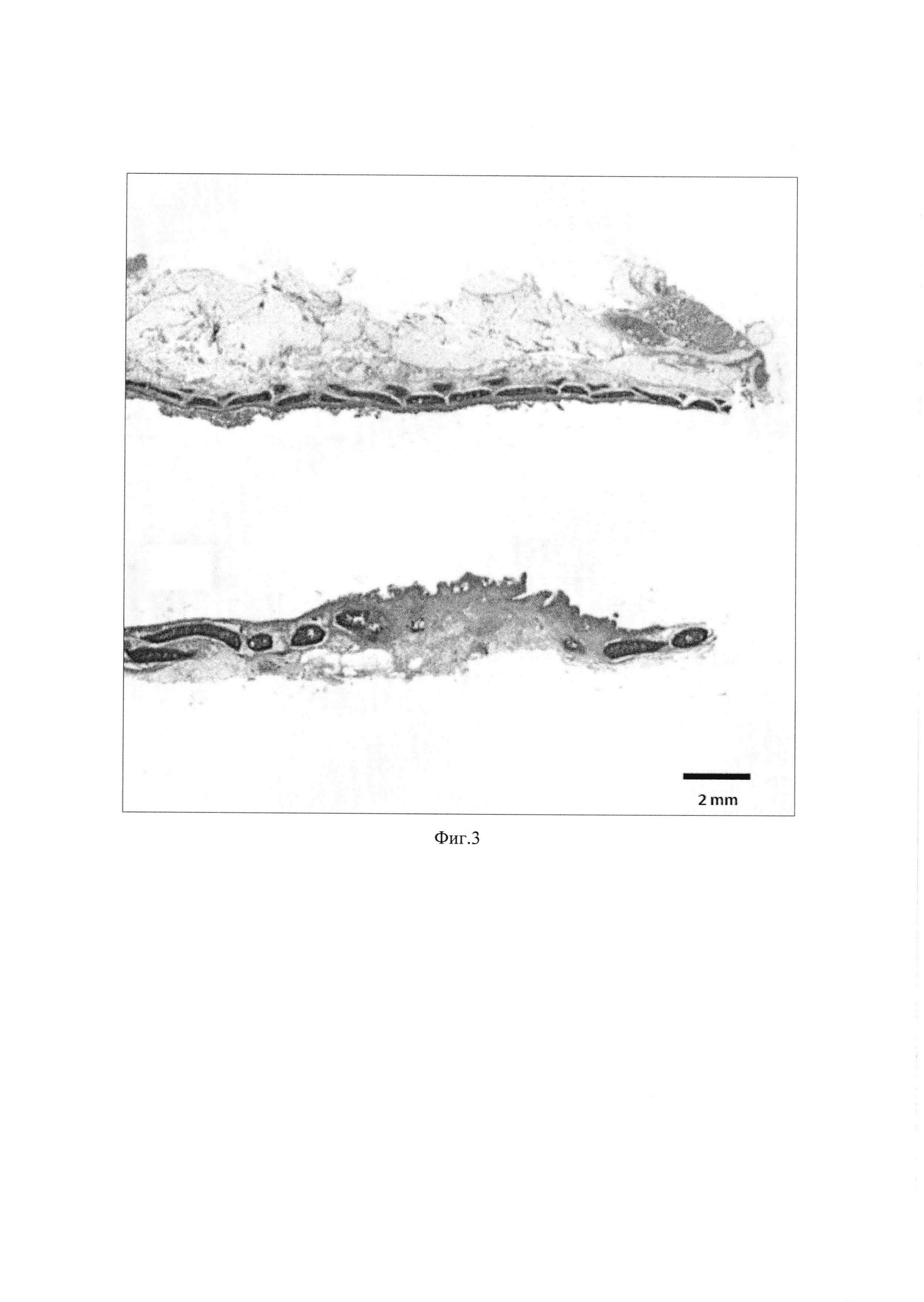
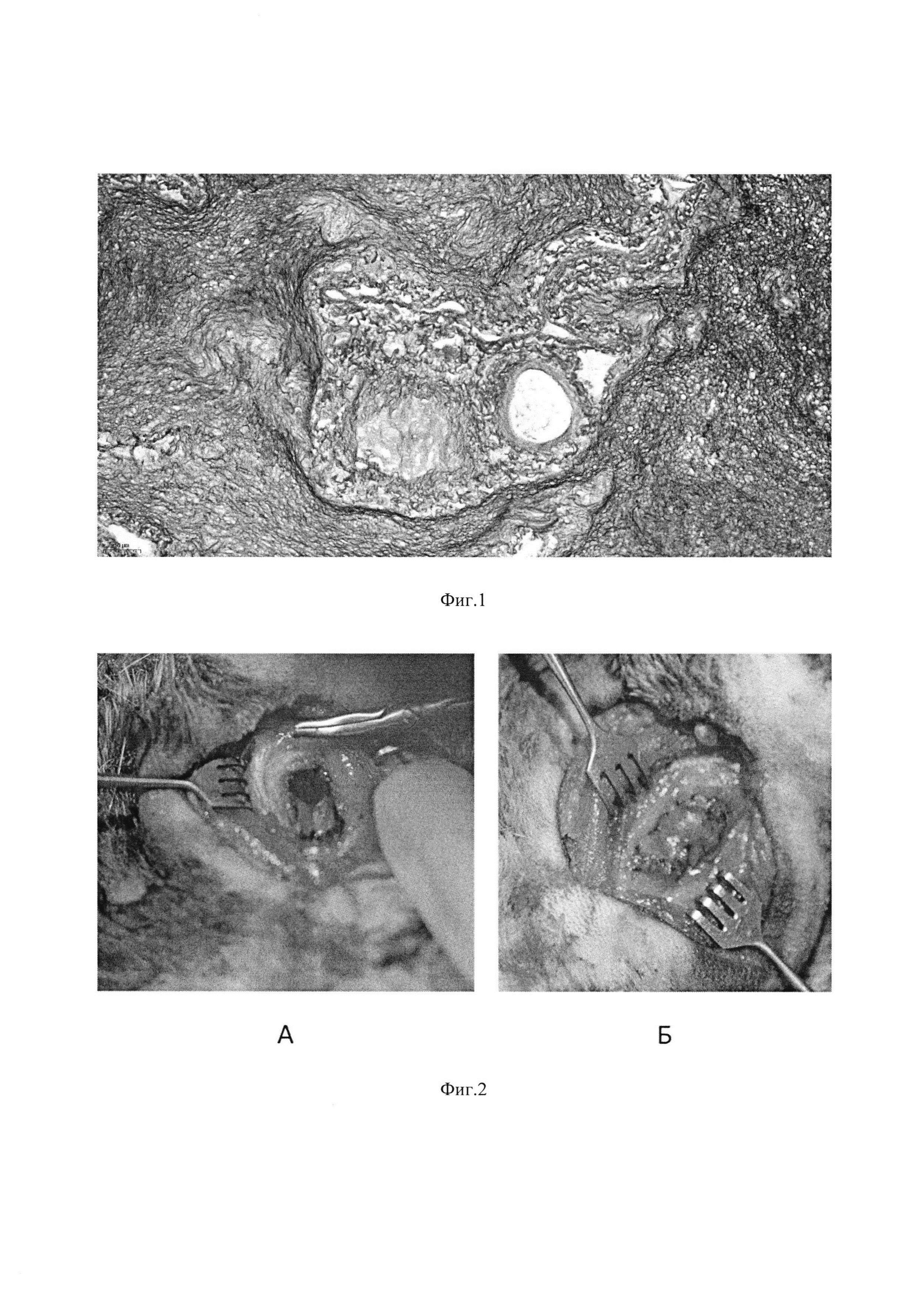
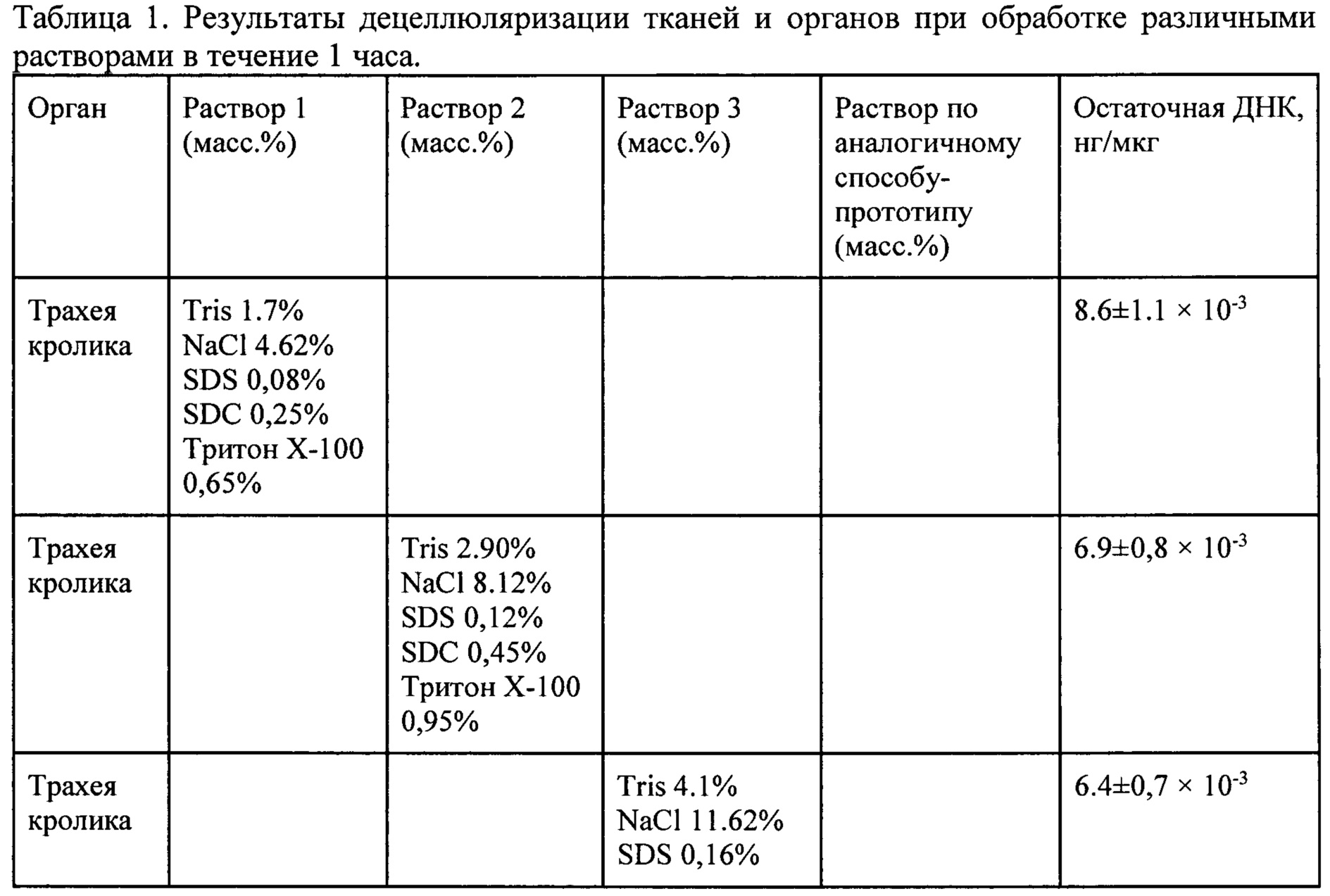
Изобретение поясняется иллюстрациями, где на Фиг. 1 представлена фотография микроскопии гистологического препарата децеллюляризированного матрикаса печени крысы породы «Вистар» (увеличение ×200, размерная шкала 50 μм); на Фиг. 2 - тканеинженерная конструкция, имплантированная кролику: (А) формирование трахеального дефекта - резекция 5 колец в трахеальной стенке кролика; (Б) тканеинженерная конструкция, имплантированная в дефект трахеи; на Фиг. 3 - ткань трахеи кролика через 6 мес. после имплантации тканеинженерной конструкции, окраска гематоксилин-эозин. Обзорное изображение тканей трахеи с двух сторон относительно разреза.
Осуществление изобретения
Предлагаемый способ осуществляют следующим образом.
Ткань или орган подготавливают к децеллюляризации следующим образом. Свежеполученный резекционный материал предварительно отмывают от крови перфузионным методом раствором Рингера с 0,2±0,2% гепарина либо варфарина, либо изотоническим солевым раствором с 0,2±0,2% гепарина либо варфарина либо 0,9% раствором натрия хлорида для инъекций с 0,2±0,2% гепарина либо варфарина при температуре 35±10°С со скоростью 40±20 мл/мин в течение 20±5 мин, и далее отмывают фосфатным буфером (PBS) с рН 7.2±1.5 либо изотоническим солевым раствором, либо 0,9% раствором NaCl для инъекций при температуре 35±5°С со скоростью 40±20 мл/мин в течение 10±5 мин.
Способ децеллюляризации ткани или органа в соответствии с настоящим изобретением состоит в следующем. Биологическую ткань или орган обрабатывают раствором 1,7-4,1% гидроксиметиламинометана (Tris), 4,62-11,62% натрия хлорида (NaCl), 0,08-0,16% додецилсульфата натрия (SDS), 0.25-0.65% дезоксихолата натрия (SDC), 0,65-1,25% Тритон Х-100 в деионизованной воде не менее 15 мин. Додецилсульфат натрия (SDS), деоксихолат натрия (SDC) - анионактивные поверхностно-активные вещества, применяются для солюбилизации белков клеточных мембран и лизиса клеток с последующим вымыванием клеточного материала из матрикса. Трис (англ. Tris) - буферный компонент, позволяющий удерживать рН в течение процедуры на биологическом уровне. Хлорид натрия (NaCl) - соль соляной кислоты, служит для поддержания ионной силы в течение процедуры на заданном уровне. Тритон Х-100 (англ. Triton Х-100) - неионогенное поверхностно-активное вещество, используется для связывания с клеточными мембранами и их разрушения, а также лизиса клеток с последующим вымыванием клеточного материала из матрикса. Данная комбинация агентов позволяет эффективно и быстро удалять клеточный материал, почти не затрагивая экстрацеллюлярный матрикс за счет малого времени взаимодействия и постоянно поддерживаемом рН, позволяющем белку находиться в единой ионной форме в течение всей процедуры и постоянно поддерживаемой ионной силе, за счет чего связывание детергентов и белков затрудняется. Данный способ позволяет удалить ускоренно клеточные компоненты из органа или ткани.
В практике настоящего изобретения могут быть использованы дальнейшие манипуляции, улучшающие другие качества продукта кроме удаления клеточного компонента, например, перфузия фосфатным буфером (PBS) с рН 7,2±1,5 либо изотоническим солевым раствором, либо 0,9% раствором NaCl для инъекций при температуре 35±5°С со скоростью 40±20 мл/мин в течение 10±5 мин или проведение промывки раствором PBS с антибиотика-антимикотика в концентрации 10Х (Gibco, Cat No 15240062, США) при 4°С, скорости потока 40±20 мл/мин в течение 15±5 минут.
Ниже представлены примеры осуществления предлагаемого способа, где в качестве децеллюляризированного органа использовали печень крысы.
Пример 1. Проведение децеллюляризации органов и тканей.
Животное (крысы породы "Вистар") усыпляли раствором ксилазина и производили вскрытие. Все растворы, использовавшиеся в работе, были простерилизованы методом фильтрования через фильтр 0,22 мкм. Орган осторожно извлекали из брюшной полости не повреждая капсулу. Децеллюляризацию проводили при помощи системы, составленной из перистальтического насоса (MasterFlex L/S, США), резервуара с раствором для перфузии, силиконовых трубок 18-26 диаметра (MasterFlex, США) и переходника с резьбой на катетер. Катетер вводили в нижнюю полую вену, после чего соединяли с перистальтическим насосом и проводили отмывку органа растворами, заполненными в резервуар системы для децеллюляризации, следующим способом.
1. Проводили перфузию печени для отмывки от остаточной крови изотоническим солевым раствором с 0,2% гепарина при температуре 35°С со скоростью 40 мл/мин в течение 20 мин.
2. Проводили отмывку от гепарина при перфузии фосфатным буфером с рН 7.2 при температуре 35°С со скоростью 40 мл/мин в течение 10 мин.
3. Децеллюляризацию поводили раствором, содержащим 2.9% Трис, 8.12% натрия хлорида, 0,12% додецилсульфата натрия, 0,45% дезоксихолата натрия, 0,95% Тритон X-100 при температуре 37°С и скорости потока 40 мл/мин, в течение 15 минут.
4. Отмывку от детергентов производили при помощи раствора фосфатного буфера при температуре 37°С, скорости потока 40 мл/мин в течение 5 минут.
5. Дополнительно проводили промывку раствором PBS с антибиотиком-антимикотиком в концентрации 10Х (Gibco, Cat No 15240062, США) при 4°С, скорости потока 40 мл/мин в течение 10 минут для предотвращения бактериальной контаминации.
Качество полученного материала в виде децеллюляризованной печени крысы оценивали подсчетом ДНК и микроскопией гистологических препаратов. При гистологическом анализе срезы были окрашены по Массону, для визуализации коллагеновых волокон. В децеллюляризированном препарате не наблюдалось морфологически сохранных клеток, ткань представлена преимущественно волокнистой структурой, образованной экстрацеллюлярным матриксом, и сосудами печени. Остаточное дцДНК составило 21.9±2.4×10-3 нг на 1 мкг образца, что свидетельствует о качественном удалении клеточного компонента с экстрацеллюлярного матрикса.
В результате проведенных исследований децеллюляризированных описанным способом органов можно сделать вывод о том, что предлагаемое изобретение обеспечивает достижение поставленной задачи, выражающейся в уменьшении времени децеллюляризации органов - общее время децеллюляризации составило 80±35 минут, в то время как общее время децеллюляризации в прототипе составляет 47,5 часов, повышении качества децеллюляризации органов, сохранении их целостности и ультраструктуры для последующей иммобилизации клеток реципиента.
Эффективность заявляемого способа проверена в серии из 7 последовательных экспериментов, достигнув при этом воспроизводимые результаты.
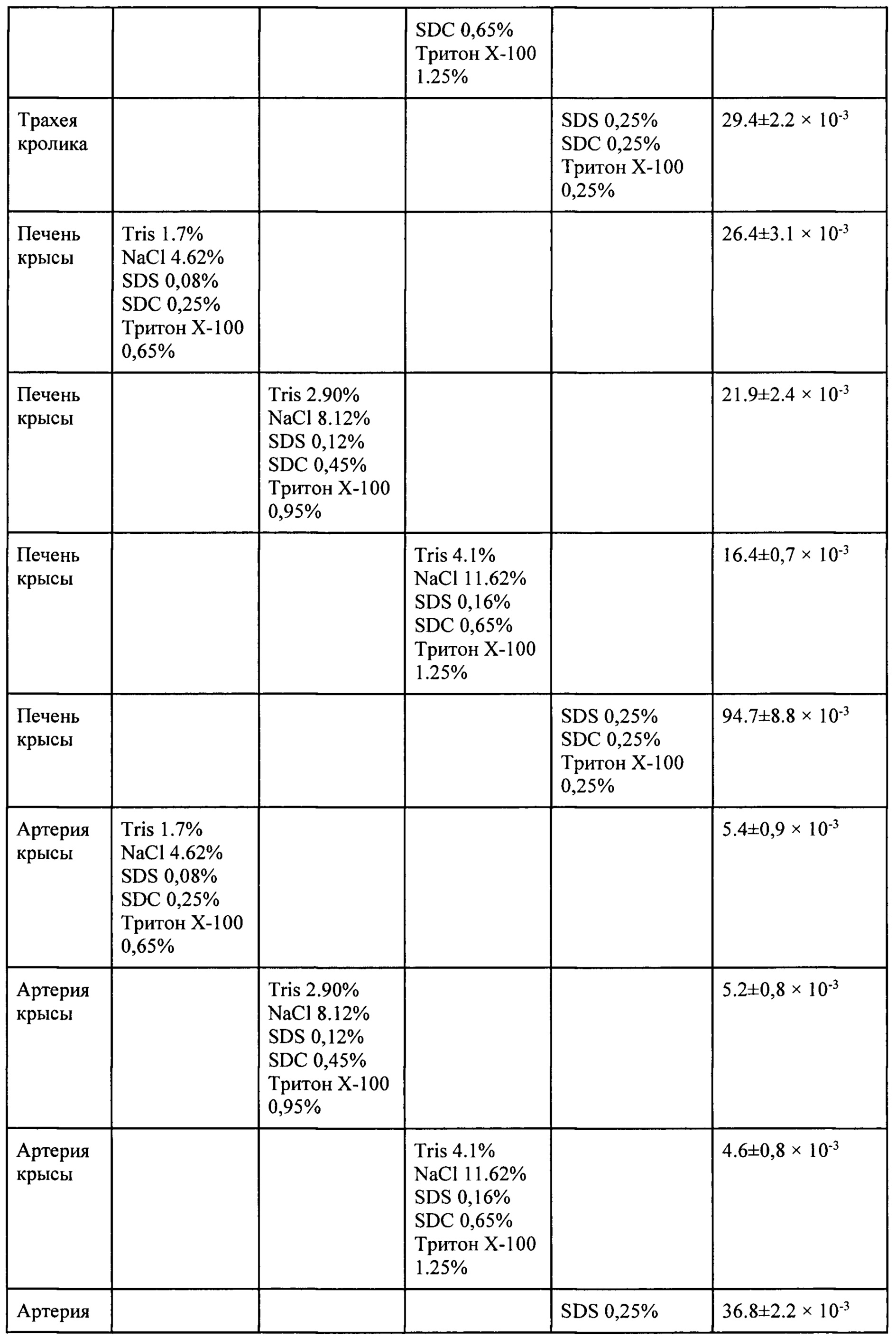
Ниже в таблице приведены результаты децеллюляризации тканей и органов в течение 1 часа при их обработке различными растворами. Таблица 1 демонстрирует, что настоящее изобретение позволяет получать децеллюляризированные органы и ткани при обработке растворами 1-3 в течение 1 часа, что не достигается раствором сравнения, состав которого был взят из патента RU 2653489.
Предлагаемый способ применим для децеллюляризации органов и тканей с хорошим кровоснабжением вследствие высокого значения плотности распределения сосудов, протоков или интерстициальных каналов в ткани или органе (печень, почка, большой сальник, легкие), что делает возможным равномерное воздействие децеллюляризирующим раствором по объему, обеспечивая тем самым полноценную децеллюляризацию ткани или органа. Помимо целых органов, в качестве резекционного материала могут использоваться участки ткани с высокой степенью васкуляризации, например, сердечный перикард и проксимальные сегменты трахеи.
Были проведены эксперименты по децеллюляризации таких органов, как печень крысы, трахея кролика, артерия крысы, в которых удалось сократить время децеллюляризации до 70 минут.
Также проводились эксперименты с желчным протоком человека. За счет морфологического сходства предлагаемый способ можно распространить не только на биологические ткани или органы лабораторного животного, но и биологические ткани или органы человека.
Полученные с использованием предлагаемого способа децеллюляризованные органы и ткани могут использоваться в тканевой инженерии для создания аутологичных трансплантатов, для замены или протезирования пораженных органов и тканей.
Пример 2. Использование децеллюляризированных органов в качестве компонента тканеинженерной конструкции в эксперименте на кроликах.
Децеллюляризированные трахеи кроликов (n=3), полученные предлагаемым способом, были использованы для создания тканеинженерных конструкций трахеи и имплантированы кроликам в ортотопическую позицию. При создании тканеинженерной конструкции децеллюляризированные трахеи кроликов в стерильных условиях были заселены назальными хондроцитами, которые культивировали на матриксе в СО2-инкубаторе в течение 1 недели в полной питательной среде, состоящей из DMEM/F12 (Invitrogen, США), содержащей 10% FBS (Invitrogen, США), 0,4 мкМ инсулина, 20 нг/мл bFGF, 10 нМ дексаметазона, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Invitrogen, США). Клетки высевали в количестве 106 кл/мл.
Кроликам в условиях операционной удаляли фрагмент трахеи и в область дефекта устанавливали тканеинженерную конструкцию (Фиг. 2). За кроликами осуществляли наблюдение, а в дальнейшем выполняли гистологическое исследование аутопсийного материала (Фиг. 3).
Децеллюляризированный материал, полученный из трахеи кролика путем ускоренного способа обработки раствором, состоящим из (масс. %) 1,7-4,1% гидроксиметиламинометана (Tris), 4,62-11,62% натрия хлорида (NaCl), 0,08-0,16% додецилсульфата натрия (SDS), 0,25-0,65% дезоксихолата натрия (SDC), 0,65-1,25% Тритон Х-100, в деионизованной воде - был пригоден для создания тканеинженерной конструкции трахеи и выполнял после имплантации кролику биологическую функцию в течение длительного периода наблюдения (6 месяцев наблюдения).