Результат интеллектуальной деятельности: N-(2-(2-(ДИАЛКИЛАМИНО)ЭТОКСИ)ЭТИЛ)КАРБОКСАМИДЫ И ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ
Вид РИД
Изобретение
Изобретение относится к области фармакологии и касается создания новых лекарственных средств для профилактики и лечения нарушений сердечного ритма.
Несмотря на значительные достижения медицины, патология сердечно-сосудистой системы (ишемическая болезнь сердца, артериальная гипертония, атеросклероз, приобретенные и врожденные пороки сердца, заболевания миокарда воспалительной этиологии) по-прежнему занимают первое место среди других соматических заболеваний человека и являются основной причиной летального исхода. Часто заболевания сердечнососудистой системы осложняются развитием нарушений сердечного ритма различного генеза [Руководство по нарушениям ритма сердца / Под ред. Е.И. Чазова, С.П. Голицына. - М.: ГЭОТАР-Медиа, 2010]. Аритмия и фибрилляция желудочков наблюдаются в 94% случаев у пациентов с инфарктом миокарда и, как правило, являются непосредственной причиной смерти. Несмотря на то, что в последние годы для лечения стали широко использоваться хирургические методы и имплантация различных технических устройств для электроимпульсной терапии, основным методом предупреждения и лечения нарушений ритма сердца остается фармакотерапия.
В настоящее время клиника располагает значительным количеством антиаритмических средств. Однако большинство из них имеет серьезные недостатки, главным из которых является малая терапевтическая широта, а также наличие кардиальных и экстракардиальных побочных явлений [Каверина Н.В. Современные аспекты поиска и доклинического изучения антиаритмических средств / Кардиология, 1986, Т. 26, №8, с. 59-63]. Более того, как было показано в исследовании CAST I и CAST II, применение высокоэффективных препаратов группы IC у пациентов с ишемической болезнью сердца сопровождается увеличением случаев внезапной клинической смерти [The Cardiac Arrhythmia Suppression trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction / The New England Journal of Medicine, 1989, V. 321, N. 6, pp. 406-412].
В этой связи разработка эффективной терапии нарушений сердечного ритма и поиск новых лекарственных препаратов с высокой антиаритмической активностью и лишенных нежелательных побочных эффектов являются одними из самых актуальных проблем современной кардиофармакологии.
Анализ литературы показывает, что из уровня техники [патент US 9670242 В2, дата публикации 06.06.2017] известны близкие по структуре соединения с формулой:
R'C(O)NHCH2CH2OCH2CH2NR2
Однако вышеприведенные соединения не обладают антиаритмическими свойствами.
Задача настоящего изобретения состояла в синтезе соединений, обладающих высокой антиаритмической активностью и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма.
Технический результат настоящего изобретения заключается в расширении арсенала средств, обладающих высокой антиаритмической активностью и перспективных для разработки на их основе лекарственных средств для лечения нарушений сердечного ритма.
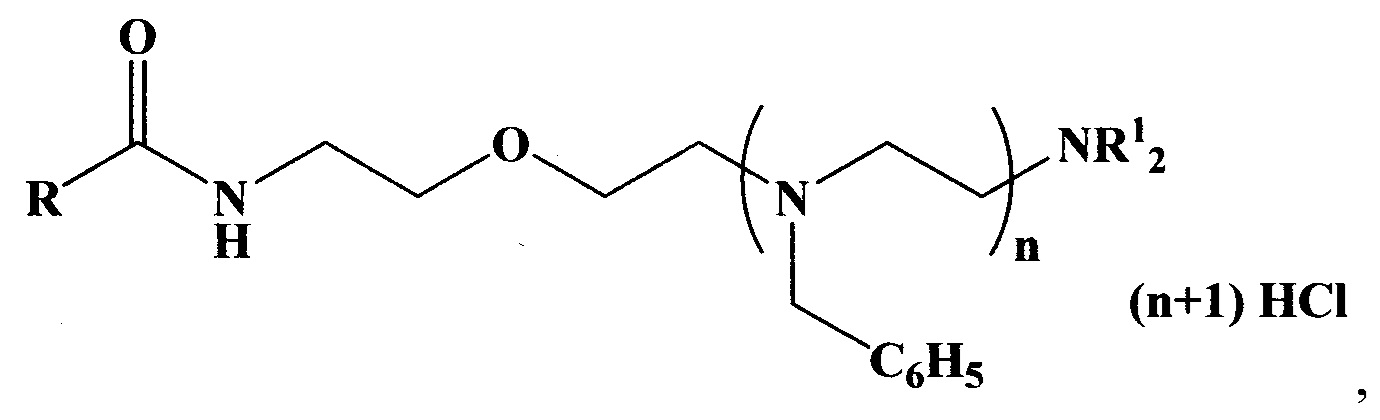
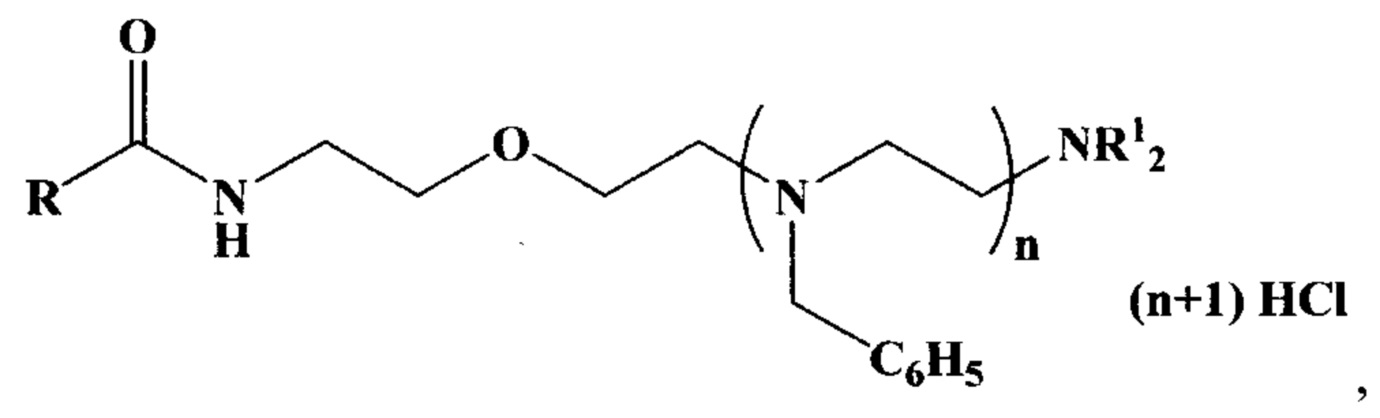
Указанные задача и технический результат достигаются тем, что получен новый класс антиаритмических азотсодержащих соединений, представленных следующей общей формулой:
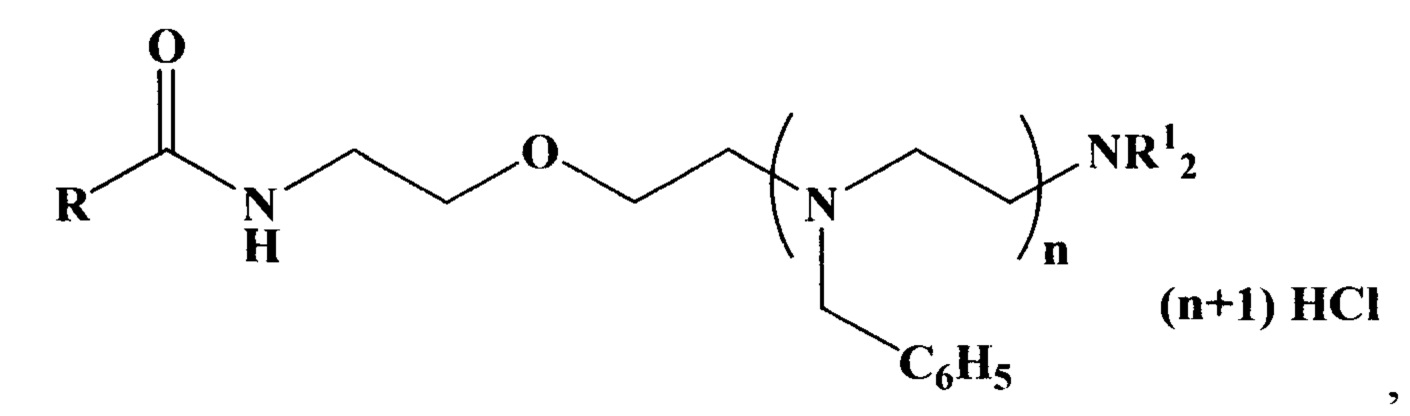 где
где
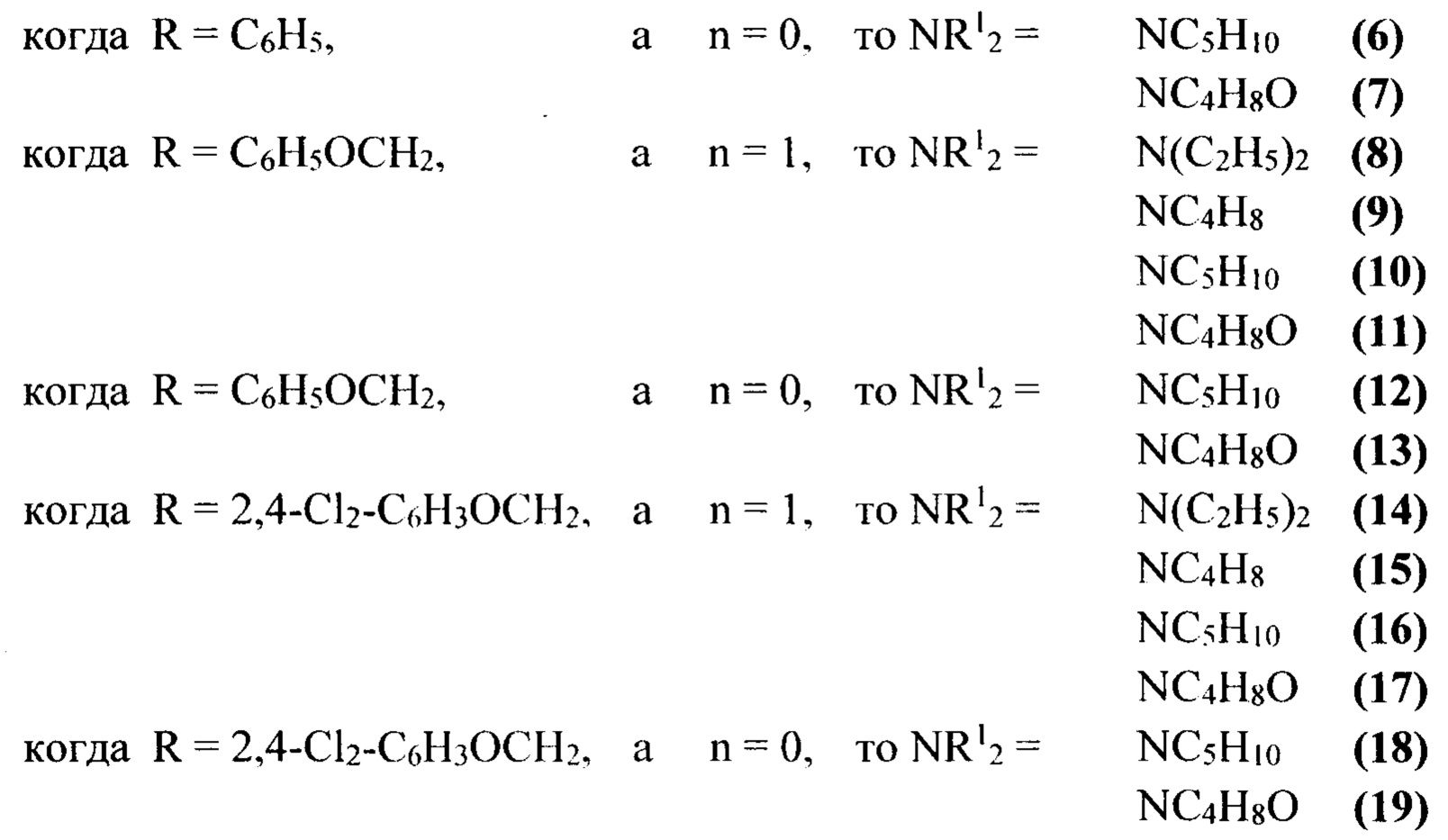
(при этом NC4H8 - пирролидино, NC5H10 - пиперидино, NC4H8O - морфолино).
Заявляемые соединения получали по схеме:
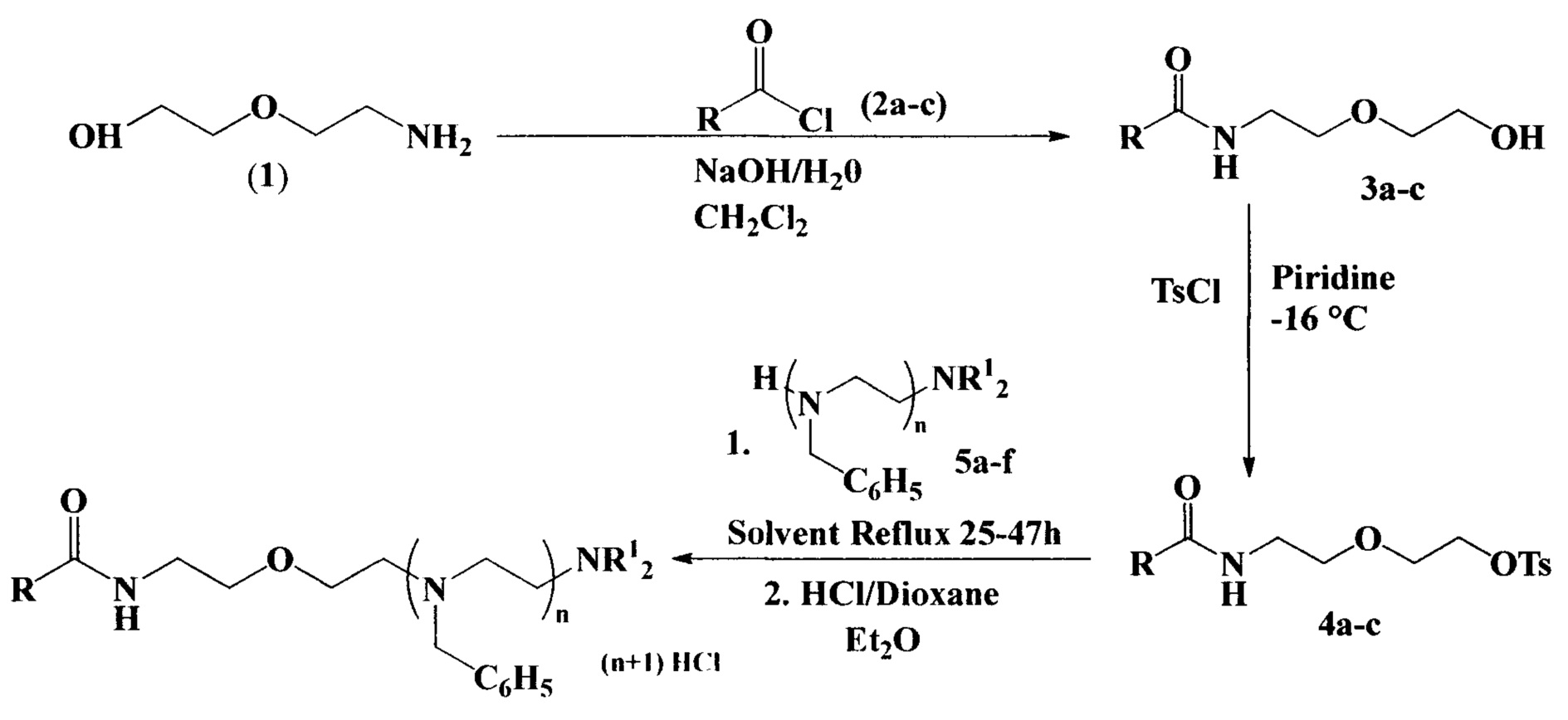
Гидроксиэтоксиэтиламиды (3а-с) получали ацилированием 2-(2-аминоэтокси)этанола (1) соответствующими хлорангидридами карбоновых кислот (2а-с) в среде хлористого метилена при перемешивании при комнатной температуре с последующей экстракцией и перекристаллизацией, получая продукты (3а-с) с выходами 72-80%.
Тозилоксиэтоксиэтиламиды (4а-с), необходимые для реакции амидоэтоксиэтилирования, синтезировали из соответствующих 2-гидроксиэтоксиэтиламидов (3а-с) реакцией последних в сухом пиридине при -16°С в течение 15-17 часов с n-толуолсульфохлоридом с последующим перемешиванием в воде в течение 1 часа до образования осадка. После фильтрования и высушивания получали тозилоксиэтоксиэтиламиды (4а-с) с выходами 67-75%.
Амидоэтоксиэтилирование вторичных аминов (5a-f) тозилоксиэтоксиэтиламидами (4а-с) проводили в кипящем пара-ксилоле (для моноаминов) или ацетонитриле в присутствии триэтиламина (для диаминов) при перемешивании в течение 20-70 часов с последующим осаждением гидрохлоридов полученных продуктов (6-19) в диэтиловом эфире с помощью раствора хлороводорода в диоксане, получая гидрохлориды N-(2-(2-(диалкиламино)этокси)этил)карбоксамидов (6-19) с выходами 43-78%.
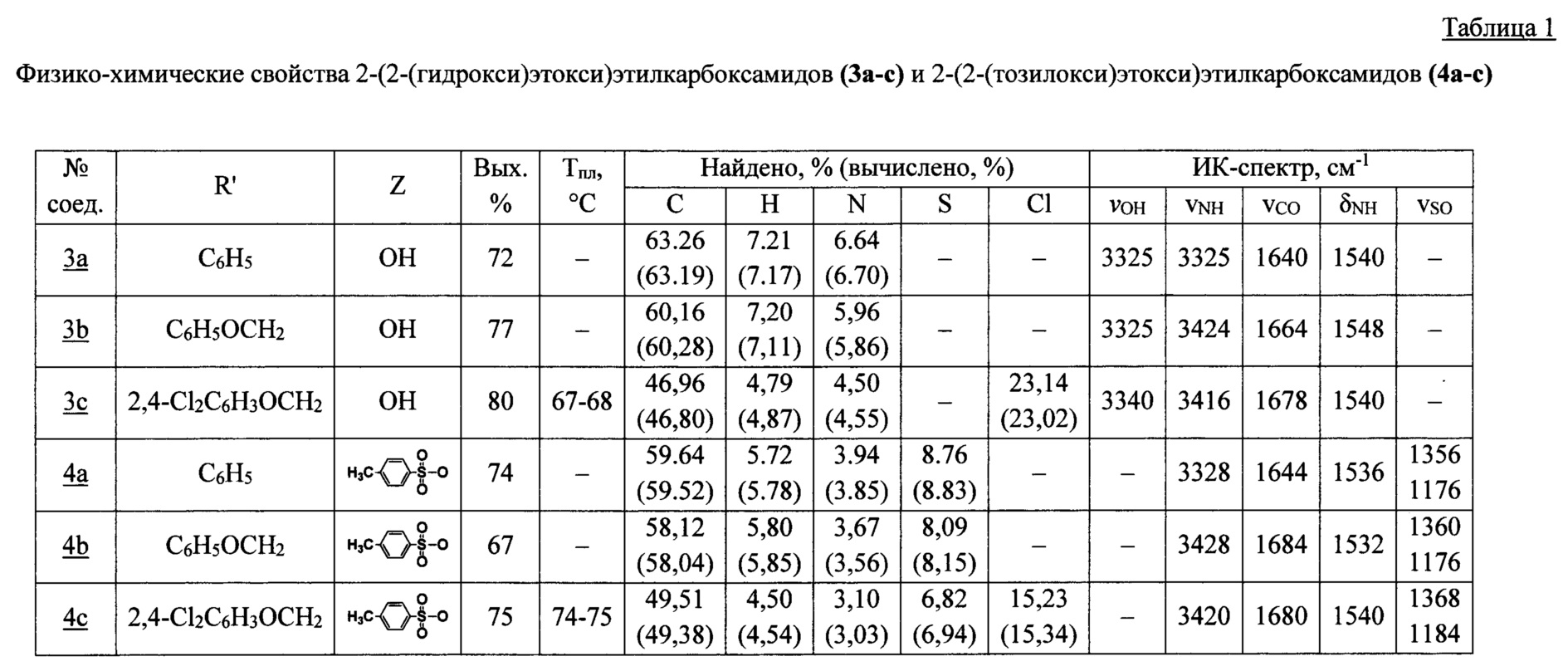
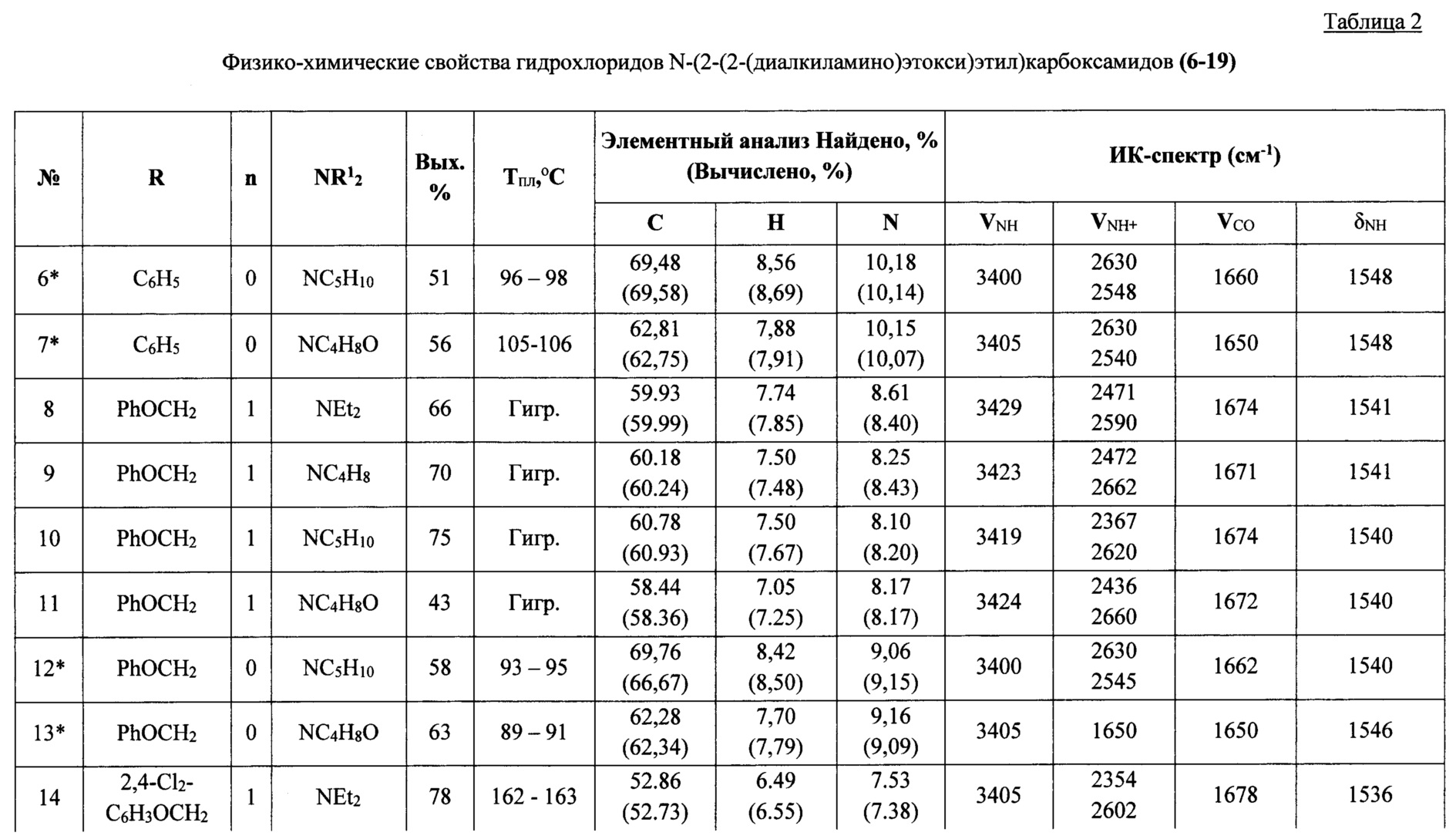
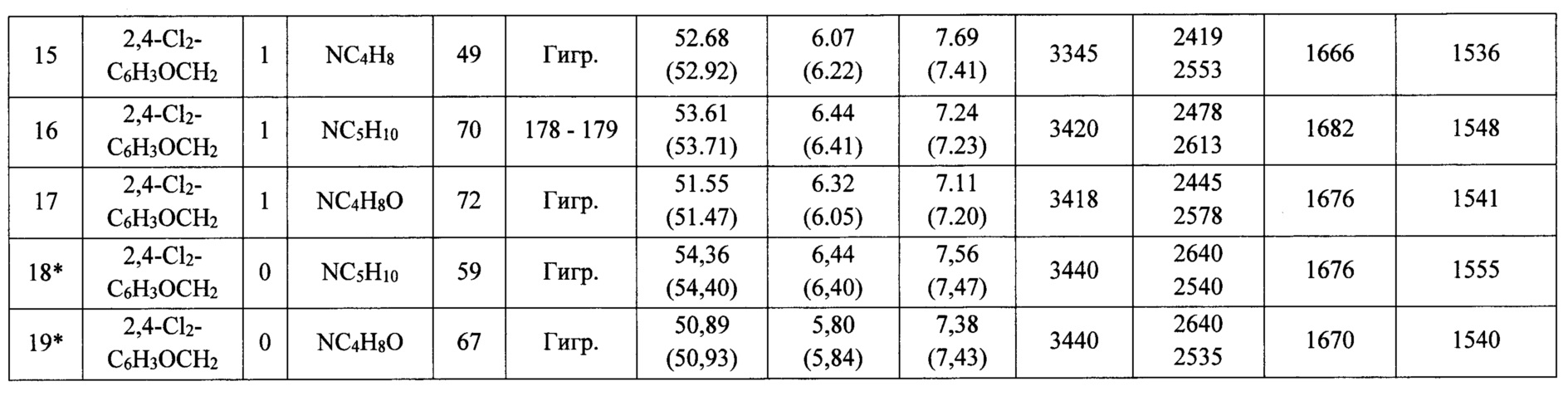
Строение соединений (3а-с), (4а-с), (6-19) подтверждено данными ИК-, ЯМР 1Н-, 13С-спектроскопии, а также масс-спектрометрии, состав - элементным анализом. Физико-химические характеристики предлагаемых соединений представлены в таблицах 1-2.
Пример 1. Смесь 2-(2-аминоэтокси)этанола (1) (1,05 г, 0,01 моль) в 25 мл хлористого метилена и 8 мл водного раствора NaOH (10%) охлаждают до -6÷-4°С. К этому, интенсивно перемешиваемому раствору, добавляют по каплям раствор хлорангидрида бензойной кислоты (2а) (1,55 г, 0,011 моль) в 30 мл хлористого метилена. Затем смесь перемешивают при комнатной температуре в течение 10 часов. Оставляют на сутки при комнатной температуре. Добавляют 15 мл воды и отделяют органический слой. Водный слой промывают хлористым метиленом (2×25 мл) и объединенные органические экстракты промывают раствором соляной кислоты (1:1, 30 мл), насыщенным раствором NaCl (30 мл) и высушивают над Na2SO4. После удаления растворителя получают масло, которое перекристаллизовывают из диэтилового эфира. Выход N-[2-(2-гидроксиэтокси)этил]бензамида (3а) составил 1,51 г (72%). Спектр ЯМР 1Н (DMSO+CCl4): δ 7.7 (m, 2Н); 7.35 (m, 3Н); 6.90 (brd 1Н); 3.60 (m, 8Н); 2.8 (brd 1H). Масс-спектр, m/z: 210 (4), 164 (43), 148 (70), 134 (78), 105 (100), 77(85).
Пример 2. К смеси 1,17 г (0,011 моль) 2-(2-аминоэтокси)этанола (1) в 25 мл хлористого метилена и 8 мл 10% водного раствора NaOH при охлаждении до 0°С и интенсивном перемешивании по каплям добавляют раствор 1,71 г (0,01 моль) феноксиацетилхлорида (2b) в 30 мл хлористого метилена. Реакционную смесь перемешивают при комнатной температуре в течение двух часов. Затем добавляют 15 мл воды, отделяют органический слой, а водный слой промывают хлористым метиленом (2×25 мл). Объединенные органические экстракты промывают 30 мл раствора хлористого натрия и высушивают над Na2SO4. После удаления растворителя получают бесцветное масло, которое перекристаллизовывают из диэтилового эфира. Получают 1,85 г (77%) N-[2-(2-гидроксиэтокси)этил]феноксиацетамида (3b). Спектр ЯМР 1H (DMSO+CCl4): δ 7.91 (brds, 1H, NH); 7.29 (t, 2Н, Hm, Ph); 6.95 (brd, 1Н, ОН); 6.95 (t, 1H, Нр, Ph); 6.92 (d, 2Н, Ho, Ph); 4.41 (s, 2Н, СН2СО); 3.50 (m, 2Н, СН2СН2); 3.48 (m, 2Н, СН2СН2); 3.32 (m, 2Н, СН2СН2); 3.23 (m, 2Н, СН2СН2). Спектр ЯМР 13С: 167.52 (СО); 157.64 (Ci); 129.25 (Cm); 121.07 (Ср); 114.64 (Co); 72.21 (СН2СО); 68.97 (СН2СН2); 66.91 (СН2СН2); 60.37 (СН2СН2); 38.98 (СН2СН2). Масс-спектр, m/z: 239 (9), 194 (12), 177 (66), 151 (72), 107 (77), 93 (60).
Пример 3. Раствор 2,39 г (0,01 моль) 2,4-дихлорфеноксиацетилхлорида (2с) в 30 мл хлористого метилена по каплям при охлаждении до 0°С и интенсивном перемешивании добавляют к смеси 1,17 г (0,011 моль) 2-(2-аминоэтокси)этанола (1) в 25 мл хлористого метилена и 8 мл 10% водного раствора NaOH. Реакционную смесь перемешивают при комнатной температуре в течение двух часов. Затем добавляют 15 мл воды, отделяют органический слой, а водный слой промывают хлористым метиленом (2×25 мл). Объединенные органические экстракты промывают 30 мл раствора хлористого натрия и высушивают над сульфатом натрия. После удаления растворителя добавляют диэтиловый эфир. Выпавший осадок перекристаллизовывают из диэтилового эфира. Получают 2,46 г (80%) N-[2-(2-гидроксиэтокси)этил]-2,4-дихлорфеноксиацетамида (3с). Спектр ЯМР 1Н (DMSO): δ 7.92 (brds, 1Н, NH); 7.59 (s, 1H, Hm, Ph); 7.54 (d, 1Н, Hm, Ph); 7.31 (d, 2H, Ho, Ph); 7.03 (brd, 1H, OH); 4.65 (s, 2H, CH2CO); 3.50 (t, 2H, CH2CH2); 3.48 (t, 2H, CH2CH2); 3.35 (m, 2H, CH2CH2); 3.30 (m, 2H, CH2CH2). Спектр ЯМР 13C: 161.53 (CO); 148.34 (Ci); 127.26, 126.09 (Cm); 123.44 (Cp-Cl); 121.06 (Co-Cl); 117.56 (Co); 75.12 (CH2CO); 72.06 (CH2CH2); 71.16 (CH2CH2); 64.25 (CH2CH2); 44.38 (CH2CH2). Масс-спектр, m/z: 307 (5), 272 (100), 246 (31), 175 (65), 145 (40).
Пример 4. К охлажденному до 0°С раствору N-[2-(2-гидроксиэтокси)этил]бензамида (3а) (3,00 г, 0,0144 моль) в 15 мл сухого пиридина добавляют охлажденный до 0°С раствор n-толуолсульфохлорида (5,49 г, 0,0288 моль) в 15 мл сухого пиридина. Реакционную смесь выдерживают при - 18°С 3 суток. По окончании реакции (контроль по ТСХ, хлороформ) раствор аккуратно сливают с кристаллов в воду со льдом и перемешивают в течение 2 часов. Водный слой промывают эфиром, слои разделяют и органический слой промывают раствором соляной кислоты (1:1), 5% раствором NaHCO3 и водой. Органический слой высушивают над Na2SO4. После удаления растворителя получают 3,87 г (74%) N-[2-(2-n-толуолсульфонилэтокси)этил]бензамида (4а) в виде светло-желтого масла, которое перекристаллизовывают из диэтилового эфира. Спектр ЯМР 1Н (DMSO+CCl4): δ 8.35 (brds, 1Н, NH); 7.85, 7.4 (m, 5Н, Ph); 7.74 (d, 2Н, PhTs); 7.45 (d, 2Н, PhTs); 4.12 (t, 2H, CH2CH2); 3.61 (t, 2Н, СН2СН2); 3.48 (m, 2Н, СН2СН2); 3.40 (m, 2Н, СН2СН2); 2.45 (s, 3Н, CH3Ts). Спектр ЯМР 13С: 166.13 (СО); 154.95 (Ci); 144.55 (Ci-Ts); 130.74 (Cm); 129.89 (Cm-Ts); 127.90 (Co-Ts); 127.60 (Cp); 127.25 (Co); 95.70 (Ci-Ts); 69.48 (CH2CH2); 69.13 (CH2CH2); 67.76 (CH2CH2); 38.72 (CH2CH2); 21.25 (CH3). Масс-спектр, m/z: 363 (5), 199 (56), 164 (70), 155 (61), 148 (65), 134 (42), 105 (100), 91 (77), 77 (81).
Пример 5. К охлажденному до 0°С раствору N-[2-(2-гидроксиэтокси)этил]феноксиацетамида (3b) (3,00 г, 0,0125 моль) в 15 мл сухого пиридина добавляют охлажденный до 0°С раствор n-толуолсульфохлорида (4,77 г, 0,0251 моль) в 15 мл сухого пиридина. Реакционную смесь выдерживают в морозильнике 2,5 суток. По окончании реакции (контроль по ТСХ, хлороформ) раствор аккуратно сливают с кристаллов в воду со льдом и перемешивают в течение 2 часов. Водный слой промывают эфиром, слои разделяют и органический слой промывают раствором соляной кислоты (1:1), 5% раствором NaHCO3 и водой. Органический слой высушивают над Na2SO4. После удаления растворителя получают 3,28 г (67%) N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамида (4b) в виде светло-желтого масла, которое перекристаллизовывают из диэтилового эфира. Спектр ЯМР 1Н (DMSO+CCl4): δ 7.89 (t, 1H, NH); 7.75 (d, 2Н, PhTs); 7.45 (d, 2Н, PhTs); 7.25,6.93 (m, 5Н, Ph); 4.41 (s, 2H, CH2CO); 4.10 (t, 2Н, СН2СН2); 3.60 (t, 2Н, СН2СН2); 3.45 (t, 2Н, СН2СН2); 3.30 (m, 2Н, СН2СН2); 2.45 (s, 3Н, CH3Ts). Спектр ЯМР 13С: 167.44 (СО); 157.64 (Ci); 144.51 (Ci-Ts); 129.89 (Cm-Ts); 129.26 (Cm); 127.62 (Co-Ts); 121.04 (Cp); 114.66 (Co); 95.70 (Ci-Ts); 69.43 (CH2CO); 68.97 (CH2CH2); 67.72 (CH2CH2); 66.94 (CH2CH2); 38.08 (CH2CH2); 21.25 (CH3). Масс-спектр, m/z: 393 (15), 199 (65), 155 (82), 91 (93).
Пример 6. К охлажденному до 0°С раствору N-[2-(2-гидроксиэтокси)этил]-2,4-дихлорфеноксиацетамида (3с) (3,08 г, 0,01 моль) в 15 мл сухого пиридина добавляют охлажденный до 0°С раствор n-толуолсульфохлорида (2,86 г, 0,015 моль) в 15 мл сухого пиридина. Реакционную смесь выдерживают в морозильнике 2.5 суток. По окончании реакции (контроль по ТСХ, хлороформ) раствор аккуратно сливают с кристаллов в воду со льдом и перемешивают в течение 2 часов. Водный слой промывают эфиром, слои разделяют и органический слой промывают раствором соляной кислоты (1:1), 5% раствором NaHCO3 и водой. Органический слой высушивают над Na2SO4. После удаления растворителя получают 3,47 г (75%) N-[2-(2-n-толуолсульфонилэтокси)этил]-2,4-дихлорфеноксиацетамида (4с) в виде белых кристаллов. Спектр ЯМР 1Н (DMSO): δ 7.92 (brds, 1H, NH); 7.80 (d, 2Н, PhTs); 7.59 (s, 1Н, Hm, Ph); 7.49 (d, 2H, PhTs); 7.35 (d, 1H, Hm, Ph); 7.05 (d, 1H, Ho, Ph); 4.62 (s, 2H, CH2CO); 4.11 (t, 2H, CH2CH2); 3.60 (t, 2H, CH2CH2); 3.40 (t, 2H, CH2CH2); 3.25 (t, 2H, CH2CH2); 2.4 (s, 3H, CH3Ts). Спектр ЯМР 13C: 166.96 (CO); 152.50 (Ci); 144.95 (Ci-Ts); 130.18 (Cm-Ts);129.38, 128.06 (Cm); 127.64 (Co-Ts); 125.23 (Cp-Cl); 122.63 (Co-Cl); 115.51 (Co); 95.70 (Ci-Ts); 72.19 (CH2CO); 69.93 (CH2CH2); 68.8 (CH2CH2); 67.91 (CH2CH2); 38.21 (CH2CH2); 21.13 (CH3). Масс-спектр, m/z: 461 (1), 462 (100), 175 (33), 155 (70).
Пример 7. N-[2-(2-n-толуолсульфонилэтокси)этил]бензамид (4a) (3,63 г, 0,01 моль) и пиперидин (5а) (4,25 г, 0,05 моль) кипятят в 50 мл ксилола в течение 35 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,60 (51%) N-(2-(2-пиперидиноэтокси)этил)бензамида гидрохлорида (6). Спектр ЯМР 1Н (CDCl3): δ 10.85 (brd s, 1H, HCl); 7.77 (brd s, 1H, NH); 7.29 (t, 2H, Hm, Ph); 7.01 (t, 1H, Hp, Ph); 6.89 (d, 2H, Ho, Ph); 3.85-3.80 (m, 4H, CH2CH2); 3.30-3.20 (m, 4H, CH2CH2); 2.94 (m, 4H, NC5H10); 1.97 (m, 4H, NC5H10); 1.56 (m, 2H, NC5H10). Спектр ЯМР 13C: 167.39 (CO); 149.09 (Ci); 136.27 (Cm); 124.56 (Cp); 117.05 (Co); 73.11 (CH2CH2); 69.05 (CH2CH2); 61.73 (CH2CH2); 56.18 (NC5H10); 44.90 (CH2CH2); 25.07 (NC5H10); 19.70 (NC5H10).
Пример 8. N-[2-(2-n-толуолсульфонилэтокси)этил]бензамид (4a) (3,63 г, 0,01 моль) и морфолин (5b) (4,35 г, 0,05 моль) кипятят в 50 мл ксилола в течение 30 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,76 (56%) N-(2-(2-морфолиноэтокси)этил)бензамида гидрохлорида (7). Спектр ЯМР 1Н (CDCl3): δ 10.93 (brds, 1Н, HCl); 7.54 (brds, 1Н, NH); 7.30 (t, 2Н, Hm, С6Н5); 6.99 (t, 2Н, Нр, С6Н5); 6.83 (d, 2Н, Но, С6Н5); 3.84 (m, 4Н, NC4H8O); 3.65 (m, 2Н, СН2СН2); 3.55 (m, 2Н, СН2СН2); 3.30 (m, 2Н, СН2СН2); 2.63 (m, 2Н, СН2СН2); 2.43 (m, 4Н, NC4H8O). Спектр ЯМР 13С: 169.37 (СО); 147.64 (Ci); 135.12 (Cm); 123.90 (Ср); 121.07 (Co); 72.19 (NC4H8O); 70.56 (СН2СН2); 70.08 (СН2СН2); 69.72 (СН2СН2); 62.80 (NC4H8O); 57.20 (СН2СН2).
Пример 9. Смесь 0,76 г (3,69 ммоль) N-бензил-2-диэтиламиноэтиламина (5с) и 1,44 г (3,66 ммоль) N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамида (4b) в 35 мл ацетонитрила в присутствии 1,86 г (18,35 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 40 мл). Органический слой отделяют.Водный слой промывают диэтиловым эфиром (3×20 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×20 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (40 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,2 г (66%) дигидрохлорида N-(2-(2-(бензил(2-(диэтиламино)этил)амино)этокси)этил)-феноксиацетамида в виде порошка (8). Спектр ЯМР 1Н (ДМСО-d6), 300.13 МГц, δ (м.д.), J (Гц): 1.22 (т, 6Н, 2СН3, J=7.2); 3.11-3.24 (м, 4Н, 2CH2N); 3.34-3.80 (м, 12Н, 2CH2O+4CH2N); 4.45 (с, 2Н, NCH2Ph); 4.53 (с, 2Н, CH2O); 76.9 (м, 3Н, Ar); 7.28 (м, 2Н, Ar); 7.44 (м, 3Н, Ar); 7.74 (м, 2Н, Ar); 8.48 (т, 1Н, NH, J=5.2); 11.29 (с, 1Н, HN+); 11.62 (с, 1Н, HN+). Спектр ЯМР 13С (ДМСО-d6), 75МГц, δ (м.д.): 8.32 (2СН3); 38.07 (CH2N); 44.70 (CH2N); 46.61 (2CH2N, NEt2); 46.88 (CH2N); 50.76 (CH2N); 57.20 (CH2N); 63.96 (CH2O); 66.71 (CH2O); 69.18 (CH2O); 114.64 (2CH, Ar); 121.07 (CH, Ar); 128.79 (2CH, Ar); 129.43 (C+2CH, Ar); 129.55 (CH, Ar); 131.58 (2CH, Ar); 157.69 (C, Ar); 167.83 (C=O). HRMS, m/z: Найдено 428.2888 [M-2Cl-H]+. C25H39N3O3Cl2. Вычислено M-2Cl-H=428.2913.
Пример 10. Смесь 0,280 г (1,38 ммоль) N-бензил-2-пирролидиноэтиламина (5d) и 0,54 г (1,38 ммоль) N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамида (4b) в 20 мл ацетонитрила в присутствии 0,7 г (6,9 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 20 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×10 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×10 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (20 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 0,48 г (70%) дигидрохлорида N-(2-(2-(бензил(2-(N'-пирролидино)этил)амино)этокси)-этил)феноксиацетамида в виде порошка (9). Спектр ЯМР 1Н (CDCl3), 300.13 МГц, δ (м.д.): 2.02 (м, 4Н, 2СН2); 2.82-3.65 (м, 16Н, CH2O+7CH2N); 4.55 (с, 4Н, 2CH2O); 6.98-7.04 (м, 3Н, Ar); 7.22-7.39 (м, 5Н, Ar); 7.74 (м, 2Н, Ar); 8.03 (с, 1H, NH); 11.88 (с, 1H, NH+); 12.06 (с, 1H, NH+). Спектр ЯМР 13С (CDCl3), 75.47 МГц, δ (м.д.): 23.28 (2СН2); 38.83 (CH2N); 49.42 (CH2N); 50.37 (CH2N); 51.76 (CH2N); 54.50 (2CH2N); 59.79 (CH2N); 64.62 (CH2O); 67.36 (CH2O); 70.32 (CH2O); 114.89 (2CH, Ar); 121.82 (CH, Ar); 128.33 (C, Ar); 129.45 (2CH, Ar); 129.65 (2CH, Ar); 130.33 (CH, Ar); 131.56 (2CH, Ar); 157.47 (C, Ar); 168.72 (C=O).
Пример 11. Смесь 0,6 г (2,75 ммоль) N-бензил-2-пиперидиноэтиламина (5е) и 1,41 г (3,6 ммоль) N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамида (4b) в 25 мл ацетонитрила в присутствии 1,39 г (13,76 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 30 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×15 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×15 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (30 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,05 г (75%) дигидрохлорида N-(2-(2-(бензил(2-(N'-пиперидино)этил)амино)этокси)-этил)феноксиацетамида в виде порошка (10). Спектр ЯМР 1Н (ДМСО-d6), 300.13 МГц, δ (м.д.), J (Гц): 1.38-1.77 (м, 6Н, Hβ+Hγ, NC5H10); 2.93 (с, 2Н, CH2N); 3.23 (с, 2Н, CH2N); 3.35-3.79 (м, 12Н, 2CH2O+4CH2N); 4.43 (с, 2Н, NCH2Ph); 4.53 (с, 2Н, CH2O); 6.95 (м, 3Н, 133 Ar); 7.29 (т, 2Н, Ar, J=7.9); 7.44 (м, 3Н, Ar); 7.72 (м, 2Н, Ar); 8.44 (т, 1Н, NH, J=5.4); 11.07 (с, 1Н, HN+); 11.40 (с, 1Н, HN+). Спектр ЯМР 13С (ДМСО-d6), 75МГц, δ (м.д.): 21.09 (Сγ, NC5H10); 22.22 (2Сβ, NC5H10); 38.08 (CH2N); 46.83 (CH2N); 49.58 (CH2N); 50.52 (CH2N); 52.36 (2Cα, NC5H10); 52.36 (2Cα, NC5H10); 57.22 (CH2N); 64.05 (CH2O); 66.75 (CH2O); 69.18 (CH2O); 114.66 (2CH, Ar); 121.09 (CH, Ar); 128.77 (2CH, Ar); 129.44 (С+3CH, Ar); 129.52 (CH, Ar); 131.62 (2CH, Ar); 157.69 (C, Ar); 167.84 (C=O). HRMS, m/z: Найдено 440.2884 [M-2Cl-H]+. C26H39N3O3Cl2. Вычислено M-2Cl-H=440.2913.
Пример 12. Смесь 0,64 г (2,9 ммоль) N-бензил-2-морфолиноэтиламина (5f) и 1,13 г (2,9 ммоль) N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамида (4b) в 25 мл ацетонитрила в присутствии 1,47 г (14,56 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 30 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×15 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×15 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (30 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 0,64 г (43%) дигидрохлорида N-(2-(2-(бензил(2-морфолиноэтил)амино)этокси)этил)-феноксиацетамида в виде порошка (11). Спектр ЯМР 13С (CDCl3), 75.47 МГц, δ (м.д.): 38.66 (CH2N); 48.08 (CH2N); 51.12 (CH2N); 51.90 (CH2N); 52.24 (2CH2N, NC4H8O); 59.32 (CH2N); 63.48 (2CH2O, NC4H8O); 64.54 (CH2O); 67.12 (CH2O); 70.07 (CH2O); 114.26 (2CH, Ar); 121.80 (CH, Ar); 128.62 (C, Ar); 129.29 (2CH, Ar); 129.61 (2CH, Ar); 130.19 (CH, Ar); 131.50 (2CH, Ar); 157.33 (C, Ar); 168.80 (C=O).
Пример 13. N-[2-(2-n-толуолсульфонилэтокси)этил]феноксиацетамид (4b) (3,93 г, 0,01 моль) и пиперидин (5а) (4,25 г, 0,05 моль) кипятят в 50 мл ксилола в течение 35 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,97 г (58%) гидрохлорида N-(2-(2-пиперидиноэтокси)этил)феноксиацетамида (12). Спектр ЯМР 1Н (CDCl3): δ 11.49 (brds, 1H, HCl); 7.81 (brds, 1Н, NH); 7.21 (t, 2H, Hm, Ph); 6.83 (t, 1Н, Hp, Ph); 6.80 (d, 2H, Ho, Ph); 4.45 (s, 2H, CH2CO); 3.54 (m, 2H, CH2CH2); 3.50 (m, 2H, CH2CH2); 3.43 (m, 2H, CH2CH2); 3.33 (m, 2H, CH2CH2); 2.32 (m, 4H, NC5H10); 1.80 (m, 2H, NC5H10). Спектр ЯМР 13C: 175.90 (CO); 161.78 (Ci); 133.19 (Cm); 125.63 (Cp); 118.97 (Co); 74.01 (CH2CO); 73.25 (CH2CH2); 71.89 (CH2CH2); 71.03 (CH2CH2); 62.80 (NC5H10); 57.59 (CH2CH2); 41.37 (NC5H10); 23.07 (NC5H10).
Пример 14. N-[2-(2-n-толуолсульфонил-этокси)этил]феноксиацетамид (4b) (3,93 г, 0,01 моль) и морфолин (5b) (4,35 г, 0,05 моль) кипятят в 50 мл ксилола в течение 28 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 2,17 г (63%) гидрохлорида N-(2-(2-морфолиноэтокси)этил)феноксиацетамида (13). Спектр ЯМР 1H (CDCl3): δ 11.50 (brd s, 1H, HCl); 7.84 (brd s, 1H, NH); 7.19 (t, 2Н, Hm, Ph); 6.83 (m, 3Н, Hp+Ho, Ph); 4.10 (s, 2H, CH2CO); 3.55 (m, 2Н, NC4H8O); 3.51 (m, 2H, CH2CH2); 3.45 (m, 2Н, СН2СН2); 3.32 (m, 2Н, СН2СН2); 2.46 (m, 2Н, СН2СН2); 2.40 (m, 2Н, NC4H8O). Спектр ЯМР 13С: 176.29 (СО); 164.10 (Ci); 134.31 (Cm); 124.97 (Ср); 119.72 (Co); 73.89 (СН2СО); 73.12 (NC4H8O); 72.58 (СН2СН2); 71.78 (СН2СН2); 71.43 (СН2СН2); 62.84 (СН2СН2); 58.93 (NC4H8O).
Пример 15. Смесь 0,76 г (3,69 ммоль) N-бензил-N-(2-диэтиламиноэтил)амина (5с) и 1,7 г (3,69 ммоль) N-[2-(2-n-толуол-сульфонилэтокси)этил]-2,4-дихлорфеноксиацетамида (4с) в 30 мл ацетонитрила в присутствии 1,87 г (18,5 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 40 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×20 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×20 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (40 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,64 г (78%) дигидрохлорида N-(2-(2-(бензил(2-(диэтиламино)этил)амино)этокси)этил)-2,4-дихлорфеноксиацетамида в виде порошка (14). Спектр ЯМР 1Н (CDCl3), 300.13 МГц, δ (м.д.), J (Гц): 1.35 (т, 6Н, 2СН3, J=5.4; 3.17 (м, 4Н, 2CH2N); 3.41-3.80 (м, 12Н, 2CH2O+4CH2N); 4.56 (м, 2Н, NCH2Ph); 4.65 (с, 2Н, CH2O); 6.95 (д, 1H, Н(6), Ar, 3 J=8.6); 7.17 (дд, 1Н, Н(5), Ar, 4 J=2.4, 3 J=8.6); 7.32 (д, 1H, Н(3), Ar, 4 J=2.4); 7.75 (м, 2Н, Ar); 7.40 (м, 3Н, Ar); 7.86 (с, 1Н, NH); 11.77 (с, 1H, HN+); 11.92 (с, 1H, HN+). Спектр ЯМР 13C(CDCl3), 75МГц, δ (м.д.): 8.74 (2СН3); 38.30 (CH2N); 46.90 (2CH2N, NEt2); 47.84 (CH2N); 49.09 (CH2N); 52.00 (CH2N); 59.77 (CH2N); 64.70 (CH2O); 68.54 (CH2O); 70.13 (CH2O); 115.34 (CH, Ar); 123.57 (C-Cl, Ar); 126.99 (C-Cl, Ar); 127.89 (CH, Ar); 129.38 (2CH, Ar); 129.89 (C+CH, Ar); 130.29 (CH, Ar); 131.47 (2CH, Ar); 152.10 (C, Ar); 167.80 (C=O). HRMS, m/z: Найдено 496.2103 [M-2Cl-H]+. C25H37N3O3Cl4. Вычислено M-2Cl-H=496.2134.
Пример 16. Смесь 1,8 г (8,82 ммоль) N-бензил-N-(2-пирролидиноэтил)амина (5d) и 4,07 г (8,83 ммоль) N-[2-(2-n-толуол-сульфонилэтокси)этил]-2,4-дихлорфеноксиацетамида (4с) в 80 мл ацетонитрила в присутствии 4,46 г (44,15 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 80 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×40 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×40 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (80 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 2,43 г (49%) дигидрохлорида N-(2-(2-(бензил(2-пирролидиноэтил)амино)этокси)этил)-2,4-дихлорфеноксиацетамида в виде порошка (15). Спектр ЯМР 1Н (ДМСО-d6), 300.13 МГц, δ (м.д.), J (Гц): 1.98 (м, 4Н, 2СН2, NC4H8); 3.05 (м, 2Н, CH2N); 3.24 (м, 2Н, CH2N); 3.33-3.67 (м, 12Н, 2CH2O + 4CH2N); 4.52 (м, 2Н, NCH2Ph); 4.72 (с, 2Н, CH2O); 7.08 (д, 1Н, Н(6), Ar, 3 J=9); 7.36 (дд, 1H, Н(5), Ar, 4 J=2.6, 3 J=9); 7.44 (м, 3Н, Ar); 7.57 (д, 1H, Н(3), Ar, 4 J=2.6); 7.72 (м, 2Н, Ar); 8.44 (т, 1H, NH, J=5.1); 11.44 (с, 2Н, 2HN+). Спектр ЯМР 13С (ДМСО-d6), 75МГц, δ (м.д.): 22.64 (2СН2, NC4H8); 38.21 (CH2N); 47.39 (CH2N); 47.97 (CH2N); 50.76 (CH2N); 53.05 (2CH2N, NC4H8); 57.19 (CH2N); 64.00 (CH2O); 67.63 (CH2O); 69.16 (CH2O); 115.31 (CH, Ar); 122.41 (C-Cl, Ar); 124.93 (C-Cl, Ar); 127.99 (CH, Ar); 128.79 (2CH, Ar); 129.29 (C+CH, Ar); 129.53 (CH, Ar); 131.55 (2CH, Ar); 152.55 (C, Ar); 167.03 (C=O). 135 HRMS, m/z: Найдено 494.1952 [M-2Cl-H]+. C25H35N3O3Cl4. Вычислено M-2Cl-H=494.1977.
Пример 17. Смесь 0,7 г (3,2 ммоль) N-бензил-N-(2-пиперидиноэтил)амина (5е) и 1,48 г (3,2 ммоль) N-[2-(2-n-толуол-сульфонилэтокси)этил]-2,4-дихлорфеноксиацетамида (4с) в 25 мл ацетонитрила в присутствии 1,62 г (16,0 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 30 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×15 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×15 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (30 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,3 г (70%) дигидрохлорида N-(2-(2-(бензил(2-пиперидино)этил)амино)этокси)этил)-2,4-дихлорфеноксиацетамида в виде порошка (16). Спектр ЯМР lH (CDCl3), 500 МГц, δ (м.д.) J (Гц): 1.40-2.07 (м, 6Н, Hβ+Hγ, NC5H10); 2.90 (шир.с, 2Н, Нα, NC5H10); 3.38-3.45 (м, 4Н, 2Нα в NC5H10+CH2N); 3.57-4.13 (с, 10Н, 2CH2O+3CH2N); 4.42-4.57 (м, 2Н, CH2Ph); 4.68 (д, 2Н, СН2СО); 6.98 (д, 1H, Н(6), Ar, 3 J=8.9), 7.20 (дд, 1H, Н(5), Ar, 4 J=2.5, 3 J=8.9); 7.35 (д, 1Н, Н(3), Ar, 4 J=2.5); 7.43 (м, 3Н, Ar); 7.73 (м, 2Н, Ar); 7.78 (с, 1H, NH); 11.78 (с, 1H, HN+); 12.01 (с, 1H, HN+). Спектр ЯМР 13С (CDCl3), 125МГц, δ (м.д.): 23.08 (Cr, NC5H10); 24.14 (2Сβ, NC5H10); 40.21 (CH2N); 50.04 (CH2N); 52.57 (CH2N); 53.39 (CH2N); 54.94 (2Сα, NC5H10); 61.30 (CH2Ph); 66.19 (CH2O); 70.19 (CH2O); 71.67 (CH2O); 117.03 (CH, Ar); 125.21 (C-Cl, Ar); 128.64 (C-Cl, Ar); 129.42 (CH, Ar); 130.91 (2CH, Ar); 131.43 (C+CH, Ar); 131.81 (CH, Ar); 132.93 (2CH, Ar); 153.63 (C, Ar); 169.31 (CO). MS/MS, m/z: 509.08 (100) [M-2Cl]+, 207 (21), 134 (8), 112 (10).
Пример 18. Смесь 0,71 г (3,2 ммоль) N-бензил-N-(2-морфолиноэтил)амина (5f) и 1,47 г (3,2 ммоль)N-[2-(2-n-толуол-сульфонилэтокси)этил]-2,4-дихлорфеноксиацетамида (4с) в 30 мл ацетонитрила в присутствии 1,62 г (16,0 ммоль) триэтиламина нагревают при кипении растворителя в течение 60 часов (контроль с ТСХ, этанол). Затем под вакуумом отгоняют растворитель и триэтиламин, к остатку добавляют смесь Et2O/H2O (1:1, 30 мл). Органический слой отделяют. Водный слой промывают диэтиловым эфиром (3×15 мл). Экстракты объединяются, промываются насыщенным раствором NaCl (3×15 мл) и сушатся над Na2SO4. Растворитель отгоняют на роторе, остаток растворяют в диэтиловом эфире (30 мл) и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 1,3 г (72%) дигидрохлорида N-(2-(2-(бензил(2-морфолино)этил)амино)этокси)этил)-2,4-дихлорфеноксиацетамида в виде порошка (17). Спектр ЯМР 1Н (CDCl3), 300.13 МГц, δ (м.д.), J (Гц): 3.01-3.97 (м, 20Н, 4CH2O+6CH2N); 4.56 (д, 2Н, NCH2Ph); 4.63 (с, 2Н, CH2O); 6.93 (д, 3 J=8.5, 136 1Н, Н(6), Ar); 7.18 (дд, 1H, Н(5), Ar, 4 J=2.15, 3 J=8.5); 7.32 (д, 1Н, Н(3), Ar, 4 J=2.1); 7.38 (м, 3Н, Ar); 7.71 (м, 3Н, NH+2H(Ar)); 11.63 (с, 1H, HN+); 12.27 (с, 1H, HN+). Спектр ЯМР 13С (CDCl3), 75МГц, δ (м.д.): 38.71 (CH2N); 47.17 (CH2N); 47.65 (CH2N); 48.18 (CH2N); 52.05 (2CH2N, NC4H8O); 59.53 (CH2N); 63.54 (2CH2O, NC4H8O); 64.78 (CH2O); 68.55 (CH2O); 70.20 (CH2O); 115.33 (CH, Ar); 123.56 (C-Cl, Ar); 127.12 (C-Cl, Ar); 127.96 (CH, Ar); 129.37 (2CH, Ar); 129.93 (C+CH, Ar); 130.27 (CH, Ar); 131.53 (2CH, Ar); 151.92 (C, Ar); 167.88 (C=O). HRMS, m/z: Найдено 510.1893 [M-2Cl-H]+. C25H35N3O4Cl4. Вычислено M-2Cl-H=510.1926.
Пример 19. N-[2-(2-n-толуолсульфонилэтокси)этил]-2,4-дихлорфеноксиацетамид (4c) (4,62 г, 0,01 моль) и пиперидин (5а) (4,25 г, 0,05 моль) кипятят в 50 мл ксилола в течение 25 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 2,42 г (59%) гидрохлорида N-(2-(2-пиперидиноэтокси)этил)-2,4-дихлорфеноксиацетамида (18). Спектр ЯМР 1Н (DMSO+CCl4): δ 11.52 (brds, 1H, HCl); 7.75 (brds, 1H.NH); 7.41 (m, 1H, HmPh); 7.27 (m, 1H, HmPh); 7.05 (m, 1H, HoPh); 4.58 (s, 2H, CH2CO); 3.53 (m, 2H, CH2CH2); 3.50 (m, 2H, CH2CH2); 3.48 (m, 2H, CH2CH2); 3.35 (m, 2H, CH2CH2); 2.45 (m, 4H, NC5H10); 2.4 (m, 4H, NC5H10); 1.56 (m, 2H, NC5H10). Спектр ЯМР 13C: 166.48 (CO); 152.24 (Ci); 129.22, 127.78 (Cm); 125.50 (Cp-Cl); 122.80 (Co-Cl); 115.31 (Co); 68.88 (CH2CO); 68.21 (CH2CH2); 67.91 (CH2CH2); 58.00 (CH2CH2); 54.51 (NC5H10); 38.34 (CH2CH2); 25.48,23.94 (NC5H10).
Пример 20. N-[2-(2-n-толуолсульфонилэтокси)этил]2,4-дихлорфеноксиацетамид (4c) (4,62 г, 0,01 моль) и морфолин (5b) (4,35 г, 0,05 моль) кипятят в 50 мл ксилола в течение 37 часов до исчезновения исходного тозильного производного (контроль ТСХ, ацетон). Растворитель и исходный амин отгоняют в вакууме, остаток растворяют в диэтиловом эфире и добавляют 3N раствор HCl/диоксан до постоянного значения рН=2. Осадок промывают диэтиловым эфиром (3×10 мл) и высушивают в вакууме. Получают 2,76 г (67%) гидрохлорида N-(2-(2-морфолиноэтокси)этил)-2,4-дихлорфенокси-ацетамида (19). Спектр ЯМР 1Н (DMSO+CCl4): δ 11,50 (brs s, 1Н, HCl); 7.73 (brs s, 1H, NH); 7.48 (s, 1H, Hm, Ph); 7.33 (d, 1H, Hm, Ph); 7.10 (d, 1H, Ho, Ph); 4.50 (s, 2H, CH2CO); 3.60 (m, 2H, CH2CH2); 3.50 (m, 2H, CH2CH2); 3.47 (m, 2H, CH2CH2); 3.30 (m, 2H, CH2CH2); 2.56 (m, 4H, NC4H8O); 1.93 (m, 4H, NC4H8O). Спектр ЯМР 13C: 166.93 (CO); 152.48 (Ci); 129.35, 127.84 (Cm); 125.63 (Cp-Cl); 122.73 (Co-Cl); 115.20 (Co); 71.04 (CH2CO); 69.27 (NC4H8); 68.51 (CH2CH2); 67.23 (CH2CH2); 65.48 (CH2CH2); 38.34 (CH2CH2); 34.25 (NC4H8O).
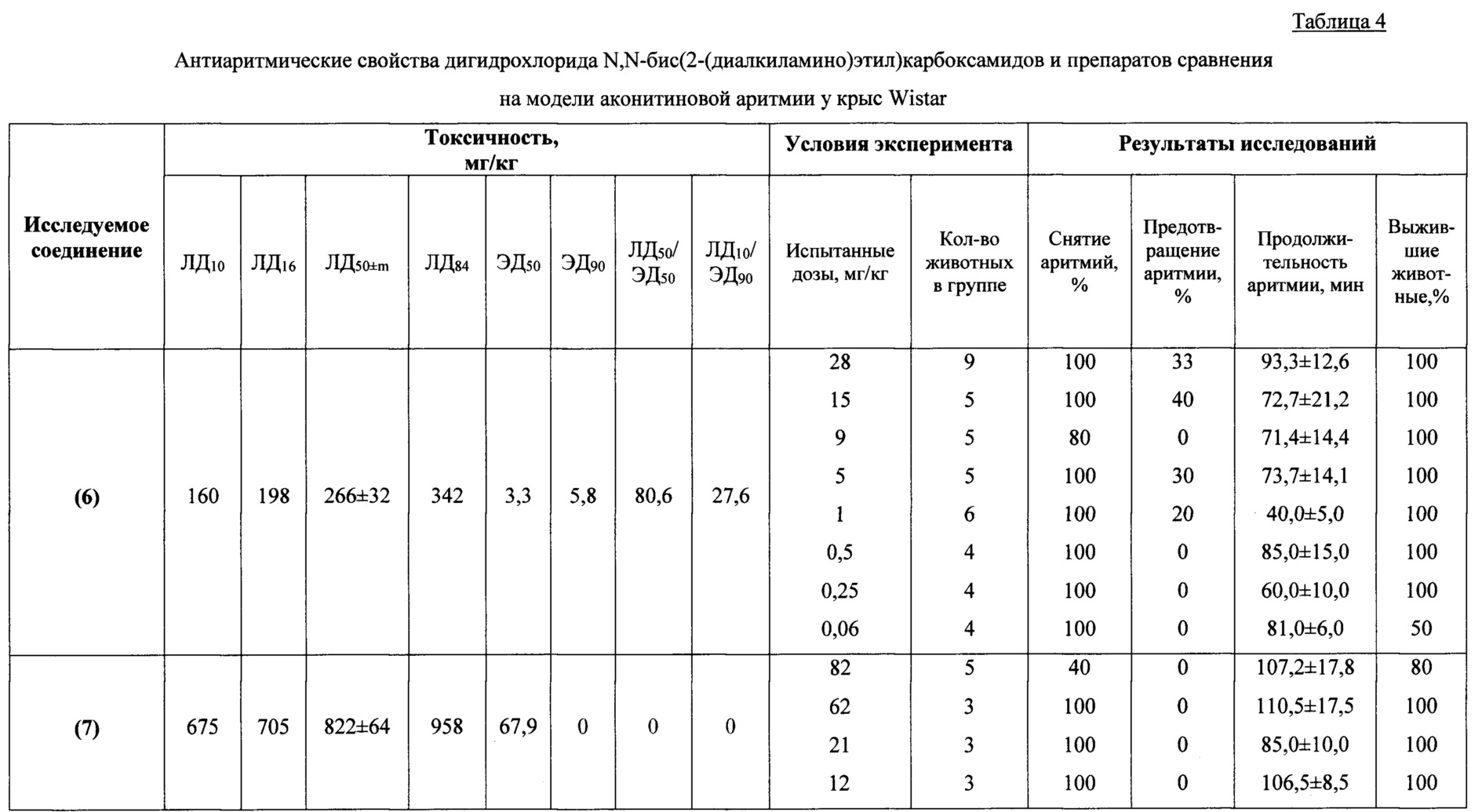
Исследование антиаритмических свойств изучаемых соединений проведено в соответствии с руководством по проведению доклинических исследований лекарственных средств [Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М: Гриф и К, 2012. - 944 с.].
Антиаритмические свойства веществ оценивались параллельно на различных моделях нарушения сердечного ритма, в которых аритмии возникают и поддерживаются различными механизмами. В качестве моделей использовали аконитиновую (аконитина гидробромид в дозах 40-50 мкг/кг), хлоридкальциевую (CaCl2 в дозе 200-250 мг/кг) и хлоридбариевую (BaCl2 в дозе 25 мг/кг) аритмии у крыс Wistar (самцы и самки, масса тела 180-240 г). Эффективность антиаритмического действия соединений характеризуется способностью предотвращать развитие аритмии или прекращать уже развившиеся аритмии, облегчать их течение и восстанавливать нормальный синусовый ритм.
Исследования токсичности и антиаритмической активности заявляемых соединений проведены на 380 мышах линии Balb/c (самцы и самки, масса тела 18-20 г), 760 крысах линии Wistar (самцы и самки, масса тела 180-240 г).
Животных содержали в соответствии с нормами группового размещения в условиях естественного освещения с принудительной 16-ти кратной вентиляцией при температуре 18-20°С и относительной влажности 40-70%. Животные имели свободный доступ к питьевой воде и стандартному (ГОСТ Р50258-92) гранулированному корму ПК 120-1 (ООО «Лабораторснаб», Россия). Условия содержания животных соответствовали приказу МЗ РФ №199н «Об утверждении правил надлежащей лабораторной практики» от 01.04.2016 и этическим нормам, изложенным в Правилах лабораторной практики (GLP) Хельсинской декларации (2000). Все исследовательские работы с лабораторными животными выполнялись в соответствии с общепринятыми нормами обращения с животными, которые соответствуют правилам, принятым Европейской Конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей [European Convention for the protection of vertebrate animals used for experimental and other scientific purposes, Strasbourg, 18 March 1986].
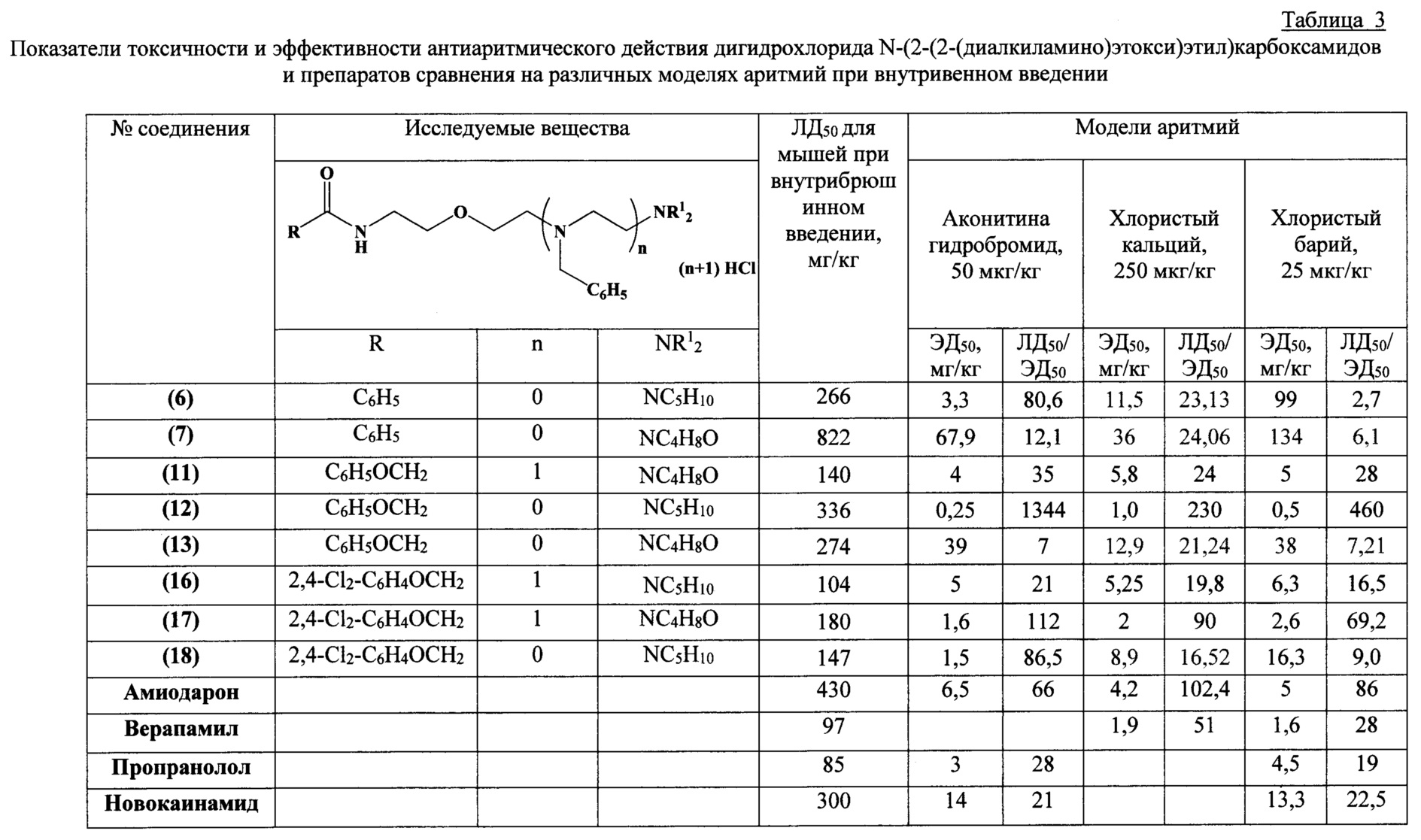
Исследованию антиаритмических свойств впервые синтезированных соединений предшествовало изучение их острой токсичности на мышах линии Balb/c (самцы и самки, масса тела 18-22 г) при однократном внутрибрюшинном введении. На I этапе по методу [Deichmann W.B., LeBlanc T.J. Determination of the approximate lethal dose with about six animals / Journal of Industrial Hygiene and Toxicology, 1943, V. 25, pp. 415-417] на малом количестве животных (5-7) определяли показатели ориентировочной ЛД50. На втором этапе в развернутом эксперименте устанавливали точное значение параметров токсикометрии с использованием метода пробит-анализа по Литчфилду и Уилкоксону (развернутый опыт на трех группах животных, по 5-6 животных в каждой, с дозами выше и ниже установленных ориентировочно ЛД50). Наблюдение за животными осуществляли на протяжении 14 дней после введения веществ. Регулярно фиксировали общее состояние, особенности поведения и двигательной активности, регистрировали сроки развития интоксикации и гибели животных. Показатели острой токсичности ЛД10, ЛД16, ЛД50±m, ЛД84 определяли с использованием метода пробит-анализа по Литчфилду и Уилкоксону [Litchfield J.Т., Wilcoxon F.A simplified method of evaluating dose-effect experiments / Journal of Pharmacology and Experimental Therapeutics, 1949, V. 96, N. 2, pp. 99-113; Беленький M.Л. Элементы количественной оценки фармакологического эффекта / 2-е изд., перераб. и доп. - Ленинград: Медгиз, 1963. - 146 с.]. Как показали проведенные исследования, изучаемые соединения оказались малотоксичными при однократном внутрибрюшинном введении мышам линии BALB/c. При этом показатели ЛД50 находились в пределах 104-822 мг/кг. Результаты экспериментов представлены в таблице 3.
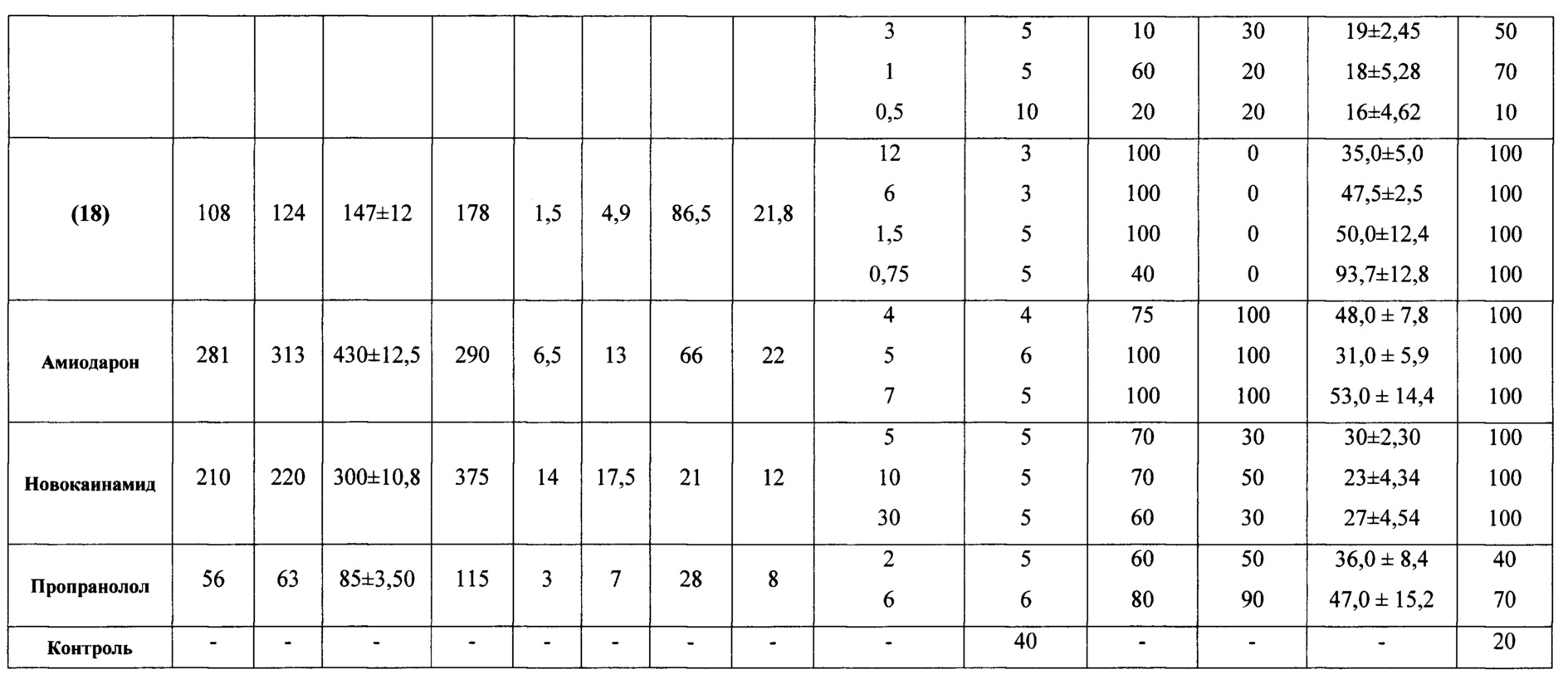
В качестве референтных препаратов использовали известные и широко применяемые в медицинской практике антиаритмические средства: амиодарон (Кордарон «Санофи-Авентис Франс»), пропранолол (Анаприлин «Татхимфармпрепараты»), верапамил (Алкалоид респ. Македония), новокаинамид (Мосхимфармпрепараты им. Н.А. Семашко).
Антиаритмическуюактивность соединений оценивали по величине среднеэффективной дозы (ЭД50), предотвращающей или снимающей нарушения сердечного ритма, антиаритмическому индексу (АИ) и индексу Шнейдера-Брокка (ЛД10/ЭД90). Последний позволяет более точно охарактеризовать фармакологическую активность препаратов, терапевтическую широту и перспективность создания на их основе лекарственных средств [Arzamastsev Е.V. The safety of drugs at the stage of screening and preclinical toxicological studies / Lab. Zhyvotnye, 1991, V. 1, N. 2, pp. 60-64]. Указанные параметры эффективности и токсичности устанавливали методом пробит-анализа по методу Литчфилду и Уилкоксона [Litchfield J.Т., Wilcoxon F.A simplified method of evaluating dose-effect experiments / Journal of Pharmacology and Experimental Therapeutics, 1949, V. 96, N. 2, pp. 99-113].
Аконитиновая модель аритмии на крысах Wistar. Эксперименты по первичной оценке антиаритмической активности выполнены на модели аконитиновой аритмии на наркотизированных уретаном (в/б, 1300 мг/кг) крысах Wistar. Внутривенное введение аконитина гидробромида в дозе 40-50 мкг/кг вызывает желудочковую экстрасистолию, быстро переходящую в тахисистолию, трепетание, мерцание и фибрилляцию желудочков, приводящих более чем в 90% случаев к гибели животных, и продолжается в случае отсутствия фибрилляции желудочков в среднем 49,3±10,4 мин. [Szekeres L. Experimental models for the study of antiarrhythmic agents / Progr. mPharmacol, 1979, V. 2, N. 4, pp. 25-31]. Электрокардиограмма представлена на фиг. 1A.
Наркотизированных животных (крысы Wistar, самцы и самки массой 180-240 г) (уретан 1300 мг/кг, в/б) фиксировали в положении на спине на операционном столе, катетеризировали бедренную вену для введения аконитина и изучаемых соединений. Перед началом эксперимента у животных регистрировали ЭКГ (II стандартное отведение, калибровочный сигнал 10 мм/мВ, скорость записи 25 мм/сек). В качестве регистратора использовали кардиограф CARDIOVITAT-1 VETSchiller (Швейцария). Затем подбирали дозу аконитина (n=10, в/в, болюсом), которая во всех экспериментах в пределах 1-2 мин после окончания его введения вызывает политопную предсердно-желудочковую экстрасистолию. Изучаемые соединения вводили в дозах 1/10-1/100 от ЛД50 для мышей при внутрибрюшинном введении, препараты сравнения в эффективных антиаритмических дозах. Регистрацию ЭКГ проводили через 3, 5, 10, 15 и 20 минут после введения аконитина. Каждую дозу исследуемых соединений испытывали на 5-10 животных.
Эффективность антиаритмического действия соединений оценивали по величине латентного периода, по продолжительности аритмии или ее предотвращению. По окончании эксперимента рассчитывали среднеэффективную дозу соединения - ЭД50 методом пробит-анализа по Литчфиллду и Уилкоксону. Для оценки эффективности антиаритмического действия изучаемых соединений и препаратов сравнения использовали антиаритмический индекс (ЛД50/ЭД50) и индекс Шнейдера-Брокка (ЛД90/ЭД90). На основании нескольких серий экспериментов, в которых исследовались антиаритмические свойства различных доз изучаемых веществ, методом пробит-анализа по Литчфилду и Уилкоксону определяли дозы, снимающие аритмию у 50 и 90% животных.
Введение исследуемых соединений в диапазоне испытанных доз 1/100-1/10 от ЛД50 (для мышей при внутрибрюшинном введении) приводило к 30-100% выживаемости животных на модели аконитиновой аритмии. Заявляемые соединения в испытанных дозах увеличивали длительность скрытого периода развития аконитиновой аритмии или полностью ее предотвращали. Кардиограммы представлены на фиг. 1-3.
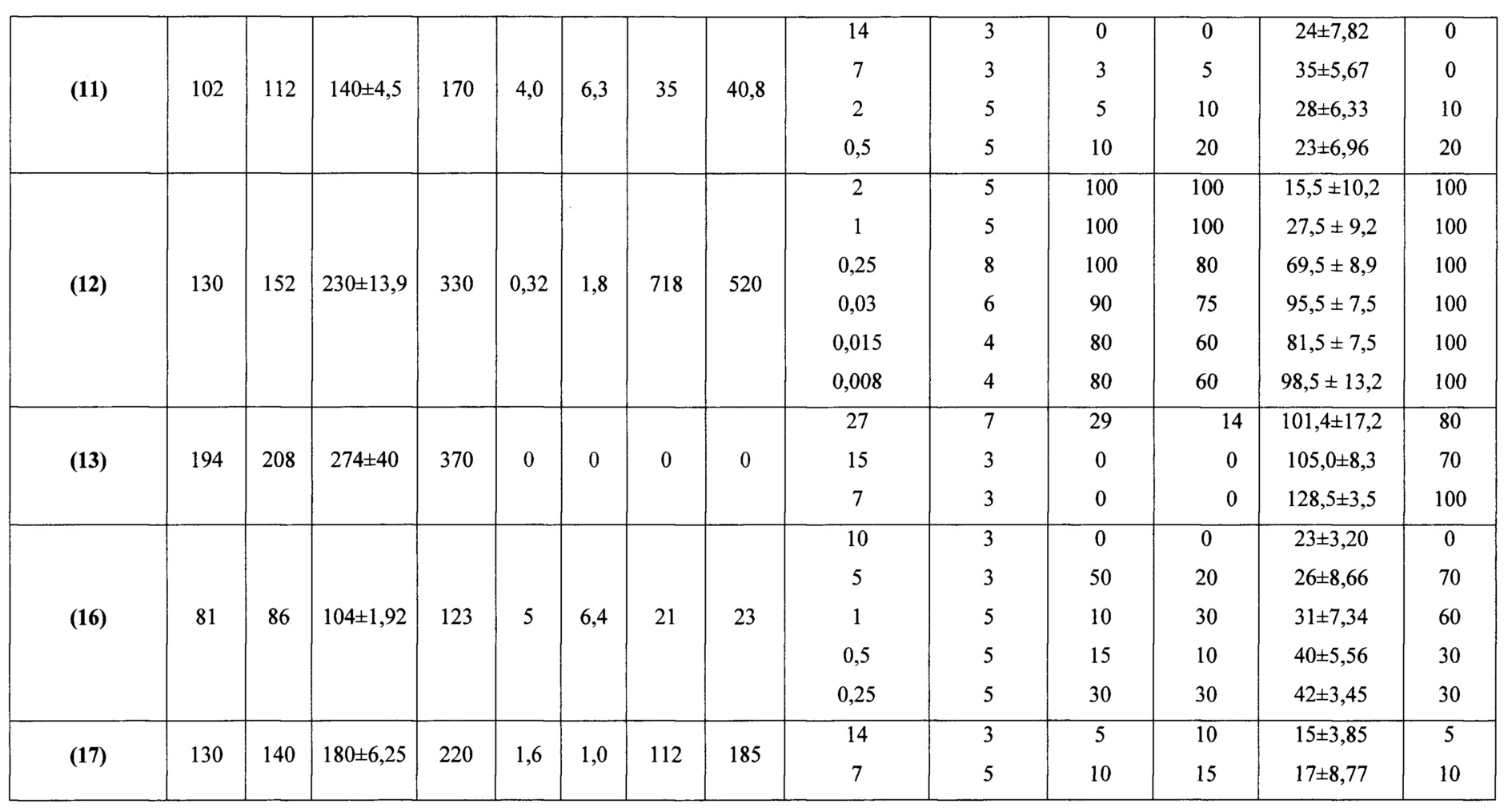
Высокая антиаритмическая активность заявляемых соединений подтверждается другим использованным критерием - процентом снятых аритмий (таблица 4). Применение этого критерия свидетельствует о выраженных антиаритмических свойствах заявляемых соединений. На моделях аконитиновой аритмии у крыс ряд заявляемых соединений в дозах до 6 мг/кг (соединения (12), (6), (18)) в 50-100% случаев снимает аритмии, вызванные введением аконитина гидробромида. Наименьшими средними эффективными дозами (ЭД50) характеризуются соединения (12), (17), (18).
Выраженные антиаритмические свойства заявляемых соединений, выявленные на модели аконитиновой аритмии, были подтвержены также и на моделях хлоридбариевой и хлоридкальциевой аритмии. Электрокардиограммы представлены на фиг. 2, 3.
Хлоридбариевая модель аритмии на крысах Wistar. Внутривенное введение хлористого бария в дозе 25 мг/кг наркотизированным крысам (уретан 1300 мг/кг внутрибрюшинно) вызывает политопную желудочковую аритмию, обусловленную нарушением автоматизма сердца, изменением возбудимости миокарда и характеризующуюся тахиаритмией и желудочковой экстрасистолией. Аритмия возникает через 10-15 сек после введения хлористого бария и, по данным электрокардиографии, отмечается на протяжении 42,7±5,2 мин, после чего наблюдается восстановление синусового ритма или в 85% случаев отмечается гибель животных. Типичная электрокардиограмма представлена на фиг. 2А.
Хлоридкальциевая модель аритмии на крысах Wistar. Нарушения ритма сердца, индуцированные хлоридом кальция (200-250 мг/кг), получали при в/в введении его в виде 10% раствора. При этом через 30 сек - 1 мин возникала фибрилляция желудочков сердца. Исследуемые соединения и препарат сравнения (верапамил) вводили в/в за 1-2 мин до введения кальция хлорида. ЭКГ регистрировали во II стандартном отведении, начиная с 1-й минуты, и далее через 5, 10, 15 и 20 мин после введения кальция хлорида. Исследование каждого соединения проводилось на 3-6 группах животных, в зависимости от количества исследуемых доз. Латентный период до появления аритмии составляет 7,5±1,2 сек, продолжительность аритмии 18±7 мин. Об антиаритмическом эффекте судили по уменьшению количества случаев летальной фибрилляции желудочков сердца.
Типичная электрокардиограмма представлена на фиг. 3А.
Такой показатель как антиаритмический индекс (соотношение ЛД50/ЭД50), характеризующий широту терапевтического действия лекарственных препаратов, для ряда заявляемых соединений превышает показатель 100 и составляет для соединений (12) и (17) величины 718 и 112 соответственно.
В качестве иллюстраций на графических изображениях (фиг. 1-3) представлены электрокардиограммы крыс с нарушениями сердечной деятельности, вызванных аконитином гидробромидом, хлористым барием и хлористым кальцием.
Впервые синтезированные N-(2-(2-(диалкиламино)этокси)этил)карбоксамиды и их гидрохлориды являются малотоксичными соединениями. Полученные в экспериментах данные свидетельствуют о выраженных антиаритмических свойствах и заметных преимуществах заявленных соединений. По сравнению с известными антиаритмиками соединения обладают меньшей токсичностью, большими терапевтическими индексами (ЛД50/ЭД50 и ЛД10/ЭД90) - важнейшими показателями, необходимыми для дальнейшего изучения и перспективности клинических испытаний, и практического применения в качестве лекарственных средств для профилактики и лечения нарушений ритма сердца.
Таким образом, проведенные исследования показали, что заявляемые аминоамиды являются малотоксичными веществами, обладают выраженными антиаритмическими свойствами, не уступающим по эффективности действия применяемым в настоящее время известным лекарственным средствам амиодарону, верапамилу и пропранололу. Заявляемые соединения являются препаратами комбинированного действия и перспективны для разработки на их основе новых высокоэффективных и безопасных лекарственных средств для лечения и профилактики нарушений сердечного ритма.