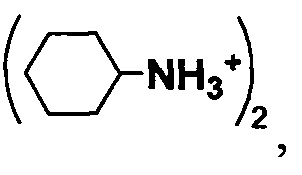
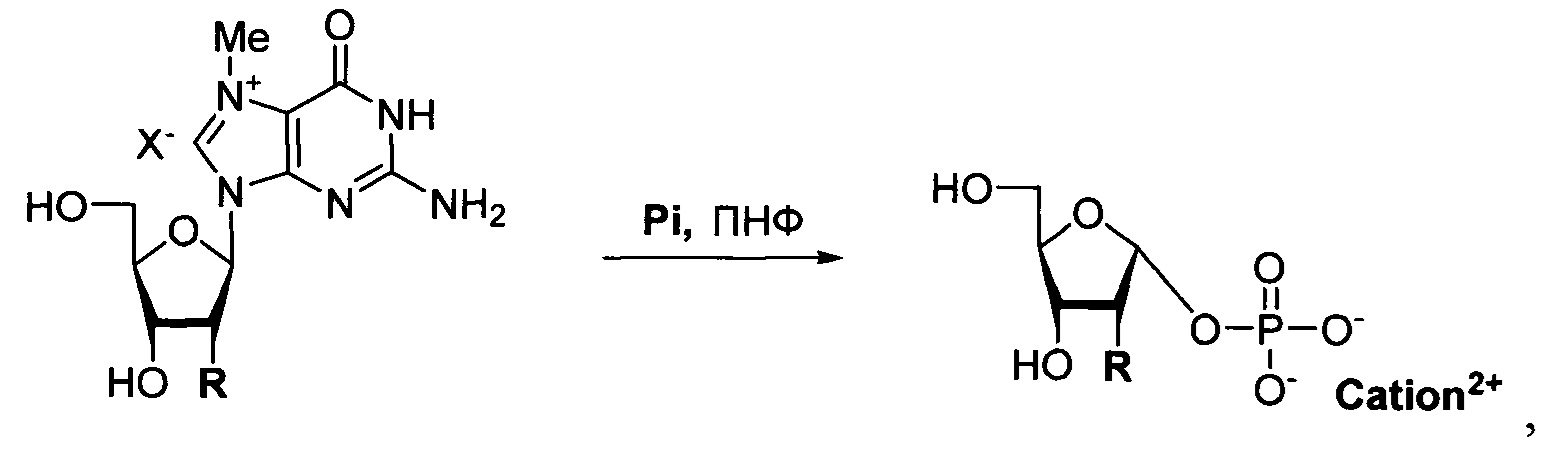
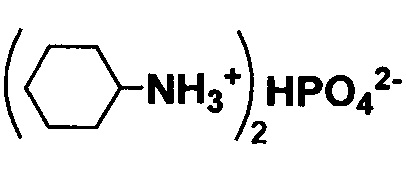Результат интеллектуальной деятельности: Способ получения соли α-D-рибофуранозо-1-фосфата или α-D-2-дезоксирибофуранозо-1-фосфата
Вид РИД
Изобретение
Область техники, к которой относится изобретение.
Изобретение относится к области биотехнологии (применение ферментов для получения природных метаболитов нуклеозидов и нуклеотидов) и фармацевтической химии (применение ферментов для получения лекарственных веществ на основе нуклеозидов).
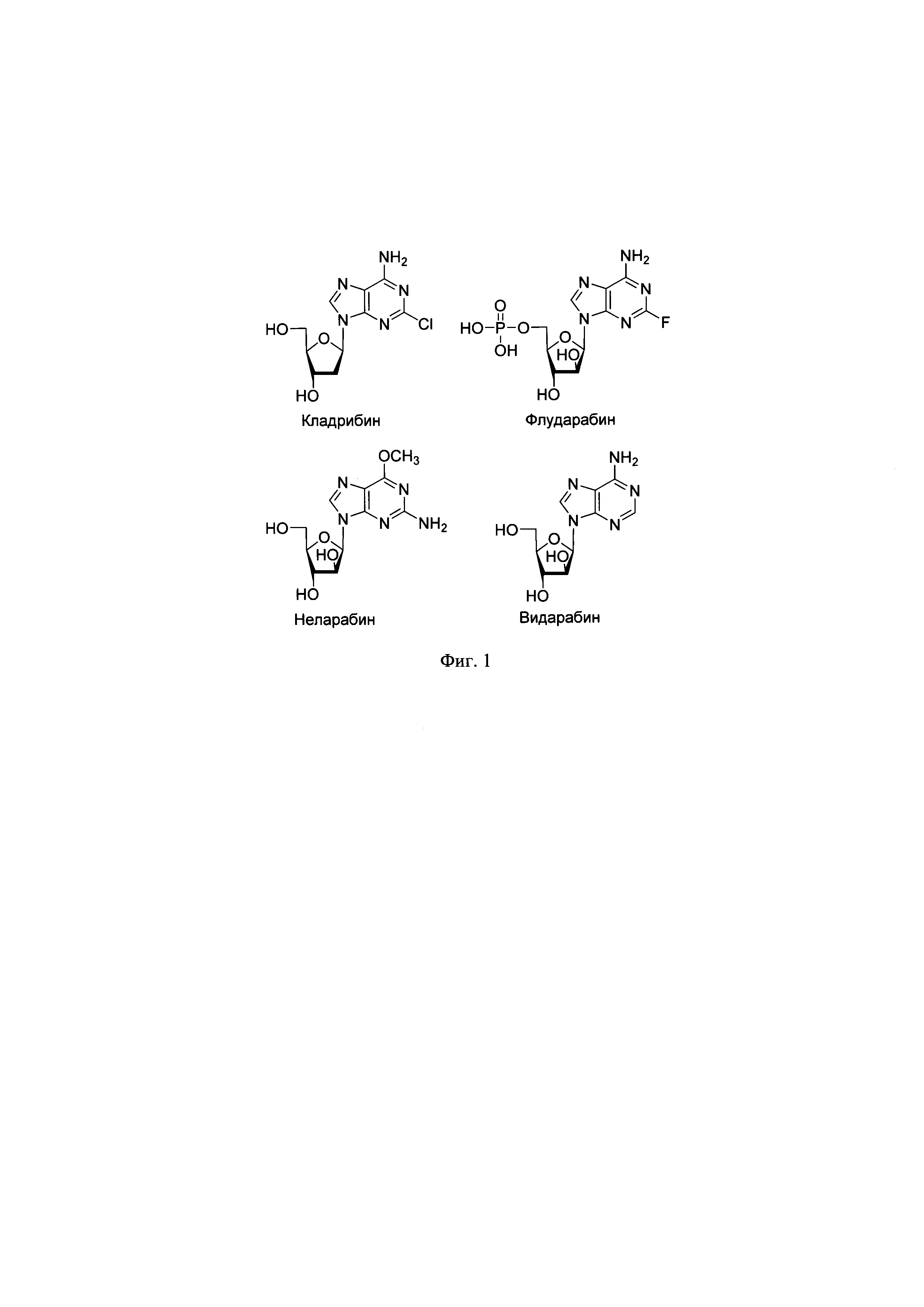
В настоящее время в клинической практике используется ряд препаратов, созданных на основе модифицированных нуклеозидов. Данные соединения обладают широким спектром биологической активности: противоопухолевой (Кладрибин, Флударабин, Пентостатин, Неларабин, Видаза, Децитабин и др.), противовирусной (гепатит С, герпес, ВИЧ и пр.) (Рибавирин, Видарабин, Зидовудин, Ламивудин и др) (W.B. Parker. Enzymology of Purine and Pyrimidine Antimetabolites Used in the Treatment of Cancer. Chem. Rev. 109, 2880-2893, 2009; E De Clercq, G. Li. Clinical Microbiology Reviews, Approved antiviral drugs over the past 50 years, 29, 695-747, 2016) (Фиг. 1). Применение известных лекарственных препаратов в терапевтической практике и поиск биологически активных веществ в ряду аналогов природных нуклеозидов тесно связаны с разработкой новых методов синтеза нуклеозидов и их аналогов. В последние годы активно развивается так называемая "зеленая" химия, целью которой является замена традиционного химического синтеза различными каталитическими методами без использования токсичных органических растворителей. При получении природных нуклеозидов и лекарственных соединений нуклеозидной природы (кладрибин, 5-фтордезоксиуридин, флударабин, неларабин, видарабин и др.) альтернативой многостадийному химическому синтезу является ферментативный синтез.
В частности, стадия химического гликозилирования гетероциклических оснований заменяется на ферментативную, протекающую под действием нуклеозидфосфорилаз. Нуклеозидфосфорилазы in vivo катализируют конденсацию пентозо-1-фосфатов и гетероциклических оснований с образованием нуклеозидов и высвобождением остатков фосфорной кислоты и обратную реакцию - фосфоролиз нуклеозидов в присутствии остатков фосфорной кислоты с образованием гетероциклических оснований и пентозо-1-фосфатов. Равновесие в этой обратимой реакции обычно смещено в сторону образования нуклеозидов. Реакция протекает селективно, регио- и стереоспецифично. Широкое разнообразие соединений - возможных субстратов обеспечивает широкие возможности для применения нуклеозидфосфорилаз при получении различных биологически активных производных нуклеозидов (I.A. Mikhailopulo, A.I. Miroshnikov, Biologically important nucleosides: modern trends in biotechnology and application. Mendeleev Commun., 2011, 21, 57-68). Разработка и применение ферментативного и химико-ферментативного синтеза нуклеозидов с участием нуклеозидфосфорилаз имеет промышленное значение, поскольку не только делает процесс производства более экологически безопасным, но и позволяет получать целевые соединения высокой степени чистоты с высокими выходами.
В настоящее время при ферментативном гликозилировании гетероциклического основания пентозо-1-фосфат получается прямо в реакционной среде из соответствующего нуклеозида - донора сахарного остатка (реакция трансгликозилирования). При реакции трансгликозилирования ключевым моментом является сдвиг равновесия в сопряженных реакциях распада-образования нуклеозидов в сторону образования целевых соединений. Использование пентозо-1-фосфата в виде индивидуального реагента позволяет избежать сопряженной обратимой реакции, что упрощает состав реакционной смеси и, соответственно, выделение целевых соединений, а также дает возможность варьировать соотношение исходных реагентов, сдвигая равновесие реакции гликозилирования в нужном направлении. В настоящее время пентозо-1-фосфаты труднодоступны и имеют высокую стоимость, что отражается на себестоимости целевых продуктов. В свете вышесказанного особое значение приобретает разработка и оптимизация методов синтеза различных пентозо-1-фосфатов как универсальных исходных соединений для синтеза самого широкого спектра природных нуклеозидов и лекарственных соединений нуклеозидной природы.
Уровень техники.
Аналоги нуклеозидов широко применяются в клинической практике, среди них противоопухолевые, противовирусные, антипаразитарные препараты. Для применения в медицине особое значение имеет содержание в лекарственной субстанции побочных соединений, а значит к методам синтеза нуклеозидов для фармацевтического использования предъявляются высокие требования по стерео- и регио-селективности.
Существует два основных метода получения аналогов нуклеозидов. Первый метод основан на модификации природных соединений (M.S. Drenichev, V.E. Oslovsky, S.N. Mikhailov. Cytokinin Nucleosides - Natural compounds with a unique spectrum of biological activities. Current Topics in Medicinal Chemistry, 16, 2562-2576, 2016). Во втором сначала получают производные гетероциклических оснований и моносахаридных производных, а затем проводят синтез нуклеозидов (С.Н. Михайлов, Ю.П. Лысов, Г.И. Яковлев. Применение функционально-компетентных аналогов нуклеозидов и нуклеотидов для изучения фермент-субстратных взаимодействий. Молекулярная биология, 33, 393-407, 1999). В этом методе ключевой стадией синтеза является создание N-гликозидной связи.
Ферментативные методы синтеза существенно дополняют химические и, в ряде случаев, имеют несомненные преимущества (I.A. Mikhailopulo, A.I. Miroshnikov, Biologically important nucleosides: modern trends in biotechnology and application. Mendeleev Commun., 2011, 21,57-68). Анализ литературных данных показывает, что ферментативные методы создания гликозидной связи могут конкурировать с химическими при получении фармацевтически важных нуклеозидов. Для получения нуклеозидов в частности используют реакцию гликозилирования с участием нуклеозидфосфорилаз (НФ): ферментов, катализируют конденсацию пентозо-1-фосфатов и гетероциклических оснований с образованием нуклеозидов и высвобождением остатков фосфорной кислоты и обратную реакцию - фосфоролиз нуклеозидов в присутствии остатков фосфорной кислоты с образованием гетероциклических оснований и пентозо-1-фосфатов:
Пентозо-1-фосфат + Основание ↔ Нуклеозид + Pi.
Нуклеозидфосфорилазы играют ключевую роль в метаболизме нуклеозидов. Эти ферменты обнаружены почти у всех организмов, при этом отличия их первичной структуры сравнительно невелики. Наиболее специфичным ферментом является тимидинфосфорилаза (ТФ) (КФ 2.4.2.4), субстратами которой являются тимидин и 2'-дезоксиуридин. Уридинфосфорилаза (УФ) (КФ 2.4.2.3) осуществляет фосфоролиз уридина, тимидина и 2'-дезоксиуридина. Субстратами пуриннуклеозидфосфорилазы (ПНФ) (КФ 2.4.2.1) являются пуриновые нуклеозиды как рибо-, так и 2'-дезоксирибо - ряда (M.J. Pugmire, S.E. Ealick, Structural analyses reveal two distinct families of nucleoside phosphorylases. Biochemical Journal, 361, 1-25, 2002). Установлено, что в обратной фосфоролизу реакции гликозилирования в случае с рибозо-1-фосфатом и α-D-2-дезоксирибозо-1-фосфатом субстратами выступают исключительно α-аномеры пентафуранозо-1-фосфатов, соответствующие β-аномеры субстратами не являются (Н. Komatsu, I. Ikeda, Synthesis of 2-deoxy-betα-D-ribose 1-phosphate, NMR comparison and its enzymatic activity for structural elucidation of synthetic alpha-isomer. Nucleosides Nucleotides Nucleic Acids, 22, 1685-1686, 2003).
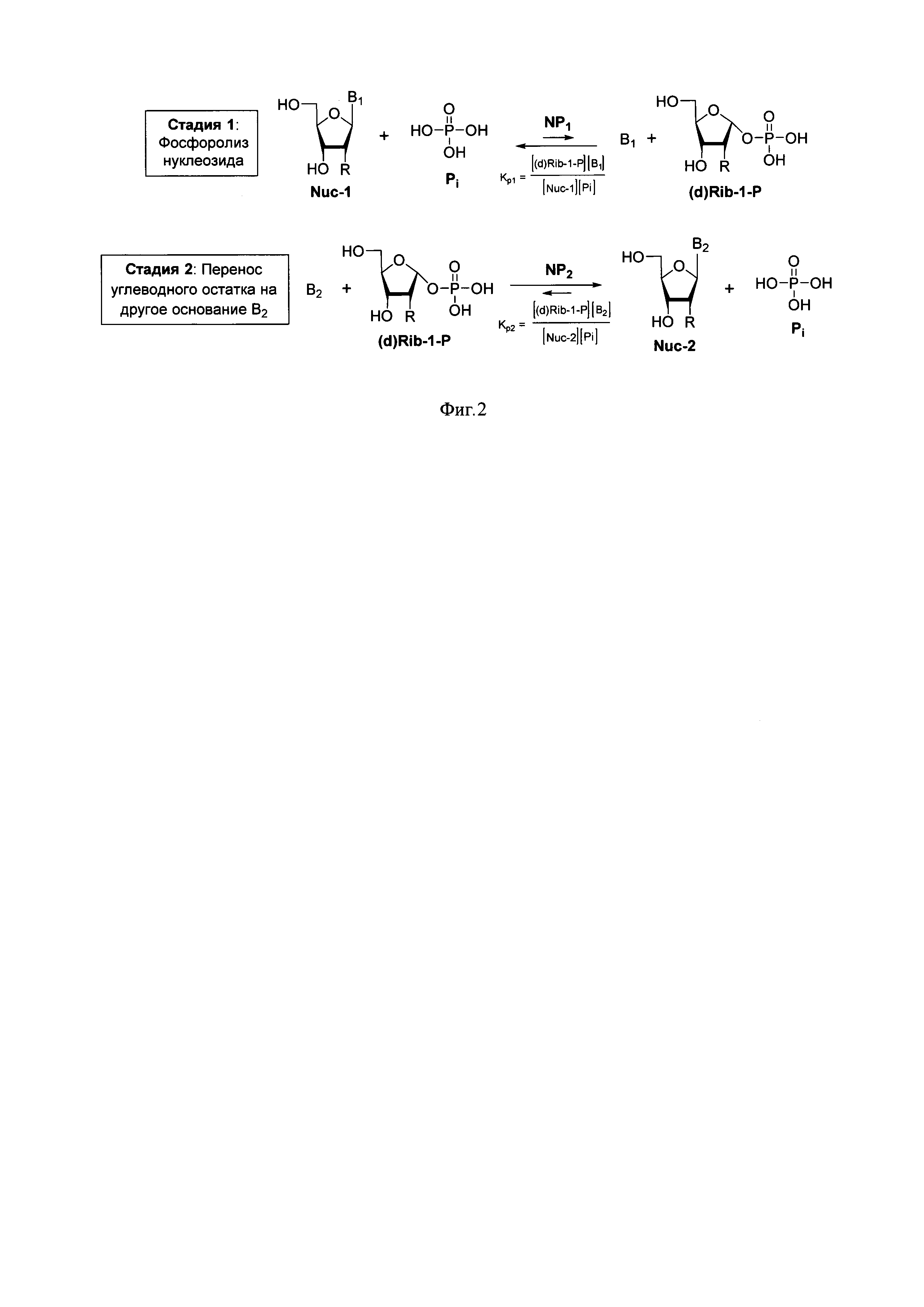
В настоящее время при ферментативном синтезе аналогов нуклеозидов наиболее часто используется реакция трансгликозилирования (переноса углеводного остатка от одного гетероциклического основания на другое). В этом случае субстратом в реакции гликозилирования выступает пентафуранозный остаток, полученный фосфоролизом коммерчески доступного или синтезированного нуклеозида. Таким образом, синтез протекает в две стадии. На первом этапе НФ катализируют реакции расщепления N-гликозидной связи в присутствии фосфата с образованием гетероциклического основания (В1) и пентафуранозо-1-фосфата (Фиг. 2, стадия 1). В процессе используются ферменты: тимидинфосфорилаза, уридинфосфорилаза и пуриннуклеозидфосфорилаза. На следующем этапе (Фиг. 2, стадия 2) происходит образование целевого нуклеозида за счет переноса углеводного остатка на гетероциклическое основание (В2).
Анализ реакции трансгликозилирования показал, что выходы искомых нуклеозидов зависят от соотношения констант равновесия реакций фосфоролиза нуклеозидов {Kp1/Kp2). Максимального выхода можно достичь, если равновесие стадии 1 сильно сдвинуто в сторону образования пентафуранозо-1-фосфата, а равновесие стадии 2 сдвинуто в сторону целевого нуклеозида (Nuc-2).
В обратимой ферментативной реакции гликозилирования гетероциклического основания пентафуранозо-1-фосфатом в присутствии ПНФ, в отличие от трансгликозилирования, нет сопряжения нескольких равновесных реакций, а равновесие ферментативного гликозилирования смещено в сторону образования нуклеозидов (Goldberg RN, Tewari YB, Bhat TN, "Thermodynamics of Enzyme-Catalyzed Reactions - a Database for Quantitative Biochemistry", Bioinformatics 2004, 20, 2874-2877). Поэтому повышения выходов данной реакции можно достичь, не используя больших избытков компонентов (что снижает стоимость синтеза и упрощает выделение целевых соединений). С этой точки зрения пентафуранозо-1-фосфаты являются оптимальными субстратами для достижения максимального выхода целевого нуклеозида, а разработка эффективного и удобного метода их синтеза приобретает особое значение.
Методы химического и ферментативного синтеза пентозо-1-фосфатов являются целью различных групп исследователей уже многие десятилетия.
Для получения этих соединений химическим путем используются следующие методы:
1. Прямая конденсация соответствующего защищенного производного D-рибофуранозил-хлорида с o-Н3РО4. Получается смесь α- и β-аномеров с общим выходом 20% (для всей последовательности стадий, исходя из природного сахара) (D.L. MacDonald, H.G. Fletcher. 2-Deoxy-D-ribose. VIII. Synthesis of the Anomeric 2-Deoxy-D-ribofuranose 1-Phosphates. J. Am. Chem. Soc, 84 (7), 1262-1265, 1962)
2. Реакция конденсации соответствующего защищенного производного D-рибофуранозил-хлорида с защищенными производными Н3РО4. Полученную смесь аномеров удается разделить, выход α-аномера 21%. (для всей последовательности стадий, исходя из природного сахара) (G.M. Tener, R.S. Wright, H.G. Khorana. Phosphorylated Sugars. III. Syntheses of of α-D-Ribofuranose 1-Phosphate. J. Org. Chem, 59, 690-692, 1994)
3. Стереоселективный химический синтез. Группой японских исследователей предложен новый способ получения производных 2-дезоксирибозо-1-фосфата. Данный метод позволяет получать 2-дезоксирибозо-1-фосфат в виде смеси β- и α-аномеров (с существенным, до 98,5:1,5 преобладанием α-аномера). Общий выход для всей последовательности стадий, исходя из природного сахара, составляет 66-69%. Последовательность превращений включает 4 стадии, одна из которых - кристаллизация с преимущественным образованием α-изомера 2-дезоксирибозо-1-фосфата. (Н. Komatsu, Н. Awano. First stereoselective synthesis of 2-deoxy-α-D-ribofuranosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation. J. Org. Chem, 67, 5419-5421, 2002).
Ферментативные методы получения пентозо-1-фосфатов обеспечивают стереоселективное получение α-аномеров. В настоящее время включают:
1. Фосфоролиз соответствующих природных и синтезированных нуклеозидов:
- фосфоролиз тимидина в присутствии ТФ. Выход 12-37%. (М. Friedkin, D. Roberts The Enzymatic Synthesis of Nucleosides II. Thymidine and Related Pyrimidine Nucleosides. J. Biol. Chem. 207, 257-266,1954; I.V. Fateev, M.I. Kharitonova, K.V. Antonov, I.D. Konstantinova, V.N. Stepanenko, R.S. Esipov, F. Seela, K.W. Temburnikar, K.L. Seley-Radtke, V.A. Stepchenko, Y.A. Sokolov, A.I. Miroshnikov, I.A. Mikhailopulo. Recognition of Artificial Nucleobases by E. coli Purine Nucleoside Phosphorylase versus its Ser90Ala Mutant in the Synthesis of Base-Modified Nucleosides. Chemistry-A European Journal, 21, 13401-13419, 2015).
- фосфоролиз уридина в присутствии УФ. Выход 22-31%. (Т. Sakai, Т. Tochikura, K. Ogata. Metabolisms of Nucleosides in Bacteria. Part III. Nucleoside-N-ribosyl Group Transfer Reaction in Bacteria. Mechanism of Nucleoside-N-ribosyl Group Transfer Reaction in Corynebacterium sepedonicum. Agr. Biol. Chem., 30 (3), 245-253, 1966; I.V. Fateev, M.I. Kharitonova, K.V. Antonov, I.D. Konstantinova, V.N. Stepanenko, R.S. Esipov, F. Seela, K.W. Temburnikar, K.L. Seley-Radtke, V.A. Stepchenko, Y.A. Sokolov, A.I. Miroshnikov, I.A. Mikhailopulo. Recognition of Artificial Nucleobases by E. coli Purine Nucleoside Phosphorylase versus its Ser90Ala Mutant in the Synthesis of Base-Modified Nucleosides. Chemistry-A European Journal, 21, 13401-13419, 2015).
- фосфоролиз инозина в присутствии НФ, ксантиноксидазы и каталазы. Выход 12% (Н.М. Kalckar. The Enzymatic Synthesis Of Purine Ribosides. J. Biol. Chem. 167, 477-486, 1947).
- фосфоролиз гуанозина в присутствии НФ. Выход 11%. (М. Friedkin, Н.М. Kalckar Desoxyribose-1-Phosphate: I. The Phosphorolysis and Resynthesis of Purine Desoxyribose Nucleoside. J. Biol. Chem. 184:437-448, 1950; M. Friedkin. Deoxyribose-1-Phosphate. II. The Isolation of Crystalline Desoxyribose-1-Phosphate. J. Biol. Chem. 184, 449-460, 1950)
Все перечисленные химические методы синтеза позволяют получить пентозо-1-фосфаты в виде смеси β- и α-аномеров. В первых двух случаях данную смесь удается разделить, но выходы целевого α-аномера, пригодного для использования в реакции ферментативного гликозилирования, составляют около 20%. Третий способ ограничен синтезом аналогов 2-дезоксирибозо-1-фосфатов, но дает достаточно высокие выходы за счет перехода одного изомера в другой при кристаллизации (выход α-D-2-дезоксирибофуранозо-1-фосфата, исходя из природного сахара, достигает 66-69%).
Перечисленные ферментативные методы синтеза более экологически безопасны, обеспечивают регио- и стерео-селективность синтеза, но максимальные выходы α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата, которые до сих пор удалось получить этими способами, не превышают 37%. Это объясняется тем, что равновесие при ферментативном фосфоролизе сдвинуто в сторону образования нуклеозидов. Повышения выходов можно достичь, используя избытки исходных реагентов. Но применение больших избытков существенно увеличивает стоимость синтеза, усложняет состав реакционной смеси и существенно затрудняет выделение целевых соединений.
Раскрытие сущности изобретения.
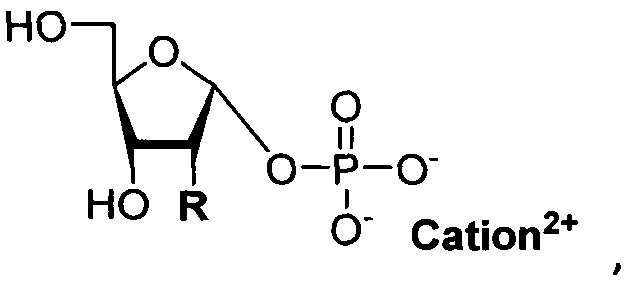
Сущность изобретения заключается в применении гидройодных солей 7-метилгуанозина и 7-метил-2'-дезоксигуанозина в качестве субстратов для получения α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата соответственно в виде солей натрия, бария, магния, кальция и дициклогексиламина при ферментативном фосфоролизе с участием пуриннуклеозидфосфорилазы ПНФ.
Изобретение решает задачу получения α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата, исходя из доступных 7-метилгуанозина (7-Me-Guo) и 7-метил-2'-дезоксигуанозина (7-Me-dGuo) соответственно. Ближайшими прототипами являются цитированные выше публикации (Н. Komatsu, Н. Awano. First stereoselective synthesis of 2-deoxy-α-D-ribofuranosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation. J. Org. Chem, 67, 5419-5421, 2002; I.V. Fateev, M.I. Kharitonova, K.V. Antonov, I.D. Konstantinova, V.N. Stepanenko, R.S. Esipov, F. Seela, K.W. Temburnikar, K.L. Seley-Radtke, V.A. Stepchenko, Y.A. Sokolov, A.I. Miroshnikov, I.A. Mikhailopulo. Recognition of Artificial Nucleobases by E. coli Purine Nucleoside Phosphorylase versus its Ser90Ala Mutant in the Synthesis of Base-Modified Nucleosides. Chemistry-A European Journal, 21, 13401-13419, 2015).
В известном способе (Fateev et al., Chem. Eur. J. 2015, 21, 13401-13419) α-D-рибофуранозо-1-фосфат получают фосфоролизом уридина в течение 3-х дней, а α-D-2-дезоксирибофуранозо-1-фосфат фосфоролизом тимидина в течение 12 ч. Реакции являются равновесными и проводятся при температуре 50°С, что приводит к снижению выхода продукта до 31% и 37% соответственно. Замена уридина или тимидина на 7-метилгуанозин или 7-метил-2'-дезоксигуанозин позволяет проводить практически полный фосфоролиз этих субстратов в более мягких условиях (20°С) в течение 5 ч, что позволяет существенно повысить выход продуктов (93-94%).
Для синтеза используются 7-Me-Guo и 7-Me-dGuo в виде гидройодных солей, хорошо растворимых в воде и водных буферных растворах (J.W. Jones, R.K. Robins, Purine nucleosides. III. Methylation studies of certain naturally occurring purine nucleosides. J. Am. Chem. Soc, 1963, 85, 193-201) и 7-Me-dGuo (M.S. Drenichev, C.S. Alexeev, N.N. Kurochkin, and S. Mikhailov, Use of Nucleoside Phosphorylases for the Preparation of Purine and Pyrimidine 2'-Deoxynucleosides, Adv. Synth. Catal. 360, 305-312, 2018)..
7-Метилпроизводное гуанозина достаточно стабильно в водных растворах в широком диапазоне температур и рН (t≤±90°C; 2≤рН≤6). При нагревании до 90°С в кислой среде (рН≤2) происходит расщепление TV-гликозидной связи, а в основной среде (рН≥7) - раскрытие имидазольного цикла (М. Lahti, Н. Santa, Е. Darzynkiewicz, Н. Lonneberg. рН-Independent depurination of 7-alkyl guanosine and their 5'-monophosphates. Acta Chemica Scandinavica, 1990, 44, 636-638). 7-Метил-2'-дезоксигуанозин существенно менее стабилен в водных растворах по сравнению с 7-метилгуанозином.
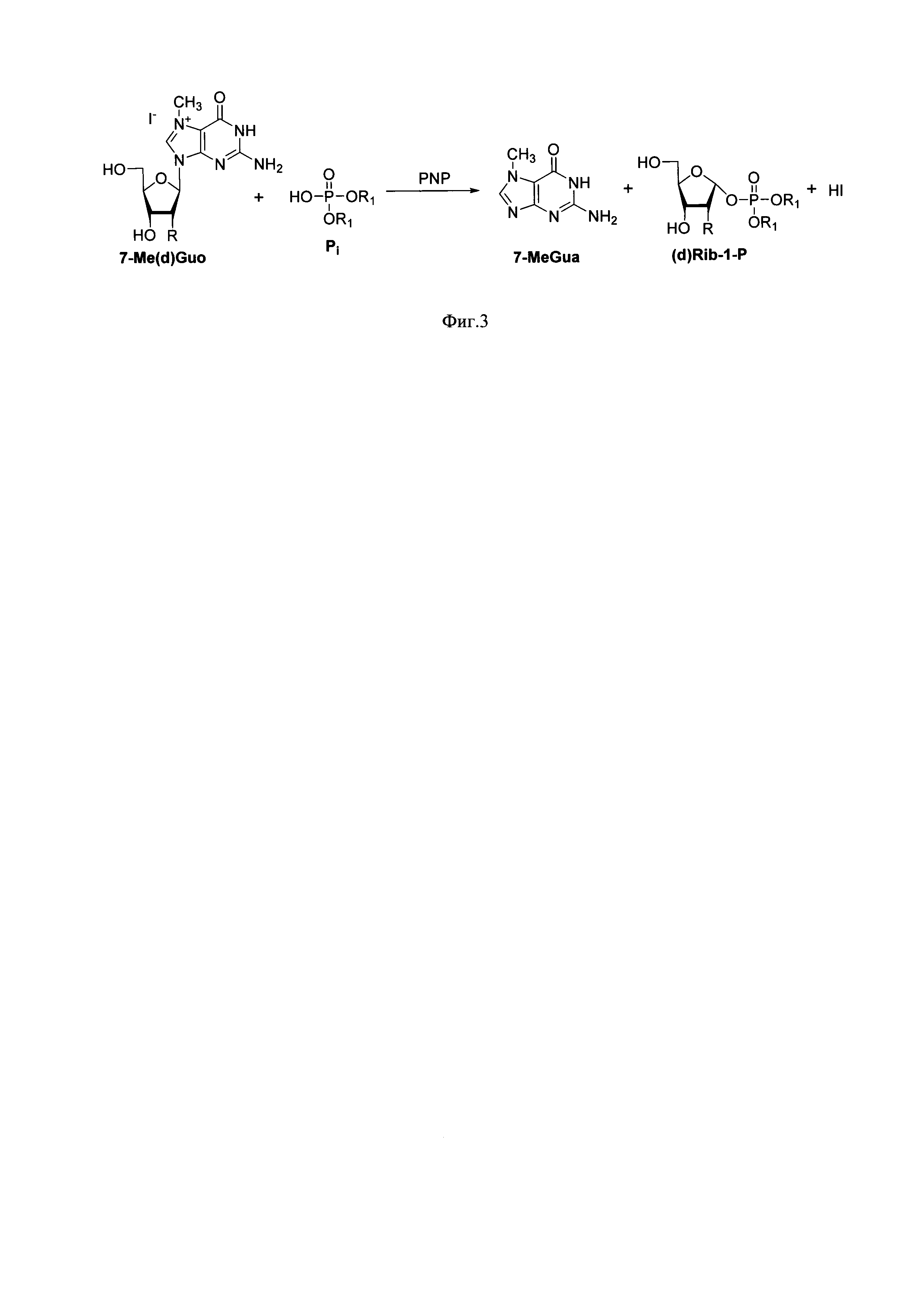
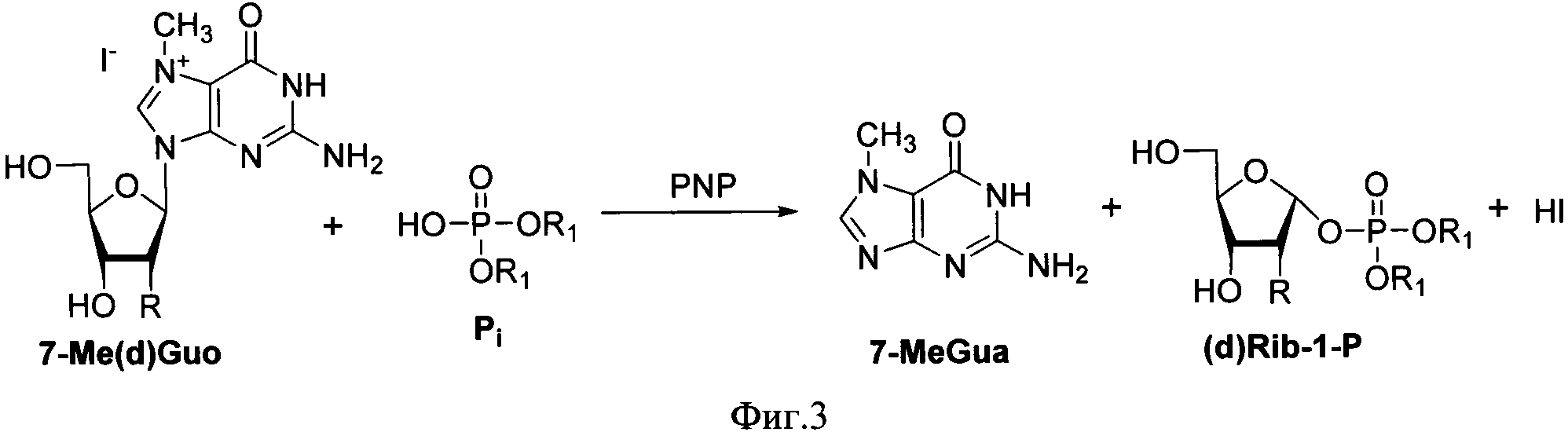
7-Me-Guo и 7-Me-dGuo необратимо подвергаются фосфоролизу в присутствии ПНФ с выходом, близким к количественному (Фиг. 3) (Е. Kulikowska, A. Bzowska, J. Wierzchowski, D. Shugar. Properties of two unusual, and fluorescent, substrates of purine-nucleoside phosphorylase: 7-methylguanosine and 7-methylinosine. Biochimica et Biophysica Acta, 1986, 874, 355-363). Реакцию проводят при значениях рН, близких к оптимальным для активности ПНФ, а также для устойчивости исходных и целевых соединений (для получения максимальных выходов рекомендуется проводить реакцию при рН 7,5). Для синтеза можно использовать ПНФ из различных бактериальных источников. Например, из Е. coli и Enterobacter. Оба фермента эффективны в реакции фосфоролиза. Однако, ПНФ из Enterobacter более активна, реакция протекает быстрее, что снижает до минимума долю продуктов неспецифического гидролиза и продуктов раскрытия имидазольного цикла исходного нуклеозида.
Необратимость фосфоролиза 7-Me-Guo и 7-Me-dGuo позволяет получать α-D-рибофуранозо-1-фосфат и α-D-2-дезоксирибофуранозо-1-фосфат с выходами, близкими к количественным по данным ВЭЖХ и до 74-96% после выделения (таблица 1). Необратимость также позволяет избегнуть применения больших избытков реагентов. Для синтеза по предложенной методике используется небольшой избыток (1,05-1,1 экв.) реагента-донора фосфатной группы по отношению к исходному нуклеозиду. Использование небольших избытков снижает стоимость синтеза и существенно упрощает выделение целевых соединений (по предложенной методике α-D-рибофуранозо-1-фосфат и α-D-2-дезоксирибофуранозо-1-фосфат выделяются кристаллизацией или высаживанием).
В качестве донора фосфатной группы в реакции используются дигидроортофосфаты калия/натрия (при получении бариевых, магниевых и кальциевых солей) или гидрофосфат дициклогексиламина (синтез в виде солей циклогексиламина и натрия). Циклогексиламинные соли кристаллизуются из водно - н-бутанольной системы. Натриевые соли получают взаимодействием солей циклогексиламина с ионообменной смолой (Dowex 50 Na+). Бариевые, магниевые, кальциевые и натриевые соли α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата высаживают из водно-этанольного раствора.
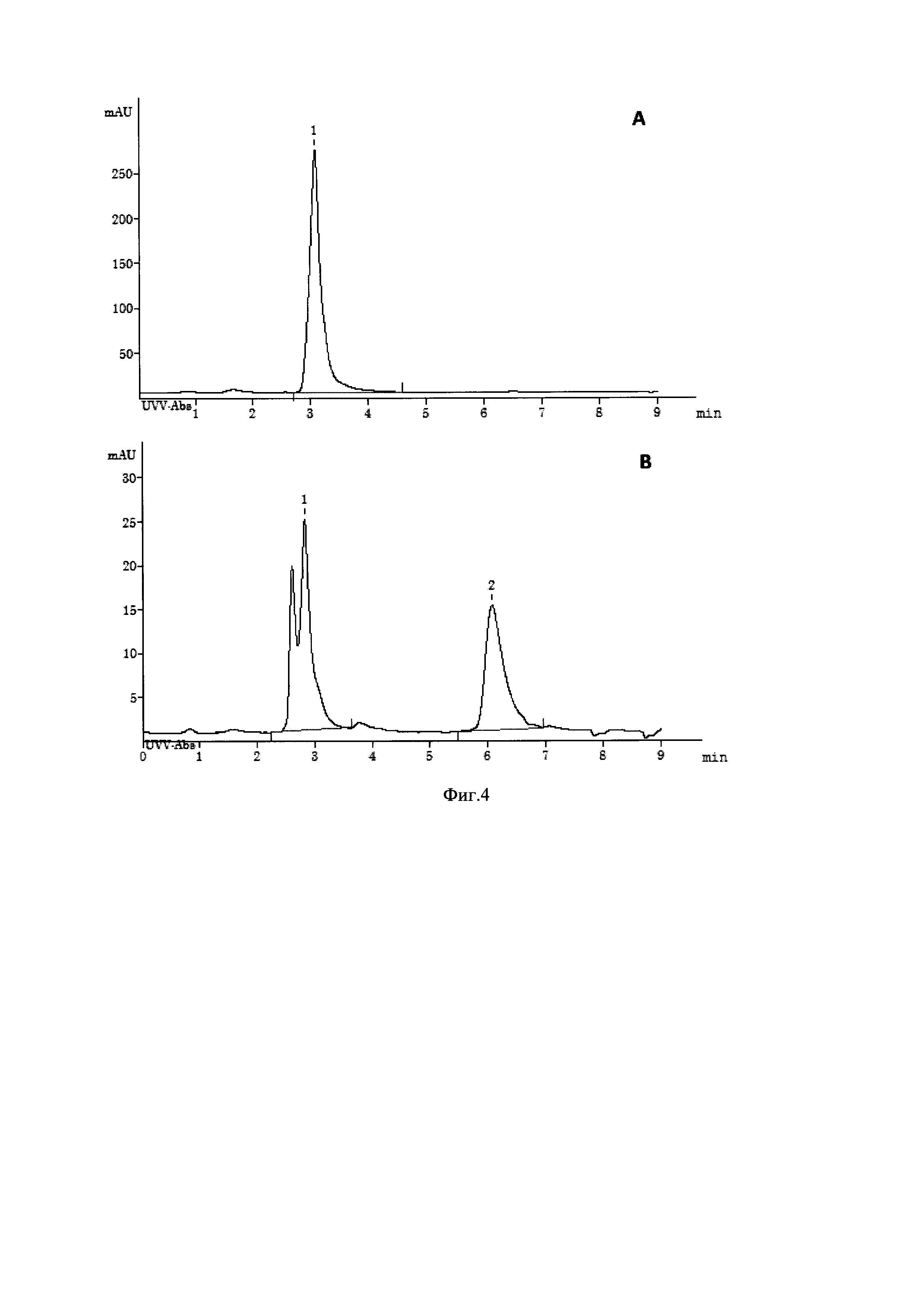
Контроль над протеканием ферментативных реакций проводится с помощью ТСХ и ВЭЖХ (Фиг. 4). Наличие целевых соединений подтверждается ТСХ с термической детекцией (выгорание пятен, содержащих рибофуранозу и 2-дезокси-рибофуранозу, при нагревании ТСХ пластин до 400°С). В момент времени to (Фиг. 4, А) на ВЭЖХ присутствует сигнал исходного нуклеозида (7-Me-Guo или 7-Me-dGuo). При ВЭЖХ на Luna® 5u NH2 7-метил-гуанозин и 7-метил-2'-дезоксигуанозин дают сигналы с RT 2,5 и 3,3 мин соответственно (градиент ацетонитрил/вода 1-8% за 6 мин, подробнее см. Осуществление изобретения). В процессе реакции наблюдается появление и увеличение сигнала 7-метилгуанина (RT 6,2 мин, те же условия).
Таким образом, предлагаемый нами метод позволяет получать α-D-рибофуранозо-1-фосфат и α-D-2-дезоксирибофуранозо-1-фосфат в виде солей натрия, бария, магния, кальция и циклогексиламина, исходя из гидройодных солей 7-метилгуанозина и 7-метил-2'-дезоксигуанозина, соответственно. Достоинствами данного метода являются: использование легко доступных солей 7-метилгуанозина и 7-метил-2'-дезоксигуанозина, регио- и стерео-специфичность протекающей реакции, полнота превращения исходных соединений (7-метилгуанозин и 7-метил-2'-дезоксигуанозин подвергаются фосфоролизу необратимо) и высокий выход целевых соединений.
Краткое описание фигур и таблиц
Фиг. 1. Кладрибин, флударабин, неларабин и видарабин - фармацевтически важные нуклеозиды. На фигуре приведены структуры лекарственных препаратов нуклеозидной природы кладрибина, флударабина, неларабина и видарабина, широко используемых в медицинской практике;
Фиг. 2. Реакции ферментативного фосфоролиза нуклеозидов и трансгликозилирования. NP1, NP2 - нуклеозидфосфорилазы, B1 и В2 - гетероциклические основания, R-Н или ОН. На фигуре приведены схемы реакций фосфоролиза нуклеозидов и гликозилирования рибозо-1-фосфатов под действием нуклеозидфосфорилаз. Как последовательные стадии, данные реакции представляют собой процесс трансгликозилирования (переноса пентафуранозного фрагмента от одного гетероциклического основания к другому);
Фиг. 3. Получение α-D-рибозо-1-фосфата и α-D-2-дезоксирибозо-1-фосфата фосфоролизом 7-метилгуанозина и 7-метил-2'-дезоксигуанозина (в форме гидройодидов) в присутствии пуриннуклеозидфосфорилаз. Реагенты и условия. ПНФ Е. Coli / Enterobacter, 5 ч, 74-96%. Фигура иллюстрирует получение α-D-рибозо-1-фосфата и α-D-2-дезоксирибозо-1-фосфата из 7-метил-гуанозина и 7-метил-2'-дезоксигуанозина в качестве субстрата в присутствии нуклеозидфосфорилаз по реакции фосфоролиза;
Фиг. 4. Ферментативный синтез α-D-2-дезоксирибозо-1-фосфата фосфоролизом 7-метил-2'-дезоксигуанозина в присутствии ПНФ (ВЭЖХ-анализ смеси на сорбенте Luna® NH2). Фигура иллюстрирует пример ВЭЖХ - анализа протекания реакции фосфоролиза 7-метил-2'-дезоксигуанозина. А - до добавления ПНФ (момент времени t0), В - через 5 часов после начала реакции (момент времени t - 5 ч). 1 - 7-метил-2'-дезоксигуанозин, 2 - 7-метилгуанин.
Табл. 1. Выходы α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата в виде солей бария, магния, кальция, натрия и циклогексиламина, полученных по реакции ферментативного фосфоролиза. В таблице приведено описание выходов α-D-рибофуранозо-1-фосфата и α-D-2-дезоксирибофуранозо-1-фосфата в виде солей бария, магния, кальция, натрия и циклогексиламина, полученных по реакции фосфоролиза 7-метилгуанозина и 7-метил-2'-дезоксигуанозина соответственно.
Осуществление изобретения
Структура заявленных соединений подтверждается методами ЯМР- и Масс-спектроскопии. ЯМР-спектры регистрируют на приборе Bruker АМХ 300 (Германия). Химические сдвиги (δ) в 1Н-ЯМР приводят в миллионных долях (м.д.) и измеряют относительно остаточного сигнала растворителя: D2O - 4,79 м.д. Величины констант спин - спинового взаимодействия (J) измеряют в герцах (Гц). При описании спектров 1H-ЯМР принимают следующие сокращения: с - синглет, ус - уширенный синглет, д - дублет, уд - уширенный дублет, т - триплет, м - мультиплет. Тонкослойную хроматографию проводят на пластинах Sorbfil ПТСХ-АФ-А-УФ (ЗАО Сорбполимер) с УФ-детекцией (λ=254 нм) и термической детекцией (нагревание ТСХ-пластин до 400°С). ВЭЖХ анализ фосфоролиза проводят на хроматографической колонке 4,6×250 мм (диаметр частиц 5 мкм, сорбент Luna® NH2, диаметр пор 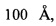 каталожный номер 00G-4378-EO, производитель Phenomenex (США)), оснащенной защитной предколонкой стандарта ЕС (4,0×3,0 мм, диаметр частиц 5 мкм, сорбент Luna® NH2 каталожный номер AJ0-4302, производитель Phenomenex (США)) в линейном градиенте ацетонитрила от 1 до 8% за 8 минут в деионизированной воде, скорость потока - 1 мл/мин, УФ-детекцию проводят при длине волны 283 нм. Масс-спектры высокого разрешения (HRMS) регистрируют на приборе Bruker Daltonics micrOTOF-Q II с электрораспылительной ионизацией (ESI). Измерения проводят в режиме отрицательно заряженных ионов. Напряжение на капилляре: 4700 V; диапазон сканирования масс m/z 50-3000; калибровка внешняя (Electrospray Calibrant Solution, Fluka); давление на распылителе: 0.4 бар; скорость потока: 3 мкл/мин; газ-распылитель: азот (4 л/мин); температура интерфейса: 200°С. Образцы подаются в распылительную камеру масс-спектрометра после жидкостного хроматографа Agilent 1260, оснащенного колонкой Agilent Poroshell 120 ЕС-С18 (3,0×50 мм; 2,7 мкм); скорость потока 0,2 мл/мин; в ВЭЖХ-хроматограф образцы вещества подаются из раствора ацетонитрил-вода 1:1 (5 мкл) и элюируются в линейном градиенте концентраций ацетонитрила (50→100%). Ионообменную хроматографию выполняют на смоле Dowex 50W-X8 (100-200 mesh) "Bio Rad". Очистку растворителей проводят по стандартным методикам. Для проведения фосфоролиза используют ферментные препараты пуриннуклеозидфофорилазы E.coli (10,6 ед.акт./мл, 0,1 мг/мл) и пуриннуклеозидфофорилазы Enterobacter (20,8 ед.акт./мл, 3,2 мг/мл).
каталожный номер 00G-4378-EO, производитель Phenomenex (США)), оснащенной защитной предколонкой стандарта ЕС (4,0×3,0 мм, диаметр частиц 5 мкм, сорбент Luna® NH2 каталожный номер AJ0-4302, производитель Phenomenex (США)) в линейном градиенте ацетонитрила от 1 до 8% за 8 минут в деионизированной воде, скорость потока - 1 мл/мин, УФ-детекцию проводят при длине волны 283 нм. Масс-спектры высокого разрешения (HRMS) регистрируют на приборе Bruker Daltonics micrOTOF-Q II с электрораспылительной ионизацией (ESI). Измерения проводят в режиме отрицательно заряженных ионов. Напряжение на капилляре: 4700 V; диапазон сканирования масс m/z 50-3000; калибровка внешняя (Electrospray Calibrant Solution, Fluka); давление на распылителе: 0.4 бар; скорость потока: 3 мкл/мин; газ-распылитель: азот (4 л/мин); температура интерфейса: 200°С. Образцы подаются в распылительную камеру масс-спектрометра после жидкостного хроматографа Agilent 1260, оснащенного колонкой Agilent Poroshell 120 ЕС-С18 (3,0×50 мм; 2,7 мкм); скорость потока 0,2 мл/мин; в ВЭЖХ-хроматограф образцы вещества подаются из раствора ацетонитрил-вода 1:1 (5 мкл) и элюируются в линейном градиенте концентраций ацетонитрила (50→100%). Ионообменную хроматографию выполняют на смоле Dowex 50W-X8 (100-200 mesh) "Bio Rad". Очистку растворителей проводят по стандартным методикам. Для проведения фосфоролиза используют ферментные препараты пуриннуклеозидфофорилазы E.coli (10,6 ед.акт./мл, 0,1 мг/мл) и пуриннуклеозидфофорилазы Enterobacter (20,8 ед.акт./мл, 3,2 мг/мл).
Пример 1. Синтез бариевой соли α-D-рибофуранозо-1-фосфата.
7-Метилгуанозина гидройодид (200 мг, 0,470 ммоль) растворяют в 90 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 9,87 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,494 ммоль). Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 98%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата бария (Ba(OAc)2 126,2 мг, 0,494 ммоль; вода 2 мл; 25% водный раствор аммиака 0,9 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 20 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакуумном эксикаторе над Р2О5. Выход 161 мг (94%) в виде аморфного порошка. Rƒ 0,16 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,68 удд (1Н, J1,2=4,9, JH-P=4,4, H1), 4,28 м (1Н, Н4), 4,17 дд (1H, J2,3=3,1, Н2), 4,08 дд (1Н, J3,4=5,8, Н3), 3,75 дд (1Н, J5a,4=3,2, J5a,5b=-11,6, Н5а), 3,63 дд (1H, J5b,4=4,6, H5b). 13С ЯМР (300 МГц, D2O): 97,47 (С1), 85,28 (С4), 71,65 (С2), 70,08 (С3), 61,85 (С5). 31Р ЯМР (300 МГц, D2O): 1,85. Масс-спектр: вычислено для C5H10O8P- 229,0119, найдено 229,0103.
Пример 2. Синтез бариевой соли α-D-2-дезоксирибофуранозо-1-фосфата. 7-Метил-2'-дезоксигуанозина гидройодид (300 мг, 0,733 ммоль) растворяют в 140 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 15,4 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,770). Реакцию инициируют добавлением 150 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 60 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метил-2'-дезоксигуанозина по данным ВЭЖХ протекает на 96%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×150 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата бария (Ba(OAc)2 173,6 мг, 0,770 ммоль; вода 3 мл; 25% водный раствор аммиака 1,2 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 30 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Сушат в вакуумном эксикаторе над Р2О5. Выход 255 мг (93%) в виде аморфного порошка. Rƒ 0,24 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,84 ддд (1H, J1,2a=6,6, J1,2b=1,4, JH-P=6,1, H1), 4,28 м (2Н, Н3, Н4), 3,79 дд (1Н, J5a,4=3,3, J5a,5b=-12,2, Н5а), 3,65 дд (1Н, J5b,4=5,5, H5'b), 2,44 ддд (1H, J2a,3=6,6, J2a,2b=-14,3, Н2а), 2,14 ддд (1H, J2b,3=2,5, H2b). 13С ЯМР (300 МГц, D2O): 102,20 (С1), 88,72 (С4), 73,96 (С3), 64,52 (С5), 44,42 (С2). 31Р ЯМР (300 МГц, D2O): 1,80.
Пример 3. Синтез магниевой соли α-D-рибофуранозо-1-фосфата.
7-Метилгуанозина гидройодид (200 мг, 0,470 ммоль) растворяют в 90 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 9,87 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,494 ммоль). Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 98%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата магния (Mg(OAc)2 ×4 H2O 105,9 мг, 0,494 ммоль; вода 2 мл; 25% водный раствор аммиака 0,9 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 20 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакуумном эксикаторе над Р2О5. Выход 111 мг (93%) в виде аморфного порошка. R/0,16 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР, 13С ЯМР и 31Р ЯМР аналогичны спектрам бариевой соли α-D-рибофуранозо-1-фосфата.
Пример 4. Синтез магниевой соли α-D-2-дезоксирибофуранозо-1-фосфата.
7-Метил-2'-дезоксигуанозина гидройодид (300 мг, 0,733 ммоль) растворяют в 140 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 15,4 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,770 ммоль). Реакцию инициируют добавлением 150 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 60 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метил-2'-дезоксигуанозина по данным ВЭЖХ протекает на 96%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×150 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата магния (Mg(OAc)2 ×4 H2O 165,1 мг, 0,770 ммоль; вода 3 мл; 25% водный раствор аммиака 1,2 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 30 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Сушат в вакуумном эксикаторе над Р2О5. Выход 161 мг (93%) в виде аморфного порошка. Rƒ 0,24 (изопропиловый спирт -аммиак - вода, 70:10:20, v/v). 1Н ЯМР, 13С ЯМР и 31Р ЯМР аналогичны спектрам бариевой соли а-0-2-дезоксирибофуранозо-1-фосфата.
Пример 5. Синтез кальциевой соли α-D-рибофуранозо-1-фосфата.
7-Метилгуанозина гидройодид (200 мг, 0,470 ммоль) растворяют в 90 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 9,87 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,494 ммоль). Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 98%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата кальция (Са(ОАс)2 (безводн.) 78,1 мг, 0,494 ммоль; вода 2 мл; 25% водный раствор аммиака 0,9 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 20 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакуумном эксикаторе над Р2О5. Выход 119 мг (94%) в виде аморфного порошка. Rƒ 0,16 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР, 13С ЯМР и 31Р ЯМР аналогичны спектрам бариевой соли α-D-рибофуранозо-1-фосфата.
Пример 6. Синтез кальциевой соли α-D-2-дезоксирибофуранозо-1-фосфата.
7-Метил-2'-дезоксигуанозина гидройодид (300 мг, 0,733 ммоль) растворяют в 140 мл буферного раствора Tris-HCl (50 мМ; рН 7,5). К полученному раствору добавляют 15,4 мл буферного раствора дигидрофосфата калия (50 мМ, рН 7,5; 0,770 ммоль). Реакцию инициируют добавлением 150 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 60 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метил-2'-дезоксигуанозина по данным ВЭЖХ протекает на 97%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×150 мл). Водный слой отделяют, добавляют к нему водно-аммиачный раствор ацетата кальция (Са(ОАс)2 (безводн.) 121,8 мг, 0,770 ммоль; вода 3 мл; 25% водный раствор аммиака 1,2 мл). Полученный раствор оставляют на 20 часов при 4°С. Выпавший осадок отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант упаривают в вакууме до объема 30 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору при перемешивании добавляют этиловый спирт до появления устойчивого помутнения. Оставляют при 4°С на 20 часов. Выпавший осадок отделяют центрифугированием, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Сушат в вакуумном эксикаторе над Р2О5. Выход 169 мг (91%) в виде аморфного порошка. Rƒ 0,24 (изопропиловый спирт -аммиак - вода, 70:10:20, v/v). 1Н ЯМР, 13С ЯМР и 31Р ЯМР аналогичны спектрам бариевой соли α-D-2-дезоксирибофуранозо-1-фосфата.
Пример 7. Синтез циклогексиламинной соли α-D-рибофуранозо-1-фосфата.
7-Метилгуанозина гидройодид (300 мг, 0,706 ммоль) и гидрофосфат дициклогексиламина (230 мг, 0,777 ммоль) растворяют в 100 мл Н2О. Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 97%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, упаривают в вакууме до объема 2 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору добавляют н-бутиловый спирт (30 мл), интенсивно встряхивают до образования однофазной системы. Оставляют при 4°С на 60 часов. Выпадает кристаллический осадок. Осадок отфильтровывают, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Сушат в вакуумном эксикаторе над Р2О5. Выход 248 мг (87%) в виде кристаллического осадка. Rƒ 0,21 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,64 дд (1H, J1,2=3,9, JH-P=6,2, H1), 4,24 м (1Н, J4,3=4,1, Н4), 4,12 дд (1Н, J2,3=6,1, Н2), 4,07 дд (1H, Н3), 3,81 дд (1H, J5a,4=3,3, J5a,5b=-12,4, Н5а), 3,68 дд (1H, J5b,4=4,7, H5'b), 3,18 м (2Н, Н циклогексиламинных остатков), 2,02 м (4Н, Н циклогексиламинных остатков), 1,83 м (4Н, Н циклогексиламинных остатков), 1,68 (2Н, Н циклогексиламинных остатков), 1,37 м (10Н, Н циклогексиламинных остатков). 13С ЯМР (300 МГц, D2O): 100,10 (C1), 86,90 (С4), 74,36 (С2), 72,62 (СЗ), 64,27 (С5), 53,10 (С циклогексиламинных остатков), 33,09 (С циклогексиламинных остатков), 27,04 (С циклогексиламинных остатков), 26,54 (С циклогексиламинных остатков). 31Р ЯМР (300 МГц, D2O): 1,92. Сигналы 1Н-31Р соотносят с использованием НМВС-экспериментов (гетероядерной спиновой корреляции с дальними атомами). Наблюдаются сигналы, указывающие на корреляцию атома Р с протонами H1 (большая интенсивность) и Н2 (меньшая интенсивность).
Пример 8. Синтез циклогексиламинной соли α-D-2-дезоксирибофуранозо-1-фосфата.
7-Метил-2'-дезоксигуанозина гидройодид (300 мг, 0,733 ммоль) и гидрофосфат дициклогексиламина (239 мг, 0,806 ммоль) растворяют в 100 мл H2O. Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 98%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, упаривают в вакууме до объема 2 мл (температура бани не должна превышать 35°↓С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору добавляют н-бутиловый спирт (30 мл), интенсивно встряхивают до образования однофазной системы. Оставляют при 4°С на 60 часов. Выпадает осадок. Осадок отфильтровывают, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Сушат в вакуумном эксикаторе над P2O5. Выход 224 мг (74%) в виде порошка. Rƒ 0,26 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,84 ддд (1H, J1,2a=6,4, J1,2b=1,3, JH-P=5,9, H1), 4,29 м (2Н, Н3, Н4), 3,79 дд (1Н, J5a,4=3,4, J5a,5b=-12,2, Н5а), 3,53 дд (1Н, J5b,4=5,2, H5'b), 3,23 м (2Н, Н циклогексиламинных остатков), 2,44 ддд (1Н, J2a,3=6,4, J2a,2b=-14,1, Н2а), 2,15 ддд (1Н, J2b,3=2,6, H2b), 2,05 м (4Н, Н циклогексиламинных остатков), 1,88 м (4Н, Н циклогексиламинных остатков), 1,72 м (2Н, Н циклогексиламинных остатков), 1,59 м (2Н, Н циклогексиламинных остатков), 1,38 м (10Н, Н циклогексиламинных остатков). 13С ЯМР (300 МГц, D2O): 99,63 (С1), 86,07 (С4), 71,21 (С3), 61,69 (С5), 50,39 (С циклогексиламинных остатков), 41,72 (С2), 30,39 (С циклогексиламинных остатков), 24,33 (С циклогексиламинныха остатков), 23,83 (С циклогексиламинных остатков). 31Р ЯМР (300 МГц, D2O): 1,67.
Пример 9. Синтез натриевой соли α-D-рибофуранозо-1-фосфата.
7-Метилгуанозина гидройодид (300 мг, 0,706 ммоль) и гидрофосфат дициклогексиламина (251 мг, 0,847 ммоль) растворяют в 100 мл H2O. Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 97%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, упаривают в вакууме до объема 2 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору добавляют н-бутиловый спирт (30 мл), интенсивно встряхивают до образования однофазной системы. Оставляют при 4°С на 60 часов. Выпавший осадок отфильтровывают, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Полученную циклогексиламинную соль растворяют в 10 мл Н2О, к раствору добавляют 1 мл Dowex-50 (Na+ форма), перемешивают 30 мин при 20°С. Смолу отфильтровывают, промывают водой (3 мл). Фильтрат упаривают в вакууме досуха. Сушат в эксикаторе над Р2О5. Выход 186 мг (96%) в виде пены. Rƒ 0,17 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,65 дд (1H, J1,2=3,9, JH-P=6,4, H1), 4,24 ддд (1Н, J4,5a=3,3, J4,5b=4,7, J4,3=4,1, H4), 4,12 ддд (1Н, J2,3=6,2, J2,P=0,9, H2), 4,07 дд (1H, H3), 3,80 дд (1H, J5a,5b=-12,4, H5a), 3,67 дд (1H, H5'b). 13C ЯМР (300 МГц, D2O): 102,31 (C1), 88,14 (C4), 72,64 (C2), 70,26 (C3), 63,33 (C5). 31P ЯМР (300 МГц, D2O): 1,93.
Пример 10. Синтез натриевой соли α-D-2-дезоксирибофуранозо-1-фосфата.
7-Метил-2'-дезоксигуанозина гидройодид (300 мг, 0,733 ммоль) и гидрофосфат дициклогексиламина (260 мг, 0,880 ммоль) растворяют в 100 мл Н2О. Реакцию инициируют добавлением 120 мкл раствора ПНФ Е. coli с активностью 10,6 ед.акт./мл (либо 40 мкл раствора ПНФ Enterobacter с активностью 20,8 ед.акт./мл), перемешивают, оставляют при 20°С на 5 часов. Превращение исходного 7-метилгуанозина по данным ВЭЖХ протекает на 98%. Реакционную смесь охлаждают на ледяной бане, выдерживают при 0°С 30 минут, затем осадок 7-метилгуанина отфильтровывают через нитроцеллюлозный фильтр Whatman (0,2 μ, 25 мм). Осветленный супернатант экстрагируют равным объемом н-бутилового спирта (2×100 мл). Водный слой отделяют, упаривают в вакууме до объема 2 мл (температура бани не должна превышать 35°С, при выпадении осадка в концентрированном растворе необходимо провести повторную фильтрацию). К полученному концентрированному водному раствору добавляют н-бутиловый спирт (30 мл), интенсивно встряхивают до образования однофазной системы. Оставляют при 4°С на 60 часов. Выпадает осадок. Осадок отфильтровывают, промывают этиловым спиртом (10 мл), диэтиловым эфиром (10 мл), сушат в вакууме досуха. Полученную циклогексиламинную соль растворяют в 10 мл H2O, к раствору добавляют 1 мл Dowex-50 (Na+ форма), перемешивают 30 мин при 20°С. Смолу отфильтровывают, промывают водой (3 мл). Фильтрат упаривают в вакууме досуха. Сушат в эксикаторе над Р2О5. Выход 182 мг (96%) в виде пены. Rƒ 0,24 (изопропиловый спирт - аммиак - вода, 70:10:20, v/v). 1Н ЯМР (300 МГц, D2O): 5,79 ддд (1H, J1,2a=5,2, J1,2b=1,4, JH-P=6,0, H1), 4,25 м (2Н, Н3, Н4), 3,75 дд (1Н, J5a,4=3,5, J5a,5b=-12,2, Н5а), 3,65 дд (1Н, J5b,4=5,1, H5'b), 2,39 ДДД (1H, J2a,3=7,3, J2a,2b=-14,4, Н2а), 2,11 ддд (1Н, J2b,3=2,5, H2b). 13С ЯМР (300 МГц, D2O): 98,77 (С1), 87,10 (С4), 70,98 (С3), 63,06 (С5), 40,78 (С2). 31Р ЯМР (300 МГц, D2O): 1,71.