Результат интеллектуальной деятельности: МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 3К11 К ПРОИЗВОДНЫМ МОРФИНА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности к антителам, связывающим производные морфина и нейтрализующие их биологическую активность.
В настоящее время, по данным федерального статистического управления Минздрава России, среди зарегистрированных больных наркоманией подавляющее большинство составляют больные с зависимостью от опиатов (78,4%) [Киржанова В.В., Григорова Н.И. О заболевании наркологическими расстройствами в 2014 г. // Вопросы наркологии, 2015, 4:19-28]. В этой связи в нашей стране проводится активный поиск эффективных путей лечения и профилактики опиатной наркомании, а также проводятся исследования в области усовершенствования детекции психоактивных веществ [Любавина И.А., Зинченко А.А., Лапенков М.И., Николаева Т.Л. Экспресс-метод выявление морфина в водных образцах с помощью иммунохроматографии с использованием моноклональных антител, меченных коллоидным золотом // Биоорганическая химия, 2005, 31:108-112].
Лечение и профилактика наркотической зависимости тесно связаны с разработкой новых эффективных методов иммунодиагностики и иммунотерапии с применением высокоспецифических антител к психоактивным веществам.
Известен способ качественного и количественного определения наркотических веществ в исследуемой среде (экстрактах из биоматериала) с использованием иммунохимического метода (поляризационный флуороиммуноанализ), включающий также воздействие эталонным реагентом и регистрацию изменений физико-химических параметров [Лисовская СБ. Разработка поляризационного флуороиммуноанализа наркотических средств, производных опиатов, барбитуратов, 1,4-бензодиазепинов в органах и тканах: Автореферат дис. к.ф.н. // Московская медицинская академия имени И.М.Сеченова, 2000, 26 с; Лисовская СБ., Смирнов А.В., Симонов Е.А., Изотов Б.Н., Буркин А.А. Иммунохимические методы определения опиатов в тканях и органах // Судебно-медицинская экспертиза, 2000, 6:25-30].
Данный способ требует дорогостоящей аппаратуры и трудоемок в отношении подготовки проб исследуемых веществ — экстрагирования из биоматериала. Кроме того, указанный способ не пригоден для определения наркотических веществ в гнилостно измененном трупном материале.
Одним из наиболее перспективных направлений является создание иммунодиагностических и лечебных препаратов на основе соответствующих антител. В настоящее время известны иммуногенные моно- и поликлональные антитела к опиатам (ЕР 0363041, 1989; JP 234826/88; RU 2548802, 2015; RU 2260186, 2005). При этом иммуногенные моноклональные антитела против морфина получают, в частности, следующим образом. Мышей линии BALB/C иммунизируют антигеном (морфин-бычий сывороточный альбумин). После гибридизации получают гибридому В1, продуцирующую специфические антитела против морфина и героина. Однако эффективность применения таких антител недостаточно высока.
Так, предлагается вакцина, содержащая в качестве антигена алкалоиды опия, которая вызывает образование в организме антител к героину и морфину. Антитела связывают героин, вводимый в организм, и таким образом уменьшается его проникновение в мозг и приятные ощущения от его введения (CN 1196955, 1998). Недостатком этой вакцины являются ограниченные возможности связывания наркотика в крови. Если наркоман увеличивает дозу, часть героина связывается антителами, но достаточная часть проникает в ЦНС, что нередко приводит лишь к увеличению употребления наркотика.
Поскольку, основными активными метаболитами героина у человека являются 6-моноацетилморфин, морфин и морфин-6-глюкуронид [Берзина А.Г., Гамалея Н.Б. и др. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015, 11(167):25-31] для целей лечения и профилактики зависимости от этих опиатов, а также для разработки методов специфической диагностики, необходимо, прежде всего, получить антитела, реагирующие как с этими наркотиками, так и с их активными производными. Такие антитела могут быть получены при иммунизации лабораторных животных производными морфина по гидроксильным остаткам при атомах углерода в 6 и 3 положениях фенантренового кольца молекулы морфина, конъюгированными с белками.
Наиболее близкими по технической сущности к заявляемому изобретению являются антитела против морфина, содержащие вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, причем в вариабельной области тяжелой цепи имеется аминокислотная последовательность, описанная в положениях 31-35 в виде CDR-H1, аминокислотная последовательность, описанная в положениях 50-65 в виде CDR-H2 и аминокислотная последовательность, описанная в положениях с 98 по ПО в виде CDR-H3, причем Fab-фрагмент включает F(ab')2, одноцепочечное антитело (scFv), фрагмент вариабельной области димеризации (V-область) (Diabody), фрагмент V-области с дисульфидной стабилизированной областью (dsFv) и область определения комплементарное™ (CDR), а вариабельная область легкой цепи содержит аминокислотную последовательность, описанную в положениях с 160 по 174 в виде CDR-L1, аминокислотную последовательность позиций от 190 до 196 в виде CDR-L2 и аминокислотную последовательность с положениями 229-237 в виде CDR-L3 (JP 2012232948, 2012).
Недостатком антитела является низкая реакционная способность по отношению к производным морфина, что ограничивает область его применения.
Технической задачей, решаемой авторами, являлось расширение круга антител, способных специфически связываться с производными морфина и ингибировать биологическую активность наркотика.
Технический результат достигался созданием моноклонального антитела (МАТ) 3К11, которое специфично и с высокой аффинностью связывается с молекулами производных морфина и не связывается с эндогенными опиоидными пептидами человека, такими как эндорфин, энкефалин и другими, которые выполняют важную роль в физиологии организма.
Моноклональное антитело 3К11 к конформационному эпитопу производного морфина содержит вариабельную область тяжелой цепи по Seq ID No: 3 и вариабельную область легкой цепи по Seq ID No: 4, а также гипервариабельные участки вариабельной области тяжелой цепи по Seq ID No: 5-7 и гипервариабельные участки вариабельной области легкой цепи по Seq ID No: 8-10. Сравнительный анализ последовательности CDR тяжелой и легкой цепей показал отсутствие между антителом ближайшего аналога и антителом 3К11 гомологий.
Полученное моноклональное антитело 3К11 специфично и с высокой аффинностью связывается с производным морфина и блокирует его биологическую активность. Оно узнает 3-О-карбоксиметильный эфир, конъюгированный как с бычьим сывороточным альбумином (БСА), так и с лизоцимом, не связывается с другим производным морфина, представляющим 6-гемисукцинильный (ГСМ) эфир, и блокирует биологическую активность морфина.
Технология получения антитела включала в себя иммунизацию животных антигеном, представляющим собой производные морфина: 6-гемисукцинильный (ГСМ) и 3-О-карбоксиметильный (КММ) эфиры, конъюгированные с БСА и лизоцимом с помощью бифункционального реагента 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида, которые были получены по методикам, описанным в статье [Берзина А.Г., Гамалея Н.Б. и других. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015,11(167):25-31].
В качестве антигенов для отбора позитивных продуцентов моноклональных антител при постановке иммуноферментного анализа (ИФА) использовали конъюгаты ГСМ и КММ с лизоцимом, а также конъюгат другого производного морфина - 2-р-карбокси-фенилазометильное (ФАМ).
Свойства и структура антитела иллюстрируются следующими графическими материалами.
На Фиг. 1 показаны результаты электрофореза в полиакриламидном геле мышиного моноклонального антитела 3К11 (4-20% полиакриламидный гель)
а - невосстанавливающие условия
б - маркеры молекулярных весов (кД)
в - восстанавливающие условия
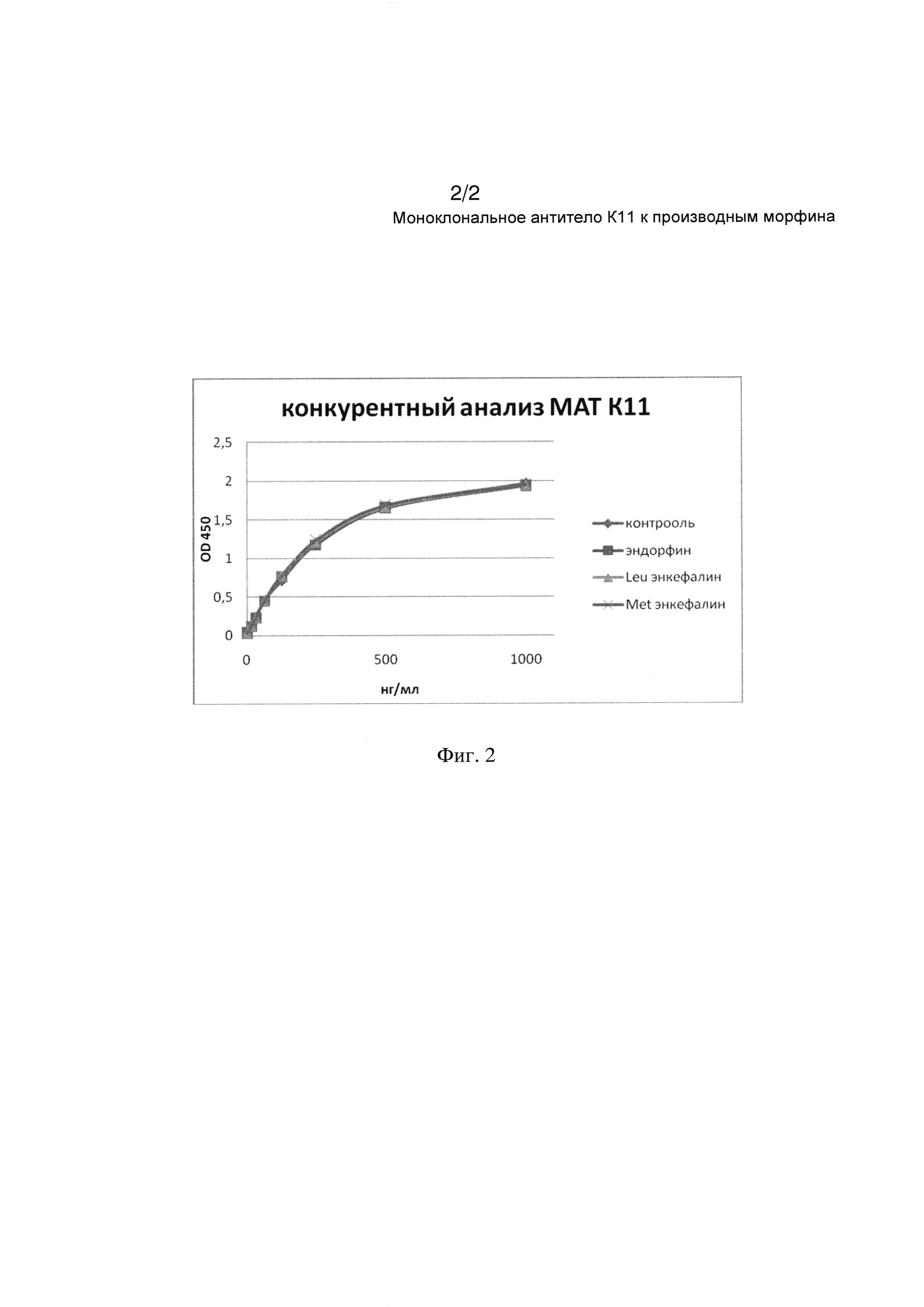
На Фиг. 2 демонстрируется отсутствие конкуренции МАТ 3К11 с эндогенными опиоидными пептидами.
Сущность и промышленная применимость изобретения поясняются следующими примерами:
Пример 1. Получение антигенов для иммунизации и скрининга гибридом, иммунизация мышей и отбор гибридомы s3К11.
Пример 1.1. Получение антигенов. Для иммунизации использовали производное морфина: 6-гемисукцинильный 3-О-карбоксиметильный (КММ) эфир, конъюгированный с бычьим сывороточным альбумином (БСА) с помощью бифункционального реагента 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида по методике, описанной в статье [Берзина А.Г., Гамалея Н.Б. и других. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015, 11(167):25-31]. В качестве антигенов для адсорбции на твердой фазе при постановке ИФА использовали 6-гемисукцинильный (ГСМ), 3-О-карбоксиметильный (КММ) и 2-р-карбоксифенилазометильный (ФАМ) эфиры, конъюгированные с лизоцимом по описанным методикам [Берзина А.Г., Гамалея Н.Б. и др. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015, 11(167):25-31]. Приготовленные конъюгаты производных морфина аликвотировали и хранили при —80°С.
Пример 1.2. Иммунизация мышей и скрининг гибридомы. Мышей линии Balb/c иммунизировали полученным как описано в примере 1.1., препаратом КММ-БСА, эмульгированным в полном адъюванте Фрейнда (ПАФ), в дозе 10 мкг на мышь в подошвенный апоневроз задних конечностей. Через 4 недели животным вводили внутривенно 5 мкг антигена в физиологическом растворе. На четвертый день после инъекции животных умерщвляли цервикальной дислокацией и выделяли лимфоциты паховых и брюшных лимфоузлов. Полученные лимфоциты смешивали с клетками миеломы SP 2/0 в соотношении 2:1.
Гибридизацию проводили 50% раствором полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да в течение 1,5 мин., затем 4-кратно добавляли с интервалом в 1 мин среду RPMI-1640 в объеме, равном объему раствора ПЭГ. После слияния клетки дважды отмывали культуральной средой и высевали в 96-луночные культуральные планшеты с суточными перитонеальными макрофагами (5×10 клеток на лунку) из расчета 5×104 клеток миеломы на лунку. Селекцию гибридом проводили в среде RPMI-1640 с добавлением 10% бычьей фетальной сыворотки, содержащей 10-4 М гипоксантина, 4×10-7 М аминоптерина и 1,6×10-5 М тимидина.
Скрининг антител проводили с помощью непрямого метода ИФА, используя в качестве антигенов для адсорбции на твердой фазе конъюгаты производных морфина с лизоцимом. При постановке теста использовали антивидовые иммунопероксидазные конъюгаты фирмы Sigma-Aldrich.
Первичный отбор позитивных клонов проводили по связыванию моноклональных антител, секретируемых гибридомами, с антигенами в ИФА. Для этого в лунки полистирольных планшетов Corning (Costar) адсорбировали КММ-лизоцим в 20 мМ боратном буфере с рН 8,0, содержащим 0,15 М NaCl, в концентрации 5 мкг/мл в течение 20 часов во влажной камере. По окончании адсорбции планшеты отмывали промывочным буфером (20 мМ боратный буфер с рН 8,0, содержащий 0,15 М NaCl и 0,05% Tween-20). Затем в каждую лунку вносили по 100 мкл промывочного буфера, содержащего 1 мг/мл БСА, и по 50 мкл культуральных сред, содержащих МАТ. Планшеты инкубировали 1 час при перемешивании при 37°С. По окончании инкубации проводили отмывку несвязавшихся с антигеном антител промывочным буфером и вносили в лунки раствор иммуноглобулинов козы к иммуноглобулинам мыши, конъюгированных с пероксидазой хрена (Sigma-Aldrich) согласно приложенной инструкции. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА, Москва). Культуральные среды клонов, показавшие специфическое связывание с антигенами, повторно проверялись в аналогичном эксперименте на КММ-лизоцим, ГСМ-лизоцим, ФАМ-лизоцим и немодифицированный лизоцим.
На основе проведенного скрининга был отобран клон s3К11, продуцирующий специфические антитела к производным морфина КММ-и ФАМ-лизоцим, не распознающие ГСМ-лизоцим. Свойства моноклональных антител 3К11 приведены в Таблица 1.
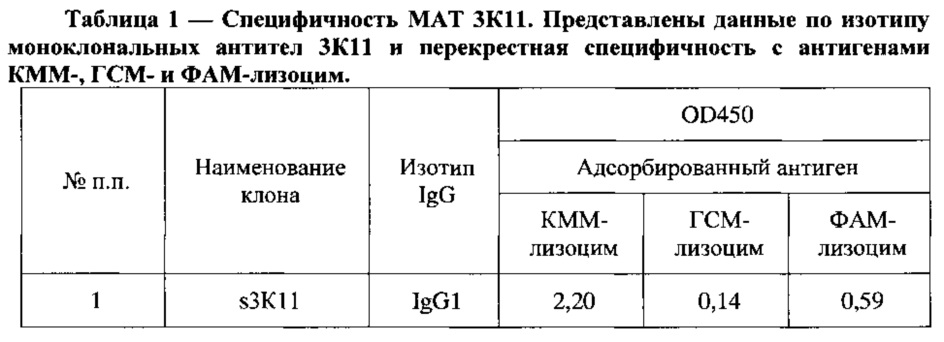
В результате последующего внутрибрюшинного размножения, криоконсервирования и контроля чистоты клеток был получен штамм гибридомы s3K11, продуцент моноклонального антитела 3К11.
Пример 2. Исследование свойств моноклонального антитела 3К11.
Пример 2.1. Очистка МАТ 3К11. Антитело 3К11 выделяли из асцитной жидкости мышей линии Balb/c с внутрибрюшинно привитой гибридомой s3K11 с помощью аффинной хроматографии на сорбенте MabSelect-сефарозе (General Electrics, США) согласно инструкции.
Пример 2.2. Изучение молекулярных свойств антитела 3К11. По результатам электрофореза в 4-20% полиакриламидном геле с додецилсульфатом натрия молекулярный вес антитела 3К11 в невосстанавливающих условиях соответствует ожидаемому для нативного IgG мыши 170 кДа (Фиг. 1а), в восстанавливающих условиях антитело диссоциирует на тяжелую (55 кДа) и легкую (29 кДа) цепи (Фиг. 1в). Изотип антитела 3К11, установленный с помощью набора «Mouse monoclonal antibody isotyping reagents» (SIGMA), - IgGl. Препараты очищенного антитела 3K11 использовали для изучения его биологических свойств.
Пример 2.3. Исследование биологических свойств моноклонального антитела 3К11.
Пример 2.3.1. Изучение биологической активности моноклональных антител 3К11 проводили на модели пролиферативной реакции культур лимфоцитов in vitro, выделенных из периферической крови 6 здоровых добровольцев на градиенте плотности фиколла-верографина (плотность 1,077 г/см). В Таблица 2 представлены результаты оценки нейтрализующего действия налоксона и моноклональных антител к морфину клона 3К11 на стимуляцию морфином синтеза ДНК в культуре лимфоцитов при их совместном введении. 
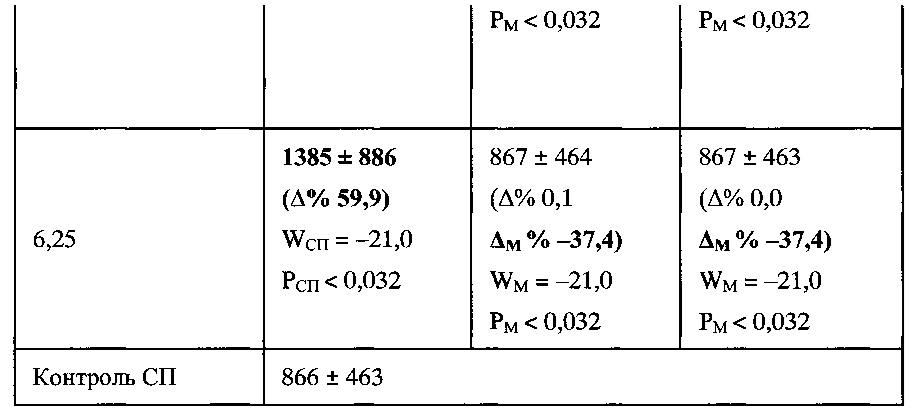
Примечание: Сравнение по одному признаку со спонтанной пролиферацией - СП (РСП) и морфином (РМ) проведено с использованием непараметрического критерия Вилкоксона (W) для двух зависимых групп без учета характера распределения вариант [Гланц С. Медико-биологическая статистика. Практика. 1999, 459 с.]. В скобках приведен процент изменения от средних значений СП и М (А% и AM % соответственно).
Анализ данных, приведенных в Таблица 2, показал наличие воздействия МАТ 3К11 на специфическую активность морфина. Показаны результаты оценки нейтрализующего действия налоксона и моноклональных антител к морфину на стимуляцию морфином синтеза ДНК в культуре лимфоцитов при их совместном введении с морфином.
Как видно из полученных данных, полученные МАТ клона 3К11 обладают способностью полностью блокировать усиление морфином синтеза ДНК в культурах лимфоцитов крови человека. Этот эффект совпадает с действием налоксона, который при совместном с морфином влиянии на лимфоциты полностью устраняет стимулирующий эффект опиата. Следует отметить, однако, что механизм нейтрализующего действия налоксона и первичных моноклональных антител к морфину является различным. Блокада налоксоном эффекта морфина осуществляется на уровне ц-опиоидных рецепторов, присутствующих на культивируемых лимфоцитах человека. Блокада первичными моноклональными антителами к морфину не связана с их действием на рецепторы лимфоцитов, поскольку сами по себе такие антитела эффекта на пролиферацию не оказывают. Блокада в данном случае обусловлена связыванием наркотика антителами в реакционной смеси, в результате чего действие морфина на u-опиоидные рецепторы лимфоцитов снижается.
Пример 2.3.2. Изучение перекрестного связывания моноклональных антител (MAT) 3К11 с некоторыми эндогенными опиоидными пептидами.
Для проверки перекрестного взаимодействия МАТ 3К11 с эндогенными опиоидными пептидами провели конкурентный твердофазный иммуноферментный анализ. В качестве конкурента использовали (3-эндорфин, Leu- и Met-энкефалины. Для этого в лунки полистирольных планшетов Corning (Costar) адсорбировали КММ-БСА в 20 мМ боратном буфере с рН 8,0, содержащем 0,15 М NaCl, в концентрации 5 мкг/мл в течение 20 часов во влажной камере. По окончании адсорбции планшеты отмывали промывочным буфером (20 мМ боратный буфер с рН 8,0, содержащий 0,15 М NaCl и 0,05% Tween-20). Затем в каждую лунку вносили по 100 мкл промывочного буфера, содержащего 1 мг/мл БСА, фиксированную концентрацию конкурента 100 мкг\мл и серии концентраций МАТ 3К11. Планшеты инкубировали 1 час при перемешивании при 37°С. По окончании инкубации проводили отмывку несвязавшихся с антигеном антител промывочным буфером и вносили в лунки раствор иммуноглобулинов козы к иммуноглобулинам мыши, конъюгированных с пероксидазой хрена (Sigma-Aldrich) согласно приложенной инструкции. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (фирмы ХЕМА). Результаты конкурентного анализа с эндогенными опиоидными пептидами представлены на Фиг. 2.
Как видно из представленных данных, моноклональные антитела 3К11 не конкурируют с отобранными опиоидными пептидами даже при очень большом молярном избытке конкурента, в то время как производное морфина конкурирует в значительно меньшем молярном избытке.
Пример 3. Синтез и секвенирование ДНК, кодирующих вариабельные части легкой и тяжелой цепей моноклонального антитела 3К11.
Из клеток гибридомы s3К11 выделяли РНК, на матрице которой с помощью наборов синтетических праймеров (Immunogenetics Information System http://www.imgt.org) были амплифицированы фрагменты ДНК, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты ДНК были клонированы в вектор pALTA (Евроген) и секвенированы с внешних праймеров (М13). Последовательности фрагментов ДНК, кодирующих VH и VL, представлены на Seq ID No: 1 и Seq ID No: 2, вычисленные аминокислотные последовательности VH и VL представлены на Seq ID No: 3 и Seq ID No: 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела 3К11 производили по Кэботу (Kabat Е.А., Wu Т.Т., Perry Н., Gottesman К. and Foeller С. (1991) Sequences of Proteins of Immuno-logical Interest, Fifth Edition. NIH Publication No. 91-3242), что позволило выделить участки CDR, определяющие комплементарность антитела антигену.
Сравнение последовательностей участков CDR с последовательностями известных антител к компонентам морфина показал отсутствие гомологии с аналогичными участками известных антител.
Моноклональное антитело 3К11 по настоящему изобретению может служить основой для конструирования химерных и гуманизированных антител, пригодных для создания лекарственных препаратов, блокирующих биологическую активность морфина.
Заявитель просит рассмотреть представленные материалы заявки «Моноклональное антитело 3К11 к производным морфина» на предмет выдачи патента РФ на изобретение.