Результат интеллектуальной деятельности: Способ скрининга противоопухолевых препаратов in vitro на многокомпонентной клеточной тест-системе
Вид РИД
Изобретение
Предполагаемое изобретение относится к области медицины, ветеринарии, фармакологии, клеточной биологии, более точно к способам скрининга противоопухолевых лекарственных препаратов или веществ с потенциальной противоопухолевой активностью in vitro. Изобретение может быть использовано для повышения качества и достоверности результатов доклинических испытаний фармакологической активности потенциальных противоопухолевых лекарственных препаратов на стадии тестирования in vitro.
По данным официальной статистики в 2015 году в Российской Федерации выявлено 589 тыс.случаев злокачественных новообразований. Прирост данного показателя по сравнению с 2014 годом составил 4,0%, по сравнению с 2005 годом - 22,1% [1]. На дату представления заявочных материалов в мире существует проблема проведения рационального первичного скрининга веществ, обладающих противоопухолевой активностью. Решение данной проблемы позволит снизить затраты на разработку безопасных и эффективных противоопухолевых препаратов для лечения онкологических заболеваний.
Для решения вышеописанной проблемы в мире разработаны и применяются различные способы доклинического скрининга лекарственных препаратов, представленные в основном моноклеточными двумерными тест-системами. Под моноклеточной двумерной тест-системой понимают способы тестирования противоопухолевой активности вещества на любом из известных типов опухолевых клеток, расположенных на плоской поверхности культурального пластика.
Примером такого способа служит современный протокол фармацевтического скрининга, принятый в 1990 году Национальным Институтом Рака (от англ. National Cancer Institute, NCI), который включает тестирование веществ на панели из 60 клеточных линий человека опухолевого происхождения (тест NCI-60), таких как культуры клеток лейкемии, меланомы, рака легкого, головного мозга, яичников и т.д. Потенциальные вещества с противоопухолевой активностью отбирают по их способности подавлять рост или вызывать гибель клеток в культуре in vitro [2].
Существенным недостатком данного способа является отсутствие воспроизведения опухолевой стромы, что приводит к низкой эффективности его использования по назначению на дальнейших этапах доклинического скрининга на лабораторных животных in vivo.
Опухолевая строма играет ключевую роль в процессах развития опухоли, прогрессии, метастазирования и формирования устойчивости к химио- и лучевой терапии. В микроокружении опухоли клетки стромы приобретают аномальный фенотип и функцию под действием межклеточных взаимодействий, в том числе прямых клетка-клетка, паракринных факторов и биологически активных молекул, переносимых микровезикулами (РНК, белки и др.) [3]. Опухолевая строма состоит из иммунных (лейкоциты, моноциты/макрофаги, лимфоциты, натуральные киллеры), эндотелиальных клеток, миофибробластов, опухоль-ассоциированных фибробластов, адипоцитов, а также внеклеточного матрикса и мезенхимных стромальных клеток [4]. Стромальные клетки, иммунные клетки и опухоль-ассоциированные фибробласты являются важным компонентом опухолевой стромы, поддерживают рост и васкуляризацию опухоли (образованию новых кровеносных сосудов), индуцируют эпителиально-мезенхимный переход, участвуют в процессах инвазии опухолевых клеток (внедрению опухолевых клеток в здоровые ткани), появлению лекарственной устойчивости и избеганию опухолью иммунного ответа [5], что в конечном счете, делает известный способ с применением моноклеточных двумерных культур недостаточно эффективным при использовании по назначению, так как существенно снижается достоверность результатов испытаний препаратов in vitro, что влечет дополнительные финансовые и временные затраты на последующих этапах скрининга.
Заявителем проведен анализ существующего уровня техники по научной и патентной информации в области скрининга противоопухолевых препаратов, тест-систем, использующих клетки млекопитающих, и выявлены следующие аналоги.
Из исследованного уровня техники выявлено изобретение по патенту ЕР 2115456А2 «Системы ко-культур клеток и ее использование» (с англ. Cell Co-Culture Systems and Uses Thereof), в качестве аналога выбран первый независимый пункт формулы изобретения и зависимый 21 пункт формулы изобретения.
Сущностью изобретения является: 1 пункт «система ко-культур клеток, содержащая: (1) первый клеточный тип, имеющий специфичный маркер для определения биологической активности интересующего вещества, причем указанный маркер, специфичен для данного типа клеток; (2) второй клеточный тип; и (3) детектор, подходящий для обнаружения маркера, специфичного для первого клеточного типа»; 21 пункт «система ко-культур клеток по 1 пункту, в которой первый клеточный тип представляет собой опухолевую клетку, а второй клеточный тип содержит клетки, присутствующие в микроокружении опухолевой клетки in vivo».
Недостатками данного способа является отсутствие аналога внеклеточного матрикса, использование только двух типов клеток, которые находятся на культуральном пластике и необходимость дополнительной маркировки клеток. Данные недостатки не позволяют воспроизвести процессы, происходящие в опухолевой строме, что делает изобретение недостаточно эффективным при использовании по назначению и усложняет процесс проведения скрининга в целом.
Из исследованного уровня техники выявлено изобретение по патенту RU 2492472 «Способ определения биологической активности вещества». Сущность способа заключается в том, что выделяют клетки из биологических тканей человека или животных, проводят мечение с использованием флуоресцентного красителя, ко-культивируют с пораженными заболеванием клетками, к ко-культуре добавляют исследуемое вещество, определяют биологическую активность исследуемого вещества путем анализа жизнеспособности определенной клеточной популяции в ко-культуре здоровых и пораженных заболеванием клеток по увеличению или снижению процента мертвых клеток. Способ применяют для выявления противоопухолевых свойств исследуемого вещества по отношению к определенной клеточной популяции в ко-культуре здоровых и пораженных заболеванием клеток.
Недостатками данного способа являются отсутствие аналога внеклеточного матрикса, использование только двух типов клеток, необходимость маркировки клеток флуоресцентной меткой для проведения анализа. Данные недостатки делают способ недостаточно эффективным при использовании по назначению, и усложняет процесс проведения скрининга.
Использование трехмерных культур в качестве моделей позволяет повысить точность и достоверность результатов скрининга противоопухолевых препаратов in vitro. Для создания трехмерных культур используют различные технологии, в частности, культивирование клеток на имитирующих тканевую архитектуру специальных матриксах [6].
Сущностью заявленного технического решения является способ скрининга противоопухолевых препаратов in vitro на многокомпонентной клеточной тест-системе, заключающийся в том, что берут опухолевые, стромальные и иммунные культуры клеток, проводят их ко-культивирование на любом из известных аналогов внеклеточного матрикса с получением многокомпонентной клеточной ко-культуры (тест-системы), к полученной многокомпонентной клеточной ко-культуре добавляют исследуемое вещество, проводят инкубирование полученной многокомпонентной клеточной ко-культуры с исследуемым веществом, определяют противоопухолевую активность исследуемого вещества посредством анализа жизнеспособности многокомпонентной клеточной ко-культуры с использованием известных методов клеточной биологии с получением результатов о наличии либо об отсутствии противоопухолевой активности исследуемого вещества с последующим отбором перспективных веществ с высокой противоопухолевой активностью для дальнейших этапов доклинического скрининга, либо отказа от дальнейшего скрининга исследуемого вещества в случае отсутствия у исследуемого вещества выраженной противоопухолевой активности.
Целью и техническим результатом предполагаемого изобретения является повышение эффективности первичного скрининга веществ с потенциальной противоопухолевой активностью, которые могут быть использованы для создания эффективных противоопухолевых лекарственных средств.
Цели и технический результат достигают тем, что берут опухолевые, стромальные и иммунные культуры клеток, проводят их ко-культивирование на любом из известных аналогов внеклеточного матрикса (например, Матригеле производства фирмы BD Biosciences, США) с получением многокомпонентной клеточной ко-культуры (тест-системы), к полученной многокомпонентной клеточной ко-культуре добавляют исследуемое вещество, проводят инкубирование полученной многокомпонентной клеточной ко-культуры с исследуемым веществом, определяют противоопухолевую активность исследуемого вещества посредством анализа жизнеспособности многокомпонентной клеточной ко-культуры с использованием известных методов клеточной биологии с получением результатов о наличии либо об отсутствии противоопухолевой активности исследуемого вещества с последующим отбором перспективных веществ с высокой противоопухолевой активностью для дальнейших этапов доклинического скрининга, либо отказа от дальнейшего скрининга исследуемого вещества в случае отсутствия у исследуемого вещества выраженной противоопухолевой активности.
Заявленный способ осуществляют, например, в нижеприведенной последовательности.
1. Берут три типа культур клеток: опухолевые, стромальные и иммунные клетки.
Опухолевые культуры клеток могут быть получены из коллекций клеточных культур человека и животных, например, из Американской коллекции типовых клеточных культур (от англ. American Type Culture Collection, АТСС) или других банков биоматериалов. Опухолевые культуры клеток могут быть выделены (с использованием стандартных культуральных методов, например путем ферментативной обработки) из биоптатов опухолевой ткани, полученной после хирургического удаления опухоли. Например, клетки нейробластомы человека линии SH-SY5Y, полученные из Американской коллекции типовых клеточных культур (АТСС CRL2266), культивируют в питательной среде, например DMEM/F12 (производства фирмы ПанЭко, Россия), содержащей 10% сыворотки крови плодов коровы (производства фирмы Invitrogen, США), L-глутамин (ПанЭко, Россия) и смесь антибиотиков пенициллин-стрептомицин (производства фирмы Биолот, Россия) при температуре 37°С, во влажной атмосфере, содержащей 5% СО2.
Стромальные клетки могут быть выделены из различных источников (костный мозг, жировая ткань и др.) с применением стандартных культуральных методов. Например, выделение стромальных клеток из аспиратов костного мозга человека осуществляют посредством центрифугирования аспиратов костного мозга в градиенте плотности фиколла (плотность 1,077 г/мл, производства фирмы ПанЭко, Россия) с последующей селективной адгезией к пластику стромальных клеток. Выделение стромальных клеток из жировой ткани проводят путем ферментативной обработки жировой ткани 0,4% раствором коллагеназы (производства фирмы Биолот, Россия). Стромальные клетки культивируют в питательной среде, например αМЕМ (производства фирмы ПанЭко, Россия), содержащей 10% сыворотки крови плодов коровы (производства фирмы Invitrogen, США), L-глутамин (производства фирмы ПанЭко, Россия) и смесь антибиотиков пенициллин-стрептомицин (производства фирмы Биолот, Россия) при температуре 37°С, во влажной атмосфере, содержащей 5% СO2.
Иммунные клетки, например мононуклеарные клетки (ядросодержащие клетки крови), получают из крови человека или животных с применением стандартных культуральных методов. Например, выделение мононуклеарных клеток из крови осуществляют посредством центрифугирования крови в градиенте плотности фиколла (плотность 1,077 г/мл, производства фирмы ПанЭко, Россия). Мононуклеарные клетки культивируют на неадгезивном культуральном пластике в питательной среде, например, IMDM (производства фирмы ПанЭко, Россия), содержащей 10% сыворотки крови плодов коровы (производства фирмы Invitrogen, США), L-глутамин (производства фирмы ПанЭко, Россия) и смесь антибиотиков пенициллин-стрептомицин (производства фирмы Биолот, Россия) при температуре 37°С, во влажной атмосфере, содержащей 5% СО2.
2. Покрывают культуральный пластик коммерчески выпускаемым аналогом внеклеточного матрикса, например, Матригелем (BD Biosciences, США). Для этого Матригель вносят в лунки планшета, например - 96-луночного, в объеме 50 мкл/лунка. Для предотвращения преждевременной полимеризации Матригеля, все манипуляции с ним выполняют на льду для обеспечения стабильной температуры от 0 до 4°С. Далее планшет с Матригелем инкубируют при температуре 37°С в течение на 20 минут для полной полимеризации матрикса, до достижения гелеобразного состояния.
3. Далее получают многокомпонентную клеточную ко-культуру путем внесения в лунки заранее подготовленного культурального планшета, покрытого аналогом внеклеточного матрикса, опухолевых, стромальных и иммунных клеток в соотношении 1:1:1 (например, по 5 тысяч клеток каждого вида), находящихся в питательной среде, например DMEM/F12 (производства фирмы ПанЭко, Россия), содержащей 10% сыворотки крови плодов коровы (производства фирмы Invitrogen, США), L-глутамин (производства фирмы ПанЭко, Россия) и смесь антибиотиков пенициллин-стрептомицин (производства фирмы Биолот, Россия). Далее многокомпонентную клеточную ко-культуру инкубируют при температуре 37°С, в насыщенной влажной атмосфере, содержащей 5% СО2 до образования клетками ко-культуры тканеподобных структур (обычно, 72 часов ±12 часов). Морфологию клеток ко-культуры анализируют с использованием фазово-контрасной микроскопии. При образовании клетками ко-культуры тканеподобных структур возможно дальнейшее ее применение для реализации следующего этапа.
4. К многокомпонентной клеточной ко-культуре добавляют вещество с исследуемой противоопухолевой активностью в различных концентрациях. Проводят инкубирование многокомпонентной клеточной ко-культуры с исследуемым веществом в течение 72 часов при температуре 37°С, в насыщенной влажной атмосфере, содержащей 5% СО2. Далее анализируют жизнеспособность ко-культуры с использованием стандартных/известных методов клеточной биологии, например MTT/MTS-теста.
Например, противоопухолевую активность вещества в ко-культуре определяют посредством следующих манипуляций. К ко-культуре добавляют вещество, например, цисплатин (производства фирмы LANS-Pharm, Россия), паклитасел (производства фирмы LANS-Pharm, Россия) или доксорубицин (производства фирмы LANS-Pharm, Россия) в различных концентрациях. Проводят инкубирование ко-культуры с препаратом в течение 72 часов при температуре 37°С, в насыщенной влажной атмосфере, содержащей 5% СО2. Противоопухолевую активность препарата определяют известным способом, например, с помощью одноэтапного колориметрического MTS-теста (производства фирмы Promega, США).
Краткая сущность метода заключается в том, что к клеткам добавляют 10 мкл смеси реагентов MTS (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолиум) и PMS (феназина метосульфат) в соотношении 19:1, которые в ходе реакции с НАДФ-Н-зависимыми клеточными оксидоредуктазными ферментами приводят к образованию соединения формазана, имеющего пурпурный цвет. Чем выше активность оксиредуктазных ферментов клеток, тем выше их жизнеспособность и больше формазана образуется в среде в ходе реакции. Для оценки жизнеспособности измеряется оптическая плотность раствора среды.
Заявленное техническое решение поясняется следующими материалами.
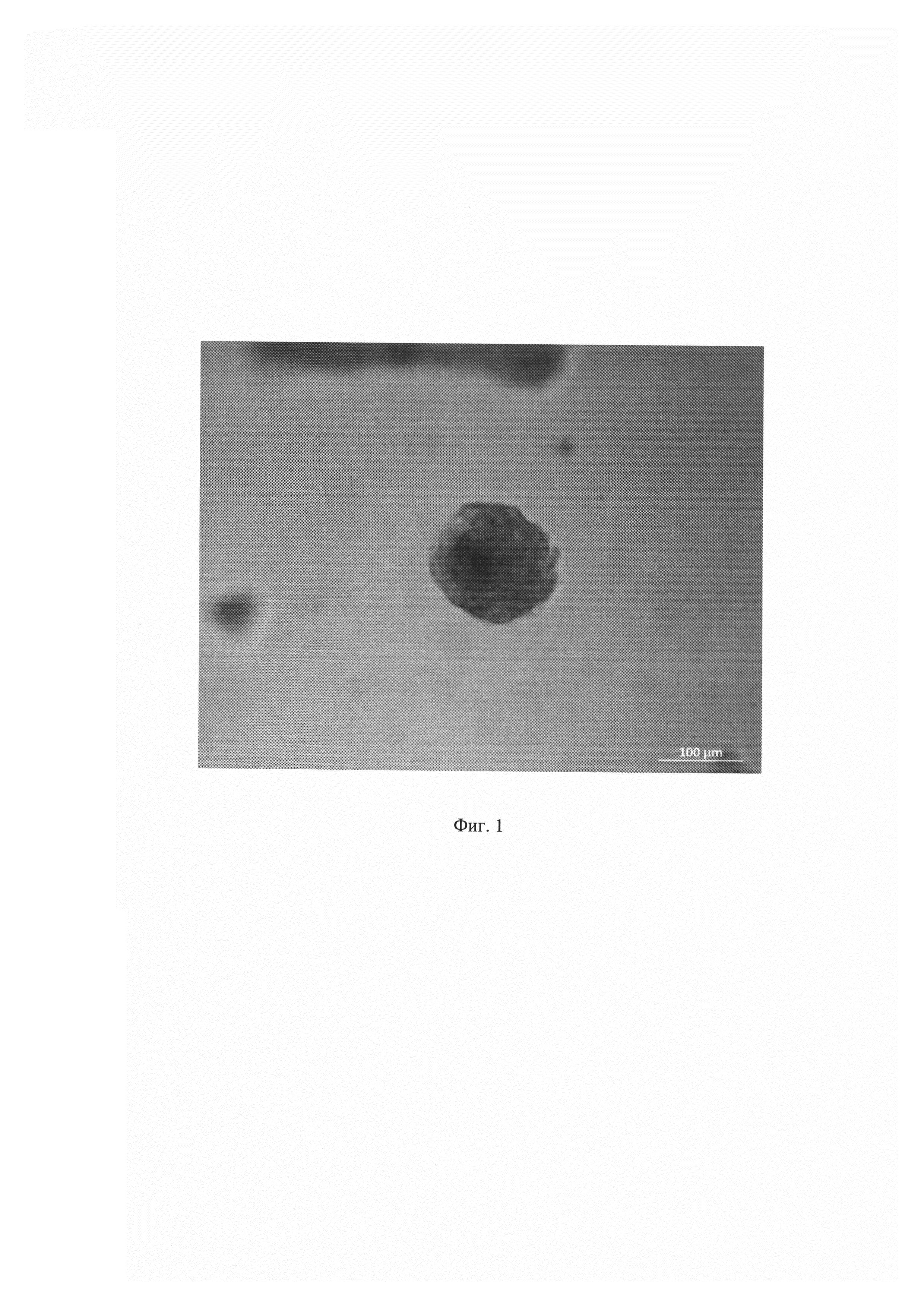
На Фиг. 1 показаны тканеподобные конгломераты, формирующиеся при совместном культивировании опухолевых, стромальных и иммунных клеток на аналоге внеклеточного матрикса (Матригеле). Данные получены с помощью фазово-контрастной микроскопии (шкала 100 мкм).
Таким образом, предложенный заявителем способ позволил получить объемные тканеподобные образования в условиях in vitro, аналогичные злокачественным новообразованиям в организме, и определить их чувствительность к противоопухолевым препаратам цисплатин, паклитаксел и доксорубицин.
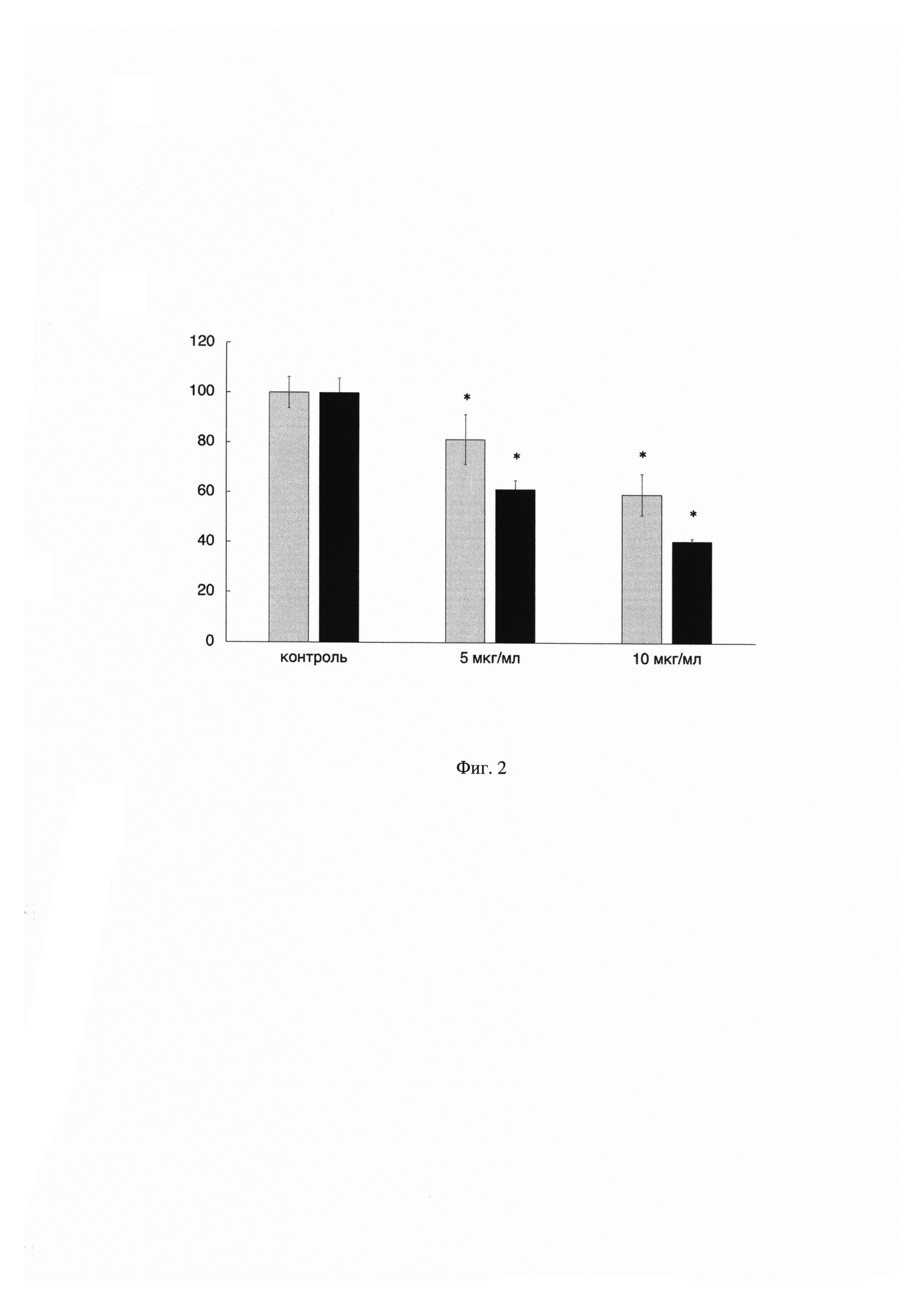
На Фиг. 2 показан график зависимости жизнеспособности клеток ко-культуры (серые столбцы) от концентрации противоопухолевого препарата цисплатин. По оси X указаны концентрации применяемого препарата, а по оси Y показана жизнеспособность клеток ко-культуры в процентном соотношении по сравнению с контрольными (необработанными препаратом) клетками. В качестве сравнения приведены данные по цитотоксичности противоопухолевого препарата цисплатин на монокультуру опухолевых клеток (черные столбцы). Данные получены с помощью MTS-теста. Результаты представлены в виде среднего значения ± СО. (n=3). Жизнеспособность контрольных клеток принята за 100%.
Из данных, показанных на Фиг. 2 видно, что жизнеспособность клеток ко-культуры после воздействия препарата цисплатин в концентрациях 5 и 10 мкг/мл выше в среднем на 20%, чем опухолевых клеток, культивируемых отдельно. Такие результаты объясняются тем фактом, что стромальные клетки играют вспомогательную роль в опухолеобразовании посредством секреции таких факторов, как интерлейкин 6 (ИЛ-6), ИЛ-8, сосудистый эндотелиальный фактор роста, тромбоцитарный фактор роста, фактор роста фибробластов 7, трансформирующий фактор роста бета и виментин, поддерживающих рост и химиорезистентность опухоли. Иммунные клетки также способствуют росту опухолевых клеток путем изменения их микроокружения, а также секретируя цитокины и матриксные металлопротеиназы, которые способствуют пролиферации, инвазии и метастазированию опухолевых клеток [3].
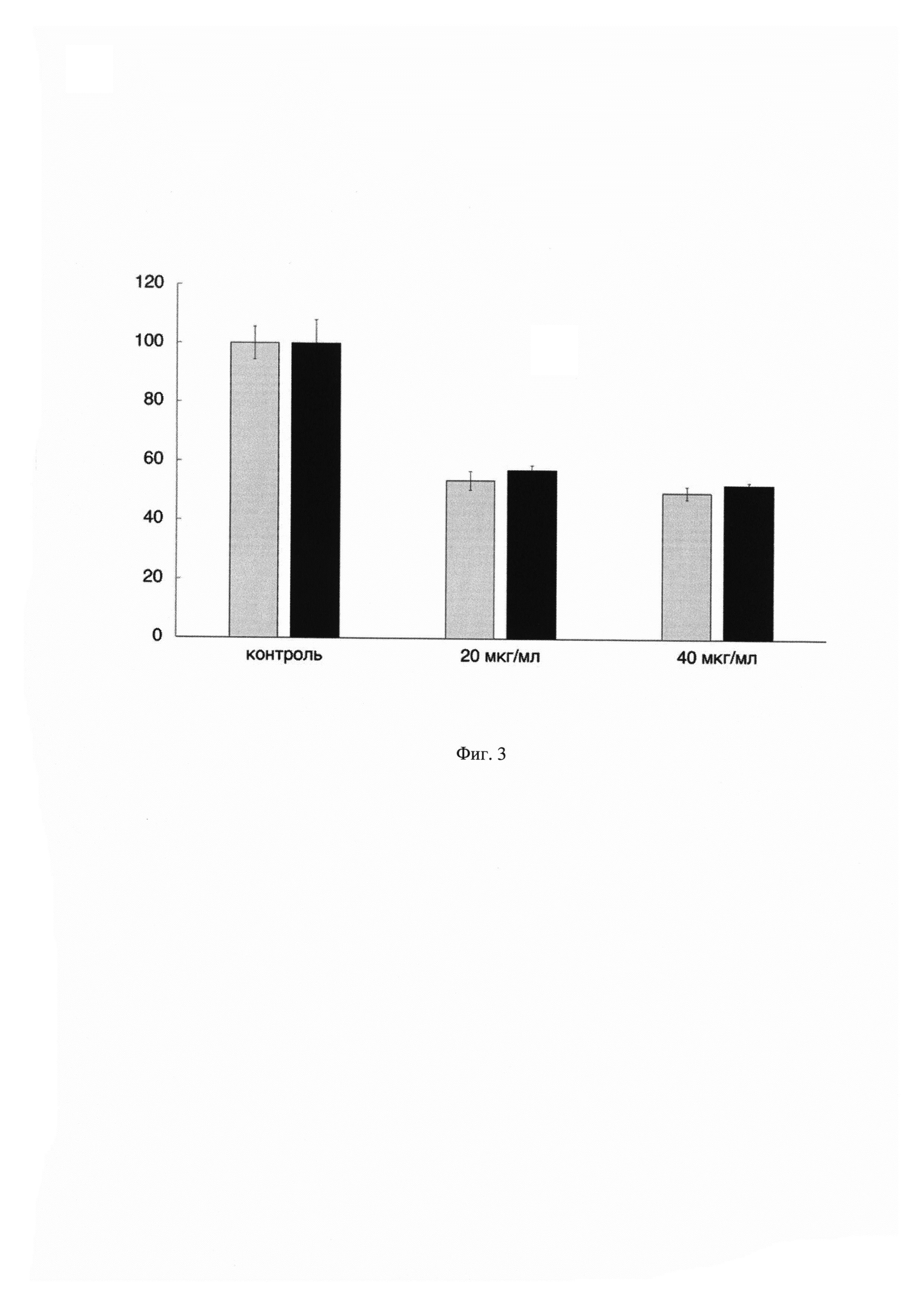
На Фиг. 3 показан график зависимости жизнеспособности клеток ко-культуры (серые столбцы) от концентрации противоопухолевого препарата доксорубицин. По оси X указаны концентрации применяемого препарата, а по оси Y показана жизнеспособность клеток ко-культуры в процентном соотношении по сравнению с контрольными (необработанными препаратом) клетками. В качестве сравнения приведены данные по цитотоксичности противоопухолевого препарата доксорубицин на монокультуру опухолевых клеток (черные столбцы). Данные получены с помощью MTS-теста. Результаты представлены в виде среднего значения ± СО. (n=3). Жизнеспособность контрольных клеток принята за 100%.
Из данных, показанных на Фиг. 3 видно, что жизнеспособность клеток ко-культуры после воздействия препарата доксорубицин в концентрациях 20 и 40 мкг/мл статистически не отличается от жизнеспособности опухолевых клеток культивируемых отдельно, однако имеют тенденцию к снижению жизнеспособности. Такие результаты объясняются тем фактом, что препарат доксорубицин активирует экспрессию генов цитокинов интерферон альфа (ИФН-α), ИФН-λ и ИЛ-2 в Т-клетках, что приводит к стимуляции иммунных реакций, направленных на уничтожение опухолевых клеток [7]. Опухолевые клетки, находящиеся в ко-культуре и обработанные доксорубицином подвергаются цитотоксическому действию не только непосредственно препарата доксорубицин, но также и иммунных клеток. Таким образом, заявленное техническое решение позволяет более полно оценить влияние противоопухолевых препаратов на межклеточные взаимодействия, и подобрать оптимальные дозы (концентрации) для следующих этапов испытаний.
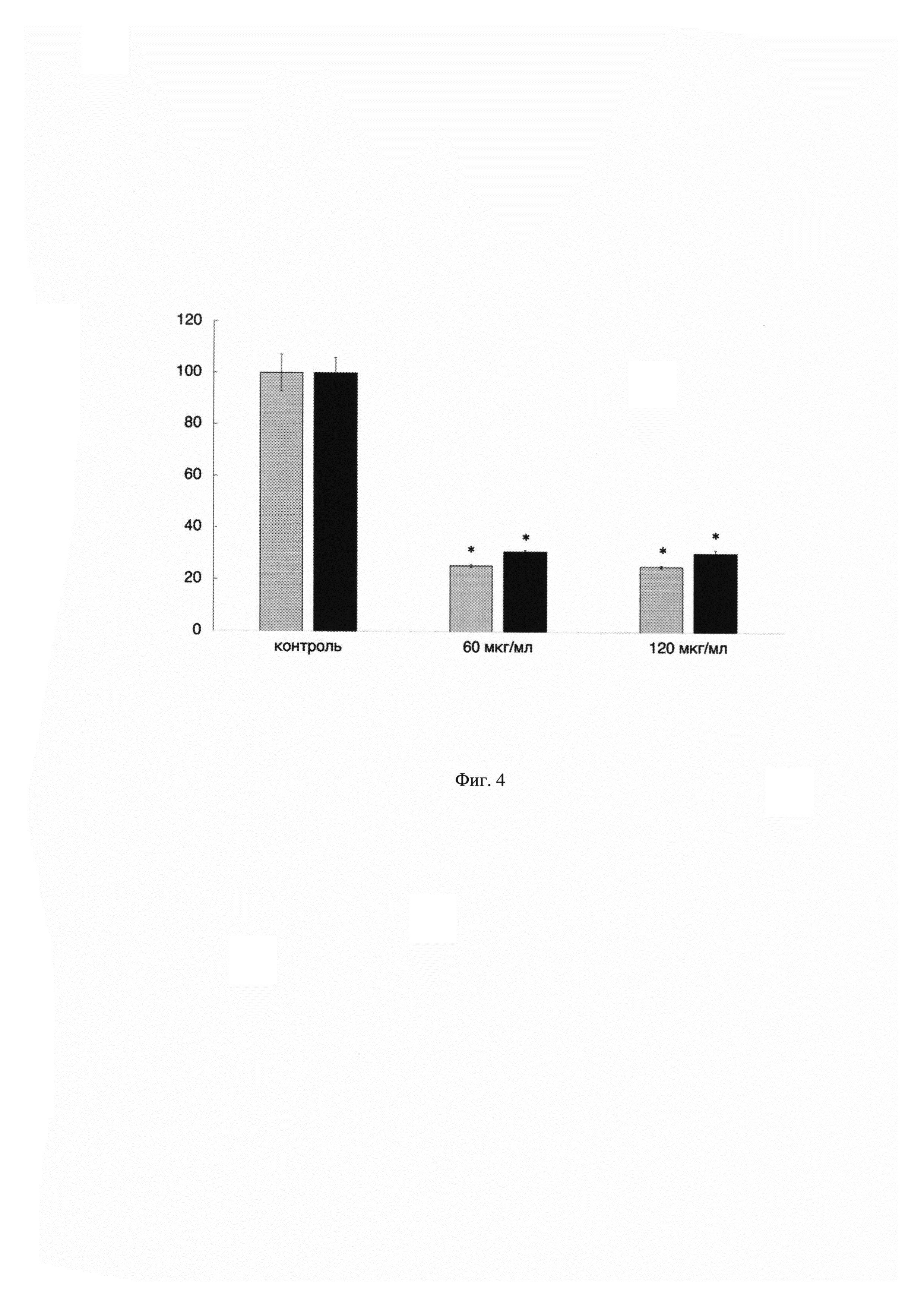
На Фиг. 4 показан график зависимости жизнеспособности клеток ко-культуры (серые столбцы) от концентрации противоопухолевого препарата паклитаксел. По оси X указаны концентрации применяемого препарата, а по оси Y показана жизнеспособность клеток ко-культуры в процентном соотношении по сравнению с контрольными (необработанными препаратом) клетками. В качестве сравнения приведены данные по цитотоксичности противоопухолевого препарата паклитаксел на монокультуру опухолевых клеток (черные столбцы). Данные получены с помощью MTS-теста. Результаты представлены в виде среднего значения ± СО. (n=3). Жизнеспособность контрольных клеток принята за 100%.
Из данных, показанных на Фиг. 4, видно, что жизнеспособность клеток ко-культуры после воздействия препарата паклитаксел в концентрациях 60 и 120 мкг/мл ниже в среднем на 5%, чем опухолевых клеток, культивируемых отдельно. Это объясняется иммуностимулирующим влиянием препарата паклитаксел, которое приводит к активному подавлению жизнеспособности и деления опухолевых клеток в ко-культуре [8]. Таким образом, данные, полученные при помощи заявленного технического решения позволили провести более корректную оценку комплексного влияния противоопухолевых препаратов на опухолевое микроокружение.
Приведенный пример осуществления предполагаемого изобретения показывает его применимость для исследования биологической активности лекарственных препаратов в медицине. Применение предлагаемого способа особо полезно при разработке in vitro тест-систем повышенной эффективности для скрининга новых веществ, обладающих противоопухолевым действием.
Предлагаемое изобретение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не обнаружено средство, которому присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, перечисленным в формуле изобретения, включая характеристику назначения.
Предлагаемый способ удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники не выявлены технические решения, имеющие признаки, совпадающие с существенными признаками заявленного технического решения, и не установлена известность влияния отличительных признаков на указанный технический результат.
Заявленное техническое решение удовлетворяет критерию «промышленная применимость», предъявляемому к изобретениям, т.к. может быть использована в промышленных масштаабах для поиска биологически активных веществ, обладающих противоопухолевой активностью, для последующих исследований для создания препаратов, предназначенных для лечения онкологических заболеваний, посредством использования известных стандартных технических устройств и оборудования.
Использованные источники:
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 году. 2016, МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава России.
2. Shoemaker R.H. The NCI60 human tumour cell line anticancer drug screen. Nat Rev Cancer, 2006. 6(10): p. 813-23.
3. Wang M., et al., Role of tumor microenvironment in tumorigenesis. J Cancer, 2017. 8(5): p. 761-773.
4. Quail D.F. and J.A. Joyce, Microenvironmental regulation of tumor progression and metastasis. Nat Med, 2013. 19(11): p. 1423-37.
5. Hanahan D. and L.M. Coussens, Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell, 2012. 21(3): p. 309-22.
6. Fang, Y. and R.M. Eglen, Three-Dimensional Cell Cultures in Drag Discovery and Development. SLAS Discov, 2017. 22(5): p. 456-472.
7. Bracci, L., et al., Immune-based mechanisms of cytotoxic chemotherapy: implications for the design of novel and rationale-based combined treatments against cancer. Cell Death Differ, 2014. 21(1): p. 15-25.
8. Javeed, A., et al., Paclitaxel and immune system. Eur J Pharm Sci, 2009. 38(4): p. 283-90.
Способ скрининга противоопухолевых препаратов in vitro на многокомпонентной клеточной тест-системе, заключающийся в том, что берут опухолевые, стромальные и иммунные культуры клеток, проводят их ко-культивирование на любом из известных аналогов внеклеточного матрикса с получением многокомпонентной клеточной ко-культуры (тест-системы), к полученной многокомпонентной клеточной ко-культуре добавляют исследуемое вещество, проводят инкубирование полученной многокомпонентной клеточной ко-культуры с исследуемым веществом, определяют противоопухолевую активность исследуемого вещества посредством анализа жизнеспособности многокомпонентной клеточной ко-культуры с использованием известных методов клеточной биологии с получением результатов о наличии либо об отсутствии противоопухолевой активности исследуемого вещества с последующим отбором перспективных веществ с высокой противоопухолевой активностью для дальнейших этапов доклинического скрининга либо отказа от дальнейшего скрининга исследуемого вещества в случае отсутствия у исследуемого вещества выраженной противоопухолевой активности.