Результат интеллектуальной деятельности: НОВОЕ СОЧЕТАНИЕ З-[(3-{ [4-(4-МОРФОЛИНИЛМЕТИЛ)-1Н-ПИРРОЛ-2-ИЛ]МЕТИЛЕН} -2-ОКСО-2,3-ДИГИДРО-1Н-ИНДОЛ-5-ИЛ)МЕТИЛ]-1,3-ТИАЗОЛИДИН-2,4-ДИОНА И ИНГИБИТОРА ТИРОЗИНКИНАЗЫ EGFR
Вид РИД
Изобретение
Настоящее изобретение относится к новому сочетанию 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона формулы (I):
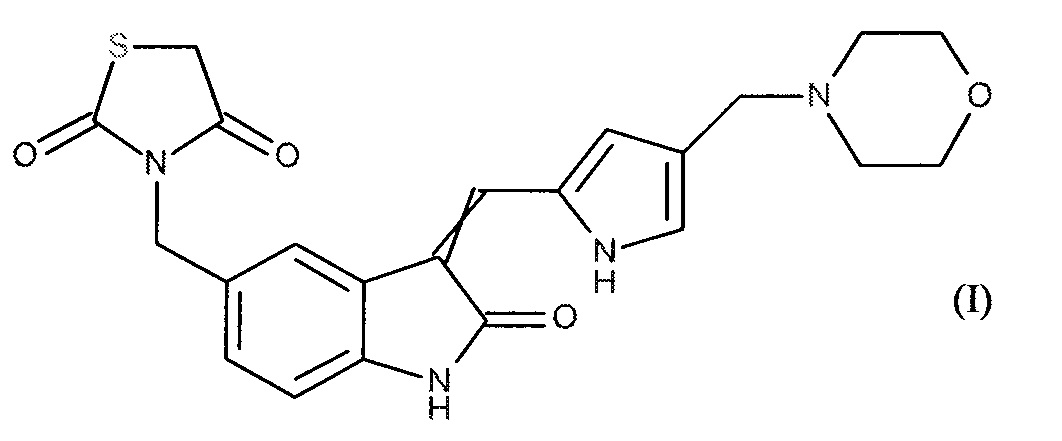
или его Z, или E изомера, и/или его аддитивной соли с фармацевтически приемлемой кислотой или основанием, и ингибитора тирозинкиназы рецептора человеческого эпидермального фактора роста (EGFR) для лечения немелкоклеточного рака легких, в частности, у пациентов, которые являются резистентными к ингибитору тирозинкиназы EGFR.
Немелкоклеточный рак легких на сегодняшний день представляет собой основную причину смерти от рака в мире (Goldstraw, P., D. Ball, J.R. Jett, С.Т. Le, Е. Lim, A.G. Nicholson и F.A. Shepherd, 2011, Немелкоклеточный рак легких: Lancet, том 378, №9804, стр. 1727-1740; Jemal, A., F. Bray, M.M. Center, J. Ferlay, E. Ward и D. Forman, 2011, Глобальная статистика рака: CA Cancer J Clin, том 61, №2, стр. 69-90). На момент диагностики основная часть пациентов имеет развитую патологию с коэффициентом однолетней выживаемости 30% и коэффициентом пятилетней выживаемости 10% (Национальный институт здравоохранения США, Национальный институт рака США http://seer.cancer.gov/archive/csr/1975_2011/results_merged/topic_delaygraphs_overview.pdf; http://www.cancerresearchuk.org/cancer-info/cancerstats/types/lung/survival/lung-cancer-survival-statistics). Активирующие мутации гена EGFR приводят к онкогенной склонности, иными словами, раковые клетки становятся зависимыми от этой аномалии для своего роста и выживания. Такие мутации являются частыми при аденокарциноме легких с 15% случаев у белых пациентов и 40-50% случаев, которые наблюдаются у пациентов азиатского происхождения (Shigematsu, Н. и др., 2005, Клинические и биологические характеристики, ассоциированные с генными мутациями гена рецептора эпидермального фактора роста при раке легких: J Natl Cancer Inst, том 97, №5, стр. 339-346). У пациентов, имеющих мутацию гена EGFR, ингибиторы тирозинкиназы EGFR значительно замедляют прогрессирование заболевания по сравнению с химиотерапией и считаются эталоном лечения. Современные методы лечения на рынке, среди прочих, представляют собой гефитиниб и эрлотиниб для ингибиторов первого поколения и афатиниб для ингибиторов второго поколения, при этом каждое поколение является нацеленным на активные мутации EGFR. К сожалению, большинство пациентов имеют рецидив после нескольких месяцев лечения по причине приобретения других генетических и белковых изменений, которые являются способными вырабатывать резистентность к ингибиторам тирозинкиназы EGFR. Было идентифицировано несколько механизмов устойчивости, и новая мутация рецептора EGFR (Т790М: замещение в положении 790 треонина на метионин), в частности, обнаруживается у большинства пациентов, которые являются резистентными к лечению. В связи с резистентностью к ингибиторам тирозинкиназы EGFR прогноз становится очень неблагоприятным, и пациентам предлагают химиотерапию с низким уровнем эффективности. В соответствии с этим поиск новых терапевтических альтернатив при немелкоклеточном раке легких, в частности, у пациентов, которые являются резистентными к ингибиторам тирозинкиназы EGFR, с целью улучшения выживаемости без прогрессирования, продолжает оставаться актуальным вопросом. В частности, повторная сенсибилизация пациентов, которые являются резистентными к ингибиторам тирозинкиназы EGFR, представляет собой сильную терапевтическую стратегию для исследования. В настоящее время разрабатывается третье поколение ингибиторов тирозинкиназы EGFR для специфического воздействия у пациентов, которые приобрели вторичную мутацию, такую как, например, Т790М, и которые будут восстанавливать активность лечения. Другие альтернативы, воздействующие на пути формирования резистентности, отличные от мутации Т790М, которые вовлекают другие клеточные рецепторы, все еще являются необходимыми и весьма долгожданными для пациентов, и могут, в частности, сочетаться с ингибиторами третьего поколения.
В дальнейшем и, если не указано иное, то "3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион" понимают как "3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион и его Z или E изомеры и/или аддитивные соли с фармацевтически приемлемой кислотой или основанием".
3-[(3-{[4-(4-Морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион представляет собой мощный ингибитор миграции раковых клеток, который может использоваться, в частности, для лечения различных видов рака и, в частности, метастатических солидных опухолей. Это является описанным в патентных заявках WO 2011/015728 и WO 2015/004395.
В соответствии с изобретением было показано, что эффекты 3-{[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил]метил}-1,3-тиазолидин-2,4-диона позволяют устранить резистентность к ингибиторам тирозинкиназы EGFR в животных моделях, которые ранее подвергались обработке пои использовании такого ингибитора.
Эти эффекты позволяют использовать сочетание 3-{[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил]метил}-1,3-тиазолидин-2,4-диона и ингибитора тирозинкиназы EGFR при лечении немелкоклеточного рака легких у пациентов, для которых наблюдали прогрессирование заболевания или рецидив, несмотря на лечение.
В частности, в сочетании в соответствии с изобретением 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион находится в форме Z изомера.
Предпочтительно, когда в сочетании в соответствии с изобретением 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион находится в форме соли, в частности, гидрохлорида или мезилата.
Еще более предпочтительно, когда сочетание в соответствии с изобретением включает мезилат 3-[((3Z)-3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона.
Среди ингибиторов тирозинкиназы EGFR в соответствии с изобретением могут быть упомянуты эрлотиниб, гефитиниб и афатиниб для первого и второго поколения ингибиторов и AZD9291 (озимертиниб) или роцилетиниб для ингибиторов третьего поколения.
В соответствии с преимущественным воплощением ингибитор тирозинкиназы EGFR сочетания в соответствии с изобретением представляет собой N-(3-этинилфенил)-6,7-ди(2-метоксиэтокси)хиназолин-4-амин или эрлотиниб формулы (II):
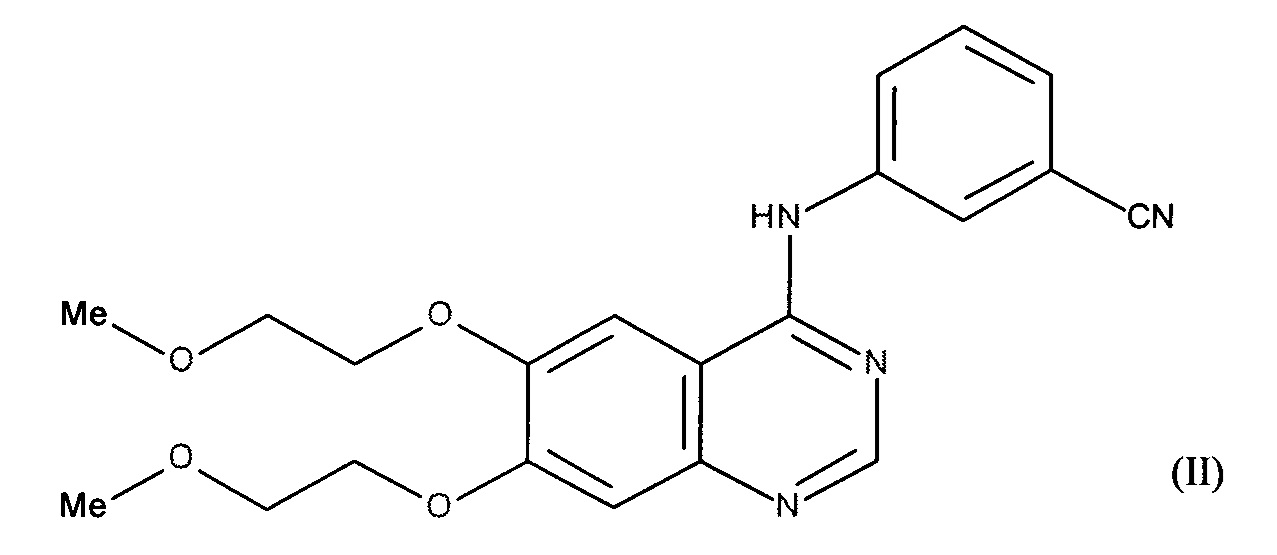
его аддитивную соль с фармацевтически приемлемой кислотой или основанием и, в частности, его гидрохлорид.
В соответствии с другим предпочтительным воплощением ингибитор тирозинкиназы EGFR сочетания в соответствии с изобретением представляет собой N-(3-хлор-4-фтор-фенил)-7-метокси-6-(3-морфолин-4-илпропокси)хиназолин-4-амин или гефитиниб формулы (III):
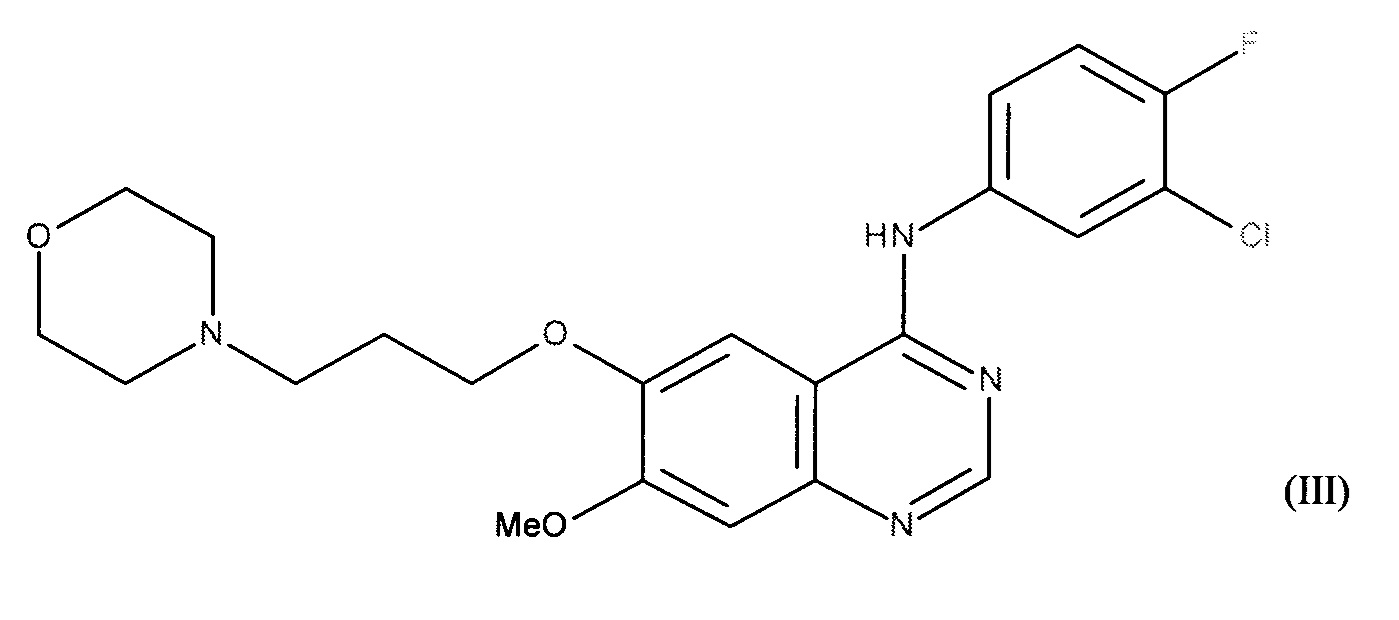
или его аддитивную соль с фармацевтически приемлемой кислотой или основанием.
Предпочтительно, когда сочетание в соответствии с изобретением включает Z изомер 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона или его фармацевтически приемлемую соль, с гефитинибом или его фармацевтически приемлемой солью.
В частности, данное изобретение относится к сочетанию мезилата 3-[((3Z)-3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона и гефитиниба или его фармацевтически приемлемой соли.
Данное изобретение также относится к фармацевтическим композициям, включающим сочетание 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона и ингибитора тирозинкиназы EGFR в комбинации с одним или более фармацевтически приемлемыми наполнителями.
Данное изобретение также относится к применению указанных фармацевтических композиций в лечении немелкоклеточного рака легких, в частности, у пациентов, которые являются резистентными к ингибитору тирозинкиназы EGFR.
Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты, в частности, те, которые пригодны для введения пероральным, парентеральным, внутримышечным и внутривенным, подкожным или чрескожным, назальным, ректальным, лингвальным, окулярным или респираторным путями и, в частности, таблетки, драже, подъязычные таблетки, желатиновые капсулы, глоссеты, капсулы, пастилки, препараты для инъекций, аэрозоли, глазные или назальные капли, суппозитории, кремы, мази, дермальные гели и т.д.
В предпочтительном воплощении 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион вводиться в пероральной форме.
В дополнение к 3-[(3-{[4-(4-морфолинил-метил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диону и ингибитору тирозинкиназы EGFR фармацевтические композиции в соответствии с изобретением включают один или более наполнителей или носителей, выбранных из разбавителей, лубрикантов, связующих агентов, дезинтегрирующих агентов, стабилизаторов, консервантов, абсорбентов, красителей, подсластителей, вкусовых добавок и т.п.
Примеры, которые могут быть упомянуты, при отсутствии каких-либо ограничений, включают:
- для разбавителей: лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу, глицерин;
- для лубрикантов: диоксид кремния, тальк, стеариновую кислоту и ее соли магния и кальция, полиэтиленгликоль;
- для связующих агентов: силикат алюминия и магния, крахмал, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия и поливинилпирролидон;
- для дезинтегрирующих агентов: агар, альгиновую кислоту и ее натриевую соль, шипучие смеси.
Соединения данного сочетания могут быть введены одновременно или последовательно. Соответствующие фармацевтические композиции могут позволять немедленное или замедленное высвобождение активных ингредиентов. Кроме того, соединения в соответствии с сочетанием могут быть введены в виде двух отдельных фармацевтических композиций, каждая из которых содержит один из активных ингредиентов, или в качестве альтернативы, в виде одной фармацевтической композиции, в которой смешаны активные ингредиенты.
Используемая дозировка варьирует в зависимости от пола, возраста и веса пациента, пути введения, от природы рака и любых сопутствующих видов лечения и находится в диапазоне от 300 до 1500 мг эквивалентов свободного основания в сутки, и, в частности, от 500 до 600 мг эквивалентов свободного основания в сутки. Доза ингибитора тирозинкиназы EGFR будет равна той, которая используется при его введении отдельно, или будет меньше. В качестве примера, в случае гефитиниба вводимая доза составляет 250 мг в сутки. Для эрлотиниба она составляет от 25 до 150 мг в сутки.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
1000 таблеток, содержащих 100 мг эквивалентов свободного основания метансульфоната 3-[3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, Z изомера
121 г
|
ПРЕДКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
А. Анализ жизнеспособности клеток на устойчивой к эрлотинибу линии клеток НСС827
Использовали анализ жизнеспособности клеток, который позволяет измерять антипролиферативную способность противоопухолевых соединений. Выбранная клеточная линия представлена линией НСС827, которая представляет собой линию немелкоклеточного рака легких, зависимую от EGFR для своего выживания. Используемый параметр представлял собой IC50, то есть концентрацию продукта, которая ингибирует на 50% пролиферацию клеток по сравнению с необработанными контрольными клетками. Высевали клетки (150 мкл) при соответствующей плотности в ячейки планшетов на 96 ячеек за 2 дня до начала проведения эксперимента. Одна колонка содержала клетки необработанного контроля, представляющие 100% пролиферацию. Остальные инкубировали с исследуемыми продуктами в четырехкратной повторности. Средняя ингибирующая концентрация тирозинкиназы EGFR эрлотиниба для жизнеспособности клеток линии НСС827 составляла 10 нМ. Приобретенная устойчивость к эрлотинибу была связана с хроническим воздействием на линию НСС827 эрлотиниба: клетки подвергались воздействию эрлотиниба в дозе 1 мкМ в культуральной среде до тех пор, пока время удвоения популяции не стабилизируется, то есть, приблизительно в течение 2 месяцев. Средняя ингибирующая концентрация эрлотиниба для жизнеспособности клеток резистентной линии НСС827 после этого была приблизительно в 1000 раз выше при 11,5 мкМ. Устойчивые клетки потом подвергали воздействию гидрохлорида 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона при концентрации 100 нМ в комбинации с повышающимися дозами эрлотиниба. Гидрохлорид 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона сам по себе не оказывал влияния на жизнеспособность. В комбинации средняя ингибирующая концентрация эрлотиниба на устойчивой линии клеток НСС827 возвращается приблизительно к такой же, что и у неустойчивой лини НСС827 при 3,8 нМ.
Этот результат показывает, что 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион является способным восстанавливать чувствительность к ингибитору тирозинкиназы EGFR в линии клеток немелкоклеточного рака легких, которая является резистентной к такому ингибитору.
В. Ингибирование роста устойчивой к эрлотинибу НСС827 опухоли
Линию НСС827, линия клеток немелкоклеточного рака легких, которая является устойчивой к эрлотинибу in vitro, прививали подкожно самкам SCID мышей в количестве 5×106 клеток на мышь. Животные с опухолями распределялись случайным образом в группы из восьми мышей, когда объем опухоли достигал около 200 мм. Ежедневную обработку при использовании соединения А (гидрохлорид 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона) при дозе 50 мг/кг и при использовании эрлотиниба при дозе 12,5 мг/кг осуществляли перорально (носители = ацетат аммония/НЕС ПЭГ300/этанол/вода буферы, соответственно) в течение периода времени 19 дней, как обозначено треугольниками на Фигуре 1 ниже. Объем опухоли измеряли два-три раза в неделю при использовании штангенциркуля. Средние объемы опухолей с межквартильный колебаниями регистрировались на графике.
В конце лечения (день 19) ингибирование роста после обработки с помощью соединений самих по себе составляло 65% для эрлотиниба и 83% для гидрохлорида 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона (соединение А). Когда два соединения использовали в комбинации, то опухоль полностью подвергалась регрессии, и такая регрессия сохранялась в течение периода времени, пока лечение не прекращали, до дня 30. Синергетический эффект, наблюдаемый между двумя продуктами, был статистически значимым в течение периода исследования (p<0,001).
КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ
У пациентов с немелкоклеточным раком легких развивается резистентность к лечению при использовании ингибитора тирозинкиназы EGFR (гефитиниба, эрлотиниба, афатиниба, озимертиниба или роцилетиниба), они больше не являются чувствительными к лечению, и болезнь прогрессирует.
Доказательство концепции исследования представляет собой прогресс для того, чтобы подтвердить результаты, которые наблюдали в предклинических исследованиях, и показать, что 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион является способным восстанавливать чувствительность к ингибитору EGFR, в данном случае к гефитинибу, у пациентов, страдающих от немелкоклеточного рака легких, которые становились резистентными. Пациенты включаются в соответствии с их молекулярным профилем. Это исследование включает в себя фазу I для оценки профиля толерантности и определения рекомендуемой дозы для дальнейшего исследования. Примерно будут включены 20 пациентов. Во время этой фазы пациенты будут подвергаться лечению в 28-дневных циклах при использовании дозы 400, 500 или 600 мг в сутки эквивалентов свободного основания 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона в комбинации с 250 мг в сутки гефитиниба. Лечение будет поддерживаться до достижения прогресса. В конце этой фазы будет начинаться фаза II, задачей которой является оценка эффективности сочетания 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона и гефитиниба. Эта фаза II будет включать приблизительно 150 пациентов. Опухоли будут оцениваться каждые 2 месяца. Пациенты будут подвергаться лечению в 28-дневных циклах при использовании рекомендуемой дозы 3-[(3-{[4-(4-морфолинил-метил)-1Н-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1Н-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона, определенной в фазе I, в комбинации с 250 мг гефитиниба в сутки.
![НОВОЕ СОЧЕТАНИЕ З-[(3-{ [4-(4-МОРФОЛИНИЛМЕТИЛ)-1Н-ПИРРОЛ-2-ИЛ]МЕТИЛЕН} -2-ОКСО-2,3-ДИГИДРО-1Н-ИНДОЛ-5-ИЛ)МЕТИЛ]-1,3-ТИАЗОЛИДИН-2,4-ДИОНА И ИНГИБИТОРА ТИРОЗИНКИНАЗЫ EGFR](https://fips.edrid.ru/images/rid/09/a1/f7/09944f0161403611823d57ac3b62dbff.jpg)
![НОВОЕ СОЧЕТАНИЕ З-[(3-{ [4-(4-МОРФОЛИНИЛМЕТИЛ)-1Н-ПИРРОЛ-2-ИЛ]МЕТИЛЕН} -2-ОКСО-2,3-ДИГИДРО-1Н-ИНДОЛ-5-ИЛ)МЕТИЛ]-1,3-ТИАЗОЛИДИН-2,4-ДИОНА И ИНГИБИТОРА ТИРОЗИНКИНАЗЫ EGFR](https://fips.edrid.ru/images/rid/09/a1/f7/3659c0307815dcaeefcfebfe036255b3.png)
![НОВОЕ СОЧЕТАНИЕ З-[(3-{ [4-(4-МОРФОЛИНИЛМЕТИЛ)-1Н-ПИРРОЛ-2-ИЛ]МЕТИЛЕН} -2-ОКСО-2,3-ДИГИДРО-1Н-ИНДОЛ-5-ИЛ)МЕТИЛ]-1,3-ТИАЗОЛИДИН-2,4-ДИОНА И ИНГИБИТОРА ТИРОЗИНКИНАЗЫ EGFR](https://fips.edrid.ru/images/rid/09/a1/f7/50e490c5627c1b95398329cd82895ec6.jpg)

