Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРИМЕТАЗИДИНА
Вид РИД
Изобретение
Изобретение относится к фармацевтической форме для пролонгированного высвобождения триметазидина и также к ее применению для лечения стенокардии.
Триметазидин, или 1-(2,3,4-триметоксибензил)пиперазин представляет собой соединение, которое, путем поддержания энергетического обмена веществ клетки, подверженной гипоксии или ишемии, позволяет избежать падения внутриклеточного уровня аденозин трифосфата (АТФ). Следовательно, он обеспечивает функционирование ионных насосов и натрий-калий трансмембранных токов и поддерживает клеточный гомеостаз.
Дигидрохлорид триметазидина используется терапевтически для профилактического лечения приступов стенокардии, во время хореоретинальных нарушений, а также для лечения головокружения сосудистого происхождения (головокружение Меньера, шум в ушах).
Описано применение триметазидина терапевтически, в форме фармацевтической композиции с быстрым высвобождением, которую вводят три раза в сутки, в частности в описании изобретения к патенту FR 2490963. В описании изобретения к патенту ЕР 1108424 описана форма с пролонгированным высвобождением, которая предоставляет возможность покрывать полностью 24-часовой период на основании введения два раза в сутки. Эта форма с пролонгированным высвобождением предоставляет возможность получать уровни в плазме крови у людей, которые больше 70 мкг/л после каждого введения, и поддерживать уровни в плазме, которые больше или равны 40 мкг/л перед последующим введением.
Фармацевтические композиции для пролонгированного высвобождения триметазидина резервуарного типа, которые обеспечивают высвобождение активного ингредиента в течение периода 16 часов, были описаны в описании к патенту ЕР 0673649. Эти формы резервуарного типа для однократного суточного введения обладают преимуществом уменьшения пиков уровней в крови, тогда как обеспечивают регулярные и постоянные уровни триметазидина в плазме.
В терапевтическом арсенале, доступном для пациентов, формы для пролонгированного высвобождения триметазидина доказано необходимы для обеспечения соблюдения пациентами инструкций по приему препарата и оптимальной терапевтической защиты для пациента. Формы с пролонгированным высвобождением в соответствии с настоящим изобретением предоставляют возможность, с одной стороны, постепенного и замедленного высвобождения в течение 24 часов при терапевтически эффективной концентрации в плазме триметазидина и, с другой стороны, доступность триметазидина при терапевтически эффективной концентрации в плазме в течение короткого промежутка времени после введения. Под терапевтически эффективной концентрацией в плазме триметазидина подразумевают уровень в плазме больше чем или равный 40 мкг/л, что предоставляет возможность эффективной защиты миокарда. Кроме того, под коротким промежутком времени подразумевают период меньше 4 часов, предпочтительно период меньше 3 часов.
Фармацевтическая композиция в соответствии с изобретением применяется путем перорального введения один раз в сутки и высвобождает триметазидин на всем протяжении 24-часового периода, при этом обеспечивает высокий уровень безопасности по отношению к любому высвобождению "импульсного" типа или прерывистому высвобождению.
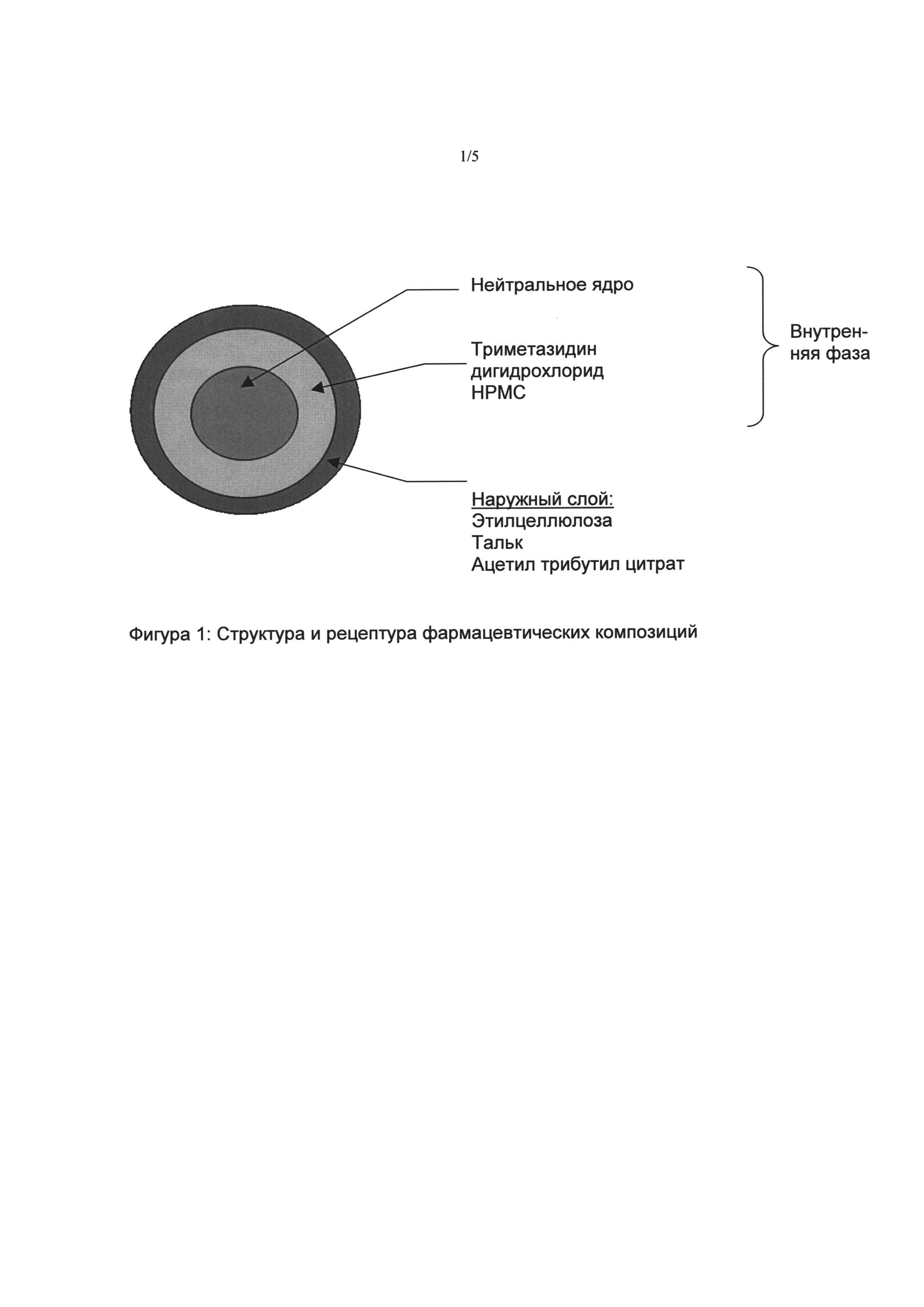
Фармацевтическая композиция в соответствии с настоящим изобретением представляет собой композицию для пролонгированного высвобождения триметазидина, в которой внутренняя фаза содержит триметазидин и наружный слой содержит ретардант и антиагломерирующее средство.
Природа и густота наполнителей в наружном слое предоставляет возможность контролировать высвобождение активного ингредиента триметазидина в зависимости от времени. Более предпочтительно, ретардант, присутствующий в наружном слое, то есть ретардант для диффузии активного ингредиента, задействован в процесс пролонгированного высвобождения.
Из ретардантов, которые могут использоваться в композициях в соответствии с изобретением, могут быть упомянуты, в качестве неограничивающих примеров, этилцеллюлоза (ЕС), этилпроизводные целлюлозы, такие как целлюлоза ацетат, целлюлоза ацетат бутират, целлюлоза ацетат пропионат, целлюлоза ацетат фталат, гидроксипропил метилцеллюлоза ацетат сукцинат и/или полиметакрилаты. Ретарданты помещают в органический раствор или в водную суспензию в ходе их использования в процессе приготовления фармацевтических композиций в соответствии с изобретением. Из ретардантов могут быть отмечены, более специфически, этилцеллюлоза.
Из антиагломерирующих средств в соответствии с изобретением могут быть упомянуты тальк, диоксиды кремния и их производные, стеарат магния, стеариновая кислота и/или фумарил стеарат натрия. Предпочтительным антиагломерирующим средством является тальк.
Кроме ретарданта и антиагломерирующего средства, наружный слой фармацевтической композиции в соответствии с изобретением содержит пластификатор. Из пластификаторов, которые следует рассматривать в соответствии с изобретением, могут быть упомянуты ацетил трибутил цитрат, глицерин триацетат, ацетил триэтил цитрат, ацетил этил цитрат, диэтил себацат, дибутил себацат, этил фталат, дибутил фталат, полиэтилен гликоль (PEG), глицерин и/или пропилен гликоль. Из пластификаторов могут быть упомянуты, более специфически, ацетил трибутил цитрат.
Процентное содержание ретарданта в фармацевтической композиции строго меньше чем 9% общего веса внутренней фазы. Более специфически, процентное содержание ретарданта находится в диапазоне от 5,5% до 8% включительно общего веса внутренней фазы.
Процентное содержание этилцеллюлозы в фармацевтической композиции строго меньше чем 9% общего веса внутренней фазы. Более специфически, процентное содержание этилцеллюлозы находится в диапазоне от 5,5% до 8% включительно общего веса внутренней фазы. Более предпочтительно, процентное содержание этилцеллюлозы составляет 6,5% общего веса внутренней фазы.
Процентное содержание антиагломерирующего средства в фармацевтической композиции находится в диапазоне от 25% до 200% включительно, предпочтительно в диапазоне от 100% до 200% включительно, веса ретарданта.
Процентное содержание талька в качестве антиагломерирующее средство в фармацевтической композиции предпочтительно находится в диапазоне от 100% до 200% включительно веса ретарданта.
Процентное содержание пластификатора в фармацевтической композиции находится в диапазоне от 5% до 50% включительно, предпочтительно в диапазоне от 5% до 30% включительно, веса ретарданта.
Процентное содержание ацетил трибутил цитрата в качестве пластификатора в фармацевтической композиции предпочтительно составляет в диапазоне от 5% до 30% включительно веса ретарданта.
Внутренняя фаза фармацевтических композиций в соответствии с настоящим изобретением содержит активный ингредиент триметазидин и связующее.
В качестве связующих в соответствии с изобретением могут быть упомянуты гидроксипропилметилцеллюлоза (HPMC), гидроксипропилцеллюлоза (HPC), мальтодекстрин, поливинилпирролидон (PVP) и/или микрокристаллическая целлюлоза.
В качестве связующих могут быть упомянуты, более специфически, гидроксипропилметилцеллюлоза, которая обычно используется в области приготовления лекарственных средств. Более специфически, выбранная гидроксипропилметилцеллюлоза имеет низкую вязкость. Предпочтительно, используемая гидроксипропилметилцеллюлоза представляет собой Pharmacoat™ 606.
Предпочтительно, триметазидин и связующее размещены на нейтральном ядре, вследствие этого полностью составляя внутреннюю фазу. Используемые ядра или пеллеты могут быть растворимыми или нерастворимыми в воде. Эти ядра представляют собой шарики сахара или шарики сахарозы/крахмала или микрокристаллической целлюлозы, ровные и защищенные - или нет - фармацевтическим наполнителем, предпочтительно производными целлюлозы. Размеры ядер изменяются от 100 до 1200 мкм, предпочтительно от 300 до 1000 мкм и, еще более предпочтительно, от 710 до 850 мкм; в соответствующих случаях, размер может быть модифицирован, если это является необходимым.
Предпочтительным является триметазидин в композициях в соответствии с изобретением, который представлен в форме дигидрохлоридатриметазидина. Количество дигидрохлоридтриметазидина в фармацевтической композиции предпочтительно составляет 80 мг.
Процентное содержание связующих в фармацевтической композиции находится в диапазоне от 1% от 15% включительно общего веса композиции. Процентное содержание гидроксипропилметилцеллюлозы в качестве связующего в фармацевтической композиции находится в диапазоне от 1% от 15% включительно общего веса композиции.
Процентное содержание нейтральных ядер в фармацевтической композиции находится в диапазоне от 15% от 40% включительно общего веса композиции. Процентное содержание ядер типа сахароза/крахмал находится в диапазоне от 15% до 40% включительно общего веса композиции.
Процентное содержание триметазидина в фармацевтической композиции находится в диапазоне от 35% до 70% общего веса композиции.
Предпочтительно, наружный слой фармацевтических композиций в соответствии с изобретением содержит от 5,5% до 8% этилцеллюлозы относительно общего веса внутренней фазы, от 5% до 30% ацетил трибутил цитрата относительно веса ретардантаи от 100% до 200% талька относительно веса ретарданта.
Аналогичным образом, предпочтительно, внутренняя фаза фармацевтических композиций в соответствии с изобретением содержит от 15% до 40% нейтрального ядра, от 35% до 70% триметазидина и от 1% до 15% гидроксипропил метилцеллюлозы относительно общего веса композиции.
Количество компонентов фармацевтической композиции составляет 80 мг дигидрохлоридтриметазидина, 36,677 мг нейтральных микрогранул, 6,40 мг гидроксипропилметилцеллюлозы, 1,2 мг ацетил трибутил цитрата, 8 мг этилцеллюлозы и 12 мг талька.
В качестве фармацевтических композиций в соответствии с изобретением могут быть упомянуты, более специфически, те, которые пригодны для орального введения, в особенности в форме капсул.
Скорость растворения композиции in vitro в соответствии с изобретением, полученной в соответствии с методологией Европейской Фармакопеи, составляет от 8% до 28% триметазидина, высвобождаемого в течение 4 часов и от 37% до 57% триметазидина, высвобождаемого в течение 8 часов и более чем 75% триметазидина, высвобождаемого в течение 24 часов. Эти кинетики растворения выбирают таким образом, чтобы терапевтически эффективная концентрация в плазме триметазидина, полученная in vivo, пролонгировалась в течение 24 часов после введения фармацевтической композиции.
В соответствии со способом приготовления фармацевтических композиций в соответствии с изобретением, ядра покрывают последовательными слоями активного ингредиента, используя установку для нанесения оболочки, с отверстиями или без них, или аппарат с псевдоожиженным слоем. Активный ингредиент в форме раствора или суспензии, которая является водной или органической, распыляют на ядра и затем высушивают. Минигранулы, приготовленные с помощью одного или другого из процессов, затем покрывают оболочкой, либо в установке для нанесения оболочки, с отверстиями или без них, или в аппарате с псевдоожиженным слоем. Минигранулы покрывают оболочкой с использованием раствора или суспензии ретарданта, который задействован в диффузию активного ингредиента и таким образом контролируют кинетики высвобождения. Покрытые оболочкой минигранулы помещают в капсулы.
В качестве примера может быть упомянут следующий процесс приготовления.
Нейтральные ядра, состоящие из сахарозы/крахмала, покрывают с помощью последовательных слоев раствора гидрохлорида триметазидина, ассоциированного с гидроксипропил метил целлюлозой в системе с псевдоожиженным слоем.
Нанесение покрытия на минигранулы, приготовленные таким способом, осуществляют в аппарате с псевдоожиженным слоем, используя суспензию, состоящую из этилцеллюлозы, ацетил трибутил цитрата и талька.
Покрытие оболочкой минигранулы заполняют в капсулы в присутствии стеарата магния.
Настоящее изобретение также относится к применению фармацевтических композиций в соответствии с изобретением для профилактического лечения стенокардии, во время хореоретинальных нарушений, а также для лечения головокружения сосудистого происхождения.
Примеры, представленные ниже, иллюстрируют, но не ограничивают изобретение.
Пример 1: Фармацевтическая композиция для капсулы, содержащей 80 мг триметазидина
Минигранулы триметазидина покрыты пленкой, содержащей 6,5% этилцеллюлозы.
На фигуре 1 проиллюстрированы структура и рецептура фармацевтической композиции, описанной ниже.
|
Пример 2: Макроскопический внешний вид минигранул
При отсутствии антиагломерирующего средства в наружной фазе фармацевтических композиций было обнаружено, в промышленном масштабе: неправильные минигранулы (фигура 2), многочисленные трещины в оболочке минигранул и даже амальгамирование между минигранулами. Эти дефекты оболочки вызывают существенные модификации кинетики растворения in vitro, в особенности профилей ускоренного растворения.
Если антиагломерирующее средство присутствует в избытке, то минигранулы, полученные в промышленном масштабе, имеют неправильную и хлопьевидную поверхность (фигура 2) вследствие присутствия избытка талька, прилипшего к поверхности минигранул. Эти минигранулы имеют кинетики растворения, которые существенно ускорены и даже кинетики быстрого высвобождения.
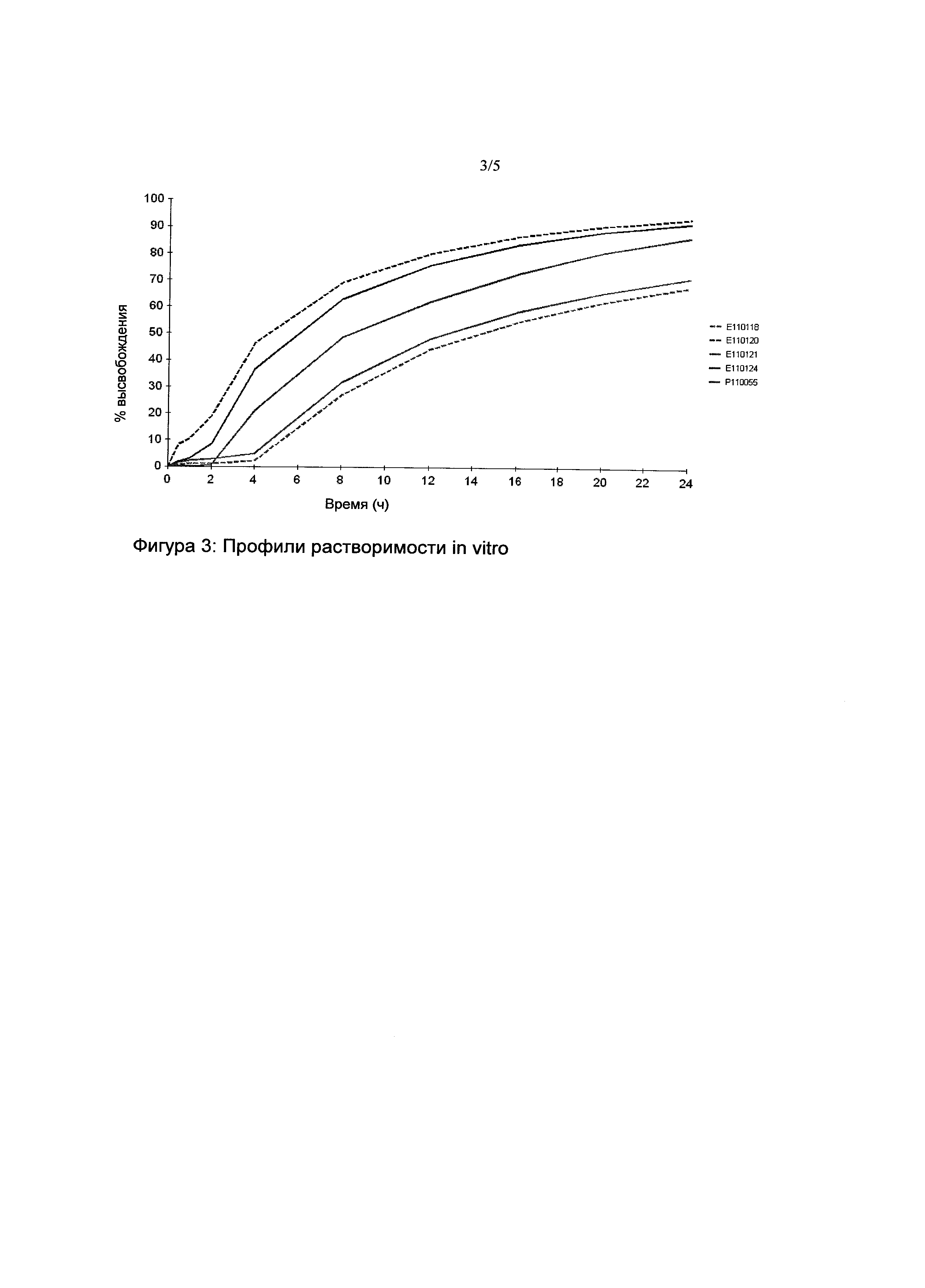
Пример 3: Сравнение кинетик растворения в зависимости от процентного содержания этилцеллюлозы в оболочке
|
Следует отметить, что соотношение оболочки рассчитывали следующим образом: вес наружной фасы/общий вес.
Кроме того, верхние профили растворимости получали, начиная с минигранул, которые не были распределены в капсулы. Профили растворимости партий в промышленном масштабе (минигранулы, инкапсулированные в капсулы) снижались на 4, 3, 2 и 1% в 4, 8, 12 и 16-часовые промежутки, соответственно, относительно профилей растворимости, описанные выше (не заполненные).
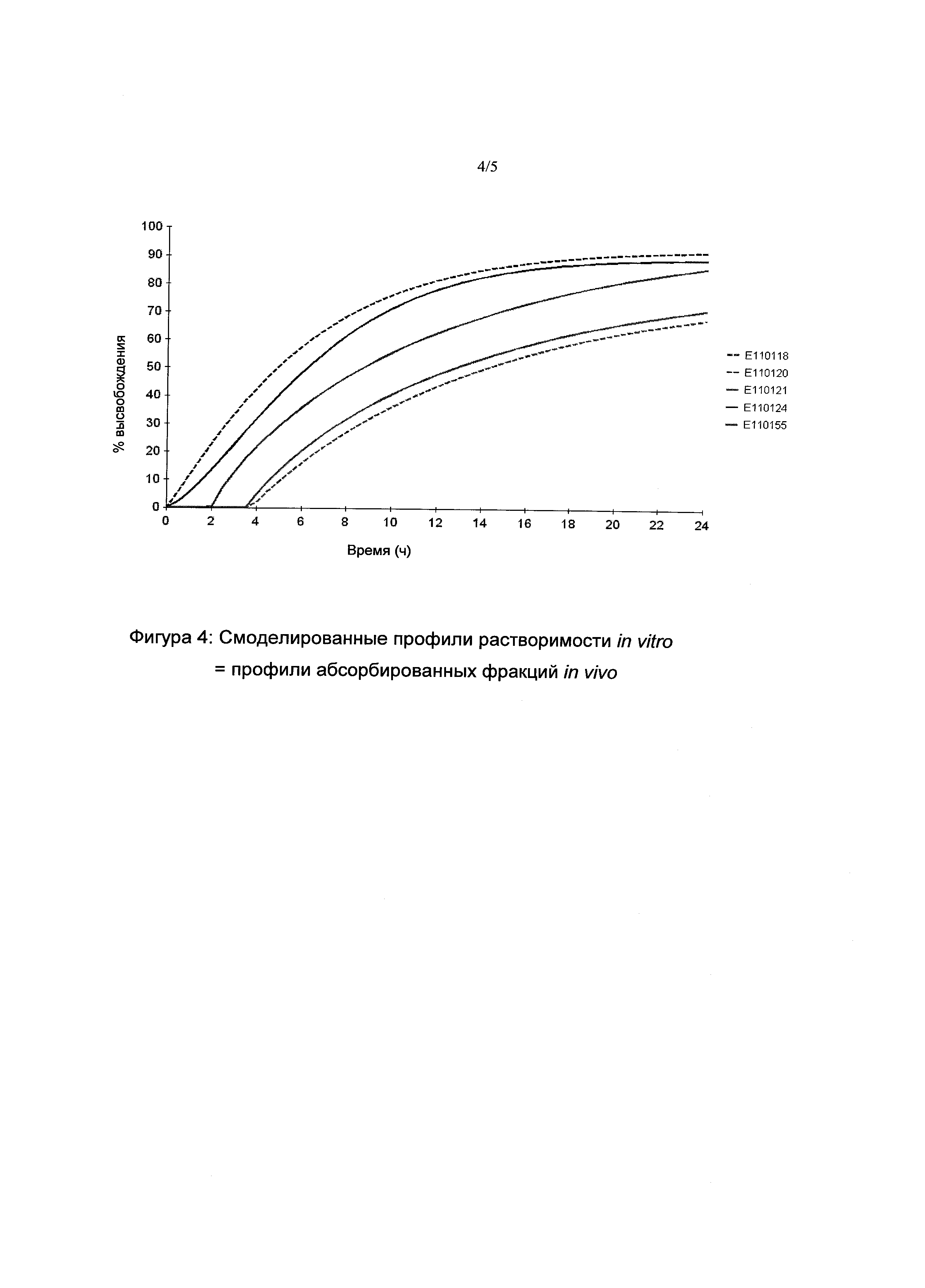
Кинетики растворения in vitro фармацевтических композиций E110118 (EC 10%), E110120 (EC 4,5%), E110121 (EC 9%), и E110124 (EC 5%) (фигура 4) сравнивали с кинетиками высвобождения in vitro эталонной фармацевтической композиции E110055 (EC 6,5%). Профили растворимости сравнивали с помощью коэффициента подобия (f2).
Кинетики растворения композиций E110118 (EC 10%) и E110121 (ЕС 9%), с одной стороны, и E110120 (EC 4,5%) и E110124 (EC 5%), с другой стороны, не были сходными с кинетиками растворения эталонной фармацевтической композиции E110055 (EC 6,5%). Следовательно, процентное содержание ретарданта в фармацевтической композиции являлось, с одной стороны, строго меньше чем 9% и, с другой стороны, строго больше 5%.
Два профиля растворимости рассматривали как сходные, если значение (f2) было больше или равно 50. Расчет коэффициента подобия (f2) осуществляли согласно директивам EMA и FDA для сравнения двух профилей растворимости и для возможности принятия решения, являются ли профили растворимости одинаковыми.
Коэффициент подобия (f2) имеет следующую формулу:
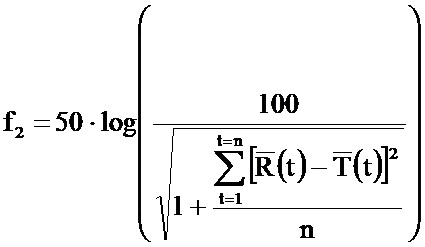
где f2 представляет собой коэффициент подобия, n представляет собой количество нормализованных точек, R(t) представляет собой среднее процентное содержание активного компонента, растворенного из эталонной фармацевтической композиции E110055 и T(t) представляет собой среднее процентное содержание активного компонента, растворенного из фармацевтической композиции E110118 (EC 10%), E110120 (EC 4,5%), E110121 (EC 9%), и E110124 (EC 5%). Нормализованные точки были по меньшей мере в t=8 часов, t=12 часов и t=16 часов.
Оцениваемые минигранулы, заполненные в капсулы, имели различную рецептуру; эти препараты чрезвычайно изменялись относительно количества этилцеллюлозы и антиагломерирующего средства.
Наблюдаемые профили растворимости фармацевтических композиций in vitro E110118 (EC 10%), E110120 (EC 4,5%), E110121 (EC 9%), и E110124 (EC 5%) (фигура 3) моделировали путем применения закона Вейбулла к каждой из них (фигура 4). Закон Вейбулла является особенно ценным приближением, представляющим возможность предсказать непрерывно профили растворимости in vitro из наблюдаемых профилей растворимости in vitro.
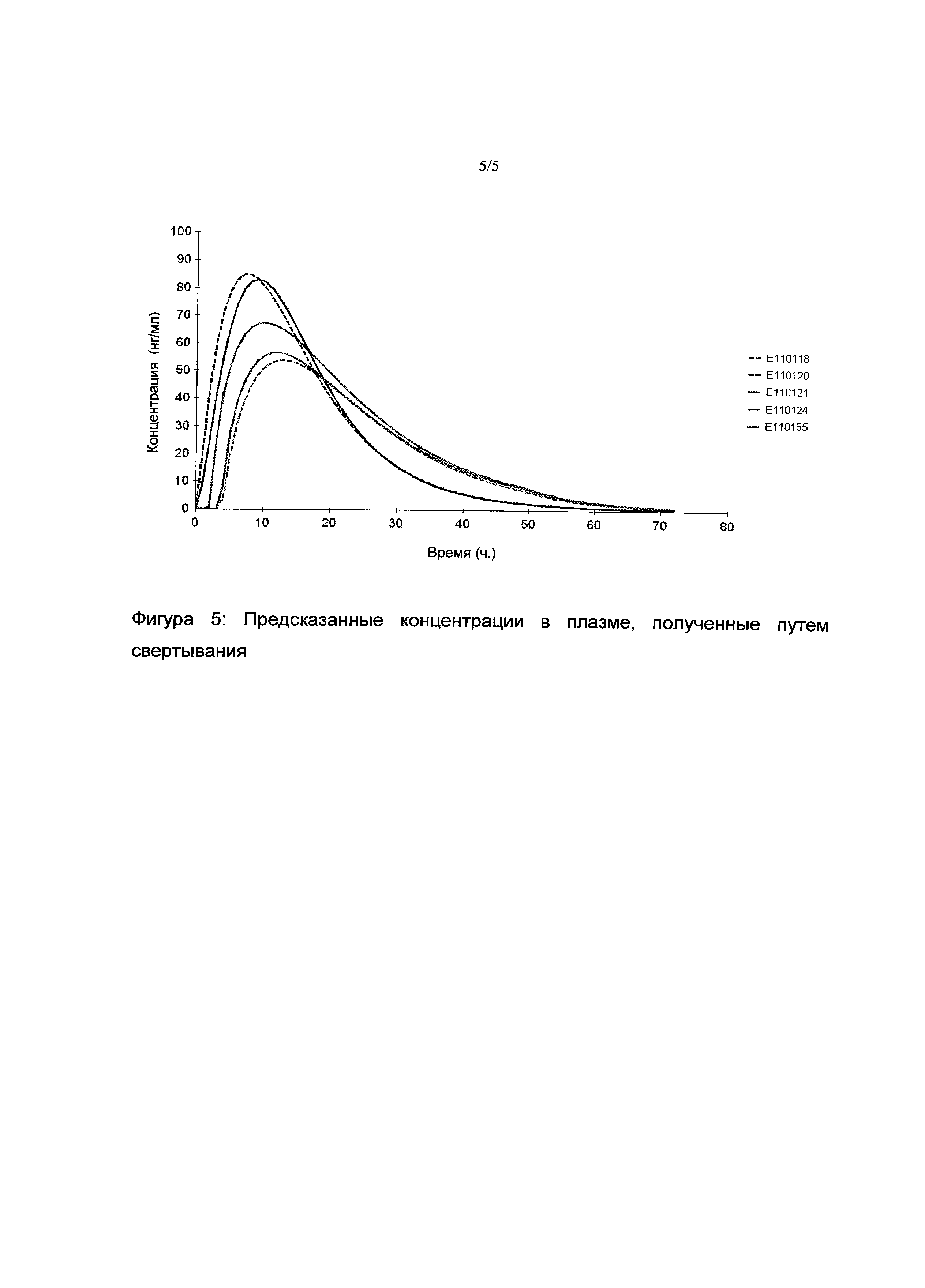
Корреляцию vitro-vivo, равная 1, предлагали в качестве гипотезы; следовательно, профили фракций, абсорбированных in vivo (фигура 4) в точности соответствовали смоделированным профилям растворимости vitro. Затем осуществляли стадию свертывания для предсказания фармакокинетических профилей различных фармацевтических композиций. Стадию свертывания (функция Cp(t)) определяли следующим образом: Cp(t)=I(t)×P(t)
где I(t) представляет собой функцию ввода и P(t) представляет собой диспозиционную функцию.
Функция ввода представляет фракции, абсорбированные in vivo в зависимости от времени, и диспозиционная функция представляет собой полиэкспоненциальное уравнение фармакокинетик фармацевтической композиции для пролонгированного высвобождения триметазидина, полученное в исследовании SKH-6790-005-FRA. Предсказанные средние фармакокинетические профили представлены на фигуре 5.
Используя в качестве исходные указанные профили в плазме, полученные путем свертывания, фармакокинетические параметры AUC и Cmax, где AUC представляет собой экспозицию лекарственного средства и Cmax максимальную концентрацию.
|
|
AUC фармацевтической композиции E110055 (ЕС 6,5%) представляет собой наибольшую из фармацевтических композиций, оцененных выше, и воздействие на пациента триметазидина существенно улучшается.
Кроме того, фармакокинетические профили предоставляют возможность определить эффективность времени защиты миокарда леченых пациентов или времени, в течение которого указанный пациент охватывается терапевтически эффективной концентрацией в плазме (40 мкг/л). Это терапевтическое времени защиты составляет по меньшей мере 22 часов для композиции E110155 (EC 6,5%), в то время как оно составляет только 16 часов для композиции E110118 (EC 10%). Терапевтическое время защиты улучшено, даже если процент ретарданта, который отвечает за пролонгированное высвобождение в терапевтической композиции, уменьшен с 10% до 6,5%.