Результат интеллектуальной деятельности: СПОСОБ СОРБЦИОННО-ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ ТАКРОЛИМУСА
Вид РИД
Изобретение
Изобретение относится к области сорбционно-хроматографических процессов и может быть использовано для выделения и очистки такролимуса.
Такролимус (23-членный макроциклический поликетид (C44H69NO12, М.в. - 804.018) относится к классу природных макролидов - небольших органических молекул с циклической структурой углеродных атомов. Такролимус наряду с другими известными макролидными антибиотиками: рапамицином (сиролимус), аскомицином (иммуномицин) и их производными подавляет иммунный ответ in vivo, также как in vitro. Такролимус используют в качестве активного вещества для приготовления лекарственных препаратов, которые востребованы в медицине, например, в хирургической практике для предотвращения отторжения органов, в терапии атипичных дерматитов, при лечении гемолитической болезни новорожденных, аутоиммунных болезней: ревматоидного артрита, красной волчанки.
Такролимус может быть получен методом микробиологического синтеза.
Например, известен способ микробиологического синтеза такролимуса с участием клеток микроорганизмов рода Streptomyces, способного к биосинтезу такролимуса в водной питательной среде, содержащей один или более источников углерода, азота, ионов металлов в виде растворимых солей, в частности соли MnSO4, с дробной подачей источника углерода в течение продуктивной стадии, при этом среда содержала рамнозу в качестве дополнительного источника углерода, и в присутствии и сорбента амберлит XAD при рН среды 7.0-7.5, 25°С-35°С (RU 2495937, 2013). Изобретение позволяет обеспечить выход такролимуса до 980 мг/л.
Однако при производстве такролимуса известными способами наряду с основным продуктом синтезируются и его аналоги: аскомицин, дигидротакролимус и другие примесные компоненты, что делает актуальной задачу обеспечения высокой чистоты синтезируемого такролимуса и, соответственно, разработки способов эффективного выделения и очистки целевого продукта.
Отделение упомянутых примесей стандартными методами, такими, как кристаллизация затруднено в связи с близкой структурой примесных соединений. Поэтому в ряде технических решений предлагается перед кристаллизацией экстракт биомассы подвергать очистке колоночной хроматографией на силикагеле, а отделение аналогов от такролимуса проводить методом высокоэффективной жидкостной хроматографии (ВЭЖХ) или с использованием сорбентов, содержащих ионы серебра.
Например, предложен способ разделения такролимуса и его аналогов на полимерных сорбентах с использованием в качестве элюента смесей ацетонитрила и воды (US 8362238, 2013).
Недостатком данного метода разделения является низкая селективность используемого сорбента, из-за чего последующую стадию кристаллизации необходимо проводить дважды, что снижает выход продукта. Кроме того, наличие воды в элюенте приводит к изомеризации такролимуса, что также снижает выход целевого продукта.
В US 6,881,341, 2005 предложено использовать двухступенчатую колоночную хроматографию, включающую адсорбцию смеси, содержащей такролимус, на неионогенном сорбенте и элюирование водно-органическими растворами, содержащими ионы серебра. Следующий этап заключается в хроматографической очистке целевой фракции, полученной на предыдущем этапе, с использованием в качестве сорбента основного оксида алюминия, а в качестве элюента - смеси органических растворителей.
Однако использование воды в элюентах вызывает изомеризацию такролимуса и, как следствие, снижение выхода целевого компонента. Кроме того, использование элюента с ионами серебра требует дополнительной операции удаления серебра.
В US 20080000834, 2008 предложен способ разделения такролимуса и его аналогов на химически модифицированном силикагеле, содержащем привитые цианопропильные группы с нанесенными ионами серебра. В качестве элюентов используют смесь ацетона и гексана.
Недостатком способа является низкая производительность (0,3 мг такролимуса на 1 мл сорбента в час), а также десорбция серебра с поверхности сорбента, что требует его последующего удаления.
Наиболее близким по технической сущности и достигаемому результату является способ сорбционно-хроматографического выделения и очистки такролимуса, предусматривающий использование катеонитов с ароматическим лигандом бензолсульфокислоты, импрегнированных ионами серебра. В качестве элюента в способе предлагается использовать ацетон или смесь этилацетата и метанола. Такой подход позволяет увеличить нагрузку до 10 мг такролимуса на 1 мл сорбента и производительность - до 2,5 мг такролимуса на 1 мл сорбента в час (US 6492513, 2002).
Согласно представленным примерам, способ по US 6492513 осуществляют следующим образом.
Культуральную среду с мицелием в количестве 3000 литров фильтруют через 50 кг кизельгура. Дополнительно мицелий обрабатывают 1000 литрами ацетона для полного извлечения целевого вещества. Полученный экстракт в количестве 1000 литров смешивают с фильтратом (2700 литров) и пропускают через колонну объемом 200 литров, заполненную неионогенным сорбентом "DiaionHP-20" (Mitsubishi Chemical Corporation, Япония). Колонну промывают 600 литрами 50% ацетона в воде и элюируют целевое вещество 75% водным ацетоном. Полученную фракцию упаривают на роторном испарителе до объема в 40 литров и из полученного концентрата двукратной обработкой 40 литрами этилацетата экстрагируют целевой компонент. Экстракт концентрируют на роторном испарителе до маслообразного состояния, растворяют в смеси 1:1 гексан-этилацетат и наносят на колонну объемом 70 литров, заполненную силикагелем (Merck, 63-200 мкм) и уравновешенную смесью гексан-этилацетат 1:1. Элюирование проводят по следующей схеме:
Гексан-этилацетат 1:1 - 420 литров
Гексан-этилацетат 1:2 - 420 литров
Этилацетат - 210 литров
Ацетон - 210 литров.
Далее целевую фракцию собирают в количестве 490 - 840 литров, упаривают до маслообразного состояния и растворяют в ацетоне до концентрации 50 мг/мл. Полученный раствор подвергают хроматографии на серебросодержащем сульфокатионите. В результате получают целевой компонент чистотой 92,7% с содержанием аскомицина на уровне 0,11%. Примеси дигидротакролимуса в конечном продукте обнаружено не было.
Недостатком известного способа, выбранного за прототип, является невысокая селективность используемого сорбента, обусловленная влиянием специфической сорбции на ароматическом лиганде, что снижает выход целевого продукта и производительность процесса в целом.
Задачей настоящего изобретения является разработка способа выделения и очистки такролимуса из органического раствора, в частности из смеси, полученной после биосинтеза такролимуса.
Техническим результатам является увеличение выхода высокочистого целевого продукта и повышение производительности процесса за счет подбора эффективных сорбционных материалов, сульфокатионитов и элюентов, используемых в способе.
Поставленная задача решается описываемым способом сорбционно-хроматографического выделения и очистки такролимуса из смеси, содержащей такролимус и его аналоги в органическом растворителе, включающим сорбционное выделение продукта путем пропускания смеси через полярный сорбент, выбранный из силикагеля или полиметилметакрилата, промывку сорбента, его элюирование с объединением фракций элюата, содержащих целевое вещество, упаривание упомянутого элюата, его растворение в ацетоне, последующую хроматографическую очистку полученного раствора на колонке, заполненной сульфокатионитом, содержащем ионы серебра, связанные с иммобилизованной на поверхности носителя сульфогруппой, выбранным из силикагеля с иммобилизованными пропилсульфогруппами или силикагеля с иммобилизованными группами формулы: -O-Si-(CH2)3-O-CH2-CH(OH)-CH2-SO3H, при фракционном элюировании колонки с сульфокатионитом безводным ацетоном или безводной смесью ацетонитрила и ацетона или последовательно вначале безводным ацетоном, затем безводной смесью ацетонитрила и ацетона, упаривание досуха фракций элюата, содержащих такролимус, и кристаллизацию такролимуса.
На стадии сорбционного выделения используют силикагель, предпочтительно, уравновешенный в толуоле с последующей промывкой изооктаном и элюированием смесями изооктан-ацетон.
На стадии сорбционного выделения используют сорбент на основе полиметилметакрилата, предпочтительно, уравновешенный в толуоле с последующим элюированием смесью толуол-ацетон.
Преимущественно, на стадии хроматографической очистки при последовательном элюировании с сульфокатионита через колонку пропускают ацетон объемом, равным 1-2 объемам колонки, а затем смесь ацетонитрила с ацетоном, взятую в объемном отношении от 1:20 до до 1:1, соответственно, в объеме, равном 2-4 объемам колонки.
В качестве исходной смеси, содержащей такролимус и его аналоги в органическом растворителе, преимущественно, используют экстракт продукта биосинтеза такролимуса, проведенного в присутствии сорбента на основе бромированного стирол-дивинилбензола.
В объеме приведенной выше совокупности признаков достигается заявленный технический результат по следующим причинам.
Предложенные для реализации способа сульфокатиониты с ионами серебра содержат привитые на поверхность полярного носителя указанные нами алкилсульфогруппы вместо бензолсульфогрупп по прототипу, что позволяет повысить селективность разделения за счет отсутствия специфической сорбции на ароматическом лиганде. При этом обеспечивается возможность использовать элюенты, не содержащие воду, что, в свою очередь, позволяет избежать как изомеризации такролимуса при элюировании, так и наличия ионов серебра в элюате.
В целом по сравнению с прототипом повышается выход целевого продукта на 20-30%, в несколько раз увеличивается производительность процесса, а также повышается чистота целевого продукта с 92-93% по прототипу до 95-97% по заявленному способу.
Ниже приведены примеры реализации изобретения, не ограничивающие объем изобретения, а иллюстрирующие возможность реализации способа с достижением указанного технического результата. Кроме того, изобретение иллюстрируется фиг. 1-4.
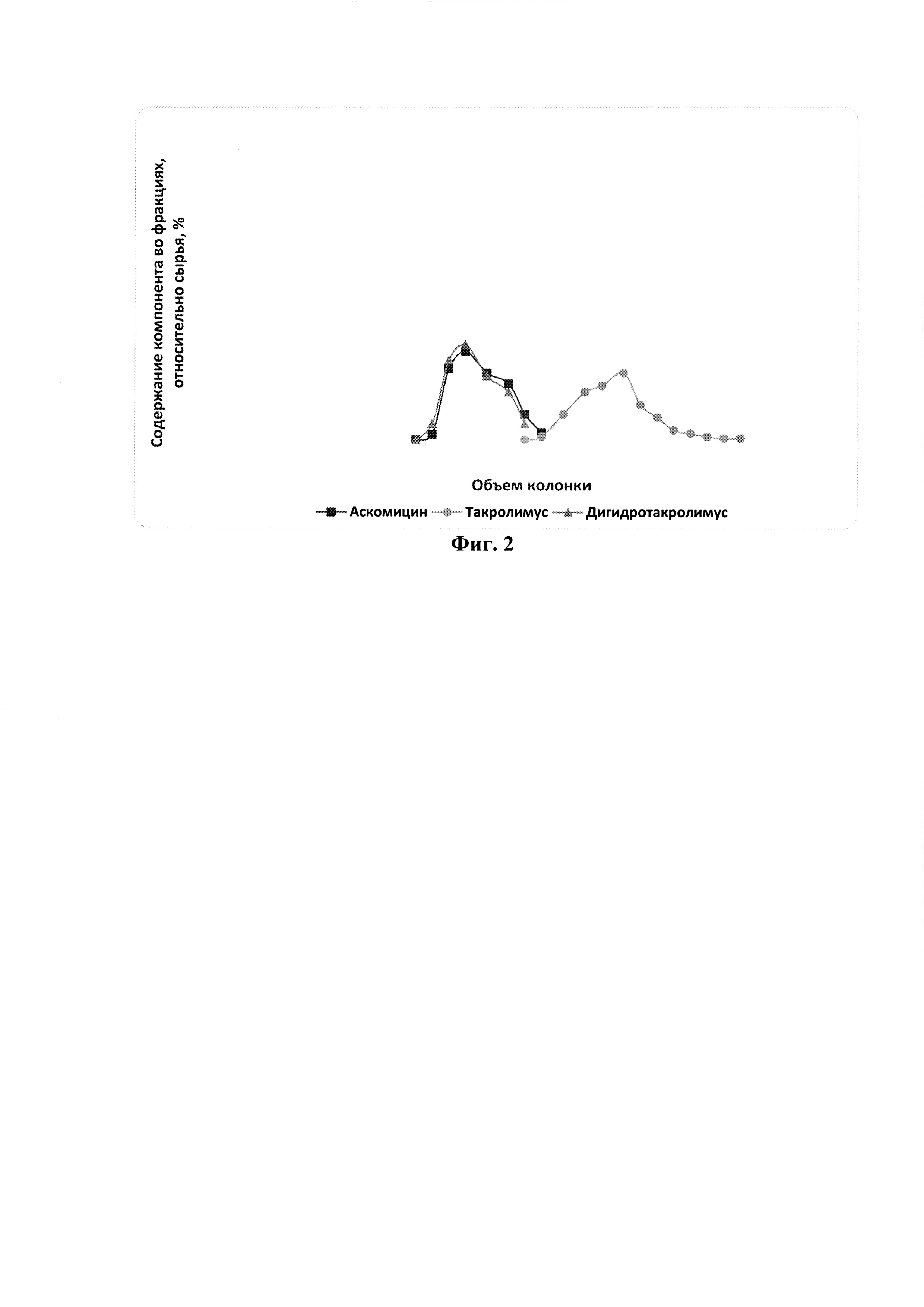
На фиг. 1 представлена хроматограмма препаративного разделения такролимуса и его аналогов на сорбенте на основе силикагеля (50 мкм) с привитыми сульфопропильными группами в Ag+ форме по примеру 1.
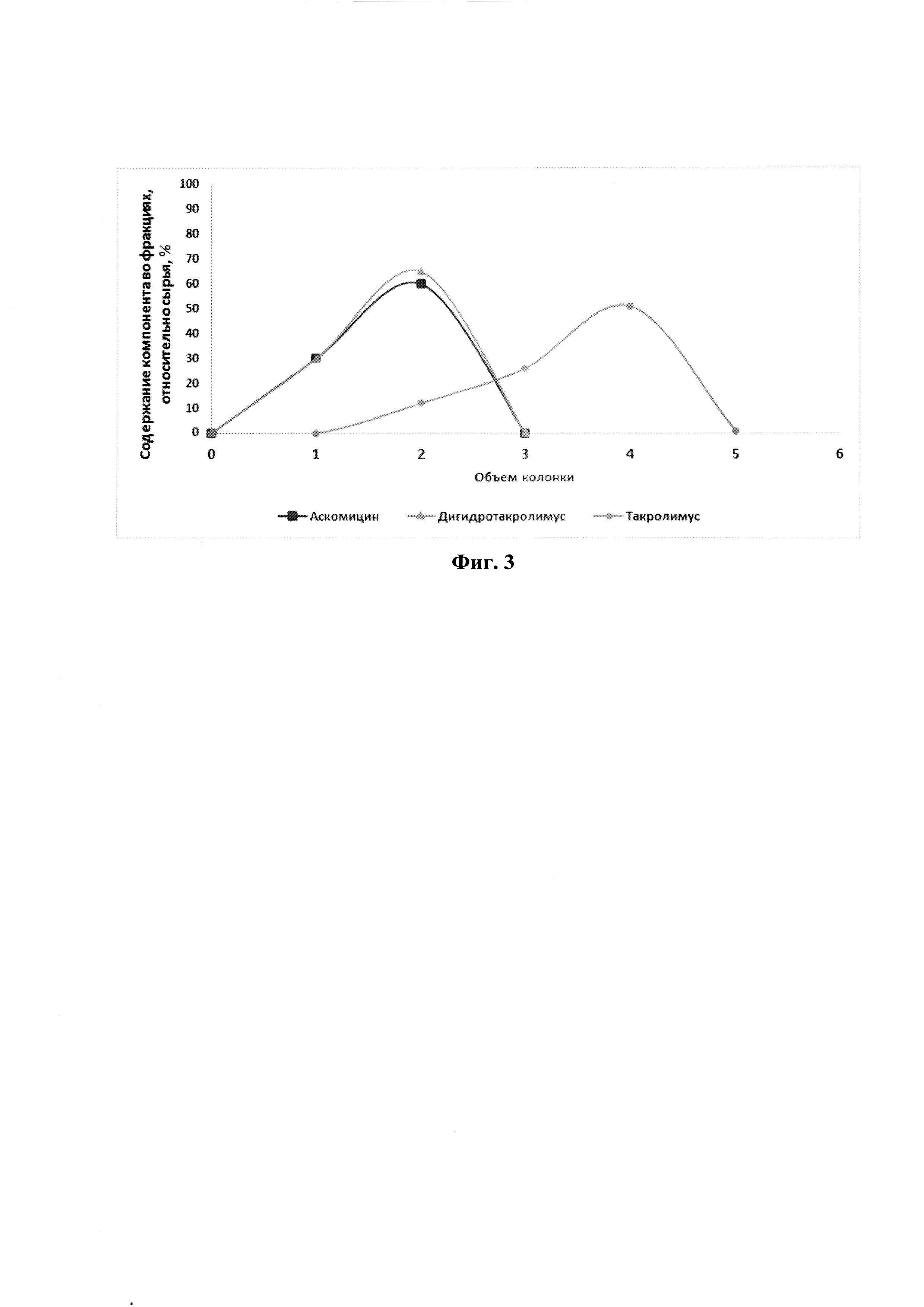
На фиг. 2 представлена хроматограмма препаративного разделения такролимуса и его аналогов на сорбенте на основе силикагеле (50 мкм) с привитыми сульфопропильными группами в Ag+ форме по примеру 2.
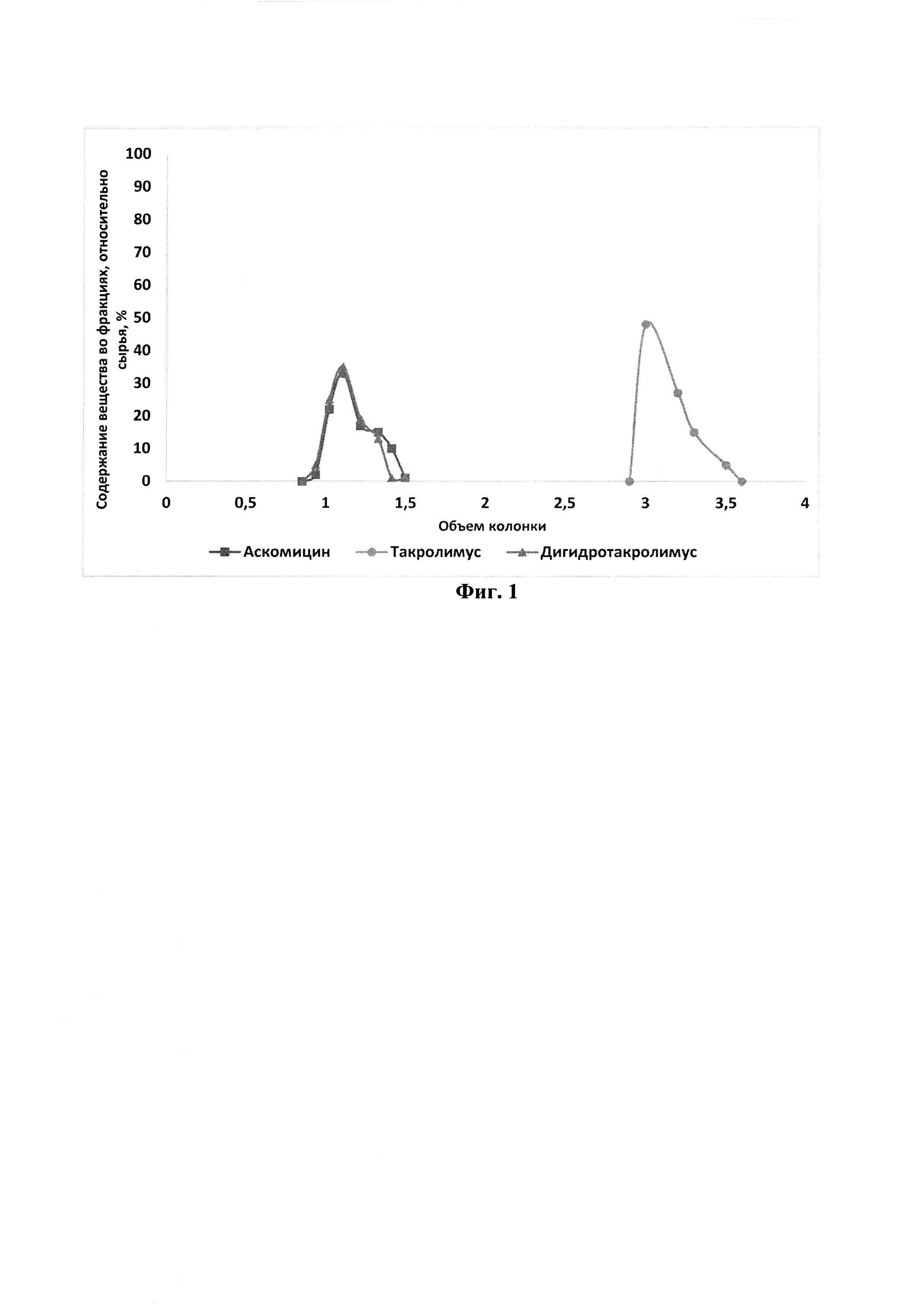
На фиг. 3 представлена хроматограмма препаративного разделения такролимуса и его аналогов на сорбенте на основе силикагеля (50 мкм) с привитыми сульфопропильными группами в Ag+ форме по примеру 3.
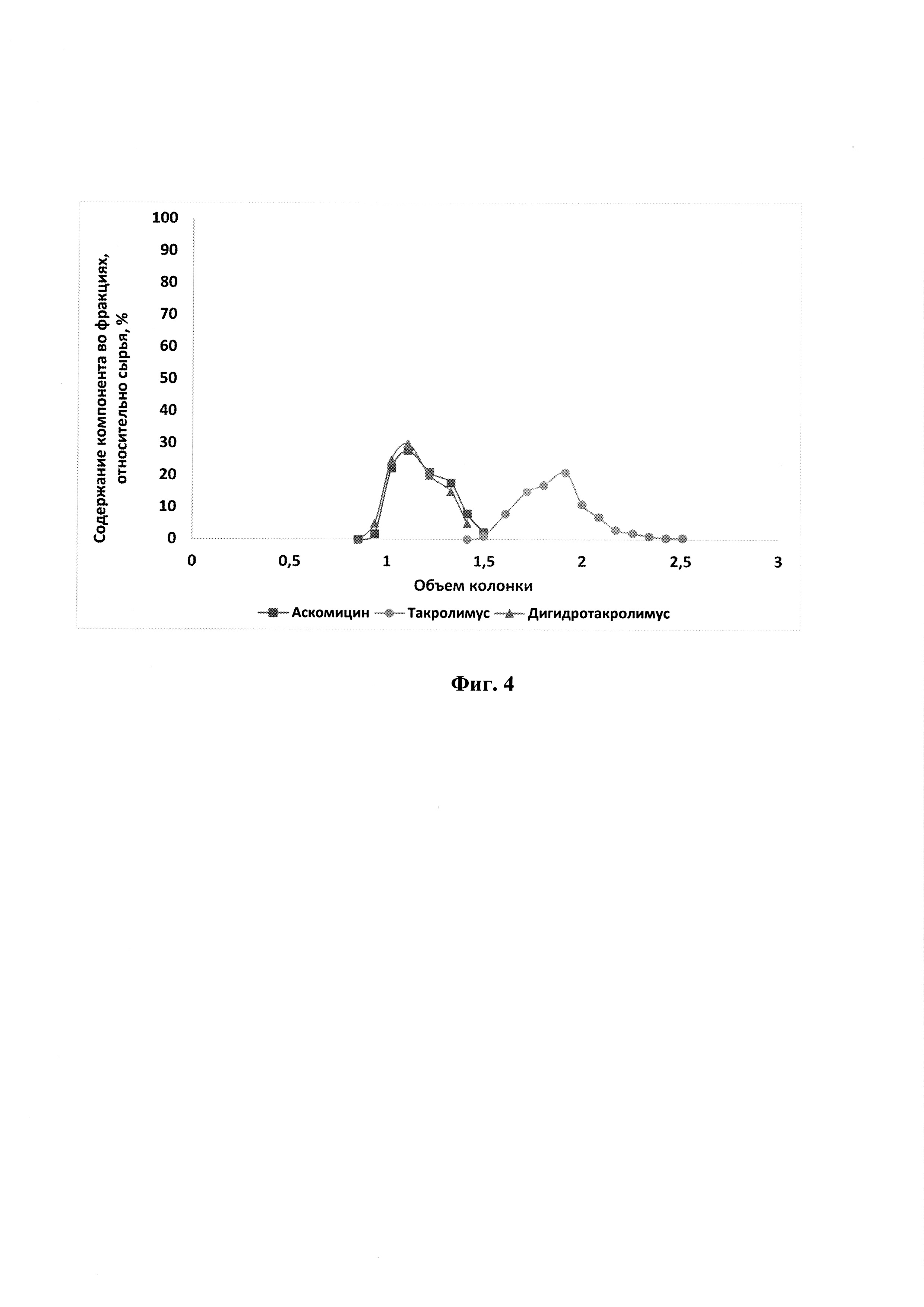
На фиг. 4 представлена хроматограмма препаративного разделения такролимуса и его аналогов на сорбенте на основе силикагеля (63-200 мкм) с привитыми -O-Si-(CH2)3-O-CH2-CH(OH)-CH2-SO3H группами в Ag+ форме по примеру 4.
Предварительно целесообразно представить сведения о варианте получения исходного сырья, содержащего такролимус и его аналоги в органическом растворителе.
В частности, исходная смесь для реализации способа получена нами известным методом биосинтеза (RU 2495937), который включает следующие стадии:
Поддержание культуры штамма Streptomyces tsukubaensis ВКМ Ас-2318Д осуществляют на среде состава, г/л: растворимый крахмал-10, дрожжевой экстракт-4, солодовый экстракт-10, агар-20, рН до автоклавирования 6.8-7.0. Рост колоний на чашках Петри с агаризованной средой проводят при 28-30°С в течение 10-14 суток.
Приготовление первого инокулята. Смыв культуры (споры и мицелий) с поверхности скошенной агаризованной среды в 2 мл стерильной воды вносят в колбу объемом 750 мл с 50 мл жидкой среды состава, г/л: растворимый крахмал («Sigma», США)-40, глюкоза-5, дрожжевой экстракт («Helicon», РФ)-10, кукурузный экстракт лиофилизованный («Fluka», США)-10, сульфата марганца (0.05 г/л), СаСО3-3, рН до автоклавирования 7.0-7.2 и инкубируют и при 30°С на роторной качалке при 200 об/мин в течение 44-48 часов.
Приготовление второго инокулята. Второй инокулят выращивают в пяти колбах с 50 мл жидкой среды указанного выше состава в аналогичных условиях в течение 24 часов, используя для засева каждой из пяти колб 5 мл выросшего первого инокулята (10%). 24-часовой второй инокулят объединяют в стерильной колбе с нижним отводом в асептических условиях и используют для засева 5-ти литрового ферментера.
Биосинтез такролимуса проводят растущей культурой в ферментере объемом 10 л с 5 л продуктивной среды состава, г/л: растворимый крахмал («Sigma», США)-75.0, глицерин-5.0, кукурузный экстракт лиофилизированный («Fluka», США)-16.6, сухие дрожжи («Саф-Момент», РФ)-12.5, СаСО3-3.0, сульфат марганца-0.05, бромированный стирол-дивинилбензольный сорбент марки SP-207 («Mitsubishi», Япония)-40.0, пеногаситель-0.04%, рН до автоклавирования 6.8-7.0. После автоклавирования среды в ферментере перед засевом вносят стерилизуемые отдельно растворы глюкозы и рамнозы. Концентрация глюкозы в среде составляла 5 г/л, рамнозы - 20 г/л. Инокулят вносят в объеме 5% от объема продуктивной среды в аппарате.
На 3-и сутки в ферментер вносят стерильный раствор лизина. На 4-5-6-7 сутки биосинтеза из колбы с нижним отводом в среду вносят стерильный раствор крахмала. Биосинтез осуществляют при 25°С в течение 10 суток. Режим ферментации основан на поддержании уровня растворенного кислорода с первых по четвертые сутки культивирования в интервале значений 40-50%, с пятых суток до окончания процесса биосинтеза уровень растворенного кислорода снижают до 30-35%, рН поддерживают в интервале 6.5-7.0 первые двое суток, затем - в интервале 7.3-7.8. Титр такролимуса по окончании процесса составил 530-640 мг/л. Проводят отделение сорбента от мицелия путем отмучивания в воде и взвешенный мицелий удаляют вакуумным насосом.
Затем проводят экстракцию такролимуса с сорбента водно-ацетоновой смесью. Для этого сорбент с такролимусом в количестве 160 грамм помещают на фильтр Шотта, промывают 1000 мл 45% раствора ацетона в воде и десорбируют целевой компонент 1000 мл 75% раствора ацетона в воде. Фракции, содержащие такролимус, объединяют и упаривают на роторном испарителе до объема 500 мл. К образовавшемуся маслянистому продукту добавляют толуол для экстракции в количестве 500 мл и получившуюся двухфазную смесь разделяют. Верхние толуольные слои объединяют и концентрируют на роторном испарителе.
В результате получен темно-бордовый экстракт объемом 425 мл, с содержанием такролимуса 5,2 мг/мл и чистотой 75% (по ВЭЖХ), который используют в качестве сырья для выделения и очистки такролимуса заявленным способом.
Пример 1.
А, Стадия сорбционной очистки
Полученный толуольный экстракт в количестве 37 мл (191 мг такролимуса) наносили на колонку, заполненную 20 мл силикагеля и уравновешенную в толуоле с использованием в качестве элюента смеси изооктана с ацетоном в соотношении 9:1 (80 мл), 7:3 (80 мл), 1:1 (60 мл) Нагрузка составляет 9,5 мг такролимуса на 1 мл сорбента.
Элюирование проводили смесью изооктана и ацетона со скоростью 2 мл/мин с колонки размерами 21×57 мм согласно нижеприведенной схеме:
1. Промывка изооктаном (1 объем колонки)
2. Промывка 10% ацетоном в изооктане (1-5 объем колонки)
3. Промывка 30% ацетоном в изооктане (5-9 объем колонки)
4. Элюирование целевого вещества 50% ацетоном в изооктане (9-12 объем колонки).
5. Промывка 100% ацетоном (12-15 объем колонки)
Фракции, содержащие целевое вещество (с 10 по 12 объем колонки), объединяли и упаривали под вакуумом. Выход составил 80%. Производительность процесса составила 3,3 мг/(мл сорбента в час). Получившийся продукт растворили в ацетоне для проведения стадии хроматографической очистки. Количество растворителя подбирали таким образом, чтобы концентрация такролимуса в растворе составляла 100 мг в мл.
Б. Стадия колоночной хроматографии Сырье, полученное после 1 этапа очистки в количестве 5 мл, загружали на колонну, заполненную сульфокатионитом на основе силикагеля с привитыми сульфопропильными группами (емкость 0,63 ммольэкв/г) в Ag+ -форме и уравновешенную в ацетоне. Для разделения использовали колонну размером 9×180 мм (объем - 11,5 мл). В качестве элюента использовали безводные ацетон и смесь ацетон-ацетонитрил 7:3. Нагрузка составила 43 мг такролимуса на мл сорбента, скорость - 3,5 объема колонки в час. Производительность составила 30 мг такролимуса/(мл сорбента в ч).
Элюирование колонны с сульфокатионитом осуществляли согласно следующей
схеме:
1. 0-2 объема колонки - 100% ацетон
2. 2-4 объема колонки - ацетонитрил/ацетон (3:7)
Выход на данной стадии 75%, степень очистки по ВЭЖХ - 95% производительность на стадии отделения аналогов составляет 30 мг такролимуса/(мл сорбента * ч). Результаты проведения хроматографии см. на фиг. 1
Полученный продукт упаривали досуха и кристаллизовали при 5°С из смеси изооктан-изопропиловый спирт-вода.
Пример 2.
Выделение и очистку такролимуса осуществляли в условиях примера 1, однако уравновешивание колонны с сульфокатионитом и элюирование аналогов и целевого компонента осуществляют смесью 5% ацетонитрила в ацетоне. Скорость потока составила 2,55 объема колонки в час, нагрузка - 8,8 мг такролимуса/мл сорбента. Получен такролимус чистотой 96% и выходом 81%. Производительность на стадии отделения аналогов составила 7,04 мг такролимуса/(мл сорбента * ч).
Результаты проведения хроматографии см. на фиг. 2.
Пример 3.
Выделение и очистку такролимуса осуществляли в условиях примера 1, но на стадии хроматографической очистки использовали колонку с сульфокатионитом на основе силикагеля с привитыми сульфопропильными группами (емкость 0,70 ммольэкв/г) в Ag+ -форме и уравновешенную в ацетоне. Для разделения использовали колонну размером 9×180 мм (объем - 11,5 мл). В качестве элюента использовали ацетон и смесь ацетон-ацетонитрил 1:1. Нагрузка составила 20 мг такролимуса на мл сорбента, скорость - 3,5 объема колонки в час.
Элюирование осуществляли согласно следующей схеме:
1. 0-2 объема колонки - 100% ацетон
2. 2-4 объема колонки - ацетонитрил/ацетон (1:1).
Выделен такролимус чистотой 95% и выходом 80%. Производительность на стадии отделения аналогов составила 14 мг такролимуса/(мл сорбента в ч). Результаты проведения хроматографии см. на фиг. 3.
Пример 4.
Выделение и очистку такролимуса осуществляли в условиях примера 1, но в качестве сульфокатионита использован силикагель с привитыми группами формулы:
-O-Si-(CH2)3-O-CH2-CH(OH)-CH2-SO3H в Ag+ -форме
емкостью 0,21 ммольэкв/г.В качестве элюента использован ацетон. Скорость потока составила 2,35 объема колонки в час, нагрузка - 8 мг такролимуса/мл сорбента.
Выделен такролимус чистотой 96% и выходом 71%. Производительность на стадии хроматографического отделения аналогов составила 2,58 мг такролимуса/(мл сорбента в ч).
Хроматограмму см. на фиг.4.
Пример 5.
Выделение и очистку такролимуса осуществляли в условиях примера 1, но на стадии сорбционной очистки вместо силикагеля использовали сорбент на основе полиметилметакрилата HP2MG («Mitsubishi», Япония). Элюирование сорбента проводили смесью толуола и ацетона со скоростью 2 мл/мин с колонки размерами 21×57 мм согласно нижеприведенной схеме:
1. Промывка 10% ацетоном в толуоле (0-3 объем колонки)
2. Элюирование целевого вещества 30% ацетоном в толуоле (3-7 объем колонки)
3. Промывка 100% ацетоном (7-10 объем колонки)
На этой стадии получили такролимус чистотой 85% и выходом 80%. Производительность отделения аналогов составила 3,3 мг такролимуса/мл сорбента в час.
Использованный сорбент был регенерирован путем промывки 5-ю объемами колонки смесью 0,5М NaOH с изопропиловым спиртом 1:1 с последующей промывкой водой и ацетоном (по 3 объема колонки). Установлено, что сорбент сохраняет разделительные свойства при многократной регенерации.
Хроматограмма разделения продуктов, проведенного по примеру 5 аналогична хроматограмме, представленной на фиг. 1.
Пример 6.
Данный пример иллюстрирует возможность реализации изобретения при использовании в качестве исходного сырья, содержащего такролимус и его аналоги в органическом растворителе, смеси, полученной методом биосинтеза, но без внесения сорбента на стадии ферментации, т.е. по сути, смеси, аналогичной прототипу (US 6492513).
Культуральную среду с мицелием профильтровали через кизельгур. Дополнительно мицелий обработали 1000 мл ацетона для полного извлечения целевого вещества. Полученный экстракт смешивают с фильтратом и пропускают через колонну объемом 200 мл, заполненную неионогенным сорбентом "SP-207" (Mitsubishi Chemical Corporation, Япония). Колонну промыли 600 мл 50% ацетона в воде и элюировали целевое вещество 75% водным ацетоном. Фракцию упарили на роторном испарителе и экстрагировали толуолом.
Получившийся раствор подвергли стадии сорбционной очистки на силикагеле согласно примеру 1, однако при этом нагрузка составила 2,5 мг такролимуса на 1 мл сорбента. Фракции, содержащие целевое вещество, объединили, упарили и растворили в ацетоне.
Последующую колоночную хроматографию проводили в условиях примера 1.
Выход на стадии 72%, степень очистки по ВЭЖХ - 93% производительность на стадии отделения аналогов составляет 25 мг такролимуса/(мл сорбента * ч).
Полученный продукт упарили досуха и кристаллизовали при 5°С из смеси изооктан-изопропиловый спирт-вода.
Из данного примера следует, что в качестве исходной смеси можно использовать экстракт продукта биосинтеза, проведенного без внесения сорбента на стадии ферментации.
При анализе результатов, полученных в примерах в 1-5 и 6, установлено, что использование сырья, полученного при проведении ферментации в присутствии сорбента бромированного стирол-дивинилбензола, является более предпочтительным. Дополнительные преимущества заключаются в упрощении стадии отделения сорбента от мицелия. При этом бромированный стирол-дивинилбензол имеет преимущества по сравнению с обычными стирол-дивинилбензольными сорбентами за счет более высокой плотности (1,19 г/мл против 1,02-1,05 для стирол-дивинилбензола).
Как следует из вышеприведенных результатов, реализация способа выделения и очистки такролимуса в объеме заявленной совокупности признаков позволяет увеличить производительность процесса отделения аналогов такролимуса в 8-15 раз и увеличить выход чистого целевого продукта на 20-30%.