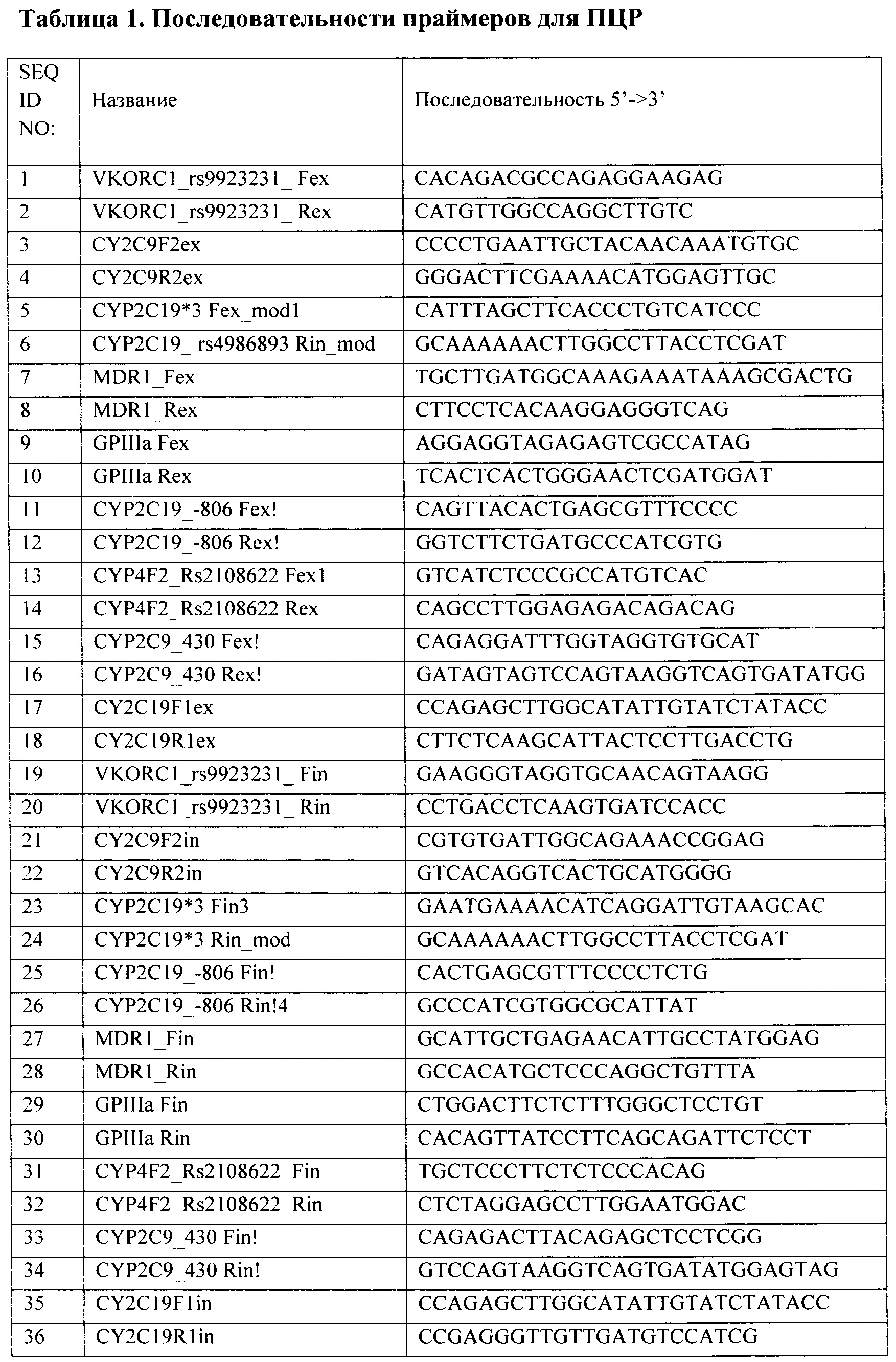
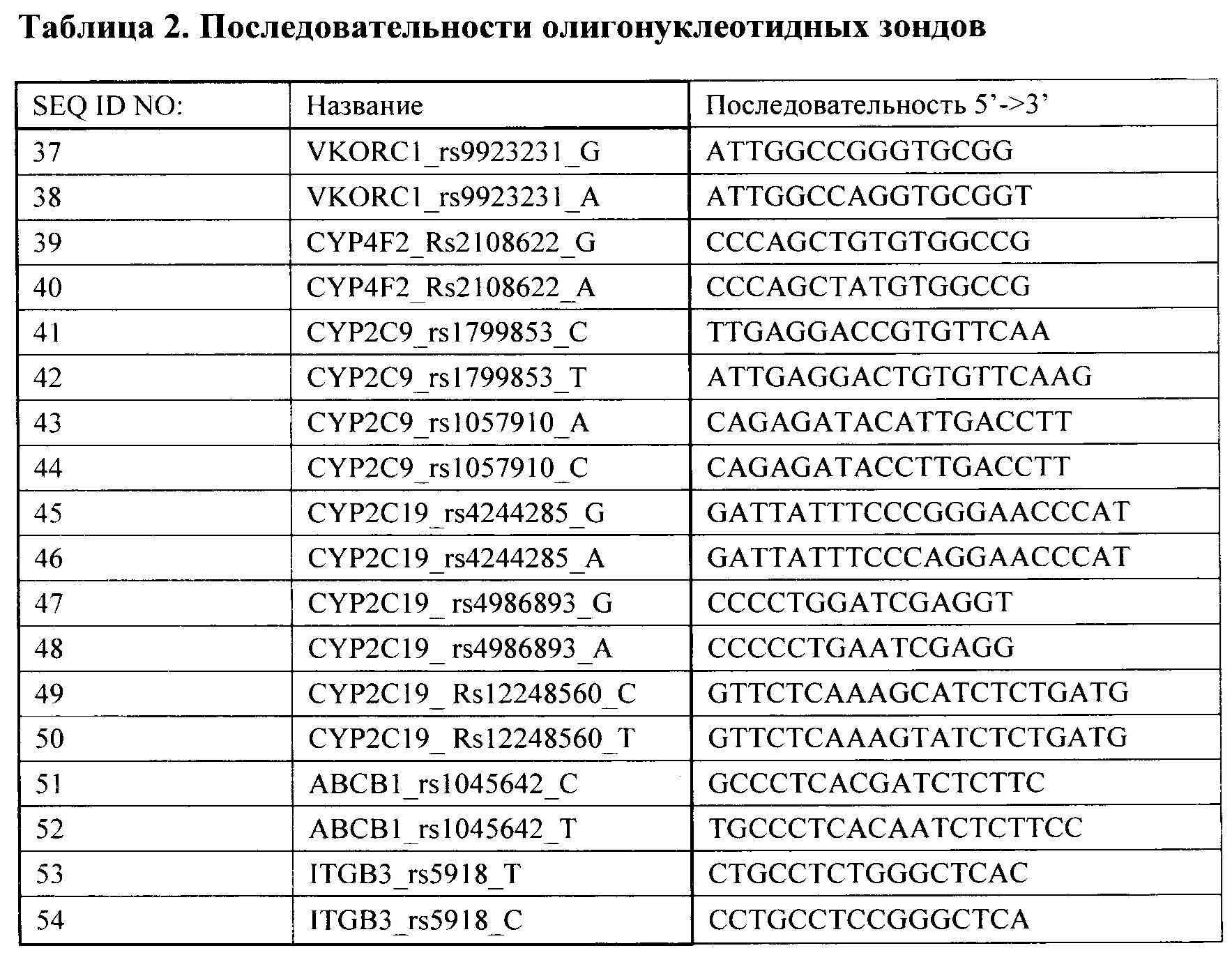
Результат интеллектуальной деятельности: Способ анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, ABCB1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области фармакогенетики и персонализированной медицины и касается способа определения генетических маркеров, которые обуславливают индивидуальную чувствительность к противосвертывающим препаратам (варфарин, клопидогрел, аспирин) с использованием полимеразной цепной реакции (ПЦР) и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом).
Применение генетического тестирования с использованием настоящего изобретения позволит эффективно подбирать препарат и его дозу при назначении противосвертывающей терапии.
Уровень техники
В настоящее время существует ряд методов анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам. Спектр анализируемых маркеров несколько варьирует.
Наиболее распространенным методом определения полиморфизма генов является ПЦР с различными вариациями. Сущность метода заключается в многократном избирательном увеличении определенного участка нуклеиновой кислоты. Существует большое количество методов обнаружения генных мутаций, основанных на ПЦР.
Аллель-специфичная ПЦР с последующим гель-электрофорезом.
При постановке ПЦР на каждую анализируемую мутацию ставится две параллельные ПЦР. В одной ПЦР-смеси содержится аллель-специфичный праймер, который на 3'-конце комплементарен последовательности дикого типа, в другой - праймер, комплементарный мутантной последовательности гена. После проведения ПЦР продукты амплификации визуализируются в агарозном геле и делается вывод о генотипе анализируемого образца. К достоинствам данного метода относится невысокая стоимость расходных материалов и отсутствие необходимости в высокой квалификации персонала. Недостатком данного метода является постановка большого количества параллельных реакций по количеству анализируемых однонуклеотидных замен и разделение их с помощью гель-электрофореза, что существенно снижает ценность метода в клинической диагностике [Orita М., Iwahana Н., Kanazawa Н., Sekya Т. Detection of polymorphism of human DNA by gel electrophoresis as single cell conformation polymorphism. Proc. Natl. Acad. Sci. 1989. 86: 2766-2770. Gaudet M, Fara AG, Beritognolo I, Sabatti M. Allele-specific PCR in SNP genotyping. Methods Mol Biol. 2009;578:415-24. Takashi Т., Nobuyuki K., Nobuyuki H. A PCR method for VKORC1 G-1639A and CYP2C9 A1075C genotyping useful to warfarin therapy among Japanese Springerplus. 2014; 3: 499].
Аллель-специфичная ПЦР в реальном времени
Данный метод является современной модифицированной версией аллель-специфичного ПЦР. Принципиальное отличие данного метода заключается в том, что он позволяет отслеживать процесс наработки продуктов ПЦР в режиме реального времени и проводить анализ без разделения этих продуктов электрофорезом. Для постановки ПЦР в данном случае используется смесь, содержащая интеркалирующий флуоресцентный краситель SYBRGreen/EVAGreen, который взаимодействует с двухцепочечной ДНК, или аллель-специфичный олигонуклеотид TaqMan, несущий флуоресцентную метку и тушитель. Рост концентрации продуктов ПЦР отслеживается по росту уровня флуоресценции, который считывается прибором на каждом цикле ПЦР. В случае применения интеркалирующего красителя контрольным показателем специфичности ПЦР является температура плавления продукта. В случае с применением олигонуклеотида TaqMan специфичность реакции определяется специфичностью самого зонда и праймеров. Недостатком данного метода является высокая стоимость оборудования. (Perez-Andreu V, Roldan V, Lopez-Fernandez MF, Anton AI. Alberca I, Corral J, Montes R. 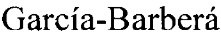 N, Ferrando F, Vicente V,
N, Ferrando F, Vicente V,  -Conejero R. Pharmacogenetics of acenocoumarol in patients with extreme dose requirements. J Thromb Haemost. 2010 May; 8(5): 1012-7. Joel A Lefferts. Mary С Schwab, Uday В Dandamudi, Hong-Kee Lee, Lionel D Lewis, and Gregory J Tsongalis Warfarin genotyping using three different platforms. Am J Transl Res. 2010; 2(4): 441-446.)
-Conejero R. Pharmacogenetics of acenocoumarol in patients with extreme dose requirements. J Thromb Haemost. 2010 May; 8(5): 1012-7. Joel A Lefferts. Mary С Schwab, Uday В Dandamudi, Hong-Kee Lee, Lionel D Lewis, and Gregory J Tsongalis Warfarin genotyping using three different platforms. Am J Transl Res. 2010; 2(4): 441-446.)
ПЦР с последующем секвенированием по Сэнгеру.
В настоящее время этот метод широко применяется в различных диагностических лабораториях. Метод основан на проведении терминирующих реакций (с добавлением терминирующих 2',3'-дидезоксинуклеозидтрифосфатов) и разделение продуктов этих реакций с помощью капиллярного электрофореза. В настоящее время метод автоматизирован, интерпретация результатов проводится с помощью специального программного обеспечения. Метод является достаточно информативным, позволяет определять полную нуклеотидную последовательность исследуемого фрагмента, позволяет обнаруживать мутации de novo. [Xiong Y, Wang M, Fang K, Xing Q, Feng G, Shen L, He L, Qin S. A systematic genetic polymorphism analysis of the CYP2C9 gene in four different geographical Han populations in mainland China. Genomics. 2011 Мау; 97(5):277-81]. Однако, он обладает и рядом существенных недостатков, так как требует постановки отдельной реакции амплификации на каждый анализируемый локус, причем необходимо использование дорогостоящего оборудования и высокая квалификация персонала.
Аллель-специфичный рестрикпионный анализ
В основе данного метода лежит способность специальных ферментов - рестриктаз специфически расщеплять ДНК в определенных сайтах. Рестриктаза распознает специфическую нуклеотидную последовательность сайта рестрикции и расщепляет в этом месте ДНК. Любые изменения в последовательности сайта рестрикции приводят к тому, что рестриктаза перестает его распознавать. Высокоселективная рестриктаза подбирается таким образом, чтобы последовательность ее сайта рестрикции соответствовала участку с исследуемой мутацией. Т.о. рестриктаза расщепляет либо только последовательность дикого типа, либо исключительно последовательность, содержащую мутацию. Анализ продуктов рестрикции проводится методом электрофореза. На основе полученной фореграммы делается вывод о наличии или отсутствии мутации. Недостатком данного метода является его низкая аналитическая способность. Данный метод не позволяет детектировать мутации de novo. Его возможности ограничены известными на текущий момент последовательностями сайтов рестрикции. Анализ каждой мутации требует постановки отдельной ПЦР и рестрикции, что делает данный метод трудоемким и повышает вероятность ошибки. Однако данный метод не требует высокой квалификации персонала и дорогостоящего оборудования. [Ota М, Fukushima Н, Kulski JK, Inoko Н. Single nucleotide polymorphism detection by polymerase chain reaction-restriction fragment length polymorphism. Nat Protoc. 2007;2(11):2857-64. Su J, Yu Q, Zhu H, Li X, Cui H, Du W, Ji L, Tong M, Zheng Y, Xu H, Zhang J, Zhu Y, Xia Y, Liu T, Yao Q, Yang J, Chen X, Yu J. The risk of clopidogrel resistance is associated with ABCB1 polymorphisms but not promoter methylation in a Chinese Han population. PLoS One. 2017 Mar 30;12(3):e0174511].
Различные варианты гибридизации с биочипами
Технологии микрочипов нашли свое применение при прогнозировании индивидуальных и физиологических реакций на фармакологические препараты. [Sebastian Т, Cooney CG, Parker J, Qu Р, Perov A, Golova JB, Pozza L. Iwasiow RM, Holmberg R. Integrated amplification microarray system in a lateral flow cell for warfarin genotyping from saliva. Clin Chim Acta. 2014; 429:198-205].
Созданная компанией Roche (Alameda, С А) на основе технологии микрочипов Affymetrix тест-система AmpliChip CYP450 была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США и применяется для индивидуального подбора психотропных препаратов и их дозировок. Данный тест позволяет выявить до 33 полиморфизмов и мутаций гена CYP2D6 и 3 полиморфизма гена CYP2C19. Сигнальный путь цитохрома Р450 (CYP) и членов суперсемейства CYP, в частности CYP2D6 и CYP2C19, задействован в метаболизме - 25% лекарственных препаратов включая антидепрессанты, иммунодепрессанты и противоопухолевые препараты [Jain KK. Applications of AmpliChip CYP450. Mol Diagn. 2005:9(3): 119-27. M С Rebsamen, J Desmeules, Y Daali, A Chiappe, A Diemand, С Rey, J Chabert, P Dayer, D Hochstrasser and M F Rossier. The AmpliChip CYP450 test: cytochrome P450 2D6 genotype assessment and phenotype prediction. The Pharmacogenomics Journal (2009) 9, 34-41]
Тест-системы Affymetrix, в основе которых лежит комбинация технологии высокоселективных инверсионных молекулярных проб (MIP) с гибридизацией на микрочипах, нашли свое применение в исследованиях роли однонуклеотидных полиморфизмов в генах, вовлеченных в метаболизм лекарственных препаратов [James K. Burmester, Richard L. Berg, Ingrid Glurich. Steven H. Yale, John R. Schmelzer. Michael D. Caldwell. Absence of Novel CYP4F2 and VKORC1 Coding Region DNA Variants in Patients Requiring High Warfarin Doses Clin Med Res. 2011 Nov; 9(3-4): 119-124. Michael D. Caldwell et al. CYP4F2 genetic variant alters required warfarin dose Blood. 2008 Apr 15; 111(8): 4106-4112. Burmester JK, Sedova M, Shapero MH, Mansfield E. DMET microarray technology for pharmacogenomics-based personalized medicine. Methods Mol Biol. 2010; 632:99-124].
Гелевые микрочипы низкой плотности находят широкое применение для фундаментальных научных исследований и медицинской диагностики, ввиду невысокой стоимости и возможности создавать актуальные панели под определенные задачи. Метод заключается в амплификации фрагментов ДНК и последующей гибридизации флуоресцентно меченой ДНК мишени с аллель-специфичными олигонуклеотидами в трехмерных гелевых ячейках микрочипа. [Gel-based microarrays in clinical diagnostics in Russia. Gryadunov D, Dementieva E, Mikhailovich V, Nasedkina T, Rubina A, Savvateeva E, Fesenko E, Chudinov A, Zimenkov D, Kolchinsky A, Zasedatelev A. Expert Rev Mol Diagn. 2011 Nov; 11(8):839-53].
Запатентовано большое количество тест-систем для анализа полиморфных генетических маркеров для определения индивидуальной чувствительности к противосвертывающим препаратам. Как правило, в таких патентах описаны способы определения полиморфизма 1-2 генов.
В китайском патенте CN 104946759 А от 2015-09-30 описан метод определения однонуклеотидного полиморфизма гена CYP2C19 -806 C>Т *17 методом SNaPshot ПЦР. В европейском патенте ЕР 2392676 А1 от 2011-12-07 опубликован метод детекции полиморфизма гена VKORC1 -1639 G>A методом аллель-специфичного ПЦР с TaqMan зондомами. В американском патенте US 20070298426 А1 2007-12-27 описан метод определения дозы варфарина путем анализа 1 SNP гена VCORC1 и 2 SNP гена CYP2C9. В китайском патенте CN 106048076 А от 2016-10-26 описано определение 2 полиморфизмов CYP2CI9 (*2 и *3) методом аллель-специфичной ПЦР в реальном времени. В китайском патенте CN 101565749 В от 2012-01-11 описан метод определения полиморфизмов CYP2C19 681 G>A *2, CYP2C19 636 G>A *3 и ABCD13435 C>Т на жидком микрочипе.
Раскрытие изобретения
Задача настоящего изобретения состоит в создании способа определения генетических маркеров, которые обуславливают индивидуальную чувствительность к противосвертывающим препаратам (варфарин, клопидогрел, аспирин).
Сущность изобретения заключается в обеспечении способа анализа однонуклеотидного полиморфизма (SNP, Single nucleotide polymorphism) генов, продукты которых участвуют в метаболизме и транспорте лекарственных препаратов, а также в процессах свертывания крови. Данный способ позволяет выявлять следующие полиморфные маркеры в генах: VKORC1 (rs9923231), CYP4F2 (rs2108622), CYP2C9 *1/*2/*3 (430C>Т - rs1799853, 1075А>С - rs1057910), CYP2C19*1/*2/*3/*17 (rs4244285, rs4986893, rs12248560), ABCB1 (rs1045642), ITGB3 (rs5918).
Основными признаками данного изобретения являются ПЦР и последующая гибридизация на биочипе, содержащем набор иммобилизованных олигонуклеотидных зондов.
Первый важный признак изобретения - специфические праймеры для амплификации участков генов, набор которых используется для получения флуоресцентно меченных продуктов в необходимом количестве для гибридизации на биочипе. Последовательности праймеров для проведения ПЦР приведены в табл.1 и Перечне последовательностей (SEQ ID NO: 1-36).
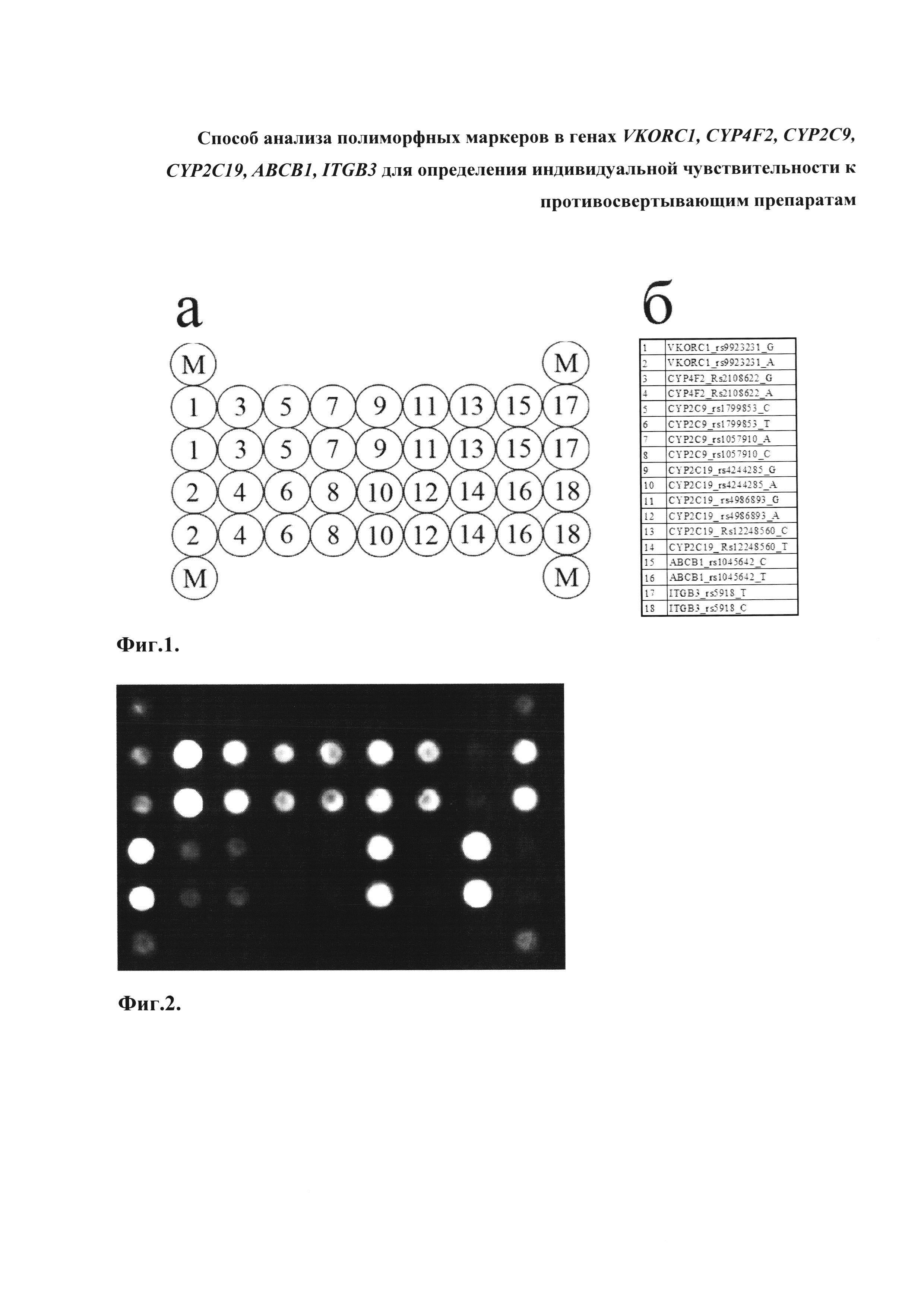
Второй важный признак изобретения - биочип, содержащий набор иммобилизованных олигонуклеотидных зондов, последовательности которых приведены в таблице 2 и Перечне последовательностей (SEQ ID NO: 37-54). Олигонуклеотидные зонды иммобилизуются в ячейках гидрогелевого микрочипа, методом фотоиндуцируемой сополимеризации (патент RU 2206575 от 2003-06-20) в концентрации 2000-4000 мкМ. Схема расположения зондов в ячейках биочипа для анализа полиморфизмов генов VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 приведена на Фиг. 1.
Набор праймеров для ПЦР используется для проведения ПЦР и получения флюоресцентно-меченного продукта для гибридизации на биочипе. Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения ПЦР, с иммобилизованными в ячейках биочипа олигонуклеотидными зондами, расположенными на пластиковой подложке. После проведения гибридизации и отмывки биочипа проводится анализ полученной флуоресцентной картины, на основании которого делается отчет о генотипе исследуемого образца. Пример картины гибридизации приведен на Фиг. 2.
Краткое описание фигур
Фиг. 1. Схема расположения зондов в ячейках биочипа для анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам, (а) расположение ячеек на биочипе; (б) расшифровка условных обозначений. В угловых позициях нанесены ячейки (М), содержащие флуоресцентный краситель Су5, светящийся перманентно, для ориентировки и контроля интенсивности свечения.
Фиг. 2. Гибридизационная картина, полученная с помощью биочипа для анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам (у пациента №1).
Осуществление изобретения
Для обеспечения оптимальных условий ПЦР необходимо использовать праймеры, обеспечивающие специфичный и эффективный отжиг на мишени при одинаковой температуре (для одного этапа), и они не образуют при этой температуре вторичных структур. Для оптимальной (стабильной и специфичной) наработки необходимого для гибридизации на биочипе количества флюоресцентно-меченого ПЦР-продукта должны быть подобраны такие параметры как концентрации реагентов в реакционной смеси и температурно-временной режим реакций. В результате проведенной работы подобраны праймеры и условия для проведения ПЦР, которые позволяют осуществлять эффективную наработку исследуемых локусов ДНК.
Для иммобилизации на биочипе подбираются олигонуклеотиды, позволяющие идентифицировать все выбранные для анализа участки генов.
Олигонуклеотидные зонды должны быть подобраны в соответствии со следующими критериями:
1) Олигонуклеотидный зонд должен обладать высокой специфичностью к анализируемому локусу.
2) Предпочтительно расположение вариабельного нуклеотида в серединной области зонда, так как такая конструкция зонда позволяет добиться лучшей дискриминации между совершенными и несовершенными дуплексами.
3) Олигонуклеотидный зонд не должен образовывать стабильных вторичных структур в условиях, при которых проводится гибридизация, наличие которых может приводить к снижению эффективности гибридизации.
На биочипе для анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3, определяющих индивидуальную чувствительность к противосвертывающим препаратам иммобилизованы 63 высокоспецифичных дифференцирующих олигонуклеотидных зонда (таблица 2 и Перечень последовательностей (SEQ ID NO: 37-54)), структура которых обеспечивает высокоспецифичное связывание с полностью комплементарными ДНК-мишенями. Яркий флюоресцентный сигнал образуется только в ячейках, в которых при гибридизации образовался совершенный дуплекс между олигонуклеотидным зондом и флюоресцентно-меченым ПЦР-продуктом.
Приведем последовательность анализа с использованием данного метода. Амплификация ПЦР-продуктов для последующей гибридизации на биочипе проводится посредством мультиплексной «гнездной» ПЦР в два этапа, при этом в качестве матрицы для проведения реакции используют образец ДНК пациентов.
ПЦР может быть проведена с использованием любого вида термостабильной полимеразы (Taq-полимераза, Taq-полимераза с горячим стартом, Tth-полимераза, Tfl-полимераза, Pfu-полимераза, Vent-полимераза, DeepVent-полимераза и другие коммерчески доступные ферменты, выделенные из термофилов), работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ). Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты за исключением праймеров.
В ходе первого этапа мультиплексной ПЦР с праймерами происходит симметричная наработка продуктов. Продукт первого этапа используется для проведения второго этапа ПЦР, при этом наработка продукта осуществляется ассиметрично (т.к. обратные праймеры присутствуют в смеси в избытке), и с его флюоресцентным маркированием с использованием дУТФ-Су5. который способен включаться в растущую цепь ДНК. В качестве флуоресцентной метки также может быть использован любой флуорохром без ограничения (например, FITC, Texas red, Су-3 и т.д.), а также биотин.
Синтез праймеров и олигонуклеотидных зондов осуществляется с помощью таких химических подходов как фосфодиэфирный метод, гидрофосфорильный метод и т.д. Для синтеза праймеров используются автоматические ДНК/РНК синтезаторы, например, производства фирмы «Applied Biosystems» (США). Для иммобилизации в гидрогелевых ячейках биочипа, к 5'- или 3'-концу олигонуклеотидных зондов добавляется активная группа (например на 3'-конец может быть добавлена свободная аминогруппа с помощью 3'-Amino-Modifier С7 CPG 500, «Glen Research», США).
Для проведения первого этапа ПЦР используют праймеры SEQ ID NO: 1-18, для второго этапа - SEQ ID NO: 19-36. Последовательности праймеров приведены в Перечне последовательностей в таблице 1.
Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения ПЦР, с иммобилизованными в ячейках геля олигонуклеотидными зондами, последовательности которых представляют собой участки, комплементарные последовательностям мажорного или минорного аллеля по исследуемым локусам.
Гибридизация ПЦР-продукта с олигонуклеотидными зондами на биочипе может быть проведена в любом гибридизационном буфере, например, в SSPE-буфере с формамидом или гуанидиновом. Перед постановкой гибридизации ПЦР-продукт прогревают при 95°С в течение 5 минут, затем охлаждают на льду в течение 2 минут, после чего наносят гибридизационную смесь на биочип. Гибридизация проводится 12-14 ч при 37°С. Отмывка биочипа после проведения гибридизации может быть проведена в любом известном в данной области техники буфере с добавлением соли (SSC, SSPE и т.п.) или более короткое время в дистиллированной воде.
Анализируемый фрагмент ДНК в условиях (состав реакции, температура и время гибридизации), при которых осуществляется гибридизация, образует совершенные дуплексы только с полностью комплементарными ему олигонуклеотидными зондами. Сигнал флюоресценции детектируется только в ячейках, в которых образовался совершенный дуплекс. В случае, если дуплекс несовершенный (присутствует хотя бы один не спаренный нуклеотид), то сигнал флюоресценции отсутствует.
После проведения гибридизации следует стадия отмывки биочипа в буфере (например, SSPE-буфере) или дистиллированной воде. Далее проводится визуализация результатов гибридизации с помощью любой детектирующей системы, способной возбуждать флюоресценцию и распознавать флуоресцентный сигнал (например, портативный анализатор биочипов, снабженный ПЗС-камерой и специальным программным обеспечением, производства ООО «БИОЧИП-ИМБ» (Москва, Россия)).
Изготовление биочипов может осуществляться посредством последовательного нанесения на поверхность подложки из стекла ячеек акриламидного геля, активации ячеек и иммобилизации в ячейках модифицированных олигонуклеотидов (Analysis of SNPs and other genomic variations using gel-based chips / A. Kolchinsky, A. Mirzabekov //Hum Mutat. - 2002. - Vol. 19. - P. 343-360. Review]. В качестве подложки кроме стекла может быть использован другой материал, в том числе металл, гибкие мембраны и пластик (Патент RU2309959, опубликован 2007-11-10). Биочипы также могут быть изготовлены любыми другими известными способами [Arrays of immobilized oligonucleotides-contributions to nucleic acids technology / H. Seliger, M. Hinz, E. Happ // Curr Pharm Biotechnol - 2003. - Vol. 4. - P. 379-395].
Для изготовления биочипа в настоящем изобретении используется набор олигонуклеотидов SEQ ID NO: 62-124, приведенный в Перечне последовательностей, а также в таблице 2. Расположение конкретных олигонуклеотидных зондов на биочипе может варьироваться в зависимости от удобства интерпретации результатов.
Далее приведены примеры, иллюстрирующие возможности применения способа анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам. Варианты и модификации осуществления изобретения, которые могут быть осуществлены, не отходя от общей концепции настоящего изобретения, также будут входить в объем притязаний настоящего изобретения.
Пример 1. Амплификация участков генов VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB метаболизма лекарственных препаратов и генов иммунного ответа с целью получения флуоресцентно меченного ПЦР-продукта в необходимом количестве.
Из крови пациента больного выделяли ДНК с помощью набора QIAamp DNA Blood Mini Kit (Qiagen, США).
Наработку участков анализируемых генов проводили методом гнездной мультиплексной ПЦР. Первый этап ПЦР проводился в двух реакциях для каждого образца («А1» и «Б1»). ПЦР-смесь общим объемом 25 мкл включала в себя: 2.5 ед. акт.Taq-полимеразы («Силекс», Россия), ПЦР-буфер (70 мМ Трис-HCl (рН 8.3), 16.6 мМ (NH4), 2.5 мМ MgCl2, 200 мкМ каждого из дНТФ («Силекс», Россия), 10 нг ДНК, по 5 пмоль каждого праймера: в реакции «А1» праймеры SEQ ID NO: 1-12, в реакции «Б1» праймеры SEQ ID NO: 13-18. Второй этап ПЦР проводился в двух реакциях для каждого образца («А2» и «Б2»), в реакционных смесях, аналогичных реакциям первого этапа, но с добавлением 8 мкМ флуоресцентно меченного дУТФ-Су5, и с избытком обратных праймеров (по 2.5 пмоль прямого и 25 пмоль обратного праймера на реакцию). В реакции «А2» праймеры SEQ ID NO: 19-30, в реакции «Б2» праймеры SEQ ID NO: 31-36. В качестве матицы использовали продукт «А1» и «Б1» для реакций «А2» и «Б2» соответственно. Амплификацию для первого и второго этапов проводили по следующей схеме: денатурация при 94°С (3 мин 30 с), далее 35 циклов: 94°С (30 с), 62°С (30 с), 72°С (30 с), затем элонгация при 72°С в течение 3 мин, на приборе Т100 («Bio-Rad», США).
Пример 2. Олигонуклеотидный биочип для анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов.
Олигонуклеотидные зонды для иммобилизации на микрочипе синтезируют на автоматическом синтезаторе 394 DNA/RNA Synthesizer («Applied Biosystems», США) с использованием стандартной фосфоамидитной процедуры. 3'-конец олигонуклеотидов содержит спейсер со свободной аминогруппой, который вводят в состав олигонуклеотида при синтезе путем использования 3'-Amino-Modifier С7 CPG 500 («Glen Research)), США).
Биочип изготовляют методом сополимеризации олигонуклеотида в акриламидном геле (патент RU 2309959, опубликованный 2007-11-10 и RU 2175972, опубликованный 2001-11-20). Биочип содержит 18 иммобилизованных олигонуклеотидных зондов (SEQ ID NO: 37-54), список которых представлен также в таблице 2. Ячейки наносят согласно схеме на Фиг. 1.
Пример 3. Гибридизация меченного продукта на биочипе Реакционную смесь, полученную после проведения второго этапа ПЦР, описанного в Примере 1, использовали для гибридизации на биочипе. 10 мкл формамида ("Serva", США), 10 мкл 20xSSPE ("Promega", США) и по 10 мкл амплификата из реакций «А2» и «Б2» смешивали. Гибридизационную смесь денатурировали при 95°С 5 минут, охлаждали во льду 2 минуты, наносили на биочип и оставляли на 12 часов при 37°С. После проведения гибридизации биочип отмывали в 1 × SSPE в течение 10 минут при комнатной температуре.
Пример 4. Регистрация и интерпретация результатов гибридизации Регистрацию гибридизационной картины производили с помощью портативного анализатора биочипов, снабженного ПЗС-камерой (ООО «Биочип-ИМБ»).
Определили генотип по гибридизационной картине, представленной на Фиг. 2.
Генотип образца:
VKORC1_rs9923231_А/А
CYP4F2_Rs2108622_G/G
CYP2C9_rs_1799853_С/С
CYP2C9_rs_1057910_А/А
CYP2C19_rs4244285_G/G
CYP2C19_rs4986893_G/G
CYP2C19_Rs12248560_С/Т
ABCB1_rs1045642_T/T
ITGB3_rs5918_Т/Т
Способ анализа полиморфных маркеров в генах VKORC1, CYP4F2, CYP2C9, CYP2C19, АВСВ1, ITGB3 для определения индивидуальной чувствительности к противосвертывающим препаратам