Результат интеллектуальной деятельности: Способы получения молекулярных конструкций, содержащих антигенные эпитопы актуальных аллергенов и сигнальные пептиды, обладающие иммунорегуляторными свойствами
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности иммунологии и молекулярной биологии, и может быть использовано для разработки средств лечения аллергии.
Уровень техники
Аллергия стала одной из наиболее распространенных патологий хронического течения во всем мире и является серьезнейшей проблемой для современного общества. Методам диагностики, профилактики и лечения аллергических заболеваний уделяется все большее внимание.
Одним из методов лечения аллергических заболеваний является метод аллерген специфической иммунотерапии (АСИТ), когда сам аллерген используется в качестве лечебного средства. Гипосенсибилизация и десенсибилизация - специфические формы иммунотерапии, при которой пациент постепенно вакцинируется нарастающими дозами специфического антигена. Это может привести как к снижению тяжести, так и к полной ликвидации гиперчувствительности. Суть метода состоит в стимуляции секреции IgG («блокирующие антитела»), которые связывают попавший в организм антиген до того, как он прореагирует с IgE (секретируемые в избытке при гиперчувствительности I типа) и тем самым предотвращают развитие аллергической реакции.
Важной задачей при иммунотерапии является идентификация индивидуальных белков, входящих в состав аллергена, например, пыльцы растений, демонстрация аллергенности этих белков, характеристика этих белков с точки зрения обнаружения IgE эпитопов. Это открывает дорогу к дальнейшему получению генно-инженерных конструкций, экспрессирующих эти белки. При подтверждении специфичности полученных белковых конструкций они могут быть использованы для иммунотерапии, значительно снижая нагрузку на иммунную систему, что является большим недостатком суммарного неочищенного аллергена. Кроме того, выделение наборов специфических белков-аллергенов позволит составлять для каждого индивидуума высокоспецифичные наборы для вакцинации при иммунотерапии, поскольку известны перекресты в IgE эпитопах белков, выделенных из аллергенов абсолютно разного происхождения, например, аллергенов томатов и пыльцы березы.
Изменение природного пути процессинга и презентации иммуногена является одним из наиболее перспективных подходов к изменению соотношения IgE и IgG ответа для данного аллергена в пользу снижения его аллергенности, связанной с его IgE эпитопами.
Известно, что процессинг антигена по пути MHC-I приводит к развитию Th1 ответа, сопровождающегося активацией CTL-клеток и IgG2a антител. Этот процесс проходит в несколько этапов. Белок, синтезированный в клетке, расщепляется протеасомой на короткие пептиды, которые переносятся белками-транспортерами, ассоциированными с процессингом антигенов (ТАР), в эндоплазматический ретикулум (ER), где они связываются с MHC-I. Затем комплекс пептид-MHC-I транспортируется на поверхность клетки для распознавания рецепторами цитотоксических CD8+ Т-клеток (CTL), которые осуществляют клеточный ответ. Поэтому усиление направления белков в протеасому или ER должно способствовать их большей доступности для представления по MHC-I пути и, следовательно, усилению клеточного ответа.
Основным источником пептидов для связывания с МНС-II являются экзогенные белки, которые с помощью эндоцитоза и далее направляются в лизосомы. Однако обнаружено, что пептиды некоторых внутриклеточных белков также могут быть представлены МНС-II посредством аутофагии. При этом белки попадают в лизосомы при шаперон-опосредованном переносе из цитоплазмы белком-транспортером, при окружении части цитоплазмы мембраной лизосом, а также при формировании двумембранных аутофогосом в цитоплазме. В лизосомах антиген расщепляется кислыми протеазами, и образованные пептиды включаются в состав МНС-II-молекул. На поверхности клеток эти комплексы распознаются рецепторами CD4+ Т-клеток. В результате происходит активация CD4+ Т-клеток, которые стимулируют как клеточный иммунитет (Th1-тип CD4+ Т-клеток), так и гуморальный иммунитет (Th2-тип).
Таким образом, становится очевидно, что в данной области иммунологии существует потребность в получении новых препаратов аллергенов, которые применялись в диагностике аллергий. Особенно важно создание их модифицированных форм, позволяющих изменять иммунный ответ организма на аллерген, что необходимо для профилактических и терапевтических целей.
Раскрытие изобретения
Данное изобретение стало возможным в результате проведенного авторами исследования по модификации аллергенов при конъюгации с сигнальными пептидами, определяющими путь процессинга белков. В ходе работы разработана методика отбора сигнальных пептидов (на примере сигнального пептида орнитиндекарбоксилазы - ODCsig), регулирующих иммунный ответ организма на модифицируемый антиген, методики клонирования последовательностей аллергенов и сигнальных пептидов, а также методики экспрессии, выделения и очистки рекомбинантных химерных белков.
Настоящее изобретение в своем аспекте относится к новому способу изменения иммунологических свойств аллергенов для смещения антительного ответа с IgE антител к IgG.
Данный способ включает следующие стадии:
1. Получение гена, кодирующего белок-аллерген с помощью клонирования.
2. Отбор последовательностей сигнальных пептидов (ODCsig), обладающих иммунорегуляторными свойствами, за счет изменения пути процессинга несущего их полипептида.
3. Клонирование ДНК-последовательностей, кодирующих сигнальные пептиды ODCsig.
4. Создание химерного гена, содержащего антигенные эпитопы актуального аллергена и сигнальный пептид ODCsig.
5. Создание ДНК-конструкций для экспрессии химерных белков-аллергенов в бактериальных клетках.
6. Экспрессия, выделение и очистка химерных белков-аллергенов, содержащих антигенные эпитопы актуальных аллергенов и сигнальные пептиды ODCsig.
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные примеры и чертежи, где
Фиг. 1 демонстрирует качество препарата кДНК пыльцы березы повислой. Электрофорез препарата кДНК пыльцы березы повислой в 1% агарозном геле. Дорожки: М - 1 kb ДНК маркер, 1 - амплифицированная кДНК.
Фиг. 2 - электрофорез рестрицированных плазмид pETBetV1 в 1,5% агарозном геле. Плазмида pETBetV1 рестрицирована по сайтам клонирования NcoI/XhoI (1, 2 - два клона). Справа указаны положения маркеров (bp).
Фиг. 3 - электрофорез рестрицированных плазмид pETBetV2 1,5% агарозном геле.
Плазмида рестрицирована по сайтам клонирования NdeI/XhoI (1,2 - два клона). Слева указаны положения маркеров (bp).
Фиг. 2 и Фиг. 3 показывают анализ клонирования генов аллергенов в экспрессионные векторы.
Фиг. 4 - электрофорез рестрицированных плазмид в 2,5% агарозном геле.
1 - маркер, bp
2 - рестрикция плазмиды pET29b-BetV1-ODC по сайту клонирования XhoI
3 - рестрикция плазмиды pET29b-Ii-BetV1 по сайту клонирования NdeI
Фиг. 5 - электрофорез рестрицированных плазмид в 1% агарозном геле. Плазмида pETBetV2-ODCsig рестрицирована по NdeI (1) и по сайтам клонирования XhoI/XhoI (2). Плазмида pET-Ii-BetV2 рестрицирована по XhoI (1) и по сайтам клонирования NdeI/NdeI (2). Справа указаны положения маркеров (bp).
Фиг. 4 и Фиг. 5 демонстрируют рестрикционный анализ плазмид, кодирующих химерные белки.
Фиг. 6 - электрофорез фракций белков BetV2-ODCsig (дорожки 1-13) в 16% ПААГ с колонки с Ni-NTA агарозой. Белки выявлены окрашиванием раствором Кумасси бриллиантовый синий. Справа указаны положения белковых маркеров молекулярных масс (кДа).
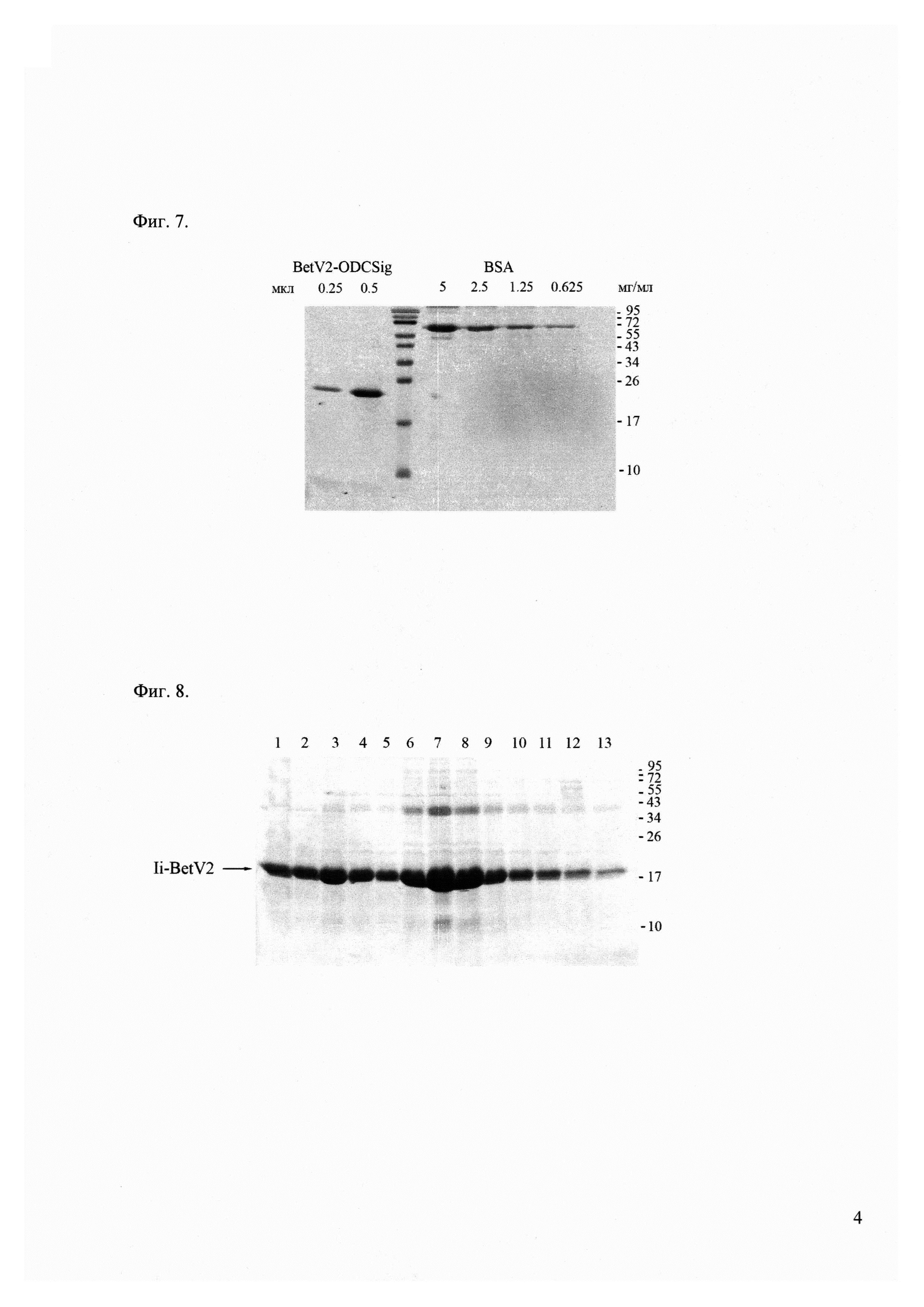
Фиг. 7 - электрофорез белков BetV2-ODCsig в 16% ПААГ. Фракции белка BetV2-ODCsig в 2 М мочевине. Белки выявляли окрашиванием раствором Кумасси бриллиантовый синий. Справа указаны положения белковых маркеров и их молекулярные масс (кДа).
Фиг. 8 - электрофорез фракций белков Ii-BetV2 (дорожки 1-13) в 16% ПААГ после колонки с Ni-NTA агарозой. Белки выявляли окрашиванием раствором Кумасси бриллиантовый синий. Справа указаны положения и молекулярные массы белковых маркеров (кДа).
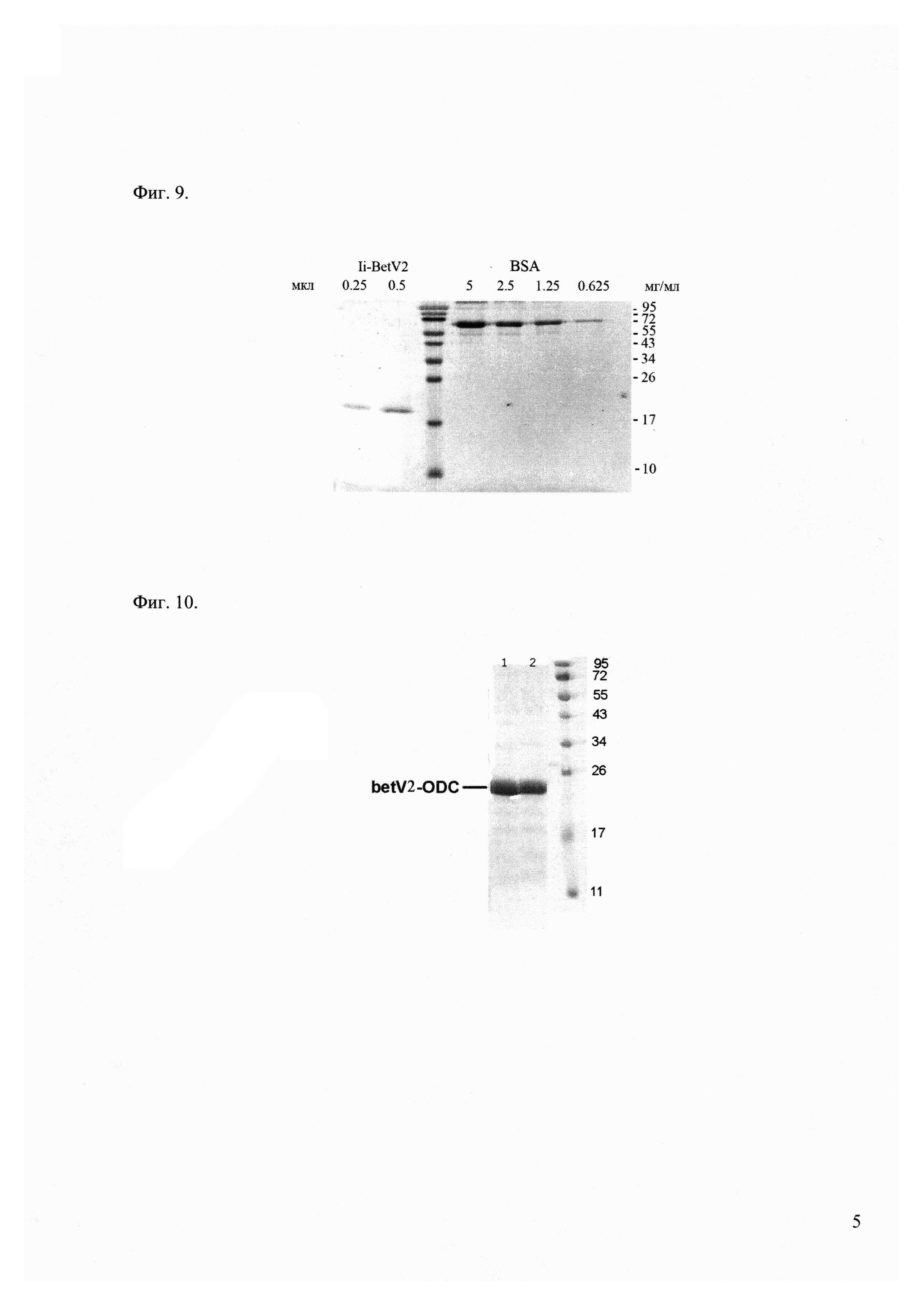
Фиг. 9 - электрофорез белков Ii-BetV2 в 16% ПААГ. Фракции белка Ii-BetV2 в 2 М мочевине. Белки выявляли окрашиванием раствором Кумасси бриллиантовый синий. Справа указаны положения белковых маркеров молекулярных масс (кДа).
Фиг. 10 - электрофорез белков BetV2-ODCsig в 16% ПААГ. Белки выявляли окрашиванием раствором Кумасси бриллиантовый синий. Справа указаны положения белковых маркеров молекулярных масс (кДа).
1 - препарат белка после хранения 1 месяц
2 - препарат белка после хранения 6 месяцев
Фиг. 6 и Фиг. 8 показывают фракции с колонки с Ni-NTA агарозой экспрессируемых рекомбинантных белков.
Фиг. 7, Фиг. 9 и Фиг. 10 демонстрируют качество полученных препаратов рекомбинантных белков, содержащих аллергенные эпитопы.
Осуществление изобретения
Данное изобретение обеспечивает создание новых препаратов, содержащих антигенные эпитопы актуальных аллергенов, которые могут быть использованы для профилактики и лечения аллергий. Усиление индукции IgG антител может быть использовано для специфической иммунотерапии.
Получение библиотеки кДНК генов
Современный уровень развития молекулярно-биологических и генно-инженерных методов позволяет при получении библиотеки кДНК избежать этапа клонирования в бактериальные клетки и получения клонотеки, заменяя их описанной ниже и представленной процедурой получения SMART-амплифицированной кДНК.
Метод SMART-синтеза кДНК основан на уникальной способности обратной транскриптазы вируса лейкемии мышей Молони неспецифически добавлять несколько дезоксинуклеотидов (преимущественно С) на 3' конец новосинтезированной цепи кДНК при достижении 5'-конца РНК-матрицы.
Олигонуклеотиды, добавленные в реакцию и содержащие олиго-(рибоG) последовательность на 3'-конце (TS-oligo), образуют пары с дезоксицитидиновыми участками кДНК. Обратная транскриптаза продолжает репликацию, используя TS-oligo в качестве матрицы и синтезируя последовательность, комплементарную TS. Таким образом, на 5' конце цепи образуются участки, несущие определенную нуклеотидную последовательность, на которую отжигаются универсальные праймеры для последующей амплификации кДНК.
Полученная данным методом кДНК является полноразмерной, двуцепочечной, амплифицированной до достаточного для дальнейшей работы количества. Используя кДНК такого качества, возможно, получать длинные и сложные по нуклеотидному составу гены с помощью ПЦР для их дальнейшего клонирования и экспрессии.
Методика отбора сигнальных пептидов, регулирующих иммунный ответ
Отбор сигнальных последовательностей, способных изменять внутриклеточную локализацию белка и, как следствие, иммунный ответ на него, включает в себя две основные стадии. На первой стадии производятся поиск и систематизация сведений об аминокислотных последовательностях, ответственных за выполнение описанных функций. Результатом данного этапа является создание базы данных соответствующих аминокислотных последовательностей. Вторая стадия заключается в отборе из последовательностей базы данных наиболее оптимальных для последующего использования в лабораторной практике. Залогом успешного применения методики является создание базы данных в соответствии с представленными ниже критериями.
А. Создание базы сигнальных последовательностей
Для создания базы аминокислотных последовательностей провести поиск литературных источников в базе PubMed, содержащих информацию об установлении функциональной активности специфических аминокислотных последовательностей (фрагментов белков - пептидов): сигналы деградации на протеасоме и сигналы транспорта в лизосомы.
1. Поиск последовательностей, ответственных за деградацию на протеасоме.
1.1. Выйти на Интернет домен PubMed http://www.ncbi.nlm.nih.gov/sites/entrez
1.2. Ввести ключевые слова поиска: «proteasome degradation signal sequence».
Результатом данной операции является получение списка публикаций, содержащих информацию об обнаружении функциональной активности фрагментов различных белков.
1.3. Проанализировать литературные источники на наличие следующей информации:
- установлено, что белок подвергается деградации на протеасоме;
- установлен фрагмент белка, ответственный за деградацию;
- установлена необходимость присутствия/отсутствия дополнительных сигналов для осуществления данной функции;
- описано, что данная последовательность при переносе в другой белок способна выполнять свою функцию.
1.4. Внести данные по последовательности в базу данных в соответствии с требованиями.
1.5. При обнаружении белка, провести дополнительный поиск по базе PubMed по ключевым словам, дополнив их названием белка. Внести дополнительные сведения в таблицу базы данных.
2. Поиск последовательностей, ответственных за деградацию на протеасоме.
2.1. Выйти на Интернет домен PubMed http://www.ncbi.nlm.nih.gov/sites/entrez
2.2. Ввести ключевые слова поиска: «lysosome targeting signal sequence».
Результатом данной операции является получение списка публикаций, содержащих информацию об обнаружении функциональной активности фрагментов различных белков.
2.3. Проанализировать литературные источники на наличие следующей информации:
- установлено, что белок деградирует в лизосоме;
- установлен фрагмент белка, ответственный за направление в лизосомы;
- установлена необходимость присутствия/отсутствия дополнительных сигналов для осуществления данной функции;
- описано, что данная последовательность при переносе в другой белок способна выполнять свою функцию.
2.4. Внести данные по последовательности в базу данных в соответствии с требованиями.
2.5. При обнаружении белка, провести дополнительный поиск по базе PubMed по ключевым словам, дополнив их названием белка. Внести дополнительные сведения в таблицу базы данных.
Б. Проведение анализа
Выбор сигнальных последовательностей для дальнейшего использования в лабораторной практике по базе данных сигнальных последовательностей проводят с учетом следующих требований:
Провести поэтапный отбор последовательностей по следующим критериям:
1. Отобрать последовательности длиной от 10 до 60 аминокислот.
2. Отобрать последовательности, для которых не требуется наличие других сигналов в белке для выполнения функции.
3. Отобрать последовательности, для которых описано сохранение функциональной активности при переносе в гетерологичный белок.
4. Должна быть описана функция последовательности (тип сигнала).
5. Должен быть охарактеризован механизм действия - за счет взаимодействия с какими белками происходит выполнение функций.
6. Успешное применение данного пептида в гетерологичном белке или системе.
Оформление результатов
База данных сигнальных последовательностей и информация об отобранных сигнальных последовательностях должны представлять собой таблицу, со следующими графами:
1. Белок
2. Сигнал
3. Длина, а.к.
4. Последовательность а.к.
5. Функция сигнала
6. Дополнительные сигналы/взаимодействия
7. Применение в гетерологичном белке.
8. Ссылка
Клонирование нуклеотидных последовательностей
Хранение и культивирование бактериального штамма.
Для краткосрочного хранения бактериального штамма E. coli (Escherichia coli DH5α (F-ϕ801acZΔM15 Δ(lacZYA-argF)U169 recA1 endA1 hsdR17(rk-, mk+) phoA supE44 thi-1 gyrA96 relA1 λ-) (Invitrogen)) клетки высеять на чашки Петри со средой LB-агар (10 г/л бакто-триптон, 5 г/л дрожжевой экстракт, 0.17 М NaCl, 15 г/л бакто-агар). При необходимости длительного хранения клетки заморозить в среде LB с 50% глицерином. Культивирование бактерий проводить в жидкой среде LB с добавлением канамицина (50 мг/мл) при перемешивании (190 об/мин) при 37°С.
Приготовление компетентных клеток E. coli
Одиночную бактериальную колонию с чашки пересеять в 3 мл LB (10 г/л бакто-триптон, 5 г/л дрожжевой экстракт, 0,17 М NaCl) и растить при перемешивании при 200-300 об/мин на 37°С 18 ч. Затем 2 мл суспензии перенести в 200 мл LB и растить при перемешивании при 18-23°С до достижения оптической плотности культуры клеток D600=0,5 о.е. (при длине оптического пути 1 см). Клетки собрать центрифугированием при 3500 об/мин в течение 10 мин при 4°С в центрифуге К-23. Осадок ресуспендировать в 60 мл холодного буфера TFB1 (30 мМ KAc, 50 мМ MgCl2, 100 мМ KCl, 15% (v/v) глицерин, pH 5.8) и инкубировать 30 мин на льду. Затем клетки центрифугировать при 6000×g в течение 5 мин при 40°С, осадок ресуспендировать в 8 мл буфера TFB2 (10 мМ KCl, 10 мМ MOPS pH 7.0, 75 мМ CaCl2, 15% (v/v) глицерин) и инкубировать 10-20 мин во льду. После инкубации во льду в течение 15 мин аликвоты (200 мкл) суспензии перенести в стерильные пробирки, заморозить в жидком азоте и хранить при -70°С.
Трансформация бактериальных клеток
К 200 мкл суспензии компетентных клеток штамма DH5α E. Coli добавить 20-200 нг плазмидной ДНК и инкубировать 30 мин во льду. Трансформацию проводить методом теплового шока при 42°С в течение 45 сек с последующим выдерживанием во льду в течение 3-5 мин. Добавить к клеткам 800 мкл жидкой среды LB, подрастить при перемешивании 40-60 мин при 37°С, высеять на чашки Петри с LB-агаром, содержащим канамицин (50 мг/мл), и инкубировать при 37°С в течение 14-20 ч.
Выделение плазмидной ДНК
Для стандартных процедур молекулярного клонирования препараты плазмидной ДНК выделять с использованием наборов Plasmid Mini-prep (Qiagen) или аналогов. Выделение проводить согласно протоколу, рекомендованному производителем с использованием прилагающихся реактивов и колонок. Все выделенные образцы плазмидной ДНК анализировать электрофорезом в агарозном геле. Концентрацию плазмидной ДНК определить на приборе NanoDrop-1000.
Рестрикционный анализ ДНК
Рестрикция ДНК (плазмид и ПЦР-фрагментов) проводить в объеме 10-30 мкл. Для реакции использовать: 1× буфер рестрикции, соответствующий выбранной рестриктазе, ДНК в количестве 1-2 мкг и 2-5 единиц активности фермента. Смесь инкубировать в течение 2-4 ч при 30-37°С. После окончания реакции ферменты инактивировать нагреванием до 65 или 80°С в течение 20 мин.
Лигирование фрагментов ДНК
В ДНК-лигазном буфере смешать вставку в трехкратном избытке и плазмидный вектор. На реакцию использовать 25-30 нг вектора, рассчитанное количество вставки, 1, 2 ед. активности ДНК-лигазы. Лигирование проводить в 10 мкл в течение 6 ч при комнатной температуре или в течение ночи при 14°С.
Электрофорез ДНК в агарозном геле
Образцы ДНК смешать с 6× буфером нанесения (0.25% бромфеноловый синий, 30% глицерин) и разделять в 1% агарозном геле, содержащем 0,5 мкг/мл бромистого этидия. Электрофорез проводить в буфере ТАЕ (40 мМ Трис, 20 мМ уксусная кистота, 1 мМ ЭДТА pH 8.0). Визуализацию ДНК в геле осуществять в трансиллюминаторе. Регистрацию свечения проводить с помощью системы Kodak на цифровую камеру и изображение обработать с использованием программного обеспечения KdS (Kodak).
Выделение фрагментов ДНК из геля
Фрагменты ДНК в геле детектировать по свечению в ультрафиолетовом свете. Нужные фрагменты идентифицировать по соответствию с положением маркеров. Фрагмент геля с фрагментом ДНК вырезать и экстрагировать с использованием набора Wizard SV Gel andPCR Clean-Up System (Promega). А именно, фрагмент геля растворить в буфере Membrane Binding Solution в соотношении 10 мкл раствора на 10 мкг геля при температуре 50-65°С в течение 10 мин. Растворившийся гель перенести на колонку, инкубировать 1 мин при комнатной температуре и центрифугировать 1 мин при 16000×g на настольной центрифуге Eppendorf MiniSpin. Колонку дважды промыть буфером Membrane Wash Solution в количестве 700 мкл и 500 мкл и цетрифугировать в течение 1 и 5 мин при 16000×g, соответственно. Для удаления остатка буфера промывки провести дополнительное центрифугирование 1 мин. Для элюции ДНК на колонку добавить 50 мкл буфера Nuclease-Free Water и инкубировать 1 мин при комнатной температуре и центрифугировать при 16000×g. Эффективность очистки контролировать электрофорезом в агарозном геле.
Полимеразная цепная реакция
Приготовить стандартную реакционную смесь (50 мкл), содержащую: 50-100 нг ДНК-матрицы, по 100 пкмоль праймеров, по 150 мкМ каждого dNTP, 5 ед. Taq ДНК-полимеразы в 1×Taq-буфере (10 мМ Трис-HCl pH 8.8, 50 мМ KCl, 1.5 мМ MgCl2) и 0,5 ед. Pfu ДНК-полимеразы в 1× Pfu-буфере (20 мМ Трис-HCl pH 8.8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgSO4) для ДНК-полимеразы. Полимеразную цепную реакцию (ПЦР) проводить на приборе iCycler (BioRad) согласно следующей схеме: предварительная денатурация - 94°С (1 мин), 25-30 циклов, состоящих из стадий денатурации (94°С, 25 сек), отжига праймеров на ДНК-матрице (58°С, 45 сек) и их элонгации (72°С, 5 мин). Режим амплификации определять исходя из нуклеотидного состава праймеров и длины амплифицируемого фрагмента. Расчет температуры отжига праймера до 24 нуклеотидов проводить по формуле:
t=2×n(A/T)+4×n(G/C)-5,
где n - число соответствующих нуклеотидов; t - температура в градусах Цельсия.
Время достройки рассчитать из соотношения, что скорость работы Taq полимеразы: 1000 нт/45 сек, Pfu полимеразы: 1000 нт/мин.
В случае ПЦР с колоний до добавления фермента вместо ДНК-матрицы в реакционной смеси ресуспендировать часть исследуемых колоний E. coli.
Экспрессия, выделение и очистка рекомбинантных белков
Общая схема экспрессии, выделения и очистки химерных рекомбинантных белков, полученных на основе бактериального экспрессируемого вектора рЕТ 29в, включает следующие этапы:
1. Трансформация плазмидной ДНК в клетки BL21(DE3) E. Coli
2. Проверка экспрессии белков в бактериальных клетках BL21(DE3) E. Coli
3. Препаративное приготовление бактериальных клеток и получение телец включения
4. Очистка химерных рекомбинантных белков на колонке с Ni-NTA агарозой
5. Диализ и концентрирование химерных рекомбинантных белков
Подробные протоколы экспрессии, выделения и очистки химерных рекомбинантных белков из пыльцы березы прилагаются отдельным документом. Методики разработаны на основании различных методик, применяемых для очистки рекомбинантных белков.
Получение компетентных клеток BL21(DE3) E. Coli
Колонию клеток штамма BL21(DE3) E. Coli перенести в 3 мл среды LB и растить при перемешивании 200-300 об/мин при 37°С в течение ночи. Затем 0.5 мл культуры перенести в 20 мл питательной среды LB и растить при перемешивании 200-300 об/мин при 37°С до D600=0,5 о.е. (при длине оптического пути 1 см). Собрать клетки в эппендорфы и центрифугировать при 3500 об/мин в течение 10 мин при 4°С. Осадок клеток суспендировать в 700 мкл 0.1 М MgCl2 и центрифугировать при 3500 об/мин в течение 10 мин при 4°С. К осадку добавить 100 мкл 0.1 М MnCl2 и 100 мкл 0.1 М CaCl2, ресуспендировать пипетированием и инкубировать на льду на 20 мин.
Трансформация плазмидной ДНК в клетки BL21(DE3) E. Coli
К 200 мкл суспензии компетентных клеток штамма BL21(DE3) E. Coli добавить 20-200 нг плазмидной ДНК и инкубировать 30 мин во льду. Трансформацию проводить методом теплового шока при 42°С в течение 45 сек с последующим выдерживанием во льду в течение 3-5 мин. После прибавления 800 мкл жидкой среды LB клетки подрастить при перемешивании 40-60 мин при 37°С, высеять на чашки Петри с LB-агаром, содержащим канамицин (50 мг/мл), и инкубировать при 37°С в течение 14-20 ч.
Проверка экспрессии белков в бактериальных клетках BL21(DE3) E. Coli
Одиночную бактериальную колонию с чашки пересеять в 3 мл LB с 50 мг/мл канамицином и растить при перемешивании при 200-300 об/мин на 37°С 18 ч. Затем 0.5 мл культуры перенести в 5 мл среды LB с 50 мг/мл канамицина и растить при перемешивании на 37°С до оптической плотности D600=0,6-0.8 о.е. (при длине оптического пути 1 см). В стерильных условиях отобрать 500 мкл культуры (не индуцированный контроль). К оставшейся суспензии клеток добавить стерильный раствор IPTG до конечной концентрации 0.5 мМ и инкубировать 4 часа на 37°С при перемешивании. Отобрать по500 мкл суспензий клеток (индуцированный контроль). Центрифугированием осадить клетки в контрольных образцах и лизировать в 2×буфере нанесения (50 мМ Трис-HCl pH 6.8, 2% SDS, 10% глицерин, 2% β-меркаптоэтанол, 0.025% бромфеноловый синий). Проверку экспрессии рекомбинантного белка проводить в 16% ПААГ в денатурирующих условиях.
Далее настоящее изобретение будет подробно проиллюстрировано со ссылкой на конкретные примеры, представляющие собой наиболее предпочтительные воплощения данного изобретения. При этом должно быть понятно, что изобретение не ограничивается этими описанными воплощениями. Напротив, предполагается, что оно включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Пример 1. Получение библиотеки кДНК генов, экспрессирующихся в пыльце березы.
1. Из пыльцы березы была выделена мРНК с использованием кита RNeasy Plant Mini Kit (Qiagen)
2. Была получена SMART-амплифицированная кДНК [
А. Синтез первой цепи кДНК:
0.15 мкг РНК
10 pmol SMART Oligo II олигонуклеотид
(содержит рибоG нуклеотиды на 3' конце)
10 pmol CDS праймер
(содержит d(Т)30 на 3' конце)
Реакционная смесь (5 мкл) прогревалась 2 минуты при 72°С,
после этого охлаждалась на льду 2 минуты
Далее была добавлена обратная транскриптаза в смесь (10 мкл), содержащую
1X First-Strand Buffer (50 mM Tris-HCl (pH 8.3); 75 mM KCl; 6 mM MgCl2)
2 mM DTT
1 mM of each dNTP
Реакция обратной транскрипции велась при 42°С 1,5 часа. Б. Синтез второй цепи кДНК:
Полученная одноцепочечная кДНК была разбавлена в 5 раз ТЕ буфером, прогрета при 72°С 7 минут и использовалась для амплификации с помощью Long-Distance PCR [92].
ПЦР реакция (50 мкл) содержит
1 мкл разбавленной одноцепочечной кДНК
1 × Advantage 2 reaction buffer (BD Biosciences Clontech)
200 мкМ dNTPs
0.3 мкМ SMART PCR праймер
1 × Advantage 2 Polymerize mix (BD Biosciences Clontech)
Проведено 16 циклов ПЦР на амплификаторе MJ Research РТС-200 DNA Thermal Cycler
Режим амплификации:
95°С 7 сек
65°С 20 сек
72°С 3 мин
Амплифицированная кДНК очищена с помощью QIAquick PCR Purification Kit (Qiagen).
Препарат к-ДНК проанализирован в агарозном геле (Фиг. 1).
Всего получено 2 мкг двуцепочечной кДНК. КДНК растворена в воде до концентрации 40 нг/мкл.
Таким образом, получен препарат двуцепочечной библиотеки кДНК генов из пыльцы березы повислой.
Пример 2. Отбор сигнальных пептидов, регулирующих иммунный ответ.
Выбор сигнальных последовательностей для дальнейшего использования в лабораторной практике по базе данных сигнальных последовательностей проводят с учетом следующих требований:
Провести поэтапный отбор последовательностей по следующим критериям:
1. Отобрать последовательности длиной от 10 до 60 аминокислот.
2. Отобрать последовательности, для которых не требуется наличие других сигналов в белке для выполнения функции.
3. Отобрать последовательности, для которых описано сохранение функциональной активности при переносе в гетерологичный белок 4. Должна быть описана функция последовательности (тип сигнала).
5. Должен быть охарактеризован механизм действия - за счет взаимодействия с какими белками происходит выполнение функций.
6. Успешное применение данного пептида в гетерологичном белке или системе.

1. Zhang М., Pickart С.М., Coffino P. Determinants of proteasome recognition of ornithine decarboxylase, a ubiquitin-independent substrate. EMBO J. 2003. 22, 1489-1496.
2. Odorizzi C.G., Trowbridge I.S., Xue L., Hopkins C.R., Davis C.D., Collawn J.F. Sorting signals in the MHC class II invariant chain cytoplasmic tail and transmembrane region determine trafficking to an endocytic processing compartment. J. Cell Biol. 1994. 126, 317-330.
Пример 3. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V1.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-29b(+) (Novagen). Ген Bet V1 получен полимеразной цепной реакцией с кДНК пыльцы березы, с использованием смеси Taq и Pfu полимераз (1:1) и праймеров:
Top-V1/NdeI
5'-CGAGCGTCATATGGGTGTTTTCAATTACGAAAC-3'
Bot-V1/XhoI
5'-CAGTATCTCGAGGTTGTAGGCATCGGAGTGTG-3'
Полученный ПЦР-фрагмент (483 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-29b(+) по сайтам NdeI и XhoI. Наличие вставки, соответствующей гену BetV1, проверено рестриктным анализом (Фиг. 2). Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 4. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V2.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-29b(+) (Novagen). Ген Bet V2 получен полимеразной цепной реакцией с кДНК пыльцы березы с использованием смеси Taq и Pfu полимераз (1:1) и праймеров: TopV2/NdeI.
5'-GTCAGTCATATGTCGTGGCAAACGTACGTGGATG-3'
BotV2/XhoI
5'-GTGCGTCTCGAGCAGGCCCTGGTCAATAAGGTA-3'
Полученный ПЦР-фрагмент (402 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-29b(+) по сайтам NdeI и XhoI. Наличие вставки, соответствующей гену BetV2, проверено рестриктным анализом (Фиг. 3). Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 5. Получение генно-инженерной конструкции, несущей фрагмент ДНК орнитиндекарбоксилазы мыши
Все стадии молекулярного клонирования и анализа проводить в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использовать плазмиду pCI-Neo (Promega).
Ген орнитиндекарбоксилазы мыши получить полимеразной цепной реакцией на кДНК мыши, используя Pfx полимеразу и праймеры:
Nhe-ODC-top
5'-CGCAGTAGCGGCTAGCATGAGCAGCTTTACTAAGGAC-3'
Xho-ODC-bot
5'-GACTATCTACTCGAGCACATTGATCCTAGCAGAAG-3'
Полученный ДНК-фрагмент (1387 п.н.) очистить с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонировать в вектор pCI-Neo по сайтам NheI/XhoI. Наличие вставки, соответствующей гену ODC, проверить рестриктным анализом. Нуклеотидную последовательность клонированного фрагмента подтвердить секвенированием района встройки.
Пример 6. Получение генно-инженерной конструкции, несущей короткий фрагмент ДНК инвариантной цепи человека с помощью олигонуклеотидов
Данная методика предполагает использование пяти олигонуклеотидов для сборки короткого ДНК-фрагмента:
1. IC_1-45 - первая половина (45 нт) последовательности клонируемого фрагмента инвариантной цепи.
2. IC_46-90 - вторая половина (45 нт) последовательности клонируемого фрагмента инвариантной цепи.
3. IC-mid - олигонуклеотид-сшивка (35 нт), комплементарный двадцати 3'-концевым нуклеотидам IC_1-45 и пятнадцати 5'-концевым нуклеотидам IC_46-90.
4. IC-F (29 нт) - прямой праймер для проведения ПЦР-реакции, состоящий из 4 нт для посадки рестриктазы, 6 нт рестрикционного сайта EcoRI и 19-нуклеотидной последовательности, идентичной 19-ти 5'-концевым нуклеотидам IC_1-45.
IC-R (28 нт) - обратный праймер для проведения ПЦР-реакции, состоящий из 4 нт для посадки рестриктазы, 6 нт рестрикционного сайта XbaI и 18 нт, комплементарных 18-ти 5'-концевым нуклеотидам IC_46-90.
Методика включает в себя несколько последовательных этапов:
А. 5'-Фосфорилирование праймера IC_46-90
Реакционную смесь объемом 40 мкл, содержащую 1× буфер А для полинуклеотидкиназы (PNK), 50 пмоль олигонуклеотида IC_46-90, 5 мМ АТФ и 10 единиц активности PNK, инкубировать 1 час при 37°С.
Б. Отжиг праймеров
После прохождения реакции фосфорилирования в реакционную смесь добавить олигонуклеотиды IC_1-45 и IC-mid, прогреть при 94°С в течение 1 мин в термостате, а затем смесь медленно, в течение 1-2 ч, охладить до комнатной температуры.
В. Лигирование
К остывшей реакционной смеси добавить 10 мМ АТФ и 1 ед. активности лигазы и инкубировать 1 час при 37°С
Г. Полимеразная цепная реакция
В реакционную смесь для ПЦР внести:
- 5 пмоль образовавшегося ДНК-фрагмента (10 мкл лигазной смеси с предыдущего шага);
- по 1 мкМ прямого и обратного праймеров (IC-F и IC-R, соответственно);
- 0.2 мМ смеси дезоксинуклеотидов;
- Pfu-полимеразу в количестве, достаточном для синтеза фрагмента длиной 100 п.н. в ходе циклов ПЦР.
Смесь готовить на 1×буфере для Pfu-полимеразы (Fermentas), содержащем MgSO4.
Амплификацию фрагментов проводить на приборе iCycler (BioRad) по следующей схеме:

В качестве базового вектора использовать плазмиду pCI-Neo (Promega).
Полученный ДНК-фрагмент (93 п.н.) очистить с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонировать в вектор pCI-Neo по сайтам EcoRI/XbaI. Наличие вставки, соответствующей гену Ii, проверить рестрикционным анализом. Нуклеотидную последовательность клонированного фрагмента подтвердить секвенированием района встройки.
Пример 7. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V1 с сигнальным пептидом ODCsig.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-BetV1.
Ген ODCsig получен полимеразной цепной реакцией с плазмиды pCIneoODC, с использованием смеси Taq и Pfu полимераз (1:1) и праймеров:
TopXhoI\ODCsig:
5'-GTGGTTGCCCTCGAGTCACGGCCAATG-3'
BotXhoI\ODCsig:
5'-CGATCATCGGTCTCGAGCACATTGATC-3'
Полученный ДНК-фрагмент (162 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-BetVl по сайту XhoI. Наличие вставки, соответствующей гену ODCsig, проверено рестриктным анализом (Фиг. 4). Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 9. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V1 с сигнальным пептидом Ii.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-BetV1.
Ген Ii получали по методике, созданной для клонирования коротких участков ДНК.
Методика основана на сборке фрагментов ДНК из набора олигонуклеотидов.
Полученный ДНК-фрагмент (93 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-BetV1 по сайтам NdeI. Наличие вставки, соответствующей гену Ii, проверено рестриктным анализом (Фиг. 4). Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 10. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V2 с сигнальным пептидом ODCsig.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-BetV2.
Ген ODCsig получен полимеразной цепной реакцией с плазмиды pCIneoODC, с использованием смеси Taq и Pfu полимераз (1:1) и праймеров:
TopXhoI\ODCsig:
5'-GTGGTTGCCCTCGAGTCACGGCCAATG-3'
BotXhoI\ODCsig:
5'-CGATCATCGGTCTCGAGCACATTGATC-3'
Полученный ДНК-фрагмент (162 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-BetV2 по сайту XhoI. Наличие вставки, соответствующей гену ODCsig, проверено рестриктным анализом (Фиг. 5). Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 11. Получение генно-инженерной конструкции, несущей ген-эквивалент белка с антигенными эпитопами актуального аллергена Bet V2 с сигнальным пептидом Ii.
Все стадии молекулярного клонирования и анализа проведены в соответствии с общими методиками, приведенными выше.
В качестве базового вектора использована плазмида pET-BetV2.
Ген Ii получали по методике, созданной для клонирования коротких участков ДНК.
Методика основана на сборке фрагментов ДНК из набора олигонуклеотидов.
Полученный ДНК-фрагмент (93 п.н.) очищен с использованием набора Wizard SV Gel и PCR Clean-Up System (Promega) и клонирован в вектор pET-BetV1 по сайтам NdeI.
Наличие вставки, соответствующей гену Ii, проверено рестриктным анализом (Фиг. 5).
Нуклеотидная последовательность клонированного фрагмента подтверждена секвенированием района встройки.
Пример 12. Получение рекомбинантых белков
В соответствии с методиками, представленными ниже, были выделены химерные рекомбинантные белки-аллергены: Bet V2-ОДК, Ii-Bet V2. Применение данных методик позволяет получить 1-2 мкг белка аллергена из 1 л бактериальной культуры. Выход такого порядка является высоким. Выполнение данной методики занимает всего три дня. Чистота получаемого продукта составляет порядка 90%, что достаточно и стандартно для белков, применяемых в иммунных тестах.
В ходе выполнения методик проводится анализ фракций колонки (Фиг. 6, 8), а также проверка чистоты конечного препарата белка (Фиг. 7, 9) с помощью электрофореза в ПААГ с последующим окрашиванием Кумасси.
Концентрация белка BetV2-ODCsig в образце составила 8,2 мг/мл.
Всего получено 8,2 мг белка.
Концентрация белка BetV2-Ii в образце составила 1,3 мг/мл.
Всего получено 1,3 мг белка BetV2-Ii.
Препаративное приготовление культуры
Колонию бактериальных клеток с чашки Петри перенести в 200 мл среды LB с 50 мг/мл канамицина и инкубировать 18 ч при 200-300 об/мин 37°С. Затем 200 мл культуры перености в 2 л среды LB с 50 мг/мл канамицина и растить при перемешивании на 37°С до оптической плотности D600=0,6-0.8 о.е. (при длине оптического пути 1 см). Отобрать аликвоту до индукции, клетки осадить центрифугированием и заморозить. К оставшейся суспензии клеток добавлен стерильный раствор IPTG (изопропил-β-D-тиогалактопиранозид) до конечной концентрации 0.5 мМ и инкубирован 4 часа при перемешивании на 37°С. Клетки осадить центрифугированием при 3500 об/мин в течение 30 мин при 4°С на центрифуге К-23 и осадок заморозить -70°С. При непосредственном переходе к следующей стадии, замораживать клетки не требуется.
Получение телец включения
Осадок клеток суспендировать в буфере А: 50 мМ Tris-Cl pH 8.0, 0.2 М NaCl, 2% Triton Х-100, 1 мМ EDTA из расчета 25 мл на 1 л исходной культуры. Клетки разрушить обработкой на ультразвуковом приборе УЗД2-0.063/22. Клеточный дебрис осадить центрифугированием 15000×g 30 мин. Насадочную жидкость удалить, а осадок сохранить.
Препаративная очистка на колонке с Ni-NTA агарозой
Осадок суспендировать в лизирующем буфере (5 мМ Tris-Cl pH 8.0, 0.5 М NaCl, 8 М мочевина). Осветленный лизат, полученный после центрифугирования и содержащий целевой белок, инкубировать с Ni-NTA агарозой (Qiagen), предварительно промытой лизирующим буфером в течение 3 ч при +4°С при медленном покачивании. Затем полученную суспензию перенести на колонку, которую последовательно промыть буфером С (50 мМ Tris-Cl pH 8.0, 0.5 М NaCl, 8 М мочевина) с 10 мМ и 25 мМ имидазола, каждый раз собирая аликвоты. Целевой белок элюировать буфером элюции (50 мМ Tris-Cl pH 7, 0.25 М NaCl, 6 М мочевины, 0,25 М имидазола, 0.02 М ЕДТА), фракции собрать. Полученные фракции анализировать в 16% ПААГ в денатурирующих условиях на наличие целевого белка.
Гель-электрофорез и иммуноблоттинг
Для разделения белков электрофорезом в полиакриламидном геле в денатурирующих условиях образцы прокипятить 3 мин в буфере нанесения (50 мМ Трис-HCl pH 6.8, 2% SDS, 10% глицерин, 2% β-меркаптоэтанол, 0.025% бромфеноловый синий) и нанести на гель. Электрофорез проводить в буфере (25 мМ Трис-HCl, 250 мМ глицин, 0.1% SDS) в 5% концентрирующем геле (130 мМ Трис-HCl pH 6.8, 0.1% SDS) и 16% разделяющем геле (375 мМ Трис-HCl pH 8.8, 0.1% SDS) при постоянной силе тока 20 мА.
Белки, разделенные в 16% полиакриламидном геле в денатурирующих условиях, перенести на нитроцеллюлозную мембрану (BioRad) с помощью электропереноса в буфере (48 мМ Трис, 39 мМ глицин, 0.037% SDS, 10% этанол) при силе тока 1-1.5 мА на см2 мембраны в течение 2 часов. Для блокирования неспецифического связывания мембраны инкубировать ночь при +4°С в блокирующем буфере (80 мМ Na2HPO4, 20 мМ NaH2PO4, 100 мМ NaCl, 0.1% Tween-20), содержащем 5% обезжиренное молоко. Связывание антител проводить в блокирующем буфере в течение часа при комнатной температуре и покачивании. Для выявления белков использовать моноклональные антитела на 6×His tag (Abcam) в разведении 1:1000 и вторичные антитела против IgG мыши, конъюгированные с пероксидазой хрена (Jackson), в разведении 1:5000. Иммунные комплексы на мембране выявлять с помощью флуоресцентной системы детекции ECL plus™ (GE Healthcare) и сигналы зарегистрировать на рентгеновскую пленку (FujiFilm). Пленку сканировать и данные обработать в программе ImageJ (http://rsb.info.nih.gov/ij).
Определение концентрации белка по методу Брэдфорд
К 1-10 мкг белка, разведенного в 100 мкл 0.15 М NaCl, добавить 1 мл раствора красителя (100 мг/л кумасси бриллиантового синего G-250, 50 мл 96% этанола, 100 мл 85% (масс./об.) фосфорной кислоты) и перемешать. Через 5 мин измерить поглощение при длине волны 595 нм. Концентрацию белка в образце определить по калибровочному графику.
Диализ и концентрирование белков
Раствор белка поместить в диализный мешок и погрузить в буфер диализа (50 мМ Tris-Cl pH 8.0, 0.2 М NaCl). Процедуру проводить при 4°С при перемешивании в течение 18 часов. Объем раствора для диализа использовать в 100-кратном избытке по отношению к объему образца диализуемого белка.
В качестве альтернативной диализу процедуры, для уменьшения концентрации солей в растворе белка и его концентрирования, использовать концентраторы Vivaspin 2 (Sartorius stedim). Фракции, содержащие рекомбинантный белок, объединить и разбавить буфером (50 мМ Tris-Cl pH 7.5, 0.25 М NaCl) для того, чтобы снизить концентрацию мочевины до 2М. Нерастворимые частицы удалить центрифугированием при 5000×g 20 мин при 4°С. Полученный раствор белка сконцентрировать до минимального объема центрифугированием при 5000 об/мин с использованием концентраторов Vivaspin 2 (Sartorius stedim) с мембраной, пропускающей белки с молекулярной массой до 10 кДа.
Хранение белков
Фракции промывки и элюции и готовые белковые препараты хранить на +4°С не более 24 ч. При более длительном хранении использовать растворы с 20% содержанием глицерина на -20°С. Белковый препарат, выпавший в виде осадка при диализе, хранить в 70% этаноле при -20°С.
Пример 13. Оценка иммунологической эффективности полученного иммуногена BetV2-ODCsig
Иммунизация мышей
Для иммунизации использовали мышей (самок) линии BALB/c весом 18-25 г.
Две группы по 12 мышей иммунизировали внутримышечно полученным ранее белком аллергеном BetV2-ODCsig и выделенным по такому же протоколу немодифицированным белком BetV2 соответственно. Повторные инъекции проводили на 4 и 8 недели от начала иммунизации. Препараты вводились в количестве 50 мкг, растворенных в 100 мкл раствора 0.9% NaCl. На пятые сутки после третьей иммунизации проводили забор крови для получения сывороток.
Иммуноферментный анализ антител в сыворотке крови мышей
Уровень специфических антител против белка BetV2 в сыворотке крови иммунизированных мышей определяли методом твердофазного иммуноферментного анализа (ELISA). Тест проводили на 96-луночных планшетах для ИФА. Посадку антигена (белка BetV2) 0.2 мг/мл проводили в 0.1 М карбонатном буфере pH 9.2 при 4°С.
Затем осуществляли отмывку 4 раза буфером PBS с 0.01% Твин 20. Для анализа исследуемые сыворотки мышей разводили 5% раствором сывороточного альбумина человека в буфере PBS с 0.01% Твин 20. Разведенные сыворотки инкубировали в планшете с иммобилизованным BetV2 в течение 16 ч при 4°С, отмывку проводили, как описано выше. Далее проводили инкубацию с вторичными антителами: конъюгированными с пероксидазой хрена иммуноглобулинами козы, специфичными к IgG мыши, разведенными 1:1000 в буфере для разведения сывороток. Инкубацию проводили в течение 1 ч при 37°С, после чего не связавшиеся антитела отмывали. Для проявления реакции добавляли субстратный раствор (0.4 мг/мл OPD в 0.05 М фосфат-цитратном буфере с 0.03% Н2О2) и инкубировали 30 минут при комнатной температуре.
Реакцию останавливали раствором 2 М серной кислоты.
Измерение оптической плотности проводили при 492 нм.
При использовании иммуноферментного анализа показано, что титры антител против BetV2 у мышей, иммунизированных немодифицированным белком BetV2, составляют для IgG1 - 1:800, a IgG2 - 1:350. Напротив, для белка BetV2-ODCsig значения титров антител примерно одинаковые: IgG1 - 1:750, a IgG2 - 1:700, что может косвенно указывать на некоторое усиление Th1 иммунного ответа.
Пример 14. Профилактическая вакцинация мышей
Иммунизацию мышей линии BALB/c провели по схеме из Примера 13.
Затем животным вводили внутрибрюшинно 20 мкг/мышь экстракта пыльцы тимофеевки по схеме 7 раз через день. Через три недели после окончания инъекций проводили восьмикратное ежедневное интраназальное введение экстракта в дозе 500 мкг/мышь. Аллергены пыльцы березы и пыльцы тимофеевки имеют перекресты в IgE эпитопах белков, поэтому на полученной модели мышей можно протестировать влияние белка BetV2-ODCsig на течение аллергической реакции.
Через двое суток после введения последней дозы экстракта проводили забор крови для получения сывороток. Методом иммуноферментного анализа (протокол из Примера 13, используя вторичные антитела к IgE мыши) проанализировали содержание BetV2 специфичных IgE в сыворотках, титры которых составили 1:1000 в случае BetV2 и 1:250 для BetV2-ODCsig. Таким образом, наблюдаемое снижение уровня IgE в крови мышей, вакцинированных BetV2-ODCsig, может говорить об эффективности данного препарата для профилактики аллергии.
Пример 15. Оценка устойчивости и стабильности полученных молекулярных конструкций на примере белка BetV2-ODCsig
Иммунобиологические препараты белковой природы чаще всего рекомендуется хранить в сухом лиофилизированном виде при температуре от 2 до 8°С. В таких условиях материал может оставаться интактным до 24 месяцев (не менее 6 месяцев). Для проверки сохранности белка BetV2-ODCsig были проведены следующие эксперименты:
1. Белок BetV2-ODCsig экспрессировали и выделили по методике, описанной в примере 12, препарат (в буфере после диализа) лиофилизировали и оставили на 6 месяцев в холодильнике при температуре 4°С.
2. Белок BetV2-ODCsig экспрессировали и выделили по методике, описанной в примере 12, препарат (в буфере после диализа) лиофилизировали и оставили на 1 месяц в холодильнике при температуре 4°С.
Затем оба препарата восстановили растворением в соответствующем объеме воды и проанализировали их качество с помощью электрофореза в полиакриламидном геле (Фиг. 10). Как видно на фореграмме, деградации белка BetV2-ODCsig не наблюдается, то есть полученный препарат обладает устойчивостью и стабильностью.