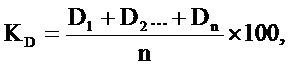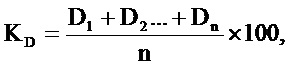Результат интеллектуальной деятельности: Способ определения типа противомикробного действия соединения, обладающего антимикробной активностью
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к медицинской микробиологии, и может быть использовано для определения типа противомикробного действия фармакологических веществ в процессе изучения их противомикробной активности.
Исследование противомикробной активности новых соединений включает как традиционное изучение минимальной подавляющей концентрации (МПК) вещества, так и других показателей, одним из которых является определение типа действия (бактерицидное или бактериостатическое) [1, 2]. Исследователи новых противомикробных соединений сталкиваются с различными проблемами на этом пути – рутинность и длительность исторически сложившихся классических методик, дороговизна питательных сред, одноразовой лабораторной посуды, недоступность традиционно применяемой аппаратуры и диагностических систем для исследований новых соединений.
Классические методы определения типа противомикробного действия включают длительные периоды наблюдения от 5 сут и более, большие затраты исследуемых соединений и питательных сред [3].
Современные методы основаны на исследовании и сравнении МПК и минимальных бактерицидных концентраций (МБК). Данные показатели дают возможность условно классифицировать новое соединение по типу действия на бактериальную клетку [1, 2].
Наиболее близким техническим решением к заявленному изобретению является методика проведения опытов при воздействии исследуемых соединений в физиологическом растворе при комнатной температуре и коротких экспозициях [3].
Недостатками известного решения являются затраты большого количества испытуемого препарата, питательной дорогостоящей среды (Мюллер-Хинтон бульон (МХБ)), лабораторной посуды и необходимость наблюдения в течении 5-7 сут. Результат оценивается с помощью невооруженного глаза, что не прибавляет точности в исследование, либо с последующим использованием чашек Петри с Мюллер-Хинтон агаром (МХА), также дорогостоящей питательной средой, для высева микроорганизмов и инкубирования в течение 18-20 ч, а это прибавляет еще сутки к проводимому эксперименту.
Задача изобретения заключается в разработке способа определения противомикробного действия (бактериостатическое или бактерицидное) на основе вычисления коэффициента оптической плотности культуральной среды в ходе культивирования микроорганизмов с противомикробными соединениями в жидкой питательной среде.
Технический результат заключается в быстром и качественном определении типа противомикробного действия биологически активных соединений за счет использования небольшое количество питательной среды при достаточно коротком временном интервале, составляющем 24 ч.
Новизна способа состоит в разработке опытным путем формулы расчета и определении показателей коэффициента оптической плотности культуральной среды, соотносящиеся с бактериостатическим типом действия и бактерицидным типом действия исследуемых соединений.
Сущность изобретения заключается в том, что способ определения типа противомикробного действия новых соединений, обладающих антимикробной активностью включает проведение исследования оптической плотности культуральной жидкости в объеме 1 мл в стерильных кюветах при длине волны 600 нм, далее зависимость оптической плотности нового соединения со штаммом бактерий Staphylococcus aureus 6538-P обнуляют по показателям оптической плотности исследуемого соединения. Определяют оптическую плотность культуральной среды в присутствии штамма бактерий Staphylococcus aureus 6538-P, культивируемого при МПК в объеме 1 мл и при двух-, четырех- и шестикратном увеличении МПК исследуемого соединения. Определяют оптическую плотность культуральной среды с исследуемым микроорганизмом при культивировании без исследуемого соединения. На основе полученных показателей вычисляют коэффициент оптической плотности культуральной среды по формуле:

где КD – коэффициент оптической плотности культуральной среды,
D – оптическая плотность культуральной жидкости при культивировании микроорганизмов в присутствии различных концентраций противомикробного соединения,
n – количество исследованных концентраций соединения.
Показатель КD с исследуемым соединением более 1 свидетельствует, что исследуемое соединение обладает бактериостатическим типом действия в отношении исследуемого микроорганизма, если менее 1 – исследуемое соединение обладает бактерицидным типом действия в отношении исследуемого микроорганизма.
В основу заявленного способа определения типа противомикробного действия новых соединений, положено следующее обоснование:
Оптический метод изучения биомассы для количественного подсчета микроорганизмов позволяет достаточно быстро и точно определить концентрацию клеток в культуральной жидкости. В его основе лежит измерение ослабления пучка света при его прохождении через суспензию клеток. В определенных пределах оно обусловлено преимущественно рассеянием света клетками и пропорционально их концентрации. Величина этого показателя зависит от многих факторов: формы клеток, размера микроорганизмов, оптических свойств самой культуральной среды, длины световой волны и т. д. Поэтому способ имеет ограничения и пригоден лишь для тех микроорганизмов, которые вызывают равномерное помутнение питательной среды, и их рост не сопровождается образованием мицелия, пленок или других посторонних соединений. Очень важно чтобы среда для культивирования была оптически прозрачной. Бактерицидные препараты не позволяют размножаться чувствительным микроорганизмам, и их концентрация в культуральной среде мало отличается от таковой в «отрицательном контроле» (пробирка с микроорганизмами, которую помещают в холодильник при температуре 4 °С, при данной температуре рост микроорганизмов не наблюдается). Бактериостатические препараты задерживают рост и размножение чувствительных микроорганизмов и в культуральной среде при наличии МПК препаратов наблюдается изменение концентрации микроорганизмов. Выявлено, что оптическая плотность культуральной среды «отрицательного контроля» Staphylococcus aureus 6538-P АТСС составляет 0,003, а видимый рост микроорганизмов наблюдается при показателях оптической плотности культуральной среды более 0,21.
Способ разработан на основании исследования, в которое было включено 2 музейных штамма микроорганизмов (Streptococcus pyogenes 19615 АТСС и Staphylococcus aureus 6538-P АТСС) и апробирован как на традиционных антимикробных препаратах с доказанным бактерицидным и бактериостатическим типом действия, так и на группе новых соединений, синтезированных на основе замещенных 4-, 5-, 6-, 7-аминоиндолов, обладающих противомикробным действием [4-11]. В качестве традиционных противомикробных средств использовались бактерицидные – ампициллин и цефазолин, и бактериостатические – азитромицин и линкомицин [12].
Заявленный способ определения типа противомикробного действия новых соединений, обладающих антимикробной активностью, в литературе не описан.
Способ осуществляется следующим образом.
В качестве тест-микроорганизмов для изучения типа противомикробного действия исследуемых соединений используют музейные штаммы Streptococcus pyogenes 19615 АТСС (Becton Dickinson France S.A.S.) и Staphylococcus aureus 6538-P АТСС (ФБУН «ГНЦ ПМБ» («ГКПМ – Оболенск»).
Для изучения типа противомикробного действия новые исследуемые соединения используют в виде раствора (в качестве растворителя используют «Димексид» (концентрат для приготовления растворов для наружного применения, производство ОАО «Марбиофарм). Группа исследуемых соединений включает амиды, циклические амиды и пирролохинолон, полученные на основе 4-, 5-, 6- и 7-аминоиндолов:
1. Производное замещенного 4-амино-2-фенилиндола: 4-гидрокси-8-фенил-4-(трифторметил)-1,3,4,7-тетрагидро-2Н-пирроло[2,3-h]хинолин-2-он (лабораторный шифр 5D).
2. Производное замещенного 5-аминоиндола: 1,5-диметил-2-фенил-8-(трифторметил)-1,5-дигидро-6Н-пирроло-[2,3-g]хинолин-6-он (лабораторный шифр 39D).
3. Производные замещенных 6-аминоиндолов: N-(1,5-диметил-2-фенил-1Н-индол-6-ил)-4,4,4-трифтор-3-оксобутанамид (лабораторный шифр S3) и 9-гидрокси-5-метил-2-фенил-9-(трифторметил)-1,6,8,9-тетрагидро-7Н-пирроло[2,3-f]хинолин-7-он (лабораторный шифр 7D).
4. Производное замещенного 7-аминоиндола: 6-гидрокси-2,3-диметил-6-(трифторметил)-1,6,7,9-тетрагидро-8H-пирроло[3,2-h]хинолин-8-он (лабораторный шифр HD).
В качестве традиционных используют бактерицидные противомикробные препараты – ампициллин (порошок для приготовления раствора для в/м и в/в введения ОАО «Биохимик») и цефазолин (порошок для приготовления раствора для в/м и в/в введения ОАО «ЛЕККО») и бактериостатические – азитромицин (порошок для приготовления суспензии для приема внутрь АО «АВВА РУС») и линкомицин (раствор для в/в и в/м введения ОАО «Синтез»). Используют МПК исследуемых соединений и их двух-, четырех- и шестикратное увеличение. МПК исследуемых соединений готовят в объеме 1 мл.
Выбор исследуемых микроорганизмов осуществляется исходя из спектра противомикробного действия соединения.
Концентрация суспензии исследуемого микроорганизма составляет 1,5×108 КОЕ/мл. Оптическая плотность бактериальной суспензии с концентрацией 1,5×108 КОЕ/мл при визуальном контроле соответствует стандарту мутности 0,5 по Мак-Фарланду. Используют коммерческий стандарт мутности. Бактериальную суспензию готовят из агаровых культур. Для приготовления инокулюма используют чистую суточную культуру микроорганизмов, выросших на плотных питательных средах. Отбирают несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах. Петлей переносят незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором, доводя плотность инокулюма точно до 0,5 по стандарту Мак-Фарланда. Инокулюм используют в течение 15 мин после приготовления. МХБ (HiMedia Laboratories Pvt.Limited), как для определения чувствительности к противомикробным препаратам [13], разливают по 0,5 мл в каждую пробирку. Количество пробирок составляют пять штук, в том числе, одна для постановки «отрицательного» контроля. Рабочий раствор исследуемого соединения готовят из основного раствора с использованием жидкой питательной среды – МХБ. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносят в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивают и новым стерильным наконечником переносят 0,5 мл раствора исследуемого соединения в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяют, пока не приготовят весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляют. Таким образом, получают ряд пробирок с растворами исследуемого соединения, концентрации которых отличаются в соседних пробирках в 2 раза. Затем засевают культурой исследуемого микроорганизма. Конечная концентрация микроорганизма в каждой пробирке составляет примерно 5×105 КОЕ/мл. Все пробирки, кроме пробирки «отрицательный» контроль, инкубируют в обычной атмосфере при температуре 37 °С в течение 16-20 или 20-24 ч (в зависимости от вида тестируемого микроорганизма). Пробирку «отрицательный» контроль помещают в холодильник при температуре 4 °С, где хранят до учета результатов.
Для исследования оптической плотности культуральной среды используют фотоэлектроколориметр (ФЭК) Apel «AP-101». Фотоэлектроколориметрически исследуют оптическую плотность МХБ, МХБ с исследуемыми культурами микроорганизмов после инкубации при температуре 37 °С в течение 24 ч (положительный контроль); МХБ с исследуемыми культурами микроорганизмов, который после посева помещают в холодильник при температуре 4 °С, где хранят до учета результатов («отрицательный контроль»); МХБ с МПК исследуемых соединений без микроорганизмов; МХБ с МПК исследуемых соединений и исследуемыми культурами микроорганизмов после инкубации при температуре 37 °С в течение 24 ч. Исследования проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм.
Зависимость оптической плотности изучаемого соединения с культурой микроорганизмов обнуляют по показателям оптической плотности исследуемого вещества. Полученную оптическую плотность микроорганизмов, культивируемых в присутствии противомикробного соединения, используют для подсчета коэффициента оптической плотности культуральной среды по следующей формуле:

где КD – коэффициент оптической плотности культуральной среды,
D – оптическая плотность культуральной жидкости при культивировании микроорганизмов в присутствии различных концентраций противомикробного соединения,
n – количество исследованных концентраций соединения.
Согласно заявленному способу определено, что коэффициент оптической плотности культуральной среды, зависит от типа противомикробного действия исследуемого соединения. Если величина KD при использовании исследуемого соединения менее 1 – данное соединение обладает бактерицидным типом действия в отношении исследуемого микроорганизма. Если величина KD более 1 – исследуемое соединение обладает бактериостатическим типом действия в отношении исследуемого микроорганизма.
Сведения, подтверждающие достижение технического результата, представлены в нижеследующих примерах.
Пример 1. Исследование типа противомикробного действия ампициллина – с доказанным бактерицидным типом противомикробного действия
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности ампициллина с культурой Streptococcus pyogenes 19615 АТСС обнуляют по показателям оптической плотности ампициллина (0,008). Оптическая плотность культуральной среды в присутствии тест-штамма Streptococcus pyogenes, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл [13] концентрациях ампициллина составляет 0,004; 0,005; 0,001; 0,003 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без ампициллина составляет 0,311.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с ампициллином менее 1, следовательно, противомикробный препарат обладает бактерицидным типом действия в отношении Streptococcus pyogenes 19615 АТСС.
Зависимость оптической плотности ампициллина с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности ампициллина. Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при концентрациях 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл ампициллина составляет 0,003; 0,0029; 0,003; 0,0028 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без ампициллина составляет 0,33.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с ампициллином менее 1, следовательно, противомикробный препарат обладает бактерицидным типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 2. Исследование типа противомикробного действия цефазолина – с доказанным бактерицидным типом противомикробного действия
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности цефазолина с культурой Streptococcus pyogenes 19615 АТСС обнуляют по показателям оптической плотности цефазолина (0,008). Оптическая плотность культуральной среды в присутствии тест-штамма Streptococcus pyogenes, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл [13] концентрациях цефазолина составляет 0,002; 0,002; 0,001; 0,001 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без цефазолина составляет 0,311.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с цефазолином менее 1, следовательно, противомикробный препарат обладает бактерицидным типом действия в отношении Streptococcus pyogenes 19615 АТСС.
Зависимость оптической плотности цефазолина с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,006). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл концентрациях цефазолина составляет 0,006; 0,008; 0,005; 0,005 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без цефазолина составляет 0,33.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с цефазолином менее 1, следовательно, противомикробный препарат обладает бактерицидным типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 3. Исследование типа противомикробного действия азитромицина – с доказанным бактериостатическим типом противомикробного действия
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности азитромицина с культурой Streptococcus pyogenes 19615 АТСС обнуляют по показателям оптической плотности азитромицина (0,039). Оптическая плотность культуральной среды в присутствии тест-штамма Streptococcus pyogenes, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл [13] концентрациях азитромицина составляет 0,061; 0,023; 0,017; 0,009 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без азитромицина составляет 0,311.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с азитромицином более 1, следовательно, противомикробный препарат обладает бактериостатическим типом действия в отношении Streptococcus pyogenes 19615 АТСС.
Зависимость оптической плотности азитромицина с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,039). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл концентрациях азитромицина составляет 0,018; 0,014; 0,01; 0,007 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без азитромицина составляет 0,33.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с азитромицином более 1, следовательно, противомикробный препарат обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 4. Исследование типа противомикробного действия линкомицина – с доказанным бактериостатическим типом противомикробного действия
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности линкомицина с культурой Streptococcus pyogenes 19615 АТСС обнуляют по показателям оптической плотности линкомицина (0,006). Оптическая плотность культуральной среды в присутствии тест-штамма Streptococcus pyogenes, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл [13] концентрациях линкомицина составляет 0,031; 0,017; 0,009; 0,005 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без линкомицина составляет 0,311.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с линкомицином более 1, следовательно, противомикробный препарат обладает бактериостатическим типом действия в отношении Streptococcus pyogenes 19615 АТСС.
Зависимость оптической плотности линкомицина с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,039). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 0,125 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1 мкг/мл концентрациях линкомицина составляет 0,051; 0,029; 0,018; 0,006 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без линкомицина составляет 0,33.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с линкомицином более 1, следовательно, противомикробный препарат обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 5. Исследование типа противомикробного действия соединения с лабораторным шифром HD
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности соединения с лабораторным шифром HD с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,012). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 29,5 мкг/мл, 59 мкг/мл, 118 мкг/мл, 236 мкг/мл концентрациях циклического амида HD составляет 0,03; 0,019; 0,011; 0,005 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без исследуемого соединения составляет 0,27.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с циклическим амидом HD более 1, следовательно, исследуемое соединение обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 6. Исследование типа противомикробного действия соединения с лабораторным шифром S3
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности соединения с лабораторным шифром S3 с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,046). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 31,25 мкг/мл, 62,5 мкг/мл, 125 мкг/мл, 250 мкг/мл концентрациях циклического амида S3 составляет 0,03; 0,019; 0,011; 0,005 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без исследуемого соединения составляет 0,27.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с циклическим амидом S3 более 1, следовательно, исследуемое соединение обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 7. Исследование типа противомикробного действия соединения с лабораторным шифром 7D
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности соединения с лабораторным шифром 7D с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,004). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 62,5 мкг/мл, 125 мкг/мл, 250 мкг/мл, 500 мкг/мл концентрациях амида 7D составляет 0,06; 0,03; 0,012; 0,004 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без исследуемого соединения составляет 0,27.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с амидом 7D более 1, следовательно, исследуемое соединение обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 8. Исследование типа противомикробного действия соединения с лабораторным шифром 39D
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности соединения с лабораторным шифром 39D с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,023). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 15,6 мкг/мл, 31,25 мкг/мл, 62,5 мкг/мл, 125 мкг/мл концентрациях пирролохинолона 39D составляет 0,06; 0,03; 0,012; 0,004 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без исследуемого соединения составляет 0,27.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с пирролохинолоном 39D более 1, следовательно, исследуемое соединение обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Пример 9. Исследование типа противомикробного действия соединения с лабораторным шифром 5D
Исследование оптической плотности культуральной жидкости проводят в объеме 1 мл в стерильных кюветах при длине волны 600 нм. Зависимость оптической плотности соединения с лабораторным шифром 5D с культурой Staphylococcus aureus 6538-P АТСС обнуляют по показателям оптической плотности антибиотика (0,006). Оптическая плотность культуральной среды в присутствии тест-штамма Staphylococcus aureus, культивируемого при 7,8 мкг/мл, 15,6 мкг/мл, 31,25 мкг/мл, 62,5 мкг/мл концентрациях циклического амида 5D составляет 0,045; 0,026; 0,014; 0,006 соответственно. Оптическая плотность культуральной среды с исследуемым микроорганизмом, при культивировании без исследуемого соединения составляет 0,27.
Исходя из полученных показателей вычисляют коэффициент оптической плотности культуральной среды:

Показатель КD с циклическим амидом 5D более 1, следовательно, исследуемое соединение обладает бактериостатическим типом действия в отношении Staphylococcus aureus 6538-P АТСС.
Исследуемые соединения, синтезированные на основе замещенных 4-, 5-, 6-, 7-аминоиндолов обладают бактериостатическим типом противомикробного действия.
Таким образом, при внедрении заявленного изобретения повысится точность определения типа действия новых противомикробных препаратов и сократится время исследования новых соединений с потенциальной антимикробной активностью.
Источники информации:
1. Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ / под ред. В.П. Фисенко. – Москва : ЗАО «ИИА «Ремедиум», 2000. – 398 с.
2. Руководством по проведению доклинических исследований лекарственных средств / под ред. Миронова А.Н., Бунатян Н.Д. [и др.]. – М. : ЗАО «Гриф и К», 2012. – Ч.1 – 940 с.
3. Першин Г.Н. Методы экспериментальной химиотерапии : практ. руководство / Г.Н. Першин [и др.]; под ред. Г.Н. Першина. – М. : Медицина, 1971. – 541 с.
4. Степаненко И.С. Изучение противомикробной активности фторзамещенных пироллохинолинов / И. С. Степаненко, А.И. Котькин, С.А. Ямашкин // Фундаментальные исследования. – № 8. – Ч. 6. – 2013. – С. 1406-1410.
5. Степаненко И.С. Исследование противотуберкулезной активности 6-гидро-кси-2,3-диметил-6-трифторметил-6,7,8,9-тетрагидро-1Н-пирроло[3,2-h]хинолина-8-она / И.С. Степаненко, С.А. Ямашкин, А.И. Котькин [и др.] // Современные проблемы науки и образования. – № 6. – 2014. – С. 1378-1381 (Электронный журнал) URL: www.science-education.ru/120-15881.
6. Степаненко И.С. Пирролохинолины: перспективный класс соединений с противомикробной активностью / И.С. Степаненко, С.А. Ямашкин, А.И. Котькин // Проблемы медицинской микологии. – Т. 17. – № 2. – 2015. – C. 135-136.
7. Степаненко И.С. Противомикробная активность производных 6-амино-5-метил-2-фенил- и 6-амино-1,5-диметил-2-фенилиндолов / И.С. Степаненко, А. И. Котькин, Е. А. Алямкина [и др.] // Современные проблемы науки и образования. – 2015. – № 5. – С. 152-160 (Электронный журнал) URL: www.science-education.ru/128-22043.
8. Степаненко И.С. Биологическая активность и анализ масс-спектрального распада трифторметилпирролохинолинов / И.С. Степаненко, С.А. Ямашкин, А.И. Котькин // Успехи современного естествознания. – 2016. – № 8. – С. 55-60.
9. Алямкина Е.А. Соединения с потенциальной антимикробной активностью на основе 4-амино-2-фенилиндола / Е.А. Алямкина, И.С. Степаненко, С.А. Ямашкин [и др.] // Вестник Московского университета. – 2016. – Т. 57. – № 6. – С. 410-417.
10. Alyamkina Е.А. 4-amino-2-phenylindole-based compounds with potential antibacterial activity // E.A. Alyamkina, S.A. Yamashkin, I.S. Stepanenko, M. A. Yurovskaya // Moscow University Chemistry Bulletin. – 2017. – Vol. 72. – №1. – P. 24-28.
11. Степаненко И.С. Противомикробная активность соединений на основе замещенных 4-, 5-, 6-, 7-аминоиндолов / И.С. Степаненко, С.А. Ямашкин, Ю.А. Костина, А.А. Батаршева [и др.] // Проблемы медицинской микологии. – 2018. – Т.20. – № 2. – С. 117.
12. Практическое руководство по антиинфекционной химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова // НИИАХ СГМА, 2007. – 420 с.
13. Определение чувствительности микроорганизмов к антимикробным препаратам : клинические рекомендации / Р.С. Козлов [и др.]. – Москва, 2018. – 206 с.