Результат интеллектуальной деятельности: Липосомальный препарат дексаметазона в гипертоническом растворе хлорида натрия и способ лечения острого повреждения легких на его основе
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к новым лекарственным препаратам для лечения острых состояний с преимущественным поражением легких и дисфункцией сердечно-сосудистой системы.
Примером патологии для эффективного использования предлагаемого липосомального препарата является острый респираторный дистресс-синдром (ОРДС) и его наиболее частая причина – острое повреждение легких (ОПЛ), сопровождающиеся высоким процентом летальности среди пациентов и в результате быстро нарастающей дыхательной недостаточности [1].
Существует 5 типов липосом, отличающихся составом и применением in vivo: простые липосомы; стерически стабилизированные липосомы; направленные липосомы (иммунолипосомы); катионные липосомы; липо-сомы, чувствительные к физическим и химическим стимулам, таким как температура, свет и изменения значения pH [2]. Однако исследователи не предлагают липосомальные препараты, способные высвобождать лекарственные субстанции при попадании в органы за счет изменения осмолярности среды, в которой они находятся.
Существуют липосомы с дексаметазоном для местного иньекционного применения в офтальмологии. Данная лекарственная форма по своему составу представляет изотоническую взвесь липосом с дексаметазоном. Эффективность включения препарата при создании известного препарата составляет 80 % при соотношении липиды/дексаметазон 40:1 [3].
Липосомы с дексаметазоном получают достаточно схожими способами. Например, получение липосом с иммунными и флуоресцентными метками. При этом изначальная методика получения препарата стандартная и включает в себя создание липидной пленки, гидратирования пленки и пропускание полученных мультиламеллярных везикул через поликарбонатный фильтр [4].
В настоящее время создание липосом для местного или системного введения происходит в изотонической водной среде. При этом многократно изучена осмотическая резистентность эритроцитов. Учитывая, что липосомальная мембрана есть не что иное, как липидный бислой, то при перемещении липосом из одной среды в другую, имеющих разную тоничность предполагается, что процессы будут происходить похожие. То есть, мембрана при перепаде осмолярности среды разрывается и содержимое эритроцита или липосомы высвобождается [5].
Недостатками предлагаемых решений являются: невозможность их использования для парентерального применения, отсутствие данных об эффективности при экстренных показаниях к интенсивной терапии, медленное и неполное высвобождение лекарственной субстанции из липосом.
Технический результат заключается в разработке новой липосомальной лекарственной формы дексаметазона с гипертонической водной средой, обусловленной раствором 7,5 %-ного хлорида натрия (NaCl) для лечения острого повреждения легких и шока на его основе, который обеспечивает снижение летальности, стабилизацию частоты сердечных сокращений (ЧСС) и частоты дыхания (ЧД), повышение артериального давления и сатурации гемоглобина (SpO2).
Новизна предлагаемого решения заключается в следующем:
1. Разработана новая липосомальная лекарственная форма дексаметазона с гипертонической водной средой, обусловленной раствором 7,5 %-ного NaCl. Проанализирована эффективность полученной лекарственной формы.
2. Предлагается способ оценки кинетики высвобождения дексаметазона из гипертонических липосом in vitro.
3. Предлагается способ оценки эффективности внутривенного введения гипертонических липосом с дексаметазоном, крысам спустя 5 мин после моделирования острого повреждения легких путем интратрахеального введения раствора ацидин-пепсина [6].
Сущность изобретения заключается в том, что липосомальный препарат представляет собой липосомы размером 320±20 нм, содержащие дексаметазон в концентрации 2,98 мг/мл в гипертонической водной среде 7,5 %-ного раствора NaCl. При внутривенном введении липосомы высвобождают лекарственную субстанцию дексаметазона в результате изменения осмолярности среды, набухания и разрыва липосомальных везикул. Липосомальную взвесь получают обращением фаз из лецитина, холестерола, дексаметазона, гипертонического раствора 7,5 %-ного раствора NaCl. Способ лечения острого повреждения легких и шока на основе липосомального препарата включает внутривенное введение липосом с дексаметазоном, находящихся в гипертонической водной среде 7,5 %-ного раствора NaCl.
Пример 1. Получение липосом с дексаметазоном в гипертонической среде 7,5 %-ного раствора NaCl:
Липосомы получают методом пассивной загрузки, смывая липидную пленку 7,5 %-ного раствора NaCl с дексаметазоном. Для количественного определения содержания дексаметазона в липосомах используют УФ-спектрофотомерию. Получение липосомальной дисперсии дексаметазона в 7,5 %-ном растворе NaCl: точную навеску лецитина (300 мг) и холестерина (3 мг) растворяют в хлороформе. Органический растворитель упаривают на роторном испарителе в течение 30 мин. После чего липидную пленку гидратируют 6,15 мл дексаметазона в 7,5 %-ном растворе NaCl, при температуре 40 °С. Образовавшуюся дисперсию мультиламеллярных везикул измельчают с помощью экструдера LIPEXTM с использованием поликарбонатного фильтра с диаметром пор 400 нм. Полученные липосомы собирают в приемную колбу. Размер липосомальных везикул определяют методом динамического светорассеяния при помощи наносайзера NANO-flex. Определение размеров проводят автоматически, с помощью программы Microtrac Flex 11.0.0.2. Средний диаметр липосом составляет 320±50 нм. Очистка липосомальной дисперсии от не включившегося в липосомы дексаметазона проводят методом диализа через мембрану с диаметром пор 12-14 кДа. Стакан с диализным фильтром устанавливают на магнитную мешалку. Для количественного определения используют УФ-спектрофотомерию. Для этого 0,5 мл дексаметазона, доводят до 25 мл 0,1 М раствором гидрокида натрия (NaOH). Оптическую плотность замеряют на спектрофотометре в диапазоне волн от 400 нм до 200 нм, в качестве раствора сравнения используют 0,1 М раствор NaOH. Максимум поглощения раствора дексаметазона находится в области 241 нм. Для количественного определения дексаметазона используют диализат, полученный при очистке липосом. Концентрация дексаметазона в очищеной липосомальной дисперсии составляет 2,9795±0,015 мг/мл; эффективность включения дексаметазона в липосомы: 74,5±0,37 %, отношение включившегося дексаметазона к лецитину: 2,9795мг/мл×6мл/300мг=0,05959.
Пример 2. Сравнительная кинетика высвобождения препарата из липосом:
Чтобы приблизить опыт к реальным условиям высвобождения препарата в изотонической среде крови рассчитывают дозу липосом и объем биорелевантной среды для высвобождения. Таким образом, объем липосом с дексаметазоном составляет 1 мл, а количество изотонической среды для высвобождения – 18 мл, что соответствует дозе препарата и объему циркулирующей крови для одной лабораторной крысы массой 250 г. Для исследования кинетики высвобождения удобнее использовать изотонический раствор объемом 250 мл, а для сохранения соотношения между объемом липосом и объемом этого раствора количество липосом увеличивают до 13,9 мл. Для контрольного опыта используют раствор дексаметазона в 7,5 %-ном растворе NaCl объемом 10,6 мл и изотонические липосомы объемом 13,9 мл, содержащие дексаметазон. Изотонические липосомы готовят с использованием изотонического раствора NaCl и они имеют одинаковую с опытными концентрацию дексаметазона на единицу объема взвеси. В качестве биорелевантной среды используют плазмозамещающий раствор «Стерофундин ISO», так как он наиболее напоминает плазму крови по ионному составу, осмолярности и значению рН.
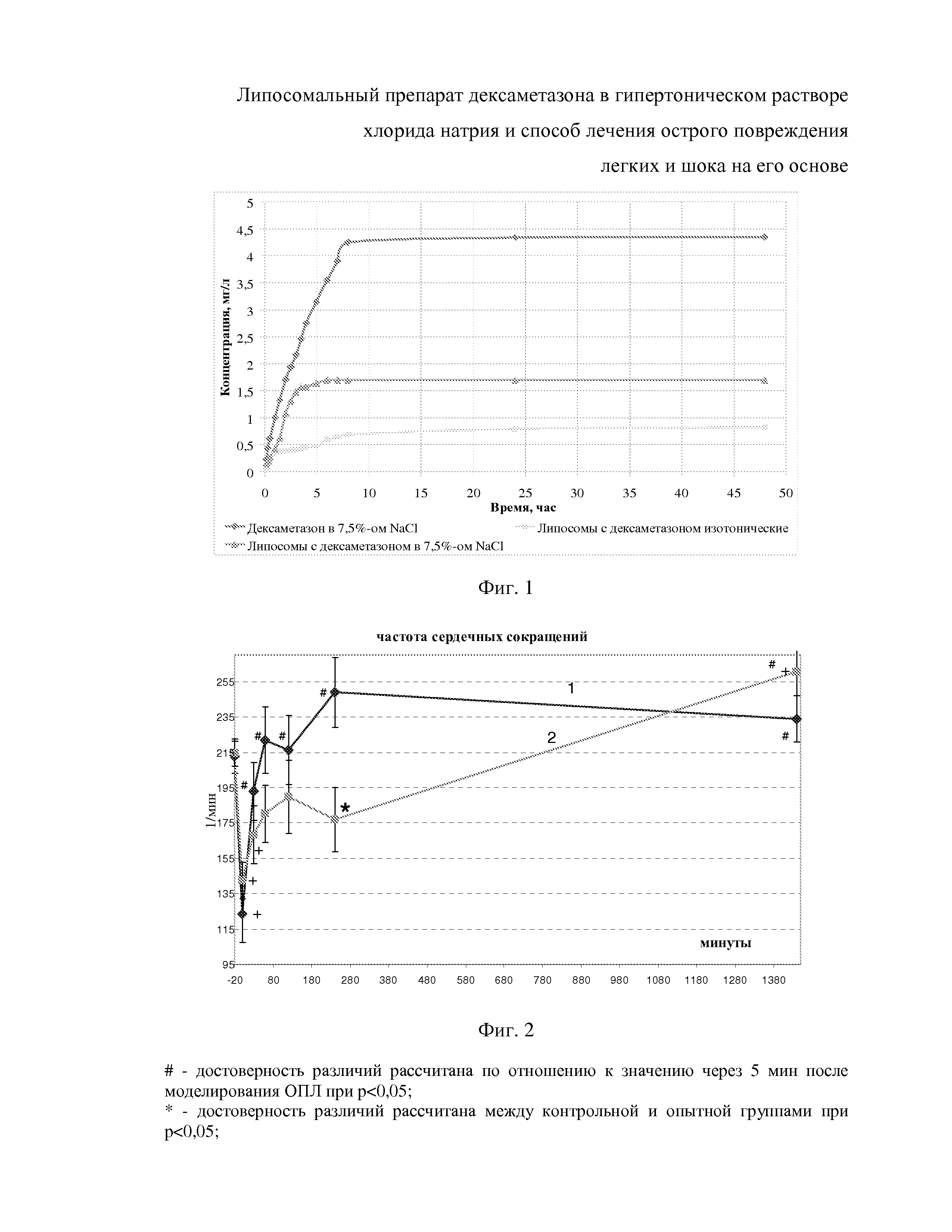
В диализный мешок длиной 50 мм помещают исследуемый раствор и раствор «Стерофундин ISO» до заполнения мешка, после чего фиксируют его зажимами. Установку помещают в мерный стакан объемом 500 мл и заполняют его Стерофундином до метки 250 мл. Стакан устанавливают на магнитную мешалку и проводят исследование при температуре раствора 35,5 °С и частоте вращения мешалки 120 об/мин. Через определенные промежутки времени производят замер концентрации дексаметазона во внешнем растворе. Для определения концентрации извлекают из внешнего раствора 1 мл, помещают в колбу объемом 50 мл и доводят до метки 0,1 М NaOH в 7,5 %-ном растворе NaCl и производят спектрофотомерию, используя в качестве раствора сравнения 0,1 М NaOH в 7,5 %-ном растворе NaCl. В результате получен график нарастания концентрации дексаметазона в биорелевантной среде с течением времени (фиг.1).
Из фиг. 1 видно, что гипертонические липосомы, содержащие дексаметазон при введении в изотоническую среду высвобождают содержимое гораздо быстрее и в большей концетрации, чем изотонические липосомы с дексаметазоном. Данные особенности высвобождения гипертонических липосом могут быть использованы для создания высокой концентрации лекарственного вещества (дексаметазона) в близлежащем органе (легких) при их внутривенном введении.
Пример 3. Сравнительное исследование терапевтической эффективности гиперосмолярных липосом с дексаметазоном и комбинации раствора дексаметазона с гипертоническим раствором NaCl при остром повреждении легких у крыс:
Для эксперимента использовались белые беспородные крысы обоего пола массой 220-300 г (питомник «Столбовая», ФГБУ «Научный центр биомедицинских технологий» РАМН). Все исследования выполнялись с соблюдением норм и правил проведения экспериментов с участием животных (решение ЛЭК ФГБОУ ВПО «МГУ им. Н.П. Огарёва» от 12.07.2015 г., протокол № 72). В эксперимент были включены 24 крысы. Животных разделили на 2 группы по 12 особей в каждой. Всем крысам под уретановым внутрибрюшинным наркозом (400 мг/кг) производили моделирование острого повреждения легких путем интратрахеального (и/т) введения 0,03 мл предварительно приготовленного раствора ацидин-пепсина [6] (1 таблетка на 0,5 мл физ. раствора). Для эксперимента использовался препарат ацидин-пепсин (таблетки), содержащий бетаина гидрохлорид 200 мг и пепсин 50 мг (Белмедпрепараты, Республика Беларусь). Всем животным после моделирования ОПЛ/ОРДС с целью профилактики инфекционных осложнений вводили цефтриаксон (порошок во флаконах), 1 г для приготовления раствора для внутримышечного и внутривенного введения (ОАО «Биосинтез», Россия) в дозе 100 мг/кг внутримышечно 1 раз в сут в течение 6 дней. Животным 1-ой группы (опыт) внутривенно однократно через 5 мин после моделирования патологии вводили гиперосмолярные липосомы с дексаметазоном в дозе 6 мг/кг по дексаметазону в объеме липосомальной взвеси 0,5-0,6 мл. Животным 2-ой группы (контроль) внутривенно однократно вводили раствор дексаметазона (раствор для инъекций 0,4 %, КРКА, д.д., Ново место, Словения) в дозе 6 мг/кг и сразу после гипертонический 7,5 %-ный раствор NaCl в объеме 4 мл/кг.
При помощи аппарата BiopacSystems МР 150 (CША) у животных оценивали: ЧСС, ЧД, SpO2 и уровни систолического и диастолического артериального давления (сАД, дАД). Измерения производили за 20 мин до аспирационного повреждения легких, через 5 мин после ОПЛ и после внутривенного введения препаратов через 30, 60 мин, 2, 4, и 24 час.
В результате эксперимента через 5 мин после аспирации ацидин-пепсина ЧСС крыс в группе с применением гиперосмолярных липосом с дексаметазоном достоверно снижалась с 212,8±9,6 до 123,6±15,9/мин. В группе, где вместо гиперосмолярных липосом (HNDEX) вводили последовательно дексаметазон и гипертонический 7,5 %-ный раствор NaCl (Д+ГР) ЧСС также достоверно снижалась после моделирования патологии до 142,5±10,4/мин, при 214±7,11 у здоровых.
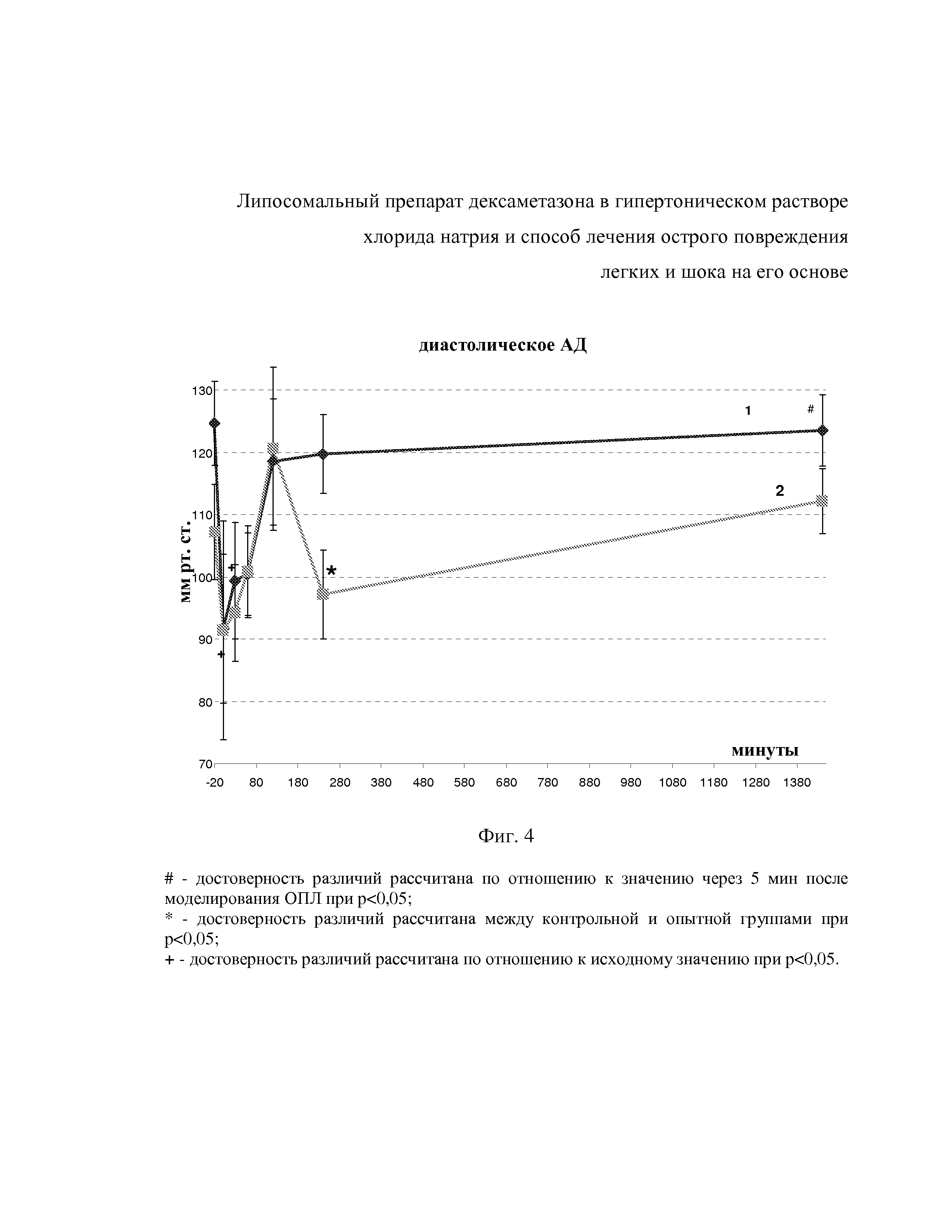
На фиг. 2 показано изменение ЧСС после внутривенного введения гипертонических липосом с дексаметазоном (1) и дексаметазона в комбинации с гипертоническим раствором NaCl (2) на фоне аспирации ацидин-пепсина.
Из фиг. 2 видно, что введение HNDEX приводило к достоверному повышению ЧСС до 193±16,3/мин через 30 мин после инъекции. Спустя 1 час после в/в введения HNDEX ЧСС возросла до 221,9±18,8 в мин, что достоверно больше, чем через 30 мин. В дальнейшем ЧСС у крыс после введения HNDEX была стабильно выше, чем через 5 мин после аспирации ацидин-пепсина. Для точек регистрации 2, 4 и 24 час данный показатель составил: 216±19,5, 248,8±19,8 и 233,9±13,2/мин соответственно. Через 30 мин после внутривенного введения дексаметазона и гипертонического раствора NaCl (Д+ГР) ЧСС крыс оставалась достоверно ниже исходного показателя здоровых особей и составила 168,2±16,3/мин, в дальнейшем, через 1 час, 2 и 4 час ЧСС у крыс составила 180,2±16,2, 189,7±20,5 и 176,9±18,0/мин соответственно. В этих временных точках ЧСС достоверно не превышала значения через 5 мин после аспирации ацидин-пепсина.
На фиг. 3. показано изменение сАД после внутривенного введения гипертониеских липосом с дексаметазоном (1) и дексаметазона в комбинации с гипертоническим раствором NaCl (2) на фоне аспирации ацидин-пепсина.
Из фиг. 3 видно, что сАД через 30 мин после введения после введения HNDEX оставалось достоверно более низким, чем у крыс исходно до аспирации ацидин-пепсина и составило 122,2±9,5 мм рт. ст. При этом через 5 минут после аспирации ацидин-пепсина сАД составило 112,0±13,8 мм рт. ст., что достоверно меньше исходного значения здоровых животных – 156,8±8,8 мм рт. ст. Через 1 час после введения HNDEX сАД составила 131,5±5,26 мм рт. ст., что оставалось достоверно ниже исходного значения. Через 2, 4 и 24 час после в/в введения HNDEX сАД достоверно не отличалось от исходного значения и составило 148,0±11,9, 136,5±10,4, 148,1±7,8 мм рт. ст. При этом через 24 час сАД имело достоверно более высокое значение, чем через 5 мин после аспирации ацидин-пепсина.
В группе контрольной терапии (сАД – 127,9±11,5 мм рт. ст.) Д+ГР после аспирации ацидин-пепсина не наблюдалось достоверного снижения сАД относительно исходного значения (133,5±6,4 мм рт. ст.). Достоверных изменений сАД не отмечалось и после в/в введения Д+ГР. сАД через 30 мин после в/в введения Д+ГР составило 119,7±11,5 мм рт. ст., через 1 час – 129,0±10,4 мм рт. ст., 2 часа – 134,5±9,1 мм рт. ст.; 4 час – 116,4±7,9 мм рт. ст., 24 час – 138,9±6,4 мм рт. ст.
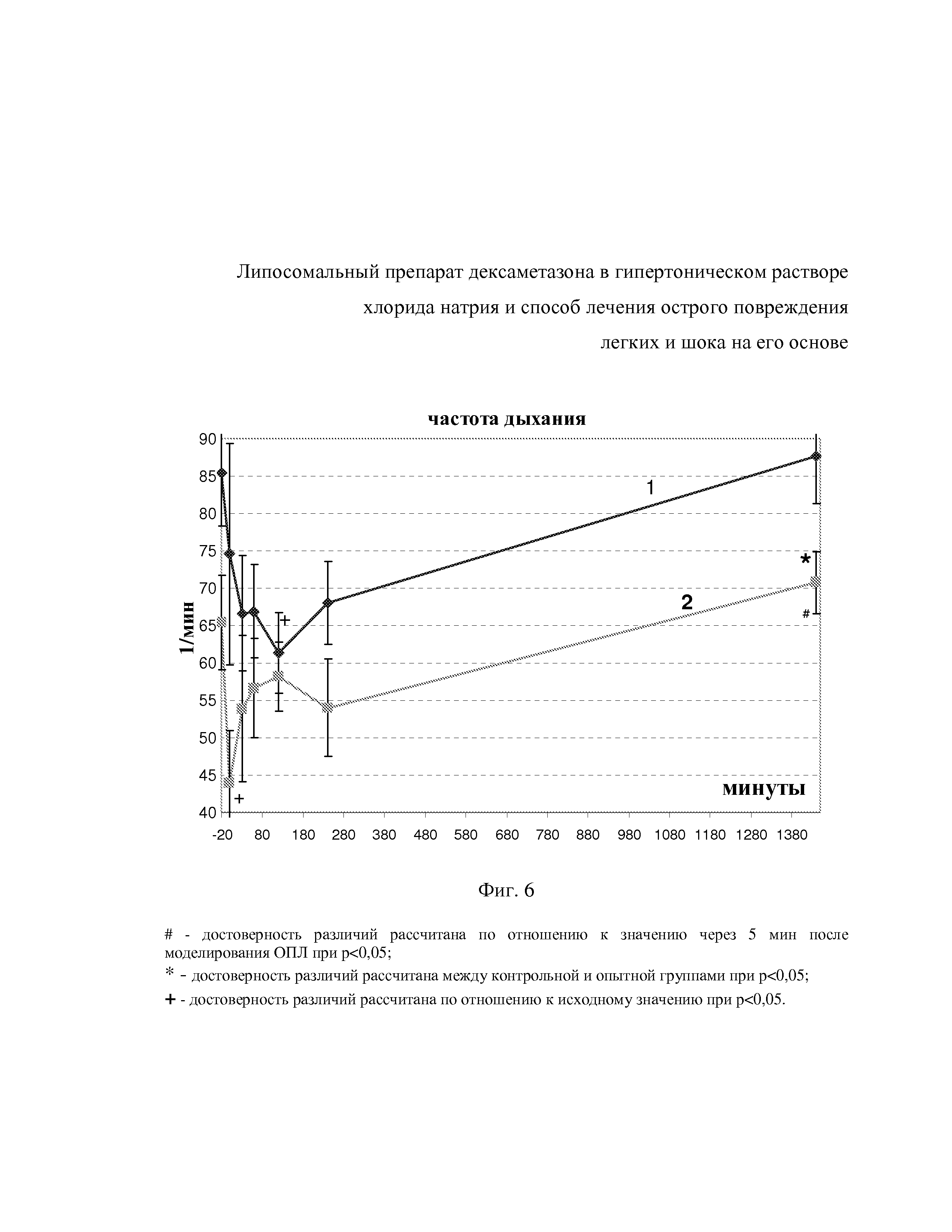
На фиг. 4 показаны изменения дАД после внутривенного введения гипертониеских липосом с дексаметазоном (1) и дексаметазона в комбинации с гипертоническим раствором NaCl (2) на фоне аспирации ацидин-пепсина.
Из фиг. 4 видно, что диастолическое давление в результате моделирования аспирационного синдрома в группе с HNDEX снижалось с 124,7±6,8 мм рт. ст. у здоровых крыс до 91,7±11,9 мм рт. ст. Для точки 1 час дАД составило 100,5±6,6 мм рт. ст., что достоверно не отличалось от такового, через 30 мин после введения HNDEX (99,4±9,4 мм рт. ст.). Спустя 2 и 4 час дАД у крыс имело тенденцию к повышению до 118,5±10,1 и 119,7±6,3 мм рт. ст. и не отличалось достоверно от исходного значения. Через 24 час после в/в введения дАД соотносится с таковым у животных исходно, до моделирования патологии и составило 123,5±5,7 мм рт. ст. Аналогичная ситуация наблюдалась с дАД после введения Д+ГР, где тоже не было зафиксировано достоверных изменений. У животных данной группы, исходно дАД составило 107,3±7,7 мм рт. ст., 5 мин после аспирации - 91,4±17,5 мм рт. ст. Через 30 мин после в/в введения Д+ГР, через 1 час, 2 и 4 час дАД составило 94,2±7,8, 100,9±7,4, 120,6±13,1 мм рт. ст. и 97,1±7,1 мм рт. ст. соответственно. Через 24 час дАД после в/в инфузии Д+ГР составило 112,0±5,2 мм рт. ст.
После ОПЛ SpO2 в группе с HNDEX достоверно снизилась с 90,3±1,76 % до 79,4±3,7 %. После введения HNDEX, через 30 мин SpO2 была достоверно больше, чем через 5 мин после аспирации ацидин-пепсина и составила 88,1±1,55 %.
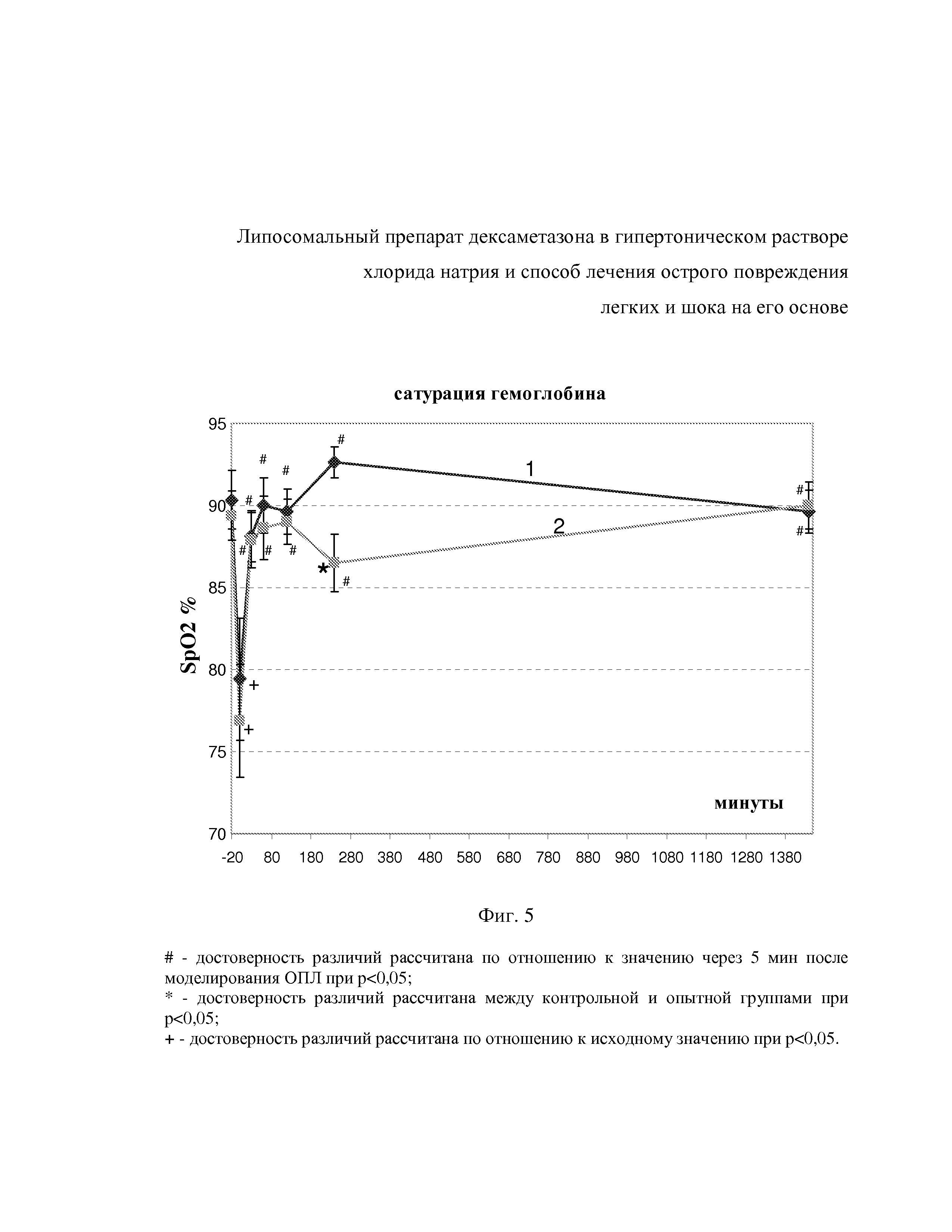
На фиг. 5 показаны изменения сатурации гемоглобина после внутривенного введения гипертонических липосом с дексаметазоном (1) и дексаметазона в комбинации с гипертоническим раствором NaCl (2) на фоне аспирации ацидин-пепсина.
Из фиг. 5 видно, что в дальнейшем, через 1 час, 2 час, 4 и 24 час сатурация была достоверно выше, чем после аспирации и до введения HNDEX. Для вышеуказанных точек SpO2 составила 90,0±1,7, 89,6±1,35, 92,6±0,96, 86,6±1,3 % соответственно. Применение терапии контроля (Д+ГР) также способствовало коррекции SpO2 до нормального уровня. В группе с Д+ГР исходная сатурация составила 89,4±1,49, а через 5 мин после аспирации ацидин-пепсина снизилась до 76,9±3,4 %. Спустя 30 мин после введения гипертонического раствора с дексаметазоном сатурация достоверно возростала до 87,9±1,7 % и в течении остального времени наблюдения и регистрации была выше, чем через 5 мин после аспирации ацидин-пепсина. Так для точки 1 час SpO2 составила 88,6±1,93 %, для точки 2 час – 89,0±1,4 % и для точек 4 и 24 час – 86,5±1,7 % и 90,0±1,44 % соответственно. Спустя 4 час после в/в введения HNDEX SpO2 была достоверно больше, чем в это же время, но после введения Д+ГР. ЧД исходно в группе с применением HNDEX была 85,3±7,0 дд/мин.
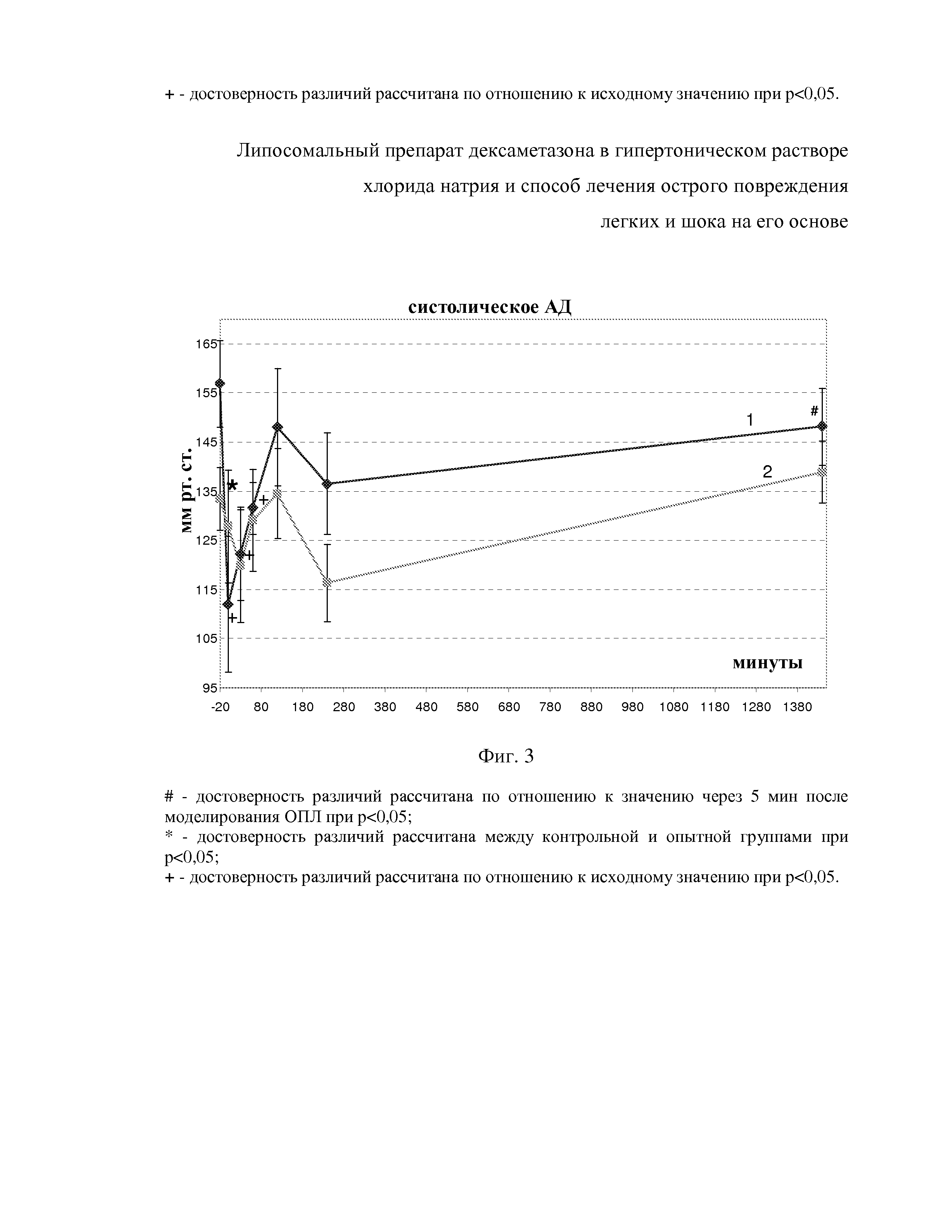
На фиг. 6 показаны изменения ЧД после внутривенного введения гипертонических липосом с дексаметазоном (1) и дексаметазона в комбинации с гипертоническим раствором NaCl (2) на фоне аспирации ацидин-пепсина.
Из фиг. 6 видно, что в результате аспирации ЧД достоверно не изменялась и составила 74,6±14,8 дд/мин. После в/в введения HNDEX через 30 минут и ч/з 1 час ЧД была 66,6±7,7 дд/мин и 66,9±6,3 дд/мин. К 2-м часам после в/в введения ЧД снизилась относительно исходного уровня до 61,4±5,4 дд/мин. После, на точке 4 и 24 часа ЧД составила 68,0±5,5 и 87,6±6,3 дд/мин. При использовании терапии сравнения исходно фиксировалась ЧД 65,4±6,3 дд/мин, а спустя 5 мин после аспирации ацидин-пепсина достоверно снижалась до 44,0±6,9 дд/мин. В последующем, через 30 мин, 1 час, 2 и 4 час, после в/в введения Д+ГР ЧД не имела значимых различий с таковой после аспирации, но без лечения и составила 53,9±9,8 дд/мин, 56,6±6,6, 58,1±4,6 и 54,0±6,5 дд/мин. Через 24 час после начала лечения ЧД была выше, чем после моделирования патологии (79,8±4,2 дд/мин). Исходные значения ЧД обоих групп достоверно не отличались, а через 24 час после введения HNDEX ЧД превышала таковую после применения Д+ГР. Летальность в группе с введением гипертонических липосом с дексаметазоном через 24 час составила 66,7 %, а в группе с введением дексаметазона и гипертонического раствора NaCl – 86,7 %.
Таким образом, разработанная липосомальная лекарственная форма дексаметазона представляет собой липосомальные везикулы с дексаметазоном в гипертонической среде, обусловленной 7,5 %-ным раствором NaCl. Данная липосомальная лекарственная форма высвобождает лекарственную субстанцию дексаметазона при попадании липосом в изотоническую среду в результате набухания и разрыва липосомальных везикул. При введении разработанных липосом лабораторным крысам на фоне модели аспирационного ОПЛ показана эффективность предлагаемой липосомальной лекарственной формы, как средства коррекции гипотонии, брадикардии, угнетения дыхания, гипоксии. Гипертонические липосомы оказывают быстрое и продолжительное действие в сравнении с комбинированным введением раствора дексаметазона и гипертонического раствора NaCl.
Источники информации
1. Новиков Н.Ю. Патоморфологические изменения аэрогематического барьера при остром респираторном дистресс-синдроме в эксперименте / Н.Ю. Новиков, Л.В. Тышкевич, К.Н. Джансыз // Таврический медико-биологический вестник. – 2012. – Т. 15. – № 1. – С. 169-175.
2. Барышников А.Ю. Наноструктурированные липосомальные системы как средство доставки противоопухолевых препаратов / А.Ю. Барышников // Вестник РАМН. – 2012 . – Т. 1. – № 3. – С. 297–315.
3. Лепарская Н.Л. Липосомы, содержащие дексаметазон: получение, характеристика и использование в офтальмологии / Н.Л. Лепарская, Г.М. Сорокоумова, Ю.В. Сычева [и др.] // Вестник МИТХТ. – 2011. - Т. 6, – № 2. – С. 37-42.
4. Chono S., Tauchi Y., Deguchi Y., Morimoto K. Efficient drug delivery to atherosclerotic lesions and the antiatherosclerotic effect by dexamethasone incorporated into liposomes in atherogenic mice. Journal of Drug Targeting. 2005. vol. 13, no. 4. pp. 267–276.
5. Прокопенко Н.В. Сохранение структурно-функциональной целостности эритроцитов человека в средах различной тоничности / Н.В. Прокопенко // Вестник ХНАДУ. – 2011. – № 52. – С. 174-177.
6. Мороз В.В. Морфологические признаки острого повреждения легких различной этиологии (экспериментальное исследование) / В.В. Мороз // Общая реаниматология. - М., 2010. – Т. 3. – № 6. – С. 29-34.