Результат интеллектуальной деятельности: Рекомбинантный пептид EL1, обладающий цитотоксической активностью по отношению к раковым клеткам человека
Вид РИД
Изобретение
Группа изобретений относится к биотехнологии, генетической и белковой инженерии, конкретно - к получению высокоактивного рекомбинантного пептида EL1.
На сегодняшний день онкологические заболевания являются одной из главных причин смертности как в России, так и за рубежом [1].
Известно, что одной из причин развития злокачественных опухолей в организме является нарушение регуляции апоптоза (программируемой гибели клеток). Разработка новых индукторов и модуляторов апоптоза раковых клеток - один из наиболее продуктивных подходов для создания современных онкотерапевтических средств [2]. Также известно, что по сравнению с прокариотическими системами экспрессии получение генно-инженерных рекомбинантных белков и пептидов человека в культуре клеток млекопитающих позволяет обеспечивать их корректный фолдинг и нативный спектр просттрансляционных модификаций, что в свою очередь благоприятно отражается на уровне функциональной активности таких рекомбинантных белков и тем самым является перспективным направлением совершенствования терапевтических средств лечения злокачественных новообразований.
Ранее из молока человека был выделен и охарактеризован протеолитический фрагмент каппа-казеина - белок лактаптин (~8.6 кДа), способный индуцировать апоптотическую гибель раковых клеток в культуре [3, 4]. Был получен ряд рекомбинантных аналогов природного пептида [5, 6] и показано, что аналог лактаптина - рекомбинантный пептид RL2, индуцирует апоптоз раковых клеток человека в культуре и тормозит рост и метастазирование опухолей животных и человека в системе in vivo. Гепатоаденокарцинома-1 мыши оказалась одной из наиболее чувствительных опухолей к действию RL2 in vitro и in vivo [7, 8]. В настоящее время проведены доклинические испытания лекарственного средства «Лактаптин», созданного на основе рекомбинантного пептида RL2, показана безопасность и противоопухолевая эффективность препарата.
Вместе с тем «Лактаптин», как и другие белковые терапевтические препараты, имеет ряд существенных недостатков. Он равномерно распределяется по органам и тканям организма, что уменьшает его концентрацию в опухоли и, соответственно, снижает эффективность противоопухолевого воздействия [9]. Помимо этого, существующий процесс наработки и очистки аналога лактаптина, рекомбинантного пептида RL2, в системе Е. coli для получения лекарственной формы основан на его выделении в преимущественно денатурированном виде из телец включения с последующим диализом и частичным рефолдингом, а также хроматографической очистке, за счет чего значительно снижается удельная активность этого препарата по сравнению с оригинальным лактаптином из молока человека.
Наиболее близкими к заявляемой группе изобретений - прототипом, является рекомбинантная плазмидная ДНК pFK2, обеспечивающая синтез рекомбинантного пептида RL2, являющегося аналогом фрагмента каппа-казеина человека и рекомбинантный пептид RL2, аналог фрагмента каппа-казеина человека, имеющий молекулярную массу 14,1 кДа, состоящий из остатка метионина, фрагмента каппа-казеина человека с 24 по 134 аминокислотный остаток и С-концевого гистидинового тракта, обладающий цитотоксической активностью по отношению к раковым клеткам, включающий аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1 [5].
Известная плазмида pFK2 имеет молекулярную массу 2,1 МДа, размер 3164 п.о., содержит следующие элементы: плазмидный вектор pGSDI, гидролизованный по SalI и BglII сайтам и содержащий сайт инициации репликации плазмиды pBR322, промотор фага Т7 и уникальные сайты рестрикции EcoRI (1595), BglII (1613), SalI (1985), PstI (1995), HindIII (2000), ClaI (2053); BglII-SalI, фрагмент размером 372 п.о., включающий стартовый кодон, сегмент, кодирующий фрагмент каппа-казеина человека с 24 по 134 аминокислотный остаток, олигопептид с последовательностью GGSHHHHHH и стоп-кодон; генетические маркеры: AMPr - ген бета-лактамазы, определяющий устойчивость к ампициллину при трансформации Escherichia coli [5].
Недостатком известной плазмиды pFK2 является то, что она не обеспечивает продукцию рекомбинантного пептида RL2 в клетках млекопитающих.
Недостатком известного рекомбинантного пептида RL2, произведенного в системе Escherichia coli, является то, что эффективность его противоопухолевого действия многократно снижена по сравнению с нативным фрагментом каппа-казеина человека.
Задачей группы изобретений является создание рекомбинантной плазмиды, обеспечивающей продукцию пептида EL1, и получение рекомбинантного пептида EL1, обладающего повышенной цитотоксической активностью по отношению к раковым клеткам человека.
Техническим результатом группы изобретений является создание рекомбинантной плазмиды pEL1, обеспечивающей синтез рекомбинантного пептида EL1, и получение рекомбинантного пептида EL1, обладающего повышенной цитотоксической активностью по отношению к раковым клеткам человека.
Указанный технический результат достигается путем конструирования плазмиды pEL1 за счет встройки в плазмидный вектор pCDH-EF1a-GlucSP-MCS-IRES-copGFP фрагмента ДНК, кодирующего рекомбинантный пептид EL1 в единой рамке трансляции с сигнальным пептидом GlucSP, трансфекции полученной плазмидой pEL1 культуры клеток человека, выращивания биомассы трансфицированных клеток с последующим использованием кондиционированных супернатантов таких клеток.
Сущность заявляемой группы изобретений заключается в следующем.
Генно-инженерными методами получают плазмиду pEL1, несущую ген, кодирующий рекомбинантный аналог лактаптина (пептид EL1), слитый с сигнальной последовательностью GlucSP. Конструкция pEL1 устроена таким образом, что клонированный ген GlucSP-EL1 находится под контролем конститутивного промотора гена EF1a человека.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pEL1 является:
а) лентивирусный вектор третьего поколения pCDH-EF1a-GlucSP-MCS-IRES-copGFP, являющийся дериватом вектора pCDH-EF1a-MCS-IRES-copGFP (SystemBio, США) и обеспечивающий встройку фрагмента ДНК, кодирующего рекомбинантный пептид EL1, его экспрессию под контролем конститутивного промотора гена EF1a человека и секрецию во внеклеточное пространство за счет использования сигнальной последовательности GlucSP;
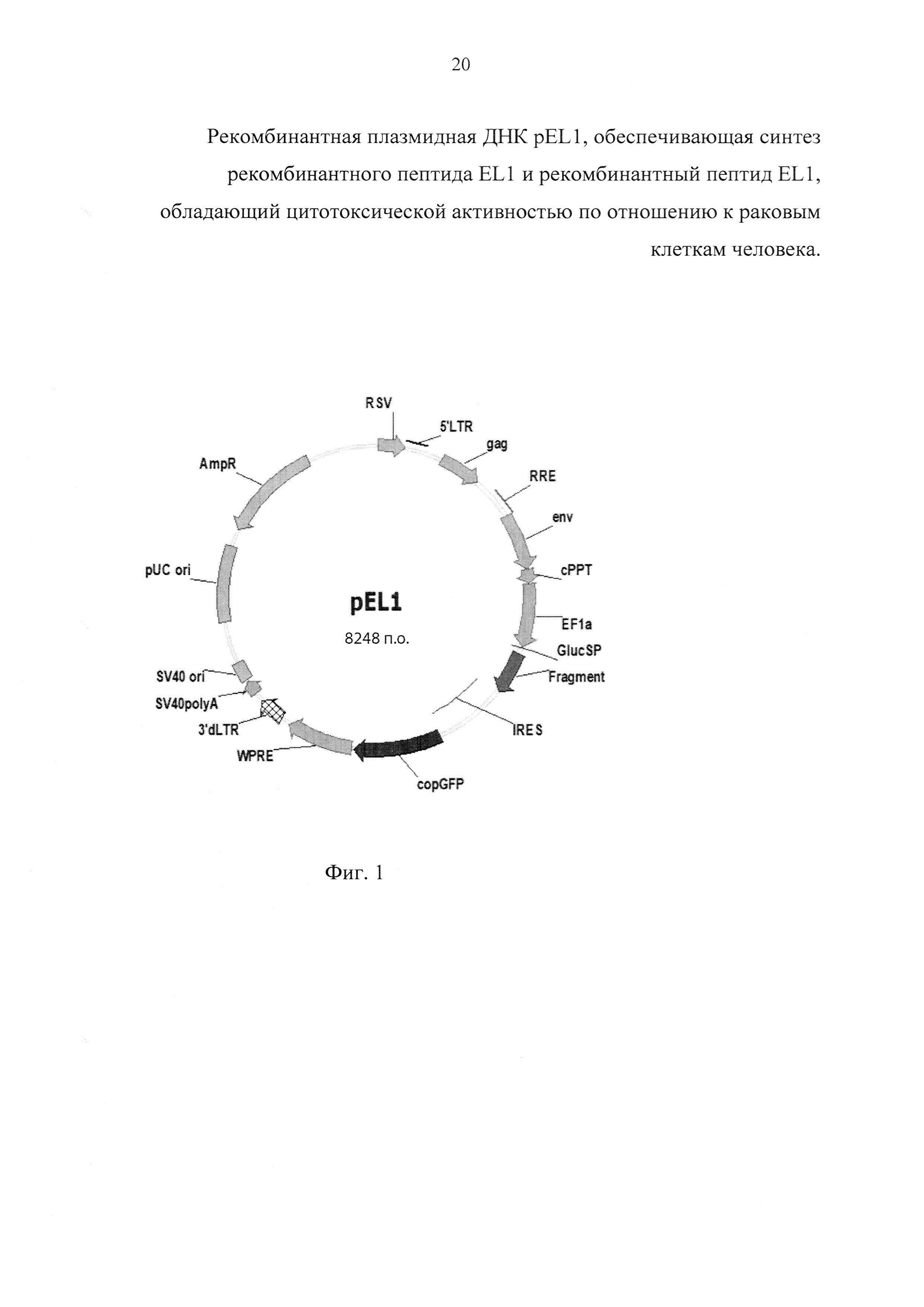
б) фланкированный сайтами рестрикции AgeI и EcoRI фрагмент ДНК, кодирующий рекомбинантный пептид EL1, который получают в полимеразной цепной реакции с использованием олигонуклеотидных праймеров: lactap_AgeF 5'-gcaccggtatgaaccagaaacaaccagca-3' и U30R 5'-atgacgttgtagtgtttgggt-3' на матрице плазмиды pVGF-FR2-PE/L-Pat [10]. Праймер lactap_AgeF обеспечивает наличие в амплификационном фрагменте сайта рестрикции AgeI. Полученная плазмида pEL1 (фиг. 1) характеризуется следующими признаками:
- имеет размер 8248 п.о.;
- кодирует рекомбинантный пептид GlucSP-EL1, содержащий остаток метионина, сигнальный пептид GlucSP (GVKVLFALICIAVAEAKPT), глициновый спейсер (G) и рекомбинантный пептид EL1, который при экспорте во внеклеточное пространство теряет сигнальную и спейсерную последовательности и конвертируется в рекомбинантный пептид EL1;
- состоит из следующих элементов:
а) фрагмента ДНК размером 426 п.о., кодирующего рекомбинантный пептид GlucSP-EL1;
б) сайта инициации репликации pUC, обеспечивающего высококопийное поддержание конструкции в клетках Escherichia coli;
в) сайта инициации репликации вируса SV40, обеспечивающего стабильное поддержание конструкции в эписомном состоянии в клетках млекопитающих, экспрессирующих большой антиген Т вируса SV40;
г) промотора гена EF1a человека, обеспечивающего конститутивную и сильную экспрессию интересующих рекомбинантных слитых белков в клетках млекопитающих;
д) генетических маркеров:
AMPr - ген ампициллин-резистентности (bla), определяющий устойчивость к ампициллину при трансформации Escherichia coli;
и
copGFP - репортерный ген зеленого флуоресцентного белка копеподы Pontellina plumata, определяющий свечение трансформированных или трансдуцированных клеток млекопитающих при их облучении в сине-зеленом УФ-диапазоне;
е) гибридного RSV-5'LTR промотора, состоящего из последовательностей вируса саркомы Раусса (RSV) и ВИЧ-1, обеспечивающего ТАТ-независимый синтез вирусных транскриптов в клетках-паковщицах лентивирусных частиц;
ж) модифицированных генетических элементов ВИЧ-1 (сРРТ, gag, env, RRE), необходимых для корректного процессинга вирусной РНК и сборки лентивирусных частиц;
з) 5'LTR и 3'dLTR-последовательностей ВИЧ-1, обеспечивающих стабильную интеграцию заключенных между ними последовательностей в геном клеток млекопитающих без возможности их дальнейшей повторной мобилизации;
и) последовательности WPRE - регуляторного элемента вируса гепатита сурков, обеспечивающего увеличение стабильности и трансляции транскриптов;
к) элемента IRES - внутреннего сайта посадки рибосомы кардиовируса А, обеспечивающего кэп-независимую инициацию трансляции сцепленного репортера copGFP;
л) сайта полиаденилирования SV40, обеспечивающего эффективную терминацию транскрипции и процессинг рекомбинантных транскриптов.
Таким образом, впервые получена плазмидная ДНК pEL1, обеспечивающая синтез в клетках человека рекомбинантного пептида GlucSP-EL1, состоящего из отщепляемого при экспорте из клетки сигнального пептида GlucSP и противоопухолевого рекомбинантного пептида EL1, обладающего цитотоксической активностью по отношению к раковым клеткам человека.
Клетки млекопитающих, например, клетки эмбрионального почечного эпителия человека HEK293, экспрессирующие температуро-чувствительный аллель большого Т-антигена вируса SV40, трансформируют сконструированной плазмидой pEL1 и выращивают 6 ч в среде IMDM с добавлением фетальной сыворотки коров до 10%, 100 мкг/мл стрептомицина и 100 ед./мл пенициллина в атмосфере 5% CO2 при 37°С. Через 6 часов после трансфекции среду в чашках заменяют на новую и инкубируют клетки 48 часов. После этого супернатанты кондиционированной среды фильтруют через 0.45 мкм PES-фильтры и используют для проведения количественной оценки уровня секретируемого рекомбинантного пептида и его цитотоксической активности в отношении раковых и условно нормальных клеточных линий человека.
Рекомбинатный пептид EL1, присутствующий в кондиционированном супернатанте трансфицированных клеток, обладает цитотоксической активностью в отношении клеток рака молочной железы человека MDA-MB-231, клеток глиобластомы человека T98G и клеток рака простаты человека РС3. Рекомбинантный пептид EL1 имеет аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1 (фиг. 2).
Изобретение иллюстрируется следующими чертежами:
Фиг. 1. Карта генетической конструкции плазмиды pEL1, где: Fragment - последовательность ДНК, кодирующая рекомбинантный пептид GlucSP-EL1; EF1a - промотор гена EF1a человека, GaussiaSP - сигнальный пептид люциферазы Gaussia princeps, IRES - внутренний сайт посадки рибосомы кардиовируса A, copGFP - зеленый флуоресцентный белок копеподы Pontellina plumata, RSV - гибридный промотор, HIV LTR - длинный концевой повтор ВИЧ-1, gag - укороченная последовательность гена gag ВИЧ-1, RRE - REV-связывающий элемент ВИЧ-1, WPRE регуляторный элемент вируса гепатита сурков, 3'dLTR - усеченный длинный концевой повтор ВИЧ-1, AmpR - ген устойчивости к ампициллину, pUCori - ориджин репликации pUC, SV40ori - сайт инициации репликации вируса SV40, SV40polyA - сайт полиаденилирования вируса SV40.
Фиг. 2. Нуклеотидная последовательность фрагмента плазмиды pEL1 и кодируемая ею аминокислотная последовательность рекомбинантного пептида EL1.
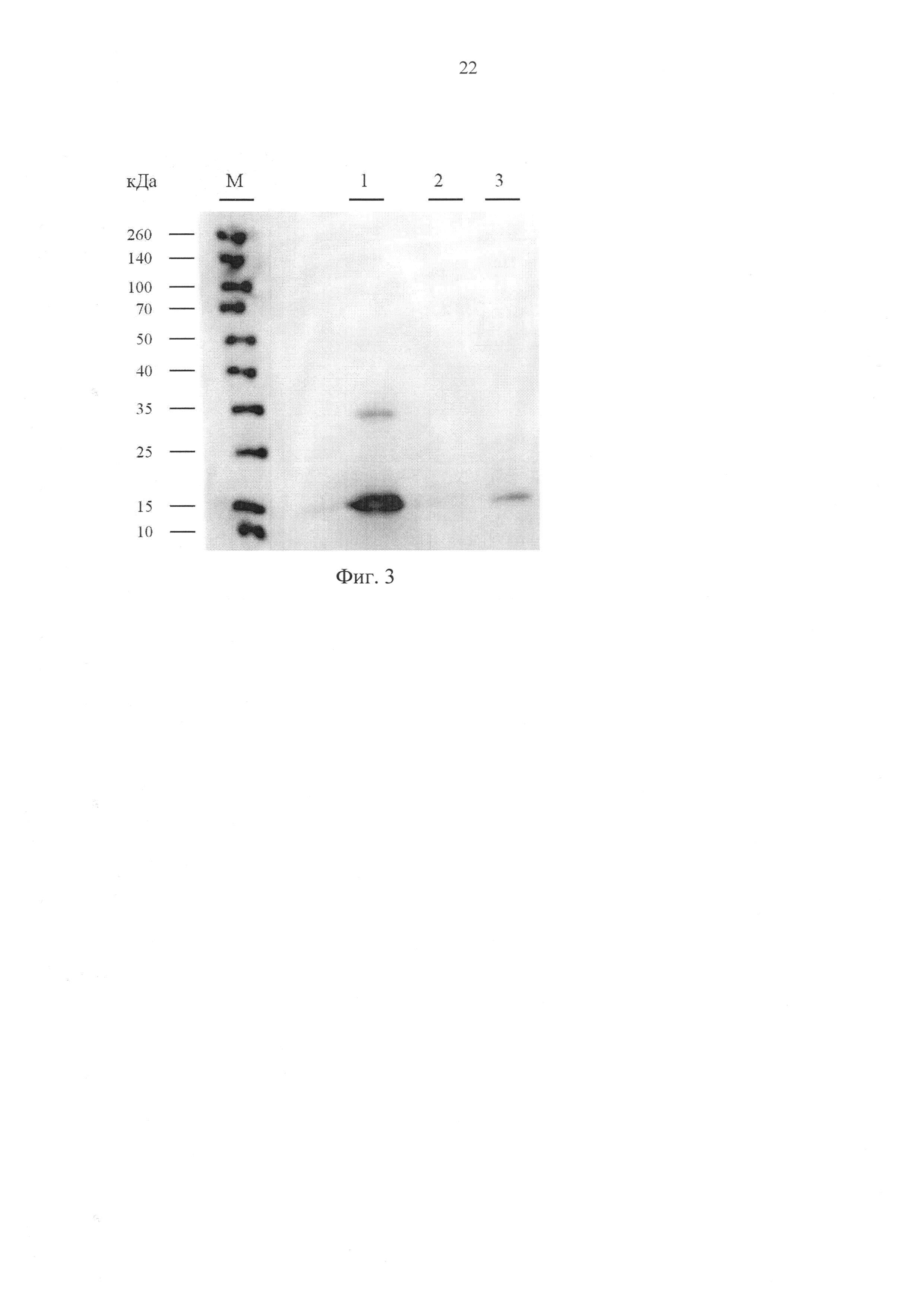
Фиг. 3. Вестерн-блот анализ содержания рекомбинантного пептида EL1 в кондиционированной среде клеток НЕК293Т, трансфицированных плазмидой pEL1 и pCDH-EF1-MCS-IRES-copGFP, где дорожки: М - набор маркерных белков известного молекулярного веса, 1 - рекомбинантный RL2, очищенный из Escherichia coli (RL2coli), 2 - среда, кондиционированная клетками HEK293T, трансфицированными «пустым» вектором pCDH-EF1-MCS-IRES-copGFP (негативный контроль); 3 - среда, кондиционированная клетками HEK293T, трансфицированными плазмидой pEL1.
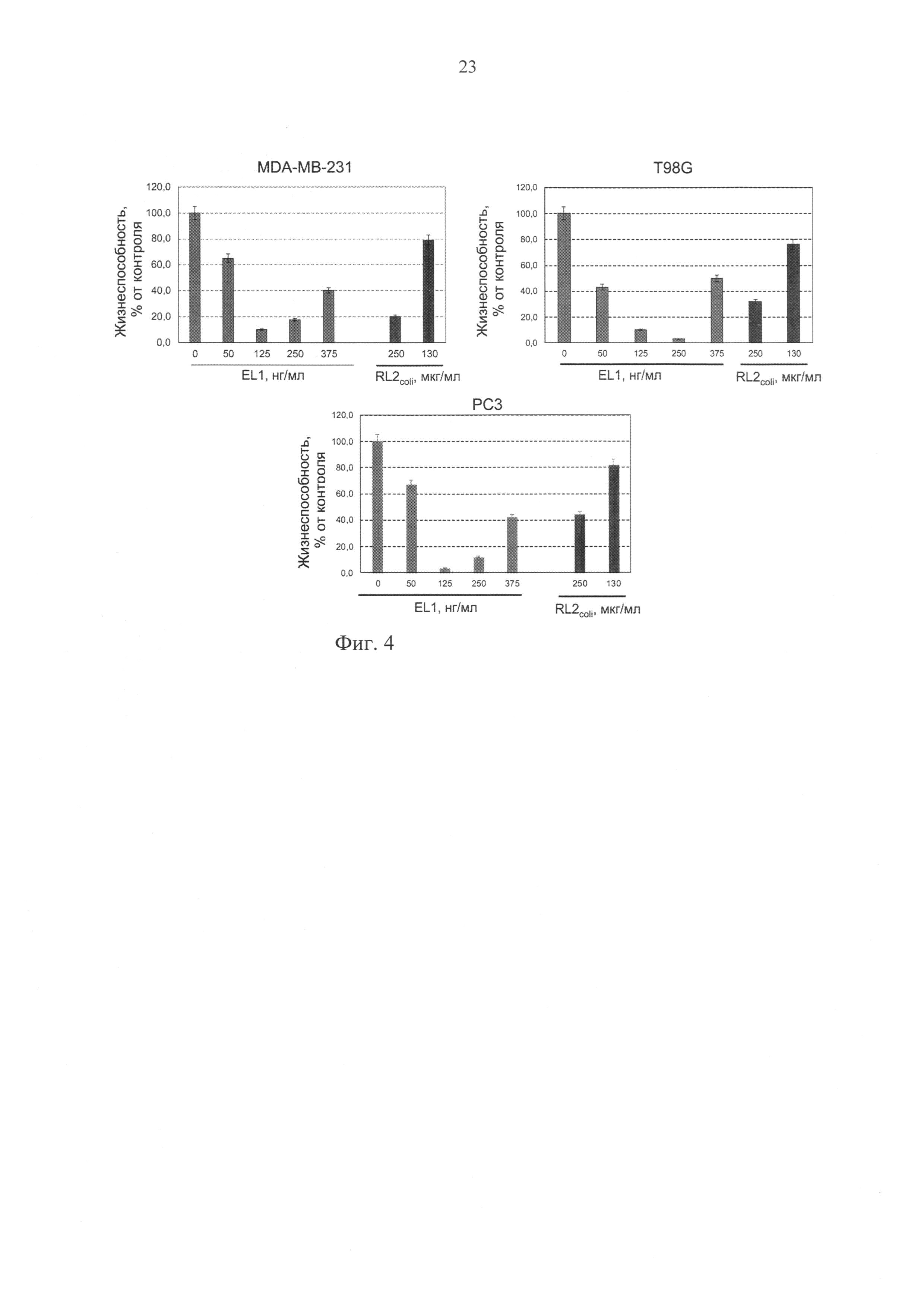
Фиг. 4. Изменение жизнеспособности клеток аденокарциномы молочной железы человека MDA-MB-231, глиобластомы человека T98G и рака простаты РС3 при инкубации с рекомбинантным пептидом RL2, полученным в системе Escherichia coli (RL2coli), и с рекомбинантным пептидом EL1 при его наработке в культуре клеток человека HEK293T. Жизнеспособность клеток определяли относительно жизнеспособности контрольных клеток (инкубации без белков) ± стандартное отклонение (М±s) по результатам трех независимых экспериментов.
Для лучшего понимания сущности предлагаемой группы изобретений ниже следуют конкретные примеры их осуществления.
Пример 1. Конструирование рекомбинантной плазмиды pEL1.
Нуклеотидную последовательность, кодирующую рекомбинантный аналог лактаптина (рекомбинантный пептид EL1), амплифицируют с плазмиды pVGF-FR2-PE/L-Pat, используя праймеры lactap_AgeF 5'-gcaccggtatgaaccagaaacaaccagca-3' и U30R 5'-atgacgttgtagtgtttgggt-3'. Реакцию проводят в амплификаторе Eppendorf Mastercycler. В состав реакционной смеси объемом 50 мкл входит: 1xSEBuffer Pfu ДНК-полимераза (СибЭнзим, Россия), смесь дезоксинуклеозид трифосфатов (dATP, dGTP, dCTP, dGTP) (dNTP-смесь) (2,5 мкМ), плазмида pVGF-FR2-PE/L-Pat (10 нг), праймер lactap_AgeF (0,3 нМ), праймер U30R (0,3 нМ), Pfu-полимераза (2,5 ед. акт.) (СибЭнзим, Россия). Условия проведения ПЦР: предварительная денатурация - 2 минуты при 96°С; 35 циклов - 15 секунд при 94°С, 15 секунд при 54°С, 20 секунд при 72°С; заключительная стадия - 2 минуты при 72°С.
По завершении ПЦР к реакции добавляют 5 мкл 3М NaAc рН 5,0 и 125 мкл 96% этилового спирта и осаждают ДНК в течение нескольких часов при температуре минус 20°С. Полученный после центрифугирования (13000 g, 10 мин) осадок дважды промывают 500 мкл 70% этилового спирта (центрифугирование 13000 g, 5 мин), высушивают в вакуумном испарителе и растворяют в 40 мкл автоклавированной бидистиллированной воды.
Векторную ДНК pCDH-EF1a-GlucSP-MCS-IRES-copGFP (2 мкг) и переосажденный ПЦР-продукт (1 мкг), кодирующий рекомбинантный пептид EL1, обрабатывают эндонуклеазами рестрикции AgeI и EcoRI (по 10 ед. акт. каждого фермента) (Thermo Scientific, Литва) в объеме реакционной смеси 50 мкл. Реакцию проводят в условиях, рекомендованных производителем.
После обработки рестриктазами AgeI и EcoRI векторную ДНК pCDH-EF1a-GlucSP-MCS-IRES-copGFP и клонируемый ПЦР-фрагмент очищают электрофорезом в 1,0% агарозном геле на ТАЕ (40 мМ Tris-HCl, 20 мМ уксусная кислота, 1 мМ ЭДТА (рН=8,4)) и экстрагируют из геля набором QIAquick Gel Extraction Kit (Qiagen, США) согласно протоколу производителя.
Реакцию лигирования Т4 ДНК-лигазой (СибЭнзим, Россия) линеализированного вектора pCDH-EF1a-GlucSP-MCS-IRES-copGFP и клонируемого фрагмента, обработанного ранее эндонуклеазами рестрикции AgeI и EcoRI, проводят в реакции объемом 10 мкл и состава 50 мМ Tris-HCl (рН=7,8); 10 мМ MgCl2; 10 мМ DTT; 1 мМ rATP, при +4°С в течение ночи. В реакции используют 50 нг линейной формы вектора и клонируемый фрагмент в трехкратном молярном избытке по отношению к вектору.
Пример 2. Получение трансфицированных клеток человека HEK293T, секретирующих рекомбинантный пептид EL1.
Клетки линии HEK293T культивируют в среде IMDM (Gibco) с 10% фетальной сывороткой коров (HyClone, США), 100 мкг/мл стрептомицина и 100 ед./мл пенициллина в атмосфере 5% CO2 при 37°С. По достижении конфлюэнтности, клетки пересевают на новую среду разбавлением суспензии клеток 1:5 (или раз в два дня) или за 16 часов перед проведением трансфекции так, чтобы на момент проведения трансфекции уровень конфлюэнтности составлял около 50-60%.
Препарат плазмиды pEL1 и pCDH-EF1a-MCS-IRES-copGFP подготавливают при помощи набора очистки плазмидной ДНК QIAGEN Plasmid Maxi в соответствии с рекомендациями производителя и ДНК растворяют в автоклавированной деионизованной воде. Затем клетки линии HEK293T трансфицируют препаратами плазмид при помощи кальций-фосфатной трансфекции. Для трансфекции 5 млн клеток в чашке диаметром 10 см используют 10 мкг ДНК. ДНК плазмиды pEL1 или pCDH-EF1a-MCS-IRES-copGFP (негативный контроль) смешивают с 31.2 мкл СаС12 и добавляют воду до 250 мкл. После этого смесь постепенно добавляют к 250 мкл стерильного HBS (150 мМ NaCl, 20 мМ HEPES, рН 7,0;), интенсивно перемешивая его на вортексе. Полученную таким образом суспензию комплексов фосфата кальция и плазмидной ДНК осторожно раскапывают по поверхности чашки с трансфицируемыми клетками HEK293T. Через 6 часов после трансфекции среду в чашках заменяют на новую и инкубируют клетки 48 часов. После этого супернатанты кондиционированных сред, полученные центрифугированием 5 мин при 800 g, фильтруют через 0.45 мкм PES-фильтры и используют для дальнейшего анализа.
Пример 3. Детекция и оценка концентрации рекомбинантного пептида EL1 в кондиционированной среде.
Для подтверждения наработки полноразмерного рекомбинантного пептида EL1 проводят Вестерн-блот анализ кондиционированной среды. К аликвотам кондиционированной среды добавляют 1/4 часть (по объему) буфера состава 100 мМ Tris-HCl рН=6,8, 400 мМ 2-меркаптоэтанол, 4% SDS, 40% глицерин, бромфеноловый голубой (300 нг/мл), ксилен цианоловый (300 нг/мл), прогревают на кипящей водяной бане 1 минуту, центрифугируют 1 минуту при 13000 g и наносят на полиакриламидный гель (5% концентрирующий и 15% разделяющий) [11]. В качестве маркера молекулярного веса используют готовый набор предокрашенных белков с молекулярной массой 10-260 кДа (Thermo Scientific Spectra Multicolor Broad range Protein Ladder, Thermo Scientific, Литва). По окончании электрофореза белки и пептиды из геля переносят на нитроцеллюлозную мембрану (Bio-Rad, США) путем влажного электропереноса при 150 В в течение 1 ч в буфере NuPAGE (Novex Life Technologies, США). Нитроцеллюлозную мембрану инкубируют в буфере iBind Solution (Novex Life Technologies, США) на приборе iBind Western (Life Technologies) в течение 18 ч с добавлением антител к RL2, конъюгированных с пероксидазой хрена (клон F14, Biosan, Россия), разведение 1:1000. После этого мембрану инкубируют с хемилюминесцентным субстратом (Novex®ECL, Invitrogen, США) в течение 1 мин и визуализируют данные на люминесцентном сканере C-Digit (LI-COR, США). Данные обрабатывают с помощью программного пакета Image Studio Ver 4.0 digits (LI-COR, США). Результаты эксперимента представлены на фиг. 3 и свидетельствуют о том, что клетки HEK293T, трансфицированные плазмидной ДНК pEL1, действительно продуцируют рекомбинантный пептид EL1, секретируемый в среду: электрофоретическая подвижность детектируемого анти-RL2 антителами рекомбинантного пептида EL1 соответствует подвижности рекомбинантного RL2, полученного в системе Escherichia coli (RL2coli).
Определение концентрации рекомбинантного пептида EL1 в кондиционированных средах проводят по следующему протоколу. Специфические моноклональные антитела к RL2 (100 мкл) (клон F21, ЗАО Биосан, РФ) в карбонат-бикарбонатном буфере (15 мМ Na2CO3, 35 мМ NaHCO3, рН=9,6.), иммобилизуют в 96-луночном сорбционном планшете для ИФА (Costar, США) и инкубируют последовательно 60 мин при 37°С и далее 18 ч при 4°С. Содержимое лунок удаляют, планшет дважды промывают 1 х промывочным буфером (150 мМ NaCl, 25 мМ Tris-HCl рН=7,5, 0.05% Tween-20) и добавляют в лунки по 200 мкл блокировочного буфера (150 мМ NaCl, 25 мМ Tris-HCl рН=7,5, 0.05% Tween-20, 0.9% BSA), инкубируют 1 ч при 37°С. Лунки дважды промывают промывочным буфером и наносят в трех повторах образцы кондиционированной среды, разбавленной в 2, 5 и 10 раз. Для построения калибровочной кривой готовят образцы рекомбинантного пептида RL2(прототип), полученного в системе Escherichia coli (RL2coli) (30 нг/мл, 60 нг/мл, 90 нг/мл, 120 нг/мл, 300 нг/мл, 600 нг/мл) и помещают по 100 мкл в трех повторах в подготовленный ИФА-планшет. Планшет инкубируют 1 ч при 37°С, после чего содержимое лунок удаляют и добавляют в каждую лунку по 100 мкл моноклональных антител к RL2 (клон F15, ЗАО Биосан, РФ), конъюгированных с пероксидазой хрена, и инкубируют 1 ч при 37°С. Лунки промывают промывочным буфером, добавляют по 100 мкл субстрата (0.05 М цитратно-фосфатный буфер, 0.1 мг/мл ТМВ, 0.006% H2O2 рН=5,0.) и инкубируют 20 мин в темноте при 24°С. Реакцию останавливают добавлением 100 мкл 2 М H2SO4. Оптическую плотность раствора в лунках измеряют на планшетном спектрофотометре Apollo LB 912 (Berthold Technologies, Германия) при λ=450 нм, референсная длина волны λ=620 нм. По полученным результатам строят калибровочную кривую и по ее линейному участку определяют содержание рекомбинантного пептида EL1 в кондиционированной среде.
Пример 4. Оценка цитотоксической активности рекомбинантного пептида EL1 по отношению к раковым клеткам человека.
Для сравнительного анализа цитотоксического воздействия RL2 (прототип), очищенного из клеток Escherichia coli штамма BL21(DE3)/pFK2, депонированного в ЦКП «Коллекция экстремофильных микроорганизмов и типовых культур» Института химической биологии и фундаментальной медицины СО РАН под номером 1020 (RL2coli), и EL1, секретируемого клетками человека HEK293T, трансфицированных плазмидной ДНК pEL1, используют клетки аденокарциномы молочной железы человека линии MDA-MB-231 и клетки глиомы человека линии T98G, полученные из коллекции клеточных культур ЗАО «Исследовательский Институт Химического Разнообразия» (г. Химки, Московская область), а также клетки рака простаты человека линии РС3 (АТСС, США).
Клетки MDA-MB-231 культивируют в среде L15 (Gibco, Life Technologies, UK) в присутствии 10% FBS, 2 мМ L-глутамина, 250 мг/мл амфотерицина В и 100 ед./мл пенициллина/стрептомицина. Клетки T98G и РС3 культивируют в среде IMDM (Gibco, Life Technologies, UK) в присутствии 10%) FBS, 2 мМ L-глутамина и 100 ед./мл пенициллина/стрептомицина. Клетки культивируют при 37°С в атмосфере 5% CO2.
В качестве способа, позволяющего быстро и точно оценить цитотоксическую активность заявляемого рекомбинантного пептида EL1, полученного в эукариотической системе экспрессии и RL2coli (прототип) используют МТТ-тест. Клетки высаживают на 96-луночные планшеты для культур клеток в концентрации 4-5*103 клеток/лунку в 100 мкл питательной среды RPMI-1640 (Gibco, Life Technologies, UK), содержащей 10% по объему FBS с добавлением раствора антибиотиков-антимикотиков состава: 100 ед./мл пенициллина G, 100 мкг/мл стрептомицина сульфата, 0,25 мкг/мл амфотерицина, и инкубируют в течение 24 ч при температуре 37°С в атмосфере 5% CO2.
Готовят ряд последовательных разбавлений референсного рекомбинантного пептида RL2coli и кондиционированных сред, содержащих EL1, в питательной среде RPMI-1640, не содержащей FBS. Вносят по 100 мкл полученных разведений в лунки пластикового планшета с клетками. Через 48 час инкубации при температуре 37°С в атмосфере 5% CO2 удаляют среду из лунок и вносят в каждую лунку по 200 мкл питательной среды RPMI-1640 и 10 мкл раствора МТТ (Sigma, США) с концентрацией 5 мг/мл, после чего продолжают инкубацию в тех же условиях в течение 4 ч. Затем удаляют среду с МТТ из лунок и растворяют образовавшиеся кристаллы МТТ-формазана добавлением 150 мкл ДМСО. Оптическую плотность растворенного в ДМСО МТТ-формазана измеряют на многоканальном планшетном сканере при λ=570 нм.
Результаты эксперимента представлены на фиг. 4 и свидетельствуют о том, что инкубация раковых клеточных линий в присутствии рекомбинантного пептида RL2 (прототип), полученного в системе Escherichia coli (RL2coli), и в присутствии рекомбинантного пептида EL1 в составе кондиционированных сред от клеток HEK293T, трансфицированных pEL1, приводит к дозозависимому снижению жизнеспособности раковых клеток. Концентрация рекомбинантного пептида RL2coli (прототип), приводящая к двукратному снижению жизнеспособности протестированных раковых клеточных линий (IC50) соответствует значению ~200 мкг/мл, в то время как IC50 для рекомбинантного пептида EL1, продуцируемого человеческими клетками линии HEK293T, трансфицированными pEL1, не выше 400 нг/мл, т.е. наблюдаются по меньшей мере 500-кратные различия в IC50.
Таким образом, сконструированная плазмидная ДНК pEL1 обеспечивает продукцию в человеческой клеточной линии HEK293T противоопухолевого рекомбинантного пептида EL1, а полученный таким образом рекомбинантный пептид EL1 обладает, как минимум, в 500 раз более выраженной цитотоксической активностью в отношении человеческих раковых клеток линий MDA-MB-231, T98G и РС3.
Источники информации
1. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава России, 2016. 250 с.
2. Millimouno F.M., Dong J., Yang L., Li J., Li X. Targeting apoptosis pathways in cancer and perspectives with natural compounds from mother nature. // Cancer Prev Res (Phila). - 2014. - Vol. 7. - N. 11. - P. 1081-1107.
3. Некипелая B.B., Семенов Д.В., Потапенко M.O., Кулигина Е.В., Кит Ю.Я., Романова И.В., Рихтер В.А. Лактаптин - белок человеческого молока, индуцирующий апоптоз клеток аденокарциномы MCF-7. // Докл. АН. - 2008. - Т. 419. - С. 268-271.
4. Власов В.В., Рихтер В.А., Семенов Д.В., Некипелая В.В., Кулигина Е.В., Потапенко М.О. Пептид, обладающий апоптотической активностью по отношению к раковым клеткам человека. // Патент RU 2317304 C1, оп. 20.02.2008.
5. Тикунова Н.В. и др. Рекомбинантная плазмидная ДНК pFK2, обеспечивающая синтез рекомбинантного пептида, являющегося аналогом фрагмента каппа-казеина человека, способ получения рекомбинантного пептида и рекомбинантный пептид, аналог фрагмента каппа-казеина человека, обладающий апоптотической активностью по отношению к раковым клеткам. // Патент RU 2401307 С1, оп. 10.10.2010.
6. Semenov D.V., Fomin A.S., Kuligina E.V., Koval O.A., Matveeva V.A., Babkina I.N., Tikunova N.V., Richter V.A. Recombinant analogues of novel milk pro-apoptotic peptide lactaptin and their effect on cultured human cells. // The Protein Journal. - 2010. - Vol. 29. - N. 3. - P. 174-180.
7. Koval O.A., Fomin A.S., Kaledin V., Semenov D.V., Potapenko M.O., Kuligina E.V., Richter V.A. A novel pro-apoptic effector lactaptin inhibits tumor growth in mice models. // Biochimie. - 2012. - Vol. 94. - N. 12. - P. 2467-2474.
8. Koval O.A., Tkachenko A.V., Fomin A.S., Semenov D.V., Nushtaeva A.A., Kuligina E.V., Zavjalov E.L., Richter V.A. Lactaptin induces p53-independent cell death associated with features of apoptosis and autophagy and delays growth of breast cancer cells in mouse xenografts. // PLoS One. - 2014. - Vol. 9, N 4. - E. 93921.
9. Бондаренко Д.А., Рихтер B.A., Кулигина E.B., Коваль О.А., Фомин А.С. и др. Исследование токсичности и фармакокинетики препарата «Лактаптин». // Биофармацевтический журнал. - 2015. - №7. - С. 40-47.
10. Kochneva G., Sivolobova G., Tkacheva A., Grazhdantseva A., Troitskaya O., Nushtaeva A., Tkachenko A., Kuligina E., Richter V., Koval O. Engineering of double recombinant vaccinia virus with enhanced oncolytic potential for solid tumor virotherapy. // Oncotarget. - 2016. - Vol. 7. - N. 45. - P. 74171-74188.
11. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. // Nature. - 1970. - V. 227. - P. 680-685.
Рекомбинантный пептид EL1, обладающий цитотоксической активностью по отношению к раковым клеткам человека, имеющий молекулярную массу 14,1 кДа, имеющий аминокислотную последовательность SEQ ID NO: 2, представленную на фиг. 2.