Результат интеллектуальной деятельности: Терапевтические полимерные наночастицы и способы их получения и применения
Вид РИД
Изобретение
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Давно признана польза систем, доставляющих пациенту определенные лекарственные средства (например, распределяемые преимущественно в тканях или клетках определенного типа или в определенной больной ткани в большей степени, чем в нормальной ткани) или контролирующих высвобождение лекарственных средств.
Например, терапевтические средства, включающие активный агент, преимущественно распределяемый в определенной больной ткани в большей степени, чем в нормальной ткани, могут увеличить воздействие лекарственного средства в этих тканях по сравнению с другими тканями организма. Это особенно важно при лечении состояния, такого как рак, где желательно, чтобы цитотоксическая доза лекарственного средства доставлялась в раковые клетки и не уничтожала окружающую нераковую ткань. Эффективное распределение лекарственного средства может уменьшить нежелательные, а иногда опасные для жизни, побочные эффекты, распространенные в противораковой терапии.
Наночастицы благодаря их размеру и поверхностным свойствам должны обеспечивать возможность пролонгированной циркуляции в сосудистой сети и преимущественного накопления в ткани посредством поврежденной архитектуры больных тканей/опухолей посредством эффекта усиленного проникновения и удерживания.
Терапевтические средства, предлагаемые для терапии с контролируемым высвобождением, должны также обладать способностью к доставке определенного количества лекарственного средства, что является известным ограничением таких систем доставки на основе наночастиц. Например, проблема может состоять в получении систем наночастиц, в которой с каждой наночастицей связано соответствующее количество лекарственного средства и при этом сохраняется достаточно мелкий размер наночастиц, чтобы они обладали преимущественными свойствами доставки.
Соответственно, существует необходимость в терапевтических средствах на основе наночастиц и в способах получения таких наночастиц, которые способны к доставке терапевтических уровней терапевтического средства для лечения заболеваний, таких как рак, при этом также уменьшая побочные эффекты для пациента.
Рак (и другое гиперпролиферативное заболевание) характеризуется неконтролируемой пролиферацией клеток. Эта потеря нормальной регуляции пролиферации клеток часто возникает как результат генетического повреждения биохимических путей клетки, контролирующих прохождение ими клеточного цикла.
Считают, что клеточный цикл у эукариотов контролируется упорядоченным каскадом фосфорилирования белков. К настоящему времени идентифицировано несколько семейств протеинкиназ, которые играют критические роли в этом каскаде. Активность многих из этих киназ повышена в опухолях человека по сравнению с нормальной тканью. Это может происходить либо за счет повышенных уровней экспрессии белка (например, в результате амплификации гена), либо за счет изменений экспрессии соактиваторных или ингибиторных белков.
Киназы Аврора (Аврора-А, Аврора-В и Аврора-С) кодируют регулируемые клеточным циклом серин-треониновые протеинкиназы (суммировано в статье Adams et al., 2001, Trends in Cell Biology, 11(2): 49-54). Эти киназы проявляют пик экспрессии и киназной активности посредством G2 и митоза, и давно подразумевается роль киназ Аврора при раке.
Ингибитор киназы Аврора, известный как AZD1152 (2-(этил(3-((4-((5-(2-((3-фторфенил)амино)-2-оксоэтил)-1Н-пиразол-3-ил)амино)хиназолин-7-ил)окси)пропил)амино)этилдигидрофосфат), изображенный ниже, также известный как барасертиб (barasertib), впервые описан в международной заявке на патент WO 2004/058781 (пример 39) и исследован компанией AstraZeneca для потенциального лечения различных раков. Однако на практике при клиническом введении AZD1152 существуют проблемы, связанные с непрерывным введением внутривенного раствора в течение многих суток.
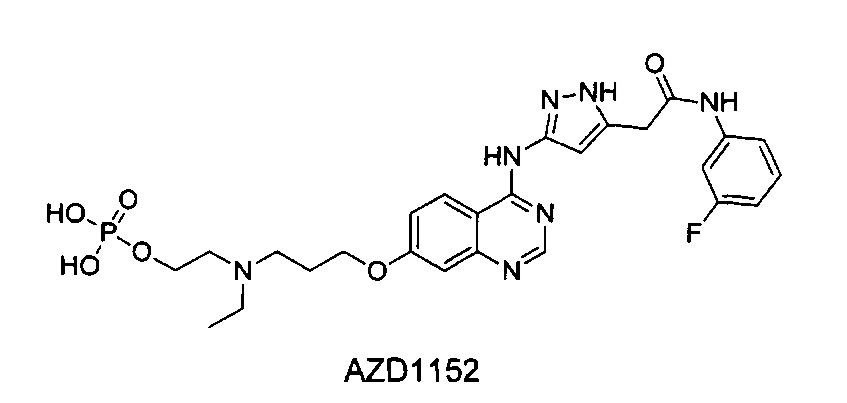
Известно, что AZD1152 метаболизируется in vivo до соединения, известного как AZD1152 hqpa (2-(3-((7-(3-(этил(2-гидроксиэтил)амино)пропокси)хиназолин-4-ил)амино)-1Н-пиразол-5-ил)-N-(3-фторфенил)ацетамид), также описанного в WO 2004/058781. Фактически AZD1152 hqpa в значительной степени представляет собой группировку, биологический эффект которой проявляется при введении самого AZD1152. Однако фармацевтические композиции AZD1152 hqpa, в частности подходящие для коммерческого применения, до сих пор не были специально описаны или протестированы.
Препараты наночастиц, включающие основные терапевтические средства с протонируемым атомом азота, описаны в WO 2014/043625.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем документе описаны полимерные наночастицы, включающие AZD1152 hqpa или его фармацевтически приемлемую соль в качестве терапевтического средства, и способы получения и применения таких терапевтических наночастиц.
Следует понимать, что в настоящем документе ссылки на конкретное терапевтическое средство или на терапевтическое средство вообще означают AZD1152 hqpa или его фармацевтически приемлемую соль, если контекстом не продиктовано иное.
В частности, терапевтическое средство представляет собой AZD1152 hqpa.
В одном аспекте предложена терапевтическая наночастица. Терапевтическая наночастица содержит от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов полиэтиленгликоля и от приблизительно 0,2 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли, в частности AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa и подходящий полимер.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, подходящий полимер и гидрофобную кислоту.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, подходящий полимер и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
Диоктилсульфоянтарную кислоту также называют в настоящем документе докузатной кислотой. Диоктилсульфосукцинат натрия также известен как докузат натрия.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, подходящий полимер и памовую кислоту.
В другом аспекте предложена терапевтическая наночастица, содержащая подходящий полимер и смесь AZD1152 hqpa и гидрофобной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая подходящий полимер и продукт, полученный путем взаимодействия AZD1152 hqpa и гидрофобной кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая подходящий полимер и гидрофобную ионную пару, образованную между AZD1152 hqpa и гидрофобной кислотой.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и гидрофобную кислоту.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и смесь AZD1152 hqpa и гидрофобной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и продукт, полученный путем взаимодействия AZD1152 hqpa и гидрофобной кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и гидрофобную ионную пару, образованную между AZD1152 hqpa и гидрофобной кислотой.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и памовую кислоту.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и смесь AZD1152 hqpa и гидрофобной кислоты, выбранной из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и продукт, полученный путем взаимодействия AZD1152 hqpa и гидрофобной кислоты, выбранной из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и гидрофобную ионную пару, образованную между AZD1152 hqpa и гидрофобной кислотой, выбранной из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и смесь AZD1152 hqpa и памовой кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и продукт, полученный путем взаимодействия AZD1152 hqpa и памовой кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и гидрофобную ионную пару, образованную между AZD1152 hqpa и памовой кислотой.
В другом аспекте предложена терапевтическая наночастица, содержащая AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет сред нечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и сред нечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 50 до приблизительно 94,95 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты и от приблизительно 5 до приблизительно 30 процентов по массе AZD1152 hqpa или его фармацевтически приемлемой соли, в частности AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 50 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли, в частности AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица. Терапевтическая наночастица содержит от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты и диоктилсульфоянтарной кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли. В другом аспекте изобретения используют смесь холевой кислоты и дезоксихолевой кислоты при их общем содержании от приблизительно 0,05 до приблизительно 35 массовых процентов от массы наночастицы. В дополнительном аспекте изобретения гидрофобная кислота представляет собой олеиновую кислоту.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота) -поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте терапевтическая наночастица содержит от приблизительно 65 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота) -поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(зтилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и смесь:
а) от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; и
б) от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и продукт, полученный путем взаимодействия:
а) от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; и
б) от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и гидрофобную ионную пару, образованную между:
а) от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой кислоты и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; и
б) от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте терапевтическая наночастица содержит от приблизительно 55 до приблизительно 80 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 10 до приблизительно 20 массовых массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 процента по массе диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa.
В другом аспекте терапевтическая наночастица содержит от приблизительно 55 до приблизительно 85 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 20 массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 55 до приблизительно 85 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля и смесь от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa и от приблизительно 5 до приблизительно 20 массовых процентов памовой кислоты.
В другом аспекте предложена терапевтическая наночастица, содержащая от приблизительно 55 до приблизительно 85 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и продукт, полученный путем взаимодействия от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa и от приблизительно 5 до приблизительно 20 массовых процентов памовой кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая от приблизительно 55 до приблизительно 85 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и гидрофобную ионную пару, образованную между от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa и от приблизительно 5 до приблизительно 20 массовых процентов памовой кислоты.
В другом аспекте терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты.
В другом аспекте терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля), от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa.
В другом аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты.
В дополнительном аспекте предложена терапевтическая наночастица, содержащая диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты.
В другом аспекте терапевтическая наночастица содержит от приблизительно 65 до приблизительно 76 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 20 массовых процентов поли(этилен)гликоля, от приблизительно 9 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В некоторых воплощениях сополимер поли(молочная кислота)-поли(этилен)гликоль имеет долю среднечисловой молекулярной массы поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9. В других воплощениях сополимер поли(молочная кислота)-поли(этилен)гликоль имеет долю среднечисловой молекулярной массы поли(молочной кислоты) от приблизительно 0,75 до приблизительно 0,85.
В некоторых воплощениях рассматриваемые наночастицы содержат от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля. В других воплощениях рассматриваемые наночастицы содержат от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
В некоторых воплощениях сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля. В других воплощениях сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
В некоторых воплощениях рассматриваемые наночастицы содержат от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера.
В некоторых воплощениях рассматриваемые наночастицы имеют гидродинамический диаметр менее 200 нм, такой как 70-140 нм.
В некоторых воплощениях рассматриваемые наночастицы содержат по существу гидрофобную кислоту, также называемую в настоящем документе "гидрофобной кислотой". Например, рассматриваемые наночастицы могут содержать от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты или от приблизительно 10 до приблизительно 20 массовых процентов по существу гидрофобной кислоты. Рассматриваемые наночастицы могут в других воплощениях содержать от приблизительно 5 до приблизительно 20 массовых процентов по существу гидрофобной кислоты. В некоторых воплощениях может быть использована более чем одна по существу гидрофобная кислота, и рассматриваемые наночастицы могут содержать от приблизительно 5 до приблизительно 15 массовых процентов или от приблизительно 10 до приблизительно 20 массовых процентов всех гидрофобных кислот вместе. Рассматриваемые наночастицы в других воплощениях могут содержать от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, холевой кислоты, смеси дезоксихолевой кислоты и холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты.
В некоторых воплощениях молярное отношение по существу гидрофобной кислоты к терапевтическому средству составляет от приблизительно 0,9:1 до приблизительно 1,1:1, где кислота представляет собой дезоксихолевую кислоту. В других воплощениях молярное отношение по существу гидрофобной кислоты к терапевтическому средству составляет от приблизительно 0,9:1 до приблизительно 1,1:1, где кислота представляет собой диоктилсульфоянтарную кислоту. В дополнительном воплощении гидрофобная кислота включает смесь дезоксихолевой кислоты и холевой кислоты, например в соотношении дезоксихолевая кислота: холевая кислота от 1:5 до 5:1, таком как дезоксихолевая кислота: холевая кислота приблизительно 3:2. В других воплощениях молярное отношение по существу гидрофобной кислоты к терапевтическому средству составляет от приблизительно 0,75:1 до приблизительно 1,0:1, где кислота представляет собой памовую кислоту.
В некоторых воплощениях pKa терапевтического средства по меньшей мере приблизительно на 1,0 единицу pKa больше, чем pKa гидрофобной кислоты.
В некоторых воплощениях по существу гидрофобная кислота и терапевтическое средство образуют гидрофобную ионную пару в рассматриваемой терапевтической наночастице. В некоторых воплощениях гидрофобная кислота представляет собой желчную кислоту. Например, в некоторых воплощениях желчная кислота представляет собой дезоксихолевую кислоту. В других воплощениях желчная кислота представляет собой холевую кислоту. В дополнительных воплощениях желчная кислота представляет собой смесь дезоксихолевой кислоты и холевой кислоты. В других воплощениях гидрофобная кислота представляет собой диоктилсульфоянтарную кислоту. В дополнительных воплощениях гидрофобная кислота представляет собой олеиновую кислоту. В дополнительных воплощениях гидрофобная кислота представляет собой памовую кислоту.
В некоторых воплощениях рассматриваемые наночастицы содержат от приблизительно 5 до приблизительно 20 массовых процентов терапевтического средства. В других воплощениях рассматриваемые наночастицы содержат от приблизительно 10 до приблизительно 20 массовых процентов терапевтического средства. В других воплощениях рассматриваемые наночастицы содержат от приблизительно 15 до приблизительно 20 массовых процентов терапевтического средства. В других воплощениях рассматриваемые наночастицы содержат от приблизительно 8 до приблизительно 15 массовых процентов терапевтического средства. В других воплощениях рассматриваемые наночастицы содержат от приблизительно 8 до приблизительно 20 массовых процентов терапевтического средства.
Следует понимать, что состав любого предпочтительного препарата может быть таким, при котором сбалансированы несколько факторов, включая, без ограничения:
препарат с повышенным содержанием лекарственного вещества, где возможна минимизация объема фармацевтической композиции, которую следует вводить пациенту;
препарат, который можно получить воспроизводимо и надежно при крупномасштабном производстве;
препарат, который оптимизирует профиль высвобождения терапевтического средства по времени;
препарат, который предпочтительно распределяется в пораженные участки.
Дополнительным фактором может быть препарат, обладающий сниженным или минимально вредным действием на костный мозг пациента после дозирования, проиллюстрированный на животных моделях в разделе Примеры настоящего документа.
В любом конкретном предпочтительном препарате может быть учтен любой один или более из описанных выше факторов.
В другом аспекте предложена наночастица, которая может быть получена любым способом, описанным или проиллюстрированным в настоящем документе. В другом аспекте предложена наночастица, полученная любым способом, описанным или проиллюстрированным в настоящем документе. В дополнительном аспекте предложена терапевтическая наночастица, по существу такая, как описано в настоящем документе.
В другом аспекте предложена фармацевтически приемлемая композиция. Фармацевтически приемлемая композиция содержит множество рассматриваемых терапевтических наночастиц и фармацевтически приемлемый эксципиент.
В еще одном аспекте предложен способ лечения рака (например, включая, без ограничения, гематологические виды рака, такие как острый миелоидный лейкоз (AML) и диффузную крупноклеточную лимфому В-клеток, и солидные опухолевые виды рака, такие как колоректальный рак и рак легкого) у пациента, нуждающегося в этом. Способ включает введение пациенту терапевтически эффективного количества композиции, содержащей терапевтические наночастицы, рассмотренные в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
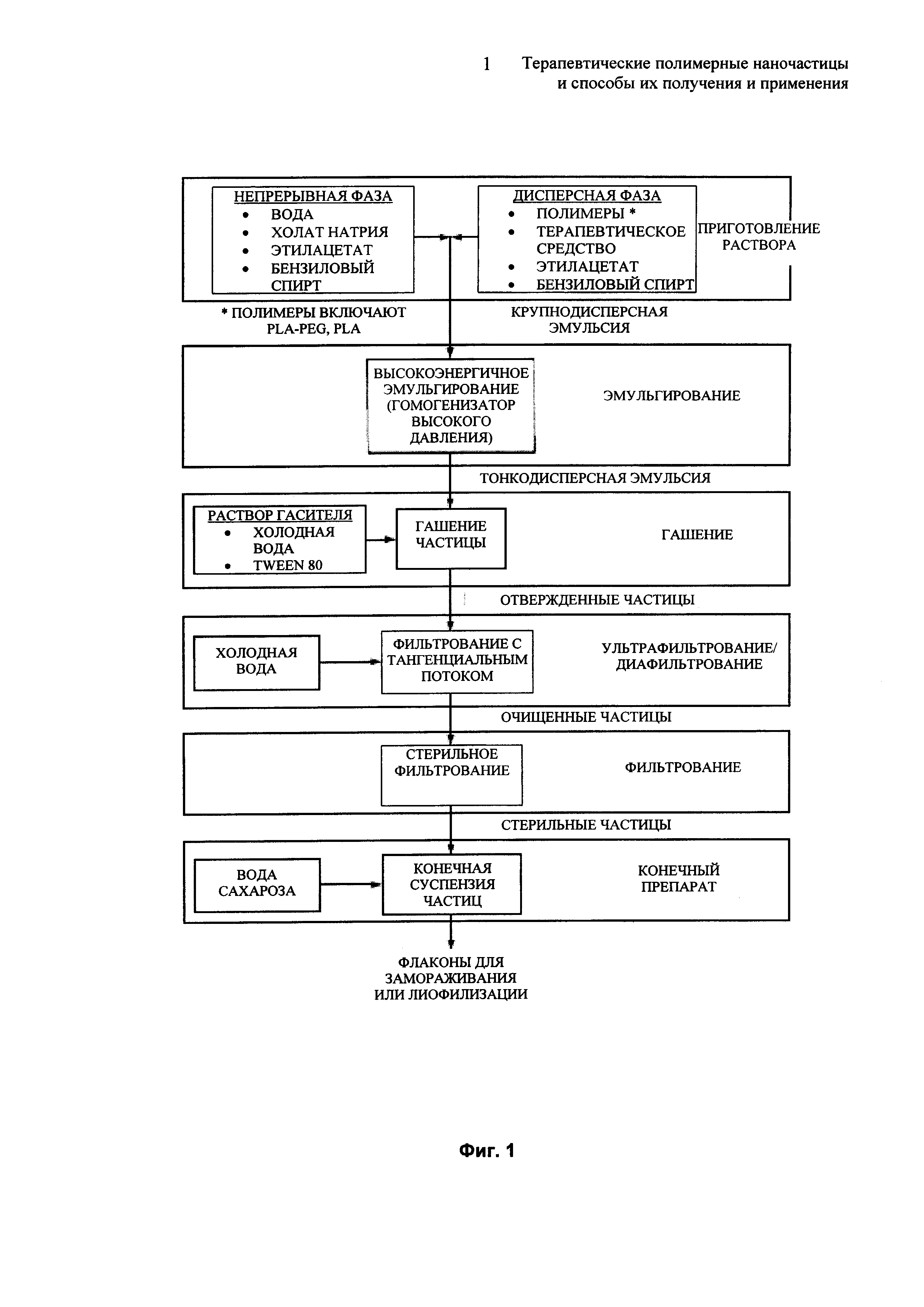
Фиг. 1 представляет собой блок-схему процесса эмульгирования для образования описанной наночастицы.
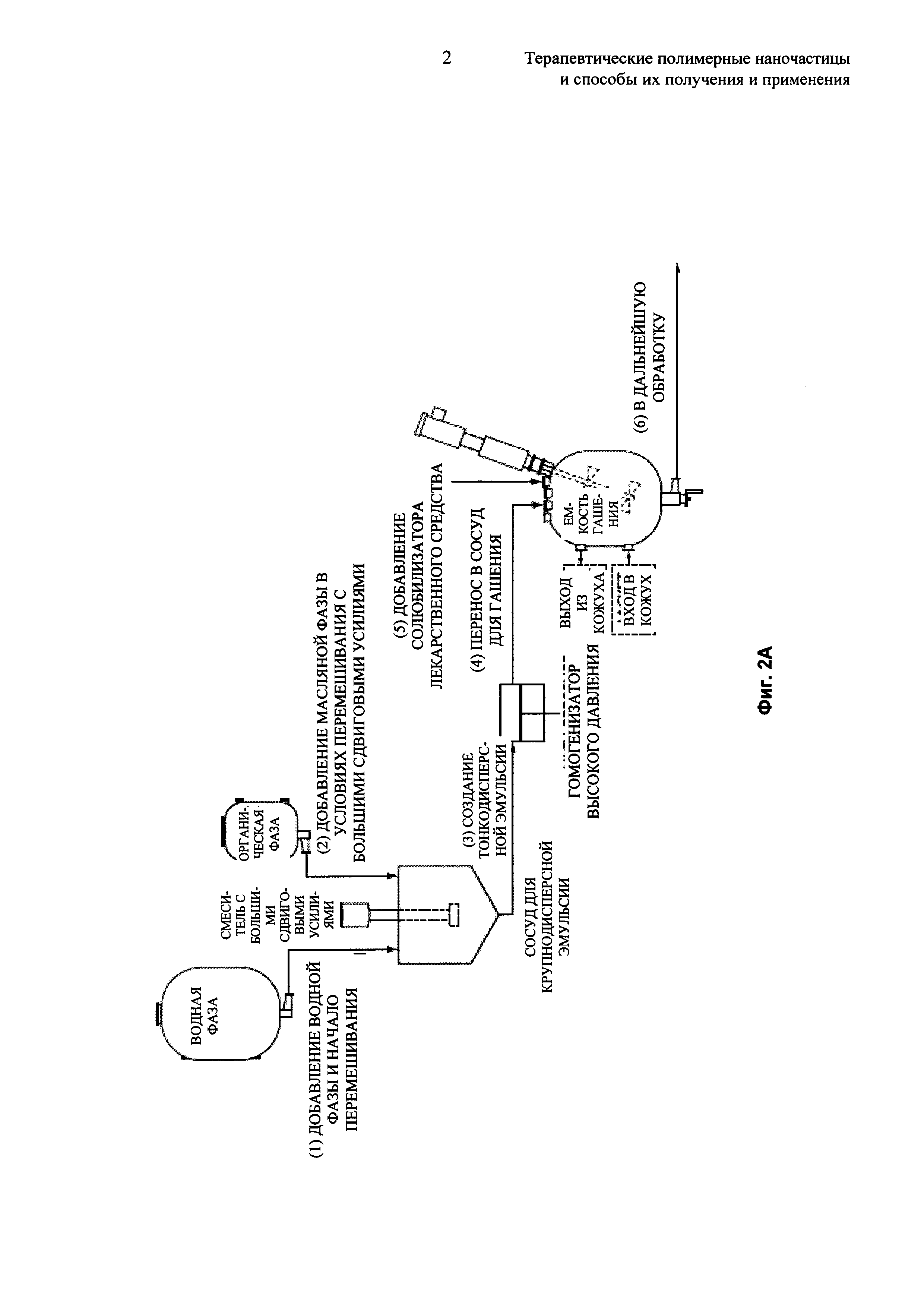
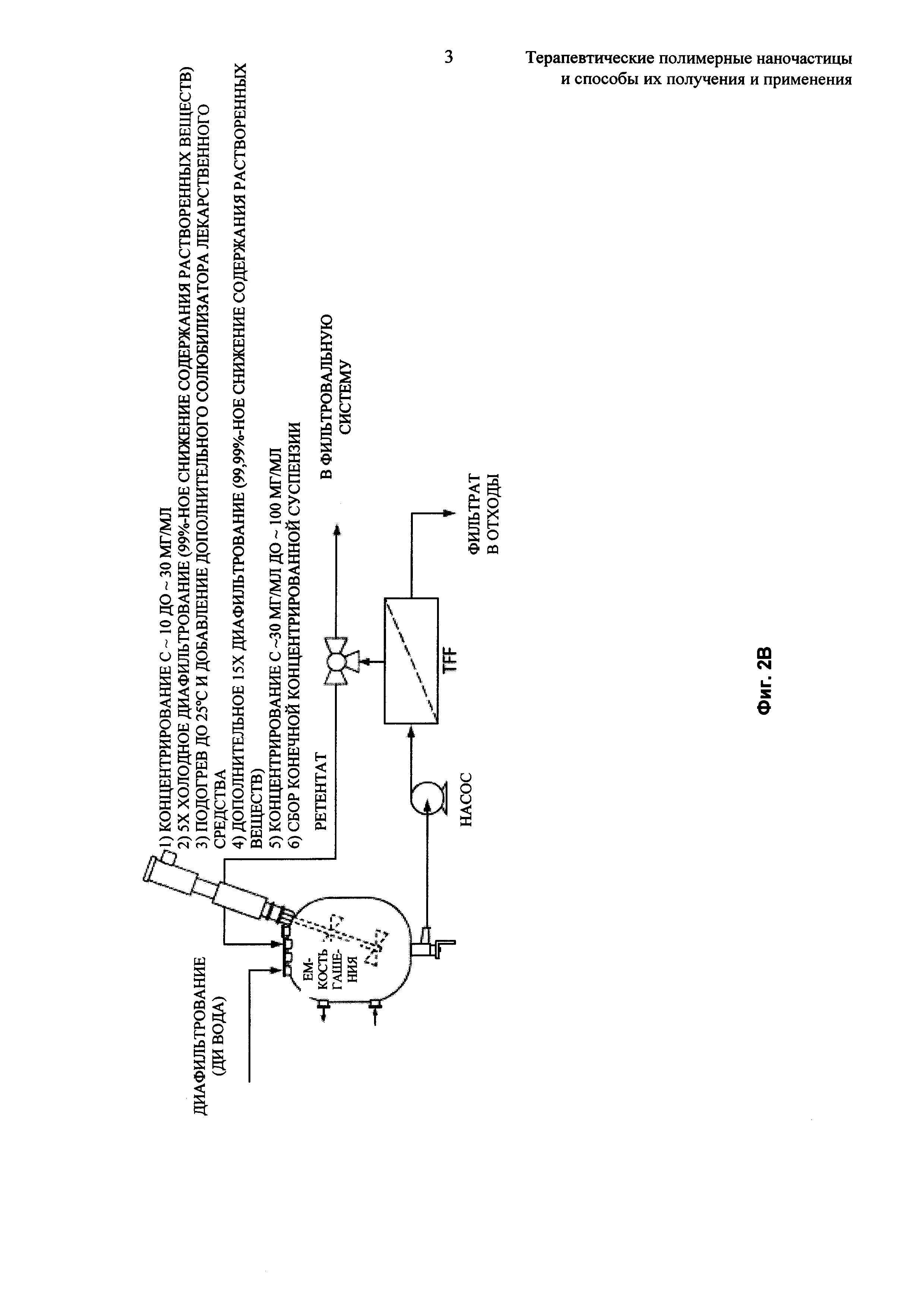
На Фиг. 2А и 2В представлены технологические схемы описанного процесса эмульгирования.
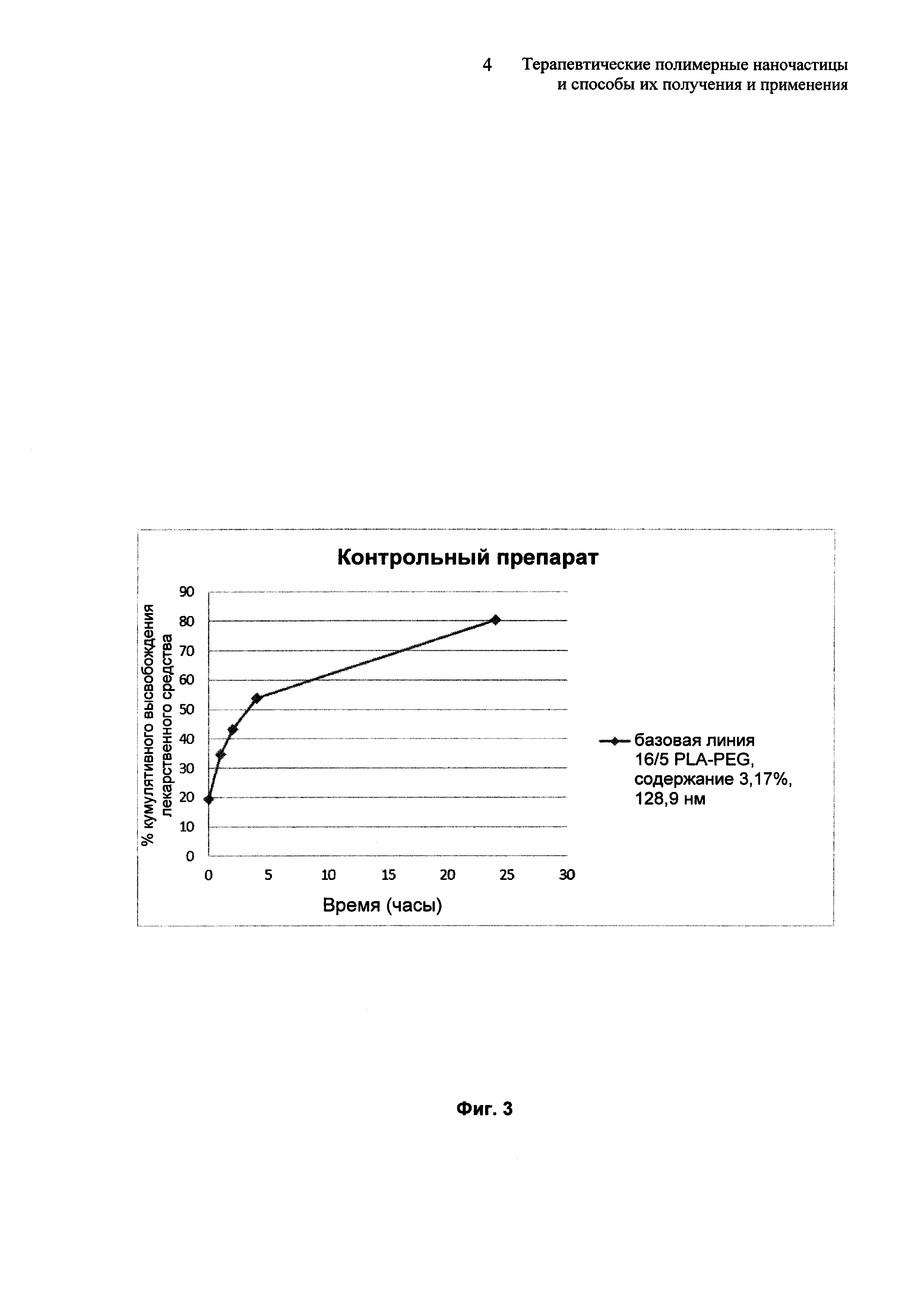
На Фиг. 3 представлен профиль высвобождения in vitro для контрольных терапевтических препаратов наночастиц.
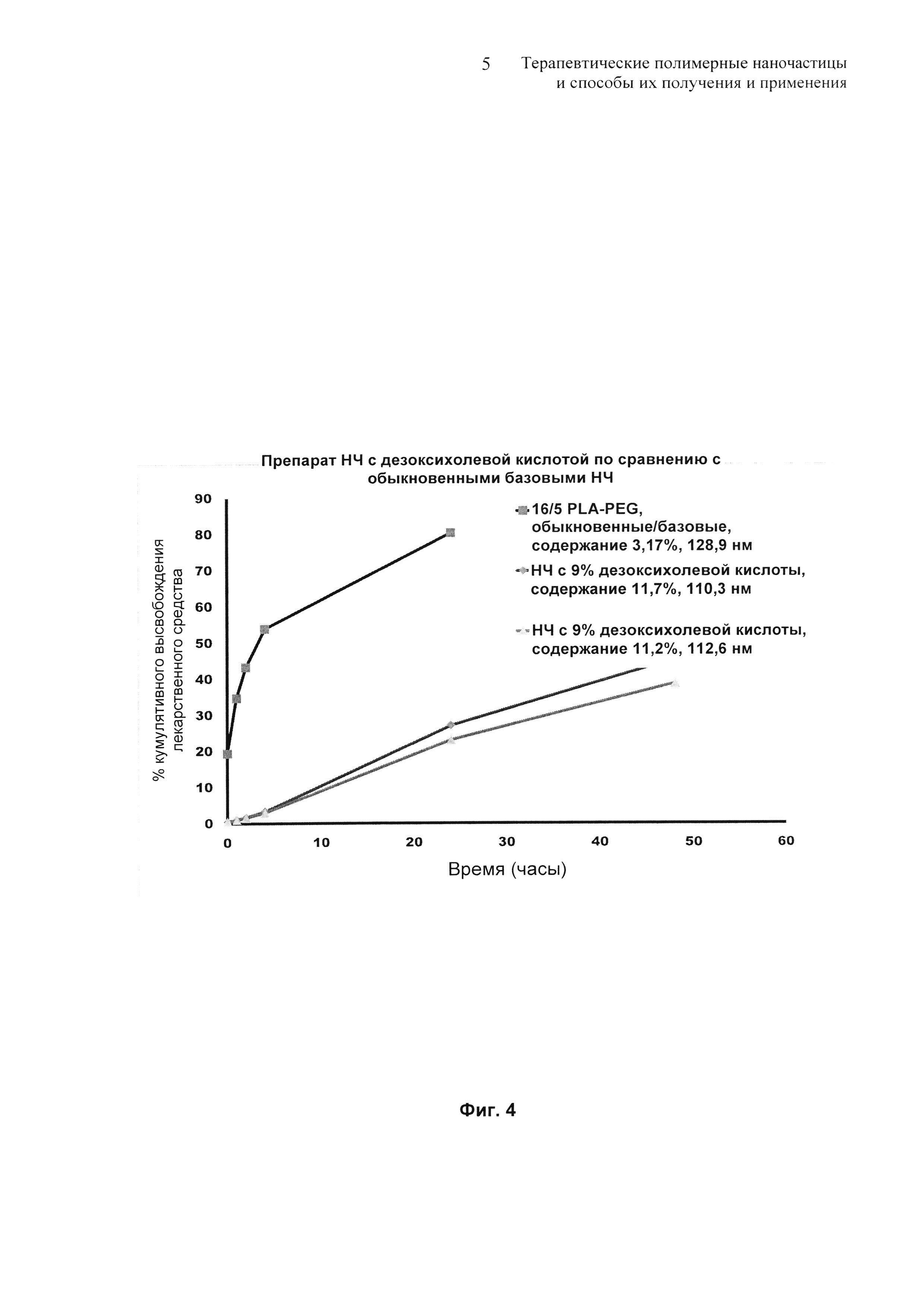
На Фиг. 4 представлены профили высвобождения in vitro для препаратов дезоксихолевокислотных наночастиц по сравнению с контрольным терапевтическим препаратом наночастиц.
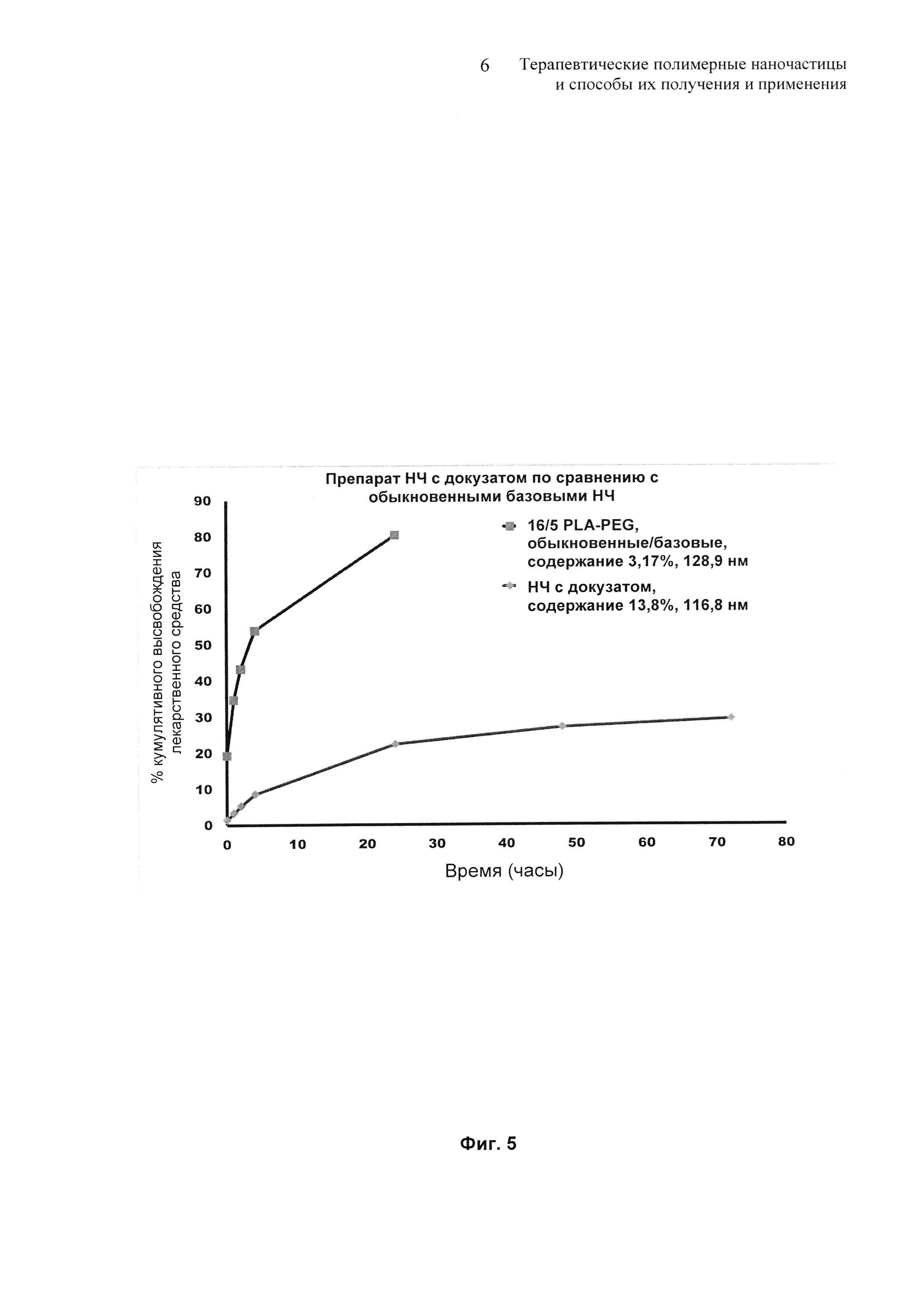
На Фиг. 5 представлены профили высвобождения in vitro для препарата докузатнокислотных наночастиц по сравнению с контрольным терапевтическим препаратом наночастиц.
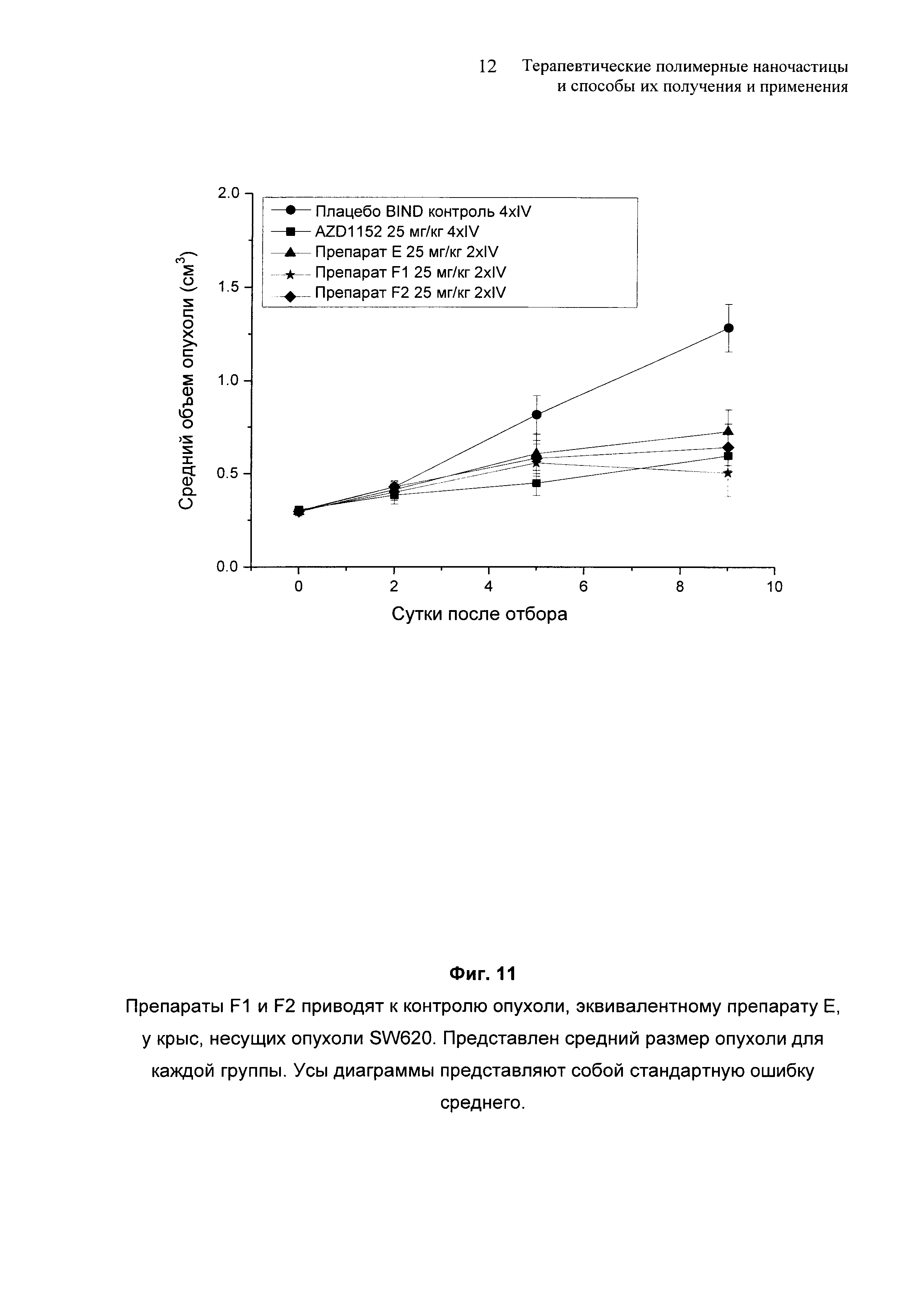
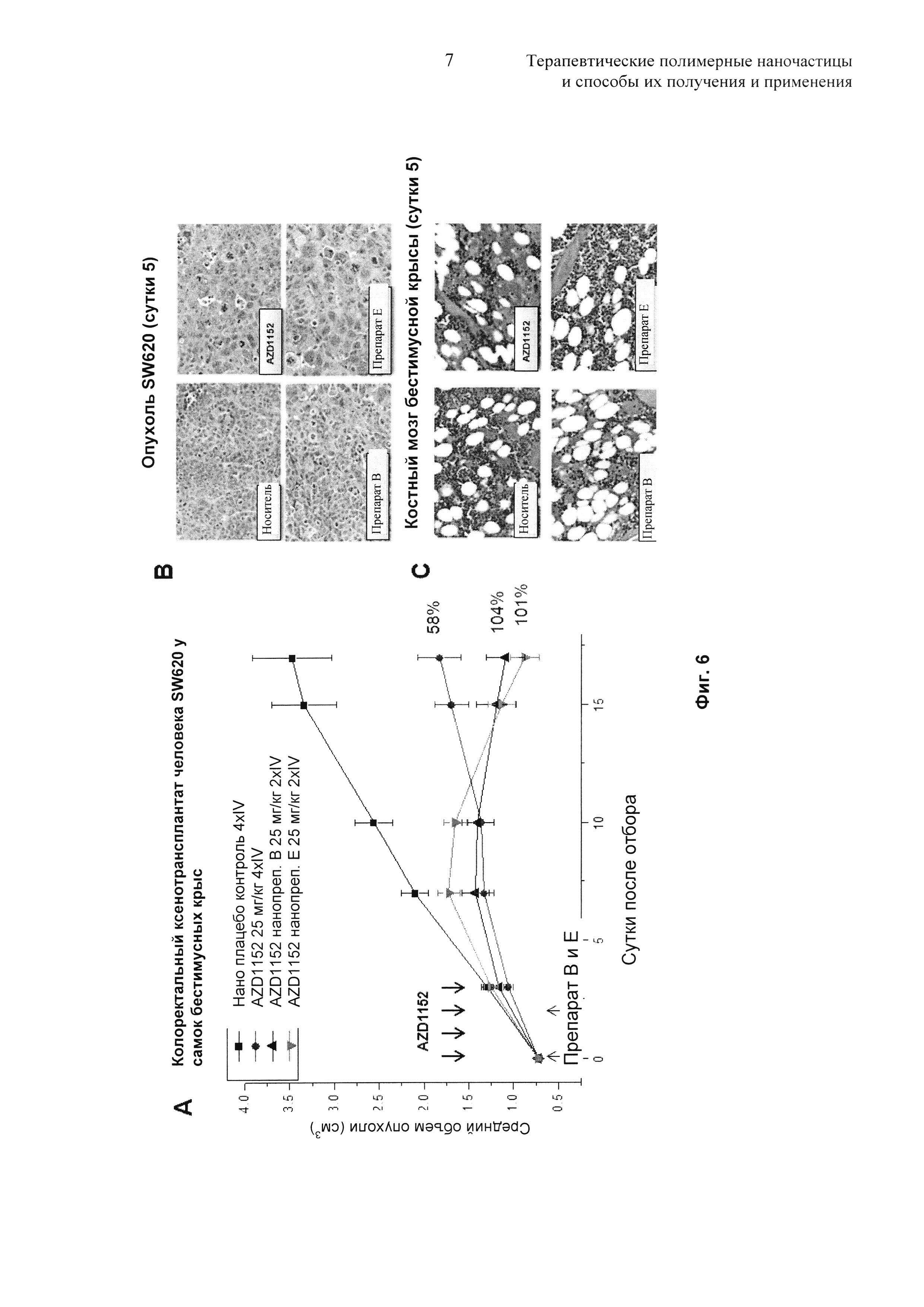
На Фиг. 6 представлены результаты, полученные на модели ксенотрансплантата колоректального рака человека SW620 у самок бестимусных крыс.
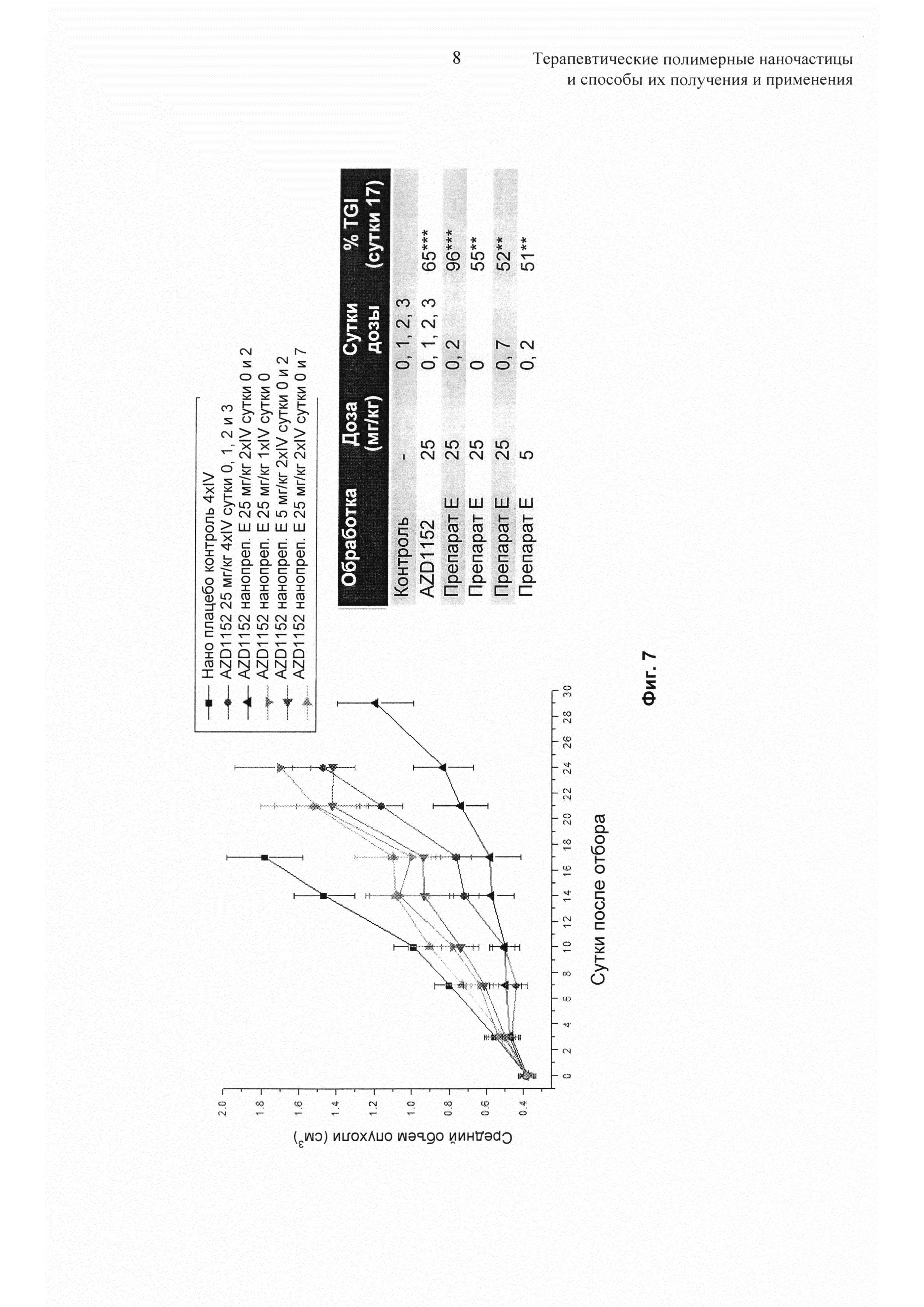
На Фиг. 7 представлены результаты исследования схемы дозирования препарата наночастиц с одним AZD1152.
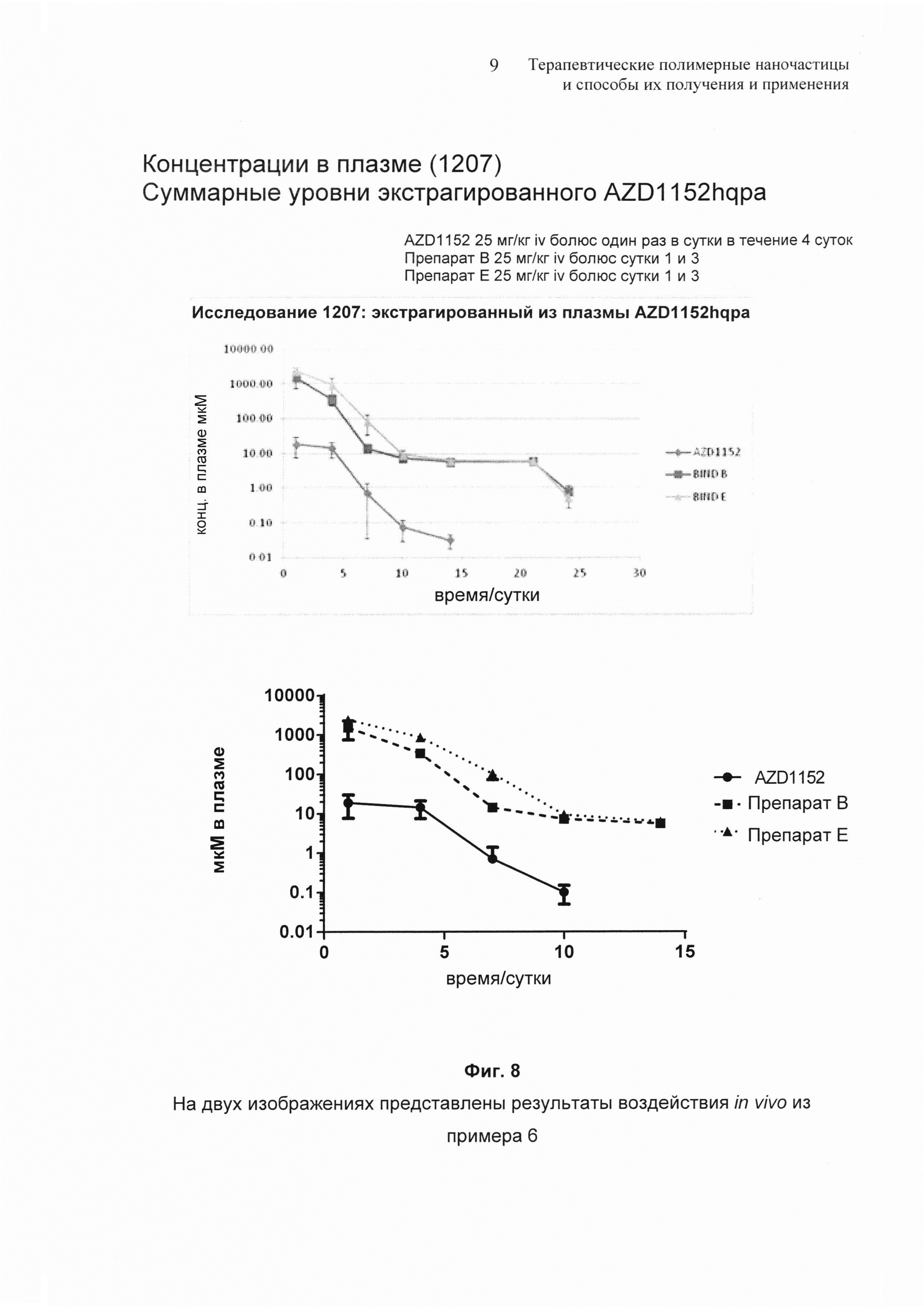
На Фиг. 8 представлено сравнение концентрации наночастиц AZD1152 hqpa в плазме по сравнению с AZD1152 IV в исследовании воздействия in vivo.
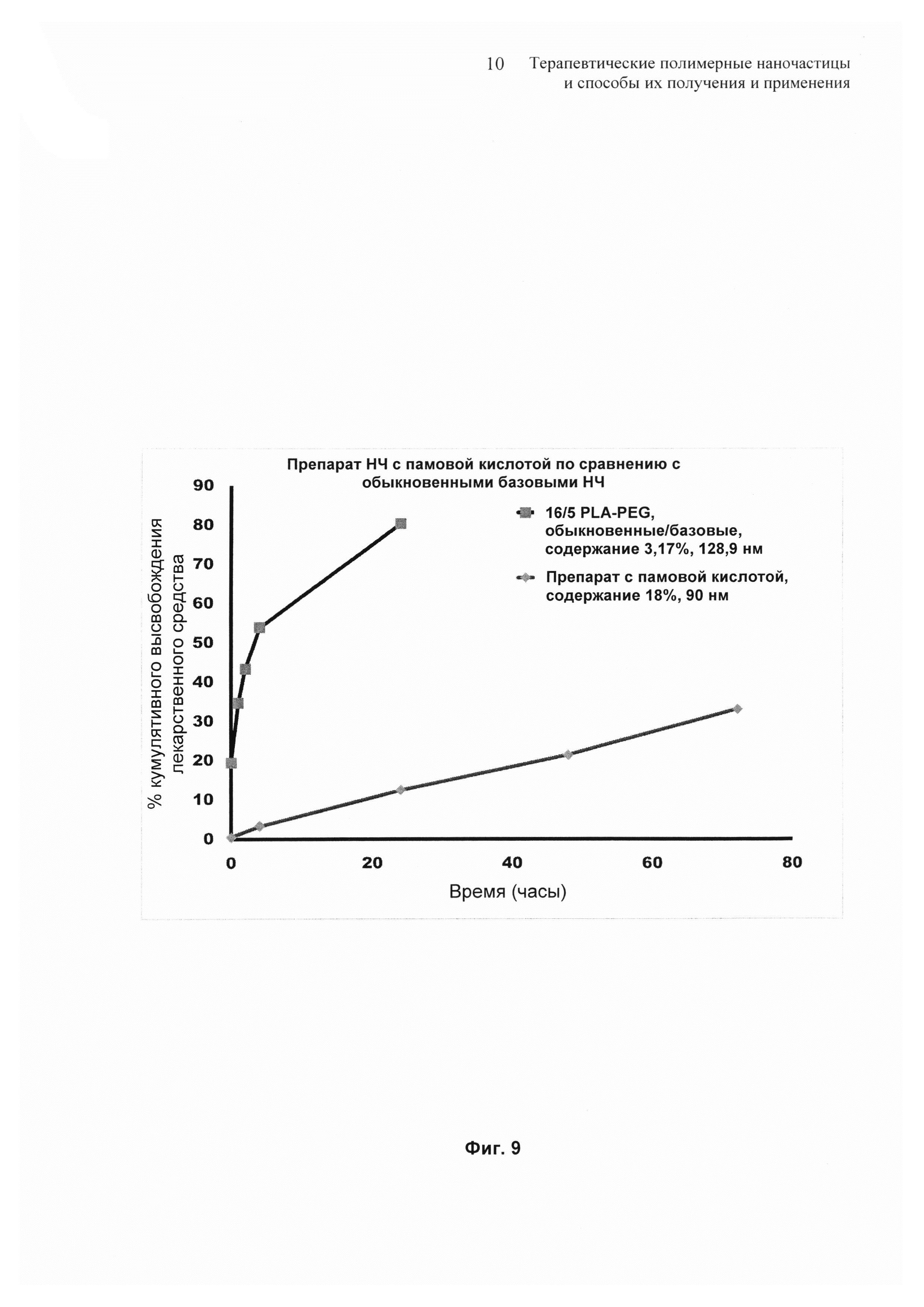
На Фиг. 9 представлены профили высвобождения in vitro для препарата памовокислотных наночастиц по сравнению с контрольным терапевтическим препаратом наночастиц.
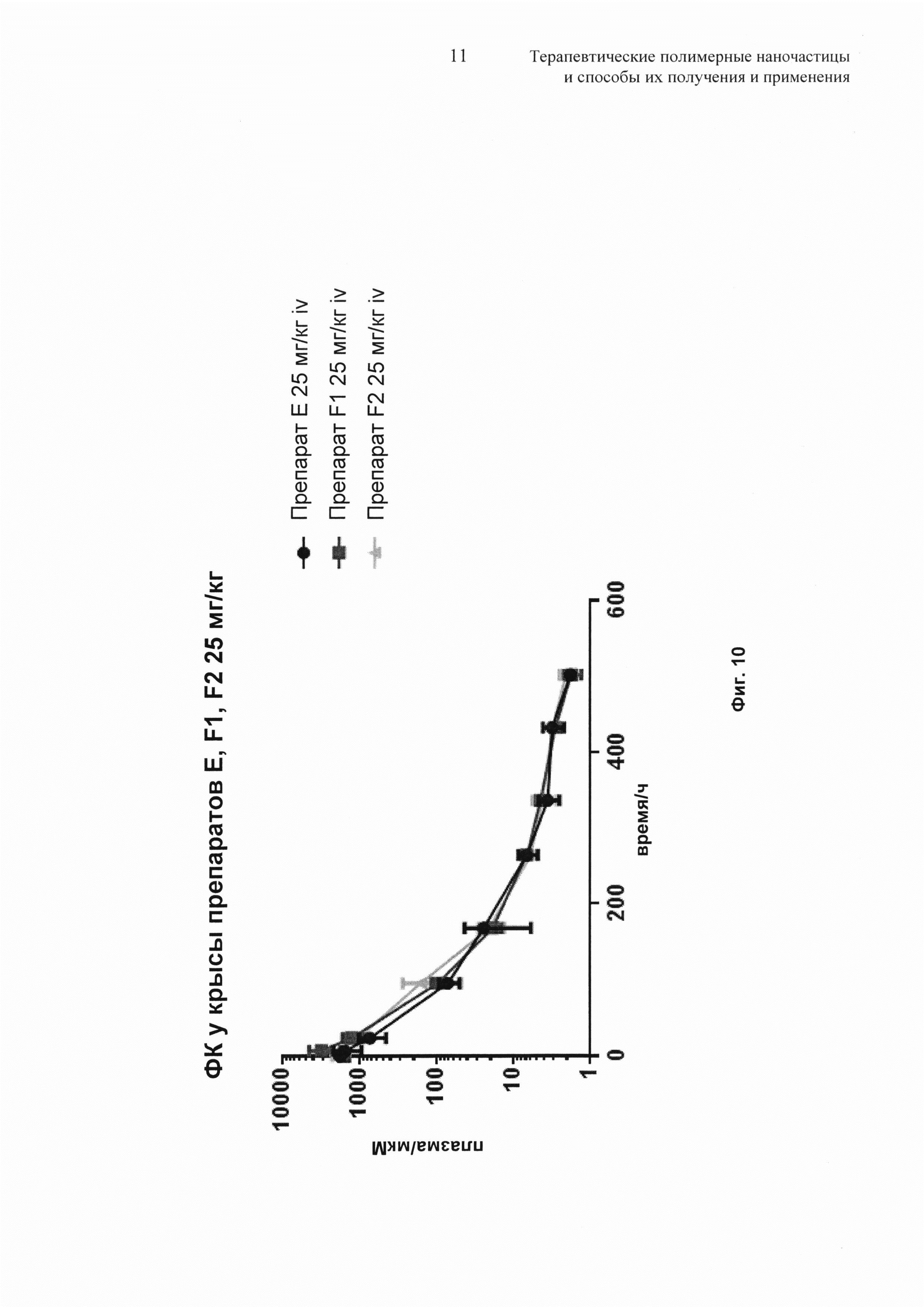
На Фиг. 10 представлены сравнительные фармакокинетические профили для трех препаратов наночастиц.
На Фиг. 11 представлено сравнение результатов исследования SW620.
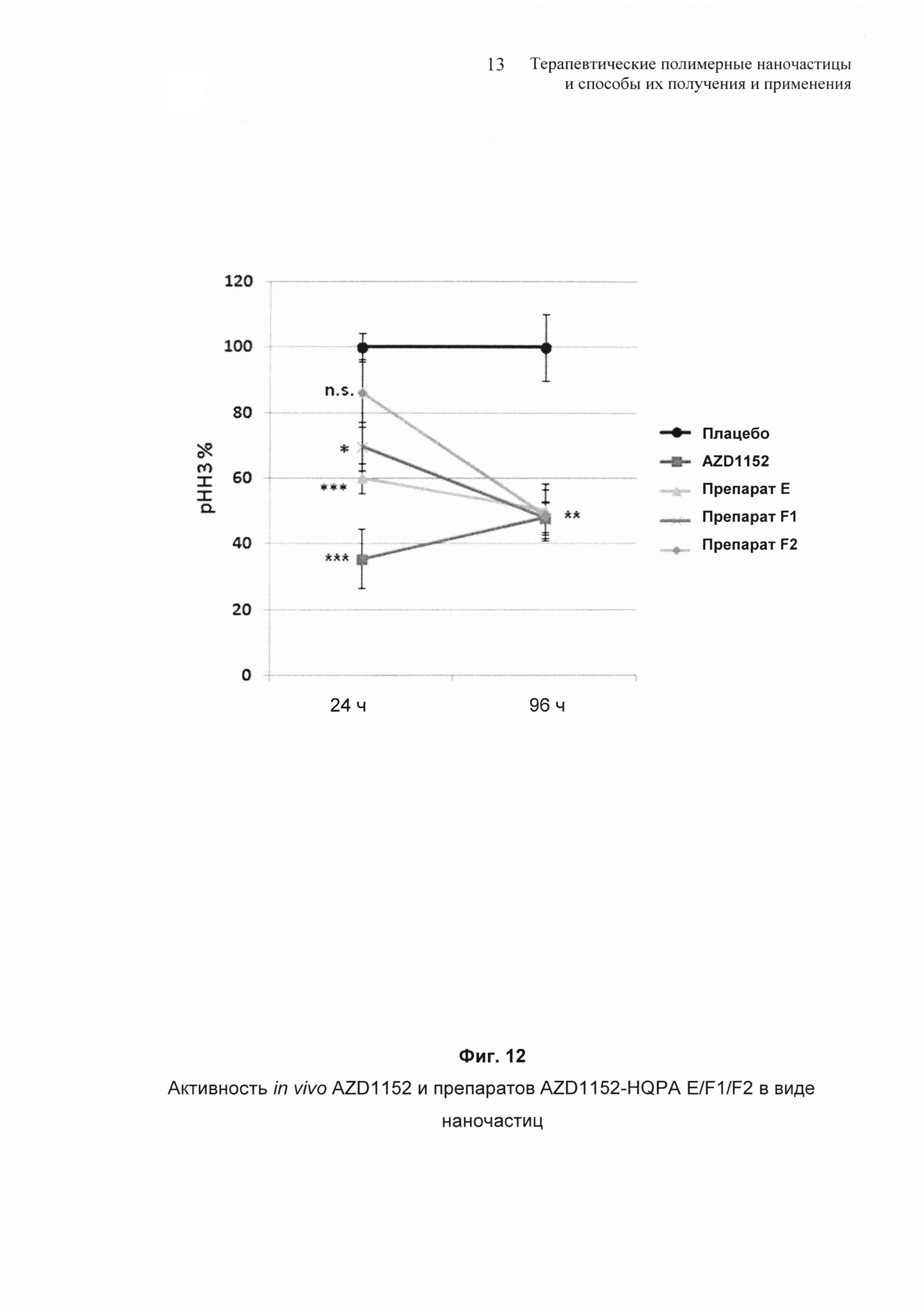
На Фиг. 12 представлено дополнительное сравнение результатов исследования SW620.
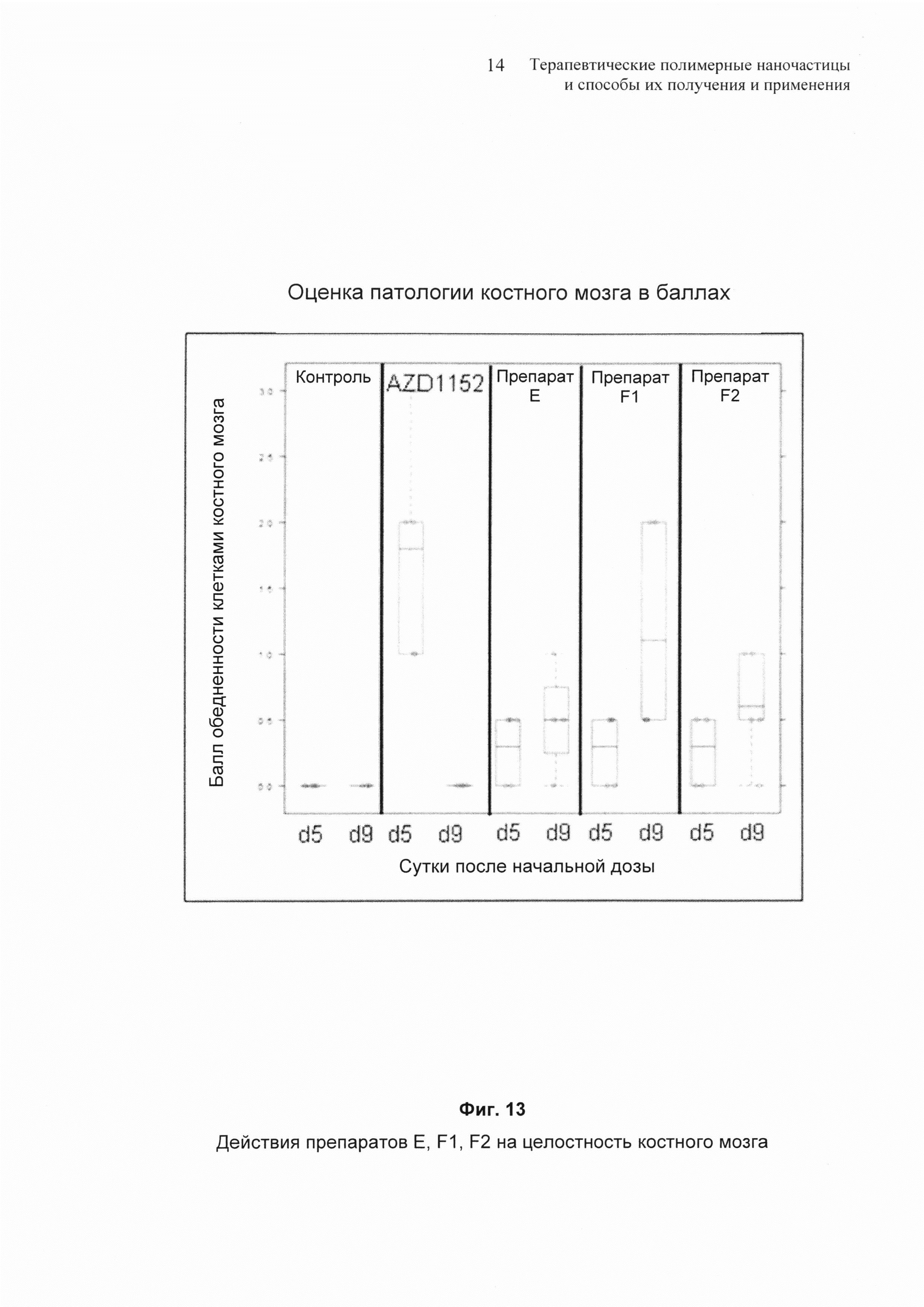
На Фиг. 13 представлены результаты действия некоторых препаратов наночастиц на костный мозг.
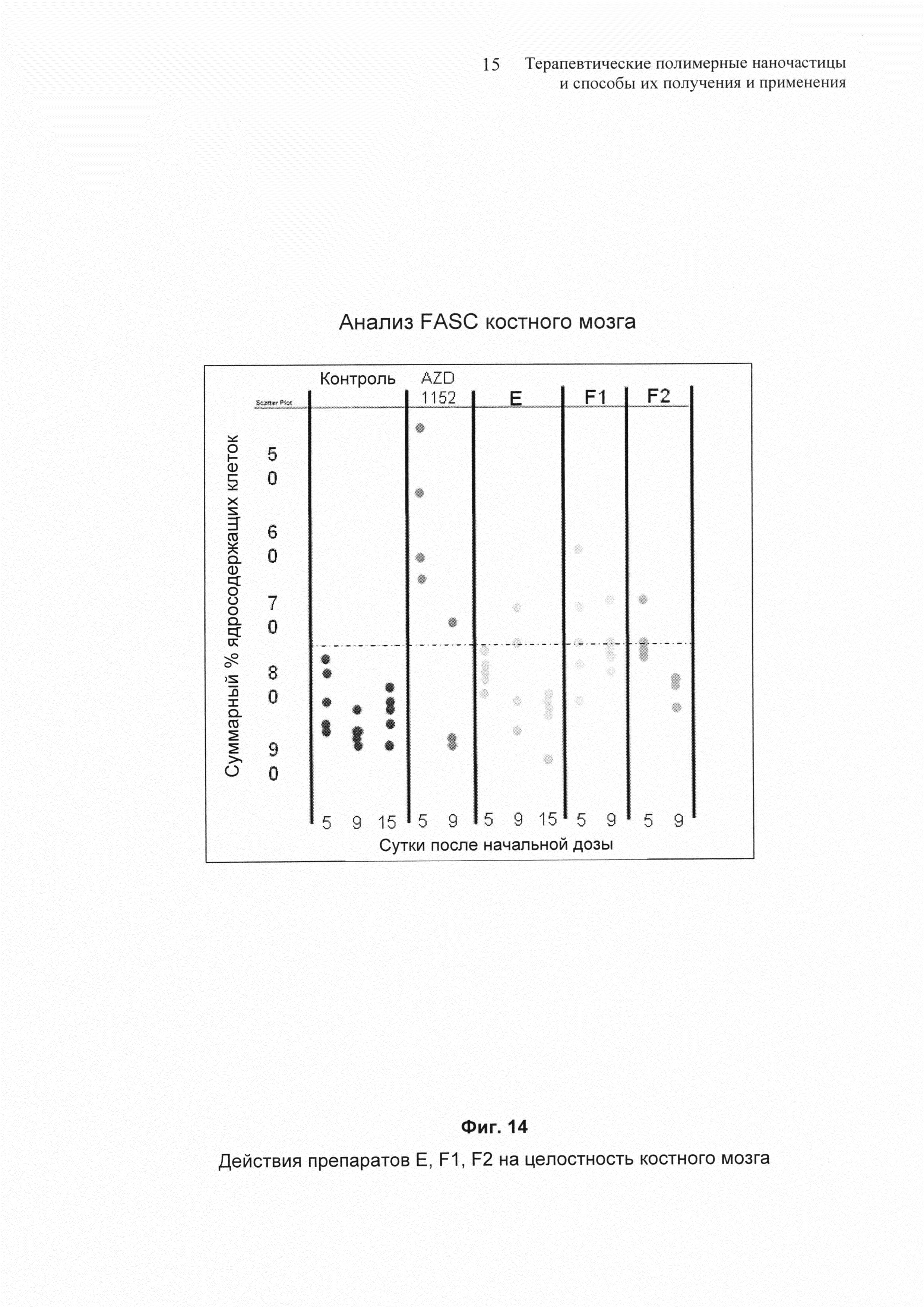
На Фиг. 14 представлены результаты действия некоторых препаратов наночастиц на костный мозг.
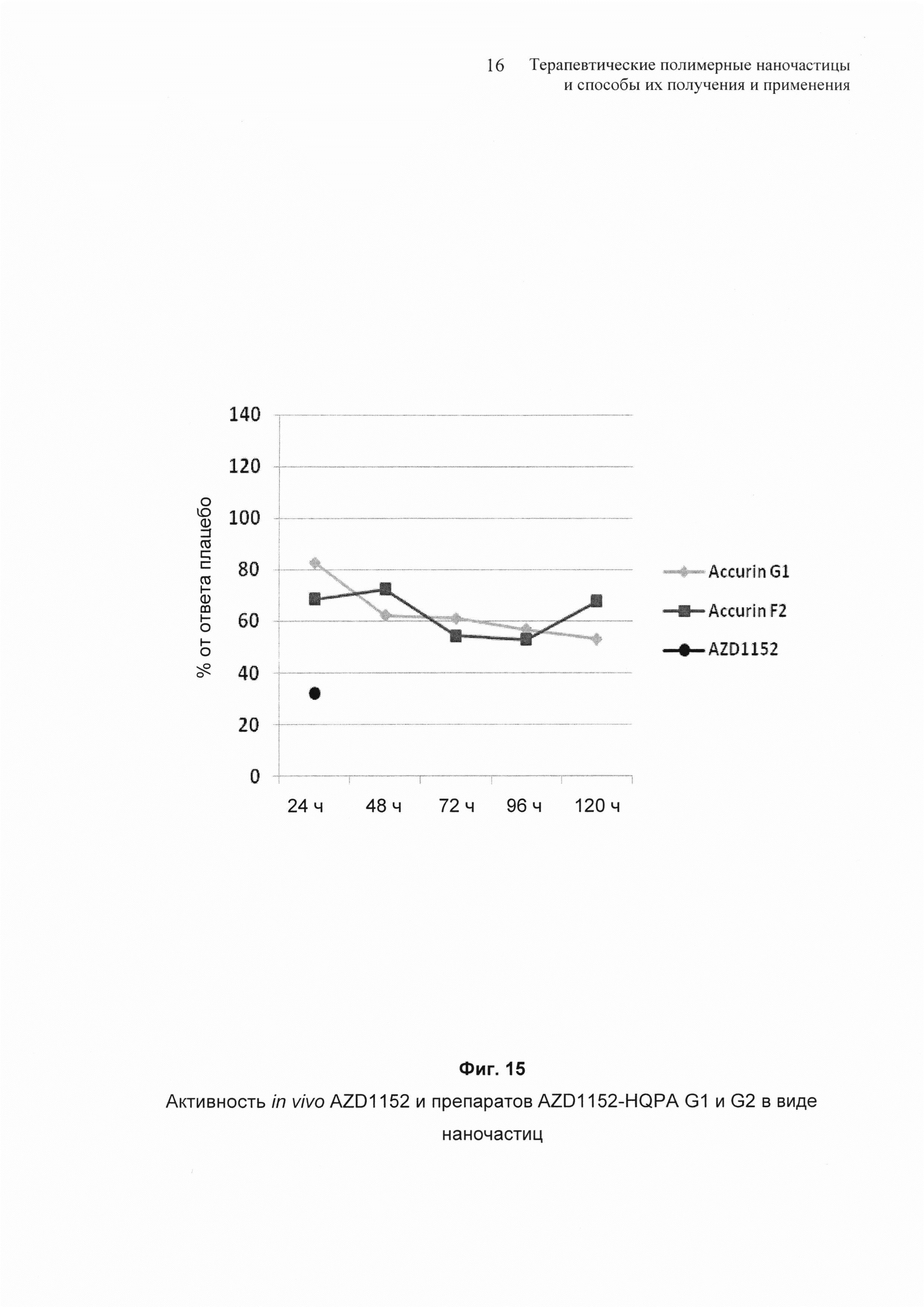
На Фиг. 15 представлена активность in vivo препаратов G1 и G2 наночастиц AZD1152 и AZD1152 hqpa.
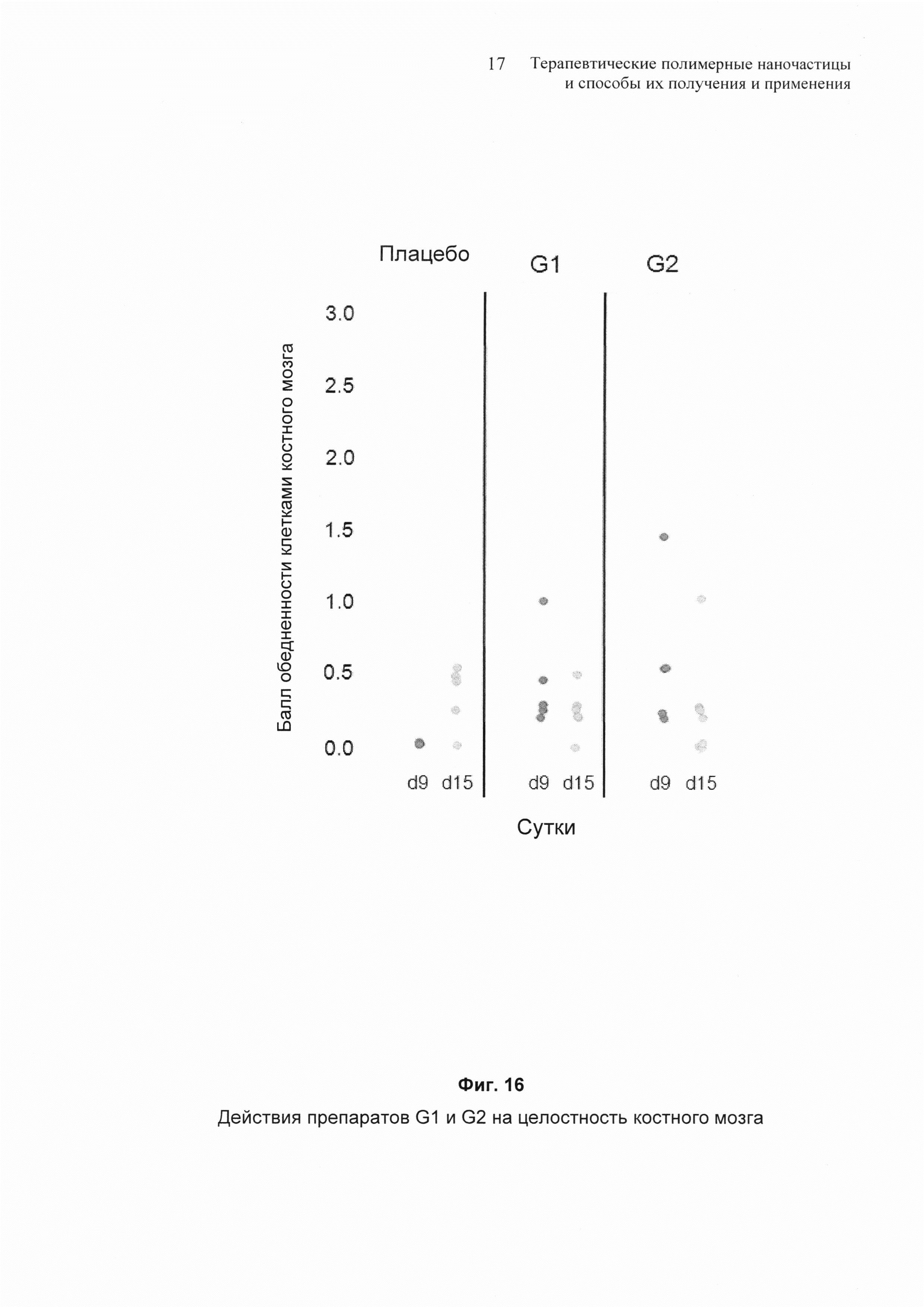
На Фиг. 16 представлены результаты влияния препаратов G1 и G2 на целостность костного мозга.
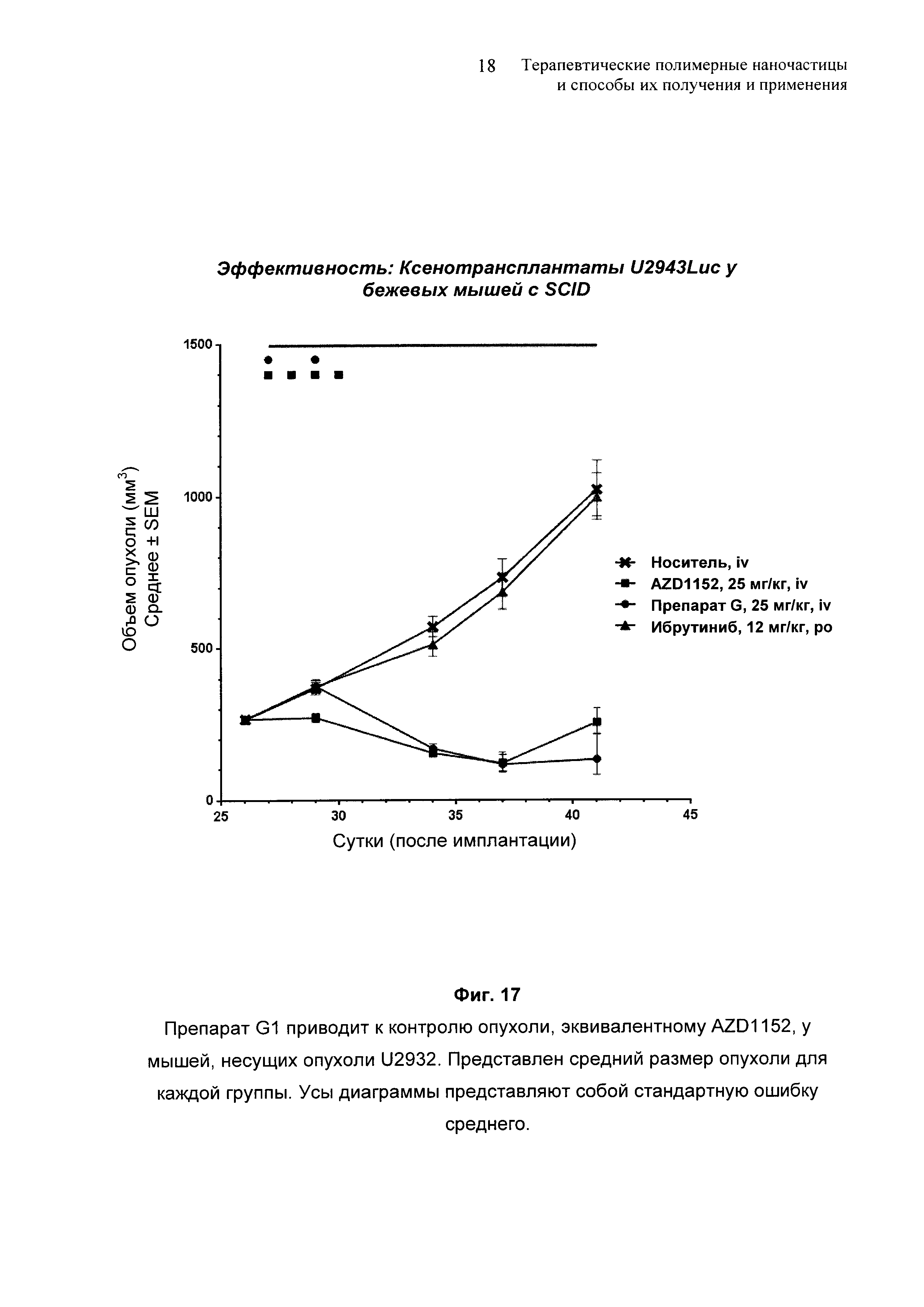
На Фиг. 17 представлено сравнение между контролем опухоли от препарата G1 и от AZD1152 у мышей, несущих опухоли U2932.
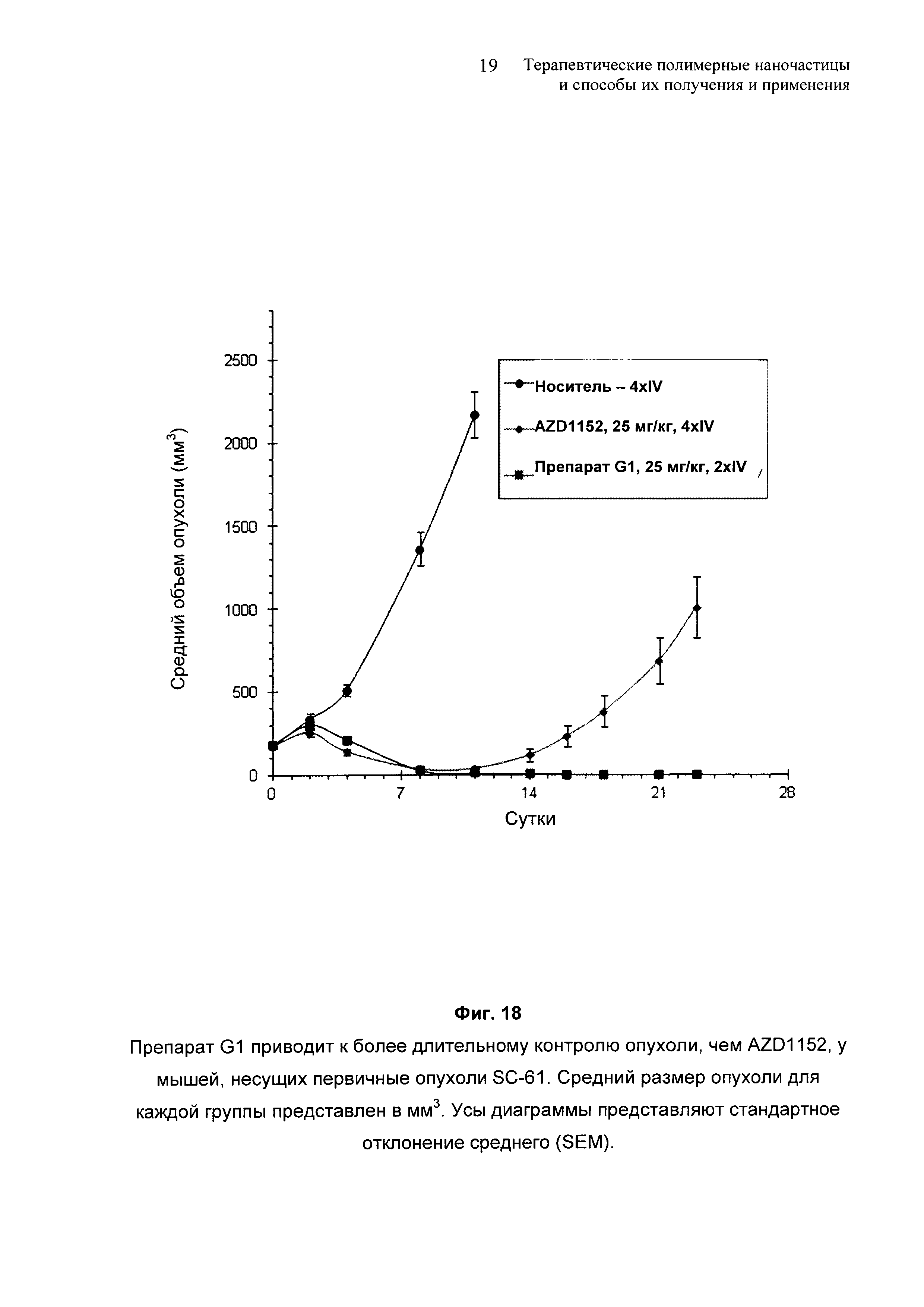
На Фиг. 18 представлено сравнение между контролем опухоли от препарата G1 и от AZD1152 у мышей, несущих первичные опухоли SC-61.
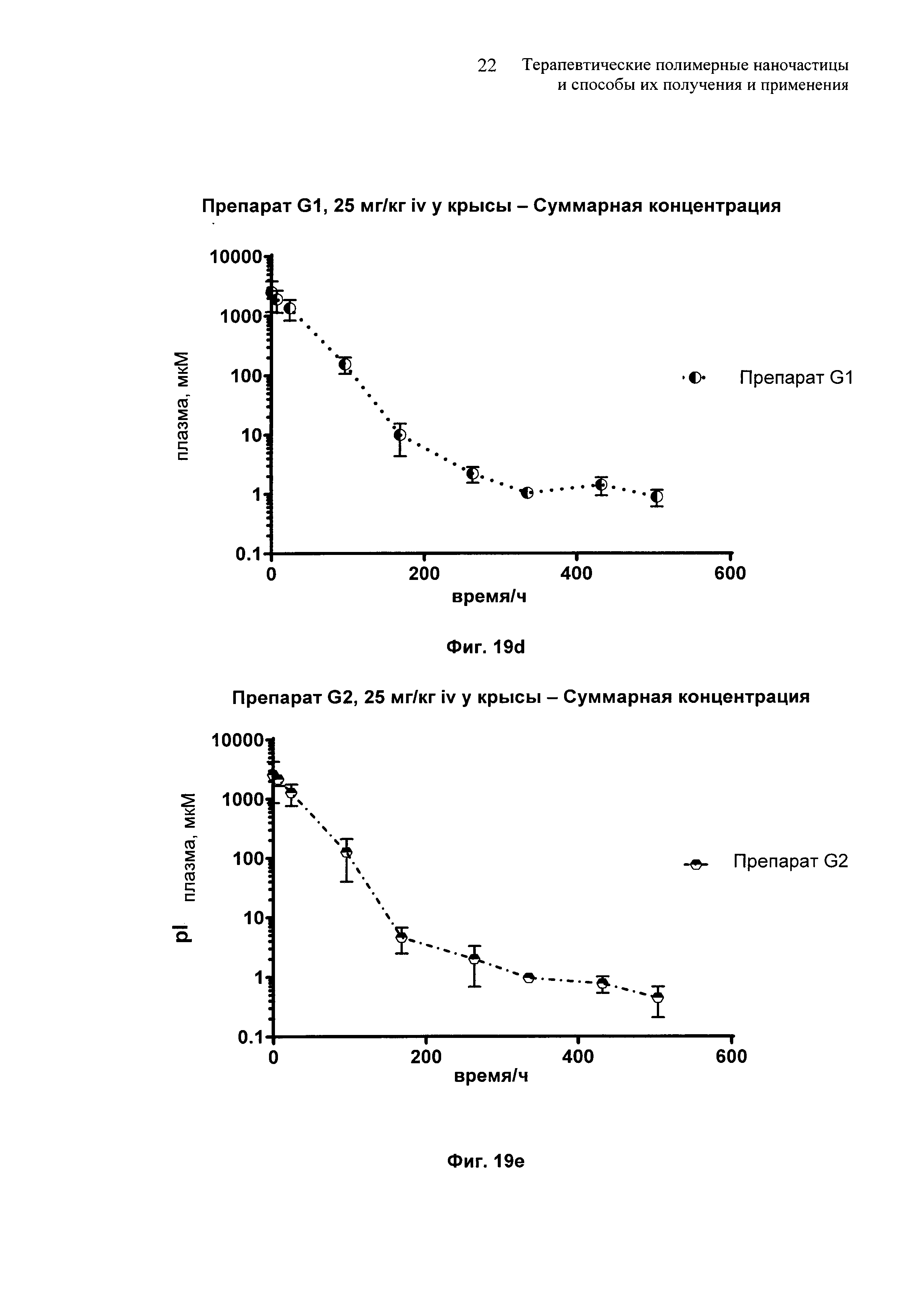
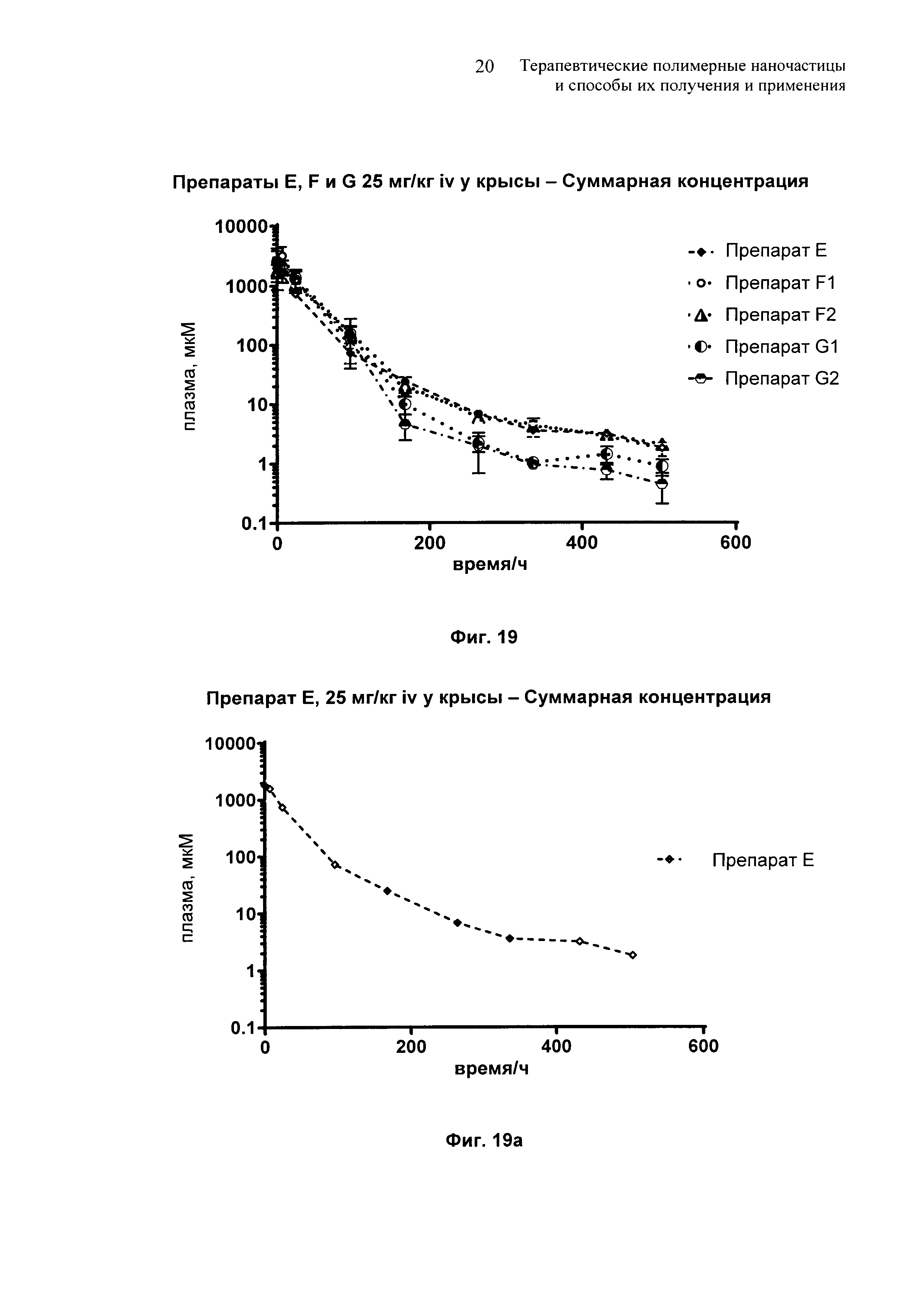
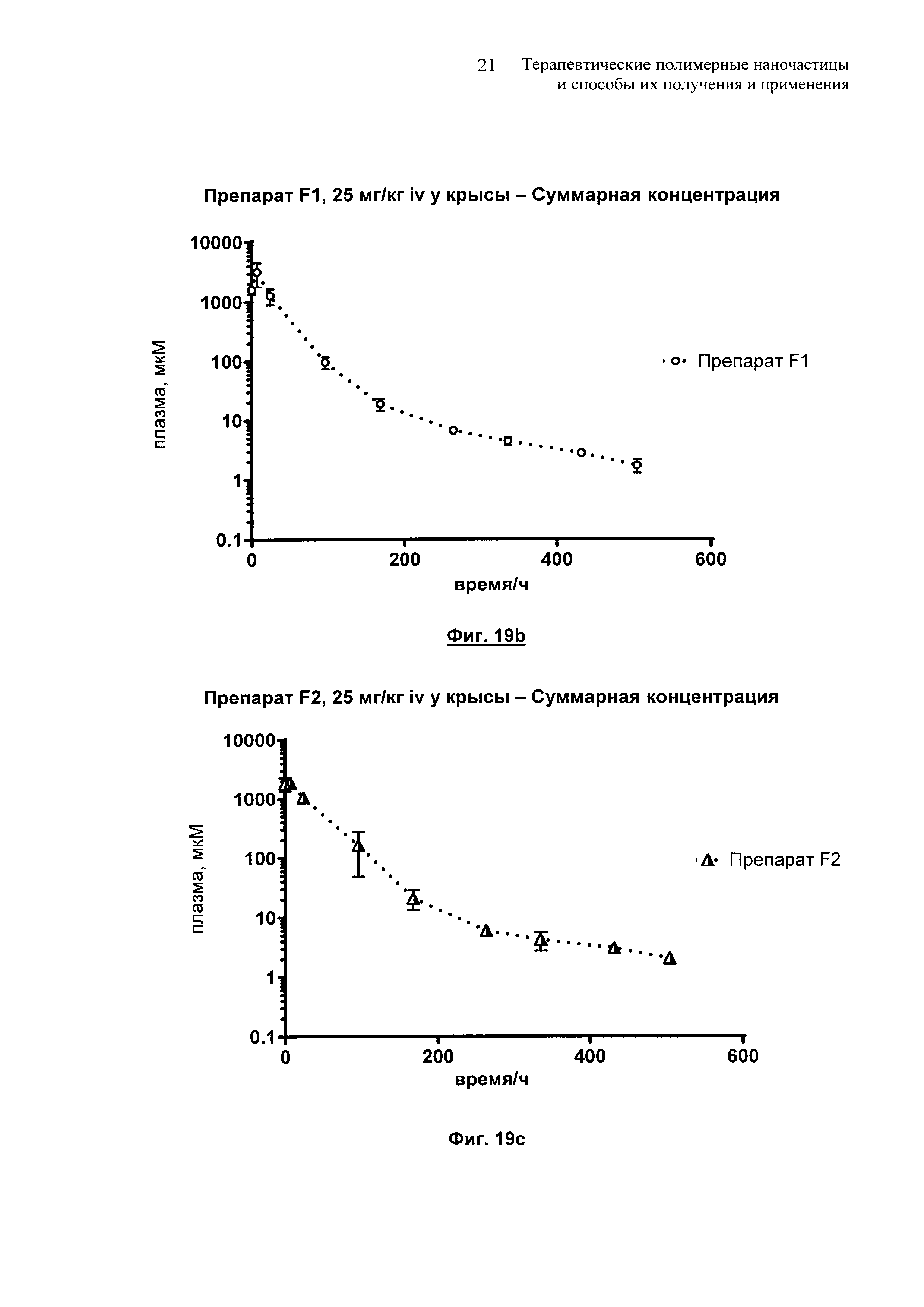
На Фиг. 19 и 19а-19е представлены сравнительные фармакокинетические профили для препаратов E-G.
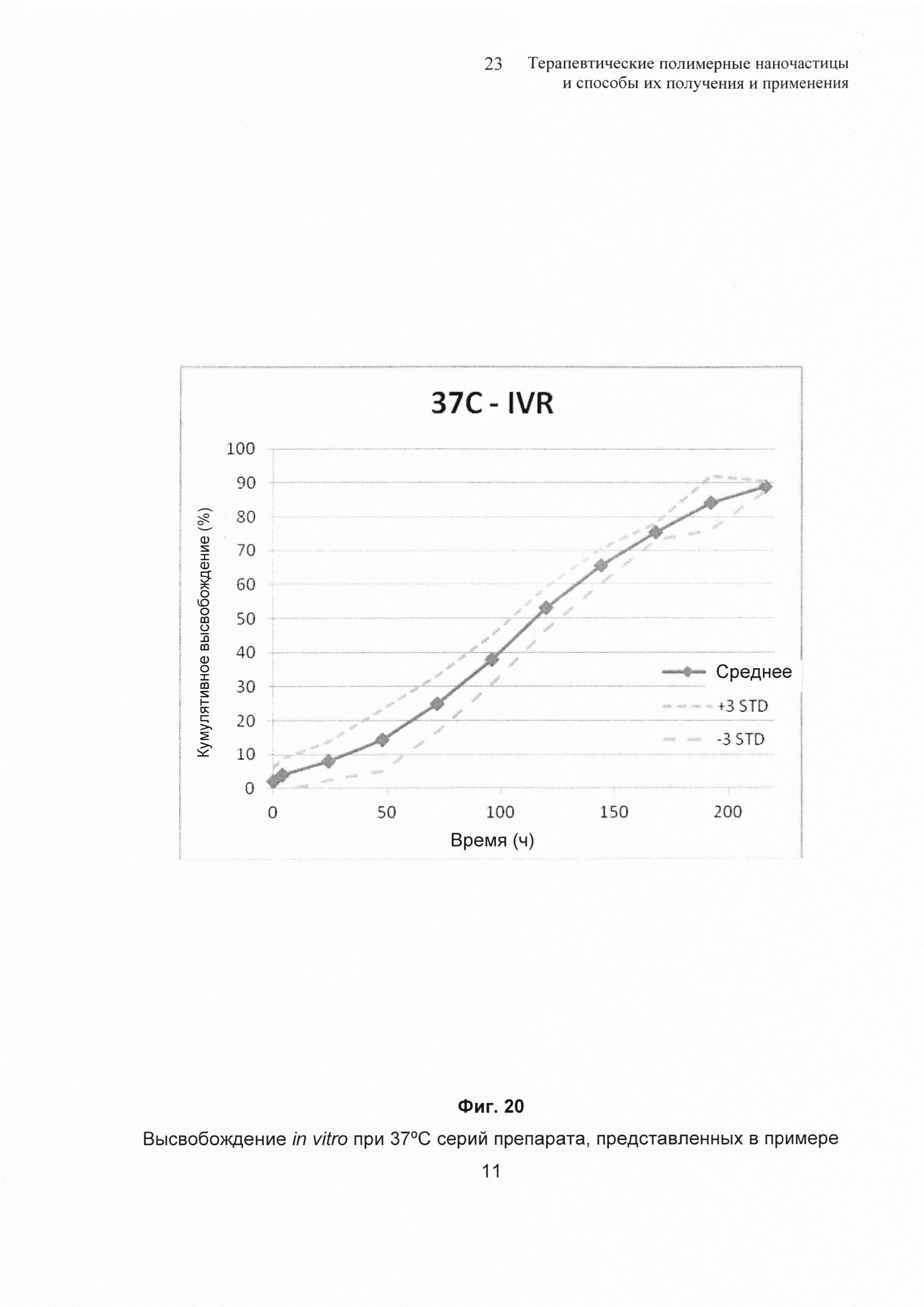
На Фиг. 20 изображено высвобождение in vitro при 37°С серий препарата G1, описанных в примере 11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе описаны полимерные наночастицы, включающие AZD1152 hqpa или его фармацевтически приемлемую соль в качестве терапевтического средства, и способы получения и применения таких терапевтических наночастиц. В некоторых воплощениях включение (введение добавки) по существу гидрофобной кислоты (такой как желчная кислота или другие подходящие кислоты, как описано в настоящем документе) в описанную наночастицу и/или включение, включенное в способ получения наночастиц, можно привести к наночастицам с улучшенным содержанием лекарственного вещества. Кроме того, в некоторых воплощениях наночастицы, включающие гидрофобную кислоту и/или полученные в ее присутствии, могут проявлять улучшенные свойства в отношении контролируемого высвобождения.
Например, описанные наночастицы могут медленнее высвобождать терапевтическое средство по сравнению с наночастицами, полученными в отсутствие гидрофобной кислоты.
Без связи с какой-либо теорией полагают, что описанные препараты наночастиц, включающих гидрофобную кислоту (такую как желчная кислота или другие подходящие кислоты, как описано в настоящем документе), обладают значительно улучшенными свойствами препарата (например, содержанием лекарственного средства и/или профилем высвобождения), которые могут иметь место вследствие образования гидрофобной ионной пары (HIP) между по существу гидрофобной кислотой и, например, аминной группой терапевтического средства. HIP при использовании в настоящем документе представляет собой пару противоположно заряженных ионов, удерживаемых вместе кулоновским притяжением. Также без связи с какой-либо теорией, в некоторых воплощениях HIP можно использовать для увеличения гидрофобности терапевтического средства. В некоторых воплощениях терапевтическое средство с увеличенной гидрофобностью может быть полезным для препаратов наночастиц и привести к образованию HIP, которая может обеспечить более высокую растворимость терапевтического средства в органических растворителях. Образование HIP, рассмотренное в настоящем документе, может привести к наночастицам, имеющим, например, повышенное содержание лекарственного вещества. Более медленное высвобождение терапевтического средства из наночастиц может также происходить, например в некоторых воплощениях, вследствие уменьшения растворимости терапевтического средства в водном растворе. Кроме того, образование комплекса терапевтического средства с гидрофобными противоионами большого размера может замедлить диффузию терапевтического средства внутри полимерной матрицы. Преимущественно образование HIP происходит без необходимости в ковалентном конъюгировании гидрофобной группы с терапевтическим средством.
Без связи с какой-либо теорией полагают, что сила HIP может влиять на содержание лекарственного вещества и скорость высвобождения рассматриваемых наночастиц. Например, силу HIP можно увеличить путем увеличения величины разности между pKa терапевтического средства и pKa гидрофобной кислоты, что более подробно обсуждается ниже. Также без связи с какой-либо теорией, полагают, что условия образования ионной пары могут влиять на содержание лекарственного вещества и скорость высвобождения рассматриваемых наночастиц.
Какой бы ни была точная природа взаимодействия (описанного выше) между AZD1152 hqpa и гидрофобными кислотами в описанных препаратах, предпочтительными являются такие препараты, которые содержат гидрофобную кислоту и которые имеют высокое содержание лекарственного вещества (например от приблизительно 15 до приблизительно 25 массовых процентов (мас. %) AZD1152 hqpa, например от приблизительно 15 до приблизительно 22 мас. % или от приблизительно 15 до приблизительно 20 мас. % AZD1152 hqpa) и подходящий профиль высвобождения, что более подробно обсуждается в настоящем документе ниже. Предпочтительно такие препараты также обладают сниженным влиянием на костный мозг по сравнению с другими препаратами, содержащими AZD1152.
Наночастицы, раскрытые в настоящем документе, включают в себя один, два, три или более биосовместимых и/или биоразлагаемых полимеров. Например, рассматриваемая наночастица может включать от приблизительно 35 до приблизительно 99,75 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 99,75 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 99,5 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 99 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 98 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 97 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 96 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 95 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 94 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 93 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 92 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 91 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 90 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 85 массовых процентов, в некоторых воплощениях от приблизительно 50 до приблизительно 80 массовых процентов и в некоторых воплощениях от приблизительно 65 до приблизительно 85 массовых процентов одного или более блок-сополимеров, которые включают биоразлагаемый полимер и поли(этиленгликоль) (PEG; ПЭГ), и от приблизительно 0 до приблизительно 50 массовых процентов биоразлагаемого гомополимера.
AZD1152 hqpa
Описанные наночастицы включают AZD1152 hqpa (pKa1 5,7; pKa2 8,46) или его фармацевтически приемлемую соль в качестве терапевтического средства. В настоящем документе ссылку на терапевтическое средство следует понимать как относящуюся к AZD1152 hqpa или его фармацевтически приемлемой соли, в частности к AZD1152 hqpa, если контекстом не продиктовано иное.
В первом аспекте изобретения предложена наночастица, содержащая AZD1152 hqpa. В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa и гидрофобную кислоту. В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая продукт, полученный путем взаимодействия AZD1152 hqpa и гидрофобной кислоты. В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая продукт, полученный путем смешивания AZD1152 hqpa и гидрофобной кислоты. В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая гидрофобную ионную пару между AZD1152 hqpa и гидрофобной кислотой.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая AZD1152 hqpa в наночастице. В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa и гидрофобную кислоту. В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтическую наночастицу, которая содержит продукт, полученный путем взаимодействия AZD1152 hqpa и гидрофобной кислоты. В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтическую наночастицу, которая содержит продукт, полученный путем смешивания AZD1152 hqpa и гидрофобной кислоты. В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтическую наночастицу, которая содержит гидрофобную ионную пару между AZD1152 hqpa и гидрофобной кислотой.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц, содержащих AZD1152 hqpa в качестве активного ингредиента. Такие наночастицы подходящим образом также содержат гидрофобную кислоту, такую как памовая кислота, смешанную с AZD1152 hqpa в наночастицах, и дополнительно содержат подходящий полимер, такой как сополимер 16/5 PLA-PEG.
Подходящая фармацевтически приемлемая соль AZD1152 hqpa может представлять собой, например, соль присоединения кислоты к AZD1152 hqpa, например, соль присоединения сильной неорганической или органической кислоты, такой как соляная, бромистоводородная, серная или трифторуксусная кислота. Другие подходящие фармацевтически приемлемые соли включают фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат и п-толуолсульфонат. Дополнительные подходящие фармацевтически приемлемые соли включают соли AZD1152 hqpa с такими кислотами, как гидрофобные кислоты, определенные в настоящем документе. Понятно, что используемый в производственном процессе противоион для подходящей соли AZD1152 hqpa должен быть выбран таким образом, чтобы он не препятствовал процессу образования наночастиц, как они описаны в настоящем документе. Для удобства можно использовать противоионы, которые легко вымываются из растворов, или которые соответствуют противоионам, уже присутствующим в процессе.
В некоторых воплощениях описанные наночастицы могут включать от приблизительно 0,2 до приблизительно 35 массовых процентов, от приблизительно 0,2 до приблизительно 20 массовых процентов, от приблизительно 0,2 до приблизительно 10 массовых процентов, от приблизительно 0,2 до приблизительно 5 массовых процентов, от приблизительно 0,5 до приблизительно 5 массовых процентов, от приблизительно 0,75 до приблизительно 5 массовых процентов, от приблизительно 1 до приблизительно 5 массовых процентов, от приблизительно 2 до приблизительно 5 массовых процентов, от приблизительно 3 до приблизительно 5 массовых процентов, от приблизительно 1 до приблизительно 20 массовых процентов, от приблизительно 2 до приблизительно 20 массовых процентов, от приблизительно 5 до приблизительно 20 массовых процентов, от приблизительно 1 до приблизительно 15 массовых процентов, от приблизительно 2 до приблизительно 15 массовых процентов, от приблизительно 3 до приблизительно 15 массовых процентов, от приблизительно 4 до приблизительно 15 массовых процентов, от приблизительно 5 до приблизительно 15 массовых процентов, от приблизительно 1 до приблизительно 10 массовых процентов, от приблизительно 2 до приблизительно 10 массовых процентов, от приблизительно 3 до приблизительно 10 массовых процентов, от приблизительно 4 до приблизительно 10 массовых процентов, от приблизительно 5 до приблизительно 10 массовых процентов, от приблизительно 10 до приблизительно 30 массовых процентов, от приблизительно 15 до приблизительно 25 или от приблизительно 15 до приблизительно 20 массовых процентов терапевтического средства.
В конкретных аспектах описанные наночастицы могут включать от приблизительно 5 до приблизительно 20, предпочтительно от приблизительно 10 до приблизительно 20, еще более предпочтительно от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa.
Гидрофобная кислота
В некоторых воплощениях описанные наночастицы содержат гидрофобную кислоту (например, желчную кислоту) и/или получены способом, включающим гидрофобную кислоту. Такие наночастицы могут иметь более высокое содержание лекарственного вещества, чем наночастицы, полученные способом, не включающим гидрофобную кислоту. Например, содержание лекарственного вещества (например, по массе) у описанных наночастиц, полученных способом, включающим гидрофобную кислоту, может быть от приблизительно в 2 раза до приблизительно в 10 раз выше или даже более, чем у описанных наночастиц, полученных способом, не включающим гидрофобную кислоту. В некоторых воплощениях содержание лекарственного вещества (по массе) у описанных наночастиц, полученных первым способом, включающим гидрофобную кислоту, может быть по меньшей мере приблизительно в 2 раза выше, по меньшей мере приблизительно в 3 раза выше, по меньшей мере приблизительно в 4 раза выше, по меньшей мере приблизительно в 5 раз выше или по меньшей мере приблизительно в 10 раз выше, чем у описанных наночастиц, полученных вторым способом, который идентичен первому способу за исключением того, что второй способ не включает гидрофобную кислоту.
Рассматривают любую подходящую гидрофобную кислоту. В некоторых воплощениях гидрофобная кислота может представлять собой карбоновую кислоту (например, монокарбоновую кислоту, дикарбоновую кислоту, трикарбоновую кислоту или тому подобную), сульфиновую кислоту, сульфеновую кислоту или сульфоновую кислоту. В некоторых случаях рассматриваемая гидрофобная кислота может включать смесь двух или более кислот. В некоторых случаях в препарате можно использовать соль гидрофобной кислоты. Понятно, что в настоящем документе ссылка на "гидрофобную кислоту" в равной степени применима к смеси рассматриваемых гидрофобных кислот, если контекст не требует иного.
Например, описанная карбоновая кислота может представлять собой алифатическую карбоновую кислоту (например, карбоновую кислоту, имеющую циклическую или ациклическую, разветвленную или неразветвленную углеводородную цепь). В некоторых воплощениях описанные карбоновые кислоты могут быть замещены одной или более функциональными группами, включающими, без ограничений, галоген (F, Cl, Br и I), сульфонил, нитро и оксо. В некоторых воплощениях описанная карбоновая кислота может быть незамещенной.
Иллюстративные карбоновые кислоты могут включать замещенную или незамещенную жирную кислоту (например, С6-С50 жирную кислоту). В некоторых случаях жирная кислота может представлять собой С10-С20 жирную кислоту. В других случаях жирная кислота может представлять собой С15-С20 жирную кислоту. Жирная кислота может в некоторых случаях быть насыщенной. В других воплощениях жирная кислота может быть ненасыщенной. Например, жирная кислота может представлять собой мононенасыщенную жирную кислоту или полиненасыщенную жирную кислоту. В некоторых воплощениях двойная связь ненасыщенной группы жирной кислоты может находиться в цис-конформации. В некоторых воплощениях двойная связь ненасыщенной жирной кислоты может находиться в транс-конформации. Ненасыщенные жирные кислоты включают, без ограничений, омега-3, омега-6 и омега-9 жирные кислоты.
Неограничивающие примеры насыщенных жирных кислот включают капроновую кислоту, энантовую кислоту, каприловую кислоту, пеларгоновую кислоту, каприновую кислоту, ундекановую кислоту, лауриновую кислоту, тридекановую кислоту, миристиновую кислоту, пентадекановую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, нонадекановую кислоту, арахидиновую кислоту, генэйкозановую кислоту, бегеновую кислоту, трикозановую кислоту, лигноцериновую кислоту, пентакозановую кислоту, церотиновую кислоту, гептакозановую кислоту, монтановую кислоту, нонакозановую кислоту, мелиссиновую кислоту, гентриаконтановую кислоту, лацериновую кислоту, псилловую кислоту, геддовую кислоту, церопластиновую кислоту, гексатриаконтановую кислоту и их комбинации.
Неограничивающие примеры ненасыщенных жирных кислот включают гексадекатриеновую кислоту, альфа-линоленовую кислоту, стеаридоновую кислоту, эйкозатриеновую кислоту, эйкозатетраеновую кислоту, эйкозапентаеновую кислоту, генэйкозапентаеновую кислоту, докозапентаеновую кислоту, докозагексаеновую кислоту, тетракозапентаеновую кислоту, тетракозагексаеновую кислоту, линолевую кислоту, гамма-линоленовую кислоту, эйкозадиеновую кислоту, дигомо-гамма-линоленовую кислоту, арахидоновую кислоту, докозадиеновую кислоту, адреновую кислоту, докозапентаеновую кислоту, тетракозатетраеновую кислоту, тетракозапентаеновую кислоту, олеиновую кислоту (pKa ~4-5; logP 6,78), эйкозеновую кислоту, мидовую кислоту, эруковую кислоту, нервоновую кислоту, румениковую кислоту, α-календовую кислоту, β-календовую кислоту, якаровую кислоту, α-элеостеариновую кислоту, β-элеостеариновую кислоту, катальповую кислоту, пунициновую кислоту, румеленовую кислоту, α-паринаровую кислоту, β-паринаровую кислоту, боссеопентаеновую кислоту, пиноленовую кислоту, подокарпиновую кислоту, пальмитолеиновую кислоту, вакценовую кислоту, гадолеиновую кислоту, эруковую кислоту и их комбинации.
Другие неограничивающие примеры гидрофобных кислот включают ароматические кислоты, такие как 1-гидрокси-2-нафтойная кислота (также известная как ксинафоевая кислота) (pKa ~2-3; log Р 2,97), нафталин-1,5-дисульфоновая кислота (pKa=-2; logP 1,3), нафталин-2-сульфоновая кислота (pKa=-1,8; logP 2,1), памовая кислота (pKa 2,4), коричная кислота, фенилуксусная кислота, (±)-камфор-10-сульфоновая кислота, додецилбензолсульфоновая кислота (pKa=-1,8; logP 6,6), и их комбинации. Другие неограничивающие примеры гидрофобных кислот включают додецилсерную кислоту (pKa=-0,09; logP 4,5), диоктилсульфоянтарную кислоту (pKa=-0,8; logP 5,2), диолеоилфосфатидиновую кислоту (pKa ~2) и витамин D3-сульфат (pKa=-1,5).
В некоторых воплощениях гидрофобная кислота может представлять собой желчную кислоту. Неограничивающие примеры желчных кислот включают хенодезоксихолевую кислоту, урсодезоксихолевую кислоту, дезоксихолевую кислоту (pKa 4,65; logP 3,79), гихолевую кислоту, бета-мурихолевую кислоту, холевую кислоту (pKa ~4,5; logP 2,48), таурохолевую кислоту, холестерилсульфат (pKa=-1,4), литохолевую кислоту, конъюгированную с аминокислотой желчную кислоту и их комбинации. В некоторых воплощениях можно использовать смесь холевой кислоты и дезоксихолевой кислоты. Конъюгированная с аминокислотой желчная кислота может быть конъюгирована с любой подходящей аминокислотой. В некоторых воплощениях конъюгированная с аминокислотой желчная кислота представляет собой глицин-конъюгированную желчную кислоту или таурин-конъюгированную желчную кислоту.
В определенных случаях гидрофобная кислота может представлять собой полиэлектролит. Например, полиэлектролит может представлять собой полисульфоновую кислоту (например, поли(стиролсульфоновую кислоту) или декстрансульфат) или поликарбоновую кислоту (например, полиполиакриловую кислоту или полиметакриловую кислоту).
В одном аспекте гидрофобная кислота выбрана из холевой кислоты, дезоксихолевой кислоты (включая смесь холевой кислоты и дезоксихолевой кислоты), диоктилсульфоянтарной кислоты и памовой кислоты.
В другом аспекте гидрофобная кислота представляет собой памовую кислоту.
В некоторых случаях рассматриваемая кислота может иметь молекулярную массу менее чем приблизительно 1000 Да, в некоторых воплощениях менее чем приблизительно 500 Да, в некоторых воплощениях менее чем приблизительно 400 Да, в некоторых воплощениях менее чем приблизительно 300 Да, в некоторых воплощениях менее чем приблизительно 250 Да, в некоторых воплощениях изобретения менее чем приблизительно 200 Да и в некоторых воплощениях изобретения менее чем приблизительно 150 Да. В некоторых случаях кислота может иметь молекулярную массу от приблизительно 100 Да до приблизительно 1000 Да, в некоторых воплощениях от приблизительно 200 Да до приблизительно 800 Да, в некоторых воплощениях от приблизительно 200 Да до приблизительно 600 Да, в некоторых воплощениях от приблизительно 100 Да до приблизительно 300 Да, в некоторых воплощениях от приблизительно 200 Да до приблизительно 400 Да, в некоторых воплощениях от приблизительно 300 Да до приблизительно 500 Да и в некоторых воплощениях от приблизительно 300 Да до приблизительно 1000 Да. В некоторых воплощениях рассматриваемая кислота может иметь молекулярную массу более чем приблизительно 300 Да, в некоторых воплощениях более чем 400 Да и в некоторых воплощениях более чем 500 Да. В некоторых воплощениях скорость высвобождения терапевтического средства из наночастицы может быть замедлена за счет увеличения молекулярной массы гидрофобной кислоты, используемой в препарате наночастиц.
В некоторых воплощениях гидрофобную кислоту можно выбирать, по меньшей мере отчасти, на основании силы кислоты. Например, гидрофобная кислота может иметь определенную при 25°С константу кислотной диссоциации в воде (pKa) от приблизительно -5 до приблизительно 7, в некоторых воплощениях от приблизительно -3 до приблизительно 5, в некоторых воплощениях от приблизительно -3 до приблизительно 4, в некоторых воплощениях от приблизительно -3 до приблизительно 3,5, в некоторых воплощениях от приблизительно -3 до приблизительно 3, в некоторых воплощениях от приблизительно -3 до приблизительно 2, в некоторых воплощениях от приблизительно -3 до приблизительно 1, в некоторых воплощениях от приблизительно -3 до приблизительно 0,5, в некоторых воплощениях от приблизительно -0,5 до приблизительно 0,5, в некоторых воплощениях от приблизительно 1 до приблизительно 7, в некоторых воплощениях от приблизительно 2 до приблизительно 7, в некоторых воплощениях от приблизительно 3 до приблизительно 7, в некоторых воплощениях от приблизительно 4 до приблизительно 6, в некоторых воплощениях от приблизительно 4 до приблизительно 5,5, в некоторых воплощениях от приблизительно 4 до приблизительно 5 и в некоторых воплощениях от приблизительно 4,5 до приблизительно 5. В некоторых воплощениях кислота может иметь определенную при 25°С pKa менее чем приблизительно 7, менее чем приблизительно 5, менее чем приблизительно 3,5, менее чем приблизительно 3, менее чем приблизительно 2, менее чем приблизительно 1 или менее чем приблизительно 0.
В некоторых воплощениях гидрофобную кислоту можно выбирать, по меньшей мере отчасти, на основании разности между pKa гидрофобной кислоты и pKa терапевтического средства. Например, в некоторых случаях разность между pKa гидрофобной кислоты и pKa терапевтического средства, определенных при 25°С, может составлять от приблизительно 1 единицы pKa до приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 1 единицы pKa до приблизительно 10 единиц pKa, в некоторых воплощениях от приблизительно 1 единицы pKa до приблизительно 5 единиц pKa, в некоторых воплощениях от приблизительно 1 единицы pKa до приблизительно 3 единиц pKa, в некоторых воплощениях от приблизительно единицы 1 pKa до приблизительно 2 единиц pKa, в некоторых воплощениях от приблизительно 2 единиц pKa до приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 2 единиц pKa до приблизительно 10 единиц pKa, в некоторых воплощениях от приблизительно 2 единиц pKa до приблизительно 5 единиц pKa, в некоторых воплощениях от приблизительно 2 единиц pKa до приблизительно 3 единиц pKa, в некоторых воплощениях от приблизительно 3 единиц pKa до приблизительно 15 единиц рKа, в некоторых воплощениях от приблизительно 3 единиц pKa до приблизительно 10 единиц pKa, в некоторых воплощениях от приблизительно 3 единиц pKa до приблизительно 5 единиц pKa, в некоторых воплощениях от приблизительно 4 единиц pKa до приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 4 единиц pKa до приблизительно 10 единиц pKa, в некоторых воплощениях от приблизительно 4 единиц pKa до приблизительно 6 единиц pKa, в некоторых воплощениях от приблизительно 5 единиц pKa до приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 5 единиц pKa до приблизительно 10 единиц pKa, в некоторых воплощениях от приблизительно 5 единиц pKa до приблизительно 7 единиц pKa, в некоторых воплощениях от приблизительно 7 единиц pKa и приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 7 единиц pKa до приблизительно 9 единиц pKa, в некоторых воплощениях от приблизительно 9 единиц pKa до приблизительно 15 единиц pKa, в некоторых воплощениях от приблизительно 9 единиц pKa до приблизительно 11 единиц pKa, в некоторых воплощениях от приблизительно 11 единиц pKa до приблизительно 13 единиц pKa и в некоторых воплощениях от приблизительно 13 единиц рKа до приблизительно 15 единиц pKa.
В некоторых случаях разность между pKa гидрофобной кислоты и pKa терапевтического средства, определенных при 25°С, может составлять по меньшей мере приблизительно 1 единицу pKa, в некоторых воплощениях по меньшей мере приблизительно 2 единицы pKa, в некоторых воплощениях по меньшей мере приблизительно 3 единицы pKa, в некоторых воплощениях по меньшей мере приблизительно 4 единицы pKa, в некоторых воплощениях по меньшей мере приблизительно 5 единиц pKa, в некоторых воплощениях по меньшей мере приблизительно 6 единиц pKa, в некоторых воплощениях по меньшей мере приблизительно 7 единиц pKa, в некоторых воплощениях по меньшей мере приблизительно 8 единиц pKa, в некоторых воплощениях по меньшей мере приблизительно 9 единиц pKa, в некоторых воплощениях по меньшей мере приблизительно 10 единиц pKa и в некоторых воплощениях по меньшей мере приблизительно 15 единиц pKa.
В одном воплощении разность между pKa гидрофобной кислоты и первой pKa AZD1152 hqpa, определенных при 25°С, составляет от 2 до 5 единиц pKa.
Во избежание сомнений, памовая кислота (4,4'-метиленбис[3-гидрокси-2-нафтойная кислота]) имеет молекулярную массу 388,37, и описано (SciFinder), что она имеет pKa1 2,67 и log Р 6,169.
В некоторых воплощениях гидрофобная кислота может иметь log Р от приблизительно 2 до приблизительно 15, в некоторых воплощениях от приблизительно 5 до приблизительно 15, в некоторых воплощениях от приблизительно 5 до приблизительно 10, в некоторых воплощениях от приблизительно 2 до приблизительно 8, в некоторых воплощениях от приблизительно 4 до приблизительно 8, в некоторых воплощениях от приблизительно 2 до приблизительно 7 или в некоторых воплощениях от приблизительно 4 до приблизительно 7. В некоторых случаях гидрофобная кислота может иметь logP более чем приблизительно 2, более чем приблизительно 4, более чем приблизительно 5 или более чем 6.
В некоторых воплощениях рассматриваемая гидрофобная кислота может иметь такую температуру фазового перехода, которая является благоприятной, например, для улучшения свойств терапевтических наночастиц. Например, кислота может иметь температуру плавления менее чем приблизительно 300°С, в некоторых случаях менее чем приблизительно 100°С и в некоторых случаях менее чем приблизительно 50°С. В некоторых воплощениях кислота может иметь температуру плавления от приблизительно 5°С до приблизительно 25°С, в некоторых случаях от приблизительно 15°С до приблизительно 50°С, в некоторых случаях от приблизительно 30°С до приблизительно 100°С, в некоторых случаях от приблизительно 75°С до приблизительно 150°С, в некоторых случаях от приблизительно 125°С до приблизительно 200°С, в некоторых случаях от приблизительно 150°С до приблизительно 250°С и в некоторых случаях от приблизительно 200°С до приблизительно 300°С. В некоторых случаях кислота может иметь температуру плавления менее чем приблизительно 15°С, в некоторых случаях менее чем приблизительно 10°С или в некоторых случаях менее чем приблизительно 0°С. В некоторых воплощениях кислота может иметь температуру плавления от приблизительно -30°С до приблизительно 0°С или в некоторых случаях от приблизительно -20°С до приблизительно -10°С.
Например, кислоту для применения в способах и наночастицах, описанных в настоящем документе, можно выбирать, по меньшей мере отчасти, на основании растворимости терапевтического средства в растворителе, содержащем кислоту. Например, в некоторых воплощениях терапевтическое средство, растворенное в растворителе, содержащем кислоту, может иметь растворимость от приблизительно 15 мг/мл до приблизительно 200 мг/мл, от приблизительно 20 мг/мл до приблизительно 200 мг/мл, от приблизительно 25 мг/мл до приблизительно 200 мг/мл, от приблизительно 50 мг/мл до приблизительно 200 мг/мл, от приблизительно 75 мг/мл до приблизительно 200 мг/мл, от приблизительно 100 мг/мл до приблизительно 200 мг/мл, от приблизительно 125 мг/мл до приблизительно 175 мг/мл, от приблизительно 15 мг/мл до приблизительно 50 мг/мл, от приблизительно 25 мг/мл до приблизительно 75 мг/мл. В некоторых воплощениях терапевтическое средство, растворенное в растворителе, содержащем кислоту, может иметь растворимость более чем приблизительно 10 мг/мл, более чем приблизительно 50 мг/мл или более чем приблизительно 100 мг/мл. В некоторых воплощениях терапевтическое средство, растворенное в растворителе, содержащем гидрофобную кислоту (например, первый раствор, состоящий из терапевтического средства, растворителя и гидрофобной кислоты), может иметь растворимость по меньшей мере приблизительно в 2 раза больше, в некоторых воплощениях по меньшей мере приблизительно в 5 раз больше, в некоторых воплощениях по меньшей мере приблизительно в 10 раз больше, в некоторых воплощениях по меньшей мере приблизительно в 20 раз больше, в некоторых воплощениях от приблизительно в 2 раза до приблизительно в 20 раз больше или в некоторых воплощениях от приблизительно в 10 раз до приблизительно в 20 раз больше, чем при растворении терапевтического средства в растворителе, не содержащем гидрофобной кислоты (например, второй раствор, состоящий из терапевтического средства и растворителя).
В некоторых случаях концентрация кислоты в растворе лекарственного средства (растворе терапевтического средства) может составлять от приблизительно 1 процента по массе до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 2 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 3 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 4 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 5 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 6 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 8 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 10 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 12 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 14 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 16 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 1 процента по массе до приблизительно 5 массовых процентов, в некоторых воплощениях от приблизительно 3 массовых процентов до приблизительно 9 массовых процентов, в некоторых воплощениях от приблизительно 6 массовых процентов до приблизительно 12 массовых процентов, в некоторых воплощениях от приблизительно 9 массовых процентов до приблизительно 15 массовых процентов, в некоторых воплощениях от приблизительно 12 массовых процентов до приблизительно 18 массовых процентов и в некоторых воплощениях от приблизительно 15 массовых процентов до приблизительно 21 процента по массе. В некоторых воплощениях концентрация гидрофобной кислоты в растворе лекарственного средства может составлять по меньшей мере приблизительно 1 процент по массе, в некоторых воплощениях по меньшей мере приблизительно 2 процента по массе, в некоторых воплощениях по меньшей мере приблизительно 3 процента по массе, в некоторых воплощениях по меньшей мере приблизительно 5 массовых процентов, в некоторых воплощениях по меньшей мере приблизительно 10 массовых процентов, в некоторых воплощениях по меньшей мере приблизительно 15 массовых процентов и в некоторых воплощениях по меньшей мере приблизительно 20 массовых процентов.
В некоторых воплощениях молярное отношение гидрофобной кислоты к терапевтическому средству (например, на начальной стадии в процессе изготовления наночастиц и/или в наночастицы) может составлять от приблизительно 0,25:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 5:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 4:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 3:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 2:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 1,5:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 1:1, в некоторых воплощениях от приблизительно 0,25:1 до приблизительно 0,5:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 5:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 4:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 3:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 2:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 1,5:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 1:1, в некоторых воплощениях от приблизительно 0,5:1 до приблизительно 0,75:1, в некоторых воплощениях от приблизительно 0,75:1 до приблизительно 2:1, в некоторых воплощениях от приблизительно 0,75:1 до приблизительно 1,5:1, в некоторых воплощениях от приблизительно 0,75:1 до приблизительно 1,25:1, в некоторых воплощениях от приблизительно 0,75:1 до приблизительно 1:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 5:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 4:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 3:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 2:1, в некоторых воплощениях от приблизительно 1:1 до приблизительно 1,5:1, в некоторых воплощениях от приблизительно 1,5:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 1,5:1 до приблизительно 5:1, в некоторых воплощениях от приблизительно 1,5:1 до приблизительно 4:1, в некоторых воплощениях от приблизительно 1,5:1 до приблизительно 3:1, в некоторых воплощениях от приблизительно 2:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 2:1 до приблизительно 4:1, в некоторых воплощениях от приблизительно 3:1 до приблизительно 6:1, в некоторых воплощениях от приблизительно 3:1 до приблизительно 5:1 и в некоторых воплощениях от приблизительно 4:1 до приблизительно 6:1. В некоторых воплощениях это отношение составляет приблизительно 2:1.
В других воплощениях молярное отношение гидрофобной кислоты к AZD1152 hqpa в процессе образования наночастиц (когда их впервые смешивают друг с другом) составляет от приблизительно 0,75:1 до приблизительно 1:1, например от приблизительно 0,8:1 до приблизительно 1:1. В одном воплощении гидрофобная кислота представляет собой памовую кислоту, и молярное отношение памовой кислоты к AZD1152 hqpa в процессе образования наночастиц (когда их впервые смешивают друг с другом) составляет от приблизительно 0,75:1 до приблизительно 1:1, например от приблизительно 0,8:1 до приблизительно 1:1. Это воплощение проиллюстрировано в примерах 7, 7а и 7b настоящего документа. В одном воплощении молярное отношение памовой кислоты к AZD1152 hqpa, когда их впервые смешивают друг с другом, составляет приблизительно 0,8:1, что проиллюстрировано в примерах 7 и 7b. В одном воплощении молярное отношение памовой кислоты к AZD1152 hqpa, когда их впервые смешивают друг с другом, составляет приблизительно 1:1, что проиллюстрировано в примере 7а.
В некоторых случаях первоначальное молярное отношение гидрофобной кислоты к терапевтическому средству (в процессе изготовления наночастиц) может отличаться от молярного отношения гидрофобной кислоты к терапевтическому средству в наночастицах (после удаления неинкапсулированных гидрофобной кислоты и терапевтического средства). В других случаях первоначальное молярное отношение гидрофобной кислоты к терапевтическому средству (в процессе изготовления наночастиц) может быть по существу таким же, как молярное отношение гидрофобной кислоты к терапевтическому средству в наночастицах (после удаления неинкапсулированных гидрофобной кислоты и терапевтического средства). Например, в препаратах, обозначенных в настоящем документе как G1, проиллюстрированных примерами 7 и 7b, исходное молярное отношение памовой кислоты к AZD1152 hqpa составляет приблизительно 0,8:1, однако конечное молярное отношение в иллюстративном G1 составляет приблизительно 0,76:1, и в типичных сериях препарата G1 составляет приблизительно 0,65-0,75:1. Аналогично, исходное отношение для G2 в примере 7а составляет приблизительно 1:1, однако конечное проиллюстрированное молярное отношение составляет приблизительно 0,87:1, где в типичных сериях оно составляет приблизительно 0,85-0,95:1.
В некоторых случаях раствор, содержащий терапевтическое средство, можно приготовить отдельно от раствора, содержащего полимер, а затем эти два раствора можно объединять перед изготовлением наночастиц. Например, в одном воплощении первый раствор содержит терапевтическое средство и гидрофобную кислоту, а второй раствор содержит полимер и возможно гидрофобную кислоту. Препараты, у которых второй раствор не содержит гидрофобной кислоты, могут обладать преимуществом, например для минимизации количества гидрофобной кислоты, применяемого в способе, или в некоторых случаях для минимизации времени контакта между гидрофобной кислотой и, например, полимером, который может разрушаться в присутствии гидрофобной кислоты. В других случаях можно приготовить единственный раствор, содержащий терапевтическое средство, полимер и гидрофобную кислоту.
В некоторых воплощениях перед изготовлением наночастиц можно образовать гидрофобную ионную пару. Например, перед изготовлением рассматриваемых наночастиц можно приготовить раствор, содержащий гидрофобную ионную пару (например, путем приготовления раствора, содержащего подходящие количества терапевтического средства и гидрофобной кислоты). В других воплощениях гидрофобную ионную пару можно образовать в процессе изготовления наночастиц. Например, первый раствор, содержащий терапевтическое средство, и второй раствор, содержащий гидрофобную кислоту, можно объединить на стадии процесса приготовления наночастиц (например, перед образованием эмульсии и/или во время образования эмульсии). В некоторых воплощениях гидрофобная ионная пара может образоваться перед инкапсулированием терапевтического средства и гидрофобной кислоты в рассматриваемой наночастице. В других воплощениях гидрофобная ионная пара может образоваться в наночастице, например после инкапсулирования терапевтического средства и гидрофобной кислоты.
В некоторых воплощениях гидрофобная кислота может иметь растворимость, определенную при 25°С, менее чем приблизительно 2 г на 100 мл воды, в некоторых воплощениях менее чем приблизительно 1 г на 100 мл воды, в некоторых воплощениях менее чем приблизительно 100 мг на 100 мл воды, в некоторых воплощениях менее чем приблизительно 10 мг на 100 мл воды и в некоторых воплощениях менее чем приблизительно 1 мг на 100 мл воды. В других воплощениях кислота может иметь растворимость, определенную при 25°С, от приблизительно 1 мг на 100 мл воды до приблизительно 2 г на 100 мл воды, в некоторых воплощениях от приблизительно 1 мг на 100 мл воды до приблизительно 1 г на 100 мл воды, в некоторых воплощениях от приблизительно 1 мг на 100 мл воды до приблизительно 500 мг на 100 мл воды и в некоторых воплощениях от приблизительно 1 мг на 100 мл воды до приблизительно 100 мг на 100 мл воды. В некоторых воплощениях гидрофобная кислота может быть по существу нерастворима в воде при 25°С.
В некоторых воплощениях описанные наночастицы могут по существу не содержать гидрофобной кислоты, используемой в процессе приготовления наночастиц. В других воплощениях описанные наночастицы могут содержать гидрофобную кислоту. Например, в некоторых воплощениях содержание кислоты в описанных наночастицах может составлять от приблизительно 0,05 процента по массе до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 0,5 процента по массе до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 1 процента по массе до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 2 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 3 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 5 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 7 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 10 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 15 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 20 массовых процентов до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 0,05 процента по массе до приблизительно 0,5 процента по массе, в некоторых воплощениях от приблизительно 0,05 процента по массе до приблизительно 5 массовых процентов, в некоторых воплощениях от приблизительно 1 процента по массе до приблизительно 5 массовых процентов, в некоторых воплощениях от приблизительно 3 массовых процентов до приблизительно 10 массовых процентов, в некоторых воплощениях от приблизительно 5 массовых процентов до приблизительно 15 массовых процентов и в некоторых воплощениях от приблизительно 10 массовых процентов до приблизительно 20 массовых процентов.
Профиль высвобождения
В некоторых воплощениях раскрытые наночастицы по существу немедленно высвобождают (например, в течение от приблизительно 1 минуты до приблизительно 30 минут, от приблизительно 1 минуты до приблизительно 25 минут, от приблизительно 5 минут до приблизительно 30 минут, от приблизительно 5 минут до приблизительно 1 часа, в течение приблизительно 1 часа или приблизительно 24 часов) менее чем приблизительно 2%, менее чем приблизительно 5%, менее чем приблизительно 10%, менее чем приблизительно 15%, менее чем приблизительно 20%, менее чем приблизительно 25%, менее чем приблизительно 30% или менее чем 40% терапевтического средства, например, при помещении в фосфатный буферный раствор при комнатной температуре (например, при 25°С) и/или при 37°С. В некоторых воплощениях наночастицы, содержащие терапевтическое средство, могут высвобождать терапевтическое средство при помещении в водный раствор (например, в фосфатный буферный раствор), например, при 25°С и/или при 37°С, со скоростью, по существу соответствующей высвобождению от приблизительно 0,01 до приблизительно 50%, в некоторых воплощениях от приблизительно 0,01 до приблизительно 25%, в некоторых воплощениях от приблизительно 0,01 до приблизительно 15%, в некоторых воплощениях от приблизительно 0,01 до приблизительно 10%, в некоторых воплощениях от приблизительно 1 до приблизительно 40%, в некоторых воплощениях от приблизительно 5 до приблизительно 40% и в некоторых воплощениях от приблизительно 10 до приблизительно 40% терапевтического средства в течение приблизительно 1 часа. В некоторых воплощениях наночастицы, содержащие терапевтическое средство, могут высвобождать терапевтическое средство при помещении в водный раствор (например, в фосфатный буферный раствор), например, при 25°С и/или при 37°С, со скоростью, по существу соответствующей высвобождению от приблизительно 10 до приблизительно 70%, в некоторых воплощениях от приблизительно 10 до приблизительно 45%, в некоторых воплощениях от приблизительно 10 до приблизительно 35% или в некоторых воплощениях от приблизительно 10 до приблизительно 25% терапевтического средства в течение приблизительно 4 часов.
В некоторых воплощениях раскрытые наночастицы могут по существу удерживать терапевтическое средство, например, в течение по меньшей мере приблизительно 1 минуты, по меньшей мере приблизительно 1 часа или более при помещении в фосфатный буферный раствор при 37°С.
В некоторых воплощениях рассматриваемая терапевтическая наночастица по существу удерживает AZD1152 hqpa в течение по меньшей мере 1 минуты при помещении в фосфатный буферный раствор при 37°С.
В некоторых воплощениях рассматриваемая терапевтическая наночастица по существу немедленно высвобождает менее чем приблизительно 30% AZD1152 hqpa при помещении в фосфатный буферный раствор при 37°С.
В некоторых воплощениях рассматриваемая терапевтическая наночастица высвобождает от приблизительно 10 до приблизительно 45% AZD1152 hqpa в течение приблизительно 1 часа при помещении в фосфатный буферный раствор при 37°С.
Профили высвобождения in vitro для рассматриваемых наночастиц можно измерять, как описано ниже:
Высвобождение вычисляли путем деления количества AZD1152 hqpa, высвобожденного из наночастицы в среду высвобождения, на общее количество AZD1152 hqpa. Чтобы получить эти два значения, заданное количество наночастицы вносили в закрытый контейнер, содержащий среду высвобождения (фосфатный буферный раствор (PBS), содержащий полисорбат 20 для обеспечения условий достаточного разбавления), путем прокалывания и инкубировали в водяной бане при 37°С. В каждый установленный момент времени отбирали два образца. Первый, используемый для получения общего содержания AZD1152 hqpa, отбирали из контейнера и готовили для ВЭЖХ. Второй образец, используемый для получения высвобожденного количества AZD1152 hqpa в момент времени, отбирали и осаждали в ультрацентрифуге, при этом в суспензии (или в супернатанте) оставался только высвобожденный AZD1152 hqpa, который затем отбирали и готовили для ВЭЖХ. Подходящий способ ВЭЖХ приведен в примере 10.
Было протестировано девять серий каждого из препаратов G1 и G2, количественные составы которых подобны приведенным в примере 7-7b, в частности, препаратов G1, имеющих молярное отношение памовая кислота: AZD1152 hqpa в диапазоне приблизительно 0,65-0,75:1, и препаратов G2, имеющих молярное отношение приблизительно 0,85-0,95:1. Приведенные ниже данные показывают средние значения высвобождения в течение 72 часов.
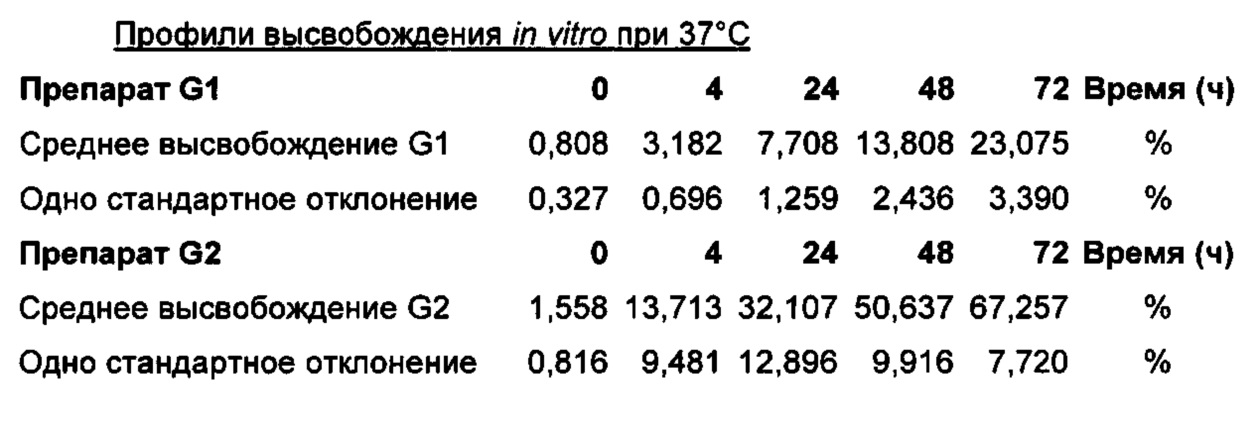
В одном аспекте рассматриваемая терапевтическая наночастица, содержащая сополимер 16-5 PLA-PEG, памовую кислоту и AZD1152 hqpa, высвобождает менее 20% AZD1152 hqpa после 30 часов в PBS и полисорбате 20 при 37°С. В другом аспекте рассматриваемая терапевтическая наночастица, содержащая сополимер 16-5 PLA-PEG, памовую кислоту и AZD1152 hqpa, высвобождает менее 20% AZD1152 hqpa после 40 часов в PBS и полисорбате 20 при 37°С. В еще одном аспекте рассматриваемая терапевтическая наночастица, содержащая сополимер 16-5 PLA-PEG, памовую кислоту и AZD1152 hqpa, высвобождает менее 20% AZD1152 hqpa после 50 часов в PBS и полисорбате 20 при 37°С. В еще одном аспекте рассматриваемая терапевтическая наночастица, содержащая сополимер 16-5 PLA-PEG, памовую кислоту и AZD1152 hqpa, высвобождает приблизительно 10% AZD1152 hqpa после 24 часов в PBS и полисорбате 20 при 37°С. В этих аспектах высвобождение легко измеряют описанным выше способом.
В одном аспекте (например, когда терапевтические наночастицы содержат дезоксихолевую кислоту, холевую кислоту (включая смесь дезоксихолевой кислоты и холевой кислоты), диоктилсульфоянтарную кислоту или памовую кислоту) терапевтические наночастицы высвобождают AZD1152 hqpa in vivo с такой скоростью, при которой через 24 часа после дозирования высвобождается менее 40%. В другом аспекте (например, когда терапевтические наночастицы содержат дезоксихолевую кислоту, холевую кислоту (включая смесь дезоксихолевой кислоты и холевой кислоты), диоктилсульфоянтарную кислоту или памовую кислоту) терапевтические наночастицы высвобождают AZD1152 hqpa in vivo с такой скоростью, при которой через 24 часа после дозирования высвобождается менее 30%. В одном аспекте (например, когда терапевтические наночастицы содержат дезоксихолевую кислоту, холевую кислоту (включая смесь дезоксихолевой кислоты и холевой кислоты), диоктилсульфоянтарную кислоту или памовую кислоту) терапевтические наночастицы высвобождают AZD1152 hqpa in vivo с такой скоростью, при которой через 24 часа после дозирования высвобождается 25-35%. В другом аспекте (например, когда терапевтические наночастицы содержат памовую кислоту) терапевтические наночастицы высвобождают AZD1152 hqpa in vivo с такой скоростью, при которой через 24 часа после дозирования высвобождается менее 15%.
Обычно "наночастица" относится к любой частице, имеющей диаметр менее 1000 нм, например от приблизительно 10 нм до приблизительно 200 нм. Раскрытые терапевтические наночастицы могут включать наночастицы, имеющие диаметр от приблизительно 60 до приблизительно 120 нм, или от приблизительно 70 до приблизительно 120 нм, или от приблизительно 80 до приблизительно 120 нм, или от приблизительно 90 до приблизительно 120 нм, или от приблизительно 100 до приблизительно 120 нм, или от приблизительно 60 до приблизительно 130 нм, либо от приблизительно 70 до приблизительно 130 нм, или от приблизительно 80 до приблизительно 130 нм, или от приблизительно 90 до приблизительно 130 нм, или от приблизительно 100 до приблизительно 130 нм, или от приблизительно 110 до приблизительно 130 нм, или от приблизительно 60 до приблизительно 140 нм, или от приблизительно 70 до приблизительно 140 нм, или от приблизительно 80 до приблизительно 140 нм, или от приблизительно 90 до приблизительно 140 нм, или от приблизительно 100 до приблизительно 140 нм, или от приблизительно 110 до приблизительно 140 нм, или от приблизительно 60 до приблизительно 150 нм, или от приблизительно 70 до приблизительно 150 нм, или от приблизительно 80 до приблизительно 150 нм, или от приблизительно 90 до приблизительно 150 нм, или от приблизительно 100 до приблизительно 150 нм, или от приблизительно 110 до приблизительно 150 нм, или от приблизительно 120 до приблизительно 150 нм.
В некоторых воплощениях гидродинамический диаметр рассматриваемой терапевтической наночастицы составляет от приблизительно 60 до приблизительно 150 нм, или от приблизительно 90 до приблизительно 140 нм, или от приблизительно 90 до приблизительно 120 нм. В дополнительном аспекте гидродинамический диаметр рассматриваемой терапевтической наночастицы составляет от приблизительно 90 до приблизительно 110 нм, например когда терапевтические наночастицы содержат по существу гидрофобную кислоту, выбранную из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты, памовой кислоты или их смесей.
В одном воплощении раскрытые наночастицы образованы с AZD1152 hqpa и памовой кислотой и имеют гидродинамический диаметр менее 500 нм, как например менее 200 нм, например 70-140 нм.
В частности, раскрытые наночастицы образованы с AZD1152 hqpa и гидрофобной кислотой, выбранной из холевой кислоты, дезоксихолевой кислоты и диоктилсульфоянтарной кислоты. В другом воплощении раскрытые наночастицы образованы с AZD1152 hqpa и гидрофобной кислотой, выбранной из дезоксихолевой кислоты и диоктилсульфоянтарной кислоты. В одном аспекте раскрытые наночастицы образованы с AZD1152 hqpa и дезоксихолевой кислотой. В другом аспекте раскрытые наночастицы образованы с AZD1152 hqpa и диоктилсульфоянтарной кислотой. В еще одном аспекте раскрытые наночастицы образованы с AZD1152 и холевой кислотой. В одном аспекте раскрытые наночастицы образованы с AZD1152 hqpa и смесью холевой кислоты и дезоксихолевой кислоты; в этом аспекте целесообразно, чтобы гидрофобные кислоты находились в отношении приблизительно 3:2 дезоксихолевая кислота: холевая кислота, и отношение гидрофобная кислота: AZD1152 hqpa составляло приблизительно 2:1 (где отношения выражены в процентах по массе). В другом аспекте раскрытые наночастицы образованы с AZD1152 hqpa и памовой кислотой.
Полимеры
В некоторых воплощениях наночастицы могут содержать матрицу из полимеров и терапевтическое средство. В некоторых воплощениях терапевтическое средство может быть связано по меньшей мере с частью полимерной матрицы. Терапевтическое средство может быть связано с поверхностью полимерной матрицы, заключено в ней, окружено ей и/или диспергировано во всем ее объеме.
В раскрытых наночастицах можно использовать любой подходящий полимер. Полимеры могут представлять собой природные полимеры или полимеры неприродного происхождения (синтетические полимеры). Полимеры могут быть гомополимерами или сополимерами, содержащими два или более мономеров. Что касается последовательности, то сополимеры могут быть статистическими, блочными или содержать комбинацию статистических и блочных последовательностей. Обычно полимеры представляют собой органические полимеры.
Термину "полимер" при использовании в настоящем документе дано его обычное значение, используемое в данной области техники, то есть он означает молекулярную структуру, содержащую одно или более повторяющихся звеньев (мономеров), соединенных ковалентными связями. Все повторяющиеся звенья могут быть идентичными, либо в некоторых случаях в полимере может присутствовать более одного типа повторяющегося звена. В некоторых случаях полимер может иметь биологическое происхождение (биополимер). Неограничивающие примеры включают пептиды или белки. В некоторых случаях в полимере могут также присутствовать дополнительные группировки, например биологические группировки, такие как описано ниже. Если в полимере присутствует более одного типа повторяющегося звена, то полимер называют "сополимером". Следует понимать, что в любом воплощении изобретения, где используют полимер, используемый полимер в некоторых случаях может представлять собой сополимер. Повторяющиеся звенья, образующие сополимер, могут располагаться любым способом. Например, повторяющиеся звенья могут располагаться в случайном порядке, в чередующемся порядке или как в блок-сополимере, то есть содержать один или более участков, каждый из которых содержит первое повторяющееся звено (например, первый блок), и один или более участков, каждый из которых содержит второе повторяющееся звено (например, второй блок) и так далее. Блок-сополимеры могут иметь два (диблок-сополимер), три (триблок-сополимер) или большее число отдельных блоков.
Раскрытые частицы могут включать сополимеры, которые в некоторых воплощениях описывают два или более полимеров (таких как описаны в данном документе), связанных друг с другом, обычно путем ковалентного связывания двух или более полимеров вместе. Таким образом, сополимер может содержать первый полимер и второй полимер, которые конъюгированы вместе с образованием блок-сополимера, где первый полимер может представлять собой первый блок блок-сополимера, а второй полимер может представлять собой второй блок блок-сополимера. Конечно, обычным специалистам в данной области техники понятно, что блок-сополимер в некоторых случаях может содержать множественные блоки полимера, и что "блок-сополимер" при использовании в настоящем документе не ограничен только блок-сополимерами, имеющими только один первый блок и один второй блок. Например, блок-сополимер может содержать первый блок, содержащий первый полимер, второй блок, содержащий второй полимер, и третий блок, содержащий третий полимер или первый полимер, и так далее. В некоторых случаях блок-сополимеры могут содержать любое количество первых блоков первого полимера и вторых блоков второго полимера (и в некоторых случаях третьих блоков, четвертых блоков и так далее). Кроме того, следует отметить, что в некоторых случаях блок-сополимеры также могут быть образованы из других блок-сополимеров. Например, первый блок-сополимер может быть конъюгирован с другим полимером (который может представлять собой гомополимер, биополимер, другой блок-сополимер и так далее), чтобы образовать новый блок-сополимер, содержащий множество типов блоков, и/или с другими группировками (например, с неполимерными группировками).
В некоторых воплощениях полимер (например, сополимер или блок-сополимер) может быть амфифильным, то есть иметь гидрофильную часть и гидрофобную часть или относительно гидрофильную часть и относительно гидрофобную часть. Гидрофильный полимер может представлять собой полимер, который обычно притягивает воду, а гидрофобный полимер может представлять собой полимер, который обычно отталкивает воду. Гидрофильный или гидрофобный полимер можно идентифицировать, например, путем приготовления образца полимера и измерения его угла контакта с водой (обычно гидрофильный полимер будет иметь угол контакта менее 60°, тогда как гидрофобный полимер будет иметь угол контакта более чем приблизительно 60°). В некоторых случаях гидрофильность двух или более полимеров можно измерить друг относительно друга, то есть первый полимер может быть более гидрофильным, чем второй полимер. Например, первый полимер может иметь меньший угол контакта, чем второй полимер.
В одной группе воплощений полимер (такой как сополимер или блок-сополимер), рассматриваемый в данном документе, включает биосовместимый полимер, представляющий собой полимер, который обычно не вызывает неблагоприятной реакции при встраивании или введении в живого субъекта, например без значительного воспаления и/или острого отторжения полимера иммунной системой, например через Т-клеточный ответ. Соответственно, терапевтические частицы, рассматриваемые в настоящем документе, могут быть неиммуногенными. Термин "неиммуногенный" при использовании в настоящем документе относится к эндогенному фактору роста в его нативном состоянии, который в норме не вызывает образования или вызывает только минимальные уровни образования циркулирующих антител, Т-клеток или реактивных иммунных клеток и который в норме не вызывает у индивидуума иммунного ответа против него.
Биосовместимость обычно относится к острому отторжению материала по меньшей мере частью иммунной системы - биологически несовместимый материал, имплантированный субъекту, провоцирует иммунный ответ у субъекта, который может быть достаточно серьезным, так что отторжение материала иммунной системой невозможно адекватно контролировать, и часто его степень такова, что материал должен быть удален из субъекта. Один из простых тестов для определения биосовместимости может заключаться в воздействии полимера на клетки in vitro; биосовместимые полимеры представляют собой полимеры, которые обычно не приводят к значительной гибели клеток при умеренных концентрациях, например при концентрациях 50 микрограммов/106 клеток. Например, биосовместимый полимер может вызывать менее чем приблизительно 20%-ную гибель клеток при воздействии на клетки, такие как фибробласты или эпителиальные клетки, даже при его фагоцитозе или ином захвате такими клетками. Неограничивающие примеры биосовместимых полимеров, которые могут быть полезны в различных воплощениях, включают полидиоксанон (PDO), полигидроксиалканоат, полигидроксибутират, поли(глицеринсебацат), полигликолид (поли(гликолевая кислота)) (PGA), полилактид (поли(молочная кислота)) (PLA), сополимер поли(молочнойкислоты) и поли(гликолевой кислоты) (PLGA), поликапролактон, либо сополимеры или производные, включающие эти и/или другие полимеры.
В некоторых воплощениях рассматриваемые биосовместимые полимеры могут быть биоразлагаемыми, так что полимер способен разлагаться химическим и/или биологическим путем в физиологической окружающей среде, например в организме. При использовании в настоящем документе "биоразлагаемые" полимеры представляют собой полимеры, которые при введении их в клетку разрушаются посредством клеточного механизма (биологически разлагаемые) и/или посредством химического процесса, такого как гидролиз (химически разлагаемые), на компоненты, которые клетки могут или повторно использовать, или утилизировать без значительного токсического эффекта на клетки. В одном воплощении биоразлагаемый полимер и побочные продукты его разложения могут быть биосовместимыми.
Частицы, раскрытые в настоящем документе, могут содержать или не содержать PEG. Кроме того, некоторые воплощения могут быть направлены на сополимеры, содержащие поли(сложный эфир-простой эфир), например полимеры, имеющие повторяющиеся звенья, соединенные сложноэфирными связями (например, связями R-C(O)-O-R') и простыми эфирными связями (например, связями R-O-R'). В некоторых воплощениях биоразлагаемый полимер, такой как гидролизуемый полимер, содержащий группы карбоновой кислоты, может быть конъюгирован с повторяющимися звеньями поли(этиленгликоля) с образованием поли(сложный эфир-простой эфир). Полимер (например сополимер, например блок-сополимер), содержащий поли(этиленгликолевые) повторяющиеся звенья, также может называться "ПЭГилированным" полимером.
Например, рассматриваемый полимер может представлять собой полимер, который самопроизвольно гидролизуется под действием воды (например, в организме субъекта), либо полимер может разлагаться под действием тепла (например, при температурах приблизительно 37°С). Разложение полимера может происходить со скоростями, изменяющимися в зависимости от используемого полимера или сополимера. Например, период полураспада полимера (время, в течение которого 50% полимера может разложиться на мономеры и/или другие неполимерные группировки) может составлять порядка нескольких суток, недель, месяцев или лет в зависимости от полимера. Полимеры могут быть биологически разлагаемыми, например посредством ферментативной активности или клеточного механизма, в некоторых случаях, например, под действием лизоцима (например, имеющие относительно низкие значения рН). В некоторых случаях полимеры могут разрушаться до мономеров и/или других неполимерных группировок, которые клетки могут или повторно использовать, или утилизировать без значительного токсического эффекта на клетки (например, полилактид может гидролизоваться с образованием молочной кислоты, полигликолид может гидролизоваться с образованием гликолевой кислоты и так далее).
В некоторых воплощениях полимеры могут представлять собой сложные полиэфиры, включая сополимеры, содержащие звенья молочной кислоты и гликолевой кислоты, такие как сополимер поли(молочная кислота-гликолевая кислота) и сополимер поли(лактид-гликолид), все называемые в настоящем документе "PLGA"; и гомополимеры, содержащие звенья гликолевой кислоты, называемые в настоящем документе "PGA", и звенья молочной кислоты, такие как поли-L-молочная кислота, поли-D-молочная кислота, поли-D,L-молочная кислота, поли-L-лактид, поли-D-лактид и поли-D,L-лактид, все называемые в настоящем документе "PLA". В некоторых воплощениях иллюстративные сложные полиэфиры включают, например, полигидроксикислоты; ПЭГилированные полимеры и сополимеры лактида и гликолида (например, ПЭГилированную PLA, ПЭГилированную PGA, ПЭГилированную PLGA и их производные). В некоторых воплощениях сложные полиэфиры включают, например, полиангидриды, сложный поли(ортоэфир), сложный ПЭГилированный поли(ортоэфир), поли(капролактон), ПЭГилированный поли(капролактон), полилизин, ПЭГилированный полилизин, поли(этиленимин), ПЭГилированный поли(этиленимин), сополимер поли(L-лактид-L-лизин), поли(сложный эфир серина), поли(сложный эфир 4-гидрокси-L-пролина), поли[α-(4-аминобутил)-L-гликолевую кислоту] и их производные.
В некоторых воплощениях полимер может представлять собой PLGA. PLGA представляет собой биосовместимый и биоразлагаемый сополимер молочной кислоты и гликолевой кислоты, и различные формы PLGA могут характеризоваться отношением молочная кислота: гликолевая кислота. Молочная кислота может представлять собой L-молочную кислоту, D-молочную кислоту или D,L-молочную кислоту. Скорость разложения PLGA можно регулировать, изменяя соотношение молочной кислоты и гликолевой кислоты. В некоторых воплощениях PLGA может характеризоваться отношением молочная кислота: гликолевая кислота, составляющим приблизительно 85:15, приблизительно 75:25, приблизительно 60:40, приблизительно 50:50, приблизительно 40:60, приблизительно 25:75 или приблизительно 15:85. В некоторых воплощениях соотношение мономеров молочной кислоты и гликолевой кислоты в полимере частицы (например, в блок-сополимере PLGA или блок-сополимере PLGA-PEG) может быть выбрано таким образом, чтобы оптимизировать различные параметры, например можно оптимизировать захват воды, высвобождение терапевтического средства и/или кинетику разложения полимера.
В некоторых воплощениях полимеры могут представлять собой один или более акриловых полимеров. В некоторых воплощениях акриловые полимеры включают, например, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метилметакрилата, этоксиэтилметакрилаты, цианоэтилметакрилат, сополимер аминоалкилметакрилата, полиакриловую кислоту), поли(метакриловую кислоту), сополимер метакриловой кислоты и алкиламида, поли(метилметакрилат), поли(метакриловую кислоту и полиакриламид, сополимер аминоалкилметакрилата, сополимеры глицидилметакрилата, полицианоакрилаты и комбинации, содержащие один или более из описанных выше полимеров. Акриловый полимер может включать полностью полимеризованные сополимеры сложных эфиров акриловой и метакриловой кислоты с низким содержанием четвертичных аммониевых групп.
В некоторых воплощениях полимеры могут представлять собой катионные полимеры. Обычно катионные полимеры способны к конденсации и/или защите отрицательно заряженных нитей нуклеиновых кислот (например, ДНК, РНК или их производных). Аминосодержащие полимеры, такие как поли(лизиновые), полиэтилениминные (PEI) и поли(амидоаминные) дендримеры, рассматриваются, в некоторых воплощениях, для применения в раскрытой частице.
В некоторых воплощениях полимеры могут представлять собой разлагаемые сложные полиэфиры, несущие катионные боковые цепи. Примеры этих сложных полиэфиров включают сополимер (L-лактид-L-лизин), поли(сложный эфир серина), поли(сложный эфир 4-гидрокси-L-пролина).
Полагают, что PEG может заканчиваться концевой группой и включать концевую группу. Например, PEG может заканчиваться гидроксильной, метокси или другой алкоксильной группой, метильной или другой алкильной группой, арильной группой, карбоновой кислотой, амином, амидом, ацетильной группой, группой гуанидино или имидазолом. Другие рассматриваемые концевые группы включают азидные, алкиновые, малеимидные, альдегидные, гидразидные, гидроксиламинные, алкоксиаминные или тиольные группировки.
Обычным специалистам в данной области техники известны способы и методики ПЭГилирования полимера, например, путем использования EDC (гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида) и NHS (N-гидроксисукцинимида) для взаимодействия полимера с заканчивающейся амином PEG-группоPEGй с помощью методов полимеризации с раскрытием кольца (ROMP) или тому подобных.
В одном воплощении молекулярную массу (или, например, отношение молекулярных масс, например, разных блоков сополимера) полимеров можно оптимизировать для эффективного лечения, как описано в настоящем документе. Например, молекулярная масса полимера может влиять на скорость разложения частиц (например, когда можно регулировать молекулярную массу биоразлагаемого полимера), растворимость, захват воды и кинетику высвобождения лекарственного средства. Например, молекулярную массу полимера (или, например, отношение молекулярных масс, например, разных блоков сополимера) можно регулировать таким образом, чтобы частица биологически разлагалась в получающем лечение субъекте в течение разумного периода времени (в диапазоне от нескольких часов до 1-2 недель, 3-4 недель, 5-6 недель, 7-8 недель и так далее).
Раскрытая частица может содержать, например, диблок-сополимер PEG и PL(G)A, где, например, часть PEG может иметь среднечисловую молекулярную массу приблизительно 1000-20000, например приблизительно 2000-20000, например от приблизительно 2 до приблизительно 10000, а часть PL(G)A может иметь среднечисловую молекулярную массу от приблизительно 5000 до приблизительно 20000 или приблизительно 5000-100000, например приблизительно 20000-70000, например приблизительно 15000-50000.
Например, в настоящем документе раскрыта терапевтическая наночастица, включающая от приблизительно 10 до приблизительно 99 массовых процентов сополимера поли(молочная кислота)-поли(этилен)гликоль или сополимера поли(молочная кислота)-поли(гликолевая кислота)-поли(этилен)гликоль либо от приблизительно 20 до приблизительно 80 массовых процентов, от приблизительно 40 до приблизительно 80 массовых процентов, либо от приблизительно 30 до приблизительно 50 массовых процентов, либо от приблизительно 70 до приблизительно 90 массовых процентов сополимера поли(молочная кислота)-поли(этилен)гликоль или сополимера поли(молочная кислота)-поли(гликолевая кислота)-поли(этилен)гликоль. Иллюстративные сополимеры поли(молочная кислота)-поли(этилен)гликоль могут включать среднечисловую молекулярную массу от приблизительно 15 до приблизительно 20 кДа или от приблизительно 10 до приблизительно 25 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа или от приблизительно 2 кДа до приблизительно 10 кДа поли(этилен)гликоля.
В некоторых воплощениях сополимер поли(молочная кислота)-поли(этилен)гликоль может иметь среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,6 до приблизительно 0,95, в некоторых воплощениях от приблизительно 0,7 до приблизительно 0,9, в некоторых воплощениях от приблизительно 0,6 до приблизительно 0,8, в некоторых воплощениях от приблизительно 0,7 до приблизительно 0,8, в некоторых воплощениях от приблизительно 0,75 до приблизительно 0,85, в некоторых воплощениях от приблизительно 0,8 до приблизительно 0,9 и в некоторых воплощениях от приблизительно 0,85 до приблизительно 0,95. Следует понимать, что среднечисловую молекулярно-массовую фракцию поли(молочнойкислоты) можно вычислить путем деления среднечисловой молекулярной массы поли(молочнокислотного) компонента сополимера на сумму среднечисловой молекулярной массы поли(молочнокислотного) компонента и среднечисловой молекулярной массы поли(этилен)гликолевого компонента.
Раскрытые наночастицы могут, возможно, включать от приблизительно 1 до приблизительно 50 массовых процентов поли(молочной кислоты) или сополимера поли(молочная кислота)-поли(гликолевая кислота) (который не включает PEG) либо могут, возможно, включать от приблизительно 1 до приблизительно 50 массовых процентов, или от приблизительно 10 до приблизительно 50 массовых процентов, или от приблизительно 30 до приблизительно 50 массовых процентов поли(молочной кислоты) или сополимера поли(молочная кислота)-поли(гликолевая кислота). Например, поли(молочная кислота) или сополимер поли(молочная кислота)-поли(гликолевая кислота) может иметь среднечисловую молекулярную массу от приблизительно 5 до приблизительно 15 кДа или от приблизительно 5 до приблизительно 12 кДа. Иллюстративная PLA может иметь среднечисловую молекулярную массу от приблизительно 5 до приблизительно 10 кДа. Иллюстративная PLGA может иметь среднечисловую молекулярную массу от приблизительно 8 до приблизительно 12 кДа.
Терапевтическая наночастица в некоторых воплощениях может содержать от приблизительно 10 до приблизительно 30 массовых процентов, в некоторых воплощениях от приблизительно 10 до приблизительно 25 массовых процентов, в некоторых воплощениях от приблизительно 10 до приблизительно 20 массовых процентов, в некоторых воплощениях от приблизительно 10 до приблизительно 15 массовых процентов, в некоторых воплощениях от приблизительно 15 до приблизительно 20 массовых процентов, в некоторых воплощениях от приблизительно 15 до приблизительно 25 массовых процентов, в некоторых воплощениях от приблизительно 20 до приблизительно 25 массовых процентов, в некоторых воплощениях от приблизительно 20 до приблизительно 30 массовых процентов, либо в некоторых воплощениях от приблизительно 25 до приблизительно 30 массовых процентов поли(этилен)гликоля, где поли(этилен)гликоль может присутствовать в виде сополимера поли(молочная кислота)-поли(этилен)гликоль, сополимера поли(молочная кислота)-поли(гликолевая кислота)-поли(этилен)гликоль или гомополимера поли(этилен)гликоля. В некоторых воплощениях полимеры наночастиц можно конъюгировать с липидом. Полимер может представлять собой, например, заканчивающийся липидом PEG.
В одном воплощении терапевтические наночастицы содержат от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(молочная кислота)-поли(гликолевая кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; и от приблизительно 0,2 до приблизительно 30 массовых процентов AZD1152 hqpa. В одном аспекте сополимер поли(молочная) кислота-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля; например, сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
В другом воплощении изобретения терапевтические наночастицы содержат от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; и от приблизительно 0,2 до приблизительно 30 массовых процентов AZD1152 hqpa. В одном аспекте сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля; например, сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
В еще одном воплощении изобретения терапевтические наночастицы содержат от приблизительно 50 до приблизительно 99 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; и от приблизительно 1 до приблизительно 30 массовых процентов AZD1152 hqpa. В одном аспекте сополимер поли(молочнаякислота) -поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля; например, сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
В одном аспекте сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9, например от приблизительно 0,75 до приблизительно 0,85.
В одном аспекте терапевтическая наночастица содержит от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля. В дополнительном аспекте терапевтическая наночастица содержит от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
В дополнительном аспекте терапевтическая наночастица содержит от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера, например от приблизительно 65 массовых процентов до приблизительно 80 массовых процентов сополимера.
В дополнительном аспекте, когда гидрофобная кислота представляет собой памовую кислоту, терапевтическая наночастица содержит от приблизительно 60 до приблизительно 80 процентов сополимера (в частности, сополимера PLA-PEG, в частности, сополимера 16/5 PLA-PEG), например от приблизительно 65 до приблизительно 75 процентов сополимера, где содержание поли(этилен)гликоля составляет от приблизительно 15 до приблизительно 20 процентов по массе от массы наночастицы. Однако специалисту в данной области техники понятно, что массовые проценты присутствующих в наночастице полимеров в некоторой степени изменяются от серии к серии по мере изменения количества гидрофобной кислоты (такой как памовая кислота) и AZD1152 hqpa.
Получение наночастиц
В другом аспекте данное изобретение направлено на системы и способы получения раскрытых наночастиц. В некоторых воплощениях свойства частиц можно контролировать, используя два или более разных полимеров (например, сополимеров, например, блок-сополимеров) в разных соотношениях и получая частицы из таких полимеров (например, сополимеров, например, блок-сополимеров). Например, полимер (например, сополимер, например блок-сополимер) можно выбирать на основании его биосовместимости и/или его способности контролировать иммуногенность получаемой в результате частицы.
В некоторых воплощениях растворитель, используемый в способе получения наночастиц (например, в способе наноосаждения или способе получения наноэмульсии, обсуждаемых ниже), может включать гидрофобную кислоту, которая может придавать полученным с использованием этого способа наночастицам полезные свойства. Как рассмотрено выше, в некоторых случаях гидрофобная кислота может повысить содержание лекарственного вещества в раскрытых наночастицах. Кроме того, в некоторых случаях за счет использования гидрофобной кислоты у раскрытых наночастиц можно улучшить свойства контролируемого высвобождения. В некоторых случаях гидрофобную кислоту можно включать, например, в органический раствор или в водный раствор, используемый в способе. В одном воплощении гидрофобную кислоту включают в водный раствор в форме водорастворимой соли (такой как натриевая соль), например в виде холата натрия. В одном воплощении лекарственное средство объединяют с органическим раствором и гидрофобной кислотой и возможно с одним или более полимерами. Концентрация гидрофобной кислоты в растворе, используемом для растворения лекарственного средства, рассмотрена выше и может составлять, например, от приблизительно 1 массового процента до приблизительно 30 массовых процентов и так далее.
В одной группе воплощений частицы формируют путем предоставления раствора, содержащего один или более полимеров, и приведения этого раствора в контакт с нерастворителем полимера с получением частицы. Раствор может быть смешиваемым или несмешиваемым с нерастворителем полимера. Например, смешиваемая с водой жидкость, такая как ацетонитрил, может содержать полимеры, и частицы формируются при приведении в контакт ацетонитрила с водой (нерастворителем полимера), например, путем вливания ацетонитрила в воду с контролируемой скоростью. Полимер, содержащийся в растворе, при контакте с нерастворителем полимера может, таким образом, осаждаться с формированием частиц, таких как наночастицы. Две жидкости называют "несмешиваемыми" или не поддающимися смешению друг с другом, когда одна жидкость нерастворима в другой до уровня, составляющего по меньшей мере 10% по массе при температуре и давлении окружающей среды. Обычно органический раствор (например, дихлорметан, ацетонитрил, хлороформ, тетрагидрофуран, ацетон, формамид, диметилформамид, пиридины, диоксан, диметилсульфоксид и так далее) и водная жидкость (например, вода или вода, содержащая растворенные соли или другие вещества, клеточные или биологические среды, этанол и так далее) являются несмешиваемыми по отношению друг к другу. Например, первый раствор можно вливать во второй раствор (с подходящей скоростью или быстротой). В некоторых случаях частицы, такие как наночастицы, могут формироваться при контакте первого раствора с несмешиваемой второй жидкостью, например, осаждение полимера при контакте заставляет полимер формировать наночастицы по мере того как первый раствор вливают во вторую жидкость, и, например, в некоторых случаях наночастицы могут формироваться при тщательном контроле скорости введения и поддержании относительно медленной скорости. Обычные специалисты в данной области техники могут легко оптимизировать контроль такого формирования частиц с использованием самых обычных экспериментов.
При использовании описанного способа можно в высокой степени контролировать такие свойства, как функциональность поверхности, поверхностный заряд, размер, зета (ζ) потенциал, гидрофобность, способность контролировать иммуногенность и тому подобное. Например, можно синтезировать библиотеку частиц и подвергнуть ее скринингу для идентификации частиц, имеющих определенное соотношение полимеров, что позволяет частицам иметь определенную плотность группировок, присутствующих на поверхности частицы. Это дает возможность получить частицы, обладающие одним или более конкретными свойствами, например конкретным размером и конкретной поверхностной плотностью группировок, без чрезмерной исследовательской работы. Соответственно, некоторые воплощения направлены на методы скрининга с использованием таких библиотек, а также любые частицы, идентифицированные с использованием таких библиотек. Кроме того, идентификацию можно выполнять с использованием любого подходящего способа. Например, идентификация может быть прямой или косвенной или быть количественной или качественной.
В другом воплощении предложен способ получения наноэмульсии, такой как способ, представленный на Фиг. 1, 2А и 2В. Например, терапевтическое средство, гидрофобную кислоту, первый полимер (например, диблок-сополимер, такой как PLA-PEG или PLGA-PEG) и возможный второй полимер (например, (PL(G)A-PEG или PLA) можно объединять с органическим раствором с образованием первой органической фазы. Такая первая фаза может включать от приблизительно 1 до приблизительно 50 мас. % сухого вещества, от приблизительно 5 до приблизительно 50 мас. % сухого вещества, от приблизительно 5 до приблизительно 40 мас. % сухого вещества, от приблизительно 1 до приблизительно 15 мас. % сухого вещества или от приблизительно 10 до приблизительно 30 мас. % сухого вещества. Первую органическую фазу можно объединять с первым водным раствором с образованием второй фазы. Органический раствор может включать, например, толуол, метилэтилкетон, ацетонитрил, тетрагидрофуран, этилацетат, изопропиловый спирт, изопропилацетат, диметилформамид, метиленхлорид, дихлорметан, хлороформ, ацетон, бензиловый спирт, Tween®80, Span ®80, Brij®100 или тому подобное, и их комбинации. Органический раствор также может включать диметилсульфоксид (DMSO). В одном из воплощений органическая фаза может включать бензиловый спирт, этилацетат и их комбинации. В другом воплощении органическая фаза может включать бензиловый спирт, этилацетат и DMSO. Вторая фаза может составлять приблизительно от 0,1 до 50 мас. %, приблизительно от 1 до 50 мас. %, приблизительно от 5 до 40 мас. % или приблизительно от 1 до 15 мас. % сухого вещества. Водный раствор может представлять собой воду, возможно в комбинации с одним или более чем одним из холата натрия, докузата натрия, этилацетата, поливинилацетата и бензилового спирта. Водный раствор также может содержать DMSO и/или Brij®100 или тому подобное. В некоторых воплощениях водный раствор содержит Brij®100, бензиловый спирт и DMSO в воде. В некоторых воплощениях рН водной фазы можно выбирать на основании pKa протонированного терапевтического средства и/или pKa гидрофобной кислоты. Например, в некоторых воплощениях терапевтическое средство, когда оно протонированное, может иметь первую pKa, гидрофобная кислота может иметь вторую pKa, а водная фаза может иметь рН, равный числу единиц pKa между первой pKa и второй pKa. В конкретном воплощении рН водной фазы может быть равен числу единиц pKa, которое является приблизительно равноудаленным от первой pKa и второй pKa.
Например, в масляной или органической фазе можно использовать растворитель, который является только частично смешиваемым с нерастворителем (водой). Таким образом, при смешивании при достаточно низком соотношении и/или при использовании воды, предварительно насыщенной органическими растворителями, органическая (масляная) фаза остается жидкой. Органическую (масляную) фазу можно эмульгировать в водном растворе и в виде капелек жидкости расщеплять на наночастицы, используя, например, дисперсионные системы высокой энергии, такие как гомогенизаторы или ультразвуковые диспергаторы. Водная часть эмульсии, иначе известная как "водная фаза", может представлять собой раствор поверхностно-активного вещества, состоящий из холата натрия (или возможно докузата натрия) и предварительно насыщенный этилацетатом и бензиловым спиртом. В некоторых случаях органическая фаза (например, первая органическая фаза) может включать терапевтическое средство. Кроме того, в некоторых воплощениях водный раствор (например, первый водный раствор) может включать по существу гидрофобную кислоту. В других воплощениях как терапевтическое средство, так и по существу гидрофобную кислоту можно растворять в органической фазе.
Эмульгирование второй фазы с образованием эмульсионной фазы можно осуществить, например, в одну или в две стадии эмульгирования. Например, можно приготовить первичную эмульсию, а затем эмульгировать ее с образованием тонкодисперсной эмульсии. Первичную эмульсию можно образовать, используя, например, простое смешивание, гомогенизатор высокого давления, зондовый ультразвуковой диспергатор, магнитную мешалку или роторно-статорный гомогенизатор. Первичную эмульсию можно превратить в тонкодисперсную эмульсию посредством использования, например, зондового ультразвукового диспергатора или гомогенизатора высокого давления, например, пропуская через гомогенизатор 1, 2, 3 или более раз. Например, при использовании гомогенизатора высокого давления используемое давление может составлять от приблизительно 30 до приблизительно 60 фунт/кв. дюйм (psi), от приблизительно 40 до приблизительно 50 фунт/кв. дюйм, от приблизительно 1000 до приблизительно 8000 фунт/кв. дюйм, от приблизительно 2000 до приблизительно 4000 фунт/кв. дюйм, от приблизительно 4000 до приблизительно 8000 фунт/кв. дюйм или от приблизительно 4000 до приблизительно 5000 фунт/кв. дюйм, например приблизительно 2000, 2500, 4000 или 5000 фунт/кв. дюйм. Используемое давление может составлять приблизительно от 5000 до 20000 фунт/кв. дюйм, например от 5000 до 15000 фунт/кв. дюйм, например приблизительно от 8000 до 15000 фунт/кв. дюйм, например от 8000 до приблизительно 12000 фунт/кв. дюйм. В способах, примеры которых приведены в настоящем документе, используют приблизительно 9000 фунт/кв. дюйм (смотри примеры 7, 7а и 7b) и приблизительно 11000 фунт/кв. дюйм (как в примере 1).
В некоторых случаях условия получения тонкодисперсной эмульсии, которая может характеризоваться очень высоким отношением поверхности к объему капелек в эмульсии, могут быть выбраны так, чтобы максимально увеличить растворимость терапевтического средства и гидрофобной кислоты и сформировать желаемую гидрофобную ионную пару (HIP). В некоторых воплощениях уравновешивание растворенных компонентов в условиях получения тонкодисперсной эмульсии может происходить очень быстро и быстрее, чем затвердевание наночастиц. Так, выбор HIP, основанный, например, на разности между pKa терапевтического средства и pKa гидрофобной кислоты, или регулирование других параметров, таких как рН тонкодисперсной эмульсии и/или рН раствора гасителя, может оказывать значительное влияние на содержание лекарственного средства и свойства высвобождения из наночастиц, обуславливая, например, формирование HIP в наночастице в противоположность диффузии терапевтического средства и/или гидрофобной кислоты вне наночастицы.
В некоторых воплощениях терапевтическое средство и по существу гидрофобную кислоту можно объединять во второй фазе перед эмульгированием второй фазы. В некоторых случаях терапевтическое средство и по существу гидрофобная кислота могут образовывать гидрофобную ионную пару перед эмульгированием второй фазы. В других воплощениях терапевтическое средство и по существу гидрофобная кислота могут образовывать гидрофобную ионную пару во время эмульгирования второй фазы. Например, терапевтическое средство и по существу гидрофобную кислоту можно объединять во второй фазе по существу одновременно с эмульгированием второй фазы, например терапевтическое средство и по существу гидрофобную кислоту можно растворить в отдельных растворах (например, в двух по существу несмешиваемых растворов), которые впоследствии объединяют во время эмульгирования. В другом примере терапевтическое средство и по существу гидрофобную кислоту можно растворить в отдельных смешиваемых растворах, которые впоследствии подают во вторую фазу во время эмульгирования.
Для завершения экстракции растворителя и затвердевания частиц может потребоваться или выпаривание растворителя или разбавление. Для лучшего контроля за кинетикой экстракции и более масштабированного процесса можно использовать разбавление растворителя посредством водного гасителя. Например, эмульсию можно разбавить в холодной воде до концентрации, достаточной для растворения всего органического растворителя с образованием фазы гашения. В некоторых воплощениях гашение можно осуществлять по меньшей мере частично при температуре приблизительно 5°С или ниже. Например, вода или другой раствор гасителя, используемые при гашении, могут иметь температуру ниже комнатной температуры (например, от приблизительно 0 до приблизительно 10°С или от приблизительно 0 до приблизительно 5°С). Растворы также можно охлаждать во время гашения. В некоторых воплощениях может быть выбран гаситель, имеющий значение рН, которое является полезным для гашения эмульсионной фазы, например, в отношении улучшения свойств наночастиц, таких как профиль высвобождения, или улучшения параметра наночастицы, такого как содержание лекарственного вещества. рН гасителя можно регулировать, например, с помощью титрования кислотой или основанием или путем выбора подходящего буфера.
В некоторых воплощениях рН гасителя можно выбирать на основании pKa протонированного терапевтического средства и/или pKa гидрофобной кислоты. Например, в некоторых воплощениях терапевтическое средство, когда оно протонированное, может иметь первую pKa, гидрофобная кислота может иметь вторую pKa, а эмульсионную фазу можно гасить водным раствором, имеющим рН, равный числу единиц pKa между первой pKa и второй pKa. В некоторых воплощениях полученная в результате фаза гашения может также иметь рН, равный числу единиц pKa между первой pKa и второй pKa. В конкретном воплощении рН может быть равен числу единиц pKa, которое является приблизительно равноудаленным от первой pKa и второй pKa.
В некоторых воплощениях гаситель может иметь рН от приблизительно 2 до приблизительно 12, в некоторых воплощениях от приблизительно 3 до приблизительно 10, в некоторых воплощениях от приблизительно 3 до приблизительно 9, в некоторых воплощениях от приблизительно 3 до приблизительно 8, в некоторых воплощениях от приблизительно 3 до приблизительно 7, в некоторых воплощениях от приблизительно 4 до приблизительно 8, в некоторых воплощениях от приблизительно 4 до приблизительно 7, в некоторых воплощениях от приблизительно 4 до приблизительно 6, в некоторых воплощениях от приблизительно 4 до приблизительно 5, в некоторых воплощениях от приблизительно 4,2 до приблизительно 4,8, в некоторых воплощениях от приблизительно 6 до приблизительно 10, в некоторых воплощениях от приблизительно 6 до приблизительно 9, в некоторых воплощениях от приблизительно 6 до приблизительно 8, в некоторых воплощениях от приблизительно 6 до приблизительно 7. В некоторых воплощениях гаситель может иметь рН приблизительно 4,5. В других воплощениях гаситель может иметь рН приблизительно 6,5. Следует понимать, что рН буферного раствора может изменяться в зависимости от температуры. Если не указано иное, рН буферного раствора, на который ссылаются в настоящем описании, означает рН при 23°С.
В некоторых воплощениях гаситель может представлять собой водный раствор, содержащий буферный агент (буферный раствор). Можно использовать любой подходящий буферный агент. Неограничивающие примеры буферных агентов включают фосфат, цитрат, ацетат, борат, имидазол, MES (4-морфолинэтансульфоновую кислоту), бис-трис (бис(2-гидроксиэтил)амино-трис(гидроксиметил)метан), ADA (N-(2-ацетамидо)иминодиуксусную кислоту), ACES (N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту), PIPES (1,4-пиперазиндиэтансульфоновую кислоту), MOPSO (3-морфолино-2-гидроксипропансульфоновую кислоту), бис-трис-пропан (1,3-бис[трис(гидроксиметил)метиламино]пропан), BES (N,N-6nc(2-гидроксиэтил)-2-аминоэтансульфоновую кислоту), MOPS (3-(N-морфолино)пропансульфоновую кислоту), TES (2-[(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]этансульфоновую кислоту), HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту), DIPSO (3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновую кислоту), MOBS (4-(N-морфолино)бутансульфоновую кислоту), TAPSO (2-гидрокси-3-[трис(гидроксиметил)метиламино]-1-пропансульфоновую кислоту), Trizma (2-амино-2-(гидроксиметил)-1,3-пропандиол), HEPPSO (4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновую кислоту)), POPSO (пиперазин-N,N'-бис(2-гидроксипропансульфоновую кислоту)), TEA (триэтиламин), EPPS (4-(2-гидроксиэтил)-1-пиперазинпропансульфоновую кислоту), трицин (N-[трис(гидроксиметил)метил]глицин), Gly-Gly (диглицин), бицин (N,N-бис(2-гидроксиэтил)глицин), HEPBS (N-(2-гидроксиэтил)пиперазин-N'-(4-бутансульфоновую кислоту)), TAPS (N-[трис(гидроксиметил)метил]-3-аминопропансульфоновую кислоту), AMPD (2-амино-2-метил-1,3-пропандиол), TABS (N-трис(гидроксиметил)метил-4-аминобутансульфоновую кислоту), AMPSO (N-(1,1-диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновую кислоту), CHES (2-(циклогексиламино)этансульфоновую кислоту), CAPSO (3-(циклогексиламино)-2-гидрокси-1-пропансульфоновую кислоту), AMP (β-аминоизобутиловый спирт), CAPS (3-(циклогексиламино)-1-пропансульфоновую кислоту), CABS (4-(циклогексиламино)-1-бутансульфоновую кислоту) и их комбинации. Следует понимать, что буфер содержит кислоту и основание в равновесии (например, кислоту и сопряженное основание и/или основание и сопряженную кислоту). Таким образом, следует также понимать, что для краткости изложения в настоящем документе на буферный раствор или буферный агент можно ссылаться посредством названия свободной кислоты (например, фосфорная кислота) или ее сопряженного основания (например, фосфат) или посредством названия свободного основания (например, имидазол) или его сопряженной кислоты (например, имидазолий), при этом обычному специалисту в данной области техники должно быть понятно, что между двумя или более различными протонированными компонентами буферного агента (например, H3PO4, H2PO4-, HPO42- и PO43-) существует равновесие. В некоторых воплощениях гаситель может содержать два или более буферных агентов. Например, гаситель может содержать два, три, четыре или пять буферных агентов. В некоторых воплощениях гаситель может содержать смесь фосфата и цитрата. В других воплощениях гаситель может содержать смесь бората, фосфата и ацетата (например, буфер Бриттона-Робинсона, содержащий 0,04 М Н3ВО3, 0,04 М Н3РО4 и 0,04 М СН3СООН, титрованный до желаемого рН).
В некоторых воплощениях буферный раствор (гаситель) может иметь подходящую буферную емкость в пределах конкретного диапазона рН. Неограничивающие диапазоны рН для иллюстративных буферных растворов представлены в таблице А ниже. В некоторых воплощениях буферный раствор может иметь концентрацию буферного агента от приблизительно 0,001 М до приблизительно 1 М, в некоторых воплощениях от приблизительно 0,001 М до приблизительно 0,5 М, в некоторых воплощениях от приблизительно 0,01 М до приблизительно 0,5 М, в некоторых воплощениях от приблизительно 0,05 М до приблизительно 0,5 М, в некоторых воплощениях от приблизительно 0,1 М до приблизительно 0,5 М, в некоторых воплощениях от приблизительно 0,01 М до приблизительно 0,2 М, в некоторых воплощениях от приблизительно 0,05 М до приблизительно 0,15 М и в некоторых воплощениях от приблизительно 0,075 М до приблизительно 0,125 М.
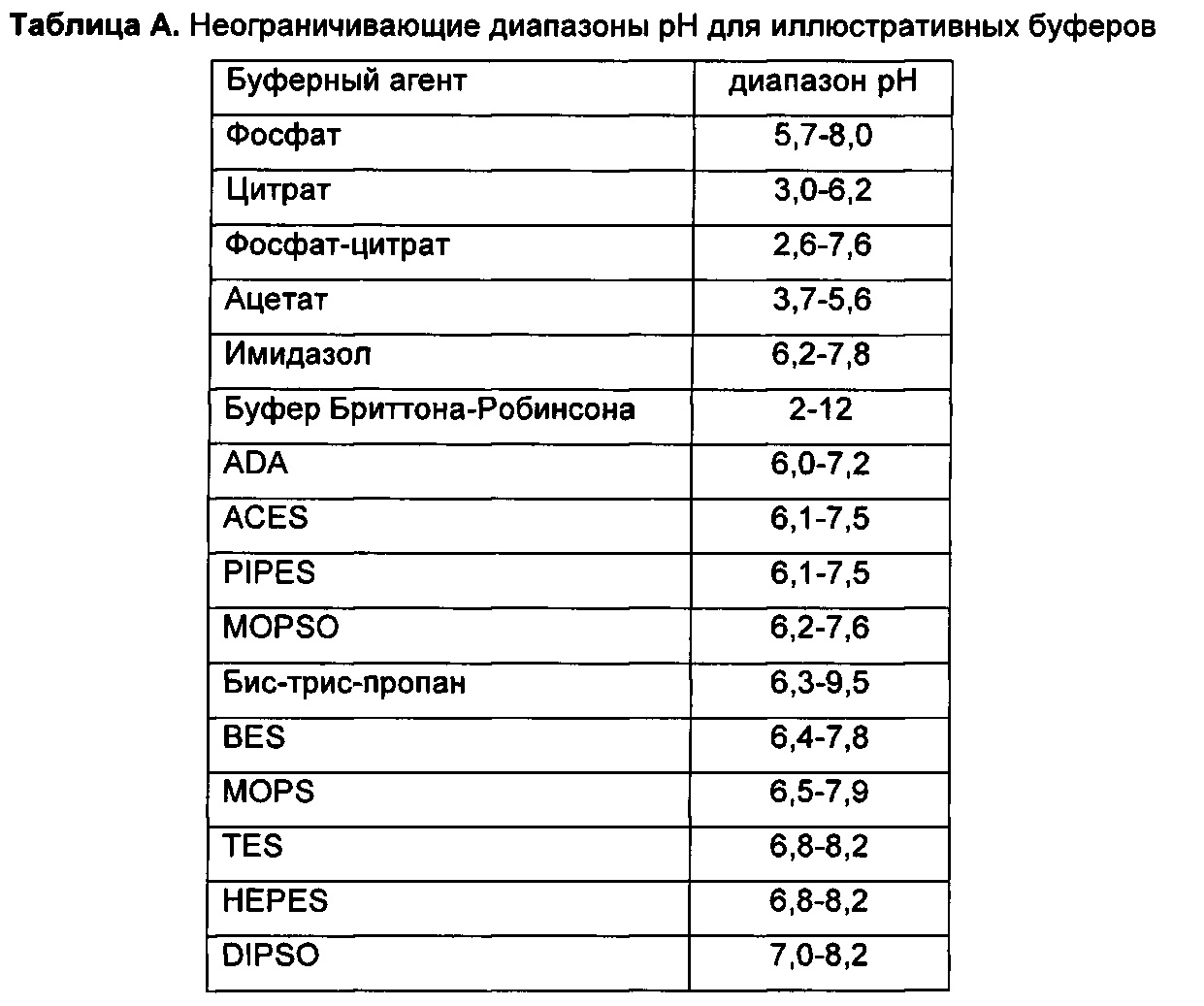

В некоторых воплощениях гаситель может иметь такую концентрацию буферного агента, которая достаточна для противодействия существенному изменению рН. Например, фаза гашения может иметь рН, отличающийся от рН эмульсионной фазы менее, чем на 1 единицу рН, в некоторых воплощениях менее, чем на 0,5 единицы рН, в некоторых воплощениях менее, чем на 0,2 единицы рН, в некоторых воплощениях менее, чем на 0,1 единицы рН и в некоторых воплощениях менее, чем на 0,05 единицы рН. В некоторых воплощениях рН фазы гашения может быть по существу таким же, как рН эмульсионной фазы (до гашения).
В некоторых воплощениях фаза гашения может иметь рН от приблизительно 2 до приблизительно 12, в некоторых воплощениях от приблизительно 3 до приблизительно 10, в некоторых воплощениях от приблизительно 3 до приблизительно 9, в некоторых воплощениях от приблизительно 3 до приблизительно 8, в некоторых воплощениях от приблизительно 3 до приблизительно 7, в некоторых воплощениях от приблизительно 4 до приблизительно 8, в некоторых воплощениях от приблизительно 4 до приблизительно 7, в некоторых воплощениях от приблизительно 4 до приблизительно 6, в некоторых воплощениях от приблизительно 4 до приблизительно 5, в некоторых воплощениях от приблизительно 4,2 до приблизительно 4,8, в некоторых воплощениях от приблизительно 6 до приблизительно 10, в некоторых воплощениях от приблизительно 6 до приблизительно 9, в некоторых воплощениях от приблизительно 6 до приблизительно 8, в некоторых воплощениях от приблизительно 6 до приблизительно 7. В некоторых воплощениях фаза гашения может иметь рН приблизительно 4,6.
Буферный раствор (например, гаситель), имеющий желаемый рН, может быть легко получен обычным специалистом в данной области техники. Например, буферный раствор, имеющий желаемый рН, может быть получен путем титрования раствора, содержащего буферный агент, сильной кислотой (например, HCl) или сильным основанием (например, NaOH). Альтернативно, буферный раствор, имеющий желаемый рН, может быть получен путем объединения слабой кислоты (например, лимонной кислоты) с ее сопряженным основанием (например, цитратом натрия) или путем объединения слабого основания (например, имидазола) с его сопряженной кислотой (например, хлоридом имидазолия). Обычный специалист в данной области техники может определить количества слабой кислоты или слабого основания и соответствующего сопряженного соединения для применения при приготовлении буферного раствора, используя уравнение Хендерсона-Хассельбаха.
В одном аспекте раствор гасителя представляет собой буферный раствор при рН 6,5 (такой как 0,17 М натрийфосфатный буфер). Для удобства раствор гасителя охлаждают до температуры менее 5°С перед добавлением к нему эмульсии. Для удобства смесь раствора гасителя и эмульсионного раствора охлаждают во время их смешивания вместе. В одном воплощении отношение раствора гасителя к эмульсии составляет 10:1 (по массе). В другом воплощении отношение раствора гасителя к эмульсии составляет 3:1. В данном аспекте и воплощениях удобно, чтобы гидрофобная кислота представляла собой памовую кислоту.
В некоторых воплощениях образование HIP может происходить во время или после эмульгирования, например вследствие равновесных условий в тонкодисперсной эмульсии. Не желая ограничиваться какой-либо теорией, полагают, что растворимые в органическом веществе противоионы (гидрофобная кислота) могут способствовать диффузии терапевтического средства в наночастицу эмульсии в результате образования HIP. Не желая ограничиваться какой-либо теорией, полагают, что HIP может оставаться в наночастице до затвердевания наночастицы, поскольку растворимость HIP в наночастице выше, чем растворимость HIP в водной фазе эмульсии и/или в гасителе. Например, путем выбора значения рН для гашения, находящегося между pKa терапевтического средства и pKa гидрофобной кислоты, можно оптимизировать образование ионизированного(й) терапевтического средства и гидрофобной кислоты. Однако выбор в качестве значения рН слишком высокого значения может привести к диффузии гидрофобной кислоты наружу из наночастицы, тогда как выбор в качестве значения рН слишком низкого значения, может привести к диффузии терапевтического средства наружу из наночастицы.
В некоторых воплощениях рН водного раствора, используемого в процессе приготовления наночастицы (например, включающего, без ограничения, водную фазу, эмульсионную фазу, гаситель и фазу гашения), может быть выбран независимо и может составлять от приблизительно 1 до приблизительно 3, в некоторых воплощениях от приблизительно 2 до приблизительно 4, в некоторых воплощениях от приблизительно 3 до приблизительно 5, в некоторых воплощениях от приблизительно 4 до приблизительно 6, в некоторых воплощениях от приблизительно 5 до приблизительно 7, в некоторых воплощениях от приблизительно 6 до приблизительно 8, в некоторых воплощениях от приблизительно 7 до приблизительно 9 и в некоторых воплощениях от приблизительно 8 до приблизительно 10. В некоторых воплощениях рН водного раствора, используемого в процессе приготовления наночастицы, может составлять от приблизительно 3 до приблизительно 4, в некоторых воплощениях от приблизительно 4 до приблизительно 5, в некоторых воплощениях от приблизительно 5 до приблизительно 6, в некоторых воплощениях от приблизительно 6 до приблизительно 7, в некоторых воплощениях от приблизительно 7 до приблизительно 8 и в некоторых воплощениях от приблизительно 8 до приблизительно 9.
Достигнутая эффективность инкапсуляции (процент активного ингредиента в наночастице по сравнению с общим количеством активного ингредиента в процессе) изменяется в зависимости от точных количеств используемых в процессе компонентов и конкретных параметров процесса. Высокая эффективность инкапсуляции более экономична. В некоторых воплощениях не все терапевтическое средство инкапсулируется в частицах на этой стадии, и к фазе гашения добавляют солюбилизатор лекарственного средства с образованием солюбилизированной фазы. Солюбилизатор лекарственного средства может представлять собой, например, Tween®80, Tween® 20, поливинилпирролидон, циклодекстран, додецилсульфат натрия, холат натрия, диэтилнитрозамин, ацетат натрия, мочевину, глицерин, пропиленгликоль, гликофурол, поли(этилен)гликоль, брис(полиоксиэтиленгликоль)додециловый эфир, бензоат натрия, салицилат натрия или их комбинации. Например, Tween®80 можно добавлять к погашенной суспензии наночастиц для солюбилизации свободного лекарственного средства и предотвращения образования кристаллов лекарственного средства. В некоторых воплощениях отношение солюбилизатора лекарственного средства к терапевтическому средству составляет от приблизительно 200:1 до приблизительно 10:1 или в некоторых воплощениях от приблизительно 100:1 до приблизительно 10:1 (по массе).
Солюбилизированную фазу можно фильтровать для извлечения наночастиц.
Например, для концентрирования суспензии наночастиц и устранения большей части посторонних веществ, таких как органический растворитель, свободное лекарственное средство (то есть неинкапсулированное терапевтическое средство), солюбилизатор лекарственного средства и другие технологические добавки (поверхностно-активные вещества), можно использовать ультрафильтрационные мембраны.
Типичное фильтрование можно осуществлять с использованием системы фильтрования с поперечным потоком или с тангенциальным потоком, при котором подачу выполняют через фильтрующую мембрану (тангенциально) при положительном давлении применительно к стороне пермеата. Часть постороннего вещества проходит через мембрану в виде пермеата или фильтрата; все остальное удерживается на стороне подачи на мембрану в виде ретентата. Например, наночастицы могут быть селективно отделены путем использования мембраны с размером пор, который является подходящим для удерживания наночастиц, однако при этом позволяет проходить растворенным веществам, мицеллам и органическому растворителю. Можно использовать примеры мембран с отсечением по молекулярной массе приблизительно 300-500 кДа (примерно 5-25 нм).
В некоторых воплощениях концентрацию постороннего вещества в ретентате можно уменьшить с помощью "вымывания" водой, то есть процесса, называемого диафильтрованием. Количество удаленного постороннего вещества зависит от объема образовавшегося фильтрата в сравнении с объемом ретентата. Объем образовавшегося фильтрата обычно обозначают терминами "объемы диафильтрования" или диаобъемы. Единичный диаобъем представляет собой объем ретентата в начале диафильтрования.
Диафильтрование можно осуществлять, используя методику постоянного объема, означающую, что диафильтрат (холодную деионизированную воду при температуре, например, от приблизительно 0 до приблизительно 5°С или от 0 до приблизительно 10°С) можно добавлять к подаваемой суспензии с той же скоростью, с которой фильтрат удаляется из суспензии. Когда объем собранного фильтрата становится равным исходному объему ретентата, тогда обработан 1 диаобъем.
В некоторых воплощениях фильтрование может включать первое фильтрование с использованием первой температуры от приблизительно 0 до приблизительно 5°С или от 0 до приблизительно 10°С и второй температуры от приблизительно 20 до приблизительно 30°С или от 15 до приблизительно 35°С. В некоторых воплощениях фильтрование может включать обработку от приблизительно 1 до приблизительно 30, в некоторых случаях от приблизительно 1 до приблизительно 15 или в некоторых случаях от 1 до приблизительно 6 диаобъемов. Например, фильтрование может включать обработку от приблизительно 1 до приблизительно 30 или в некоторых случаях от приблизительно 1 до приблизительно 6 диаобъемов при температуре от приблизительно 0 до приблизительно 5°С и обработку по меньшей мере одного диаобъема (например, от приблизительно 1 до приблизительно 15, от приблизительно 1 до приблизительно 3 или от приблизительно 1 до приблизительно 2 диаобъемов) при температуре от приблизительно 20 до приблизительно 30°С. В некоторых воплощениях фильтрование включает обработку разных диаобъемов при разных четко выраженных температурах.
В одном воплощении используют приблизительно 20 диаобъемов холодной деионизированной воды. В другом воплощении используют приблизительно 20 диаобъемов деионизированной воды при температуре окружающей среды.
После очистки и концентрирования суспензии наночастиц частицы можно пропускать через один, два или более стерилизующих и/или пористых фильтров, например, используя пористый фильтр предварительной очистки примерно 0,2 мкм. Например, стадия стерильного фильтрования может включать фильтрование терапевтических наночастиц с использованием фильтровальной технологической линии с контролируемой скоростью. В некоторых воплощениях фильтровальная технологическая линия может включать пористый фильтр и стерильный фильтр.
В другом воплощении получения наночастиц формируют органическую фазу, состоящую из смеси терапевтического средства (AZD1152 hqpa) и полимера (гомополимера и сополимера). Органическую фазу смешивают с водной фазой в соотношении приблизительно 1:5 (органическая фаза: водная фаза), где водная фаза состоит из поверхностно-активного вещества и некоторого количества растворенного растворителя. Первичную эмульсию формируют путем объединения двух фаз при простом перемешивании или с помощью использования роторно-статорного гомогенизатора. Затем первичную эмульсию формируют в тонкодисперсную эмульсию путем использования гомогенизатора высокого давления. Затем тонкодисперсную эмульсию гасят путем добавления к деионизированной воде при перемешивании. В некоторых воплощениях отношение гаситель : эмульсия может составлять от приблизительно 2:1 до приблизительно 40:1 или в некоторых воплощениях от приблизительно 5:1 до приблизительно 15:1. В некоторых воплощениях отношение гаситель: эмульсия составляет приблизительно 8,5:1. Затем к гасителю добавляют раствор Tween® (например, Tween®80) до достижения общего содержания 2% Tween®. Это помогает растворить свободное, неинкапсулированное терапевтическое средство (то есть, AZD1152 hqpa). Затем наночастицы выделяют либо путем центрифугирования, либо путем ультрафильтрования/диафильтрования.
Должно быть понятно, что количества полимера, терапевтического средства (то есть, AZD1152 hqpa) и гидрофобной кислоты, используемые при получении препарата, могут отличаться от количеств в конечном препарате. Например, некоторое количество AZD1152 hqpa может не полностью включиться в наночастицу, и такое свободное лекарственное средство AZD1152 hqpa можно, например, отфильтровать. Например, в одном из воплощений при получении препарата можно использовать первый органический раствор, содержащий приблизительно 11 массовых процентов от теоретического количества лекарственного средства AZD1152 hqpa в первом органическим растворе, содержащем приблизительно 9% первой гидрофобной кислоты (например, жирной кислоты), второй органический раствор, содержащий приблизительно 89 массовых процентов полимера (например, полимер может включать PLA-PEG), и водный раствор, содержащий приблизительно 0,12% второй гидрофобной кислоты (например, желчной кислоты), что приводит к получению в результате, например, конечной наночастицы, содержащей приблизительно 2 массовых процента AZD1152 hqpa, приблизительно 97,5 массовых процента полимера и приблизительно 0,5% общего количества гидрофобной кислоты. Такими способами могут быть получены конечные наночастицы, подходящие для введения пациенту, включающие от приблизительно 1 до приблизительно 20 процентов по массе AZD1152 hqpa, например приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 8, приблизительно 10 или приблизительно 15 процентов AZD1152 hqpa по массе.
Кроме того, понятно, что продукт, образующийся в результате способов, в которых используют гидрофобные кислоты, такие как трифторуксусная кислота (смотри, например, пример 3), могут подвергаться ионному обмену с гидрофобными кислотами из солей, таких как холат натрия, первоначально используемых в качестве поверхностно-активных веществ в водной фазе. Например, холевая кислота может задерживаться в качестве гидрофобной кислоты в наночастицах после использования трифторуксусной кислоты и холата натрия при обработке, как показано в примере 3.
В некоторых воплощениях гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 2 до приблизительно 8, таким как от приблизительно 4 до приблизительно 7.
В другом аспекте предложен способ получения терапевтической наночастицы. Этот способ включает объединение первой органической фазы с первым водным раствором с образованием второй фазы; эмульгирование второй фазы с образованием эмульсионной фазы, где эмульсионная фаза содержит первый полимер, основное терапевтическое средство, представляющее собой AZD1152 hqpa, и по существу гидрофобную кислоту; гашение эмульсионной фазы с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
В некоторых воплощениях способ дополнительно включает фильтрование фазы гашения для извлечения терапевтических наночастиц.
В некоторых воплощениях способ дополнительно включает объединение AZD1152 hqpa и кислоты во второй фазе перед эмульгированием второй фазы. Например, в некоторых воплощениях AZD1152 hqpa и кислота образуют гидрофобную ионную пару перед эмульгированием второй фазы. В других воплощениях AZD1152 hqpa и кислота образуют гидрофобную ионную пару во время эмульгирования второй фазы.
В некоторых воплощениях способ дополнительно включает объединение AZD1152 hqpa и кислоты во второй фазе по существу одновременно с эмульгированием второй фазы. Например, в некоторых воплощениях первая органическая фаза содержит AZD1152 hqpa, а первый водный раствор содержит кислоту.
В других воплощениях первая органическая фаза содержит полимер, AZD1152 hqpa и по существу гидрофобную кислоту.
В одном аспекте предложен способ получения терапевтической наночастицы, включающий объединение первой органической фазы с первым водным раствором с образованием второй фазы; эмульгирование второй фазы с образованием эмульсионной фазы, где эмульсионная фаза содержит первый полимер, основное терапевтическое средство, представляющее собой AZD1152 hqpa, и памовую кислоту; гашение эмульсионной фазы с образованием фазы гашения. В этом аспекте гашение эмульсионной фазы предпочтительно включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий объединение первой органической фазы с первым водным раствором с образованием второй фазы; эмульгирование второй фазы с образованием эмульсионной фазы, где эмульсионная фаза содержит первый полимер, основное терапевтическое средство, представляющее собой AZD1152 hqpa, и по существу гидрофобную кислоту, выбранную из дезоксихолевой кислоты и диоктилсульфоянтарной кислоты; гашение эмульсионной фазы с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
Для удобства эмульсионную фазу выдерживают, например путем хранения во льду в течение периода (такого как от 5 до 15 минут), предшествующего гашению. В некоторых аспектах, как описано выше, получение эмульсии осуществляют в двухстадийном процессе с образованием крупнодисперсной эмульсии, предшествующим образованию тонкодисперсной эмульсии. В некоторых воплощениях формируют крупнодисперсную эмульсию, и эту эмульсию можно для удобства выдерживать, например, путем хранения во льду в течение периода (такого как от 5 до 15 минут), предшествующего образованию тонкодисперсной эмульсии. Саму тонкодисперсную эмульсию также можно хранить, например, при температуре 0-5°С, в некоторых воплощениях при приблизительно 2°С, в течение периода 1-15 минут (в некоторых воплощениях в течение приблизительно 1 минуты, в других воплощениях в течение приблизительно 2 минут, в других воплощениях в течение не более 1 минуты, в других воплощениях в течение по меньшей мере 5 минут) до гашения.
Удобно осуществлять гашение при пониженной температуре, например, при менее 5°С.
Целесообразно, чтобы в описанных выше аспектах и воплощении первая водная фаза содержала поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий объединение первой органической фазы с первым водным раствором с образованием второй фазы; эмульгирование второй фазы с образованием эмульсионной фазы, где эмульсионная фаза содержит первый полимер, основное терапевтическое средство, представляющее собой AZD1152 hqpa, и по существу гидрофобную кислоту, выбранную из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты; возможно, выдерживание эмульсионной фазы в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С); гашение эмульсионной фазы с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5), предпочтительно при менее 5°С. Удобно, когда первая водная фаза содержит поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в одном или более чем одном растворителе) с первым водным раствором (содержащим поверхностно-активное вещество в воде) с образованием второй фазы;
2) эмульгирование второй фазы с образованием эмульсии;
3) возможно, выдерживание эмульсионной фазы в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С);
4) гашение эмульсионной фазы при температуре ниже 5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
5) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда первая водная фаза содержит поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в одном или более чем одном растворителе) с первым водным раствором (содержащим поверхностно-активное вещество в воде) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при температуре ниже 5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда первая водная фаза содержит поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA (трифторуксусная кислота)/вода/бензиловый спирт и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием эмульсии;
3) возможно, выдерживание эмульсионной фазы в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С);
4) гашение эмульсионной фазы при температуре ниже 5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
5) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween® 80 в воде.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween® 80 в воде.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и памовую кислоту в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween® 80 в воде.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении от 1:3 до 1:4) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween® 80 в воде.
В дополнительном аспекте, предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и памовую кислоту в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН 6,5;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе от приблизительно 20:1 до 100:1;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении от 1:3 до 1:4) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора к раствору гашения;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где отношение водной фазы к органической фазе составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5, где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества к гасителю;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут, например, 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении приблизительно 1 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), и где соотношение второго водного раствора и эмульсии составляет приблизительно 10:1;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе приблизительно 100:1;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении приблизительно 1 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложен способ получения терапевтической наночастицы, включающий:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3, а памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 1 моль памовой кислоты: 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5, и где соотношение второго водного раствора и эмульсии составляет приблизительно 10:1;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе приблизительно 100:1;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительных аспектах предложен способ получения терапевтической наночастицы, включающий любой из конкретных способов, изложенных в приведенных примерах.
В некоторых воплощениях AZD1152 hqpa, являясь протонированным, имеет первую pKa, кислота имеет вторую pKa, и эмульсионную фазу гасят водным раствором, имеющим рН, равный числу единиц pKa между первой pKa и второй pKa. Например, в некоторых случаях фаза гашения имеет рН, равный числу единиц pKa между первой pKa и второй pKa. В некоторых воплощениях AZD1152 hqpa, являясь протонированным, имеет первую pKa, кислота имеет вторую pKa, и первый водный раствор имеет рН, равный числу единиц pKa между первой pKa и второй pKa. В некоторых воплощениях рН (например, фазы гашения или первого водного раствора) равен числу единиц pKa, которое является приблизительно равноудаленным от первой pKa и второй pKa.
В другом аспекте предложена терапевтическая наночастица. Терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и по существу гидрофобную кислоту, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц.
В другом аспекте предложена терапевтическая наночастица, где терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и по существу гидрофобную кислоту, выбранную из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц.
Еще в одном другом аспекте предложена терапевтическая наночастица, где терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и памовую кислоту, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц.
В некоторых воплощениях гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 2 до приблизительно 8, такой как приблизительно от рН 4 до 7. Предпочтительно гашение при пониженной температуре, такой как менее 5°С.
Еще в одном другом аспекте предложена терапевтическая наночастица, где терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и по существу гидрофобную кислоту, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц, где гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
Еще в одном другом аспекте предложена терапевтическая наночастица, где терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и по существу гидрофобную кислоту, выбранную из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц, где гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
Еще в одном другом аспекте предложена терапевтическая наночастица, где терапевтическую наночастицу получают путем эмульгирования смеси, содержащей первый полимер, AZD1152 hqpa и памовую кислоту, с образованием эмульсионной фазы и гашения эмульсионной фазы с образованием фазы гашения, содержащей множество терапевтических наночастиц, где гашение эмульсионной фазы включает смешивание эмульсионной фазы с водным раствором, имеющим рН от приблизительно 4 до приблизительно 7.
В некоторых воплощениях рН рассматриваемого водного раствора (например, первого или второго водного раствора составляет от приблизительно 4 до приблизительно 7, например от приблизительно 4 до приблизительно 5 или от приблизительно 6 до приблизительно 7).
В некоторых воплощениях рассматриваемый водный раствор содержит фосфат, цитрат или смесь фосфата и цитрата. В некоторых воплощениях второй водный раствор содержит смесь бората, фосфата и ацетата.
В некоторых воплощениях рассматриваемый способ получения терапевтической наночастицы дополнительно включает фильтрование фазы гашения с извлечением терапевтических наночастиц.
В некоторых воплощениях фаза гашения имеет по существу такое же значение рН, как эмульсионная фаза. В некоторых воплощениях фаза гашения имеет рН от приблизительно 4 до приблизительно 7, например от приблизительно 4 до приблизительно 5 или от приблизительно 6 до приблизительно 7.
В другом аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в одном или более чем одном растворителе) с первым водным раствором (содержащим поверхностно-активное вещество в воде) с образованием второй фазы;
2) эмульгирование второй фазы с образованием эмульсии;
3) возможно, выдерживание эмульсионной фазы в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С);
4) гашение эмульсионной фазы при температуре ниже 5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
5) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда первая водная фаза содержит поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в одном или более чем одном растворителе) с первым водным раствором (содержащим поверхностно-активное вещество в воде) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда первая водная фаза содержит поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте.
В другом аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием эмульсии;
3) возможно, выдерживание эмульсионной фазы в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С);
4) гашение эмульсионной фазы при температуре ниже 5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
5) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween® 80 в воде.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и фазу по существу гидрофобной кислоты, выбранной из дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты, в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, имеющим рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween®80 в воде.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и памовую кислоту в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как холат натрия или полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween®80 в воде.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении от 1:3 до 1:4) с первым водным раствором (содержащим поверхностно-активное вещество, такой как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН от приблизительно 4 до приблизительно 7 (такой как рН приблизительно 6,5);
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В раствор гашения перед концентрированием и фильтрованием может быть добавлено дополнительное поверхностно-активное вещество, такое как Tween®80 в воде.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер в этилацетате, AZD1152 hqpa в системе растворителей TFA/вода/бензиловый спирт и памовую кислоту в DMSO) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер, имеющий рН 6,5;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас./мас.) раствора Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе приблизительно от 20:1 до 100:1;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложена терапевтическая наночастица, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей полимер, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении от 1:3 до 1:4) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 5 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора к раствору гашения;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G1, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G1, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим поверхностно-активное вещество, такое как полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
7) добавление водного раствора поверхностно-активного вещества в качестве солюбилизатора;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G1, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5, где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества к гасителю;
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G1, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного раствора (мас./мас.) Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G2, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного раствора (мас./мас.) Tween®80 в воде) к раствору гасителя;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении приблизительно 1 моль памовой кислоты : 1 моль AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G2, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), и где соотношение второго водного раствора и эмульсии составляет приблизительно 10:1;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного раствора (мас./мас.) Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе приблизительно 100:1;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении приблизительно 1 моль памовой кислоты: 1 моль AZD1152 hqpa.
В дополнительном аспекте предложена терапевтическая наночастица, описанная в настоящем документе в качестве препарата G2, где терапевтическая наночастица получена способом получения, включающим:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 1 моль памовой кислоты: 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) приблизительно через 1 минуту гашение эмульсионной фазы при приблизительно 2°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5, и где соотношение второго водного раствора и эмульсии составляет приблизительно 10:1;
6) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного раствора (мас./мас.) Tween®80 в воде) к гасителю при соотношении Tween®80 к лекарственному средству по массе приблизительно 100:1;
7) концентрирование и выделение полученных наночастиц путем фильтрования.
В одном аспекте конечные наночастицы включают от приблизительно 5 до приблизительно 20% по массе AZD1152 hqpa, например от приблизительно 8 до приблизительно 20% по массе, например от приблизительно 10 до приблизительно 20% по массе, например от приблизительно 10 до приблизительно 15% по массе, например от приблизительно 10 до приблизительно 16% по массе, например от приблизительно 12 до приблизительно 16% по массе, например от приблизительно 15 до приблизительно 20% по массе, например от приблизительно 15 до приблизительно 18% по массе. В одном аспекте конечные наночастицы включают от приблизительно 10 до приблизительно 20% по массе AZD1152 hqpa. В дополнительном аспекте конечные наночастицы включают от приблизительно 15 до приблизительно 20% по массе AZD1152 hqpa. В дополнительном аспекте конечные наночастицы включают от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa.
В дополнительном аспекте изобретения предложены конечные наночастицы, содержащие приблизительно 10-16% по массе AZD1152 hqpa, от приблизительно 50 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет сред нечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты и диоктилсульфоянтарной кислоты. В одном воплощении этого аспекта гидрофобная кислота выбрана из дезоксихолевой кислоты и диоктилсульфоянтарной кислоты. В другом воплощении этого аспекта гидрофобная кислота представляет собой дезоксихолевую кислоту. В еще одном воплощении этого аспекта гидрофобная кислота представляет собой диоктилсульфоянтарную кислоту. В еще одном воплощении этого аспекта гидрофобная кислота представляет собой холевую кислоту. В еще одном воплощении этого аспекта гидрофобная кислота представляет собой смесь холевой кислоты и дезоксихолевой кислоты; в этом воплощении удобно, когда гидрофобные кислоты находятся в молярном соотношении дезоксихолевая кислота: холевая кислота приблизительно 3:2, а молярное соотношение суммарная гидрофобная кислота: AZD1152 hqpa составляет приблизительно 2:1.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 10-20% по массе AZD1152 hqpa, от приблизительно 50 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В другом аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В еще одном аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В еще одном аспекте терапевтическая наночастица содержит от приблизительно 65 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 15 по массе процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В еще одном аспекте терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В еще одном аспекте терапевтическая наночастица содержит от приблизительно 55 до приблизительно 80 массовых процентов диблок-сополимера поли(молочная) кислота-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 10 до приблизительно 20 массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В еще одном аспекте терапевтическая наночастица содержит от приблизительно 65 до приблизительно 76 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, имеющего среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 20 массовых процентов поли(этилен)гликоля, от приблизительно 9 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 10-20 массовых процентов AZD1152 hqpa, от приблизительно 50 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и памовую кислоту.
Дополнительные аспекты изобретения включают каждый из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2. Кроме того, дополнительные аспекты изобретения включают каждый из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1% по массе (и также соответственно изменяется количество полимера). Кроме того, дополнительные аспекты изобретения включают каждый из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1,5% по массе (и также соответственно изменяется количество полимера). Кроме того, дополнительные аспекты изобретения включают каждый из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-2% по массе (и также соответственно изменяется количество полимера).
В одном аспекте рассматриваемые наночастицы имеют гидродинамический диаметр менее 200 нм, такой как 70-140 нм.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-25 массовых процентов AZD1152 hqpa, приблизительно от 7 до 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля и поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочная кислота) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, от приблизительно 7 до 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 7 до 10 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. В другом воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 40 часов в PBS и полисорбате 20 при 37°С. В еще одном воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 50 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы можно легко измерить, используя описанный в настоящем документе выше способ.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 7 до 10 массовых процентов памовой кислоты, где AZD1152 hqpa и памовая кислота образуют гидрофобную ионную пару, и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. В другом воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 40 часов в PBS и полисорбате 20 при 37°С. В еще одном воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 50 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы можно легко измерить, используя описанный в настоящем документе выше способ.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 7 до 10 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота) поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С, и где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В дополнительном аспекте изобретения предложены наночастицы, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 7 до 10 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100), в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства при приблизительно 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В одном аспекте предложены терапевтические наночастицы, описанные в настоящем документе в качестве препарата G1, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 7 до 10 массовых процентов памовой кислоты и диблок-сополимер поли(молочная) кислота-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная) кислота-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В другом аспекте предложены терапевтические наночастицы, описанные в настоящем документе в качестве препарата G2, содержащие приблизительно 15-22 массовых процентов AZD1152 hqpa, приблизительно от 9 до 13 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
Фармацевтические препараты
Согласно другому аспекту, раскрытые в настоящем документе наночастицы можно объединять с фармацевтически приемлемыми носителями с образованием фармацевтической композиции. Как должно быть понятно специалистам в данной области техники, носители могут быть выбраны на основании пути введения, как он описан ниже, расположения желаемой мишени, доставляемого лекарственного средства, периода доставки лекарственного средства и тому подобного.
В еще одном аспекте предложена фармацевтически приемлемая композиция. Фармацевтически приемлемая композиция содержит множество рассматриваемых терапевтических наночастиц и фармацевтически приемлемый носитель. Фармацевтически приемлемая композиция также может содержать один или более эксципиентов и/или разбавителей. В одном из воплощений этого аспекта фармацевтическая композиция содержит множество терапевтических наночастиц, где наночастицы содержат приблизительно 10-20% по массе AZD1152 hqpa, приблизительно от 50 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную кислоту, выбранную из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa и возможно дополнительно содержит гидрофобную кислоту.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, подходящий полимер и возможно дополнительно содержит гидрофобную кислоту.
В еще одном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где наночастицы содержат AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля), и гидрофобная кислота выбрана из холевой кислоты, дезоксихолевой кислоты, памовой кислоты и диоктилсульфоянтарной кислоты.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa и дополнительно содержит гидрофобную кислоту. В этих аспектах удобно, когда гидрофобная кислота выбрана из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; для удобства гидрофобная кислота может представлять собой смесь дезоксихолевой кислоты и холевой кислоты.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 55 до приблизительно 80 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 10 до приблизительно 20 массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
В дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 76 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 20 массовых процентов поли(этилен)гликоля, от приблизительно 9 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
Для описанных выше фармацевтических композиций удобно, чтобы сополимер имел среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
Дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2. Кроме того, дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1% по массе (и также соответственно изменяется количество полимера). Кроме того, дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1,5% по массе (и также соответственно меняется количество полимера) по сравнению с описанными в примерах. Кроме того, дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/- 2% по массе (и также соответственно меняется количество полимера) по сравнению с описанными в примерах. Кроме того, дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa изменяется на вплоть до приблизительно +/-3% по массе, количество гидрофобной кислоты изменяется в пропорции к количеству AZD1152 hqpa, соответствующей пропорциям в препаратах, примеры которых приведены в настоящем документе, и соответственно изменяется количество полимера.
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 25% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и от приблизительно 63 до приблизительно 78 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и смесь от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе памовой кислоты.
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе памовой кислоты.
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22% по массе (от массы наночастицы) AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе (от массы наночастицы) памовой кислоты.
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. В другом воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 40 часов в PBS и полисорбате 20 при 37°С. В еще одном воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 50 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы легко измеряют, используя описанный в настоящем документе выше способ.
В дополнительном аспекте предложена фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С, и где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты: 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100) в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства приблизительно при 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда наночастицы в описанных выше фармацевтических композициях имеют гидродинамический диаметр менее 200 нм, такой как 70-140 нм.
Фармацевтические композиции можно вводить пациенту любыми способами, известными в данной области техники, включая пероральный и парентеральный пути. Термин "пациент" при использовании в настоящем документе относится как к людям, так и к животным, не являющимся людьми, включающим, например, млекопитающих, птиц, рептилий, амфибий и рыб. Например, животные, не являющие людьми, могут представлять собой млекопитающих (например, грызуна, мышь, крысу, кролика, обезьяну, собаку, кошку, примата или свинью). В некоторых воплощениях желательны парентеральные пути, поскольку они позволяют избежать контакта с пищеварительными ферментами, обнаруживаемыми в пищеварительном тракте. В соответствии с такими воплощениями композиции по изобретению можно вводить путем инъекции (например, внутривенной, подкожной или внутримышечной, интраперитонеальной инъекции), ректально, вагинально, местно (например, в виде порошков, кремов, мазей или капель) или путем ингаляции (например, в виде спреев).
В конкретном воплощении наночастицы вводят субъекту, нуждающемуся в этом, системно, например, путем IV (внутривенной) инфузии или инъекции.
Инъекционные препараты, например, стерильные инъекционные водные или масляные суспензии можно готовить в соответствии с известными способами в данной области техники, используя подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно применять, находятся вода, раствор Рингера Фарм. США и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно применяют стерильные нелетучие масла. Для этой цели можно применять любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, при получении инъекционных препаратов применяют жирные кислоты, такие как олеиновая кислота. В одном воплощении конъюгат по изобретению суспендируют в текучей среде-носителе, содержащей 1% (мас./об.) натрийкарбоксиметилцеллюлозы и 0,1% (об./об.) TWEEN™ 80. Инъекционные препараты можно стерилизовать, например, фильтрованием через фильтр, задерживающий бактерии, или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъекционной среде перед применением.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах инкапсулированный или некапсулированный конъюгат смешивают с по меньшей мере одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат и/или (а) наполнители или объемообразующие агенты, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (б) связывающие вещества, такие как, например, карбоксиметилцеллюлоза, альгинат, желатин, поливинилпирролидон, сахароза и аравийская камедь, (в) смачивающие средства, такие как глицерин, (г) разрыхлители, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, (е) добавки для замедления растворения, такие как парафин, (f) ускорители абсорбции, такие как соединения четвертичного аммония, (д) увлажняющие агенты, такие как, например, цетиловый спирт и глицерилмоностеарат, (h) абсорбенты, такие как каолин и бентонитовая глина, и (i) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль дозируемая форма может также содержать буферные агенты.
Должно быть понятно, что точную дозу наночастицы, содержащей терапевтическое средство, индивидуальный врач выбирает в свете пациента, подлежащего лечению, как правило, дозу и введение регулируют, чтобы обеспечить эффективное количество терапевтической наночастицы пациенту, подлежащему лечению. При использовании в настоящем документе "эффективное количество" наночастицы, содержащей терапевтическое средство, относится к количеству, необходимому, чтобы вызвать желаемый биологический ответ. Как должно быть понятно обычному специалисту в данной области техники, эффективное количество наночастицы, содержащей терапевтическое средство, может изменяться в зависимости от таких факторов, как желаемый биологический результат, доставляемое лекарственное средство, ткань-мишень, путь введения и так далее. Например, эффективное количество наночастицы, содержащей терапевтическое средство, может представлять собой количество, приводящее в результате к желаемому количественному уменьшению размера опухоли в течение желаемого периода времени. Дополнительные факторы, которые можно принимать во внимание, включают тяжесть болезненного состояния; возраст, массу и пол пациента, подлежащего лечению; рацион питания, время и частоту введения; комбинации лекарственных средств; чувствительности реакции и толерантность/ответ на терапию.
Для простоты введения и однородности дозирования наночастицы можно включать в единичную дозированную форму. Выражение "единичная дозированная форма" при использовании в настоящем документе относится к физически дискретной единице наночастиц, подходящей для пациента, подлежащего лечению. Тем не менее понятно, что решение о суммарном суточном применении композиций будет принято лечащим врачом в пределах объема тщательной медицинской оценки. Для любой наночастицы терапевтически эффективную дозу можно первоначально оценивать либо в анализах на культуре клеток, либо в моделях на животных, обычно мышей, крыс, кроликов, собак или свиней. Модель на животных часто используют для достижения желаемого диапазона концентраций и пути введения. Затем такую информацию можно использовать, чтобы определить полезные дозы и пути для введения людям. Терапевтическую эффективность и токсичность наночастиц можно определить с помощью стандартных фармацевтических методик на культурах клеток или подопытных животных, например, ED50 (доза терапевтически эффективна в 50% популяции) и LD50 (доза летальна для 50% популяции). Соотношение дозы, вызывающей токсический и терапевтический эффект, представляет собой терапевтический индекс и может быть выражено в виде отношения LD50/ED50. Фармацевтические композиции, проявляющие высокие терапевтические индексы, могут быть полезны в некоторых воплощениях. Данные, полученные из анализов на клеточных культурах и исследований на животных, можно использовать при составлении диапазона дозы для медицинского применения.
В одном аспекте фармацевтический препарат, включающий наночастицы, содержащие AZD1152 hqpa, разработан таким образом, что высвобождает AZD1152 hqpa медленно в течение нескольких суток. Например, фармацевтический препарат может быть таким, что дозу вводят пациенту (например) на сутки 1 и 3, сутки 1 и 5 или сутки 1 и 7 семидневного цикла лечения. Цикл можно повторять каждую неделю, каждые две недели или каждые три недели в ежемесячном или двухмесячном цикле лечения. Таким образом, вычисляют количество лекарственного средства, которое следует вводить при каждом посещении с целью достижения общего воздействия конкретного лекарственного вещества на протяжении схемы лечения. Преимущественно препараты, содержащие наночастицу, могут уменьшать время, необходимое для введения лекарственного средства пациенту при каждой дозе, и могут уменьшать число посещений больницы пациентом по сравнению с известными ранее способами введения AZD1152.
Целесообразно, чтобы при введении человеку доза AZD1152 hqpa, доставляемая препаратом по изобретению в виде наночастиц, могла находиться в диапазоне от 100 мг до 2000 мг. Точная суммарная доза, которую необходимо вводить, будет определяться оптимальным фармакокинетическим профилем и профилем безопасности для пациента и типом опухоли, подлежащим лечению, для доставки, например, по схемам, описанным выше.
В одном из воплощений композиции, раскрытые в настоящем документе, могут включать менее чем приблизительно 10 млн-1 палладия, либо менее чем приблизительно 8 млн-1, либо менее чем приблизительно 6 млн-1 палладия. Например, в настоящем документе предложена композиция, включающая наночастицы, где композиция содержит менее чем приблизительно 10 млн-1 палладия.
В некоторых воплощениях рассмотрена композиция, подходящая для замораживания, включающая наночастицы, раскрытые в настоящем документе, и раствор, подходящий для замораживания, например, раствор сахара, такого как моно-, ди- или полисахарид, например, сахароза и/или трегалоза, и/или соли и/или циклодекстрина, добавляют к суспензии наночастиц. Сахар (например, сахароза или трегалоза) может действовать, например, в качестве криопротектора, чтобы предотвращать агрегацию частиц при замораживании. Например, в настоящем документе предложен препарат в виде наночастиц, содержащий множество описанных наночастиц, сахарозу, галогенид иона и воду; где соотношение наночастицы/сахароза/вода/галогенид иона составляет приблизительно 3-40%/10-40%/20-95%/0,1-10% (мас./мас./мас./мас.) или приблизительно 5-10%/10-15%/80-90%/1-10% (мас./мас./мас./масс). Например, такой раствор может включать наночастицы, как описано в настоящем документе, от приблизительно 5% до приблизительно 20% по массе сахарозы, и галогенид ион, такой как хлорид натрия, в концентрации от приблизительно 10 до приблизительно 100 мМ. В другом примере в настоящем документе предложен препарат в виде наночастиц, содержащий множество раскрытых наночастиц, трегалозу, циклодекстрин и воду; где соотношение наночастицы/трегалоза/вода/циклодекстрин составляет приблизительно 3-40%/1-25%/20-95%/1-25% (мас./мас./мас./мас.) или приблизительно 5-10%/1-25%/80-90%/10-15% (мас./мас./мас./масс).
Например, рассматриваемый раствор может включать наночастицы, как описано в настоящем документе, от приблизительно 1% до приблизительно 25% по массе дисахарида, такого как трегалоза или сахароза (например, от приблизительно 5% до приблизительно 25% трегалозы или сахарозы, например, приблизительно 10% трегалозы или сахарозы или приблизительно 15% трегалозы или сахарозы, например, приблизительно 5% сахарозы) по массе) и циклодекстрин, такой как β-циклодекстрин, в концентрации от приблизительно 1% до приблизительно 25% по массе (например, от приблизительно 5% до приблизительно 20%, например, 10% или приблизительно 20% по массе, или от приблизительно 15% до приблизительно 20% по массе циклодекстрина). Рассматриваемые препараты могут включать множество раскрытых наночастиц (например, наночастиц, содержащих PLA-PEG и активный агент) и от приблизительно 2% до приблизительно 15 мас. % (или от приблизительно 4 мас. % до приблизительно 6 мас. %, например, приблизительно 5 мас. %) сахарозы и от приблизительно 5 мас. % до приблизительно 20 мас. % (например, от приблизительно 7 мас. % до приблизительно 12 мас. %, например, приблизительно 10 мас. %) циклодекстрина, например, HPbCD).
Настоящее описание отчасти относится к лиофилизированным фармацевтическим композициям, которые при разведении имеют минимальное количество крупных агрегатов. Такие крупные агрегаты могут иметь размер более чем приблизительно 0,5 мкм, более чем приблизительно 1 мкм или более чем приблизительно 10 мкм и могут быть нежелательными в разведенном растворе. Размеры агрегатов можно измерять, используя разнообразные методы, включая методы, указанные в фармакопее США 32<788>, включенной в настоящее описание посредством ссылки. Тесты, описанные в Фарм. США 32<788>, включают подсчет количества частиц в режиме светотени, подсчет количества частиц под микроскопом, лазерную дифракцию и оптическое зондирование одиночных частиц. В одном воплощении размер частиц в данном образце измеряют с использованием лазерной дифракции и/или оптического зондирования одиночных частиц.
В Фарм. США 32<788> приведены нормативы по отбору образцов на измерение размеров частиц в суспензии методом подсчета количества частиц в режиме светотени. Для растворов, имеющих объем, меньший или равный 100 мл, препарат соответствует критериям теста, если среднее число присутствующих частиц не превышает 6000 на контейнер, имеющих размер не менее 10 мкм, и 600 на контейнер частиц, имеющих размер не менее 25 мкм.
Согласно нормативам, приведенным в Фарм. США 32<788> по подсчету количества частиц под микроскопом, для определения количества частиц используют бинокулярный микроскоп с отрегулированным увеличением 100±10х, оборудованный окулярным микрометром. Окулярный микрометр представляет собой окружную диаметральную измерительную сетку, состоящую из окружности, разделенной на квадранты, где черные эталонные кружки обозначают 10 мкм и 25 мкм при наблюдении при 100х увеличении.
Ниже измерительной сетки находится линейная шкала. Подсчитывают число частиц, соответствующих 10 мкм и 25 мкм. Для растворов, имеющих объем, меньший или равный 100 мл, препарат соответствует критерию теста, если среднее число присутствующих частиц не превышает 3000 на контейнер, имеющих размер не менее 10 мкм, и 300 на контейнер частиц, имеющих размер не менее 25 мкм.
В некоторых воплощениях водный образец раскрытой композиции объемом 10 мл после разведения содержит менее 600 частиц на мл, имеющих размер, больший или равный 10 мкм; и/или менее 60 частиц на мл, имеющих размер, больший или равный 25 мкм.
Для измерения размера частиц можно использовать динамическое светорассеяние (DLS), однако этот метод основан на броуновском движении, поэтому некоторые более крупные частицы можно не обнаружить. Лазерная дифракция основана на разностях показателя преломления между частицей и суспензионной средой. Этим методом можно обнаружить частицы в диапазоне от субмикронного до миллиметрового. В суспензиях наночастиц можно обнаружить относительно малые (например, приблизительно 1-5 мас. %) количества более крупных частиц. При оптическом зондировании одиночных частиц (SPOS; single particle optical sensing) для подсчета отдельных частиц приблизительно 0,5 мкм используют светоблокировку разбавленных суспензий. Зная концентрацию частиц в измеряемом образце, можно вычислить процентное содержание агрегатов по массе или концентрацию агрегатов (частиц/мл).
Образование агрегатов может происходить во время лиофилизации вследствие дегидратации поверхности частиц. Этой дегидратации можно избежать путем использования лиопротекторов, таких как дисахариды, в суспензии перед лиофилизацией. Подходящие дисахариды включают сахарозу, лактулозу, лактозу, мальтозу, трегалозу или целлобиозу и/или их смеси. Другие рассматриваемые дисахариды включают коджибиозу, нигерозу, изомальтозу, β,β-трегалозу, α,β-трегалозу, софорозу, ламинарибиозу, гентиобиозу, туранозу, мальтулозу, палатинозу, гентиобулозу, маннобиазу, мелибиозу, меллибиулозу, рутинозу, рутинулозу и ксилобиозу. Разведение показывает эквивалентные распределения частиц по размеру в DLS по сравнению с исходной суспензией.
Тем не менее, в некоторых разведенных растворах лазерная дифракция может обнаружить частицы размером более 10 мкм. Кроме того, SPOS также может обнаружить частицы размером более 10 мкм при более высокой концентрации, чем в нормативах Управления США по надзору за качеством пищевых продуктов и медикаментов (FDA) (104-105 частиц/мл для частиц более 10 мкм).
В некоторых воплощениях в качестве дополнительного лиопротектора помимо сахара, такого как сахароза, трегалоза или их смеси, можно использовать одну или более солей с галогенид ионом. Сахара могут включать дисахариды, моносахариды, трисахариды и/или полисахариды, а также могут включать другие эксципиенты, например глицерин, и/или поверхностно-активные вещества. Возможно включение циклодекстрина в качестве дополнительного лиопротектора. Циклодекстрин можно добавлять вместо соли с галогенид ионом. Альтернативно, циклодекстрин можно добавлять дополнительно к соли с галогенид ионом.
Подходящие соли с галогенид ионом могут включать хлорид натрия, хлорид кальция, хлорид цинка или их смеси. Дополнительные подходящие соли с галогенид ионом включают хлорид калия, хлорид магния, хлорид аммония, бромид натрия, бромид кальция, бромид цинка, бромид калия, бромид магния, бромид аммония, йодид натрия, йодид кальция, йодид цинка, йодид калия, йодид магния или йодид аммония и/или их смеси. В одном воплощении вместе с солью с галогенид ионом можно использовать от приблизительно 1 до приблизительно 15 массовых процентов сахарозы. В одном воплощении лиофилизированная фармацевтическая композиция может содержать от приблизительно 10 до приблизительно 100 мМ хлорида натрия. В другом воплощении лиофилизированная фармацевтическая композиция может содержать от приблизительно 100 до приблизительно 500 мМ хлоридной соли двухвалентного иона, такой как хлорид кальция или хлорид цинка. В еще одном воплощении суспензия для лиофилизации может дополнительно содержать циклодекстрин, например можно использовать от приблизительно 1 до приблизительно 25 массовых процентов циклодекстрина.
Подходящий циклодекстрин может включать α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин или их смеси. Иллюстративные циклодекстрины, рассматриваемые для применения в композициях, раскрытых в настоящем документе, включают гидроксипропил-β-циклодекстрин (HPbCD), гидроксиэтил-β-циклодекстрин, сульфобутиловый эфир-β-циклодекстрин, метил-β-циклодекстрин, диметил-β-циклодекстрин, карбоксиметил-β-циклодекстрин, карбоксиметилэтил-β-циклодекстрин, диэтил-β-циклодекстрин, три-О-алкил-β-циклодекстрин, глюкозил-β-циклодекстрин и мальтозил-β-циклодекстрин. В одном воплощении вместе с циклодекстрином можно использовать от приблизительно 1 до приблизительно 25 массовых процентов трегалозы (например, от приблизительно 10% до приблизительно 15%, например, от 5 до приблизительно 20% по массе). В одном воплощении лиофилизированная фармацевтическая композиция может содержать от приблизительно 1 до приблизительно 25 массовых процентов β-циклодекстрина. Иллюстративная композиция может содержать наночастицы, содержащие PLA-PEG, активное/терапевтическое средство, от приблизительно 4 мас. % до приблизительно 6 мас. % (например приблизительно 5 мас. %) сахарозы и от приблизительно 8 до приблизительно 12 массовых процентов (например приблизительно 10 мас. %) HPbCD.
В одном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая раскрытые наночастицы, где после разведения лиофилизированной фармацевтической композиции при концентрации наночастиц приблизительно 50 мг/мл в менее чем или приблизительно в 100 мл водной среды разведенная композиция, подходящая для парентерального введения, содержит менее 6000, например менее 3000, микрочастиц с размером, большим или равным 10 мкм; и/или менее 600, например менее 300, микрочастиц с размером, большим или равным 25 мкм.
Число микрочастиц можно определить посредством, как описано в Фарм. США 32<788>, подсчета количества частиц в режиме светотени, Фарм. США 32<788> подсчета частиц под микроскопом, лазерной дифракции и оптического зондирования отдельных частиц.
В одном аспекте предложена фармацевтическая композиция, подходящая для парентерального применения после разведения, содержащая множество терапевтических частиц, каждая из которых содержит сополимер, имеющий гидрофобный полимерный сегмент и гидрофильный полимерный сегмент; активный агент; сахар и циклодекстрин.
Например, сополимер может представлять собой блок-сополимер поли(молочная кислота)-поли(этилен)гликоль. После разведения 100 мл водного образца может содержать менее 6000 частиц, имеющих размер, больший или равный 10 мкм; и менее 600 частиц, имеющих размер, больший или равный 25 мкм.
Стадия добавления дисахарида и соли с галогенид ионом может включать добавление от приблизительно 5 до приблизительно 15 массовых процентов сахарозы или от приблизительно 5 до приблизительно 20 массовых процентов трегалозы (например, от приблизительно 10 до приблизительно 20 массовых процентов трегалозы) и от приблизительно 10 до приблизительно 500 мМ соли с галогенид ионом. Соль с галогенид ионом может быть выбрана из хлорида натрия, хлорида кальция и хлорида цинка или их смесей. В одном из воплощений также добавляют от приблизительно 1 до приблизительно 25 массовых процентов циклодекстрина.
В другом воплощении стадия добавления дисахарида и циклодекстрина может включать добавление от приблизительно 5 до приблизительно 15 массовых процентов сахарозы или от приблизительно 5 до приблизительно 20 массовых процентов трегалозы (например, от приблизительно 10 до приблизительно 20 массовых процентов трегалозы) и от приблизительно 1 до приблизительно 25 массовых процентов циклодекстрина. В одном из воплощений добавляют от приблизительно 10 до приблизительно 15 массовых процентов циклодекстрина. Циклодекстрин может быть выбран из α-циклодекстрина, β-циклодекстрина, γ-циклодекстрина или их смесей.
В другом аспекте предложен способ предотвращения существенной агрегации частиц в фармацевтической композиции наночастиц, включающий добавление к лиофилизированному препарату сахара и соли для предотвращения агрегации наночастиц после разведения. В одном из воплощений в лиофилизированный препарат также добавляют циклодекстрин. В еще одном аспекте предложен способ предотвращения существенной агрегации частиц в фармацевтической композиции наночастиц, включающий добавление к лиофилизированному препарату сахара и циклодекстрина для предотвращения агрегации наночастиц после разведения.
Рассматриваемая лиофилизированная композиция может иметь концентрацию терапевтических частиц более чем приблизительно 40 мг/мл. Препарат, подходящий для парентерального введения, может иметь менее чем приблизительно 600 частиц, имеющих размер более 10 микрон, в дозе 10 мл. Лиофилизация может включать замораживание композиции при температуре более чем приблизительно -40°С или, например, менее чем приблизительно -30°С, получение замороженной композиции и сушку замороженной композиции с образованием лиофилизированной композиции. Стадию сушки можно осуществлять при приблизительно 50 мТорр при температуре от приблизительно -25 до приблизительно -34°С или от приблизительно -30 до приблизительно -34°С.
Дополнительные аспекты изобретения включают лиофилизированную фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2. Кроме того, дополнительные аспекты изобретения включают лиофилизированную фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1% по массе (и также соответственно изменяется количество полимера). Кроме того, дополнительные аспекты изобретения включают лиофилизированную фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-1,5% по массе (и также соответственно изменяется количество полимера) по сравнению с описанным в примерах. Кроме того, дополнительные аспекты изобретения включают лиофилизированную фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/-2% по массе (и также соответственно изменяется количество полимера) по сравнению с описанными в примерах. Кроме того, дополнительные аспекты изобретения включают лиофилизированную фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица соответствует одному из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, где % по массе AZD1152 hqpa изменяется на вплоть до приблизительно +/-3% по массе, количество гидрофобной кислоты изменяется в пропорции к количеству AZD1152 hqpa, соответствующей пропорциям в препаратах, примеры которых приведены в настоящем документе, и также соответственно изменяется количество полимера.
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 25% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная) кислота-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная) кислота-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и от приблизительно 63 до приблизительно 78 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная) кислота-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля).
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и смесь от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе памовой кислоты.
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе памовой кислоты.
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа полимера молочной кислоты и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22% по массе (от массы наночастицы) AZD1152 hqpa и от приблизительно 7 до приблизительно 15% по массе (от массы наночастицы) памовой кислоты.
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. В другом воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 40 часов в PBS и полисорбате 20 при 37°С. В еще одном воплощении этого аспекта менее 20% AZD1152 hqpa высвобождается из наночастицы через 50 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы легко измеряют, используя описанный в данном документе выше способ.
В дополнительном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22% по массе AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С, и где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100) в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства приблизительно при 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
Удобно, когда наночастицы в описанных выше фармацевтических композициях имели гидродинамический диаметр менее 200 нм, такой как 70-140 нм.
В дополнительном аспекте предложен набор частей, содержащий:
1) лиофилизированную фармацевтическую композицию, содержащую раскрытые наночастицы, как описано в настоящем документе выше; и
2) инструкции по применению.
В дополнительном аспекте предложен набор частей, содержащий:
1) сублимированную фармацевтическую композицию, содержащую раскрытые наночастицы, как описано в настоящем документе выше; и
2) инструкции по применению.
Способы лечения
В некоторых воплощениях рассматриваемые наночастицы можно применять для лечения, облегчения, улучшения, ослабления, задержки возникновения, ингибирования прогрессирования, уменьшения тяжести и/или уменьшения частоты возникновения одного или более симптомов или признаков заболевания, расстройства и/или состояния. В некоторых воплощениях рассматриваемые наночастицы можно применять для лечения солидных опухолей, например рака, и/или раковых клеток.
Термин "рак" включает как предопухолевые, так и злокачественные виды рака. Виды рака включают без ограничений гематологические (кровь) (например, хронический миелогенный лейкоз, хронический миеломоноцитарный лейкоз, положительный по филадельфийской хромосоме острый лимфобластный лейкоз, лимфому из клеток мантийной зоны, острый миелоидный лейкоз (AML), диффузную В-крупноклеточную лимфому (DLBCL), миелому, периферическую Т-клеточную лимфому, миелодиспластический синдром), рак предстательной железы, рак желудка, колоректальный рак, рак кожи, например меланомы или базальноклеточные карциномы, рак легкого (например, немелкоклеточный рак легкого (NSCLC), мелкоклеточный рак легкого (SCLC)), рак молочной железы, рак яичника, рак головы и шеи, рак бронха, рак поджелудочной железы, рак мочевого пузыря, рак головного мозга или центральной нервной системы, рак периферической нервной системы, рак пищевода, рак полости рта или глотки, рак печени (например, печеночно-клеточную карциному), почечный рак (например, почечно-клеточную карциному), рак яичка, рак желчных путей, рак тонкой кишки или аппендикса, гастроинтестинальную стромальную опухоль, рак слюнной железы, рак щитовидной железы, рак надпочечника, остеосаркому, хондросаркому, рак гематологических тканей и тому подобное. "Раковые клетки" могут находиться в форме опухоли (солидной опухоли), существовать отдельно внутри субъекта (например, лейкозные клетки) или представлять собой линии клеток, полученные из раковых.
В одном аспекте рак, подлежащий лечению, представляет собой лейкоз. В другом аспекте рак, подлежащий лечению, представляет собой гематологический рак. В еще одном аспекте рак, подлежащий лечению, представляет собой гематологический рак, такой как AML. В еще одном аспекте рак, подлежащий лечению, представляет собой гематологический рак, такой как DLBCL. В еще одном аспекте рак, подлежащий лечению, представляет собой гематологический рак, такой как миелодиспластический синдром.
В другом аспекте рак, подлежащий лечению, представляет собой солидную опухоль. В еще одном аспекте рак, подлежащий лечению, представляет собой NSCLC. В еще одном аспекте рак, подлежащий лечению, представляет собой SCLC. В еще одном аспекте рак, подлежащий лечению, представляет собой рак яичника. В еще одном аспекте рак, подлежащий лечению, представляет собой колоректальный рак.
В одном аспекте наночастицы по изобретению применяют для лечения высокопролиферативных типов рака.
Пациенты могут быть выбраны с использованием биомаркеров, которые могут указывать на повышенную вероятность получения пользы от такого лечения. Например, вследствие того, что опухоль содержит клетки с высокой скоростью пролиферации (например, из-за высокой экспрессии или амплификации с-myc) или с разрегулированной апоптической функцией (например, из-за транслокации гена Bcl-2).
Рак может ассоциироваться с множеством физических симптомов. Симптомы рака обычно зависят от типа и локализации опухоли. Например, рак легкого может вызывать кашель, одышку и боль в груди, тогда как рак ободочной кишки часто вызывает диарею, запор и кровь в кале. Тем не менее, в качестве нескольких примеров, следующие симптомы часто обычно ассоциируются со многими видами рака: лихорадка, озноб, ночная потливость, кашель, диспноэ, потеря массы, потеря аппетита, анорексия, тошнота, рвота, диарея, анемия, желтуха, гепатомегалия, кровохарканье, утомляемость, недомогание, когнитивная дисфункция, депрессия, гормональные нарушения, нейтропения, боль, незаживающие раны, увеличенные лимфатические узлы, периферическая невропатия и половая дисфункция.
В одном аспекте предложен способ лечения рака. В некоторых воплощениях лечение рака включает введение терапевтически эффективного количества частиц по изобретению субъекту, нуждающемуся в этом, в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата. В некоторых воплощениях "терапевтически эффективное количество" частицы по изобретению представляет собой количество, эффективное для лечения, облегчения, улучшения, ослабления, задержки возникновения, ингибирования прогрессирования, уменьшения тяжести и/или уменьшения частоты возникновения одного или более симптомов или признаков рака.
Таким образом, согласно одному аспекту изобретения предложен способ предупреждения или лечения рака у теплокровного животного, такого как человек, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества композиции, содержащей терапевтическую наночастицу, содержащую AZD1152 hqpa.
В одном аспекте предложен способ введения композиций по изобретению субъекту, страдающему раком. В некоторых воплощениях наночастицы можно вводить субъекту в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата (лечения рака). В некоторых воплощениях "терапевтически эффективное количество" рассматриваемой наночастицы представляет собой количество, эффективное для лечения, облегчения, улучшения, ослабления, задержки возникновения, ингибирования прогрессирования, уменьшения тяжести и/или уменьшения частоты возникновения одного или более симптомов или признаков рака.
В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa, для применения в качестве лекарственного средства для теплокровного животного, такого как человек.
В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa, для применения в получении антипролиферативного эффекта у теплокровного животного, такого как человек.
Согласно дополнительному воплощению этого аспекта изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa, для применения для теплокровного животного, такого как человек, в качестве антиинвазивного средства в сдерживании и/или лечении солидноопухолевого заболевания.
В дополнительном аспекте изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, в предупреждении или лечении рака у теплокровного животного, такого как человек.
В дополнительном аспекте изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa, для применения в предупреждении или лечении рака у теплокровного животного, такого как человек.
В дополнительном аспекте изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, в изготовлении лекарственного средства для предупреждения или лечения рака у теплокровного животного, такого как человек.
В одном из описанных выше аспектов рак представляет собой солидную опухоль. В другом из этих аспектов рак представляет собой лейкоз.
Согласно дополнительному аспекту изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, для получения антипролиферативного эффекта у теплокровного животного, такого как человек.
Согласно дополнительному воплощению этого аспекта изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, в изготовлении лекарственного средства для применения в получении антипролиферативного эффекта у теплокровного животного, такого как человек.
Согласно дополнительному воплощению этого аспекта изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, в изготовлении лекарственного средства для применения для теплокровного животного, такого как человек, в качестве антиинвазивного средства в сдерживании и/или лечении солидноопухолевого заболевания.
Согласно дополнительному воплощению этого аспекта изобретения предложен способ получения антипролиферативного эффекта у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества терапевтической наночастицы, содержащей AZD1152 hqpa.
Согласно дополнительному воплощению этого аспекта изобретения предложен способ получения антиинвазивного эффекта путем сдерживания и/или лечения солидноопухолевого заболевания у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества терапевтической наночастицы, содержащей AZD1152 hqpa.
Согласно дополнительному аспекту изобретения предложена терапевтическая наночастица, содержащая AZD1152 hqpa, для применения в предупреждении или лечении солидноопухолевого заболевания у теплокровного животного, такого как человек.
Согласно дополнительному аспекту изобретения предложено применение терапевтической наночастицы, содержащей AZD1152 hqpa, в изготовлении лекарственного средства для применения в предупреждении или лечении солидноопухолевого заболевания у теплокровного животного, такого как человек.
Согласно дополнительному воплощению этого аспекта изобретения предложен способ предупреждения или лечения солидноопухолевого заболевания у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества терапевтической наночастицы, содержащей AZD1152 hqpa.
В описанных выше применениях и способах удобно вводить от 100 мг до 2000 мг AZD1152 hqpa (например) на сутки 1 и 3, сутки 1 и 5 или сутки 1 и 7 семидневного цикла лечения. Этот цикл можно повторять каждую неделю, две недели или три недели в ежемесячном или двухмесячном цикле лечения.
В описанных выше применениях и способах терапевтическую наночастицу, содержащую AZD1152 hqpa, удобно вводить в виде фармацевтической композиции, такой как приведенная в списке от 1) до 16):
1) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa и возможно дополнительно содержит гидрофобную кислоту;
2) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, подходящий полимер и возможно дополнительно содержит гидрофобную кислоту;
3) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, подходящий полимер и дополнительно содержит гидрофобную кислоту;
в этих аспектах удобно, когда гидрофобная кислота выбрана из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; для удобства гидрофобная кислота может представлять собой смесь дезоксихолевой кислоты и холевой кислоты;
4) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и дополнительно содержит гидрофобную кислоту. В этих аспектах удобно, когда гидрофобная кислота выбрана из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; для удобства гидрофобная кислота может представлять собой смесь дезоксихолевой кислоты и холевой кислоты;
5) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислот, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
6) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
7) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
8) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 55 до приблизительно 80 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 10 до приблизительно 20 массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
9) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 76 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 20 массовых процентов поли(этилен)гликоля, от приблизительно 9 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
10) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 25 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля);
11) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 5 кДа поли(этилен)гликоля);
12) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(зтилен)гликоля) и смесь от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты;
13) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты;
14) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22 массовых процентов (от массы наночастицы) AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов (от массы наночастицы) памовой кислоты;
15) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы легко измеряют, используя описанный в настоящем документе выше способ.
16) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С, и где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100) в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства приблизительно при 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В фармацевтических композициях, описанных выше, для применения в описанных выше применениях и способах удобно, когда сополимер имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
В описанных выше применениях и способах терапевтическую наночастицу, содержащую AZD1152 hqpa, удобно вводить, в виде фармацевтической композиции, содержащей один из препаратов примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей. Для применения в описанных выше способах и применениях терапевтические наночастицы, содержащие AZD1152 hqpa, также удобно вводить в виде фармацевтической композиции, содержащей препарат, описанный в примерах в качестве препаратов Е, F1, F2, G1 и G2, но где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/- 1% по массе (и также соответственно изменяется количество полимера) по сравнению с описанными в примерах, и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей. В описанных выше способах и применениях терапевтические наночастицы, содержащие AZD1152 hqpa, также удобно вводить в виде фармацевтической композиции, содержащей препарат, описанный в примерах в качестве препаратов Е, F1, F2, G1 и G2, но где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/- 1,5% по массе (и также соответственно изменяется количество полимера) по сравнению с описанными в примерах, и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей. Для применения в описанных выше способах и применениях терапевтические наночастицы, содержащие AZD1152 hqpa, также удобно вводить в виде фармацевтической композиции, содержащей препарат, описанный в примерах в качестве препаратов Е, F1, F2, G1 и G2, но где % по массе AZD1152 hqpa и/или % по массе гидрофобной кислоты изменяется на приблизительно +/- 2% по массе (и также соответственно изменяется количество полимера) по сравнению с описанными в примерах, и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей. Дополнительные аспекты изобретения включают фармацевтическую композицию, содержащую множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица соответствует одному из примеров, называемых в настоящем документе препаратами Е, F1, F2, G1 и G2, но где % по массе AZD1152 hqpa изменяется на вплоть до приблизительно +/- 3% по массе, количество гидрофобной кислоты изменяется в пропорции к количеству AZD1152 hqpa, соответствующей пропорциям в препаратах, примеры которых, приведены в настоящем документе, и соответственно изменяется количество полимера.
В некоторых из описанных выше аспектов терапевтические наночастицы могут содержать от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и возможно дополнительно содержит по существу гидрофобную кислоту, как определено в настоящем документе, такую как холевая кислота, дезоксихолевая кислота или диоктилсульфоянтарная кислота (в частности, дезоксихолевую кислоту, диоктилсульфоянтарную кислоту или смесь дезоксихолевой кислоты и холевой кислоты).
Терапевтические протоколы по изобретению включают введение терапевтически эффективного количества рассматриваемой наночастицы здоровому индивиду (то есть субъекту, у которого не проявляется никаких симптомов рака и/или у которого не диагностирован рак). Например, здоровых индивидов можно "иммунизировать" рассматриваемой наночастицей до развития рака и/или возникновения симптомов рака; индивидов, подверженных риску (например, пациентов, имеющих семейную историю рака; пациентов, несущих одну или более генетических мутаций, ассоциированных с развитием рака; пациентов, имеющих генетический полиморфизм, ассоциированный с развитием рака; пациентов, инфицированных вирусом, ассоциированным с развитием рака; пациентов, имеющих привычки и/или образ жизни, ассоциированные с развитием рака; и так далее) можно лечить по существу одновременно (например, в пределах 48 часов, в пределах 24 часов или в пределах 12 часов) с возникновением симптомов рака. Индивиды, у которых наличие рака известно, могут, конечно же, получить лечение по изобретению в любое время.
В других воплощениях раскрытые наночастицы можно применять для ингибирования роста раковых клеток, например клеток рака легкого. При использовании в настоящем документе термин "ингибирует рост раковых клеток" или "ингибирование роста раковых клеток" относится к любому замедлению скорости пролиферации и/или миграции раковых клеток, остановке пролиферации и/или миграции раковых клеток или уничтожению раковых клеток, так что скорость роста раковых клеток уменьшается про сравнению с наблюдаемой или прогнозируемой скоростью роста необработанных контрольных раковых клеток. Термин "ингибирует рост" может также относиться к уменьшению размера или исчезновению раковой клетки или опухоли, а также к снижению ее метастатического потенциала. Предпочтительно такое ингибирование на клеточном уровне может уменьшить размер, ограничить рост, уменьшить агрессивность, либо предотвратить или ингибировать метастаз рака у пациента. Специалисты в данной области техники могут легко определить с помощью ряда подходящих показателей, ингибирован ли рост раковой клетки.
Об ингибировании роста раковой клетки может свидетельствовать, например, остановка раковых клеток в конкретной фазе клеточного цикла, например остановка в фазе G2/M клеточного цикла. Об ингибировании роста раковой клетки может также свидетельствовать прямое или косвенное измерение размера раковой клетки или размера опухоли. У пациентов-людей, страдающих раком, такие измерения обычно проводят, используя хорошо известные способы визуализации, такие как магнитно-резонансная визуализация, аксиальная компьютерная томография и рентгеновская визуализация. Рост раковых клеток также можно опредить косвенно, например путем определения уровней циркуляции карциноэмбрионального антигена, простатоспецифического антигена или других специфичных для рака антигенов, которые коррелируют с ростом раковых клеток. Ингибирование роста рака также обычно коррелирует с пролонгированным выживанием и/или улучшением состояния здоровья и самочувствия субъекта.
В настоящем документе также предложены способы введения пациенту раскрытой в настоящем документе наночастицы, включающей активный агент, где при введении пациенту такие наночастицы по существу уменьшают объем распределения и/или по существу уменьшают свободную Cmax по сравнению с введением только лишь одного средства (то есть не в виде раскрытой наночастицы).
Наночастицы по настоящему изобретению можно вводить пациенту в виде монотерапии, либо их можно вводить в комбинации (одновременно или последовательно) с традиционным хирургическим лечением, либо радиотерапией, либо химиотерапией. Такая химиотерапия может включать одну или более из следующих категорий противоопухолевых средств:
(1) другие антипролиферативные/противоопухолевые лекарственные средства и их комбинации, применяемые в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, оксалиплатин, карбоплатин, циклофосфамид, хлорметин, мелфалан, хлорамбуцил, бусульфан, темозоламид и нитрозомочевины); антиметаболиты (например, гемцитабин и антифолаты, такие как фторпиримидины, такие как 5-фторурацил и тегафур, ралтитрексед, метотрексат, цитозинарабинозид и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, винкаалкалоиды, такие как винкристин, винбластин, виндезин и винорелбин, и таксоиды, такие как таксол и таксотер, и ингибиторы полокиназы); ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин); и другие, такие как терапевтические антитела (например, ритуксимаб);
(2) антигормональные средства, такие как антиэстрогены (например, тамоксифен, фулвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), прогестогены (например, мегестролацетат), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и экземестан);
(3) ингибиторы функции факторов роста и их нисходящих биохимических путей передачи сигнала: включены антитела (Ab)-модуляторы любых мишеней фактора роста или рецептора фактора роста, описанные в обзоре Stern et al. (Critical Reviews in Oncology/Haematology, 2005, 54, pp. 11-29); также включены низкомолекулярные ингибиторы таких мишеней, например ингибиторы киназы - примеры включают антитело против erbB2 трастузумаб [Herceptin™], антитело против рецептора эпидермального фактора роста (EGFR) панитумумаб, антитело против EGFR цетуксимаб [эрбитукс, С225], и ингибиторы тирозинкиназы, включающие ингибиторы семейства рецепторов erbB, такие как ингибиторы семейства рецепторных тирозинкиназ эпидермального фактора роста (EGFR/erbB1), такие как гефитиниб или эрлотиниб, ингибиторы тирозинкиназы erbB2, такие как лапатиниб, и смешанные ингибиторы erb1/2, такие как афатаниб; подобные стратегии доступны для других классов факторов роста и их рецепторов, например, ингибиторы семейства факторов роста гепатоцитов или их рецепторов, включая c-met и ron; ингибиторы инсулина и семейства факторов роста инсулина или их рецепторов (IGFR, IR), ингибиторы семейства фактора роста тромбоцитов или их рецепторов (PDGFR) и ингибиторы передачи сигнала, опосредованного другими рецепторными тирозинкиназами, такими как с-kit, AnLK и CSF-1R;
также включены модуляторы, которые нацелены на сигнальные белки в биохимическом пути передачи сигнала PI3-киназы, например, ингибиторы изоформ PI3-киназы, таких как PI3K-α/β/γ, и серинтреонинкиназ, таких как AKT, mTOR, PDK, SGK, PI4K или PIP5K; также включены ингибиторы серинтреонинкиназ, не перечисленных выше, например, ингибиторы raf, такие как вемурафениб, ингибиторы МЕK, такие как селуметиниб (AZD6244), ингибиторы Abl, такие как иматиниб или нилотиниб, ингибиторы Btk, такие как ибрутиниб, ингибиторы Syk, такие как фостаматиниб, ингибиторы других серинтирозинкиназ, таких как JAK, STAT и IRAK4, и ингибиторы циклин-зависимой киназы;
(4) модуляторы биохимических путей передачи сигнала повреждения ДНК, например, ингибиторы PARP (например, олапариб), ингибиторы ATR или ингибиторы ATM и модуляторы клеточного цикла, например, ингибиторы CDK4 и CDK6 (например, палбоциклиб);
(5) модуляторы апоптических биохимических путей и биохимических путей клеточной гибели, такие как модуляторы семейства Bcl (например, АВТ-263/навитоклакс, АВТ-199);
(6) антиангиогенные средства, такие как средства, ингибирующие действия фактора роста эндотелия сосудов (VEGF) [например, антитело против фактора роста эндотелия сосудов бевацизумаб (Avastin™) и, например, ингибитор рецепторной тирозинкиназы VEGF, такой как сорафениб, акситиниб, пазопаниб, сунитиниб и вандетаниб (и соединения, действующие по другим механизмам (например, линомид, ингибиторы функции интегрина αvβ3 и ангиостатин)];
(7) средства, повреждающие сосуды, такие как комбретастатин А4;
(8) антиинвазивные средства, например, ингибиторы семейства киназ с-Src, например, дазатиниб (J. Med. Chem., 2004, 47, 6658-6661) и бозутиниб (SKI-606) и ингибиторы металлопротеиназы, такие как маримастат, ингибиторы рецепторной функции активатора плазминогена урокиназного типа или антитела к гепараназе];
(9) иммунотерапевтические подходы, включающие, например, подходы ex vivo и in vivo, чтобы повысить иммуногенность опухолевых клеток пациента, такие как трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или гранулоцитарно-макрофагальный колониестимулирующий фактор, подходы к снижению Т-клеточной толерантности, подходы, в которых используют трансфицированные иммунные клетки, такие как трансфицированные цитокинами дендритные клетки, подходы, в которых используют линии опухолевых клеток, трансфицированных цитокинами, и подходы, в которых используют антиидиотипические антитела. Конкретные примеры включают моноклональные антитела, нацеленные на PD-1 (например, BMS-936558), PDL-1 (например, MEDI4736, см. US 8779108) или CTLA4 (например, ипилимумаб и тремелимумаб);
(10) терапии, основанные на РНК-ингибировании (РНКи), например, нацеленные на перечисленные мишени.
(11) методы генотерапии, включающие, например, методы замещения аберрантных генов, таких как аберрантный р53 или аберрантные BRCA1 или BRCA2, методы GDEPT (ген-направленная ферментативная пролекарственная терапия - gene-directed enzyme pro-drug therapy), такие как использование цитозиндеаминазы, тимидинкиназы или бактериального фермента нитроредуктазы, и методы повышения толерантности пациента к химиотерапии или радиотерапии, такие как мультирезистентная генотерапия.
В одном воплощении предложена комбинация, подходящая для применения в лечении рака, содержащая наночастицы по настоящему изобретению, как определено в настоящем документе, и другое противоопухолевое средство, выбранное из 1-а), 4-а) и 9-а), как определено ниже, где 1-а) представляет собой подгруппу 1) выше, 4-а) представляет собой подгруппу 4) выше, и 9-а) представляет собой подгруппу 9) выше, и где:
1-а) включает режимы химиотерапии стандартом лечения, включающие, без ограничения, замещающие или объединяющие антимитотические химиотерапии при солидных опухолях и гематологических раках, такие как таксаны и винкаалкалоиды;
4-а) включает терапии, нацеленные на ответ повреждения ДНК, включающие, без ограничения, средства, которые ингибируют репарацию повреждений ДНК и клеточный цикл; и
9-а) включает иммуно-опосредованные терапии, включающие, без ограничения, ингибиторы блокады иммунных контрольных точек, такие как терапии, нацеленные на CTLA4, PD-1 и PDL-1.
Согласно этому аспекту изобретения предложена комбинация, подходящая для применения в лечении рака, содержащая наночастицы по настоящему изобретению, как определено в настоящем документе, и другое противоопухолевое средство, в частности, любое из противоопухолевых средств, перечисленных в (1) - (11) выше. В частности, противоопухолевое средство, перечисленное в (1) - (11) выше, представляет собой стандарт лечения для конкретного рака, подлежащего лечению; специалисту в данной области техники должно быть понятно значение "стандарта лечения".
Таким образом, в дополнительном аспекте изобретения предложены наночастицы по настоящему изобретению, как описано в настоящем документе, в комбинации с другим противоопухолевым средством, в частности с противоопухолевым средством, выбранным из перечисленных в (1) - (11) выше, таких как 1-а), 4-а) или 9-а). Например, наночастицы по изобретению для применения в комбинации с противоопухолевым средством, выбранным из перечисленных в (1) - (11) выше, таких как 1-а), 4-а) или 9-а), могут быть предложены в виде фармацевтической композиции, выбранной из 1) - 16) ниже:
1) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa и возможно дополнительно содержит гидрофобную кислоту;
2) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, подходящий полимер и возможно дополнительно содержит гидрофобную кислоту;
3) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, подходящий полимер и дополнительно содержит гидрофобную кислоту;
в этих аспектах удобно, когда гидрофобная кислота выбрана из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; для удобства гидрофобная кислота может представлять собой смесь дезоксихолевой кислоты и холевой кислоты;
4) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит AZD1152 hqpa, диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль и дополнительно содержит гидрофобную кислоту. В этих аспектах удобно, когда гидрофобная кислота выбрана из дезоксихолевой кислоты, холевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты; для удобства гидрофобная кислота может представлять собой смесь дезоксихолевой кислоты и холевой кислоты;
5) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
6) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 90 массовых процентов по массе диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, смеси холевой и дезоксихолевой кислоты, диоктилсульфоянтарной кислоты и памовой кислоты, и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
7) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 35 до приблизительно 94 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 1 до приблизительно 35 массовых процентов памовой кислоты и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
8) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 55 до приблизительно 80 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, от приблизительно 10 до приблизительно 20 массовых процентов памовой кислоты и от приблизительно 10 до приблизительно 25 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
9) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 65 до приблизительно 76 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 20 массовых процентов поли(этилен)гликоля, от приблизительно 9 до приблизительно 15 массовых процентов памовой кислоты и от приблизительно 15 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли;
10) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 25 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля);
11) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля);
12) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 5 кДа поли(этилен)гликоля) и смесь от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты;
13) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и продукт, полученный путем взаимодействия от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты;
14) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля) и гидрофобную ионную пару, образованную между от приблизительно 15 до приблизительно 22 массовых процентов (от массы наночастицы) AZD1152 hqpa и от приблизительно 7 до приблизительно 15 массовых процентов (от массы наночастицы) памовой кислоты;
15) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15% по массе памовой кислоты и диблок-сополимер поли(молочная кислота)-поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С. Высвобождение AZD1152 hqpa из наночастицы легко измеряют, используя описанный в настоящем документе выше способ.
16) фармацевтическая композиция, содержащая множество терапевтических наночастиц и один или более фармацевтически приемлемых эксципиентов, разбавителей и/или носителей, где каждая терапевтическая наночастица содержит от приблизительно 15 до приблизительно 22 массовых процентов AZD1152 hqpa, от приблизительно 7 до приблизительно 15 массовых процентов памовой кислоты и диблок-сополимер поли(молочная кислота) - поли(этилен)гликоль (где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля, и сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля); где менее 20% AZD1152 hqpa высвобождается из наночастицы через 30 часов в PBS и полисорбате 20 при 37°С, и где наночастицы получены способом, включающим следующие стадии:
1) объединение первой органической фазы (содержащей сополимер 16:5 PLA-PEG, AZD1152 hqpa и памовую кислоту в смеси растворителей, содержащей TFA, бензиловый спирт, DMSO и этилацетат, так что бензиловый спирт и этилацетат присутствуют в молярном соотношении приблизительно 1:3,6, и памовую кислоту и AZD1152 hqpa добавляют при исходном соотношении 0,8 моль памовой кислоты : 1 моль AZD1152 hqpa) с первым водным раствором (содержащим полиоксиэтилен-(100)-стеариловый эфир (например, продаваемый под торговым названием Brij®S100) в воде, DMSO и бензиловом спирте) с образованием второй фазы, где соотношение водной фазы и органической фазы составляет приблизительно 5,5:1;
2) эмульгирование второй фазы с образованием крупнодисперсной эмульсии;
3) выдерживание крупнодисперсной эмульсии в течение времени выдерживания (такого как от 10 до 15 минут, для удобства приблизительно при 0°С, например, путем погружения в ледяную баню);
4) формирование наноэмульсии с использованием гомогенизатора высокого давления;
5) возможно, ожидание в течение времени задержки по меньшей мере 5 минут, например 10 минут;
6) гашение эмульсионной фазы при 0-5°С с образованием фазы гашения, где гашение эмульсионной фазы включает смешивание эмульсионной фазы со вторым водным раствором, содержащим буфер при рН 6,5 (такой как 0,17 М фосфатный буфер), где соотношение второго водного раствора и эмульсии составляет от приблизительно 2:1 до приблизительно 10:1, такое как приблизительно 3:1;
7) добавление водного раствора поверхностно-активного вещества (такого как Tween®80, например, 35%-ного (мас./мас.) раствора Tween®80 в воде) к раствору гасителя (например, при соотношении Tween®80 к лекарственному средству по массе приблизительно 20:1);
8) концентрирование и выделение полученных наночастиц путем фильтрования.
В описанных выше комбинациях также можно использовать другие подходящие фармацевтические композиции, содержащие AZD1152 hqpa, в виде наночастицы, описанной в настоящем документе.
Дополнительные аспекты изобретения определены с помощью следующих признаков:
1. Терапевтическая наночастица, содержащая:
от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера поли(сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; и
от приблизительно 0,2 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
2. Терапевтическая наночастица по признаку 1, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9.
3. Терапевтическая наночастица по признаку 1, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,75 до приблизительно 0,85.
4. Терапевтическая наночастица по признаку 1, 2 или 3, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля.
5. Терапевтическая наночастица по признаку 1, 2 или 3, где терапевтическая наночастица содержит от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
6. Терапевтическая наночастица по любому из предшествующих признаков, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля.
7. Терапевтическая наночастица по признаку 6, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
8. Терапевтическая наночастица по любому из признаков 1-6, содержащая от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера.
9. Терапевтическая наночастица по любому из признаков 1-8, дополнительно содержащая по существу гидрофобную кислоту.
10. Терапевтическая наночастица по любому из признаков 1-8, дополнительно содержащая от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты.
11. Терапевтическая наночастица по любому из признаков 1-8, дополнительно содержащая от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты.
12. Терапевтическая наночастица по любому из признаков 1-8, дополнительно содержащая от приблизительно 10 до приблизительно 20 массовых процентов по существу гидрофобной кислоты.
13. Терапевтическая наночастица по любому из признаков 9-12, где гидрофобная кислота представляет собой желчную кислоту.
14. Терапевтическая наночастица по признаку 13, где желчная кислота представляет собой дезоксихолевую кислоту, холевую кислоту или их смесь.
15. Терапевтическая наночастица по любому из признаков 9-12, где гидрофобная кислота представляет собой диоктилсульфоянтарную кислоту.
16. Терапевтическая наночастица по любому из признаков 9-12, где гидрофобная кислота представляет собой памовую кислоту.
17. Терапевтическая наночастица по любому из признаков 9-12, где молярное соотношение по существу гидрофобной кислоты и терапевтического средства составляет от приблизительно 0,5:1 до приблизительно 1,6:1, где кислота представляет собой дезоксихолевую кислоту, холевую кислоту или смесь холевой кислоты и дезоксихолевой кислоты.
18. Терапевтическая наночастица по любому из признаков 9-12, где молярное соотношение по существу гидрофобной кислоты и AZD1152 hqpa составляет от приблизительно 1,3:1 до приблизительно 1,6:1, где кислота представляет собой смесь холевой кислоты и дезоксихолевой кислоты.
19. Терапевтическая наночастица по любому из признаков 9-12, где молярное соотношение по существу гидрофобной кислоты и AZD1152 hqpa составляет от приблизительно 0,9:1 до приблизительно 1,1:1, где кислота представляет собой диоктилсульфоянтарную кислоту.
20. Терапевтическая наночастица по любому из признаков 9-15, где рKа AZD1152 hqpa по меньшей мере на приблизительно 1,0 единицу рKа больше, чем рKа гидрофобной кислоты.
21. Терапевтическая наночастица по любому из признаков 9-19, где по существу гидрофобная кислота и AZD1152 hqpa образуют гидрофобную ионную пару в терапевтической наночастице.
22. Терапевтическая наночастица по любому из признаков 1-21, содержащим от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa.
23. Терапевтическая наночастица по любому из признаков 1-21, содержащая от приблизительно 10 до приблизительно 20 массовых процентов AZD1152 hqpa.
24. Терапевтическая наночастица, содержащая: от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; от приблизительно 5 до приблизительно 30 массовых процентов терапевтического средства, представляющего собой AZD1152 hqpa или его фармацевтически приемлемую соль; и либо от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты и диоктилсульфоянтарной кислоты; либо от приблизительно 0,05 до приблизительно 35 массовых процентов смеси по существу гидрофобных кислот, представляющих собой дезоксихолевую кислоту и холевую кислоту.
25. Терапевтическая наночастица, содержащая: от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; от приблизительно 5 до приблизительно 30 массовых процентов терапевтического средства, представляющего собой AZD1152 hqpa или его фармацевтически приемлемую соль; и либо от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты и диоктилсульфоянтарной кислоты; либо от приблизительно 0,05 до приблизительно 35 массовых процентов смеси по существу гидрофобных кислот, представляющих собой дезоксихолевую кислоту и холевую кислоту.
26. Терапевтическая наночастица, содержащая: от приблизительно 35 до приблизительно 94,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты (или смеси холевой и дезоксихолевой кислоты), диоктилсульфоянтарной кислоты и памовой кислоты; и от приблизительно 5 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
27. Терапевтическая наночастица, содержащая: от приблизительно 65 до приблизительно 90 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты (или смеси холевой и дезоксихолевой кислоты), диоктилсульфоянтарной кислоты и памовой кислоты; и от приблизительно 5 до приблизительно 20 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
28. Терапевтическая наночастица по признаку 24, признаку 25, признаку 26 или признаку 27, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9.
29. Терапевтическая наночастица по признаку 24, признаку 25, признаку 26 или признаку 27, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,75 до приблизительно 0,85.
30. Терапевтическая наночастица по признаку 24, признаку 25, признаку 26 или признаку 27, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля.
31. Терапевтическая наночастица по признаку 24, признаку 25, признаку 26 или признаку 27, где терапевтическая наночастица содержит от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
32. Терапевтическая наночастица по любому из признаков 24-31, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля.
33. Терапевтическая наночастица по любому из признаков 24-31, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 5 кДа поли(этилен)гликоля.
34. Терапевтическая наночастица по любому из признаков 24-33, содержащая от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера.
35. Фармацевтически приемлемая композиция, содержащая множество терапевтических наночастиц по любому из признаков 1-34 и фармацевтически приемлемый эксципиент.
36. Способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества композиции, содержащей терапевтическую наночастицу по любому из признаков 1-34.
37. Способ по признаку 36, где рак представляет собой рак легкого.
38. Способ по признаку 36, где рак представляет собой лейкоз.
39. Способ по признаку 36, где рак представляет собой колоректальный рак.
Дополнительные аспекты изобретения определены с помощью следующих признаков:
1а. Терапевтическая наночастица, содержащая: от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль или диблок-сополимера (сополимер молочной кислоты и гликолевой кислоты)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; и от приблизительно 0,2 до приблизительно 30 массовых процентов AZD1152 hqpa или его фармацевтически приемлемой соли.
2а. Терапевтическая наночастица по признаку 1а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9.
3а. Терапевтическая наночастица по признаку 1а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,75 до приблизительно 0,85.
4а. Терапевтическая наночастица по признаку 1а, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля.
5а. Терапевтическая наночастица по признаку 1а, где терапевтическая наночастица содержит от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
6а. Терапевтическая наночастица по признаку 1а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля.
7а. Терапевтическая наночастица согласно признаку 6а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
8а. Терапевтическая наночастица по любому из признаков 1а-6а, содержащая от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера.
9а. Терапевтическая наночастица по любому из признаков 1а-8а, дополнительно содержащая по существу гидрофобную кислоту.
10а. Терапевтическая наночастица по любому из признаков 1а-8а, дополнительно содержащая от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты.
11а. Терапевтическая наночастица по любому из признаков 1а-8а, дополнительно содержащая от приблизительно 5 до приблизительно 15 массовых процентов по существу гидрофобной кислоты.
12а. Терапевтическая наночастица по любому из признаков 1а-8а, дополнительно содержащая от приблизительно 10 до приблизительно 20 массовых процентов по существу гидрофобной кислоты.
13а. Терапевтическая наночастица по любому из признаков 9а-12а, где молярное соотношение по существу гидрофобной кислоты и терапевтического средства составляет от приблизительно 0,5:1 до приблизительно 1,6:1, где кислота представляет собой дезоксихолевую кислоту, холевую кислоту или смесь холевой кислоты и дезоксихолевой кислоты.
14а. Терапевтическая наночастица по любому из признаков 9а-12а, где молярное соотношение по существу гидрофобной кислоты и терапевтического средства составляет от приблизительно 1,3:1 до приблизительно 1,6:1, где кислота представляет собой смесь холевой кислоты и дезоксихолевой кислоты.
15а. Терапевтическая наночастица по любому из признаков 9а-12а, где молярное соотношение по существу гидрофобной кислоты и терапевтического средства составляет от приблизительно 0,9:1 до приблизительно 1,1:1, где кислота представляет собой диоктилсульфоянтарную кислоту.
16а. Терапевтическая наночастица по любому из признаков 9а-15а, где pKa терапевтического средства по меньшей мере на приблизительно 1,0 единицу pKa больше, чем pKa гидрофобной кислоты.
17а. Терапевтическая наночастица по любому из признаков 9а-16а, где по существу гидрофобная кислота и терапевтическое средство образуют гидрофобную ионную пару в терапевтической наночастице.
18а. Терапевтическая наночастица по любому из признаков 9а-17а, где гидрофобная кислота представляет собой желчную кислоту.
19а. Терапевтическая наночастица по признаку 18а, где желчная кислота представляет собой дезоксихолевую кислоту, холевую кислоту или их смесь.
20а. Терапевтическая наночастица по любому из признаков 9а-18а, где гидрофобная кислота представляет собой диоктилсульфоянтарную кислоту.
21а. Терапевтическая наночастица по любому из признаков 1а-20а, содержащая от приблизительно 5 до приблизительно 20 массовых процентов терапевтического средства.
22а. Терапевтическая наночастица по любому из признаков 1а-20а, содержащая от приблизительно 10 до приблизительно 20 массовых процентов терапевтического средства.
23а. Терапевтическая наночастица, содержащая: от приблизительно 50 до приблизительно 99,75 массовых процентов диблок-сополимера поли(молочная кислота)-поли(этилен)гликоль, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 30 массовых процентов поли(этилен)гликоля; от приблизительно 5 до приблизительно 30 массовых процентов терапевтического средства, представляющего собой AZD1152 hqpa или его фармацевтически приемлемую соль; и либо от приблизительно 0,05 до приблизительно 35 массовых процентов по существу гидрофобной кислоты, выбранной из группы, состоящей из дезоксихолевой кислоты, холевой кислоты и диоктилсульфоянтарной кислоты; либо от приблизительно 0,05 до приблизительно 35 массовых процентов смеси по существу гидрофобных кислот, представляющих собой дезоксихолевую кислоту и холевую кислоту.
24а. Терапевтическая наночастица по признаку 23а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,7 до приблизительно 0,9.
25а. Терапевтическая наночастица по признаку 23а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярно-массовую фракцию поли(молочной кислоты) от приблизительно 0,75 до приблизительно 0,85.
26а. Терапевтическая наночастица по признаку 23а, где терапевтическая наночастица содержит от приблизительно 10 до приблизительно 25 массовых процентов поли(этилен)гликоля.
27а. Терапевтическая наночастица по признаку 23а, где терапевтическая наночастица содержит от приблизительно 20 до приблизительно 30 массовых процентов поли(этилен)гликоля.
28а. Терапевтическая наночастица по признаку 23а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу от приблизительно 15 кДа до приблизительно 20 кДа поли(молочной кислоты) и среднечисловую молекулярную массу от приблизительно 4 кДа до приблизительно 6 кДа поли(этилен)гликоля.
29а. Терапевтическая наночастица по признаку 28а, где сополимер поли(молочная кислота)-поли(этилен)гликоль имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля.
30а. Терапевтическая наночастица по любому из признаков 23а-29а, содержащая от приблизительно 65 массовых процентов до приблизительно 85 массовых процентов сополимера.
31а. Фармацевтически приемлемая композиция, содержащая множество терапевтических наночастиц по любому из признаков 1а-30а и фармацевтически приемлемый эксципиент.
32а. Способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества композиции, содержащей терапевтическую наночастицу по любому из признаков 1а-30а.
33а. Способ по признаку 32а, где рак представляет собой рак легкого.
34а. Способ по признаку 32а, где рак представляет собой лейкоз.
35а. Способ по признаку 32а, где рак представляет собой колоректальный рак.
ПРИМЕРЫ
Изобретение, описанное в целом, будет понятнее со ссылкой на приведенные ниже примеры, предназначенные исключительно для целей иллюстрации некоторых аспектов и воплощений и никоим образом не предназначенные для ограничения изобретения.
В каждом из приведенных ниже примеров предложен отдельный независимый аспект изобретения. В частности, препараты, описанные в приведенных ниже примерах, и способы, описанные для их получения, составляют отдельные независимые аспекты изобретения.
AZD1152 hqpa может быть получен, как описано в WO 2004/058781 или WO 2007/132210.
Сокращения:
Можно использовать следующие сокращения.
ЕА этилацетат
ВА бензиловый спирт
DI деионизованный
TFF фильтрование с тангенциальным потоком
TFA трифторуксусная кислота
Лио/сушилка лиофильная сушилка
DMSO диметилсульфоксид
SCID тяжелый комбинированный иммунодефицит
Brij®100 поверхностно-активное вещество Brij®S 100 представляет собой имеющийся в продаже полиоксиэтилен-(100)-стеариловый эфир со средней молекулярной массой приблизительно 4670, номер по журналу CAS 9005-00-9
Tween®80 имеющийся в продаже полиоксиэтиленсорбитанмоноолеат, также известный как полисорбат 80, номер CAS 9005-65-6
Span®80 имеющийся в продаже сорбитанмоноолеат, номер CAS 1338-43-8
Во избежание сомнений, если в приведенных ниже примерах ссылаются на "полимер-PEG", он означает сополимер PLA-PEG, где сополимер имеет среднечисловую молекулярную массу приблизительно 16 кДа поли(молочной кислоты) и среднечисловую молекулярную массу приблизительно 5 кДа поли(этилен)гликоля. Такие полимеры имеются в продаже или могут быть получены способами, известными в данной области техники. Такие полимеры применяются, например, в WO 2010/005721.
ПРИМЕР 1: Получение терапевтических наночастиц, содержащих 2-(3-((7-(3-(этил(2-гидроксиэтил)амино)пропокси)хиназолин-4-ил)амино)-1Н-пиразол-5-ил)-N-(3-фторфенил)ацетамид, с использованием способа получения наноэмульсии
В данном примере продемонстрированы методики получения наночастиц, содержащих AZD1152 hqpa.
Методика получения наночастиц дезоксихолевой кислоты
1. Приготовление раствора полимера
1.1 В стеклянный флакон на 20 мл добавляют полимер-PEG, 350 мг.
1.2 В стеклянный флакон добавляют 3,15 г этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
2. Приготовление раствора лекарственного средства
2.1 Для получения 9% дезоксихолевой кислоты/ВА добавляют 1,8 г дезоксихолевой кислоты в 18,2 г ВА в 20 мл сцинтилляционном флаконе на основании таблицы рецептов.
2.2 Нагревают раствор при 80°С в течение 30 мин.
2.3 Взвешивают 150 мг терапевтического средства в 20 мл сцинтилляционном флаконе.
2.4 Добавляют описанную выше 9% дезоксихолевую кислоту к лекарственному средству и оставляют при 80°С на 15-30 мин до получения прозрачного раствора лекарственного средства.
2.5 Непосредственно перед получением препарата объединяют растворы лекарственного средства и полимера.
3. Приготовление водного раствора:
- 0,475% холат натрия, 4% бензиловый спирт в воде.
3.1 В бутылку на 1 л добавляют 4,75 г холата натрия и 955,25 г DI воды и перемешивают на магнитной мешалке до растворения.
3.2 Добавляют 40 г бензилового спирта к холату натрия/воде и перемешивают на магнитной мешалке до растворения.
4. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5:1
4.1 Наливают органическую фазу в водный раствор и гомогенизируют, используя ручной роторно-статорный гомогенизатор в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии.
4.2 Подают раствор через гомогенизатор высокого давления (110S) при установке давления примерно 11000 фунт/кв. дюйм на датчике для 1 отдельного пропуска с образованием наноэмульсии.
5. Формирование наночастиц
Наливают эмульсию в гаситель (DI вода) при температуре менее 5°С при перемешивании на магнитной мешалке. Соотношение гасителя и эмульсии составляет 10:1.
6. Добавляют 35% (мас./мас.) Tween® 80 в воде для гашения при соотношении 100:1 Tween® 80 и лекарственного средства по массе.
7. Концентрируют наночастицы посредством TFF
7.1 Концентрируют гаситель при TFF с кассетой 300 кДа Pall (мембраны 2×0,1 м2) до примерно 200 мл.
7.2 Подвергают диафильтрованию примерно 20 диаобъемов (4 литра) с использованием холодной DI воды.
7.3 Доводят объем до минимального.
7.4 Добавляют в сосуд 100 мл холодной воды и прокачивают через мембрану для промывания.
7.5 Собирают материал в стеклянный флакон, примерно 100 мл.
8. Определение концентрации сухого вещества в нефильтрованной конечной суспензии:
8.1 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
8.2 Определяют массу наночастиц в объеме высушенной суспензии.
9. Определение концентрации сухого вещества в конечной суспензии, отфильтрованной через 0,45 мкм фильтр:
9.1 Фильтруют приблизительно порцию образца конечной суспензии, после чего добавляют сахарозу через шприцевой фильтр 0,45 мкм.
9.2 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем отфильтрованного образца и сушат под вакуумом в лио/сушилке.
10. Добавляют 1 часть сахарозы к конечным 9 частям образца суспензии до достижения концентрации 10% сахарозы.
11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
Методика получения наночастиц докузата
1. Приготовление раствора полимера
1.1 В стеклянный флакон на 20 мл добавляют полимер-PEG, 750 мг.
1.2 В стеклянный флакон добавляют 2,75 г этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
2. Приготовление раствора лекарственного средства
2.1 Для получения 30% докузата/бензиловый спирт ("30% докузат/ВА"), используют таблицу 1.
2.2 Взвешивают 250 мг терапевтического средства в сцинтилляционный флакон на 20 мл.
2.3 Добавляют описанные выше 690 мг 30% докузата к лекарственному средству и перемешивают на вортексе в течение более 1 ч до получения прозрачного раствора лекарственного средства.
2.4 Непосредственно перед получением препарата добавляют раствор лекарственного средства и полимера.

3. Приготовление водного раствора:
- 0,475% холат натрия, 4% бензиловый спирт в воде.
3.1 В бутылку на 1 л добавляют 4,75 г холата натрия и 955,25 г DI воды и перемешивают на магнитной мешалке до растворения.
3.2 Добавляют 40 г бензилового спирта к холату натрия/воде и перемешивают на магнитной мешалке до растворения.
4. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5:1.
4.1 Наливают органическую фазу в водный раствор и гомогенизируют, используя ручной роторно-статорный гомогенизатор в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии.
4.2 Подают раствор через гомогенизатор высокого давления (110S) при установке давления примерно 11000 фунт/кв. дюйм на датчике для 1 отдельного пропуска с образованием наноэмульсии.
5. Формирование наночастиц
Наливают эмульсию в гаситель (DI вода) при температуре менее 5°С при перемешивании на магнитной мешалке. Соотношение гасителя и эмульсии составляет 10:1.
6. Добавляют 35% (мас./мас.) Tween® 80 в воде для гашения при соотношении 100:1 Tween® 80 и лекарственного средства по массе.
7. Концентрируют наночастицы посредством TFF
7.1 Концентрируют гаситель при TFF с кассетой 300 кДа Pall (мембраны 2×0,1 м2) до примерно 200 мл.
7.2 Подвергают диафильтрованию примерно 20 диаобъемов (4 литра) с использованием холодной DI воды.
7.3 Доводят объем до минимального.
7.4 Добавляют в сосуд 100 мл холодной воды и прокачивают через мембрану для промывания.
7.5 Собирают материал в стеклянный флакон, примерно 100 мл.
8. Определение концентрации сухого вещества нефильтрованной конечной суспензии:
8.1 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
8.2 Определяют массу наночастиц в объеме высушенной суспензии.
9. Определение концентрации сухого вещества в конечной суспензии, отфильтрованной через 0,45 мкм фильтр:
9.1 Фильтруют приблизительно порцию образца конечной суспензии, после чего добавляют сахарозу через шприцевой фильтр 0,45 мкм.
9.2 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем отфильтрованного образца и сушат под вакуумом в лио/сушилке.
10. Добавляют 1 часть сахарозы к конечным 9 частям образца суспензии до достижения концентрации 10% сахарозы.
11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
В варианте описанной выше методики докузат натрия можно использовать вместо холата натрия на стадии 3.1 выше.
ПРИМЕР 2: Получение характеристик терапевтических наночастиц, содержащих AZD1152 hqpa
В данном примере продемонстрировано, что совместная инкапсуляция с гидрофобными противоионами, такими как дезоксихолевая кислота и докузат, значительно улучшает содержание лекарственного вещества (содержание лекарственного вещества от примерно 3% вплоть до примерно 15%). Высвобождение терапевтического средства из наночастиц было существенно медленнее при включении в препарат в виде гидрофобной ионной пары по сравнению с контрольным препаратом.
Контрольные препараты
Контрольные препараты были получены в виде обыкновенных наночастиц ("НЧ") без каких-либо противоионов. НЧ получали с использованием полимерного матрикса PLA-PEG (16 кДа PLA / 5 кДа PEG) ("16/5 PLA-PEG") без дополнительных эксципиентов.
Терапевтическое средство растворяли в бензиловом спирте ("ВА") или ВА/воде с образованием раствора лекарственного средства, и в раствор лекарственного средства вливали раствор полимера в этилацетате ("ЕА") непосредственно перед добавлением в водный раствор для гомогенизации. В результате получают контрольный препарат в виде наночастиц с относительно низким содержанием лекарственного вещества (примерно 3%), высоким разрывом (примерно 20%) и быстрым высвобождением (более 50% за 4 ч) (смотри таблицу 1 и Фиг. 3). Эти результаты не являются необычными для активных фармацевтических ингредиентов (API) с относительно низкой молекулярной массой (MW) (менее 600 кДа) и/или меньшей гидрофобностью (log Р менее 3).

Препараты дезоксихолевой кислоты
Препараты дезоксихолевой кислоты получали согласно методике в примере 1, используя различные количества дезоксихолевой кислоты в органической фазе, как показано в таблице 3. Наночастицы получали, используя 16/5 PLA-PEG.
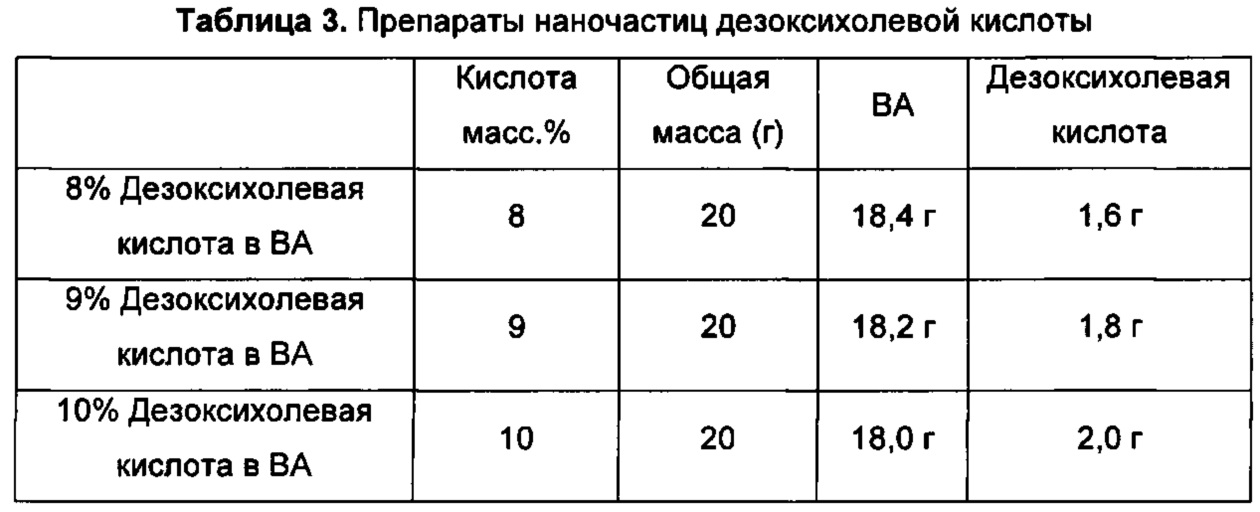
В таблице 4 ниже приведены характеристики препаратов дезоксихолевой кислоты. Данные свидетельствуют о том, что присутствие дезоксихолевой кислоты значительно повышает содержание API в конечных препаратах в виде наночастиц по сравнению с контрольными наночастицами.
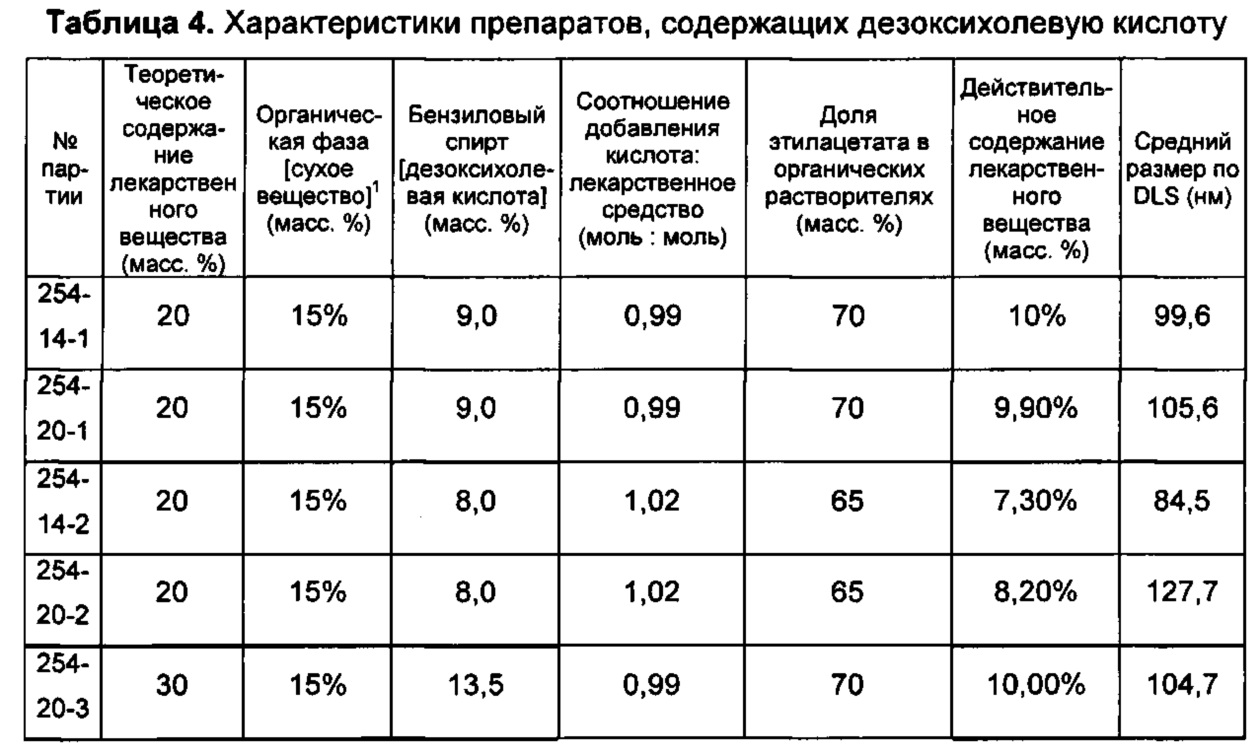
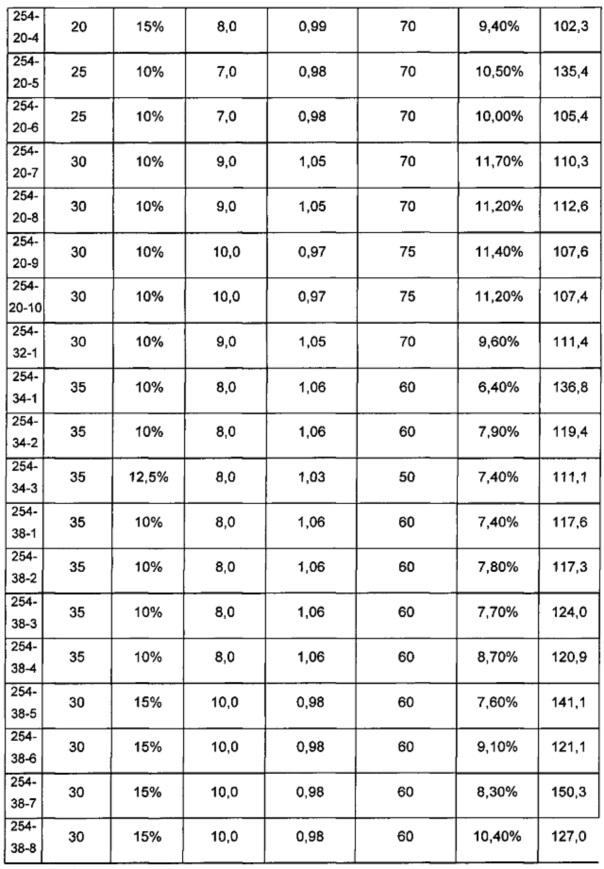
1 Данное значение = концентрация мас. % лекарственного вещества + полимер, деленная на содержание органических веществ, и не включает дезоксихолевую кислоту для этих серий.
DLS представляет собой динамическое светорассеяние.
На Фиг. 4 показано высвобождение in vitro терапевтического средства, показывающее контролируемое и медленное/пролонгированное высвобождение лекарственных средств из НЧ с дезоксихолевой кислотой по сравнению с контрольными НЧ без противоионов дезоксихолевой кислоты.
В таблице ниже описана композиция (в процентах по массе) каждого компонента в частице конкретного препарата в виде наночастиц, обозначенного в настоящем документе как "препарат F1".
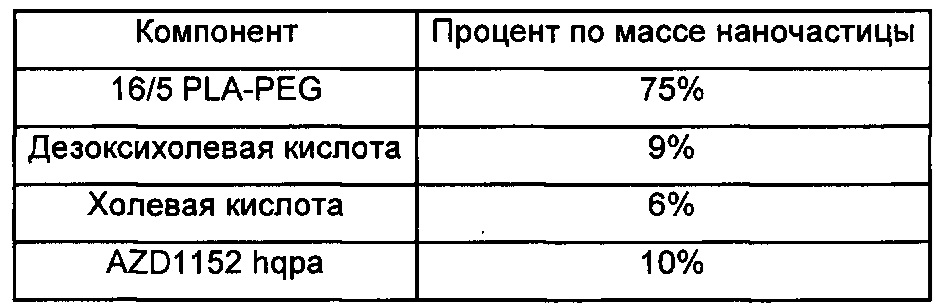
Препараты докузата
Докузат натрия (например, имеющийся в продаже как "Аэрозоль ОТ" или "АОТ") превращали в кислотную форму (то есть в диоктилсульфоянтарную кислоту), используя способ преобразования in situ перед смешиванием с лекарственным средством. Докузат натрия растворяли в ВА и добавляли концентрированный раствор HCl в контролируемых соотношениях HCl/докузат. Смесь перемешивали на вортексе, чтобы способствовать обмену протонами и преобразованию натриевой соли в форму свободной кислоты. Затем добавляли насыщенный раствор хлорида натрия и перемешивали с помощью вортекса, чтобы экстрагировать воду и соль хлорид натрия, образовавшуюся в ВА смеси. После перемешивания образец инкубировали при комнатной температуре для разделения фаз. Со временем постепенно образовались два слоя, ВА сверху и водный слой снизу. Верхний слой отсасывали, и он представлял собой растворитель лекарственного средства, содержащий противоион докузат. Концентрации докузата кислоты в ВА указаны как концентрации докузата натрия в ВА. Препараты докузата в виде наночастиц были получены с использованием методики в примере 1 с полимером 16/5 PLA/PEG, как для препарата дезоксихолевой кислоты. Типичные препараты докузата кислоты приведены в таблице 5.
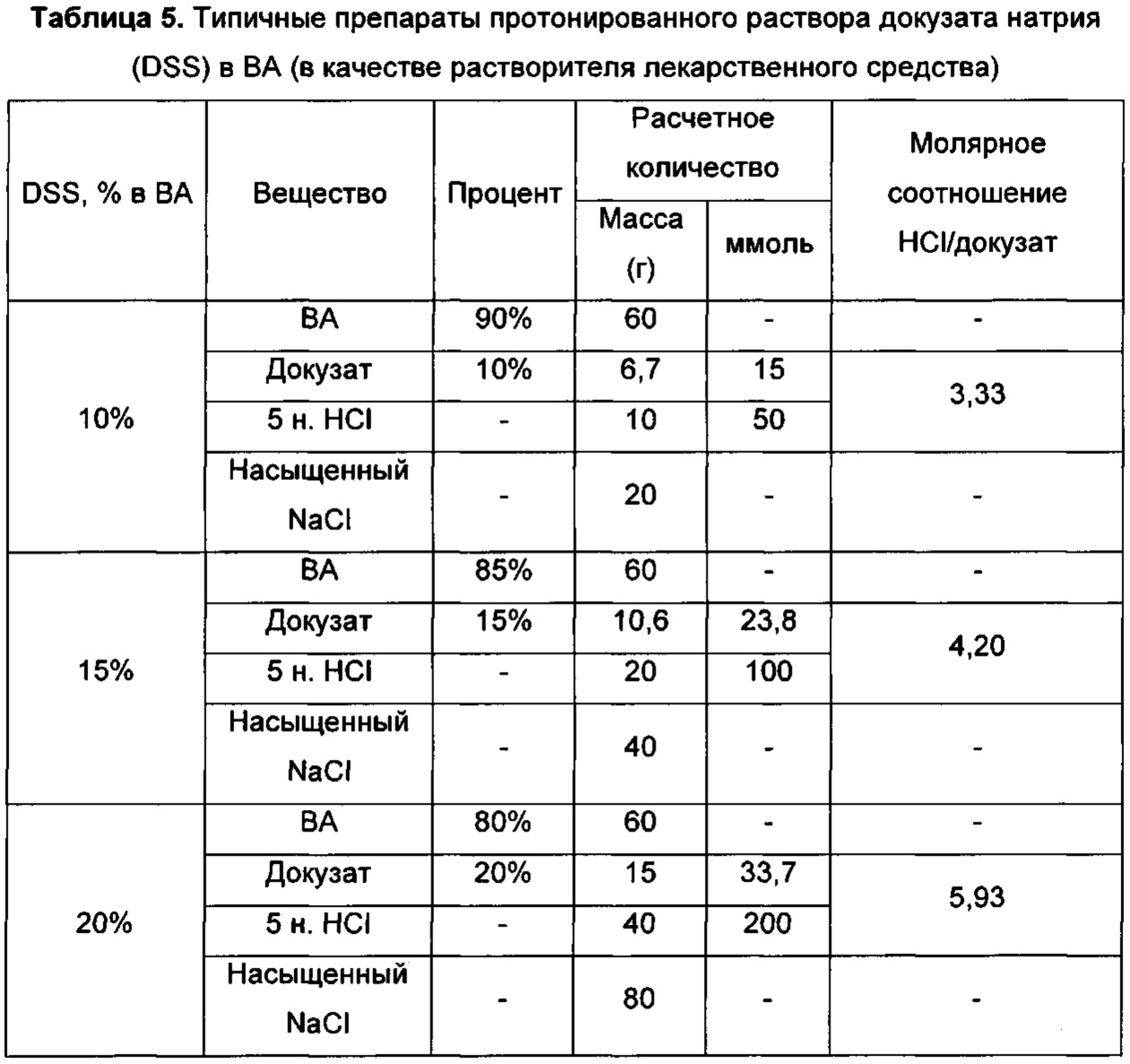
В таблице 6 ниже приведены характеристики репрезентативных препаратов докузата. Не желая ограничиваться какой-либо теорией, считают, что присутствие противоиона докузата служит для усиления инкапсуляции лекарственного средства и его содержания за счет процесса образования гидрофобной ионной пары (HIP).
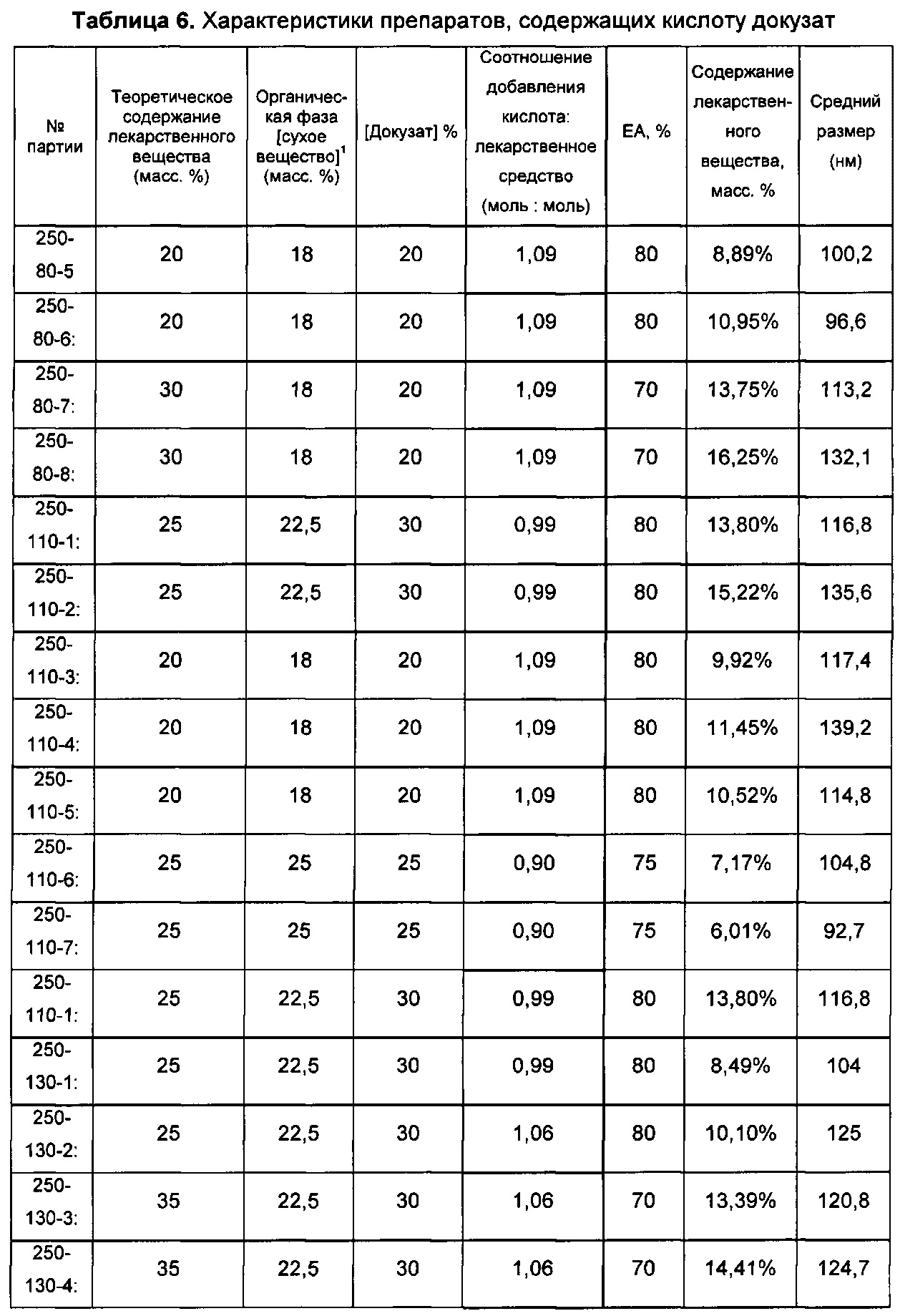

На Фиг. 5 показано высвобождение in vitro терапевтического средства, показывающее контролируемое и медленное/пролонгированное высвобождение лекарственных средств из НЧ с кислотой докузатом по сравнению с контрольными НЧ без противоионов докузата.
В таблице ниже описана композиция (в процентах по массе) каждого компонента в частице конкретного препарата в виде наночастиц, обозначенного в настоящем документе как "препарат F2".
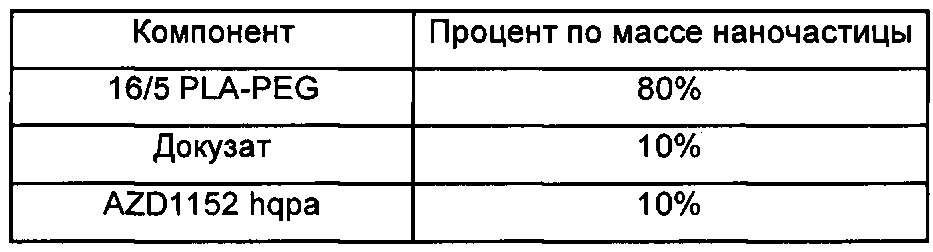
ПРИМЕР 3
Ниже описан препарат, содержащий холевую кислоту. Этот препарат обозначен в настоящем документе как "препарат Е".
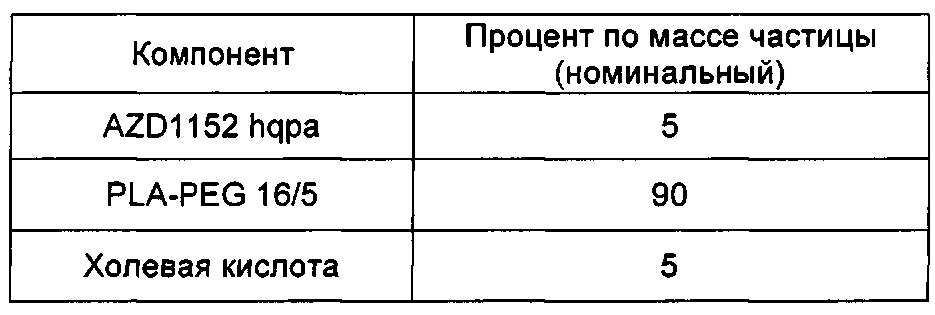
Методика получения препарата наночастиц дезоксихолевой кислоты
1. Приготовление раствора полимера
1.1 В стеклянный флакон на 20 мл добавляют полимер-PEG, 350 мг.
1.2 Добавляют в стеклянный флакон 8,11 г этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
2. Приготовление раствора лекарственного средства
2.1 Для получения 3% TFA/BA добавляют 63 мг TFA в 2,03 г ВА в 20 мл сцинтилляционном флаконе на основании таблицы рецепта.
2.2 Взвешивают 150 мг терапевтического средства в 20 мл сцинтилляционном флаконе.
2.3 Добавляют полученный выше 3% раствор TFA в ВА к лекарственному средству и перемешивают в течение 15-30 мин до получения прозрачного раствора лекарственного средства.
2.4 Непосредственно перед приготовлением препарата объединяют раствор лекарственного средства и полимера.
3. Приготовление водного раствора:
- 0,52% холат натрия, 4% бензиловый спирт в воде.
3.1 В бутылку на 1 л добавляют 5,2 г холата натрия и 954,8 г DI воды и перемешивают на магнитной мешалке до растворения.
3.2 Добавляют 40 г бензилового спирта к холату натрия/воде и перемешивают на магнитной мешалке до растворения.
4. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5:1.
4.1 Наливают органическую фазу в водный раствор и гомогенизируют с использованием ручного роторно-статорного гомогенизатора в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии.
4.2 Подают раствор через гомогенизатор высокого давления (110S) при установке давления примерно 11000 фунт/кв. дюйм на датчике для 1 отдельного пропуска с образованием наноэмульсии.
5. Формирование наночастиц
Наливают эмульсию в гаситель (DI вода) при температуре менее 5°С при перемешивании на магнитной мешалке. Отношение гасителя к эмульсии составляет 10:1.
6. Добавляют 35% (мас./мас.) Tween® 80 в воде для гашения при соотношении 100:1 Tween® 80 и лекарственного средства по массе.
7. Концентрируют наночастицы посредством TFF
7.1 Концентрируют гаситель при TFF с кассетой Pall с 300 кДа (мембраны 2×0,1 м2) до примерно 200 мл.
7.2 Подвергают диафильтрованию примерно 20 диаобъемов (4 литра) с использованием холодной DI воды.
7.3 Доводят объем до минимального.
7.4 Добавляют в сосуд 100 мл холодной воды и прокачивают через мембрану для промывания.
7.5 Собирают материал в стеклянный флакон, примерно 100 мл.
8. Определение концентрации сухого вещества нефильтрованной конечной суспензии:
8.1 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
8.2 Определяют массу наночастиц в объеме высушенной суспензии.
9. Определение концентрации сухого вещества в конечной суспензии, профильтрованной через 0,45 мкм фильтр:
9.1 Фильтруют приблизительно порцию образца конечной суспензии, после чего добавляют сахарозу через шприцевой фильтр 0,45 мкм.
9.2 В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем отфильтрованного образца и сушат под вакуумом в лио/сушилке.
10. Добавляют 1 часть сахарозы к конечным 9 частям образца суспензии до достижения концентрации сахарозы 10% по массе.
11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
ПРИМЕР 4
Дополнительный препарат готовили способом, подобным способу приготовления препарата диоктилсульфоянтарной кислоты в примере 1. Этот дополнительный препарат подробно описан в таблице ниже и обозначен в настоящем документе как "препарат В".

ПРИМЕР 5 - Терапевтический индекс
Данные получены в модели ксенотрансплантата опухоли человека SW620 у крысы и мыши.
Известно, что модель самок бестимусных крыс, несущих SW620, склонна к самопроизвольным регрессиям опухоли, которые больше распространены при длительных исследованиях ксенотрансплантата, и эти данные не показаны.
Исследования терапевтического индекса у крыс (SW620 у самок бестимусных крыс)
Самок бестимусных крыс разводили в компании AstraZeneca и вводили в исследование при минимальной массе 150 г. В бок животного прививали опухолевые клетки человека SW620, и дозирование начинали, когда опухоли достигали 0,4-0,9 см3. Соединения дозировали внутривенно (IV) по 5 мл/кг либо контроля, либо препарата AZD1152, либо AZD1152 hqpa в виде наночастиц В или Е. AZD1152 дозировали в носителе трис-буфере (сутки 1-4 IV, каждая доза составляла 25 мг/кг), а препарат AZD1152 hqpa в виде наночастиц дозировали в физиологическом растворе (доза составляла 25 мг/кг на каждые из суток 1 и 3 IV). В указанные моменты времени животных умерщвляли и брали образцы опухоли, крови и бедренной кости/костного мозга. Воздействия обработки на опухоль и костный мозг оценивались специалистом-патологом на срезах, полученных из бедренной кости, окрашенных гематоксилином и эозином.
Воздействия AZD1152 и препаратов AZD1152 в виде наночастиц В и Е на опухоль характеризуют на основании наличия увеличенных полиплоидных ядер. На Фиг. 6 показаны репрезентативные изображения опухоли после обработки каждым видом терапевтического средства из образцов, полученных на сутки 5. Воздействия AZD1152 и препаратов в виде наночастиц AZD1152 hqpa В и Е на костный мозг характеризуют на основании потери клеток из костного мозга. На Фиг. 6 показаны репрезентативные изображения опухоли после обработки каждым видом терапевтического средства из образцов, полученных на сутки 5.
Фиг. 6 показывает, что препарат Е, доставляемый при половинной интенсивности дозы AZD1152, обладает повышенной эффективностью (А), индуцирует подобный спектр патологических изменений опухоли (В) и сохраняет больше костного мозга (С).
Противоопухолевое исследование у мыши (SW620 у самцов бестимусных мышей)
Самцов бестимусных мышей разводили в компании AstraZeneca. В бок животного прививали опухолевые клетки человека SW620, а затем рандомизировали их в исследование, когда опухоли достигали приблизительно 0,25 см3. AZD1152 дозировали в носителе трис-буфере при указанной концентрации. Препарат в виде наночастиц AZD1152 hqpa Е дозировали в физиологическом растворе. Предшествующая доклиническая работа и методологии работы с AZD1152 опубликованы в статье Wilkinson et al, Clinical Cancer Research 2007 (13) 3682.
Данные, полученные в модели ксенотрансплантата опухоли человека SW620 у крысы и мыши, позволяют предположить, что доставка AZD1152 IV в дозе 25 мг/кг в течение 4 суток приводит к максимальной эффективности (суммарная доза 100 мг/кг).
В модели SW620 у мыши наночастицы из примера 3 продемонстрировали эффективность, эквивалентную AZD1152 IV при дозе 100 мг/кг, и эта эффективность достигалась при более низких дозах, составляющих всего лишь 25 мг/кг в виде однократной дозы или даже 5 мг/кг на сутки 1 и 3 (эквивалент 10 мг/кг), что показывает, что эффективность можно обеспечить, используя ряд различных режимов и значительно более низкие дозы при применении препарата AZD1152 hqpa в виде наночастиц, чем при применении IV препарата AZD1152.
Следовательно, заявленный препарат AZD1152 hqpa в виде наночастиц показал эквивалентную или улучшенную противоопухолевую эффективность при доставке при пониженной интенсивности дозы. Это может привести в результате к меньшим побочным эффектам, например меньшей токсичности для костного мозга.
Максимальная активность была достигнута при эквиваленте дозы 50 мг/кг препарата AZD1152 hqpa в виде наночастиц по сравнению со 100 мг/кг IV AZD1152. В результате применения препаратов по настоящему изобретению можно обеспечить возможность получения пациентом большего количества активного ингредиента при таких же побочных эффектах, как для установленной ранее максимально переносимой дозы AZD1152, вводимой IV. Таким образом, можно улучшить профиль безопасности препаратов по настоящему изобретению.
На Фиг. 7 представлены данные исследований эффективность/доза для препарата Е в модели ксенотрансплантата SW620 у бестимусной мыши. В данном исследовании AZD1152 дозировали на сутки 0-3 в дозе 25 мг/кг (суммарно 100 мг/кг). Препарат Е дозировали при ряде различных режимов, как описано выше.
ПРИМЕР 6
Воздействие in vivo изучали, сравнивая AZD1152 IV (дозируемый 4×25 мг/кг) сутки 1-4 IV) с препаратами В (дозируемым 2×25 мг/кг на сутки 1 и 3 IV) и Е (дозируемым 2×25 мг/кг на сутки 1 и 3 IV) из исследования на бестимусных крысах, описанного в примере 5. Результаты показаны (усредненное значение для нескольких точечных данных) на Фиг. 8. Концентрации, измеренные после дозы AZD1152 IV, представляют собой концентрации для лекарственного средства AZD1152 hqpa.
Данные показывают суммарное количество AZD1152 hqpa, экстрагированного из образца (внутри наночастиц и высвобожденного из них) в момент отбора образца, и, таким образом, показывают, насколько долго либо лекарственное средство, либо инкапсулированное лекарственное средство все еще находится в организме в течение данного отрезка времени, то есть длительность воздействия AZD1152 hqpa после дозирования. Данные показывают, что меньшая интенсивность дозы приводила к повышенной суммарной концентрации лекарственного средства в крови, сохраняющейся в течение более длительного периода времени при доставке в препарате в виде наночастиц по сравнению с внутривенно активным лекарственным средством.
Краткое изложение биоаналитического способа измерения суммарного лекарственного средства из образцов in vivo, дозированного с помощью наночастиц
Данное измерение представляет собой многостадийный способ, который необходимо по возможности выполнять на льду, чтобы остановить дальнейшее высвобождение лекарственного средства из наночастиц.
Общий способ экстракции лекарственного средства:
- Растворяют твердое исходное лекарственное средство в DMSO до концентрации 2 мМ.
- Переносят аликвоты по 50 мкл каждого образца плазмы, используя соответствующий коэффициент разведения, в 96-луночный планшет.
- Получают стандартную калибровочную кривую, используя дозирующую рабочую станцию Hamilton Star Robot, из исходного раствора 2 мМ в DMSO (подробное описание получения см. в приложении 1).
- Добавляют 150 мкл ацетонитрила с внутренним стандартом.
- Встряхивают планшет для перемешивания образцов.
- Осаждают на центрифуге при 4500 об/мин в течение 10 минут.
- Переносят 50 мкл супернатанта в чистый 96-луночный планшет.
- Добавляют 300 мкл воды.
- Анализируют с помощью ЖХ-МС/МС (жидкостная хроматография с масс-спектрометрией/тандемная масс-спектрометрия).
Приложение 1 - Подробное описание получения стандартной кривой
Сначала робот добавляет подходящий разбавитель в микропланшет для получения серийных разведений исходного раствора справа налево в микропланшете, один ряд на соединение (смотри таблицу А ниже):
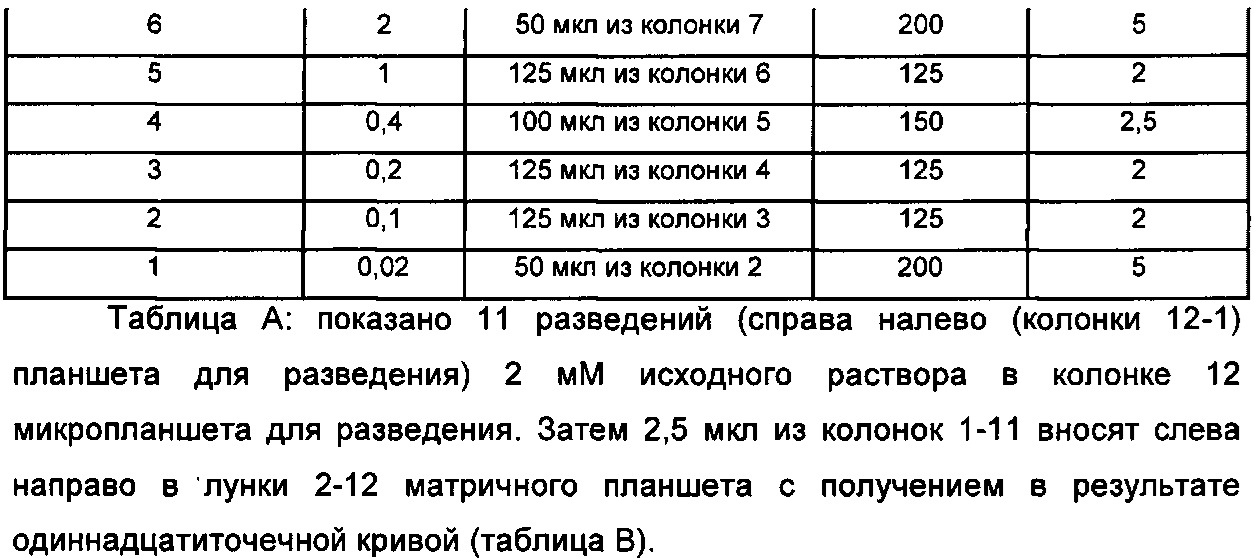
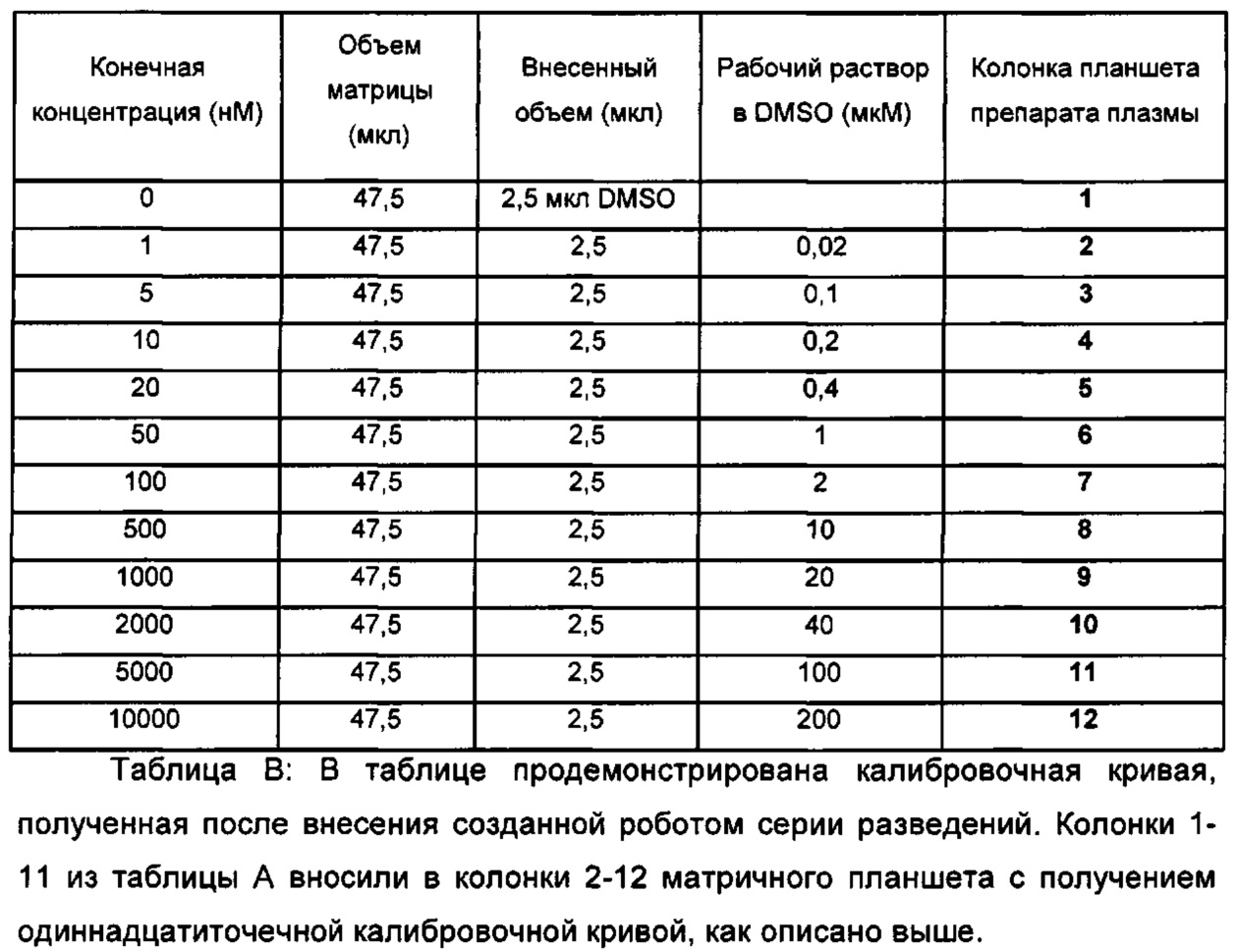
Параметры ЖХ-МС/МС

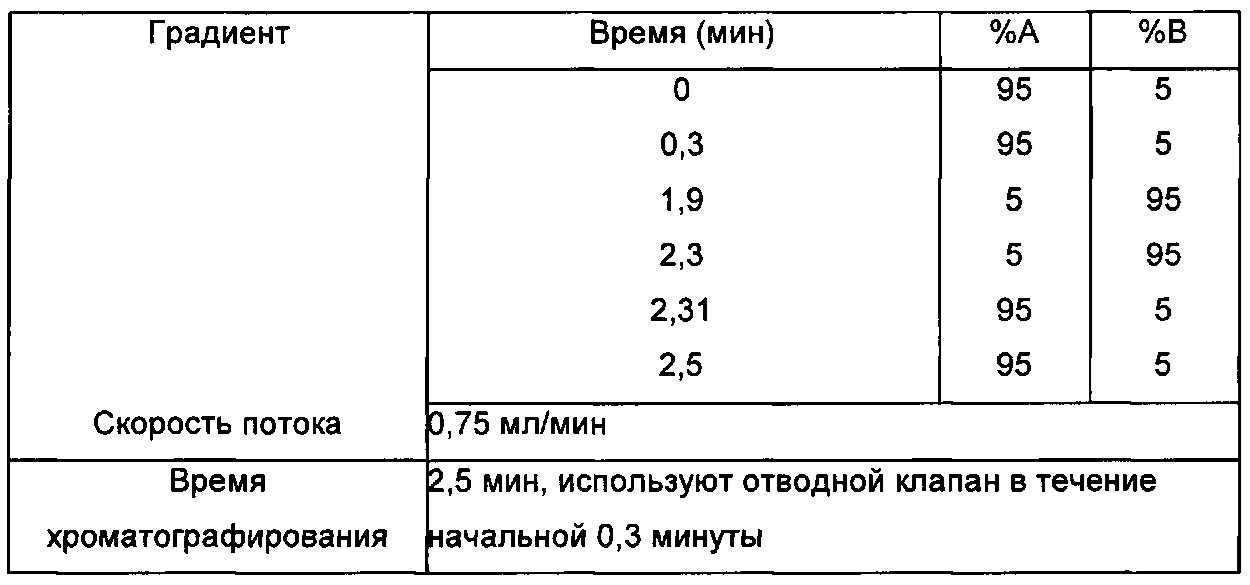
Параметры оптимизации
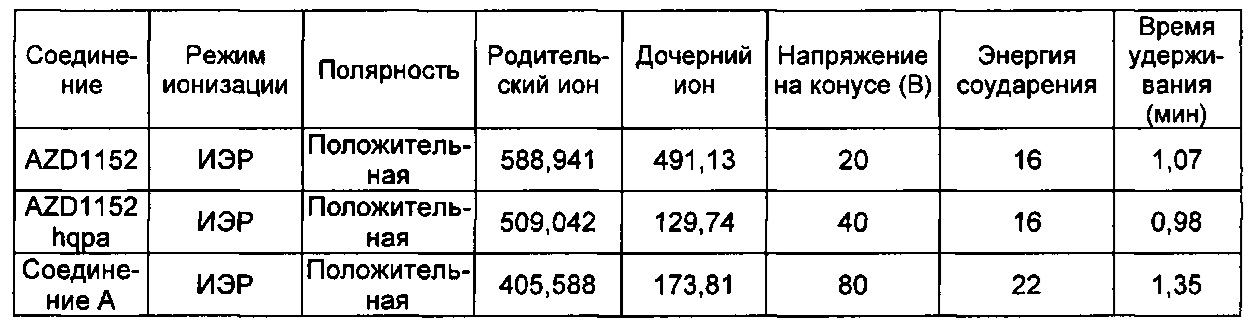
Соединение А: 2-этил-4-{[2'-(1Н-тетразол-5-ил)дифенил-4-ил]метокси}хинолин (внутренний стандарт). Смотри, например, WO 92/02508 и WO 92/13853.
ПРИМЕР 7 (использование номинальной серии 1 г)
Методика получения наночастиц с памовой кислотой
Наночастицы AZD1152 hqpa с памовой кислотой получали согласно описанному ниже способу.
Состав (препарата, далее в настоящем документе описанного как препарат G1):
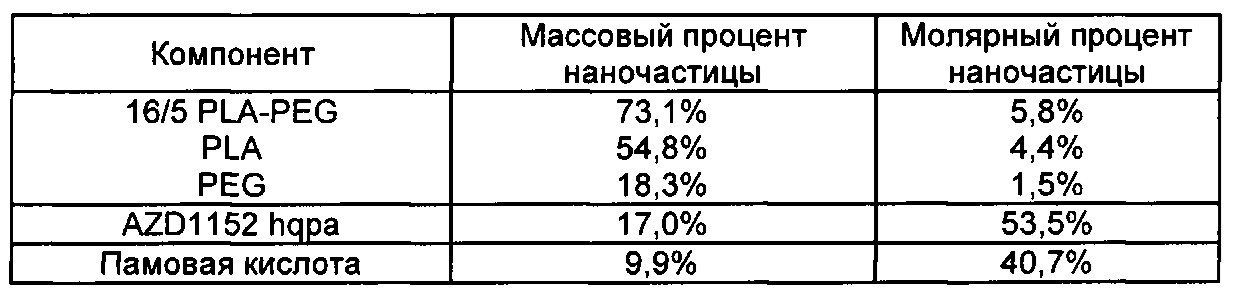
7.1 Приготовление раствора памовой кислоты. 29% (мас./мас.) раствор памовой кислоты в DMSO готовили путем смешивания 2,9 г памовой кислоты с 7,1 г DMSO в контейнере. Контейнер нагревали в печи с подогревом при 70-80°С до растворения всей памовой кислоты.
7.2 Приготовление раствора раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %). Трифторуксусную кислоту (TFA) (3,2 г), деионизированную (DI) воду (3,0 г) и бензиловый спирт (ВА) (33,8 г) объединяли с получением раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %).
7.3 Приготовление буфера:
Для получения 1000 мл 0,17 М фосфатного буфера (рKа2=7,2), рН 6,5: готовят два исходных буфера: А. растворяют 13,26 г одноосновного фосфата натрия, безводного NaH2PO4 Н2О (Mr=119,98) в 650 мл очищенной воды и В. растворяют 10,82 г двухосновного фосфата натрия, безводного NaH2PO4 (Mr=141,96) в 650 мл очищенной воды. Добавляют буфер В к буферу А при перемешивании до рН 6,50 при лабораторной температуре 25°С.
Альтернативно:
Для получения 1000 мл 0,17 М натрийфосфатного буфера при рН 6,5: в примерно 800 мл DI воды растворяют 16,26 г одноосновного фосфата натрия, дигидрата (NaH2PO4-2H2O; молекулярная масса по формуле (FW) 156,01) и 11,70 г двухосновного фосфата натрия, дигидрата (Na2HPO4-2H2O; FW 177,99) и добавляют достаточное дополнительное количество воды до получения 1000 мл при лабораторной температуре 25°С.
7.4 Приготовление раствора полимера
- В стеклянный флакон на 20 мл добавляют полимер-PEG, 700 мг
- Добавляют в стеклянный флакон 7078 мг этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
7.5 Приготовление водного раствора:
- 0,12% Brij®100, 4% бензиловый спирт в воде
- в бутылку на 1 л добавляют 1,2 г Brij®100 и 958,8 г DI воды и перемешивают на магнитной мешалке до растворения.
- Добавляют 40 г бензилового спирта к Brij®/вода и перемешивают на магнитной мешалке до растворения.
7.6 Приготовление раствора лекарственного средства
- Взвешивают 300 мг AZD1152 hqpa в 20 мл сцинтилляционном флаконе
- Добавляют 2399 мг описанного выше раствора 8% TFA/7,5% воды/ВА к AZD1152
- Добавляют 634 мг описанного выше раствора 29% памовой кислоты/DMSO к раствору лекарственного средства и перемешивают на вортексе до получения прозрачного раствора лекарственного средства
- Непосредственно перед приготовлением препарата объединяют раствор лекарственного средства и полимера.
7.7. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5:1.
- Наливают органическую фазу в водный раствор и гомогенизируют с использованием ручного роторно-статорного гомогенизатора в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии. Хранят во льду в течение 10-15 минут.
- Подают раствор через гомогенизатор высокого давления (110S) при установке давления примерно 9000 фунт/кв. дюйм на впускном датчике сжатого воздуха для 1 отдельного пропуска с образованием наноэмульсии.
Формирование наночастиц
- Наливают эмульсию в гаситель (0,17 М фосфат натрия, рН 6,5) при температуре менее 5°С при перемешивании на магнитной мешалке. Гарантируют, что с момента начала сбора перед гашением прошло по меньшей мере 5 минут. Отношение гасителя к эмульсии составляет 10:1.
- Добавляют 35% (мас./мас.) Tween® 80 в воде для гашения при соотношении 100:1 Tween® 80 и лекарственного средства по массе.
- Концентрируют наночастицы посредством фильтрования с тангенциальным потоком (TFF)
- Концентрируют гаситель при TFF с кассетой Pall с 300 кДа (мембраны 3×0,1 м2) до примерно 200 мл.
- Подвергают диафильтрованию примерно 20 диаобъемов (4 литра), используя холодную DI воду.
- Доводят объем до минимального.
- Добавляют в сосуд 100 мл холодной воды и перекачивают через мембрану для промывания.
- Собирают материал в стеклянный флакон, примерно 100 мл.
7.8. Определение концентрации сухого вещества нефильтрованной конечной суспензии:
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
- Определяют массу наночастиц в объеме высушенной суспензии.
7.9. Определение концентрации сухого вещества в конечной суспензии, профильтрованной через 0,45 мкм фильтр:
- Фильтруют порцию образца конечной суспензии, после чего добавляют сахарозу через шприцевой фильтр 0,45 мкм.
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем профильтрованного образца и сушат под вакуумом в лио/сушилке.
7.10. Добавляют 1 часть сахарозы к конечным 9 частям образца суспензии до достижения концентрации 10% сахарозы.
7.11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
На Фиг. 9 показано высвобождение in vitro репрезентативного AZD1152 hqpa, демонстрирующее контролируемое и медленное/пролонгированное высвобождение лекарственных средств из наночастиц с памовой кислотой по сравнению с высвобождением из базовых наночастиц без противоионов памовой кислоты (полученных, как описано для контрольных препаратов в примере 2).
Другой препарат с памовой кислотой, далее в настоящем документе обозначенный как препарат G2, был получен, как описано ниже (используя номинальную серию 1 г):
Состав:
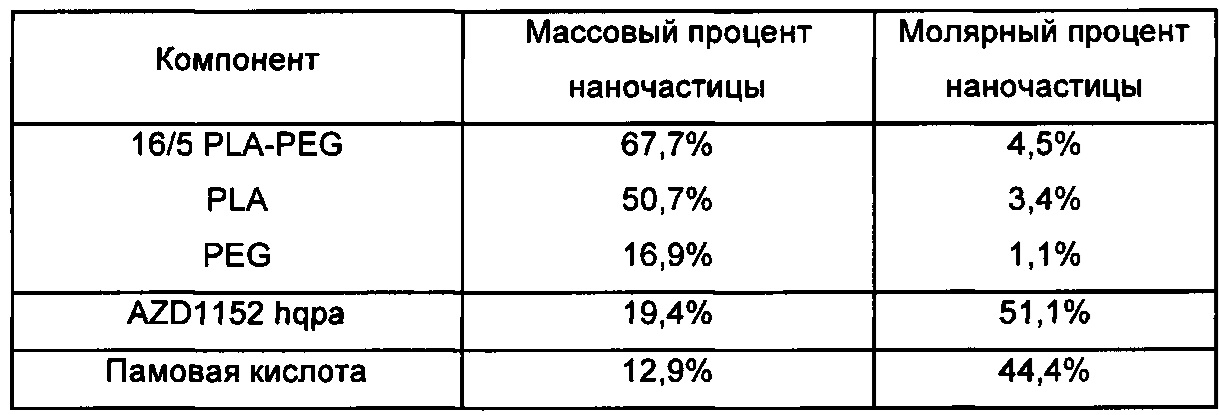
ПРИМЕР 7а
7а.1. Приготовление раствора памовой кислоты. 29% (мас./мас.) раствор памовой кислоты в DMSO готовили путем смешивания 2,9 г памовой кислоты с 7,1 г DMSO в контейнере. Контейнер нагревали в печи с подогревом при 70-80°С до растворения всей памовой кислоты.
7а.2. Приготовление раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %). Трифторуксусную кислоту (TFA) (3,2 г), деионизированную (DI) воду (3,0 г) и бензиловый спирт (ВА) (33,8 г) объединяли с получением раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %).
7а.3. Приготовление буфера:
Для получения 1000 мл 0,17 М фосфатного буфера (рKа2 7,2), рН 6,5: готовят два исходных буфера: А. растворяют 13,26 г одноосновного фосфата натрия, безводного NaH2PO4 H2O (Mr 119,98) в 650 мл очищенной воды и В. растворяют 10,82 г двухосновного фосфата натрия, безводного NaH2PO4 (Mr 141,96) в 650 мл очищенной воды. Добавляют буфер В к буферу А при перемешивании до рН 6,50 при лабораторной температуре 25°С.
Альтернативно:
Для получения 1000 мл 0,17 М натрийфосфатного буфера при рН 6,5: в примерно 800 мл DI воды растворяют 16,26 г одноосновного фосфата натрия, дигидрата (NaH2PO4-2H2O; FW 156,01) и 11,70 г двухосновного фосфата натрия, дигидрата (Na2HPO4-2H2O; FW 177,99) и добавляют достаточное дополнительное количество воды до получения 1000 мл при лабораторной температуре 25°С.
7а.4. Приготовление раствора полимера
- В стеклянный флакон на 20 мл добавляют полимер-PEG, 700 мг
- Добавляют в стеклянный флакон 6572 мг этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
7а.5. Приготовление водного раствора:
- 0,15% Brij®100, 4% бензиловый спирт в воде
- В бутылку на 1 л добавляют 1,5 г Brij®100 и 958,5 г DI воды и перемешивают на магнитной мешалке до растворения.
- Добавляют 40 г бензилового спирта к Brij®/вода и перемешивают на магнитной мешалке до растворения.
7а.6. Приготовление раствора лекарственного средства
- Взвешивают 300 мг AZD1152 hqpa в 20 мл сцинтилляционном флаконе.
- Добавляют 2746 мг описанного выше раствора 8% TFA/7,5% вода/ВА к AZD1152.
- Добавляют 792 мг описанного выше 29% раствора памовой кислоты/DMSO к раствору лекарственного средства и перемешивают на вортексе до получения прозрачного раствора лекарственного средства.
- Непосредственно перед приготовлением препарата объединяют раствор лекарственного средства и полимера.
7а.7. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5:1.
- Наливают органическую фазу в водный раствор и гомогенизируют с использованием ручного роторно-статорного гомогенизатора в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии. Хранят на льду в течение 10 минут.
- Подают раствор через гомогенизатор высокого давления (110S) при установке давления примерно 9000 фунт/кв. дюйм на впускном датчике сжатого воздуха для 1 отдельного пропуска с образованием наноэмульсии.
Формирование наночастиц:
- Сразу наливают эмульсию в гаситель (0,17 М фосфат натрия, рН 6,5) при температуре менее 5°С при перемешивании на магнитной мешалке. Отношение гасителя к эмульсии составляет 10:1.
- Добавляют 35% (мас./мас.) Tween® 80 в воде для гашения при соотношении 100:1 Tween® 80 и лекарственного средства по массе.
- Концентрируют наночастицы посредством фильтрования с тангенциальным потоком (TFF).
- Концентрируют гаситель при TFF с кассетой Pall с 300 кДа (мембраны 3×0,1 м2) до примерно 200 мл.
- Подвергают диафильтрованию примерно 20 диаобъемов (4 литра), используя холодную DI воду.
- Доводят объем до минимального.
- Добавляют в сосуд 100 мл холодной воды и перекачивают через мембрану для промывания.
- Собирают материал в стеклянный флакон, примерно 100 мл.
7а.8. Определение концентрации сухого вещества конечной нефильтрованной суспензии:
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
- Определяют массу наночастиц в объеме высушенной суспензии.
7а.9. Определение концентрации сухого вещества суспензии, профильтрованной через фильтр 0,45 мкм:
- Фильтруют порцию образца конечной суспензии, после чего добавляют сахарозу через 0,45 мкм шприцевой фильтр;
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем фильтрованного образца и сушат под вакуумом в лио/сушилке.
7а.10. Добавляют 1 часть сахарозы к конечным 9 частям образца суспензии до достижения концентрации сахарозы 10% по массе.
7a.11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
ПРИМЕР 7b
Ниже описан дополнительный способ получения препарата G1 (номинальная серия 1 г):
7b.1. Приготовление раствора памовой кислоты. 29% (мас./мас.) раствор памовой кислоты в DMSO готовили путем смешивания 2,9 г памовой кислоты с 7,1 г DMSO в контейнере. Контейнер нагревали в термостате при 70-80°С до растворения всей памовой кислоты.
7b.2. Приготовление раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %). Объединяли трифторуксусную кислоту (TFA) (3,2 г), деионизованную (DI) воду (3,0 г) и бензиловый спирт (ВА) (33,8 г) с получением раствора 8% TFA/7,5% воды/84,5% бензилового спирта (мас. %).
7b.3. Приготовление буфера:
Для получения 1000 мл 0,17 М фосфатного буфера (рKа2 7,2), рН 6,5: готовят два исходных буфера: А. растворяют 13,26 г одноосновного фосфата натрия, безводного NaH2PO4 Н2О (Mr 119,98) в 650 мл очищенной воды и В. растворяют 10,82 г двухосновного фосфата натрия, безводного NaH2PO4 (Mr 141,96) в 650 мл очищенной воды. Добавляют буфер В к буферу А при перемешивании до рН 6,50 при лабораторной температуре 25°С.
Альтернативно:
Для получения 1000 мл 0,17 М натрийфосфатного буфера при рН 6,5: в примерно 800 мл DI воды растворяют 16,26 г одноосновного фосфата натрия, дигидрата (NaH2PO4-2H2O; FW 156,01) и 11,70 г двухосновного фосфата натрия, дигидрата (Na2HPO4-2H2O; FW 177,99) и добавляют достаточное дополнительное количество воды до получения 1000 мл при лабораторной температуре 25°С.
7b.4. Приготовление раствора полимера
- В стеклянный флакон на 20 мл добавляют полимер-PEG, 591,3 мг.
- Добавляют в стеклянный флакон 5978,6 мг этилацетата и перемешивают на вортексе в течение ночи с получением раствора полимер-ЕА.
7b.5. Приготовление водного раствора:
- 0,12% Brij®100, 4% бензиловый спирт, 5,7% DMSO в воде.
- В бутылку на 1 л добавляют 1,4 г Brij® 100 и 901,6 г DI воды и перемешивают на магнитной мешалке до растворения.
- Добавляют 40 г бензилового спирта и 57 г DMSO к Brij®/вода и перемешивают на магнитной мешалке до растворения.
7b.6. Приготовление раствора лекарственного средства
- Взвешивают 253,4 мг AZD1152 hqpa в 20 мл сцинтилляционном флаконе.
- Добавляют 2026,8 мг описанного выше раствора 8% TFA/7,5% воды/ВА к AZD1152.
- Добавляют 535,5 мг описанного выше раствора 29% памовая кислота/DMSO к раствору лекарственного средства и перемешивают на вортексе до получения прозрачного раствора лекарственного средства.
- Непосредственно перед приготовлением препарата объединяют раствор лекарственного средства и полимера.
7b.7. Формирование эмульсии. Соотношение водной фазы и органической фазы составляет 5,5:1.
- Наливают органическую фазу в водный раствор и гомогенизируют с использованием ручного роторно-статорного гомогенизатора в течение 10 секунд при комнатной температуре с образованием крупнодисперсной эмульсии. Хранят во льду в течение 10-15 минут.
- Подают раствор через гомогенизатор высокого давления (11 OS) при установке давления примерно 9000 фунт/кв. дюйм на впускном датчике сжатого воздуха для 1 отдельного пропуска с образованием наноэмульсии.
Формирование наночастиц
- Наливают эмульсию в гаситель (0,17 М фосфат натрия, рН 6,5) при температуре менее 5°С при перемешивании на магнитной мешалке. Гарантируют, чтобы с начала сбора перед гашением прошло по меньшей мере 5 минут. Отношение гасителя к эмульсии составляет 3:1 по массе.
- Добавляют 35% (мас./мас.) Tween® 80 в воде к гасителю при соотношении 20:1 Tween® 80 и лекарственного средства по массе.
- Концентрируют наночастицы посредством фильтрования в тангенциальном потоке (TFF).
- Концентрируют гаситель при TFF с кассетой Pall с 300 кДа (мембраны 3×0,1 м2) до примерно 200 мл.
- Подвергают диафильтрованию примерно 20 диаобъемов (4 литра), используя DI воду при температуре окружающей среды.
- Доводят объем до минимального.
- Добавляют в сосуд 100 мл DI воды и перекачивают через мембрану дл промывания.
- Собирают материал в стеклянный флакон, примерно 100 мл.
7b.8. Определение концентрации сухого вещества нефильтрованной конечной суспензии:
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем конечной суспензии и сушат под вакуумом в лио/сушилке.
- Определяют массу наночастиц в объеме высушенной суспензии.
7b.9. Определение концентрации сухого вещества конечной суспензии, фильтрованной через 0,45 мкм:
- Фильтруют часть образца конечной суспензии, после чего добавляют сахарозу через 0,45 мкм шприцевой фильтр.
- В точно взвешенный сцинтилляционный флакон на 20 мл добавляют объем фильтрованного образца и сушат под вакуумом в лио-сушилке.
7b.10. Добавляют 1 часть сахарозы к конечным 9 частям образца нефильтрованной суспензии до достижения 10% сахарозы по массе.
7b.11. Замораживают оставшийся образец нефильтрованной конечной суспензии с сахарозой.
ПРИМЕР 8: Сравнение препаратов Е, F1 и F2
Препарат Е был описан в примере 3. Препараты F1 и F2 были описаны в примере 2.
Воздействие in vivo
На Фиг. 10 показано сравнение воздействия in vivo у крысы для препаратов Е, F1 и F2. Эксперименты проводили при однократных дозах 25 мг/кг у крыс и анализировали способом, аналогичным описанному в примере 6.
Данные по эффективности in vivo
Данные, представленные на Фиг. 11, показывают, что препараты Е, F1 и F2 приводят к эквивалентной эффективности после краткосрочного дозирования у бестимусных крыс с прижившимися ксенотрансплантатами опухоли SW620. Эксперименты проводили в соответствии со способами, описанными в примере 5. Крысам, несущим опухоли SW620, дозировали AZD1152 в дозе 25 мг/кг ежесуточно в течение 4 суток или препарат Е, F1 и F2 в дозе 25 мг/кг на сутки 0 и 2. Препараты Е, F1 и F2 приводят к эквивалентной эффективности. Эффективность была эквивалентна AZD1152 и сравнима с наблюдаемой в предыдущих исследованиях для AZD1152 и препарата Е в данный момент времени. Исследование останавливали на сутки 9, чтобы дать возможность анализа фармакодинамических маркеров опухоли и костного мозга. Эти данные демонстрируют, что препараты Е, F1 и F2 приводят к эквивалентной эффективности.
Сравнение действия препаратов Е, F1 и F2 в виде наночастиц на биомаркеры опухоли фосфо-гистоны Н3
В данном эксперименте сравнивают действие препаратов Е, F1 и F2 на фосфорилирование фосфогистона Н3 (рНН3) в опухолях SW620. AZD1152 включали в качестве положительного контроля. Активность измеряли в виде ингибирования фосфорилирования гистона Н3 на Ser10 (рНН3 в качестве чувствительного, высоко динамичного суррогатного маркера активности киназы Аврора В). Средний уровень положительности рНН3 [%] вычисляли для клеток в фазе G2/M клеточного цикла для каждой экспериментальной группы через 24 ч и 96 ч после 1й дозы и сравнивали с уровнем рНН3, наблюдаемым для клеток в фазе клеточного цикла G2/M, которые были извлечены из опухолей, обработанных плацебо BIND (обозначенным здесь как 100%). Статистическую значимость вычисляли с использованием оценки неодинаковых дисперсий с помощью t-критерия Стьюдента (*р<0,05, ** р<0,01, *** р<001, не значимо: Р>0,05).
Препараты (препараты Е, F1 и F2) дозировали, как описано выше, в ксенотрансплантаты ободочной кишки опухоли SW620 у самок бестимусных крыс. Крысам инъецировали IV либо плацебо BIND (0 мг/кг), либо AZD1152 или препарат AZD1152 hqpa E/F1/F2 в дозе 25 мг/кг на сутки 1 и прекращали введение на сутки 2 (24 ч после 1й дозы) или на сутки 5 (96 ч после 1й дозы). Замороженные опухоли разъединяли, используя Medimachine (BD Biosystems), фиксировали 80% этанолом в течение минимум 12 ч и готовили для анализа на содержание ДНК (окрашивание иодидом пропидия (PI; propidium iodide)) и анализа рНН3 с помощью проточной цитометрии с использованием анализатора сортировки флуоресцентно-активированных клеток BD FACS Canto (первое антитело к рНН3: Millipore 06-570; второе антитело: второе антитело к IgG кролика, конъюгированное с флуоресцеином (FITC) Millipore AP307F), как описано ранее в статье Wilkinson, RW et al., Clin Cancer Res, 2007; 13(12).
На Фиг. 12 показано, что доля рНН3-положительных клеток в пределах фазы G2/M клеточного цикла была максимально подавлена AZD1152 через 24 часа. Опухоли, подвергаемые воздействию препаратов Е или F1, F2, проявляли меньшее снижение рНН3 через 24 часа после однократной дозы по сравнению с животными, получающими AZD1152. Через 96 часов уровни снижения рНН3 были сравнимыми во всех группах.
Эти данные показывают, что препараты Е, F1 и F2 приводят к эквивалентному подавлению рНН3 и, следовательно, активности киназы Аврора В в течение периода действия однократной дозы.
Действия препаратов Е, F1 и F2 на костный мозг
В данном примере показаны действия препаратов на костный мозг, оцениваемые с помощью двух независимых измерений.
Крысам инъецировали IV плацебо BIND (0 мг/кг), либо AZD1152/AZD1152 hqpa препарат E/F1/F2 в дозе 25 мг/кг в указанные моменты времени и умерщвляли в указанные моменты времени.
У каждого животного извлекали образцы костного мозга. Сначала образцы костного мозга обрабатывали для патологической оценки. Бедренно-тибиальные сочленения помещали в 10% забуференный формалин, декальцифицировали, используя стандартные методики, заключали в парафин и окрашивали гематоксилином и эозином. Патологическая оценка обедненности клетками костного мозга проводилась патологом (Фиг. 13). Баллы целостности костного мозга определялись патологом. Балл обедненности клетками костного мозга определяли на основании системы баллов 0-4, где 0 представляет собой отсутствие действия на костный мозг, а 4 представляет собой максимальное действие на костный мозг. На фигурах показаны медианы, 95% доверительные интервалы и диапазон для каждой группы животных на сутки 5 и 9. Данные показывают, что AZD1152 оказывает обширное влияние на костный мозг, а каждый из протестированных препаратов AZD1152 hqpa в виде наночастиц обладает эквивалентными минимальными действиями на костный мозг.
Затем брали смывы костного мозга на исследование клеточности костного мозга с помощью сортировки флуоресцентно-активированных клеток (FACS). После умерщвления костный мозг из каждой бедренной кости помещали в 50% фетальную бычью сыворотку (FBS) и 50% фосфатно-солевой буфер (PBS) на льду. Клетки осаждали центрифугированием при 4°С и ресуспендировали в PBS. Клетки снова осаждали при 4°С и ресуспендировали в PBS. Добавляли 50 мкл LDS-751 (0,5 мг/мл в метаноле) и клетки перемешивали на вортексе. Наконец, клетки фильтровали через 50-мкм фильтр в пробирку FACS. Образцы анализировали на FACS Canto (Beckton Dickinson). Результаты представлены на Фиг. 14. Обедненность костного мозга клетками представлена в виде суммарного количества ядросодержащих клеток относительно необработанных контролей. Показан процент клеточности каждого образца костного мозга у каждого индивидуального животного. Пунктирная линия представляет собой самый низкий процент суммарного числа ядросодержащих клеток, наблюдаемых у животных, получающих только носитель (пустую наночастицу). Данные показывают, что AZD1152 оказывает обширное влияние на костный мозг, а каждый из протестированных препаратов AZD1152 hqpa в виде наночастиц обладает эквивалентными минимальными действиями на костный мозг.
ПРИМЕР 9: Данные для препаратов G
Сравнение действия препаратов G1 и G2 в виде наночастиц на биомаркеры опухоли фосфо-гистоны Н3
В данном эксперименте сравнивают действие препаратов G1 и G2 на фосфорилирование фосфогистона Н3 (рНН3) в опухолях SW620. AZD1152 включали в качестве положительного контроля.
Активность измеряли в виде ингибирования фосфорилирования гистона Н3 на Ser10 (рНН3 в качестве чувствительного, высоко динамичного суррогатного маркера активности киназы Аврора В). Средний уровень положительности рНН3 [%] вычисляли для клеток в фазе G2/M клеточного цикла для каждой экспериментальной группы через 24, 48, 72, 96 и 120 ч после 1 дозы и сравнивали с уровнем рНН3, наблюдаемым для клеток в фазе клеточного цикла G2/M, которые были извлечены из опухолей, обработанных плацебо BIND (обозначенным здесь как 100%).
Препараты (препараты G1 и G2) дозировали, как описано выше, в ксенотрансплантаты ободочной кишки опухоли SW620 у самок бестимусных крыс. Крысам инъецировали IV либо плацебо BIND (0 мг/кг), либо AZD1152 или препарат AZD1152 hqpa G1 или G2 в дозе 25 мг/кг на сутки 1 и прекращали введение на сутки 2 (24 ч после 1й дозы), сутки 3 (48 ч после 1й дозы), сутки 4 (72 ч после 1й дозы), сутки 5 (96 ч после 1й дозы) и сутки 6 (120 ч после 1й дозы). Замороженные опухоли разъединяли, используя Medimachine (BD Biosystems), фиксировали 80% этанолом в течение минимум 12 ч и готовили для анализа на содержание ДНК (окрашивание PI) и анализа рНН3 с помощью проточной цитометрии с использованием BD FACS Canto анализатора (первое антитело к рНН3: Millipore 06-570; второе антитело: второе антитело к IgG кролика, конъюгированное с флуоресцеином (FITC) Millipore AP307F), как описано ранее в статье Wilkinson, RW et al., Clin Cancer Res, 2007; 13(12).
На Фиг. 15 показано, что доля рНН3-положительных клеток в пределах фазы G2/M клеточного цикла была максимально подавлена AZD1152 через 24 часа. Опухоли, подвергаемые воздействию препаратов G1 или G2, проявляли меньшее снижение рНН3 через 24 часа после однократной дозы по сравнению с животными, получающими AZD1152. Максимальное снижение активности рНН3 происходит между 72 и 120 ч после 1й дозы препаратов G1 или G2. Эти данные показывают, что препараты G1 и G2 подавляют рНН3 и, следовательно, активность киназы Аврора В в течение периода действия однократной дозы.
Действия препаратов G1 и G2 на костный мозг
В данном примере показаны действия препаратов на костный мозг.
Крысам инъецировали IV плацебо BIND (0 мг/кг), либо AZD1152 hqpa препарат G1 или G2 в дозе 25 мг/кг на сутки 1 и на сутки 3 и умерщвляли в указанные моменты времени.
У каждого животного извлекали образцы костного мозга и обрабатывали для патологической оценки. Бедренно-тибиальные сочленения помещали в 10% забуференный формалин, декальцифицировали, используя стандартные методики, заключали в парафин и окрашивали гематоксилином и эозином. Патологическая оценка обедненности клетками костного мозга проводилась патологом (Фиг. 16). Баллы целостности костного мозга определялись патологом. Балл обедненности клетками костного мозга определяли на основании системы баллов 0-4, где 0 представляет собой отсутствие действия на костный мозг, а 4 представляет собой максимальное действие на костный мозг. На фигурах показаны баллы для индивидуальных животных в каждой группе животных на сутки 5 и 9. Данные показывают, что каждый из протестированных препаратов AZD1152 hqpa в виде наночастиц приводит к обедненности клетками костного мозга от слабой до умеренной на сутки 5, и она возвращается к таким же уровням, как для плацебо BIND, на сутки 9.
Исследование эффективности на ксенотрансплантате диффузной В-крупноклеточной лимфомы U2932
Самок мышей с scid разводили в лаборатории Charles River. В бок животных прививали опухолевые клетки человека U2932, а затем рандомизировани в исследование, когда опухоли достигали приблизительно 0,25 см3. AZD1152 дозировали в носителе трис-буфере при указанной концентрации. Препарат AZD1152 hqpa G1 в виде наночастиц дозировали в физиологическом растворе. В модели U2932 у мыши препарат G1 в виде наночастиц продемонстрировал эффективность, эквивалентную AZD1152 IV при суммарной дозе 100 мг/кг, и эта эффективность достигалась при сниженной суммарной дозе, составляющей лишь 50 мг/кг, что показывает, что сниженные дозы AZD1152 hqpa в виде наночастиц эквивалентны IV препарату AZD1152.
На Фиг. 17 представлены данные исследования эффективности препарата G1 на ксенотрансплантате U2932 у мыши с scid. Мышам, несущим опухоли U2932, дозировали внутривенно AZD1152 в дозе 25 мг/кг ежесуточно на сутки 26-30 после имплантации опухоли (суммарная доза 100 мг/кг) или препарат G1 25 мг/кг на сутки 26 и 28 после имплантации опухоли (суммарная доза 50 мг/кг).
Эти данные демонстрируют, что препарат G1 обладает эффективностью, эквивалентной AZD1152, при лишь половинной дозе.
Исследование эффективности на эксплантате SC-61 пациента с мелкоклеточным раком легкого (SCLC)
Самок бестимусных мышей разводили в лаборатории Harlan. В бок животных прививали фрагменты опухоли человека SC-61, а затем рандомизировани в исследование, когда опухоли достигали приблизительно 0,2 см3. AZD1152 дозировали в носителе трис-буфере при указанной концентрации. Препарат AZD1152 hqpa G1 в виде наночастиц дозировали в физиологическом растворе. В модели SC-61 у мыши препарат G1 в виде наночастиц при суммарной дозе 50 мг/кг продемонстрировал эффективность, эквивалентную AZD1152 IV при суммарной дозе 100 мг/кг.
На Фиг. 18 представлены данные исследования эффективности препарата G1 на эксплантате SC-61, выделенном у пациента, у бестимусных мышей. Мышам, несущим опухоли SC-61, дозировали внутривенно AZD1152 в дозе 25 мг/кг ежесуточно на сутки 0-3 после рандомизации (суммарная доза 100 мг/кг) или препарат G1 25 мг/кг на сутки 0 и 2 после рандомизации (суммарная доза 50 мг/кг).
Эти данные демонстрируют, что в данной модели препарат G1 лишь при половине дозы приводит к более длительному контролю опухоли, чем AZD1152.
Воздействие препаратов G1 и G2in vivo
На Фиг. 19 показаны данные воздействия in vivo для препаратов G1 и G2, совмещенные с данными для препаратов Е и F из Фиг. 10. Все данные были получены при однократной дозе соответствующего препарата, составляющей 25 мг/кг, у крысы и проанализированы способом, аналогичным описанному в примере 6. На Фиг. 19а-19е каждая из индивидуальных линий данных показана отдельно.
ПРИМЕР 10: Подходящие условия ВЭЖХ для измерения высвобождения in vitro
Параметры прибора
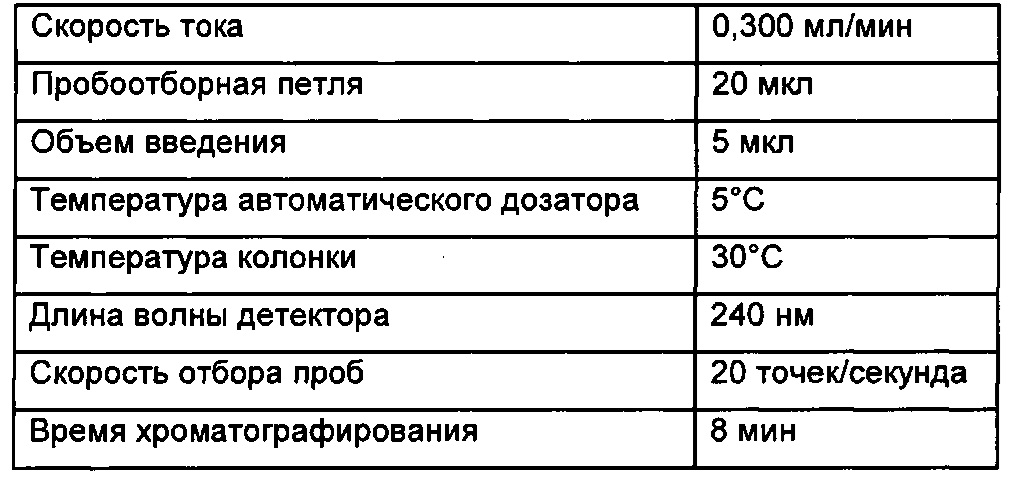
Программа градиентного насоса
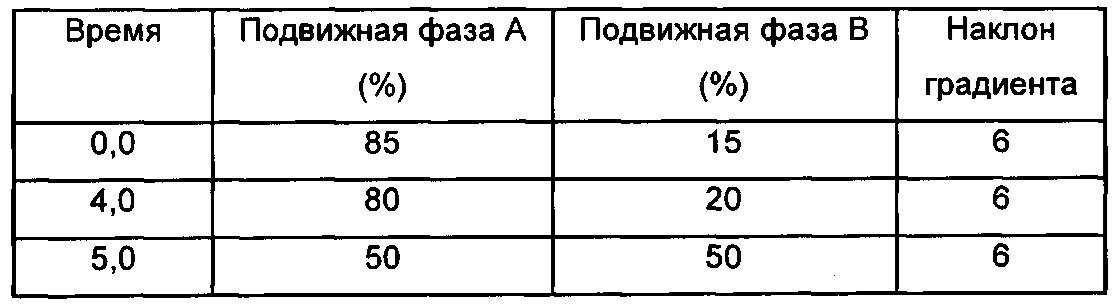
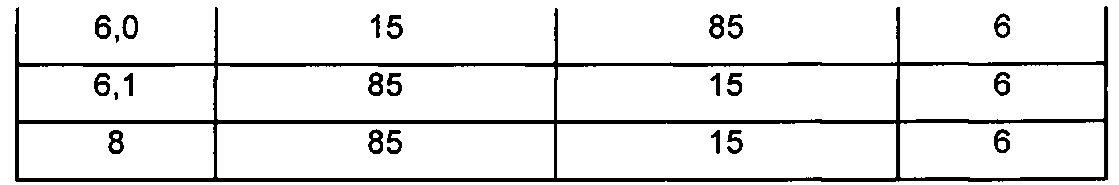
Подвижная фаза А: 0,10% TFA в воде: Заполняют 2 л стеклянную бутылку для среды 2 л очищенной воды. Добавляют 2,0±0,1 мл TFA и перемешивают.
Подвижная фаза В: 0,08% TFA в ацетонитриле: Заполняют 2 л стеклянную бутылку для среды 2 л ацетонитрила. Добавляют 1,6±0,1 мл TFA и перемешивают.
Колонка ВЭЖХ: Waters Acquity CSH С18, 2,1×150 мм, 3 мкм (P/N 186005298)
ПРИМЕР 11
Ниже приведены данные серии для 3 серий препаратов G1, содержащих памовую кислоту. Размер частиц измеряли с помощью динамического светорассеяния.
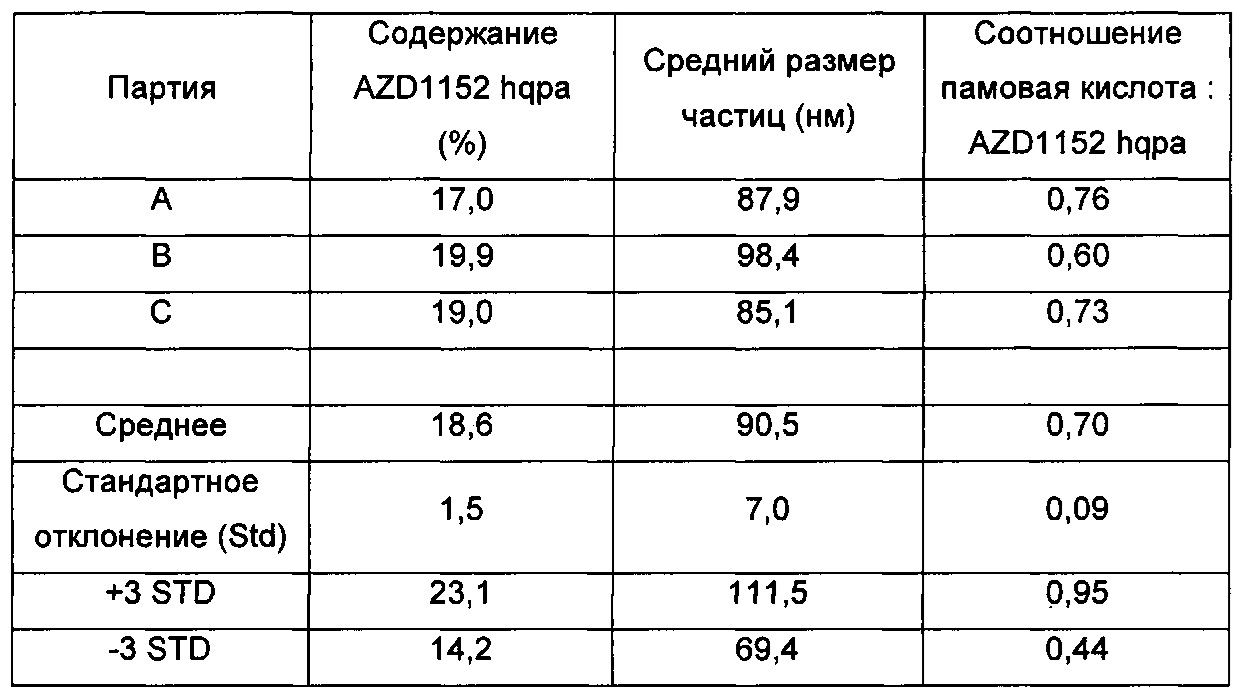
Профили высвобождения in vitro при 37°С для этих серий представлены на Фиг. 20.
ЭКВИВАЛЕНТЫ
Специалисты в данной области техники понимают или могут определить многие эквиваленты конкретных воплощений изобретения, описанного в настоящем документе, используя не более одного рутинного эксперимента. Такие эквиваленты подразумеваются как охваченные приведенной ниже формулой изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Полное содержание всех патентов, опубликованных патентных заявок, веб-сайтов и других ссылок, цитируемых в настоящем документе, в полном объеме явным образом включено в настоящий документ посредством ссылки.