Результат интеллектуальной деятельности: Направленно доставляемые терапевтические наночастицы и способы их получения и использования
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По данной заявке испрашивается приоритет предварительной патентной заявки США №62/020,609, поданной 3 июля 2014 года, полное содержание которой включено в данное описание посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Системы, которые доставляют некоторые лекарственные средства в организм пациента (например, направленно доставляют в конкретную ткань или конкретный тип клеток или направленно доставляют в конкретную больную ткань, а не в нормальную ткань), или которые контролируют высвобождение лекарственных средств, давно признаны предпочтительными.
[0003] Например, терапевтические средства, которые включают в себя активное лекарственное средство, и которые направленно воздействуют, например, на конкретную ткань или конкретный тип клеток или направленно воздействуют на конкретную больную ткань, а не на нормальную ткань, могут снижать количество лекарственного средства в тканях организма, на которые оно направленно не воздействует. Это особенно важно при лечении состояния, такого как рак, когда желательно, чтобы цитотоксическая доза лекарственного средства доставлялась в раковые клетки, не убивая окружающую нераковую ткань. Эффективная направленная доставка лекарственного средства может снижать нежелательные и иногда опасные для жизни побочные эффекты, обычные при противораковой терапии. Кроме того, такие терапевтические средства могут давать возможность лекарственным средствам достигать некоторых тканей, которых в ином случае они неспособны достигать.
[0004] Терапевтические средства, которые обеспечивают контролируемое высвобождение и/или направленную терапию, должны быть в состоянии доставлять эффективное количество лекарственного средства, что является известным ограничением в других системах направленной доставки на основе наночастиц. Например, проблемой может быть получение систем на основе наночастиц, которые имеют подходящее количество лекарственного средства, ассоциированного с каждой наночастицей, и при этом сохраняют размер наночастиц, достаточно малый, чтобы иметь преимущественные свойства доставки. Тем не менее, хотя желательно нагружать наночастицу большим количеством терапевтического агента, препараты из наночастиц, в которых использована слишком большая лекарственная нагрузка, будут приводить к наночастицам, которые слишком большие для практического терапевтического применения.
[0005] Соответственно, существует потребность в терапевтических наночастицах и способах получения таких наночастиц, которые способны доставлять терапевтические уровни лекарственного средства для лечения заболеваний, таких как рак, и при этом также снижают побочные эффекты у пациентов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] В данном документе описаны полимерные наночастицы, которые содержат терапевтический агент, и способы получения и использования таких терапевтических наночастиц. В некоторых воплощениях предусмотренные наночастицы могут содержать эксципиент.
[0007] В одном аспекте предложена терапевтическая наночастица. Эта терапевтическая наночастица содержит от примерно 0,05 до примерно 30 массовых процентов эксципиента, выбранного из группы, состоящей из полианионного полимера и поликатионного полимера; от примерно 0,2 до примерно 35 массовых процентов терапевтического агента; и от примерно 35 до примерно 99,75 массовых процентов биосовместимого полимера.
[0008] В некоторых воплощениях эксципиент представляет собой полианионный полимер. Например, в некоторых воплощениях полианионный полимер представляет собой сополимер из субъединиц метакриловой кислоты и субъединиц метилметакрилата. В некоторых случаях соотношение субъединиц метакриловой кислоты и субъединиц метилметакрилата в полианионном полимере составляет от примерно 1:0,9 до примерно 1:3.
[0009] В некоторых воплощениях эксципиент представляет собой поликатионный полимер. Например, в некоторых воплощениях поликатионный полимер представляет собой сополимер алкилметакрилата и диметиламиноэтилметакрилата. В некоторых случаях поликатионный полимер представляет собой сополимер из субъединиц диметиламиноэтилметакрилата, бутил метакрилата и метилметакрилата. В некоторых воплощениях соотношение субъединиц диметиламиноэтилметакрилата, субъединиц бутилметакрилата и субъединиц метилметакрилата в поликатионном полимере составляет примерно 1:2:1.
[0010] В некоторых воплощениях эксципиент имеет молекулярную массу от примерно 20 кДа до примерно 60 кДа или от примерно 100 кДа до примерно 150 кДа.
[0011] В некоторых воплощениях эксципиент имеет температуру стеклования от примерно 40°С до примерно 50°С или выше примерно 100°С.
[0012] В некоторых воплощениях предусмотренная наночастица содержит от примерно 5 до примерно 25 массовых процентов эксципиента.
[0013] В некоторых воплощениях предусмотренная наночастица дополнительно содержит от примерно 0,05 до примерно 35 массовых процентов циклодекстрина или от примерно 15 до примерно 30 массовых процентов циклодекстрина. В некоторых воплощениях циклодекстрин выбран из группы, состоящей из α-циклодекстрина, β-циклодекстрина, γ-циклодекстрина и их смесей.
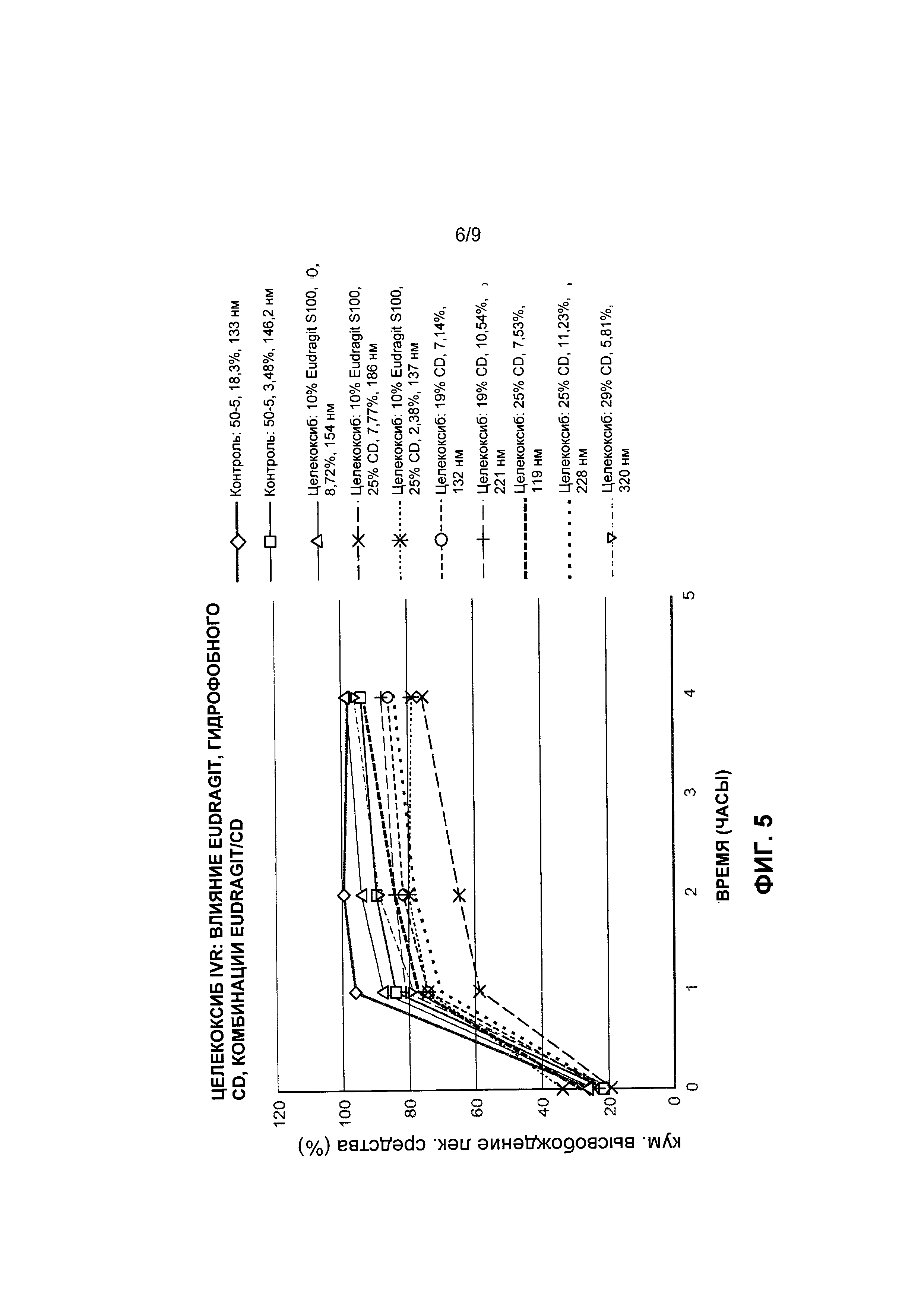
[0014] В некоторых воплощениях терапевтический агент представляет собой химиотерапевтический агент. Например, в некоторых воплощениях химиотерапевтический агент выбран из группы, состоящей из доцетаксела, винкристина, винорелбина, эпотилона, эпотилона В, фторурацила, иринотекана, капецитабина и оксалиплатина. В некоторых воплощениях терапевтический агент представляет собой целекоксиб. В некоторых воплощениях предусмотренные наночастицы содержат от примерно 3 до примерно 20 массовых процентов терапевтического агента или от примерно 5 до примерно 15 массовых процентов терапевтического агента.
[0015] В некоторых воплощениях гидродинамический диаметр предусмотренной терапевтической наночастицы составляет от примерно 60 до примерно 200 нм или от примерно 90 до примерно 140 нм.
[0016] В некоторых воплощениях биосовместимый полимер выбран из группы, состоящей из сополимера поли(молочная) кислота-поли(этилен)гликоль и сополимера поли(молочная) кислота-поли(гликолевая) кислота-поли(этилен)гликоль. В некоторых воплощениях сополимер поли(молочная) кислота-поли(этилен)гликоль имеет долю среднечисленной молекулярной массы поли(молочной) кислоты от примерно 0,6 до примерно 0,95, от примерно 0,6 до примерно 0,8, от примерно 0,75 до примерно 0,85 или от примерно 0,7 до примерно 0,9.
[0017] В некоторых воплощениях предусмотренная терапевтическая наночастица содержит от примерно 10 до примерно 25 массовых процентов поли(этилен)гликоля, от примерно 10 до примерно 20 массовых процентов поли(этилен)гликоля, от примерно 15 до примерно 25 массовых процентов поли(этилен)гликоля или от примерно 20 до примерно 30 массовых процентов поли(этилен)гликоля.
[0018] В некоторых воплощениях предусмотренная терапевтическая наночастица дополнительно содержит сополимер 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-поли(этилен)гликоль.
[0019] В некоторых воплощениях предусмотренная терапевтическая наночастица по существу немедленно высвобождает менее примерно 70% терапевтического агента через 0,5 часа, когда она помещена в фосфатный буферный раствор при 37°С.
[0020] В еще одном аспекте предложена терапевтическая наночастица. Эта терапевтическая наночастица получена способом, включающим эмульгирование первой органической фазы, содержащей терапевтический агент или его фармацевтически приемлемую соль, эксципиент, выбранный из группы, состоящей из полианионного полимера и поликатионного полимера, и диблоксополимер поли(молочная) кислота-полиэтиленгликоль или диблоксополимер поли(молочная) кислота-со-поли(гликолевая) кислота-полиэтиленгликоль, с образованием эмульсионной фазы; гашение эмульсионной фазы с образованием погашенной фазы; и фильтрование погашенной фазы с выделением терапевтической наночастицы.
[0021] В еще одном аспекте предложена фармацевтически приемлемая композиция. Фармацевтически приемлемая композиция содержит множество предусмотренных терапевтических наночастиц и фармацевтически приемлемый эксципиент.
[0022] В некоторых воплощениях предусмотренная фармацевтически приемлемая композиция дополнительно содержит сахарид и/или циклодекстрин. Например, в некоторых воплощениях сахарид представляет собой дисахарид, выбранный из группы, состоящей из сахарозы или трегалозы или их смеси. В некоторых воплощениях циклодекстрин выбран из группы, состоящей из α-циклодекстрина, β-циклодекстрина, γ-циклодекстрина и их смесей.
[0023] В еще одном аспекте предложен способ получения терапевтической наночастицы. Способ получения терапевтической наночастицы включает объединение терапевтического агента и первого полимера с органическим растворителем с образованием первой органической фазы, имеющей от примерно 5 до примерно 50% твердых частиц; объединение первой органической фазы с первым водным раствором с образованием второй фазы, где первая водная фаза содержит неионное поверхностно-активное вещество; эмульгирование второй фазы с образованием эмульсионной фазы; гашение эмульсионной фазы с образованием погашенной фазы; и фильтрование солюбилизированной фазы для выделения терапевтических наночастиц с образованием посредством этого суспензии терапевтических наночастиц, имеющих диаметр от примерно 80 нм до примерно 180 нм.
[0024] В некоторых воплощениях неионное поверхностно-активное вещество имеет гидрофильно-липофильный баланс (HLB) больше примерно 15. Например, в некоторых воплощениях неионное поверхностно-активное вещество имеет гидрофильно-липофильный баланс (HLB) от примерно 15 до примерно 20. В некоторых воплощениях неионное поверхностно-активное вещество представляет собой полимерное неионное поверхностно-активное вещество.
[0025] В некоторых воплощениях неионное поверхностно-активное вещество содержит полиэтиленоксид или его сополимер. Например, в некоторых воплощениях полимерное неионное поверхностно-активное вещество представляет собой сополимерное неионное поверхностно-активное вещество, выбранное из сополимера поли(молочная кислота)-полиэтиленоксид и сополимера поли(молочная кислота)-со-(гликолевая кислота)-полиэтиленоксид. В некоторых воплощениях сополимерное неионное поверхностно-активное вещество содержит полиэтиленоксид, имеющий молекулярную массу от примерно 2 кДа до примерно 10 кДа или от примерно 4 кДа до примерно 6 кДа. В некоторых воплощениях сополимерное неионное поверхностно-активное вещество содержит сополимер поли(молочная кислота)-полиэтиленоксид, где поли(молочная) кислота имеет молекулярную массу от примерно 0,2 кДа до примерно 1,0 кДа. В некоторых воплощениях сополимерное неионное поверхностно-активное вещество содержит сополимер поли(молочная кислота)-полиэтиленоксид с поли(молочной) кислотой, имеющей молекулярную массу от примерно 0,4 кДа до примерно 0,8 кДа, и полиэтиленоксидом, имеющим молекулярную массу от примерно 4 кДа до примерно 6 кДа.
[0026] В некоторых воплощениях поверхностно-активное вещество представляет собой стеариловый эфир полиоксиэтилена. Например, в некоторых воплощениях стеариловый эфир полиоксиэтилена представляет собой стеариловый эфир полиоксиэтилена (100). В некоторых воплощениях стеариловый эфир полиоксиэтилена имеет молекулярную массу от 4 кДа до 6 кДа.
[0027] В некоторых воплощениях водный раствор содержит от примерно 0,01 до примерно 5 массовых процентов поверхностно-активного вещества, от примерно 0,01 до примерно 1 массового процента поверхностно-активного вещества, от примерно 0,05 до примерно 0,2 массового процента поверхностно-активного вещества, от примерно 1 до примерно 5 массовых процентов поверхностно-активного вещества или от примерно 0,01 до примерно 5 массовых процентов поверхностно-активного вещества.
[0028] В некоторых воплощениях предусмотренные наночастицы содержат от примерно 0,2 до примерно 35 массовых процентов терапевтического агента, от примерно 3 до примерно 35 массовых процентов терапевтического агента или от примерно 4 до примерно 15 массовых процентов терапевтического агента. В некоторых воплощениях терапевтический агент выбран из группы, состоящей из доцетаксела, винкристина, винорелбина, эпотилона, эпотилона В, фторурацила, иринотекана, капецитабина, оксалиплатина и целекоксиба.
[0029] В некоторых воплощениях первый полимер содержит диблоксополимер полимолочная кислота-полиэтиленгликоль. В некоторых воплощениях первый полимер содержит диблоксополимер поли(лактид-со-гликолид)-поли(этиленгликоль).
[0030] В еще одном аспекте предложен способ лечения рака у нуждающегося в этом пациента. Данный способ включает введение пациенту терапевтически эффективного количества композиции, содержащей предусмотренную терапевтическую наночастицу.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
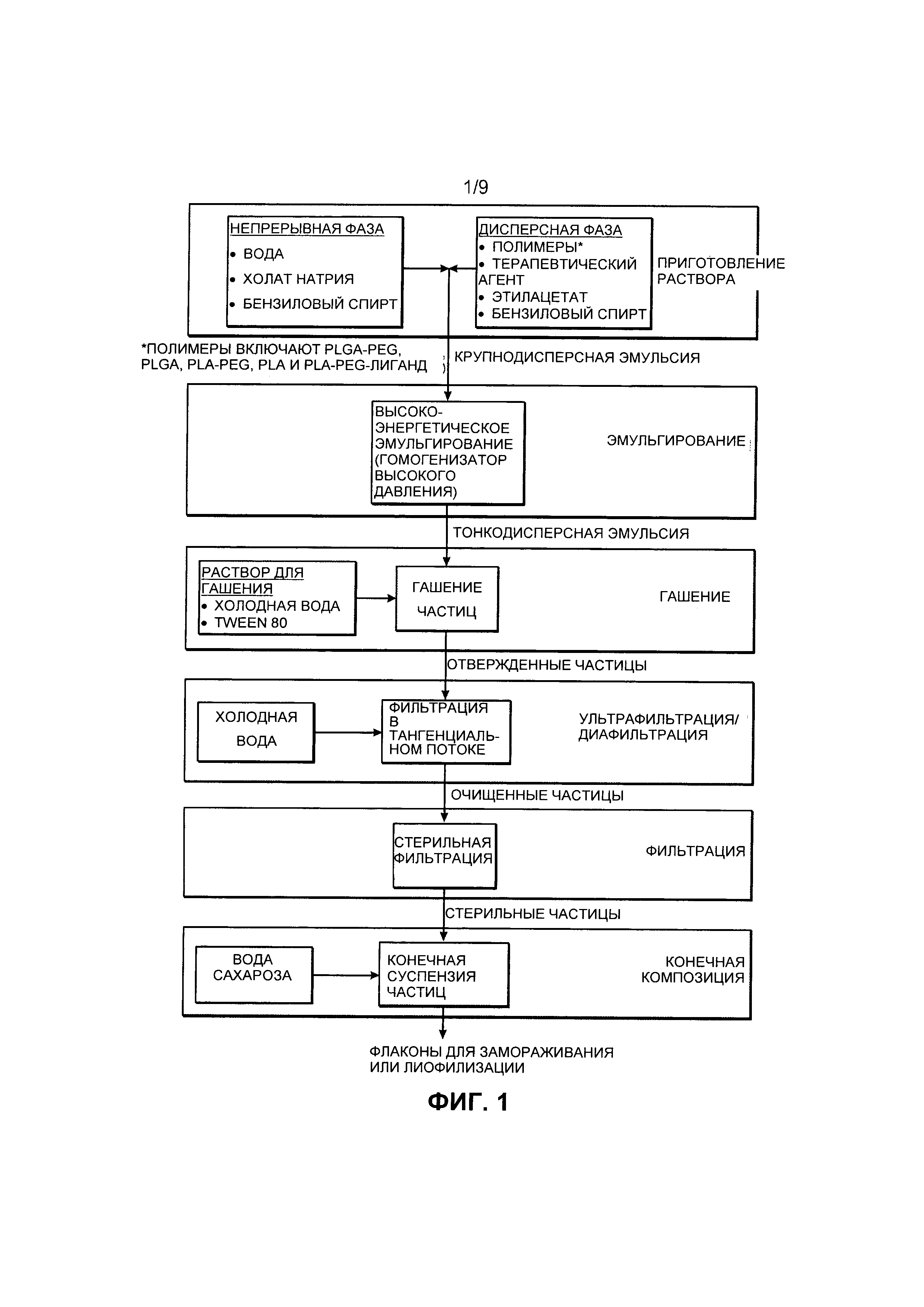
[0031] Фиг.1 представляет собой блок-схему процесса эмульгирования для образования раскрытых наночастиц согласно воплощению.
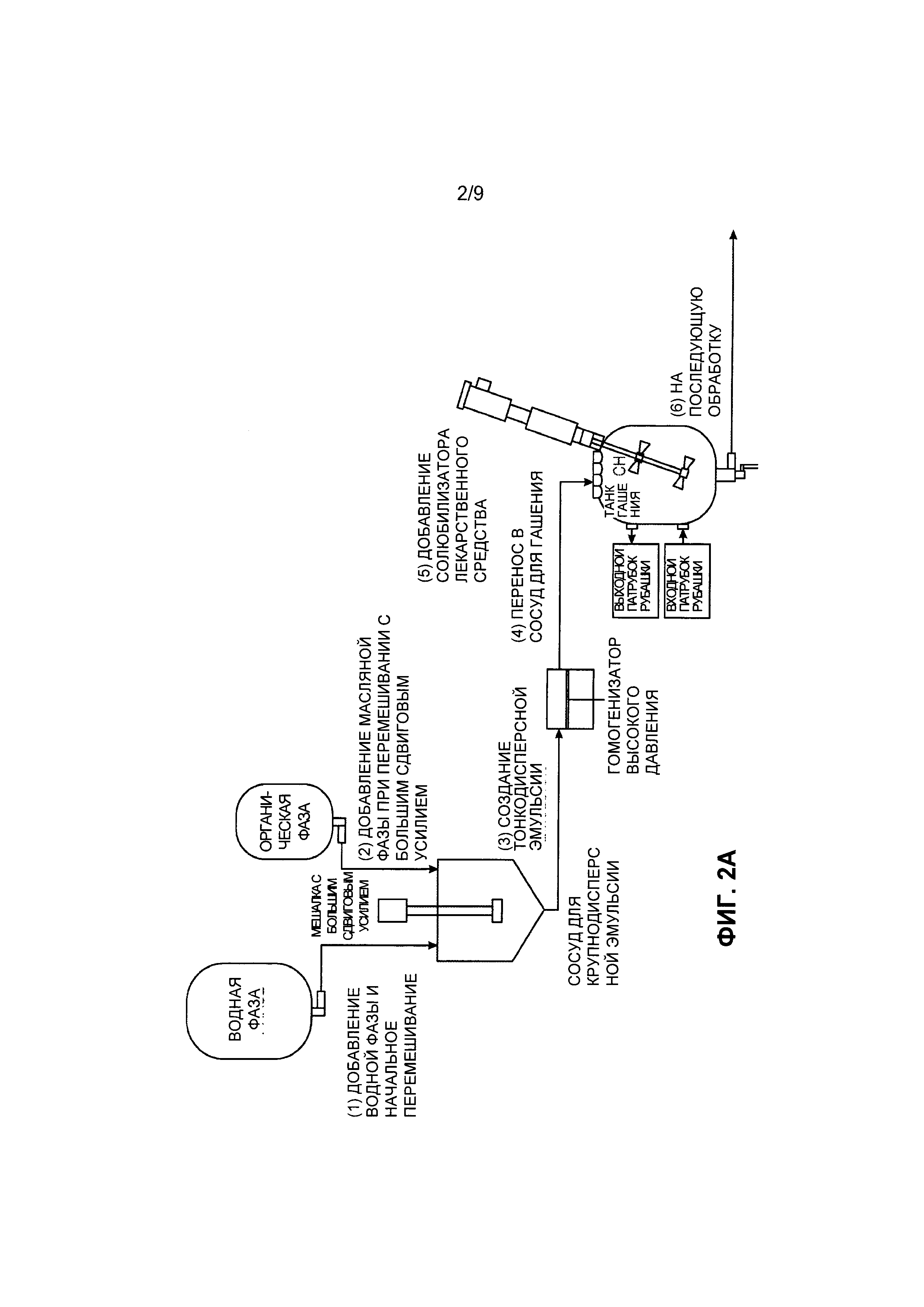
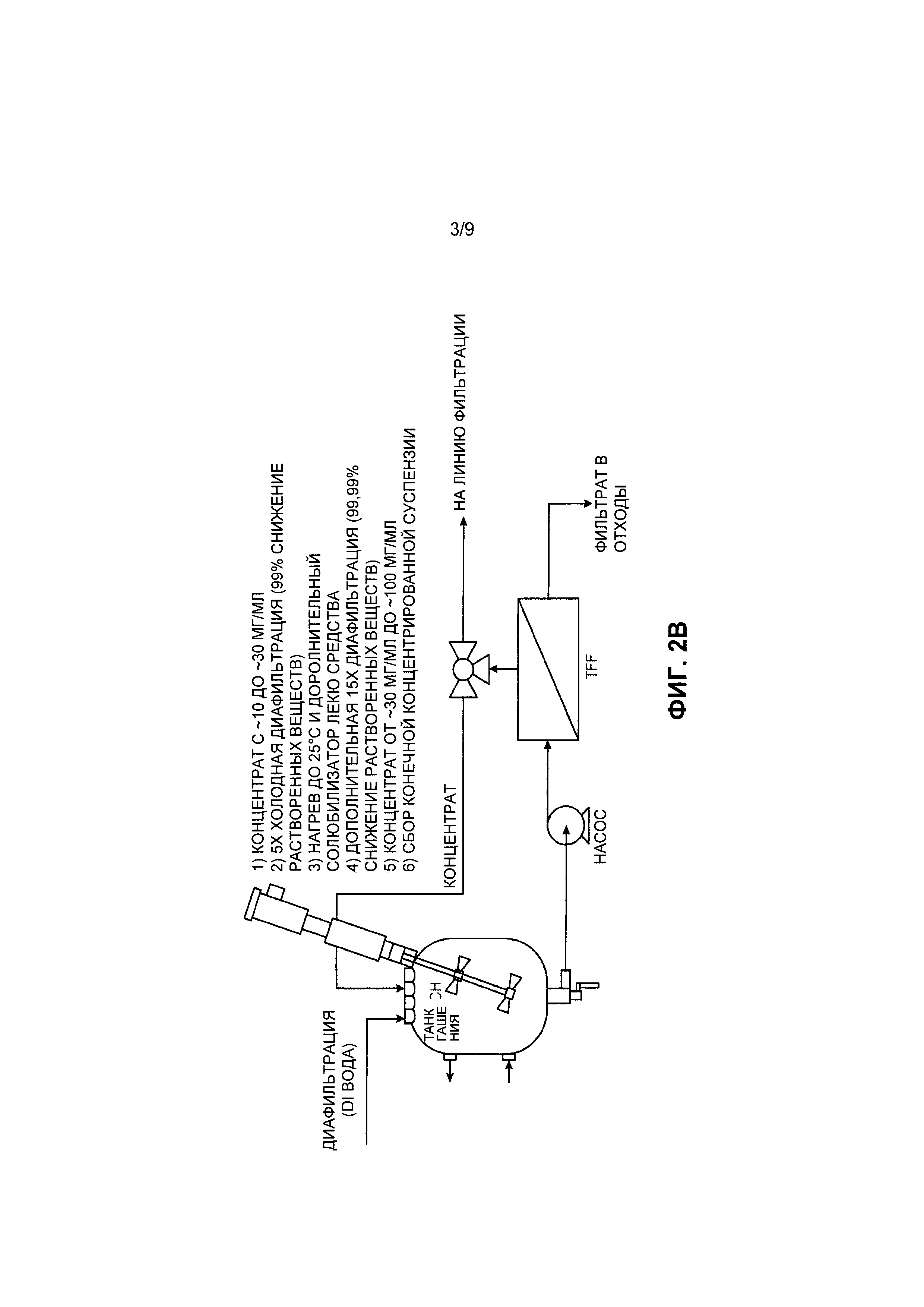
[0032] Фиг. 2А и Фиг. 2В представляют собой блок-схемы раскрытого процесса эмульгирования. На Фиг. 2А показано образование и отверждение частиц (обработка согласно верхней части блок-схемы). На Фиг. 2В показана обработка и очистка частиц (обработка согласно нижней састи блок-схемы) согласно воплощению.
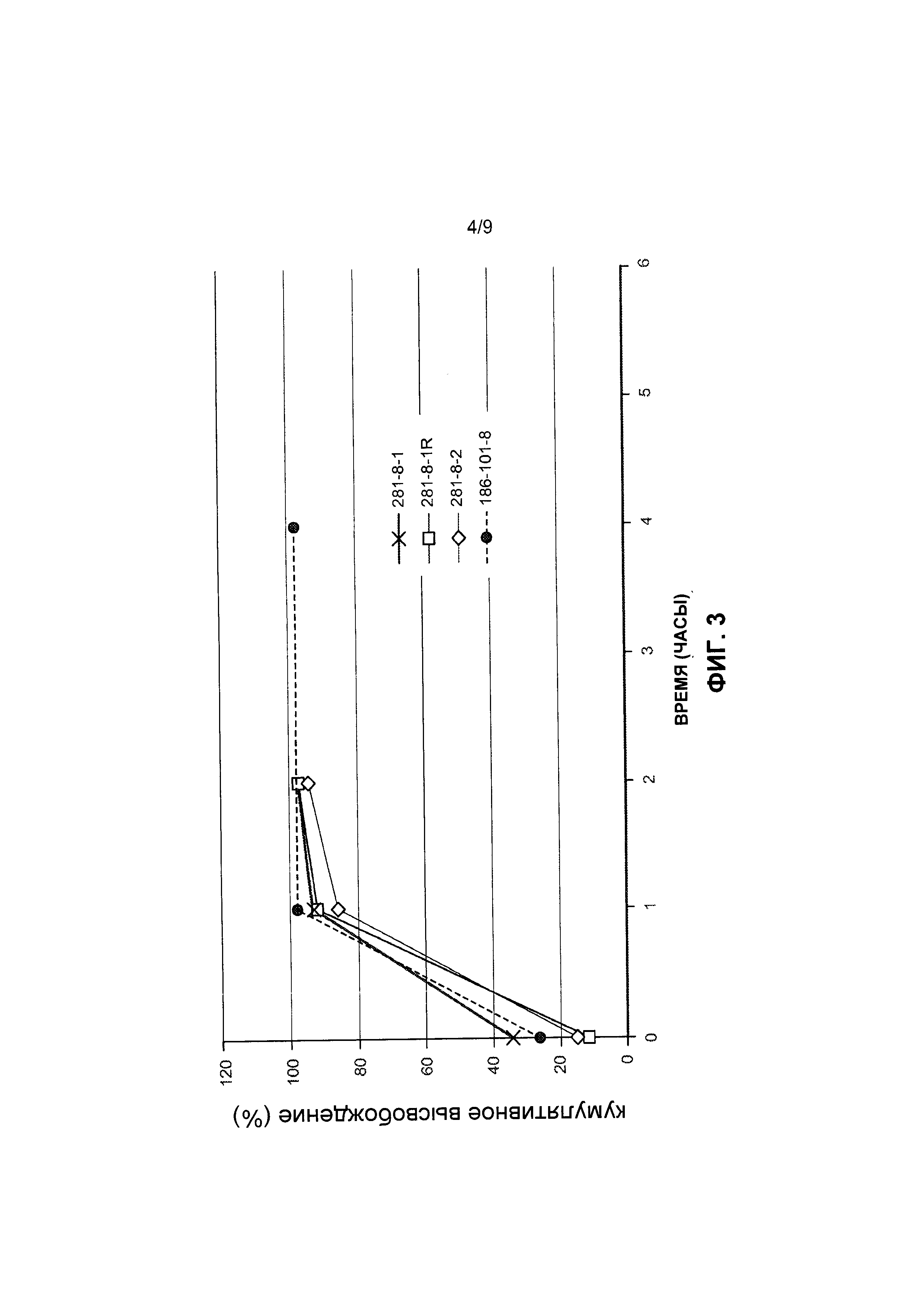
[0033] На Фиг. 3 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц патупилона, содержащих эксципиент Eudragit, по сравнению с контролем.
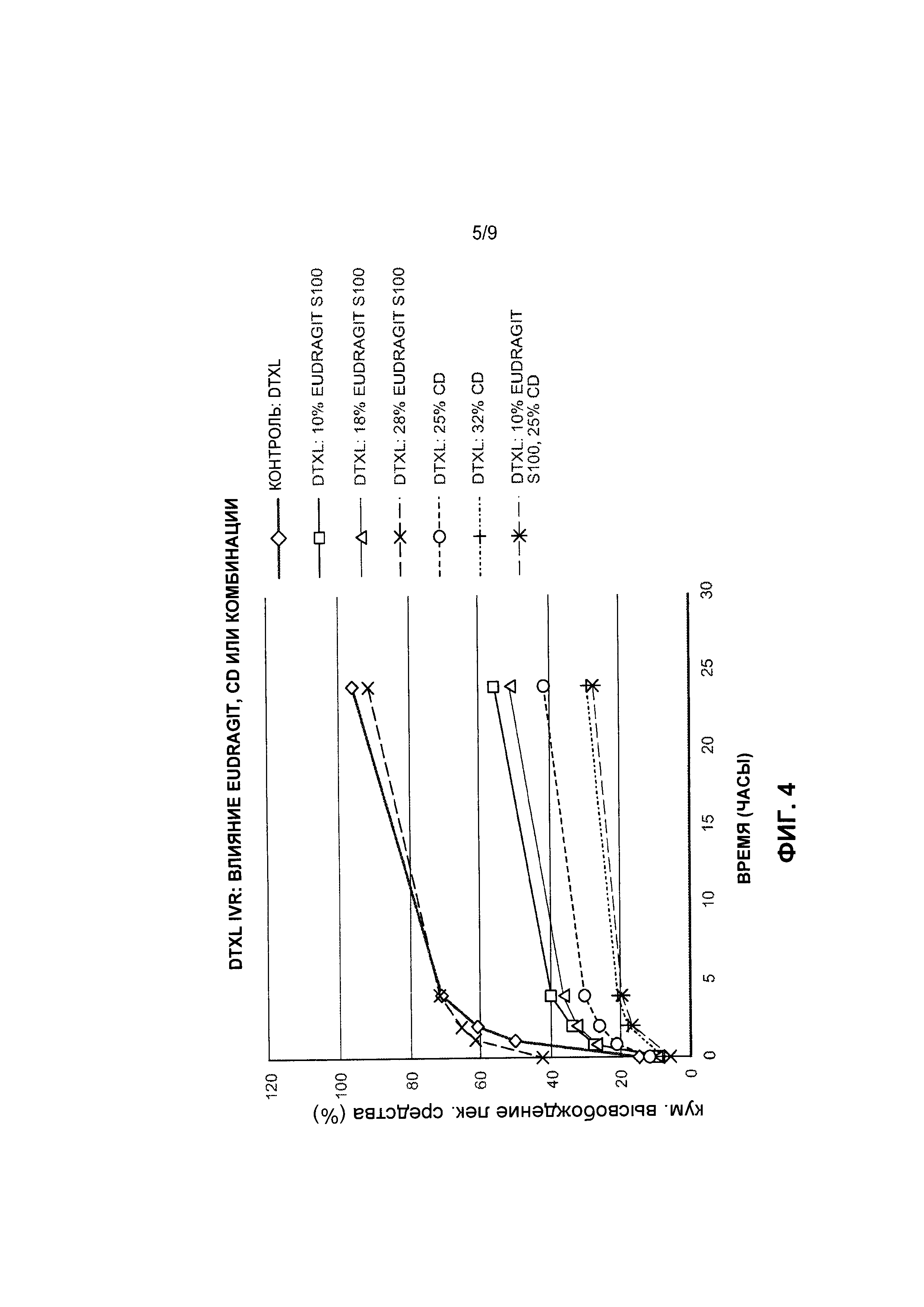
[0034] На Фиг. 4 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц доцетаксела, содержащих эксципиент Eudragit и/или циклодекстрин, по сравнению с контролем.
[0035] На Фиг. 5 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц целекоксиба, содержащих эксципиент Eudragit и/или циклодекстрин, по сравнению с контролями.
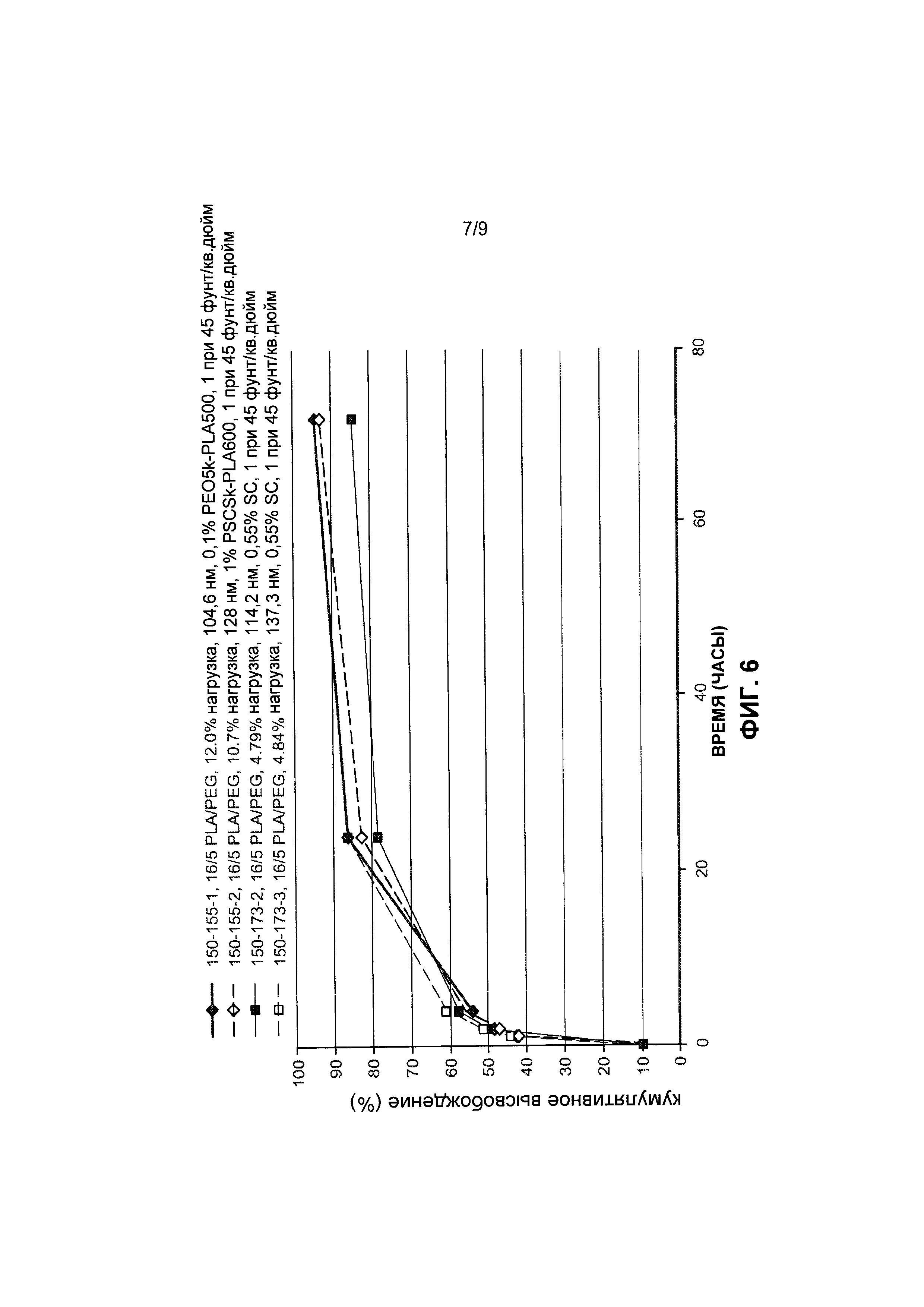
[0036] На Фиг. 6 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц доцетаксела, содержащих эксципиент блоксополимер полиэтиленоксид-полимолочная кислота (PEO-PEG), по сравнению с контролями.
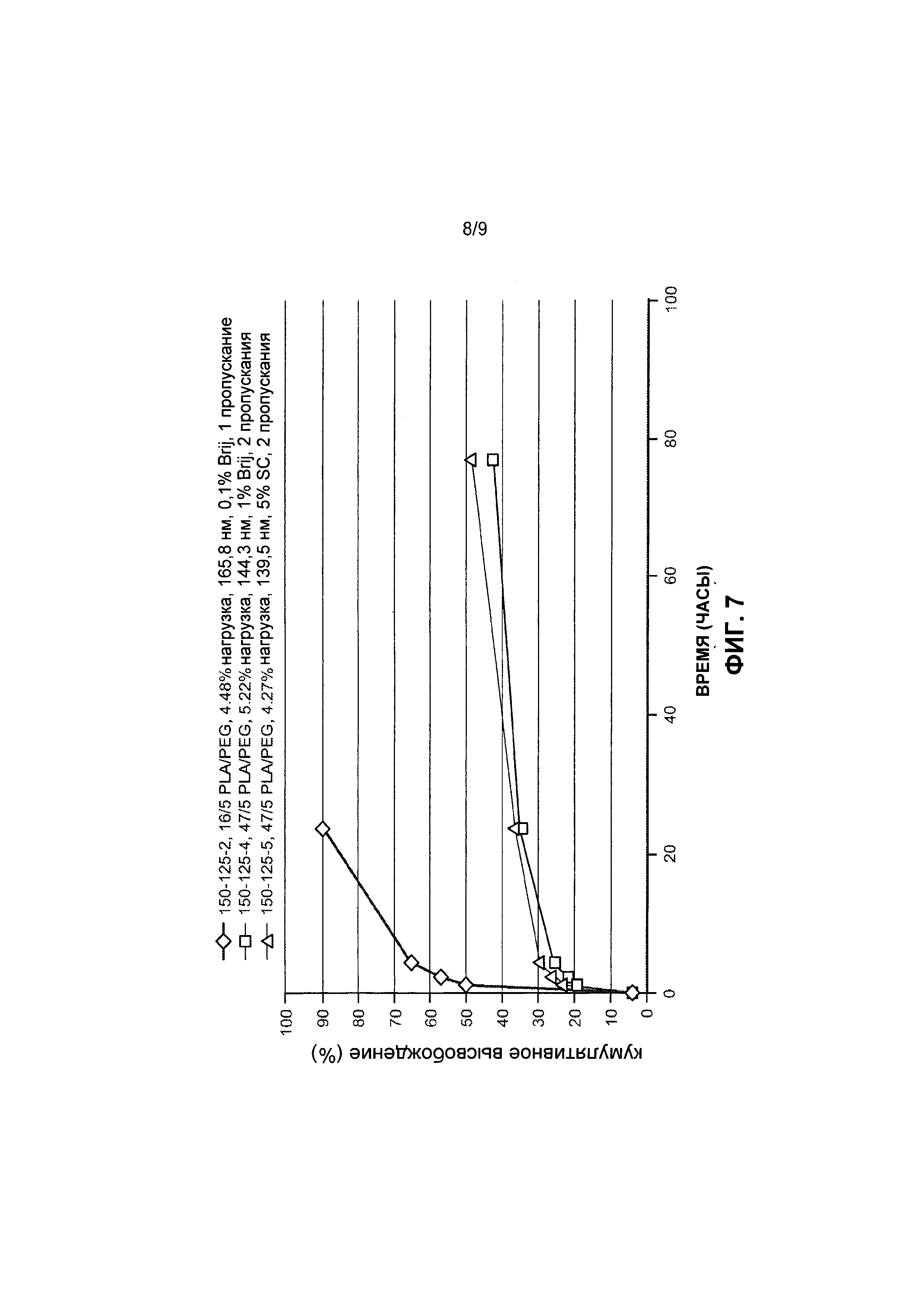
[0037] На Фиг. 7 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц доцетаксела, содержащих эксципиент Brij® 100.
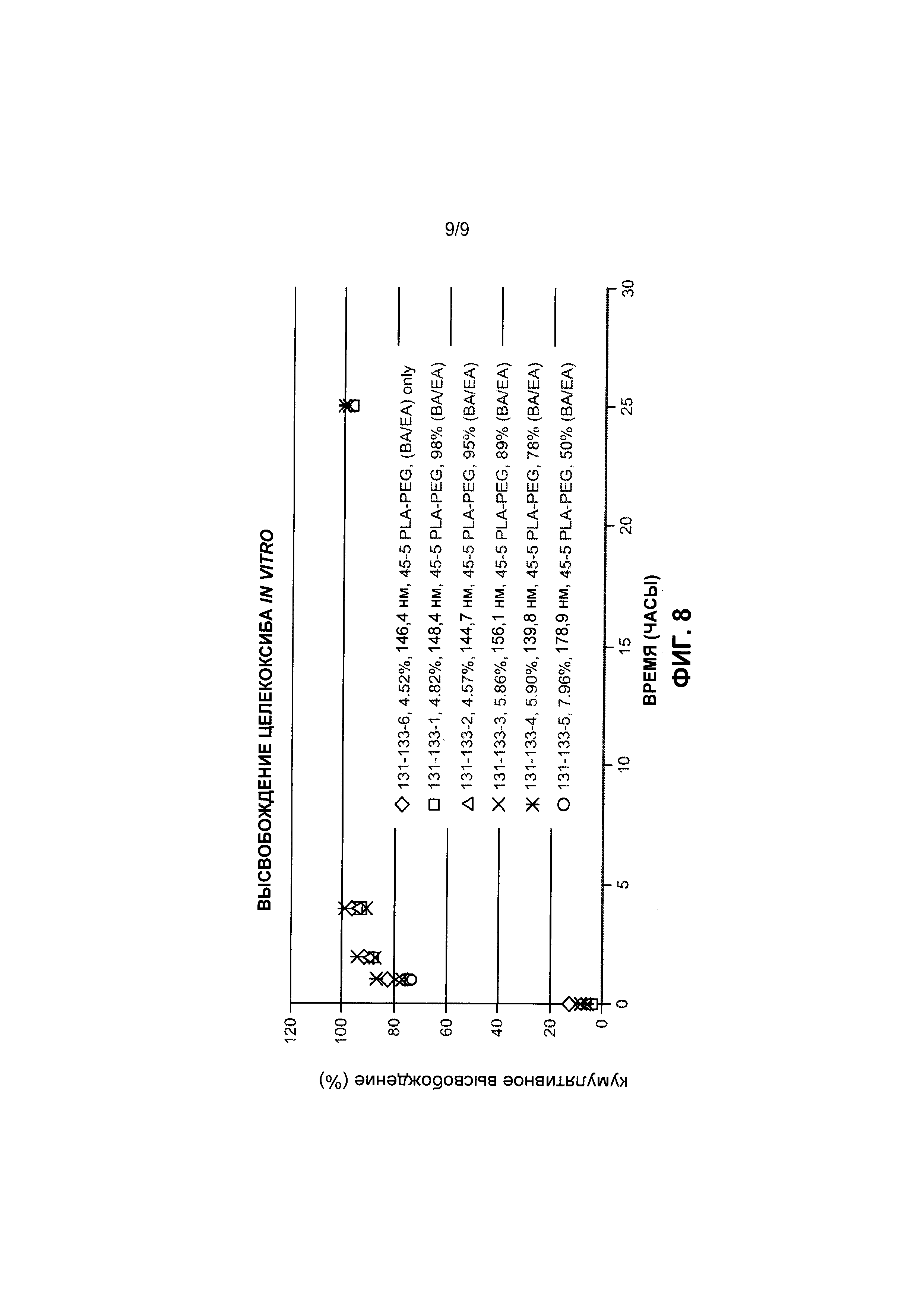
[0038] На Фиг. 8 представлены данные по высвобождению in vitro для предусмотренных композиций наночастиц доцетаксела, содержащих эксципиент блоксополимер полиэтиленоксид-полимолочная кислота, по сравнению с контролем.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0039] Описаны полимерные наночастицы, которые содержат терапевтический агент, и способы получения и использования таких терапевтических наночастиц. В некоторых воплощениях предусмотренные наночастицы могут содержать эксципиент. В некоторых случаях включение эксципиента в композицию наночастицы улучшает свойства наночастицы, такие как лекарственная нагрузка наночастицы, по сравнению с наночастицами, приготовленными без эксципиента.
[0040] Наночастицы, раскрытые в данном документе, содержат один, два, три или более биосовместимых и/или биоразлагаемых полимеров. Например, предусмотренная наночастица может содержать от примерно 35 до примерно 99,6 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 99,6 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 99,5 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 99 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 98 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 97 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 96 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 95 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 94 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 93 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 92 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 91 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 90 массовых процентов, в некоторых воплощениях от примерно 50 до примерно 85 массовых процентов и в некоторых воплощениях от примерно 50 до примерно 80 массовых процентов одного или более блоксополимеров, которые содержат биоразлагаемый полимер и поли(этиленгликоль) (PEG), и от примерно 0 до примерно 50 массовых процентов биоразлагаемого гомополимера.
[0041] В некоторых воплощениях раскрытые наночастицы могут содержать от примерно 0,2 до примерно 35 массовых процентов, от примерно 0,2 до примерно 30 массовых процентов, от примерно 0,2 до примерно 20 массовых процентов, от примерно 0,2 до примерно 10 массовых процентов, от примерно 0,2 до примерно 5 массовых процентов, от примерно 0,5 до примерно 5 массовых процентов, от примерно 0,75 до примерно 5 массовых процентов, от примерно 1 до примерно 5 массовых процентов, от примерно 2 до примерно 5 массовых процентов, от примерно 3 до примерно 5 массовых процентов, от примерно 1 до примерно 30 массовых процентов, от примерно 1 до примерно 20 массовых процентов, от примерно 2 до примерно 20 массовых процентов, от примерно 5 до примерно 20 массовых процентов, от примерно 1 до примерно 15 массовых процентов, от примерно 2 до примерно 15 массовых процентов, от примерно 3 до примерно 15 массовых процентов, от примерно 4 до примерно 15 массовых процентов, от примерно 5 до примерно 15 массовых процентов, от примерно 1 до примерно 10 массовых процентов, от примерно 2 до примерно 10 массовых процентов, от примерно 3 до примерно 10 массовых процентов, от примерно 4 до примерно 10 массовых процентов, от примерно 5 до примерно 10 массовых процентов, от примерно 10 до примерно 30 массовых процентов или от примерно 15 до примерно 25 массовых процентов активного агента.
[0042] В некоторых воплощениях раскрытые терапевтические наночастицы могут содержать эксципиент. Эксципиент может представлять собой любое соединение или смесь соединений, которые придают преимущественное свойство наночастице. Например, в некоторых воплощениях, включение эксципиента в композицию наночастицы может приводить в результате к увеличению лекарственной нагрузки в наночастице по сравнению с наночастицами, изготовленными без эксципиента. В другом воплощении свойства контролируемого высвобождения из наночастицы могут быть преимущественно изменены за счет использования эксципиента, например скорость высвобождения может быть изменена, снижена и т.д. В некоторых воплощениях размер наночастиц может быть увеличен или уменьшен. В некоторых случаях использование эксципиента делает возможным получение наночастицы с меньшим количеством или без одного или более компонентов, которая все еще имеет по существу аналогичные свойства по сравнению с наночастицами, изготовленными без эксципиента, включая по существу аналогичный размер частиц, аналогичную лекарственную нагрузку и/или скорость высвобождения.
[0043] В некоторых воплощениях эксципиент может представлять собой полимер. Например, в некоторых случаях эксципиент может представлять собой полианионный полимер или поликатионный полимер. Не ограничивающие примеры полианионных и поликатионных полимеров включают, но не ограничены ими, полимеры и сополимеры акрилата и его производных (например, метакрилата и алкилметакрилатов, таких как метилметакрилат, диметиламиноэтилметакрилат и бутилметакрилат). Не ограничивающие примеры полианионных полимеров включают полиакриловую кислоту, полиметакриловую кислоту, Eudragit® S 100 (поли(метакриловая кислота-со-метилметакрилат) 1:2), and Eudragit® L 100 (поли(метакриловая кислота-со-метилметакрилат) 1:1)). Не ограничивающие примеры поликатионных полимеров включают Eudragit® Е РО (поли(бутилметакрилат-со-(2-диметиламиноэтил)метакрилат-со-метилметакрилат) 1:2:1).
[0044] Как обсуждается выше, в некоторых воплощениях эксципиент может представлять собой сополимер (например, сополимер, образованный из двух или более полимерных субъединиц). В некоторых воплощениях сополимер, образованный из первой субъединицы и второй субъединицы, может иметь соотношение первой субъединицы ко второй субъединице от примерно 5:1 до примерно 1:5, в некоторых воплощениях от примерно 4:1 до примерно 1:4, в некоторых воплощениях от примерно 3:1 до примерно 1:3, в некоторых воплощениях от примерно 2:1 до примерно 1:2, в некоторых воплощениях от примерно 1,5:1 до примерно 1:1.5, в некоторых воплощениях от примерно 2:1 до примерно 1:5, в некоторых воплощениях от примерно 1:1 до примерно 1:5, в некоторых воплощениях от примерно 1:1 до примерно 1:4, в некоторых воплощениях от примерно 1:1 до примерно 1:3 и в некоторых воплощениях от примерно 1:0,9 до примерно 1:3.
[0045] В некоторых воплощениях эксципиент может иметь молекулярную массу от примерно 20 кДа до примерно 200 кДа, в некоторых воплощениях от примерно 20 кДа до примерно 150 кДа, в некоторых воплощениях от примерно 20 кДа до примерно 125 кДа, в некоторых воплощениях от примерно 20 кДа до примерно 100 кДа, в некоторых воплощениях от примерно 20 кДа до примерно 75 кДа, в некоторых воплощениях от примерно 20 кДа до примерно 60 кДа, в некоторых воплощениях от примерно 40 кДа до примерно 60 кДа, в некоторых воплощениях от примерно 50 кДа до примерно 200 кДа, в некоторых воплощениях от примерно 75 кДа до примерно 200 кДа, в некоторых воплощениях от примерно 100 кДа до примерно 200 кДа, в некоторых воплощениях от примерно 125 кДа до примерно 200 кДа и в некоторых воплощениях от примерно 100 кДа до примерно 150 кДа.
[0046] В некоторых воплощениях эксципиент может иметь температуру стеклования от примерно 30°С до примерно 130°С, в некоторых воплощениях от примерно 30°С до примерно 100°С, в некоторых воплощениях от примерно 30°С до примерно 80°С, в некоторых воплощениях от примерно 30°С до примерно 60°С, в некоторых воплощениях от примерно 35°С до примерно 60°С, в некоторых воплощениях от примерно 40°С до примерно 60°С или в некоторых воплощениях от примерно 40°С до примерно 50°С. В некоторых воплощениях эксципиент может иметь температуру стеклования выше примерно 40°С, в некоторых воплощениях выше примерно 50°С, в некоторых воплощениях выше примерно 60°С, в некоторых воплощениях выше примерно 80°С, в некоторых воплощениях выше примерно 100°С, в некоторых воплощениях выше примерно 120°С или в некоторых воплощениях выше примерно 130°С.
[0047] В некоторых воплощениях наночастица может содержать от примерно 0,05 до примерно 35 массовых процентов эксципиента, в некоторых воплощениях от примерно 0,05 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 0,1 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 0,5 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 1 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 2 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 5 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 10 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 15 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 20 до примерно 30 массовых процентов эксципиента, в некоторых воплощениях от примерно 15 до примерно 25 массовых процентов эксципиента, в некоторых воплощениях от примерно 5 до примерно 25 массовых процентов эксципиента, в некоторых воплощениях от примерно 5 до примерно 20 массовых процентов эксципиента или в некоторых воплощениях от примерно 5 до примерно 15 массовых процентов эксципиента.
[0048] Как правило, ''наночастица'' относится к любой частице, имеющей диаметр менее 1000 нм, например от примерно 10 нм до примерно 200 нм. Раскрытые терапевтические наночастицы могут включать наночастицы, имеющие диаметр от примерно 60 до примерно 200 нм, от примерно 60 до примерно 190 нм, или от примерно 70 до примерно 190 нм, или от примерно 60 до примерно 180 нм, или от примерно 70 нм до примерно 180 нм, или от примерно 50 нм до примерно 200 нм, или от примерно 60 до примерно 120 нм, или от примерно 70 до примерно 120 нм, или от примерно 80 до примерно 120 нм, или от примерно 90 до примерно 120 нм, или от примерно 100 до примерно 120 нм, или от примерно 60 до примерно 130 нм, или от примерно 70 до примерно 130 нм, или от примерно 80 до примерно 130 нм, или от примерно 90 до примерно 130 нм, или от примерно 100 до примерно 130 нм, или от примерно 110 до примерно 130 нм, или от примерно 60 до примерно 140 нм, или от примерно 70 до примерно 140 нм, или от примерно 80 до примерно 140 нм, или от примерно 90 до примерно 140 нм, или от примерно 100 до примерно 140 нм, или от примерно 110 до примерно 140 нм, или от примерно 60 до примерно 150 нм, или от примерно 70 до примерно 150 нм, или от примерно 80 до примерно 150 нм, или от примерно 90 до примерно 150 нм, или от примерно 100 до примерно 150 нм, или от примерно 110 до примерно 150 нм, или от примерно 120 до примерно 150 нм.
Полимеры
[0049] В некоторых воплощениях наночастицы могут содержать матрицу из полимеров и терапевтический агент. В некоторых воплощениях терапевтический агент и/или группировка, обеспечивающая направленную доставку, может быть ассоциирован(а) с по меньшей мере частью полимерной матрицы. Терапевтический агент может быть ассоциирован с поверхностью полимерной матрицы, может быть инкапсулирован в полимерной матрице, может быть окружен полимерной матрицей и/или может быть диспергирован по всей полимерной матрице.
[0050] Любой подходящий полимер может быть использован в раскрытых наночастицах. Полимеры могут представлять собой природные или неприродные (синтетические) полимеры. Полимеры могут представлять собой гомополимеры или сополимеры, содержащие два или более мономеров. Что касается последовательности, сополимеры могут быть неупорядоченными, блочными, или могут содержать комбинацию неупорядоченных и блочных последовательностей. Обычно полимеры являются органическими полимерами.
[0051] Термин ''полимер'' в данном документе имеет его обычное значение, которое используется в данной области, т.е. означает молекулярную структуру, содержащую одно или более повторяющихся звеньев (мономеров), связанных ковалентными связями. Повторяющиеся звенья все могут быть идентичными, или в некоторых случаях в полимере может присутствовать больше, чем один тип повторяющихся звеньев. В некоторых случаях полимер иметь биологическое происхождение, т.е. биополимер. Не ограничивающие примеры включают пептиды и белки. В некоторых случаях в полимере могут присутствовать также дополнительные группировки, например биологические группировки, такие как те, которые описаны ниже. Если в полимере присутствуют повторяющиеся звенья белее одного типа, то полимер называется "сополимером". Следует иметь в виду, что в любом воплощении с использованием полимера используемым полимером может быть сополимер в некоторых случаях. Повторяющиеся звенья, образующие сополимер, могут быть расположены любым образом. Например, повторяющиеся звенья могут быть расположены в произвольном порядке, в переменном порядке или в виде блоксополимера, т.е. содержащего один или более участков, каждый из которых содержит первое повторяющееся звено (например, первый блок), и один или более участков, каждый из которых содержит второе повторяющееся звено (например, второй блок) и т.п. Блоксополимеры могут иметь два (диблоксополимер), три (триблоксополимер) или больше различающихся блоков.
[0052] Раскрытые частицы могут содержать сополимеры, которые в некоторых воплощениях представляют собой два или более полимеров (таких как полимеры, описанные в данном документе), которые ассоциированы друг с другом, обычно посредством ковалентного связывания двух или более полимеров вместе. Так, сополимер может содержать первый полимер и второй полимер, которые конъюгированы вместе с образованием блоксополимера, где первый полимер может представлять собой первый блок блоксополимера, и второй полимер может представлять собой второй блок блоксополимера. Разумеется, специалистам в данной области будет понятно, что блоксополимер в некоторых случаях может содержать множество полимерных блоков, и что ''блоксополимер'' в данном документе не ограничен только блоксополимерами, имеющими только один первый блок и один второй блок. Например, блоксополимер может содержать первый блок, содержащий первый полимер, и второй блок, содержащий второй полимер, и третий блок, содержащий третий полимер или первый полимер, и т.д. В некоторых случаях блоксополимеры могут содержать любое количество первых блоков первого полимера и вторых блоков второго полимера (и в некоторых случаях третьи блоки, четвертые блоки и т.д.). Кроме того, следует отметить, что блоксополимеры могут быть также образованы, в некоторых случаях, из других блоксополимеров. Например, первый блоксополимер может быть конъюгирован с другим полимером (который может представлять собой гомополимер, биополимер, другой блоксополимер и т.д.) с образованием нового блоксополимера, содержащего множество типов блоков, и/или с другими группировками (например, с неполимерными группировками).
[0053] В некоторых воплощениях полимер (например сополимер, например блоксополимер) может быть амфифильным, т.е. имеющим гидрофильную часть и гидрофильную часть, или относительно гидрофильную часть и относительно гидрофобную часть. Гидрофильный полимер может представлять собой полимер, который обычно притягивает воду, и гидрофобный полимер может представлять собой полимер, который обычно отталкивает воду. Гидрофильный или гидрофобный полимер может быть идентифицирован, например, путем получения образца полимера и измерения его угла контакта с водой (обычно полимер будет иметь угол контакта менее 60°, тогда как гидрофобный полимер будет иметь угол контакта более примерно 60°). В некоторых случаях гидрофильность двух или более полимеров может быть измерена относительно друг друга, т.е. первый полимер может быть более гидрофильным, чем второй полимер. Например, первый полимер может иметь меньший угол контакта, чем второй полимер.
[0054] В одной совокупности воплощений полимер (например сополимер, например блоксополимер), предусмотренный в данном документе, включает биосовместимый полимер, т.е. полимер, который обычно не вызывает неблагоприятной ответной реакции при введении или инъецировании живому субъекту, например не вызывает значительного воспаления и/или острого отторжения полимера иммунной системой, например посредством Т-клеточного ответа. Соответственно, терапевтические частицы, предусмотренные в данном документе, могут быть неиммуногенными. Термин ''неиммуногенный'', использованный в данном документе, относится к эндогенному ростовому фактору в его нативном состоянии, который в норме не вызывает или вызывает только минимальные уровни циркулирующих антител, Т-клеток или реакционноспособных иммунных клеток, и который в норме не вызывает у индивидуума иммунный ответ против самого себя.
[0055] Биосовместимость типично относится к острому отторжению вещества по меньшей мере частью иммунной системы, т.е. небиосовместимое вещество, имплантированное субъекту, провоцирует у субъекта иммунный ответ, который может быть достаточно тяжелым, так что отторжение вещества иммунной системой не может адекватно контролироваться, и часто бывает такой степени, что вещество должно быть удалено из субъекта. Один простой тест для определения биосовместимости заключается в подвергании клеток воздействию полимера in vitro. Биосовместимыми полимерами являются полимеры, которые в умеренных концентрациях обычно не будут приводить к значительной гибели клеток, например в концентрациях 50 микрограммов/106 клеток. Например, биосовместимый полимер может вызывать менее чем примерно 20%-ную гибель клеток при воздействии на клетки, такие как фибробласты или эпителиальные клетки, даже если он фагоцитирован или иным образом поглощен такими клетками. Не ограничивающие примеры биосовместимых полимеров, которые могут быть полезными в различных воплощениях, включают полидиоксанон (PDO), полигидроксиалканоат, полигидроксибутират, поли(глицеролсебацат), полигликолид (т.е. поли(гликолевая) кислота) (PGA), полилактид (т.е. поли(молочная) кислота) (PLA), поли(молочная) кислота-со-поли(гликолевая) кислота (PLGA), поликапрлактон, или сополимеры или производные, содержащие те и/или иные полимеры.
[0056] В некоторых воплощениях предусмотренные биосовместимые полимеры могут быть биоразлагаемыми, т.е. полимер способен разлагаться, химически и/или биологически в физиологической среде, например в организме. В данном документе "биоразлагаемыми" полимерами являются те полимеры, которые при введении в клетки разрушаются клеточными структурами (биологически разлагаемые) и/или разрушаются под действием химических процессов, таких как гидролиз (химически разлагаемые), на компоненты, которые клетки могут либо повторно использовать, либо ликвидировать без значительного токсического воздействия на клетки. В одном воплощении биоразлагаемые полимеры и их побочные продукты разложения могут быть биосовместимыми.
[0057] Частицы, раскрытые в данном документе, могут содержать или могут не содержать PEG. Кроме того, некоторые воплощения могут относиться к сополимерам, содержащим поли(сложные эфиры-простые эфиры), например полимеры, имеющие повторяющиеся звенья, соединенные сложноэфирными связями (например, связями R-C(O)-O-R') и простыми эфирными связями (например, связями R-O-R'). В некоторых воплощениях биоразлагаемый полимер, такой как гидролизуемый полимер, содержащий карбоновокислотные группы, может быть конъюгирован с поли(этиленгликолевыми) повторяющимися звеньями с образованием поли(сложного эфира-простого эфира). Полимер (например сополимер, например блоксополимер), содержащий поли(этиленгликолевые) повторяющиеся звенья, может также упоминаться как ''PEGилированный'' полимер.
[0058] Например, предусмотренный полимер может представлять собой полимер, который гидролизуется самопроизвольно под воздействием воды (например, внутри субъекта), полимер, который может разлагаться под воздействием нагревания (например, при температурах примерно 37°С). Разложение полимера может происходить с различными скоростями в зависимости от используемого полимера или сополимера. Например, срок полужизни полимера (время, за которое 50% полимера может разложиться на мономеры и/или другие неполимерные группировки) может составлять порядка дней, недель, месяцев или лет в зависимости от полимера. Полимеры могут быть биологически разлагаемыми, например в результате ферментативной активности или клеточных механизмов, в некоторых случаях, например, посредством воздействия лизосом (например имеющих относительно низкий рН). В некоторых случаях полимеры могут разлагаться на мономеры и/или другие неполимерные группировки, которые клетки могут либо повторно использовать, либо ликвидировать без значительного токсического воздействия на клетки (например, полилактид может гидролизоваться с образованием молочной кислоты, полигликолид может гидролизоваться с образованием гликолевой кислоты и т.д.).
[0059] В некоторых воплощениях полимеры могут представлять собой полиэфиры, в том числе сополимеры, содержащие звенья молочной кислоты и гликолевой кислоты, такие как поли(молочная кислота-со-гликолевая кислота) и поли(лактид-со-гликолид), собирательно именуемые в данном документе как ''PLGA''; и гомополимеры, содержащие звенья гликолевой кислоты, именуемые в данном документе как ''PGA,'' и звенья молочной кислоты, такие как поли-L-молочная кислота, поли-D-молочная кислота, поли-D,L-молочная кислота, поли-L-лактид, поли-D-лактид и поли-D,L-лактид, собирательно именуемые в данном документе как ''PLA.'' В некоторых воплощениях типичные полиэфиры включают, например, полигидроксикислоты, PEGилированные полимеры и сополимеры лактида и гликолида (например PEGилированные PLA, PEGилированные PGA, PEGилированные PLGA и их производные). В некоторых воплощениях полиэфиры включают, например, полиангидриды, поли(орто-эфиры), PEGилированный поли(орто-эфир), поли(капролактон), PEGилированный поли(капролактон), полилизин, PEGилированный полилизин, поли(этиленимин), PEGилированный поли(этиленимин), поли(L-лактид-со-L-лизин), поли(сложный эфир серина), поли(сложный эфир 4-гидрокси-L-пролина), поли[α-(4-аминобутил)-L-гликолевая кислота] и их производные.
[0060] В некоторых воплощениях полимер может представлять собой PLGA. PLGA представляет собой биосовместимый и биоразлагаемый сополимер молочной кислоты и гликолевой кислоты, и различные формы PLGA могут быть охарактеризованы соотношением молочная кислота : гликолевая кислота. Молочная кислота может представлять собой L-молочную кислоту, D-молочную кислоту или D,L-молочную кислоту. Скорость разложения PLGA можно регулировать путем изменения соотношения молочная кислота : гликолевая кислота. В некоторых воплощениях PLGA может быть охарактеризована соотношением молочная кислота: гликолевая кислота приблизительно 85:15, приблизительно 75:25, приблизительно 60:40, приблизительно 50:50, приблизительно 40:60, приблизительно 25:75 или приблизительно 15:85. В некоторых воплощениях соотношение мономеров молочной кислоты к мономерам гликолевой кислоты в полимере частицы (например, PLGA блоксополимер или PLGA-PEG блоксополимер), может быть выбрано для оптимизации различных параметров, таких как водопоглощение, высвобождение терапевтического агента и/или кинетика разложения полимера.
[0061] В некоторых воплощениях полимеры могут представлять собой один или более акриловых полимеров. В некоторых воплощениях акриловые полимеры включают, например, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метилметакрилата, этоксиэтилметакрилаты, цианоэтилметакрилат, сополимер аминоалкилметакрилата, поли(акриловую кислоту), поли(метакриловую кислоту), сополимер алкиламида и метакриловой кислоты, поли(метилметакрилат), поли(метакриловую кислоту), полиакриламид, сополимер аминоалкилметакрилата, сополимеры глицидилметакрилата, полицианоакрилаты и комбинации, содержащие один или более вышеуказанных полимеров. Акриловый полимер может содержать полностью полимеризованные сополимеры сложных эфиров акриловой и метакриловой кислоты с низким содержанием четвертичных аммониевых групп.
[0062] В некоторых воплощениях полимеры могут представлять собой катионные полимеры. Как правило, катионные полимеры способны конденсировать и/или защищать отрицательно заряженные цепи нуклеиновых кислот (например, ДНК, РНК или их производных). Аминосодержащие полимеры, такие как дендримеры на основе поли(лизина), полиэтиленимина (PEI) и поли(амидоамина) предусмотрены для использования в некоторых воплощениях в раскрытой частице.
[0063] В некоторых воплощениях полимеры могут представлять собой разлагаемые полиэфиры, имеющие катионные боковые цепи. Примеры этих полиэфиров включают поли(L-лактид-со-L-лизин), поли(сложный эфир серина), поли(сложный эфир 4-гидрокси-L-пролина).
[0064] Предусматривается, что PEG может быть концевым и может иметь концевую группу. Например, PEG может оканчиваться гидроксильной, метокси или другой алкоксильной группой, метильной или другой алкильной группой, арильной группой, карбоновокислотной группой, аминогруппой, амидогруппой, ацетильной группой, гуанидиногруппой или имидазолом. Другие предусмотренные концевые группы включают азидные, алкиновые, малеимидные, альдегидные, гидразидные, гидроксиламинные, алкоксиаминные или тиольные группировки.
[0065] Специалистам в данной области техники известны способы и методы PEGилирования полимера, например с использованием EDC (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида) и NHS (N-гидроксисукцинимид) для взаимодействия полимера с PEG группой, оканчивающейся в амине, методами полимеризации с раскрытием кольца (ROMP) или т.п.
[0066] В одном из воплощений молекулярная масса (или, например, соотношение молекулярных масс, например разных блоков сополимера) полимеров может быть оптимизирована в целях эффективного лечения, как раскрыто в данном документе. Например, молекулярная масса полимера может оказывать влияние на скорость распада частицы (например, когда молекулярную массу биоразлагаемого полимера можно регулировать), растворимость, водопоглощение и кинетику высвобождения лекарственного средства. Например, молекулярную массу полимера (или, например, соотношение молекулярных масс, например разных блоков сополимера) можно регулировать таким образом, чтобы частица распадалась в организме субъекта, которого лечат, в течение разумного периода времени (в пределах от нескольких часов до 1-2 недель, 3-4 недель, 5-6 недель, 7-8 недель и т.д.).
[0067] Раскрытая частица может содержать, например, диблоксополимер PEG и PL(G)A, где, например, PEG-часть может иметь среднечисленную молекулярную массу примерно 1000-20000, например примерно 2000-20000, например от примерно 2 до примерно 10000, a PL(G)A-часть может иметь среднечисленную молекулярную массу от примерно 5000 до примерно 20000 или примерно 5000-100000, например примерно 20000-70000, например примерно 15000-50000.
[0068] Например, раскрыта иллюстративная терапевтическая наночастица, которая содержит от примерно 10 до примерно 99 массовых процентов сополимера поли(молочная) кислота-поли(этилен)гликоль или сополимера поли(молочная)-со-поли(гликолевая) кислота-поли(этилен)гликоль, или от примерно 20 до примерно 80 массовых процентов, от примерно 40 до примерно 80 массовых процентов, или от примерно 30 до примерно 50 массовых процентов, или примерно 70 до примерно 90 массовых процентов сополимера поли(молочная) кислота-поли(этилен)гликоль или сополимера поли(молочная)-со-поли(гликолевая) кислота-поли(этилен)гликоль. Иллюстративные сополимеры поли(молочная) кислота-поли(этилен)гликоль могут иметь среднечисленную молекулярную массу от примерно 15 до примерно 20 кДа (например 15 или 16 кДа), или от примерно 10 до примерно 25 кДа поли(молочной) кислоты и среднечисленную молекулярную массу от примерно 4 до примерно 6 (например 5 кДа) или примерно от 2 кДа до примерно 10 кДа поли(этилен)гликоля.
[0069] В некоторых воплощениях сополимер поли(молочная) кислота-поли(этилен)гликоль может иметь долю среднечисленной молекулярной массы поли(молочной) кислоты от примерно 0,6 до примерно 0,95, в некоторых воплощениях от примерно 0,7 до примерно 0,9, в некоторых воплощениях от примерно 0,6 до примерно 0,8, в некоторых воплощениях от примерно 0,7 до примерно 0,8, в некоторых воплощениях от примерно 0,75 до примерно 0,85, в некоторых воплощениях от примерно 0,8 до примерно 0,9, и в некоторых воплощениях от примерно 0,85 до примерно 0,95. Следует иметь в виду, что доля среднечисленной молекулярной массы поли(молочной) кислоты может быть вычислена путем деления среднечисленной молекулярной массы компонента сополимера поли(молочная) кислота на сумму среднечисленной молекулярной массы компонента поли(молочная) кислота и среднечисленной молекулярной массы компонента поли(этилен)гликоль.
[0070] Раскрытые наночастицы возможно могут содержать от примерно 1 до примерно 50 массовых процентов поли(молочной) кислоты или поли(молочной) кислоты-со-поли(гликолевой) кислоты (которая не содержит PEG), или возможно могут содержать от примерно 1 до примерно 50 массовых процентов, или от примерно 10 до примерно 50 массовых процентов, или от примерно 30 до примерно 50 массовых процентов поли(молочной) кислоты или поли(молочной) кислоты-со-поли(гликолевой) кислоты. Например, поли(молочная) или поли(молочная)-со-поли(гликолевая) кислота может иметь среднечисленную молекулярную массу от примерно 5 до примерно 15 кДа, или от примерно 5 до примерно 12 кДа. Иллюстративная PLA может иметь среднечисленную молекулярную массу от примерно 5 до примерно 10 кДа. Иллюстративная PLGA может иметь среднечисленную молекулярную массу от примерно 8 до примерно 12 кДа.
[0071] Терапевтическая наночастица может содержать в некоторых воплощениях от примерно 10 до примерно 30 массовых процентов, в некоторых воплощениях от примерно 10 до примерно 25 массовых процентов, в некоторых воплощениях от примерно 10 до примерно 20 массовых процентов, в некоторых воплощениях от примерно 10 до примерно 15 массовых процентов, в некоторых воплощениях от примерно 15 до примерно 20 массовых процентов, в некоторых воплощениях от примерно 15 до примерно 25 массовых процентов, в некоторых воплощениях от примерно 20 до примерно 25 массовых процентов, в некоторых воплощениях от примерно 20 до примерно 30 массовых процентов или в некоторых воплощениях от примерно 25 до примерно 30 массовых процентов поли(этилен)гликоля, где поли(этилен)гликоль может присутствовать в виде сополимера поли(молочная) кислота-поли(этилен)гликоль, сополимера поли(молочная)-со-поли(гликолевая) кислота-поли(этилен)гликоль гомополимера или поли(этилен)гликоля. В некоторых воплощениях полимеры наночастиц могут быть конъюгированы с липидом. Полимер может представлять собой, например, липид-концевой PEG. Как описано ниже, липидная часть полимера может быть использована для самосборки с другим полимером, облегчая образование наночастицы. Например, гидрофильный полимер может быть конъюгирован с липидом, который будет обеспечивать самосборку с гидрофобным полимером.
[0072] В некоторых воплощениях липиды представляют собой масла. Как правило, любое масло, известное в данной области, может быть конъюгировано с полимерами, используемыми в наночастицах. В некоторых воплощениях масло может содержать одну или более групп жирных кислот или их солей. В некоторых воплощениях группа жирной кислоты может содержать перевариваемые, длинноцепочечные (например С6-С50), замещенные или незамещенные углеводороды. В некоторых воплощениях группа жирной кислоты может представлять собой С10-С20 жирную кислоту или ее соль. В некоторых воплощениях группа жирной кислоты может представлять собой С15-С20 жирную кислоту или ее соль. В некоторых воплощениях жирная кислота может быть незамещенной. В некоторых воплощениях группа жирной кислоты может быть монозамещенной. В некоторых воплощениях группа жирной кислоты может быть полизамещенной. В некоторых воплощениях двойная связь группы незамещенной жирной кислоты может находиться в цис конфигурации. В некоторых воплощениях двойная связь незамещенной жирной кислоты может находиться в транс конфигурации.
[0073] В некоторых воплощениях группа жирной кислоты может представлять собой одну или более из масляной, капроновой, каприловой, лауриловой, миристиновой, пальмитиновой, стеариновой, арахидоновой, бегеновой или лигноцериновой кислоты. В некоторых воплощениях группа жирной кислоты может представлять собой одну или более из пальмитолевой, олеиновой, вакценовой, линолевой, альфа-линоленовой, гамма-линолевой, арахидоновой, гадоленовой, арахидоновой, эйкозапентаеновой, докозагексановой или эруциновой кислоты.
[0074] В конкретном воплощении липид представляет собой соединение формулы V:
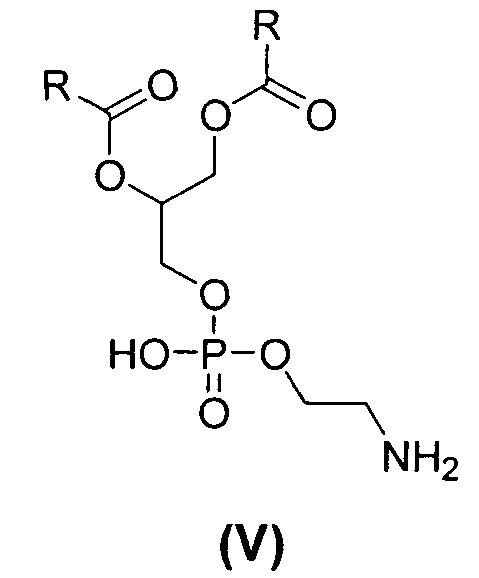
или его соль, где каждый R независимо представляет собой C1-30алкил. В одном из воплощений формулы V липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE) и его соли, например натриевую соль.
[0075] В одном из воплощений возможные обеспечивающие направленную доставку группировки небольших молекул связаны, например ковалентно связаны, с липидным компонентом наночастицы.
Наночастицы
[0076] В одной совокупности воплощений частицы могут иметь внутреннюю часть и поверхность, где поверхность имеет композицию, отличающуюся от внутренней части, т.е. по меньшей мере одно соединение присутствует во внутренней части, но не присутствует на поверхности (или наоборот), и/или по меньшей мере одно соединение присутствует во внутренней части и на поверхности в разных концентрациях. Например, в одном из воплощений соединение, такое как группировка, обеспечивающая направленную доставку, может присутствовать как во внутренней части, так и на поверхности частицы, но в более высокой концентрации на поверхности, чем во внутренней части частицы. Хотя в некоторых случаях концентрация во внутренней части частицы может быть по существу ненулевой, т.е. во внутренней части частицы присутствует детектируемое количество соединения.
[0077] В некоторых случаях внутренняя часть частицы является более гидрофобной, чем поверхность частицы. Например, внутренняя часть частицы может быть относительно гидрофобной по сравнению с поверхностью частицы, и лекарственное средство или другая полезная нагрузка может быть гидрофобным(ой) и легко ассоциируется с относительно гидрофобным центром частицы. Таким образом, лекарственное средство или другая полезная нагрузка может содержаться во внутренней части частицы, которая может защищать ее от внешней среды, окружающей частицу (или наоборот). Например, содержащееся внутри частицы лекарственное средство, или другая полезная нагрузка, вводимое субъекту, будет защищено от организма субъекта, и организм может быть также по существу изолированным от лекарственного средства в течение по меньшей мере некоторого периода времени.
[0078] Например, в данном документе раскрыта терапевтическая полимерная наночастица, содержащая первый нефункционализированный полимер; возможный второй нефункционализированный полимер; возможный функционализированный полимер, содержащий обеспечивающую направленную доставку группировку; и терапевтический агент. В конкретном воплощении первый нефункционализированный полимер представляет собой PLA, PLGA или PEG или их сополимеры, например диблоксополимер PLA-PEG. Например, иллюстративные наночастицы могут иметь корону из PEG с плотностью примерно 0,065 г/см3 или от примерно 0,01 до примерно 0,10 г/см3.
[0079] Раскрытые наночастицы могут быть стабильными (например, они могут сохранять по существу весь активный агент), например в растворе, который может содержать сахарид, в течение по меньшей мере примерно 3 суток, примерно 4 суток или по меньшей мере примерно 5 суток при комнатной температуре или при 25°С.
[0080] В некоторых воплощениях предусмотренная наночастица может содержать циклодекстрин. Подходящий циклодекстрин может включать α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин или их смеси. Иллюстративные циклодекстрины, предусмотренные для использования в наночастицах, раскрытых в данном документе, включают гидроксипропил-β-циклодекстрин (HPbCD), гидроксиэтил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрин, метил-β-циклодекстрин, диметил-β-циклодекстрин, карбоксиметил-β-циклодекстрин, карбоксиметилэтил-β-циклодекстрин, диэтил-β-циклодекстрин, три-О-алкил-β-циклодекстрин, глюкозил-β-циклодекстрин и мальтозил-β-циклодекстрин. В некоторых воплощениях циклодекстрин может быть ковалентно присоединен к полимеру. Например, в некоторых воплощениях циклодекстрин может быть ковалентно присоединен к хитозану.
[0081] Например, в некоторых воплощениях предусмотренная наночастица может содержать от примерно 0,05 до примерно 35 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 0,05 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 0,1 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 0,5 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 1 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 2 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 5 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 10 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 15 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 20 до примерно 30 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 15 до примерно 25 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 5 до примерно 25 массовых процентов циклодекстрина, в некоторых воплощениях от примерно 5 до примерно 20 массовых процентов циклодекстрина, или в некоторых воплощениях от примерно 5 до примерно 15 массовых процентов циклодекстрина.
[0082] В некоторых воплощениях раскрытые наночастицы могут также содержать жирный спирт, который может увеличивать скорость высвобождения лекарственного средства. Например, раскрытые наночастицы могут содержать C8-С30 спирт, такой как цетиловый спирт, октанол, стеариловый спирт, арахидиловый спирт, докозональ или октазональ.
[0083] Наночастицы могут иметь свойства контролируемого высвобождения, например могут быть способны доставлять некоторое количество терапевтического агента пациенту, например в конкретное место пациента, в течение продолжительного периода времени, например в течение 1 суток, 1 недели или дольше.
[0084] В некоторых воплощениях раскрытые наночастицы по существу немедленно высвобождают (например, в течение от примерно 1 минуты до примерно 30 минут) менее примерно 2%, менее примерно 4%, менее примерно 5% или менее примерно 10% активного агента, например когда они помещены в фосфатный буферный раствор при комнатной температуре и/или при 37°С.
[0085] В другом воплощении раскрытая наночастица может высвобождать менее примерно 40%, менее 50% или менее 60%, менее 70% активного агента, например, когда она помещена в фосфатный буферный раствор при комнатной температуре или при 37°С, в течение 0,5 часа или дольше. В одном из воплощений раскрытая наночастица может высвобождать менее примерно 70% терапевтического агента в течение 0,5 часа, когда она помещена в фосфатный буферный раствор при 37°С.
[0086] В другом воплощении раскрытая наночастица может высвобождать менее примерно 20%, менее примерно 30%, менее примерно 40%, менее 50% или даже менее 60% (или больше), например, когда она помещена в фосфатный буферный раствор при комнатной температуре или при 37°С, в течение 1 суток или дольше. В одном из воплощений раскрытая наночастица может высвобождать менее примерно 60% терапевтического агента в течение 2 часов, когда она помещена в фосфатный буферный раствор при комнатной температуре.
[0087] В некоторых воплощениях после введения субъекту или пациенту раскрытой наночастицы или композиции, которая содержит раскрытую наночастицу, максимальная концентрация в плазме крови (Сmax) терапевтического агента у пациента по существу выше по сравнению с Сmax терапевтического агента в том случае, когда его вводят сам по себе (например не как часть наночастицы).
[0088] В другом воплощении раскрытая наночастица, содержащая терапевтический агент, при введении субъекту может иметь tmax терапевтического агента по существу длительнее по сравнению с tmax терапевтического агента, вводимого самого по себе.
[0089] Могут быть созданы библиотеки таких частиц. Например, за счет варьирования соотношений двух (или более) полимеров в частице эти библиотеки могут быть полезны для скрининговых тестов, анализов с высокой пропускной способностью или т.п. Частицы в библиотеке могут иметь различные свойства, такие как свойства, описанные выше, и в некоторых случаях более чем одно свойство частиц может варьироваться в библиотеке. Соответственно, одно воплощение относится к библиотеке наночастиц, имеющих разные соотношения полимеров с разными свойствами. Библиотека может включать в себя любое(ые) подходящее(ие) соотношение(я) полимеров.
[0090] В некоторых воплощениях биосовместимый полимер представляет собой гидрофобный полимер. Не ограничивающие примеры биосовместимых полимеров включают полилактид, полигликолид и/или поли(лактид-со-гликолид).
[0091] В другом воплощении данное описание предусматривает наночастицу, содержащую 1) полимерную матрицу; 2) возможно амфифильное соединение или слой, которое(ый) окружает или диспергирован(о) внутри полимерной матрицы, образующей непрерывную или не являющуюся непрерывной оболочку для частицы; 3) нефункционализированный полимер, который может составлять часть полимерной матрицы, и 4) возможно эксципиент, который может составлять часть полимерной матрицы. Например, амфифильный слой может снижать поникание воды в наночастицу, тем самым усиливая эффективность инкапсулирования лекарственного средства и замедляя высвобождение лекарственного средства.
[0092] Используемый в данном документе термин ''амфифильный'' относится к свойству, когда молекула имеет как полярную часть, так и неполярную часть. Часто амфифильное соединение имеет полярную головную часть, присоединенную к длинному гидрофобному хвосту. В некоторых воплощениях полярная часть является растворимой в воде, а неполярная часть является нерастворимой в воде. Кроме того, полярная часть может иметь либо формальный положительный заряд, либо формальный отрицательный заряд. Альтернативно, полярная часть может иметь как формальный положительный, так и отрицательный заряд, и может представлять собой цвиттерион или внутреннюю соль. В некоторых воплощениях амфифильное соединение может представлять собой, без ограничения, одно или множество из следующего: липиды природного происхождения, поверхностно-активные вещества или синтезированные соединения, как с гидрофильными, так и с гидрофобными группировками.
[0093] Конкретные примеры амфифильных соединений включают, без ограничения, фосфолипиды, такие как 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC) и дилигноцероилфатидилхолин (DLPC), включаемые в соотношении 0,01-60 (масса липида/масса полимера), наиболее предпочтительно 0,1-30 (масса липида/масса полимера). Фосфолипиды, которые могут быть использованы, включают, без ограничения, фосфатидиновые кислоты, фосфатидилхолины как с насыщенными, так и ненасыщенными липидами, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилсерины, фосфатидилинозитолы, лизофосфатидильные производные, кардиолипин и β-ацил-у-алкилфосфолипиды. Примеры фосфолипидов включают, без ограничения, фосфатидилхолины, такие как диолеоилфосфатидилхолин, димиристоилфосфатидилхолин, дипентадеканоилфосфатидилхолин, дилауроилфосфатидилхолин, дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибегеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1-гексадецил-2-пальмитоилглицерофосфоэтаноламин. Синтетические фосфолипиды с асимметрическими ацильными цепями (например, с одной ацильной цепью из 6 атомов углерода и другой ацильной цепью из 12 атомов углерода) также могут быть использованы.
[0094] В конкретном воплощении амфифильный компонент, который может быть использован для образования амфифильного слоя, представляет собой лецитин и, в частности, фосфатидилхолин. Лецитин является амфифильным липидом и, как таковой, образует фосфолипидный бислой, имеющий гидрофильные (полярные) головные группы, обращенные к их окружениям, которые чаще всего являются водными, и гидрофобные хвосты, обращенные друг к другу. Лецитин имеет преимущество в том, что он является природным липидом, который доступен, например, из соевых бобов, и который уже имеет разрешение FDA (Управление по контролю пищевых продуктов и лекарственных средств США) на применение в других средствах доставки. Кроме того, смесь липидов, таких как лецитин, еще более предпочтительна, чем один единственный чистый.
[0095] В некоторых воплощениях раскрытая наночастица имеет амфифильный монослой, и это означает, что этот слой не является фосфолипидным бислоем, а существует в виде единственного непрерывного или прерывистого слоя вокруг или внутри наночастицы. Амфифильный слой ''ассоциирован с'' наночастицей, и это означает, что он расположен в некоторой близости к полимерной матрице, например окружает внешнюю сторону полимерной оболочки, или диспергирован в полимерах, которые создают наночастицу.
Получение наночастиц
[0096] Другой аспект данного изобретения относится к системам и способам изготовления раскрытых наночастиц. В некоторых воплощениях свойства частиц контролируют, используя два или более разных полимеров (например сополимеров, например блоксополимеров) в разных соотношениях и получая частицы из этих полимеров (например сополимеров, например блоксополимеров). Например, полимер (например сополимер, например блоксополимер) может быть выбран ввиду его биосовместимости и/или его способности контролировать иммуногенность полученной в результате частицы.
[0097] В одной совокупности воплощений частицы образуют путем приготовления раствора, содержащего один или более полимеров, и приведения раствора в контакт с нерастворителем полимеров с получением частицы. Раствор может быть смешиваемым или несмешиваемым с нерастворителем полимеров. Например, смешиваемая с водой жидкость, такая как ацетонитрил, тетрагидрофуран, ацетон, формамид, диметилформамид, пиридин, диоксан или диметилсульфоксид, может содержать полимеры, и частицы образуются, когда смешиваемый с водой органический раствор приводят в контакт с водой, нерастворителем полимеров, например вливая смешиваемый с водой органический раствор в воду с контролируемой скоростью. Полимер, содержащийся в смешиваемом с водой органическом растворе, после контактирования с нерастворителем полимеров затем может быть осажден с образованием частиц, таких как наночастицы.
[0098] Две жидкости называют ''смешиваемыми'' или ''несмешиваемыми'' друг с другом, когда одна нерастворима в другой до уровня по меньшей мере 10% по массе при температуре и давлении окружающей среды. Обычно органический раствор (например, дихлорметан, хлороформ и т.д.) и водная жидкость (например, вода или вода, содержащая растворенные соли или другие типы молекул, клеточную или биологическую среду, этанол и т.д.) являются несмешиваемыми друг с другом. Например, первый раствор можно вливать во второй раствор (с подходящей скоростью). В некоторых случаях частицы, такие как наночастицы, могут образовываться, когда первый раствор контактирует с несмешиваемой второй жидкостью. Например, осаждение полимера при контактировании заставляет полимер образовывать наночастицы, когда первый раствор вливают во вторую жидкость, и в некоторых случаях наночастицы могут образовываться, например, когда скорость введения тщательно контролируется и когда поддерживается относительно медленная скорость. Специалист в данной области без труда сможет оптимизировать контроль такого образования частиц, используя лишь рутинное экспериментирование.
[0099] В некоторых воплощениях водный раствор может содержать поверхностно-активное вещество. Например, поверхностно-активное вещество может представлять собой неионное поверхностно-активное вещество, ионное поверхностно-активное вещество или их смесь. В некоторых случаях неионное поверхностно-активное вещество может иметь гидрофильно-липофильный баланс (HLB) более примерно 10, в некоторых воплощениях боле примерно 12, в некоторых воплощениях более примерно 15 и в некоторых воплощениях более примерно 18. В некоторых воплощениях HLB может составлять от примерно 10 до примерно 20, в некоторых воплощениях от примерно 12 до примерно 20, в некоторых воплощениях от примерно 15 до примерно 20 или в некоторых воплощениях от примерно 18 до примерно 20.
[00100] В некоторых воплощениях неионное поверхностно-активное вещество может представлять собой полимер. Например, в некоторых случаях неионное поверхностно-активное вещество может содержать гидрофильный полимер, такой как полиалкиленоксид (например, полиэтиленоксид). В некоторых воплощениях гидрофильный полимер (например, полиэтиленоксид) может иметь молекулярную массу от примерно 2 кДа до примерно 10 кДа или в некоторых случаях от примерно 4 кДа до примерно 6 кДа. В некоторых воплощениях неионное поверхностно-активное вещество может содержать гидрофобный полимер. Например, гидрофобный полимер в некоторых случаях может представлять собой поли(молочную кислоту) или поли(молочную кислоту)-со-(гликолевую кислоту). В некоторых воплощениях поли(молочная кислота) или поли(молочная кислота)-со-(гликолевая кислота) может иметь молекулярную массу от примерно 0,2 кДа до примерно 1,0 кДа или в некоторых случаях от примерно 0,4 кДа до примерно 0,8 кДа. В некоторых воплощениях неионное поверхностно-активное вещество может представлять собой блоксополимер, например полиэтиленоксид-блок-поли(молочную кислоту) или полиэтиленоксид-блок-поли(молочная кислота)-со-(гликолевую кислоту).
[00101] В некоторых воплощениях поверхностно-активное вещество может представлять собой алкиловый эфир полиоксиалкилена. Например, в некоторых случаях алкиловый эфир полиоксиалкилена может представлять собой стеариловый эфир полиоксиэтилена (100) (т.е. Brij® 100), цетиловый эфир полиоксиэтилена (20) (т.е. Brij® 58) или лауриловый эфир полиоксиэтилена (23) (т.е. Brij® 35). В некоторых воплощениях алкиловый эфир полиоксиалкилена может иметь молекулярную массу от примерно 1 кДа до примерно 10 кДа, в некоторых воплощениях от примерно 1 кДа до примерно 8 кДа, в некоторых воплощениях от примерно 1 кДа до примерно 6 кДа, в некоторых воплощениях от примерно 1 кДа до примерно 4 кДа, в некоторых воплощениях от примерно 1 кДа до примерно 2 кДа, в некоторых воплощениях от примерно 2 кДа до примерно 10 кДа, в некоторых воплощениях от примерно 4 кДа до примерно 10 кДа, в некоторых воплощениях от примерно 2 кДа до примерно 8 кДа, в некоторых воплощениях от примерно 4 кДа до примерно 6 кДа.
[00102] В некоторых воплощениях водный раствор, используемый в образовании предусмотренных наночастиц (т.е. водная фаза), может содержать от примерно 0,01 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,05 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,1 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,2 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 1 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 2 до примерно 5 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,01 до примерно 4 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,01 до примерно 2 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,01 до примерно 1 массового процента поверхностно-активного вещества, в некоторых воплощениях от примерно 0,01 до примерно 0,1 массового процента поверхностно-активного вещества, в некоторых воплощениях от примерно 0,05 до примерно 2 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,05 до примерно 1 массового процента поверхностно-активного вещества, в некоторых воплощениях от примерно 0,05 до примерно 0,2 массового процента поверхностно-активного вещества, в некоторых воплощениях от примерно 0,1 до примерно 2 массовых процентов поверхностно-активного вещества, в некоторых воплощениях от примерно 0,1 до примерно 1 массового процента поверхностно-активного вещества или в некоторых воплощениях от примерно 1 до примерно 2 массовых процентов поверхностно-активного вещества.
[00103] Свойства, такие как поверхностная функциональность, поверхностный заряд, размер, дзета (ζ) потенциал, гидрофобность, способность контролировать иммуногенность и т.п., можно тщательно контролировать, используя раскрытый способ. Например, библиотека частиц может быть синтезирована и подвергнута скринингу для идентификации частиц, имеющих конкретное соотношение полимеров, которое позволяет частицам иметь конкретную плотность группировок, присутствующих на поверхности частицы. Это дает возможность получать частицы с одним или более конкретными свойствами, например конкретным размером и конкретной поверхностной плотностью группировок, без неоправданной степени усилий. Соответственно, некоторые воплощения относятся к способам скрининга с использованием таких библиотек, а также любых частиц, идентифицированных с использованием таких библиотек. Кроме того, идентификация может происходить любым подходящим способом. Например, идентификация может быть прямой или непрямой, или может протекать количественно или качественно.
[00104] В другом воплощении предложен способ наноэмульгирования, такой как способ, представленный на ФИГ. 1, 2А и 2В. Например, терапевтический агент, первый полимер (например, диблоксополимер, такой как PLA-PEG или PLGA-PEG), и возможный эксципиент (например, выбранный из группы, состоящей из сополимера метакриловой кислоты, Тип А - NF (т.е. Eudragit® L 100); сополимера метакриловой кислоты, Тип В - NF (т.е. Eudragit® S 100); и сополимера аминометакрилата - NF (т.е. Eudragit® E PO)) могут быть объединены с органическим раствором с образованием первой органической фазы. Такая первая фаза может содержать от примерно 1 до примерно 50% масс. Твердых частиц, от примерно 5 до примерно 50% масс. Твердых частиц, от примерно 5 до примерно 40% масс. твердых частиц, от примерно 1 до примерно 15% масс. твердых частиц или от примерно 10 до примерно 30% масс. твердых частиц. Первая органическая фаза может быть объединена с первым водным раствором, возможно содержащим поверхностно-активное вещество, с образованием второй фазы. Органический раствор может включать, например, толуол, метилэтилкетон, ацетонитрил, тетрагидрофуран, этилацетат, изопропиловый спирт, изопропилацетат, диметилформамид, диметилсульфоксид, метиленхлорид, дихлорметан, хлороформ, ацетон, бензиловый спирт, Tween 80, Span 80 или т.п. и их комбинации. В одном воплощении органическая фаза может содержать бензиловый спирт, этилацетат и их комбинации. В другом воплощении органическая фаза может содержать бензиловый спирт, этилацетат, диметилформамид, диметилсульфоксид и их комбинации. Вторая фаза может составлять от примерно 0,01 до 50% масс. от 0,1 до 50% масс., от примерно 1 до 50% масс., от примерно 5 до 40% масс. или от примерно 1 до 15% масс. твердых частиц. Водный раствор может представлять собой воду, возможно в комбинации с одним или более растворенных веществ, например холатом натрия, этилацетатом, бензиловым спиртом или поверхностно-активным веществом, выбранным из группы, состоящей из поливинилацетата, полиэтиленоксид-блок-поли(молочная кислота), полиэтиленоксид-блок-поли(молочная кислота-со-гликолевая кислота) и детергента Brij® (например, Brij® 100, Brij® 58 и/или Brij® 35).
[00105] Например, для масла или органической фазы можно использовать растворитель, который только частично смешивается с нерастворителем (водой). Таким образом, при смешивании в достаточно низком соотношении и/или при использовании воды, предварительно насыщенной органическими растворителями, масляная фаза остается жидкой. Масляная фаза может быть эмульгирована в водном растворе и в виде жидких капель разделена на наночастицы с использованием, например, высокоэнергетических дисперсионных систем, таких как гомогенизаторы или ультразвуковые диспергаторы. Водная часть эмульсии, иначе известная как ''водная фаза'', может представлять собой раствор поверхностно-активного вещества, состоящий из холата натрия, полиэтиленоксид-блок-поли(молочная кислота), полиэтиленоксид-блок-поли(молочная кислота-со-гликолевая кислота) и/или детергента Brij, и может быть предварительно насыщена этилацетатом и бензиловым спиртом.
[00106] Эмульгирование второй фазы с образованием эмульсионной фазы может быть осуществлено, например, за одну или две стадии эмульгирования. Например, первичная эмульсия может быть получена и затем эмульгирована с образованием тонкодисперсной эмульсии. Первичная эмульсия может быть образована, например, с использованием простого смешивания, гомогенизатора высокого давления, ультразвукового диспергатора с датчиком, магнитной мешалки или роторно-статорного гомогенизатора. Первичная эмульсия может быть преобразована в тонкодисперсную эмульсию с использованием, например, ультразвукового диспергатора или гомогенизатора высокого давления, применяя, например, 1, 2, 3 или более пропусканий через гомогенизатор. Например, при использовании гомогенизатора высокого давления можно применять давление от примерно 30 (207 кПа) до примерно 60 фунт/кв. дюйм (414 кПа), от примерно 40 (276 кПа) до примерно 50 фунт/кв. дюйм (345 кПа), от примерно 1000 (6900 кПа) до примерно 8000 фунт/кв. дюйм (55500 кПа), от примерно 5000 (34500 кПа) до примерно 15000 фунт/кв. дюйм (103500 кПа), от примерно 2000 (13800 кПа) до примерно 4000 фунт/кв. дюйм (27600 кПа), от примерно 4000 (27600 кПа) до примерно 8000 фунт/кв. дюйм (55500 кПа) или от примерно 4000 (27600 кПа) до примерно 5000 фунт/кв. дюйм (34500 кПа), например примерно 2000 (13800), 2500 (17250), 4000 (27600) или 5000 фунт/кв. дюйм (34500 кПа).
[00107] Для завершения экстракции растворителя и отверждения частиц может потребоваться либо выпаривание растворителя, либо разбавление. Для лучшего контроля кинетики экстракции и большей масштабируемости процесса можно использовать разбавление растворителя водой. Например, эмульсия может быть разбавлена холодной водой до концентрации, достаточной для растворения всего органического растворителя с образованием погашенной фазы. В некоторых воплощениях, гашение может быть осуществлено по меньшей мере частично при температуре примерно 5°С или ниже. Например, вода, используемая для гашения, может иметь температуру, которая меньше комнатной температуры (например, от примерно 0 до примерно 10°С или от примерно 0 до примерно 5°С).
[00108] В некоторых воплощениях не весь терапевтический агент инкапсулируется в частицах на этой стадии, и в погашенную фазу добавляют солюбилизатор лекарственного средства с образованием солюбилизированной фазы. Солюбилизатор лекарственного средства может представлять собой, например, Tween 80, Tween 20, поливинилпирролидон, циклодекстран, додецилсульфат натрия, холат натрия, диэтилнитрозамин, ацетат натрия, мочевину, глицерин, пропиленгликоль, глюкофурол, поли(этилен)гликоль, бис(полиоксиэтиленгликоль)додециловый эфир, бензоат натрия, салицилат натрия или их комбинации. Например, Tween-80 может быть добавлен в погашенную суспензию наночастиц для солюбилизации свободного лекарственного средства (т.е. терапевтического агента) и предотвращения образования кристаллов лекарственного средства. В некоторых воплощениях соотношение солюбилизатора лекарственного средства к терапевтическому агенту составляет от примерно 200:1 до примерно 10:1 или в некоторых воплощениях от примерно 100:1 до примерно 10:1.
[00109] Солюбилизированная фаза может быть подвергнута фильтрации для выделения наночастиц. Например, ультрафильтрационные мембраны могут быть использованы для концентрирования суспензии наночастиц и по существу удаления органического растворителя, свободного лекарственного средства (т.е. неинкапсулированного терапевтического агента), солюбилизатора лекарственного средства и других технологических вспомогательных веществ (поверхностно-активных веществ). Типичная фильтрация может быть осуществлена с использованием системы фильтрации в тангенциальном потоке. Например, наночастицы могут быть селективно выделены с использованием мембраны с размером пор, подходящим для того, чтобы наночастицы оставались, а растворенные вещества, мицеллы и органический растворитель проходили. Могут быть использованы типичные мембраны с отсечкой молекулярных масс примерно 300-500 кДа (~5-25 нм).
[00110] Диафильтрация может быть осуществлена с использованием подхода постоянного объема, что означает, что диафильтрат (холодная деионизированная вода, например от примерно 0 до примерно 5°С или 0 до примерно 10°С) может быть добавлен в подаваемую суспензию с такой же скоростью, с которой фильтрат удаляют из суспензии. В некоторых воплощениях фильтрование может включать первое фильтрование с использованием первой температуры от примерно 0 до примерно 5°С или от 0 до примерно 10°С, и второй температуры от примерно 20 до примерно 30°С или от 15 до примерно 35°С. В некоторых воплощениях фильтрование может включать обработку от примерно 1 до примерно 30, в некоторых случаях от примерно 1 до примерно 15 или в некоторых случаях от 1 до примерно 6 диаобъемов. Например, фильтрование может включать обработку от примерно 1 до примерно 30 или в некоторых случаях от примерно 1 до примерно 6 диаобъемов, при температуре от примерно 0 до примерно 5°С, и обработку по меньшей мере одного диаобъема (например от примерно 1 до примерно 15, от примерно 1 до примерно 3 или от примерно 1 до примерно 2 диаобъемов) при температуре от примерно 20 до примерно 30°С. В некоторых воплощениях фильтрование включает обработку разных диаобъемов при разных температурах.
[00111] После очистки и концентрирования суспензии наночастиц частицы могут быть пропущены через один, два или более стерилизующих и/или объемных фильтров, например с использованием объемного префильтра ~0,2 мкм. Например, стадия стерильной фильтрации может включать фильтрование терапевтических наночастиц с использованием фильтрационной линии при контролируемой скорости. В некоторых воплощениях фильтрационная линия может включать объемный фильтр и стерильный фильтр.
[00112] В другом воплощении получения наночастиц образуют органическую фазу, состоящую из смеси терапевтического агента и полимера (гомополимера и сополимера). Органическую фазу смешивают с водной фазой в соотношении приблизительно 1:5 (масляная фаза : водная фаза), где водная фаза состоит из поверхностно-активного вещества и растворенного растворителя. Первичную эмульсию образуют путем объединения двух фаз простым смешиванием или смешиванием с использованием роторно-статорного гомогенизатора. Первичную эмульсию затем преобразуют в тонкодисперсную эмульсию с использованием гомогенизатора высокого давления. Тонкодисперсную эмульсию затем гасят добавлением в деионизированную воду при перемешивании. В некоторых воплощениях соотношение гаситель : эмульсия может составлять от примерно 2:1 до примерно 40:1 или в некоторых воплощениях от примерно 5:1 до примерно 15:1. В некоторых воплощениях соотношение гаситель : эмульсия составляет приблизительно 8,5:1. Затем в гаситель добавляют раствор Tween (например, Tween 80) до достижения приблизительно 2% Tween в сумме. Это обеспечивает растворение свободного, неинкапсулированного терапевтического агента. Наночастицы затем выделяют либо центрифугированием, либо ультрафильтрацией/диафильтрацией.
[00113] Будет понятно, что количества полимера и терапевтического агента, которые используют в приготовлении композиции, могут отличаться от конечной композиции. Например, некоторое количество терапевтического агента может быть не полностью введено в наночастицу, и такой свободный терапевтический агент может быть, например, отфильтрован. Например, в одном воплощении первый органический раствор, содержащий примерно 11 массовых процентов теоретической нагрузки терапевтическим агентом в первом органическом растворе, второй органический раствор, содержащий примерно 89 массовых процентов полимера (например, полимер может включать PLA-PEG), и водный раствор могут быть использованы в приготовлении композиции, которая дает в результате, например, конечную наночастицу, содержащую примерно 2 массовых процента терапевтического агента и примерно 98 массовых процентов полимера (где полимер может включать PLA-PEG). Такие способы могут обеспечивать получение конечных наночастиц, подходящих для введения пациенту, которые содержат от примерно 1 до примерно 20 массовых процентов терапевтического агента, например примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 8, примерно 10 или примерно 15 массовых процентов терапевтического агента.
Терапевтические агенты
[00114] В одном аспекте раскрытыми наночастицами можно доставлять любой агент, включая, например, терапевтические агенты (например, противораковые агенты или противовоспалительные агенты), диагностические агенты (например, контрастные агенты; радионуклиды; и флуоресцентные, люминесцентные и магнитные группировки), профилактические агенты (например, вакцины) и/или нутрицевтические агенты (например, витамины, минералы и т.д.). Иллюстративные агенты, доставляемые в соответствии с настоящим изобретением, включают, без ограничения, небольшие молекулы (например, цитотоксические агенты или противовоспалительные агенты), нуклеиновые кислоты (например, миРНК, РНКи и микроРНК агенты), белки (например антитела), пептиды, липиды, углеводы, гормоны, металлы, радиоактивные элементы и соединения, лекарственные средства, вакцины, иммунологические агенты и т.д. и/или их комбинации. В некоторых воплощениях агент, который требуется доставлять, представляет собой агент, полезный в лечении рака. В других воплощениях агент может быть полезен для лечения воспалительного заболевания.
[00115] В конкретном воплощении лекарственное средство или другая полезная нагрузка могут высвобождаться из частицы контролируемым образом и взаимодействовать локально с конкретным участком-мишенью (например, опухолью или воспаленной тканью). Термин ''контролируемое высвобождение'' (и варианты этого термина), используемый в данном документе (например, в контексте ''системы контролируемого высвобождения''), обычно означает высвобождение вещества (например, лекарственного средства) в выбранном участке или высвобождение, иным образом контролируемое по скорости, интервалу и/или количеству. Контролируемое высвобождение охватывает, но необязательно ограничено ими, по существу непрерывную доставку, доставку по схеме (например, прерывистую доставку в течение определенного периода времени, которая прерывается через регулярные или нерегулярные промежутки времени) и доставку болюсом выбранного вещества (например в виде предопределенного, дискретного количества вещества в течение относительно короткого периода времени (например, в течение нескольких секунд или минут)).
[00116] Активный агент или лекарственное средство может представлять собой терапевтический агент, такой как антинеопластический агент, такой как ингибиторы mTor (например, сиролимус, темсиролимус или эверолимус), алкалоиды барвинка, такие как винкристин, дитерпеновое производное или таксан, такой как паклитаксел (или его производные, такие как DHA-паклитаксел или PG-паклитаксел) или кабазитаксел.
[00117] В одной совокупности воплощений полезная нагрузка представляет собой лекарственное средство или комбинацию более одного лекарственных средств. Такие частицы могут быть полезными, например, в воплощениях, где обеспечивающая направленную доставку группировка может быть использована для направленной доставки частицы, содержащей лекарственное средство, в конкретно локализованное местоположение в организме субъекта, например для обеспечения локализованной доставки лекарственного средства. Иллюстративные терапевтические агенты включают химиотерапевтические агенты, такие как доксорубицин (адриамицин), гемцитабин (гемзар), даунорубицин, прокарбазин, митомицин, цитарабин, этопозид, метотрексат, венорелбин, 5-фторурацил (5-FU), алкалоиды барвинка, такие как винбластин или винкристин, блеомицин, паклитаксел (таксол), доцетаксел (таксотер), кабазитаксел, альдеслейкин, аспарагиназа, бисульфан, карбоплатин, кладрибин, камптотецин, СРТ-11, 10-гидрокси-7-этилкамптотецин (SN38), дакарбазин, S-I капецитабин, фторафур, 5'-дезоксифторуридин, UFT, энилурацил, дезоксицитидин, 5-азацитозин, 5-азадезоксицитозин, аллопуринол, 2-хлороаденозин, триметрексат, аминоптерин, метилен-10-деазааминоптерин (MDAM), оксаплатин, пикоплатин, тетраплатин, сатраплатин, платина-DACH, ормаплатин, CI-973, JM-216 и их аналоги, эпирубицин, этопозида фосфат, 9-аминокамптотецин, 10,11-метилендиоксикамптотецин, каренитецин, 9-нитрокамптотецин, TAS 103, виндезин, L-фенилаланиновый аналог иприта, ифосфамид, мефосфамид, перфосфамид, трофосфамид, кармустин, семустин, эпотилоны А-Е, томудекс, 6-меркаптопурин, 6-тиогуанин, амсакрин, этопозида фосфат, каренитецин, ацикловир, валацикловир, ганцикловир, амантадин, римантадин, ламивудин, зидовудин, бевацизумаб, трастузумаб, ритуксимаб, 5-фторурацил и их комбинации.
[00118] Не ограничивающие примеры потенциально подходящих лекарственных средств включают противораковые агенты, в том числе, например, кабазитаксел, митоксантрон и митоксантрона гидрохлорид. В другом воплощении полезная нагрузка может представлять собой противораковое лекарственное средство, такое как 20-эпи-1,25-дигидроксивитамин D3, 4-ипомеанол, 5-этинилурацил, 9-дигидротаксол, абиратерон, аквицин, акларубицин, акодазола гидрохлорид, акронин, ацилфиилвен, адецифенол, адозелезин, альдеслейкин, all-tk антагонисты, алтретамин, амбамустин, амбомицин, аметантрона ацетат, амидокс, амифостин, аминоглутетимид, аминолевулиновая кислота, амрубицин, амсакрин, анагрелид, анастрозол, андрографолид, ингибиторы ангиогенеза, антагонист D, антагонист G, антареликс, антрамицин, антинейральный морфогенетический белок-1, антиэстроген, антинеопластон, антисмысловые олигонуклеотиды, афидиколина глицинат, модуляторы гена апоптоза, регуляторы апоптоза, апуриновая кислота, ARA-CDP-DL-PTBA, аригининдеаминаза, аспарагиназа, асперлин, асулакрин, атаместан, атримустин, аксинастатин 1, аксинастатин 2, аксинастатин 3, азацитидин, азасетрон, азатоксин, азатирозин, азетепа, азотомицин, производные баккатина III, баланол, батимастат, бензохлорины, бензодепа, бензоилстауроспорин, производные бета-лактама, бета-алетин, бетасламицин В, бетулиновая кислота, ингибитор BFGF, бикалутамид, бисантрен, бисантрена гидрохлорид, бисазуидинилспермин, биснафид, биснафида димезилат, бистратен А, бизелезин, блеомицин, блеомицина сульфат, антагонисты BRC/ABL, брефлат, бреквинар натрий, бропиримин, будотитан, бисульфан, бутионин сульфоксимин, кактиномицин, калципотриол, калфостин С, калустерон, производные камптотецина, канарипокс IL-2, капецитабин, карацераид, кабазитаксел, карбетимер, карбоплатин, карбоксамид-амино-триазол, карбоксиамидотриазол, карест М3, кармустин, earn 700, ингибитор, получаемый из хряща, карубицина гидрохлорид, карзелезин, ингибиторы казеинкиназы, кастаноспермин, цекропин В, цедефингол, цетрореликс, хлорамбуцил, хлорины, хлорохиноксалина сульфонамид, цикапрост, циролемицин, цисплатин, цис-порфирин, кладрибин, аналоги кломифена, кпартияримазол, коллисмицин А, коллисмицин В, комбретастатин А4, аналог комбретастатина, конагенин, крамбесцидин 816, криснатол, криснатола мезилат, криптофицин 8, производные криптофицина А, курацин А, циклопентантрахиноны, циклофосфамид, циклоплатам, суремицин, цитарабин, цитарабина окфосфат, цитолитический фактор, цитостатин, дакарбазин, дакликсимаб, дактиномицин, даунорубицина гидрохлорид, децитабин, дегидродидемнин В, деслорелин, дексифосфамид, дексормаплатин, дексразоксан, дексверапамил, дезагуанин, дезагуанина мезилат, диазиквон, дидемнин В, дидокс, диэтихиорспермин, дигидро-5-азацитидин, диоксамицин, дифенилспиромустин, доцетаксел, докозанол, доласетрон, доксифлуридин, доксорубицин, доксорубицина гидрохлорид, дролоксифен, дролоксифена цитрат, дромостанолона пропионат, дронабинол, дуазомицин, дуокармицин SA, эбелелен, экомустин, эдатрексат, эделфосин, эдреколомаб, эфломитин, эфломитина гидрохлорид, элемен, элсарнитруцин, эмитефур, энолоплатин, энпромат, эпипропидин, эпирубицин, эпирубицина гидрохлорид, эпристерид, эрбулозол, векторная система для генной терапии эритроцитов, эзорубицина гидрохлорид, эстрамустин, аналог эстрамустина, эстрамустина фосфат натрий, агонисты эстрогенов, антагонисты эстрогенов, этанидазол, этопозид, этопозида фосфат, этоприн, экземестан, фадрозол, фадрозола гидрохлорид, фазарабин, фенретинид, филграстим, финастерид, флавопиридол, флезеластин, флоксуридин, флуастерон, флударабин, флударабина фосфат, фтородаунорубицина гидрохлорид, фторурацил, флуроцитабин, форфенимекс, форместан, фосквидон, фостриецин, фостриецин натрий, фотемустин, тексафирин гадолиния, нитрат галлия, галоцитабин, ганиреликс, ингибиторы желатиназы, гемцитабин, гемцитабина гидрохлорид, ингибиторы глутатиона, гепсульфам, герегулин, гексаметилен-бисацетамид, гидроксимочевина, гиперицин, ибандроновая кислота, идарубицин, идарубицина гидрохлорид, идоксифен, идрамантон, ифосфамид, ихнофосин, иломастат, имидазоакридоны, имиквимод, иммуностимулирующие пептиды, ингибитор рецептора инсулиноподобного фактора роста 1, агонисты интерферонов, интерферон альфа-2А, интерферон альфа-2В, интерферон альфа-NI, интерферон альфа-N3, интерферон бета-IA, интерферон гамма-IB, интерфероны, интерлейкины, иобенгуан, иододоксорубицин, ипроплатм, иринотекан, иринотекана гидрохлорид, ироплакт, ирсогладин, изобенгазол, изогомогаликондрин В, итасетрон, джасплакинолид, кахалалид F, ламелларина-N триацетат, ланреотид, ланреотида ацетат, лейнамицин, ленограстим, лентинана сульфат, лептолстатин, летрозол, лейкемия-ингибирующий фактор, лейкоцитарный альфа-интерферон, лейкопролида ацетат, лейкопролид/эстроген/прогестерон, лейпрорелин, левамисол, лиарозол, лиарозола гидрохлорид, линейный полиаминный аналог, липофильный дисахаридный пептид, липофильные соединения платины, лиссоклинамид, лобаплатин, ломбрицин, лометрексол, лометрексол натрий, ломустин, лонидамин, лозоксантрон, лозоксантрона гидрохлорид, ловастатин, локсорибин, луртотекан, лютеция тексафирин, лизофиллин, литические пептиды, майтанзин, манностатин А, маримастат, масопрокол, маспин, ингибиторы матрилизина, ингибиторы матриксных металлопротеиназ, майтанзин, мехлорэтамина гидрохлорид, мегестрола ацетат, меленгестрола ацетат, мелфалан, меногарил, мербарон, меркаптопурин, метерелин, метиониназа, метотрексат, метотрексат натрий, метослопраамид, метоприн, метуредепа, ингибиторы микроалгальной протеинкиназы С, ингибитор MIF, мифепристон, милтефозин, миримостин, некомплементарная двухнитевая РНК, митиндомин, митокарцин, митокромин, митогиллин, митогуазон, митолактол, митомалцин, митомицин, аналоги митомицина, митонафид, митосфер, митотан, митотоксин, фактор роста фибробластов-сапорин, митоксантрон, митоксантрона гидрохлорид, мофаротен, молграмостим, моноклональное антитело, человеческий хориоидальный гонадотропин, монофосфориллипид А/клеточная стенка миобактерии SK, мопидамол, ингибитор гена множественной лекарственной устойчивости, терапия на основе супрессора множественных опухолей 1, противораковый агент на основе иприта, микапероксид В, экстракт из микобактериальных клеточных стенок, микофеноловая кислота, мириапорон, N-ацетилдиналин, нафарелин, нагрестип, налоксон/пентазоцин, напавин, нафтерпин, нартограстим, недаплатин, неморубицин, неридроновая кислота, нейтральная эндопептидаза, нилутамид, низамицин, модуляторы оксидов азота, нитроксидный антиоксидант, нитруллин, нокодазол, ногаламицин, N-замещенные бензамиды, O6-бензилгуанин, октреотид, окиценон, олигонуклеотиды, онапристон, ондансетрон, орацин, перорпльный идуктор цитокинов, ормаплатин, осатерон, оксалиплатин, оксауномицин, оксисуран, паклитаксел, аналоги паклитаксела, производные паклитаксела, палауамин, пальмитоилризоксинп, памидроновая кислота, панкситриол, паномифен, парабактин, пазеллипптин, пегаспаргаза, пелдезин, пелиомицин, пентамустин, пентозана полисульфат натрий, пентостатин, пентрозол, пепломицина сульфат, перфлуброн, перфосфамид, перилловый спирт, феназиноомицин, фенилацетат, ингибиторы фосфатазы, пицибанил, пилокарпина гидрохлорид, пипоброман, пипосульфан, пирарубицин, пиритрексим, пироксантрона гидрохлорид, плацети А, плацетин В, ингибитор активатора плазминогена, платиновый комплекс, платиновые соединения, комплекс платина-триамин, пликамицин, пломестан, порфимер натрий, порфиромицин, преднимустин, прокарбазина гидрохлорид, пропил-бис-акридон, простагландин J2, антиандроген карциномы предстательной железы, ингибиторы протеасомы, иммуномодулятор на основе белка А, ингибитор протеинкиназы С, ингибиторы протеинтирозинфосфатазы, ингибиторы пуриннуклеозидфосфорилазы, пуромицин, пуромицина гидрохлорид, пурпурины, пиразорурин, пиразолакридин, конъюгат пиридоксилированного гемоглобина с полиоксиэтиленом, антагонисты RAF, ралтитрексед, рамосетрон, ингибиторы фарнезилпротеинтрансферазы RAS, ингибиторы RAS, ингибитор RAS-GAP, ретеллиптин деметилированный, этидронат рения RE 186, ризоксин, рибоприн, рибозимы, ретинарнид RH, РНКи, роглетимид, рохитукин, ромуртид, роквинимекс, рубигинон BI, рубоксил, сафингол, сафингола гидрохлорид, саинтопин, саркну, саркофитол А, сарграмостим, миметики SDI1, семустин, ингибитор старения 1, смысловые олигонуклеотиды, ингибиторы сигнальной трансдукции, модуляторы сигнальной трансдукции, симтразен, одноцепочечный антигенсвязывающий белок, сизофиран, собузоксан, борокаптат натрия, фенилацетат натрия, солверол, соматомединсвязывающий белок, сонермин, спарфозаф-натрий, спарфозовая кислота, спарзомицин, спикамицин D, спирогермания гидрохлорид, спироомустин, спироплатин, спленопентин, спонгистатин 1, скваламин, ингибитор стволовых клеток, ингибиторы деления стволовых клеток, стипиамид, стрептонигрин, стрептозоцин, ингибиторы стрмелезина, сульфинозин, сулофенур, суперактивный антагонист вазоактивного интестинального пептида, сурадиста, сурамин, свайнсонин, синтетические гликозаминогликаны, талисомицин, таллимустин, тамоксифена метилйодид, тауромустин, тазаротен, текогалан натрий, тегафур, теллурапирилий, ингибиторы теломеразы, телоксантрона гидрохлорид, темопорфин, темозоломид, тенипозид, тероксирон, тестолактон, тетрахлордекаоксид, тетразомин, талибластин, талидомид, тиамиприн, тиокоралин, тиогуанин, тиотепа, тромбопоэтин, миметик тромбопоэтина, тимальфасин, агонист рецептора тимопоэтина, тимотринан, тироидстимулирующий гормон, тиазфурин, оловоэтилэтиопурпурин, тирапазамин, дихлорид титаноцена, топотекана гидрохлорид, топсентин, торемифен, торемифена цитрат, фактор роста тотипотентных стволовых клеток, ингибиторы трансплантации, трестолона ацетат, третиноин, триацетилуридин, трицирибин, трицирибина фосфат, триметрексат, триметрексата глюкуронат, трипторелин, трописетрон, тубулозола гидрохлорид, туростерид, ингибиторы тирозинкиназ, тирфостины, ингибиторы UBC, убенимекс, урацильный аналог иприта, уредепа, ингибирующий фактор развития из урогенитального синуса, антагонисты рецепторов урокиназы, вапреотид, вариолин В, валарезол, верамин, вердины, вертепорфин, винбластина сульфат, винкристина сульфат, виндезин, виндезина сульфат, винепидина сульфат, винглицината сульфат, винлейрозина сульфат, винорелбин или винорелбина тартрат, винрозидина сульфат, винксалтин, винзолидина сульфат, витаксин, ворозол, занотерон, зениплатин, зиласкорб, зиностатин, зиностатин стималамер или зорубицина гидрохлорид.
[00119] Не ограничивающие примеры потенциально подходящих лекарственных средств также включают противовоспалительные агенты, в том числе, например, противовоспалительные стероиды и нестероидные противовоспалительные агенты (NSAID). Не ограничивающие примеры противовоспалительных агентов включают метотрексат, циклоспорин, алклометазон, азатиоприн, беклометазона дипропионат, бетаметазона дипропионпт, будесонид, целекоксиб, хлоропреднизон, циклесонид, кортизол, кортикоспорин, кортивазол, дефлазакорт, гексаметазон, флудроксикортид, флунизолид, флуоцинонид, флуокортолон, флурометолон, флутиказон, флутиказона фуроат, флутиказона пропионат, глюклкортикоиды, гидрокортамат, мегестрола ацетат, мезалазин, мепреднизон, 6-меркаптопурин, метилпреднизолон, мометазона фуроат, параметазон, преднизолон, преднизон, преднилиден, прегнадиен, прегнатриен, прегнен, проктоседил, римексолон, тетрагидрокортикостерон, тобрамицин/дексаметазон, триамцинолон и улобетазол.
Фармацевтические композиции
[00120] Наночастицы, раскрытые в данном документе, могут быть объединены с фармацевтически приемлемыми носителями с образованием фармацевтической композиции согласно еще одному аспекту. Как должно быть понятно специалисту в данной области, носители могут быть выбраны в зависимости от пути введения, как описано ниже, локализации ткани-мишени, лекарственного средства, которое требуется доставлять, динамики доставки лекарственного средства и т.д.
[00121] Фармацевтические композиции можно вводить пациенту любым способом, известным в данной области, включая пероральный и парентеральный пути. Термин "пациент" в данном документе относится к людям, а также к животным, не являющимся людьми, включая, например, млекопитающих, птиц, рептилий, амфибий и рыбу. Например, животными, не являющимися людьми, могут быть млекопитающие (например, грызун, мышь, крыса, кролик, обезьяна, собака, кошка, примат или свинья). В некоторых воплощениях желательными являются парентеральные пути, поскольку они позволяют избегать контакта с пищеварительными ферментами, которые находятся в пищеварительном тракте. Согласно таким воплощениям композиции по изобретению можно вводить инъекциями (например, внутривенными, подкожными или внутримышечными, интраперитонеальными инъекциями), ректально, вагинально, местно (в виде порошков, кремов, мазей или капель) или ингаляцией (в виде спреев).
[00122] В конкретном воплощении наночастицы вводят нуждающемуся в этом субъекту системно, например внутривенной инфузией или инъекцией.
[00123] Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии, могут быть приготовлены способами, известными в данной области, с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный инъецируемый препарат может представлять собой также стерильный инъецируемый раствор, суспензию или эмульсию в нетоксичном, парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, находятся вода, раствор Рингера в соответствии с U.S.Р. (Фармакопея США) и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла традиционно используют в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. Кроме того, в приготовлении инъекционных композиций используют жирные кислоты, такие как олеиновая кислота. В одном из воплощений конъюгат по изобретению суспендируют в жидкости-носителе, содержащей 1% (масс./об.) натрий-карбоксиметилцеллюлозы и 0,1% (об./об.) TWEEN™ 80. Инъецируемые композиции могут быть стерилизованы, например, фильтрованием через удерживающий бактерии фильтр или посредством введения стерилизующих агентов в форме стерильных твердых композиций, которые перед использованием могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде.
[00124] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах инкапсулированный или неинкапсулированный конъюгат смешивают с по меньшей мере одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или (а) наполнителями или веществами, увеличивающими объем, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (б) связывющими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, (в) увлажнителями, такими как глицерин, (г) диспергирующими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые салицилаты и карбонат натрия, (д) агентами, замедляющими растворение, такими как парафин, (е) ускорителями всасывания, такими как четвертичные аммониевые соединения, (ж) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, (з) абсорбентами, такими как каолиновая и бентонитовая глина, и (и) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль лекарственная форма может содержать также буферные агенты.
[00125] Должно быть понятно, что точную дозировку наночастицы, содержащей терапевтический агент, выбирает лечащий врач с учетом пациента, подлежащего лечению, и обычно дозировку и введение корректируют для обеспечения введения эффективного количества наночастицы, содержащей терапевтический агент, пациенту, которого лечат. В данном документе ''эффективное количество'' наночастицы, содержащей терапевтический агент, относится к количеству, необходимому для того, чтобы вызвать желаемый биологический ответ. Специалистам в данной области будет понятно, что эффективное количество наночастицы, содержащей терапевтический агент, может сильно зависеть от таких факторов, как желаемый биологический результат, лекарственное средство, предназначенное для доставки, ткань-мишень, путь введения и т.д. Например, эффективное количество наночастицы, содержащей терапевтический агент, может представлять собой количество, которое вызывает сокращение размера опухоли за желаемый период времени. Дополнительные факторы, которые могут быть приняты во внимание, включают тяжесть болезненного состояния; возраст, массу тела и пол пациента, которого лечат; диету, время и частоту введения; комбинации лекарственных средств; реакционную чувствительность; и толерантность к терапии/ответная реакция на терапию.
[00126] Наночастицы могут быть приготовлены в стандартной лекарственной форме для облегчения введения и единообразия дозировки. Выражение ''стандартная лекарственная форма'' в данном документе относится к физически дискретной единице наночастицы, подходящей для пациента, которого лечат. Будет понятно, однако, что суммарное суточное употребление композиций будет решать лечащий врач в рамках здравого смысла с медицинской точки зрения. Для любой наночастицы терапевтически эффективную дозу можно оценить первоначально либо в анализах на клеточной культуре, либо на животных моделях, обычно на мышах, кроликах, собаках или свиньях. Животную модель также используют для определения желаемого диапазона концентраций и пути введения. Такая информация затем может быть использована для определения полезных доз, путей введения людям. Терапевтическая эффективность и токсичность наночастиц может быть определена по стандартным фармацевтическим методикам на клеточных культурах или экспериментальных животных, например как ED50 (доза, терапевтически эффективная у 50% популяции) и LD50 (доза, летальная для 50% популяции). Соотношение доз, вызывающих токсические эффекты, к дозам, вызывающим терапевтические эффекты, представляет собой терапевтический индекс, и его выражают как соотношение LD50/ED50. Фармацевтические композиции, которые демонстрируют большие терапевтические индексы, могут быть полезными в некоторых воплощениях. Данные, полученные из анализов на клеточных культурах и в результате исследований на животных, могут быть использованы в определении диапазона дозировок для применения у людей.
[00127] В иллюстративном воплощении раскрыта фармацевтическая композиция, которая содержит множество наночастиц, каждая из которых содержит терапевтический агент и фармацевтически приемлемый эксципиент.
[00128] В одном из воплощений раскрытые в данном документе композиции могут содержать менее примерно 10 м.д. (миллионные доли) палладия, или менее примерно 8 м.д., или менее примерно 6 м.д. палладия. Например, предложена композиция, которая содержит наночастицы, имеющая менее примерно 10 м.д. палладия.
[00129] В некоторых воплощениях предусмотрена композиция, подходящая для замораживания, содержащая наночастицы, раскрытые в данном документе, и раствор, подходящий для замораживания, например раствор сахара, такого как моно-, ди- или полисахарид, например сахарозу и/или трегалозу, и/или раствор соли и/или циклодекстрина добавляют в суспензию наночастиц. Сахар (например, сахароза или трегалоза) может действовать, например, в качестве криозащитного вещества для предотвращения агрегации частиц при замораживании. Например, предложена композиция наночастиц, содержащая множество раскрытых наночастиц, сахарозу, ионный галогенид и воду; где соотношение наночастицы/сахароза/вода/ионный галогенид составляет примерно 3-40%/10-40%/20-95%/0,1-10% (масс./масс./масс./масс.) или примерно 5-10%/10-15%/80-90%/1-10% (масс./масс./масс./масс). Например, такой раствор может содержать наночастицы, раскрытые в данном документе, от примерно 5% до примерно 20% масс. сахарозы и ионного галогенида, такого как хлорид натрия, в концентрации примерно 10-100 мМ. В качестве другого примера предложена композиция наночастиц, содержащая множество раскрытых наночастиц, трегалозу, циклодекстрин и воду; где соотношение наночастицы/трегалоза/вода/циклодекстрин составляет примерно 3-40%/1-25%/20-95%/1-25% (масс./масс./масс./масс.) или примерно 5-10%/1-25%/80-90%/10-15% (масс./масс./масс./масс.).
[00130] Например, предусмотренный раствор может содержать раскрытые в данном документе наночастицы, от примерно 1% до примерно 25% масс. дисахарида, такого как трегалоза или сахароза (например, от примерно 5% до примерно 25% трегалозы или сахарозы, например от примерно 10% трегалозы или сахарозы или от примерно 15% трегалозы или сахарозы, например примерно 5% сахарозы) по массе) и циклодекстрин, такой как β-циклодекстрин, в концентрации от примерно 1% до примерно 25% масс. (например от примерно 5% до примерно 20%, например 10% или примерно 20% масс., или от примерно 15% до примерно 20% масс. циклодекстрина). Предусмотренные композиции могут содержать множество раскрытых наночастиц (например наночастиц, имеющих PLA-PEG и активный агент) и от примерно 2% до примерно 15% масс. (или от примерно 4% до примерно 6% масс., например примерно 5% масс.) сахарозы и от примерно 5% масс. до примерно 20% (например от примерно 7% массовых процентов до примерно 12% масс., например примерно 10% масс.) циклодекстрина, например HPbCD).
[00131] Настоящее изобретение в части относится к лиофилизированным фармацевтическим композициям, которые при разведении имеют минимальное количество больших агрегатов. Такие большие агрегаты имеют размер больше примерно 0,5 мкм, больше примерно 1 мкм или больше примерно 10 мкм и могут быть нежелательными в разведенном растворе. Размеры агрегатов могут быть измерены с использованием целого ряда различных методов, включая методы, указанные в Фармакопее США (USP) 32 <788>, которая включена в данное описание посредством ссылки. Тесты, в общих чертах изложенные в USP 32 <788>, включают тест, основанный на подсчете частиц в режиме светоблокировки, тест, основанный на микроскопическом подсчете частиц, лазерную дифракцию и оптическое считывание одиночных частиц. В одном из воплощений размер частиц в данном образце измеряют с использованием лазерной дифракции и/или оптического считывания одиночных частиц.
[00132] В USP 32 <788> для теста с подсчетом частиц в режиме светоблокировки изложены рекомендации для выборочного исследования размеров частиц в суспензии. Для растворов 100 мл или менее препарат удовлетворяет тесту, если среднее количество присутствующих частиц не превышает 6000 частиц на контейнер, размер которых ≥10 мкм, и 600 частиц на контейнер, размер которых ≥25 мкм.
[00133] В USP 32 <788> в отношении микроскопического теста подсчета частиц изложены инструкции по определению количества частиц с использованием бинокулярного микроскопа, установленного на увеличение 100±10х, имеющего окулярный микрометр. Окулярный микрометр представляет собой круговую окулярную сетку, которая состоит из окружности, разделенной на квадранты черными делительными кружками, обозначающими 10 мкм и 25 мкм при просмотре с 100х увеличением. Линейная шкала предусмотрена ниже окулярной сетки. Количество частиц с отнесением к 10 мкм и 25 мкм подсчитывают визуально. Для растворов 100 мл или менее препарат удовлетворяет тесту, если среднее количество присутствующих частиц не превышает 3000 на контейнер, размер которых ≥10 мкм, и 300 на контейнер, размер которых ≥25 мкм.
[00134] В некоторых воплощениях 10-миллилитровый водный образец раскрытой композиции после разведения содержит менее 600 частиц на мл, имеющих размер 10 микрон или более; и/или менее 60 частиц на мл, имеющих размер 25 микрон или более.
[00135] Динамическое светорассеяние (DLS) может быть использовано для измерения размера частиц, но этот метод опирается на броуновское движение и поэтому не может обнаруживать некоторые более крупные частицы. Лазерная дифракция основывается на разности показателей преломления частицы и суспензионной среды. Этот метод способен обнаруживать частицы в диапазоне от субмикронного до миллиметрового. Относительно небольшие (например, примерно 1-5% масс.) количества более крупных частиц могут быть определены в суспензиях наночастиц. Оптическое считывание одиночной частицы (SPOS) использует светоблокировку разбавленных суспензий для подсчета индивидуальных частиц примерно 0,5 мкм. Зная концентрацию частиц в измеренном образце, можно вычислить массовый процент агрегатов или концентрацию агрегатов (частиц на мл).
[00136] Образование агрегатов может происходить во время лиофилизации вследствие дегидратации поверхности частиц. Этой дегидратации можно избежать, используя в суспензии перед лиофилизацией лиопротектанты, такие как дисахариды. Подходящие дисахариды включают сахарозу, лактулозу, лактозу, мальтозу, трегалозу или целлобиозу и/или их смеси. Другие предусмотренные дисахариды включают койибиозу, нигерозу, изомальтозу, β,β-трегалозу, α,β-трегалозу, софорозу, ламинарибиозу, гентиобиозу, туранозу, мальтулозу, палатинозу, гентиобиулозу, маннобиазу, мелибиозу, мелибиулозу, рутинозу, рутинулозу и ксилобиозу. Разведение показывает эквивалентные распределения частиц по размерам DLS по сравнению с исходной суспензией. Однако в некоторых разведенных растворах лазерная дифракция может детектировать частицы размером >10 мкм. Дополнительно, SPOS также может детектировать частицы размером >10 мкм при концентрации выше концентрации согласно инструкциям FDA (104-105 частиц/мл для частиц >10 мкм).
[00137] В некоторых воплощениях одна или более ионных галогенидных солей могут быть использованы в качестве дополнительного лиопротектанта к сахару, такому как сахароза, трегалоза или их смеси. Сахара могут включать дисахариды, моносахариды, трисахариды и/или полисахариды и могут включать другие эксципиенты, например глицерин и/или поверхностно-активные вещества. Возможно, циклодекстрин может быть включен в состав в качестве дополнительного лиопротектанта. Вместо ионной галогенидной соли можно добавлять циклодекстрин. Альтернативно, циклодекстрин может быть добавлен в дополнение к ионной галогенидной соли.
[00138] Подходящие ионные галогенидные соли могут включать хлорид натрия, хлорид кальция, хлорид цинка или их смеси. Дополнительные подходящие ионные галогенидные соли включают хлорид калия, хлорид магния, хлорид аммония, бромид натрия, бромид кальция, бромид цинка, бромид калия, бромид магния, бромид аммония, йодид натрия, йодид кальция, йодид цинка, йодид калия, йодид магния или йодид аммония и/или их смеси. В одном из воплощений от примерно 1 до примерно 15 массовых процентов сахарозы может быть использовано с ионной галогенидной солью. В одном из воплощений лиофилизированная фармацевтическая композиция может содержать от примерно 10 до примерно 100 мМ хлорида натрия. В другом воплощении лиофилизированная фармацевтическая композиция может содержать от примерно 100 до примерно 500 мМ двухвалентной ионной хлоридной соли, такой как хлорид кальция или хлорид цинка. В еще одном воплощении суспензия, которую лиофилизируют, может дополнительно содержать циклодекстрин; например, может быть использовано от примерно 1 до примерно 25 массовых процентов циклодекстрина.
[00139] Подходящий циклодекстрин может включать α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин или их смеси. Иллюстративные циклодекстрины, предусмотренные для использования в композициях, раскрытых в данном документе, включают гидроксипропил-β-циклодекстрин (HPbCD), гидроксиэтил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрин, метил-β-циклодекстрин, диметил-β-циклодекстрин, карбоксиметил-β-циклодекстрин, карбоксиметил-этил-β-циклодекстрин, диэтил-β-циклодекстрин, три-О-алкил-β-циклодекстрин, глюкозил-β-циклодекстрин и мальтозил-β-циклодекстрин. В одном из воплощений от примерно 1 до примерно 25 массовых процентов трегалозы (например, от примерно 10% до примерно 15%, например от 5 до примерно 20% масс.) может быть использовано с циклодекстрином. В одном из воплощений лиофилизированная фармацевтическая композиция может содержать от примерно 1 до примерно 25 массовых процентов β-циклодекстрина. Иллюстративная композиция может содержать наночастицы, содержащие PLA-PEG, активный/терапевтический агент, от примерно 4% до примерно 6% (например, от примерно 5% массовых процентов) сахарозы и от примерно 8 до примерно 12 массовых процентов (например примерно 10% масс.) HPbCD.
[00140] В одном аспекте предложена лиофилизированная фармацевтическая композиция, содержащая раскрытые наночастицы, где при разведении этой лиофилизированной фармацевтической композиции в концентрации наночастиц примерно 50 мг/мл в примерно 100 мл или менее водной среды разведенная композиция, подходящая для парентерального введения, содержит менее 6000, например менее 3000, микрочастиц размером 10 микрон или более; и/или менее 600, например менее 300, микрочастиц размером 25 микрон или более.
[00141] Количество микрочастиц может быть определено такими методами, как тест в соответствии с USP 32 <788> с подсчетом частиц в режиме блокировки света, микроскопический тест в соответствии с USP 32 <788> с подсчетом частиц, лазерная дифракция и оптическое считывание одиночных частиц.
[00142] В одном аспекте предложена фармацевтическая композиция, подходящая для парентерального применения после разведения, содержащая множество терапевтических частиц, каждая из которых содержит сополимер, имеющий сегмент гидрофобного полимера и сегмент гидрофильного полимера; активный агент; сахар; и циклодекстрин.
[00143] Например, сополимер может представлять собой сополимер поли(молочная) кислота-блок-поли(этилен)гликоль. После разведения водный образец 100 мл может содержать менее 6000 частиц, имеющих размер 10 микрон или больше; и менее 600 частиц, имеющих размер 25 микрон или больше.
[00144] Стадия добавления дисахарида и ионной галогенидной соли может включать добавление от примерно 5 до примерно 15 массовых процентов сахарозы или от примерно 5 до примерно 20 массовых процентов трегалозы (например, от примерно 10 до примерно 20 массовых процентов трегалозы) и от примерно 10 до примерно 500 мМ ионной галогенидной соли. Ионная галогенидная соль может быть выбрана из хлорида натрия, хлорида кальция и хлорида цинка или их смесей. В одном из воплощений может быть также добавлено от примерно 1 до примерно 25 массовых процентов циклодекстрина.
[00145] В другом воплощении стадия добавления дисахарида и циклодекстрина может включать добавление от примерно 5 до примерно 15 массовых процентов сахарозы или от примерно 5 до примерно 20 массовых процентов трегалозы (например, от примерно 10 до примерно 20 массовых процентов трегалозы) и от примерно 1 до примерно 25 массовых процентов циклодекстрина. В одном из воплощений добавляют от примерно 10 до примерно 15 массовых процентов циклодекстрина. Циклодекстрин может быть выбран из α-циклодекстрина, β-циклодекстрина, γ-циклодекстрин или их смесей.
[00146] В другом аспекте предложен способ предотвращения существенной агрегации частиц в фармацевтической композиции наночастиц, включающий добавление сахара и соли в лиофилизированную композицию для предотвращения агрегации наночастиц после разведения. В одном воплощении циклодекстрин также добавляют в лиофилизированную композицию. В еще одном аспекте предложен способ предотвращения существенной агрегации частиц в фармацевтической композиции наночастиц, включающий добавление сахара и циклодекстрина в лиофилизированную композицию для предотвращения агрегации наночастиц при разведении.
[00147] Предусмотренная лиофилизированная композиция может иметь концентрацию терапевтических частиц выше примерно 40 мг/мл. Композиция, подходящая для парентерального введения, может иметь менее примерно 600 частиц, имеющих размер больше 10 микрон в дозе 10 мл. Лиофилизация может включать замораживание композиции при температуре выше примерно -40°С или, например, ниже примерно -30°С, с образованием замороженной композиции; и сушку замороженной композиции с образованием лиофилизированной композиции. Стадию сушки можно проводить при примерно 50 мторр (66,65 Па) при температуре от примерно -25 до примерно -34°С или от примерно -30 до примерно -34°С.
[00148] В одном из воплощений предложена фармацевтическая водная суспензия, содержащая множество наночастиц, например наночастиц, раскрытых в данном документе, имеющих температуру стеклования от примерно 37°С до примерно 50°С или от примерно 37°С до примерно 39°С в указанной суспензии.
Способы лечения
[00149] В некоторых воплощениях предусмотренные наночастицы могут быть использованы для лечения, облегчения, ослабления, купирования, задержки начала, ингибирования прогрессирования, ослабления тяжести и/или снижения инцидентности одного или более симптомов или признаков заболевания, расстройства и/или состояния. В некоторых воплощениях предусмотренные наночастицы можно применять для лечения солидных опухолей, например рака и/или раковых клеток.
[00150] Термин ''рак'' охватывает предзлокачественные, а также злокачественные виды рака. Виды рака включают, без ограничения, рак крови (например, лейкоз, хронический миелогенный лейкоз, хронический миеломоноцитарный лейкоз, острый лимфобластный лейкоз, филадельфийская хромосома-положительный острый лимфобластный лейкоз, мантийноклеточная лимфома, неходжкинская лимфома, ходжкинская лимфома), рак предстательной железы, рак желудка, колоректальный рак, рак кожи, например меланомы или базальноклеточные крциномы, рак легкого (например немелкоклеточный рак легкого), рак молочной железы, рак в области головы и шеи, рак бронха, рак поджелудочной железы, рак мочевого пузыря, рак головного мозга или центральной нервной системы, рак периферической нервной системы, рак пищевода, рак ротовой полости или глотки, рак печени (например печеночноклеточную карциному), рак почки (например почечноклеточную карциному, острую нефробластому), рак яичка, рак желчного протока, рак тонкой кишки или аппендикса, гастроинтестинальную стромальную опухоль, рак слюнной железы, рак щитовидной железы, рак надпочечника, остеосаркому, хондросаркому, рак гематологических тканей и т.п. ''Раковые клетки'' могут быть в форме опухоли (т.е. солидной опухоли), могут существовать сами по себе в организме субъекта (например лейкозные клетки) или могут представлять собой линии, происходящие из рака.
[00151] Рак может быть ассоциирован с различными физическими симптомами. Симптомы рака обычно зависят от типа и локализации опухоли. Например, рак легкого может служить причиной кашля, одышки и боли в грудной клетке, а рак ободочной кишки часто вызывает диарею, запор и кровь в стуле. Однако в качестве нескольких примеров, со многими видами рака часто ассоциированы следующие симптомы: лихорадка, озноб, ночные потения, кашель, диспноэ, потеря веса, потеря аппетита, анорексия, тошнота, рвота, диарея, анемия, желтуха, гепатомегалия, гемоптис, слабость, недомогание, когнитивная дисфункция, депрессия, гормональные нарушения, нейтропения, боль, незаживающие язвы, увеличенные лимфатические узлы, периферическая невропатия и сексуальная дисфункция.
[00152] В одном аспекте предложен способ лечения рака. В некоторых воплощениях лечение рака включает введение терапевтически эффективного количества частиц по изобретению нуждающемуся в этом пациенту в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата. В некоторых воплощениях ''терапевтически эффективное количество'' предусмотренной наночастицы подставляет собой количество, эффективное для лечения, облегчения, ослабления, купирования, задержки начала, ингибирования прогрессирования, ослабления тяжести и/или снижения инцидентности одного или более симптомов или признаков рака.
[00153] В одном аспекте предложен способ введения композиций по изобретению субъекту, страдающему раком. В некоторых воплощениях частицы можно вводить субъекту в таких количествах и в течение такого времени, которые необходимы для достижения желаемого результата (т.е. лечения рака). В некоторых воплощениях ''терапевтически эффективное количество'' направленно доставляемой частицы по изобретению представляет собой количество, эффективное для лечения, облегчения, ослабления, купирования, задержки начала, ингибирования прогрессирования, ослабления тяжести и/или снижения инцидентности одного или более симптомов или признаков рака.
[00154] Терапевтические протоколы по изобретению включают введение терапевтически эффективного количества направленно доставляемой частицы по изобретению здоровому индивидууму (т.е. субъекту, который не проявляет никаких симптомов рака и/или у которого рак не диагностирован). Например, здоровые индивидуумы могут быть ''иммунизированы'' направленно доставляемой частицей по изобретению до развития рака и/или начала симптомов рака; индивидуумы с повышенным риском (например пациенты, имеющие семейную историю рака; пациенты, несущие одну или более генетических мутаций, ассоциированных с развитием рака; пациенты, имеющие генетический полиморфизм, ассоциированный с развитием рака; пациенты, инфицированные вирусом, ассоциированным с развитием рака; пациенты с вредными привычками и/или образом жизни, ассоциированными с развитием рака; и т.д.) могут получать лечение по существу одновременно (например в пределах 48 часов, в пределах 24 часов или в пределах 12 часов) с возникновением симптомов рака. Разумеется, индивидуумы с установленным раком могут получать лечение в любое время.
[00155] В других воплощениях раскрытые наночастицы могут быть использованы для ингибирования роста раковых клеток, например клеток рака легкого или ободочной кишки. В данном документе термин ''ингибирует рост раковых клеток'' или ''ингибирование роста раковых клеток'' относится к любому замедлению скорости пролиферации и/или миграции раковых клеток, остановке пролиферации и/или миграции раковых клеток или уничтожению раковых клеток с целью снижения скорости роста раковых клеток по сравнению с наблюдаемой или прогнозируемой скоростью роста контрольных раковых клеток, не подвергнутых лечению. Термин ''ингибирует рост'' может также относиться к сокращению размера опухоли или исчезновению раковых клеток или опухоли, а также к снижению их метастатического потенциала. Предпочтительно, такое ингибирование на клеточном уровне может снижать размер, останавливать рост, снижать агрессивность или предупреждать или ингибировать метастазирование рака у пациента. Специалисты в данной области без труда смогут определить по любому из множества различных подходящих признаков, ингибирован ли рост раковых клеток.
[00156] Об ингибировании роста раковых клеток может свидетельствовать, например, остановка раковых клеток в конкретной фазе клеточного цикла, например остановка в фазе G2/M клеточного цикла. Ингибирование роста раковых клеток может быть также доказано прямым или опосредованным измерением размера раковых клеток или опухоли. У раковых пациентов-людей такие измерения обычно выполняют с использованием общеизвестных методов визуализации, таких как магнитно-резонансная визуализация, компьютерная аксиальная томография и рентген. Рост раковых клеток может быть определен также опосредованнно, например путем определения уровней циркулирующего карциноэмбрионического антигена, простат-специфического антигена или других рак-специфических антигенов, которые коррелируются с ростом раковых клеток. Ингибирование роста раковых клеток также обычно коррелируется с пролонгированным выживанием и/или улучшением здоровья и самочувствия субъекта.
[00157] Предложены также способы введения пациенту раскрытой в данном документе наночастицы, содержащей активный агент, где после введения пациенту такие наночастицы по существу снижают объем распределения и/или по существу снижают свободную Сmax по сравнению с введением только агента (т.е. не в виде раскрытой в данном документе наночастицы).
[00158] Предложены также способы лечения воспалительного заболевания у нуждающегося в этом пациента. Способ включает введение пациенту терапевтически эффективного количества наночастиц по изобретению. В некоторых воплощениях воспалительное заболевание может представлять собой воспалительное заболевание кишечника, такое как болезнь Крона, неспецифический язвенный колит, коллагеновый колит, лимфоцитарный колит, ишемический колит, колит в отключенной кишке, болезнь Бехчета или неопределенный колит. В других воплощениях предложен способ лечения синдрома раздраженного кишечника у нуждающегося в этом пациента. Способ включает введение пациенту терапевтически эффективного количества наночастиц по изобретению. В некоторых воплощениях наночастицы могут содержать терапевтический агент. Например, в некоторых воплощениях терапевтический агент может представлять собой противовоспалительный агент, такой как описано выше.
ПРИМЕРЫ
[00159] Изобретение, описанное в общем, станет намного понятнее из приведенных ниже примеров, которые приведены только в целях иллюстрации некоторых аспектов и воплощений и никоим образом не ограничивают изобретение.
ПРИМЕР 1: Композиции наночастиц с патупилоном, содержащие эксципиент Eudragit
[00160] Терапевтические наночастицы были получены с использованием следующей композиции:
25% (масс./масс.) теоретического лекарственного средства;
75% (масс./масс.) полимера (80% 16/5 PLA-PEG (16 кДа PLA, 5 кДа PEG) и 20% полимера Eudragit);
общее содержание твердых частиц, % = 10%; и
растворители: 20% бензилового спирта/вода (92,5% бензилового спирта, 7,5% воды (масс./масс.)), 80% этилацетата (масс./масс.).
[00161] Для партии 1 грамм 125 мг лекарственного средства растворяли в бензиловом спирте, содержащем 7,5% масс. воды, до образования раствора лекарственного средства. 16/5 PLA-PEG (300 мг) растворяли в этилацетате до образования раствора PLA-PEG. Полимер Eudragit (75 мг) растворяли либо в растворе лекарственного средства, либо в растворе PLA-PEG. Раствор лекарственного средства и раствор полимера смешивали непосредственно перед приготовлением наночастиц.
[00162] Терапевтические наночастицы получали следующим образом. Для того чтобы приготовить раствор лекарственного средства/полимера, 125 мг патупилона добавляли в стеклянный сосуд на 20 мл вместе с 900 мг бензилового спирта, содержащего 7,5% воды. Эту смесь вращали на вортексе до максимального растворения лекарственного средства, тем самым образуя раствор лекарственного средства. Во второй стеклянный сосуд на 20 мл добавляли 300 мг 16/5 PLA-PEG и 3,6 г этилацетата. Смесь вращали на вортексе до масимального растворения PLA-PEG, тем самым образуя раствор полимера. Eudragit (75 мг) добавляли либо в раствор лекарственного средства, либо в раствор полимера и вращали на вортексе, пока не растворилась большая часть Eudragit. Раствор полимера затем вливали в раствор лекарственного средства и вращали на вортексе, пока раствор не стал прозрачным.
[00163] Готовили водный раствор, содержащий 0,1% Brij 100, растворенный в растворе 4% бензилового спирта в воде (масс/масс). Конкретно, 5%-ный раствор Brij 100, содержащий 4% бензилового спирта, готовили путем смешивания 227,5 г воды, 10 г бензилового спирта и 12,5 г Brij 100 в стеклянном сосуде на 500 мл с использованием магнитной мешалки до тех пор, пока все компоненты не растворились, тем самым образуя концентрированный водный раствор. Этот концентрированный водный раствор затем охлаждали до температуры ниже 5°С. Разбавитель, состоящий из 4% бензилового спирта в воде, получали путем смешивания 80 г бензилового спирта и 1920 г воды в стеклянном сосуде на 500 мл с использованием магнитной мешалки до растворения. Разбавитель затем охлаждали до температуры ниже 5°С. Водный раствор затем получали путем добавления 10 г концентрированного водного раствора к 490 г разбавителя и смешивания с использованием магнитной мешалки.
[00164] Эмульсию образовывали путем объединения органической фазы и водного раствора с соотношении 5:1 (водная фаза : масляная фаза). Органическую фазу вливали в водный раствор и гомогенизировали, используя ручной гомогенизатор, в течение 15 секунд при комнатной температуре до образования крупнодисперсной эмульсии. Крупнодисперсную эмульсию затем пропускали через гомогенизатор высокого давления (110S), установив давление 45 фунт/кв. дюйм (310,5 кПа), осуществляя одно пропускание, с образованием наноэмульсии.
[00165] Наноэмульсию гасили холодной DI (деионизированной) водой при <5°С, одновременно перемешивая с использованием магнитной мешалки. Соотношение гасителя и эмульсии составляло 10:1. 35% (масс./масс.) Tween 80 в воде затем добавляли в погашенную эмульсию в соотношении 150:1 (Tween 80 : лекарственное средство).
[00166] Наночастицы концентрировали посредством фильтрации в тангенциальном потоке (TFF), после чего подвергали диафильтрации для удаления растворителей, некапсулированного лекарственного средства и солюбилизатора. Погашенную эмульсию первоначально концентрировали посредством TFF с использованием 300 КДа Pall кассеты (3 мембрана) до объема приблизительно 200 мл. После этого осуществляли диафильтрацию с использованием приблизительно 20 диаобъемов (4 л) холодной DI воды. Объем минимизировали добавлением 100 мл холодной воды в сосуд и прокачивая через мембрану для промывки. Приблизительно 60 мл вещества собирали в стеклянный сосуд.
[00167] Для того чтобы определить концентрацию твердых частиц в нефильтрованной конечной суспензии, конечную суспензию в объеме 10 мл добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили под вакуумом в лиофильной сушилке. Затем определяли вес наночастиц в объеме высушенной суспензии. Концентрированную сахарозу (0,666 г/г) добавляли в образец конечной суспензии до достижения конечной концентрации сахарозы 10%.
[00168] Для того чтобы определить концентрацию твердых частиц в пропущенной через фильтр 0,45 мкм конечной суспензии, порцию образца конечной суспензии фильтруют, после чего добавляют сахарозу, используя шприц-фильтр 0,45 мкм. Объем фильтрованного образца затем добавляют в тарированный сцинтилляционный флакон вместимостью 20 мл и сушат под вакуумом в лиофильной сушилке. Оставшийся образец нефильтрованной конечной суспензии замораживают с сахарозой.
[00169] Три композиции патупилона с Eudragit, партии 281-8-1, 281-80-1R и 281-8-2, были приготовлены в разных условиях эмульгирования, которые перечислены в Таблице 1 ниже. Партия 186-101-8 была приготовлена без полимера Eudragit в сравнимых условиях.
[00170] Данные в Таблице 1 показывают лекарственную нагрузку и размер частиц для всех композиций. По сравнению с наночастицами (NP), полученными без использования Eudragit, лекарственная нагрузка NP с Eudragit показала увеличение более чем в три раза, вплоть до 15,18%.
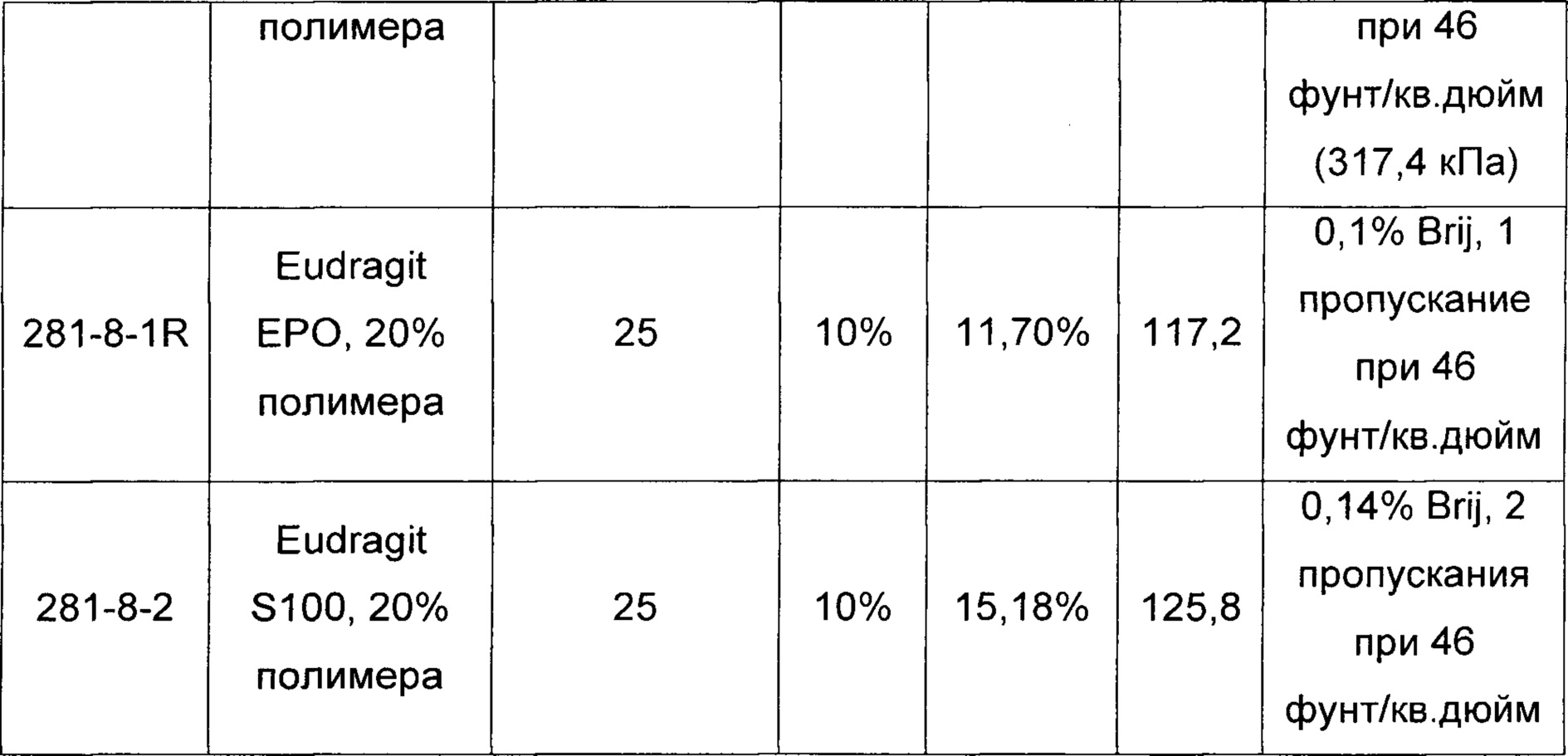
[00171] На Фиг. 3 представлены данные по высвобождению in vitro для композиций из Таблицы 1. Почти 100% патупилона высвобождалось из NP через один час независимо от того, содержала ли композиция Eudragit или нет. Кроме того, эксципиент Eudragit в NP не изменял профили высвобождения in vitro.
ПРИМЕР 2: Композиции наночастиц с доцетакселом, содержащие эксципиент Eudragit
[00172] Наночастицы, содержащие доцетаксел, получали аналогично описанному в Примере 1. В Таблице 2 указаны свойства NP и скорости высвобождения доцетаксела из наночастиц.
Таблица 2. Влияние Eudragit, гидрофобного CD (циклодекстрин) и комбинации Eudragit/CD на высвобождение доцетаксела (DTXL) из 16/5 PLA-PEG NP in vitro
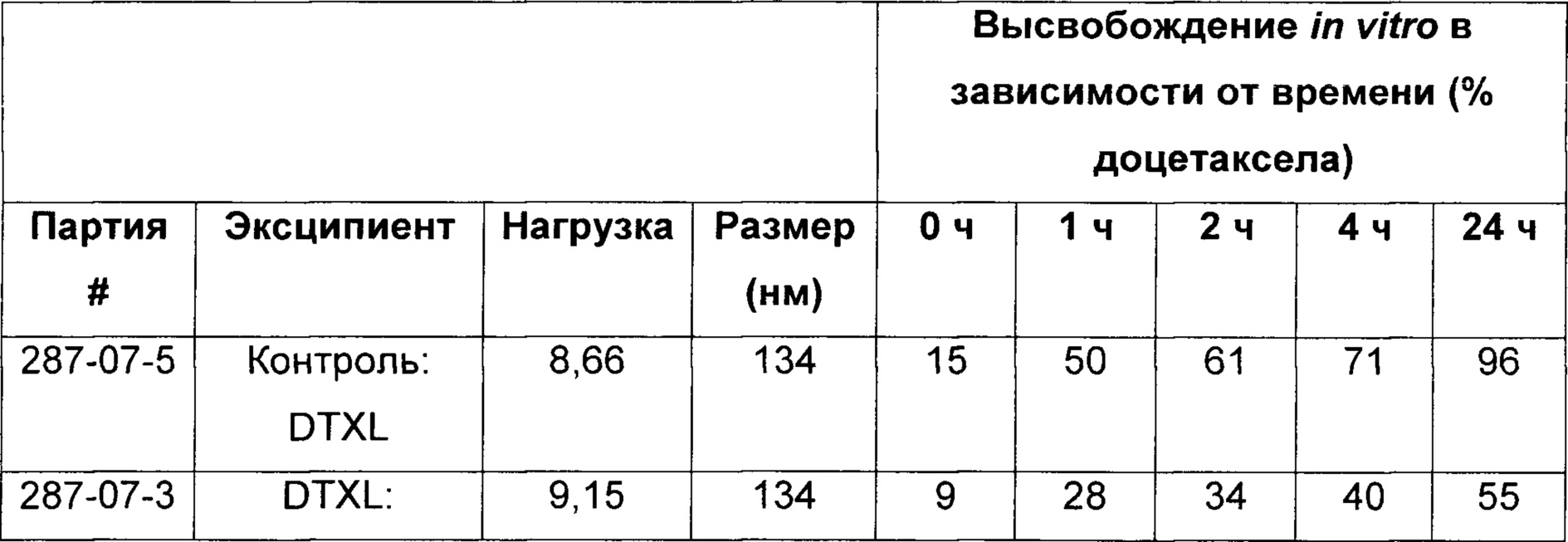
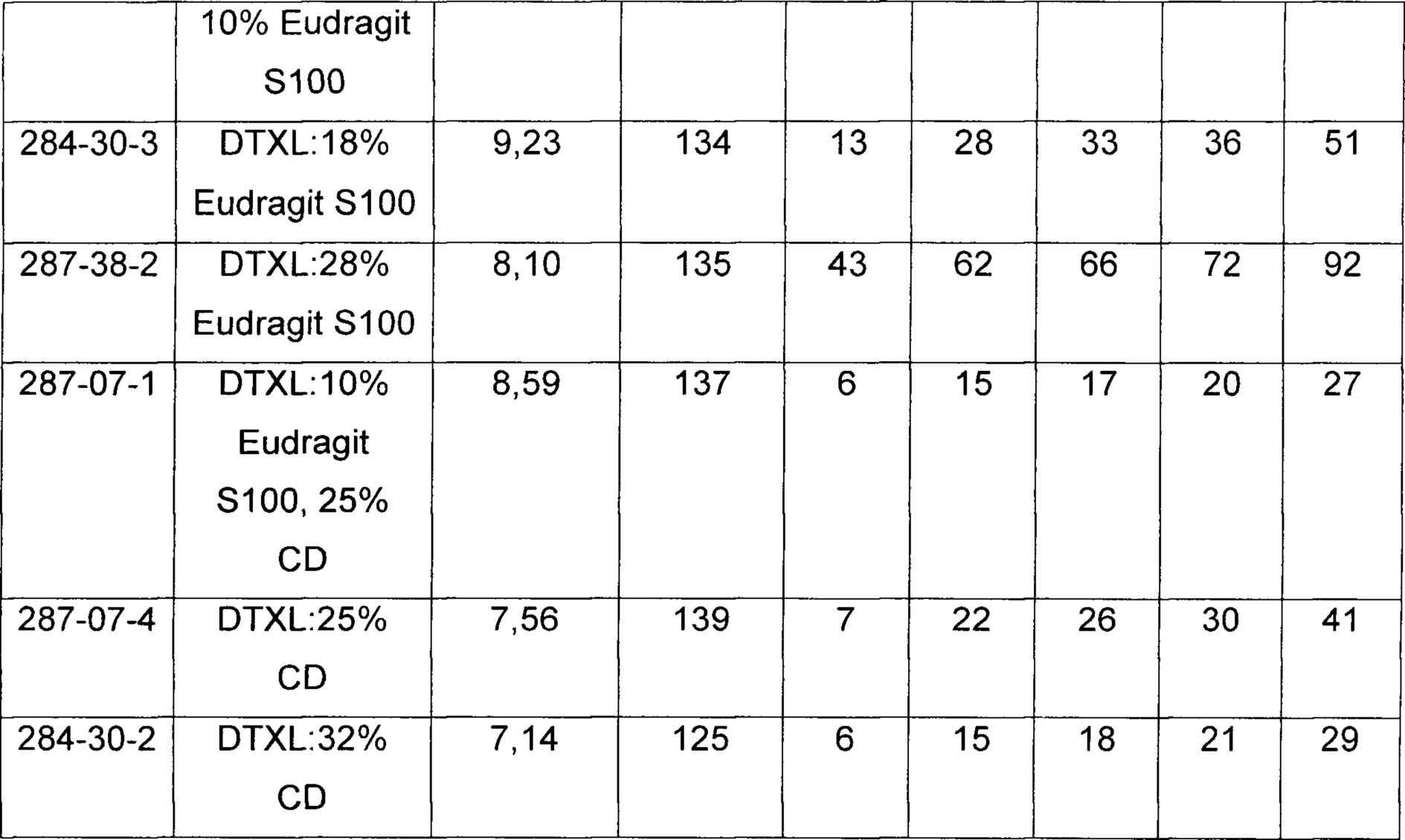
[00173] На Фиг. 4 представлены данные по высвобождению in vitro для композиций из Таблицы 2. Добавление Eudragit, CD или комбинации Eudragit и CD показало понижение высвобождения доцетаксела по сравнению с только полимером. Одним исключением было добавление 28% Eudragit, которое показало высвобождение, аналогичное высвобождению с использованием только полимера. Композиции, содержащие 10% или 18% Eudragit, имели сходные профили высвобождения. Увеличение количества CD с 25% до 32% показало высвобождение. Комбинация 10% Eudragit/25% CD показала профиль высвобождения, аналогичный профилю с использованием только 32% CD. Добавление Eudragit, CD или их комбинации влияет на высвобождение доцетаксела in vitro. Во всех случаях показано понижение высвобождения, за исключением добавления 28% Eudragit, как отмечено выше.
ПРИМЕР 3: Композиции наночастиц с целекоксибом, содержащие эксципиент Eudragit
[00174] Наночастицы, содержащие целекоксиб, были получены аналогично описанному в Примере 1. В Таблице 3 указаны свойства NP и скорости высвобождения для наночастиц с целекоксибом.
Таблица 3. Влияние Eudragit, гидрофобного CD и комбинации Eudragit/CD на высвобождение целекоксиба из 50/5 PLA-PEG NP in vitro
[00175] На Фиг. 5 представлены данные по высвобождению in vitro для композиций из Таблицы 3. Композиции высвобождали приблизительно 75-96% целекоксиба через 1 час, за исключением композиции 287-20-1 (частица 186 нм), которая высвобождала приблизительно 60% целекоксиба через 1 час.
ПРИМЕР 4: Композиции наночастиц с доцетакселом, содержащие эксципиент PEO-PLA
[00176] Терапевтические наночастицы были получены с использованием следующей композиции:
20% (масс./масс.) теоретического лекарственного средства;
80% (масс./масс.) полимера (16/5 PLA-PEG);
общее содержание твердых частиц, % = 20%;
растворители: 21% бензилового спирта, 79% этилацетата (масс./масс.);
поверхностно-активное вещество в водной фазе: РЕО(5 кДа)-блок-PLA(0,5 кДа), РЕО(5 кДа)-блок-PLA(0,6 кДа) или холат натрия.
[00177] Для партии размером 0,5 грамма (партии 150-155-1 и 150-155-2) использовали 100 мг лекарственного средства и 400 мг 16/5 PLA-PEG. Для партии размером 1 грамм (партии 150-173-2 и 150-173-3) использовали 200 мг лекарственного средства и 800 мг 16/5 PLA-PEG.
[00178] Терапевтические наночастицы получали следующим образом. Для приготовления раствора лекарственное средство/полимер 100 мг доцетаксела и 400 мг полимера добавляли в стеклянный флакон на 7 мл вместе с 2000 мг смеси бензиловый спирт/этилацетат (21% масс./79% масс. соответственно). Смесь вращали на вортексе до растворения лекарственного средства и полимера.
[00179] Готовили водный раствор, содержащий 0,1% PEO-PLA, растворенного в растворе из 2% масс. бензилового спирта и 4% масс. этилацетата в воде. Конкретно, в сосуд на 250 мл добавляли 0,1 г PEO-PLA и 93,9 г DI воды, и эту смесь перемешивали с использованием магнитной мешалки до растворения. В этот раствор добавляли 2 г бензилового спирта и 4 г этилацетата, и смесь перемешивали с использованием магнитной мешалки до растворения.
[00180] Эмульсия образовывалась при объединении органической фазы и водного раствора в соотношении 5:1 (водная фаза : масляная фаза). Органическую фазу вливали в водный раствор и гомогенизировали, используя ручной гомогенизатор, в течение 10 секунд при комнатной температуре до образования крупнодисперсной эмульсии. Крупнодисперсную эмульсию затем пропускали через гомогенизатор высокого давления (110S), установив давление 45 фунт/кв. дюйм, осуществляя одно пропускание, до образования наноэмульсии.
[00181] Наноэмульсию гасили холодной DI водой при <5°С, одновременно перемешивая с использованием магнитной мешалки. Соотношение гасителя и эмульсии составляло 5:1.
[00182] Наночастицы концентрировали посредством фильтрации в тангенциальном потоке (TFF), после чего подвергали диафильтрации для удаления растворителей, некапсулированного лекарственного средства и солюбилизатора. Погашенную эмульсию первоначально концентрировали через TFF с использованием 300 КДа Pall кассеты (2 мембрана) до объема приблизительно 200 мл. После этого осуществляли диафильтрацию с использованием приблизительно 20 диаобъемов (4 л) холодной DI воды. Объем минимизировали добавлением 100 мл холодной воды в сосуд и прокачивая через мембрану для промывки. Приблизительно 50-100 мл вещества собирали в стеклянный сосуд.
[00183] Для того чтобы определить концентрацию твердых частиц в нефильтрованной конечной суспензии, конечную суспензию в объеме 10 мл добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили под вакуумом при 80°С в вакуумном шкафу. Затем определяли вес наночастиц в объеме высушенной суспензии. Концентрированную сахарозу (0,111 г/г) добавляли в образец конечной суспензии до достижения конечной концентрации сахарозы 10%.
[00184] Для того чтобы определить концентрацию твердых частиц в пропущенной через фильтр 0,45 мкм конечной суспензии, порцию образца конечной суспензии фильтруют, после чего добавляют сахарозу, используя шприц-фильтр 0,45 мкм. Объем фильтрованного образца затем добавляют в тарированный сцинтилляционный флакон вместимостью 20 мл и сушат при 80°С в вакуумном шкафу. Оставшийся образец нефильтрованной конечной суспензии замораживают с сахарозой.
[00185] В Таблице 4 указаны условия, использованные для получения наночастиц. В Таблице 5 указаны некоторые свойства наночастиц. В Таблице 6 представлены результаты высвобождения доцетаксела из наночастиц in vitro. На Фиг. 6 также представлены свойства высвобождения in vitro для наночастиц, полученных с использованием PEO-PLA по сравнению с SC.
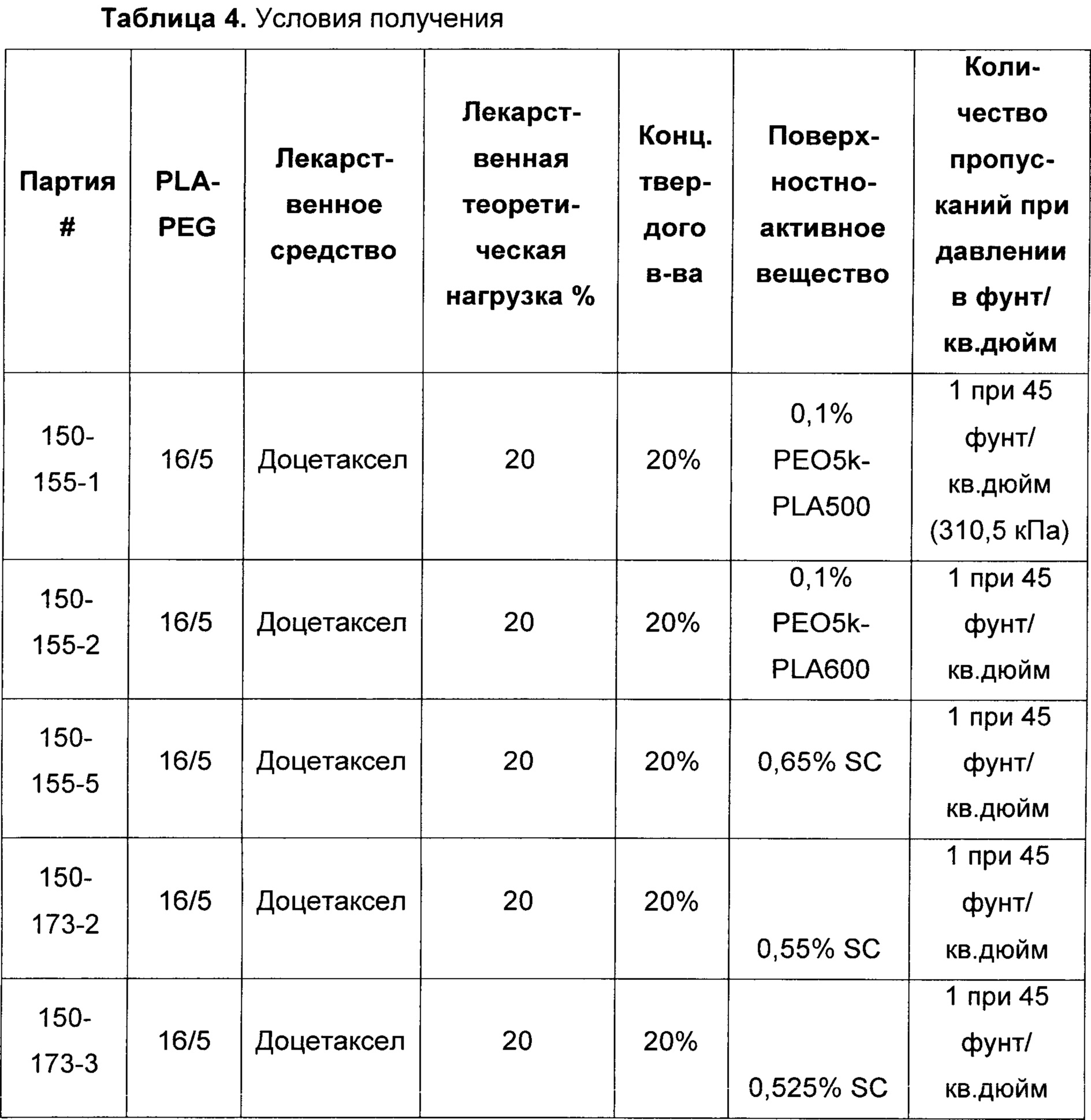
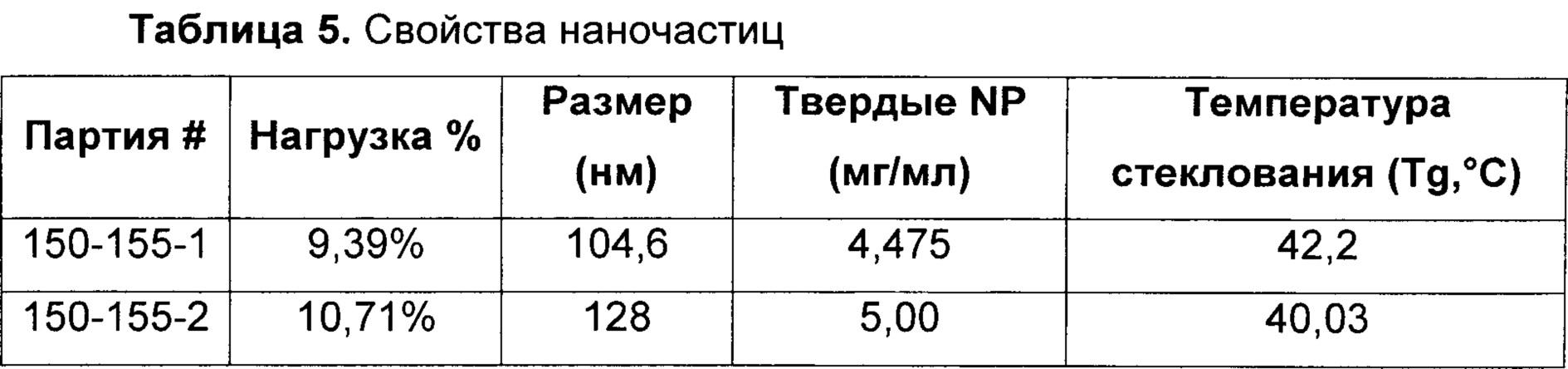

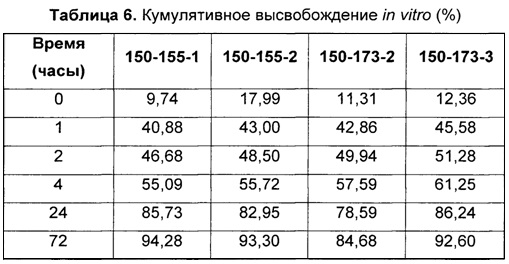
[00186] PEO-PLA блоксополимеры, использованные в качестве поверхностно-активных веществ в этом исследовании, состояли из длинной цепи PEG и короткой цепи PLA. Из-за высокого значения гидрофильно-липофильного баланса (HLB), ~18, этот тип полимера растворятся в воде и может быть использован для стабилизации эмульсии масло-в-воде (O/W). Для способа наноэмульгирования с использованием полимера PLA-PEG для получения наночастиц этот тип поверхностно-активного вещества может быть предпочтительным, например в виду фармацевтической приемлемости остаточного поверхностно-активного вещества, поскольку PEO-PLA имеет по существу такие же компоненты, как и PLA-PEG.
[00187] Были приготовлены четыре композиции с использованием PEO5k-PLA0.5k или PEO5k-PLA0.6k в качестве поверхностно-активного вещества (150-155-1, 150-155-2, 150-155-3 и 150-155-4). Две композиции были также приготовлены в качестве контролей с использованием холата натрия в качестве поверхностно-активного вещества (150-155-5 и 150-155-6). Из всех композиций были образованы стабильные эмульсии.
[00188] В случае 16/5 PLA-PEG от 9,39% до 10,71% доцетаксела было нагружено в наночастицах с использованием 0,1% раствора РЕO5k-PLA0.5k (150-155-1) или PEO5k-PLA0.6k (150-155-2) в качестве водной фазы, с размерами частиц 104,6 нм и 128 нм соответственно.
[00189] В случае 47/5 PLA-PEG (т.е 47 кДа PLA-5 кДа PEG) от 14,46% до 16,29% доцетаксела было нагружено в наночастицах с использованием 1,37% раствора PEO5k-PLA0.5k (150-155-3) или 1,17% раствора PEO5k-PLA0.6k (150-155-4) в качестве водной фазы, с размерами частиц 208,2 нм и 251,1 нм соответственно. Эти частицы могут быть оптимизированы путем использования более высокой концентрации водного раствора PEO-PLA.
[00190] Сравнение с соответствующим контролем, 150-155-1 и 150-155-2 против 150-155-5, 150-155-3 и 150-155-4 против 150-155-6, NP, полученные с использованием PEO-PLA в качестве поверхностно-активного вещества, имели значительно более высокие лекарственные нагрузки, чем наночастицы, полученные с использование холата натрия в качестве поверхностно-активного вещества.
[00191] Концентрации собранных твердых наночастиц были сравнимы с контролями, несмотря на то, что партии PEO-PLA были приготовлены в масштабе 0,5 граммов, а партии холата натрия (SC) были приготовлены в масштабе 1 грамм. Наименьшая концентрация твердых частиц для 150-155-3, 1,75 мг/мл, была следствием большого объема сбора, который разбавлял конечную концентрацию NP.
[00192] Температуры стеклования всех партий PEO-PLA были выше или близки температурам стеклования NP, полученным с использованием холата натрия в качестве поверхностно-активного вещества, и были значительно выше 37°С.
[00193] Профили высвобождения in vitro всех перечисленных партий, использующих поверхностно-активные вещества SC или РЕGилированный PLA, были аналогичными, с кумулятивным высвобождением примерно 10-20% через Т=0, примерно 40-45% через Т=1 час, примерно 45-50% через Т=2 часа и примерно 55-60% через Т=4 часа.
[00194] В общем, никакой значительной разницы не наблюдалось для частиц, полученных с использованием PEO-PLA или холата натрия в качестве поверхностно-активного вещества, в отношении лекарственной нагрузки, выхода, размера частиц и высвобождения in vitro. PEO-PLA в качестве поверхностно-активного вещества дает эквивалентные или улучшенные наночастицы по сравнению с холатом натрия.
[00195] Кроме того, меньшие концентрации PEO-PLA (0,1% и <2%) были использованы по сравнению с SC (0,65% и 5%). Включение PEO-PLA в композицию наночастицы может быть предпочтительным при получении наночастиц из высокомолекулярных полимеров PLA-PEG, которые, в некоторых случаях, извлекают пользу от поверхностно-активных веществ с более высокой способностью к эмульгированию для получения наночастиц, имеющих меньшие диаметры.
[00196] Дополнительными преимуществами использования PEO-PLA по сравнению с холатом натрия являются (1) такой же тип полимера, как и PLA-PEG, который является общепринятым в качестве инъекционного фармацевтического компонента, (2) неионная нейтральная молекула, которая инертна по отношению к большинству соединений, (3) концентрация ниже, чем концентрация холата натрия, при изготовлении наночастиц в одинаковых условиях, что потенциально расширяет возможности технологии приготовления лекарственных средств.
ПРИМЕР 5: Композиции наночастиц с доцетакселом, содержащие эксципиент Brij 100
[00197] Терапевтические наночастицы получали с использованием следующей композиции:
20% (масс./масс.) теоретического лекарственного средства;
80% (масс./масс.) полимера (16/5 PLA-PEG или 47/5 PLA-PEG);
% суммарных твердых веществ = 20%;
растворители: 21% бензилового спирта, 79% этилацетата (масс./масс.);
поверхностно-активное вещество в водной фазе: Brij 100 или холат натрия.
[00198] Для партии размером 1 грамм использовали 200 мг лекарственного средства и 800 мг 16/5 PLA-PEG или 47/5 PLA-PEG.
[00199] Терапевтические наночастицы получали следующим образом. Для того чтобы приготовить раствор лекарственное средство/полимер, 200 мг доцетаксела и 800 мг полимера добавляли в стеклянный флакон вместимостью 20 мл вместе с 4000 мг смеси бензиловый спирт/этилацетат (21% масс./79% масс. соответственно). Смесь вращали на вортексе до растворения лекарственного средства и полимера.
[00200] Готовили водный раствор, содержащий 0,1% Brij 100, растворенного в растворе из 2% масс. бензилового спирта и 4% масс. этилацетата в воде. Конкретно, в сосуд вместимостью 1 л добавляли 1 г Brij 100 и 939 г DI воды, и эту смесь перемешивали с использованием магнитной мешалки до растворения. В этот раствор добавляли 20 г бензилового спирта и 40 г этилацетата, и смесь перемешивали с использованием магнитной мешалки до растворения.
[00201] Эмульсию образовывали путем объединения органической фазы и водного раствора в соотношении 5:1 (водная фаза : масляная фаза). Органическую фазу вливали в водный раствор и гомогенизировали, используя ручной гомогенизатор, в течение 10 секунд при комнатной температуре до образования крупнодисперсной эмульсии. Эту крупнодисперсную эмульсию затем пропускали через гомогенизатор высокого давления (110S), установив давление 45 фунт/кв. дюйм, осуществляя одно пропускание, до образования наноэмульсии.
[00202] Наноэмульсию гасили холодной DI водой при <5°С, одновременно перемешивая с использованием магнитной мешалки. Соотношение гасителя и эмульсии составляло 5:1.
[00203] Наночастицы концентрировали посредством фильтрации в тангенциальном потоке (TFF), после чего подвергали диафильтрации для удаления растворителей, неинкапсулированного лекарственного средства и солюбилизатора. Погашенную эмульсию первоначально концентрировали посредством TFF с использованием 300 КДа Pall кассеты (2 мембрана) до объема приблизительно 200 мл. После этого осуществляли диафильтрацию с использованием приблизительно 20 диаобъемов (4 л) холодной DI воды. Объем минимизировали путем добавления 100 мл холодной воды в сосуд и прокачивания через мембрану для промывки. Приблизительно 50-100 мл вещества было собрано в стеклянный флакон.
[00204] Для определения концентрации твердых частиц в нефильтрованной суспензии конечную суспензию в объеме 10 мл добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили под вакуумом при 80°С в вакуумном шкафу. После этого определяли вес наночастиц в объеме высушенной суспензии. Концентрированную сахарозу (0,111 г/г) добавляли в образец конечной суспензии до достижения конечной концентрации 10% сахарозы.
[00205] Для определения концентрации твердых частиц подвергнутой фильтрованию через фильтр 0,45 мкм конечной суспензии порцию образца конечной суспензии фильтровали, затем добавляли сахарозу, используя шприц-фильтр 0,45 мкм. Объем фильтрованного образца затем добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили при 80°С в вакуумном шкафу. Оставшийся образец нефильтрованной конечной суспензии замораживали с сахарозой.
[00206] В таблице 7 указаны условия, использованные для получения наночастиц. В Таблице 8 указаны некоторые свойства наночастиц. В Таблице 9 приведены результаты высвобождения доцетаксела из наночастиц in vitro. На Фиг. 7 также показаны свойства высвобождения in vitro наночастиц, полученных с использованием Brij 100, по сравнению с SC.
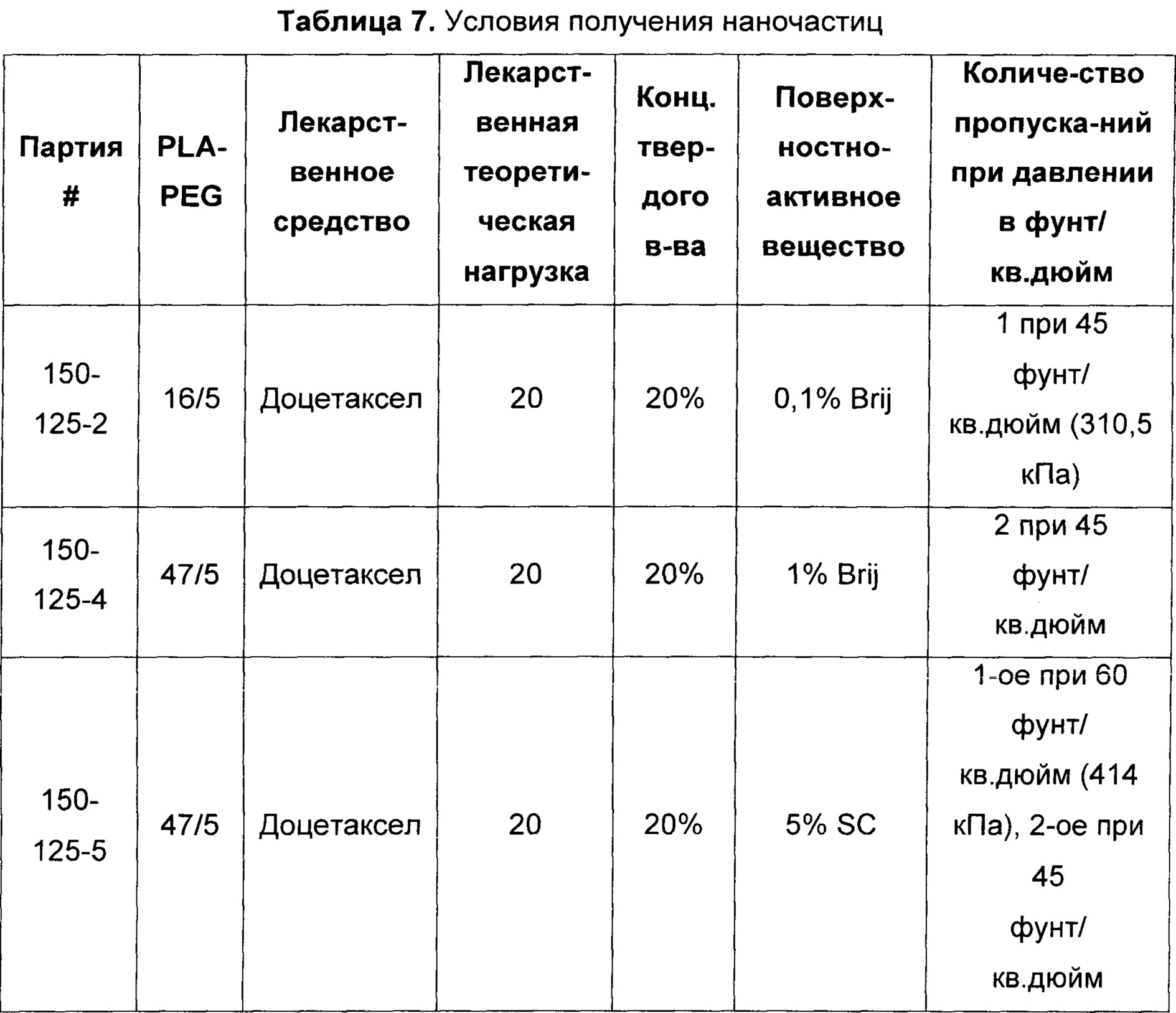
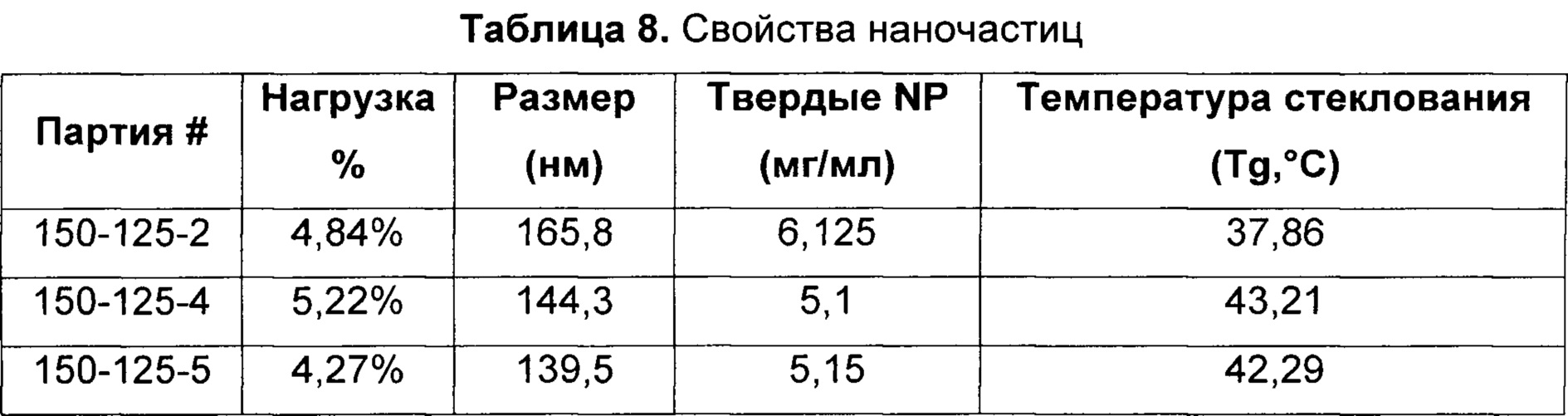
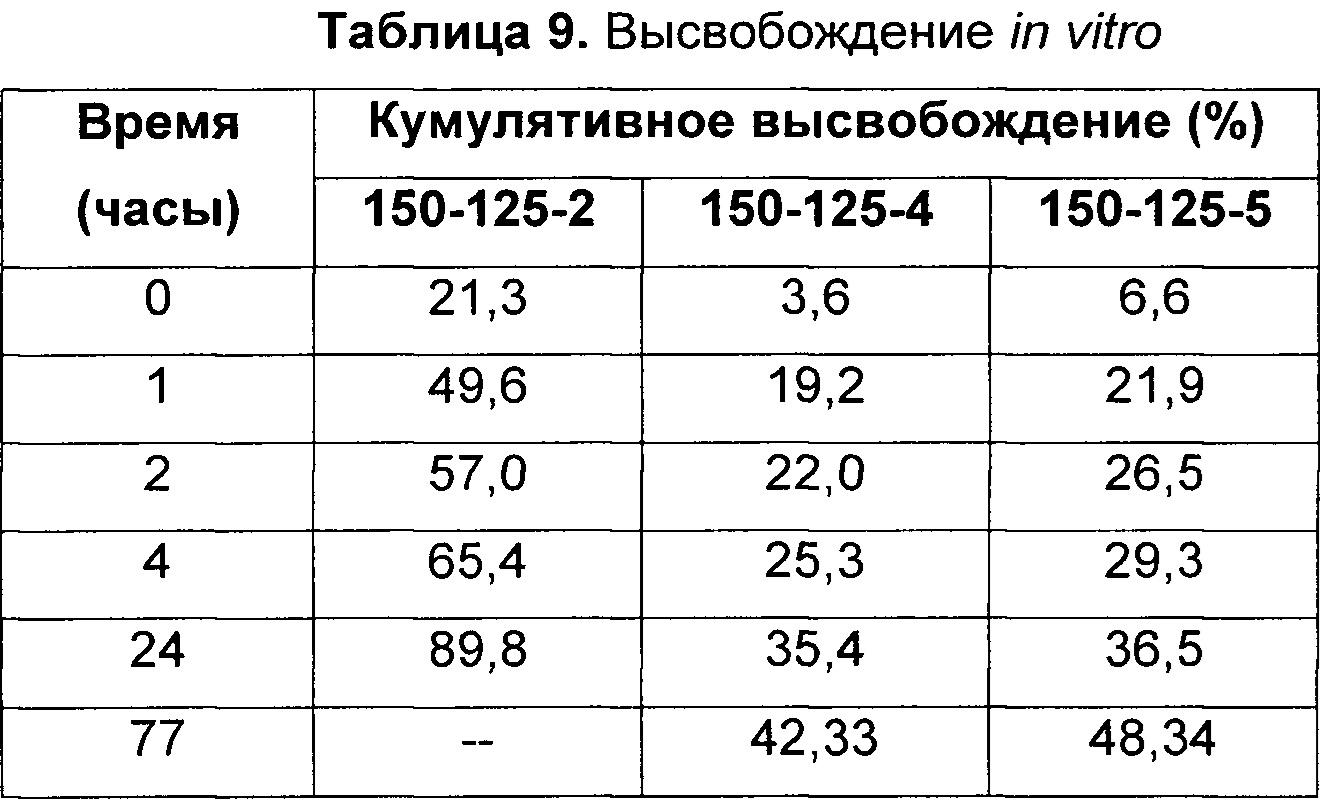
[00207] Brij 100 представляет собой неионное поверхностно-активное вещество, стеариловый эфир полиоксиэтилена (100) со средней Мn ~4,670. Его значение HLB составляет 18,8. Оно состоит из двух нейтральных блоков, липофильной короткой цепи и гидрофильной цепи PEG. Brij 100 используют в фармацевтике в качестве эмульгатора, смачивающего агента или солюбилизатора масла. Оно представляет собой водорастворимое бледно-желтое вещество и считается нетоксичным, нераздражающим, неканцерогенным соединением с LD50 (пероральная доза, крыса) >16 г/кг.
[00208] Две композиции были приготовлены с использованием Brij 100 в качестве поверхностно-активного вещества (150-125-2 и 150-125-4), и одна композиция была приготовлена в качестве контроля с использованием холата натрия в качестве поверхностно-активного вещества (150-125-5).
[00209] Для 16/5 PLA-PEG 4,84% доцетаксела нагружали в наночастицы с использованием 0,1% раствора Brij в качестве водной фазы, с размером частиц 165,8 нм (150-125-2). Для 47/5 PLA-PEG 5,22% доцетаксела нагружали в наночастицы с использованием 0,1% Brij (150-125-4). Эти результаты являются сравнимыми или слегка выше, чем в случае контрольной партии с использованием холата натрия в качестве поверхностно-активного вещества (150-125-5). Размеры частиц двух партий были сходными, 144,3 нм для партии с Brij 100 против 139,5 нм для партии с холатом натрия. Концентрации собранных твердых наночастиц также были сходными: 5,1 мг/мл против 5,15 мг/мл. Температуры стеклования двух партий наночастиц обе были выше физиологической температуры 37°С, с разницей менее 1°С (43,21°С против 42,29°С).
[00210] Высвобождение доцетаксела из наночастиц, полученных из 16/5 PLA-PEG, демонстрирует более быстрое высвобождение, чем из наночастиц из 47/5 PLA-PEG, и оно контролируется в основном молекулярной массой полимера. Наночастицы, полученные из 47/5 PLA-PEG и либо Brij 100, либо холата натрия в качестве поверхностно-активного вещества, демонстрируют сходные профили высвобождения, с незначительным колебанием с разницей <±2%.
В общем, никакой значительной разницы не наблюдалось для наночастиц, полученных с использованием Brij 100 или холата натрия в качестве поверхностно-активного вещества, в отношении лекарственной нагрузки, выхода, размера частиц и профиля высвобождения in vitro. PEO-PLA в качестве поверхностно-активного вещества дает эквивалентные или улучшенные наночастицы по сравнению с холатом натрия. Использование Brij 100 в качестве поверхностно-активного вещества давало сходные наночастицы по сравнению с использованием холата натрия в качестве поверхностно-активного вещества. Кроме того, намного меньшая концентрация Brij 100 (1%) была использована по сравнению с холатом натрия (5%), что свидетельствует о том, что концентрация Brij может быть увеличена, если это необходимо. Следовательно, Brij 100 может быть предпочтительным для использования вместо холата натрия при получении наночастиц из высокомолекулярных полимеров PLA-PEG, которые извлекают пользу от поверхностно-активных веществ с более высокой способностью эмульгирования для получения наночастиц, имеющих меньшие диаметры.
[00211] Дополнительными преимуществами использования PEO-PLA по сравнению с холатом натрия являются: (1) неионная нейтральная молекула, которая является инертной к большинству соединений, (2) меньшая концентрация, чем концентрация холата натрия, при получении наночастиц в одинаковых условиях, которая потенциально расширяет возможности технологии получения, и (3) более экономичное ценообразование при $86,8/1 кг для Brij 100 против $91,3/100 г для холата натрия (Sigma).
ПРИМЕР 6: Композиции наночастиц с целекоксибом, полученные с использованием смешиваемого с водой органического растворителя
[00212] Терапевтические наночастицы были получены с использованием следующей композиции:
10% (масс./масс.) теоретического лекарственного средства;
90% (масс./масс.) полимера (45/5 PLA-PEG);
общее содержание твердых частиц, % = 10%;
растворители: 33-98% 21/79 ВА/ЕА (21/79 ВА/ЕА = 21% бензилового спирта, 79% этилацетата (масс./масс.)) + DMSO или DMF;
[00213] Для партии размером 1 грамм использовали 100 мг лекарственного средства и 900 мг 45/5 PLA-PEG.
[00214] Терапевтические наночастицы получали следующим образом: Для приготовления раствора лекарственного средства 100 мг целекоксиба и 990 мг диметилсульфоксида добавляли в стеклянный флакон вместимостью 20 мл и вращали на вортексе до растворения лекарственного средства. Для приготовления раствора полимера 900 мг PLA-PEG добавляли во второй стеклянный флакон вместимостью 20 мл вместе с 8010 мг смеси бензиловый спирт/этилацетат (21% масс./79% масс. соответственно), и смесь вращали на вортексе до растворения полимера. Раствор лекарственного средства и раствор полимера объединяли и вращали на вортексе до образования наночастиц.
[00215] Готовили водный раствор, содержащий 0,4% холата натрия, растворенного в растворе 2% масс. бензилового спирта и 4% масс. этилацетата в воде. Конкретно, в 1-литровый сосуд добавляли 4 г холата натрия и 956 г DI воды, и эту смесь перемешивали с использованием магнитной мешалки до растворения. В этот раствор добавляли 20 г бензилового спирта и 40 г этилацетата, и смесь перемешивали с использованием магнитной мешалки.
[00216] Эмульсию образовывали путем объединения органической фазы и водного раствора в соотношении 5:1 (водная фаза : масляная фаза). Органическую фазу вливали в водный раствор и гомогенизировали, используя ручной гомогенизатор, в течение 10 секунд при комнатной температуре до образования крупнодисперсной эмульсии. Эту крупнодисперсную эмульсию затем пропускали через гомогенизатор высокого давления (110S), установив давление 25 фунт/кв. дюйм, осуществляя одно пропускание, до образования наноэмульсии.
[00217] Наноэмульсию гасили холодной DI водой при <5°С, одновременно перемешивая с использованием магнитной мешалки. Соотношение гасителя и эмульсии составляло 5:1.
[00218] Наночастицы концентрировали посредством фильтрации в тангенциальном потоке (TFF), после чего подвергали диафильтрации для удаления растворителей, неинкапсулированного лекарственного средства и солюбилизатора. Погашенную эмульсию первоначально концентрировали посредством TFF с использованием 300 КДа Pall кассеты (2 мембрана) до объема приблизительно 200 мл. После этого осуществляли диафильтрацию с использованием приблизительно 20 диаобъемов (4 л) холодной DI воды. Объем минимизировали путем добавления 100 мл холодной воды в сосуд и прокачивания через мембрану для промывки. Приблизительно 50-100 мл вещества было собрано в стеклянный флакон.
[00219] Для определения концентрации твердых частиц в нефильтрованной суспензии конечную суспензию в объеме 10 мл добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили вод вакуумом при 80°С в вакуумном шкафу. После этого определяли вес наночастиц в объеме высушенной суспензии. Концентрированную сахарозу (0,111 г/г) добавляли в образец конечной суспензии до достижения конечной концентрации 10% сахарозы.
[00220] Для определения концентрации твердых частиц подвергнутой фильтрации через фильтр 0,45 мкм конечной суспензии порцию образца конечной суспензии фильтровали, затем добавляли сахарозу, используя шприц-фильтр 0,45 мкм. Объем фильтрованного образца затем добавляли в тарированный сцинтилляционный флакон вместимостью 20 мл и сушили при 80°С в вакуумном шкафу. Оставшийся образец нефильтрованной конечной суспензии замораживали с сахарозой.
[00221] В таблице 10 указаны условия, использованные для получения наночастиц. В Таблице 11 указаны некоторые свойства наночастиц. В Таблице 12 приведены результаты по высвобождения доцетаксела из наночастиц in vitro. На Фиг. 8 также показаны свойства высвобождения наночастиц, полученных с использованием DMSO, in vitro.
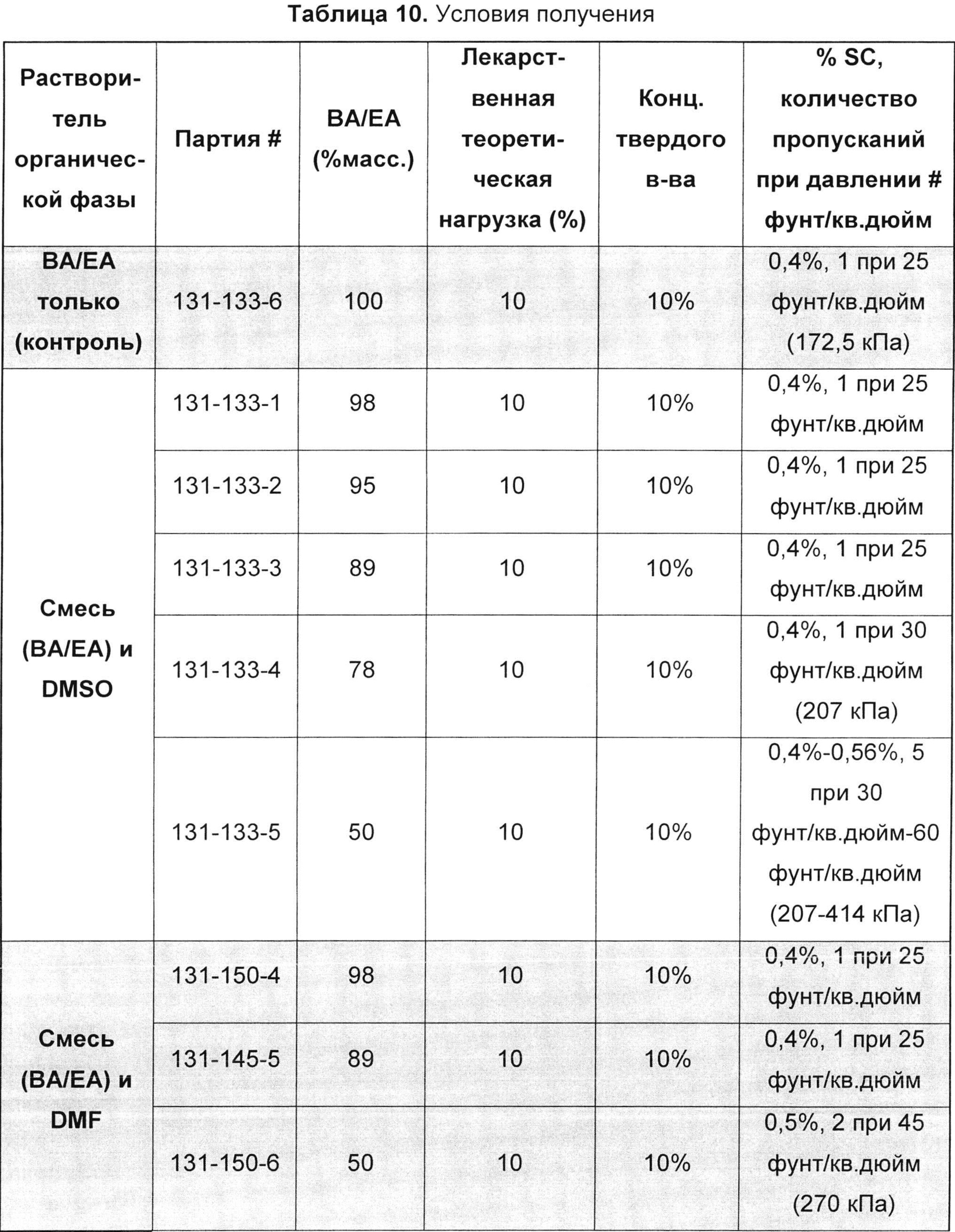
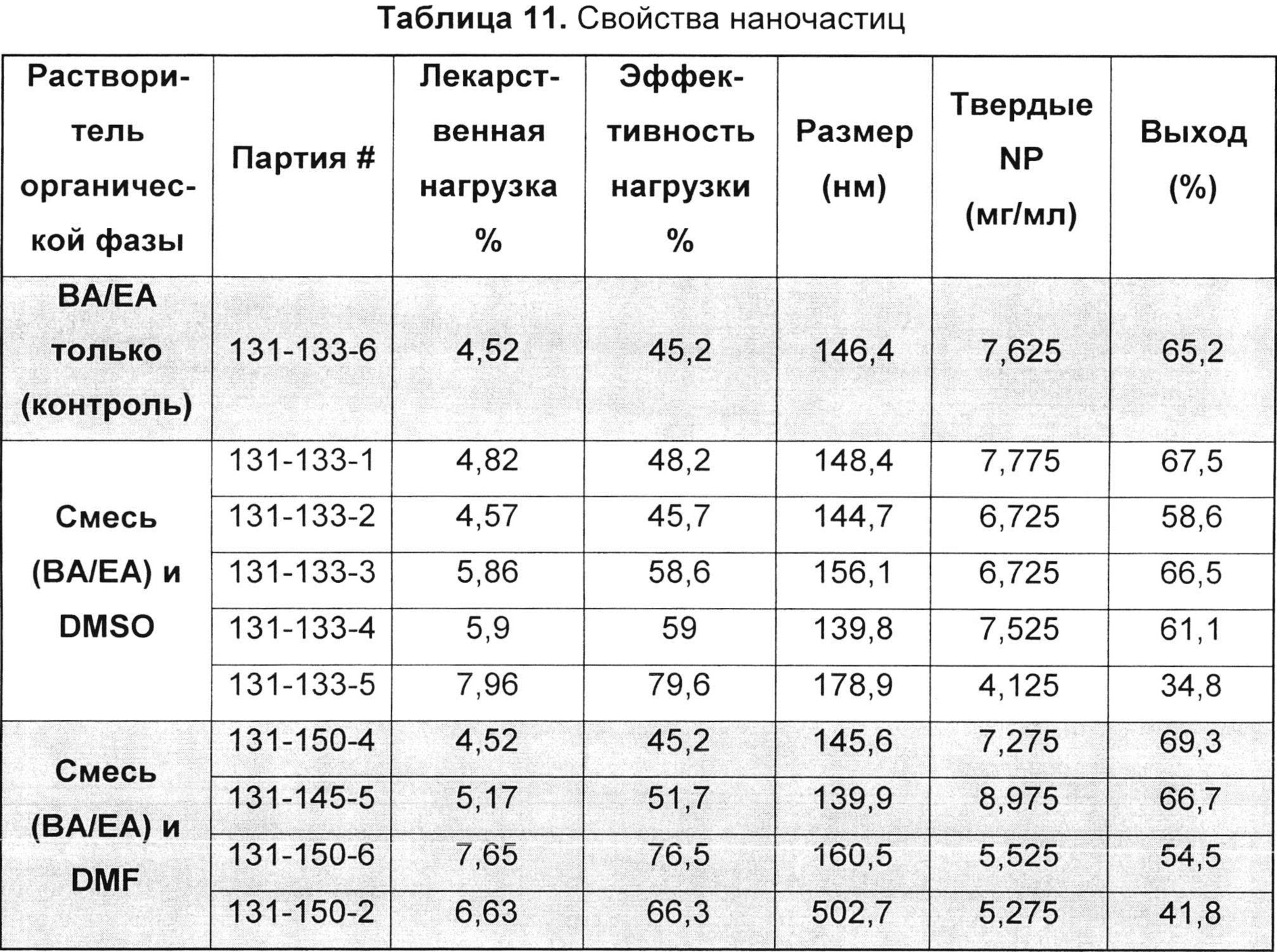
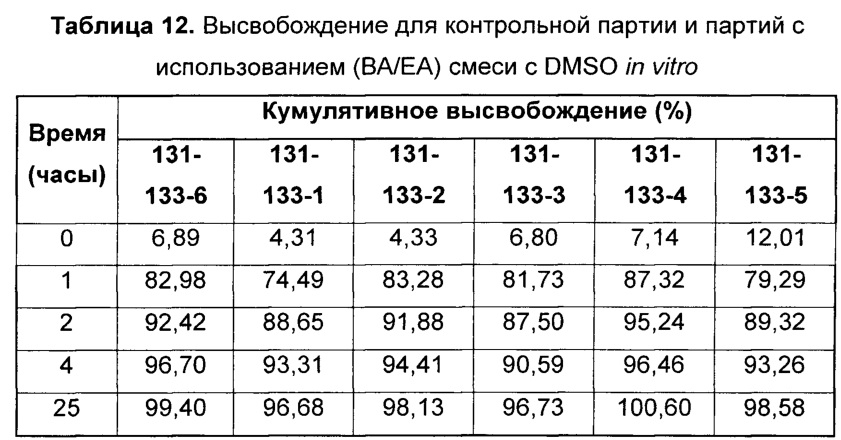
[00222] Концентрация твердых наночастиц (NP) в диапазоне примерно 5-8 мг/мл наблюдалась для всех композиций, и выходы NP все были выше 50%, за исключением двух партий с более низким содержанием (ВА/ЕА), партия 131-133-5 с 50% (ВА/ЕА) и партия 131-150-2 с 33% (ВА/ЕА).
[00223] Размеры частиц хорошо контролировались в диапазоне примерно 140-160 нм для всех партий с содержанием ВА/ЕА ≥50%. Когда содержание ВА/ЕА падало до 33% для партии 131-150-2, тогда наблюдали значительно более крупные частицы (502,7 нм), даже при использовании вплоть до 2% холата натрия и давления 60 фунт/кв. дюйм.
[00224] Лекарственные нагрузки всех композиций были равны или были выше, чем в случае контроля. Эти результаты демонстрируют потенциал использования этих смесей для увеличения лекарственной нагрузки.
Профили высвобождения in vitro из партий, полученных с использованием смеси (ВА/ЕА) с DMSO, перекрываются с высвобождением из контрольной партии, партия 131-133-6. Добавление несмешиваемых с водой растворителей в органическую фазу не влияет на высвобождение из наночастиц in vitro.
[00225] В общем, за счет добавления несмешиваемых с водой растворителей, DMSO или DMF, в органическую фазу в разумном количестве вплоть до 50% подходящие наночастицы могут быть получены с использованием метода наноэмульгирования BIND без изменения высвобождения из наночастиц in vitro. Значение этой модифицированной фазы растворителя заключается в потенциальном расширении диапазона лекарственных средств, которые могут быть инкапсулированы с использованием метода наноэмульгирования. Поскольку DMSO и DMF обычно являются хорошими растворителями для большинства соединений, лекарственные средства (нерастворимые в органических растворителях, используемых в методе наноэмульгирования, включая бензиловый спирт, этилацетат и метиленхлорид) легко могут растворяться в DMSO или DMF. При смешивании DMSO или DMF с нерастворителем лекарственного средства (например, ВА, ЕА или CH2Cl2) растворимость лекарственного средства обычно может быть улучшена, что дает преимущество инкапсулирования лекарственного средства с увеличением теоретической лекарственной нагрузки. Лекарственные средства, которые не могли быть инкапсулированы или демонстрировали низкую эффективность инкапсулирования ранее, потенциально могут быть инкапсулированы с использованием этих растворителей модифицированной органической фазы.
ЭКВИВАЛЕНТЫ
[00226] Специалисты в данной области знают или способны установить с использованием рутинного экспериментирования множество эквивалентов конкретных воплощений изобретения, описанных в данном документе. Такие эквиваленты охвачены прилагаемой формулой изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Полное содержание всех патентов, опубликованных патентных заявок, вебсайтов и других источников информации, процитированных в данном описании, в прямой форме во всей их полноте включены в данное описание посредством ссылки.