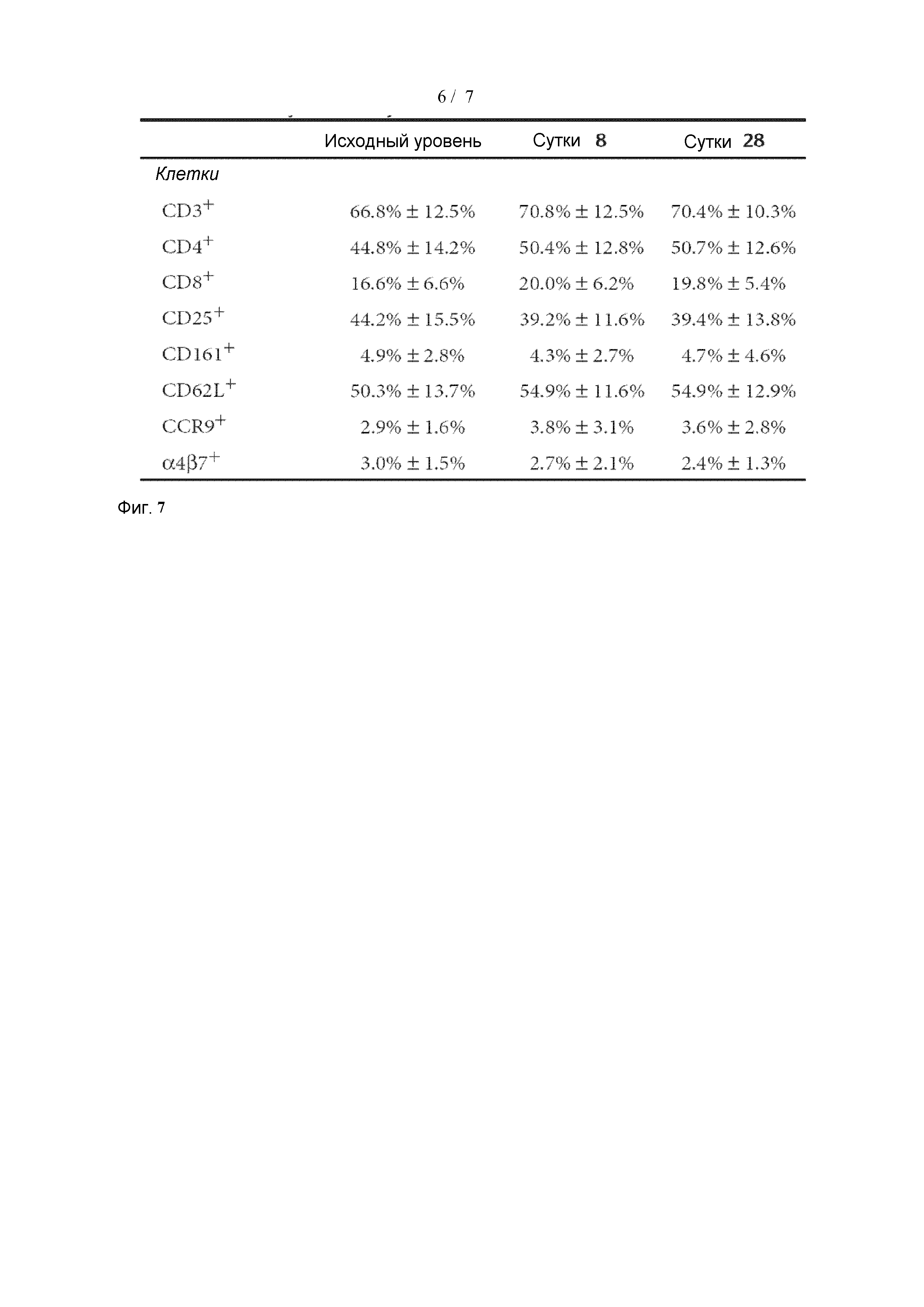Результат интеллектуальной деятельности: СПОСОБЫ КОНТРОЛЯ ВОСПРИИМЧИВОСТИ АНТИ-SMAD7 ТЕРАПИИ
Вид РИД
Изобретение
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет европейской заявки на патент ЕР 11425234,9, поданной 15 сентября 2011 года, и приоритет заявки на патент США 61/576556, поданной 16 декабря 2011 года, раскрытие которых, таким образом, во всей полноте включено посредством ссылки в настоящую заявку для всех целей.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Воспалительное заболевание кишечника (ВЗК) является хроническим воспалительным расстройством желудочно-кишечного тракта, которым страдает приблизительно один миллион пациентов в Соединенных Штатах Америки. Двумя наиболее распространенными формами ВЗК являются болезнь Крона (БК) и язвенный колит (ЯК). Хотя БК может затрагивать весь желудочно-кишечный тракт, она преимущественно поражает подвздошную кишку (дистальную и нижнюю часть тонкого кишечника) и толстую кишку. ЯК преимущественно поражает ободочную и прямую кишку. Лечение БК и ЯК, проводимое в настоящее время, включает аминосалицилаты (например, 5-аминосалициловую кислоту, сульфасалазин и месаламин), антибиотики (например, ципрофлоксацин и метронидазол), кортикостероиды (например, будезонид или преднизон), иммуносупрессоры (например, азатиоприн или метотрексат) и антагонисты фактора некроза опухоли (ФНО) (например, инфликсимаб (Ремикейд®)). Ответная реакция пациента на эти терапии варьируется в зависимости от тяжести заболевания, и она может варьироваться в зависимости от циклов активного воспалительного процесса и ремиссии. Кроме того, многие терапии ВЗК, проводимые в настоящее время, связаны с нежелательными явлениями.
[0003] Хотя этиология БК и ЯК неизвестна, оба заболевания считаются воспалительными заболеваниями слизистой кишечника. Недавние исследования показали, что TGF-β31 выступает в качестве потенциального иммунорегулятора, способного контролировать воспаление слизистой оболочки кишечника. TGF-β31 связывает гетеродимерный рецептор трансмембранной серин/треонин киназы, содержащий две субъединицы, TGF-β31 R1 и TGF-β31 R2. При связывании лиганда рецептор TGF-β31 R1 конститутивно фосфорилируется активным TGF-β31 R2 рецептором, и сигнал распространяется к ядру белками, принадлежащими к семейству SMAD. Активированный TGF-β31 R1 напрямую фосфолирует белки SMAD2 и SMAD3, которые затем взаимодействуют с SMAD4. Комплекс SMAD2/SMAD3/SMAD4 перемещается к ядру и модулирует транскрипцию определенных генов.
[0004] Дополнительные исследования показали, что другой SMAD белок, SMAD7, также играет роль в воспалении. SMAD7, внутриклеточный белок, продемонстрировал препятствие связыванию SMAD2/SMAD3 с TGF-β31 R1, предотвращая фосфорилирование и активацию этих белов. Кроме того, повышенная экспрессия белка SMAD7 связана с ингибированием TGF-β31-опосредованной передачи сигнала. Образцы слизистой оболочки, взятые от пациентов с ВЗК, характеризуются высокими уровнями SMAD7 и сниженными уровнями фосфорилированного SMAD3, указывая на то, что TGF-β31-опосредованная передача сигнала у этих пациентов нарушена.
[0005] Внимание недавних исследований сконцентрировано на SMAD7 как цели лечения пациентов с ВЗК. Такие терапии включают анти-SMAD7 антисмысловые терапии. Фактически, существует необходимость в способах, основанных на прогнозирующих биомаркерах, которые можно использовать для определения вероятности проявления (или отсутствия проявления) у пациентов восприимчивости к лечению анти-SMAD7 терапиями.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Изобретение частично основано на том открытии, что модуляция определенных T-клеточных популяций (например, увеличение CCR9+ FoxP3+ T-клеток, уменьшение CCR9+IFN-гамма положительных (IFN-γ+) T-клеток, уменьшение CCR9+IL17A+T-клеток, уменьшение FoxP3+T-клеток, уменьшение IFN-γ+T-клеток и/или уменьшение IL17A+T-клеток) в биологическом образце (например, крови или ткани), взятом от индивидуума (например, пациента, являющегося человеком), страдающего воспалительным заболеванием кишечника (ВЗК) (например, болезнью Крона или язвенным колитом), коррелируется с чувствительностью к лечению анти-SMAD7 терапией.
[0007] Следует понимать, что целесообразно иметь способность прогнозировать предварительно или вскоре после начала лечения вероятность восприимчивости пациента с ВЗК к лечению анти-SMAD7 терапией. Модуляция клеточных популяций, как описано в настоящем документе, прогнозирует эффективность лечения индивидуума с ВЗК анти-SMAD7 терапией. Предпочтительно, способы по изобретению в конечном итоге помогут врачам выбрать эффективные терапии и приведут к улучшению течения заболевания пациента, лучшему медицинскому обслуживанию и снижению общих расходов пациента.
[0008] Таким образом, в первом аспекте, изобретение относится к способу определения восприимчивости индивидуума с воспалительным заболеванием кишечника (ВЗК) к лечению, по меньшей мере, одной анти-SMAD7 терапией, данный способ содержит:
определение количества, по меньшей мере, одной клеточной популяции, выбранной из группы, состоящей из: CCR9+ FoxP3+ T-клеток, CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-гамма+ T-клеток и IL17A+T-клеток, в, по меньшей мере, одном образце, полученном от индивидуума,
где, увеличение количества клеточной популяции CCR9+ FoxP3+ T-клеток, и/или уменьшение количества, по меньшей мере, одной из клеточных популяций CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-гамма + T-клеток и IL17A+T-клеток, в, по меньшей мере, одном образце относительно известного контрольного уровня, по меньшей мере, одной клеточной популяции прогнозирует восприимчивость индивидуума с ВЗК к анти-SMAD7 терапии.
[0009] Следует принимать во внимание то, что «определение восприимчивости индивидуума» включает прогнозирование или контроль эффективности или восприимчивости индивидуума с ВЗК к лечению, по меньшей мере, одной анти-SMAD7 терапией.
[0010] Соответственно, образцом является биологический образец.
[0011] В предпочтительном варианте осуществления способа по изобретению определению восприимчивости индивидуума к терапии может способствовать распознавание модуляции двух или более из следующего:
увеличение количества CCR9+ FoxP3+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии;
уменьшение количества CCR9+ IFN-гамма+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии;
уменьшение количества CCR9+IL17A+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии;
уменьшение количества FoxP3+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии;
уменьшение количества IFN-гамма+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и
уменьшение количества IL17A+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии.
[0012] В первом предпочтительном варианте осуществления клеточной популяцией являются CCR9+ FoxP3+ T-клетки. Во втором предпочтительном варианте осуществления клеточной популяцией являются CCR9+ IFN-гамма+ T-клетки. В третьем предпочтительном варианте осуществления клеточной популяцией являются CCR9+IL17A+ T-клетки. В четвертом предпочтительном варианте осуществления предпочтительной клеточной популяцией являются FoxP3+ T-клетки. В пятом предпочтительном варианте осуществления клеточной популяцией являются IFN-гамма+ T-клетки. В шестом предпочтительном варианте осуществления клеточной популяцией являются IL17A+T-клетки. Другими предпочтительными клеточными популяциями являются любые из FoxP3+ CD103+ T-клеток, CD103+ T-клеток или интегрин a4β7+ T-клеток.
[0013] Соответственно, способы по изобретению можно проводить in vitro.
[0014] Предпочтительно, в способах по изобретению этапу определения количества может предшествовать этап получения образца от индивидуума, страдающего ВЗК. Образец может быть взят посредством забора крови или проведения биопсии ткани.
[0015] Соответственно, индивидуум может получать, по меньшей мере, одну анти-SMAD7 терапию при получении от индивидуума, по меньшей мере, одного образца.
[0016] Предпочтительно, в способе по изобретению определение увеличения количества CCR9+ FoxP3+ T-клеток, уменьшения количества CCR9+ IFN-гамма+ T-клеток, уменьшения количества CCR9+ IL17A+ T-клеток, уменьшения количества FoxP3+ T-клеток, уменьшения количества IFN-γ+ T-клеток или уменьшения количества IL17A+ T-клеток указывает на вероятность вхождения индивидуума в ремиссию.
[0017] Соответственно, количество, по меньшей мере, одной клеточной популяции можно определять посредством проточной цитометрии, посредством иммуногистохимии (например, ELISA) и/или посредством РНК/ДНК анализа с использованием реагентов/способа, известных специалистам в данной области.
[0018] Следует понимать, что проточную цитометрию и/или иммуногистохимию можно проводить с использованием антитела, выбранного из группы, состоящей из: антитела к CCR9, антитела к FoxP3, антитела к IFN-гамма и антитела к IL17A.
[0019] Альтернативно, определение количества клеток можно проводить посредством измерения количества РНК, кодирующей, по меньшей мере, один маркер, выбранный из группы, состоящей из: CCR9, FoxP3, IFN-гамма и IL17A.
[0020] Предпочтительно, контроль означает контрольный уровень, который является исходным уровнем количества, по меньшей мере, одной клеточной популяции, полученной от образца пациента (с ВЗК) до введения, по меньшей мере, одной анти-SMAD7 терапии, или полученной непосредственно после введения, по меньшей мере, одной анти-SMAD7 терапии. Под «непосредственно после введения» подразумевают первые те же сутки начала лечения.
[0021] В соответствующем аспекте в настоящем документе описывается способ контроля индивидуума, страдающего ВЗК и проходящего лечение анти-SMAD7 терапией, для определения восприимчивости индивидуума к терапии и/или для определения необходимости продолжения терапии. Способ включает: (a) определение количества, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток в образце, полученном от индивидуума с ВЗК, получающего анти-SMAD7 терапию; и (b) сравнение количества в образце с контрольным уровнем, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток, соответственно. Восприимчивость (например, чувствительность) к терапии и/или возможность продолжения восприимчивости к лечению анти-SMAD7 терапией индивидуума можно определить, если имеется увеличение количества CCR9+ FoxP3+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, или если имеется уменьшение количества, по меньшей мере, одну из CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и IL17A+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом. Альтернативно, может быть выявлена невосприимчивость (например, устойчивость) к лечению и/или невозможность продолжения восприимчивости к лечению анти-SMAD7 терапией индивидуума, если имеется уменьшение количества CCR9+ FoxP3+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, или если имеется увеличение количества, по меньшей мере, одной из CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0022] В другом аспекте в настоящем документе описывается способ определения индивидуумов с ВЗК, которые, возможно, проявят восприимчивость или проявляют восприимчивость к лечению анти-SMAD7 терапией (например, анти-SMAD7 антисмысловому олигонуклеотиду). Способ включает: (a) определение количества, по меньшей мере, одной из CR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток в образце, полученном от индивидуума с ВЗК; и (b) сравнение количества в образце по сравнению с контрольным уровнем, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток, соответственно. Восприимчивость (например, чувствительность) к терапии и/или возможность проявления восприимчивости к лечению анти-SMAD7 терапией индивидуума можно определить, если имеется увеличение количества CCR9+ FoxP3+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, или если имеется уменьшение количества, по меньшей мере, одной из CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом. Альтернативно, может быть выявлена невосприимчивость (например, устойчивость) к лечению и/или невозможность проявления восприимчивости к лечению анти-SMAD7 терапией индивидуума, если имеется уменьшение количества CCR9+ FoxP3+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, или если имеется увеличение количества, по меньшей мере, одной из CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток и IL17A+ T-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0023] Другими словами, обеспечивается способ определения восприимчивости индивидуума с воспалительным заболеванием кишечника (ВЗК) к, по меньшей мере, одной анти-SMAD7 терапии, способ содержит:
(a) определение количества CCR9+ FoxP3+ T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества CCR9+ FoxP3+ T-клеток в образце с контрольным уровнем CCR9+ FoxP3+ клеток,
где увеличение количества CCR9+ FoxP3+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и/или
(a) определение количества CCR9+ IFN-гамма+ T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества CCR9+ IFN-гамма+ T-клеток в образце с контрольным уровнем CCR9+ IFN-гамма+ клеток,
где уменьшение количества CCR9+ IFN-гамма+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и/или
(a) определение количества CCR9+ IL17A+ T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества CCR9+ IL17A+ T-клеток м CCR9+IL17A+ клеток,
где уменьшение количества CCR9+IL17A+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и/или
(a) определение количества FoxP3+ T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества FoxP3+ Т-клеток в образце с контрольным уровнем FoxP3+ T-клеток, где уменьшение количества FoxP3+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и/или
(a) определение количества IFN-гамма+ T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества IFN-гамма+ T-клеток в образце с контрольным уровнем IFN-гамма+ клеток,
где уменьшение количества IFN-гамма+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии; и/или
(a) определение количества IL17A+T-клеток в образце, полученном от индивидуума с ВЗК;
(b) сравнение количества IL17A+T-клеток в образце с контрольным уровнем IL17A+ клеток, где уменьшение количества IL17A+ T-клеток указывает на то, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии.
[0024] В соответствующем аспекте обеспечивается, по меньшей мере, одно антитело к клеточным маркерам для, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-гамма+ T-клеток и IL17A+T, и FoxP3+ CD103+ T-клеток, CD103+ T-клеток и интегрин α4β7+ T-клеток, для применения в способе диагностики, практикуемом на организме человека или животного.
[0025] Соответственно, способ диагностики можно использовать для прогнозирования или контроля восприимчивости индивидуума с воспалительным заболеванием кишечника (ВЗК) к лечению, по меньшей мере, одной анти-SMAD7 терапией или для определения соответствия индивидуума с воспалительным заболеванием кишечника (ВЗК) для лечения, по меньшей мере, одной анти-SMAD7 терапией, для определения того, что индивидуум, возможно, проявит восприимчивость или проявляет восприимчивость к анти-SMAD7 терапии и/или для определения вероятности вхождения индивидуума в ремиссию.
[0026] В соответствующем варианте осуществления обеспечивается набор, содержащий, по меньшей мере, одно антитело к CCR9, антитело к FoxP3, антитело к IFN-гамма и/или антитело к IL17A для определения клеточных популяций или реагентов для детектирования экспрессии РНК, кодирующей клеточные маркеры белка, для, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-гамма+ Т-клеток и IL17A+T-клеток.
[0027] Соответственно, набор дополнительно содержит, по меньшей мере, один из буферов, реагентов и подробные инструкции для определения, сортировки и подсчета клеток с использованием FACS технологии.
[0028] Предпочтительно, в наборе по изобретению антителом является первичное антитело к белку CCR9, первичное антитело к белку FoxP3 и вторичное антитело, сопряженное с ферментом-репортером, и набор необязательно также содержит, по меньшей мере, буферы, реагенты и подробные инструкции для определения клеточных популяций с использованием IHC технологии.
[0029] Соответственно, набор по изобретению включает иммобилизированное антитело к белку CCR9, идентифицирующее антитело к белку FoxP3 и/или вторичное антитело, сопряженное с ферментом-репортером; и необязательно дополнительно содержит буферы, реагенты и подробные инструкции для определения клеточных популяций с использованием ELISA технологии.
[0030] В настоящем документе предполагается, что описанные способы, применения и наборы можно использовать для персонализации лечения анти-SMAD7 терапиями индивидуумов, которые, возможно, проявят восприимчивость или проявляют восприимчивость к таким терапиям.
[0031] Также предусмотрено в настоящем документе, что описанные способы, применения и наборы можно использовать для определения вероятности вхождения индивидуума в ремиссию после заболевания ВЗК. Например, вероятность вхождения индивидуума в ремиссию можно определить, если имеется увеличение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, и/или имеется уменьшение количества CCR9+ IFN-γ+ T-клеток, CCR9+IL17A+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0032] Как указано выше, образцом, полученным от индивидуума, может быть образец крови, такой как образец изолированной мононуклеарной клетки периферической крови. Альтернативно, образцом, полученным от индивидуума, может быть образец ткани. Например, ткань может быть получена из желудочно-кишечного тракта индивидуума (например, из тонкого кишечника индивидуума).
[0033] Контрольный образец или образец контрольного уровня может включать образец (например, образец крови или ткани), полученный от индивидуума до лечения анти-SMAD7 терапией. Контрольный образец обеспечивает исходный уровень количества, по меньшей мере, одной клеточной популяции по изобретению, присутствующей до лечения, и его можно использовать для контроля ответной реакции индивидуума на лечение. Контрольный образец или образец контрольного уровня можно получать от индивидуума на сутки первого введения анти-SMAD7 терапии (например, 1 сутки на схеме лечения). В других вариантах осуществления контрольный образец или образец контрольного уровня можно получать от индивидуума, по меньшей мере, за одни сутки до начала анти-SMAD7 терапии (например, 0 сутки на схеме лечения).
[0034] В определенных вариантах осуществления количество, по меньшей мере, одной из CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T клеток, CCR9+IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и IL17A+ Т-клеток в образце определяют посредством проточной цитометрии. В других вариантах осуществления определение проводят посредством иммуногистохимии или посредством ELISA анализа. FACS, иммуногистохимию и ELISA анализы можно проводить с использованием антител, выбранных из группы, состоящей из, по меньшей мере, одного антитела к CCR9, антитела к FoxP3, антитела к IFN-гамма и антитела к IL17A. В другом варианте осуществления количество клеточной популяции определяют посредством измерения количества РНК, кодирующей, по меньшей мере, один маркер, выбранный из группы, состоящей из CCR9, FoxP3, IFN-гамма и IL17A. В определенных вариантах осуществления анти-SMAD7 терапией является анти-SMAD7 антисмысловой олигонуклеотид. Терапией анти-SMAD7 антисмысловым олигонуклеотидом может быть анти-SMAD7 антисмысловой олигонуклеотид, выбранный из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9. В иллюстративном варианте осуществления анти-SMAD7 антисмысловой олигонуклеотид содержит SEQ ID NO: 6.
[0035] Указанные выше аспекты и варианты осуществления изобретения можно в полной мере понять посредством ссылки на следующие фигуры, подробное описание и формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
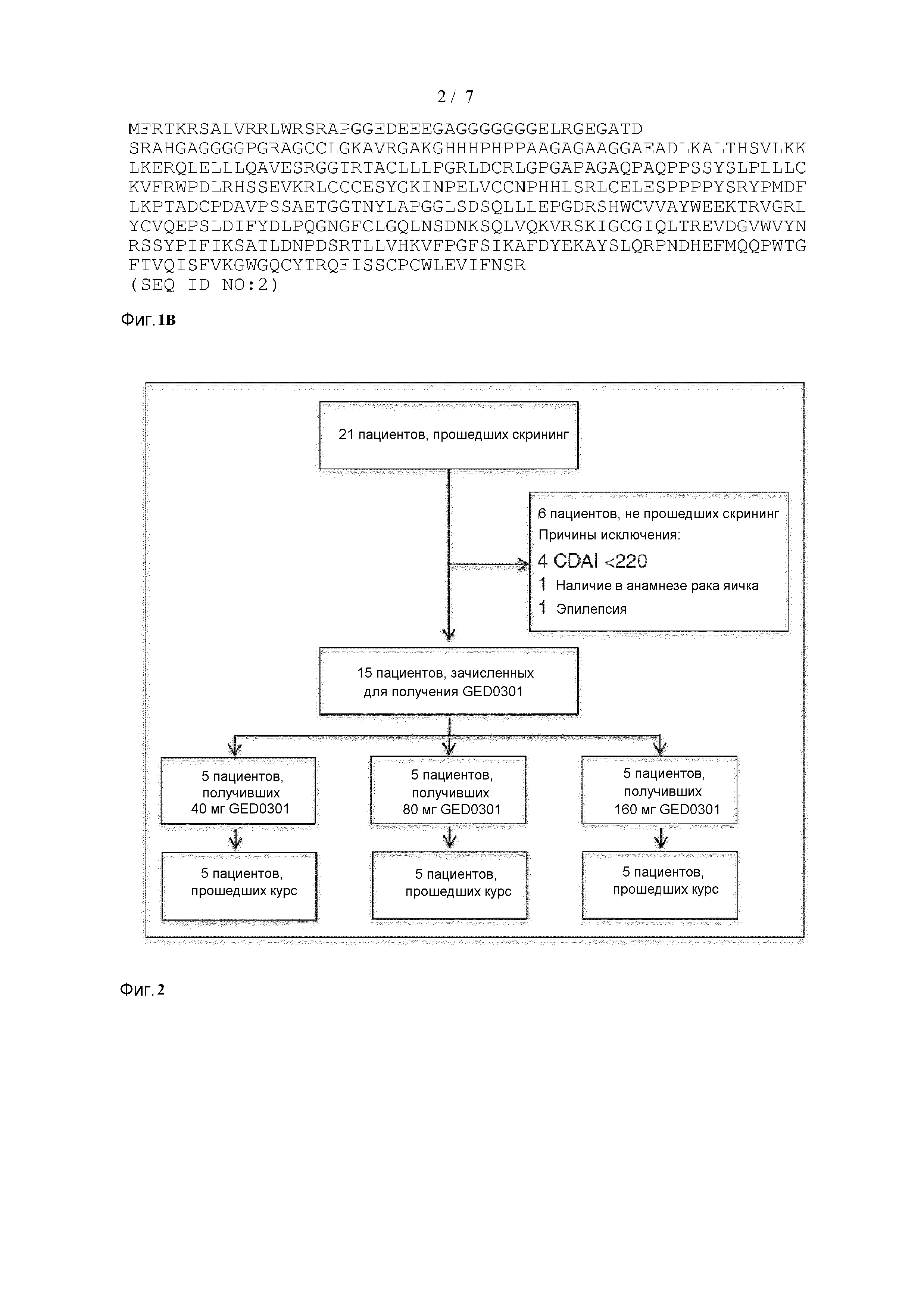
[0036] Фиг. 1(A) обеспечивает последовательность нуклеиновой кислоты SMAD7 (SEQ ID NO: 1) и (B) обеспечивает аминокислотную последовательность SMAD7 (SEQ ID NO: 2).
[0037] Фиг. 2 представляет собой блок-схему, на которой показаны результаты скрининга заявителей и разделение участвующих пациентов на когорты.
[0038] На Фиг. 3 изображены демографические и клинические характеристики, относящиеся к пациентам, включенным в испытание.
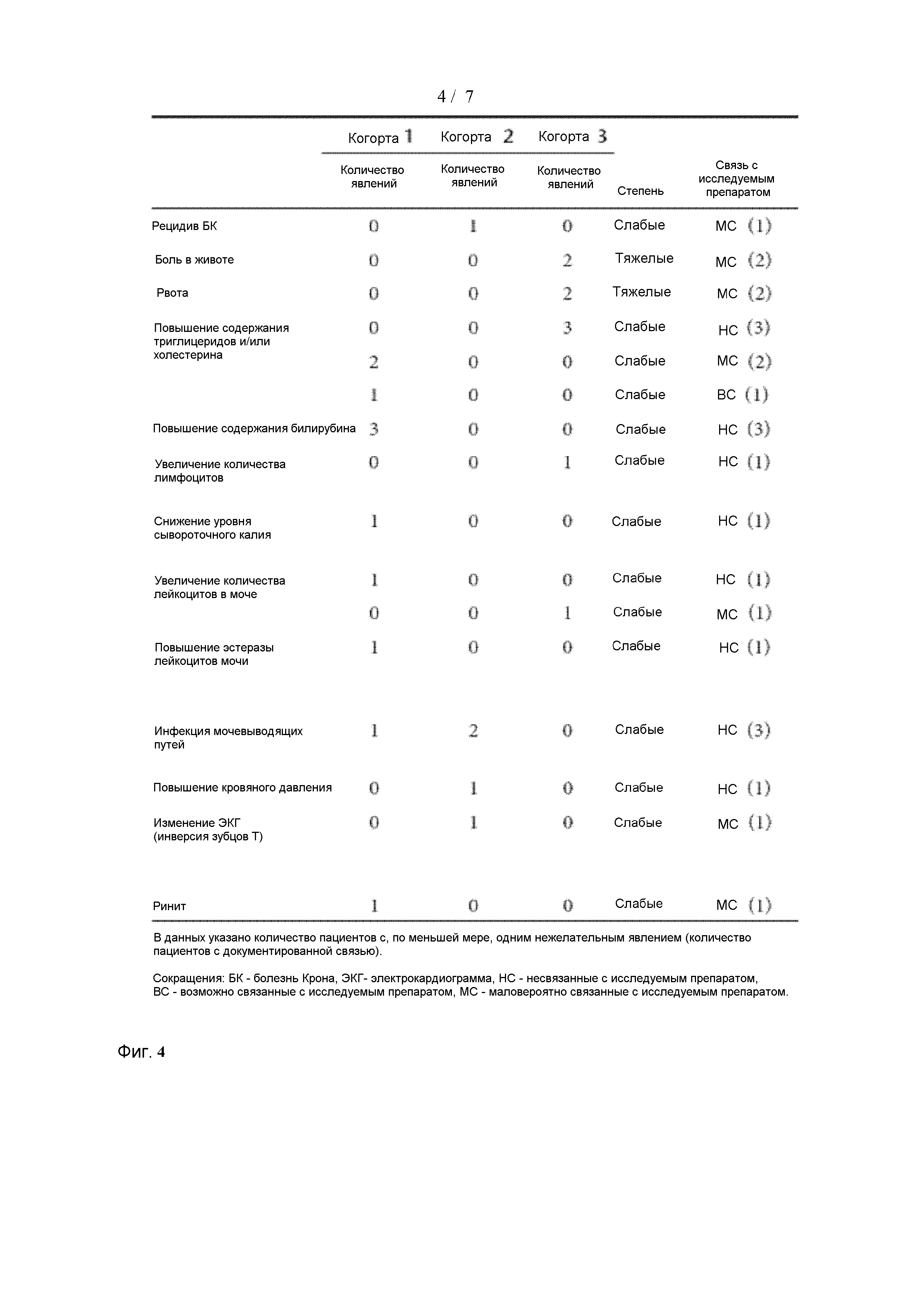
[0039] На Фиг. 4 показаны различные типы нежелательных явлений, частота их возникновения во время испытания и их связь с GED0301.
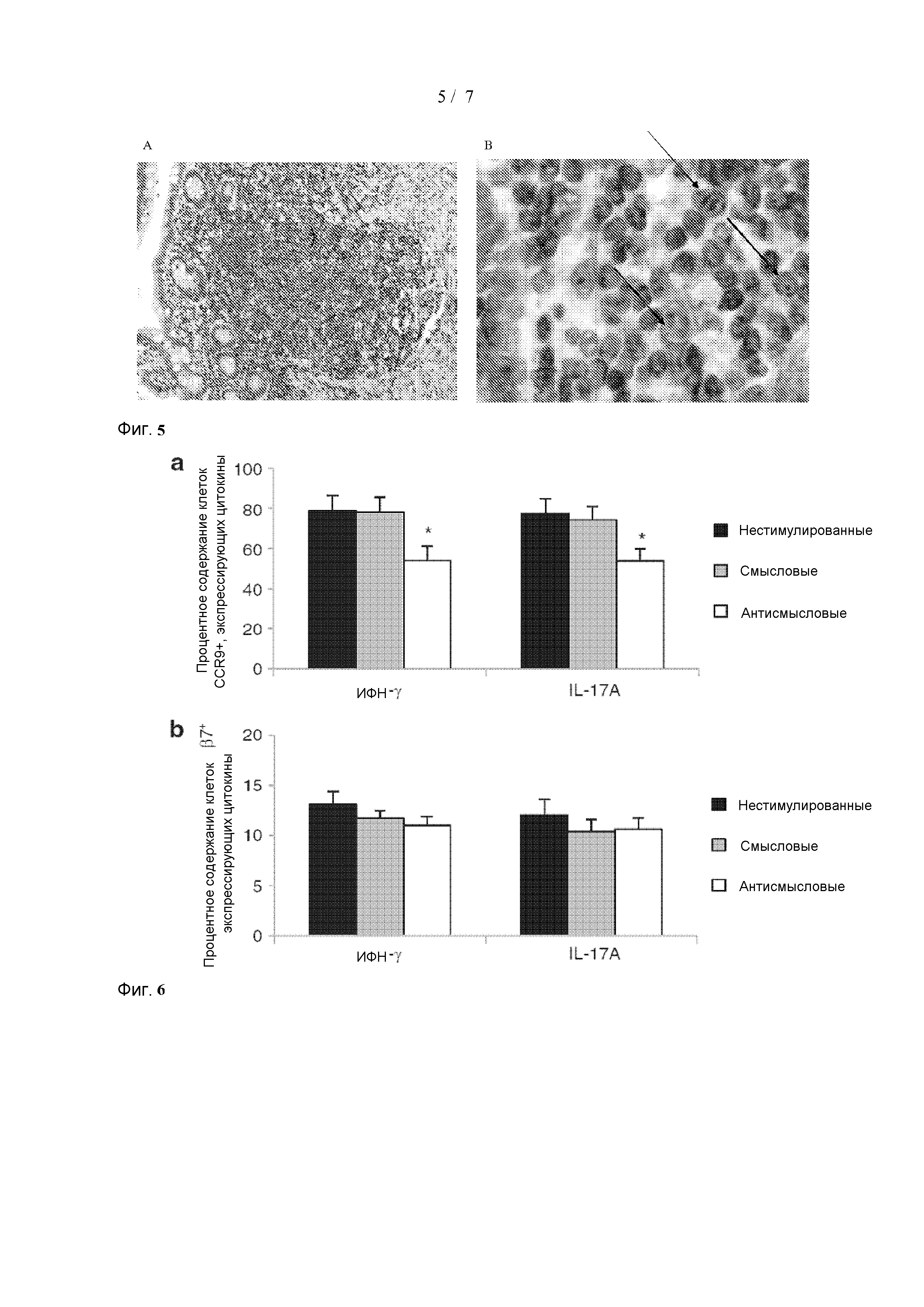
[0040] Фиг. 5(A и B) представляют собой фотографии иммуногистохимического анализа, который показывает, что SMAD7 экспрессируется в кишечных железах человека и пейеровых бляшкях у индивидуума, страдающего болезнью Крона. На B стрелки показывают экспрессию SMAD7 в ядре и цитоплазме. A - 100× увеличение; B - 200× увеличение.
[0041] На фиг. 6 представлено воздействие изолированных МКПК от пациентов с БК, оставленных без стимуляции (нестим.) или получивших лечение Smad7 смысловыми или GED0301 (антисмысловыми) олигонуклеотидами от процента IFN-γ или IL-17A клеток в пределах (A) CCR9+ или (B) β7+ популяций.
[0042] Фиг. 7 изображена фракция Т-клеток, показывающих положительную реакцию на различные маркеры на исходном уровне, и на 8 сутки и 28 сутки клинического испытания.
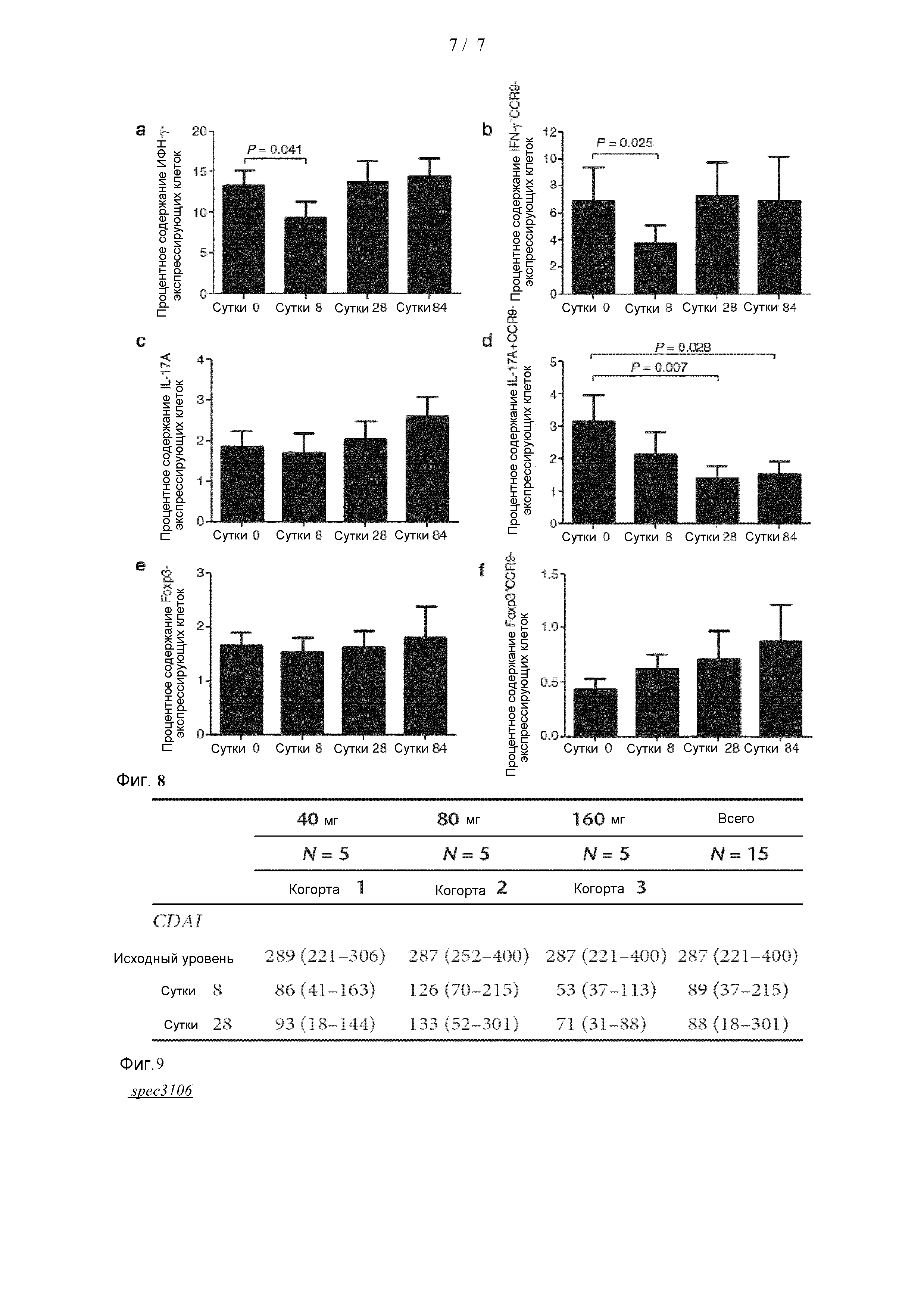
[0043] На Фиг. 8 отображены графы, показывающие процентное содержание (A) IFN-γ+, (B) IFN-γ+ CCR9+, (C) IL-17A+,
(D) CCR9+IL-17A+, (E) FoxP3+, и (F) FoxP3+ CCR9+ Т-клеток спустя 0, 8, 28 и 84 сутки.
[0044] На фиг. 9 представлены средние значения CDAI на исходном уровне, 8 сутки и 28 сутки испытания для каждой когорты, а также средние значения CDAI для каждого момента времени для всей группы пациентов.
ПОДРОБНОЕ ОПИСАНИЕ
[0045] Описаны способы контроля возможной восприимчивости (например, чувствительности или устойчивости) индивидуума к лечению анти-SMAD7 терапией. Способы частично основаны на том открытии, что модуляция определенных T-клеточных популяций (например, увеличение CCR9+ FoxP3+ T-клеток, уменьшение CCR9+ IFN-гамма положительных (IFN-γ+) T-клеток, уменьшение CCR9+IL17A+ T-клеток, уменьшение FoxP3+ T-клеток, уменьшение IFN-γ+ T-клеток и/или уменьшение IL17A+ T-клеток) в образце крови, взятом от индивидуума, страдающего воспалительным заболеванием кишечника (ВЗК), например, болезнью Крона или язвенным колитом, коррелируется с чувствительностью к лечению анти-SMAD7 терапией.
[0046] Как описано в настоящем документе, одна или несколько T-клеточных популяций индивидуума, страдающего ВЗК и получившего лечение анти-SMAD7 терапией, находятся под контролем для определения восприимчивости индивидуума к проводимой терапии и/или для определения необходимости продолжения терапии. В одном из аспектов способ включает (a) определение количества CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума с ВЗК, получающего анти-SMAD7 терапию; и (b) сравнение количества в образце с контрольным уровнем CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ T-клеток, соответственно. Восприимчивость (например, чувствительность) к терапии и/или возможность продолжения восприимчивости к лечению анти-SMAD7 терапией индивидуума можно определить, если имеется увеличение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом и/или если имеется уменьшение количества CCR9+ IFN-γ+ T-клетки, CCR9+ IL17A+ T-клетки, FoxP3+ T-клетки, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума по сравнению с контрольным образцом.
[0047] Альтернативно, можно определить восприимчивость (например, чувствительность) к терапии и/или возможность продолжения восприимчивости к лечению анти-SMAD7 терапией индивидуума, если имеется уменьшение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, или если имеется увеличение количества CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0048] В другом аспекте осуществляется контроль одной или нескольких T-клеточных популяций индивидуума с ВЗК для определения вероятности восприимчивости индивидуума к лечению анти-SMAD7 терапией. Способ включает: (a) определение количества CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуум с ВЗК; и (b) сравнение количества в образце с контрольным уровнем CCR9+ FoxP3+ T-клеток, CCR9+ IFN-гамма+ T-клеток, CCR9+IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ T-клеток, соответственно. Восприимчивость (например, чувствительность) к терапии и/или возможность продолжения восприимчивости к лечению анти-SMAD7 терапией индивидуума можно определить, если имеется увеличение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, и/или если имеется уменьшение количества CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0049] Альтернативно, может быть выявлена невосприимчивость (например, устойчивость) к лечению и/или невозможность проявления восприимчивости к лечению анти-SMAD7 терапией индивидуума, если имеется уменьшение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, и/или если имеется увеличение количества CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0050] В определенных вариантах осуществления можно также измерить количество FoxP3+ CD103+ T-клеток, CD103+ Т-клеток и/или интегрин α4β7+ Т-клеток. Индивидуумы, проявляющие восприимчивость к терапии, показывают постоянное количество этих клеточных популяций в течение проведения терапии, по сравнению с уровнем до лечения.
[0051] В других вариантах осуществления описанные способы можно использовать для определения вероятности вхождения в ремиссию индивидуума с ВЗК. Например, можно определить вероятность вхождения индивидуума в ремиссию, если имеется увеличение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом, и/или если имеется уменьшение количества CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, CCR9+IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом.
[0052] Для удобства определенные термины в описании изобретения, примерах и приложенной формуле изобретения собраны в данном разделе.
[0053] В рамках изобретения «CCR9» (хемокин (C-C motif) рецептор 9, также известный как CDw199, GPR-9-6, GPR28, C-C CKR-9, рецептор, сопряженный с G-белком 28) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 10803 и в его аллельных вариантах.
[0054] В рамках изобретения «FoxP3» (forkhead box P3, также известный как JM2, AIID, DIETER, IPEX, MGC141961, MGC141963, PIDX, XPID) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 50943 и в его аллельных вариантах.
[0055] В рамках изобретения «IFN-гамма» или «IFN-γ» (интерферон гамма также известный как IFNG, IFG, IFI) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 3458 и в его аллельных вариантах.
[0056] В рамках изобретения «IL17A» (интерлейкин 17A, также известный как CTLA8, IL-17, IL-17A, IL17, антиген, связанный с цитотоксическим T-лимфоцитом 8; белок, связанный с цитотоксическим T-лимфоцитом 8; серин эстераза, связанная с цитотоксическим T-лимфоцитом 8) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 3605 и в его аллельных вариантах.
[0057] В рамках изобретения «CD103» (CD103 антиген также известный как интегрин, альфа e; антиген 1 лимфоцита слизистой, альфа пептид; HUMINAE, интегрин альфа-IEL; интегрин альфа-E; HML-1 антиген; и MGC141996) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 3682 и в его аллельных вариантах.
[0058] В рамках изобретения «α4β7» (интегрин, альфа 4 бета 7, также известный как бета-субъединица циркулирующего рецептора и ITGB7) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 3695 и в его аллельных вариантах.
[0059] В рамках изобретения «SMAD7» (также известный как CRCS3, FLJ16482, MADH7, MADH8, MAD (mothers against decapentaplegic, дрозофила) гомолог 7, MAD гомолог 8, SMAD, mothers against DPP гомолог 7, mothers against DPP гомолог 8) означает белок человека, кодируемый геном, определенным в Entrez GenelD No. 4092 и в его аллельных вариантах.
[0060] В рамках изобретения «индекс активности болезни Крона» или «CDAI» относится к измерению или использованию индекса для оценки прогресса пациентов с БК, как описано в Best et al., Gastroenterology, 70:439-44 (1976). Значения CDAI индекса, составляющие 150 или ниже, обычно связаны с неактивным заболеванием и являются показателем лучшего прогноза, чем более высокие значения. Значения выше 150 обычно связаны с активным заболеванием, и значения выше 450 связаны с чрезвычайной тяжестью заболевания. Значения CDAI можно использовать для определения степени восприимчивости пациента к терапии и можно использовать для определения пациентов, находящихся в ремиссии. В определенных вариантах осуществления показателем клинической эффективности является то, что у индивидуума наблюдается снижение значений CDAI на, по меньшей мере, 100 единиц. В клиническом испытании, значение CDAI, составляющее 150 или ниже, обычно связано с ремиссией.
[0061] В рамках изобретения «индекс активности язвенного колита» или «UCDAI» относится к измерению или использованию индекса для оценки прогресса пациентов с ЯК, как описано Sutherland et al., Gastroenterology, 92:1894-98 (1987). UCDAI является серией спецификаторов симптомов ЯК, включая частоту стула, аноректальное кровотечение, появление выстилки ободочной кишки и определение врачом уровня активности заболевания. Каждому из этих параметров присваивается число от 0 до 3, где 3 является самым высоким уровнем активности заболевания. В клиническом испытании на ремиссию часто указывается значение UCDAI, составляющее 1 или менее, и улучшением является снижение на 3 или более единиц от значения в начале испытания. UCDAI можно использовать в клинических испытаниях для определения степени восприимчивости пациента к терапии и можно использовать для определения пациентов, находящихся в ремиссии. Другие широко используемые индексы для измерения степени тяжести заболевания у пациентов с ЯК включают классификацию Truelove и Witts, St. Mark's Index, простой клинический индекс активности колита (SCCAI), индекс Личтайгера, индекс выраженности симптомов неспецифического язвенного колита (UCSS) и систему оценки степени тяжести клиники Мейо.
[0062] В рамках изобретения «ответная реакция» или «проявляющий восприимчивость» к лечению означает то, что индивидуум с болезнью Крона показывает: (a) снижение индекса активности болезни Крона, например, снижение индекса активности болезни Крона на 20 единиц, 30 единиц, 40 единиц, 50 единиц, 60 единиц, 70 единиц, 80 единиц, 90 единиц, 100 единиц или более; (b) значение CDAI менее 150; и/или (c) индукцию ремиссии. В отношении индивидуума с ЯК «ответная реакция» или «проявляющий восприимчивость» к лечению означает, что у индивидуума наблюдается (a) снижение значений UCDAI, например, снижение значения UCDAI на 1 единицу, 2 единицы или более; (b) значение UCDAI, составляющее 1 или менее; и/или (c) индукция ремиссии.
Анти-SMAD7 терапия
[0063] Анти-SMAD7 терапия включает направленные анти-SMAD7 терапии (например, анти-SMAD7 антисмысловые терапии и антитела против SMAD7). Антисмысловые олигонуклеотиды являются короткими синтетическими олигонуклеотидными последовательностями, комплементарными с РНК-посредника (мРНК), кодирующей целевой белок (например, SMAD7). Антисмысловые олигонуклеотидные последовательности гибридизируются с мРНК с получением двухспирального гибрида, который может привести к активации убиквитарных каталитических ферментов, таких как РНКаза H, которые ухудшают ДНК/РНК гибридные спирали, таким образом, предотвращая трансляцию белка.
[0064] В определенных вариантах осуществления анти-SMAD7 антисмысловой олигонуклеотид может быть направлен на сайт 403, 233, 294, 295, 296, 298, 299 и/или 533 (т.е., нуклеотиды 403, 233, 294, 295, 296, 298, 299 и 533, соответственно) SMAD7 мРНК человека (например, SEQ ID NO: 1).
[0065] В определенных вариантах осуществления антисмысловой олигонуклеотид можно получать из следующего анти-SMAD7 антисмыслового олигонуклеотида - 5'-GTCGCCCCTTCTCCCCGCAGC-3' (SEQ ID NO: 3).
[0066] В настоящем документе предполагается, что антисмысловой олигонуклеотид, направленный на SMAD7, может содержать смешанную основную цепь, где остатки цитозина в паре CpG заменены 5'-метилцитозином (сокращенно Me-dC). Связи метилфосфоната могут также находиться на 5' и/или 3'-концах антисмыслового олигонуклеотида (сокращенно MeP).
[0067] Иллюстративные терапии антисмысловым олигонуклеотидом, направленные на SMAD7, в качестве неограничивающих примеров включают 5'-GTXYCCCCTTCTCCCXYCAG-3' (SEQ ID NO: 4), где X является нуклеотидом, содержащим азотистое основание, выбранное из группы, состоящей из цитозина и 5-метилцитозина или нуклеозида 2'-O-метилцитозина, и где Y является нуклеотидом, содержащим азотистое основание, выбранное из группы, состоящей из гуанина и 5-метилгуанина или нуклеозида 2'-O-метилгуанина, при условии, что, по меньшей мере, один из нуклеотидов X или Y содержит метилированное азотистое основание;
[0068] 5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 5), где X является 5-метил 2'-дезоксицитидин 5'-монофосфатом;
[0069] 5'-GTXGCCCCTTCTCCCXGCAGC-3' (SEQ ID NO: 6), где X является 5-метил 2'-дезоксицитидин 5'-монофосфатом;
[0070] 5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 7), где X является 5-метил 2'-дезоксицитидин 5'-монофосфатом и Z является 2'-дезоксигуанозин метилфосфонатом;
[0071] 5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 8), где X является 5-метил 2'-дезоксицитидин 5'-монофосфатом и Z is 2'-дезоксигуанозин метилфосфонатом;
[0072] 5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 9), где X является 5-метил 2'-дезоксицитидин 5'-монофосфатом. (См. например, патент US № 7807818 и 6159697, каждый из которых включен в настоящий документ посредством ссылки.)
[0073] В иллюстративном варианте осуществления анти-SMAD7 антисмысловую терапию можно составлять в фармацевтически приемлемом носителе и вводить перорально индивидууму с ВЗК.
Образец крови
[0074] Образец крови от индивидуума можно получать с использованием методов, хорошо известных в данной области. Образцы крови могут включать мононуклеарные клетки периферической крови (МКПК) или цельную кровь без форменных элементов крови. МКПК можно получать из образцов цельной крови с использованием процесса центрифугирования в различном градиенте плотности (например, градиенте плотности Фиколла). Например, цельная кровь (например, антикоагулированная цельная кровь) наносится слоями на среду разделения и проводится центрифугирование. По окончании этапа центрифугирования проводится наблюдение следующих слоев сверху вниз: плазма/тромбоциты, МКПК, среда разделения и эритроциты/гранулоциты. Слой МКПК можно собрать и промыть для удаления загрязняющих примесей.
Образец ткани
[0075] Образец ткани от индивидуума (например, образец ткани, полученный из тонкого кишечник и/или толстой кишки индивидуума, например, индивидуума с БК или ЯК) можно использовать в качестве источника клеток, источника РНК, источника белка или источника тонкого среза для иммуногистохимии (IHC) для измерения количества CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце. Образец ткани можно получать с использованием общепринятых приборов и процедур для проведения биопсии. Эндоскопическая биопсия, экцизионная и инцизионная биопсия являются примерами признанных медицинских процедур, которые может использовать специалист в данной области для получения образцов желудочно-кишечной ткани. Образец ткани должен быть достаточно большого размера, чтобы обеспечить достаточное количество клеток, РНК, белка или тонких срезов для измерения уровня экспрессии маркерного гена (например, CCR9, FoxP3, IFN-γ и/или IL17A) или визуализации отдельных клеток посредством проточной цитометрии, IHC или ELISA, например, экспрессии CCR9+ FoxP3+ T-клетки, CCR9+ IFN-γ+ T-клетки, CCR9+ IL17A+ T-клетки, FoxP3+ T-клетки, IFN-γ+ T-клетки и/или IL17A+ T-клетки.
[0076] Образец ткани может быть достаточного размера в любом виде для сортировки клетки, экстракции РНК, экстракции белка или получения тонких срезов. Таким образом, образец ткани может быть свежим, сохраненным посредством подходящих криогенных средств или сохраненным посредством некриогенных средств. Стандартным процессом для обработки клинического биоптата является фиксация образца ткани в формалине, а затем заключение его в парафин. Образцы в таком виде общеизвестны как зафиксированная формалином, заключенная в парафин (FFPE) ткань. Подходящие методы получения ткани для последующего анализа хорошо известны специалистам в данной области.
Проточная цитометрия
[0077] Клеточные популяции можно сортировать на основе поверхностных клеточных маркеров посредством проточной цитометрии (например, анализом флуоресцентно активированной сортировки клеток (FACS)). Способы сортировки и подсчета клеток посредством FACS-анализа общеприняты и известны специалистам в данной области. См., например, Robinson "Current Protocols in Cytometry" John Wiley & Sons Inc., Нью-Йорк. В целом, клетки полученные из образца крови или образца ткани можно получать в одноклеточной суспензии. Затем производится мечение клеток флуоресцентной меткой (например, флуоресцентно меченое антитело с маркером клеточной поверхности, присутствующим в клеточной(ых) популяции(ях), подлежащей(их) определению). Флуоресценция может быть прямой или косвенной. Для прямой флуоресценции флуоресцентная метка (например, флуоресцеин, родамин или другой флуорохром) прикрепляется ковалентной связью к первичному антителу. Для косвенной флуоресценции первичное антитело, связанное с маркером, присутствующим на клеточной поверхности, не помечается флуоресцентной меткой. Первичное антитело связывается с клеточной поверхностью целевой клеточной популяции. Несвязанное антитело удаляют на этапе промывки. Добавляют флуоресцентно-направленное вторичное антитело, связывающее первичное антитело, и любое несвязанное антитело удаляют на этапе промывки.
[0078] FACS-анализ можно проводить с живыми или фиксированными клетками. Приборы FACS доступны специалистам в данной области и включают FACScan, FACStar Plus и FACSCalibur (Becton-Dickinson). Программное обеспечение FACS-анализ доступно специалистам в данной области и включает FlowJo, CellQuest Pro (Becton-Dickinson) и WinMDI (Windows многодокументный интерфейс для проточной цитометрии).
[0079] Специалисту в данной области следует принимать во внимание, что FACS-анализ можно проводить с одним антителом или многими антителами для определения, подсчета и сортировки отдельных клеточных популяций. Например, метка клеточной популяции одним антителом может быть детектирована и отсортирована от клеток, не экспрессирующих указанный маркер (например, FoxP3+ T-клеточные популяции можно определить с помощью антитела, определенного для FoxP3; IFN-γ+ T-клеточные популяции можно определить с помощью антитела, определенного для IFN-γ; и IL17A+ T-клеточные популяции можно определить с помощью антитела, определенного для IL17A.)
[0080] Прибор FACS, оборудованный несколькими лазерами и флуоресцентными детекторами, позволяет использовать мечение многочисленными антителами и может точно определить целевую клеточную популяцию. Для достижения детектирования клетки можно пометить многими антителами, каждое, меченное различной флуоресцентной меткой. Например, образец крови может быть одномоментно помечен меченым аллофикоцианином антителом мыши против CCR9 человека и меченым фикоэритрином антителом против FoxP3 человека для детектирования CCR9+ FoxP3+ T-клеточных популяций. В другом варианте осуществления образец ткани может быть помечен меченым аллофикоцианином антителом мыши против CCR9 человека и Alexa Fluor 647 антителом мыши против IL17A человека для детектирования CCR9+IL17A+ T-клеточной популяции.
[0081] Иллюстративные антитела, которые можно использовать для определения CCR9+ FoxP3+ T-клеточных популяций, CCR9+IFN-γ+ T-клеточных популяций и/или CCR9+ IL17A+ T- клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против CCR9 человека, такие как меченое аллофикоцианином антитело мыши против CCR9 человека (R&D Systems, Catalog Numbers FAB179A и FAB 1791 A), Alexa Fluor® 647 антитело мыши против CCR9 человека (BD Pharmigen, номер по каталогу 557975), меченое флуоресцеином антитело мыши против CCR9 человека (R&D Systems, номер по каталогу FAB179F) и меченое фикоэритрином антитело мыши против CCR9 человека (R&D Systems, номер по каталогу FAB179P).
[0082] Иллюстративные антитела, которые можно использовать для определения FoxP3+ T-клеточных популяций и CCR9+FoxP3+ T-клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против FoxP3 человека, такие как меченое фикоэритрином антитело к FoxP3 человека (Miltenyi Biotec, номер по каталогу 130-093-014), меченое аллофикоцианином антитело к FoxP3 человека (Miltenyi Biotec, номер по каталогу 130-093-013), Alexa Fluor® 647 антитело мыши против FoxP3 человека (BD Pharmigen, номер по каталогу 560045), Alexa Fluor® 488 антитело мыши против FoxP3 человека (AbD Serotec, номер по каталогу MCA2376A488) и меченое флуоресцирующее антитело мыши против FoxP3 человека (Abeam, номер по каталогу ab93512).
[0083] Иллюстративные антитела, которые можно использовать для определения IFN-гамма+ T-клеточных популяций и CCR9+IFN-гамма+ T-клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против IFN-гамма человека, такие как меченое флуоресцирующее антитело мыши против IFN-гамма человека (Abeam, номер по каталогу ab47344), меченое фикоэритрином антитело мыши против IFN-гамма человека (Abeam, номер по каталогу ab47345, и R&D Systems, номер по каталогу IC285P) и меченое флуоресцеином антитело мыши против IFN-гамма человека (R&D Systems, номер по каталогу IC285F).
[0084] Иллюстративные антитела, которые можно использовать для определения IL17A+ T-клеточных популяций и CCR9+IL17A+ T- клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против IL17A человека, такие как Alexa Fluor 647 антитело мыши против IL17A человека (eBioscience, номер по каталогу 51-7179-42), меченое фикоэритрином антитело мыши против IL17A человека(R&D Systems, номер по каталогу IC3171P) и меченое аллофикоцианином антитело мыши против IL17A человека (R&D Systems, номер по каталогу IC3171 A).
[0085] Иллюстративные антитела, которые можно использовать для определения CD103+ T-клеточных популяций и FoxP3+CD103+ T-клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против CD103 человека, такие как меченое фикоэритрином моноклональное антитело мыши против интегрин альфа E человека (Abeam, номер по каталогу ab33267) и меченое флуоресцирующее моноклональное антитело мыши против CD103 человека (AbD Serotec, номер по каталогу MCA1416FT).
[0086] Иллюстративные антитела, которые можно использовать для определения α4β7+ клеточных популяций посредством FACS-анализа, включают флуоресцентно меченые антитела против α4β7 человека, которые доступны от BD Biosciences.
[0087] В другом варианте осуществления количество клеточных популяций определяют с помощью сортировки клеток посредством проточной цитометрии, а затем измерения количества РНК, кодирующей, по меньшей мере, один маркер, выбранный из группы, состоящей из CCR9, FoxP3, IFN-гамма и IL17A из отсортированной клеточной популяции. Способы изолирования и количественного определения РНК общеизвестны в данной области.
Иммуногистохимия
[0088] Отдельные клеточные популяции также можно определить посредством иммуногистохимии (IHC). В частности, количество CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в конкретной клеточной популяции можно определять (например, визуально) посредством IHC. Например, для анализа CCR9+ FoxP3+ T-клеточной популяции посредством IHC необходимо, например, по меньшей мере, одно антитело к белку CCR9, например, по меньшей мере, одно антитело к CCR9, и, по меньшей мере, одно антитело к антителу к FoxP3, например, по меньшей мере, одно антитело к FoxP3. В иллюстративных вариантах осуществления антитело к CCR9 и антитело к FoxP3+ являются мечеными различными метками, например, различными флуоресцентными метками. В определенных вариантах осуществления антитело к CCR9 и антитела к FoxP3 являются различными антителами, например, мыши, крысы, кролика, и т.д., таким образом, обеспечивая дифференциальное детектирование посредством меченых, например, флуоресцентно, вторичных антител.
[0089] Для проведения исследования IHC, например, заключенные в парафин зафиксированные формалином образцы ткани можно нарезать на срезы, например, 5 микронные срезы. Как правило, тканевые срезы изначально обрабатывают так, чтобы извлечь антигенную структуру белков, зафиксированных в начальном процессе сбора и сохранения материала ткани. Затем производится блокировка срезов с целью предотвращения неспецифического связывания идентифицирующими антителами. Затем осуществляется детектирование присутствующих, например, CCR9, FoxP3, IFN-гамма и/или белков IL17A, посредством связывания анти-CCR9, анти-FoxP3, анти-IFN-гамма и/или антител к IL17A с соответствующими белками. Идентифицирующее (первичное) антитело связано с флуоресцентной меткой, напрямую или косвенно, например, с помощью вторичного антитела или полимера, который специфически распознает идентифицирующее (первичное) антитело. Как правило, тканевые срезы отмывают и блокируют неспецифичным белком, таким как альбумин бычьей сыворотки между этапами. Образцы могут быть контрастно окрашены гематоксилином и/или эозином.
[0090] Антитела к CCR9, подходящие для IHC, коммерчески доступны, такие как, например, поликлональное антитело козы CCR9 человека от Enzo Life Sciences (номер по каталогу ALX-210-847-C200), поликлональное антитело кролика CCR9 человека от Gen Way Biotech (номер по каталогу 18-461-10269-0.05 ml), антитело к CCR9 от Novus Biologicals (номер по каталогу NBP1-44201), и моноклональное антитело мыши CCR9 человека от R&D Systems (номер по каталогу MAB179).
[0091] Антитела к FoxP3, подходящие для IHC, коммерчески доступны, такие как, например, поликлональное антитело кролика против FoxP3 от Abbiotec (номер по каталогу 250655), поликлональное антитело козы против FoxP3 человека от Abgent (номер по каталогу AF1438a), моноклональное антитело мыши против FoxP3 человека от LifeSpan Biosciences (номер по каталогу LS-C51576-40) и моноклональное антитело мыши против FoxP3 человека от MBL International (номер по каталогу M120-3).
[0092] Антитела к IFN-гамма, подходящие для IHC, коммерчески доступны, такие как, например, поликлональное антитело кролика против IFN-гамма от Abbiotec (номер по каталогу 250707), моноклональное антитело мыши против IFN-гамма человека от BioLegend (номер по каталогу 506512), моноклональное антитело козы против IFN-гамма человека от R&D Systems (номер по каталогу AF-285-NA) и поликлональное антитело кролика против IFN-гамма человека от Cell Sciences (номер по каталогу CP2008).
[0093] Антитела к IL17A, подходящие для IHC, коммерчески доступны, такие как, например, поликлональное антитело кролика против IL17A человека от Proteintech Group (номер по каталогу 13082-1-AP) и поликлональное антитело козы против IL17 человека от R&D Systems (номер по каталогу AF-317-NA).
[0094] Антитела против CD103, подходящие для IHC, коммерчески доступны, такие как, например, моноклональное антитело мыши против интегрин-альфа E человека от Abcam (номер по каталогу ab33266) и моноклональное антитело мыши против CD103 человека от AbD Serotec (номер по каталогу P38570).
[0095] Антитела против интегрина α4β7 коммерчески доступны от BD Biosciences.
Твердофазный иммуноферментный анализ на основе клеток
[0096] В некоторых вариантах осуществления клеточные популяции можно определить посредством трехфазного иммуноферментного анализа (ELISA). В частности, CCR9+ FoxP3+ T-клетки, CCR9+ IFN-γ+ T-клетки, CCR9+ IL17A+ T-клетки, FoxP3+ T
клетки, IFN-γ+ Т-клетки и/или IL17A+ Т-клетки в конкретной клеточной популяции можно определять посредством ELISA на основе клеток. Например, для проведения анализа CCR9+ FoxP3+ клеточной популяции посредством ELISA необходимо, по меньшей мере, одно антитело к белку CCR9, например, по меньшей мере, одно антитело к CCR9, по меньшей мере, одно антитело к белку FoxP3, например, по меньшей мере, одно антитело к FoxP3, и/или по меньшей мере, одно вторичное антитело, например, по меньшей мере, одно меченое вторичное антитело. В иллюстративных вариантах осуществления антитело к CCR9 и антитело к FoxP3 являются либо немечеными, либо мечеными различными метками, например, различными флуоресцентным метками. В определенных вариантах осуществления антитело к CCR9 и антитело к FoxP3 являются различными антителами, например, мыши, крысы, кролика, и т.д., таким образом, обеспечивая дифференциальное детектирование с помощью меченых, например, флуоресцентно или ферментно, вторичных антител.
[0097] Для проведения ELISA, например, ELISA на основе клеток, необходимо, по меньшей мере, одно иммобилизированное антитело, по меньшей мере, одно идентифицирующее антитело, и/или, по меньшей мере, ферментно или флуоресцентно меченое вторичное антитело. Например, для проведения анализа CCR9+ FoxP3+ клеточной популяции посредством ELISA на основе клеток может потребоваться поликлональное антитело к CCR9, как иммобилизированное антитело. Поликлональное антитело к CCR9 иммобилизируется на твердой подложке, такой как полистирольный планшет для микротитрования. Затем добавляют клетки, полученные из образца крови или образца ткани и позволяют собраться в одно целое со связанным антителом. Несвязанные клетки удаляют промыванием. Идентифицирующее антитело, например, моноклональное антитело к FoxP3, добавляют и оставляют для связывания с клетками. Идентифицирующее антитело связано с ферментом, напрямую или косвенно, например, с помощью вторичного антитела, которое специфически распознает идентифицирующее антитело. Как правило, между каждым этапом планшет со связанными клетками отмывают промывочным буфером, например, мягким моющим раствором. Типичные протоколы ELISA также включают один или несколько этапов блокировки, которые включают в себя использование неспецифически связывающего белка, такого как альбумин бычьей сыворотки, для блокировки нежелательного неспецифического связывания белковых реагентов на планшете. После окончательного этапа промывки в планшет добавляют соответствующий субстрата фермента, для получения визуального сигнала, указывающего на количество CCR9+ FoxP3+ клеток в образце. Субстратом может быть, например, хромогенный субстрат или флуорогенный субстрат.
[0098] Способы, реагенты и оборудование для проведения ELISA хорошо известны в данной области и коммерчески доступны.
[0099] Многочисленные антитела к CCR9, подходящие для ELISA, являются коммерчески доступными, такими как, например, поликлональное антитело к CCR9 от Abcam (номер по каталогу ab38567), поликлональное антитело козы против CCR9 человека от Enzo Life Sciences (номер по каталогу ALX-210-847-C200) и поликлональное антитело кролика против CCR9 человека от Novus Biologicals (номер по каталогу H00010803-D01P).
[00100] Многие антитела к FoxP3, подходящие для ELISA, коммерчески доступны, такие как, например, поликлональное антитело кролика против FoxP3 от Abbiotec (номер по каталогу 250655), поликлональное антитело козы против FoxP3 человека от Abgent (номер по каталогу AF1438a) и моноклональное антитело мыши против FoxP3 человека от LifeSpan Biosciences (номер по каталогу LS-C82119-100).
[00101] Многие антитела к IFN-гамма, подходящие для ELISA, коммерчески доступны, такие как, например, поликлональное антитело кролика против IFN-гамма от Abbiotec (номер по каталогу 250707), моноклональное антитело мыши против IFN-гамма человека от BioLegend (номер по каталогу 507502) и поликлональное антитело кролика против IFN-гамма человека от Cell Sciences (номер по каталогу CP2008).
[00102] Антитела к IL17A, подходящие для ELISA, коммерчески доступны, такие как, например, поликлональное антитело кролика против IL17A человека от Proteintech Group (номер по каталогу 13082-1-AP) и моноклональное антитело козы против IL17 человека от R&D Systems (номер по каталогу MAB317).
[00103] Антитела против CD103, подходящие для ELISA, коммерчески доступны, такие как, например, антитело кролика против интегрин альфа E человека от Novus Biologicals (номер по каталогу 36520002).
[00104] Антитела против интегрина α4β7 коммерчески доступны от BD Biosciences.
[00105] В другом варианте осуществления количество клеточной популяции определяют с помощью сортировки клеток посредством проточной цитометрии, а затем измерения количества РНК, кодирующей, по меньшей мере, один маркер, выбранный из группы, состоящей из CCR9, FoxP3, IFN-гамма и IL17A из отсортированной клеточной популяции. Способы изолирования и количественного определения РНК общеизвестны в данной области.
Контрольные образцы
[00106] Контрольный образец может включать образец (например, образец крови или ткани), полученный от индивидуума до лечения анти-SMAD7 терапией. Контрольный образец обеспечивает исходный уровень для контроля прогресса лечения индивидуума. Контрольный образец можно получать от индивидуума за сутки до первого введения анти-SMAD7 терапии (например, 1 сутки на схеме лечения). В других вариантах осуществления контрольный образец можно получать от индивидуума за одни сутки до начала анти-SMAD7 терапии (например, 0 сутки на схеме лечения). Альтернативно, контрольный образец можно получать от индивидуума за 2, 3, 4, 5, 6, 7 или более суток до начала анти-SMAD7 терапии. Например, положительную регуляцию или отрицательную регуляцию определенных клеточных образцов можно измерять до лечения (например, контрольный образец), во время лечения и/или после лечения для контроля ответной реакции индивидуума на терапию, например, анти-SMAD7 терапию.
[00107] В некоторых вариантах осуществления контрольный уровень может быть установлен для индивидуума на основе длительного контроля определенных клеточных популяций у индивидуума. В таких случаях предусмотрено, что индивидуум может проходить несколько циклов лечения анти-SMAD7 терапией. Количество определенной клеточной популяции, детектированной после многочисленных циклов лечения можно сравнивать с более ранним контрольным уровнем индивидуума для контроля проявленной восприимчивости к терапии индивидуума и/или вероятности проявления восприимчивости к дальнейшему лечению индивидуума анти-SMAD7 терапией. В других вариантах осуществления контрольный или исходный уровень индивидуума может быть установлен на основе среднего измерения определенной клеточной популяции, выявленной из многочисленных исходных образцов, полученных с течением времени (например, полученных на протяжении курса длительностью несколько недель, месяцев или лет). Таким образом, любой тест или анализ, проводимый, как описано в настоящем документе, можно сравнивать с предыдущим или установленным контрольным уровнем, и может не возникнуть необходимости в получении нового контрольного образца от индивидуума для сравнения, например, если индивидуум получает более чем один цикл лечения анти-SMAD7 терапией.
Толкование данных
[00108] Восприимчивость индивидуума к лечению анти-SMAD7 терапией можно толковать относительно контрольного образца, полученного от индивидуума до начала лечения. Чувствительность (например, восприимчивость или возможность проявления восприимчивости) к лечению анти-SMAD7 терапией индивидуума может быть выявлена, если имеется увеличение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, или уменьшение количества CCR9+ IFN-гамма+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ Т-клеток и/или IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом. Образец можно получать на 8 сутки или позднее после начала терапии для определения чувствительности к лечению. В некоторых вариантах осуществления образец можно получать на 28, 56 и/или 84 сутки и/или позднее. В других вариантах осуществления образец можно получать спустя 8 суток, например, одну неделю, две недели, один месяц, два месяца, три месяца, шесть месяцев и/или один год или позднее после начала терапии для контроля чувствительности к лечению.
[00109] Альтернативно, может быть выявлена устойчивость (например, невосприимчивость или невозможность проявления восприимчивости) к лечению анти-SMAD7 терапией индивидуума, если имеется уменьшение количества CCR9+ FoxP3+ Т-клеток в образце, полученном от индивидуума, или увеличение количества CCR9+ IFN-γ+ T-клеток и/или CCR9+ IL17A+ Т-клеток в образце, полученном от индивидуума, по сравнению с контрольным образцом. Образец можно получать на 8 сутки или позднее после начала терапии для определения устойчивости к лечению. В некоторых вариантах осуществления образец можно получать на 28, 56, 84 сутки или через более суток после начала лечения. В других вариантах осуществления образец можно получать спустя 8 суток, например, одну неделю, две недели, один месяц, два месяца, три месяца, шесть месяцев и/или один год или позднее после начала терапии для контроля чувствительности к лечению.
Наборы для анализа
[00110] Изобретение включает набор для анализа, содержащий определенные компоненты для осуществления способов, описываемых в настоящем документе. Набор для анализа может повысить удобство, скорость и воспроизводимость при проведении описанных анализов. Например, иллюстративный набор для анализа на основе FACS может включать антитела для определения, сортировки и подсчета клеток, например, антител к CCR9, антител к FoxP3, антител к IFN-гамма и/или антител к IL17A. В других вариантах осуществления набор для анализа содержит не только антитела, но также буферы, реагенты и подробные инструкции для определения, сортировки и подсчета клеток с использованием FACS технологии. В некоторых вариантах осуществления набор включает тестовый протокол и все расходуемые компоненты, необходимые для анализа, за исключением образца(ов) клетки и/или ткани.
[00111] Иллюстративный набор для анализа на основе IHC может содержать материалы для определения клеточных популяций посредством IHC. Набор для IHC, например, может содержать первичное антитело к белку CCR9, например, антитело мыши против CCR9 человека и первичное антитело к белку FoxP3, например, антитело мыши к FoxP3 человека, и вторичное антитело, сопряженное с ферментом-репортером, например, пероксидазой хрена. В других вариантах осуществления набор для анализа содержит не только антитела, но также буферы, реагенты и подробные инструкции для определения клеточных популяций с использованием IHC технологии.
[00112] Иллюстративный набор для анализа на основе ELISA может содержать материалы для определения клеточных популяций посредством ELISA. Набор для ELISA на основе клеток, например, может содержать иммобилизированное антитело к белку CCR9, например, поликлональное антитело кролика к CCR9 человека, и идентифицирующее антитело к белку FoxP3, например, моноклональное антитело мыши против FoxP3 человека, и/или вторичное антитело, сопряженное с ферментом-репортером, например, пероксидазой хрена. В других вариантах осуществления набор для анализа содержит не только антитела, но также буферы, реагенты и подробные инструкции для определения клеточных популяций с использованием ELISA технологии.
ПРИМЕРЫ
[00113] Изобретение также продемонстрировано на следующих примерах. Примеры представлены исключительно в иллюстративных целях и не подлежат толкованию как ограничивающие каким-либо образом объем или содержание по изобретению.
Пример 1: Фаза I клинического испытания для оценки безопасности и эффективности анти-SMAD7 антисмыслового лечения у пациентов с БК
[00114] Пятнадцать пациентов с активной БК участвовали в фазе I клинического испытания для оценки безопасности и эффективности анти-SMAD7 антисмысловой терапии для лечения БК. Первоначально пациенты были ограждены от группы из 21 заявителя, и зачисленные пациенты были отнесены к одной из трех когорт с равным количеством пациентов (фиг. 2). Среди участников-пациентов не проводились значимые отличия по демографическим или клиническим характеристикам. Однако длительность заболевания пациентов когорты 1 составляла больше времени по сравнению с пациентами двух других когорт, и пациенты когорт 1 и 2 ранее чаще проходили резекцию кишечника по сравнению с пациентами когорты 3 (фиг. 3). Пациенты получали 40 мг/сутки (N=5; когорта I); 80 мг/сутки (N=5; когорта 2); или 160 мг/сутки (N=5; когорта 3) GED-0301, Smad7 антисмысловой олигонуклеотид (GTXGCCCCTTCTCCCXGCAGC, где X является 5-метил-2'-дезоксицитидин 5' монофосфатом (5-Me-dC) (SEQ ID NO: 6)) в течение 7 суток.
[00115] Правом на участие обладали пациенты, соответствующие следующим критериям: 1.) Письменное согласие на основе полученной информации, с личной подписью и датой, поставленными пациентом до начала любой процедуры, имеющей отношение к исследованию; 2.) Пациенты мужского или женского пола в возрасте 18-45 лет; 3.) Пациенты женского рода не детородного возраста; пациенты женского рода детородного возраста при отрицательном результате теста на беременность на скрининге и пользующиеся эффективным способом предохранения от беременности в течение проведения исследования; 4.) Пациенты с активной БК во время скринингового визита, определенной по значению CDAI >220 и <400 в течение, по меньшей мере, одной недели до участия; 5.) БК, ограниченная терминальным отделом подвздошной кишки и/или восходящей ободочной кишкой; 6.) Не проходили лечение анти-ФНО-альфа препаратами, другими биопрепаратами, иммуносупрессорами (например, азатиоприном, меркаптопурином, метотрексатом) за 90 суток до участия; 7.) Пациенты со стероидной резистентностью или стероидной зависимостью; и 8.) Способность понять и соблюдать процедуры и ограничения при исследовании.
[00116] Индивидуумы исключались из исследования при соответствии какому-либо из следующих критериев: 1.) Беременные или кормящие грудью женщины; 2.) Пациенты с БК, затрагивающей желудок и/или проксимальный отдел тонкой кишки, или пациенты с поражением, ограниченным поперечной и/или нисходящей ободочной кишкой; 3.) Применение за 90 суток до первой дозы иммуномодуляторов и биопрепаратов (например, азатиоприна, меркаптопурина, метотрексата, инфликсимаба, адалимумаба натализумаба); 4.) Присутствие местных осложнений (например, абсцессов, стриктур и фистулы) дисплазии и злокачественных новообразований и проявлений внекишечной локализации; 5.) Предшествующая эндоскопическая балонная дилятация, пластика стриктуры или хирургическое удаление стриктур БК; 6.) Пациенты проходили проктоколэктомию; 7.) Какое-либо из следующих лабораторных изменений: АЧТВ>1,5 верхняя граница нормы (ВГН); количество тромбоцитов <100,000/мм3; креатинин сыворотки >1,5 ВГН; общее количество билирубина >1,5 ВГН (исключая синдром Жильбера); уровень АСТ и АЛТ >1,5 ВГН; интервал QT >450 мсек для мужчин и >470 мсек для женщин; 8.) Текущий или соответствующий предыдущий анамнез серьезного, тяжелого или нестабильного (острого или прогрессирующего) физического или психического заболевания, включая инфекции, злокачественное новообразование, заболевание, которое может требовать лечения (например, почечная или печеночная недостаточность) или то, что, возможно, помешает индивидууму пройти полное исследование, или любое состояние, представляющее неоправданный риск от исследуемого препарата или процедур исследования; 9.) Пациенты, которые курят или употребляют другие табачные изделия; 10.) Наличие в анамнезе злоупотребления алкоголем или другим веществом в пределах последнего года; 11.) Пациенты, потенциально представляющие низкую надежность (например, слабое психическое состояние); 12.) Известна гиперчувствительность к олигонуклеотидам или любому ингредиенту в продуктах исследования; 13.) Пациенты, использовавшие другой исследуемый препарат или принимавшие участие в клиническом испытании в пределах последних 12 месяцев суток до рамдомизации.
[00117] Ежедневно проводилась оценка безопасности GED-0301 с учетом следующего: медицинские осмотры, масса тела (кг), основные показатели состояния организма (систолическое и диастолическое артериальное давление, частота сердечных сокращения, частота дыхательных движений, температура тела), ЭКГ (12 отведений), сбор НЯ и серьезных нежелательных явлений. Проводили проверку образцов крови на: гемоглобин, гематокрит, средний объем клетки, подсчет эритроцитов, общий и дифференциальный подсчет лейкоцитов, MCH, подсчет тромбоцитов, протромбиновое время, активированное парциальное тромбопластиновое время, креатинин, BUN, глюкоза, мочевая кислота, белки, билирубины, щелочная фосфатаза, CPK, АСТ, АЛТ, y-GT, Na, K, холестерин и триглицериды, активации комплемента (с помощью контроля Bb, C5a и C3a). Также проводили анализ мочи (pH, кетоны, лейкоциты, белок, глюкоза, цито-бактериологическое исследование).
[00118] Не отмечалось никаких соответствующих отклонений лабораторных показателей от нормы или изменений в основных показателях состояния организма у какого-либо пациента во время проведения исследования. Существенное увеличение уровней сыворотки в факторах комплемента не было документально подтверждено. Во всех образцах в трех когортах были получены значения менее нижнего предела количественного определения, за исключением одного образца одного пациента из когорты 1 (пациент 5, 7 сутки, 6 часов), результат которого составил 11,2 нг/мл GED0301.
[00119] Не было зарегистрировано серьезных нежелательных явлений. Было зарегистрировано двадцатьпять нежелательных явлений (НЯ) у 11 пациентов, наиболее распространенные явления отмечены как слабые (фиг. 4). Исследователи оценили НЯ как не относящиеся в лечению в 14 (56%) случаях. Одиннадцать из этих 14 НЯ, включая отклонения лабораторных показателей от нормы, были зарегистрированы у 8 пациентов до введения препарата. Связь НЯ с исследуемым препаратом была сочтена маловероятной в 12 случаях (48%), и связь с исследуемым препаратом была сочтена возможной в одном случае (4%). Это было повышение количества триглицеридов в сыворотке во время введения исследуемого препарата. Не было установлено очевидной зависимости «доза-ответная реакция» в НЯ, появившихся во время лечения. У одного пациента когорты 2 произошел слабый рецидив заболевания на 84 сутки, в то время как другой пациент когорты 3 перенес два тяжелых приступа боли в животе и рвоты, требовавших ежедневного лечения стероидами. Один пациент, получивший лечение 80 мг/сутки, перенес повышенное диастолическое давление на 1 сутки, через несколько минут после введения GED0301 и инверсию зубца T (при грудном отведении) на 84 сутки. После проведения тщательного обследования кардиологами, оба этих НЯ были сочтены вторичными к лечению будезонидом, полученному пациентом в течение последних месяцев. У одного пациента, имеющего в анамнезе аллергическое заболевание, был зарегистрирован приступ аллергического ринита на 31 сутки. Это НЯ было легко устранено после введения антигистаминного соединения.
[00120] Независимый комитет по безопасности (с экспертными знаниями в области токсикологии, фармакологического надзора и клинического воспалительного заболевания кишечника) был назначен как для контроля, так и оценки параметров безопасности. На 1 сутки и 7 сутки образцы крови также брали через 0, 2, 6, 12 и 24 часов после введения дозы для проведения фармакокинетического анализа и изолирования мононуклеарной клетки периферической кровь (МКПК). Эффективность лечения была установлена с помощью оценки на различных моментах времени (например, 8, 28, 60 и 90 сутки) количества пациентов, соответствующих критериям ремиссии (CDAI<150) или достигли клинической ответной реакции, определенной уменьшением на 70 единиц или более от исходного значения CDAI.
Пример 2: Экспрессия SMAD7 в кишечных железах и пейеровых бляшках человека
[00121] Образцы кишечника были получены от четырех пациентов с БК, проходящих хирургическое удаление хронически активного заболевания и проявляющих слабую восприимчивость к медицинскому лечению. Эти образцы использовали для анализа SMAD7 посредством иммуногистохимии.
[00122] Тканевые срезы от пациентов с БК вырезали, депарафинизировали и дегидратировали с использованием ксилола и этанола. С целью восстановления антигена, срезы инкубировали в микроволновой печи в течение 10 минут в 0,01 M цитратном буфере, pH 6. Для блокировки эндогенной пероксидазы срезы затем инкубированы в 2% H2O2 в течение 20 минут при комнатной температуре. Инкубацию с мышиным антителом против SMAD7 человека проводили при комнатной температуре в течение 1 часа. После промывания в TRIS-буферизированном физрастворе срезы инкубировали с антимышиным антителом кролика, коньюгированным с пероксидазой хрена в течение 30 минут при комнатной температуре. Иммунореактивные клетки визуализировали с помощью добавления диаминобензадина в качестве субстрата и слегка контрастно окрашивали гематоксилином. В качестве отрицательного контроля тканевые срезы обрабатывали с использованием очищенной, стандартной кроличьей антисыворотки вместо первичного SMAD7 антитела.
[00123] Эти исследования показали, что SMAD7 экспрессируется в кишечных железах и пейеровых бляшках человека (фиг. 5). Данное наблюдение позволяет предположить, что подавление или нокаут SMAD7 с помощью SEQ ID NO: 6 может позволить TGF-бета1 действовать в этих структурах, таким образом, снижая фракцию Т-клеток, экспрессирующих воспалительные цитокины (например, IFN-гамма), и повышая процентное содержание регуляторных Т-клеток (обозначаемых в настоящем документе как Tregs).
Пример 3: Лечение анти-SMAD7 антисмысловым олигонуклеотидом модулирует экспрессию воспалительных цитокинов в культивируемых T-клетках
[00124] Проводили исследование воздействия GED0301 на экспрессию воспалительных цитокинов в культивируемых CCR9-положительных клетках. Для определения воздействия GED0301 экспонирование на CCR9-положительные клетки, МКПК, изолированные от пяти активных стероид-зависимых пациентов с БК, не участвовавших в испытании, ресуспендировали в X-vivo бессывороточной среде для культивирования (Lonza, Venders, Бельгия), дополненной пенициллином (100 Ед/мл) и стрептомицином (100 Ед/мл), и культивировали в присутствии или отсутствии Smad7 антисмыслового (GED0301) или смыслового олигонуклеотида (2 (мкг/мл) в течение 48 часов. Как Smad7 антисмысловые, так и смысловые олигонуклеотиды объединяли с Липофектамином 2000 (Invitrogen, город Карлсбад, штат Калифорния) для способствования эффективной трансфекции культивируемых клеток. Клетки окрашивали и анализировали посредством проточной цитометрии с использованием антитела, направленного против CCR9, β7, IFN-γ и IL17A с целью определения процентного содержания Т-клеток, экспрессирующих либо IFN-γ, либо IL17A в рамках CCR9+ или β7+ популяций при каждом лечении.
[00125] Экспрессию IFN-γ и IL17A в CCR9+ и β7+ популяциях из культивируемых выше МКПК анализировали с целью определения возможности GED0301 напрямую ингибировать экспрессию воспалительных цитокинов в CCR9+ клетках. Лечение МКПК БК с помощью GED0301 (Smad7 антисмыслового) значительно снизило процент IFN-γ и IL-17A-экспрессирующих CCR9+ клеток (фиг. 6A), в то время как фракция цитокин-экспрессирующих β7+ клеток осталась без изменений (фиг. 6B). Например, процентное содержание CCR9+ клеток, экспрессирующих IFN-γ, составило 78,9±7,3 в клетках, не получивших лечение; 78,3±7,3 - в клетках, получивших лечение смысловой цепью; и 54±7,2 - в клетках, получивших лечение с помощью GED0301. Аналогичным образом, процентное содержание CCR9+ клеток, экспрессирующих IL-17A, составило 77,4±7,3 в клетках, не получивших лечение; 74,3±6,4 - в клетках, получивших лечение смысловой цепью; и 53,9±5,7 - в клетках, получивших лечение с помощью GED0301. Для сравнения, процентное содержание не получивших лечение, получивших лечение с помощью смысловых и получивших лечение с помощью GED0301 β7+ клеток, экспрессирующих IFN-γ, составило 13,1±1,2; 11,7±0,7 и 11±0,8, соответственно, и процентное содержание не получивших лечение, получивших лечение с помощь смысловых и получивших лечение с помощью GED0301 β7+ клеток, экспрессирующих IL-17A, составило 12,1±1,5; 10,4±1,2 и 10,6±1,1. Таким образом, прямое экспонирование культивируемых CCR9+ МКПК БК с помощью GED0301 приводит к снижению экспрессии воспалительных цитокинов.
Пример 4: Лечение анти-SMAD7 антисмысловым олигонуклеотидом модулирует экспрессию T-клеточных популяций
[00126] Настоящий пример описывает исследование фракции циркулирующих CCR9+ FoxP3+ T-клеток, CCR9+ IFN-γ+ T-клеток, CCR9+ IL17A+ T-клеток, FoxP3+ T-клеток, IFN-γ+ T-клеток, IL17A+ T-клеток, FoxP3+ CD103+ Т-клеток и интегрин α4β7+ Т-клеток, так как статус активации этих Treg клеточных популяций отражает иммунный ответ, возникающий в железах и пейеровых бляшках кишечника. В этих описанные ниже исследованиях в каждой тестируемой когорте T-клеточные популяции измеряли с 0 суток для определения исходного измерения для каждого пациента. GED-0301 вводили, как описано выше в примере 1, в течение 7 суток, и T-клеточные популяции измеряли снова на 8 сутки, 28 сутки и для некоторых клеточных популяций на 84 сутки.
[00127] Манипуляция периферического пула Tregs является объектом особенного внимания для лечения иммуно-опосредованных заболеваний и трансплантации. Предыдущие исследования показали, что количество Tregs периферической крови
можно увеличить с помощью антител против ФНО антител, и такое увеличение заметно только у пациентов, проявляющих восприимчивость к терапиям анти-ФНО-альфа. Воздействие анти-ФНО-альфа терапии на Tregs может быть опосредовано TGF-бета1.
[00128] Воздействие терапии SMAD7 антисмысловым олигонуклеотидом исследовали для определения возможности положительной регуляции терапии SMAD7 антисмысловым олигонуклеотидом количества Tregs в результате усиленной активности TGF-бета1. Также изучали воздействие SMAD7 антисмысловой терапии для определения возможности возникновения изменений в количестве циркулирующих FoxP3+ Tregs в результате такого лечения и возможности связи воздействия с изменениями в процентном содержании эффекторных Th1/Th17 клеток.
[00129] Кроме того, CCR9+ Т-клетки содержатся в большом количестве в периферическом кровоообращении пациентов с болезнью Крона и обладают характеристиками T-клеток слизистой, включая активацию фенотипа, восприимчивость к активации CD2, и способность создавать как воспалительные (например, IFN-гамма), так и регуляторные (например, IL10) цитокины. Также проводилось исследование воздействия SMAD7 антисмысловой терапии для определения возможности такого лечения изменять количество циркулирующих CCR9+ клеток.
[00130] Для изолирования МКПК и проведения анализа проточной цитометрии, образцы крови (10 мг) собирали в гепарин-содержащие пробирки, разбавляли с помощью RPMI 1640 (1:1) и отделяли центрифугированием в градиенте плотности Фиколл-Пака. Для этой цели трубки центрифугировали со скоростью 1800 об./мин. в течение 30 минут, и полученные МКПК собирали и дважды промывали в RPMI 1640.
[00131] МКПК ресуспендировали в RPMI 1640, дополненном 10% инактивированной эмбриональной бычьей сывороткой, пенициллином (100 Ед/мл) и стрептомицином (100 мг/мл). Клетки были фенотипически охарактеризованы посредством проточной цитометрии с использованием следующих антител: меченых аллофикоцианином против CCR9 человека и меченых фикоэритрином против Foxp3 человека. Все антитела использовали при окончательном титре 1:50.
[00132] МКПК были также посеяны в 96-луночные с U-образным дном планшеты для культивирования, и стимулированы форбол 12-миристат 13-ацетатом (PMA, 10 нг/мл), иономицином (1 мг/мл) и брефелдином A (10 мг/мл). Через 5 часов клетки окрашивали для CCR9 экспрессии с использованием вышеуказанных антител, а также для IFN-гамма и IL-17A с использованием следующих антител: флуоресцирующее антитело к IFN-гамма человека, Alexa Fluor 647 антитело к IL-17A человека и фикоэритриновое антитело к IL17A человека. Все антитела использовали при окончательном титре 1:50. Соответствующий изотип контроль был включен во все эксперименты. Флуоресцирующее антитело к IFN-гамма человека получали от Beckton Dickinson и все другие антитела, использованные в настоящем документе, получали от EBiosciences.
[00133] Выраженные значения являются срединными, и различия между группами сравнивали с использованием U-критерия Манна. Статистическую значимость (p<0,05) определяли с использованием теста согласованных пар Уилкоксона.
[00134] Проводилось исследование воздействия GED0301 лечения на фракцию воспалительных/контррегуляторных лимфоцитов. GED0301 лечение существенно не изменило процентное содержание циркулирующих CD3+, CD4+, CD8+, CD25+, CD161+, CD62L+, α4β7+ или CCR9+ клеток согласно контролю, проведенному на 8 и 28 сутки испытания (фиг. 7). Аналогичным образом, не наблюдалось существенных изменений во фракции интерлейкина клеток (IL)-17A+, клеток IL-10+, клеток FoxP3+, клеток α4β7+, экспрессирующих интерферон (IFN)-γ- и IL-17A или клеток CD103+, экспрессирующих FoxP3 после GED0301 лечения.
[00135] В таблицах I и Ia представлены результаты когорты 1, получившей 40 мг GED-0301/сутки в течение 7 суток.
В таблице I показано процентное содержание конкретной T-клеточной популяции во всей клеточной популяции на 0, 8, 28 сутки. В таблице Ia показано процентное содержание CCR9+ FoxP3+ T-клеток, FoxP3+ Т-клеток и CD103+ FoxP3+ Т-клеток во всей клеточной популяции на 0, 8, 28 и 84 сутки.
[00136] В таблице II представлены результаты когорты 2, получившей 80 мг GED-0301/сутки в течение 7 суток. В таблице II показано процентное содержание конкретной T-клеточной популяции во всей клеточной популяции на 0, 8 и 28 сутки. В таблице IIa показано процентное содержание CCR9+ FoxP3+ T-клеток, FoxP3+ Т-клеток и CD103+ FoxP3+ Т-клеток во всей клеточной популяции на 0, 8, 28 и 84 сутки.
[00137] В таблице III приведены результаты когорты 3, получившей 160 мг GED-0301/сутки в течение 7 суток. В таблице III показано процентное содержание конкретной T-клеточной популяции во всей клеточной популяции на 0, 8 и 28 сутки. В таблице IIIa показано процентное содержание CCR9+ FoxP3+ T-клеток, FoxP3+ Т-клеток и CD103+ FoxP3+ Т-клеток во всей клеточной популяции на 0, 8, 28 и 84 сутки.
[00138] В таблице IV приведены объединенные результаты всех пациентов в когортах 1-3. В таблице IV показано процентное содержание конкретной T-клеточной популяции во всей клеточной популяции на 0, 8 и 28 сутки. В таблице IVa показано процентное содержание CCR9+ FoxP3+ T-клеток, FoxP3+ Т-клеток и CD103+ FoxP3+ Т-клеток во всей клеточной популяции на 0, 8, 28 и 84 сутки.
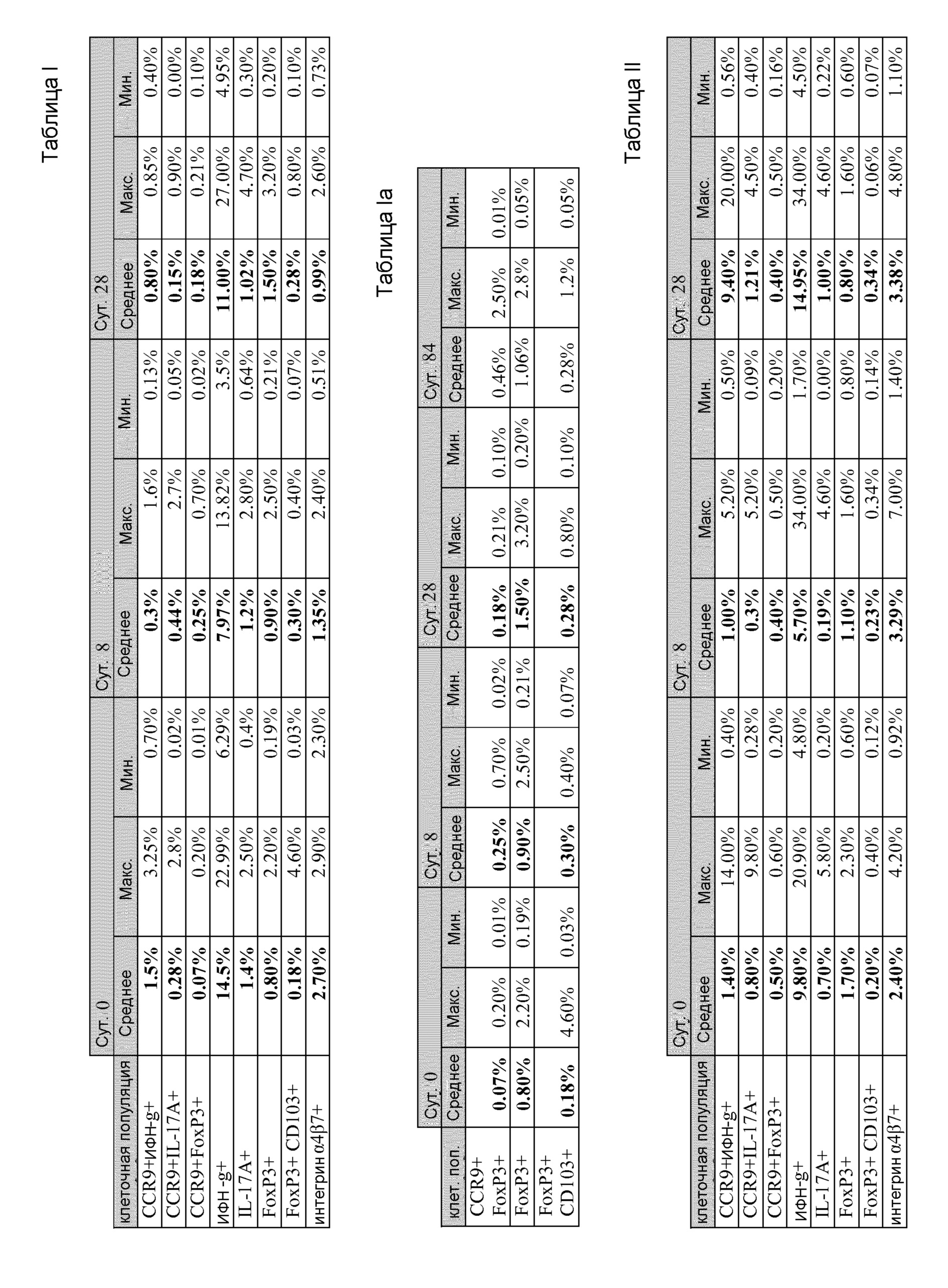
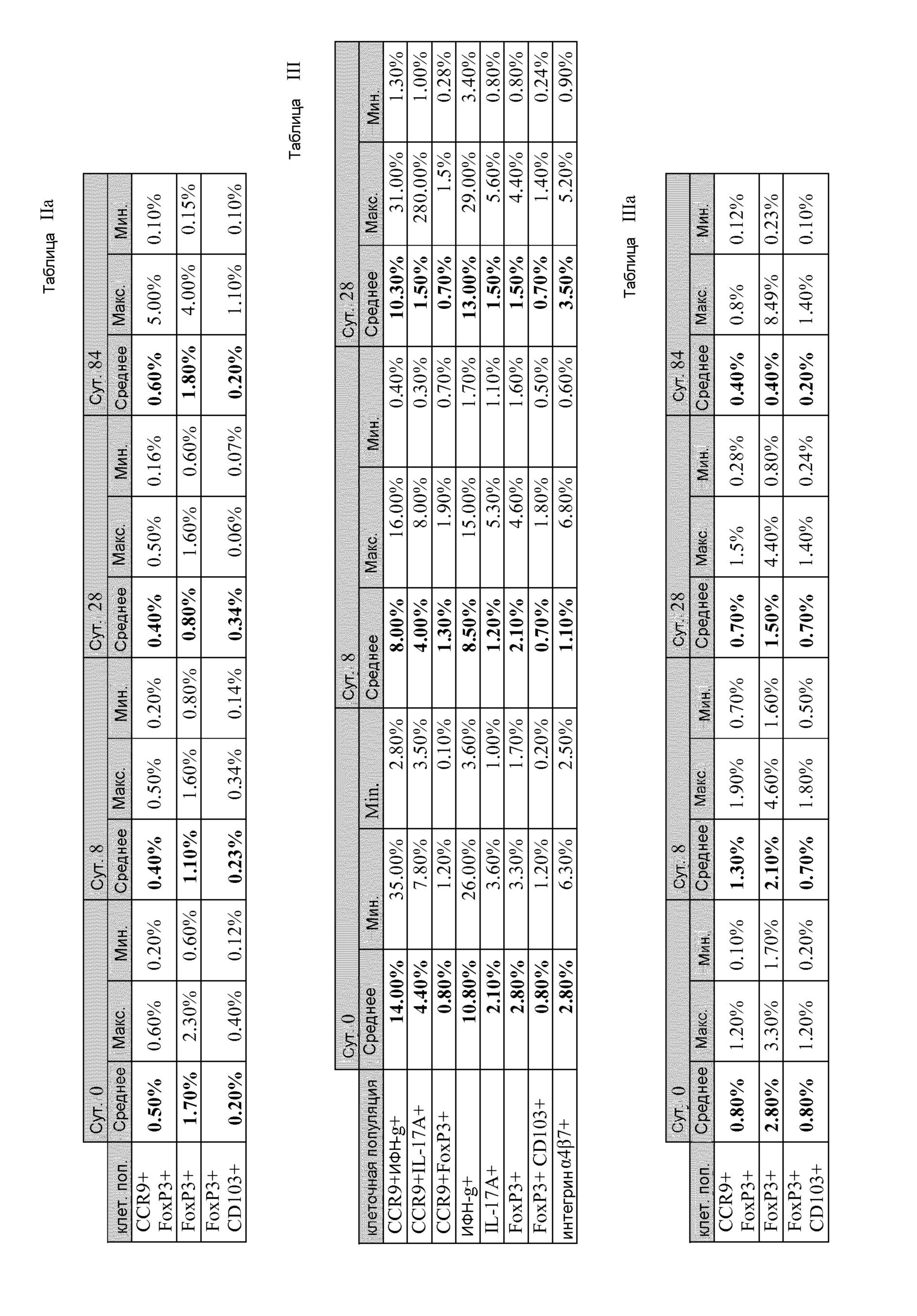
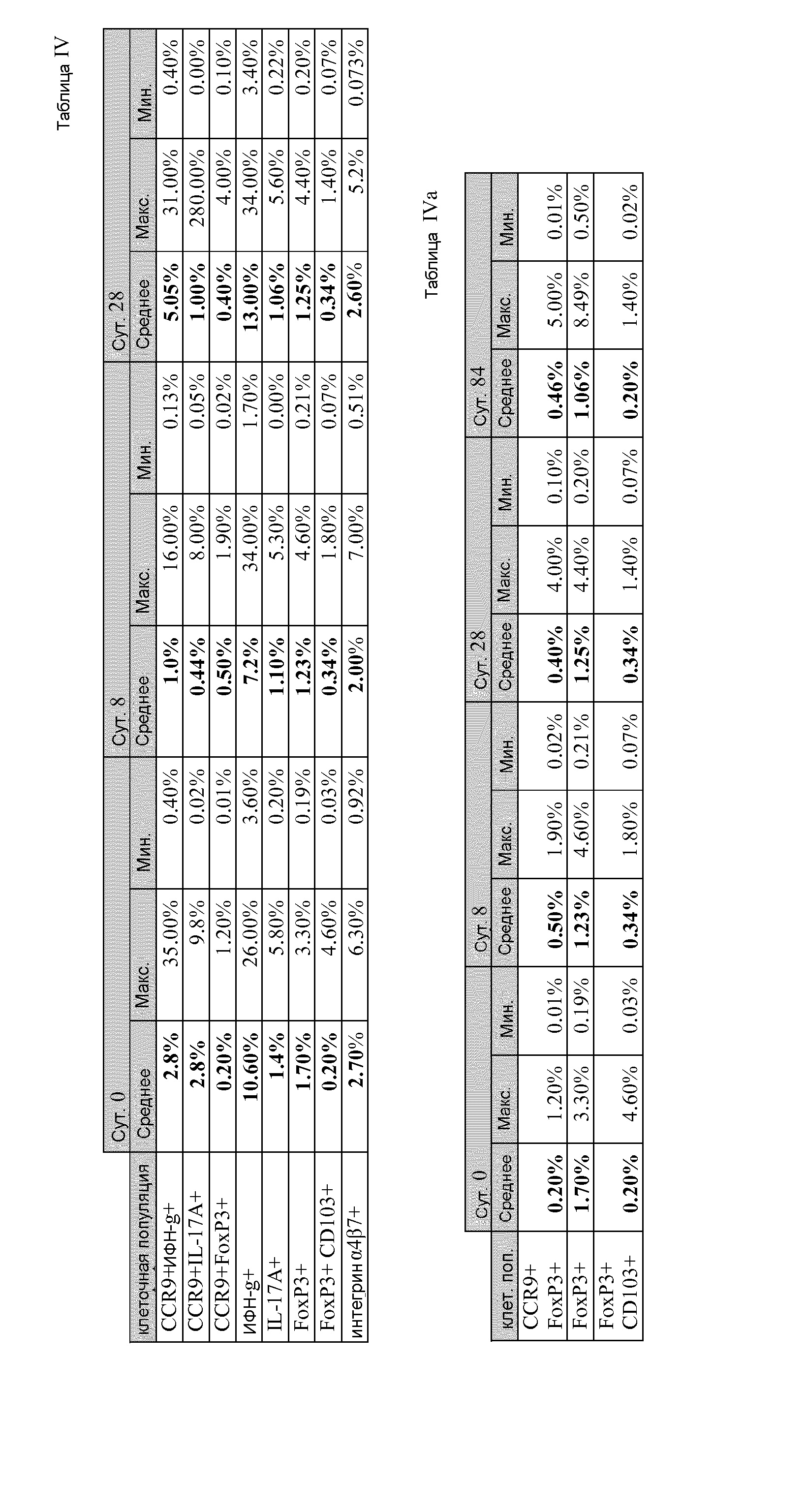
[00139] Как показано в каждой из приведенных выше таблиц, значительное уменьшение T-клеточных популяций, экспрессирующих CCR9+ IFN-γ+, наблюдалось на 8 сутки (например, в таблице IV показана экспрессия 2,8% на 0 сутки и экспрессия 1,0% на 8 сутки; см. Фиг. 8B).
[00140] Уменьшение CCR9+IL17A+ T-клеточных популяций также наблюдалось (например, в таблице IV показана экспрессия 2,8% на 0 сутки и экспрессия 0,44% на 8 сутки; см. Фиг. 8D). Значительное уменьшение с 0 суток также наблюдалось на 28 сутки в CCR9+ IL17A+ T-клеточных популяциях (например, в таблице IV показана экспрессия 1,00% на 28 сутки;
см. Фиг. 8D). Уменьшение все еще присутствовало на 84 сутки (средняя экспрессия 1%; диапазон 0,08%-4,8%).
[00141] Увеличение CCR9+ FoxP3+ T-клеточных популяций наблюдали с 8 суток по 84 сутки (например, в таблице IV показана экспрессия 0,2% на 0 сутки и экспрессия 0,5% на 8 сутки; см. Фиг. 8F).
[00142] Значительное уменьшение IFN-γ+ T-клеточных популяций наблюдалось на 8 сутки (например, в таблице IV показана экспрессия 10,6% на 0 сутки и экспрессия 7,2% на 8 сутки; см. Фиг. 8A).
[00143] Также наблюдалось уменьшение IL17A+ T-клеточных популяций (например, в таблице IV показана экспрессия 1,4% на 0 сутки и экспрессия 1,1% на 8 сутки; см. Фиг. 8C).
[00144] Уменьшение FoxP3+ T-клеточных популяций также наблюдалось на 8 сутки (например, в таблице IV показана экспрессия 1,7% на 0 сутки и экспрессия 1,23% на 8 сутки; см. Фиг. 8E).
[00145] Никаких изменений не наблюдалось в FoxP3+ CD103+ T-клеточных популяциях (например, в таблице IV показана экспрессия 0,2% на 0 сутки и экспрессия 0,34% на 8 сутки) и интегрин α4β7 T-клеточных популяциях (например, в таблице IV показана экспрессия 2,7% на 0 сутки и экспрессия 2% на 8 сутки).
[00146] Согласно результатам, приведенным в таблицах I-IV, ингибирование SMAD7 с помощью GED-0301 у пациентов с БК модулирует экспрессию определенных T-клеточных популяций. В частности, авторы наблюдали отрицательную регуляцию (**снижение, снижение экспрессии, подавление**) CCR9+ IFN-γ+ T-клеточных, CCR9+IL17A+ T-клеточных, FoxP3+ T-клеточных, IFN-γ+ T-клеточных и IL17A+ T-клеточных популяций после GED-0301 лечения на 8 сутки и положительную регуляцию (**повышение экспрессии, стимуляция**) CCR9+ FoxP3+ T-клеточных популяций после GED-0301 лечения на 8 сутки. Также возникла отрицательная регуляция CCR9+IL17A+ T-клеточных популяций после GED-301 лечения на 28 сутки (например, по сравнению с 0 сутками). Результаты, приведенные в таблицах I- IV, позволяют предположить, что ингибирование SMAD7 с помощью GED-0301 у пациентов с БК снижает синтез цитокинов Th1 и восстанавливает предрасположенность эффекторных Т-клеток к иммуносупрессии, опосредованной регуляторными Т-клетками(Tregs). Это соответствует показателю того, что TGF-бета1 является сильным ингибитором ответных реакций клетки Th1, и ключевым посредником периферийной дифференцировки и активности T regs.
[00147] Значения CDAI также измеряли у пациентов в каждой из трех когорт, рассмотренных выше.
Исходные значения CDAI измеряли на 0 сутки и измеряли снова на 1, 4, 8, 28 и 84 сутки лечения.
В таблицах V-VII представлены значения CDAI представителей пациентов каждой из когорт 1-3, соответственно.
X. Как показано в приведенной ниже таблице V, у пациентов когорты 1, получавших 40 мг GED-0301 в течение 7 суток, отмечалось снижение значения CDAI к 4 суткам лечения, которое сохранялось на протяжении всего периода контроля (84 суток).
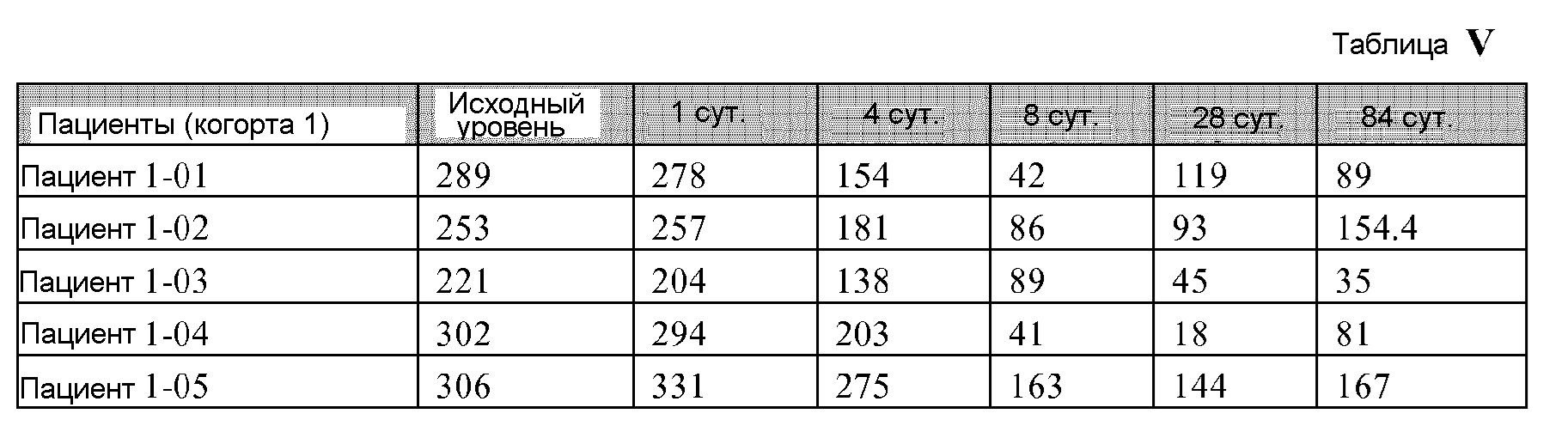
[00148] Как показано в приведенной ниже таблице VI, у пациентов когорты 2, получавших 80 мг GED-0301 в течение 7 суток, отмечалось снижение значения CDAI к 4 суткам лечения, которое сохранялось на протяжении всего периода контроля (84 суток).
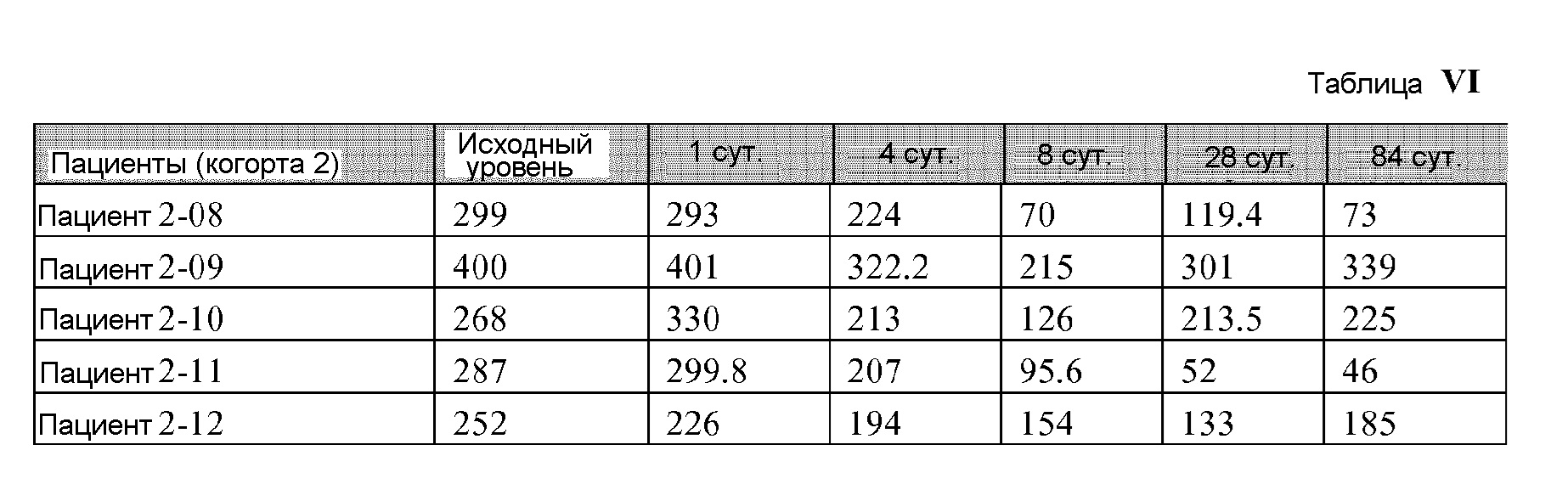
[00149] Как показано в приведенной ниже таблице VII, у пациентов когорты 3, получавших 160 мг GED-0301 в течение 7 суток, отмечалось уменьшение значения CDAI к 4 суткам лечения, которое сохранялось на протяжении всего периода контроля (84 суток).
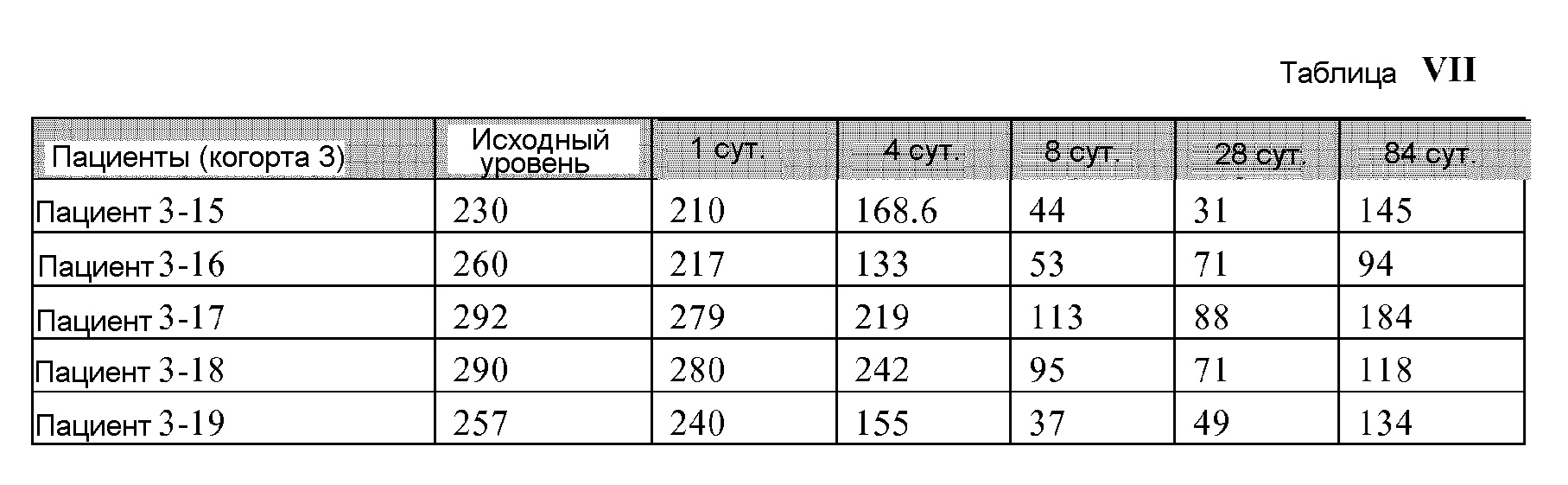
[00150] Согласно результатам, приведенным в таблицах V-VII, лечение с использованием GED-0301 снижает значения CDAI у пациентов c болезнью Крона. При включении среднее значение индекса активности болезни (CDAI) всех пациентов составляло 287 (221-400) (фиг. 9). Среднее значение CDAI составляло 289 (диапазон 221-306) у пациентов когорты 1, 287 (диапазон 252-400) - у пациентов когорты 2 и 287 (диапазон 221-400) - у пациентов когорты 3. Во всех трех когортах пациенты проявляли восприимчивость к лечению (например, снижение на 70 единиц или больше от исходного значения CDAI наблюдалось у каждого пациента), так что на 8 сутки у всех 15 пациентов отмечалось снижение значения CDAI, и 12/15 пациентов из когорты 1-3 вошли в ремиссию (т.е., значение CDAI <150). (Таблицы V-VII). В особенности 4/5 пациентов когорты 1, 3/5 пациентов когорты 2 и 5/5 пациентов когорты 3 имели значение CDAI <150 (таблицы V-VII). На 28 сутки клиническая ответная реакция была также очевидна у всех 15 пациентов (таблицы V-VII), и произошло существенное снижение значения CDAI по сравнению с исходным (P<0,0001). Клиническая ремиссия на 28 сутки была зарегистрирована у 13/15 пациентов (86%) (5/5 в когорте 1, 3/5 в когорте 2 и 5/5 в когорте 3) (Таблицы V-VII). На 84 сутки общее значение CDAI было значительно ниже по сравнению с измеренным исходным (таблицы V-VII, P<0,0001), и 9/15 (60%) пациентов все еще находились в ремиссии. В частности, это отмечалось у 3 пациентов когорты 1, 2 пациентов когорты 2 и 4 пациентов когорты 3 (таблицы V-VII). Значительное уменьшение значения CDAI от исходного к 8, 28 и 84 суткам отмечалось, даже когда анализ проводили в каждой когорте (фиг. 9). Результаты позволяют предположить, что имеется соответствие между индукцией ремиссии и/или улучшенного результата и T-клеточными субпопуляциями. Кроме того, значения CDAI, наблюдаемые 84 суткок, показывают увеличение от более ранних моментов времени (например, 8 и 28 суток), что указывает на соответствующие колебания в определенных T-клеточных популяциях на 84 сутки (например, увеличение CCR9+ FoxP3+ T-клеточных популяций с 0 суток по 8 сутки, но на 84 сутки появляется уменьшение данной популяции Т-клеток).
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00151] Раскрытие в полной мере каждого из патентных документов и научных статей, использованных в настоящем документе, включено посредством ссылки для всех целей.
ЭКВИВАЛЕНТЫ
[00152] Изобретение может быть осуществлено в других особых формах с отступлением от его существенных характеристик. Указанные выше варианты осуществления, таким образом, следует считать иллюстративными нежели ограничивающими изобретение, описываемое в настоящем документе. Объем изобретения указан в приложенной формуле изобретения нежели указанным выше описанием, и все изменения, возникающие в рамках значения и диапазона эквивалентности, предназначены для охвата в рамках настоящего документа.