Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ ДИАБЕТА И/ИЛИ УЛУЧШЕНИЯ ВЫЖИВАНИЯ ПАНКРЕАТИЧЕСКИХ ОСТРОВКОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет по патентной заявке США 61/625904, поданной 18 апреля 2012 г., полное содержание которой включено сюда посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем смысле относится к антисмысловым олигонуклеотидам к SMAD7 и их применениям для лечения и/или предотвращения диабета и/или для улучшения выживания клеток панкреатических островков после трансплантации.
УРОВЕНЬ ТЕХНИКИ
Диабет является метаболическим заболеванием, характеризующимся высокими уровнями сахара в крови. Двумя наиболее распространенными типами диабета являются сахарный диабет 1 типа и сахарный диабет 2 типа. Диабет 1 типа, или инсулинозависимый сахарный диабет, представляет собой хроническое аутоиммунное заболевание, характеризующееся распространяющейся потерей бета-клеток панкреатических островков, которые вырабатывают инсулин. Диабет 2 типа или инсулиннезависимый сахарный диабет, развивается, когда клетки мышц, жира и печени не могут нормально отвечать на инсулин (инсулинорезистентность). В частности, диабет 2 типа стал эпидемией, обусловленной увеличением ожирения и малоподвижного образа жизни и общим старением популяции во многих странах. В недавней клинической практике стало все труднее отличить сахарный диабет 1 типа от сахарного диабета 2 типа, поскольку многие дети с сахарным диабетом 1 типа имеют избыточный вес при диагностике, и у значительной части молодых людей с диагностируемым терапевтом сахарным диабетом 2 типа есть признаки аутоиммунного заболевания поджелудочной железы (Badaru, A. and Pihoker, C. “Type 2 diabetes in childhood: clinical characteristics and role of beta-cell autoimmunity,” Curr. Diab. Rep., 2012, 12, 75-81). В 2011 г. более 346 миллионов человек по всему миру болели диабетом.
Недавние исследования показали, что TGF-β (Трансформирующий фактор роста β, transforming growth factor β (TGF-β)) играет роль в функционировании панкреатических островков и развитии диабета (Moritani, M. et al. “Abrogation of autoimmune diabetes in nonobese diabetic mice and protection against effector lymphocytes by transgenic paracrine TGF-β1,” J. Clin. Invest., 1998, 102, 499-506; Olivieri, A. et al. “Serum transforming growth factor β1 during diabetes development in non-obese diabetic mice and humans,” Clin. Exp. Immunol., 2010, 162, 407-414). Например, было показано, что специфичная для островков импульсная экспрессия TGF-β на протяжении одной недели откладывает развитие диабета у мышей NOD (Wållberg, M. et al. “An islet-specific pulse of TGF-β abrogates CTL function and promotes β cell survival independent of Foxp3+ T cells,” J. Immunol., 2011, 186, 2543-2551), широко применяемой животной модели диабета 1 типа (Roep, B.O. et al. “Satisfaction (not) guaranteed: re-evaluating the use of animal models of type 1 diabetes,” Nat. Rev. Immunol., 2004, 4, 989-997). TGF-β1 был эффективным не только в лечении диабета у мышей NOD с диабетом и в ингибировании деструктивного аутоиммунного заболевания островков, но также в стимуляции регенерации островков (Luo, X. et al. “Systemic transforming growth factor-β1 gene therapy induces Foxp3+ regulatory cells, restores self-tolerance, and facilitates regeneration of beta cell function in overtly diabetic nonobese diabetic mice,” Transplantation, 2005, 79, 1091-1096). Следовательно, терапевтические вмешательства по ходу данного пути способны не только остановить прогрессию заболевания, но могут даже восстановить функцию (т.е. адекватный уровень выработки инсулина) после начала гипергликемии.
TGF-β 1-3 участвуют в разнообразных биологических функциях, включающих рост клеток, развитие органов, фиброгенез и регуляцию иммунных клеток. TGF-β1 является доминирующим среди экспрессирующихся в клетках иммунной системы, и в настоящее время он считается определяющим регулятором иммунных ответов, которые могут угнетать Т-клеточный ответ (Li, M.O. and Flavell, R.A. “TGF-beta: a master of all T cell trades,” Cell, 2008, 134, 392-404). В частности, TGF-β1 связывается с гетеродимерным трансмембранным серин/треониновым киназным рецептором, содержащим две субъединицы, TGF-β1 R1 и TGF-β1 R2. При связывании лиганда рецептор TGF-β1 R1 фосфорилируется конститутивно активным рецептором TGF-β1 R2, и сигнал передается в ядро белками, относящимися к семейству SMAD. Активированный TGF-β1 R1 напрямую фосфорилирует белки SMAD2 и SMAD3, которые затем взаимодействуют с SMAD4. Комплекс SMAD2/SMAD3/SMAD4 перемещается в ядро и регулирует транскрипцию определенных генов. SMAD7 является другим членом этого белкового семейства, который действует как общий антагонист TGF-β по механизмам отрицательной обратной связи (Yan, X. and Chen, Y.G. “Smad7: not only a regulator, but also a cross-talk mediator of TGF-beta signalling,” Biochem. J., 2011, 434, 1-1).
Исследования показали, что SMAD7 играет роль в диабете и функционировании β-клеток. Было показано, что внутриклеточный белок SMAD7 мешает связыванию SMAD2/SMAD3 с TGF-β R1, предотвращая фосфорилирование и активацию этих белков, приводя к ингибированию TGF-β1-опосредованной передачи сигнала. Было показано, что экспрессия SMAD7 в β-клетках поджелудочной железы нарушает передачу сигнала через TGF-β и вызывает обратимый сахарный диабет (Smart, N.G. et al. “Conditional expression of Smad7 in pancreatic beta cells disrupts TGF-beta signaling and induces reversible diabetes mellitus,” PLoS Biol., 2006, 4, e39). Более того, результаты, полученные на мышах NOD, тоже указывают на участие путей передачи сигнала через Smad2 и TGF-β в активированных дендритных клетках при развитии диабета, и существуют свидетельства, полученные в полногеномных исследованиях ассоциаций у человека, подтверждающие роль Smad7 в диабете 1 типа человека (Hook, S.M. et al. “Smad2: A candidate gene for the murine autoimmune diabetes locus Idd21.1,” J. Clin. Endocrinol. Metab., 2011, 96, E2072-E2077). Поскольку было показано, что TGF-β1 вносит вклад в подавление выработки цитокинов, ингибирование Т-клеточного ответа и индукцию регуляторных Т-клеток (Трег) (Kawamoto, K. et al. “Transforming growth factor beta 1 (TGF-β1) and rapamycin synergize to effectively suppress human T cell responses via upregulation of FoxP3+ Tregs,” Transpl. Immunol., 2010, 23, 28-33), регуляция SMAD7 также может способствовать трансплантации островков, поддерживая функцию трансплантата, ограничивая токсичность и предотвращая иммунное отторжение.
Таким образом, существует нереализованная потребность в новых видах терапии диабета и трансплантации панкреатических островков.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрытые способы частично основаны на открытии специфических ингибиторов экспрессии или функции SMAD7, например, антисмысловых олигонуклеотидов к SMAD7, которые ингибируют SMAD7 и таким образом восстанавливают передачу сигнала через TGF-β. Примеры антисмысловых олигонуклеотидов к SMAD7 включают, например, SEQ ID No: 5 или SEQ ID NO: 6, которые можно применять в фармацевтической композиции. Описанные ингибиторы SMAD7 можно применять для лечения и/или предотвращения диабета, например, диабета 1 типа, диабета 2 типа и гестационного диабета. Антисмысловые олигонуклеотиды к SMAD7 также можно применять для улучшения выживания клеток панкреатических островков после трансплантации.
Вышеизложенные аспекты и варианты применения настоящего изобретения можно более полно понять, обратившись к следующим фигурам, подробному описанию и формуле изобретения. В данном контексте «включая» означает «без ограничений», и приведенные примеры не являются ограничивающими.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 (А) представляет нуклеотидную последовательность SMAD7 (SEQ ID NO: 1) и (B) представляет аминокислотную последовательность SMAD7 (SEQ ID NO: 2).
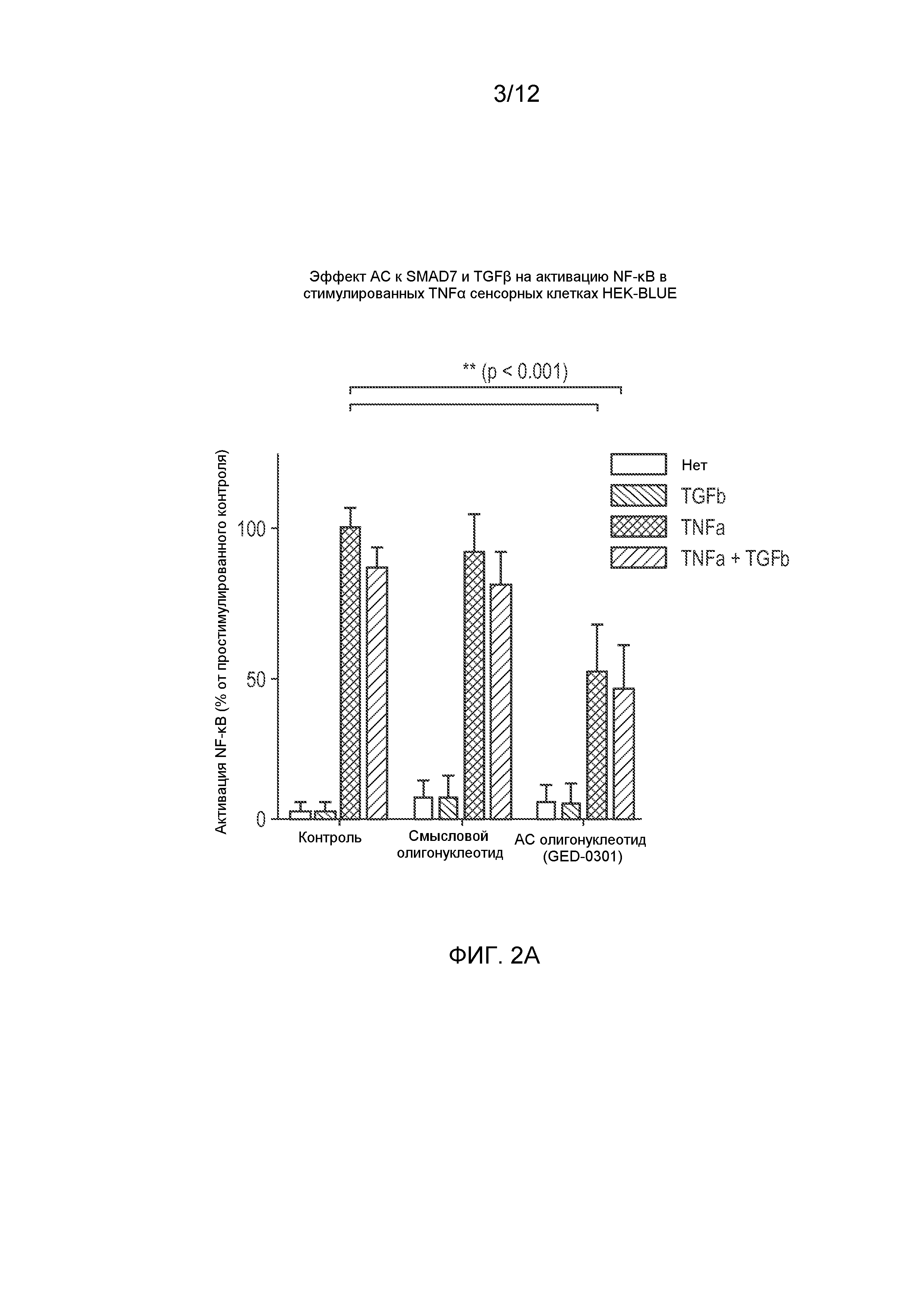
Фиг. 2 (А) представляет собой график, показывающий эффекты TGFβ и GED-0301 (антисмыслового нуклеотида к SMAD7, SEQ ID NO: 6) на активацию NF-κB в TNF-α-сенсорных клетках HEK-Blue, и (B) представляет собой график, показывающий эффекты TGFβ и GED-0301 на активацию NF-κB в CD40L-сенсорных клетках HEK-Blue, обработанных TNF-α и CD40L, соответственно.
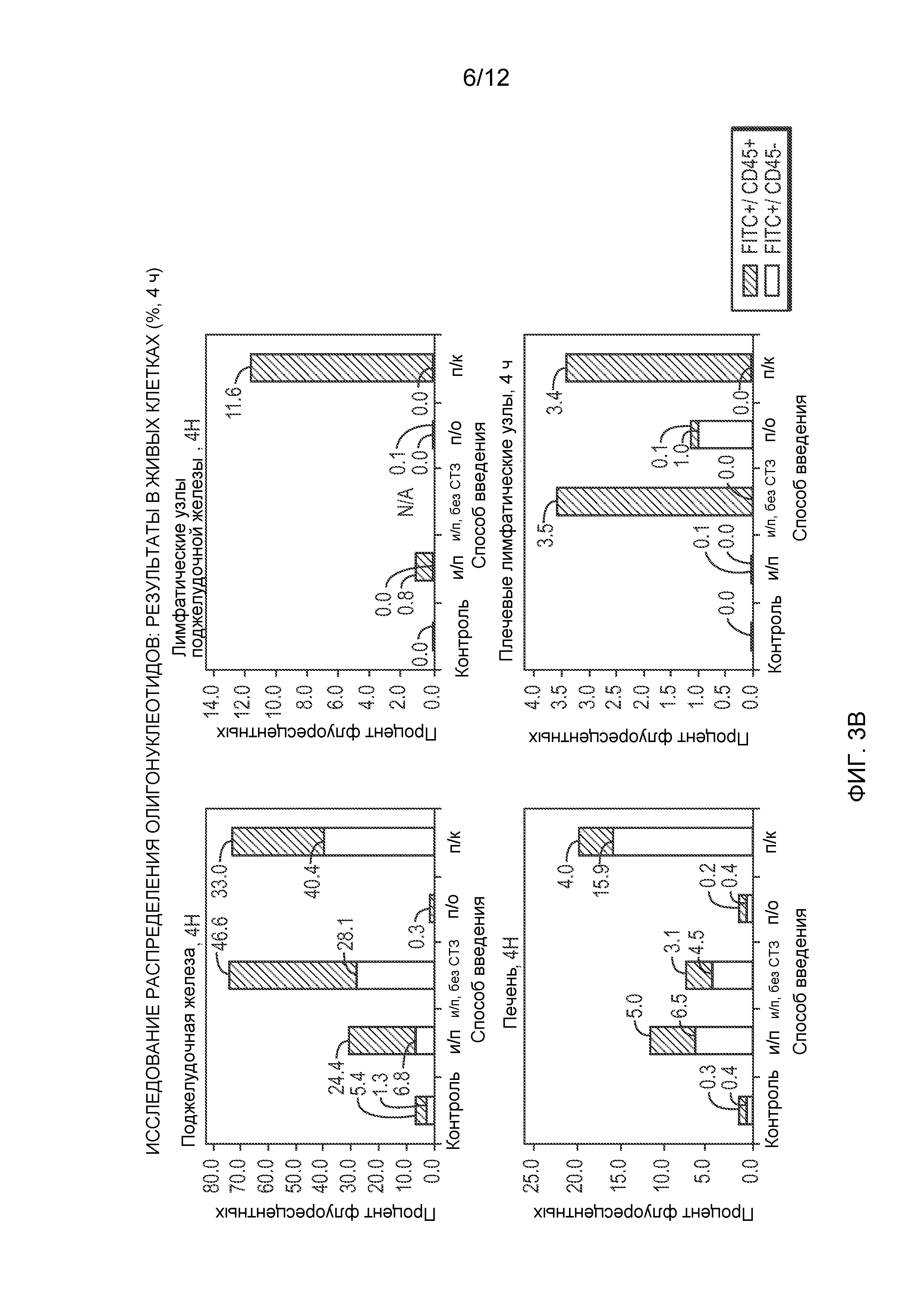
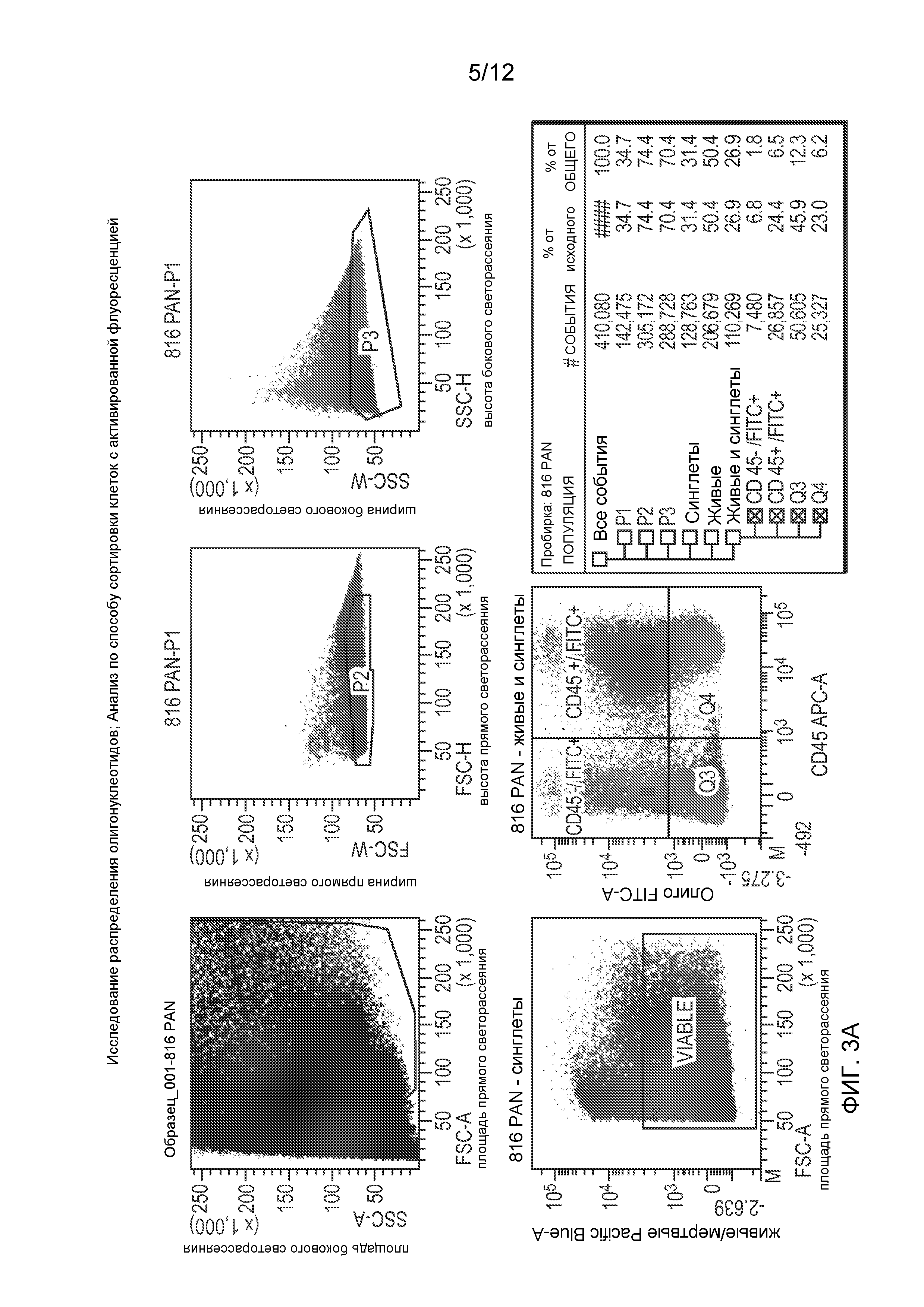
Фиг. 3 (А) представляет собой панель, показывающую способ установки дискриминационного окна, применяющийся для анализа результатов проточной цитометрии по органоспецифичному поглощению флуоресцентно меченого GED-0301 после введения мышам разными путями, и Фиг. 3 (В) показывает соответствующий процент поглощения (FITC+) в живых клетках в тканях указанных органов.
Фиг. 4 представляет собой многоканальное микроскопическое изображение высокого разрешения, показывающее срезы поджелудочной железы контрольной мыши и мыши, которой подкожно вводили меченный флуоресцеином GED-0301 (через 4 часа после введения). Цветовое обозначение: зеленый - флуоресцентный GED-0301, серый - DAPI (маркер клеточного ядра), красный - инсулин (указывающий на вырабатывающие инсулин β-клетки) и синий - CD45 (указывающий на CD45 или общий лейкоцитарный антиген, LCA, маркер лейкоцитов, элементов кровеносной системы, которые включают клетки иммунитета и воспаления).
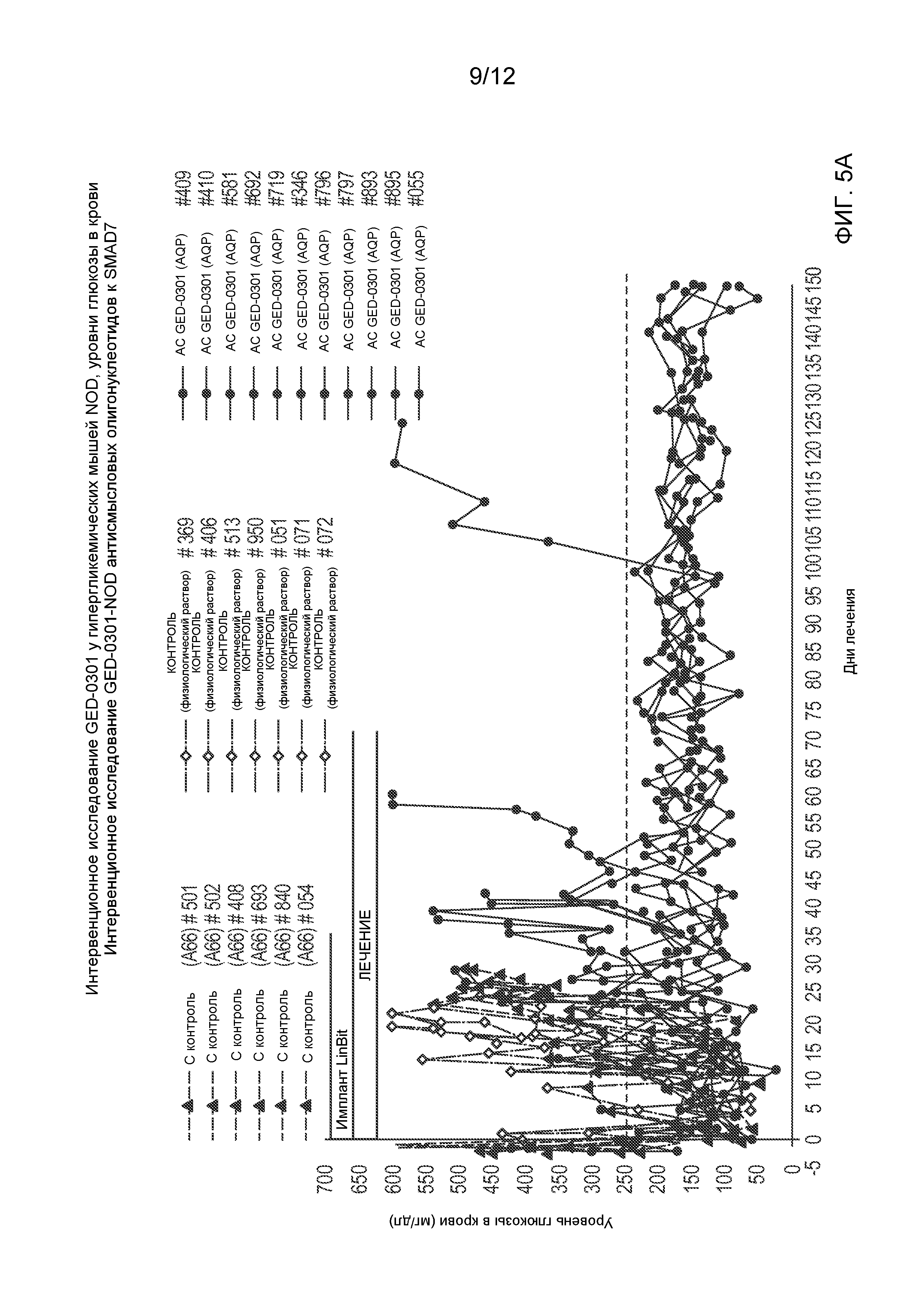
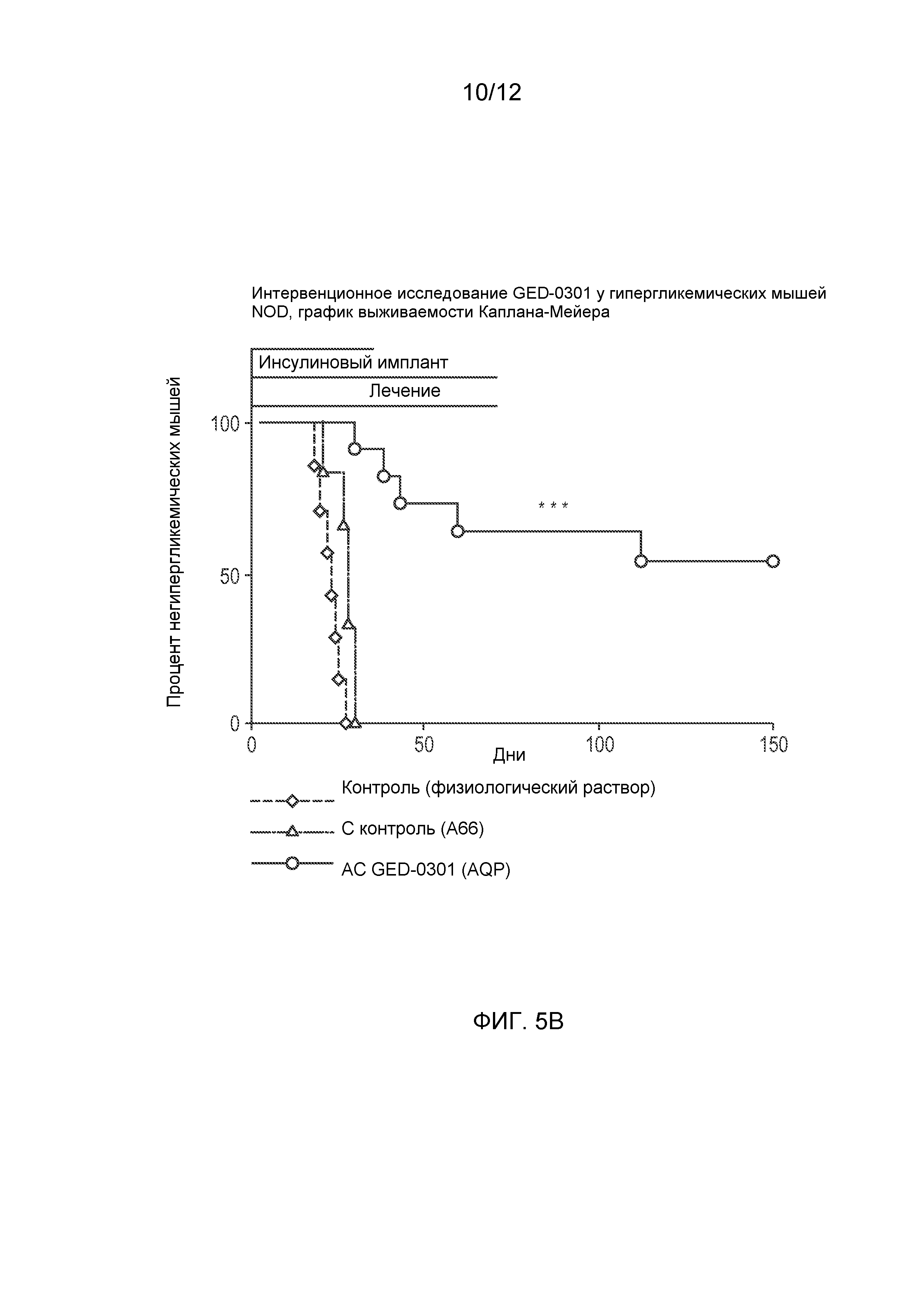
Фиг. 5 (А) представляет собой график, показывающий уровни глюкозы в крови у мышей NOD, обработанных антисмысловым олигонуклеотидом к SMAD7 GED-0301 (АС GED-0301), соответствующим смысловым контролем (С контроль) и физиологическим раствором (Контроль) (125 мкг/животное, подкожно (п/к), ежедневно) после начала гипергликемии, и Фиг. 5 (В) представляет собой соответствующую кривую выживаемости Каплана-Мейера, показывающую процент животных, остающихся без диабета, в зависимости от времени.
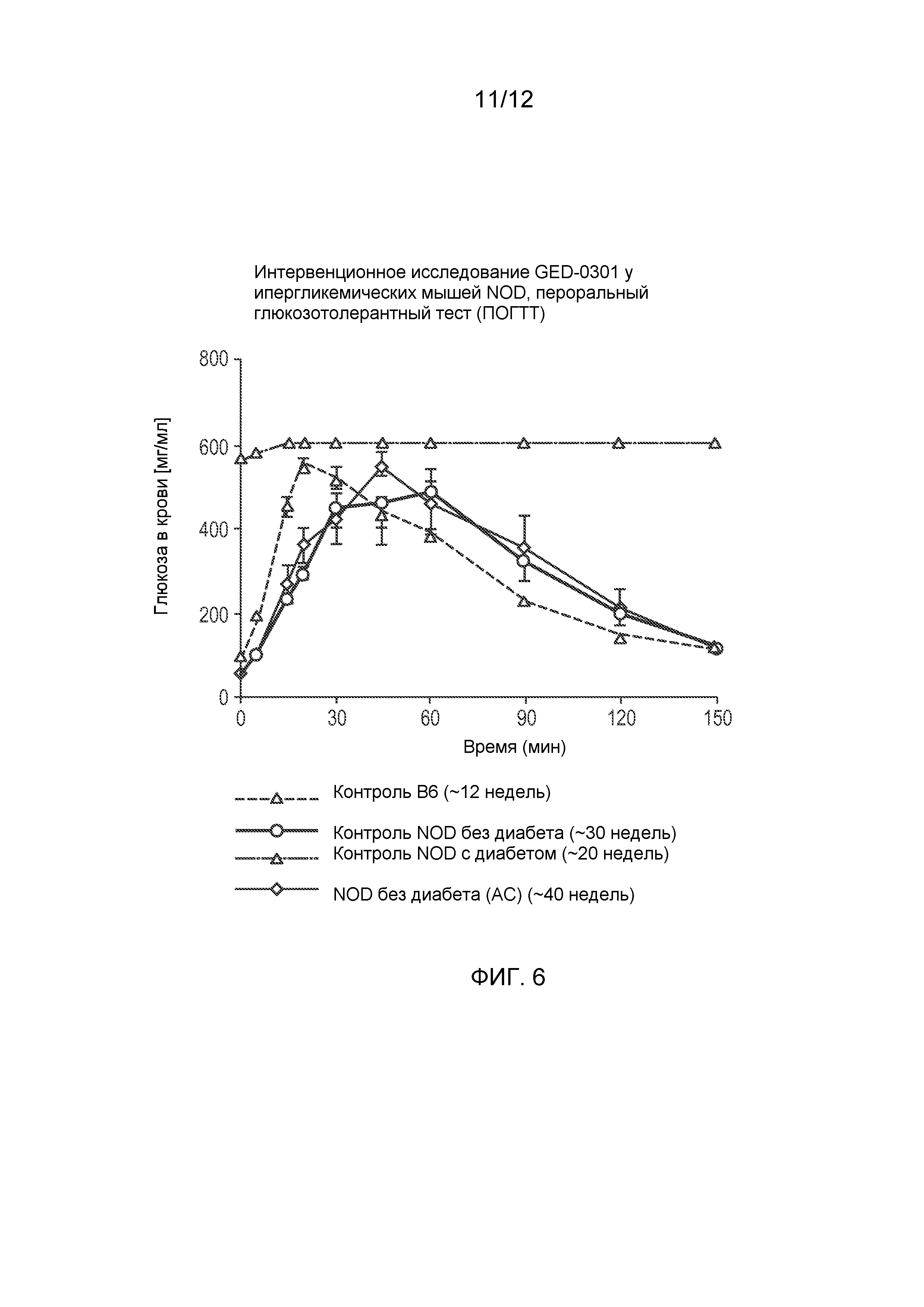
Фиг. 6 представляет собой график, сравнивающий результаты перорального глюкозотолерантного теста, проведенного у обработанных GED-0301 мышей NOD, которые не заболели диабетом к концу исследования (день 150), и у контрольных мышей.
Фиг. 7 показывает многоканальные Z-стопки конфокально-микроскопических изображений высокого разрешения, сравнивая репрезентативные содержащие островки срезы поджелудочной железы из обработанных GED-0301 мышей NOD, которые не заболели диабетом к концу исследования (день 150), и соответствующих контролей. Цветовое обозначение: синий - DAPI (маркер клеточного ядра), красный - инсулин (указывающий на вырабатывающие инсулин β-клетки) и зеленый - глюкагон (указывающий на вырабатывающие глюкагон α-клетки).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее раскрытие изобретения в общем смысле относится к антисмысловым нуклеотидам к SMAD7 и их применению для лечения и/или предотвращения диабета и/или улучшения выживания клеток панкреатических островков после трансплантации.
Анти-SMAD7 терапия
Описанные способы относятся к применению специфичного ингибитора SMAD7, выбранного из группы, состоящей из малых связывающих молекул, например, естественных или синтетических соединений, антител, аптамеров, интрамеров, антисмысловых молекул для РНК-интерференции (двухцепочечных РНК, киРНК (коротких интерферирующих РНК)) и анти-SMAD7 антисмысловых молекул для лечения и/или предотвращения диабета и/или для улучшения выживания клеток панкреатических островков после трансплантации. Ингибиторы SMAD7 также могут включать укороченные и/или мутантные молекулы SMAD7, которые влияют на с SMAD7 и которые таким образом ингибируют функцию SMAD7.
Например, анти-SMAD7 терапия включает целевые терапии против SMAD7 (например, анти-SMAD7 антисмысловые терапии, т.е. антисмысловые олигонуклеотиды к SMAD7 и антитела против SMAD7). Антисмысловые олигонуклеотиды представляют собой короткие синтетические олигонуклеотидные последовательности комплементарные матричной РНК (мРНК), которая кодирует целевой белок (например, SMAD7). Антисмысловые олигонуклеотидные последовательности гибридизуются с мРНК, образуя двухцепочечный гибрид, который может привести к активации широко распространенных каталитических ферментов, таких как РНКаза Н, которая деградирует гибридные цепи ДНК/РНК, препятствуя таким образом трансляции белка.
В определенных вариантах применения настоящего изобретения антисмысловой олигонуклеотид анти-SMAD7 может действовать на сайты 403, 233, 294, 295, 296, 298, 299 и/или 533 (т.е. нуклеотиды 403, 233, 294, 295, 296, 298, 299 и/или 533, соответственно) в мРНК SMAD7 человека (например, из SEQ ID NO: 1) (см. Фиг. 1). В примере варианта применения настоящего изобретения антисмысловой олигонуклеотид анти-SMAD7 действует на нуклеотиды 403-423 мРНК SMAD7 человека.
В определенных вариантах применения настоящего изобретения антисмысловой олигонуклеотид можно получить из следующего антисмыслового олигонуклеотида анти-SMAD7 5'-GTCGCCCCTTCTCCCCGCAGC-3' (SEQ ID NO: 3).
Настоящее изобретение предусматривает, что антисмысловой олигонуклеотид, действующий на SMAD7, может включать смешанный остов, в котором остатки цитозина а паре CpG заменены на 5'-метилцитозин (кратко обозначаемый как Me-dC). Метилфосфонатные связи также можно поместить на 5'- и/или 3'-концы антисмыслового олигонуклеотида (кратко обозначаемые как MeP). Фосфонатный остов предполагаемых настоящим изобретением антисмыслового олигонуклеотида анти-SMAD7 может при необходимости включать 1, 2, 3, 4 или более тиофосфатных связей (например, тиофосфатные связи заменяют фосфодиэфирные связи). В одном варианте применения настоящего изобретения все фосфонатные связи могут быть тиофосфатными связями.
Примеры терапии антисмысловыми олигонуклеотидами, действующими на SMAD7, включают, но не ограничиваются следующими:
5'-GTXYCCCCTTCTCCCXYCAG-3' (SEQ ID NO: 4), в котором X представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, состоящей из цитозинового и 5-метилцитозинового или 2'-O-метилцитозинового нуклеозида, и где Y представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, состоящей из гуанинового и 5-метилгуанинового или 2'-O-метилгуанинового нуклеозида, при условии, что по меньшей мере один из нуклеотидов X или Y включает метилированное азотистое основание;
5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 5), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат;
5'-GTXGCCCCTTCTCCCXGCAGC-3' (SEQ ID NO: 6), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат;
5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 7), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат и Z представляет собой 2'-дезоксигуанозинметилфосфонат;
5'-ZTXGCCCCTTCTCCCXGCAZC-3' (SEQ ID NO: 8), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат и Z представляет собой 2'-дезоксигуанозинметилфосфонат.
В частном случае применения настоящего изобретения предполагаемая изобретением антисмысловая последовательность к SMAD7 может быть последовательностью, включающей один из:
5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 9), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монотиофосфат;
5'-GTXGCCCCTTCTCCCXGCAGC-3' (SEQ ID NO: 10), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монотиофосфат;
5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 11), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монотиофосфат и Z представляет собой 2'-дезоксигуанозинметилтиофосфат;
5'-ZTXGCCCCTTCTCCCXGCAZC-3' (SEQ ID NO: 12), в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монотиофосфат и Z представляет собой 2'-дезоксигуанозинметилтиофосфат.
Например, SEQ ID NO. 9-12 включают 1, 2, 3, 4 или более тиофосфатных связей. В одном варианте применения настоящего изобретения все O,O фосфонатные связи в SEQ ID NO. 9-12 представляют собой тиофосфатные связи.
Способы лечения
Здесь представлены способы улучшения выживания органа и/или клетки, например, клетки панкреатического островка, после трансплантации, включающие введение нуждающемуся в них пациенту эффективного количества специфичного ингибитора экспрессии или функции SMAD7, например, антисмыслового олигонуклеотида к SMAD7.
Также здесь представлены способы лечения и/или предотвращения диабета, например, диабета 1 типа и диабета 2 типа, включающие введение нуждающемуся в них пациенту эффективного количества специфичного ингибитора экспрессии или функции SMAD7, например, антисмыслового олигонуклеотида к SMAD7.
Диабет включает группу метаболических заболеваний, характеризующихся высоким уровнем сахара в крови или кетоацидозом, а также хронические, общие метаболические нарушения, вызванные длительным повышением уровня сахара в крови или снижением толерантности к глюкозе. Диабет включает обе формы заболевания, диабет 1 типа и диабет 2 типа, гестационный диабет и другие состояния инсулиновой недостаточности.
Следует принимать во внимание, что описанные способы также применимы к лечению и предотвращению латентного аутоиммунного диабета (т.е. диабета 1,5 типа), метаболических нарушений, преддиабетического состояния, метаболического синдрома, нарушений, связанных с липидами или глюкозой, например, гиперлипидемии и/или гиперхолестеринемии и других связанных заболеваний.
Метаболические нарушения могут включать любое нарушение или заболевание или состояние, которые ассоциированы с повышенным уровнем глюкозы в плазме крови. Метаболическое нарушение, например, включает сахарный диабет, гестационный диабет, генетические нарушения функции β-клеток, генетические дефекты действия инсулина, заболевания экзокринной части поджелудочной железы, эндокринопатии, инфекции, вызванные лекарственными препаратами или химическими веществами, прочие генетические синдромы, ассоциированные с диабетом, преддиабетическое состояние и метаболический синдром.
Метаболический синдром характеризуется группой метаболических факторов риска у одного человека, как описано Американской кардиологической ассоциацией. Метаболический синдром также известен как метаболический синдром Х, синдром Х, синдром инсулиновой резистентности, синдром Ривена или «заболевание коронарных артерий, гипертензия, атеросклероз, ожирение и инсульт». Факторы риска включают, но не ограничиваются абдоминальным ожирением, атерогенной дислипидемией, гипертензией, инсулиновой резистентностью или непереносимостью глюкозы, протромботическим состоянием (высоким уровнем фибриногена или ингибитора активатора плазминогена 1) и провоспалительным состоянием (повышенным уровнем С-реактивного белка).
Термины «обрабатывать», «лечение», «лечить» и подобные применяют здесь для общего обозначения достижения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим в смысле полного или частичного предотвращения заболевания или его симптома и/или может быть терапевтическим в смысле частичного или полного излечения заболевания и/или нежелательного эффекта, относящегося к заболеванию. Термин «лечение» в данном контексте распространяется на любое лечение заболевания у млекопитающих, особенно у людей, и включает: (а) предотвращение возникновения заболевания у объекта, который может быть предрасположен к данному заболеванию, но у которого еще не было диагностировано данное заболевание; (б) подавление заболевания, т.е. прекращение его развития; или (в) облегчение заболевания, т.е. индукция регрессии заболевания.
В частных случаях применения настоящего изобретения ответ объекта на проведение анти-SMAD7 терапии можно интерпретировать относительно контрольного образца (описанного ниже), полученного у данного объекта перед лечением. Пациента можно определить как отвечающего на проведение анти-SMAD7 терапии при снижении экспрессии SMAD7; при повышении общего содержания инсулина поджелудочной железы; при поддержании и/или восстановлении функции β-клеток (например, по оценке с помощью стандартных способов, таких как внутривенный глюкозотолерантный тест, ВВГТТ); и/или при нормогликемии, т.е. при поддержании и/или восстановлении нормального уровня глюкозы в крови. В других вариантах применения настоящего изобретения объект, который получил трансплантат островка, например, аллогенный трансплантат островка, можно определить как отвечающий на проведение анти-SMAD7 терапии, если наблюдается предотвращение отторжения и/или более продолжительное выживание островков.
Опытный образец можно получить от пациента, например, на неделе 1, на неделе 2, на неделе 4, на неделе 8, на неделе 10 или позже после начала лечения, для определения чувствительности к терапии. В некоторых вариантах применения настоящего изобретения опытный образец можно получить, например, через одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель, пять месяцев, шесть месяцев и/или один год или более после начала терапии для контроля чувствительности к лечению.
Контрольный образец может включать образец (например, образец крови или ткани), полученный от объекта перед проведением анти-SMAD7 терапии. Контрольный образец представляет собой исходный уровень для наблюдения за прогрессом пациента в ответ на лечение. Контрольный образец можно получить от пациента в первый день введения анти-SMAD7 терапии (например, в день 1 курса лечения). В других вариантах применения настоящего изобретения контрольный образец можно получить от пациента за один день до начала анти-SMAD7 терапии (например, в день 0 курса лечения). В качестве альтернативы контрольный образец можно получить от пациента за 2, 3, 4, 5, 6, 7 или более дней до начала анти-SMAD7 терапии. Например, повышенную или пониженную регуляцию определенных клеточных образцов можно измерить перед лечением (например, контрольного образца), во время лечения и/или после лечения для контроля ответа пациента на терапию, например, на анти-SMAD7 терапию.
Контрольный образец может включать, например, образец для наблюдения за уровнем глюкозы у объекта, в котором образец получали от объекта перед проведением анти-SMAD7 терапии.
В некоторых вариантах применения настоящего изобретения контрольный уровень для объекта можно установить на основании длительного наблюдения за определенными клеточными популяциями у объекта. В таких случаях считается, что объект может пройти много курсов лечения с помощью анти-SMAD7 терапии. Количество определенных клеточных популяций, определенное после проведения множества раундов терапии, можно сравнить с предыдущим контрольным уровнем у данного объекта, чтобы определить, отвечает ли объект на терапию и/или склонен ответить на последующее проведение анти-SMAD7 терапии. В других вариантах применения настоящего изобретения контрольный или исходный уровень для объекта можно установить на основании среднего измерений определенной клеточной популяции, определенного по множеству исходных образцов, полученных в течение времени (например, полученных в течение недель, месяцев или лет). В соответствии с этим, любой тест или анализ, проведенный, как описано здесь, можно сравнить с предшествующим или с установленным контрольным уровнем, и получение от объекта нового контрольного образца может не понадобиться для сравнения, например, если объект получает более одного курса лечения с помощью анти-SMAD7 терапии.
Введение и формула
В некоторых вариантах применения настоящего изобретения, здесь предусмотрены фармацевтические композиции, включающие предполагаемый изобретением антисмысловой олигонуклеотид к SMAD7 и фармацевтически приемлемый носитель. Например, фармацевтическую композицию можно вводить подкожно. В качестве альтернативы, фармацевтическую композицию можно вводить перорально.
В данном контексте «фармацевтически приемлемый носитель» обозначает буферы, носители и вспомогательные вещества, подходящие для применения при контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергического ответа и прочих проблем или осложнений, соответствующие разумному соотношению пользы и рисков. Носитель(и) должен быть «приемлемым» в смысле совместимым с другими ингредиентами в формулах и не вредным для реципиента. Фармацевтически приемлемые носители включают буферы, растворители, диспергирующие среды, вещества оболочки, изотонические и задерживающие адсорбцию агенты и подобные, которые совместимы с фармацевтическим введением. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области техники.
В одном варианте применения настоящего изобретения предусмотренный настоящим изобретением антисмысловой олигонуклеотид к SMAD7 и его фармацевтическую композицию можно вводить одним из способов, включающим пероральный, местный, парентеральный, например, подкожную инъекцию, ингаляцию спрея или ректальное введение. Термин парентеральный в данном контексте включает подкожные инъекции, введение в поджелудочную железу, внутривенную, внутримышечную, внутрибрюшинную, интрастернальную инъекцию или инфузионные способы. Например, антисмысловой олигонуклеотид к SMAD7 можно ввести объекту подкожно. В другом примере антисмысловой олигонуклеотид к SMAD7 можно ввести пациенту перорально.
Фармацевтические композиции, содержащие антисмысловой олигонуклеотид к SMAD7, такие как описанные здесь, могут быть представлены в виде стандартной лекарственной формы и получены любым подходящим способом. Фармацевтическая композиция должна быть составлена так, чтобы быть совместимой с предполагаемым способом введения. Пригодные формулы можно приготовить с помощью способов, широко известных в фармацевтике. Например, см. Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing Company, 1990).
Предпочтительно, чтобы фармацевтические формулы были стерильными. Стерилизацию можно провести, например, посредством фильтрации через стерильные фильтровальные мембраны. В случае лиофилизации композиции стерилизацию фильтрованием можно провести до или после лиофилизации и растворения.
В примере варианта применения настоящего изобретения фармацевтическая композиция для подкожного введения антисмыслового олигонуклеотида к SMAD7 включает антисмысловой олигонуклеотид, такой как представленный в SEQ ID NO: 6, или его фармацевтически приемлемую соль (такую как натриевая соль) и фармацевтически приемлемый носитель.
В другом варианте применения настоящего изобретения таблетированная фармацевтическая формула для перорального введения антисмыслового олигонуклеотида к SMAD7 включает интрагранулярную фазу, в которой интрагранулярная фаза включает антисмысловой олигонуклеотид, такой как представленный SEQ ID NO: 6, или его фармацевтически приемлемую соль (такую как натриевая соль) и фармацевтически приемлемый наполнитель, и которая может также включать экстрагранулярную фазу, которая может включать фармацевтически приемлемое вспомогательное вещество, такое как диспергирующее вещество. Например, фармацевтически приемлемая таблетка для перорального применения может включать интрагранулярную фазу, содержащую приблизительно от 5 до 10% по весу антисмыслового олигонуклеотида, представленного SEQ ID NO: 6, или его фармацевтически приемлемой соли, около 40% по весу маннитола, около 8% по весу микрокристаллической целлюлозы, около 5% по весу гидропропилметилцеллюлозы и около 2% по весу натрия крахмала гликолята; экстрагранулярную фазу, включающую около 17% по весу микрокристаллической целлюлозы, около 2% по весу натрия крахмала гликолята, около 0,4% по весу стеарата магния; и кишечнорастворимую оболочку таблетки, включающую около 13% по весу AcrylEZE® (см., например, публикация Договора Патентной Кооперации № WO/2010/054826, которая полностью включена в данный документ посредством ссылки).
Примеры формул включают лекарственные формы, которые включают или состоят в основном из приблизительно от 35 мг до 500 мг антисмыслового олигонуклеотида к SMAD7. Например, здесь предусмотрены формулы, которые включают около 35 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг или 250 мг антисмыслового олигонуклеотида к SMAD7. В одном варианте применения настоящего изобретения формула может включать около 40 мг, 80 мг или 160 мг антисмыслового олигонуклеотида к SMAD7. Вводимое количество будет зависеть от таких переменных как тип и распространенность заболевания или показания, которое подлежит лечению, общего состояния здоровья пациента, активности антител in vivo, фармацевтической композиции и способа введения. Исходную дозу можно повысить выше верхнего уровня для быстрого достижения желаемого уровня в крови или ткани. В качестве альтернативы исходная доза может быть меньше оптимальной и дозировку можно постепенно увеличивать на протяжении курса терапии. Дозировку для человека можно оптимизировать, например, в стандартном исследовании с увеличением дозы фазы I, спланированном в интервале от 40 мг до 160 мг. Частота приема лекарственного средства может варьировать в зависимости от таких факторов, как способ введения, величина дозы и заболевание, которое подлежит лечению. Примеры частоты приема лекарственных препаратов включают один раз в сутки, один раз в неделю и один раз в две недели. В некоторых случаях применения настоящего изобретения дозировка составляет один раз в 7 дней. Предпочтительным способом введения является подкожный.
В некоторых вариантах применения настоящего изобретения способы, представленные здесь, могут дополнительно включать введение по меньшей мере одного агента, который предназначен для лечения заболеваний и нарушений, описанных здесь. В одном варианте применения настоящего изобретения другие предполагаемые агенты можно вводить совместно (например, последовательно или одновременно).
Предполагаемые агенты включают имууносупрессорные агенты, включающие глюкокортикоиды, цитостатики, антитела, агенты, действующие на иммунофилины, интерфероны, опиодиды, TNF-связывающие белки, микофенолат и малые биологические агенты. Например, предполагаемые иммуносупрессорные агенты включают, но не ограничиваются такролимусом, циклоспорином, пимерколимусом, сиролимусом, эверолимусом, микофеноловой кислотой, финголимодом, дексаметазоном, флударабином, циклофосфамидом, метотрексатом, азатиоприном, лефлуномидом, терифлуномидом, анакинрой, антитимоцитовым глобулином, антилимфоцитарным глобулином, муромонабом-CD3, афутузумабом, ритуксимабом, теплизумабом, эфализумабом, даклизумабом, базиликсимабом, адалимумабом, инфликсимабом и этанерцептом.
Предполагаемые агенты включают лекарственные терапии для регуляции уровня сахара в крови, включающие пероральные терапии гипогликемическими агентами и/или пероральными антидиабетическими агентами, инъекционные терапии и подобные. Безмедикаментозная терапия для регуляции уровня сахара в крови включает, но не ограничивается мерами по контролю диеты и/или физической нагрузки.
Пероральные лекарственные терапии для регуляции уровня сахара в крови включают гипогликемические агенты, которые могут включать, но не ограничиваются акарбозой, ацетогексамидом, хлорпропамидом, дарглитазоном натрия, глимепиридом, глипизидом, глибуридом, репаглинидом, троглитазоном, толазамидом и толбутамидом.
Пероральные лекарственные терапии для регуляции уровня сахара в крови включают антидиабетические агенты, которые могут включать, но не ограничиваются акарбозом, ацетогексамидом, буформином, гидрохлоридом бутоксамина, камиглибозом, хлорпропамидом, циглитазоном, энглитазоном натрия, гидгохлоридом этоформина, глиамилидом, глиборнуридом, глицетанилом глицлазидом натрия, глифлумидом, инсулин изофаном, человеческим инсулином с цинком, расширенным инсулином, инсулином лизпро, линоглиридом, Фуматаром линоглирида, метформином, метилпальмоксиратом, пальмоксиратом натрия, гидрохлоридом пиоглитазона, тартратом пироглирида, человеческим проинсулином, репаглинидом, ацетатом сеглитида, толазамидом, толбутамидом, толпиррамидом, троглитазоном и зополрестатом.
Инъекционные терапии для регуляции уровня сахара в крови могут включать, но не ограничиваются быстродействующим инсулином, инсулином длительного действия и родственный инсулин. Быстродействующий инсулин включает простой инсулин, быстродействующую суспензию инсулина с цинком и инсулин Semilente®, инъекцию Humalog®, Humulin® R, Iletin II, Novolin R, простой очищенный свиной инсулин и человеческий инсулин Velosulin BR. Инсулин длительного действия включает суспензию протамин-цинк-инсулин, расширенную суспензию инсулина с цинком, инсулин Ultralente® и Humulin® U. Прочие инсулины включают суспензию инсулина изофана, нейтральный протамин Хагедорна инсулин, инсулин изофан; суспензию инсулина с цинком Lente® инсулин, суспензию человеческого инсулина изофана/инъекцию человеческого инсулина, Humulin® 50/50, Humulin® 70/30 и Novolin® 70/30.
ПРИМЕРЫ
Настоящее изобретение ниже иллюстрирует следующие примеры. Примеры представлены исключительно в целях иллюстрации и ни коем образом не должны интерпретироваться как ограничивающие масштаб или содержание изобретения.
Пример 1: Действие антисмысловых олигонуклеотидов к SMAD7 на активацию NF-κB
TNF-α/IL-1β-сенсорные клетки HEK-Blue™ (InvitroGen) созданы для детектирования биоактивных TNF-α (Tumor Necrosis Factor α , фактор некроза опухоли α) и IL-1β (InterLeukine 1β, интерлейкин 1β) посредством наблюдения за активацией NF-κB пути. Эти клетки были созданы посредством стабильной трансфекции клеток эмбриональной почки человека HEK293 репортерным геном SEAP (секретируемая эмбриональная щелочная фосфатаза) под контролем минимального промотора INF-β (Interferon β, интерферон-β), слитого с пятью сайтами связывания NF-κB и пятью сайтами связывания AP-1. CD40L-сенсорные клетки HEK-Blue™ (InvitroGen) применяют для измерения биоактивности CD154 (CD40L) посредством секреции эмбриональной щелочной фосфатазы (SEAP) при активации NF-κB после стимуляции CD40. Эти клетки были созданы посредством стабильной трансфекции клеток HEK293 человеческим геном CD40 и NF-κB-индуцируемой конструкцией SEAP. Таким образом, клетки HEK-Blue™ измеряют биоактивность TNF-α/CD40 посредством секреции эмбриональной щелочной фосфатазы (SEAP) при активации NF-κB после стимуляции TNFR/CD40. Фактор некроза опухоли альфа (TNF-α) представляет собой известный цитокин, вовлеченный в системное воспаление и регуляцию иммунных клеток. CD40L представляет собой костимулирующий белок, вовлеченный в активацию Т-клеток и развитие эффективных иммунных ответов, и считается вовлеченным в развитие аутоиммунных заболеваний, включающих сахарный диабет 1 типа (Margolles-Clark, E. et al. “Small molecule costimulatory blockade: organic dye inhibitors of the CD40-CD154 interaction,” J. Mol. Med., 2009, 87, 1133-1143).
TNFα- и CD40L-сенсорные клетки HEK-Blue (Invitrogen) (50000/лунка) инкубировали с антисмысловым (АС) олигонуклеотидом GED-0301 или с контрольным смысловым (С) олигонуклеотидом (ОГН; 4 мкг/мл) в течение 6 ч в присутствии липофектамина (ЛПФ), а затем среды, на протяжении 18 ч после обработки TNFα (1 нг/мл) или CD40L (25 нг/мл) в присутствии или в отсутствие TGF-β (200 нг/мл; 24 ч, среда DMEM (Dulbecco modified Eagle's medium, среда Игла, модифицирована по способу Дульбекко), пенициллин/стрептомицин, 2% сыворотка). GED-0301 представляет собой антисмысловой олигонуклеотид к SMAD7 (GTXGCCCCTTCTCCCXGCAGC, в котором X представляет собой 5-метил-2'-дезоксицитидин-5'-монофосфат (5-Me-dC) (SEQ ID NO: 6)). Секрецию SEAP, индуцированную TNFα или CD40L в этих клетках, количественно определяли, применяя QUANTI-Blue™, колориметрический ферментный тест, предоставленный производителем и специально разработанный для данной цели, со средой, которая меняет цвет на багрово-синий в присутствии SEAP, что можно количественно оценить, измеряя оптическую плотность при 625-655 нм. Данные представляют собой среднее из трех независимых экспериментов, проведенных в четырех повторах в каждой плашке, с применением значений, нормализованных к простимулированному ответу (только TNFα или CD40L) в необработанных контрольных клетках.
Эффекты TGF-β и GED-0301 на активацию NF-κB в клетках HEK-Blue посредством TNFα и CD40L, соответственно, показаны на Фиг. 2А и 2B. Результаты показывают, что и TNFα, и CD40L вызывали значительную активацию NF-κB (по измерению экспрессии SEAP) и что оба белка подавлялись TGF-β. Такое подавление значительно усиливалось при дальнейшей обработке антисмысловым олигонуклеотидом к SMAD7 GED-0301, что указывало на то, что данная обработка способна усиливать и/или восстанавливать эффекты TGF-β. В клеточных системах TGF-β может либо усиливать, либо ингибировать активацию NF-κB в зависимости от применяемого типа клеток (Hong, S. et al. “Smad7 sensitizes tumor necrosis factor induced apoptosis through the inhibition of antiapoptotic gene expression by suppressing activation of the nuclear factor-kappaB pathway,” Cancer Res., 2007, 67, 9577-9583 и ссылки в данной публикации). TGF-β был негативным регулятором NF-κB в B-клетках и в мононуклеарных клетках собственной пластинки (МКСП) слизистой оболочки кишечника человека. Результаты, полученные для трансфицированных клеток HEK, схожи с таковыми, полученными на клетках МКСП, на которых было показано, что TGF-β1 отрицательно регулирует активацию NF-κB в нормальных МКСП (поскольку предварительная обработка TGF-β1 подавляла TNF-α-индуцированную активацию NF-κB), и что лечение воспалительного заболевания кишечника МКСП специфичными к Smad7 антисмысловыми олигонуклеотидами приводило к ингибированию активации NF-κB (Monteleone, G. et al. “A failure of transforming growth factor-β1 negative regulation maintains sustained NF-κB activation in gut inflammation,” J. Biol. Chem., 2004, 279, 3925-3932).
Для доказательства того, что GED-0301 может проникать в исследуемые клетки сенсорные клетки HEK Blue (50000/лунка) инкубировали с меченым флуоресцеином GED-0301 АС ОГН в течение 48 ч в присутствии или в отсутствие липофектамина (ЛПФ, Invitrogen), а затем анализировали на предмет захвата клетками. Микроскопия подтвердила, что сенсорные клетки HEK Blue, которые инкубировали с меченым флуоресцеином GED-0301 в присутствии липофектамина, захватывали меченый флуоресцеином GED-0301 лучше, чем клетки, не обработанные липофектамином.
Пример 2: исследование распределения антисмысловых олигонуклеотидов к SMAD7 у мышей
Обычным мышам В6 (6 недель, самцы; Jackson Lab.) с диабетом, индуцированным многократными низкими дозами стрептозотоцина (СТЗ, специфичного β-клеточного токсина; 40 мг/кг в/б в течение 5 дней подряд), вводили меченые флуоресцеином антисмысловые олигонуклеотиды GED-0301 (TriLink) тремя разными способами: перорально (п/о), внутрибрюшинно (в/б) и подкожно (п/к) (125 мкг/мышь = 5 мг/кг; п/о посредством принудительного перорального кормления, применяя 500 мкл раствора бикарбоната, рН 9,5, для защиты от деградации в желудке). В две временные точки (4 ч и 24 ч) собирали и обрабатывали органы у двух различных животных: поджелудочную железу, печень, почки, селезенку, тимус, кишечник, головной мозг, кровь, лимфатические узлы поджелудочной железы, плечевые лимфатические узлы, лимфоидную ткань, ассоциированную с кишечником. Для анализа с помощью проточной цитометрии органы переваривали коллагеназой D (Roche), пропускали через приспособление для окрашивания клеток (70 мкм; BD Falcon), ресуспендировали в HBSS (Hanks balanced salt solution, сбалансированный солевой раствор Хенкса) и окрашивали живые клетки (набор реактивов LIVE/DEAD® fixable violet dead cell stain kit; Invitrogen) и лейкоциты (антимышиные антитела к CD45 с аллофикоцианином; eBioscience). Затем их анализировали на содержание флуоресцеина в живых клетках при помощи проточного цитометра BD LSR II (BD Biosciences, Сан-Джозе, штат Калифорния) и программного обеспечения FlowJo версия 7.2.2 (Ашланд, штат Орегон). Фиг. 3А показывает пример, иллюстрирующий способ установки дискриминационного окна для анализа результатов проточной цитометрии. Фиг. 3В включает иллюстративные результаты проточной цитометрии, полученные для соответствующего процента захвата красителя живыми клетками в специфичных органах, которые показывают значительный уровень захвата антисмыслового олигонуклеотида (процент FITC+) поджелудочной железой, лимфатическими узлами поджелудочной железы и другими органами (как лейкоцитами, CD45+/FITC+, так и другими клетками, CD45-/FITC+), особенно после п/к введения. Данные результаты подтверждают, что GED-0301 может доставляться в специфичные органы при применении клинически приемлемых способов введения, включающих подкожное введение.
Многоканальные микроскопические изображения высокого разрешения (Фиг. 4) подтвердили распределение GED-0301 в поджелудочную железу после подкожного введения флуоресцентно меченого антисмыслового олигонуклеотида в соответствии с результатами проточной цитометрии (Фиг. 3В). Цветовое обозначение: зеленый - флуоресцентный GED0301, серый - DAPI (маркер клеточного ядра), красный - инсулин (показывающий образующие инсулин β-клетки) и синий - CD45 (показывающий CD45 или общий лейкоцитарный антиген, LCA, маркер элементов кровеносной системы, которые включают клетки иммунитета и воспаления).
Пример 3: In vivo исследования с помощью антисмысловых олигонуклеотидов к SMAD7
Следующие in vivo исследования можно применять для определения эффекта лечения на животных моделях
Исследование антисмысловых олигонуклеотидов к SMAD7 по обращению гипергликемии у мышей NOD
Не страдающие ожирением мыши с диабетом (NOD), например, мыши NOD, применяли в интервенционном исследовании по предотвращению диабета, где лечение начинали только после начала гипергликемии. Мыши NOD представляют собой широко применяемую животную модель диабета 1 типа (Roep, B.O. et al. Satisfaction (not) guaranteed: re-evaluating the use of animal models of type 1 diabetes. Nat. Rev. Immunol., 2004, 4, 989-997), и применяются для оценки большого числа возможных лечений (Shoda, L. K. et al. “A comprehensive review of interventions in the NOD mouse and implications for translation,” Immunity, 2005, 23, 115-126). Доставляли восьминедельных преддиабетных самок мышей (Taconic) и, начиная с недели 10 (после акклиматизации), наблюдали за глюкозурией два раза в неделю. У животных, которые оказывались положительными, отслеживали уровень глюкозы в крови (гликемию) три раза в неделю. Животные с повышенным уровнем глюкозы (гликемия не натощак >200 мг/дл) в течение двух дней подряд получали один имплант капсулы медленно высвобождающегося инсулина (LinBit, LinShin Canada, Inc.) для предотвращения тяжелой формы гипергликемии и истощения/перегрузки оставшихся β-клеток и начинали получать лечение. Препараты вводили п/к, поскольку данный способ введения является клинически значимым и исследования распределения, описанные выше, показали, что он является эффективным для распределения в поджелудочную железу, лимфатические узлы поджелудочной железы и другие органы представляющие возможный интерес. Животных распределяли в одну из трех групп лечения в соответствии с предварительно определенной схемой чередования в порядке развития у них гипергликемии. Препараты (GED-0301 = Smad7 АС ОГН; 125 мкг/мышь) и соответствующие контроли (С ОГН и только физиологический раствор) вводили ежедневно. За животными наблюдали два раза в неделю и оценивали их способность поддерживать нормогликемию. После исчезновения эффектов имплантированных инсулиновых капсул (около 25 дней) животных с тремя последовательными значениями уровня глюкозы >250 мг/дл считали заболевшими диабетом, их умерщвляли и отбирали репрезентативные органы (поджелудочную железу, лимфатические узлы поджелудочной железы). У животных, не заболевших диабетом, ежедневное лечение прекращали через 10 недель, и наблюдали их в течение дополнительных 12 недель (всего до 150 дней), чтобы определить, существует ли продолжительный эффект. В конце всех животных умерщвляли и отбирали репрезентативные органы (поджелудочную железу, лимфатические узлы поджелудочной железы и другие).
Результаты исследования показаны на Фиг. 5 с данными об уровне глюкозы в крови на Фиг. 5А и соответствующей кривой выживаемости Каплана-Мейера, показывающей процент животных, остающихся без диабета, в зависимости от времени, на Фиг. 5В. Лечение начинали после начала гипергликемии, когда уже произошло повреждение β-клеток. Соответственно, тяжелая форма гипергликемии может развиться очень быстро. У всех животных, обработанных физиологическим раствором или контрольным смысловым олигонуклеотидом, развивался диабет (n=7 и 6, соответственно), о чем свидетельствует гипергликемия (уровень глюкозы в крови >250 мг/дл) после истощения импланта LinBit с медленно высвобождающимся инсулином ко дню 20-25. Среди животных, обработанных активным антисмысловым олигонуклеотидом GED-0301, у 6 из 11 обработанных животных не развивалась гипергликемия, и они оставались без диабета до окончания исследования (дня 150), в течение длительного времени после прекращения лечения (день 70).
Для проверки глюкозного ответа у животных без диабета в конце исследования (день 150) проводили пероральный глюкозотолерантный тест (ПОГТТ) у нескольких обработанных GED-0301 мышей, а также у контрольных мышей. Глюкозу в дозировке 150 мг вводили посредством принудительного перорального кормления мышам после 16 часового голодания и отбирали образцы крови в заранее определенные временные интервалы продолжительностью до 150 мин. Результаты, показанные на Фиг. 6, подтверждают, что глюкозный ответ и, следовательно, способность секретировать инсулин, был сравним с таковым у здоровых животных. Уровень глюкозы в крови возвращался к норме в течение 150 мин после перорального введения у всех животных.
Конфокальную микроскопию высокого разрешения со срезами поджелудочной железы обработанных GED-0301 мышей NOD, которые не заболели диабетом к концу исследования (день 150), проводили, чтобы подтвердить наличие образующих инсулин β-клеток. Фиг. 7 показывает серию многоканальных Z-стопок изображений репрезентативных содержащих островки срезов поджелудочной железы из обработанных GED-0301 мышей и соответствующих контролей. Различные цвета (столбики) обозначают следующее: синий - DAPI (маркер клеточного ядра), красный - инсулин (указывающий на вырабатывающие инсулин β-клетки) и зеленый - глюкагон (указывающий на вырабатывающие глюкагон α-клетки). Масштабная линейка 100 мкм. В то время как у нормальных контрольных мыши без диабета были нормальные островки, содержащие как инсулин- так и глюкагон-образующие клетки (верхний ряд), мыши NOD, которые заболели диабетом во время исследования, утратили вырабатывающие инсулин β-клетки из островков (нижний ряд; из обработанных смысловым олигонуклеотидом мышей, у которых не восстановилась нормогликемия). У животных, обработанных антисмысловым (АС) олигонуклеотидом GED-0301, которые не заболели диабетом после лечения, начатом при начале гипергликемии, было несколько островков, которые утратили образующие инсулин клетки (второй ряд сверху, показывающий наличие глюкагона, но не инсулина), но у них также были островки с сохраненными инсулин-образующими клетками (третий ряд сверху). Следовательно, обработка GED-0301, начатая в начале гипергликемии, по-видимому, противодействует действию аутоиммунной атаки у мышей NOD и сохраняет вырабатывающие инсулин β-клетки в количестве, достаточном для поддержания нормального глюкозного ответа в крови и предотвращения начала гипергликемии.
Исследование антисмысловых олигонуклеотидов к SMAD7 при трансплантации островков
Восстановление передачи сигнала через TGF-β в локальном микроокружении оказалось перспективным в экспериментальной модели аллогенной трансплантации островков, в том числе при наличии лежащего в основе аутоиммунного заболевания. Обработку GED-0301 можно провести для определения эффекта антисмысловых олигонуклеотидов к SMAD7 на выживание и/или толерантность к аллогенным трансплантатам островков. В частности, можно определить эффект GED-0301 по предотвращению отторжения и/или увеличению продолжительности выживания островков в модели аллогенной трансплантации у грызунов, заболевших диабетом при введении специфичного для бета-клеток токсина (СТЗ). Первичные конечные точки могут включать выживание аллотрансплантата островков, маркеры активации на Т-лимфоцитах, дендритных клетках, частоту и супрессорную функцию Трег и других супрессорных клеток в виде корреляции с экспрессией/регуляцией Smad7 в месте трансплантации.
Исследование антисмысловых олигонуклеотидов к SMAD7 и неспецифичного воспаления при диабете 2 типа
Поскольку неспецифичное системное и местное воспаление характеризует преддиабетическое состояние и диабет 2 типа, можно определить потенциальную роль SMAD7 в развитии неспецифичного воспаления внутри панкреатического островка. Более того, можно изучить роль SMAD7 при сосудистых осложнениях при диабете.
Исследование антисмысловых олигонуклеотидов к SMAD7 при диабетической нефропатии
При диабетической нефропатии человека и других протеинурических гломерулярных болезнях Smad7 сильно повышен. Это повышение происходит в первую очередь в подоцитах, гломерулярных клетках, отвечающих за целостность гломерулярного фильтрационного барьера и за предотвращение альбуминурии, независимого предиктора кардиоваскулярного исхода в общей популяции. Действие на TGF-β является предметом интенсивного прикладного исследования (исследование с пирфенидоном). В этих исследованиях результаты, касающиеся вылечивания диабетической нефропатии и других хронических заболеваний почек, неожиданно оказались отрицательными. Восстановление полноценной передачи сигнала через TGF-β посредством ингибирования Smad7 может быть перспективным и новым подходом к лечению данных состояний. Установленные экспериментальные модели диабетической нефропатии, разработанные Консорциумом по диабетическим осложнениям Национальных Институтов Здравоохранения, можно применять для получения предварительных in vivo данных по мягким и тяжелым почечным исходам (альбуминурии, уровне гломерулярной фильтрации, гламерулосклерозе). Последующие клинические исследования можно разработать в Клинике диабетической нефропатии в Институте исследования диабета.
Исследование действия антисмысловых олигонуклеотидов к SMAD7 на стимулированную глюкозой секрецию инсулина
Мыши с β-клетками поджелудочной железы со сверхэкспрессией Smad7 характеризуются нарушением выделения инсулина и повышенным уровнем глюкозы натощак. Таким образом, ингибирование Smad7 могло бы привести к улучшению функции β-клеток поджелудочной железы. Можно провести эксперименты по стимулированной глюкозой выработке инсулина в островках человека, генетически измененных для экспрессии SMAD7 на разном уровне. В дальнейших исследованиях можно изучать пациентов для определения роли ингибирования Smad7 в непереносимости глюкозы у объектов с преддиабетическим состоянием.
Включение сведений посредством ссылки
Полное изложение содержания каждого из патентных документов и научных статей, процитированных здесь, включено посредством ссылки в любых целях.
Эквиваленты
Настоящее изобретение может быть осуществлено в других специфичных формах с выходом за пределы его существенных характеристик. Таким образом, вышеизложенные варианты осуществления настоящего изобретения следует считать скорее иллюстративными, чем ограничивающими изобретение, описанное здесь. Объем изобретения указан скорее в прилагаемой формуле изобретения, чем в вышеизложенном описании, и предполагается, что все изменения в пределах значения и диапазона эквивалентности формулы изобретения включены в нее.