Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS NIDULANS И ЕГО ПРИМЕНЕНИЕ ДЛЯ 11α-ГИДРОКСИЛИРОВАНИЯ ПРОГЕСТЕРОНА И ДЛЯ АЦЕТИЛИРОВАНИЯ 11α-ГИДРОКСИПРОГЕСТЕРОНА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к области биотехнологии, а также к генетике и молекулярной биологии, конкретно к клеткам живых культур, включая рекомбинантные, и касается создания и применения нового рекомбинантного штамма мицелиального гриба для гидроксилирования и ацетилирования стероидных соединений, в частности, соединений ряда прегнана (производных прогестерона), и может быть использовано в промышленной биотехнологии, а также в фармацевтической промышленности, для производства стероидных медицинских препаратов.
Уровень техники
Введение гидроксильной группы в положение С11 стероидной молекулы имеет большое промышленное значение, так как не только обеспечивает изменение биологической активности исходной молекулы в желаемом направлении, но и создает возможность для дальнейшей модификации молекулы, например, введения атома галогена в положение С9, с целью создания фармакологически более активных производных. Осуществление 11(α/β)-гидроксилирования стероидов микроорганизмами, особенно прогестерона, является экономически важным для производства кортикостероидов, так как одной из основных проблем их синтеза является введение кислородной функции в 11 положение, трудно осуществимое химическими методами. Так, например, химический синтез кортизона из желчных кислот включает ~30 стадий и общий выход составляет несколько десятых долей процента [Л. Физер, М. Физер. Стероиды. Пер. с англ. под ред. д.х.н. Н.Н Суворова и д.х.н. И.В. Торгова. М.: Мир, 1964, с. 673]. Напротив, синтез ацетата кортизона из 11α-гидроксипрогестерона состоит из 10 стадий и общий выход достигает 14,6% [SU 106380, 1956].
Известно, что 11-гидроксилирование стероидов в одну стадию с высокой степенью селективности возможно только биотехнологически с применением ферментной системы микроорганизмов, в основном, мицелиальных грибов, одним из которых является род Aspergillus. Однако этому роду присуща видовая специфичность трансформации стероидов ряда прегнана. Так, трансформация прогестерона у ряда видов (например, А. terreus [K. Yildirim, A. Uzuner, and E.Y. Gulcuoglu. Biotransformation of some steroids by Aspergillus terreus MRC 200365. Collect. Czech. Chem. Commun. 2010, Vol. 75(6), 665-673], A. tamarii [K. Yildirim, A. Uzuner and E.Y. Gulcuoglu. Baeyer-Villiger oxidation of some steroids by Aspergillus tamarii MRC 72400. Collect. Czech. Chem. Commun. 2011, Vol. 76(6), 743-754], A. versicolor [H.Y. Yang, H.L. Su, G. Du, G.J. Shen, J.X. Sun, and H.Y. Chen. Progesterone side-chain cleavage by Aspergillus versicolor. Advanced Materials Research. Advances in Chemical Engineering III. 2013. Vols. 781-784, 1164-1167; Abed Nosrat M. Side chain degradation of progesterone by Aspergillus versicolor 79. Pakistan Journal of Biochemistry, 1972, Vol. 5(1), 5-7], A. flavus [M.E. Mostafa, and A.A. Zohri. Progesterone side-chain degradation by some species of Aspergillus flavus group. Folia Microbiol (Praha). 2000; Vol. 45(3), 243-7]) может протекать не в направлении гидроксилирования, а в направлении элиминирования боковой прегнановой цепи с образованием соединений ряда андростана. Другие штаммы рода Aspergillus способны гидроксилировать прогестерон, вводя гидроксильную группу в различные положения молекулы, в том числе в 11α-положение. При этом направление гидроксилирования может существенно зависеть не только от видовой принадлежности штамма, но и от условий проведения трансформации.
Биотрансформация прогестерона с образованием 11α-гидроксипрогестерона наиболее изучена с применением грибов Aspergillus ochraceus, селективность 11α-гидроксилирования у которых может достигать 90% и более [Т.K. Dutta, and Т.В. Samanta. Bioconversion of progesterone by the activated immobilized conidia of Aspergillus ochraceus TS. Curr. Microbiol. 1999; Vol. 39(6), 309-312; P. Somal, and C.L. Chopra. Microbial conversion of steroids. III: 11a-hydroxylation by fungal mycelium. Applied Microbiology and Biotechnology, 1985, Vol. 21(5), 267-269]. Штаммы A. ochraceus нашли применение в качестве промышленных культур.
Мицеллиальный гриб Aspergillus nidulans является одной из наиболее известных эукариотических генетических систем и широко используется в качестве модельной системы для расшифровки биологии клеточного цикла, патогенности, лекарственной устойчивости, болезней человека, первичного и вторичного метаболизма других микроорганизмов. Несмотря на это, штаммы гриба A. nidulans как стероид-трансформирующие микроорганизмы мало изучены. Однако имеются сообщения, что этот вид обладает 11α-монооксигеназной активностью и способен трансформировать прогестерон с образованием преимущественно 11α-гидрокси-производного. Так, M.J. Henry и H.D. Sisler [M.J. Henry, and H.D. Sisler. Effects of sterol biosynthesis-inhibiting (SBI) fungicides on cytochrome P-450 oxygenations in fungi. Pesticide Biochemistry and Physiology, 1984, Vol. 22(3), 262-275], изучая влияние фунгицидов, ингибирующих биосинтез эргостерина в грибах, на цитохором-Р450-зависимое гидроксилирование прогестерона, сообщили, что гриб A. nidulans (Eidam) Winter (штамм 003) гидроксилирует прогестерон при начальной концентрации 100 мкг/мл с образованием смеси, содержащей 11α-гидроксипрогестерон (50%), 6β-гидроксипрогестерон (5%), 6β,11α-дигидроксипрогестерон (14%) и неконвертированный прогестерон (31%). При этом лиазная активность (расщепление боковой цепи по связи С17-С20) у этого штамма не наблюдалась.
Также известно, что культура гриба A. nidulans (из коллекции Центра культур лаборатории микробиологической химии, National Research Centre, Каир, местная среда обитания), обладая стероид-11α-гидроксилирующей активностью, может трансформировать прогестерон не только в 11α-гидроксипрогестерон, но и в 21-гидроксипрогестерон (он же 11-дезоксикортикостерон) [А.Н. El-Refai, and K.М. Ghanem. Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987, Vol. 22(2), 327-338; A.H. El-Refai, and K.M. Ghanem. Microbial response to steroids. Egyptian Journal of Microbiology, 1989, Vol. 23(1), 1-11]. Авторы вносили прогестерон в ростовую среду в растворе 96% этанола с финальной концентрацией растворителя 1%. Трансформацию прогестерона проводили с нагрузкой 1 г/л при температуре 30±2°С на качалке (200 об/мин, амплитуда 7 см) в течение 48 ч. При этом наблюдалось образование дигидроксилированного производного - 6β,11α-дигидроксипрогестерона. Был сделан вывод, что при значениях рН среды, близких к нейтральным, 6β-гидроксилирование является вторичным процессом и 6β,11α-дигидроксипрогестерон образуется из первично образованного 11α-гидроксипрогестерона [А.Н. El-Refai, and K.М. Ghanem. Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987, Vol. 22(2), 327-338].
Известно, что микроорганизмы способны ацетилировать стероидные вторичные спирты. Так, известна способность некоторых видов дрожжей и дрожжеподобных организмов (Saccharomyces fragilis, S. lactis, Candida pseudotropicalis и Torulopsis sphaerica) ацетилировать тестостерон [A. 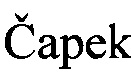 , M. Tadra, and J.
, M. Tadra, and J. 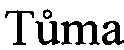 . Microbial transformations of steroids XXIV. Separation of androstane 17-hydroxy-epimers. Folia Microbiol. 1964, Vol. 9(6), 380-382]. При этом отмечалось, что ацетилирование происходит только с 17β-гидроксипроизводным, тогда как соответствующий 17α-эпимер остается нетронутым. В этих условиях не происходит ацетилирования молекулы стероида с гидроксигруппой в положениях 11α, 11β, 20β и 21. Однако информация о способности мицелиальных грибов, к которым относится род Aspergillus, ацетилировать стероидные спирты, в литературных источниках отсутствует.
. Microbial transformations of steroids XXIV. Separation of androstane 17-hydroxy-epimers. Folia Microbiol. 1964, Vol. 9(6), 380-382]. При этом отмечалось, что ацетилирование происходит только с 17β-гидроксипроизводным, тогда как соответствующий 17α-эпимер остается нетронутым. В этих условиях не происходит ацетилирования молекулы стероида с гидроксигруппой в положениях 11α, 11β, 20β и 21. Однако информация о способности мицелиальных грибов, к которым относится род Aspergillus, ацетилировать стероидные спирты, в литературных источниках отсутствует.
Из уровня техники известно, что ацетилирование 11α-гидроксипрогестерона осуществляют химически, используя в качестве ацетилирующего агента уксусный ангидрид. Так, известным химическим методом [D.H. Peterson, Н.С. Murray, S.H. Eppstein, L.M. Reineke, A. Weintraub, P.D. Meister, and H.M. Leigh. Microbiological Transformations of Steroids. I. Introduction of Oxygen at Carbon-11 of Progesterone. J. Am. Chem. Soc., 1952, Vol. 74 (23), 5933-5936] получают 11α-ацетоксипрогестерон, ацетилируя 11α-гидроксипрогестерон (20 мг) действием уксусного ангидрида (0,6 мл) в среде пиридина (0,6 мл). Смесь выдерживают в течение 16 ч при комнатной температуре. По окончании реакции реакционную массу разбавляют 25 мл воды, выдерживают в течение 1 ч, охлаждают для начала кристаллизации. Кристаллы отделяют фильтрацией, промывают водой и сушат. Получают 16,1 мг 11α-ацетоксипрогестерона с т.пл. 176-177°С.
Таким образом, из уровня техники следует, что образование 11α-ацетоксипрогестерона при трансформации прогестерона культурами мицеллиальных грибов вообще, в частности, рода Aspergillus, конкретно Aspergillus nidulans, ранее не наблюдалось. О применении грибов A. nidulans, обладающих стероид-11α-гидроксилирующей активностью и способных конвертировать прогестерон в 11α-гидроксипрогестерон, для получения 11α-ацетоксипрогестерона сообщается впервые. При этом этерификация 11α-гидроксипрогестерона грибом A. nidulans с образованием 11α-ацетоксипрогестерона является вторым этапом процесса трансформации прогестерона и может быть осуществлена как с выделением, так и без выделения 11α-гидроксипрогестерона из культуральной жидкости, образованного на первом этапе биотрансформации.
11α-Гидроксипрогестерон (11α-гидроксипрегн-4-ен-3,20-дион, CAS №80-75-1) является физиологически активным производным прогестерона (прегн-4-ен-3,20-диона, CAS №57-83-0) - нативного стероидного гормона, синтезируемого желтым телом яичника, корковым веществом (корой) надпочечников, семенными пузырьками и плацентой. Препараты на основе прогестерона применяются в качестве лекарственных средств в медицине и ветеринарии. 11α-Гидроксипрогестерон, как и его 11β-эпимер, обладает ингибирующей активностью в отношении фермента 11β-гидроксистероид-дегидрогеназы, который окисляет 11-гидрокси-группу в 11-кето-группу, таким образом играя регулятивную роль в поддержании электролитного баланса [G.W. Souness, S.A. Latif, J.L. Laurenzo, D.J. Morris. 11 alpha- and 11 beta-hydroxyprogesterone, potent inhibitors of 11 beta-hydroxysteroid dehydrogenase (isoforms 1 and 2), confer marked mineralocorticoid activity on corticosterone in the ADX rat. Endocrinology. 1995, Vol. 136(4), 1809-1812].
11α-Ацетоксипрогестерон (11α-гидроксипрогестерона ацетат, CAS №2268-98-6) обладает физиологической активностью, является активным фармацевтическим ингредиентом и относится к средствам, снижающим риск преждевременных родов [http://www.imcopharma.cz/ru/api/11-alfa-gidroksiprogesteron-acetat]. 11α-Ацетоксипрогестерон также служит исходным субстратом в синтезе других стероидных соединений.
11α-Ацетоксипрогестерон и 11α-гидроксипрогестерон, являясь производными прогестерона, обладающими гестагенной активностью, могут быть использованы в комбинации с природными или синтетическими эстрогенами в качестве активного ингредиента как в препаратах для пероральной контрацепции, так и в препаратах для гормональной заместительной терапии женщин в постклимактерический период.
Кроме того, 11α-гидроксипрогестерон и его ацетат могут быть использованы не только в качестве прогестагенных средств, как указано выше, но и в качестве антиандрогенных агентов для снижения сальных выделений у пациентов, страдающих себореей, аллопецией и другими заболеваниями кожи, связанными с гиперандрогенизацией [RU 2432952, 2011]. Также известны косметические композиции для ухода за волосами и кожей головы, содержащие 11α-гидроксипрогестерон или 11α-ацетоксипрогестерон [DE 2757024, 1979]. При этом отмечено, что у этих соединений при местном применении гормональные побочные эффекты отсутствуют.
11α-Гидроксипрогестерон и 11α-ацетоксипрогестерон могут быть использованы как исходные продукты в синтезе других лекарственных средств для медицинского применения. Например, 11α-гидроксипрогестерон может быть использован в синтезе 11-кетопрогестерона (кетогестина, CAS №516-15-4), который далее превращают в кортизон или 11β-гидроксипрогестерон - предшественник нативного гидрокортизона - методами, известными из уровня техники. Химический метод перехода от 11α-гидроксипрогестерона к 11-кетопрогестерону с выходом более 90% и далее в 11β-гидроксипрогестерон описан в патенте [US 2015376225, 2015, примеры 1 и 7 соответственно]. Кроме того, 11α-гидроксипрогестерон может быть использован в качестве исходного соединения в синтезе перспективных аналогов нейростероидного анестетика альфаксолона [P.Y. Savechenkov, D.C. Chiara, R. Desai, A.T. Stern, X. Zhou, A.M. Ziemba, A.L. Szabo, Y. Zhang, J.B. Cohen, S.A. Forman, K.W. Miller, K.S. Bruzik. Synthesis and pharmacological evaluation of neurosteroid photoaffinity ligands. European Journal of Medicinal Chemistry. 2017. Vol. 136, P. 334-347].
Раскрытие изобретения
Технической задачей, решаемой с помощью настоящего изобретения, является расширение номенклатуры микроорганизмов, способных проводить 11α-гидроксилирование прогестерона, а именно, создание нового рекомбнантного штамма аскомицета A. nidulans, содержащего новую автономно реплицируемую плазмиду, способного к 11α-гидроксилированию прогестерона, а также расширение ассортимента методов ацетилирования вторичной гидроксильной группы при атоме С11 молекулы прогестерона, благодаря наличию способности штамма по настоящему изобретению ацетилировать вторичную гидроксильную группу при атоме С11 молекулы прогестерона, как альтернативы химическому методу ацетилирования.
Поставленная задача решалась путем использования штамма A. nidulans 031/pDHG25-SgrDI (pyrG-), полученного трансформацией автономно реплицируемой плазмиды pDHG25-SgrDI с геном устойчивости к ампициллину APr, геном argB и уникальным сайтом рестрикции SgrDI в штамм A. nidulans 031 (argB-; pyrG-) - ауксотроф штамма дикого типа A. nidulans ВКПМ F-1069 ранее для биотрасформации стероидных соединений, в том числе прогестерона, не применялся. Штамм A. nidulans 031 (argB-; pyrG-) (synonym FP-308.1; AN031; CBS 129193) - ауксотроф штамма Aspergillus nidulans ВКПМ F-1069 (synonym FGSC A4; ATCC 3863, 12996, 26451; CBS 112.46; NRRL 194), несущий мутации argB2 (требующий аргинин) и pyrG89 (требующий уридин и урацил).
Штамм A. nidulans 031/pDHG25-SgrDI (pyrG-) - новый рекомбинантный штамм, получен впервые, его стероид-11α-гидроксилирующая активность обнаружена впервые. Этот штамм впервые применен для биотрасформации прогестерона. Установлена способность этого штамма конвертировать прогестерон в 11α-гидроксипрогестерон и 11α-ацетоксипрогестерон.
Для получения штамма A. nidulans 031/pDHG25-SgrDI (pyrG-) была создана новая плазмида pDHG25-SgrDI. Плазмида pDHG25-SgrDI сконструирована на основе известной автономно реплицируемой плазмиды pDHG25 для организма Aspergillus nidulans [D. Gems, I.L. Johnstone, A.J. Clutterbuck. An autonomously replicating plasmid transforms Aspergillus nidulans at high frequency. Gene, 1991, Vol. 98, 61-67] путем введения в нее уникального сайта SgrDI с помощью известных молекулярно-генетических методов [J. Sambrook, Т. Maniatis, and E.F. Fritsch. Molecular cloning a laboratory manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.; 1989].
Для вставки уникального сайта SgrDI проводилась рестрикция известной автономной плазмиды pDHG25 по сайту BamHI с помощью рестриктазы BamHI. Затем проводили дефосфорилирование концов фрагмента с помощью щелочной фосфатазы. Олигонуклеотидный линкер Bam_SgrDI (SEQ ID №1) фосфорилировали T4 полинуклиотидкиназой и с помощью Т4 ДНК-лигазы лигировали дефосфорилированный фрагмент с линкером.
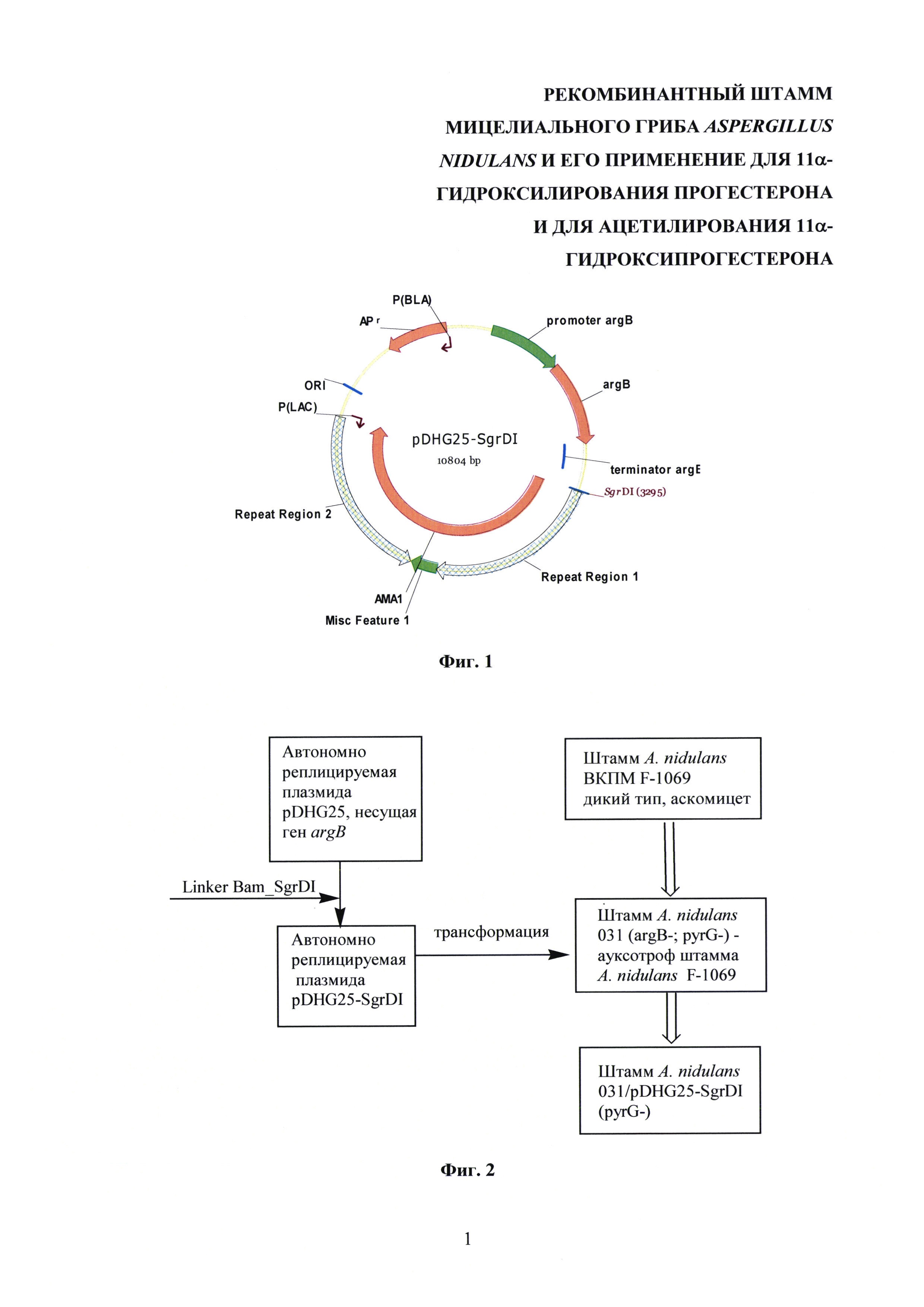
Полученная плазмида pDHG25-SgrDI содержит: репликон плазмиды рМВ1; ген устойчивости к ампициллину APr, что обеспечивает репликацию в E. coli; ген argB A. nidulans; участок АМА1, обеспечивающий автономное реплицирование в A. nidulans, представляющий собой обратный повтор, который является участком центромеры хромосомы A. nidulans. На фиг. 1 изображена карта кольцевой автономно реплицируемой плазмиды pDHG25-SgrDI.
Проведена трансформация мутантного штамма A. nidulans 031 (argB-; pyrG-) полученной плазмидой pDHG25-SgrDI, несущей ген argB, с отбором на селективной среде. Из полученных трансформантов, способных расти на среде без аргинина, для дальнейшей работы был выбран штамм, обозначенный как A. nidulans 031/ pDHG25-SgrDI (pyrG-). [Aleksenko, A.Y., Makarova, N.A., Nikolaev, I.V., and Clutterbuck, A.J., Integrative and replicative transformation of Penicillium canescens with a heterologous nitrate-reductase gene, Curr. Genet., 1995, vol. 28, pp. 474-478].
Техническим результатом является создание нового рекомбинантного штамма мицелиального гриба и применение его для биокаталитического получения стероидных спиртов и их этерификации без использования химических методов. Получение 11α-ацетоксипрогестерона биотрансформацией прогестерона в одну стадию имеет преимущества перед известным из уровня техники двухстадийным процессом, включающим следующие этапы: 1) микробиологическое 11α-гидроксилирование прогестерона и 2) химическое ацетилирование вторичной 11α-гидроксильной группы. Биотехнологическое 11α-гидроксилирование прогестерона и ацетилирование образованного 11α-гидроксипрогестерона с выделением или без выделения его из реакционной массы является экономически эффективным процессом, преимущества которого перед химическим методом ацетилирования состоят в следующем:
- процесс проводится без использования агрессивных химических реагентов, таких как уксусный ангидрид или хлорангидрид уксусной кислоты, без использования сильных минеральных кислот в качестве катализаторов ацетилирования, таких как 60% хлорная кислота;
- биокаталитическая этерификация 11α-гидроксипрогестерона является альтернативой химическому методу ацетилирования, является экологически более чистым и безопасным методом;
- биокаталитическое ацетилирование протекает регионаправленно без образования побочного продукта енолацетилирования Δ4-3-кетогруппы молекулы 11α-гидроксипрогестерона - 3,11α-диацетоксипрегна-3,5-диен-20-она, содержание которого при использовании химического метода ацетилирования может сотавлять 20-30%, что существенно осложняет очистку целевого 11α-ацетоксипрогестерона и приводит к потерям его выхода.
Для достижения указанного выше технического результата предлагается использовать новый штамм Aspergillus nidulans по заявляемому изобретению в качестве биокатализатора для биотехнологических процессов 11α-гидроксилирования и 11α-ацетоксилирования прогестерона, а также биокаталитической этерификации 11α-гидроксипрогестерона.
11α-Ацетоксипрогестерон при необходимости может быть гидролизован любым удобным способом с образованием 11α-гидроксипрогестерона, известным из уровня техники. Так, например, известен химический метод получения 11α-гидроксипрогестерона сольволизом 11α-ацетоксипрогестерона действием (бистрибутилолово)оксида [M.G. Perez, and M.S. Maier. Mild deprotection of steroid esters by bis(tributyltin)oxide. Tetrahedron Letters, 1995. Vol. 36(19), 3311-3314] или традиционным способом химического сольволиза в условиях основного катализа: в среде метанола в присутствии КОН [Т. Kubota, and F. Hayashi. Studies on A-norsteroids - VI. Directing effects of С11 substituents on the addition of osmium tetroxide to steroidal Δ1,4-3-ketones. Tetrahedron, 1967. Vol. 23, 995-1006].
Культурально-морфологические особенности заявляемого штамма.
Штамм A. nidulans 031/pDHG25-SgrDI (pyrG-) на агаризованной среде образует круглые колонии диаметром 30-35 мм через 7 суток роста. Поверхность ровная, выпуклая, пушистая. Текстура средней плотности. Край колоний плотный, неровный. Цвет колоний в зоне спороношения зеленовато-белый. Обратная сторона палево-коричневая. Эксудат отсутствует. Характеризуются интенсивным спороношением. Цвет спор ярко-зеленый.
Основным свойством штамма по заявляемому изобретению является наличие стероид-11α-гидроксилирующей активности и способности конвертировать прогестерон в 11α-ацетоксипрогестерон, а также ацетилирующей активности и способности этерифицировать 11α-гидроксипрогестерон.
Схема создания нового штамма A. nidulans 031/pDHG25-SgrDI (pyrG-) по настоящему изобретению, исходя из известного штамма A. nidulans ВКПМ F-1069, приведена на фиг. 2.
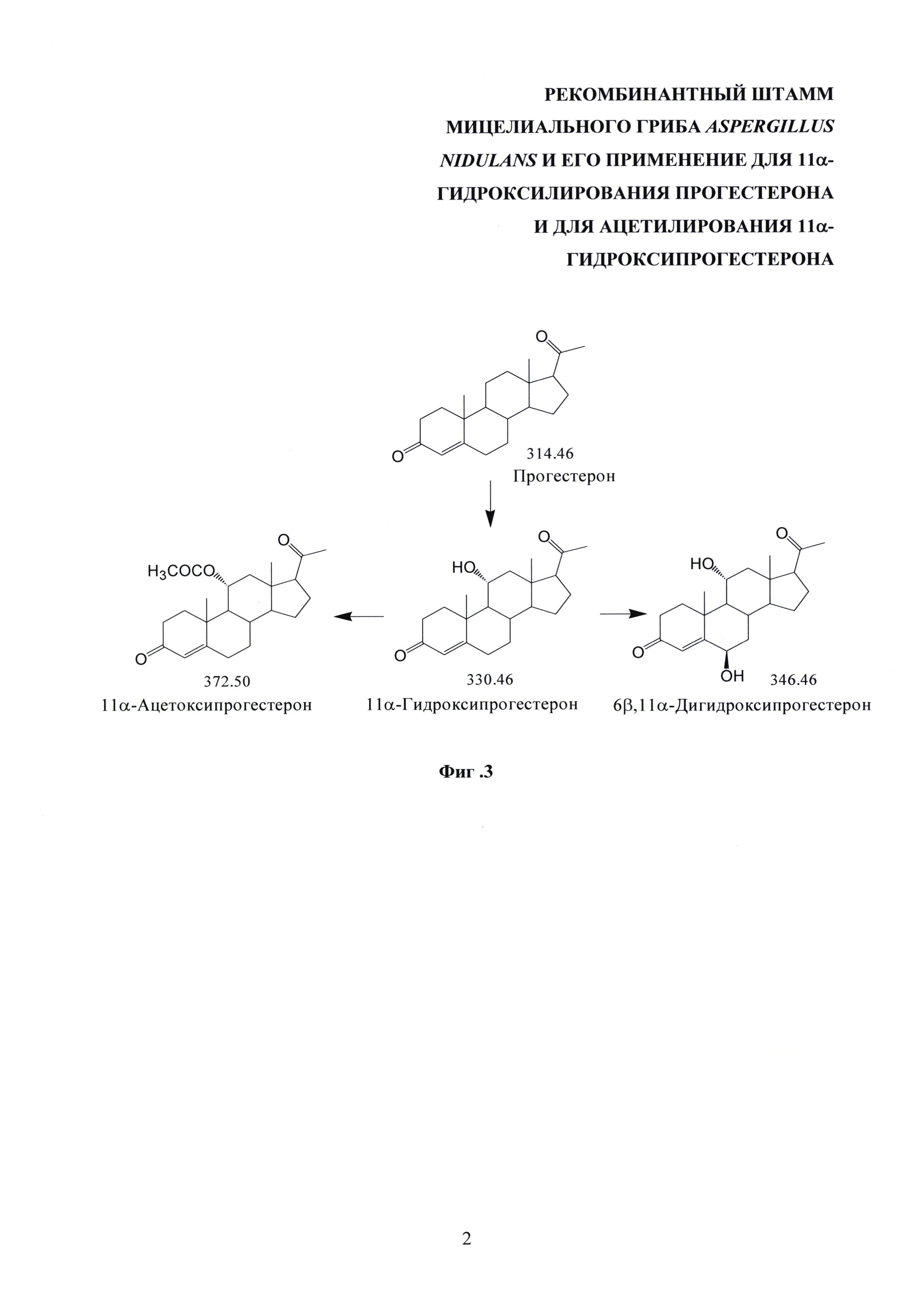
На фиг. 3 представлена схема трансформации прогестерона заявляемым штаммом Aspergillus nidulans 031/pDHG25-SgrDI (pyrG-).
Трансформация прогестерона протекает с первичным образованием 11α-гидроксипрогестерона. Процессы ацетилирования гидроксильной группы образованного 11α-гидроксипрогестерона и его 6β-гидроксилирования с образованием 6β,11α-дигидроксипрогестерона являются вторичными, конкурентными процессами трансформации, причем процесс биокаталитической этерификации имеет преимущества. Этот вывод подтвержден экспериментально. При продолжительности трансформации 14 ч штаммом A. nidulans 031/pDHG25-SgrDI (pyrG-) в культуральной среде определено наличие только 11α-ацетоксипрогестерона и нетрансформированного исходного субстрата. Кроме того, используя 11α-гидроксипрогестерон вместо прогестерона в качестве исходного субстрата в аналогичных условиях трансформации штаммом А. nidulans 031/pDHG25-SgrDI (pyrG-), было отмечено, что в течение 23 ч имеет место образование исключительно 11α-ацетоксипрогестерона.
Таким образом, сущность заявленного изобретения заключается в создании нового рекомбинантного штамма мицелиального гриба A. nidulans 031/pDHG25-SgrDI (pyrG-) трансформацией новой автономно реплицируемой плазмиды pDHG25-SgrDI в штамм А. nidulans 031 (argB-; pyrG-) - ауксотроф штамма дикого типа Aspergillus nidulans ВКПМ F-1069 - и его применении для 11α-гидроксилирования прогестерона и ацетилирования 11α-гидроксипрогестерона с выделением или без выделения последнего из культуральной жидкости.
Преимущества применения штамма A. nidulans 03l/pDHG25-SgrDI (pyrG-) по настоящему изобретению состоят в способности конвертировать прогестерон в 11α-гидроксипрогестерон и ацетилировать гидроксильную группу в молекуле 11α-гидроксипрогестерона с образованием 11α-ацетоксипрогестерона как с выделением 11α-гидроксипрогестерона из культуральной среды, так и без выделения, in situ.
Краткое описание чертежей
На фиг. 1 изображена карта кольцевой автономно реплицируемой плазмиды pDHG25-SgrDI.
На фиг. 2 представлена схема создания штамма Aspergillus nidulans 031/pDHG25-SgrDI (pyrG) по настоящему изобретению, исходя из известного штамма A. nidulans ВКПМ F-1069.
На фиг. 3 представлена схема трансформации прогестерона штаммом A. nidulans 031/pDHG25-SgrDI (pyrG).
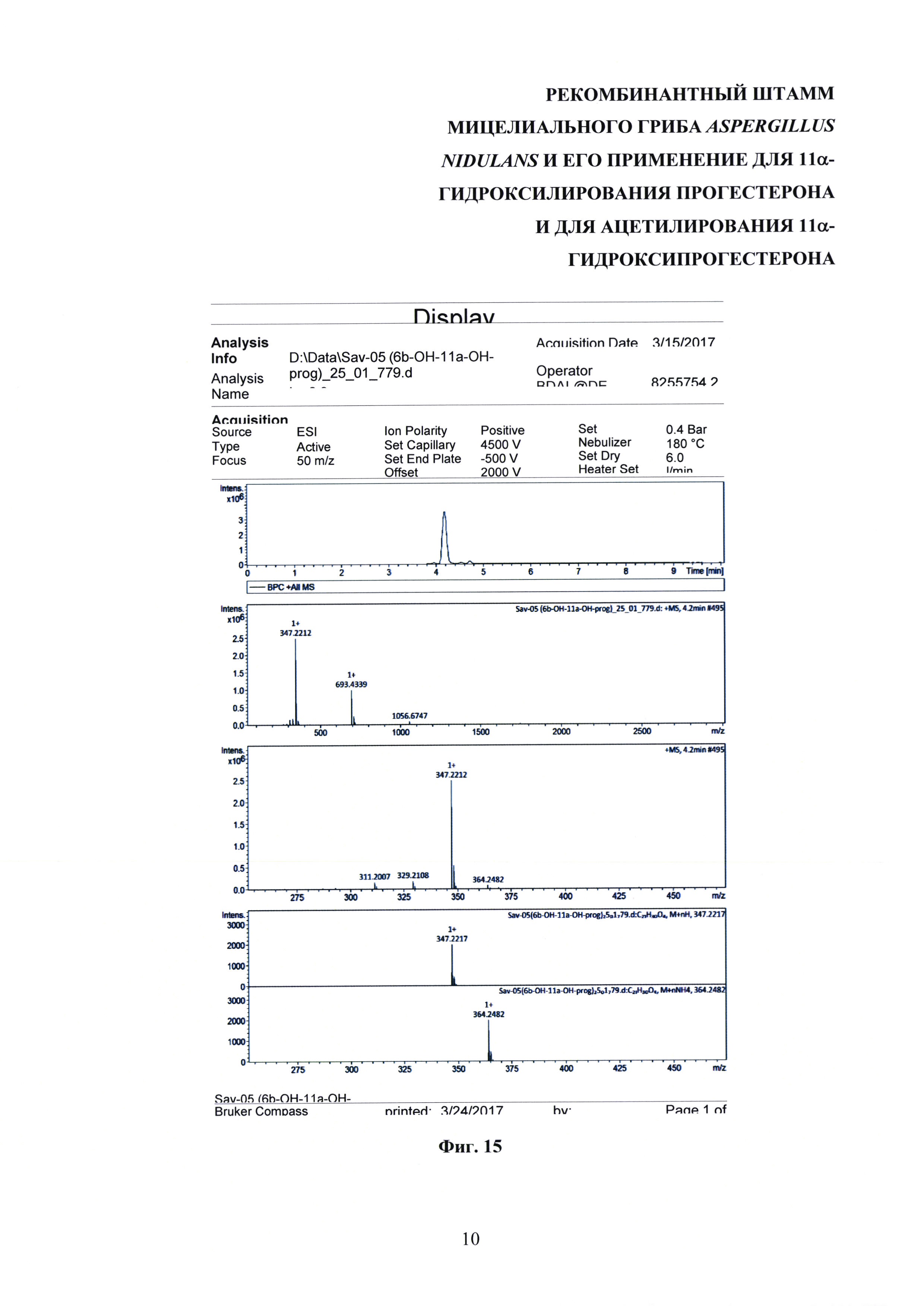
На фиг. 4, 7 и 15 представлены хроматограммы хромато-масс-спектрометрического анализа 11α-гидроксипрогестерона, 11α-ацетоксипрогестерона и 6β,11α-дигидроксипрогестерона соответственно.
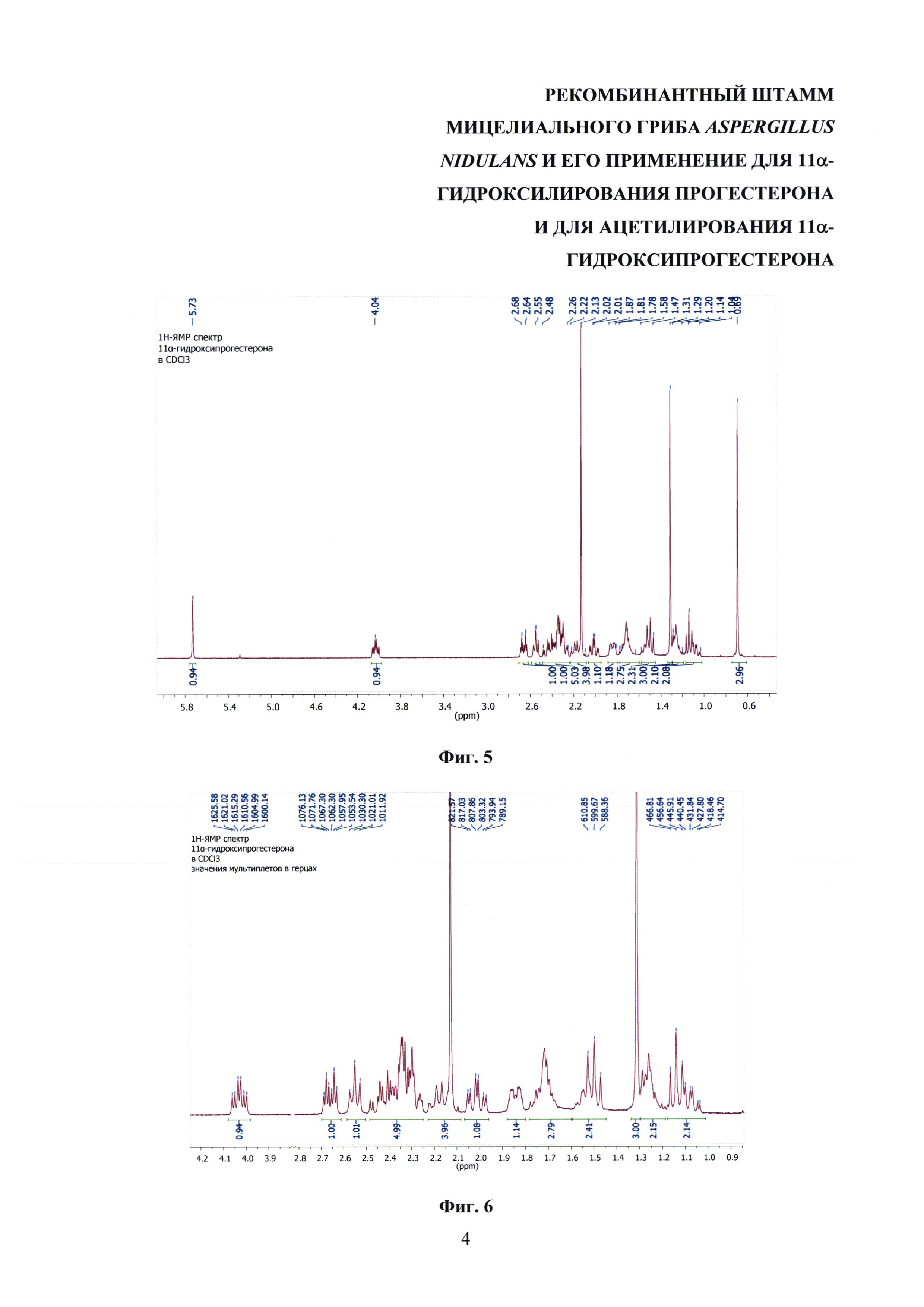
На фиг. 5 и 6 представлены 1Н ЯМР-спектры 11α-гидроксипрогестерона.
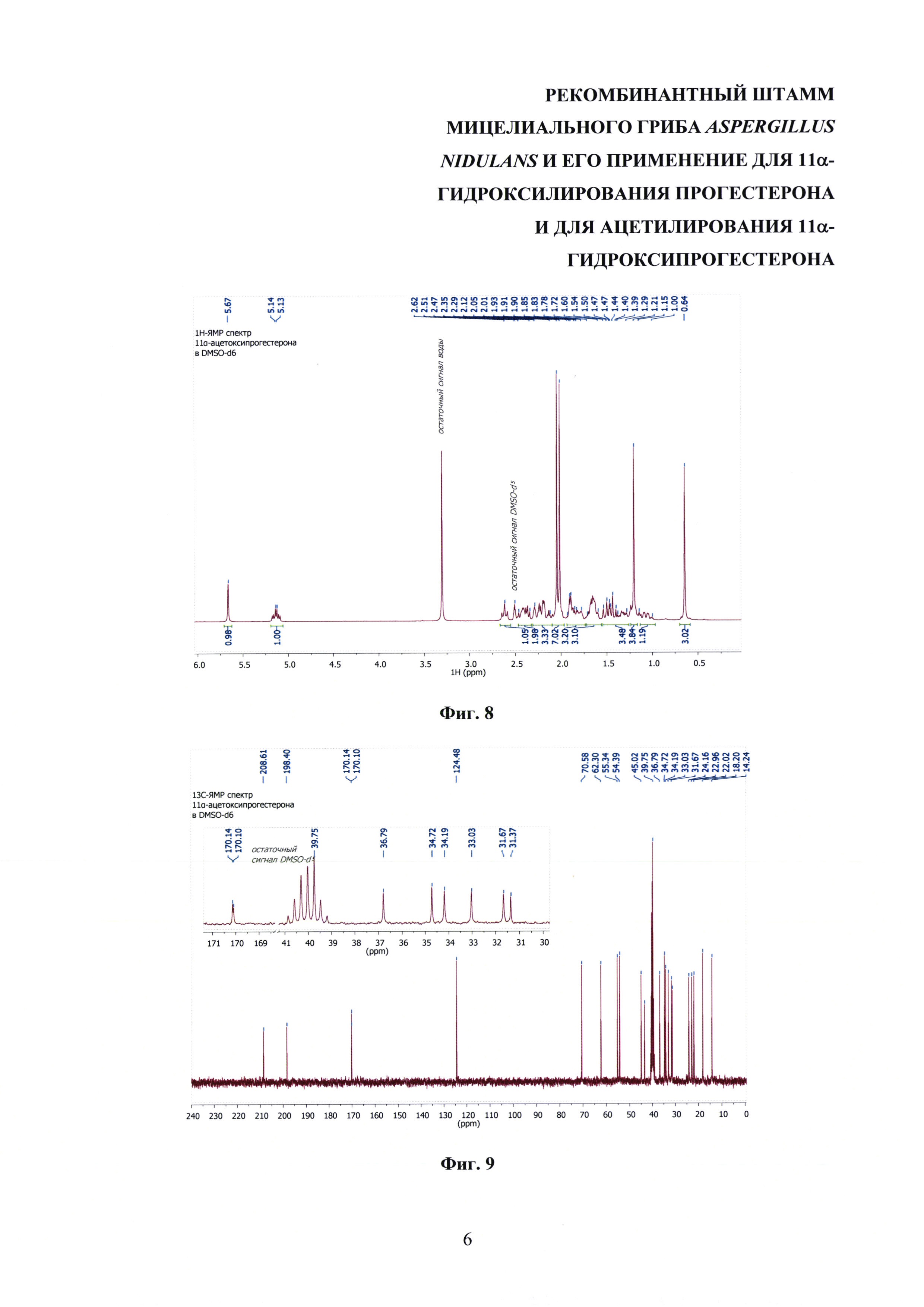
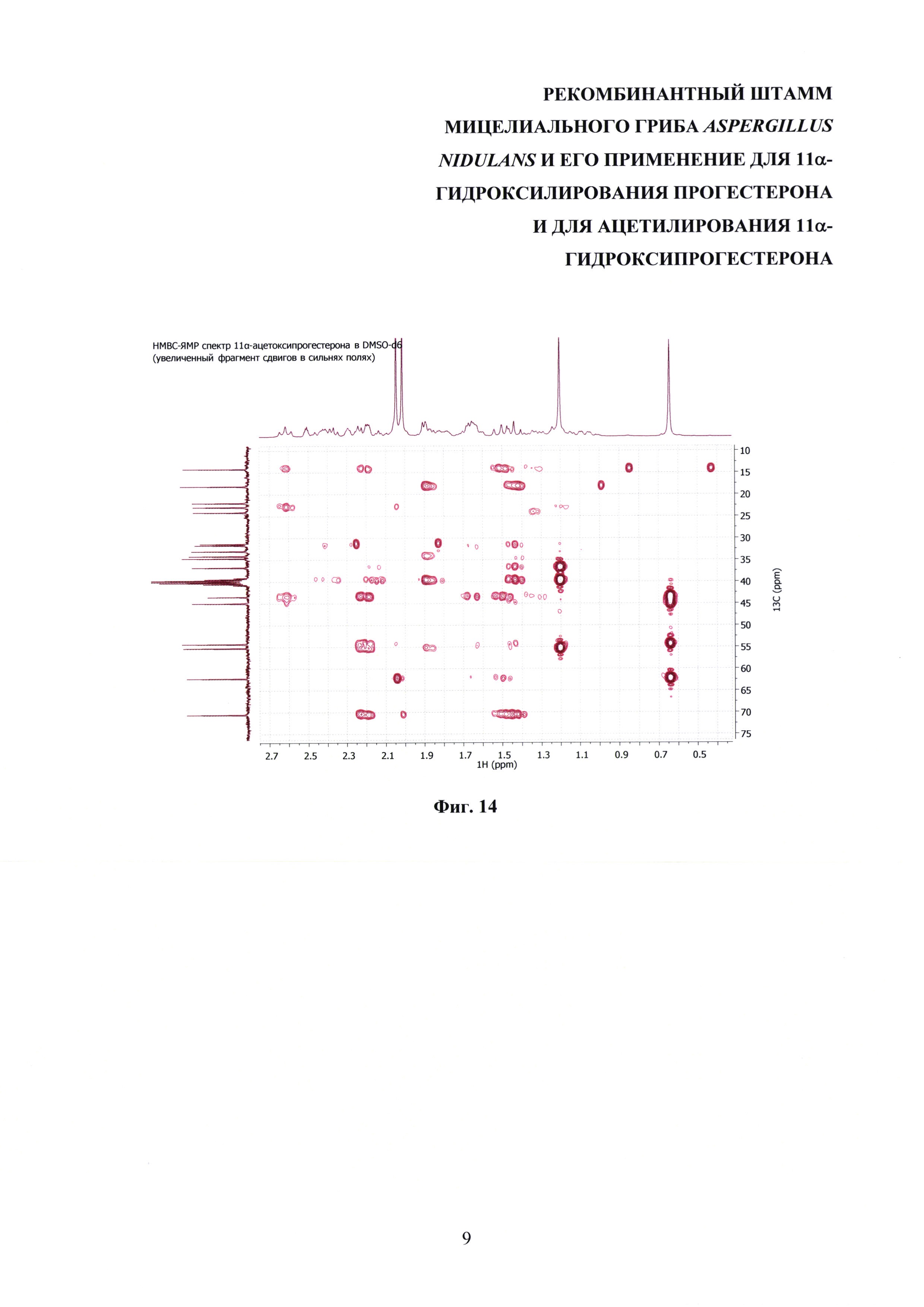
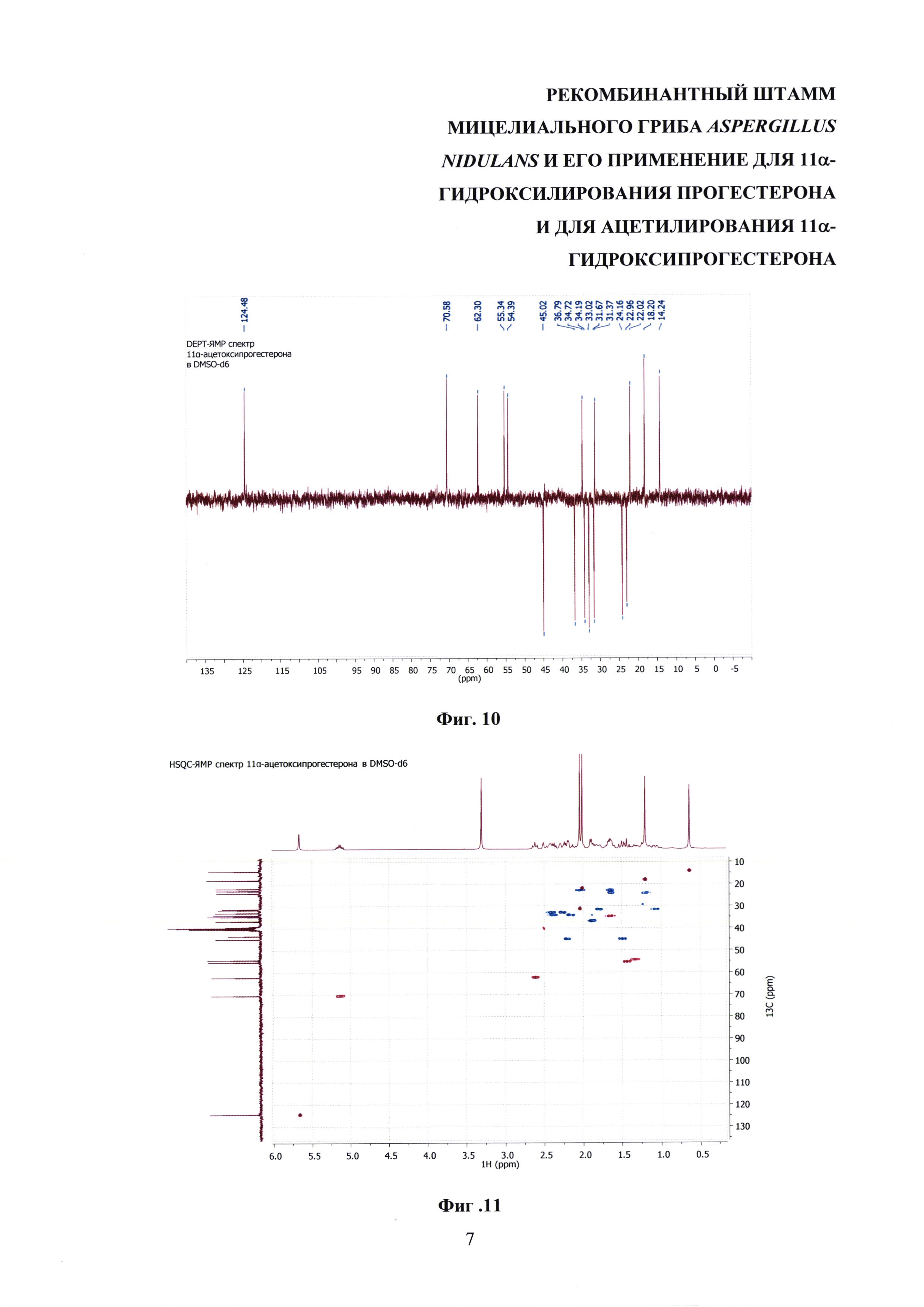
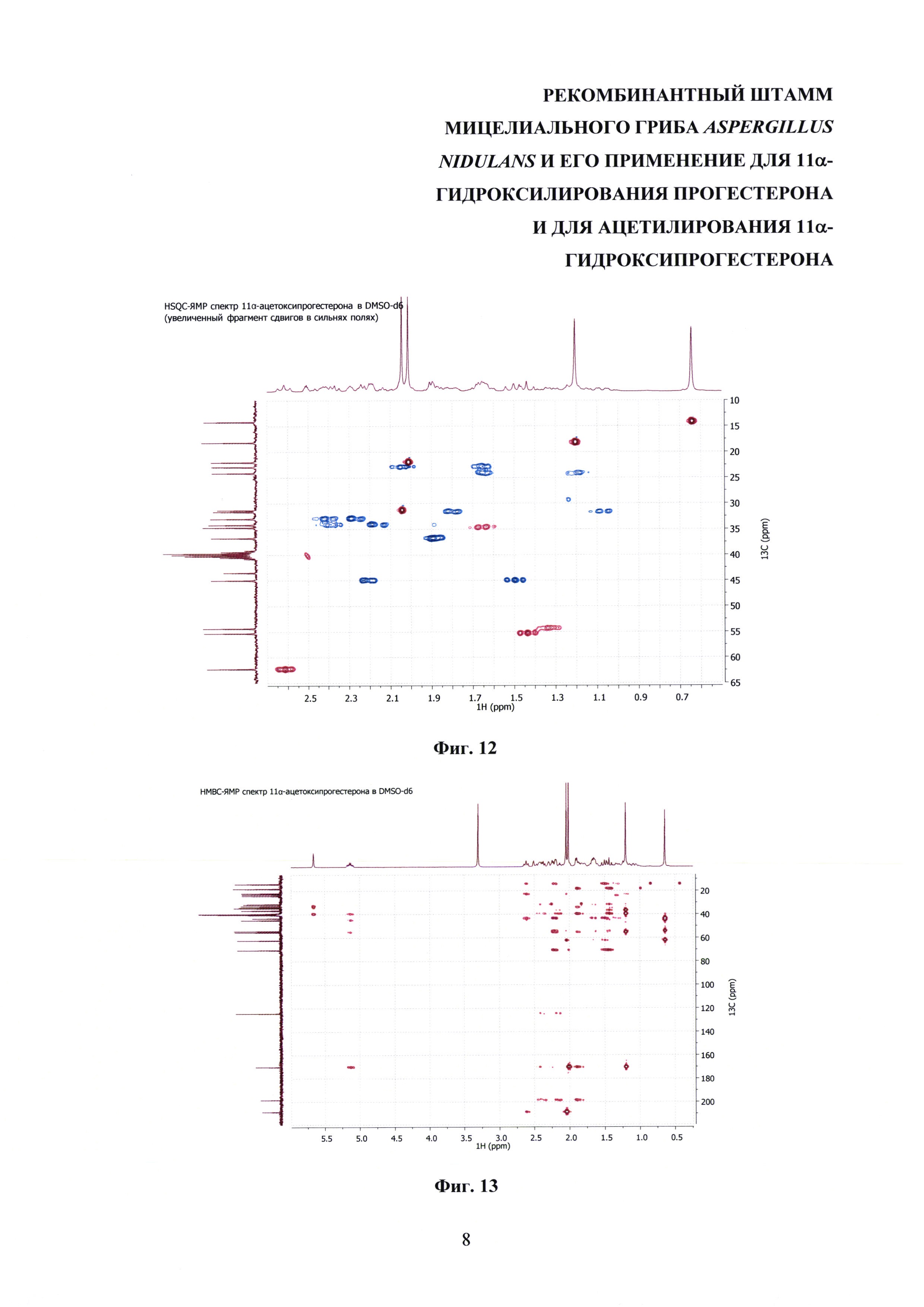
На фиг. 8-14 представлены 1Н ЯМР-, 13С ЯМР-, DEPT-ЯМР-, HSQC-ЯМР- и НМВС-ЯМР- спектры 11α-ацетоксипрогестерона.
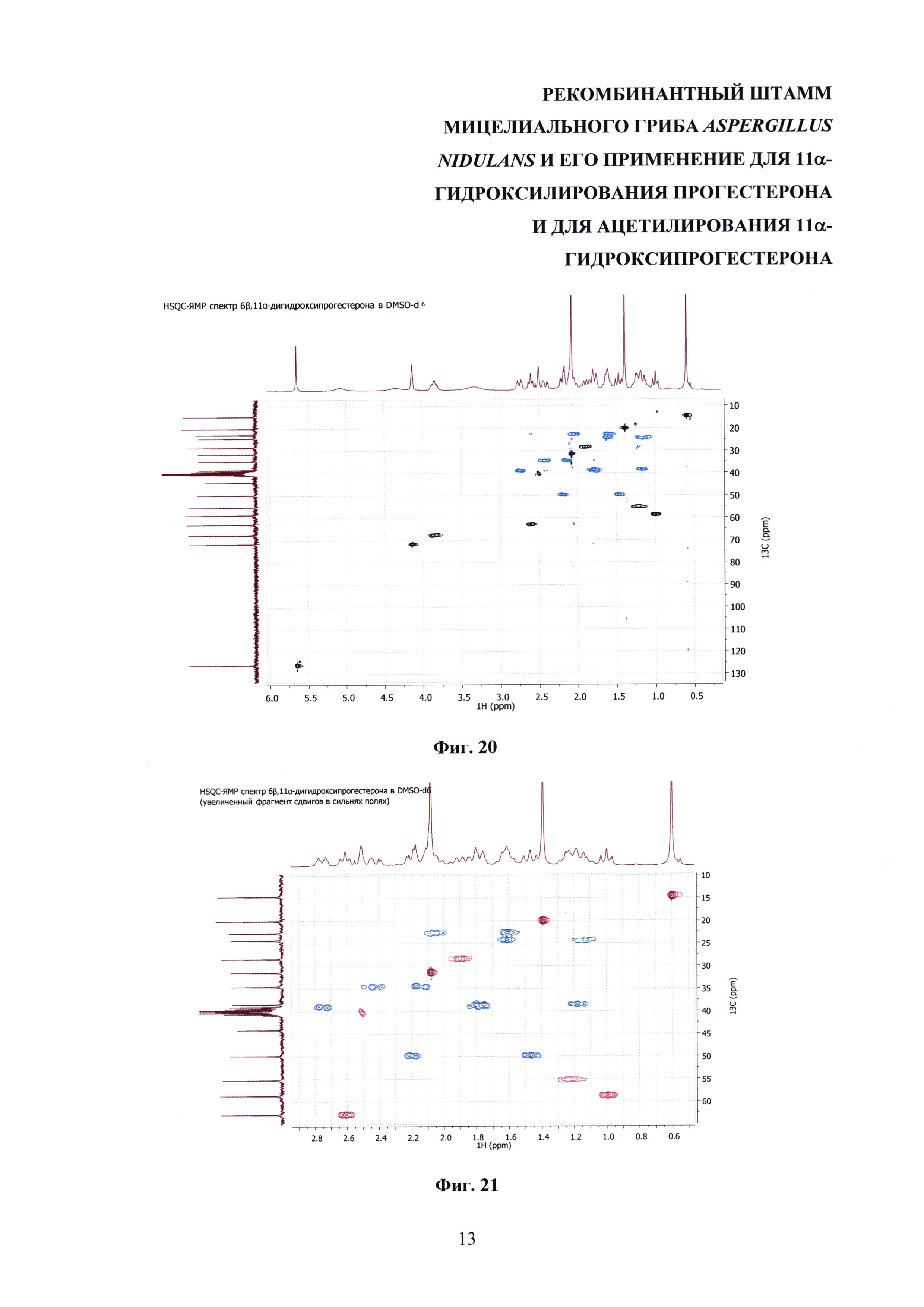
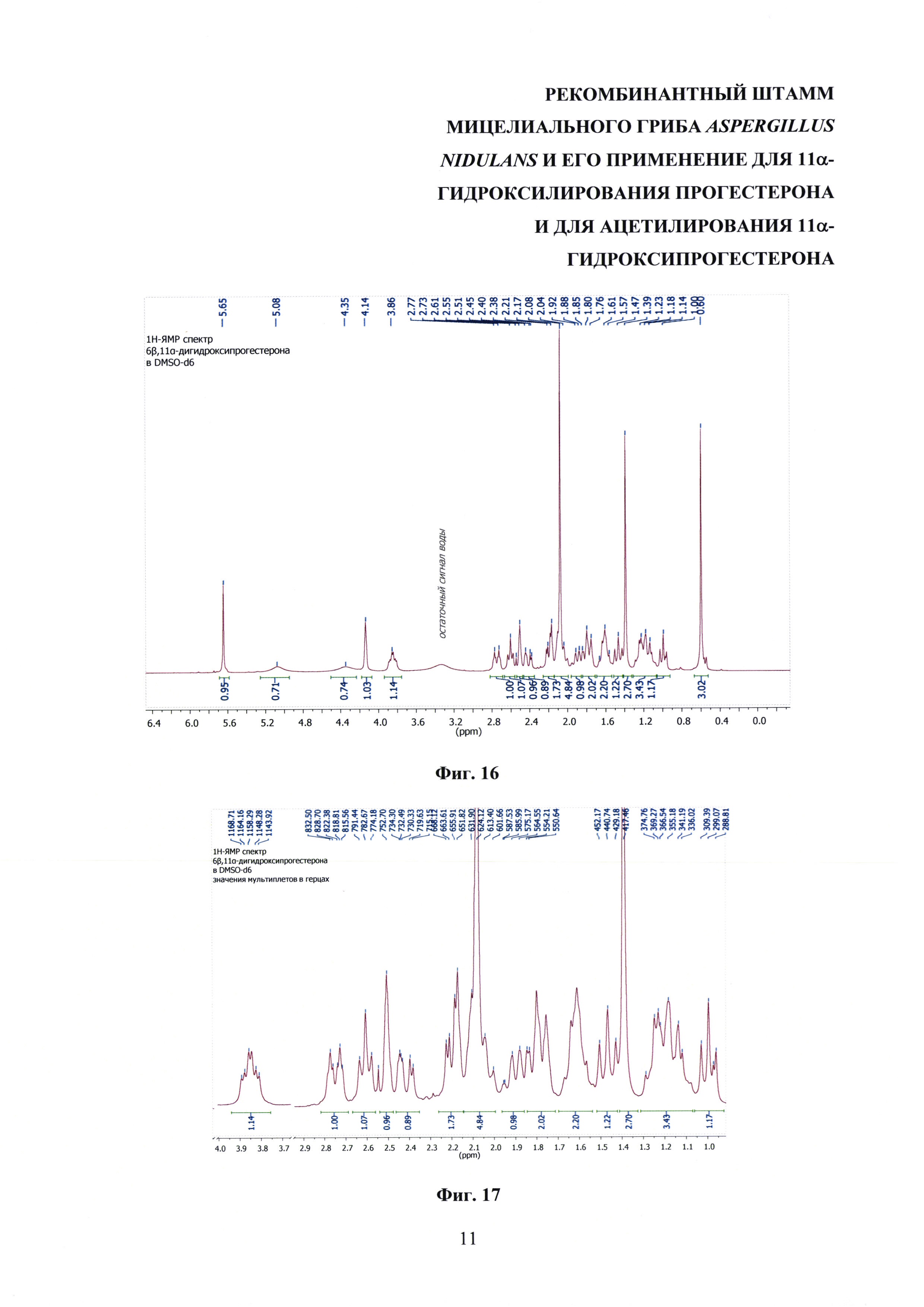
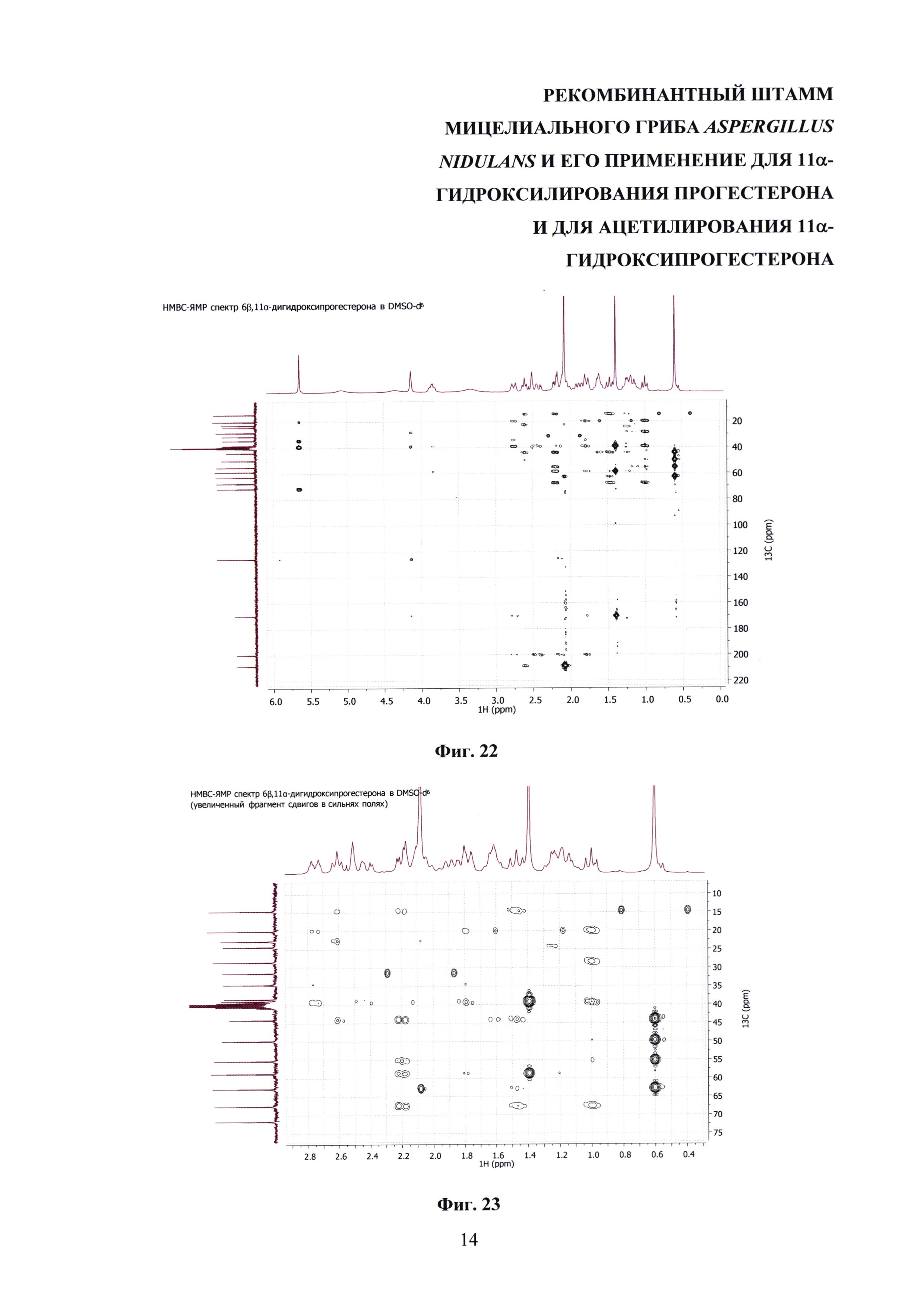
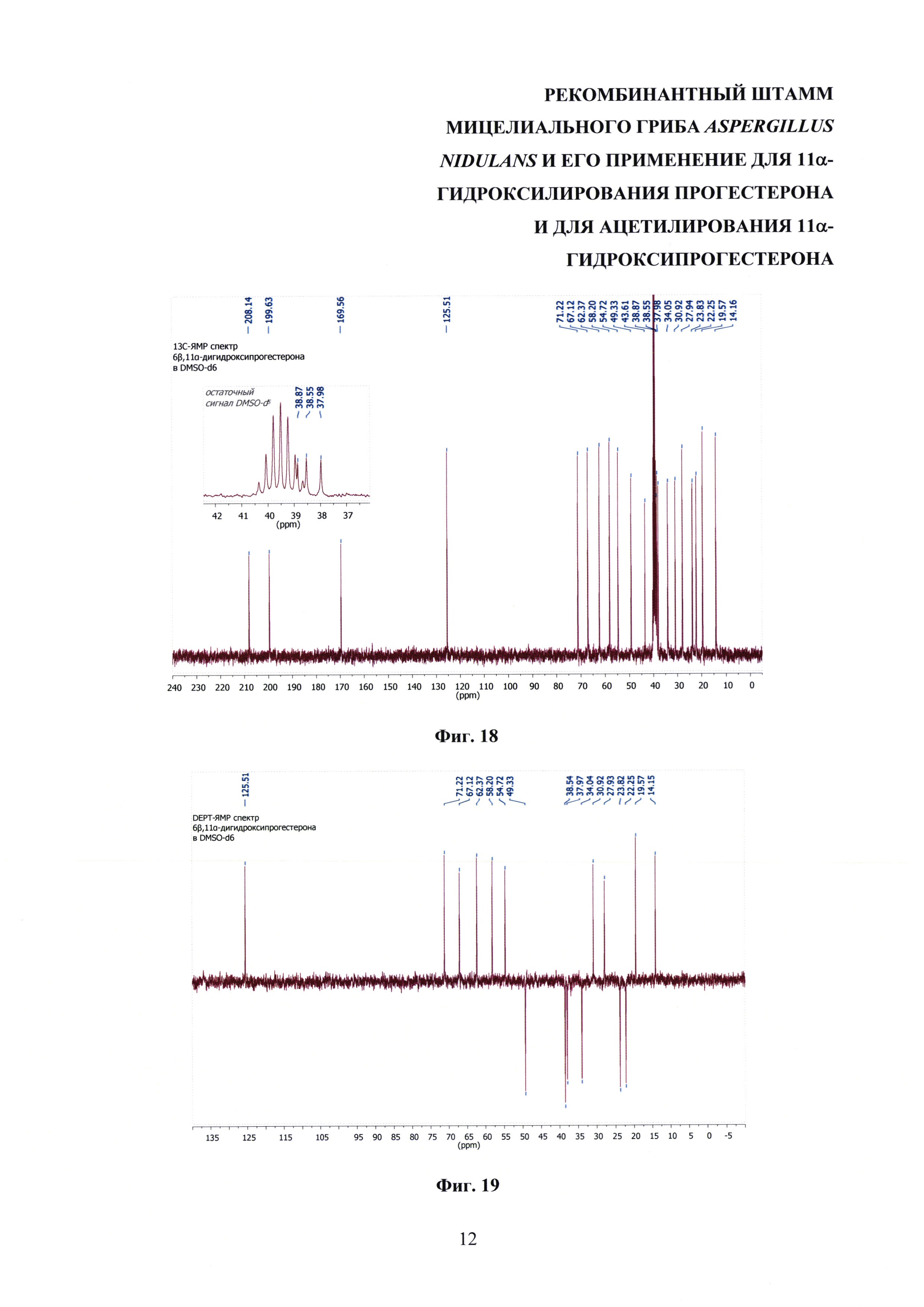
На фиг. 16-23 представлены 1Н-ЯМР-, 13С-ЯМР-, DEPT-ЯМР-, HSQC-ЯМР- и НМВС-ЯМР - спектры 6β,11α-дигидроксипрогестерона.
Осуществление изобретения
Ауксотроф штамма A. nidulans ВКПМ F-1069 - A. nidulans 031 (argB-, pyrG-) (synonym FP-308.1 [U. Christensen, B.S. Gruben, S. Madrid, H. Mulder, I. Nikolaev, and R.P. de Vries, Unique Regulatory Mechanism for d-Galactose Utilization in Aspergillus nidulans, Appl Environ Microbiol. 2011 Vol. 77(19), 7084-7087]; AN031 [J.V. Forment, D. 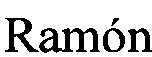 , and A.P. MacCabe; Consecutive gene deletions in Aspergillus nidulans: application of the Cre/loxP system. Curr Genet. 2006. Vol. 50, 217-224]); депонирован в коллекции "The CBS-KNAW culture collection" (Нидерланды) под номером CBS 129193 [http://www.westerdijkinstitute.nl/Collections/Biolomics.aspx?Table=CBS%20strain%20database].
, and A.P. MacCabe; Consecutive gene deletions in Aspergillus nidulans: application of the Cre/loxP system. Curr Genet. 2006. Vol. 50, 217-224]); депонирован в коллекции "The CBS-KNAW culture collection" (Нидерланды) под номером CBS 129193 [http://www.westerdijkinstitute.nl/Collections/Biolomics.aspx?Table=CBS%20strain%20database].
Прогестерон (I) (CAS №57-83-0, C21H30O2), 11α-гидроксипрогестерон (II) (CAS №80-75-1, C21H30O3) и 11α-ацетоксипрогестерон (C23H32O4, M.w. 372.5 являются коммерчески доступными и могут быть приобретены, например, у компании Steraloids Inc. (USA) или у других производителей.
Неорганические соли были приобретены у компании Fluka (Germany). Дрожжевой экстракт и агар - Difco Becton Dickinson and company (Sparks, USA).
Другие реагенты, растворители, и инертные газы являются коммерчески доступными, были приобретены у российских производителей.
Для приготовления сред для культивирования и трансформации, водных растворов кислот, солей и щелочей использовали дистиллированную воду. Для промывки экстрактов в органических растворителях использовали питьевую водопроводную воду, если не оговорено особо.
Все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 20 до 25°С. Для процессов, требующих более низкие температуры, чем комнатная, охлаждение обеспечивали холодной водопроводной водой (в диапазоне от 10 до 20°С), или смесью колотого льда и холодной воды (в диапазоне от 5 до 10°С), или смесью колотого льда и хлорида кальция (при температуре ниже 5°С).
Культивирование микроорганизмов осуществляли на качалке New Brunswick™ Innova® 44/44R в термостатированном помещении при температуре 37°С (240-250 об/мин., амплитуда 5 см).
Упаривание растворителей в вакууме осуществляли с использованием ротационного вакуумного испарителя Rotavapor ( Labortechnik AG), при остаточном давлении 0,35±0,05 кгс/см2 (35±5 кПа) и температуре воды в бане в диапазоне от 35-50°С в зависимости от природы упариваемого растворителя.
Labortechnik AG), при остаточном давлении 0,35±0,05 кгс/см2 (35±5 кПа) и температуре воды в бане в диапазоне от 35-50°С в зависимости от природы упариваемого растворителя.
Высушивание кристаллов продуктов до постоянного веса осуществляли при температуре 35-45°С при атмосферном давлении или с использованием вакуум-сушильного шкафа при остаточном давлении 0,35±0,05 кгс/см2 (35±5 кПа).
Для определения рН промывных вод использовали универсальную индикаторную бумагу с диапазоном значений от 0 до 12 (Лахема, Чехия).
Колоночную хроматографию осуществляли на колонке (16×650 мм), используя силикагель марки Silica gel 60 (0.040-0.063 mm) (Merck, Germany).
Контроль за ходом элюирования осуществляли методом тонкослойной хроматографии (ТСХ), используя пластины Silica gel 60 F254 (Merck, Germany) и хроматографические системы растворителей: дихлорметан-ацетон 9:1 (v/v) или дихлорметан-ацетон 4:1 (v/v). Пластинки просматривали в УФ-свете при длине волны 254 нм, затем опрыскивали 1% раствором ванилина в 10% водном растворе HClO4, проявляли при температуре 100-120°С.
Структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ Silica gel 60 F254 (Merck, Germany)), масс-спектрометрия, элементный анализ, ядерный магнитный резонанс (ЯМР), высокоэффективная жидкостная хроматография (ВЭЖХ).
Температуру плавления выделенных соединений определяли на приборе для определения точки плавления М-565 ( Labortechnik AG).
Labortechnik AG).
1Н- и 13C- ЯМР спектры были определены на спектрометре Bruker Avance-400 (Bruker BioSpin GmbH) с рабочей частотой 400 МГц и 100.6 МГц соответственно, используя дейтерированный хлороформ (99,8% D, Sigma-Aldrich), или дейтерированный диметилсульфоксид (99,9% D, Sigma-Aldrich) в качестве растворителя относительно тетраметилсилана (TMS NMR grade ≥99,9%, Sigma-Aldrich) в качестве внутреннего стандарта, в миллионных долях (м.д.).
Масс-спектры высокого разрешения (HRMS) регистрировали на приборе Bruker Daltonics micrOTOF-Q II, используя электрораспылительную ионизацию (ESI). Измерения были получены в режиме положительных ионов со следующими параметрами: граничное напряжение капилляра 4500 В; диапазон масс от m/z 50 до 3000; внешняя калибровка (Electricpray Calibrant Solution, Fluka); давление распылителя 0,4 бар; скорость потока 3 мкл/мин; азот применяли в виде сухого газа (6 л/мин); температура интерфейса была установлена при 180°С. Образец вводили в камеру масс-спектрометра из системы HPLC Agilent 1260, снабженной колонкой Agilent Poroshell 120 ЕС-С18 (3.0×50 mm; 2,7 μm) и защитой, используя автосамплер. Образец вводили в растворе 50% ацетонитрила (квалификация LC-MS) в воде (ультрачистая вода MilliQ, Merck Millipore KGaA, Germany), и колонку элюировали смесью ацетонитрила (А) и воды (В) в градиенте концентраций со скоростью потока 400 мкл/мин в следующих параметрах градиента: 0-15% А в течение 6 мин, 15% - 85% А в течение 1,5 мин, 85% - 0% А в течение 0,1 мин, 0% А в течение 2,4 мин. Время удерживания было следующим: 11α-гидроксипрогестерон - 5,2 мин; прогестерон - 6,7 мин; 11α-ацетоксипрогестерон - 6,0 мин; 6β,11α дигидроксипрогестерон - 4,2 мин.
Образование 11α-ацетоксипрогестерона в результате трансформации прогестерона или 11α-гидроксипрогестерона культурой гриба A. nidulans 031/pDHG25-SgrDI (pyrG-) подтверждено данными спектров 1Н ЯМР, 13С ЯМР, 2D ЯМР, хромато-масс-спектрометрии высокого разрешения. На фиг. №№5, 6, 7-14 и 16-23 приведены спектры и на фиг. №№4, 7 и 15 - хроматограммы полученных соединений.
Для подтверждения образования 11α-ацетоксипрогестерона в процессе трансформации прогестерона или 11α-гидроксипрогестерона культурой A. nidulans 031/ pDHG25-SgrDI (pyrG-) 11α-ацетоксипрогестерон был получен химическим синтезом из 11α-гидроксипрогестерона с применением метода ацетилирования.
При осуществлении изобретения помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [J. Sambrook, Т. Maniatis, and E.F. Fritsch. Molecular cloning a laboratory manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.; 1989; F.M. Ausubel, R. Brent, R.E. Kingston, D.D. Moore, J.G. Seidman, J.A. Smith, and K. Struhl. Current Protocols in Molecular Biology, John Wiley and Sons, N.Y., 1997].
Выходы 11α-гидроксипрогестерона и 11α-ацетоксипрогестерона, полученные биотрансформацией прогестерона и 11α-гидроксипрогестерона штаммом по настоящему изобретению и приведенные в примерах заявляемого изобретения, безусловно, ниже тех, которые необходимы для эффективного промышленного процесса. Однако примеры даны лишь для иллюстрации биокаталитической способности заявляемых штаммов конвертировать прогестерон не только в 11α-гидроксипрогестерон, но и в ацетат 11α-гидроксипрогестерона. Следует отметить, что указанная ацетилирующая способность выявлена нами впервые. Выходы могут быть значительно улучшены за счет оптимизации условий проведения биотрансформации с целью минимизации образования 6β,11α-дигидроксипрогестерона и сдвига направления вторичной модификации 11α-гидроксипрогестерона в сторону ацетилирования. Известно, что состав продуктов зависит от состава среды, рН среды, возраста культуры, от индукции исходным субстратом или продуктом [А.Н. El-Refai, and K.M. Ghanem Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987. Vol. 22(2), 327-338]. Поэтому для снижения активности вторичного энзима 6β-гидроксилазы и уменьшения количества, образованного 6β,11α-дигидроксипрогестерона необходимо оптимизировать параметры проведения процесса трансформации, например, значение рН среды, возраст культуры, способ внесения субстрата, состав среды для трансформации, температурный режим и другие, известные из уровня техники. Для примера в таблице 1 приведено влияние состава среды на конверсию прогестерона заявляемым штаммом, на его 11α-монооксигенаазную активность (суммарно) и на относительную селективность образования 11α-гидроксипрогестерона и 11α-ацетоксипрогестерона, при прочих одинаковых условиях.
Для трансформации мы использовали 2 варианта сред следующего состава:
1 - среда СМ, использованная A.  et al. [А.
et al. [А.  , М. Tadra, J.
, М. Tadra, J.  . Microbial transformations of steroids XXIV. Separation of androstane 17-hydroxy-epimers. Folia Microbiologica. 1964. Vol. 9(6), 380-382] для ацетилирования тестостерона дрожжами и описанная в статье А.Н. El-Refai и K.M. Ghanem [А.Н. El-Refai, and K.M. Ghanem. Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987. Vol. 22(2), 327-338] (среда II, рН 6,5), как наиболее благоприятная для конверсии прогестерона в 11α-гидрокси-производное культурой A. nidulans. Состав среды, г/л: глюкоза - 40; MgSO4×7H2O - 1; KH2PO4 - 0,74; пептон - 1; дрожжевой экстракт - 1; L-аспарагин - 0,7; уридин - 1,1; урацил - 1,2.
. Microbial transformations of steroids XXIV. Separation of androstane 17-hydroxy-epimers. Folia Microbiologica. 1964. Vol. 9(6), 380-382] для ацетилирования тестостерона дрожжами и описанная в статье А.Н. El-Refai и K.M. Ghanem [А.Н. El-Refai, and K.M. Ghanem. Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987. Vol. 22(2), 327-338] (среда II, рН 6,5), как наиболее благоприятная для конверсии прогестерона в 11α-гидрокси-производное культурой A. nidulans. Состав среды, г/л: глюкоза - 40; MgSO4×7H2O - 1; KH2PO4 - 0,74; пептон - 1; дрожжевой экстракт - 1; L-аспарагин - 0,7; уридин - 1,1; урацил - 1,2.
2 - минимальная синтетическая среда ММ. Состав среды, г/л: глюкоза - 20; MgSO4×7H2O - 0,52; KH2PO4 - 1,52; NaNO3 - 0,85; CuSO4×5H2O - 0,13; CaCl2 - 0,11; KCl - 0,52, Н3ВО3 - 5×10-6; MnSO4×5H2O - 1×10-3; ZnSO4×7H2O - 0,8×10-3; Na2MoO4×4H2O - 0,8×10-3; FeSO4×5H2O - 0,8×10-3; уридин - 1,1; урацил - 1,2; 0.5 М фосфатно-цитратный буфер (рН 6.6) - 200 мл/л.
Известно, что минеральные соли, добавленные в среду для культивирования, в частности, CuSO4, могут быть ингибиторами стероид-С21-монооксигеназы (ЕС №1.14.99.10 [Springer Handbook of Enzymes, Vol. 27, Class 1. Oxidoreductases XII. EC 1.14.15-1.97. Second edition. Springer. 2006, p. 302]). Однако результаты экспериментов показали, что на среде СМ образование 21-гидроксипрогестерона как продукта трансформации не наблюдается. Следует отметить, что 21-гидроксипрогестерон наряду с 11α-гидроксипрогестероном является одним из продуктов трансформации прогестерона в этой среде штаммом A. nidulans известным способом [А.Н. El-Refai, and K.M. Ghanem. Some physiological relations of progesterone conversion by Aspergillus nidulans. Egyptian Journal of Microbiology, 1987, Vol. 22(2), 327-338].
Возможность реализации заявляемого изобретения показана, но не ограничена, в примерах конкретного выполнения.
Пример 1. Конструирование плазмиды pDHG25-SgrDI
Для вставки уникального сайта SgrDI проводилась рестрикция известной автономной плазмиды pDHG25 по сайту BamHI с помощью рестриктазы BamHI (фирмы Thermo Fisher Scientific, согласно инструкции производителя [https://www.thermofisher.com/order/catalog/product/ER0051]). Затем проводили дефосфорилирование концов фрагмента с помощью щелочной фосфатазы (Shrimp Alkaline Phosphatase фирмы Thermo Fisher Scientific, согласно инструкции производителя [https://www.thermofisher.com/order/catalog/product/783901000UN]). Олигонуклеотидный линкер Bam_SgrDI (SEQ ID №1) фосфорилировали Т4 полинуклиотидкиназой (фирмы СибЭнзим, согласно инструкции производителя [http://russia.sibenzyme.com/service/protocols/protocol17]) и с помощью Т4 ДНК-лигазы (СибЭнзим, [http://russia.sibenzyme.com/service/protocols/protocol13]) лигировали дефосфорилированный фрагмент с линкером.
Использовали следующие условия лигирования: смесь, состоящую из 5 мкл дефосфорилированного фрагмента (500 нг), 10 мкл линкера, 1 мкл 10-кратного буфера BamHI (СибЭнзим), 2 мкл 50-кратного PEG400, 1 мкл 10 mM АТР, 2 мкл Т4 ДНК лигазы (1 ед./мкл, Сибэнзим) инкубировали в течение 15 ч при 14°С, затем прогревали 10 мин при 65°С, охлаждали во льду.
5 мкл полученной лигазной смеси использовали для трансформации ультракомпетентных клеток штамма E. coli XL10Gold (Stratagene). Отбор ампициллин-устойчивых клонов осуществляли на среде LB с ампициллином. Дополнительную селекцию проводили с помощью рестрикционного анализа препаратов плазмидной ДНК. Для этого проводили рестрикцию по сайтам PstI, BglII и выбирали плазмидную конструкцию, образующую после рестрикции фрагменты размером 5272, 3954, 1578 пар нуклеотидов. Отобранные плазмидные конструкции секвенировали с помощью олигонуклеотида PrArgB_seq (SEQ ID №2). Выбранную конструкцию (SEQ ID №3) обозначили как pDHG25-SgrDI и использовали в дальнейшей работе для получения штамма A. nidulans 031/pDHG25-SgrDI (pyrG-).
Пример 2. Получение рекомбинантного штамма Aspergillus nidulans 031/ pDHG25-SgrDI (pyrG-)
Для получения рекомбинантного штамма A. nidulans 031/pDHG25-SgrDI (pyrG-), штамм A. nidulans 031 (argB-; pyrG-) был трансформирован плазмидой pDHG25-SgrDI (полученной по примеру 1), несущей ген argB, с отбором по маркеру argB2. [Aleksenko, A.Y., Makarova, N.A., Nikolaev, I.V., and Clutterbuck, A.J., Integrative and replicative transformation of Penicillium canescens with a heterologous nitrate-reductase gene, Curr. Genet., 1995, vol. 28, pp. 474-478]. Была получена серия трансформантов, из которой были отобраны штаммы, способные расти на среде без аргинина. Суммарную клеточную ДНК трансформантов выделяли стандартным методом, наличие плазмиды в выросших штаммах подтверждали секвенированием с использованием праймера PrArgB_seq (SEQ ID №2). Выбрали клон, несущий плазмиду pDHG25-SgrDI. Отобранный штамм был назван A nidulans 031/pDHG25-SgrDI (pyrG-).
Пример 3. Общий метод биотрансформации прогестерона штаммом Aspergillus nidulans 031/ pDHG25-SgrDI (pyrG-) на средах CM и MM в течение 66 ч.
Для получения споровой суспензии штамм выращивали на агаризованной среде МПА (мальт-экстракт - 3 г/л, пептон - 1 г/л, агар - 20 г/л, уридин - 1,1 г/л, урацил - 1,2 г/л) при температуре 37°С в течение 7-10 дней. Споровую суспензию высевали в качалочные колбы вместимостью 750 мл, содержащие по 100 мл среды для культивирования, выращивали на качалке (240-250 об/мин, амплитуда 5 см) при температуре 37°С в течение 4 дней. Затем в ростовую среду вносили прогестерон в виде раствора в диметилсульфоксиде до финальной концентрации 1 г/л, при этом концентрация растворителя не превышала 6% (об.). Трансформацию проводили в течение 66 ч в тех же условиях, параллельно культивируя штаммы без прогестерона в качестве контроля. Каждый эксперимент выполняли в трех повторностях.
Для извлечения продуктов трансформации прогестерона по окончании инкубации мицелий отфильтровывали, промывали дихлорметаном на фильтре. Культуральную жидкость экстрагировали трижды порциями дихлорметана равного объема. Стероиды, адсорбированные на мицелии, извлекали ре-мацерацией (трижды), используя метанол и выдерживая без перемешивания в течение 4 ч. Метанол упаривали, остаток, содержащий воду, экстрагировали дихлорметаном трижды. Объединенные экстракты культуральной жидкости и мицелия промывали водой, сушили Na2SO4, осветляли активированным углем и упаривали до прекращения погона. Остаток растворяли в 5 мл смеси этилацетата и дихлорметана (1:2) и хроматографировали на колонке, используя 30-кратное количество силикагеля к весу остатка после упаривания. В качестве элюэнта использовали смесь дихлорметана и ацетона (от 0 до 25% ацетона), для контроля элюции использовали ТСХ. Хроматографическую чистоту соединений подтверждали с помощью ТСХ и ЯМР-спектроскопии.
Результаты биотрансформации прогестерона штаммом A. nidulans 031/pDHG25-SgrDI (pyrG-) по настоящему изобретению приведены в таблице 1.
Пример 4. Трансформация прогестерона штаммом Aspergillus nidulans 031/ pDHG25-SgrDI (pyrG-) в течение 14 ч.
Споровую суспензию штамма A. nidulans 031/pDHG25-SgrDI (pyrG-) высевали в 4 качалочные колбы вместимостью 750 мл, содержащие по 100 мл среды ММ для культивирования, выращивали на качалке (240-250 об/мин, амплитуда 5 см) при температуре 37°С в течение 4 дней. Затем в ростовую среду вносили прогестерон в растворе диметилсульфоксида до финальной концентрации 1 г/л, при этом концентрация растворителя составляла 4% (об.). Трансформацию проводили в течение 14 ч в тех же условиях.
Для извлечения продуктов трансформации прогестерона по окончании инкубации мицелий отфильтровывали, промывали дихлорметаном на фильтре. Культуральную жидкость экстрагировали трижды порциями дихлорметана равного объема. Стероиды, адсорбированные на мицелии, извлекали ре-мацерацией (трижды), используя метанол и выдерживая без перемешивания в течение 4 ч. Метанол упаривали, остаток, содержащий воду, экстрагировали дихлорметаном трижды. Объединенные экстракты культуральной жидкости и мицелия промывали водой, сушили Na2SO4, осветляли активированным углем и упаривали до прекращения погона. Остаток растворяли в 5 мл смеси этилацетата и дихлорметана (1:2) и хроматографировали на колонке, используя 30-кратное количество силикагеля к весу остатка после упаривания. В качестве элюэнта использовали смесь дихлорметана и ацетона (от 0 до 25% ацетона), для контроля элюции использовали ТСХ. Одинаковые по составу стероидов фракции элюата объединяли и упаривали досуха. Кристаллизующийся остаток растирали с эфиром, осадок отфильтровывали, сушили до постоянного веса в вакуум-сушильном шкафу. Хроматографическую чистоту соединений подтверждали с помощью ТСХ и ЯМР-спектроскопии.
Из 400 мг прогестерона, загруженного на трансформацию, получили 392 мг прогестерона (98%) и 5,82 мг 11α-ацетоксипрогестерона с выходом 1,23% на загруженный субстрат (61,4% на конвертированный субстрат). По данным ТСХ анализа другие продукты трансформации отсутствуют.
Пример 5. Биокаталитическое ацетилирование 11α-гидроксипрогестерона штаммом Aspergillus nidulans 031/pDHG25-SgrDI (pyrG-)
Споровую суспензию штамма A. nidulans 031/pDHG25-SgrDI (pyrG-) высевали в 4 качалочные колбы вместимостью 750 мл, содержащие по 100 мл среды ММ для культивирования, выращивали на качалке (240-250 об/мин, амплитуда 5 см) при температуре 37°С в течение 4 дней. Затем в ростовую среду вносили 11α-гидроксипрогестерон в растворе диметилсульфоксида до финальной концентрации 0,5 г/л, при этом концентрация растворителя составляла 2% (об.). Трансформацию проводили в течение 23 ч в тех же условиях.
Для извлечения продуктов трансформации 11α-гидроксипрогестерона по окончании инкубации мицелий отфильтровывали, промывали дихлорметаном на фильтре. Культуральную жидкость экстрагировали трижды порциями дихлорметана равного объема. Стероиды, адсорбированные на мицелии, извлекали ре-мацерацией (трижды), используя метанол и выдерживая без перемешивания в течение 4 ч. Метанол упаривали, остаток, содержащий воду, экстрагировали дихлорметаном трижды. Объединенные экстракты культуральной жидкости и мицелия промывали водой, сушили Na2SO4, осветляли активированным углем и упаривали до прекращения погона. Остаток растворяли в 5 мл смеси этилацетата и дихлорметана (1:2) и хроматографировали на колонке, используя 30-кратное количество силикагеля к весу остатка после упаривания. В качестве элюэнта использовали смесь дихлорметана и ацетона (от 0 до 20% ацетона), для контроля элюции использовали ТСХ. Одинаковые по составу стероидов фракции элюата объединяли и упаривали досуха. Кристаллизующийся остаток растирали с эфиром, осадок отфильтровывали, сушили до постоянного веса в вакуум-сушильном шкафу. Хроматографическую чистоту соединений подтверждали с помощью ТСХ и ЯМР-спектроскопии.
Из 200 мг 11α-гидроксипрогестерона, загруженного на трансформацию, получили 168 мг 11α-гидроксипрогестерона (84%) и 29,48 мг 11α-ацетоксипрогестерона с выходом 13,08% на загруженный субстрат (81,73% на конвертированный субстрат). По данным ТСХ анализа другие продукты трансформации отсутствуют.
ЯМР-спектры полученного 11α-ацетоксипрогестерона идентичны спектрам стандартного образца и спектрам образца, полученного химическим методом ацетилирования 11α-гидроксипрогестерона.
Пример 6. Получение 11α-ацетоксипрогестерона химическим методом
К раствору 34 мг 11α-гидроксипрогестерона в 0,2 мл уксусного ангидрида добавили 1 каплю 60% хлорной кислоты. Реакционную массу выдерживали при комнатной температуре в течение 1 ч. По окончании реакции реакционную массу добавляли по каплям в 5 мл воды, содержащей 1 мл 25% раствора аммиака (рН ~7.5). Перемешивали 30 мин., затем реакционную массу экстрагировали дихлорметаном трижды, экстракт промыли водой до нейтральной реакции, упарили досуха. Получили 39 мг остатка, из которого препаративной хроматографией извлекли 27 мг 11α-ацетоксипрогестерона с выходом 70,45%. Т.пл. 173-174°С (лит. Т.пл. 176-177°С [D.H. Peterson, Н.С. Murray, S.H. Eppstein, L.M. Reineke, A. Weintraub, P.D. Meister, and H.M. Leigh. Microbiological Transformations of Steroids. I. Introduction of Oxygen at Carbon-11 of Progesterone. J. Am. Chem. Soc., 1952, Vol. 74 (23), 5933-5936]
Характеристика продуктов биотрансформации
11α-Гидроксипрогестерон, полученный биотрансформацией прогестерона штаммом Aspergillus nidulans 031/pDHG25-SgrDI (pyrG-).
Т.пл. 164-166°C (лит. Т.пл. 164-165°С [K. Yildirim, and A. Kuru. Biotransformation of some steroids by Aspergillus candidus. Journal of Chemical Research, 2015. Vol. 39(9), 546-549]). M.w. 330.46.
Масс-спектр высокого разрешения C21H30O3 (m/z): рассчитано для [М+Н]+ 331.2268, найдено 331.2264; рассчитано для [M+Na]+ 353.2087, найдено 353.2088.
1Н-ЯМР (400 МГц, CDCl3): 5.73 (с, 1Н СН-4), 4.04 (ддд (псевдо-дт), 1H, 3J11, 9=10.3 Гц, 3J11, 12α 4.8 Гц, 3J11, 12β 4.6 Гц, СН-11), 2.66 (дт, 1H, 2J1β, 1α 13.7 Гц, 3J1β, 2 4.4 Гц, СН-1β), 2,55 (дд (псевдо-т), 1H, 3J17, 16α 8.7 Гц, 3J17, 16β 9.1 Гц, СН-17), 2.48-2.26 (м, 5Н, СН2-2 & СН2-6 & СН-12β), 2.22-2.10 (м, 1H, СН-16β), 2.13 (с, 3Н, СН3-21), 2.02 (тд, 1Н, 2J1a, 1b 13.7 Гц, 3J1α, 2 4.5 Гц, СН-1α), 1.87-1.81 (м, 1H, СН-7β), 1.78-1.64 (м, 3Н, СН-8 & СН-15α & СН-16α), 1.58-1.47 (2Н (т, 1Н, 3J12α, 12β 11.3 Гц, СН-12α), 1.31 (с, 3Н, СН3-19), 1.29-1.20 (м, 2Н, СН-12α & СН-14), 1.14 (т, 1Н, 3J9, 8 10.3 Гц, СН-9), 1.14-1.04 (2×ддд, 2Н, 3J7α, 7β 13.1 Гц, 3J7, 6 13.0 Гц, 3J7α, 8 3.8 Гц, СН2-7α), 0.69 (с, 3Н, СН3-18).
11α-Ацетоксипрогестерон, полученный биотрансформацией прогестерона штаммом Aspergillus nidulans 031/ pDHG25-SgrDI (pyrG-).
Т.пл. 172-174°С (лит. Т.пл. 176-177°С [D.H. Peterson, Н.С. Murray, S.H. Eppstein, L.M. Reineke, A. Weintraub, P.D. Meister, and H.M. Leigh. Microbiological Transformations of Steroids. I. Introduction of Oxygen at Carbon-11 of Progesterone. J. Am. Chem. Soc., 1952, Vol. 74 (23), 5933-5936]. M.w. 372.5;
Масс-спектр высокого разрешения C23H32O4 (m/z): рассчитано для [М+Н]+ 373.2373, найдено 373.2361; рассчитано для [M+Na]+ 395.2193, найдено 395.2183.
1Н-ЯМР (300 МГц, DMSO-d6): 5.67 (с, 1H СН-4), 5.14 (дт, 1Н, 3J11, 9=10.6 Гц, 3J11, 10 5.0 Гц, СН-11), 2,62 (дд (псевдо-т), 1Н, 3J17, 16α 8.9 Гц, 3J17, 16β 9.1 Гц, СН-17), 2.47-2.35 (м, 2Н, СН-2β & СН-6β), 2.29-2.12 (м, 3Н, СН-6α & СН-12β & СН-2α), 2.10-1.96 (м, 1Н, СН-16β), 2.05 (с, 3Н, СН3-21), 2.01 (с, 3Н, СН3-23), 1.91-1.78 (м, 3Н, СН2-1 & СН-7α), 1.72-1.60 (м, 3Н, СН-16α & СН-15α & СН-8), 1.50 (т, 1H, 3J12α, 12β 11.6 Гц, СН-12α), 1.44 (т, 1H, 3J9, 8 10.6 Гц, СН-9), 1.39-1.29 (ддд, 1Н, 3J14, 8 10.7 Гц, 3J14, 15β 6.4 Гц, 3J14, 15α 5.6 Гц, СН-14) 1.29 (уш.с, 4Н, СН3-19 & СН-15β), 1.17-1.00 (2×ддд, 2Н, 3J7α, 7β 12.6 Гц, 3J7, 6α ~ 3J7, 6β 12.2 Гц, 3J7α, 8 3.1 Гц, СН2-7), 0.64 (с, 3Н, CH3-18).
13С-ЯМР (300 МГц, DMSO-d6): 208.61 (с, СО-20), 199.40 (с, СО-3), 170.14 (с, С-5), 170.10 (с, СО-22) 124.48 (с, СН-4), 70.58 (с, СНОН-11), 62.30 (с, СН-17), 55.34 (с, СН-9), 54.39 (с, СН-14), 45.02 (с, СН2-12), 43.54 (с, С-13), 39.75 (с, С-10), 36.79 (с, СН2-1), 34.72 (с, СН-8) 34.19 (с, СН2-2), 33.03 (с, СН2-6), 31.67 (с, СН2-7), 31.37 (с, СН3-21) 30.92 (с, СН3-21), 24.16 (с, СН2-15), 22.96 (с, СН2-16), 22.02 (с, СН3-21), 18.20 (с, СН3-19), 14.24 (с, СН3-18).
Спектры идентичны спектрам стандартного образца, а также спектрам образца, полученного методом биокаталитического ацетилирования штаммом A. nidulans 031/ pDHG25-SgrDI (pyrG-), и образца, полученного химическим методом ацетилирования 11α-гидроксипрогестерона
6β,11α-Дигидроксипрогестерон, полученный биотрансформацией прогестерона штаммом Aspergillus nidulans 031/pDHG25-SgrDI (pyrG-).
Т.пл. 242-244°C (лит. т.пл. 244-246°C [Z. Habibi, M. Yousefi, Sh. Ghanian, M. Mohammadi, S. Ghasemi. Biotransformation of progesterone by Absidia griseolla var. igachii and Rhizomucor pusillus. Steroids, 2012, Vol. 77, p. 1446-1449]. M.w. 346.46;
Масс-спектр высокого разрешения C23H32O4 (m/z): рассчитано для [М+Н]+ 373.2373, найдено 373.2361; рассчитано для [M+Na]+ 395.2193, найдено 395.2183.
1Н-ЯМР (300 МГц, DMSO-d6): 5.67 (с, 1Н СН-4), 5.14 (дт, 1H, 3J11, 9=10.6 Гц, 3J11, 10 5.0 Гц, СН-11), 2,62 (дд (псевдо-т), 1Н, 3J17, 16α 8.9 Гц, 3J17, 16β 9.1 Гц, СН-17), 2.47-2.35 (м, 2Н, СН-2β & СН-6β), 2.29-2.12 (м, 3Н, СН-6α & СН-12β & СН-2α), 2.10-1.96 (м, 1H, СН-16β), 2.05 (с, 3Н, СН3-21), 2.01 (с, 3Н, СН3-23), 1.91-1.78 (м, 3Н, СН2-1 & СН-7α), 1.72-1.60 (м, 3Н, СН-16α & СН-15α & СН-8), 1.50 (т, 1Н, 3J12α, 12β 11.6 Гц, СН-12α), 1.44 (т, 1Н, 3J9, 8 10.6 Гц, СН-9), 1.39-1.29 (ддд, 1Н, 3J14, 8 10.7 Гц, 3J14, 15β 6.4 Гц, 3J14, 15α 5.6 Гц, СН-14) 1.29 (уш.с, 4Н, СН3-19 & СН-15β), 1.17-1.00 (2×ддд, 2Н, 3J7α, 7β 12.6 Гц, 3J7, 6α ~ 3J7, 6β 12.2 Гц, 3J7α, 8 3.1 Гц, СН2-7), 0.64 (с, 3Н, СН3-18).
13С-ЯМР (300 МГц, DMSO-d6): 208.61 (с, СО-20), 199.40 (с, СО-3), 170.14 (с, С-5), 170.10 (с, СО-22) 124.48 (с, СН-4), 70.58 (с, СНОН-11), 62.30 (с, СН-17), 55.34 (с, СН-9), 54.39 (с, СН-14), 45.02 (с, СН2-12), 43.54 (с, С-13), 39.75 (с, С-10), 36.79 (с, СН2-1), 34.72 (с, СН-8) 34.19 (с, СН2-2), 33.03 (с, СН2-6), 31.67 (с, СН2-7), 31.37 (с, СН3-21) 30.92 (с, СН3-21), 24.16 (с, СН2-15), 22.96 (с, СН2-16), 22.02 (с, СН3-21), 18.20 (с, СН3-19), 14.24 (с, СН3-18).
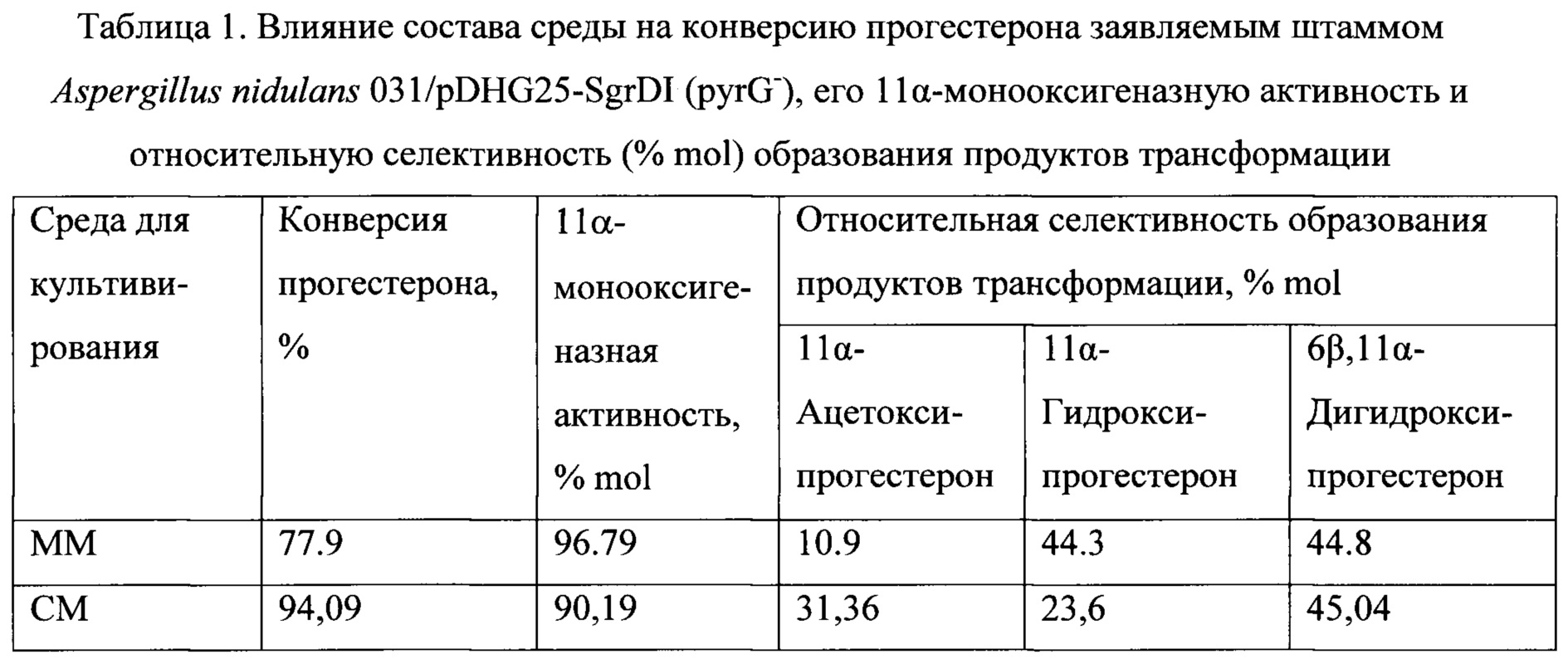
Таким образом, общая селективность 11α-гидроксилирования достигает 96% и более, а содержание 11α-ацетоксипрогестерона в смеси продуктов превышает 31%. Указанная способность заявляемого рекомбинантного штамма подтверждена не только с помощью физико-химических методов анализа структуры органических соединений (масс-спектрометрия высокого разрешения, ЯМР-спектроскопия 1Н, 13С и 2D ЯМР), но и встречным химическим синтезом.