Результат интеллектуальной деятельности: СПОСОБ ПРИГОТОВЛЕНИЯ ИНЪЕКЦИОННОЙ ФОРМЫ ПРЕПАРАТА ХОНДРОИТИНА СУЛЬФАТА
Вид РИД
Изобретение
Предлагаемое изобретение относится к медицине и фармацевтике и касается способа приготовления инъекционной формы препарата хондроитина сульфата (далее ХС), являющегося стимулятором репарации тканей.
Препараты хондроитина сульфата (в частности, на основе Na-соли хондроитинсульфата - мукополисахарида из животных тканей) широко используются в современной медицине для лечения дегенеративно-дистрофических заболеваний суставов и позвоночника (остеоартроза, остеохондроза), ускорения формирования костной мозоли при переломах. Препараты ХС производят в различных лекарственных формах, в том числе в инъекционных, в частности - в форме раствора для внутримышечного введения.
Из патента RU №2021812 известно средство в форме инъекционного раствора, предназначенное для лечения артрологических заболеваний, которое представляет собой смесь хондроитинсульфатов А и С в соотношении 3:2-1:1, консерванта - бензилового спирта и апирогенной воды. Данное средство готовят путем растворения бензилового спирта и ХС в апирогенной воде, после чего раствором натрия гидроксида доводят pH до 7,5, стерильно фильтруют и разливают в ампулы.
Известен также способ получения инъекционной формы препарата хондроитина сульфата, который включает растворение бензилового спирта в воде, установление 30% раствором натрия гидроксида значения pH 7,2-7,4, последующее растворение в полученном растворе ХС, подогрев смеси до 50°C с дальнейшей стерилизующей фильтрацией, розливом в ампулы и их запайкой (Регламент на производство раствора хондроитина сульфата для инъекций // Всесоюзный научно-исследовательский институт технологии кровезаменителей и гормональных препаратов. - М., 1994; цитировано по патенту RU №2200018).
Недостатки этих двух способов описаны в патенте RU №2200018 при характеристике предшествующего уровня техники: «Часто при изготовлении препарата, содержащего ХС (состоящий из уроновой кислоты и гексозамина) и бензиловый спирт, при pH 7,2-7,5 появляется розовое окрашивание раствора, которое усиливается при его хранении. Возникновение розовой окраски свидетельствует о появлении в растворе некоторых производных ХС, наличие которых исключает применение препарата в терапевтических целях».
За прототип предлагаемого изобретения выбран способ приготовления инъекционной формы препарата хондроитина сульфата, охраняемый патентом RU №2200018. Способ-прототип включает растворение бензилового спирта, ХС и гидроксида натрия в инъекционной воде, с использованием нагревания до 50°С, стерилизующей фильтрации, розлива в ампулы и запайки, причем растворы компонентов препарата готовят раздельно, при этом вначале субстанцию ХС растворяют в подогретой инъекционной воде с последующей стерилизацией и охлаждением (раствор А), затем готовят раствор бензилового спирта (раствор Б) и раствор гидроксида натрия (раствор В), затем в раствор А при перемешивании добавляют раствор В до pH 6,2-6,8 и раствор Б, полученную смесь разбавляют инъекционной водой, разливают в ампулы и запаивают (RU №2200018. Способ приготовления инъекционной формы препарата хондроитина сульфата. 10.03.2003).
Способ-прототип позволяет избежать появления розового окрашивания, характерного для описанных выше двух аналогов. Однако он не лишен некоторых недостатков:
- использование нагрева до 50°С и промежуточной стерилизации раствора субстанции порождает риски деградации структуры молекул хондроитина сульфата и изменения интервала заявленной молекулярной массы;
- приготовление нескольких растворов (растворы А, Б, В) в разных единицах оборудования увеличивает время приготовления, усложняет способ приготовления раствора, увеличивает риски изначальной контаминации раствора, тем самым не исключая накопление бакэндотоксинов.
В задачу предлагаемого изобретения положено снижение рисков деградации структуры молекул ХС и изменения интервала заявленной молекулярной массы ХС, снижение рисков изначальной контаминации раствора и накопления бакэндотоксинов, упрощение и ускорение способа приготовления, при условии достижения всех этих результатов одновременно с исключением появления розового окрашивания раствора.
Поставленная задача достигается тем, что предложен способ приготовления инъекционной формы препарата хондроитина сульфата, включающий последовательное растворение в инъекционной воде натрия дисульфита (синонимы: натрия метабисульфит; натрия пиросульфит, натрий пиросернистокислый), соли хондроитина сульфата (МНН хондроитина сульфат), спирта бензилового, с последующим доведением, при необходимости, pH раствора до 6,0-7,5, при этом весь процесс растворения ингредиентов ведут под защитой азота, готовый раствор препарата фильтруют, разливают в ампулы и запаивают ампулы в токе азота.
Отдельными аспектами заявляемого способа являются следующие:
- используют инъекционную воду с температурой 15-30°С;
- растворение каждого ингредиента проводят при постоянном перемешивании до полного растворения;
- доводят pH раствора до 6,0-7,5 с помощью 1 М раствора натрия гидроксида;
- готовый раствор препарата последовательно фильтруют через систему фильтров предварительной и стерилизующей фильтрации;
- заполнение ампул проводят в токе азота.
Новый технический результат, достигаемый заявляемым изобретением, заключается в следующем:
- исключение нагрева до 50°С и промежуточной стерилизации раствора субстанции позволяет уберечь структуру молекул хондроитина от деградации, обеспечить заявленный интервал молекулярной массы;
- использование антиоксиданта и азотной защиты позволяет стабилизировать раствор (предотвратить изменение цветности, pH и количественного содержания);
- исключение стадий раздельного приготовления нескольких растворов (в нескольких единицах оборудования) и приготовление препарата в одной единице оборудования сокращает время приготовления, упрощает способ приготовления раствора, уменьшает риски изначальной контаминации раствора, тем самым предотвращая накопление бакэндотоксинов (что снижает риск получения нестерильного фильтрата).
При отработке технологии препарата изучали последовательность добавления ингредиентов, условия растворения действующего вещества, необходимость защиты препарата азотом в процессе приготовления раствора и при запайке ампул, возможность применения стерилизующей фильтрации и тепловой стерилизации, необходимость добавления вспомогательных веществ, светостойкость и морозостойкость препарата.
В лабораторных условиях были изготовлены образцы препарата:
- с использованием полной газовой защиты азотом;
- с запайкой в токе азота;
- без защиты азотом;
- со стерилизующей фильтрацией через мембрану с диаметром пор 0,22 мкм;
- со стерилизацией автоклавированием при 100°С в течение 30 минут;
- с различным набором вспомогательных веществ (Трилон Б, натрия метабисульфит, натрия сульфит безводный).
Применение термической стерилизации приводит к существенному изменению цветности раствора, изменению pH и количественного содержания действующего вещества в растворе. Поэтому был выбран метод стерилизующей фильтрации раствора.
Была изучена необходимость защиты препарата азотом в процессе приготовления раствора и при запайке ампул. В лабораторных условиях были изготовлены образцы препарата с использованием газовой защиты азотом и без нее. Образцы были заложены на хранение для изучения стабильности методом «ускоренного старения» при температуре 40°С в течение срока, эквивалентного 2 годам хранения в естественных условиях. В течение срока хранения образцы анализировались ОКК по внешнему виду, pH, количественному содержанию хондроитина и бензилового спирта и цветности. Применение азотной защиты привело к снижению падения количественного содержания хондроитина сульфата и бензилового спирта, к замедлению процессов изменения цветности при хранении раствора. Изменение прозрачности раствора не было зафиксировано ни для одного из образцов.
После наработки первых промышленных серий была изучена стабильность препарата при хранении в естественных условиях в течение 2 лет и 3 месяцев (температура (25±2)°С). В течение всего срока наблюдений значения количественного содержания, цветности и pH раствора не выходили за пределы, регламентированные в ФСП. Изменение остальных показателей качества не было зафиксировано ни для одного из образцов.
Предлагаемый способ осуществляют следующим образом.
Проводят расчет загрузки количества ингредиентов:
- Количество субстанции хондроитина сульфата натрия:
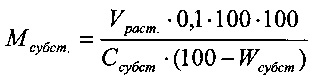 , где
, где
Мсубст.. - масса субстанции хондроитина сульфата натрия, требуемой для загрузки, кг;
Vрост. - регламентированный объем загрузки, л;
Ссубст - количественное содержание хондроитина сульфата натрия в субстанции, масс. % (если количественное содержание по паспорту больше 100%, при расчетах принимать его равным 100%);
Wсубсст - потери в массе при высушивании субстанции хондроитина сульфата натрия, масс. %.
- Количество бензилового спирта:
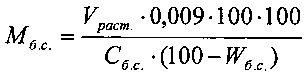
где Мб.с.. - масса раствора бензилового спирта, требуемого для загрузки, кг;
Vраст. - регламентированный объем загрузки, л;
Сб.с. - количественное содержание бензилового спирта в сырье, масс. %;
Wб.с. - содержание воды в сырье, масс. %.
- Количество натрия дисульфита:
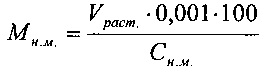
где Мн.м.. - масса натрия дисульфита, требуемого для загрузки, кг;
Vраст. - регламентированный объем загрузки, л;
Сн.м. - количественное содержание натрия дисульфита, масс. %;
- Количество воды для инъекций для загрузки рассчитывается по формуле:
Mводы = Mраст. - Mсубст. - Mб.с. - Mн.м. - Mн.г.,
где Мводы - масса воды для инъекций, требуемой для загрузки, кг;
Мраст. - масса раствора, кг;
Мн.г. - масса 1 М раствора гидроксида натрия, кг.
Перед началом процесса приготовления раствора готовят 1 М раствор натрия гидроксида.
1 л раствора содержит 0,04 г натрия гидроксида.
В стакан вместимостью 1 л наливают около 500 мл воды для инъекций. В отдельном стакане взвешивают 40 г сухого натрия гидроксида, пересыпают его в стакан с водой и перемешивают стеклянной палочкой до полного растворения. Раствор, полученный в стакане, осторожно переносят в мерную колбу вместимостью 1 л (при необходимости используют стеклянную воронку) и доводят объем раствора в мерной колбе до 1 литра, долив воду для инъекций с температурой 25±2°С. Для приготовления большего количества раствора операцию повторяют (или используют стакан или колбу большего объема, с соответствующим пересчетом количественного содержания ингредиентов).
В предварительно подготовленный реактор для приготовления растворов загружают рассчитанное количество воды для инъекций (с температурой 15-30°С).
Весь процесс растворения компонентов ведут под защитой азота, с перерывом для загрузки компонентов
В реактор для приготовления растворов при работающей мешалке (200-350 об/мин загружают рассчитанное количество натрия дисульфита и перемешивают до полного растворения, осуществляя визуальный контроль за полнотой растворения, через смотровое окно люка реактора.
Затем в реактор для приготовления растворов порционно загружают рассчитанное количество хондроитина сульфата (хондроитина сульфата натрия) и перемешивают до полного растворения субстанции, осуществляя визуальный контроль за полнотой растворения, через смотровое окно люка реактора.
Далее в реактор для приготовления растворов загружают рассчитанное количество спирта бензилового, перемешивают до полного растворения и отбирают пробу. Измеряют рН полученного раствора, значение которого должно быть в пределах от 6,0 до 7,5. При необходимости проводят корректировку раствора 1 М раствором натрия гидроксида. После добавления 1 М натрия гидроксида раствор перемешивают и повторно измеряют рН (процедуру повторяют до получения удовлетворительного результата).
При получении удовлетворительных результатов анализа в реактор загружают воду для инъекций до достижения массы раствора до заданной и перемешивают.
Проводят контрольный анализ по физико-химическим и микробиологическим показателям.
Затем раствор подают в систему предварительной и стерилизующей фильтрации под давлением стерильного азота 0,1-4,0 бар, состоящую из последовательно расположенных фильтродержателей для фильтр-картриджа предварительной фильтрации (размер пор - от 1,00 до 0,22 мкм,) и фильтродержателя для фильтр-картриджа стерилизующей фильтрации (размер пор от 0,1 до 0,22 мкм).
Затем проводят розлив и запайку препарата в ампулы и осуществляют это с локальной защитой продукта ламинарным потоком стерильного воздуха в токе азота.
Пример конкретного выполнения способа.
С использованием заявляемого способа был приготовлен препарат хондроитина сульфата в форме раствора для внутримышечного введения следующего состава:
1 ампула 1 мл (или 2 мл) содержит:
Активное вещество - хондроитина сульфат натрия - 100 или 200 мг.
Вспомогательные вещества:
бензиловый спирт - 9,0 мг (или 18,0 мг);
дисульфит натрия -1,0 мг (или 2,0 мг);
натрия гидроксид - до рН 6,0-7,5;
вода для инъекций - до 1 мл (или 2 мл).
Провели расчет загрузки и получили следующие показатели:


Перед началом процесса приготовления раствора лекарственного препарата приготовили 1 М раствор натрия гидроксида.
1 мл раствора содержит 0,04 г натрия гидроксида.
В стакан вместимостью 1 л налили около 500 мл воды для инъекций. В отдельном стакане взвесили 40 г сухого натрия гидроксида, пересыпали его в стакан с водой и перемешали стеклянной палочкой до полного растворения. Раствор, полученный в стакане, осторожно перенесли в мерную колбу вместимостью 1 л и довели объем раствора в мерной колбе до 1 литра, долив воду для инъекций с температурой 25±2°С.
В предварительно подготовленный реактор для приготовления растворов загрузили 180 кг (360 кг для загрузки 400 л) воды для инъекций с температурой (15-30)°С.
Весь процесс растворения компонентов вели под защитой азота, с перерывом для загрузки компонентов.
В реактор для приготовления растворов при работающей мешалке (200-350 об/мин) загрузили 0,2 кг (0,4 кг для загрузки 400 л) натрия дисульфита (в пересчете на 100% вещество) и перемешивали до полного растворения, осуществляя визуальный контроль за полнотой растворения, через смотровое окно люка реактора.
Затем в реактор для приготовления растворов порционно загрузили 20 кг (40 кг для загрузки 400 л) хондроитина сульфата натрия (в пересчете на 100% вещество) и перемешивали до полного растворения субстанции, осуществляя визуальный контроль за полнотой растворения, через смотровое окно люка реактора.
Далее в реактор для приготовления растворов загрузили 1,8 кг (3,6 кг для загрузки 400 л) спирта бензилового (в пересчете на 10% вещество), перемешивали не менее 20 мин и отобрали пробу. Измерили pH полученного раствора, значение которого должно быть в пределах от 6,0 до 7,5. После добавления 1 М натрия гидроксида раствор перемешивали не менее 10 мин и повторно измеряли pH (процедуру повторяли до получения удовлетворительного результата).
Провели контроль по физико-химическим и микробиологическим показателям.
Затем подали раствор в систему предварительной и стерилизующей фильтрации под давлением стерильного азота 0,1-4,0 бар, состоящую из последовательно расположенных фильтродержателей для фильтр-картриджа предварительной фильтрации (размер пор - 0,45 мкм,) и фильтродержателя для фильтр-картриджа стерилизующей фильтрации (размер пор - 0,22 мкм,).
Розлив в токе азота и запайку препарата в ампулы осуществляли это с локальной защитой продукта ламинарным потоком стерильного воздуха.
Была изучена стабильность препарата при хранении в естественных условиях в течение 2 лет и 3 месяцев (температура (25±2)°С). В течение всего срока наблюдений значения количественного содержания, цветности и pH раствора не выходили за пределы, регламентированные в ФСП. Изменение остальных показателей качества не было зафиксировано ни для одного из образцов.
Подводя итог всему изложенному в данной заявке, следует отметить, что поставленная задача достигнута. Разработанная технология, в отличие от способа-прототипа, имеет минимальные риски деградации структуры молекул ХС и изменения интервала заявленной молекулярной массы ХС (за счет исключения нагрева до 50°С), а также минимальные риски изначальной контаминации раствора и накопления бакэндотоксинов (за счет исключения стадий раздельного приготовления нескольких растворов). При этом достигнуто упрощение и ускорение способа (также за счет исключения стадий раздельного приготовления нескольких растворов). Все перечисленные результаты обеспечиваются одновременно с исключением появления розового окрашивания раствора и сохранением требуемых значений количественного содержания, цветности и pH раствора в течение более 2-х лет хранения.

