Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТОК, ПОКРЫТЫХ КИШЕЧНОРАСТВОРИМОЙ ОБОЛОЧКОЙ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Предлагаемое изобретение относится к медицине и фармацевтической промышленности и касается фармацевтической композиции в форме таблеток, покрытых кишечнорастворимой оболочкой, содержащей 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в качестве активного компонента. Композиция может использоваться для лечения острых нарушений мозгового кровообращения, энцефалопатии различного генеза, легких когнитивных расстройств атеросклеротического генеза, последствий воздействия экстремальных факторов и профилактики вызываемых ими соматических заболеваний, купирования абстинентного синдрома, лечения острой интоксикации антипсихотическими лекарственными средствами.
Разработка новых лекарственных средств для лечения различных, и в первую очередь сосудистых, поражений мозга является актуальной задачей современной медицины. Сосудистые заболевания мозга занимают второе место в структуре смертности от заболеваний системы кровообращения после ишемической болезни сердца, а инсульт в настоящее время становится основной социально-медицинской проблемой неврологии. Ежегодно в мире церебральный инсульт переносят около 6 млн человек, а в России более 450 тыс., то есть каждые 1,5 минуты у кого-то из россиян развивается это заболевание; в крупных городах России количество острых инсультов составляет от 100 до 120 в сутки (Е.И. Гусев, В.И. Скворцова, 2001-2004).
Высокой эффективностью при остром и хроническом нарушении мозгового кровообращения обладают отечественные препараты из класса производных 3-гидроксипиридина, в частности - препараты с торговыми названиями Мексидол, Нейрокс, имеющие оба МНН «Этилметилгидроксипиридина сукцинат» (Государственный реестр лекарственных средств РФ, http://www.grls.rosminzdrav.ru).
Особое место среди отечественных разработок лекарственных средств из класса производных 3-гидроксипиридина занимает такое вещество, как 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты; другое название - 2-этил-6-метил-3-оксипиридиния N-ацетил-L-глутаминат; вещество известно также как ЭМОПАГ или ЭМОП-АГ (Патент RU №2394816 С1. Нейротропное средство, обладающее антиоксидантной, противогипоксической, нейропротекторной, антиамнестической и противоукачивающей активностью и способностью улучшать когнитивные функции. Опубликовано 20.07.2010). Это вещество синтезировано и описано недавно, оно показало многократно более высокую фармакологическую эффективность в сравнении с ближайшими аналогами, в частности - в сравнении с Мексидолом (см. там же - патент RU №2394816).
До настоящего времени лекарственных препаратов в виде готовых лекарственных форм на основе 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты известно не было; в указанном выше патенте RU 2394816 приведены результаты исследований на экспериментальных животных с введением либо непосредственно активного вещества, либо раствора для внутрибрюшинного введения, специально приготовленного для серии исследований с экспериментальными животными.
Сведений о фармацевтических составах, пригодных для использования в клинической практике, у пациентов-людей, нет.
Поэтому разработка на основе 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты лекарственных препаратов в виде готовых лекарственных форм является актуальной задачей современной медицины и фармацевтики.
Особенно актуально создание удобных для пациентов и медицинского персонала лекарственных форм, например, лекарственной формы таблетки.
В задачу настоящего изобретения положена разработка фармацевтической композиции в лекарственной форме таблетки, содержащей 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в качестве активного компонента. Композиция должна быть пригодной для использования в клинике и поэтому должна отвечать требованиям высокого качества, проявляющегося в требуемых показателях стабильности, прочности, сыпучести, сроков хранения (на фоне высокой фармакологической активности и безопасности препарата).
Поставленная задача достигается тем, что разработана фармацевтическая композиция в форме таблеток, содержащая в качестве активного компонента 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в фармакологически эффективной дозе, а также вспомогательные вещества.
Одним из аспектов предлагаемого изобретения является то, что разработана фармацевтическая композиция, содержащая 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в дозе 50-200 мг.
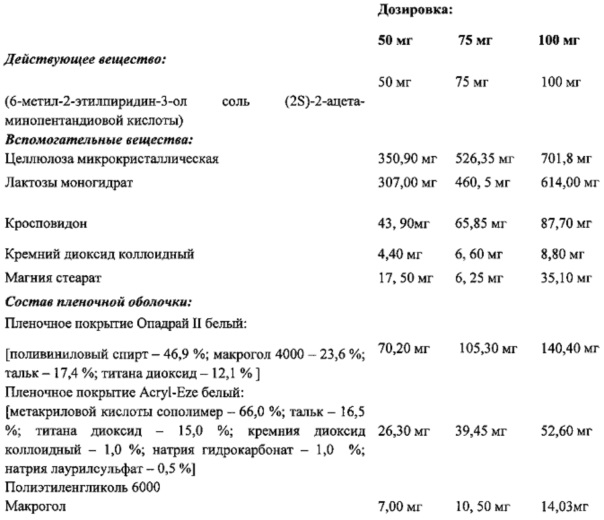
Одним из аспектов предлагаемого изобретения является также то, что разработана фармацевтическая композиция, содержащая 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в дозе 50 мг или 75 мг или 100 мг
Одним из аспектов предлагаемого изобретения является также то, что разработана фармацевтическая композиция, выполненная в форме таблеток, покрытых кишечнорастворимой оболочкой.
Одним из аспектов предлагаемого изобретения является также то, что разработана фармацевтическая композиция в форме таблеток, покрытых кишечнорастворимой оболочкой, содержащая 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в качестве активного компонента, а также вспомогательные вещества, включающие целлюлозу микрокристаллическую, лактозы моногидрат, кросповидон, магния стеарат, кремния диоксид коллоидный, при следующем соотношении компонентов, масс %:
|
Вспомогательные вещества:
|
При этом кишечнорастворимая оболочка включает пленочное покрытие «Акрил - из белый», пленочное покрытие «Опадрай II белый» и макрогол, при следующем соотношении компонентов, масс % на состав таблетки:
|
Одним из аспектов предлагаемого изобретения является также то, что разработана фармацевтическая композиция в форме таблеток, покрытых кишечнорастворимой оболочкой, содержащая 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в качестве активного компонента и вспомогательные вещества, включающие целлюлозу микрокристаллическую, лактозы моногидрат, кросповидон, магния стеарат, кремния диоксид коллоидный, при следующем соотношении компонентов, масс %:
|
Вспомогательные вещества:
|
Одним из аспектов предлагаемого изобретения является также конкретный состав предложенный композиции (в пределах указанных выше диапазонов значений содержания ингредиентов) при следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Одним из аспектов является также способ получения указанной фармацевтической композици, при котором сначала получают массу для таблетирования путем смешивания с помощью перемешивающего устройства в течение 40-45 минут субстанции 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты, лактозы моногидрата, микрокристаллической целлюлозы, кросповидона и аэросила с последующим добавлением в полученную смесь магния стеарата и повторным перемешиванием в течение 3-5 минут, затем проводят таблетирование на таблетпрессе с получением таблеток-ядер, готовят две суспензии пленочных покрытий путем перемешивания сухого премикса покрытия «Опадрай II белый» с водой и сухого премикса покрытия «Акрил - из белый» с водой и макроголом, полученные суспензии наносят на таблетки-ядра в 3 этапа, с использованием машины для нанесения пленочных покрытий, при этом на первом этапе наносят суспензию «Опадрай II белый» в течение 15-20 минут при скорости подачи суспензии 4-6 г/мин, на втором этапе наносят суспензию «Опадрай II белый» при скорости подачи суспензии 9-11 г/мин до полного использования суспензии, а на третьем этапе наносят суспензию «Акрил - из белый» при скорости подачи суспензии 4-6 г/мин до полного использования суспензии, затем проводят сушку и охлаждение таблеток.
Новый технический результат заключается, во-первых, в создании готовой лекарственной формы, содержащей 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты в качестве активного компонента. Ранее составов с таким активным веществом, пригодных для использования в клинике, известно не было. Также новый технический результат заключается в достижении высоких показателей качества препарата на фоне высокой фармакологической активности и безопасности. Проведенные многочисленные исследования показали, что разработанная фармацевтическая композиция отличается отсутствием токсических и аллергических проявлений и характеризуется высокими показателями стабильности, прочности, сыпучести, длительности хранения. Все это наблюдается на фоне высокой эффективности в отношении лечения ряда заболеваний (острых нарушений мозгового кровообращения, энцефалопатии различного генеза, легких когнитивных расстройств атеросклеротического генеза, последствий воздействия экстремальных факторов и профилактики вызываемых ими соматических заболеваний, купирования абстинентного синдрома, лечения острой интоксикации антипсихотическими лекарственными средствами), причем фармакологическая эффективность заявляемой композиции в разы выше эффективности известных в настоящее время аналогичных средств (в частности, таких препаратов, как Мексидол и Нейрокс).
Состав заявленной фармацевтической композиции разработан в результате ряда экспериментальных исследований.
Для включения в состав композиции были выбраны известные в фармацевтике компоненты, используемые в качестве вспомогательных веществ, однако в серии специальных экспериментов была изучена совместимость их с активным веществом композиции - 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты (как уже говорилось, другое название - 2-этил-6-метил-3-оксипиридиния N-ацетил-L-глутаминат; вещество известно также как ЭМОПАГ).
В заявляемой композиции лактозы моногидрат использовался в качестве инертного наполнителя, придающего необходимые физико-химические свойства, в частности, по показателям сыпучести таблеток. Также для улучшения сыпучести применялся кремния диоксид коллоидный. Микрокристаллическая целлюлоза использовалась для улучшения прочности таблеток, кросповидон - для улучшения их распадаемости, магния стеарат - в качестве смазывающего вещества.
Несмотря на то, что использовались известные в фармацевтике вспомогательные вещества, возможность их включения в состав заявляемой композиции не была очевидной, т.к. из уровня техники не было известно, совместимы ли они с активным веществом разрабатываемого препарата, являющегося новой и еще мало изученной фармацевтической субстанцией.
Как уже было отмечено, совместимость веществ была специально исследована авторами данной заявки в серии экспериментов.
Изучались следующие модельные составы:
- Микрокристаллическая целлюлоза + 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты;
- Лактоза + 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты;
Кросповидон + 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты;
Кремния диоксид коллоидный + 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты;
Магния стеарат + 6-метил-2-этилпиридин-3-ол соль (2S)-2-ацетаминопентандиовой кислоты.
Содержание активного вещества в каждом модельном составе изначально было в пределах 48-51%. Хранение модельных составов при температуре 50 градусов в течение 3-х месяцев показало изменение содержания активного вещества в пределах 1-5%, что свидетельствовало об отсутствии взаимодействия между активным и вспомогательным веществом в каждом модельном составе и, следовательно, о совместимости веществ.
Количественное значение каждого ингредиента заявляемой композиции также было разработано в ходе экспериментальных исследований авторов данной заявки.
Оптимальное количество лактозы моногидрата было разработано в ходе изучения влияния содержания лактозы моногидрата на следующие фармако-технологические показатели таблеточной массы для получения заявляемой композиции: сыпучесть массы, г/см; насыпная плотность, г/мл; плотность после уплотнения (1250 ударов), г/мл; индекс Карра, %; соотношение Хауснера. Было установлено, что при содержании лактозы моногидрата в пределах 25-35 масс % достигаются лучшие значения перечисленных показателей, характеризующих качество таблеточной массы.
Оптимальное количество магния стеарата было разработано в 2 этапа. На первом этапе изучалось влияние содержания этого ингредиента на следующие фармако-технологические показатели таблеточной массы для получения заявляемой композиции: высота таблеток, мм; прочность таблеток на раздавливание, Н; усилие выталкивания, Н. Было установлено, что при содержании магния стеарата в пределах 0,3-1 масс % достигаются требуемые значения перечисленных показателей, характеризующих качество таблеточной массы, причем лучшие показатели наблюдались при более высоких (из изучаемых) значениях, т.е. при содержании порядка 1 масс %. На втором этапе целью экспериментов было установления количественных показателей содержания магния стеарата, исключающих риск «подлипания» таблеточной массы на поверхности пуансона при долгой работе таблеточного пресса. Также на этом этапе изучалась кинетика растворения составов с разным количеством магния стеарата. В результате всех перечисленных выше экспериментов было рекомендовано содержании магния стеарата в пределах от 1,00 до 2,00 масс % (наилучшие результаты наблюдались при значениях от 1,8 до 2,0 масс %).
Оптимальное количество целлюлозы микрокристаллической также было установлено в 2 этапа. На первом этапе методология экспериментов была та же, что и на первом этапе исследований с магнием стеаратом; таблеточная масса оценивалась по тем же показателям. На первом этапе оптимальное значение содержания микрокристаллической целлюлозы было определено в пределах 30 масс %. Однако при наработке опытно-промышленной серии было отмечено сильное падение прочности таблеток-ядер на скорости пресса 50 об/ мин ротора; на некоторых таблетках обнаруживалось слоение. С целью исключения таких нежелательных явлений был проведен 2-ой этап экспериментов по определению оптимального значения количества микрокристаллической целлюлозы. Изучалась максимальная прочность таблеток на раздавливание, распадаемость таблеток-ядер и наличие слоения при различных значениях содержания микрокристаллической целлюлозы в условиях необходимых значений скорости пресса. В результате всех перечисленных выше экспериментов было рекомендовано содержании микрокристаллической целлюлозы в пределах 25-40 масс % (наилучшие результаты наблюдались в диапазоне 35-40 масс %).
Оптимальное количество кросповидона также устанавливалось в 2 этапа, и при этом на первом этапе использовалась та же методология проведения эксперимента, что и для первого этапа экспериментов с магнием стеаратом и микрокристаллической целлюлозой. В результате первого этапа экспериментов оптимальное значение содержания кросповидона было определено в пределах 2 масс %. Однако при наработке опытно-промышленной серии было отмечено сильное падение прочности таблеток-ядер на скорости пресса 50 об/ мин ротора; на некоторых таблетках обнаруживалось слоение. Избежать этих нежелательных явлений, как уже было отмечено, удалось увеличением количества микрокристаллической целлюлозы до 35-40%. Но увеличение количества микрокристаллической целлюлозы в свою очередь повлекло за собой увеличение времени распадания таблеток. Для уменьшения времени распадания таблеток было предложено скорректировать значение содержания кросповидона в сторону увеличения. Изучалась максимальная прочность таблеток на раздавливание, распадаемость таблеток-ядер при различных значениях содержания кросповидона в пределах от 2 до 5%; наилучшие результаты наблюдались при значениях от 4,5 до 5 масс %. В результате всех экспериментов было рекомендовано содержание кросповидона в пределах 2,00-5,00 масс %.
Оптимальное количество кремния диоксида было разработано в ходе изучения влияния содержания этого компонента в пределах от 0,2 до 0,5 масс % на следующие фармако-технологические показатели таблеточной массы для получения заявляемой композиции: сыпучесть массы (через матрицу 10 мм), г/см; насыпная плотность, г/мл; плотность после уплотнения (1250 ударов), г/мл. При значениях от 0,2 до 0,5 масс % достигаются лучшие значения перечисленных показателей, характеризующих качество таблеточной массы. И при этом при значениях от 0,4 до 0,5 масс % показатели качества таблеточной массы практически не меняются, т.е. увеличение содержания более 0,5% нецелесообразно. В результате было рекомендовано значение содержания кремния диоксида для включения в разрабатываемый состав 0,2-0,5 масс %.
В качестве кишечнорастворимого покрытия было выбрано готовое покрытие «Акрил - из белый».
Для уменьшения количества кишечнорастворимой пленки было решено предварительно покрывать таблетки-ядра готовым суспензионным пленочным покрытием «Опадрай II белый».
Составы этих покрытий следующие:
Пленочное покрытие Опадрай II белый:
[поливиниловый спирт - 46,9%; макрогол 4000 - 23,6%; тальк - 17,4%; титана диоксид - 12,1% (НД фирмы, Колоркон)]
Пленочное покрытие Acryl-Eze белый:
[метакриловой кислоты сополимер - 66,0%; тальк - 16,5%; титана диоксид - 15,0%; кремния диоксид коллоидный - 1,0%; натрия гидрокарбонат - 1,0%; натрия лаурилсульфат - 0,5% (НД фирмы, Колоркон)]
Для определения оптимального количества содержания пленочного покрытия были проведены специальные эксперименты.
Проводилось изучение кинетики растворения таблеток-ядер, устойчивости полученных таблеток, покрытых разными концентрациями кишечнорастворимой пленки, в 0,1 М растворе хлористоводородной кислоты и кинетики растворения в фосфатном буфере с pH 6,82.
При содержании покрытия «Акрил -из белый» менее 6 масс % таблетки не выдерживали испытания в 0,1 М хлористоводородной кислоте; при содержании же более 8 масс % медленно растворялись в фосфатном буфере pH 6,82. Поэтому было рекомендовано содержание этого покрытия в пределах 6-8 масс %.
В отношении покрытия «Опадрай II белый» оптимальные значения содержания были установлены в пределах 1,5-3%.
А в отношении макрогола (полиэтиленгликоля 6000) оптимальные значения были установлены в пределах 0,6-0,8 масс %.
Предлагаемую фармацевтическую композицию получают следующим образом.
Активное вещество просеивают через сито 1,0 мм в технологическую тару, лактозу моногидрат, микрокристаллическую целлюлозу, кросповидон - через сито с номинальным диаметром отверстий 2,0 мм, магния стеарат - через сито с номинальным размером отверстий 0,315 мм.
Все компоненты отвешивают в необходимых количествах на весах.
В емкость для смешивания перемешивающего устройства смесителя загружают активное вещество, лактозу моногидрат, микрокристаллическую целлюлозу, кросповидон, кремния диоксид коллоидный. Перемешивание ведут в течение 40 минут при скорости вращения привода 30-35 об/мин.
Затем в полученную смесь добавляют магния стеарат и снова перемешивают в течение 3-5 минут при той же скорости вращения.
Таблетирование проводят на таблетпрессе Piccola 372. В процессе таблетирования контролируют внешний вид таблеток, среднюю массу и прочность на излом.
Затем готовят две суспензии пленочного покрытия.
Сухой премикс пленочного покрытия «Опадрай II» загружают в емкость с водой (необходимые количества предварительно отвешивают) и перемешивают в течение 45-55 минут при пониженных оборотах верхнеприводной мешалки и затем фильтруют через сито 0,315 мм.
Для приготовления суспензии пленочного покрытия №2 в емкость для перемешивания с верхнеприводной мешалкой загружают воду и затем при оборотах мешалки, обеспечивающих образование воронки, загружают необходимое количество полиэтиленгликоля 6000 (макрогола) и перемешивают 5 минут. Затем добавляют необходимое количество пленочного покрытия «Акрил - из белый» и перемешивают в течение 45-55 минут при пониженных оборотах мешалки. Полученную суспензию фильтруют через сито 0,315 мм.
Процесс нанесения оболочки на таблетки-ядра ведут в 3 этапа при скорости подачи пленкообразующей суспензии на 1-ом и 3-ем этапе 4-6 г/мин, а на втором этапе - 9-11 г/мин при скорости вращения барабана на 1-ом этапе 6 об/ мин, а 2-ом и 3-ем этапе - 10 об/мин. При этом на 1-ом и 2-ом этапе наносят покрытие «Опадрай II белый», а на 3-ем этапе - покрытие «Акрил - из белый».
Процесс покрытия таблеток-ядер ведут до полного использования пленкообразующей суспензии. Затем проводят сушку таблеток, покрытых пленочной оболочкой. Параметры сушки:
Температура входящего воздуха - 55 град C
Время сушки - 5-10 минут.
Затем таблетки охлаждают в течение 10-15 минут.
Пример 1.
Таблетки, характеризующиеся следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Для получения таблеток с указанным соотношением компонентов используют количества ингредиентов в мг, отраженные в таблице 1.
Таблица 1
Значения ингредиентов (мг) при содержании активного вещества 18,05 масс %

Состав на одну таблетку, покрытую кишечнорастворимой оболочкой:

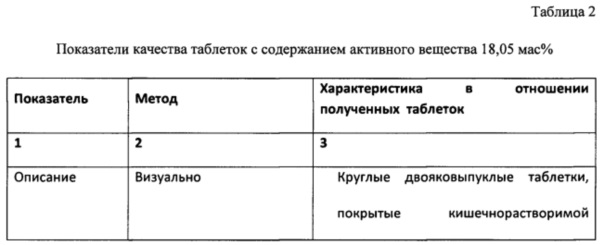


Таким образом, из таблицы видно, что таблетки характеризовались необходимыми значениями показателей прочности, сыпучести, растворимости. Срок годности составил 2 года. В специально проведенных экспериментах таблетки показали высокую фармакологическую активность при отсутствии токсических и аллергических проявлений.
Пример 2.
Таблетки, характеризующиеся следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Для получения таблеток с указанным соотношением компонентов используют количества ингредиентов в мг, указанные в таблице 3.

Состав на одну таблетку, покрытую кишечнорастворимой оболочкой:
Пример 3.
Таблетки, характеризующиеся следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Для получения таблеток с указанным соотношением компонентов используют следующие количества ингредиентов в мг (отражены в таблице 4).

Состав на одну таблетку, покрытую кишечнорастворимой оболочкой:

Пример 4.
Таблетки, характеризующиеся следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Для получения таблеток с указанным соотношением компонентов используют следующие количества ингредиентов в мг (отражены в таблице 5).


Пример 5.
Таблетки, характеризующиеся следующим соотношением компонентов, масс %:
|
Вспомогательные вещества:
|
Кишечнорастворимая оболочка:
|
Для получения таблеток с указанным соотношением компонентов используют количества ингредиентов в мг, указанные в таблице 6.


Подводя общий итог изложению сущности заявленного изобретения, следует еще раз отметить, что предлагаемое изобретение впервые позволяет получить готовый лекарственный препарат на основе 6-метил-2-этилпиридин-3-ол соли (2S)-2-ацетаминопентандиовой кислоты, причем в удобной для приема пациентами форме - в форме таблеток. Ранее составов с таким активным веществом, пригодных для использования в клинической практике, известно не было. Созданная композиция отвечает требованиям высокого качества, проявляющегося в требуемых показателях стабильности, прочности, сыпучести и длительных сроках хранения, которые, в свою очередь, наблюдаются на фоне высокой фармакологической активности и высокой безопасности препарата.

