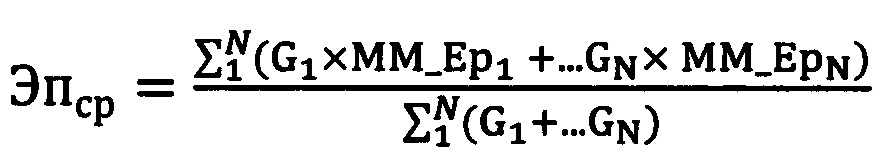Результат интеллектуальной деятельности: Способ выбора реципиента при пересадке трупной почки
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к трансплантологии. Данный способ может быть использован в хирургических отделениях, занимающихся трансплантацией почек; центрах органного донорства, занимающихся распределением донорских почек, а также лабораториях тканевого типирования, и предназначен для выбора оптимальной пары донор-реципиент.
Трансплантация почки - оптимальный метод заместительной почечной терапии, который по сравнению с гемо- и перитонеальным диализом обеспечивает наиболее полную медицинскую и социальную реабилитацию больных хронической болезнью почек.
Тканевая совместимость между донором и реципиентом остается одним из основных факторов, определяющих долгосрочную выживаемость трансплантата. Гены главного комплекса гистосовместимости кодируют белки на клеточной мембране - лейкоцитарные антигены человека HLA. Главный комплекс гистосовместимости отличается значительным полиморфизмом. В связи с этим в реальных условиях достичь полного тканевого соответствия практически невозможно и у реципиента неизбежно развивается реакция отторжения трансплантата.
Для снижения иммунологического конфликта между донором и реципиентом и продления срока жизни трансплантата, выполняют подбор оптимальной пары, т.е. выбор реципиента, имеющего наименьше несоответствие с донорским органом. В основе такого подбора лежит тканевое генотипирование. В рутинной клинической практике в России выполняют типирование на низком разрешении с определением фенотипа донора и реципиента, а именно трех пар антигенов HLA локусов А, В и DR.
В основе реакции отторжения лежит деструктивное взаимодействие иммунокомпетентных клеток и антител реципиента с донорскими антигенами, которые не совпадают с собственными антигенами реципиента. При этом основным механизмом инициации отторжения является процесс презентации антигена в комплексе с молекулой HLA Т-клеточному рецептору, который дополняется несколькими костимулирующими сигналами.
Даже при отсутствии несовпадений между донором и реципиентом по этим шести антигенам(трем парам: А, В и DR) может развиться отторжение. Частично это обусловлено тем, что при типировании на низком разрешении определяется не непосредственно аллель и, соответственно, определенная нуклеотидная последовательность молекулы HLA, присутствующая у пациента, а аллельная группа (широкий антиген) - несколько весьма гомологичных молекул. При этом точно сказать, какая именно аллель в данном конкретном случае из этой аллельной группы, невозможно. Точно установить это возможно только путем проведения типирования на высоком уровне. Таким образом, при более детальном анализе станет очевидно, что в действительности несовпадения есть.
Молекула HLA представлена набором эпитопов - антигенных детерминант, к которым возможно образование антител. При этом каждая аллель обладает уникальным репертуаром эпитопов, однако, некоторые аллели имеют общие эпитопы.
Даже при несовпадении по широким антигенам, несовпадающие антигены могут иметь определенное количество общих эпитопов. Поэтому потенциальных реципиентов при одинаковом числе несовпадений по широким антигенам может быть разное количество несовпадающих с фенотипов донора эпитопов. Антигенная нагрузка и, соответственно, риски развития отторжения и утраты трансплантата у таких больных будут разные.
Сложности подбора идеального реципиента, несовершенство существующих лабораторных методов, а также неполнота представлений о течении иммунных реакций после трансплантации почки приводит к тому, что отторжение рано или поздно развивается у всех реципиентов. При этом срок полужизни трансплантата составляет 8 лет. Основные надежды на увеличение этого срока связывают с иммуносупрессивной терапией.
Известен способ выбора пары донор-реципиент с использованием подсчета количества широких антигенов донора, отсутствующих у реципиента (Трансплантация почки / Пер. с англ. под ред. Я.Г. Мойсюка. - М: ГЭОТАР-Медиа, 2013. С. 100).
Однако при данном методе возможно лишь стратифицировать реципиентов на шесть групп: в зависимости от количества несовпадений по широким антигенам (от 0 до 6). Этот метод не позволяет сделать выбор между реципиентами с одинаковым числом несовпадений.
Кроме того, метод предполагает тот факт, что пациенты, имеющие одинаковое количество несовпадений являются равнозначными кандидатами на трансплантацию. Тем не менее, существует несколько десятков общий специфичностей, которые одинаковы у некоторых антигенов. Таким образом, две разные пары несовпадающих антигенов могут иметь разное количество несовпадающих антигенных детерминант - эпитопов. Т.е. реципиенты, имеющие одинаковое количество несовпадающих антигенов, полученных на низком разрешении, на эпитопном уровне имеют разный уровень гетерогенности.
Наиболее близким является способ выбора реципиента при пересадке трупной почки (Патент РФ №2425625, МПК А61В 5/0 G01N 33/48, публ. 2010), включающий предоперационное обследование потенциальных реципиентов и сопоставление эпитопов HLA потенциального реципиента и донора, выявление аллоэпитопов, присутствующих у донора, но отсутствующих у потенциального реципиента; сопоставление HLA-DR антигена или антигенов потенциального реципиента с выявленными аллоэпитопами; сравнение полученных комбинаций со следующими комбинациями: A9C-DR7; A10C-DR3; A10C-DR6; A28C-DR1; Bw4-DR6; B8C-DR3; B12C-DR2; B27C-DR5. При отсутствии указанных комбинаций выносят суждение о биологической совместимости тканей потенциального реципиента и донора и выбирают данного потенциального реципиента в качестве реципиента трупной почки. Помимо этого, дополнительно исследуют отвергнутых потенциальных реципиентов, имеющих хотя бы одну из указанных комбинаций. Для этого сопоставляют HLA-DR фенотип отвергнутого потенциального реципиента и HLA-DR фенотип донора. При наличии у донора только того антигена или тех антигенов HLA-DR, которые присутствуют у отвергнутого потенциального реципиента, ткани отвергнутого потенциального реципиента и донора считают биологически совместимыми, что позволяет выполнить ему трансплантацию, т.е. выбирают данного пациента в качестве реципиента.
Недостатком данного метода является то, что авторы не оценивают общее количество аллоэпитопов донора, отсутствующих у реципиента, а учитывают лишь наличие нежелательных совпадений аллоэтипов HLA-A, - В с антигенами HLA-DR. При использовании этого способа, возможно выявление нескольких потенциальных реципиентов, у которых возможно выполнение трансплантации, однако, они могут иметь разное количество аллоэпитопных несовпадений, а соответственно - и риск отторжения трансплантата. Кроме выявления определенных нежелательных совпадений аллоэпитопов с антигенами локуса DR, данный метод не предполагает подсчет несовпадений по локусам А и В. Это может привести к недооценке риска развития отторжения. По сути, способ позволяет не выбрать конкретного реципиента, а лишь отвергнуть реципиентов, имеющих нежелательные несовпадения.
Задачей предложенного способа является устранение указанных недостатков, оптимизация подбора пары донор-реципиент, обеспечивающая увеличение срока функционирования трансплантата, за счет более точной оценки тканевой совместимости, обеспечивающей снижение антигенной нагрузки.
Для решения поставленной задачи в способе выбора реципиента при пересадке трупной почки, включающего проведение последовательного обследования донора и потенциальных реципиентов с выявлением антигенов HLA-A, HLA-B и HLA-DR, сопоставление эпитопов антигенов HLA-A и HLA-B потенциального реципиента и донора, полученные при типировании на низком разрешении, выявление аллоэпитопов присутствующих у донора, но отсутствующих у потенциального реципиента, и выбор реципиента по полученным данным, предложено дополнительно для каждого реципиента определять все возможные сочетания генотипов с генотипами донора на аллельном уровне N, соответствующих ранее выявленным показателям на низком разрешении. Затем определяют популяционную частоту G каждого сочетания по известной формуле. Затем по генотипам донора и реципиента на аллельном уровне выявляют все их эпитопы с определением количества аллоэпитопов донора, отсутствующих у реципиента для каждого сочетания генотипов донора и реципиента, после чего вычисляют взвешенное среднее количества эпитопных несовпадений по формуле:
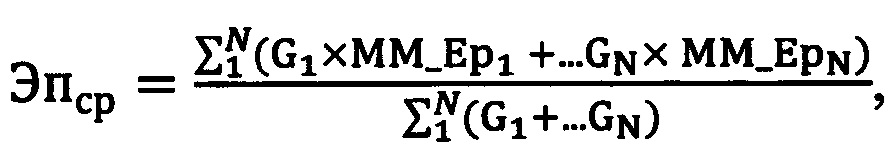 где
где
N - количество сочетаний генотипов донора и реципиента на аллельном уровне, соответствующий ранее выявленным показателям на низком разрешении,
G - популяционная частота сочетания генотипов донора и реципиента на высоком уровне,
MM_Ep1,2…N - количество аллоэпитопных несовпадений (аллоэпитопов в фенотипе донора, отсутствующих в фенотипе реципиента), соответствующих 1,2…N сочетаний генотипов донора и реципиента на аллельном уровне.
По результатам этого подсчета выявляют реципиента с наименьшим значением Эпср и в его сыворотке определяют анти-HLA антитела, при отсутствии антител к донорским HLA-антигенам, выбирают в качестве реципиента данного пациента.
В данном случае, предоперационное обследование не ограничивается рутинным определением количества несовпадений HLA, полученных на низком разрешении, а также - определением конкретных нежелательных сочетаний HLA-DR с определенными аллоэпитопами. Использование этих подходов приводит к неоднозначности результата и позволяет лишь отвергнуть потенциальных реципиентов, имеющих высокую степень тканевой несовместимости, но не выбрать среди нескольких потенциальных реципиентов, рекомендованных к трансплантации. Исходом применения данного метода является ранжированный список потенциальных реципиентов, упорядоченный в порядке снижения гистосовместимости, т.е. увеличения среднего взвешенного количества аллоэпитопных несовпадений. При этом появление неоднозначности, т.е. одинакового среднего взвешенного количества аллоэпитопных несовпадений крайне низкое, что повышает точность подбора пары донор - реципиент. В результате можно выбрать оптимального реципиента. В случае если этому реципиенту по каким-то причинам выполнить трансплантацию не представляется возможным, выбор делают в пользу второго по рядку реципиента.
Кроме того, в отличие от аналога и прототипа, данный способ позволяет однозначно выбрать оптимального реципиента, а также оценить тяжесть антигенной нагрузки - количество аллоэпитопных несовместимостей в рамках конкретной пары донор-реципиент. При этом потенциальные реципиенты, в зависимости от конкретного генотипа, могут иметь разное количество эпитопных несовпадений даже при одинаковом количестве антигенных или аллельных несовпадений.
Важное преимущество данного способа является его доступность: типирование на высоком разрешении не требуется. Тем не менее, метод учитывает не только аллоэпитопные несовпадения аллелей, обладающих наибольшей популяционной частотой, но и также более редкие варианты. Это значительно повышает чувствительность метода.
Способ осуществляется следующим образом.
Предлагаемый способ применяют при трансплантации трупной донорской почки.
Перед трансплантацией проводят генотипирование донора и потенциальных реципиентов на низком разрешении по А, В и DR локусам. Определяют потенциальных реципиентов, имеющих меньшее количество несовпадений по результатам этого типирования.
Выявляют все возможные аллельные варианты HLA антигенов донора и потенциальных реципиентов, полученных на низком разрешении по номенклатуре аллелей (например, из открытой электронной базы по адресу: http://hla.alleles.org/proteins/class1.html). После этого, составляют все возможные гаплотипы для донора и реципиента на аллельном уровне на основе набора широких антигенов, а также определяют их популяционную частоту в данном конкретном географическом регионе или на основе энтической принадлежности (например, из открытой электронной базы аллельных частот по адресу: http://www.allelefrequencies.net).
После этого отдельно для каждого потенциального реципиента составляют все возможные сочетания генотипов реципиента и донора на аллельном уровне, соответствующие ранее выявленным показателям на низком разрешении и рассчитывают их популяционную частоту по формуле, которая следует из закона Харди-Вейберга:
gen_freq=(2*D_gapl_freq1*D_gapl_freq2)*(2*R_gapl_freq1*R_gapl_freq2),
где gen_freq - популяционная частота сочетания генотипов донора и реципиента на аллельном уровне,
D_gapl_freq1 - популяционная частота гаплотипа 1 донора,
D_gapl_freq2 - популяционная частота гаплотипа 2 донора,
R_gapl_freq1 - популяционная частота гаплотипа 1 реципиента,
R_gapl_freq2 - популяционная частота гаплотипа 2 реципиента.
[Мауо О. A century of Hardy-Weinberg equilibrium. Twin Res Hum Genet. 2008 Jun; 11(3):249-56. doi: 10.1375/twin. 11.3.249]
Затем по базе данных эпитопов (например, из открытой электронной базы - регистра эпитопов по адресу: http://www.epregistry.com.br) выявляют все эпитопы в фенотипе донора и все эпитопы в фенотипе реципиента для каждого сочетания генотипов донора и реципиента на аллельном уровне, сравнивают их и подсчитывают количество аллоэпитопных несовпадений. При этом учитывают лишь аллоэпитопы в фенотипе донора, отсутствующие в фенотипе реципиента. После чего вычисляют взвешенное среднее количества эпитопных несовпадений по формуле:
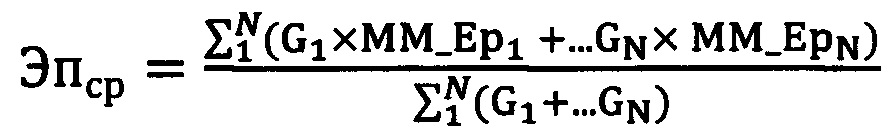 , где
, где
N - количество сочетаний генотипов донора и реципиента на аллельном уровне, соответствующий ранее выявленным показателям на низком разрешении,
G - популяционная частота сочетания генотипов донора и реципиента на высоком уровне,
MM_Ep1,2…N - количество аллоэпитопных несовпадений (аллоэпитопов в фенотипе донора, отсутствующих в фенотипе реципиента).
Такие вычисления выполняют для каждого потенциального реципиента и выбирают реципиента с наименьшим значением взвешенного среднего количества эпитопных несовпадений Эпср. Затем в сыворотке этого реципиента определяют анти-HLA антитела. При отсутствии антител к донорским HLA-антигенам, выбирают в качестве реципиента данного пациента.
Пример 1.
В отделение поступила донорская почка от донора 54 лет с диагнозом острое нарушение мозгового кровообращения, смерть головного мозга.
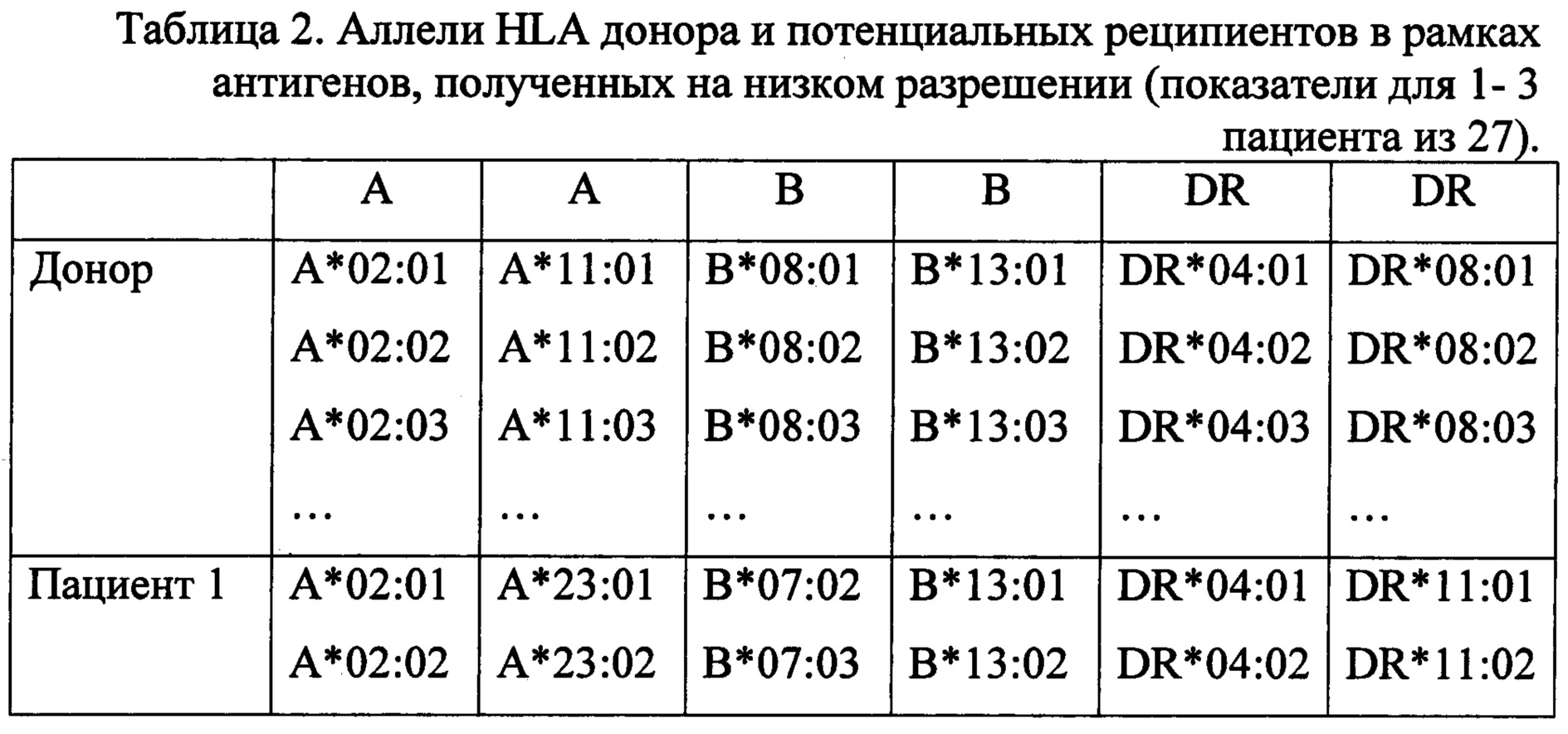
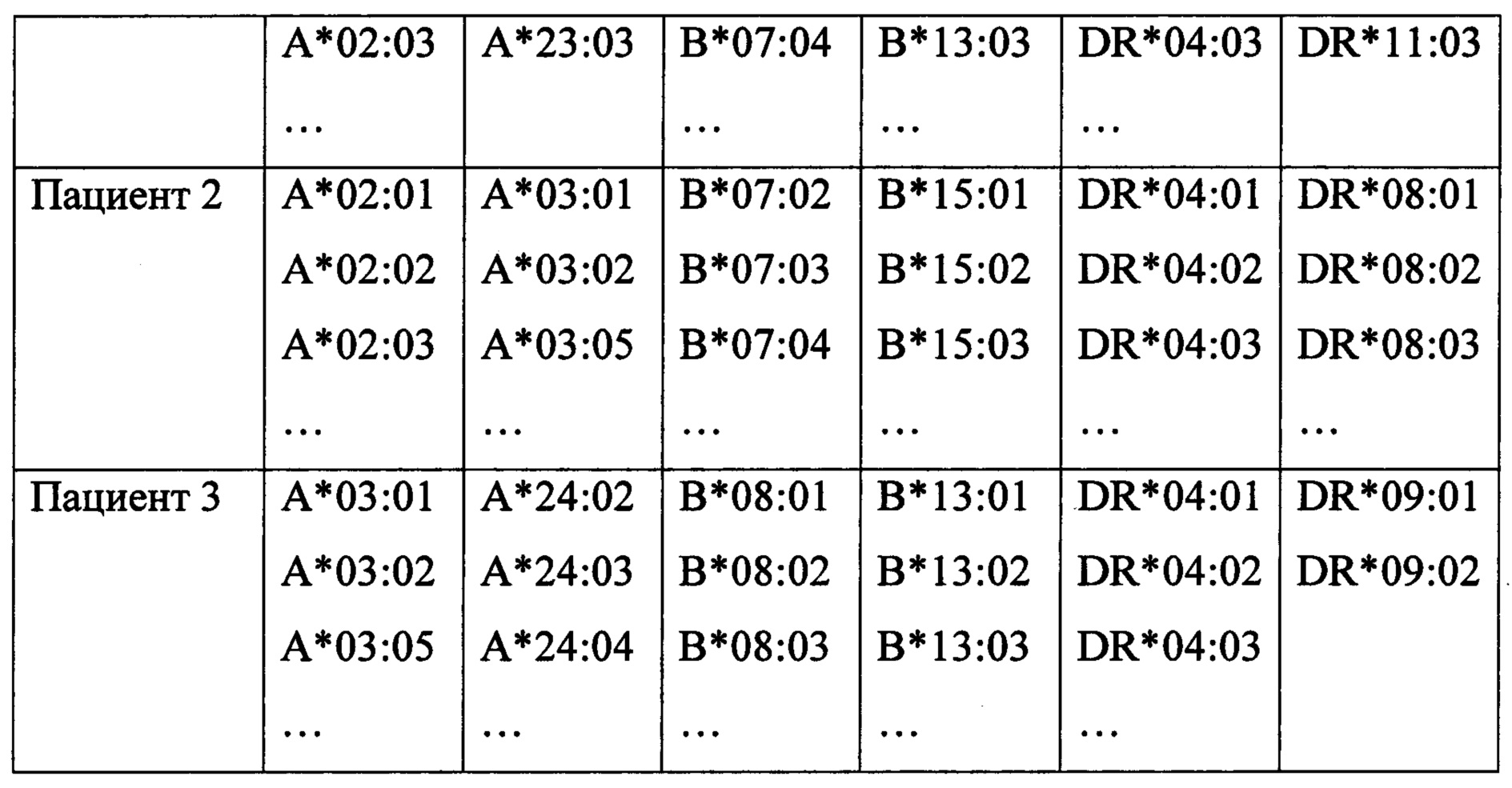
Было выполнено генотипирование на низком разрешении. В результате этого был определен фенотип донора и потенциальных реципиентов. Предварительно для трансплантации было отобрано 3 пациента (из 27 подходящих по группе крови), каждый из которых имел три несовместимости с донором - таблица 1.

Используя базу данных, полученных с ресурса http://hla.alleles.org/proteins/class1.html были определены все возможные аллели HLA, которые находятся в рамках антигенов донора и потенциальных реципиентов, полученных на низком разрешении. Примеры вида получаемых данных приведены в табл. 2.
После этого для были составлены все возможные варианты гаплотипов и по данным с ресурса http://www.allelefrequencies.net определены их популяционные частоты для популяции European Caucasoid - таблица 3.

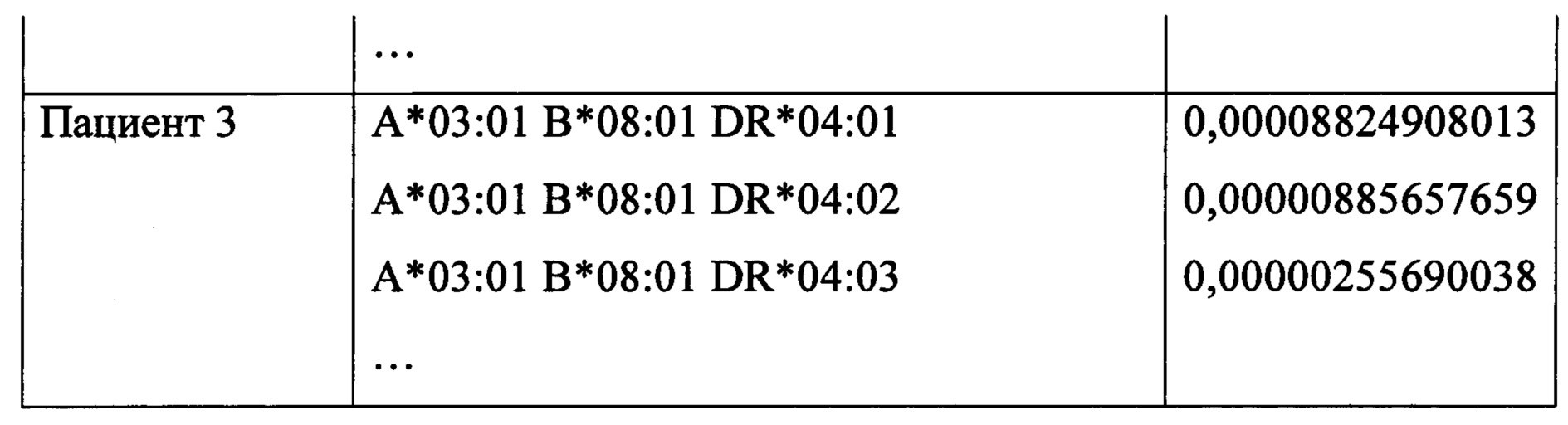
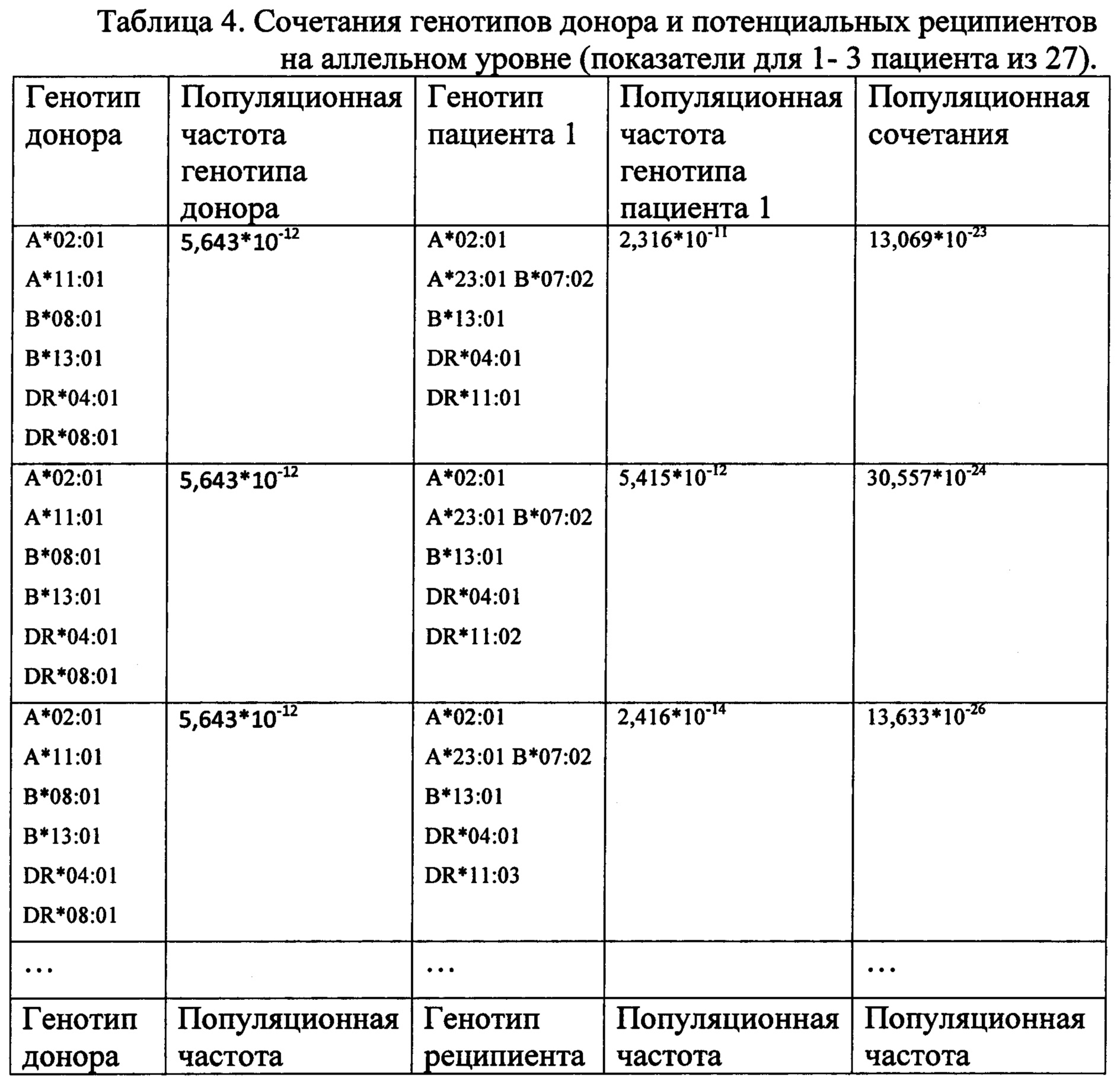
После этого отдельно для каждого реципиента на основе этих гаплотипов были составлены все возможные сочетания генотипов донора и реципиента на аллельном уровне и популяционные частоты таких сочетаний по формуле, приведенной выше - таблица 4.


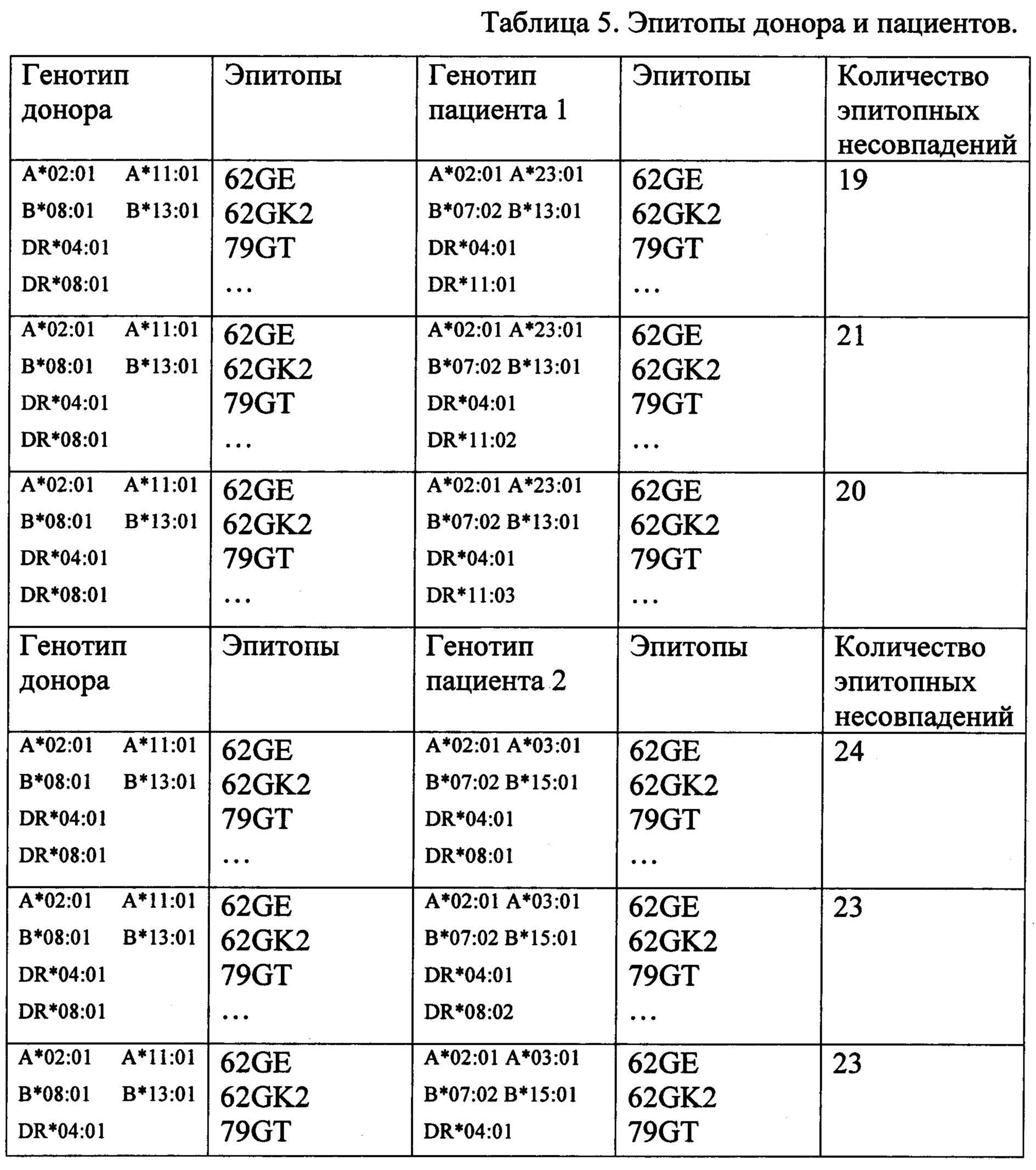
По данным из базы данных ресурса http://www.epregistry.com.br для каждого из сочетаний генотипов были определены все эпитопы донора и реципиента, а затем подсчитано количество аллоэпитопов в фенотипе донора, отсутствующих в фенотипе реципиента - таблица 5.

После этого на основе данных о количестве аллоэпитопных несовместимостей и частот сочетаний генотипов подсчитано взвешенное среднее количества аллоэпитопных несовпадений. Так, наименьшие значения Эпср (из 27) составили: 18,8; 25,7; 28,1. У одного пациента антидонорские антитела в сыворотке отсутствовали. Трансплантация была выполнена пациенту со значением Эпср=18,8.
После трансплантации функция трансплантата была стабильная. В качестве индукции иммуносупрессии пациент получил стандартную терапию: базиликсимаб 20 мг внутривенно (до операции и на 4-е сутки после). Метилпреднизолон вводился внутривенно капельно во время трансплантации 10 мг/кг, затем на 1-е и 4-е сутки по 250 мг. Базовая иммуносупрессия включала такролимус в стартовой дозе 0,12 мг/кг массы тела в сутки, микофенолата мофетил 2 г/сутки и преднизолон 30 мг в сутки.
Нормализация креатинина произошла на 7 сутки. Пациент был выписан на 26 сутки. В течение одиннадцати месяцев наблюдения функция трансплантата стабильная (креатинин крови 0,07-0,08 ммоль/л), кризов отторжения не зафиксировано.
Пример 2.
В отделение поступила донорская почка от донора 33 лет с диагнозом черепно-мозговая травма, смерть головного мозга. При генотипировании на низком разрешении был определен фенотип донора. Всего было выявлено 43 потенциальных реципиента, подходящих по группе крови. При этом, лучшей совместимостью обладали 7 их них: двое имели 2 несовместимости (первый: 2 несовместимости по В локусу, 1 по DR; второй: 1 - по В локусу соответственно), 5 имели 3 несовместимости (двое: 2 - по А локусу и 1 - по В локусу; двое: 1 - по А локусу, 2 - по В локусу; один - 1 - по А локусу, 1 - по В локусу и 1 - по DR локусу).
Для каждого из этих потенциальных реципиентов в соответствии с данными типирования на низком разрешении последовательно были определены все возможные сочетания генотипов донора и реципиента на высоком уровне и подсчитаны популяционные частоты таких сочетаний. В соответствии с данными с ресурса http://www.epregistrv.com.br для каждого сочетания генотипов донора и реципиента были все определены эпитопы. При сопоставлении эпитопов донора и реципиента для каждого и сочетания генотипов были подсчитаны аллоэпитопные несовместимости. По формуле для каждого реципиента подсчитано взвешенное среднее количества аллоэпитопных несовпадений. Для двух реципиентов с двумя несовпадениями значение Эпср составило 10,2 и 14,7, а для больных с тремя несовпадениями - 12,3; 14,8; 17,8; 21,6; 24,5 соответственно. Поскольку у пациент с Эпср 10,2 в крови были выявлены антитела к донорским антигенам DR, в трансплантации отказано. Трансплантация была выполнена пациенту с Эпср=12,3, у которого в крови антидонорских анти-HLA антител не обнаружено.
Пациент получил стандартную индукционную иммуносупрессивную терапию, включающую базиликсимаб и метилпреднизолон. Базовая иммуносупрессия включала такролимус в стартовой дозе 0,2 мг/кг массы тела в сутки, микофенолата мофетил 2 г/сутки, а также и преднизолон 30 мг в сутки.
Нормализация креатинина произошла на 5 сутки. Пациент был выписан на 28 сутки. В течение полутора лет наблюдения функция трансплантата стабильная (креатинин крови не превышает 0,1 ммоль/л), кризов отторжения не было. Стабильная хорошая функция трансплантата позволила безопасно постепенно снизить дозу преднизолона до 7,5 мг/сут.
По данной методике был проведен выбор реципиента при выполнении 21 трансплантации. Срок наблюдения составил от 8 месяцев до 2 - 4,5 лет.За этот период у всех пациентов трансплантата функционирует.Всего отмечено 3 криза клеточно-опосредованного отторжения (два случая IA и один случай IB категории по классификации Banff 05). Потребовалось 5 госпитализаций, средний срок стационарного лечения составил 14,4±3,9 дней. Донор-специфичные антитела обнаружены у одного реципиента.
В группе сравнения со стандартными критериями выбора реципиента, которая включала 20 пациентов отмечено 8 случаев отторжения (два случая IA, три случая IB категории, один случай IIA и два случая IIB категории по классификации Banff 05) при сроке наблюдения от 6 месяцев до 4,2 лет. Общее количество госпитализаций 12 со средним временем стационарного лечения 22,4±5,1 дня. Донор-специфичные антитела обнаружены у трех реципиентов.
Таким образом, данная методика позволяет выбрать оптимального реципиента для трансплантации неродственного донорского органа. Это позволяет снизить напряженность иммунологического конфликта между реципиентом и донорским органом, снизить риск отторжения и образования донор-специфичных антител, уменьшить потребность в стационарном лечении и сократить его срок, повысить качество жизни пациентов.