Результат интеллектуальной деятельности: Противохламидийная вакцина и способ ее получения
Вид РИД
Изобретение
Изобретение относится к биотехнологии и медицине и касается противохламидийной вакцины и способа ее получения. Предложенная для профилактики хламидиозов вакцина способна защищать от урогенитального хламидиоза и венерической лимфогранулемы.
Предшествующий уровень техники
Как известно, хламидии являются внутриклеточными патогенными бактериями, ответственными за широкий спектр важных инфекций человека и животных. Хламидиоз является серьезной проблемой здравоохранения как развитых, так и развивающихся стран. Урогенитальный хламидиоз, вызываемый Chlamydia trachomatis, является социально значимым, наиболее часто регистрируемым бактериальным инфекционным заболеванием, передаваемым половым путем. По данным Всемирной организации здравоохранения (ВОЗ) ежегодно диагностируется более 100 миллионов случаев инфицирования С. trachomatis (WHO, 2012). Значительное количество бессимптомно протекающих заражений также вносит вклад в распространение урогенитального хламидиоза. Наиболее часто хламидиоз клинически проявляется как уретрит и цервицит.Острое воспаление, как правило, затухает в течение нескольких недель. Однако у значительного количества больных возникают длительные осложнения, включающие воспалительные процессы в органах малого таза, внематочную беременность и бесплодие. В развивающихся странах также часто регистрируют трахому и лимфогранулему, вызываемые С. trachomatis.
Научно-обоснованным методом профилактики хламидиоза является вакцинация. К настоящему времени не зарегистрировано ни одной коммерческой вакцины, направленной на профилактику и лечение заболеваний, вызываемых С. trachomatis. Это связано с особенностями иммунного ответа на хламидии. Так, показано, что иммунный ответ на хламидии часто сопровождается повреждением тканей репродуктивных органов [41], что опосредовано продукцией воспалительных цитокинов, таких как интерлейкин-1 (ИЛ-1), интерлейкин-8 (ИЛ-8) и фактор некроза опухоли - альфа (ФНОα) [25, 26, 41]. Таким образом, основной задачей при разработке противохламидийной вакцины является формирование иммунного ответа, направленного на разрешение воспалительных процессов в репродуктивных органах и не вызывающего развития патологии. Кроме того, при разработке композиции вакцинного препарата предпочтительно использовать консервативные антигены, способные индуцировать протективный иммунный ответ против различных серотипов С. trachomatis.
Важным является формирование иммунного ответа эффективного на различных стадиях жизненного цикла хламидий, как при острой, так и при хронической инфекциях. В настоящее время считают, что создание эффективной вакцины против хламидийной инфекции предполагает формирование ответа специфических Т-хелперов первого типа (T×1), способных эффективно достигать ткани и органы локализации патогена, и формирование специфических системных и локальных антител [5].
Разработка генетических вакцин, в первую очередь, основана на выборе антигенов, обладающих наибольшей иммуногенностью и протективной активностью. В настоящее времени исследован целый ряд антигенов С. trachomatis с целью их потенциального применения для создания вакцинных препаратов. Наиболее часто в качестве протективных антигенов для разработки эффективной противохламидийной вакцины используют хламидийные белки наружной мембраны, такие как, основной белок наружной мембраны МОМР (Major Outer Membrane Protein), полиморфные белки POMPs (Polymorphic Outer Membrane Proteins), цистеин богатые белки CrpA (Cysteine richp rotein A), OmcB (Outer membrane complex protein B) [24, 30, 38, 42].
К наиболее изученным можно отнести основной белок наружной мембраны, МОМР, обладающий высокой иммуногенностью при условии сохранения его нативной конформации [10]. Известна композиция на основе антигенов МОМР, полученных из различных сероваров С. trachomatis, и/или других видов хламидий, а также клинически одобренного адъюванта Е6020, CAS Number 287180-63-6 (WO 2012065263 А1). Эта разработка зарегистрирована как метод индукции иммунного ответа к различным видам хламидий. Преимуществом данного технического решения является широкий спектр действия препарата на основе рекомбинантного белка МОМР и адъюванта Е6020 в отношении различных видов хламидий и использование адъюванта, одобренного для использования в клинике в США.
Недостатками разработки можно считать:
1. Недостаточность данных в отношении эффективности предложенного вакцинного препарата, в отношении патологии, развивающейся в моделях, отличных от урогенитального хламидиоза, вызываемого С. trachomatis.
2. Необходимость 3-х кратного введения вакцинного препарата, что усложняет процедуру иммунизации.
3. Недостаточно охарактеризованный Т-клеточный ответ, его направленность и длительность.
4. В данной работе использованы лиганды толл-подобных рецепторов 7 и 8 типов. Однако доказательств влияния использованных активаторов естественной резистентности на эффективность вакцинного препарата, содержащего композицию антигенов МОМР, приведено не было.
Необходимость поддержания нативной конформации антигена в составе вакцины создает значительные технологические трудности и делает процесс производства такой вакцины избыточно дорогостоящим [34, 38]. Кроме того, данный антиген является вариабельным, что также существенно ограничивает эффективность иммунного ответа на него в отношении различных серотипов С. trachomatis [27, 32, 46, 47].
Известно техническое решение, в котором создана химерная вакцина против гепатита B и С. trachomatis, в которой пептиды рекомбинантного МОМР включены в состав корового антигена гепатита В (HBcAg). Было показано, что такой химерный белок способен индуцировать клеточный и гуморальный иммунный ответ против С. trachomatis. Продемонстрирована иммуногенность и иммунопротективные свойства различных вариантов химерных белков [50].
Недостатками данного технического решения можно считать:
1. Не была подтверждена универсальность исследуемого вакцинного препарата для всех серотипов С. trachomatis.
2. Отсутствие в химерном белке каких-либо дополнительных компонентов, стимулирующих врожденный иммунный ответ, что может ограничивать способность вакцины подавлять внутриклеточную инфекцию.
3. Необходимость многократных введений вакцинного препарата, что усложняет процедуру иммунизации.
4. Не охарактеризован антивоспалительный потенциал предлагаемой вакцины.
Другими кандидатами целевых белков вакцины являются секретируемые белки. Известно использование секретируемого белка хламидий CPAF (Chlamydial Protease/proteasome-like Activity Factor), являющегося протеазой/фактором с протеасомо-подобной активностью [22]. Интраназальная иммунизация рекомбинантным белком CPAF в сочетании с ИЛ-12 индуцировала выраженную продукцию интерферона-γ (ИФγ) и приводила к значительному снижению накопления возбудителя в генитальном тракте мышей, а также ограничивала развитие осложнений в верхних отделах репродуктивной системы [28, 48].
Аналогом можно считать создание вакцины на основе аденовирусноого вектора, экспрессирующие белок CPAF (Ad-CPAF) [9]. Иммунизация Ad-CPAF с бустированием рекомбинантным CPAF (rCPAF) в сочетании с адъювантами олигодезоксинуклеотидами CpG и синтетическим иммуномодулирующим пептидом HН2 (CpG/HH2) приводила к формированию гуморального протективного ответа у мышей при урогенитальном заражении С. trachomatis MoPn.
Недостатками этой разработки можно считать:
1. Такая иммунизация вызывала формирование незначительного Т-клеточного ответа с преобладанием Tx1 и Тх17. Следуют отметить, что продукцию Tx17 связывают с развитием воспалительных реакций в репродуктивных органах при урогенитальном хламидиозе, приводящих к тяжелой патологии.
2. Использованный в исследовании адъювант не разрешен для использования в клинике в России и за рубежом.
Новым подход - это использование эффекторного белка системы секреции III типа (ССТТ), TARP (Translocated Actin-Recruiting Phosphoprotein) в качестве целевого белка для вакцинного препарата [42]. Индукция иммунного ответа на белок TARP ССТТ хламидий может способствовать усилению механизмов защиты от патогена. Использование TARP для иммунизации приводила к формированию протективного Tx1 иммунитета, снижало продуктивную инфекцию в нижних отделах репродуктивного тракта и развитие патологии фаллопиевых труб [42]. Следует отметить, что TARP не является антигеном, постоянно экспрессируемым хламидиями, и, возможно, иммунный ответ на него не будет эффективным на стадии хронической инфекции. Кроме того, в данном исследовании [42] в качестве адъюванта был использован CpG и неполный адъювант Фрейнда (НАФ), не разрешенные к использованию в клинике в России и за рубежом.
Известна разработка вакцины для перекрестной защиты против широкого диапазона сероваров Chlamydia trachomatis на основе композиций полипептидов, содержащих один хламидийный антиген или нескольких хламидийных белков [51]. Вариант такой вакцины может содержать белок Ct-089, также известный как CopN, предполагаемый экспортируемый регулятор системы секреции III типа [49]. В случае использования только этого белка недостатком является его присутствие в клеточной стенке хламидий не на всех стадиях развития патогена.
Известно техническое решение, в котором для вакцины предлагаются высокоиммуногенные B-клеточные эпитопы эффекторного белка третьей транспортной системы TARP С. trachomatis [50]. Сильной стороной данного изобретения является иммунизация эпигонами данного белка ССТТ хламидий, что направлено на усиление протективного потенциала организма хозяина.
Недостатками данного технического решения являются:
1. Отсутствие разрешенных в клинике в России и за рубежом разработанных систем доставки антигена и адъювантов.
2. Иммунизация направлена на В-клеточный ответ, что недостаточно для создания длительного протективного иммунитета.
3. Использование пептидных эпитопов эффекторного белка третьей транспортной системы TARP С. trachomatis требует многократных иммунизаций.
4. Поскольку TARP не является антигеном, постоянно экспрессируемым хламидиями, иммунный ответ к нему может быть не эффективным на стадии хронической инфекции.
Одной из перспективных мишеней для создания противохламидийных вакцин можно рассматривать систему секреции III типа, которая является доминирующим фактором патогенности хламидий. Эта структура характеризуется высокой степенью консервативности для всех представителей семейства Chlamydiaceae. Она обеспечивает транспорт эффекторных молекул в клетку хозяина, что позволяет подавлять защиту хозяина и поддерживать инфекционный процесс, как при остром, так и хроническом течении инфекции. Данная система секреции характеризуется наличием более 20 белков, составляющих аппарат ("молекулярный шприц") для транспорта в клетку хозяина факторов патогенности, взаимодействующих с мембраной или проникающих непосредственно в цитоплазму клетки хозяина и изменяющих ее нормальное физиологическое состояние, способствуя инвазии и внутриклеточному размножению патогена [1]. Во внутренней мембране бактерий расположена кольцевая белковая структура, играющая основную роль в распознавании секретируемых молекул, в инициации процесса секреции и его энергетическом обеспечении. Эта белковая структура состоит из базального тела и окружающих его белков-экспортеров, обеспечивающих активный транспорт белков в периплазматическое пространство. Непосредственно к этой базальной структуре присоединен белковый канал, проходящий через пептидогликан и наружную мембрану бактериальной клетки. В наружной мембране канал фиксируется кольцевыми белковыми структурами (секретон). Секретон состоит из ряда белков наружной мембраны бактерии, участвующих в транспорте эффекторных белков и компонентов транслокона через внешнюю мембрану бактерии. Над поверхностью микробной клетки выступает белковая структура - «игла» и транслокон, формирующий пору в мембране эукариотической клетки [8]. Игла ССТТ имеет размеры около 60-80 нм в длину и 8 нм в диаметре и образована структурными белками, представленным на поверхности наружной мембраны клеточной стенки. Диаметр отверстия в игле примерно равен 3 нм.
Известно, что одна бактерия может иметь несколько сотен структур ССТТ. Хламидии на всех этапах жизненного цикла при острой инфекции, а также и при хронической инфекции абсолютно зависимы от функционирования ССТТ. Этот секреторный аппарат обеспечивает патогену инвазию, блокирование иммунного ответа, предотвращение слияния с лизосомой; регулирует созревание включения и его миграцию в цитоплазме в направлении центра организации микротрубочек; определяет поступление питательных веществ и липидов; позволяет управлять клеточным циклом и сигнальными путями, индуцирующими воспаление, a также обеспечивает выход нового поколения инфекционных частиц после завершения внутриклеточного цикла. Таким образом, подавление функциональной активности ССТТ хламидий приводит к подавлению размножения патогена и блокированию инфекционного процесса, что свидетельствует о перспективности выбора белков ССТТ в качестве мишеней для создания вакцинных препаратов.
Структурный белок CdsF (Chlamydia needle filament protein of the injectisome) ССТТ хламидий, предложенный в качестве главного компонента кандидатной вакцины в нашем изобретении, является основным белком инжектосомы третьей транспортной системы хламидий. Белок CdsF концентрируется на внешней мембране элементарных телец (ЭТ) и ретикулярных телец (РТ) и формирует поверхностную структуру, обозначаемую как «игла» [13]. Во время контакта с эукариотической клеткой происходит полимеризация белка CdsF и, как следствие, активация (сборка) инжектосомы [6]. Формирование иммунного ответа против этого ключевого компонента ССТТ хламидий представляется крайне перспективным. Будучи структурным белком ССТТ, CdsF экспрессирован на мембране хламидий на всех стадиях развития патогена, в том числе как при острой, так и при хронической инфекциях. Кроме этого, хламидийный белок «иглы» CdsF ССТТ содержит остатки цистеина, которые являются уникальными для белков «иглы» ССТТ [6]. Дисульфидные связи в полимеризованной «игле» ССТТ связаны со степенью окисления оболочки хламидий и стадиями развития патогена [7]. Предполагают, что дисульфидные связи, обнаруженные у CdsF, локализованного у элементарных телец (ЭТ), могут участвовать в функционировании секреторного аппарата хламидий.
Поскольку антигены, обладающие наибольшим протективным потенциалом, не всегда являются высокоиммуногенными, разработка эффективных и безопасных систем доставки и рациональное использование адъювантов, разрешенных в клинической практике, является крайне актуальной.
Одним из наиболее эффективных на сегодняшний день подходов для создания безопасных и эффективных вакцин нового поколения является использование генетических вакцин, в том числе базирующихся на рекомбинантных аденовирусных векторах [45]. При введении в организм таких вакцин происходит попадание генетического материала в клетки и экспрессия в них генов целевых белков патогена. В результате антигены соответствующих патогенов распознаются иммунной системой, что приводит к индукции как гуморального, так и клеточного иммунного ответа. В настоящее время наиболее перспективными и часто используемыми для создания генетических вакцин являются рекомбинантные аденовирусные векторы, созданные на основе аденовируса человека пятого серотипа [20].
Вакцины на основе рекомбинантных аденовирусных векторов имеют ряд преимуществ:
- рекомбинантные аденовирусные векторы являются репликативно-дефектными и не способны вызывать заболевания. Безопасность аденовирусов человека пятого серотипа с делетированными Е1 и Е3 областями генома подтверждается клиническими испытаниями различных вакцинных и терапевтических препаратов на их основе.
- не требуют многократных дополнительных введений, так как экспрессия целевого антигена (фъюжн-белка) происходит непосредственно в организме иммунизированного субъекта;
- рекомбинантные аденовирусные векторы позволяют проводить интраназальную иммунизацию, и, как следствие, индуцируют образование мукозального иммунного ответа;
- рекомбинантные аденовирусные векторы по сравнению с рекомбинантными белками, получаемыми в культуре эукариотов, более дешевы и высокоиммуногенны, так как их небольшая доза позволяет продуцировать в организме значительные количества белка.
- на сегодняшний момент разработаны быстрые и гибкие технологии получения рекомбинантных аденовирусных векторов, позволяющие реализовывать на одной технологической линии масштабное производство различных кандидатных вакцин на их основе, без ее переоборудования и изменения регламента. Среди генетических вакцин, проходящих клинические испытания, на долю вакцин на основе рекомбинантных аденовирусов приходится около 24% (clinicaltrials. gov).
Вышеперечисленные свойства делают рекомбинантные аденовирусные векторы хорошей технологической платформой для создания широкого спектра вакцин против различных патогенов [2, 12, 29, 36, 37, 44].
Помимо выбора высокоиммуногенных антигенов, эффективных систем доставки, важную роль в разработке вакцины играет успешный выбор адъювантов. Одними из первых разработанных адъювантов являются масляные эмульсии. Они представляют собой комбинации двух несмешиваемых компонентов, обычно воды и масла, один из которых диспергирован (рассредоточен) в составе другого в виде капель. Поскольку в эмульсии сочетаются несовместимые вещества, необходимы стабилизаторы, в роли которых выступают поверхностно-активные вещества и эмульгаторы, покрывающие капли снаружи. В качестве адъювантов применяют так называемые «наноэмульсии» - такие эмульсии, диаметр капель масла или воды в которых составляет 10-1000 нм (в среднем 20-600 нм). Существует два основных типа эмульсий: «масло в воде» (масляно-водные) и «вода в масле» (водно-масляные). Оба типа обладают адъювантной активностью и усиливают выработку антител на вакцинные антигены (это является важным показателем эффективности стимуляции иммунитета), но водно-масляные адъюванты более реактогенны и токсичны. По этой причине масляно-водные адъюванты широко применяются в составе лицензированных человеческих вакцин [16].
Большинство масляно-водных адъювантов современных вакцин в качестве масляного компонента содержат сквален, структурная формула которого представлена ниже:
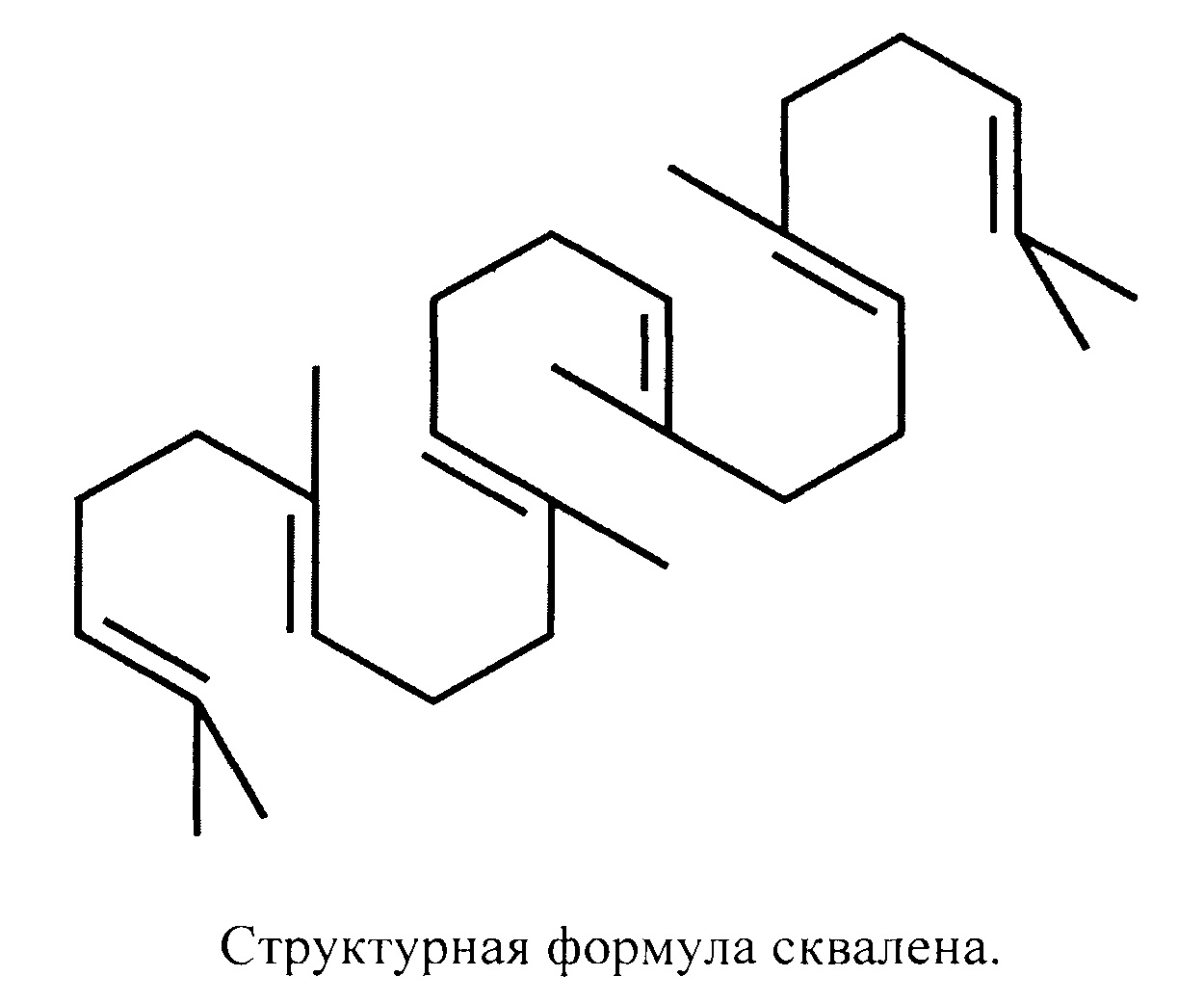
Сквален - органический полимер из группы каротиноидов - компонент животных и растительных клеток, является промежуточным соединением в биологическом синтезе стероидов, а также синтезируется рядом микроорганизмов. Эти факторы обусловливают биосовместимость и биодеградируемость сквалена. До недавнего времени основным его источником служила печень акул. Однако после обнаружения сквалена в растениях его стали получать из растительных масел, поскольку технология выделения сквалена из печени акулы весьма трудоемкая. В отличие от минеральных масел, входящих в состав многих водно-масляных эмульсий, сквален гораздо быстрее метаболизируется (расщепляется) в организме, а значит, он более биодеградируем и биосовместим, собой наноэмульсию
При выборе адъювантов для создания противохламидийной вакцины необходимо учитывать следующее обстоятельство. Используемый адъювант, помимо решения задачи повышения иммуногенности вакцинного препарата, должен нивелировать сопутствующую инфекции патологическую симптоматику. Такими свойствами обладают некоторые лиганды толл-подобных рецепторов. Толл-подобные рецепторы - это трансмембранные белки, локализованные на поверхности плазматической мембраны клеток, а также в составе внутриклеточных компартментов (эндосом). Лигандами толл-подобных рецепторов могут служить молекулы различной химической природы и структуры, такие, как липополисахариды (ЛПС), флагеллин, бактериальные липопептиды, бактериальная и вирусная ДНК и другие. Получены многочисленные данные, характеризующие способность лигандов толл-подобных рецепторов активировать NF-kB (транскрипционный фактор, nuclear factor kappa-light-chain-enhancer of activated B cells) как in vitro, так и in vivo [11]. Опосредованная NF-kB-способность лигандов толл-подобных рецепторов запускать различные реакции иммунной системы позволяет использовать лиганды в качестве средств немедленной защиты от патогенов, молекулярных адъювантов и т.д. [19, 43].
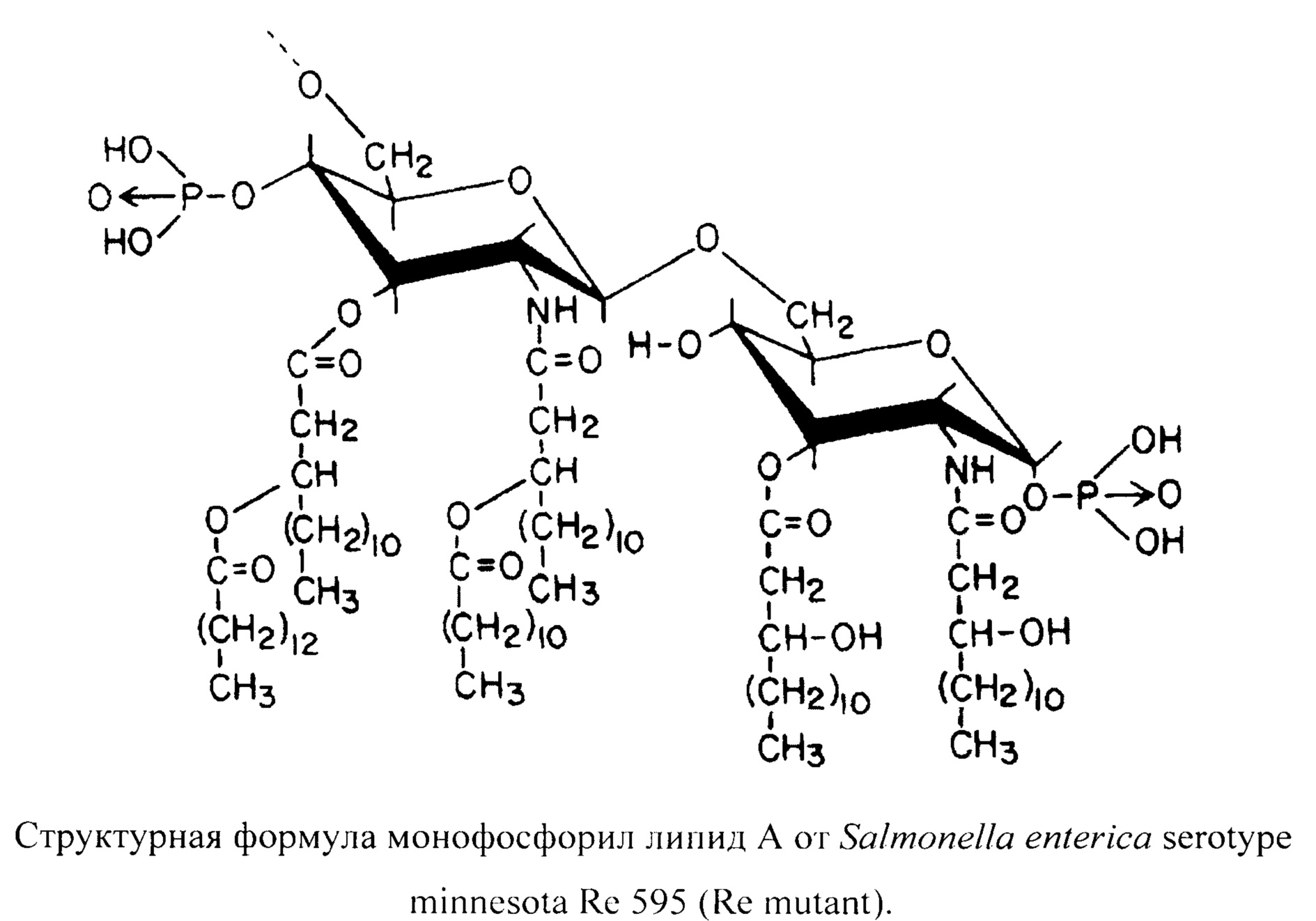
Одним из таких лигандов, утвержденных для использования в клинике, является монофосфорил липид A (monophosphoryl lipid A, MPLA) [12], структурная формула которого представлена ниже. MPLA широко используется в качестве адъюванта к вакцинам, и его безопасность подтверждена многолетними исследованиями [18]. MPLA является производным эндотоксина, который используется в качестве адъюванта таких вакцин для человека, как «Энджерикс B» - для формирования иммунного ответа у пациентов с иммунодефицитным состоянием [17] и против вируса гепатита B [40], «Церварикс» - против вируса папилломы человека [14]; и в разработке вакцины против туберкулеза [15]. MPLA производится путем гидролиза нативного дифосфорил липида A, компонента липополисахарида (ЛПС), который распознается толл-подобным рецептором 4 типа, в результате чего происходит удаление всех фосфатных групп, кроме одной, и различной степени деацилирование [31]. Эти структурные изменения позволяют уменьшить системную токсичность на более 99% по сравнению с нативным липидом А, в результате чего получается иммуномодулирующее средство с более высоким потенциалом для клинического применения [3, 39]. MPLA в отсутствии токсичности снижает индукцию провоспалительных цитокинов, таких как ФНОα, ИЛ-1, и гамма-интерферона (ИФγ) в течение начального воздействия [33]. После введения летальных доз ЛПС мышам применение MPLA способствует увеличению выживаемости [3, 23]. Тем самым, использование MPLA в качестве адъюванта к вакцинам является перспективным.
В разработке вакцины значимым является выбор оптимального способа иммунизации. При сравнении разных способов иммунизации было установлено, что перспективным является использование интраназальной иммунизации, которая обеспечивает индукцию мукозального иммунного ответа, особенно важного при урогенитальном хламидиозе. Кроме того, известно, что мукозальный способ введения вакцин, как правило, не ассоциирован с развитием воспалительных поствакцинальных осложнений [21].
Таким образом, существует необходимость в поиске новых кандидатных белков хламидий, в выборе эффективного способа доставки, в повышении их иммуногенности за счет адъювантов, в оптимальном способе иммунизации и усилении протективных свойств, предотвращающих развитие восходящей инфекции и патологии в репродуктивных органах.
Раскрытие изобретения
Цель настоящего изобретения - создание комбинированной противохламидийной вакцины, обладающей протективной активностью путем индукции как гуморального, так и клеточного иммунного ответов против различных серотипов С. trachomatis.
Термин «комбинированная противохламидийная вакцина» для целей настоящего изобретения означает вакцину, способную индуцировать защитный иммунный ответ против хламидийной инфекции с помощью последовательной иммунизации, при этом праймирование осуществляется компонентом на основе рекомбинантного аденовирусного вектора, экспрессирующего полноразмерный структурный белок системы секреции III типа (ССТТ) С. trachomatis, в то время как бустирование осуществляется компонентом на основе рекомбинантного структурного белка ССТТ С. trachomatis, монофосфорил липида A (MPLA) и сквалена.
Термин «праймирующий компонент» для целей настоящего изобретения означает компонент, состоящий из рекомбинантного аденовирусного вектора, экспрессирующего полноразмерный структурный белок ССТТ С. trachomatis, который вводят однократно интраназально.
Термин «бустирующий компонент» для целей настоящего изобретения означает компонент, который вводят подкожно через две недели после праймирующего компонента и который состоит из эмульсии, содержащей рекомбинантный структурный белок ССТТ С. Trachomatis и комбинацию адъювантов: MPLA - лиганда толл-подобного рецептора 4 типа и сквалена.
Сущность изобретения заключается в разработке технологии (способа получения) новой оригинальной комбинированной противохламидийной вакцины, содержащей праймирующий компонент - рекомбинантный аденовирус, несущий химерный ген, состоящий из N-концевой части маннозо-связывающего лектина, спейсера и гена антигена CdsF хламидий, которые слиты в единую рамку считывания и экспрессируются как единый белковый продукт; и содержащей бустирующий компонент, состоящий из рекомбинантного структурного белка rCdsF ССТТ хламидий, комбинированного адъюванта, содержащего монофосфорил липида А (MPLA) - лиганд толл-подобного рецептора 4 типа и сквален.
Под геном антигена CdsF в настоящем изобретении следует понимать ген хламидий, кодирующий белок, образующий инжектосому ССТТ. В различных штаммах этот белок имеет различные обозначения, например: СТ666 - Chlamydia trachomatis (strain D/UW-3/Cx), ТС_0037 в Chlamydia trachomatis MoPn (strain Nigg).
Технический результат настоящего изобретения заключается в том, что комбинированная противохламидийная вакцина, созданная на основе полноразмерного структурного белка CdsF системы секреции III типа хламидий, в экспериментах in vivo в доклинических исследованиях вызывает выраженную протективную активность путем индукции специфического гуморального и специфического Т-клеточного иммунного ответов.
Заявленная комбинированная противохламидийная вакцина содержит на дозу:
- рекомбинантный аденовирусный вектор, экспрессирующий ген полноразмерного структурного белка системы секреции III типа хламидий - 108-109 БОЕ в фармацевтически приемлемом буфере объемом 0,5 мл.
- рекомбинантный структурный белок системы секреции III типа хламидий 10,0-20,0 мкг, MPLA 50,0 мкг, сквален 10,0 мг в 0.5% Tween 80, в объеме 0.5-1 мл.
Под "фармацевтически приемлемым буфером" следует понимать раствор, содержащий субстанции или композиции, которые не вызывают аллергической или похожей нежелательной реакции при введении человеку.
17Для более ясного понимания настоящего изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ, далее приводится подробное описание получения и действия комбинированной вакцины с примерами в качестве целевого гена белка CdsF хламидий и ссылки на фигуры чертежей.
Т.к. необходимо было показать, что предлагаемая вакцина обеспечивает защиту против хламидийной инфекции in vivo, то была разработана модель острой и восходящей урогенитальной инфекции у мышей. Для моделирования инфекционного процесса у мышей был выбран серотип С. trachomatis MoPn, который является естественным мышиным патогеном. Данная модель урогенитальной хламидийной инфекции, имитирует многие аспекты урогенитальной инфекции у женщин, вызванной человеческими штаммами С. trachomatis. При урогенитальной инфекции, вызванной С. trachomatis MoPn у мышей в течение нескольких недель развивается инфекция в нижних отделах урогенитального тракта, которая затем переходит в восходящую, приводя к развитию патологии репродуктивных органов и бесплодию, аналогично как при урогенитальной хламидийной инфекции у женщин.
Краткое описание чертежей
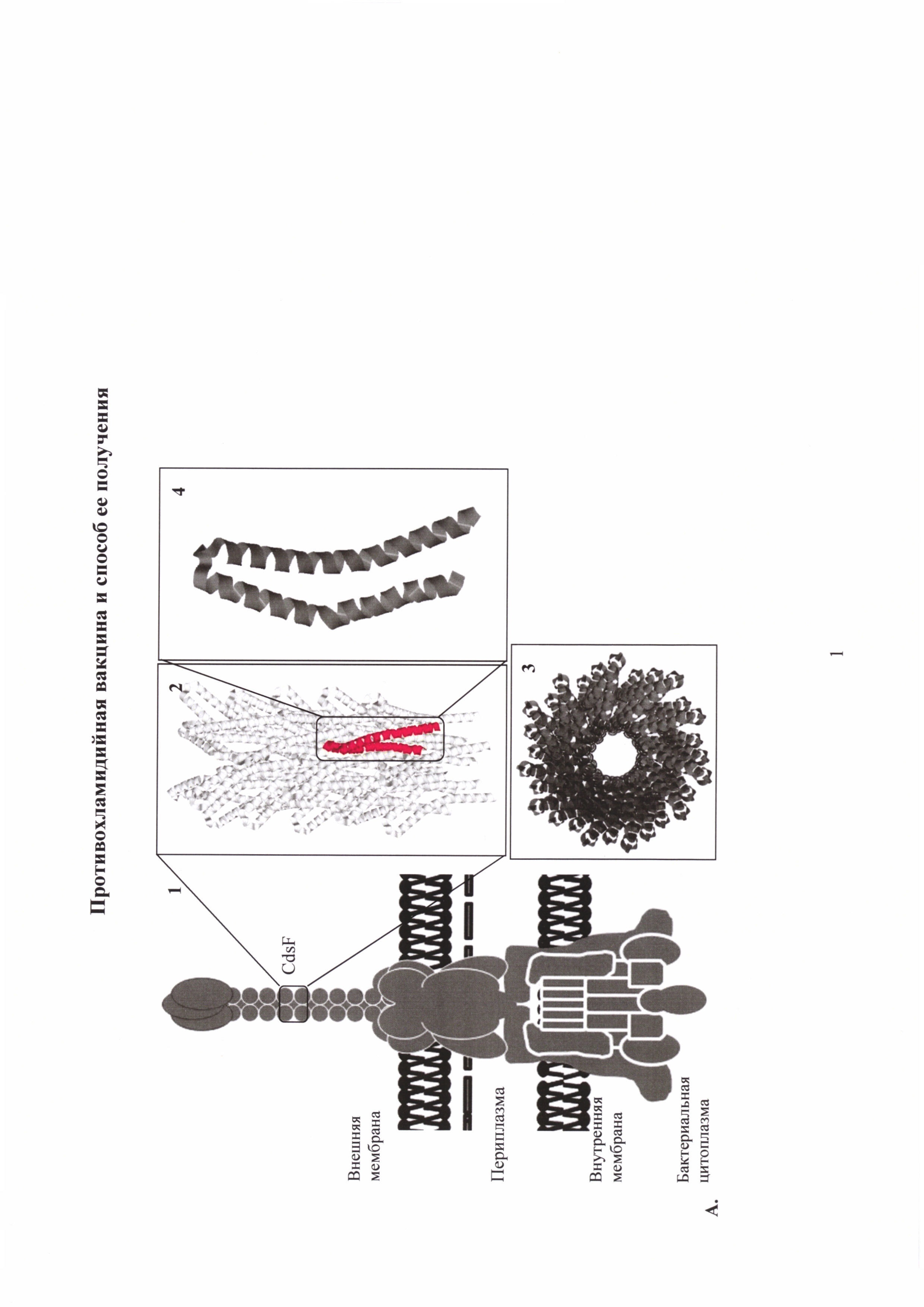
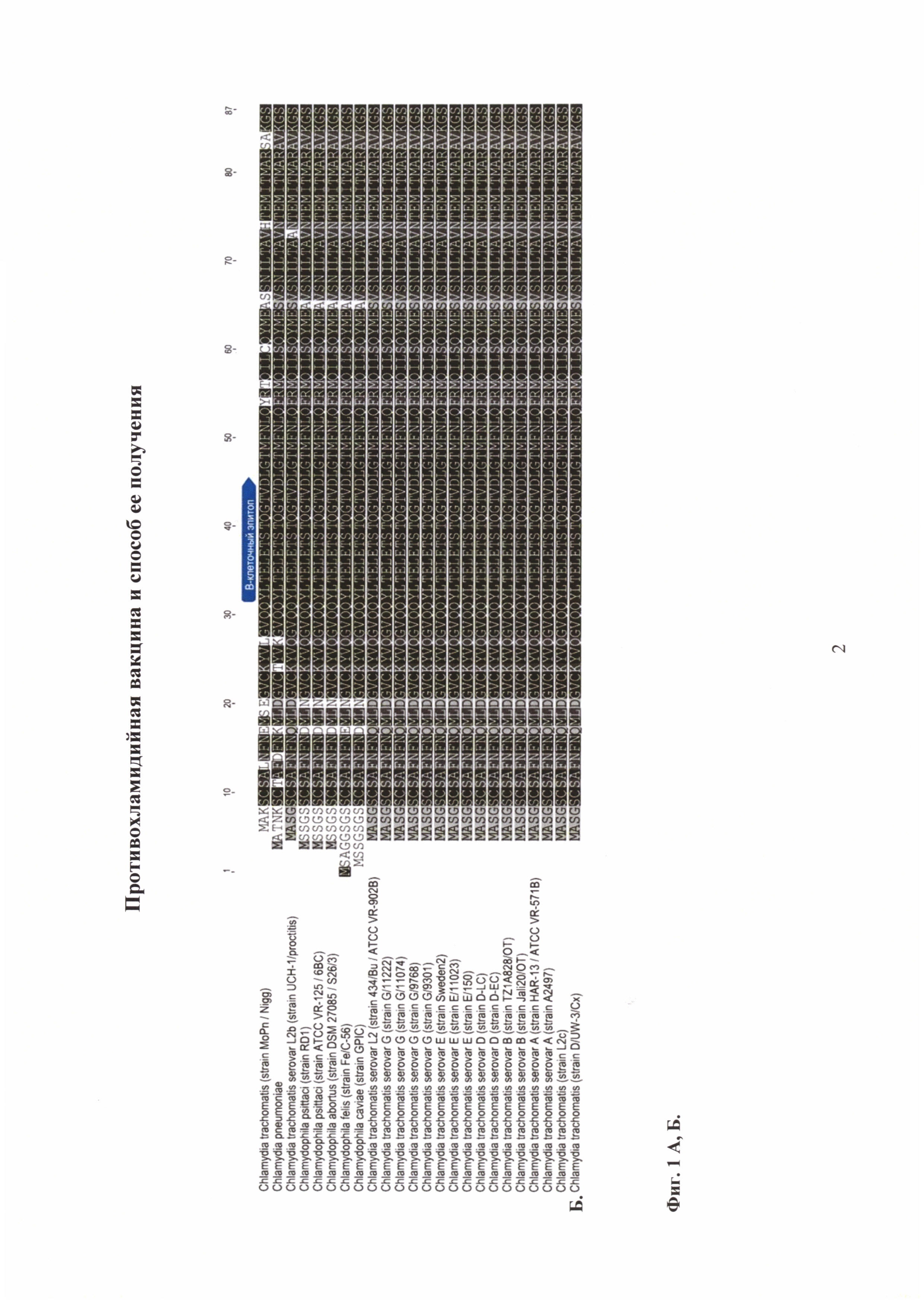
На фиг. 1 показаны строение ССТТ С. trachomatis MoPn и консервативность белка CdsF, образующего инжектосому ССТТ у представителей семейства Chlamydiaceae:
1А. Схема строения системы секреции третьего типа (ССТТ) С. trachomatis MoPn, в которой
1 - белок инжектосомы CdsF ССТТ.
2 - вид инжектосомы сбоку.
3 - вид инжектосомы сверху.
4 - мономер белка CdsF.
1Б. Консервативность белка CdsF, образующего инжектосому ССТТ, у представителей семейства Chlamydiaceae. Над аминокислотной последовательностью белка отмечен консервативный В-клеточный эпитоп.
На фиг. 2 представлена эпитопная карта антигена CdsF для молекул МНС мышей линии BALB/c, имеющих гаплотип H-2d (2А) и молекул HLA наиболее распространенных в российской популяции (2Б). Над аминокислотной последовательностью белка отмечены эпитопы МНС I класса, под - эпитопы МНС II класса. Эпитопы для различных аллелей МНС II представлены разными оттенками серого. Волнистой линией отмечен B-клеточный эпитоп.
На фиг. 3 показана нуклеотидная последовательность гена, кодирующего полноразмерный белок ТС_0037 С. trachomatis МоРn.
На фиг. 4 показана аминокислотная последовательность полноразмерного белка ТС_0037 С. trachomatis МоРn.
На фиг. 5 показана нуклеотидная последовательность глицин-серинового спейсера (GS-спейсера).
На фиг. 6 представлена нуклеотидная последовательность гена белка маннозо-связывающего лектина (MBL).
На фиг. 7 показана аминокислотная последовательность глицин-серинового спейсера.
На фиг. 8 представлена аминокислотная последовательность MBL.
На фиг. 9 показана полная нуклеотидная и аминокислотная
последовательность генетической конструкции MBL-TC_0037.
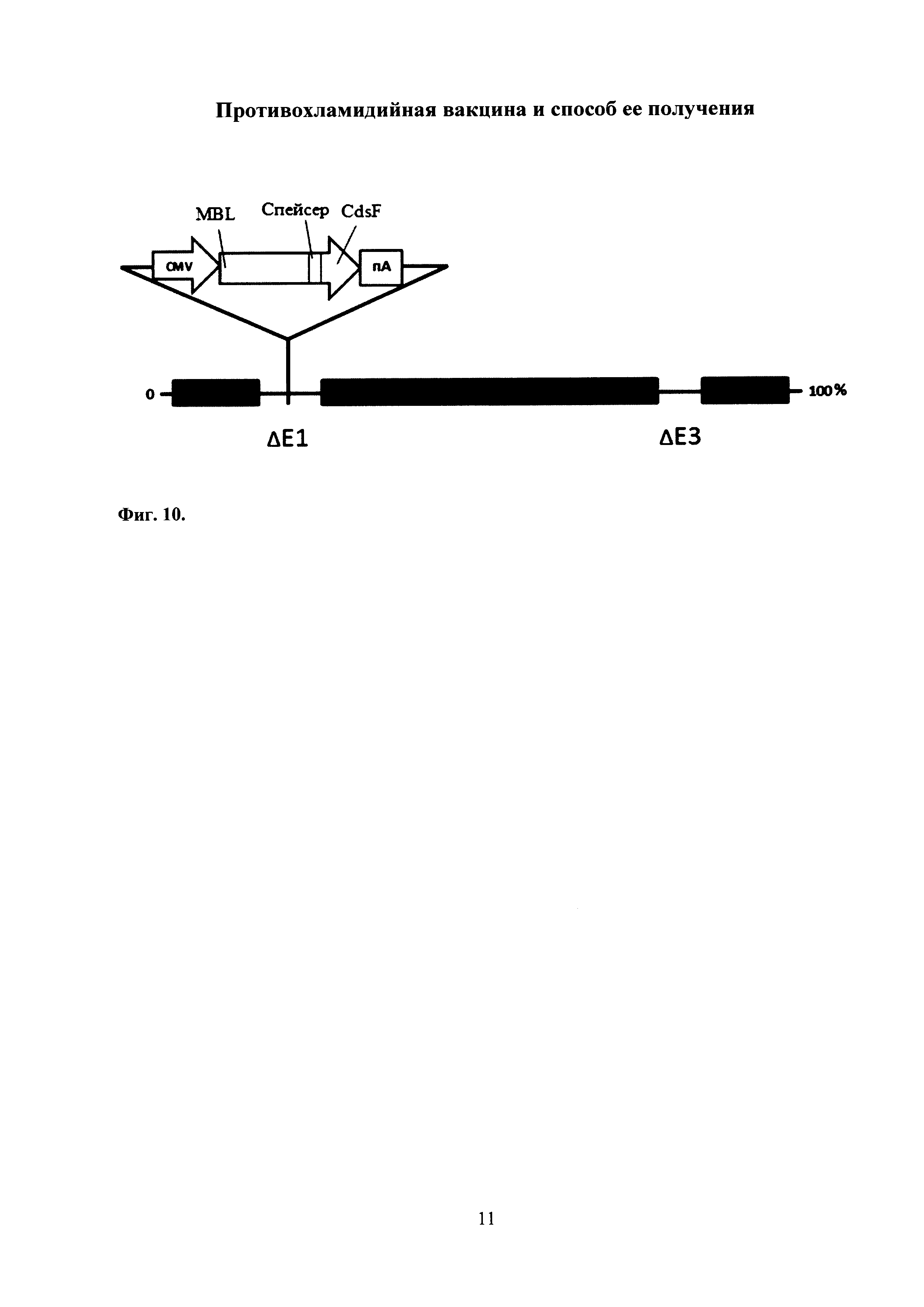
На фиг. 10 представлена схема экспрессионной кассеты рекомбинантного аденовируса человека 5 серотипа под контролем промотора цитомегаловируса человека (CMV-промотора). ΔЕ3-удаленны гены Е3 области.
На месте удаленной Е1-области (ΔЕ1) аденовирусного генома вставлена экспрессионная кассета, которая содержит:
CMV - промотор цитомегаловируса человека,
пА - сигнал полиаденилирования,
CdsF - антиген С. trachomatis,
MBL - маннозо-связывающий лектин Mus musculus.
На фиг. 11 показана нуклеотидная последовательность гена, кодирующего белок ТС_0037 С. trachomatis MoPn с шестью кодонами гистидина на С-конце (TC_0037-6*His).
На фиг. 12 показана аминокислотная последовательность белка ТС_0037-6*His.
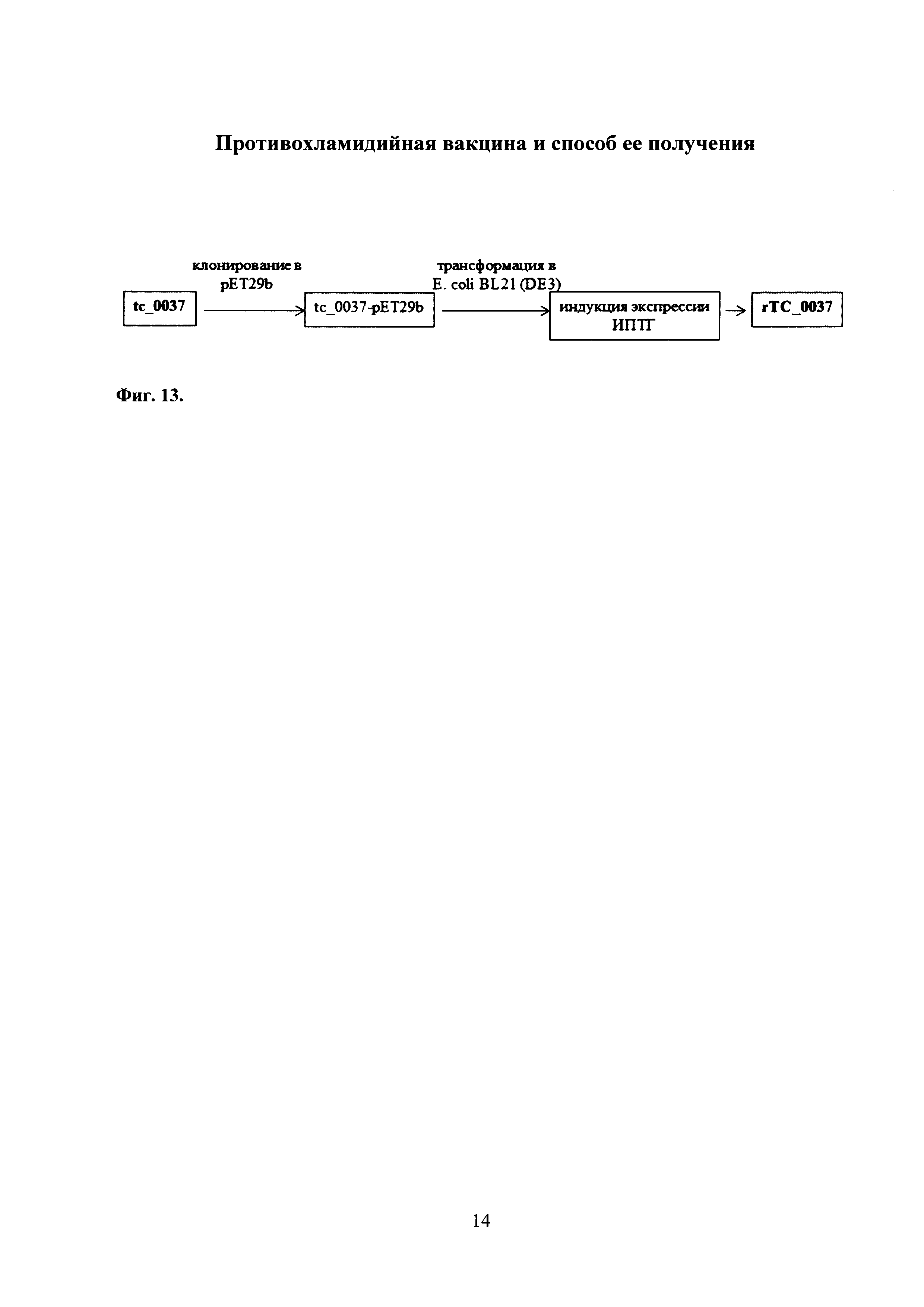
На фиг. 13 представлена схема получения рекомбинантного белка для бустирующего компонента на примере гена белка ТС_0037 С. trachomatis MoPn, в которой
tc_0037 - ген полноразмерного белка ТС_0037 С. trachomatis;
pET29b - плазмида;
Е. coli BL21 (DE3) -Е. coli штамм BL21 (DE3);
ИПТГ - изопропил-β-D-1-тиогалактопиранозид;
rТС_0037 - рекомбинантный белок ТС_0037.
На фиг. 14 показан вестерн-блотт белка TC_0037-6*His, очищенного из клеток E.coli, в которой под
1 - контроль с 6*His.
2-5 - разведения нерастворимой фракции белка, полученной в денатурирующих условиях (8 М мочевина):
1 - контроль с 6*His;
2 - 1: 50;
3 - 1: 100;
4 - 1: 200;
5 - 1: 250.
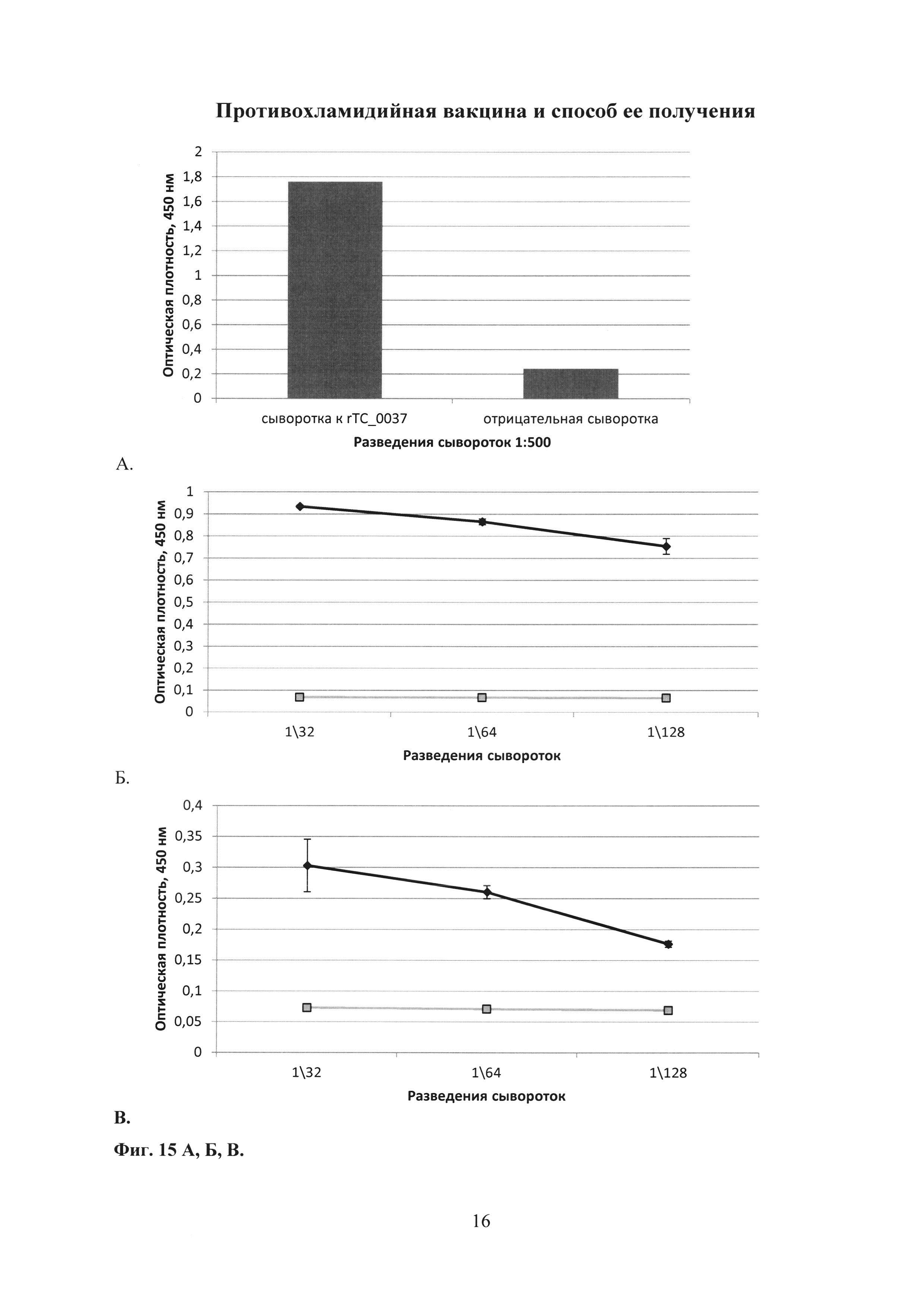
На фиг. 15 (А, Б, В) представлены графики определения специфических антител к рекомбинантному белку rTC_0037 С. trachomatis MoPn.
15А. Определение специфических антител к рекомбинантному белку rTC_0037 С. trachomatis MoPn в сыворотке крови кролика (разведение 1:500), иммунизированного rTC_0037, где
 - rTC_0037
- rTC_0037
15Б. Определение специфических антител к рекомбинантному белку rTC_0037 С. trachomatis MoPn в сыворотке крови кролика, иммунизированного С. trachomatis L2, где
 - сыворотка к С. trachomatis L2;
- сыворотка к С. trachomatis L2;
 - отрицательная сыворотка.
- отрицательная сыворотка.
15В. Определение специфических антител к рекомбинантному белку rTC_0037 С. trachomatis MoPn в сыворотке крови, взятой от человека больного хламидиозом, вызванным С. trachomatis, где
 сыворотка к С. trachomatis L2;
сыворотка к С. trachomatis L2;
 - отрицательная сыворотка.
- отрицательная сыворотка.
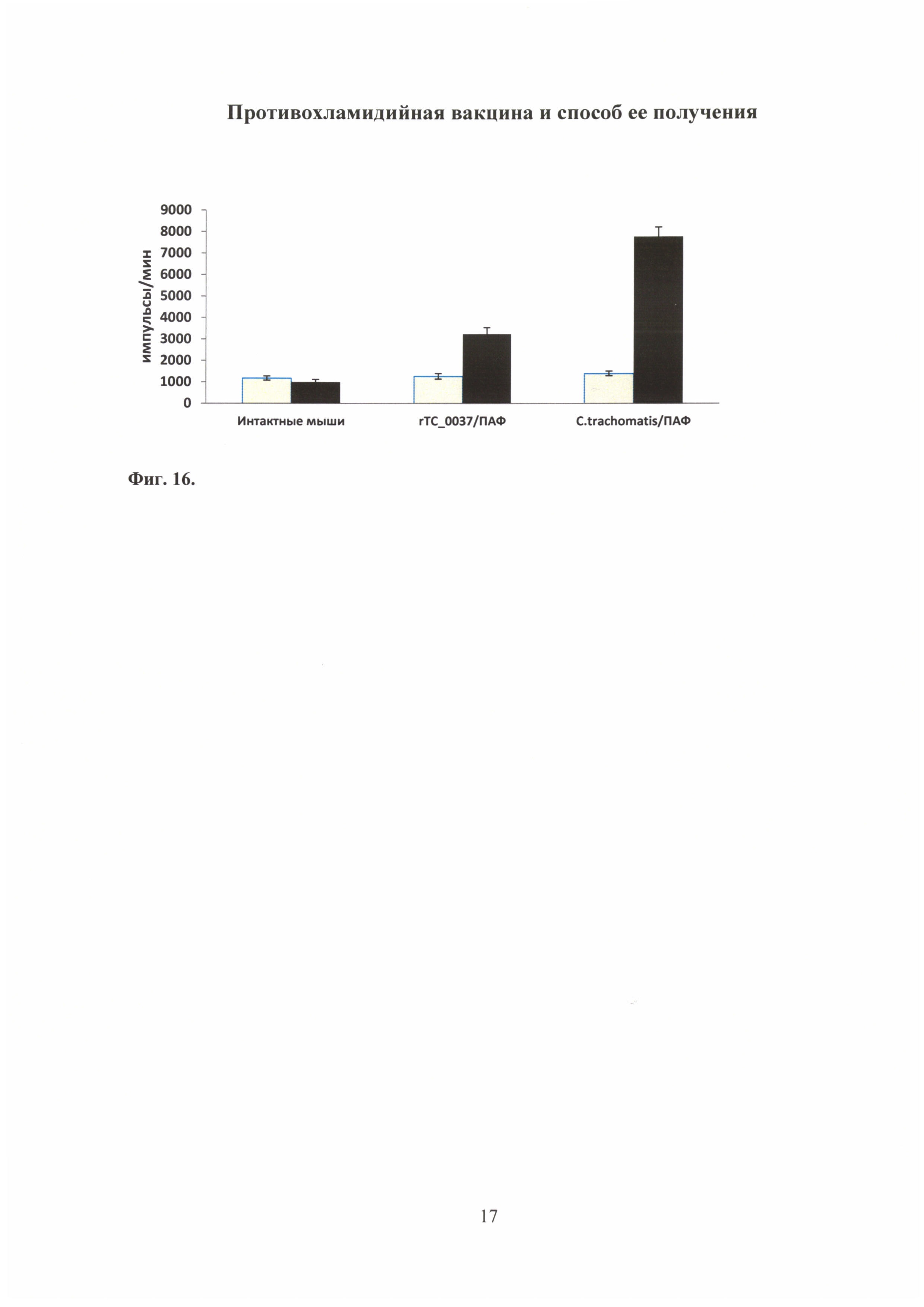
На фиг. 16 показан специфический лимфопролиферативный ответ к антигену rTC_0037, где
 - контроль;
- контроль;
 - rTC_0037.
- rTC_0037.
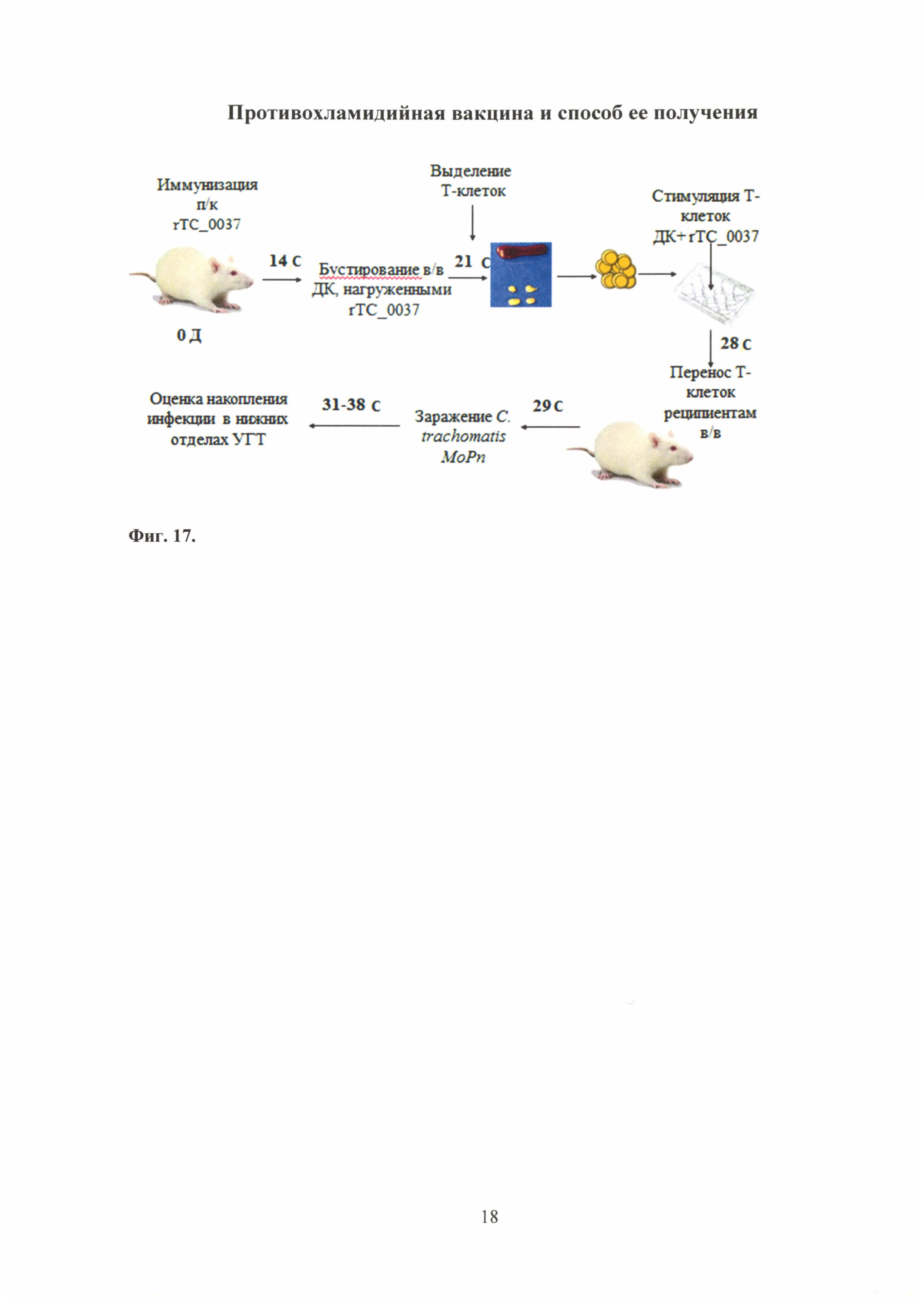
На фиг. 17 представлена схема проведения эксперимента по адаптивному переносу Т-клеток, где
rTC_0037 - рекомбинантный белок rTC_0037 С. trachomatis MoPn;
ДК - дендридные клетки;
п/к - подкожная инъекция;
в/в - внутривенная инъекция;
УГТ - урогенитальный тракт.
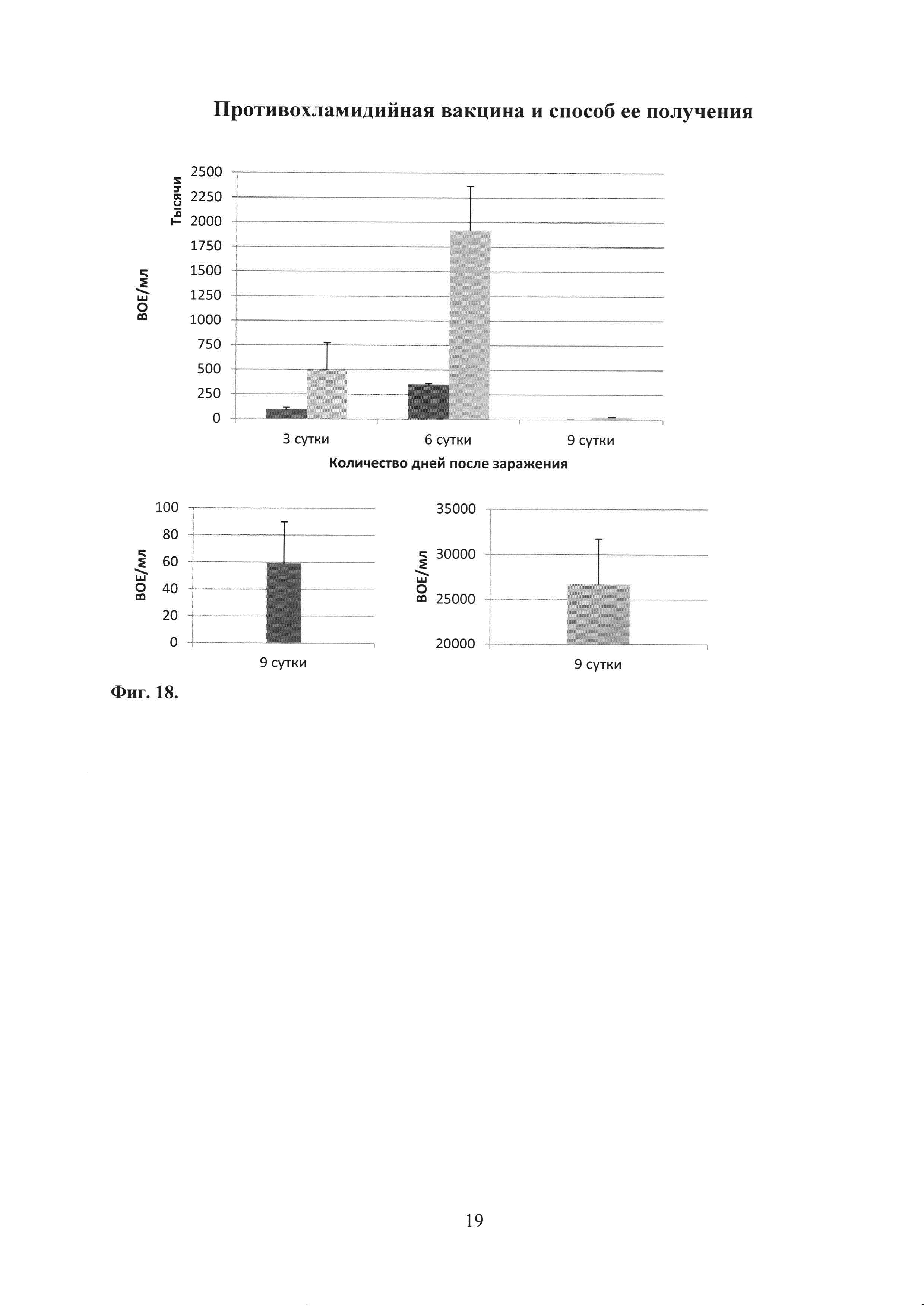
На фиг. 18 показан график по изучению протективности антигена rTC_0037 С. trachomatis MoPn после проведения адаптивного переноса на модели острой урогенитальной инфекции у мышей, в котором
 rTC_0037 - группа мышей, которым перенесли Т-клетки от мышей иммунизированных rTC_0037;
rTC_0037 - группа мышей, которым перенесли Т-клетки от мышей иммунизированных rTC_0037;
 С. trachomatis - группа мышей, которым не производили перенос Т-клеток (контроль заражения С.trachomatis MoPn), где
С. trachomatis - группа мышей, которым не производили перенос Т-клеток (контроль заражения С.trachomatis MoPn), где
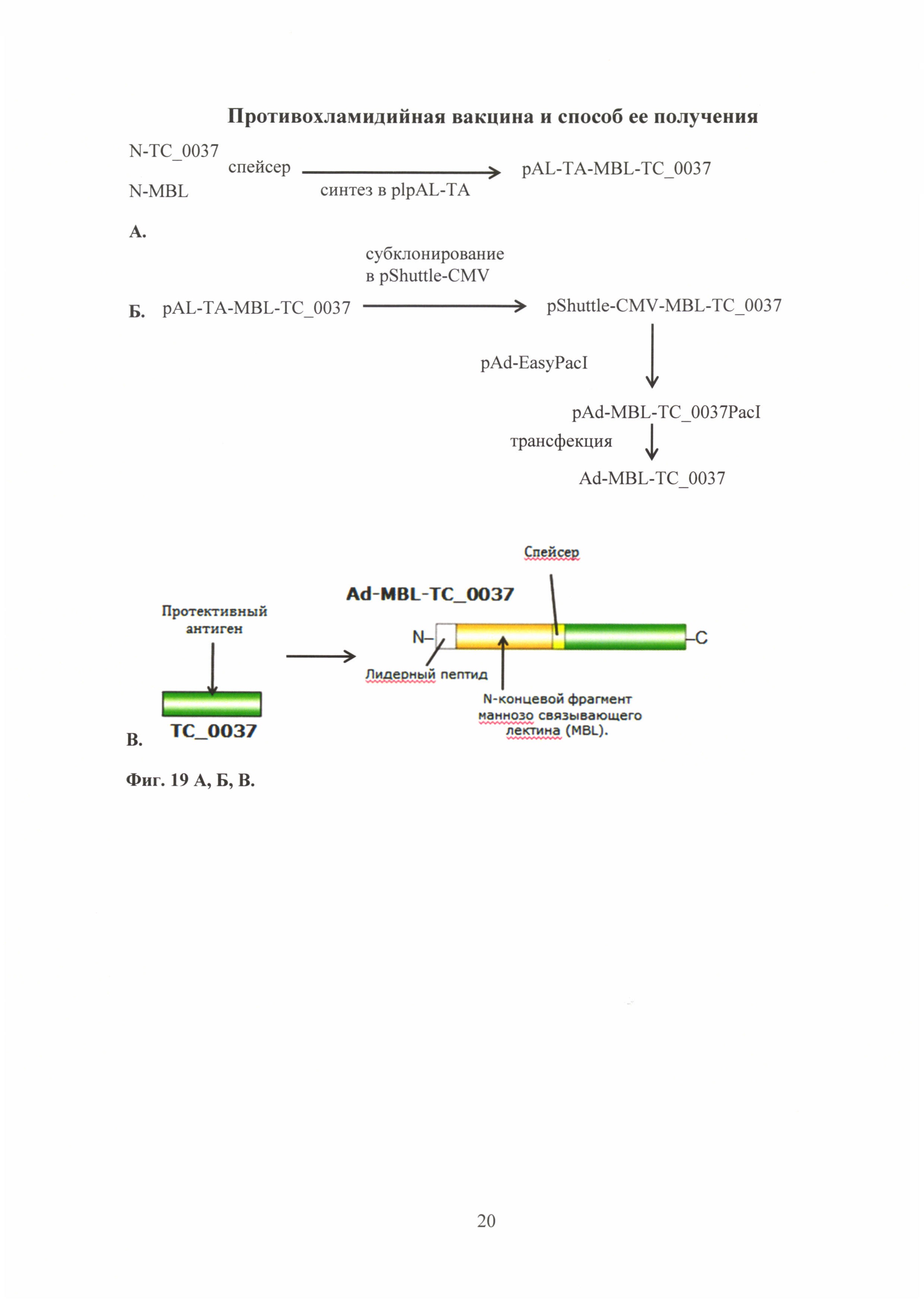
На фиг. 19 (А, Б, В) показана схема получения генетической конструкции на основе аденовирусного вектора, несущего ген белка CdsF С. trachomatis MoPn, включающая:
19А. Синтез гена MBL-TC_0037 в плазмиду pAL-TA;
19Б. Получение рекомбинантного аденовируса Ad-MBL-TC_0037;
19В. Схематическое изображение рекомбинантного аденовируса, несущего ген антигена ТС_0037 С. trachomatis MoPn (Ad-MBL-TC_0037), где:
ТС_0037 С. trachomatis MoPn - протектиный антиген;
MBL - N-концевой фрагмент маннозо-связывающего лектина;
лидерный пептид - N-концевая последовательность секреторного белка ТС_0037, состоящая из 15 аминокислот, которая отщепляется в процессе посттрансляционного изменения такого препептида, в результате чего он превращается в зрелый секретируемый пептид;
спейсер - глицин-сериновый спейсер.
На фиг. 20 показана экспрессия рекомбинантного белка MBL-TC_0037 (24кДа) из аденовирусного вектора.
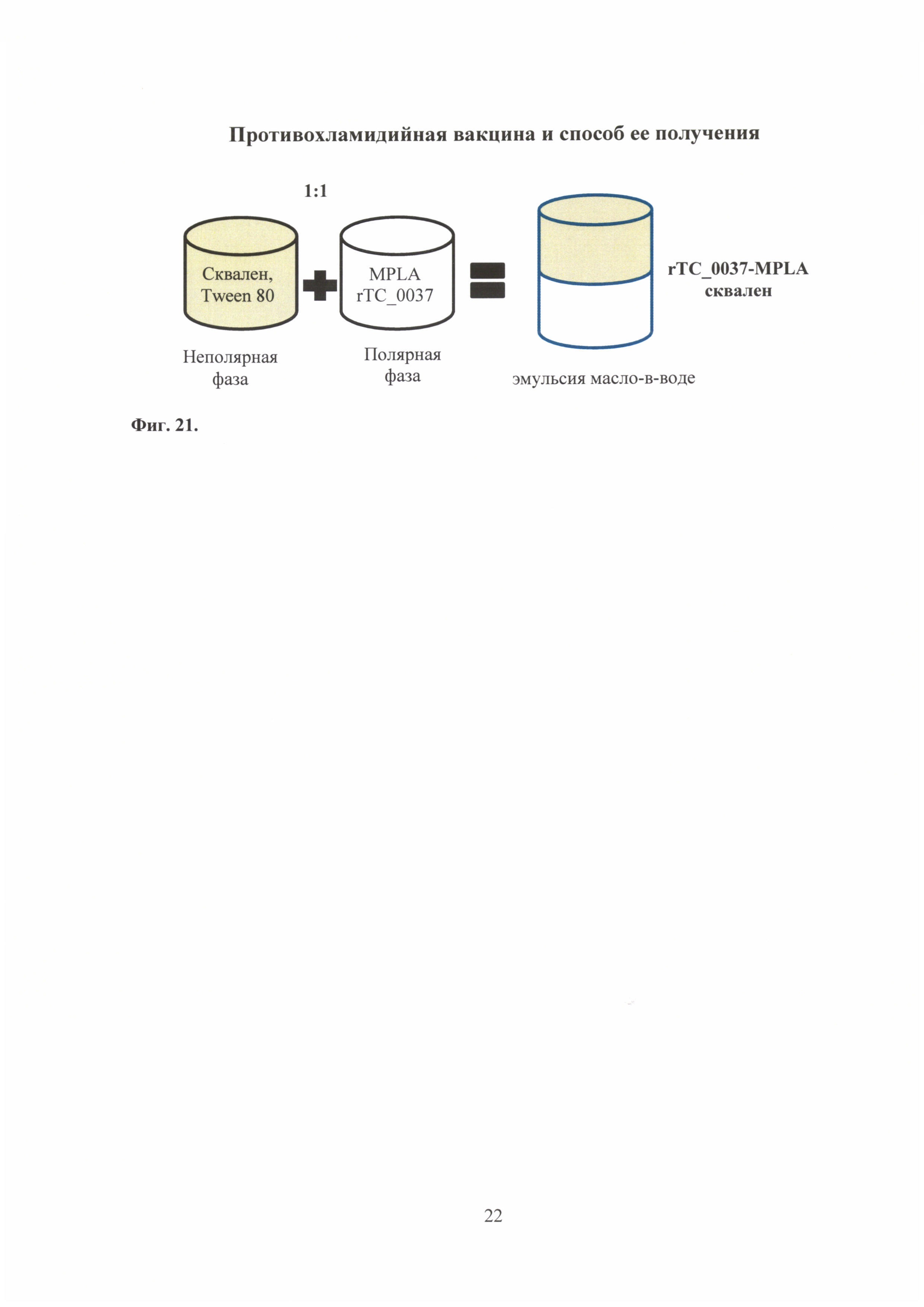
На фиг. 21 представлена схема получения бустирующего компонента rTC_0037-MPLA комбинированной вакцины.
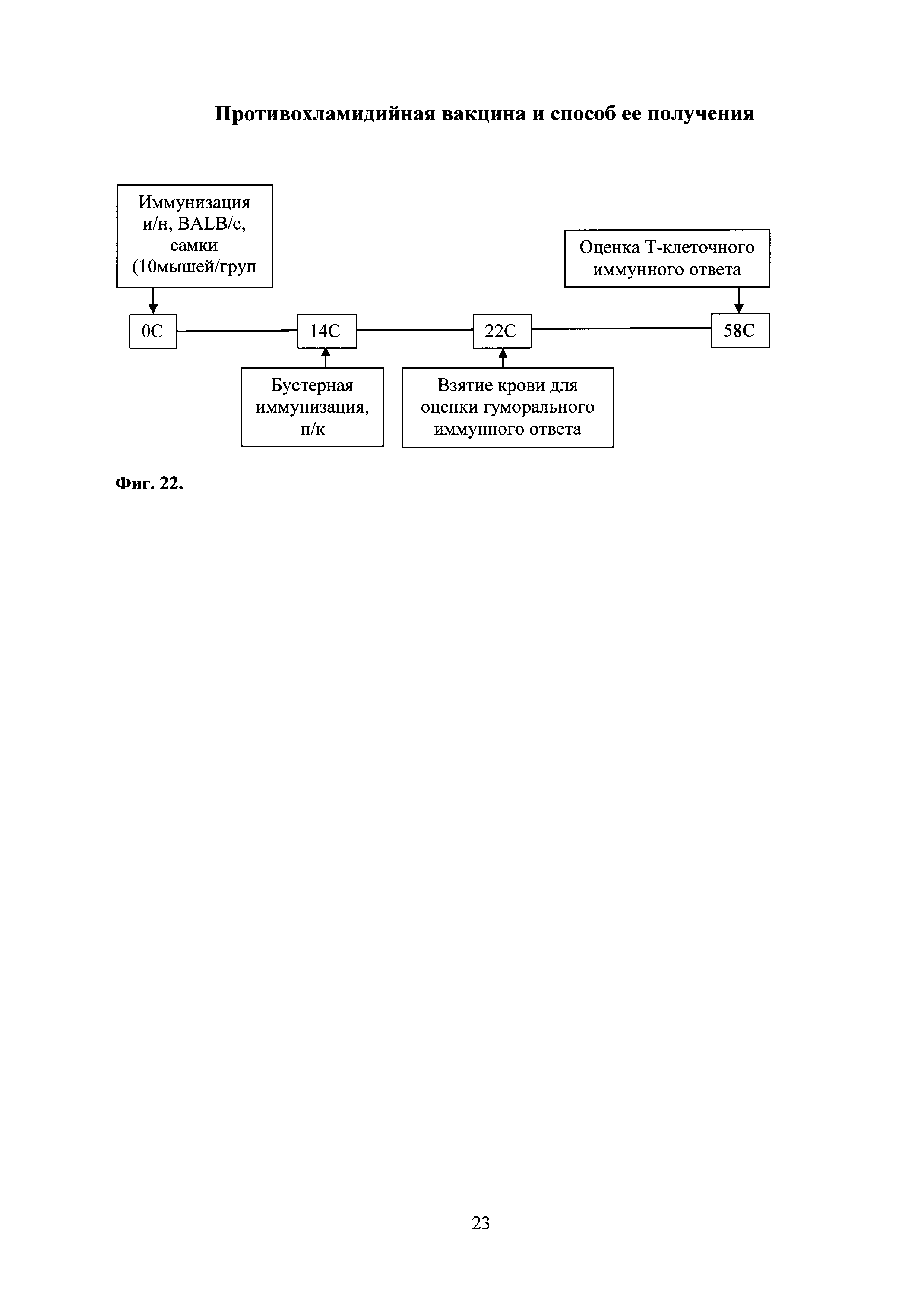
На фиг. 22 представлена схема проведения эксперимента по иммунизации комбинированной вакциной, где
0С (С - сутки) - интраназальная иммунизация праймирующим компонентом Ad-MBL-TC_0037; введение интраназально мышам Ad-null.
14С - подкожная иммунизация бустирующим компонентом rTC_0037-MPLA в составе эмульсии сквалена; введение подкожно MPLA в составе эмульсии сквалена.
28С - оценка гуморального иммунного ответа.
58С - оценка Т-клеточного иммунного ответа.
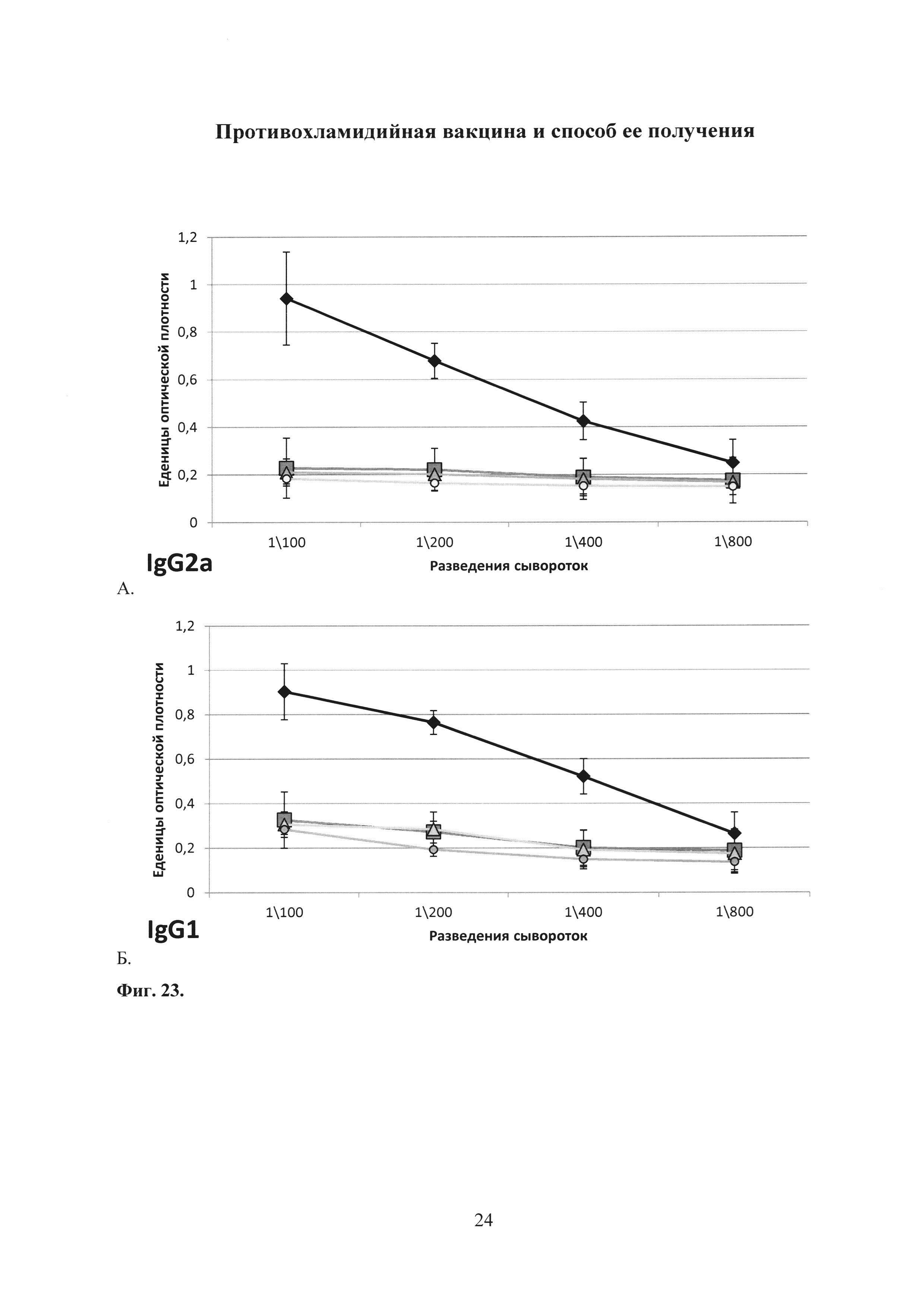
На фиг. 23 показан уровень специфических антител класса IgG к антигену ТС_0037 С.trachomatis MoPn:
23А. изотипа IgG2a;
23Б. изотипа IgG1.
 Ad-MBL-TC_0037 + rTC_0037-MPLA - экспериментальная группа;
Ad-MBL-TC_0037 + rTC_0037-MPLA - экспериментальная группа;
 Ad-null + MPLA - контрольная группа;
Ad-null + MPLA - контрольная группа;
 Ad-null - контрольная группа;
Ad-null - контрольная группа;
 ФПБ - контрольная группа.
ФПБ - контрольная группа.
На фиг. 24 представлена схема эксперимента по изучению индукции Т-клеточного иммунного ответа у мышей.
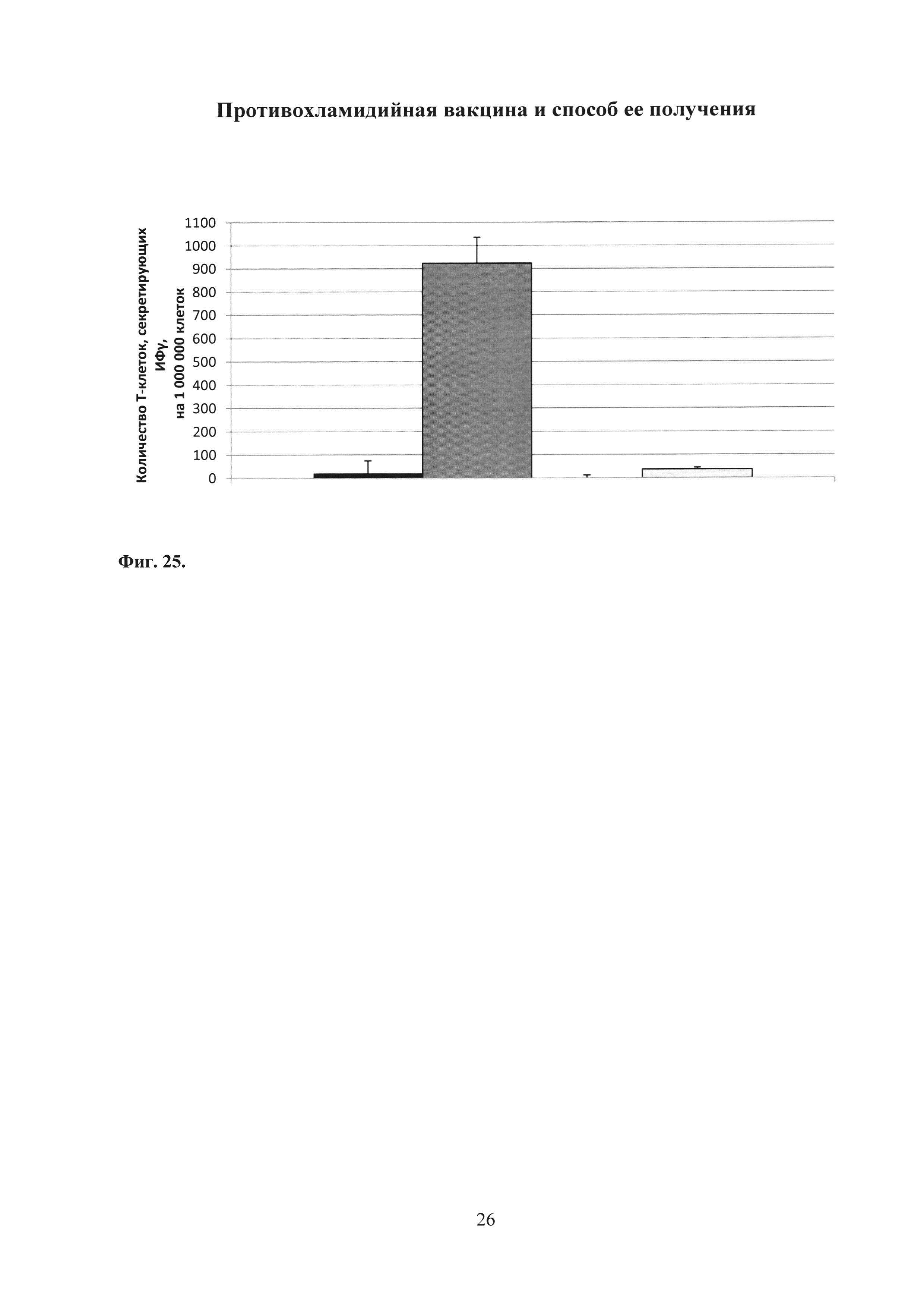
На фиг. 25 показано количество Т-клеток, отвечающих секрецией ИФγ, в ответ на антиген ТС_0037 С. trachomatis MoPn в нижних отделах урогенитального тракта после заражения С. trachomatis MoPn.
Группы:
 получивших ФПБ;
получивших ФПБ;
 иммунизированных Ad-MBL-TC_0037+rTC_0037-MPLА;
иммунизированных Ad-MBL-TC_0037+rTC_0037-MPLА;
 получивших Ad-null+MPLA;
получивших Ad-null+MPLA;
 получивших Ad-null.
получивших Ad-null.
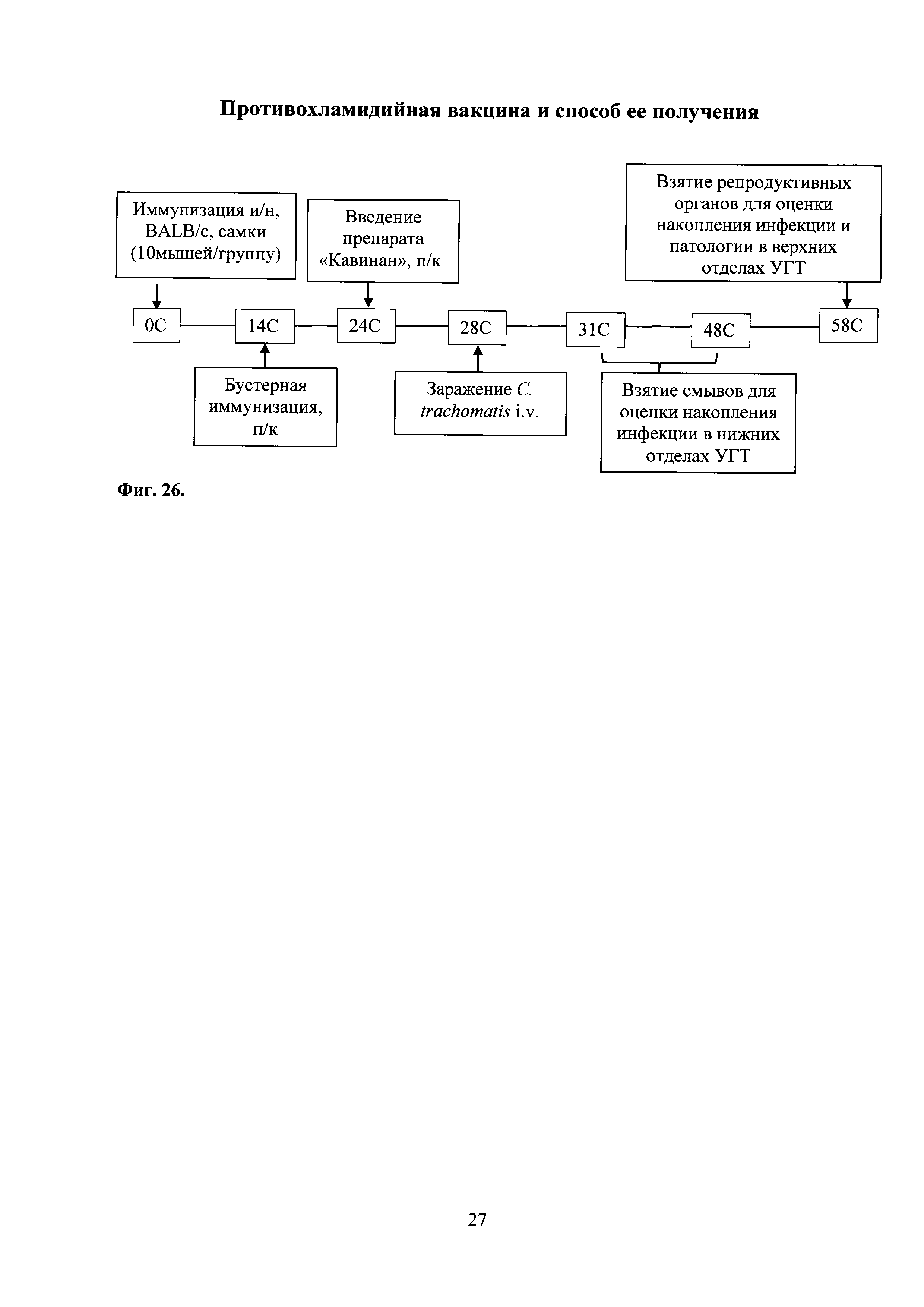
На фиг. 26 представлена схема эксперимента по изучению протективной активности комбинированной вакцины, в которой:
0С - интраназальная иммунизация праймирующим компонентом Ad-MBL-TC_0037; введение интраназально мышам Ad-null.
14С - подкожная иммунизация бустирующим компонентом rTC_0037-MPLA в составе эмульсии сквалена; введение подкожно MPLA в составе эмульсии сквалена.
24С - синхронизация полового цикла мышей аналогом прогестерона - препаратом «Кавинан».
28С - оценка Т-клеточного иммунного ответа.
31С-48С - взятие вагинальных смывов.
58С - оценка накопления хламидий в репродуктивных органах, изучение патологии репродуктивных органов.
Ad-MBL-TC_0037+rTC_0037-MPLA - экспериментальная группа;
Ad-null+MPLA - контрольная группа;
Ad-null - контрольная группа;
ФПБ - контрольная группа.
С. trachomatis MoPn - контроль инфекции.
УГТ - урогенитальный тракт.
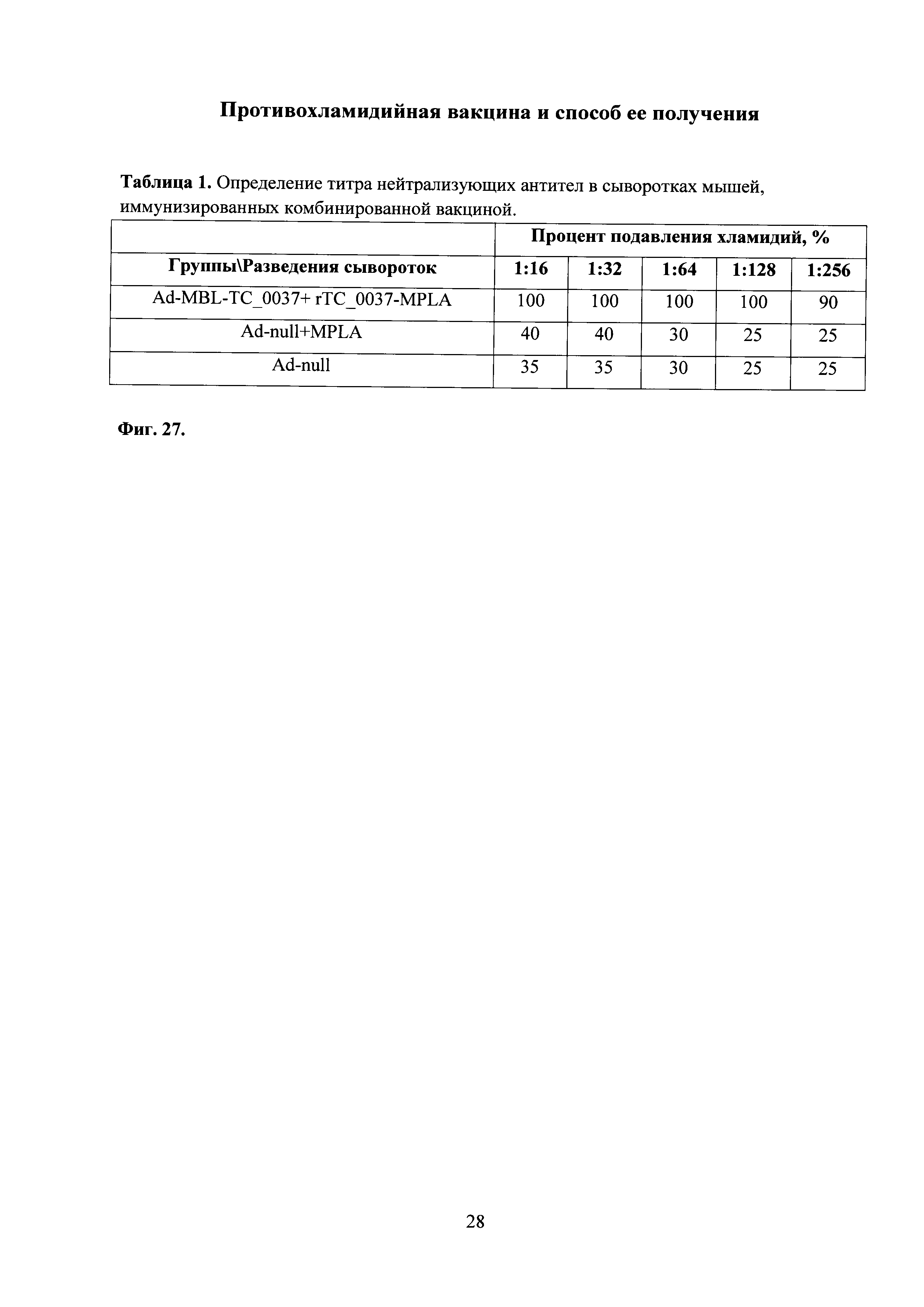
На фиг. 27 приведена таблица с показаниями нейтрализующей активности антител, полученных из сывороток крови мышей, иммунизированных комбинированной вакциной, в культуре клеток, зараженных С. trachomatis MoPn, где
Ad-MBL-TC_0037 - интраназальная иммунизация мышей праймирующим компонентом Ad-MBL-TC_0037;
Ad-null-введение однократно интраназально мышам Ad-null (отрицательный контроль);
rTC_0037-MPLA - подкожная иммунизация мышей бустирующим компонентом rTC_0037-MPLA в составе эмульсии сквалена;
MPLA - введение подкожно MPLA в эмульсии сквалена.
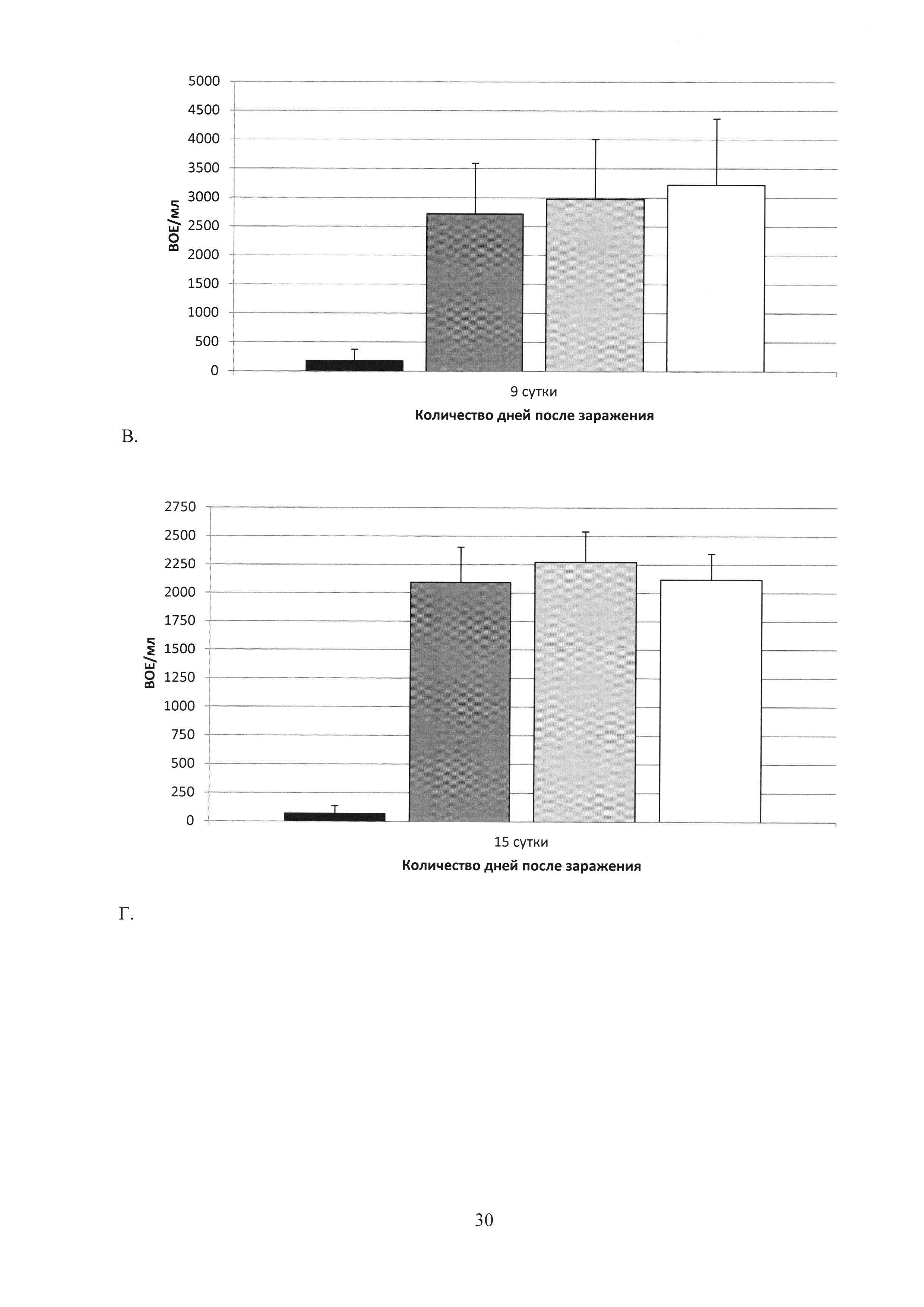
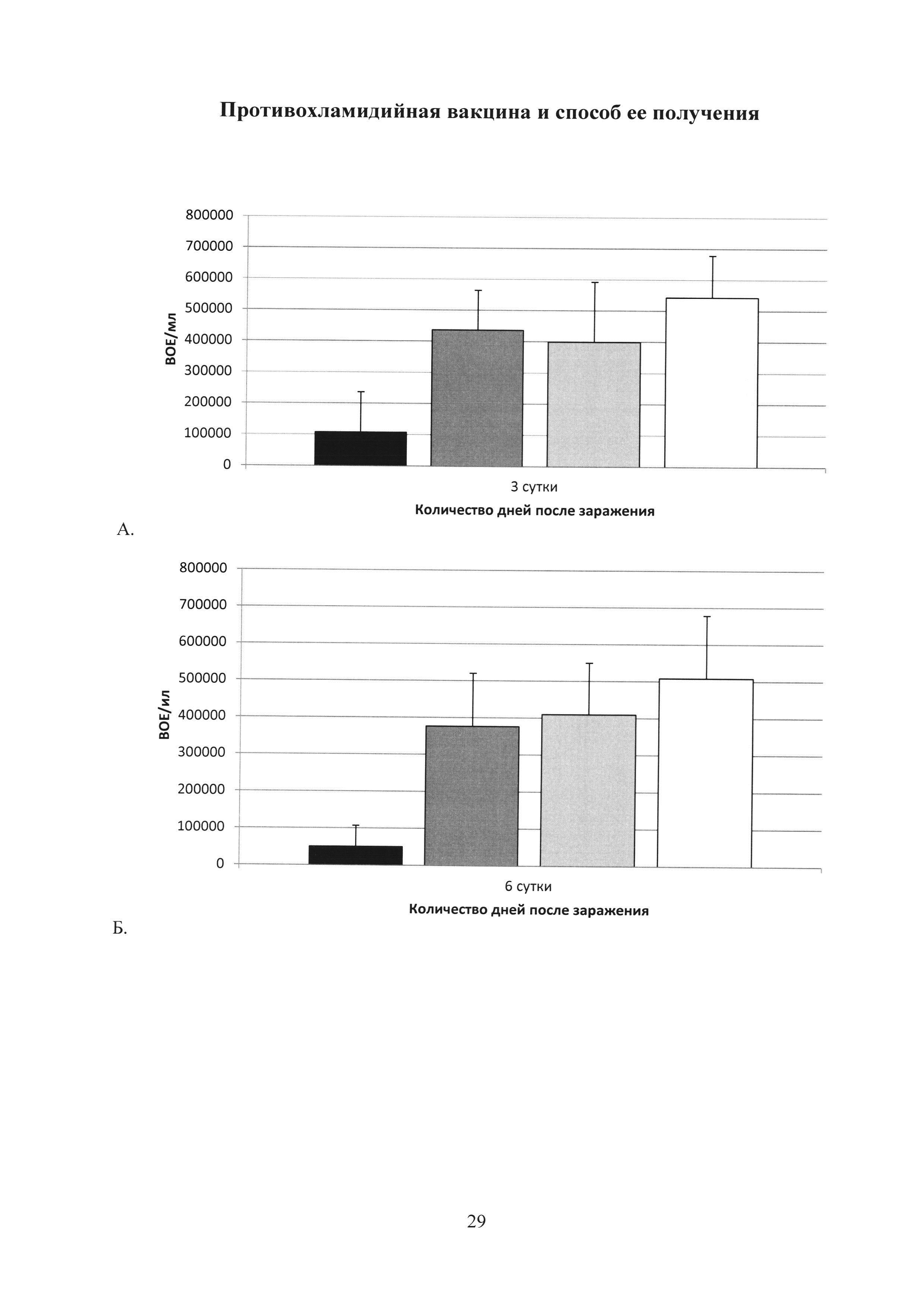
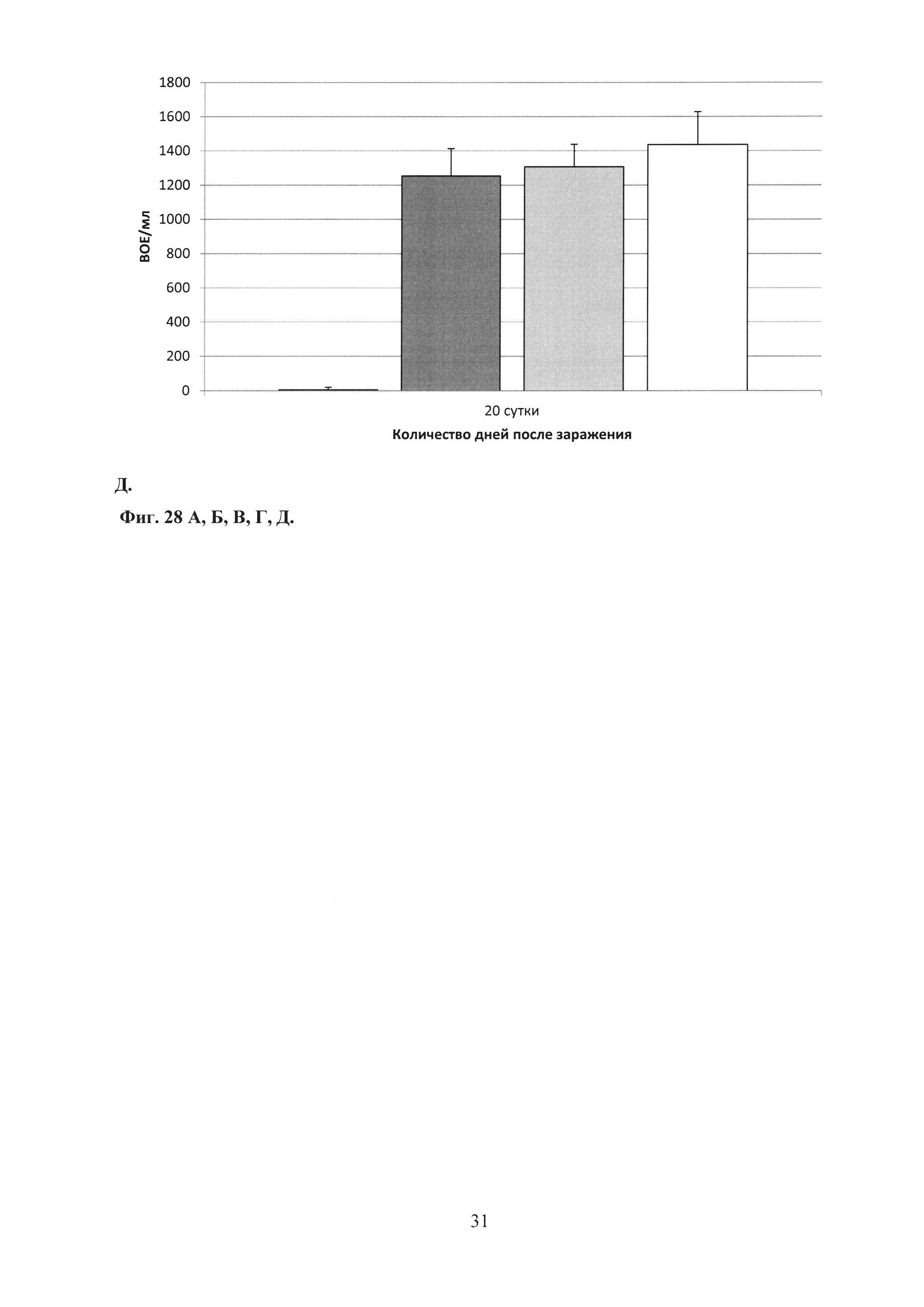
На фиг. 28 (А, Б, В, Г, Д) показаны графики подавление хламидийной инфекции в нижних отделах урогенитального тракта после заражения С. trachomatis MoPn: А. на 3 сутки; Б. на 6 сутки; В. на 9 сутки; Г. на 15 сутки; Д. на 20 сутки.
Ad-MBL-TC_0037 - однократная интраназальная иммунизация мышей праймирующим компонентом Ad-MBL-TC_0037;
Ad-null - введение однократно интраназально мышам Ad-null (отрицательный контроль);
rTC_0037-MPLA - подкожная иммунизация мышей бустирующим компонентом rTC_0037-MPLA в составе эмульсии сквалена;
MPLA - введение подкожно MPLA в эмульсии сквалена;
С. trachomatis MoPn - интравагинальное заражение мышей С. trachomatis MoPn.
 Ad-MBL-TC_0037/rTC_0037-MPLA;
Ad-MBL-TC_0037/rTC_0037-MPLA;
 Ad-null/MPLA;
Ad-null/MPLA;
 Ad-null;
Ad-null;
 С. trachomatis.
С. trachomatis.
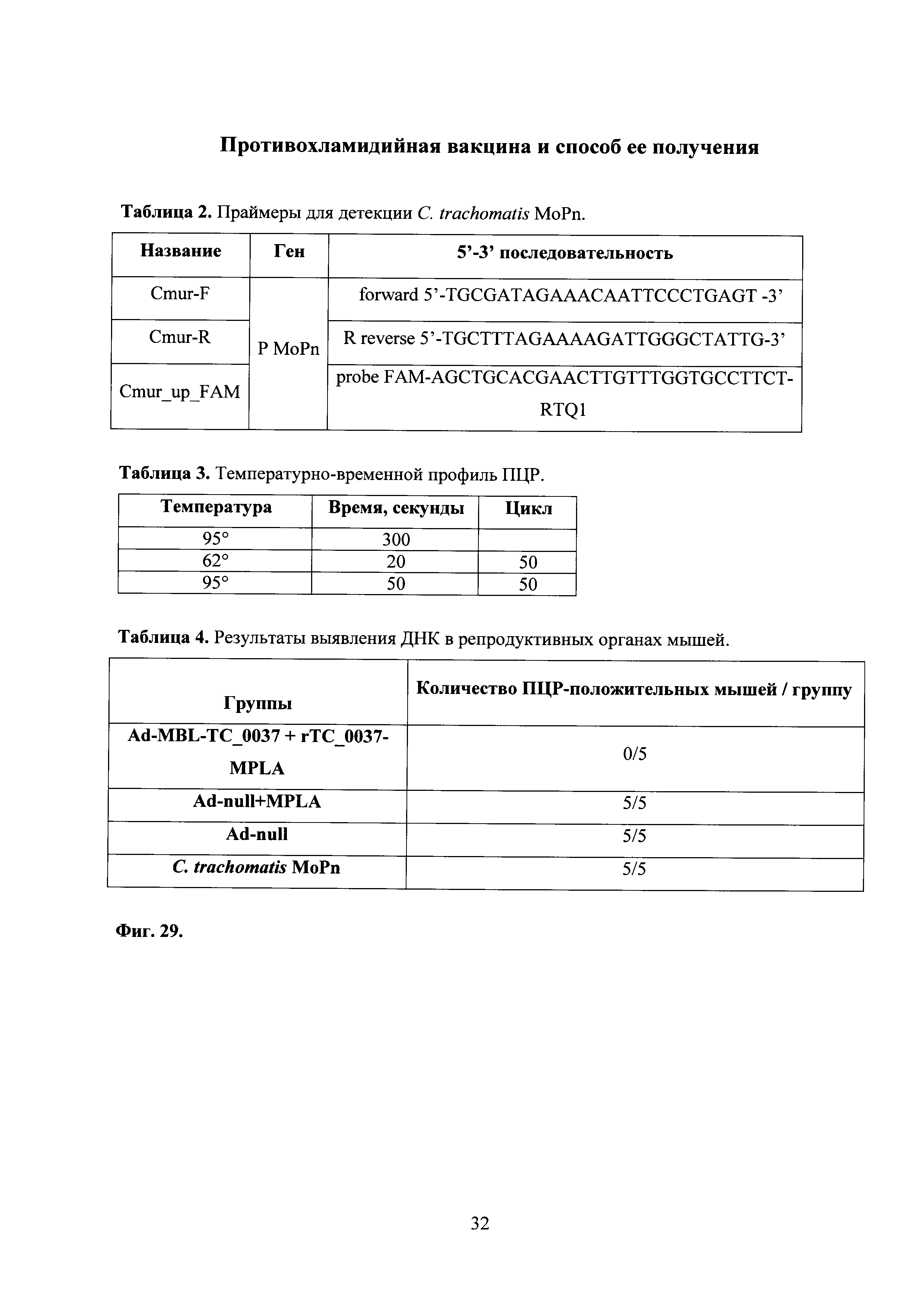
На фиг. 29 представлены таблицы, где показано определение ДНК С. trachomatis MoPn в репродуктивных органах, где:
Ad-MBL-TC_0037 - однократная интраназальная иммунизация мышей праймирующим компонентом Ad-MBL-TC_0037, где
Ad-null - введение однократно интраназально мышам Ad-null (отрицательный контроль);
rTC_0037-MPLA - подкожная иммунизация мышей бустирующим компонентом rTC_0037-MPLA в составе эмульсии сквалена;
MPLA - введение подкожно MPLA в эмульсии сквалена;
С. trachomatis MoPn - интравагинальное заражение мышей С. trachomatis MoPn.
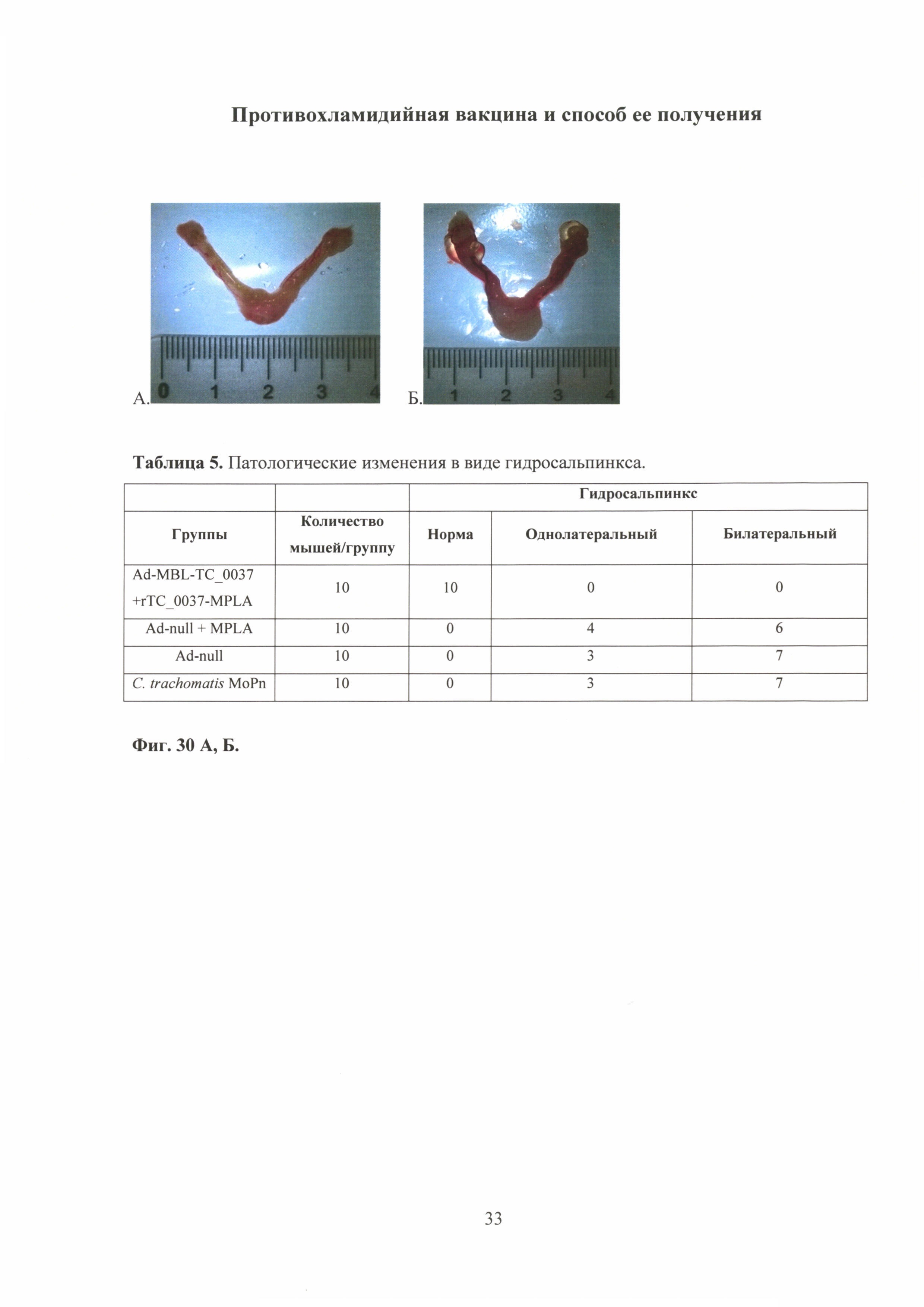
На фиг. 30 (А, Б) представлены фотографии матки и яичников мышей, на которых показаны в сравнении патологические изменения в репродуктивных органах после заражения С. trachomatis MoPn у контрольной группы и отсутствие патологии у иммунизированной группы:
30А. Отсутствие патологических изменений.
30Б. Патологические изменения.
Ad-MBL-TC_0037+rTC_0037-MPLA - экспериментальная группа;
Ad-null+MPLA - контрольная группа;
Ad-null - контрольная группа;
ФПБ - контрольная группа.
С. trachomatis MoPn - контроль инфекции.
Примеры осуществления заявленного изобретения
Следующие примеры приведены ниже для сведения и для более подробной иллюстрации настоящего изобретения и не ограничивают объем изобретения.
Пример 1. Сравнения последовательностей белка CdsF.
Пример 2. Способ получения рекомбинантного белка CdsF хламидий.
Пример 3. Иммуногенные свойства рекомбинантного белка rCdsF хламидий.
Пример 4. Создание праймирующего компонента предлагаемой вакцины.
Пример 5. Способ получения бустирующего компонента предлагаемой вакцины.
Пример 6. Иммунизация мышей комбинированной вакциной.
Пример 7. Гуморальный иммунный ответ на комбинированную вакцину.
Пример 8. Т-клеточный иммунный ответ на комбинированную вакцину.
Пример 9. Протективная активность полученной комбинированной вакцины.
Пример 1. Сравнение последовательностей белка CdsF.
В нашем изобретении структурный белок CdsF ССТТ С. trachomatis MoPn был предложен в качестве главного компонента кандидатной вакцины. Он концентрируется на внешней мембране элементарных телец (ЭТ) и ретикулярных телец (РТ) и формирует поверхностную структуру, обозначаемую как «игла» (фиг. 1. А), которая имеет размеры около 60-80 нм в длину и 8 нм в диаметре. Диаметр отверстия в игле примерно равен 3 нм.
Белок CdsF экспрессирован на мембране хламидий и играет важную роль в развитии инфекции на всех стадиях ее жизненного цикла. Кроме этого, хламидийный белок «иглы» CdsF ССТТ содержит остатки цистеина, которые являются уникальными для него, а дисульфидные связи, обнаруженные у CdsF, могут участвовать в функционировании секреторного аппарата хламидий. Так же они связаны со степенью окисления оболочки хламидий и стадиями развития патогена.
Для оценки возможности использования белка CdsF в качестве целевого белка (антигена) для создания вакцинного препарата, эффективного в отношении всех серотипов С. trachomatis, мы проанализировали наличие в составе аминокислотной последовательности В- и Т- клеточных эпитопов, а также их основных характеристик с помощью доступных биоинформационных баз данных (http://tools.iedb.org/bcell/; http://www.cbs.dtu.dk/services/BepiPred/; http://www.cbs.dtu.dk/services/NetMHC/; http://www.cbs.dtu.dk/services/NetMHCII;). Аминокислотные последовательности были получены из филогенетической базы данных ОМА (http://omabrowser.org), (ОМА Group 877704). Выравнивания показаны на фиг. 1. Б (Примечание: аминокислотные последовательности были получены из филогенетической базы данных ОМА (http://omabrowser.org), (ОМА Group 877704)).
Было установлено, что и В-клеточные эпитопы и Т-клеточные эпитопы для молекул гистосовместимости I и II класса, как у человека, так и у мышей, располагались в высококонсервативных областях антигена CdsF, что говорит о перспективности данного белка для использования в качестве целевого антигена кандидатного вакцинного препарата для человека (фиг. 1Б, 2).
Эпитопное картирование показало, что в антигене CdsF присутствуют как В-клеточные, так и Т-клеточные эпитопы для CD8+ и CD4+ Т-лимфоцитов. Далее, чтобы доказать их консервативность в других штаммах хламидий, были взяты все известные сиквенсы белка CdsF ССТТ, и выровнены между собой для максимального соответствия в пределах заданной области (фиг. 1Б). Представленные на фиг. 1Б аминокислотные последовательности белка CdsF разных серотипов и видов хламидий являются «по существу идентичными» (имеют более 85%-ую гомологию).
Мы подтвердили данные, полученные с помощью биоинформационных методов, о наличии консервативных B-клеточных эпитопов в антигене CdsF, экспериментально. Показано присутствие антител к белку CdsF в сыворотках пациентов, больных хламидийной инфекцией. Эти данные говорят о перспективности консервативного белка CdsF для использования в качестве целевого антигена кандидатного вакцинного препарата для разных серотипов, т.к. он имеет высокую степень идентичности последовательности среди различных сероваров Chlamydia trachomatis.
Выбранный белок CdsF является основным компонентом вакцинного препарата, эффективного в отношении всех серотипов С. trachomatis, благодаря своей важной роли в функционировании ССТТ хламидий, обеспечивающей патогенность возбудителя как при остром, так и хроническом течении инфекции, консервативности его B- и T-клеточных эпитопов и выявленной нами иммуногенности данного белка для человека. Так между антигенами разных серотипов Chlamydia можно видеть перекрестную реактивность, и, следовательно, предположить, что данный консервативный хламидийный антиген ССТТ смогут обеспечить защитный иммунный ответ против серовара отличного от того, из которого был получен антиген.
Пример 2. Способ получения рекомбинантного белка CdsF.
Т.к. необходимо было показать, что предлагаемая вакцина обеспечивает защиту против хламидийной инфекции in vivo, была разработана модель острой и хронической урогенитальной инфекции у мышей. Для этой цели была также, как вариант, создана вакцина на основе использования белков Chlamydia trachomatis MoPn
Для моделирования инфекционного процесса у мышей был выбран серотип С. trachomatis MoPn, который является естественным мышиным патогеном. Данная модель урогенитальной хламидийной инфекции, имитирует многие аспекты урогенитальной инфекции у женщин, вызванной человеческими штаммами С. trachomatis. При урогенитальной инфекции, вызванной С. trachomatis MoPn у мышей в течение нескольких недель развивается инфекция в нижних отделах урогенитального тракта, которая затем переходит в восходящую, приводя к развитию патологии репродуктивных органов и бесплодию, аналогично как при урогенитальной хламидийной инфекции у женщин.
Предлагаемый способ получения рекомбинантного структурного белка CdsF будет показан па примере создания структурного белка ССТТ С. trachomatis MoPn, а именно: rTC_0037 (Фиг. 3, 4).
С этой целью ген, кодирующий полноразмерный белок ТС_0037, содержащий метку из шести гистидипов (6*His) (фиг. 11, 12), был клонирован в плазмидный вектор pET29b (Novagen, США) по Ndel/Xhol сайтам рестрикции. Полученной плазмидой трансформировали клетки E.coli штамма B1,21 (DE3), после чего индуцировали экспрессию добавлением 1 M изопропил-β-D-1-тиогалактопирапозида (ИПТГ) (Фиг. 13, 14). Для очистки rTC_0037 выделенного из клеток E.coli использовали тотальный лизат бактерий, приготовленный с использованием 8М мочевины, Очистку проводили с помощью Со2+ аффинного сорбента в денатурирующих условиях. Экспрессию белка определяли методом вестерн-блота с применением моноклональных антител к метке, состоящей из шести гистидинов. В результате был детектирован специфический фрагмент размером ~13 кДа, соответствующий расчетной молекулярной массе белка rTC_0037, слитого с 6 гистидиновыми молекулами, равной 10134.51 Да. Был получен рекомбинантный белок rTC_0037 в концентрации 200 мг/мл в 50 мМ натрий-фосфатном буфере, pH 6,0 с 4 М мочевиной.
Предлагаемый способ получения рекомбинантного белка CdsF на примере С.trachomatis MoPn универсален и идентичен для разных серотипов Chlamydia trachomatis.
Пример 3. Иммуногенные свойства рекомбинантного белка rCdsF.
Исследования иммуногенных свойств rCdsF ССТТ приведены на варианте белка С. trachomatis MoPn - rTC_0037.
Для оценки иммунногенных свойств белка rTC_0037 С. trachomatis MoPn:
1) определяли специфические антитела к рекомбинантному белку rTC_0037;
2) проводили анализ специфической лимфопролиферации;
3) проводили исследования по адоптивному переносу Т-клеток.
1) Определение специфических антител к рекомбинантному белку rTC_0037 С. trachomatis MoPn
Специфические антитела к рекомбинантному белку rTC_0037 С. trachomatis MoPn определяли методом непрямого иммуноферментного анализа (ИФА). (Фиг. 15А, Б, В)
А. Определение специфических антител к белку ТС_0037 в сыворотке кролика, иммунизированного белком rTC_0037.
Для этих целей использовали сыворотку, полученную при иммунизации кролика рекомбинантным белком rTC_0037 в сочетании с адъювантом Фрейнда, в дозе 2,612 мг/кролик. Иммунизацию кролика проводили 4 раза. Первая иммунизация: белком rTC_0037 с полным адъювантом Фрейнда (1:1) - в количестве 500 мкг, вторая иммунизация: белком rTC_0037 с неполным адъювантом Фрейнда (1:1) - в количестве 600,0 мкг (через 4-и недели после первой); третья иммунизация: белком rTC_0037 в количестве 720,0 мкг (через две недели после второй) и четвертую иммунизацию проводили через неделю после третьей в количестве 792,0 мкг. Забор крови проводили через 14 суток после последней иммунизации. В качестве отрицательного контроля использовали сыворотку, полученную от интактного кролика.
ИФА проводили общепринятым методом. В качестве антигена применяли белок rTC_0037. Полученную сыворотку от иммунизированного кролика разводили 1:500. Для определения специфических антител класса IgG в качестве конъюгата использовали козьи моноклональные антикроличьи антитела класса IgG («Sigma-Aldrich», США) в разведении 1:1000, меченные пероксидазой хрена,в качестве субстрата - тетраметилбензидин (ТМБ) («Biolegend», США). Учет реакции проводили при длине волны 450 нм.
При исследовании были выявлены специфические антитела класса IgG к белку rTC_0037 в разведении 1:500, что более чем в 6 раз выше, чем в сыворотке крови от интактного кролика контрольной группы (отрицательный контроль), что указывает на высокую иммуногенность данного белка (фиг. 15А).
Б. Определение специфических антител к белку rTC_0037 в сыворотке кролика, иммунизированного человеческим инактивированным штаммом С. trachomatis L2/Bu434 (далее - L2).
Для этих целей использовали сыворотку, полученную при иммунизации кролика C. trachomatis L2 в дозе 107 ВОЕ/кролик. Иммунизацию кролика проводили трижды с интервалом в 2 недели: первую - С. trachomatis L2 с ПАФ (1:1) - в количестве 500,0 мкг, вторую и третью - С. trachomatis L2 с НАФ (1:1) - в количестве 500,0 мкг. Забор крови производили через 14 суток после последней иммунизации. Из крови была получена гипериммунная кроличья сыворотка к С. trachomatis L2 с титром в ИФА 1:2000 к полному комплексу антигенов С. trachomatis L2. В качестве отрицательного контроля была получена сыворотка от интактного кролика.
ИФА проводили общепринятым методом. В качестве антигена использовали белок rTC_0037. Сыворотку разводили 1:32, 1:64 и 1:128. Для определения специфических антител класса IgG в качестве конъюгата применяли козьи моноклональные антикроличьи антитела класса IgG («Sigma-Aldrich», США) в разведении 1:1000, меченные пероксидазой хрена. В качестве субстрата использовали тетраметилбензидин (ТМБ) («Biolegend», США). Учет реакции проводили при длине волны 450 нм.
При исследовании в сыворотке, полученной при иммунизации кролика человеческим инактивированным штаммом С. trachomatis L2, выявлены антитела в разведении более чем 1:128, специфически связывающиеся с rTC_0037 ССТТ С. trachomatis MoPn. Это еще раз подтверждает консервативность структурного белка CdsF среди разных серотипов Chlamydia trachomatis (фиг. 15Б).
В. Определение специфических антител к белку ТС_0037 в сыворотке крови человека больного хламидиозом, вызванного С. trachomatis.
Для этих целей использовали сыворотку крови человека, больного хламидиозом, в разведении 1:32, 1:64 и 1:128. ИФА проводили общепринятым методом. В качестве отрицательного контроля использовали сыворотку человека, не имеющего хламидийной инфекций. Для определения специфических антител класса IgG в качестве конъюгата использовали козьи моноклональные античеловеческие антитела класса IgG («Sigma-Aldrich», США) в разведении 1:1000, меченные пероксидазой хрена. В качестве субстрата применяли тетраметилбензидин (ТМБ) («Biolegend», США). Учет реакции проводили при длине волны 450 нм.
Обнаружено, что в сыворотке, полученной от больного хламидиозом, присутствуют антитела в разведении более чем 1:128, специфически связывающиеся с rTC_0037 С. trachomatis MoPn (фиг. 15В).
Взаимодействие данного антигена с антителами сыворотки крови больного хламидиозом, еще раз подтверждает консервативность белка CdsF в отношении разных серотипов хламидий.
2) Анализ специфической лимфопролиферации в ответ на антиген rTC_0037 С. trachomatis MoPn
Для оценки иммунногенности белка rCdsF на примере rTC_0037 исследовали антиген-специфическую пролиферацию в ответ на рекомбинантный белок rTC_0037 спленоцитов, выделенных из селезенок мышей линии BALB/c (4 мышей/группу), предварительно иммунизированных подкожно: rTC_0037 в концентрации 10 мкг/мл с полным адъювантом Фрейнда (ПАФ) (в соотношении 1:1) в объеме 100,0 мкл или убитой нагреванием (60 минут при 60°C) С. trachomatis MoPn в дозе 104 ВОЕ/100 мкл в ПАФ (1:1). Контролем служили неиммунизированные интактные мыши.
Полученные спленоциты доводили до концентрации 2,5×106/мл в культуральной среде (RPMI-1640, 5% FBS) и инкубировали в 200,0 мкл в присутствии 10,0 мкг белка rTC_0037. В качестве контроля использовали клетки, не стимулированные rTC_0037. Через 36 часов в культуру вносили 0,5 мкН3-тимидина и инкубировали в течение 12 часов. Для анализа количества связавшейся с ДНК радиоактивной метки использовали сцинтилляционный жидкостный счетчик (Wallac Laboratory, Turku, Finland). Результаты представлены в импульсах в минуту. (Фиг. 16).
Было показано, что спленоциты мышей, иммунизированных рекомбинантным белком rTC_0037 и С. trachomatis MoPn, пролиферировали в ответ на рекомбинантный белок rTC_0037, что свидетельствует об иммунногенности этого белка для Т-клеток. Клетки, полученные от интактных мышей, не пролиферировали в ответ на антиген rTC_0037.
3) Адоптивный перенос Т-клеток от мышей, иммунизированных белком rTC_0037.
Схема эксперимента по адоптивному переносу Т-клеток, иммунизированных белком rTC_0037 C. trachomatis MoPn представлена на фиг. 17.
Для проведения эксперимента по адоптивному переносу использовали мышей линии BALB/c (5 мышей/группу), которых иммунизировали подкожно рекомбинантным белком rTC_0037 в концентрации 10,0 мкг/мышь с полным адъювантом Фрейнда (ПАФ) - 500,0 мкл/мышь (в соотношении 1:1). Через 14 сут. мышей бустировали внутривенно дендридными клетками (ДК), нагруженными антигеном rTC_0037. Через неделю после бустирования были выделены клетки из регионарных лимфатических узлов и селезенки от иммунизированных мышей. Выделенные клетки инкубировали в 24-х луночном планшете в концентрации 4×106/мл в присутствие антигена rTC_0037 (10 мкг/мл). Через 7 сут. выделяли Т-клетки согласно протоколу производителя (Cedarlane, Канада).
Полученные Т-клеточные линии использовали для адоптивного переноса с целью определения их протективного потенциала in vivo. После переноса Т-клеток мышам-реципиентам (вводили внутривенно) (5 мышей/группу), на следующий день их заражали интравагинально С. trachomatis MoPn 106 ВОЕ/мл. Контролем служили интактные мыши.
Подавление инфекции в нижних отделах урогенитального тракта оценивали методом культурального анализа. Культуральное выделение С. trachomatis MoPn проводили на линии клеток McCoy по стандартной методике [35]. Для этого у мышей (5 мышей/группу) брали вагинальные смывы и помещали в 500,0 мкл среды RPMI, содержащей 5% фетальную сыворотку, глюкозу, амфотерицин B, гентамицин. Заражение клеточной линии McCoy полученным материалом проводили в 24 луночном планшете. После заражения планшет центрифугировали на 2000 об/мин при t=+25°C в течение 1 часа. После инкубации в термостате (37°C, 5% CO2) в течение 2 часов удаляли среду и добавляли 1,0 мл среды с циклогексимидом. Планшет инкубировали при 37°C, 5% CO2 в течение 48 часов. Затем клетки фиксировали и окрашивали специфическими к хламидийному ЛПС (липополисахарид) моноклональными антителами, меченными ФИТЦ. Идентификацию и количественную оценку содержания хламидий в инфицированных культурах осуществляли методом иммунофлюоресцентной микроскопии. Для подсчета хламидийных включений образующих единиц (ВОЕ) использовали стандартную формулу [35].
При культуральном исследовании вагинальных смывов из нижних отделов урогенитального тракта выявлено снижение уровня хламидийной инфекции в группе с переносом Т-клеток, полученных от мышей, иммунизированных белком rTC_0037, по сравнению с контролем - мышами, зараженными С. trachomatis MoPn (фиг. 18).
Таким образом, на модели острой урогенитальной инфекции показано, что иммунизация рекомбинантным белком rTC_0037 способствует образованию Т-клеток памяти. Перенос этих клеток интактным реципиентам защищает их при последующем заражении С. trachomatis MoPn (фиг. 18).
Пример 4. Создание праймирующего компонента предлагаемой вакцины
Создание аденовирусной генетической конструкции, являющейся праймирующим компонентом вакцины, проводили на примере белка - ТС_0037 С. trachomatis MoPn. Технология получения праймирующего компонента вакцины представлена на фиг. 19А, Б, В.
Нуклеотидная последовательность гена полноразмерного белка ТС_0037 С. trachomatis MoPn получена из базы данных UniProtKB (Q9PLQ8). Был проведен in silico анализ гена tc_0037 на наличие в нем бактериальной сигнальной последовательности (http://www.cbs.dtu.dk/services/SignalP/), которой не было обнаружено в белке. Кодоны, кодирующие ген tc_0037, были модифицированы для лучшей экспрессии в клетках Mus musculus. Наиболее часто встречающиеся кодоны Chlamydia trachomatis MoPn и Mus musculus определены согласно базе данных используемых кодонов http://www.kazusa.or.jp/codon/. Поскольку, во-первых, антиген ТС_0037 находится в высокой плотности на поверхности бактериальных клеток, а во-вторых, антиген небольшой по своим размерам (82 аминокислоты, 9 кДа), было решено к N-концевой части антигена добавить N-концевую часть маннозо-связывающего лектина (MBL) Mus musculus. MBL способен гексамеризовать антиген за счет коллагенподобного домена. Нуклеотидная последовательность гена MBL была получена из базы данных UniProtKB (Р41317). Между последовательностями антигена ТС_0037 и MBL был поставлен гибкий глицин-сериновый спейсер. Модифицированный ген MBL-ТС_0037 был синтезирован, и далее была получена плазмида pAL-TA-MBL-ТС_0037 для Chlamydia trachomatis MoPn (фиг. 19А). Таким же способом была создана конструкция pAL-TA-MBL-CT666 для Chlamydia trachomatis
Затем ген MBL-TC_0037 был субклонирован в челночный вектор pShuttle-CMV, который в дальнейшем использовали для получения плазмидных конструкций рекомбинантных аденовирусов методом гомологичной рекомбинации в клетках Escherichia coli, с использованием системы AdEasy Adenovir Vector System (Stratagene, CШA). Рекомбинантные аденовирусы, сконструированные на основе генома аденовируса человека 5-го серотипа, получали в результате трансфекции клеток линии НЕK293 соответствующей плазмидной конструкцией, гидролизованной рестриктазой PacI. В результате гидролиза вырезали фрагмент, содержащий сайт инициации репликации Ori и ген резистентности к антибиотику ампицилину, с образованием линейной структуры, состоящей из полноразмерного генома аденовируса и экспрессирующей кассеты. Трансфекцию проводили реагентом Lipofectamin (Invitrogen, США) согласно прилагаемому руководству в 24-луночном планшете на клетках линии НЕК293 с 90%-ной конфлюэнтностью. Через десять сут. после трансфекции наблюдали цитопатическое действие (ЦПД) вируса. (Фиг. 19Б). Полученные вирусные образцы, в виде суспензии зараженных клеток с титром БОЕ/мл 108, хранили при температуре минус 70°C.
Экспрессию белка MBL-TC_0037 определяли методом вестерн-блота с использованием гипериммунной мышиной сыворотки. Для этого клетки линии НЕK293 были трансдуцированы Ad-MBL-TC_0037, через 48 часов была отобрана культуральная среда и сконцентрирована в 10 раз. В результате в были детектированы специфические фрагменты, ~24 кДа, соответствующие расчетной молекулярной массе, равной 23742.76 Да (фиг. 20).
Аналогично была создана конструкция Ad-MBL-CT666 на основе рекомбинантного аденовируса несущего ген белка CdsF ССТТ С. trachomatis, что говорит о соответствии данной конструкции заявляемым по изобретению требованиям.
В противохламидийной комбинированной вакцине, в праймирующем иммунный ответ компоненте, состоящим из рекомбинантного аденовируса, нуклеотидная последовательность гена, кодирующего оптимизированный полноразмерный структурный белок ТС_0037 С. trachomatis MoPn представлена SEQ ID NO: 1 (фиг. 3). Аминокислотная последовательность оптимизированного полноразмерного структурного белка ТС_0037 С. trachomatis MoPn представлена SEQ ID NO: 4 (фиг. 4). Нуклеотидная последовательность гена, кодирующего глицин-сериновый спейсер, представлена на SEQ ID NO: 2 (фиг. 5) и нуклеотидная последовательность гена белка MBL представлена на SEQ ID NO: 3 (фиг. 6). Кодирующие этими нуклеотидными последовательностями полипептиды представлены на SEQ ID NO: 5 (фиг. 7) и SEQ ID NO: 6 (фиг. 8). Указанные выше нуклеотидные последовательности соединены между собой в следующем порядке: MBL - спейсер - ТС_0037 и образуют единую рамку считывания, обозначенную как MBL - ТС_0037 (фиг. 9). Ген химерного, гипериммуногенного антигена вставлен в экспрессионную кассету рекомбинантного аденовируса под контролем CMV-промотора (фиг. 10).
Получение предлагаемой вакцины проходит в несколько этапов. Разработанная технология должна обеспечивать производство праймирующего компонента вакцины следующего качества:
- доза 106-109 БОЕ/мл рекомбинантных псевдоаденовирусных частиц;
- объем дозы 0,5 мл (доводится фармацевтически приемлемым буферным раствором).
Для этого полученную клеточную суспензию, содержащую рекомбинантные аденовирусные частицы с титром 108 БОЕ/мл, использовали для наращивания с целью приготовления вакцины с заданным содержанием рекомбинантных аденовирусных частиц.
Таким образом, для наработки необходимых титров рекомбинантных аденовирусных частиц волновой биореактор с 4500,0 мл суспензии пермиссивной клеточной культуры 293НЕК засевали клеточной суспензией объемом 500,0 мл, содержащей рекомбинантные аденовирусные частицы с титром 108 БОЕ/мл.
Для наращивания рекомбинантных аденовирусных частиц и достижения титра 2×108 БОЕ/мл, их культивировали в течение 48 часов. Затем, клеточную массу очищали в несколько этапов:
1) Вначале проводили осаждение клеточной массы центрифугированием при режиме 6000 g в течение 15 мин, твердую часть, содержащую клетки и рекомбинантные аденовирусные частицы, подавали на дальнейшую очистку.
2) Извлечение рекомбинантных аденовирусных частиц из клеточной культуры проводили путем разрушения клеток перемораживанием при pH 8.0 (Буферный раствор 5 mM ТрисHCl, 0.075 MNaCl, 1 mM MgCl2, 5% сахароза, 1% полисорбат 80) в жидком азоте.
3) Для дальнейшего удаления геномной клеточной ДНК проводили дополнительную обработку бензоназой (Merk Millipore, Германия) (150,0 ЕД/мл) и ставили на мягкое перемешивание на 3 часа при комнатной температуре (21-23°C).
4) Удаление клеточного дебриса осуществляли центрифугированием при 9000 g, с целью получения супернатанта содержащего рекомбинантные аденовирусные частицы.
5) Полученный супернатант разводили буфером (50 mM TrisHCl pH 7.5, 1 М NaCl, 2 mМ MgCl2, 5% сахароза, pH 7,5) до объема не менее 200 мл и подвергали ультрафильтрации.
6) Далее очистку производили путем анионобменной хроматографии.
Ретентат наносили на колонку (AxiChrom 70/300 объемом 400,0 мл), содержащую анионнообменный сорбент Q Sepharose virus licenced (GE Healthcare, Щвеция). Условия хроматографирования: поток 193,0 мл/мин, буфер A (40,0 mM TrisHCl, 0,27 М NaCl, 2,0 mM MgCl2, 5% Сахароза, 0,1% Полисорбат 80, pH 7.5), проводимость ~28-30 mS/cm; буфер Б (40,0 mM TrisHCl, 0.5 М NaCl, 2,0 mM MgCl2, 5% сахароза, 0,1% полисорбат 80, pH 7.5) проводимость ~50 mS/cm.
7) Эксклюзионная хроматография.
Полученный в предыдущей стадии элюат в объеме 200,0 мл наносили на колонку (AxiChrom 100/300 объемом 800,0 мл), содержащую сорбент Q Sepharose 4 FastFlow (GE Healthcare, Щвеция). Высокомолекулярные вещества, не входящие в поры сорбента, элюировали первым пиком (к ним относятся рекомбинантные аденовирусные частицы), примеси элюировали после выхода пика нереплицирующихся наночастиц. Условия хроматографирования: поток 130,0 мл/мин,буфер (10 mM TrisHCl, 75 мМ NaCl, 1 mM MgCl2, 5% сахароза, 0,05% полисорбат 80, pH 8.0).
Затем элюат стабилизировали при помощи добавления этанола до концентрации 0,5% и этилендиаминтетрауксусной кислоты (ЭДТА) до концентрации 100 мкМ.
8) Нормальная фильтрация.
Для стерилизации полученный препарат фильтровали через систему фильтров с размером пор 0,22 мкМ и разбавляли стерильным фармацевтическим приемлемым буферным раствором, например: 10 mM TrisHCl, 75 mM NaCl, 1 mM MgCl2, 5% сахароза, 0,05% полисорбат 80, 0,5% этанол, 100 мкм ЭДТА, pH 8.0, до получения активного компонента с учетом требуемой конечной активности 108-109 БОЕ рекомбинантных аденовирусных частиц. Полученный объем препарата разливают по флаконам по 0,5 мл одна доза.
Т.о., поставленная задача по приготовлению праймирующего компонента вакцины по изобретению выполнена. Возможно получение праймирующего компонента вакцины, содержащей:
- рекомбинантных аденовирусных частиц, экспрессирующих ген белка CdsF хламидий, - 108-109 БОЕ/мл.
- фармацевтически приемлемый буферный раствор - до 0,5 мл.
Пример 5. Получение бустирующего компонента предлагаемой вакцины.
В данном примере описан способ получения бустирующего компонента вакцины - эмульсии сквалена (масло в воде), содержащей рекомбинантный белок ССТТ хламидий - rTC_0037 С. trachomatis MoPn и монофосфорил липид A (MPLA) (фиг. 21).
Для получения одной терапевтической дозы бустирующего компонента необходимо приготовить полярную фазу - водный раствор, содержащий MPLA (50,0 мкг), а также рекомбинантный структурный белок системы секреции III типа хламидий 10,0-20,0 мкг. Для приготовления неполярной фазы к сквалену (10,0 мг) добавить 0.5% Tween 80. Смешать полярную и неполярные фазы, довести итоговый объем до 0.5-1,0 мл изотоничным буферным раствором. Для получения наноразмерной эмульсии образец обрабатывают ультразвуком.
Т.о., поставленная задача по приготовлению бустирующего компонента вакцины по изобретению выполнена. Возможно получение бустирующего компонента, содержащего: рекомбинантный белок rCdsF - 10,0 мкг, монофосфорил липид A - 50,0 мкг, сквален 10,0 мг, 0,5% Tween 80, в объеме 0.5 мл.
Пример 6. Иммуногенность противохламидийной комбинированной вакцины
Изучение иммуногености вакцины, состоящей из праймирующего компонента, и бустирующего компонента проведено по ее способности индуцировать выработку специфических антител и специфическую реакцию Т-клеточного иммунного ответа у мышей.
На фиг. 22 представлена схема иммунизации мышей линии Balb/c, самок, массой 14-16 г. Для этого использовали разработанный вариант комбинированной вакцины, адаптированной для мышей и состоящей из праймирующего компонента, обозначенного Ad-MBL-TC_0037, и бустирующего компонента, обозначенного rTC_0037-MPLA. Иммунизацию праймирующим компонентом проводили интраназально дозой 109 БОЕ. Через 14 сут. иммунизированных животных бустировали подкожно 0,5 мл эмульсии, содержащей 10,0 мкг сквалена, 10,0 мкг белка rTC_0037 и 50,0 мкг MPLA.
Пример 7. Гуморальный иммунный ответ на комбинированную вакцину.
Полученную комбинированную вакцину, содержащую Ad-MBL-ТС_0037 и rTC_0037-MPLA, использовали для изучения гуморального иммунного ответа.
Все работы выполняли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приказ МЗ №755 от 12.08.1977 г.). В исследовании использовали мышей линии BALB/c (самки), 6-7 недель (массой 14-16 г). Было 4 группы животных по 10 особей в каждой. Первая группа мышей была иммунизирована Ad-MBL-TC_0037 в дозе 109 БОЕ/мл с последующим бустированием rTC_0037-MPLA, остальные группы использовали в качестве контролей - группа, получавшая Ad-null с бустированием MPLA; группа, получавшая Ad-null в дозе 109 БОЕ/мл; и группа мышей, получавшая фармацевтически приемлемый буфер (ФПБ) -50,0 мкл.
Мышам вводили однократно интраназально 50,0 мкл предлагаемого препарата, либо Ad-null, либо ФПБ. Далее через две недели после интраназальной иммунизации проводили подкожно бустирование rTC_0037-MPLA и MPLA. Забор крови у животных во всех группах производили через 14 суток после бустирования. В сыворотке крови определяли титры специфических антител класса IgG изотипов IgG2a и IgG1 к белку ТС_0037 в реакции иммуноферментыого анализа (ИФА) (фиг.23А, Б).
В качестве антигена для оценки антител к белку ТС_0037 использовали рекомбинантный белок rTC_0037 С. trachomatis MoPn в концентрации 10,0 мкг/мл.
ИФА проводили общепринятым методом. Использовали 96-луночные планшеты с высокой сорбционной способностью (Costar, США). Для определения специфических антител класса IgG в качестве конъюгата использовали козьи моноклональные антимышиные антитела изотипов IgG2a и IgG1 (Sigma-Aldrich, США) в разведении 1:1000, меченные пероксидазой хрена. В качестве субстрата использовали тетраметилбензидин (ТМБ) (Biolegend, США). Учет реакции проводили при длине волны 450 нм. За титр принимали наибольшее разведение сыворотки, которое дает оптическую плотность, по крайней мере, в 2 раза больше, чем сыворотки, взятые у контрольных групп.
В результате исследования была выявлена продукция специфических антител класса IgG-IgG2a и IgG1 изотипов в ответ на иммунизацию Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA, что говорит об иммуногенности данного препарата, индуцирующего протективный иммунитет по Th1-типу. Титр антител к антигену ТС_0037 в сыворотках крови мышей, иммунизированных Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA составил в среднем 1:400, что выше, чем у мышей контрольных групп (фиг. 23А, Б).
Таким образом, были детектированы специфические антитела к белку ТС_0037 в сыворотках крови мышей, однократно интраназально иммунизированных кандидатной вакциной Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA. Наличие специфической активности - иммуногенности означает возможность использования при данной схеме иммунизации конструкции Ad-MBL-TC_0037 с последующим бустированием rTC_0037-MPLA в качестве комбинированной противохламидийной вакцины.
Пример 8. Т-клеточный иммунный ответ на комбинированную вакцину.
Полученную комбинированную вакцину, содержащую Ad-MBL-ТС_0037 с бустированием rTC_0037-MPLA, также использовали для изучения Т-клеточного иммунного ответа у мышей. Схема эксперимента представлена на фиг. 24.
Для этой цели применяли метод ELISPOT, позволяющий выявлять Т-лимфоциты, специфичные к белку ТС_0037, по их способности секретировать ИФγ в ответ на стимуляцию антиген-презентирующими клетками, «нагруженными» антигеном rTC_0037.
Все работы выполняли в соответствие с «Правилами проведения работ с использованием экспериментальных животных» (приказ МЗ №755 от 12.08.1977 г.). В исследовании использованы 4 группы мышей линии Balb/c (самки), 6-7 недель (массой 14-16 г), по 5 особей в каждой.
Эксперимент проводили на животных после однократного интраназального введения 50,0 мкл препарата, содержащего Ad-MBL-ТС_0037 с последующим подкожным бустированием rTC_0037-MPLA (см. схему проведения иммунизации фиг. 22). В качестве отрицательных контролей использованы мыши, однократно интраназально получившие Ad-null в дозе 109 БОЕ, или фармацевтически приемлемый буфер, или Ad-null в дозе 109 БОЕ с бустированием MPLA. Через 44 сут. после бустерной иммунизации мышей умерщвляли бескровным методом и выделяли спленоциты. Спленоциты реактивировали in vitro дендридными клетками, презентирующими белок ТС_0037, и определяли количество спленоцитов, отвечающих секрецией ИФγ в ответ на специфическую реактивацию.
При специфической реактивации спленоцитов антиген-презентирующими клетками, «нагруженными» антигеном ТС_0037, было детектировано в среднем 144 ИФγ-секретирующих клеток на 1 млн. спленоцитов в группе животных, иммунизированных Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA. Было показано, что уровень ИФγ-секретирующих клеток у иммунизированных Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA мышей, был достоверно выше, чем в контрольных группах. Результаты эксперимента представлены на фиг. 25.
Таким образом, методом ELISPOT была продемонстрирована индукция значимого уровня Т-клеточного иммунного ответа к антигену ТС_0037 у мышей, однократно интраназально иммунизированных Ad-MBL-TC_0037 с последующим подкожным бустированием rTC_0037-MPLA.
Заключено, что изучение Т-клеточного ответа у животных, иммунизированных вакциной по изобретению, показало наличие выраженного Т-клеточного иммунного ответа, что соответствует современным требованиям к вакцинам.
Пример 9. Протективная активность полученной комбинированной вакцины.
В данном примере продемонстрирована возможность индукции протективного иммунного ответа при помощи иммунизации кандидатной вакциной, содержащей Ad-MBL-TC_0037 с бустированием rTC_0037-MPLА (см. схему проведения иммунизации и заражения фиг. 26).
С этой целью поставлены эксперименты по изучению протективной активности на модели урогенитальной хламидийной инфекции у мышей. Исследования протективных свойств проводились с использованием С. trachomatis MoPn, т.к. данная модель урогенитальной хламидийной инфекции у мышей, имитирует многие аспекты урогенитальной инфекции у женщин, вызванной другими штаммами С. trachomatis.
1) Нейтрализующая активность специфических антител при иммунизации полученной вакциной, содержащей Ad-MBL-TC_0037 с бустированием rTC_0037-МPLА
К важнейшим изучаемым иммунным реакциям относят реакцию нейтрализации специфическими антителами. Для постановки реакции нейтрализации использовали клетки линии McCoy. Полученные сыворотки от иммунизированных животных инкубировали с С. trachomatis MoPn в различных разведениях (1:8; 1:16; 1:32; 1:64; 1:128; 1:256) в течение 30 минут при t=37°C. Затем полученную смесь добавляли к клеткам и центрифугировали при 2000 об/мин, t=25°C в течение 45 мин. Инкубацию проводили в атмосфере CO2 при температуре 37°C в течение 48 часов. Количественную оценку эффекта нейтрализации проводили методом иммунофлуоресценции при подсчете хламидийных включений в культуре клеток McCoy.
Было показано, что иммунизация Ad-MBL-TC_0037 с последующим бустированием rTC_0037-MPLA, приводила к продукции специфических антител, обладающих 100% нейтрализующей активностью в отношении С. trachomatis MoPn инфекции in vitro в разведении 1:128 (фиг. 27, табл. 1).
2) Оценка развития инфекции в нижних отделах урогенитального тракта у мышей при иммунизации вакциной, содержащей Ad-MBL-ТС_0037 с бустированием rTC_0037-MPLA.
Для моделирования инфекционного процесса у мышей был выбран серотип С. trachomatis MoPn, который является естественным мышиным патогеном. Данная модель урогенитальной хламидийной инфекции, имитирует многие аспекты урогенитальной инфекции у женщин, вызванной человеческими штаммами С. trachomatis. При урогенитальной инфекции, вызванной С. trachomatis MoPn у мышей в течение нескольких недель развивается инфекция в нижних отделах урогенитального тракта, которая затем переходит в восходящую, приводя к развитию патологии репродуктивных органов и бесплодию, аналогично как при урогенитальной хламидийной инфекции у женщин.
С 3 по 20 сут. после заражения С. trachomatis MoPn у мышей производили забор вагинальных смывов. Развитие хламидийной инфекции определяли с помощью культурального метода исследования.
Культуральное выделение С. trachomatis MoPn проводили на линии клеток McCoy по стандартной методике [35]. Для этого у мышей брали вагинальные смывы и помещали в 500,0 мкл культуральной среды (RPMI с добавлением 5% фетальной сыворотки, глюкозы, амфотерицина B, гентамицина). Заражение клеточной линии McCoy полученным материалом проводили в 24 луночном планшете. После заражения планшет центрифугировали на 2000 об/мин при t=+25°C в течение 1 часа. После инкубации в термостате (37°C, 5% CO2) в течение 2 часов удаляли среду и добавляли 1,0 мл среды с циклогексимидом. Планшет инкубировали при 37°C, 5% CO2 в течение 48 часов. Затем фиксированные клетки окрашивали специфическими к хламидийному ЛПС моноклональными антителами, меченными ФИТЦ. Идентификацию и количественную оценку содержания хламидий в инфицированных культурах осуществляли методом иммунофлюоресцентной микроскопии. Для подсчета хламидийных включения образующих единиц (ВОЕ) использовали стандартную формулу [35].
Изучение динамики развития инфекции в нижних отделах урогенитального тракта показало, что иммунизация Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA приводила к почти полному подавлению хламидийной инфекции на 20 сутки после заражения, в то время как в контрольной группе инфекция выявлялась в количестве 104 ВОЕ/мл (фиг. 28).
3) Оценка подавления восходящей хламидийной инфекции в верхних отделах урогенитального тракта при иммунизации полученной вакциной, содержащей Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA.
а) Выделение ДНК из тканей
Образцы органов (матки, яичников) от мышей BALB/c (5 мышей/группу) (см. схему эксперимента фиг. 26) гомогенизировали в 1 мл 1% раствора PBS. Выделение ДНК проводили на автоматическом экстракторе нуклеиновых кислот NucliSENS® easyMAG® ( , Нидерланды). Суспензию в объеме 1000,0 мкл лизировали при температуре 65°C в течение 1 часа в 1,0 мл лизирующего буфера с протеиназой K («Синтол», Россия) в количества 40,0 мкл.
, Нидерланды). Суспензию в объеме 1000,0 мкл лизировали при температуре 65°C в течение 1 часа в 1,0 мл лизирующего буфера с протеиназой K («Синтол», Россия) в количества 40,0 мкл.
б) постановка ПЦР
С целью обнаружения С. trachomatis MoPn в исследуемом материале от мышей, с помощью программ Primer3 и Oligo38 подобраны праймеры и TaqMan-зонд к области криптической плазмиды (С. trachomatis plasmid pMoPn) для проведения ПЦР (Таблица 2).
Объем реакционной смеси составил 25,0 мкл: 2.5 мкл 10×ПЦР буфера, 2.5 мМ MgCl2, 0.25 мМ DNTP, по 5 pmol праймеров, 2.5 pmol зонда, 2.5 единицы термостабильной полимеразы, 5 мкл ДНК. Температурно-временной профиль указан в таблице 3.
Показано, что чувствительность выявления ДНК методом ПЦР составляет 100 копий/пробу.
Выявлено, что иммунизация вакциной, содержащей Ad-MBL-TC_0037 с бустированием rTC_0037-MPLА, полностью подавляет хламидийную инфекцию в верхних отделах урогенитального тракта у всех исследованных мышей при сравнении с контрольными группами (см. схему эксперимента фиг. 26), в которых все мыши были инфицированы (фиг. 29, табл. 4).
4) Оценка патологических изменений в репродуктивных органах при иммунизации вакциной, содержащей Ad-MBL-TC_0037 с бустированием rTC_0037-MPLA.
Через 30 сут. после заражения С. trachomatis MoPn патологические изменения оценивали визуально. Для этого мышей забивали, проводили вскрытие и изъятие репродуктивных органов (матки, яичников). Были сделаны макроснимки органов и сравнительный анализ патологических изменений между экспериментальной и контрольными группами животных (фиг. 30, табл. 5).
При аутопсии яичников и матки в группе животных, иммунизированных комбинированной вакциной, содержащей Ad-MBL-TC_0037 и rTC_0037-MPLA, не выявлено патологических изменений. Спаечный процесс не наблюдался. Гидросальпинкса не обнаружено (фиг. 30А).
При аутопсии яичников и матки у неиммунизированных мышей, зараженных С. trachomatis MoPn, патология репродуктивных органов была ярко выражена, в особенности в виде гидросальпинкса, характерного при поражении хламидийной инфекцией, также регистрировали наличие серозно-геморрагического экссудата в небольшом количестве и сильную гиперемия маточных рогов, яичников (фиг. 30Б).
Приведенные примеры подтверждают промышленную применимость заявленной вакцины.
Промышленная применимость
Создана новая оригинальная комбинированная противохламидийная вакцина, содержащая праймирующий компонент с генетической конструкцией на основе рекомбинантного аденовируса пятого серотипа, кодирующей химерный ген, состоящий из N-концевой части маннозо-связывающего лектина, спейсера и гена антигена CdsF хламидий, которые слиты в единую рамку считывания и экспрессируются как единый белковый продукт; и содержащей также бустирующий компонент, состоящий из рекомбинантного структурного белка rCdsF ССТТ хламидий, - адъюванта монофосфорил липида A (MPLA) - лиганда толл-подобного рецептора 4 типа и сквалена. Предложена технология производства (способ получения) такой вакцины. Проведены испытания этой вакцины, показано, что она обеспечивают защиту против хламидийной инфекции на мышиных моделях.
Разработанную противохламидийную вакцину, обладающую способностью индуцировать выработку специфических антител и специфическую реакцию Т-клеточного иммунного ответа, и состоящую из рекомбинантного аденовирусного вектора, экспрессирующего гипериммунный полноразмерный структурный белок CdsF ССТТ хламидий, и эмульсии для бустирования, в состав которой входит рекомбинантный белок rCdsF ССТТ и комбинированный адъювант, содержащий MPLA и сквален.
Предлагаемую вакцину можно рассматривать в качестве кандидатного препарата для доклинических исследований как противохламидийную вакцину против урогенитального хламидиоза и венерической лимфогранулемы.
Библиографический список
1. Зигангирова Н.А., Нестеренко Л.Н. и др. Регуляторная роль системы секреции III типа грамотрицательных бактерий в развитии хронического инфекционного процесса // Молекулярная генетика, микробиология и вирусология: Квартальный научно-теоретический журнал. - 07/2012. - N3. - С. 3-13.
2. Щербинин Д.Н., Шмаров М.М., Народицкий Б.С., Рубакова Э.И., Кондратьева Т.К. Исследование вакцинных противотуберкулезных препаратов на основе рекомбинантных аденовирусов в экспериментальной модели на мышах. // Туберкулез и болезни легких. 2010. Т. 87. №10. С. 50-53.
3. Astiz М.Е., Galera A., Saha D.C., Carpati С., Rackow Е.С. Monophosphoryl lipid A protects against Gram-positive sepsis and tumor necrosis factor. // Shock. 1994. V. 2. P. 271-274.
4. Casella C.R., Mitchell T.C. Putting endotoxin to work for us: monophosphoryl lipid A as a safe and effective vaccine adjuvant. Cell Mol Life Sci. 2008 Oct; 65 (20): 3231-40.
5. Beagley K.W. and Timms P. Chlamydia trachomatis infection: incidence, health costs and prospects for vaccine development. // J Reprod Immunol. 2000. V. 48. №1. P. 47-68.
6. Betts H.J., Twiggs L.E., Sal M.S., Wyrick P.B. and Fields K.A. Bioinformatic and biochemical evidence for the identification of the type III secretion system needle protein of Chlamydia trachomatis.// J. Bacteriol. 2008. V. 190, P. 1680-1690.
7. Betts H.J. and Fields K.A. The Chlamydial Type III Secretion Mechanism: Reveiling Cracks in a Tough Nut. // Front Microbiol. 2010. V. 1. P. 114.
8. Blocker A.J., Deane J.E., Veenendaal A.K., Roversi P., Hodgkinson J.L., Johnson S. and Lea S.M. (2008). What's the point of the type III secretion system needle? Proc. Natl. Acad. Sci U.S.A 105, 6507-6513.
9. Brown Т.Н., Brown Т.Н., David J., Acosta-Ramirez E. Comparison of immune responces and protective efficacy of intranasal prime-boost immunization regimens using adenovirus-based and CpG/HH2 adjuvanted-subunit vaccines against genital Chlamydia muridarum infection.// Vaccine. 2012. V. 2. Vol. 30.
10. Brunham R.C. and Peeling R.W. Chlamydia trachomatis antigens: role in immunity and pathogenesis. // Infect Agents Dis. 1994. V. 3. №5. P. 218-33.
11. Carmody R.J., Chen Y.H. // Cell. Mol. Immunol. 2007. V. 1. P. 31-41.
12. Casella C.R, Mitchell T.C. Putting endotoxin to work for us: monophosphoryl lipid A as a safe and effective vaccine adjuvant. Cell Mol Life Sci. 2008 Oct; 65 (20): 3231-40.
13. Choi J.H., Schafer S.C., Zhang L., Kobinger G.P., Juelich Т., Freiberg A.N., Croyle M.A. A single sublingual dose of an adenovirus-based vaccine protects against lethal Ebola challenge in mice and guinea pigs. // Mol Pharm. 2012. V. 9. №1. P. 156-67.
14. Dai W., Li Z. Conserved type III secretion system exerts important roles in Chlamydia trachomatis. Int J Clin Exp Pathol. 2014; 7 (9): 5404-5414.
15. Dubensky Т., Jr, Reed S. (2010) Adjuvants for cancer vaccines. SeminImmunol 22: 155-161.
16. Esparza-Gonzalez S.C., Troy A.R., and Izzo A.A. Comparative Analysis of Bacillus subtilis Spores and Monophosphoryl Lipid A as Adjuvants of Protein-Based Mycobacterium tuberculosis-Based Vaccines: Partial Requirement for Interleukin-17A for Induction of Protective Immunity. // Clin Vaccine Immunol. 2014 Apr. V. 21. №4. P. 501-508.
17. Garcon N., Leroux-Roels G., Cheng W.F.. Vaccine adjuvants. // Perspectives in Vaccinology. 2011.1, 89-113.
18. Garcon N., Chomez P., Marcelle Van Mechelen GlaxoSmithKline Adjuvant Systems in vaccines: concepts, achievements and perspectives // Vaccine. 2007. V. 6. №5. P. 723-739.
19. Giannini S.L. et al. Enhanced humoral and memory В cellular immunity using HPV16/18 LI VLP vaccine formulated with the MPL/aluminium salt combination (AS04) compared to aluminium salt only. // Vaccine.2006. V. 24. P. 5937-5949.
20. Gill N., Davies E.J., Ashkar A.A. // Am. J. Reprod. Immunol. 2008. V. 59. P. 35-43.
21. Hoelscher M.A., Garg S., Bangari D.S. et al. Development of adenoviral-vector-based pandemic influenza vaccine against antigenically distinct human H5N1 strains in mice // Lancet. 2006. V. 367, №9509. P. 475-481.
22. Holmgren J, Czerkinsky C. Mucosal immunity and vaccines. Nat Med. 2005; 11: S45-53.
23. Huang Z., FengY., ChenD. et al. Structural Basis for Activation and Inhibition of the Secreted Chlamydia Protease CPAF. Cell Host Microbe. 2008 Dec 11; 4 (6): 529-42.
24. Johnson A.G., Tomai M., Solem L., Beck L., Ribi E. Characterization of a nontoxic monophosphoryl lipid A. // Rev Infect Dis. 1987.V. 9.№5. P. 512-6.
25. Li W., Guentzel M.N., Seshu J., Zhong G., Murthy A.K. and Arulanandam B.P. Induction of cross-serovar protection against genital chlamydial infection by a targeted multisubunit vaccination approach. // Clin Vaccine Immunol. 2007. V. 14. №12. P. 1537-44.
26. Loomis W.P., Starnbach M.N. T cell responses to Chlamydia trachomatis.// CurrOpinMicrobiol. 2002. V. 5. №1. P. 87-91.
27. Mascellino M.T., Boccia P., and OlivaA. Immunopathogenesis in Chlamydia trachomatis Infected Women. // ISRN Obstetrics and Gynecology. Volume 2011. P. 9.
28. Mossman D, Beagley KW, Landay AL, Loewenthal M, Ooi C, Timms P & Boyle M (2008) Genotyping of urogenital Chlamydia trachomatis in Regional New South Wales, Australia. Sex Transm Dis 35: 614-616.
29. Murthy A.K., Guentzel M.N., Zhong G., Arulanandam B.P. Chlamydial protease-like activity factor-insights into immunity and vaccine development. // J ReprodImmunol. 2009. V. 83. №1-2. P. 179-84.
30. O'Brien L.M., Stokes M.G., Lonsdale S.G., Maslowski D.R., Smither S.J., Lever M.S., Laws T.R., Perkins S.D. Vaccination with recombinant adenovirus esexpressing Ebola virus glycoprotein elicits protection in the interferon alpha/betareceptor. knock-out mouse. // Virology. 2014 V. 452. In press.
31. Pal S., Peterson E.M. and de la Maza L.M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. // Infect Immun. 2005. №12. P. 8153-60.
32. Qureshi N., Takayama K., Ribi E. Purification and structural determination of nontoxic lipid A obtained from the lipopolysaccharide of Salmonella typhimurium. // J Biol Chem. 1982. V. 257. №19. P. 11808-15.
33. Ramsey K.H., Sigar I.M., Schripsema J.H., Denman C.J., Bowlin A.K., Myers G.A. and Rank R.G. Strain and virulence diversity in the mouse pathogen Chlamydia muridarum. // Infect Immun. 2009. V. 77. №8. P. 3284-93.
34. Salkowski C.A., Detore G.R., Vogel S.N. Lipopolysaccharide and monophosphoryl lipid A differentially regulate interleukin-12, gamma interferon, and interleukin-10 mRNA production in murine macrophages. // Infect. Immun. 1997. V. 65. P. 3239-3247.
35. Schautteet K., Stuyven E., Beeckman D.S., Van Acker S., Carlon M., Chiers К., Cox E. and Vanrompay D. Protection of pigs against Chlamydia trachomatis challenge by administration of a MOMP-based DNA vaccine in the vaginal mucosa. // Vaccine. 2012. V. 29. №7. P. 1399-407.
36. Scidmore M.A. (2005) Cultivation and Laboratory Maintenance of Chlamydia trachomatis. Curr Protoc Microbiol Chapter 11: Unit 11A 11.
37. Sedova E.S., Shcherbinin D.N., Migunov A.I. et al. Recombinant Influenza Vaccines. ActaNaturae. 2012. V.4. №4. P. 17-27.
38. Shmarov M.M., Sedova E.S., Verkhovskaya L.V. et al. Induction of a Protective Heterosubtypic Immune Response. Against the Influenza Virus by using Recombinant Adenoviral Vectors Expressing Hemagglutinin of the Influenza H5 Virus. // ActaNaturae. 2010. V. 2. №1. P. 111-8.
39. Sun G., Pal S., Weiland J., Peterson E.M. and de la Maza L.M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. // Vaccine. 2009. V. 27. №36. P. 5020-5.
40. Takayam K., Qureshi N., Ribi E., Cantrell J.L. Separation and characterization of toxic and nontoxic forms of lipid A. // Rev Infect Dis. 1984. V. 6. №4. P. 439-443.
41. Thoelen S., Van D.P., Mathei C, Leroux-Roels G., Desombere I. et al. Safety and immunogenicity of a hepatitis В vaccine formulated with a novel adjuvant system. // Vaccine. 1998. V. 16. P. 708-714.
42. Vergara M.R.C., Buendia Marin A.J., del Rio Alonzo L., Gijon F.C., Hernandez N.O., Ruiz M.C.G., Lorente J.S. Chlamydia trachomatis genital infection: immunity and prospects for vaccine development. // Immunologia.2005. V. 24. P. 298-312.
43. Wang J., Chen L., Chen F. et al. A chlamydial type III-secreted effector protein (Tarp) is predominantly recognized by antibodies from humans infected with Chlamydia trachomatis and induces protective immunity against upper genital tract pathologies in mice. // Vaccine.2009. V. 27. №22. P. 2967-80.
44. Weeratna R.D., Makinen S.R., McCluskie M.J., Davis H.L. // Vaccine. 2005. V. 45. P. 5263-5270.
45. Xiang Z.Q., Greenberg L., Ert H.C., Rupprecht C.E. Protection of non-human primates against rabies with an adenovirus recombinant vaccine. // Virology. 2014. V. 450-451. P. 243-9.
46. Zaia J.A. The status of gene vectors for the treatment of diabetes // Cell Biochem. Biophys. - 2007. - v. 48 (2-3). - pp. 183-90.
47. Zhang Y.X., Stewart S., Joseph Т., Taylor H.R. and Caldwell H.D. Protective monoclonal antibodies recognize epitopes located on the major outer membrane protein of Chlamydia trachomatis. // J Immunol. 1987. V. 138. №2. P. 575-81.
48. Zhang Y.X., Stewart S.J. and Caldwell H.D. Protective monoclonal antibodies to Chlamydia trachomatis serovar- and serogroup-specific major outer membrane protein determinants. // Infect Immun. 1989.V. 57. №2. P. 636-8.
49. Zhong G., Fan P., Ji H. et al. Identification of a chlamydial protease-like activity factor responsible for the degradation of host transcription factors. // J. Exp. Med. 2001. V. 8. P. 935-942.
50. Wolf К., H.J. Betts, B. Chellas-Gery, S. Hower, C.N. Linton, and K.A. Fields Treatment of Chlamydia trachomatis with a small molecule inhibitor of the Yersinia type III secretion system disrupts progression of the chlamydial developmental cycle // Molecular microbiology, 2006.
51. Заявка на патент CN 104558196 (A), 29.04.2015.
Zhang Lifang; Zhu Shanli; Chen Jun; Chen Shao; Feng Yan; Li Wenshu; Xue Xiangyang В cell epitope of Tarp protein of chlamydia trachomatis and application of В cell epitope // CN 104558196 (A), 2015
52. Евразийский патент №200701825, 31.03.2005.
Барт Бренда (US), Бхатия Аджай (US), Олдерсон Марк (US), Мезоннёв Жан-Франсуа Л. (US), Лобе Ив (BE), Нозе Флоренс Бернадетт (BE), Маршан Мартин (BE), Меттен Паскаль (BE), Скейки Ясир A. (US), Пробст Питер (US) Вакцины против хламидиоза// Евразийский патент №014527, 2005.
МПК: А61К 39/118
Противохламидийная вакцина и способ ее получения
Информация в электронной форме подготовлена согласно стандарту ВОИС ST. 25 и идентична перечню аминокислотных последовательностей, содержащемуся в заявке:
SEQ ID NO:4 представляет собой аминокислотнуюпоследовательность полноразмерного белка TC_0037 C. trachomatis MoPn.
MetAlaLysSerCysSerAlaLeuAsnPheAsnGluMetSerGluGlyValCysLysTyrValLeuGlyValGlnGlnTyrLeuThrGluLeuGluThrSerThrGlnGlyThrValAspLeuGlyThrMetPheAsnLeuGlnTyrArgThrGlnIleLeuCysGlnTyrMetGluAlaSerSerAsnIleLeuThrAlaValHisThrGluMetIleThrMetAlaArgSerAlaLysGlySer
SEQ ID NO:5 представляет собой аминокислотную последовательность глицин-серинового спейсера.
GlySerProGlySerGlySerGlySerGlySerGlySerArgSer
SEQ ID NO:6 представляет собой аминокислотную последовательность MBL.
MetSerIlePheThrSerPheLeuLeuLeuCysValValThrValValTyrAlaGluThrLeuThrGluGlyValGlnAsnSerCysProValValThrCysSerSerProGlyLeuAsnGlyPheProGlyLysAspGlyArgAspGlyAlaLysGlyGluLysGlyGluProGlyGlnGlyLeuArgGlyLeuGlnGlyProProGlyLysValGlyProThrGlyProProGlyAsnProGlyLeuLysGlyAlaValGlyProLysGlyAspArgGlyAspArgAlaGluPheAspThrSerGluIleAspSerGluIleAlaAlaLeuArgSerGluLeuArgAlaLeuArgAsnTrpValLeuPheSerLeuSerGlu
 Фиг. 9. Полная нуклеотидная и аминокислотная последовательность генетической конструкции MBL-TC_0037.
Фиг. 9. Полная нуклеотидная и аминокислотная последовательность генетической конструкции MBL-TC_0037.
SEQ ID NO:8 представляет собой аминокислотную последовательность белка TC_0037-6*His.
MetAlaLysSerCysSerAlaLeuAsnPheAsnGluMetSerGluGlyValCysLysTyrValLeuGlyValGlnGlnTyrLeuThrGluLeuGluThrSerThrGlnGlyThrValAspLeuGlyThrMetPheAsnLeuGlnTyrArgThrGlnIleLeuCysGlnTyrMetGluAlaSerSerAsnIleLeuThrAlaValHisThrGluMetIleThrMetAlaArgSerAlaLysGlySerLeuGluHisHisHisHisHisHis
МПК: А61К 39/118
Противохламидийная вакцина и способ ее получения
Информация в электронной форме подготовлена согласно стандарту ВОИС ST. 25 и идентична перечню нуклеотидных последовательностей, содержащемуся в заявке:
SEQ ID NO:1 представляет собой нуклеотидную последовательность гена полноразмерного белка TC_0037 C. trachomatis MoPn.
atggccaagagctgctccgctctgaacttcaatgagatgagcgaaggcgtgtgtaagtacgtcctcggagtgcagcaatatctgaccgagctggaaacatccacccagggcacagtggacctcggaaccatgttcaacctgcagtacaggacacaaatcctctgccagtacatggaggcctccagcaacattctgaccgctgtgcacacagagatgatcaccatggccaggtctgctaagggcagctaa
SEQ ID NO:2 представляет собой нуклеотидную последовательность глицин-серинового спейсера.
ggatccccaggcagcgggtctggatctggcagcggaagcagatct
SEQ ID NO:3 представляет собой нуклеотидную последовательность гена белка MBL.
atgtccattttcacatccttccttctgctgtgtgtggtgacagtggtttatgcagagaccttaaccgaaggtgttcaaaattcctgccctgtggttacctgcagttctccaggcctgaatggcttcccaggcaaagatggacgtgacggtgccaagggagaaaagggagaaccaggtcaagggctcagaggcttgcaaggccctcctggaaaagtaggacctacaggacccccagggaatccggggttaaaaggagcagtgggaccgaaaggagaccgtggggacagagcagaatttgatactagcgaaattgattcagaaattgcagccctacgatcagagctgagagccctgagaaactgggtgctcttctctctgagtgaa
 Фиг. 9. Полная нуклеотидная и аминокислотная последовательность генетической конструкции MBL-TC_0037.
Фиг. 9. Полная нуклеотидная и аминокислотная последовательность генетической конструкции MBL-TC_0037.
SEQ ID NO:7 представляет собой нуклеотидную последовательность гена белка TC_0037-6*His.
atggctaaatcctgctccgctctgaacttcaacgaaatgtccgaaggtgtttgcaaatacgttctgggtgttcagcagtacctgaccgaactggaaacctccacccagggtaccgttgacctgggtaccatgttcaacctgcagtaccgtacccagatcctgtgccagtacatggaagcttcctccaacatcctgaccgctgttcacaccgaaatgatcaccatggctcgttccgctaaaggttccctcgagcaccaccaccaccaccactga