Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ИНДОЛ-3-ИЛ-ГЛИОКСИЛАМИДОВ ДЛЯ ПОДАВЛЕНИЯ ХЛАМИДИЙНОЙ ИНФЕКЦИИ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и конкретно касается способа идентификации соединений, обладающих активностью в качестве специфических ингибиторов белка - фактора патогенности хламидий CPAF (протеазы), с использованием компьютера. Также изобретение касается применения соединений, найденных указанным способом, в качестве специфических ингибиторов фактора патогенности хламидий CPAF для подавления хламидийной инфекции.
Проблема антибиотикорезистентности является одной из наиболее острых проблем фармакологии на данный момент, поскольку отмечено, что ко всем существующим классам антибактериальных препаратов у патогенных бактерий развивается устойчивость в той или иной степени (Сидоренко С.В. Механизмы антибиотикорезистентности / Антибактериальная терапия: Практическое руководство под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. - 2000. - М.: Фарммединфо. - 190 с.; Страчунский Л.С., Богданович Т.М. Состояние антибиотикорезистентности в России / Антибактериальная терапия: Практическое руководство под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. - 2000. - М, Фарммединфо. - 190 с.; Фурлетова Н.М., Карп В.П., Мирская М.А., Никитин А.П. Мониторинг спектра и чувствительности выделяемой микрофлоры в стационаре - МКО-10, 2002; Clatworthy A.E., Pierson E., Hung D.T. Targeting virulence: a new paradigm for antimicrobial therapy - Nature Chemical Biology - 2007. - V.3. - N 9. - P.541-548). Кроме того, используемые в клинической практике антибиотики в большинстве своем эффективно работают против острых инфекций, но не эффективны в отношении хронической стадии инфекционного процесса. По данным ВОЗ почти 60% случаев смертности связаны именно с хроническими заболеваниями. Хронические инфекции не только вирусной, но и бактериальной природы - основа многих тяжелых хронических соматических заболеваний, патогенез которых связан с развитием хронического воспаления. Для таких заболеваний, как язва и рак желудка, артриты, астма, аутоиммунные заболевания, некоторые формы рака, атеросклероз, являющихся ведущими причинами смертности людей, экспериментальными и клиническими данными доказана инфекционная природа, связанная с конкретными бактериальными патогенами (Samaras V., Rafailidis P.I., Mourtzoukou E.G. et al. Chronic bacterial and parasitic infections and cancer: a review. Infect. Dev. Ctries. 2010; 4(5): 267-281; Schiavoni G., Di Pietro M., Ronco C. et al. Chlamydia pneumoniae infection as a risk factor for accelerated atherosclerosis in hemodialysis patients. J. Biol. Regul. Homeost. Agents. 2010; 24(3): 367-75). При этом потери от этих заболеваний не только соизмеримы, но и больше, чем от инфекций, протекающих в острой форме. На данный момент эффективных антибиотиков, оказывающих выраженный терапевтический эффект на хроническую инфекцию, на рынке лекарственных препаратов не существует. Это объясняется тем, что острая и хроническая инфекции - две разные формы взаимодействия патогена и организма хозяина, при которых реализуются две различные стратегии, заложенные в геноме патогена. При хронической инфекции имеет место эволюционно выработанная адаптация патогена, направленная на длительное выживание в макроорганизме, в том числе изменение метаболической активности. Это приводит к снижению чувствительности микроорганизма к антибактериальным препаратам, эффективным на острой стадии инфекционного процесса.
В связи с вышесказанным очевидна необходимость выбора иной стратегии поиска лекарственных средств, основанной на выявлении у бактериальных патогенов принципиально новых мишеней. Эффективный препарат должен быть направлен на подавление вирулентности. Такие препараты должны иметь ряд преимуществ по сравнению с используемыми ныне антибиотиками. Во-первых, действие на вирулентные свойства патогена, которые важны при взаимодействии в системе патоген-хозяин, без подавления жизнеспособности дает основание прогнозировать снижение селективного давления и отсутствие эффекта отбора резистентных штаммов бактерий. Во-вторых, такие лекарственные средства могут быть активными в отношении хронических форм инфекций. Кроме того, препараты, действующие на специфические мишени патогенных бактерий, не будут токсичными для эукариотических клеток и для нормальной микрофлоры человека, что представляет собой серьезнейшую проблему при использовании антибиотиков.
В уровне техники известны соединения, воздействующие на вирулентные свойства патогенных бактерий. Например, соединения, которые подавляют секреторные функции некоторых грамотрицательных бактерий, таких как Yersinia pseudotuberculosis, Salmonella enterica, Pseudomonas aeruginosa, патогенных штаммов Escherichia coli, Chlamydia spp.и не вызывают развитие устойчивости к препаратам на их основе. К таким соединениям можно отнести гидразоны, полученные на основе гидразидов бензойных и пиридинкарбоновых кислот (FEBS Letters, 581, (2007) 587-595; Infection and Immunity, 2005, p.3104-3114, Vol.73, No.5; PNAS, 26, 2006 vol.103. No.39, 14566-14571).
В связи с этим в конце XX - начале XXI века была сформулирована новая концепция поиска антимикробных препаратов, получившая название «Мишень-направленный (таргетный) поиск лекарственных препаратов» (Бухарин О.В. Персистенция патогенных бактерий. М.: Медицина, 1999. 367 с.; Сидоренко С.В. Инфекционный процесс как «диалог» между хозяином и паразитом. Клиническая микробиология и антимикробная химиотерапия. 2001; 3(4): 301-315.).
В рамках этой концепции в качестве кандидатных антимикробных препаратов выбираются вещества, специфически ингибирующие активность важного для патогенности или вирулентности белка бактерии-возбудителя. В связи с этим встает задача поиска низкомолекулярных химических соединений, обладающих специфической активностью в отношении ингибирования выбранного белка-мишени. Одним из методов, нацеленных на решение этой задачи, является виртуальный скрининг библиотек химических соединений, предполагающий использование компьютера.
Методы виртуального скрининга делятся на так называемые structure-based и ligand-based. Structure-based методы, или, иначе, методы, основанные на известной трехмерной структуре белка-мишени, подразумевают последовательное моделирование взаимодействия белка-мишени и каждого низкомолекулярного соединения из базы данных низкомолекулярных химических веществ. Результатом такого моделирования, называемого молекулярным докингом, для одного низкомолекулярного соединения является наиболее энергетически выгодная конформация этого соединения в исследуемом сайте белка-мишени, а также оценка силы их взаимодействия. В результате перебора всех веществ из базы данных возможно отобрать те соединения, которые обладают наименьшей энергией взаимодействия с белком-мишенью, и, следовательно, потенциально являются лучшими ингибиторами с более низкой действующей концентрацией.
Существует множество программных продуктов для осуществления молекулярного докинга, как свободно-доступных, так и коммерческих. Хотя используемые алгоритмы и детали реализации различаются в зависимости от конкретного программного решения, общие принципы, лежащие в основе метода молекулярного докинга, сходны, и могут быть разделены на две составляющих: перебор возможных конформаций лиганда в заданном сайте белка и оценка энергии взаимодействия лиганда и белка-мишени. Таким образом, происходит поиск конформаций низкомолекулярного вещества, в которой оно обладает минимальной (то есть, наилучшей) энергией взаимодействия с белком-мишенью. В качестве алгоритма перебора конформаций чаще всего используются различные варианты метода Монте-Карло, генетические алгоритмы и методы, основанные на реконструировании лиганда в активном центре. Потенциалы энергии взаимодействия обычно включают в себя оценку энергии Ван-дер-Ваальсовых межатомных взаимодействий, энергию водородных связей, электростатический потенциал, оценку энергии десольватации как белка, так и лиганда, а также энтропийные эффекты, связанные с ограничением степеней свободы лиганда при его связывании с белком. Из наиболее широко используемых и часто цитируемых в научной литературе программных реализации метода можно выделить AutoDock, Gold, FlexX, ICM и DOCK (Sousa S.F., Fernandes P.A., Ramos M.J. Protein-ligand docking: current status and future challenges. Proteins 2006; 65(1); 15-26).
Известные методы используют базы данных химических веществ, среди которых ищется ингибитор белка-мишени. Недостатком этих методов является необходимость моделировать взаимодействия каждого из веществ из выбранной базы данных с белком-мишенью, что требует значительного компьютерного времени в связи со значительными размерами обычно используемых баз данных химических соединений. Таким образом, желателен метод виртуального скрининга, позволяющий моделировать взаимодействие только части соединений из базы данных с белком-мишенью, и позволяющий, тем не менее, эффективно идентифицировать потенциальные ингибиторы.
Урогенитальный хламидиоз занимает первое место по распространенности среди бактериальных инфекций урогенитальной сферы (Andersen В., Ostergaard L., Nygård В., Olesen F. Urogenital Chlamydia trachomatis infections in general practice: diagnosis, treatment, follow-up and contact tracing. Fam. Pract. 1988; 15(3): 223-228). При этом наиболее серьезная проблема связана с осложнениями и хроническими состояниями, развивающимися в подавляющем большинстве случаев в отсутствии лечения на начальных этапах заболевания и являющимися ведущей причиной женского и мужского бесплодия, патологии беременности, артрита. Следует отметить, что, несмотря на принципиальное улучшение диагностики, обеспеченное внедрением молекулярных методов, и проведение национальных программ скрининга, урогенитальный хламидиоз и его осложнения имеют в последнее время угрожающую тенденцию к росту распространенности во всем мире, что свидетельствует об отсутствии эффективных лекарственных препаратов.
Респираторный хламидиоз, составляющий до 20% в структуре респираторных инфекций, часто протекает в стертой форме или бессимптомно, а больные не получают адекватной антибактериальной терапии. В результате этого, половина населения планеты перенесла респираторную хламидийную инфекцию в детстве или юношеском возрасте и является носителем возбудителя в течение всей жизни. Такая длительная персистенция патогена отнюдь не безобидна и может приводить к развитию хронического инфекционного процесса в различных тканях организма. Так, хорошо известно, что именно для возбудителя респираторного хламидиоза экспериментальными и клиническими данными доказана триггерная роль в развитии атеросклероза и астмы (Fazio G., Giovino M., Gullotti A. et al. Atherosclerosis, inflammation and Chlamydia pneumonia. World J. Cardiol. 2009; 1(1): 31-40; Ieven M.M., Hoymans V.Y. Involvement of Chlamydia pneumoniae in atherosclerosis: more evidence for lack of evidence. J. Clin. Microbiol. 2005; 43(1): 19-24; Zaitsu M. The development of asthma in wheezing infants with Chlamydia pneumoniae infection. J. Asthma. 2007; 44(7): 565-568).
За развитие хронических хламидиозов ответственны персистирующие формы хламидий. Они представляют собой метаболически активное состояние, характеризующееся специфическим профилем активности генов, что обеспечивает им наилучшую адаптацию к выживанию в макроорганизме. На основании изучения клинического материала, полученного от больных, было установлено, что персистирующие формы представляют собой не транзиторное состояние микроба в неблагоприятных условиях, а фактически являются одной из основных форм существования хламидий в организме хозяина (Hogan R.J., Mathews S.A., Mukhopadhyay S. et al. Chlamydial persistence: beyond the biphasic paradigm. Infect. Immun. 2004; 72(4): 1843-1855; Monack D.M., Mueller A., Falkow S. Persistent bacterial infections: the interface of the pathogen and the host immune system. Nature Rev. Microbiol. 2004; 2:747-765). Патогенетическое значение персистирующих форм хламидий определяется, в основном, двумя обстоятельствами. С одной стороны, они представляют собой форму длительного выживания и распространения патогена в организме хозяина, с другой, они сами ответственны за развитие тяжелых иммунопатологических состояний вследствие постоянной активации клеток иммунной системы, поддержания хронического воспаления, а также влияния на многие внутриклеточные процессы. Еще одной важной особенностью персистирующих форм хламидий является утрата ими чувствительности к антибиотикам. Молекулярные механизмы такой лекарственной устойчивости еще до конца не поняты. Это может быть связано как с изменением бактериальных мишеней для действия антибиотиков вследствие изменения метаболизма патогена, так и с нарушением системы транспорта соединений через клеточную стенку. Такая лекарственная устойчивость создает серьезную проблему лечения хронических хламидийных инфекций и фактически в настоящее время отсутствуют эффективные терапевтические препараты для борьбы с этими инфекциями.
Белок CPAF (Chlamydial Protease\proteasome-like Activity Factor) является протеазой хламидий, необходимой для выживания хламидийных включений внутри клетки-хозяина. Было показано, что он расщепляет многие транскрипционные факторы и структурные белки клетки хозяина, препятствуя презентации антигенов хламидий на поверхности зараженной клетки, блокируя индукцию апоптоза хозяйской клетки и способствуя росту хламидийных включений. Так, например, протеаза CPAF деградирует транскрипционные факторы RFX5 и USF-1, и именно с этой ее активностью связано подавление нормальной работы системы главного комплекса гистосовместимости, и, как следствие, отсутствие презентации хламидийных антигенов и неспособность Т-лимфоцитов распознать зараженные хламидиями клетки. Также, белок CPAF способен расщеплять компоненты системы промежуточных филаментов клетки-хозяина: кератин-8, цитокератин-18 и виментин, таким образом «разрыхляя» сеть промежуточных филаментов и обеспечивая беспрепятственный рост хламидийных включений. Чтобы предотвратить запрограммированную гибель клетки-хозяина - апоптоз - протеаза CPAF гидролизует ВН3-only белки, ингибирующие антиапоптозные белки и активирующие проапоптозные белки (Карягина А.С., Алексеевский А.В., Спирин С.А. и др. Эффекторные белки хламидий. Молекулярная биология 2009; 43(4): 1-22). Таким образом, белок CPAF, по-видимому, является одним из основных факторов патогенеза хламидий, что делает его перспективной мишенью при создании инновационных антихламидийных препаратов, нацеленных на механизмы вирулентности возбудителя.
Белок CPAF высоко консервативен среди родственных видов и штаммов хламидий и не имеет сколько-нибудь близких гомологов среди белков человека, что предполагает возможность создания ингибиторов этого белка, обладающих высокой специфичностью и не оказывающих прямого действия на протеолитические системы клеток человека.
Предлагаемый способ идентификации специфических ингибиторов фактора патогенности хламидий - протеазы CPAF - заключается в следующем.
1. Берут модель структуры протеазы CPAF. В случае если в модели отсутствуют координаты атомов водорода, соответствующие координаты восстанавливаются одним из известных в уровне техники способов. Определяют область активного центра как область, включающую все остатки, находящиеся на расстоянии не более чем заданное максимальное расстояние от аминокислотных остатков, непосредственно вовлеченных в катализ, либо от присутствующего в модели известного лиганда белка-мишени. В случае если указанная модель содержит ингибитор или природный лиганд белка-мишени, удаляют ингибитор или лиганд. Конформации аминокислотных остатков в области активного центра выбирают таким образом, чтобы они соответствовали каталитически-активному состоянию белка.
2. Далее берут электронное представление библиотеки низкомолекулярных соединений. Вещества из взятой библиотеки кластеризуют на основе сходства их химической структуры с помощью одного из известных в уровне техники способов (например, на основании фингерпринтов).
3. Далее из каждого кластера выбирают наиболее простое вещество - представитель кластера. В таком случае вещества из каждого кластера будут совпадать с представителем кластера по базовой структуре, но отличаться наличием различных заместителей.
4. Затем для каждого из выбранных представителей кластеров проводят молекулярный докинг в структуру белка-мишени с помощью известного в уровне техники программного обеспечения для молекулярного докинга. Вещества ранжируют по полученному ими в результате молекулярного докинга счету, отражающему вероятность вещества быть ингибитором белка-мишени. Из всех веществ - представителей кластеров из исходной библиотеки выбирают вещества, получившие счет не хуже заранее заданного, либо выбирают заданную долю веществ с лучшим счетом от всех представителей кластеров.
5. Далее для каждого отобранного представителя кластера из исходной базы данных выбирают все вещества, соответствующие этому кластеру.
6. Для веществ из полученной новой выборки снова осуществляют молекулярный докинг аналогично предыдущему. Далее вещества из новой выборки ранжируют по полученному в результате докинга счету и отбирают необходимое для экспериментального тестирования количество веществ с лучшим счетом. Предпочтительно отбираются вещества, принадлежащие к разным кластерам. Отобранные вещества являются потенциальными ингибиторами белка-мишени.
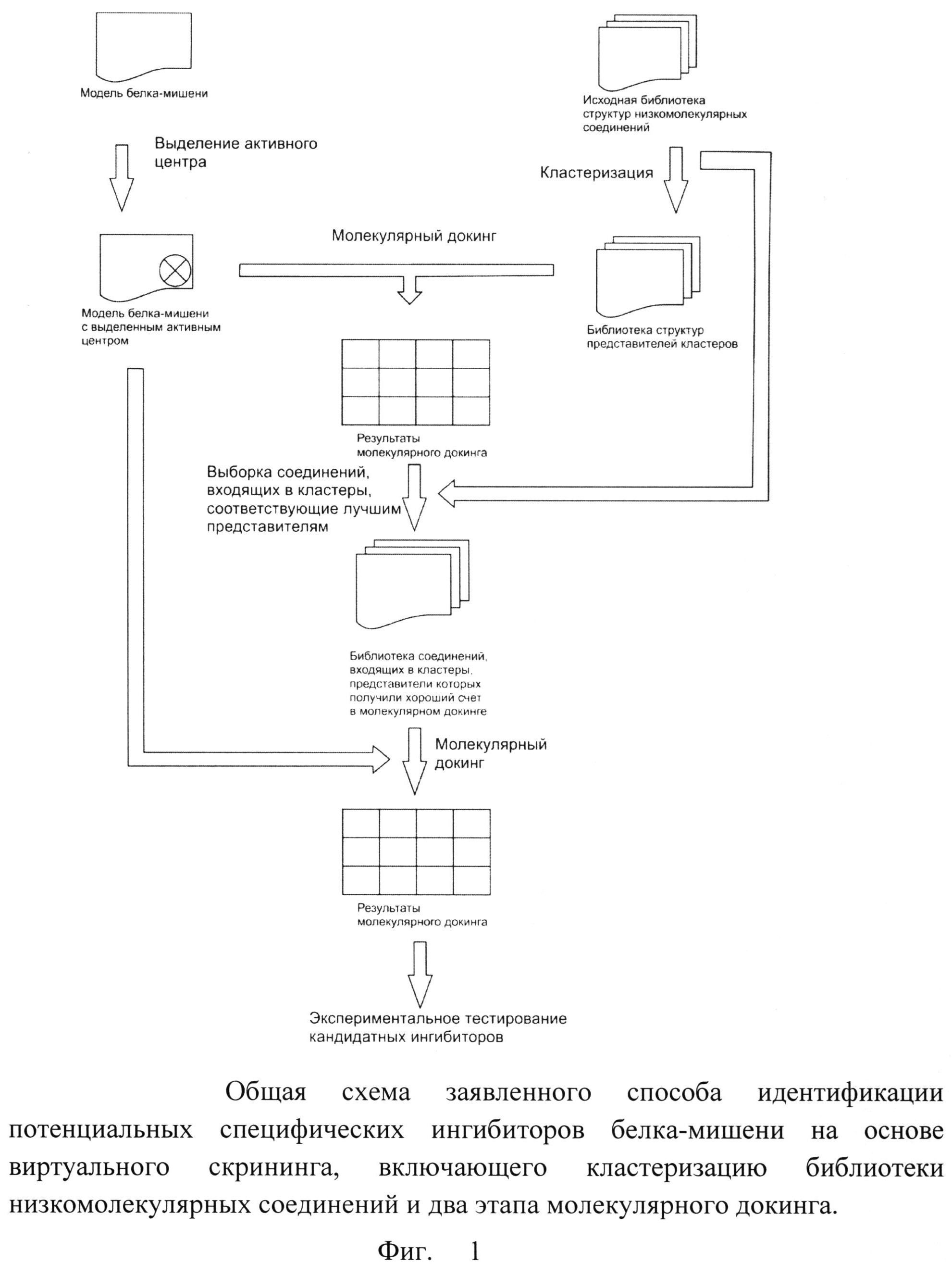
Суть описанной процедуры виртуального скрининга с предварительной кластеризацией библиотеки химических веществ заключается в том, что сначала определяется, может ли заданная базовая структура вещества быть пригодной для ингибирования белка-мишени, а затем определяется, какое из веществ с заданной базовой структурой будет ингибировать белок-мишень наилучшим образом. Сущность изобретения дополнительно поясняется с помощью схемы, представленной на фиг.1.
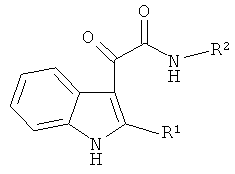
Таким образом, предлагается применение индол-3-ил глиоксиламидов, идентифицированных в качестве специфических ингибиторов CPAF указанным способом, для подавления хламидийной инфекции. Указанные индол-3-ил глиоксиламиды характеризуются общей формулой
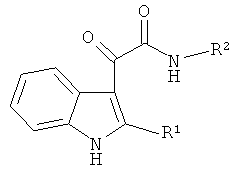
где R1 представляет собой Н, алкил C1-C5, Ph; R2 представляет собой пиридинил, Ar замещенный F, COOR3, а R3 представляет собой алкил C1-C5.
Индолил-3-глиоксиламиды III были получены ацилированием соответствующих 2-R индолов I оксалилхлоридом в безводном диэтиловом эфире при охлаждении (0-10°C) и последующей реакцией промежуточно образующихся индолил-3-глиоксилхлоридов II с соответствующим амином R2NH2.
Подавление хламидийной инфекции достигается за счет воздействия на хламидии эффективным количеством одного или смеси соединений из указанного класса индол-3-ил глиоксиламидов.
В качестве ближайшего аналога выделен патент RU 2402531 C2, в котором описываются гидразоны тиогидразидов оксаминовых кислот и их применение для подавления патогенных бактерий. Указанные вещества ингибируют систему секреции третьего типа, участвующую в переносе факторов вирулентности в хозяйскую клетку. Система секреции третьего типа присуща только патогенным штаммам микроорганизмов и не является необходимой для жизнедеятельности.
Технический результат выражается в сокращении компьютерного времени, требуемом для идентификации специфических ингибиторов заданного белка-мишени, в частности, фактора патогенности хламидий CPAF. Также достигаемый технический результат выражается в подавлении хламидийной инфекции без применения антибиотиков и других веществ, снижающих жизнеспособность бактерий, использование которых ведет к развитию устойчивости.
Изобретение иллюстрируется следующими примерами.
Пример 1. Выбор модели белка CPAF и области активного центра.
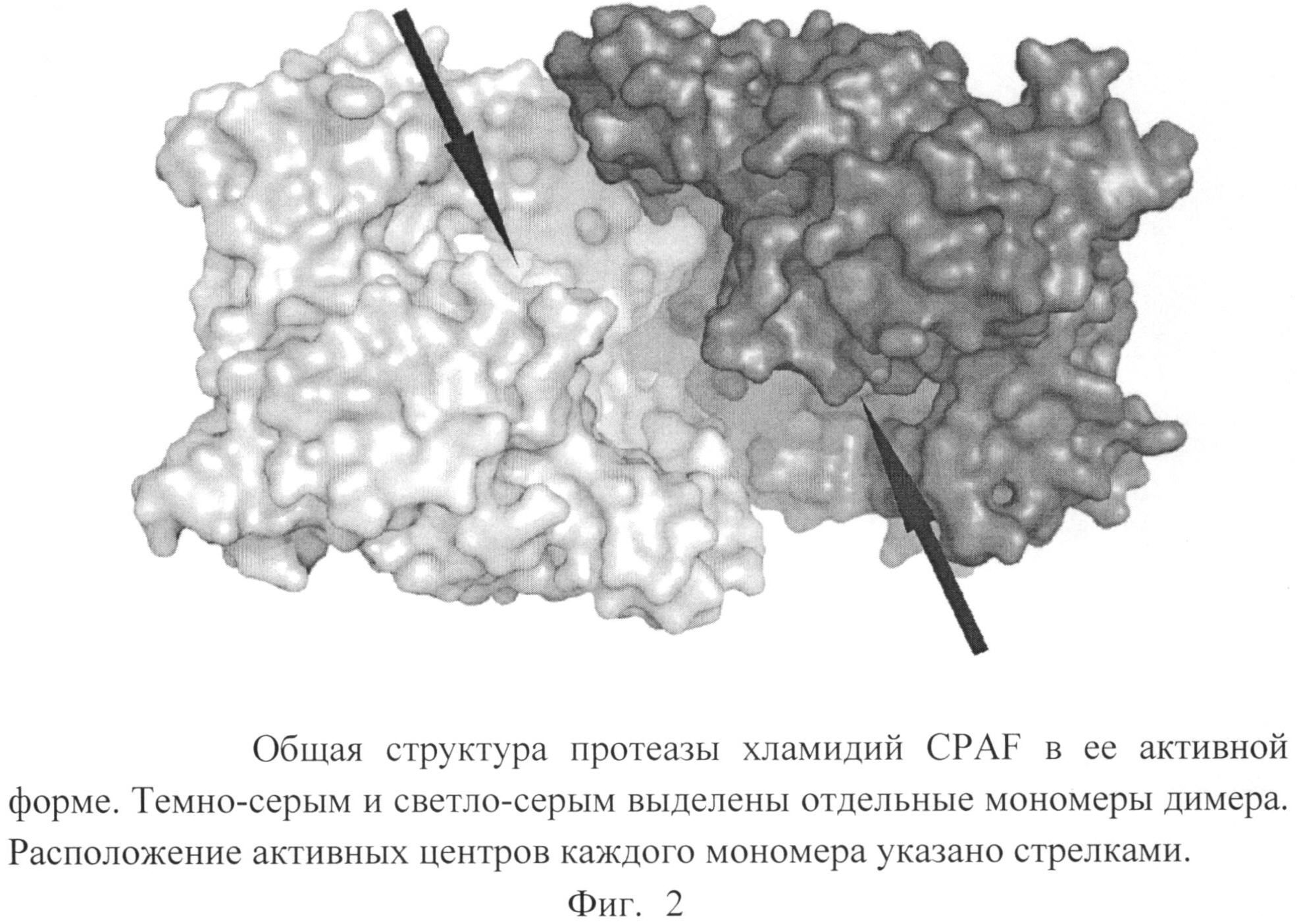
Для получения модели трехмерной структуры протеазы хламидий CPAF использовалась свободно-доступная база данных трехмерных структур макромолекул Protein Data Bank. Использовалась запись этой базы данных 3DPM, соответствующая белку CPAF в комплексе с низкомолекулярным ковалентным ингибитором лактацистином (омуралидом) (Huang Z., Feng Y., Chen D. et al. Structural basis for activation and inhibition of the secreted Chlamydia protease CPAF. Cell Host & Microbe 2008; 4: 529-542). Общая структура протеазы CPAF представлена на фиг.2.
В качестве области активного центра была выбрана область пространства, включающая все аминокислотные остатки, находящиеся на расстоянии 5Å от какого-либо атома омуралида (аминокислотные остатки 105, 333, 374, 375, 376, 377, 378, 398, 471, 498, 499, 500, 503, 526, 527, 528 согласно нумерации в модели 3DPM).
Затем координаты атомов омуралида были удалены из модели белка CPAF.
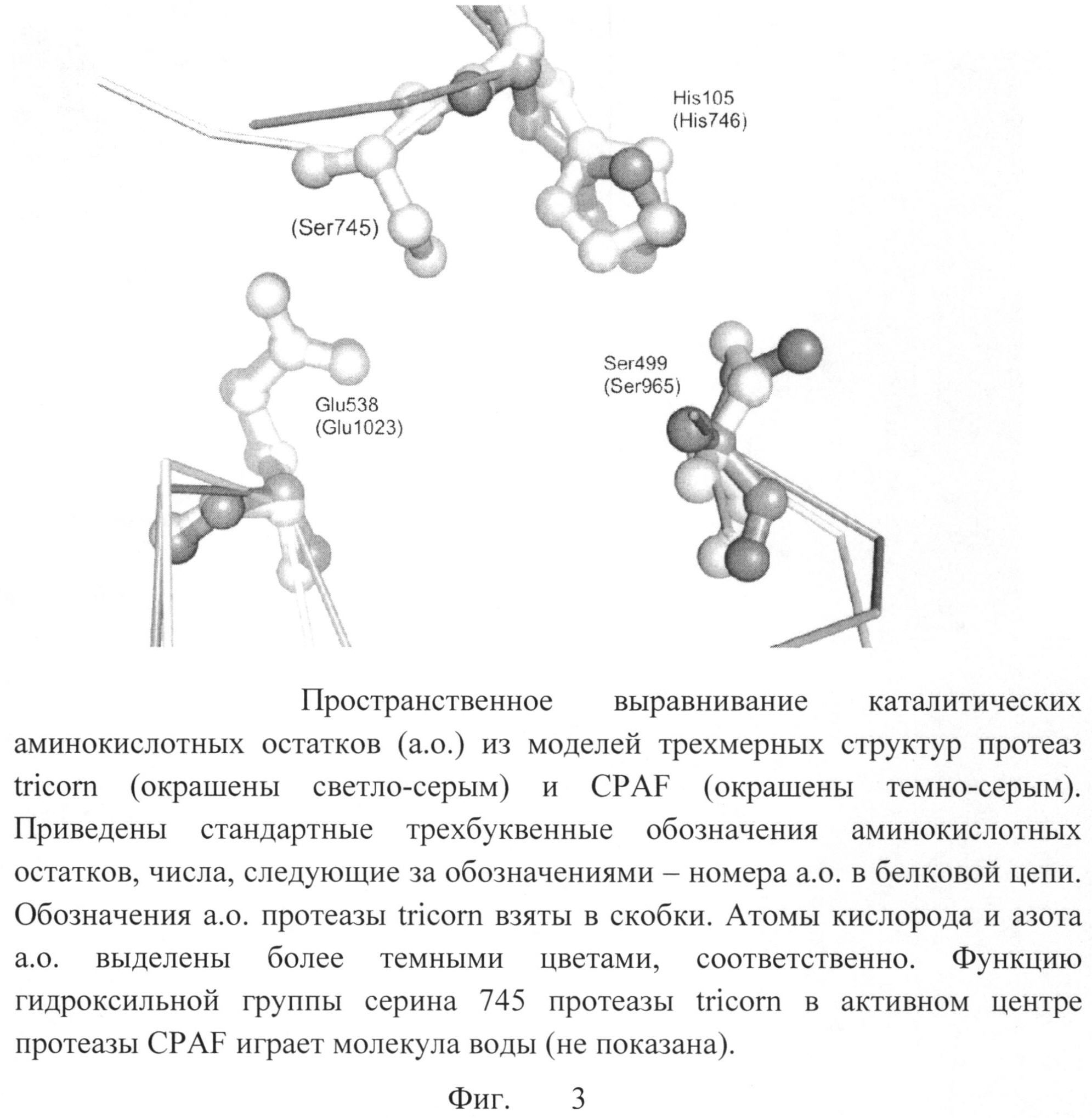
Были проанализированы конформации боковых цепей остатков активного центра (серина 499 и гистидина 105). Протеаза хламидий CPAF относится к группе сериновых протеаз, катализ в которых осуществляется с помощью гидроксильной группы боковой цепи остатка аминокислоты серина. В протеазе CPAF остаток серина 499 активируется за счет взаимодействия с гистидином 105. Таким образом, важна правильная взаимная ориентация этих остатков для воспроизведения каталитически активной конформации протеазы CPAF. Конформации каталитических остатков протеазы CPAF в модели 3DPM, а также в других моделях структуры протеазы CPAF (3DJA, 3DOR, 3DPN) не соответствуют конформациям, необходимым для каталитически активной протеазы. В связи с этим для каталитических остатков были взяты конформации соответствующих остатков другой сериновой протеазы - tricorn Thermoplasma acidophilum (PDB запись 1K32). Совмещение каталитических остатков протеазы CPAF, как они представлены в модели 3DPM, и каталитических остатков протеазы tricorn представлено на фиг.3.
Для боковых цепей других аминокислотных остатков, входящих в область активного центра, проводилась локальная минимизация энергии с помощью свободного программного обеспечения для молекулярного моделирования и молекулярной динамики GROMACS (Hess В., Kutzner С., van der Spoel D., Lindahl E. GROMACS 4: Algorithms for highly efficient, load balanced, and scalable molecular simulation. J. Chem. Theory Comput., 2008, 4(3), pp 435-447).
Пример 2. Виртуальный скрининг против активного центра протеазы CPAF.
Использовалась база данных химических структур низкомолекулярных соединений, записанная в известном в уровне техники формате SDF общим объемом 2071038 соединений. Для всех соединений из базы данных были удалены явно заданные атомы водорода. С помощью известного пакета программ OpenBabel для каждого вещества из базы данных были рассчитаны фингерпринты - двоичное представление химической структуры вещества. Затем на основе полученных фингерпринтов с помощью программы CD-HIT-FP вещества были разбиты на кластеры с порогом на вхождение в кластер, заданным как 80%-ное сходство по фингерпринтам с первым веществом в кластере.
В результате было получено 173026 кластеров низкомолекулярных соединений. Из каждого кластера было отобрано по одному наиболее простому соединению, определявшемуся по наименьшему количеству единиц в двоичном фингерпринте вещества. Таким образом было отобрано 173026 низкомолекулярных соединения соответственно.
Был проведен виртуальный скрининг отобранных представителей кластеров в активный центр модели структуры протеазы CPAF с помощью известной в уровне техники свободно распространяемой программы AutoDock (Morris G.M., Goodsell D.S., Halliday R.S. et al. Automated docking using a Lamarckian genetic algorithm and an empirical binding free energy function. J. Comput. Chem. 1998; 19(14): 1639-1662). При скрининге не учитывались низкомолекулярные вещества с молекулярной массой больше 1000 или меньше 100, с предсказанным значением logP больше 10 или меньше -5, количеством доноров и акцепторов водородных связей больше 10 и 20 соответственно.
Лучший результат показало соединение STOCK3 S-47883. Из результатов первого раунда скрининга были отобраны лучшие 7% представителей кластеров (12112 соединений). Для каждого из отобранных в результате первого раунда виртуального скрининга представителя кластера из исходных баз данных были извлечены вещества, входящие в соответствующие кластеры (то есть, сходные с ними более чем на 80% на основе бинарных фингерпринтов). В результате этого получилась библиотека размером 153575 веществ. В эту выборку входили вещества, получившие лучшие счеты в первом раунде скрининга, и вещества, схожие с ними по химической структуре.
Далее был проведен второй раунд скрининга в активный центр модели структуры протеазы CPAF. Скрининг проводился аналогично первому раунду, но с использованием описанной библиотеки из веществ, получивших лучшие счеты в первом раунде скрининга, и веществ, схожих с ними по химической структуре.
Лучшим результат показало соединение ASN05927738. В среднем лучшие 20% соединений имели молекулярную массу 436,9 Да, предсказанное значение logP 4,27 единиц, PSA (polar surface area - площадь поверхности полярных атомов) 69,13 Å2. Многие из веществ, получивших высокий счет, образуют водородные связи с атомами азота остатков 302, 303, 424 и 427 протеазы CPAF, а также участвуют в гидрофобных взаимодействиях боковыми с цепями остатков 395, 427, 475, 481. Из веществ, отобранных для экспериментальной проверки на основании полученных в молекулярном докинге счетов, наилучшую активность показали индол-3-ил глиоксиламиды.
Пример 3. Получение N-(4-Карбометокси-фенил)-2-(2-метил-1Н-индол-3-ил)-2-оксо-ацетамида (CL-62)
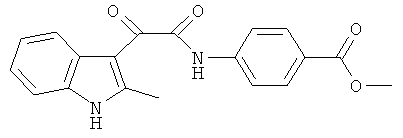
В 20 мл сухого тетрагидрофурана растворяют 2,19 гр (0,01 моль) (2-метил-1H-индол-3-ил)-оксо-ацетил хлорида (1) и 1,5 гр (0,01 моль) метилового эфира 4-аминобензойной кислоты и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из смеси этилацетат-гексан получают 1,2 гр кремовых кристаллов с т пл. = 238-240°C. Выход - 40%.
1H NMR (250 MHz, DMSO-d6) 12.28 (s, 1H), 11.18 (s, 1H), 8.01-7.88 (m, 5H), 7.45-7.42 (m, 1H), 7.23-7.15 (m, 2H), 3.85 (s, 3H), 2.62 (s, 3H)
Найдено (%): C 68.78 H 4.72, N 8.31. Вычислено (%): C 67.85, H 4.79, N 8.33. Масс-спектр, m/z: 336.
Пример 4: Получение N-(4-Карбометокси-фенил)-2-(1H-индол-3-ил)-2-оксо-ацетамида (CL-63)
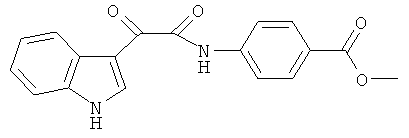
В 20 мл сухого тетрагидрофурана растворяют 2,1 гр (0,01 моль) (1H-индол-3-ил)-оксо-ацетил хлорида (2) и 1,5 гр (0,01 моль) метилового эфира 4-аминобензойной кислоты и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из смеси этилацетат-гексан получают 1,61 гр бежевых кристаллов с т пл. = 281-283°C. Выход - 54%.
1H NMR (300 MHz, DMSO-d6) 12.37 (s, 1H), 11.00 (s, 1H), 8.75 (s, 1H), 8.30-8.27 (m, 1H), 8.04-7.96 (m, 4H), 7.58-7.55 (m, 1H), 7.30 (d, 2H, J=9.0), 3.84 (s, 3Н).
Найдено (%): С 66.98 Н 4.32, N 8.61. Вычислено (%): С 67.08 Н 4.38, N 8.69. Масс-спектр, m/z: 322.
Пример 5: Получение N-(4-Карбометокси-фенил)-2-(2-фенил-1H-индол-3-ил)-2-оксо-ацетамида (CL-64)
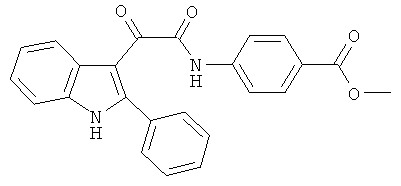
В 20 мл сухого тетрагидрофурана растворяют 2,82 гр (0,01 моль) (2-фенил-1H-индол-3-ил)-оксо-ацетил хлорида (3) и 1,5 гр (0,01 моль) метилового эфира 4-аминобензойной кислоты и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из смеси этилацетат-гексан получают 1,97 гр коричневых кристаллов с т пл. = 218-219°C. Выход - 50%.
1H NMR (400 MHz, DMSO-d6) 12.54 (br s, 1H), 10.91 (s, 1H), 8.11-8.07 (m, 1H), 7.63-7.47 (m, 5H), 7.46-7.17 (m, 7H), 3.82 (s, 3H).
Найдено (%): C 72.30, H 4.52, N 6.97. Вычислено (%): C 72.35, H 4.55, N 7.03. Масс-спектр, m/z: 398.
Пример 6: Получение N-(2,4-Дифтор-фенил)-2-(1H-индол-3-ил)-2-оксо-ацетамида (CL-65)
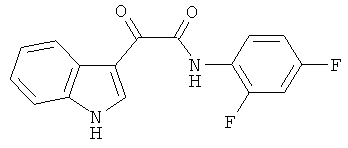
В 20 мл сухого тетрагидрофурана растворяют 2,1 гр (0,01 моль) (1H-индол-3-ил)-оксо-ацетил хлорида (2) и 1,3 гр (0,01 моль) 2,4-дифторанилина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из этилацетата получают 2,4 гр желтых кристаллов с т пл. = 241-243°C. Выход - 82%.
1H NMR (300 MHz, DMSO-d6) 12.34 (s, 1H), 10.39 (s, 1H), 8.78 (s, 1H), 8.31-8.25 (m, 1H), 7.84 (m, 1H), 7.60-7.54 (m, 1H), 7.42-7.38 (m, 1H), 7.38-7.27 (m, 2H), 7.18-7.12 (m, 1H).
Найдено (%): C 63.96, H 3.34, N 9.27. Вычислено (%): C 64.00, H 3.36, N 9.33. Масс-спектр, m/z: 300.
Пример 7: Получение N-(2,4-Дифтор-фенил)-2-(2-метил-1H-индол-3-ил)-2-оксо-ацетамида (CL-66)
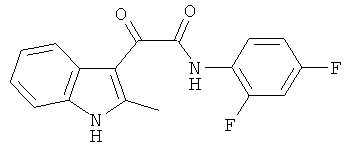
В 20 мл сухого тетрагидрофурана растворяют 2,19 гр (0,01 моль) (2-метил-1H-индол-3-ил)-оксо-ацетил хлорида (1) и 1,3 гр (0,01 моль) 2,4-дифторанилина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из этилацетата получают 1,1 гр кремовых кристаллов с т пл. = 215-217°C. Выход - 35%.
1H NMR (300 MHz, DMSO-d6) 12.23 (s, 1H), 10.68 (s, 1H), 8.01-7.98 (m, 1H), 7.85-7.77 (m, 1H), 7.45-7.35 (m, 2H), 7.23-7.13 (m, 3H), 2.64 (s, 3H).
Найдено (%): C 64.96, H 3.85, N 8.90. Вычислено (%): C 64.97, H 3.85, N 8.91. Масс-спектр, m/z: 314.
Пример 8: Получение N-(2-Пиридил)-2-(1H-индол-3-ил)-2-оксо-ацетамида (CL-67)
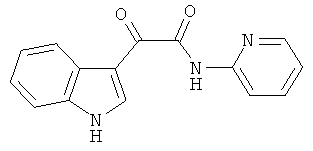
В 20 мл сухого тетрагидрофурана растворяют 2,1 гр (0,01 моль) (1H-индол-3-ил)-оксо-ацетил хлорида (2) и 1,0 гр (0,01 моль) 2-аминопиридина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Экстрагируют этилацетатом (3×50 мл) и отделяют органический слой, сушат над сульфатом натрия и упаривают растворитель досуха. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из смеси этилацетат-гексан получают 1,42 гр кремовых кристаллов с т пл. = 212-214°C. Выход - 53%.
1H NMR (300 MHz, DMSO-d6) 12.38 (s, 1H), 10.95 (s, 1H), 9.05 (m, 1H), 8.80 (m, 1H), 8.35 (d, 1H, J=4.5), 8.32-8.25 (m, 2H), 7.60-7.54 (m, 1H), 7.44-7.39 (m, 1H), 7.33-7.27 (m, 2H).
Найдено (%): C 67.90, H 4.08, N 15.79. Вычислено (%): C 67.92, H 4.18, N 15.84. Масс-спектр, m/z: 265.
Пример 9: Получение N-(2-Пиридил)-2-(2-метил-1H-индол-3-ил)-2-оксо-ацетамида (CL-68)
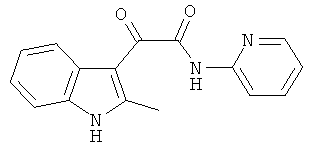
В 20 мл сухого тетрагидрофурана растворяют 2,19 гр (0,01 моль) (2-метил-1H-индол-3-ил)-оксо-ацетил хлорида (1) и 1,0 гр (0,01 моль) 2-аминопиридина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Экстрагируют этилацетатом (3×50 мл) и отделяют органический слой, сушат над сульфатом натрия и упаривают растворитель досуха. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из смеси этилацетат-гексан получают 1,31 гр бежевых кристаллов с т пл. = 209-21 ГС. Выход-47%.
1H NMR (300 MHz, DMSO-d6) 12.34 (s, 1H), 11.09 (s, 1H), 8.91 (m, 1H), 8.36 (m, 1H), 8.18 (m, 1H), 7.98-7.95 (m, 2H), 7.45-7.43 (m, 2H), 7.23-7.15 (m, 2H), 2.62 (s, 3H).
Найдено (%): C 68.80, H 4.64, N 15.00. Вычислено (%): C 68.81, H 4.69, N 15.04. Масс-спектр, m/z: 279.
Пример 10: Получение N-(2,3,4,5,6-Пентафтор-фенил)-2-(1H-индол-3-ил)-2-оксо-ацетамида (CL-69)
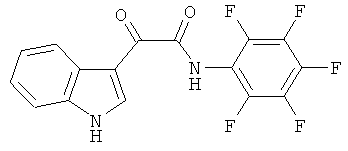
В 20 мл сухого тетрагидрофурана растворяют 2,1 гр (0,01 моль) (1H-индол-3-ил)-оксо-ацетил хлорида (2) и 0,9 гр (0,01 моль) 2,3,4,5,6-пентафторанилина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из смеси этилацетат-гексан получают 1,8 гр белых кристаллов с т пл. = 294-296°C. Выход - 51%.
1H NMR (300 MHz, DMSO-d6) 12.41 (s, 1H), 10.92 (s, 1H), 8.69 (s, 1H), 8.29-8.26 (m, 1H), 7.59-7.56 (m, 1H), 7.32-7.29 (m, 2H).
Найдено (%): C 54.20, H 1.94, N 7.87. Вычислено (%): C 54.25, H 1.99, N 7.91. Масс-спектр, m/z: 354.
Пример 11: Получение N-(2,3,4,5,6-Пентафтор-фенил)-2-(2-метил-1H-индол-3-ил)-2-оксо-ацетамида (CL-70)
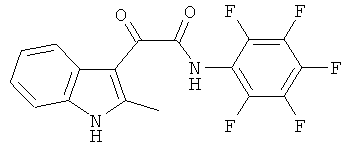
В 20 мл сухого тетрагидрофурана растворяют 1,1 гр (0,005 моль) (2-метил-1H-индол-3-ил)-оксо-ацетил хлорида (1) и 0,9 гр (0,005 моль) 2,3,4,5,6-пентафторанилина и прибавляют к реакционной смеси 10 мл триэтиламина одной порцией. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа, а затем кипятят в течение 3 часов. Затем растворитель упаривают на роторном испарителе досуха, к остатку приливают 100 мл воды. Выпавшие кристаллы отфильтровывают и сушат на фильтре Шотта. После перекристаллизации из смеси этилацетат-гексан получают 0,25 гр белых кристаллов с т пл. = 253-255°C. Выход - 20%.
1H NMR (300 MHz, DMSO-d6) 12.37 (s, 1H), 11.06 (s, 1H), 8.02-7.92 (m, 1H), 7.46-7.35 (m, 1H), 7.22-7.19 (m, 2H), 2.65 (s, 3H).
Найдено (%): С 55.41, H 2.44, N 7.57. Вычислено (%): C 55.45, H 2.46, N 7.61. Масс-спектр, m/z: 368.
Пример 12. Определение цитотоксического эффекта ингибиторов CPAF
А) Для определения токсичности в отношении эукариотической клетки использовали метод окрашивания клеток метиленовым синим (стандартная методика), с последующим спектрометрическим учетом результатов. Работу проводили в формате 96-луночных планшетов.
В суточном монослое клеток McCoy (гибридная линия синовиальных клеток человека и мышиных фибробластов) заменяли среду культивирования на свежую среду и вносили разные дозы исследуемых химических соединений. Клетки инкубировали в течение 24 часов в CO2 инкубаторе при 37°C. Спустя 24 часа из лунок отбирали культуральную среду и отмывали клетки 0,1 мМ раствором фосфатно-солевого буфера (ФСБ). Клетки фиксировали охлажденным метанолом (20 мкл) в течение 15 мин при 4°C. К фиксированным клеткам добавляли 40 мкл 0,5% метиленового синего и инкубировали 20 мин при комнатной температуре. После инкубации метиленовый синий отбирали из лунок и отмывали клетки ФСБ 4 раза. В лунки добавляли 100 мкл 5% додецилсульфата натрия (SDS) в ФСБ и инкубировали в течение 1 часа при комнатной температуре до полного лизиса клеток. Количество живых клеток определяли спектрофотометрически при длине волны 540 нм на фотометре MultiscanEX.
Б) Метод, направленный на определение метаболической активности клетки - MTT-тест (Niks M., Otto M. Towards an optimized MTT assay. // J Immunol. 1900. V.130, №1, p.149-151), основанный на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенил-тетразолия бромид, MTT) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток с образованием голубых кристаллов формазана, количество которого измеряется спектрофотометрически.
Исследование проводили в формате 96-луночного культурального планшета. В суточном монослое клеток McCoy заменяли среду культивирования на свежую среду и вносили разные дозы исследуемых химических соединений. Клетки инкубировали в течение 24 часов в CO2 инкубаторе при 37°C. За 4 часа до окончания эксперимента вносили 1:10 от объема культуральной среды 10х раствора МТТ (5 мг/мл). Инкубировали 4 часа при 37°C 5% CO2. Отбирали культуральную среду, отмывали однократно ФСБ. Добавляли в каждую лунку по 100 мкл изопропанола (пропанола-2). Инкубировали при комнатной температуре 30 минут. Оценивали оптическую плотность при длине волны 540 нм на фотометре Multiscan EX. Субстратное поглощение оценивали при 405 нм.
Экспериментальные данные, полученные двумя методами определения цитотоксического эффекта, были представлены значением pIC50 (отрицательный десятичный логарифм величины IC50). Величина IC50 (ингибирующая концентрация) является количественной оценкой, показывающей концентрацию вещества, необходимого для 50% гибели клеток.
Пример 13. Суспензионное заражение эукариотических клеток хламидиями.
Метод суспензионного заражения эукариотических клеток хламидиями позволяет стандартизовать проведение биологических экспериментов в скрининговом формате на 96-луночных планшетах. Для получения суспензии клеток использовали суточный монослой клеток McCoy, который обрабатывали раствором трипсина и версена (соотношение 1:3, соответственно) для открепления клеток от поверхности флакона. Флакон помещали в термостат на 5 мин. Затем отбирали раствор трипсина и версена и клетки суспендировали в среде культивирования (RPMI 1640 с 10% фетальной сывороткой).
Для получения монослоя из приготовленной клеточной суспензии производили подсчет клеток в камере Горяева из расчета 1,5×105 кл/мл. Заражение клеток штаммом Bu-434 Chlamydia trachomatis серовар L2 производили в соотношении бактерия: клетка 1:1 в необходимом объеме транспортной среды (среда RPMI с 5% фетальной сывороткой, 25 мМ раствора глюкозы, 5 мкг/мл амфотерицина и 4 мкг/мл гентамицина), что обеспечивает 80-90% инфицирование клеток. Готовую суспензию вносили в лунки 96- или 24-луночных планшетов в объеме 100 мкл или 1000 мкл, соответственно. Для осаждения клеток и стимуляции взаимодействия с ними хламидий планшеты центрифугировали при 3000 об/мин 1 час при температуре 25°C. После этого планшет помещали в CO2 инкубатор на 48 ч при 37°C.
Пример 14. Определение влияния на внутриклеточное размножение хламидий.
Исследуемые химические соединения в разных концентрациях вносили в культуру клеток одновременно с патогеном для оценки их влияния на внутриклеточное размножение хламидий. Эффект оценивали методом прямой иммунофлюоресценции.
Методы иммунофлюоресценции направлены на выявление объектов, содержащих некоторый антиген, и основаны на обработке препаратов соответствующими антителами, меченными флюорохромом, с последующей микроскопией в ультрафиолетовом луче.
В данной работе использован метод прямой иммунофлюоресценции (стандартная методика), позволяющий проводить полуколичественный учет развития хламидийной инфекции при использовании моноклональных антител к видоспецифическому белковому антигену C.trachomatis.
Работу проводили на клеточных линиях McCoy, инфицированных методом суспензионного заражения Bu-434 С.trachomatis серовар L2 в формате 96-луночных планшетов или 24-луночных со стеклами. Исследуемые химические соединения добавляли в разных дозах непосредственно при заражении клеток. Через 48 ч из лунок отбирали надосадок и фиксировали клетки. При работе с 96-лу ночными планшетами фиксацию осуществляли ледяным 72° этанолом с последующим помещением планшета на 30-40 мин на -20°C. При работе с 24-луночными планшетами стекла промывали в 0,1 мМ растворе ФСБ и высушивали. После этого клетки фиксировали ацетоном в течение 15 мин при комнатной температуре. На фиксированные клетки наносили 30-50 мкл моноклональных, меченных ФИТЦ антител к белковому антигену С.trachomatis (ХлаМоноСкрин-2, ООО «НИАРМЕДИК ПЛЮС»), и инкубировали в течение 30 мин во влажной камере при 37°C. После инкубации клетки промывались 2 раза раствором ФСБ. Препарат полностью высушивали. В формате 24-луночных планшетов, подготовленные таким образом стекла монтировали на предметное стекло при помощи монтирующей жидкости (глицерин в ФСБ). Готовые препараты исследовали в люминесцентном микроскопе.
Пример 15. Определение специфического подавления фактора патогенности хламидий - белка CPAF.
Для определения специфического подавления фактора патогенности хламидий - протеазного белка CPAF был использован Вестерн блот, который является аналитическим методом для определения специфических белков в образце. На первом этапе проведения блота используется электрофорез белков в полиакриламидном геле для разделения денатурированных белков по длине. Затем белки переносятся на нитроцеллюлозную мембрану и далее детектируются с использованием антител, специфичных к заданному белку.
Нуклеарный экстракт был получен из клеточных линий HeLa с помощью набора для выделения NE-PER nuclear and cytoplasmic extraction kit (Thermo Scientific). Ферментативную активность белка CPAF и его подавление под действием исследуемых соединений оценивали in vitro. Реакционная смесь, содержащая 15 мкл TBS или раствор ингибитора соответствующего разведения (0,5 - 1 mM) и 2 мкл CPAF (0.07 mg/ml), претерпевала инкубацию при комнатной температуре в течение 15 минут. Затем к приготовленной реакционной смеси добавляли 3 мкл нуклеарного экстракта (0,85 мкг/мл) и инкубировали еще час при 37°C. Затем к пробам вносили Laemmli sample buffer и инкубировали в течение 5 минут при 95°C. Протеолитическая активность белка измерялась в условиях деградации субстрата - трансляционного фактора RFX5 в присутствии протеазы CPAF. Для детекции белка использовали кроличью сыворотку, специфичную к RFX5 в разведении 1:1000 (Rockland Immunochemicals, Inc. Gilbertsville, PA, USA, #200-401-194).
Пример 16. Влияние индол-3-ил глиоксиламидов на жизнеспособность эукариотических клеток.
Анализ токсичности 10 исследуемых соединений в условиях in vitro при добавлении в среду культивирования эукариотических клеток в дозах 25, 50 и 100 мкМ и последующим инкубированием в течение 24 часов при 37°C, проведенный методами А и Б примера 12, выявил отсутствие негативного влияния на жизнеспособность эукариотических клеток соединений класса индол-3-ил глиоксиламидов. Результаты представлены в таблице 1.
Экспериментальные данные, представленные значениями IC50 (50% ингибирующая концентрация, М), были переведены в логарифмы pIC50=-log10IC50. Диапазон pIC50 составил с 2 до 4. На основании оценки результатов изучения токсичности 10 отобранных соединений с использованием двух стандартных токсикологических тестов можно сделать вывод, что все соединения являются нетоксичными. Все тестируемые соединения вызывали гибель не более 10% клеток, что соответствует pIC50 в диапазоне с 2 до 3,5 (метиленовый тест) и подавляли метаболизм не более чем 15% клеток (МТТ тест). Таким образом, основываясь на полученных экспериментальных данных, все 10 низкомолекулярных химических соединений являются малотоксичными для эукариотических клеток.
Пример 17. Влияние индол-3-ил глиоксиламидов на развитие хламидийной инфекции в культуре клеток.
С целью изучения влияния индол-3-ил глиоксиламидов на развитие хламидийной инфекции в культуре клеток ингибиторы в разных концентрациях: 25, 50 и 100 мкМ вносили в культуру клеток одновременно с патогеном С.trachomatis. Через 48 ч инкубации проводили анализ ингибирующего влияния на развитие инфекции по следующим критериям: изменение морфологических характеристик и подавление инфекционности патогена
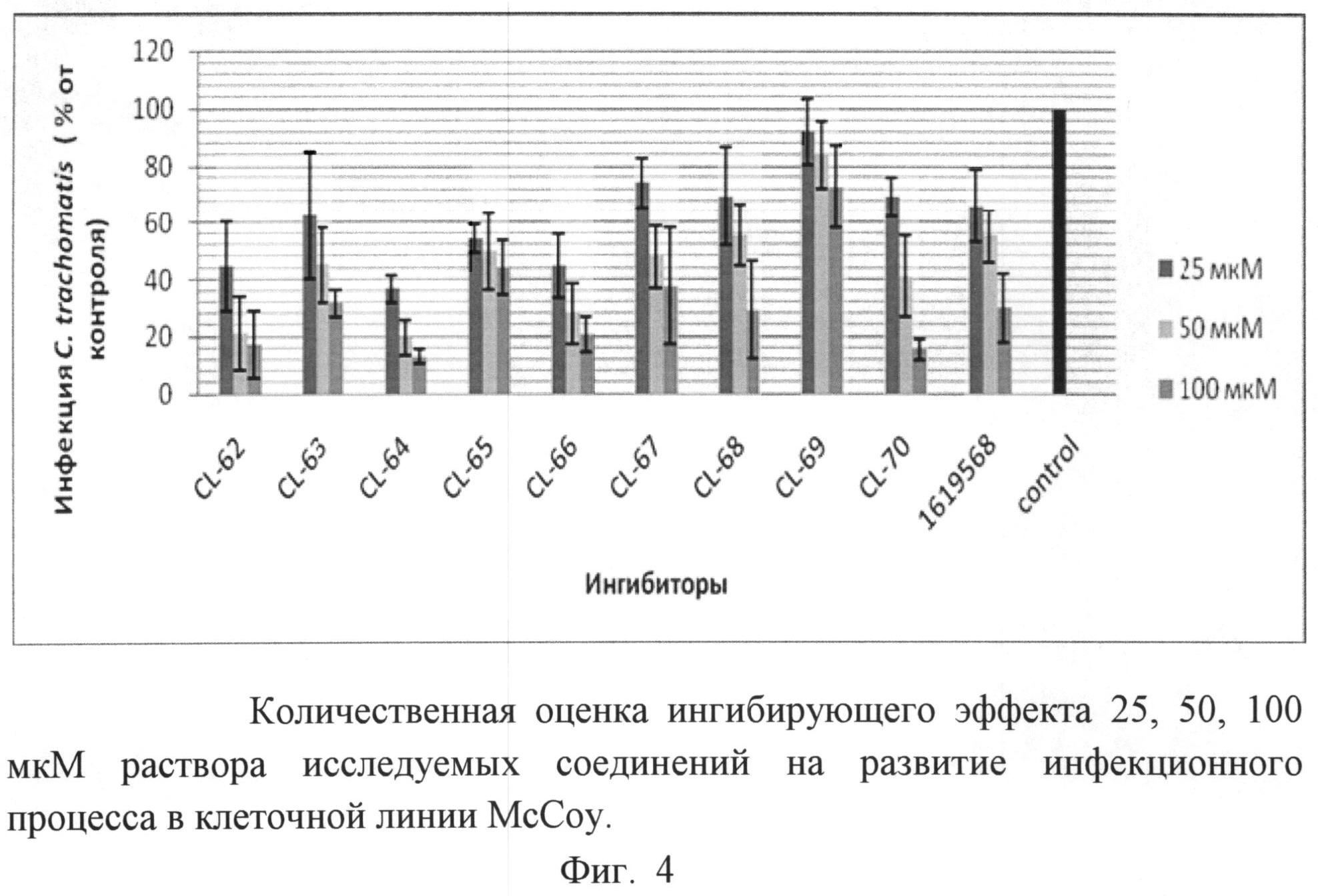
Ингибирующую активность соединений оценивали на клеточной линии McCoy, инфицированной С.trachomatis, при внесении разных концентраций соединений на этапе заражения клеток. В качестве контроля использовали зараженные хламидиями эукариотические клетки. Способность 10 соединений подавлять внутриклеточный жизненный цикл хламидий в условиях in vitro оценивалась при помощи методов, описанных в примерах 13, 14. Результаты представлены на фиг.4.
Морфологическая характеристика действия испытуемых соединений на хламидийную инфекцию показала выраженное ингибирующее действие на количество инфицированных клеток в монослое и размеры внутриклеточных хламидийных включений.
Как видно из фиг.4, синтезированные вещества подавляли внутриклеточное развитие хламидийной инфекции в прямой зависимости от дозы соединений.
Анализ эффективности указанных выше соединений выявил, что соединения CL-62 и CL-64 оказывали выраженный ингибирующий эффект в дозе 50 мкМ, подавляя инфекцию на ~80%. Соединения CL-63, 65, 66, 67, 70 в той же концентрации подавляли внутриклеточное развитие C.trachomatis на 50-70%. Соединения CL-68 и CL-69 в дозе 50 мкМ уменьшали количество хламидийных включений только на 35% и 18%, соответственно. Для соединений CL-62, CL-64, CL-66 и CL-70 было характерно подавление инфекционного процесса в дозе 100 мкМ более чем на 80% (рис.4). Остальные соединения (CL-63, 65, 67, 68) в концентрации 100 мкМ ингибировали внутриклеточное развитие C.trachomatis на ~60%. При действии ингибиторов размеры включений уменьшались, что свидетельствует об ингибировании размножения патогена. Соединение CL-69 оказывало наименьший подавляющий эффект на развитие хламидийной инфекции, оставались множественные включения.
Итак, наилучший эффект оказывали соединения CL-62 и CL-64, подавляя жизнеспособность хламидий более чем на 80% при концентрации 50 мкМ в условиях добавления соединений в транспортную среду одновременно с инфекционным материалом (штамм C.trachomatis L2) и последующего культивирования в течение 48 часов. Показано, что в данных условиях инфицированные клетки в анализируемом монослое практически отсутствуют (на фиг.5 показано влияние этих соединений на внутриклеточное развитие хламидийной инфекции в условиях in vitro через 48 часов). Использование разных концентраций этих соединений показало зависимый от дозы препарата эффект подавления инфекции в культуре клеток.
Пример 18. Влияние индол-3-ил глиоксиламидов на активность протеазы C.trachomatis, белка CPAF.
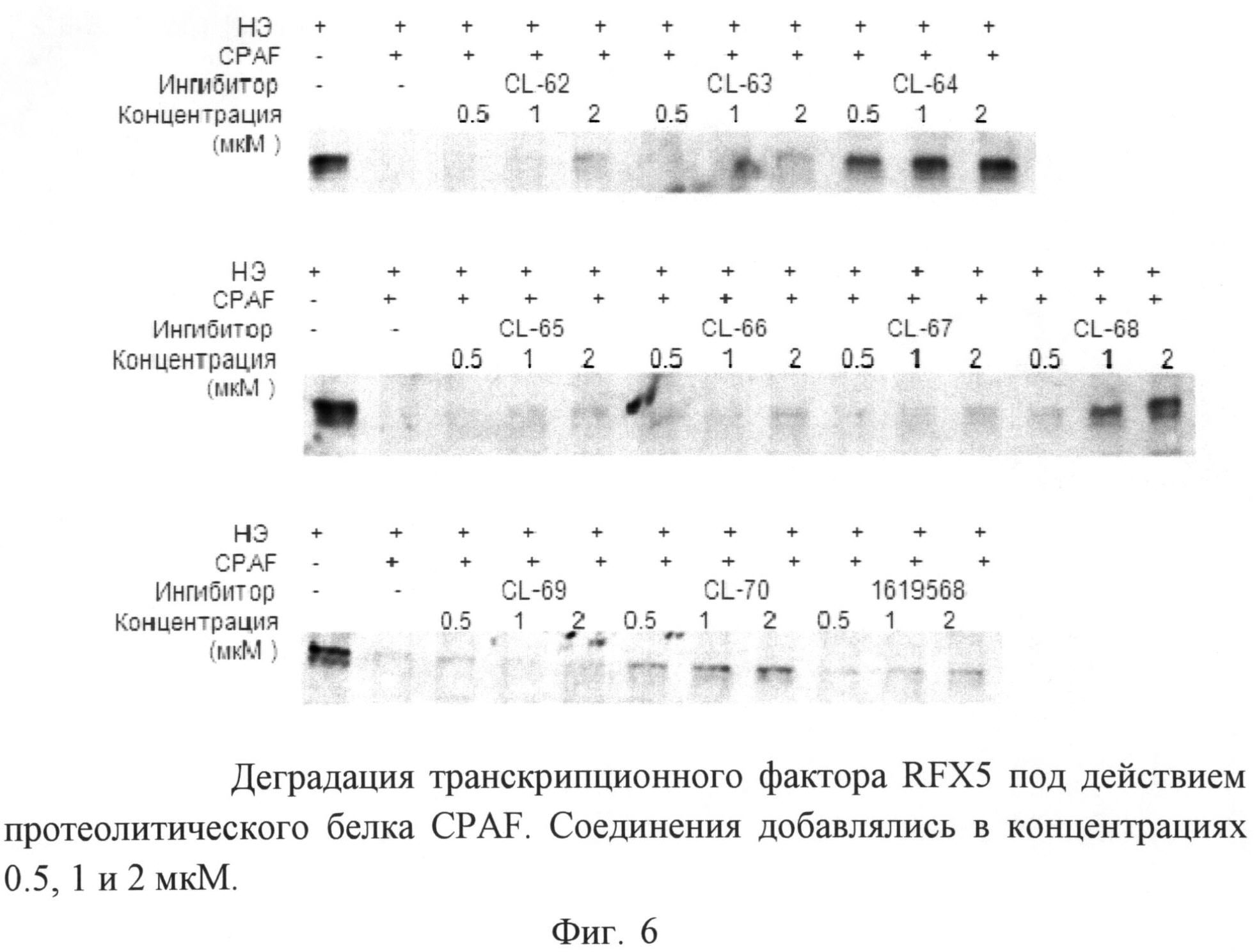
Протеазный белок CPAF секретируется патогеном C.trachomatis в цитозоль инфицированной клетки хозяина, где расщепляет многие транскрипционные факторы, проапоптозные белки и белки промежуточных филаментов. Таким образом, при добавлении к клеточному экстракту, содержащему транскрипционный фактор RFX5, рекомбинантного белка CPAF, мы наблюдали деградацию субстрата. При добавлении к протеазному белку раствора ингибиторов в разных концентрациях, соединения CL-64, CL-68 и CL-70 ингибировали протеолитическую активность белка CPAF (фиг.6). При этом соединение CL-64 проявило наилучшую ингибирующую активность, поскольку блокировало деградацию транскрипционного фактора RFX5 белком в концентрации 0,5 мкМ.
Остальные соединения ингибировали CPAF в той или иной степени только в концентрации 2 мкМ, при этом их ингибирующая активность была в несколько раз ниже, чем при добавлении соединения CL-64.
|