Результат интеллектуальной деятельности: Аминокислотные производные 2-норборнануксусной кислоты и их противогриппозная активность
Вид РИД
Изобретение
Изобретение относится к фармакологии и вирусологии и касается соединений, в том числе и новых, являющихся производными 2-норборнануксусной кислоты, применяемых в качестве средств, обладающих противовирусной активностью. Предлагаемые соединения можно рекомендовать для создания новых противовирусных препаратов, с использованием как в виде индивидуального средства, так и в составе композиций.
Грипп является серьезным инфекционным заболеванием, которое представляет опасность для жизни, особенно для детей, пожилых людей и пациентов с ослабленным иммунитетом. В некоторых странах от сезонного гриппа ежегодно страдает до 40% населения. Ежегодно в мире заболевает до 500 млн. человек, 2 миллиона из которых умирают, чаще всего от осложнений [1]. Новые штаммы высоковирулентного вируса гриппа могут появиться неожиданно и вызвать всемирные пандемии с высоким уровнем заболеваемости и смертности.
Стратегия борьбы с сезонными и пандемическими штаммами вируса гриппа включает в себя создание вакцин против гриппа и разработку новых противогриппозных препаратов. В настоящее время разработка противовирусных препаратов представляется наиболее перспективной стратегией в области контроля и профилактики инфекций, вызванных сезонным и пандемическим гриппом. Противовирусные препараты могут преодолеть ограничения, присущие вакцинным препаратам. В частности, затраты времени на молекулярный дизайн ежегодной вакцины, недостаточная защита для пациентов с ослабленным иммунитетом и непредсказуемые изменения антигенной структуры штаммов вируса гриппа снижают эффективность вакцинации. В настоящий момент основное внимание уделяется разработке ингибиторов вирусного фермента нейраминидазы. Представителями этого класса ингибиторов являются тамифлю (Tamiflu®) и реленза (Relenza®), которые были утверждены ВОЗ в качестве основных лекарственных средств для профилактики и лечения гриппозных инфекций [2].
На данный момент известны случаи формирования резистентности к озельтамивиру, так, к нему была резистентна практически вся популяция сезонных штаммов вируса гриппа A(H1N1) [3, 4]. В частности было показано, что невосприимчивость к озельтамивиру у штаммов вируса гриппа А(H1N1) обусловлена мутацией в участке H275Y в последовательности генома, кодирующего нейраминидазу. Однако штамм А(H1N1) оставался чувствительным к занамивиру (реленза). Вероятно, это связано со значительно меньшими объемами использования препарата релензы в качестве средства для профилактики и лечения гриппа, чем препарата тамифлю [2].
Помимо ингибиторов нейраминидазы существуют препараты - блокаторы функции ионного канала М2: римантадин гидрохлорид и 1-аминоадамантан гидрохлорид (амантадин). Ингибирующее действие этих соединений направлено на угнетение функции протон-проводящего канала М2 в оболочке вируса. Белок М2, который образует тетрамерный канал в оболочке вируса гриппа, является типичным представителем семейства виропоринов. Виропорин М2 вируса гриппа А отвечает за однонаправленный транспорт протонов внутрь вирусной частицы. Высокая селективность и сродство канала М2 именно к ионам водорода обусловлены особым строением гидрофобного трансмембранного (ТМ) домена, который содержит остатки гистидина в положении 37 (His37) и триптофана в положении 41 (Trp41). Поставщиками протонов из клетки-хозяина служат ионы гидроксония (H3О+). Они подходят к кольцу имидазольного сопряжения гистидинов и соединяются водородными связями с атомом азота, а при изменении конфигурации кольца переходят во внутреннее пространство вирусной частицы [5]. Конформационное изменение положения остатков гистидина после протонирования имидазольных колец является результатом электростатического отталкивания, что приводит к расширению канала в районе His37 и пропускает протоны внутрь. Конформационный скачок снимает избыточный заряд ионов имидазолия, и гистидины возвращаются в нейтральное состояние [6]. Таким образом, канал М2 представляет собой мишень, на которую направлено действие препаратов адамантанового ряда. Активность молекул римантадина и амантадина была связана с образованием водородной связи между аминогруппой карбоцикла и гидроксильной группой остатка серина в положении 31 (Ser31) внутри поры канала М2. В последние годы вследствие мутационной замены Ser31 на аспарагин (S31N) циркулирующие вирусы гриппа приобрели устойчивость к препаратам адамантанового ряда, и их применение для лечения и профилактики является неэффективным [7]. Для преодаления резистентности к препаратам адамантанового ряда проводятся исследования по созданию синтетических препаратов пептидной природы на основе адамантанового и других карбоциклов, являющихся ингибиторами вирусных ионных каналов. Ранее нами был предложен способ преодоления резистентности вирусов гриппа А к препаратам адамантанового ряда путем введения новых функциональных групп (карбоксильной, гидроксильной, имидазольной, индольной и др.) в аминоадамантановый карбоцикл с использованием для этого аминокислот, пептидов или других физиологически важных соединений. Полученный ряд адамантил-аминокислот и пептидов способен ингибировать высокопатогенные штаммы вирусов гриппа А, включая и такие как A/H1N1pdm09, A/H5N1, A/H3N2 и др [8].
Ингибиторы функции белка М2, как правило, состоят из гидрофобной части молекулы (в препаратах амантадин и римантадин - адамантан), соединенной с полярной функциональной группой. В амантадине или римантадине заместитель представлен амино- или эти л аминогруппой. Адамантильный остаток может быть заменен на другие гидрофобные группы, в том числе сопряженные и спиро-сопряженные мультициклические алканы, разветвленные ациклические алканы и силаны [9, 10]. Эти соединения показали достаточную активность в отношении дикого типа, а некоторые были весьма активны в отношении мутантов V27A и L26F [10, 11]. Однако ни одно из этих производных не показало противовирусной активности в отношении штаммов, несущих замену S31N в М2, превосходящей активность амантадина. Так же блокаторами виропоринов могут быть гексаметиленамилорид и длинноцепочечные производные ацилиминосахаров [12].
В ряду известных соединений норборнана выраженная противовирусная активность зарегистрирована в случае 2-(1-аминоэтил)норборнана, в частности в форме гидрохлорида (дейтифорина):
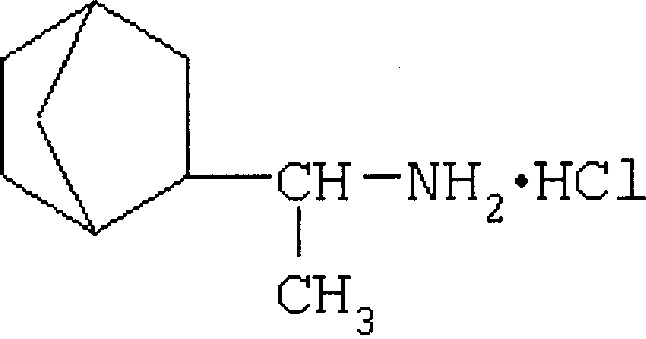
Препарат обладает противовирусной активностью в отношении серотипов вируса гриппа типа А; парагриппа 3 типа и РС-вируса [7].
По химической структуре, биологической активности и клиническим показаниям дейтифорин является близким аналогом римантадина (1-(1-аминоэтил) адамантан гидрохлорида) который также высокоактивен в отношении ряда штаммов вируса гриппа А [13, 14]
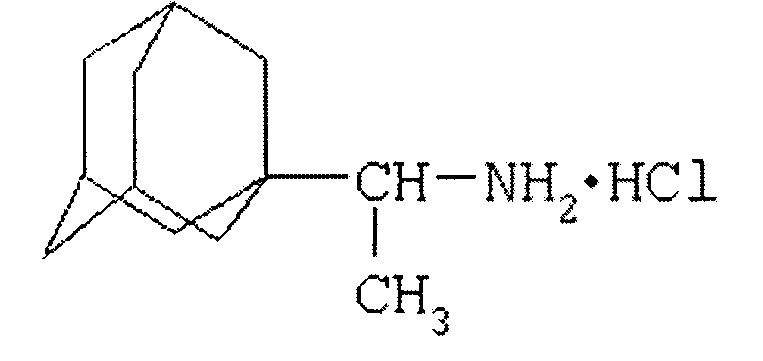
Однако соединения адамантанового ряда (каркасные трициклы) имеют более сложное химическое строение, чем норборнановые аналоги (бициклы), что обусловливает значительно более сложный синтез и меньшую доступность адамантановых соединений по сравнению с норборнановыми. Кроме того, адамантановые абиотики в целом более токсичны, чем аналогичные производные норборнана, который составляет основу ряда природных бициклических терпеноидов (камфора, камфен, борнеол, изоборнеол, фенхен, фенхон и др.) [14].
Появление новых вариантов гриппа, устойчивых к лекарственным средствам, подчеркивает необходимость в инновационной стратегии разработки новых препаратов с улучшенным противовирусным эффектом и безопасных для организма человека. Разработка противовирусных средств, ориентированных на белки клетки хозяина, которые играют важную роль в репликации вируса, также активно развивается в последнее время. Кроме того, комбинированная терапия, основанная на применении двух или более различных противовирусных средств, представляет собой перспективный подход к борьбе с гриппозной инфекцией.
Известно, что соединения адамантанового ряда (каркасные трициклы) имеют более сложное химическое строение, чем норборнановые аналоги (бициклы), что обусловливает значительно более сложный синтез и меньшую доступность адамантановых соединений по сравнению с норборнановыми. Кроме того, адамантановые абиотики в целом более токсичны, чем аналогичные производные норборнана, который составляет основу ряда природных бициклических терпеноидов (камфора, камфен, борнеол, изоборнеол, фенхен, фенхон и др.).
Таким образом, есть все предпосылки полагать, что синтетические производные 2-норборнануксусной кислоты с остатками аминокислот и пептидов ввиду их значительной активности и низкой токсичности могут претендовать на модель для создания новых противовирусных препаратов против современных штаммов гриппа А.
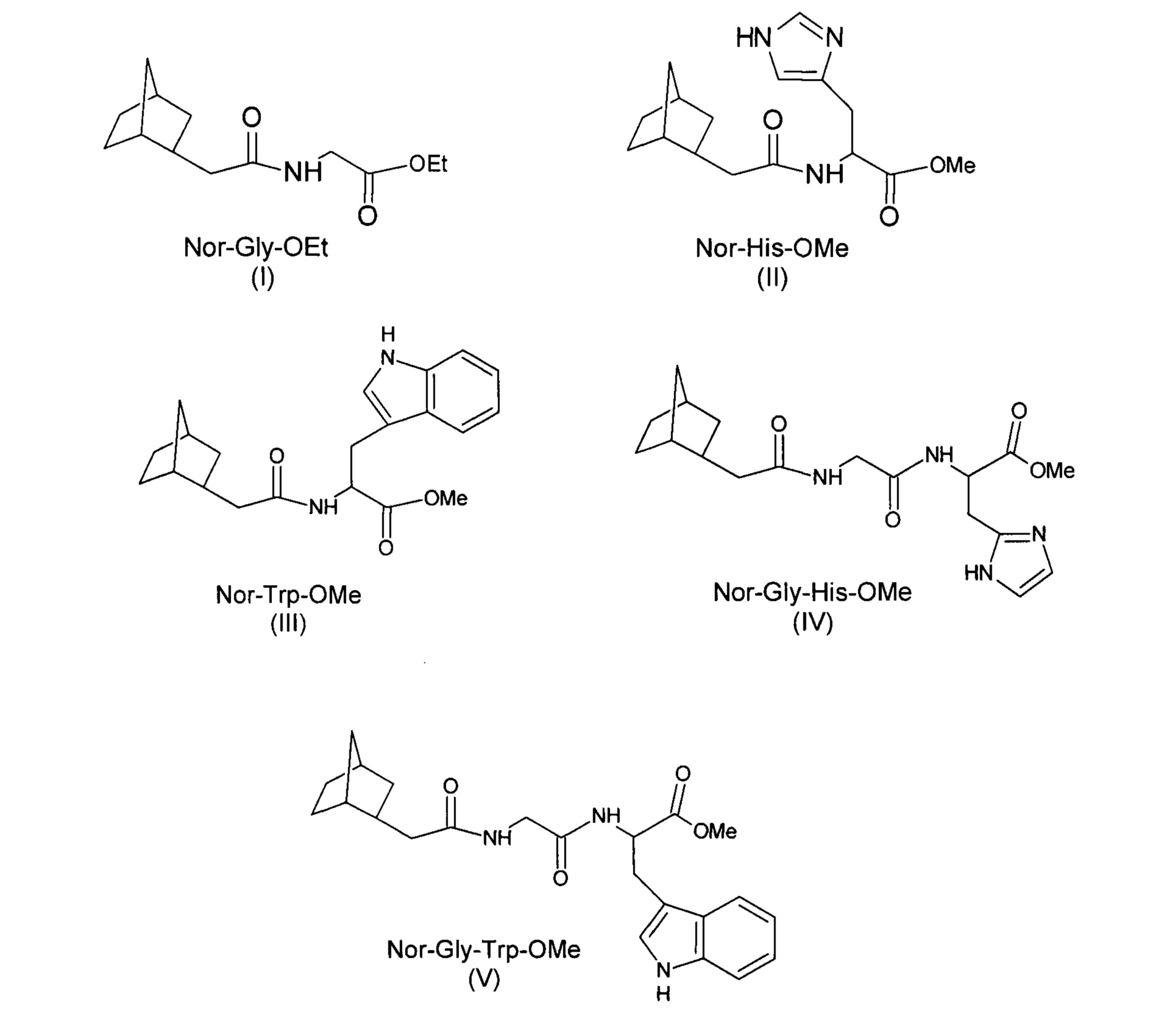
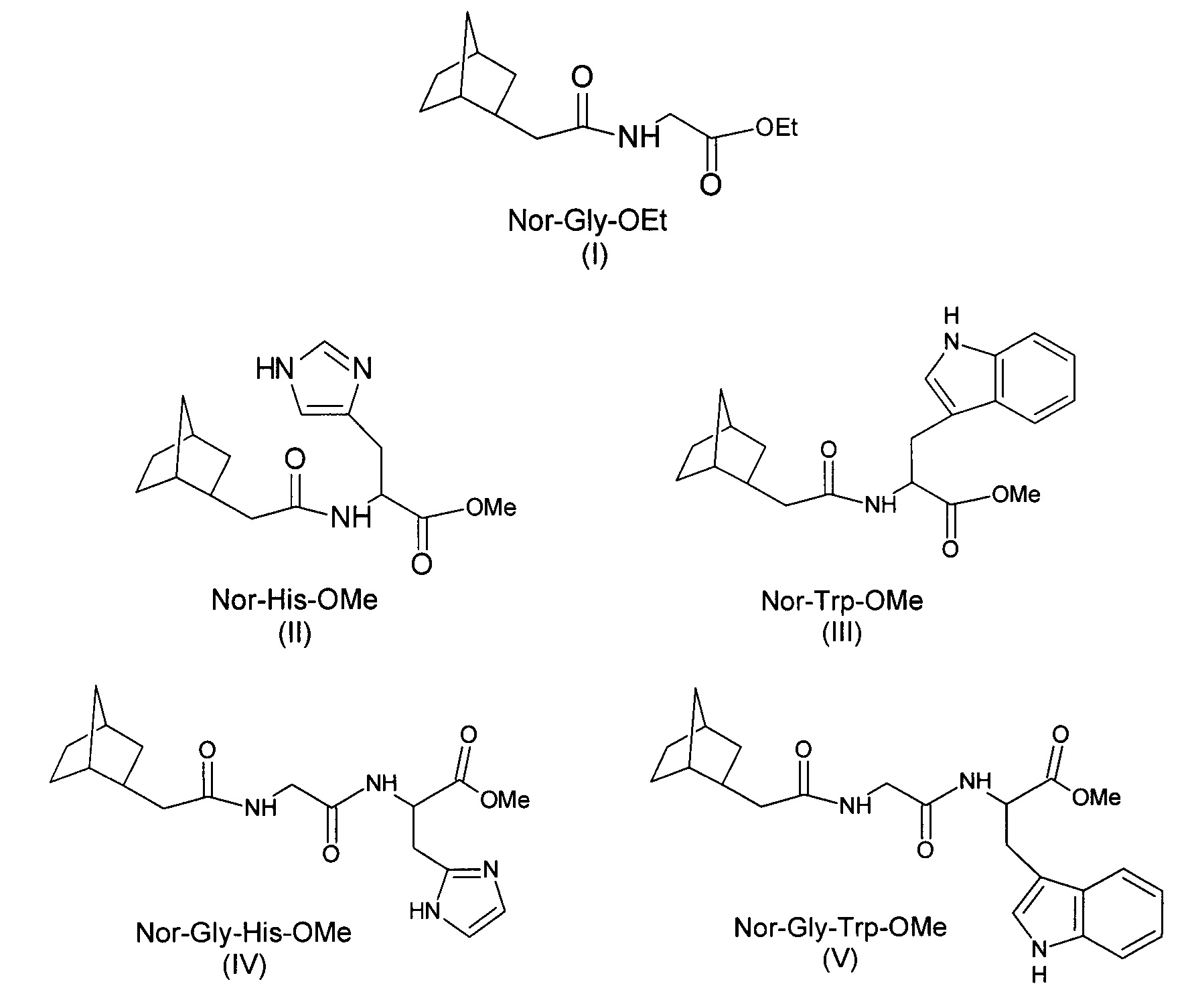
Изобретение относится к применению соединений (I-V), являющихся производными 2-норборнануксусной кислоты, из которых соединения (II, IV, V) - новые.
Сущность изобретения заключается в выявлении у производных 2-норборнануксусной кислоты - соединений, имеющих структурные формулы (I-V), специфической биологической активности - противовирусной активности в отношении вирусов гриппа А:
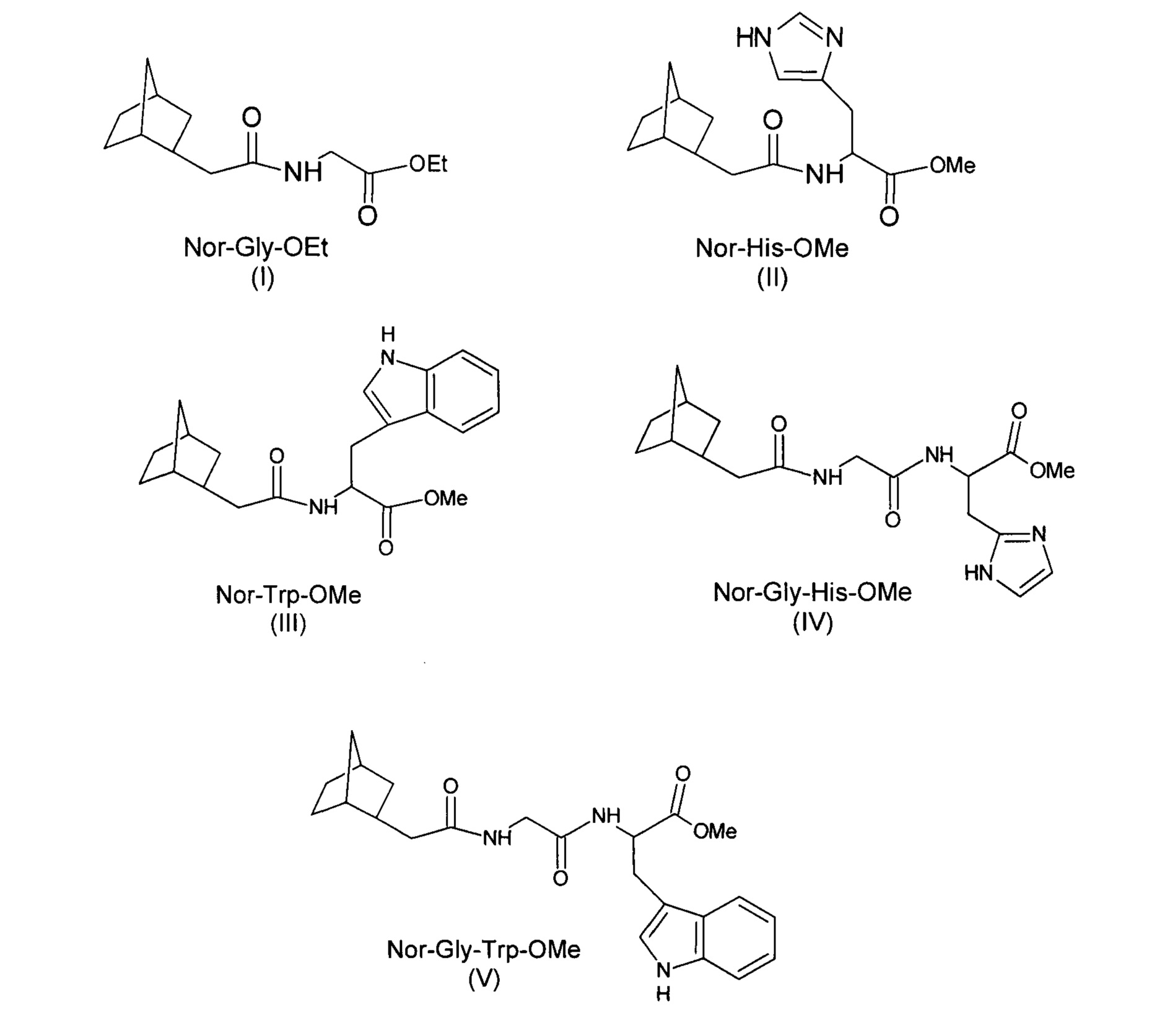
- соединение I - 2-норборнилацеткарбокси-глицин этиловый эфир ((этил{[(бицикло[2.2.1]гепт-2-ен)ацетил]амино}ацетат);
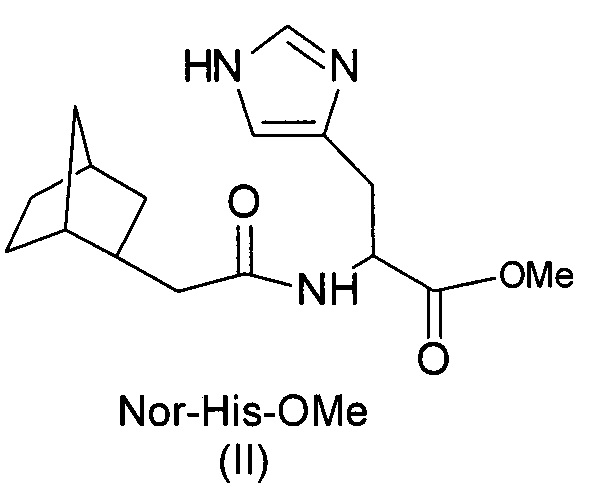
- соединение II - 2-норборнилацеткарбокси-гистидин метиловый эфир ((метил-2-{[(бицикло[2.2.1]гепт-2-ил)ацетил]амино}-3-(1Н-имидазол-4-ил)пропаноат);
- соединение III - 2-норборнилкарбокси-триптофан метиловый эфир (метил-3-(1Н-индол-3-ил)-2-[(3-(бицикло[2.2.1]гепт-2-ил)ацетил)амино]пропаноат);
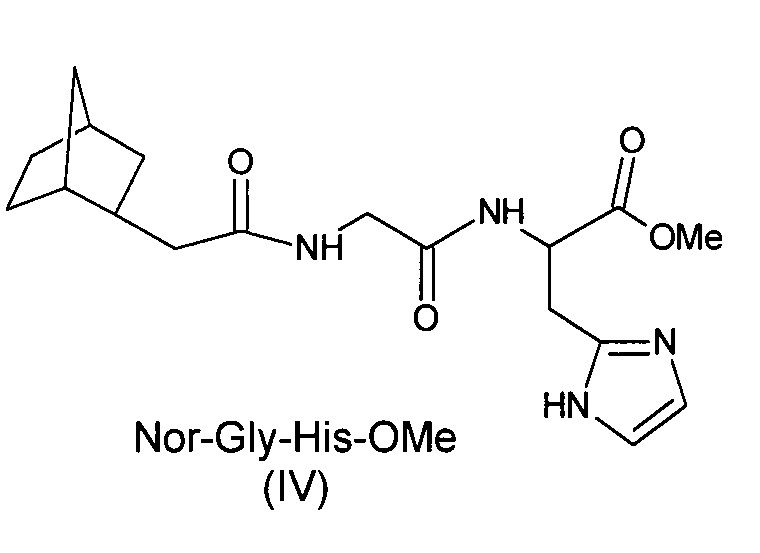
- соединение IV - 2-норборнилкарбокси-глицил-гистидин метиловый эфир (метил-3-(1Н-имидазол-4-ил)-2-({[(3-(бицикло[2.2.1]гепт-2-ил)ацетил)амино]ацетил}амино)пропаноат);
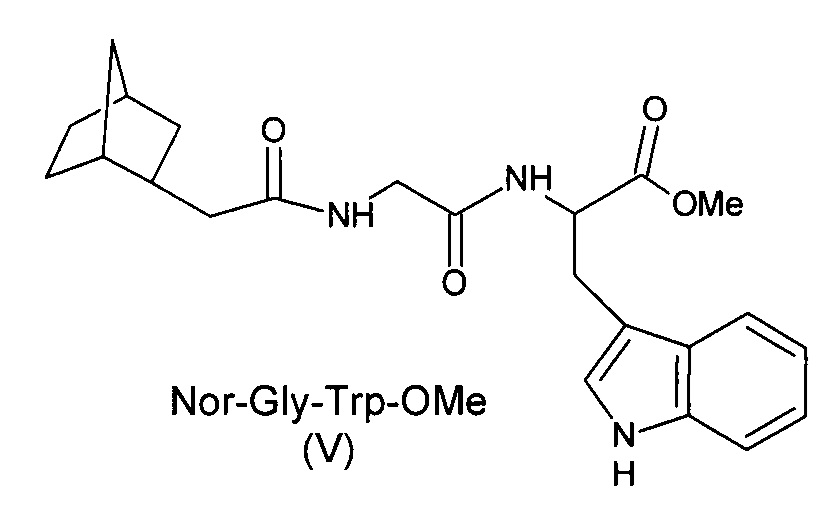
- соединение V - 2-норборнилкарбокси-глицил-триптофан метиловый эфир (метил-3-(1Н-индол-3-ил)-2-({[(3-(бицикло[2.2.1]гепт-2-ил)ацетил)амино]ацетил}амино)пропаноат).
Соединения I-V имеют следующие структурные формулы:
Предлагаемые соединения ингибируют репродукцию патогенных штаммов вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09 и A/H5N1, резистентных к действию римантадина, причем соединения I, II, IV, V обладают меньшим токсическим эффектом на монослой клеток MDCK и Vero-Е6, чем римантадин.
Технический результат: заявленные соединения ингибируют патогенные штаммы вируса гриппа А, в том числе и резистентные к действию препаратов римантадина и амантадина, и обладают малой токсичностью.
Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
Краткое описание чертежей.
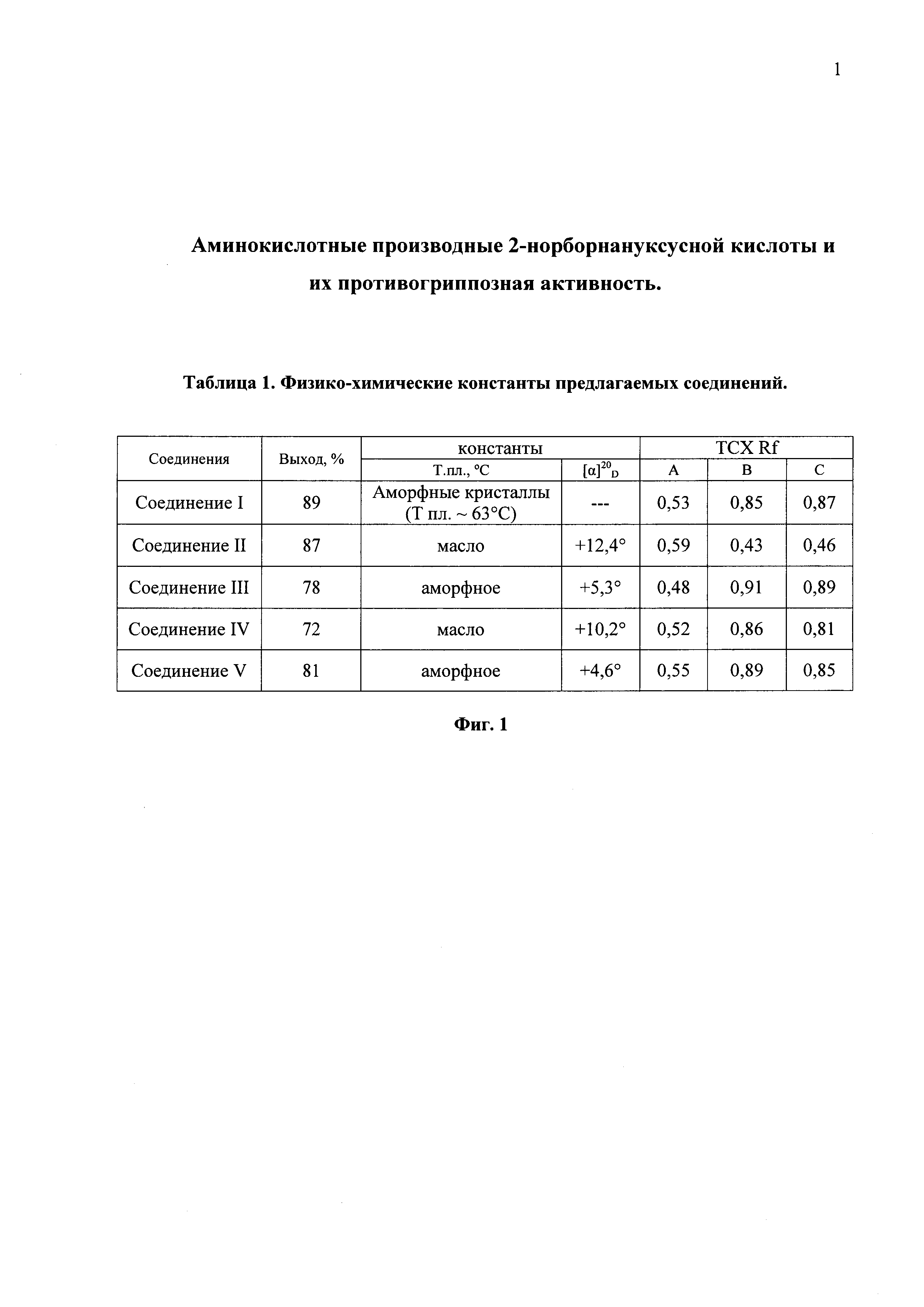
На фиг. 1 представлены в виде таблицы 1 выход и физико-химические константы предлагаемых соединений: [α]20D - показатель вращения в этиловом спирте при 20°С с концентрацией 1,0 мг/мл и длине кюветы 5 см, Rf - (Ratio of Fronts) характеристика положение пятен веществ по окончании разделения в условиях тонкослойной хроматографии (ТСХ)
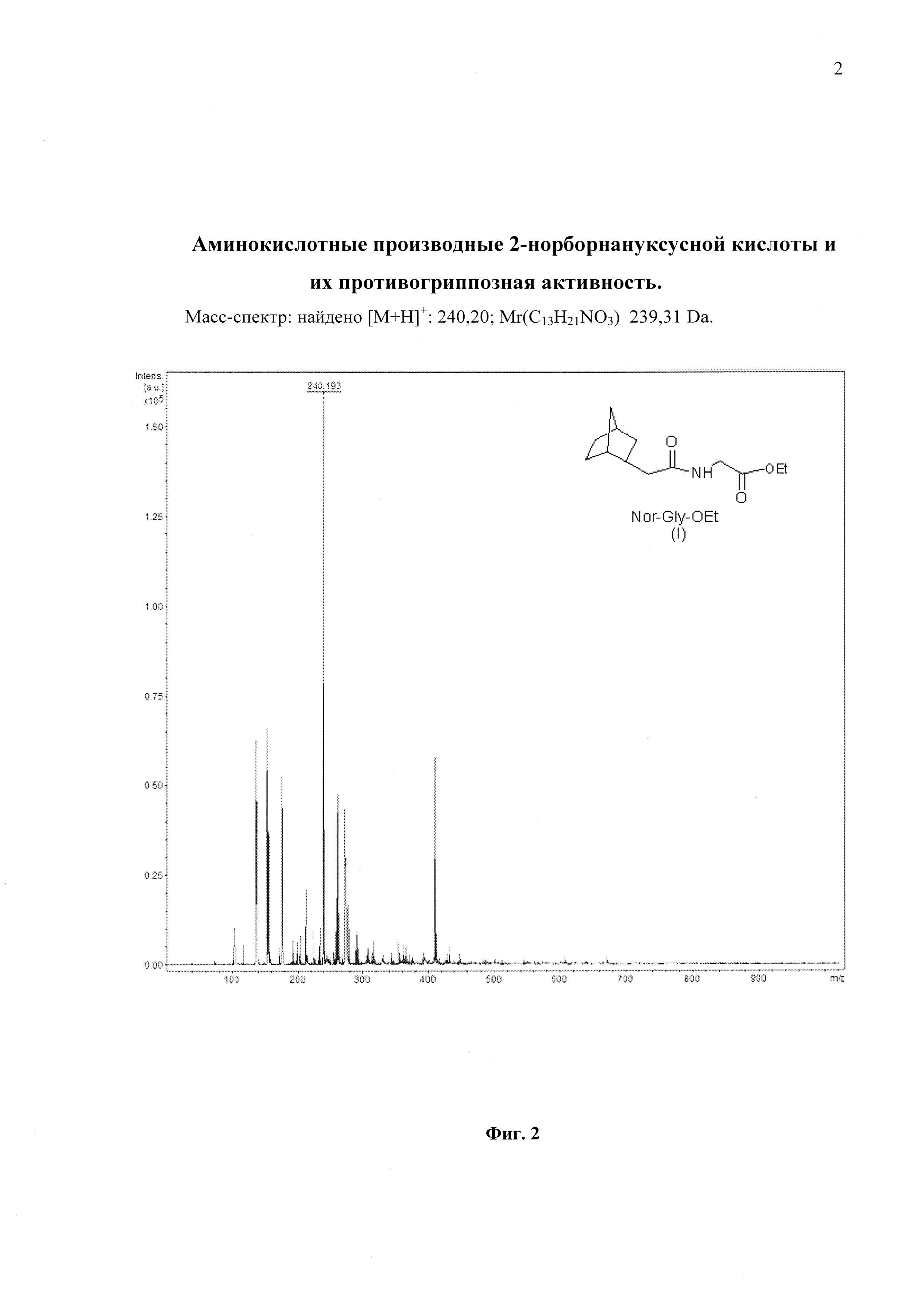
На фиг. 2 представлен Масс-спектр соединения Nor-Gly-OEt (I)
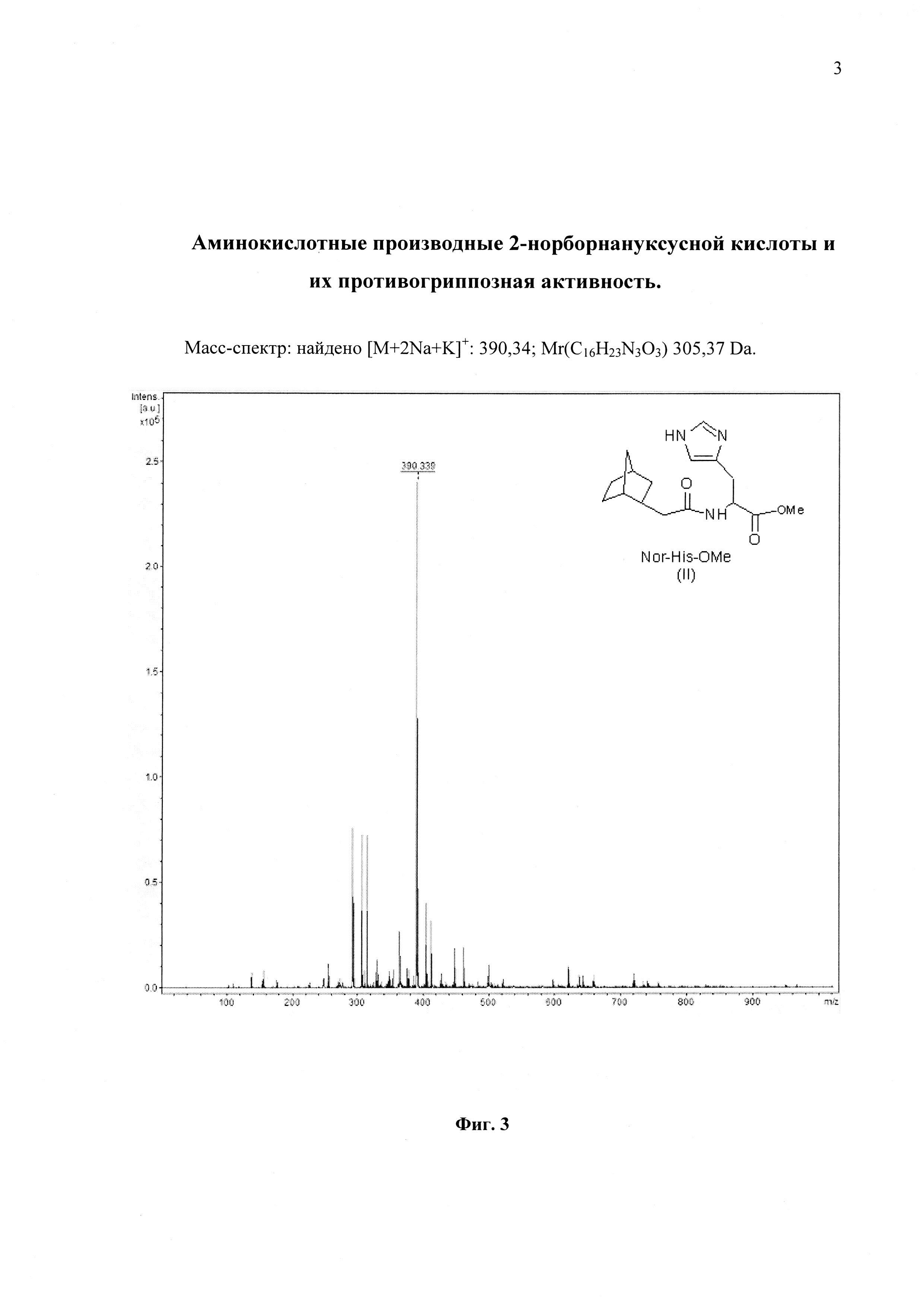
На фиг. 3 представлен Масс-спектр соединения Nor-His-OMe (II)
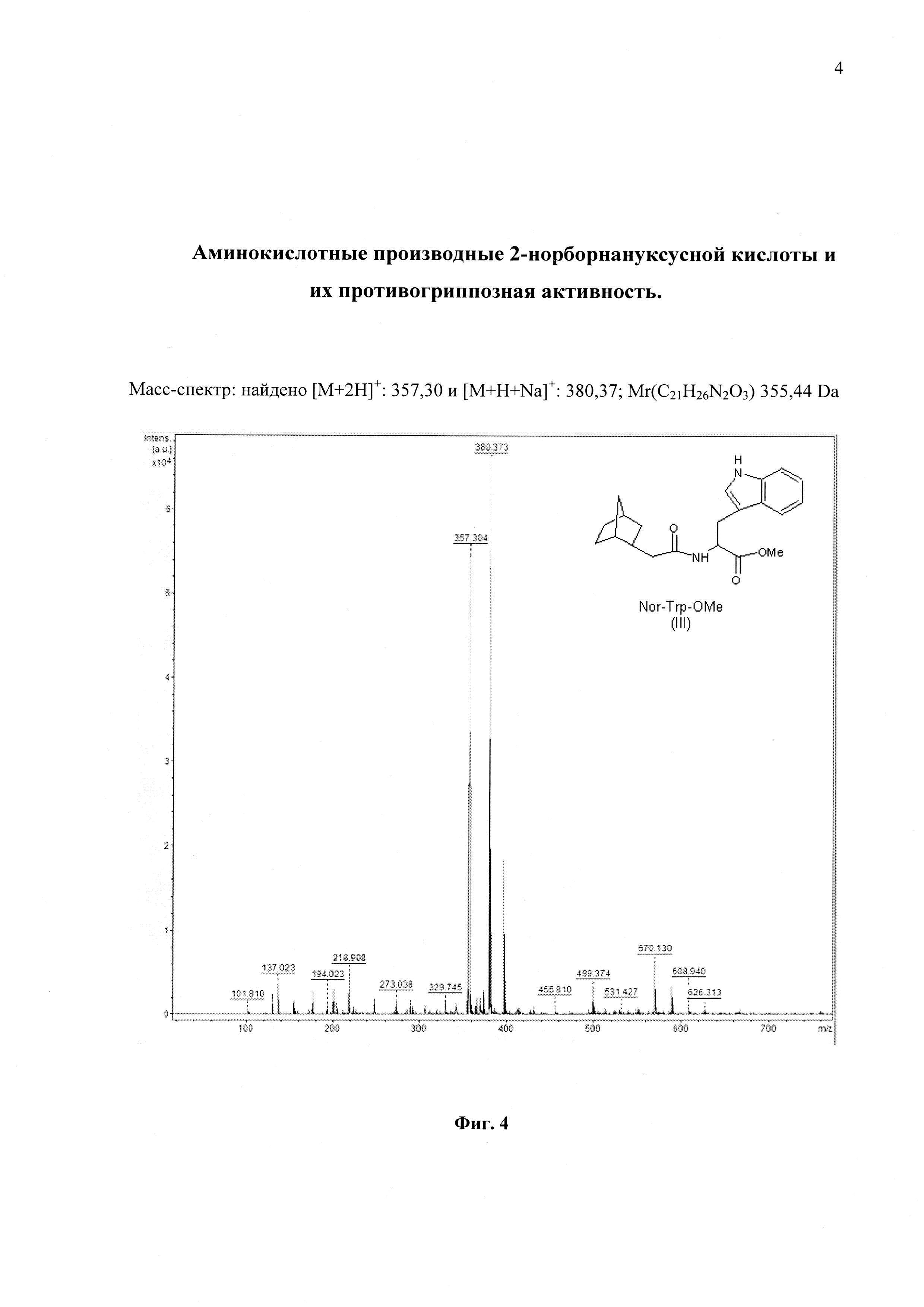
На фиг. 4 представлен Масс-спектр соединения Nor-Trp-OMe (III)
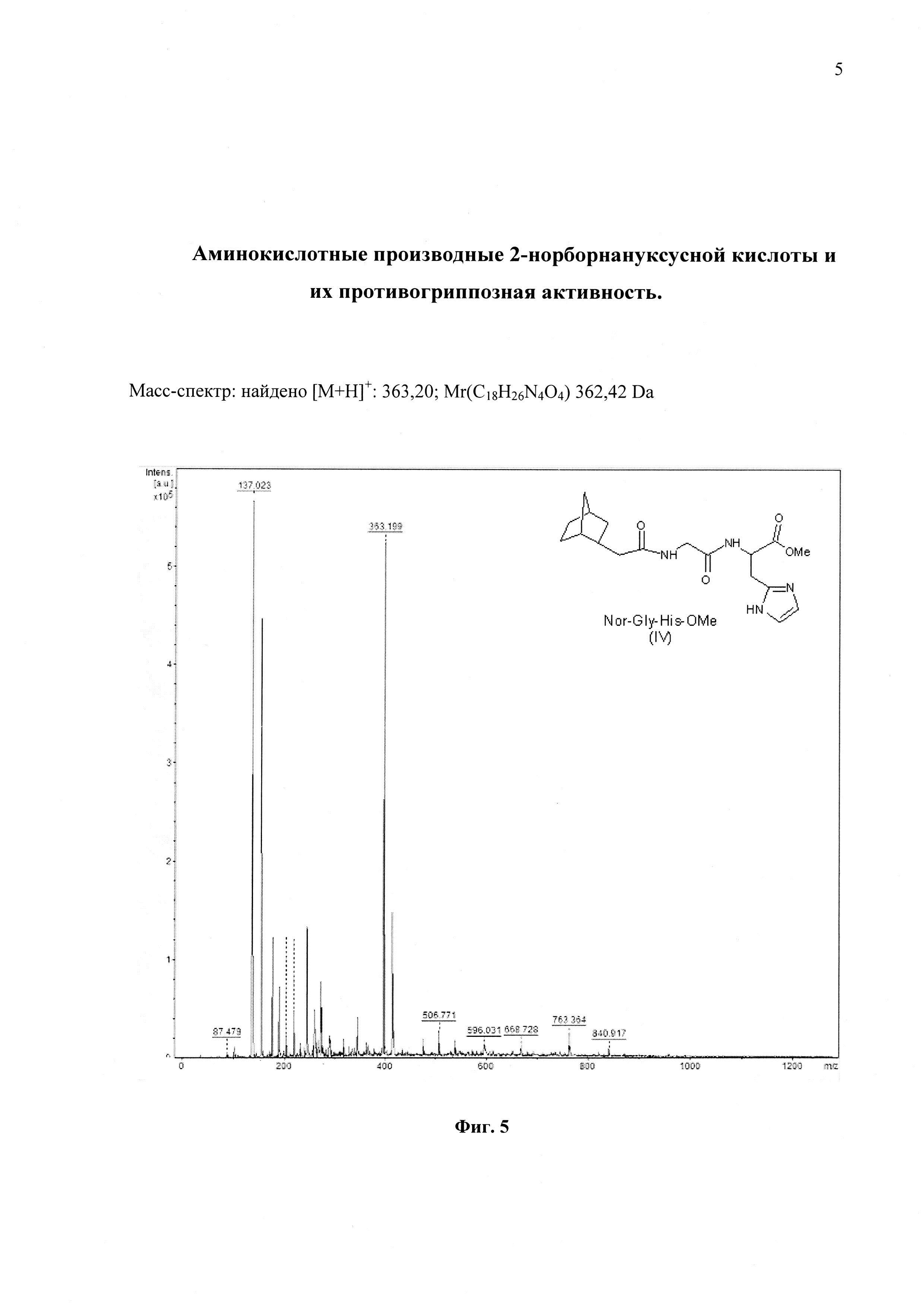
На фиг. 5 представлен Масс-спектр соединения Nor-Gly-His-OMe (IV)
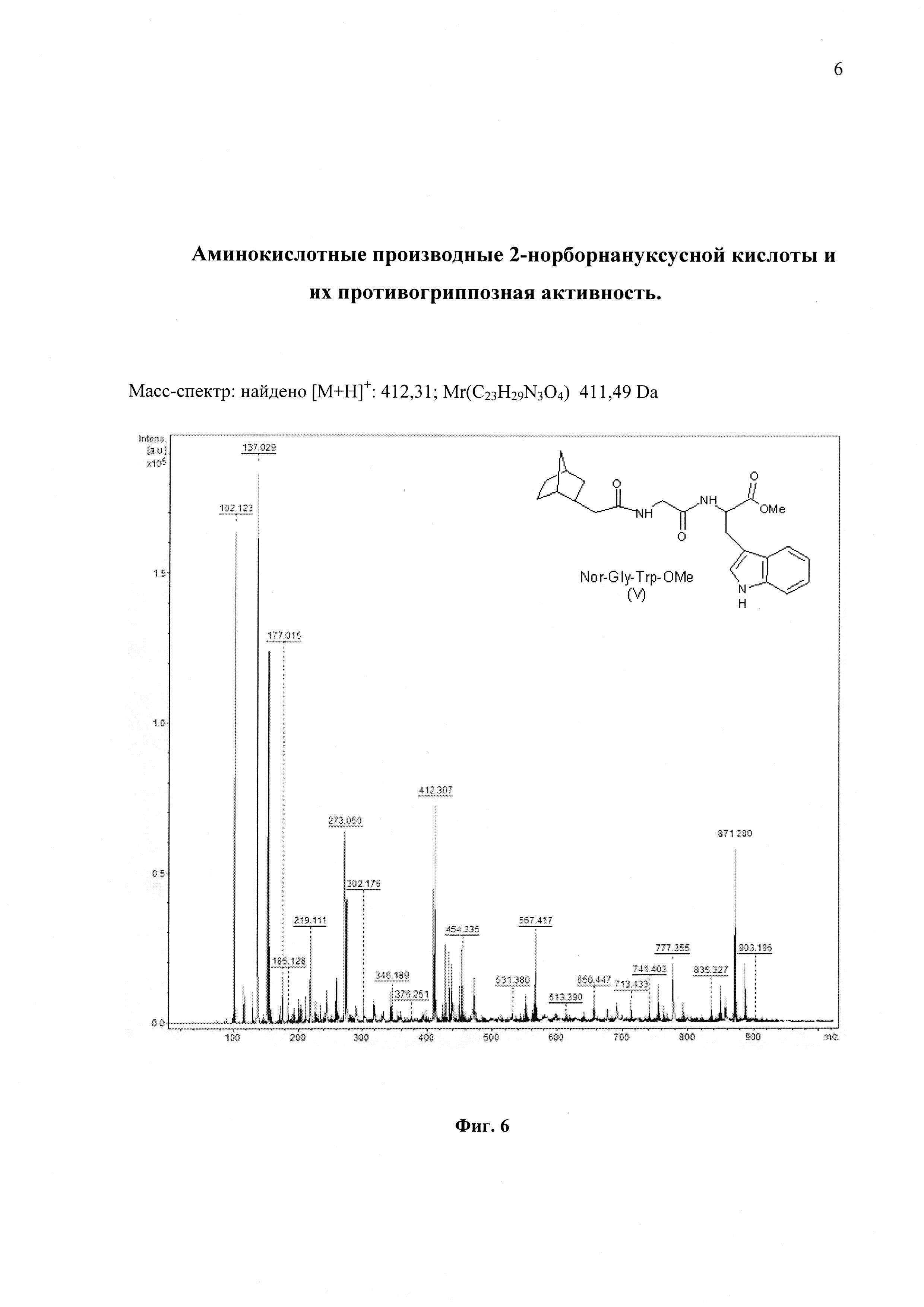
На фиг. 6 представлен Масс-спектр соединения Nor-Gly-Trp-OMe (V)
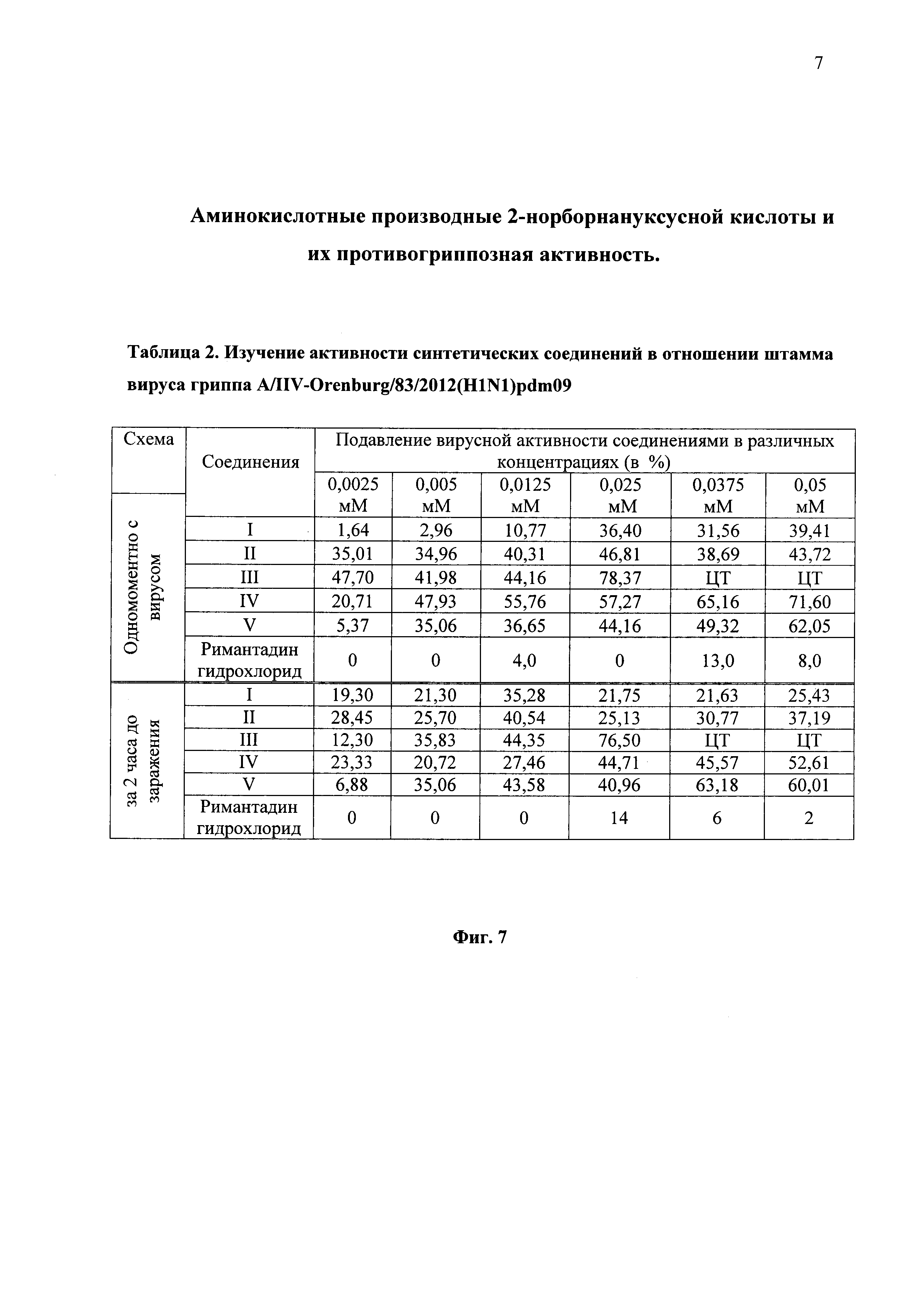
На фиг. 7 представлены в виде таблицы 2 данные влияния различных концентраций соединений I-V на репродукцию пандемического штамма вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09 в культуре Madin Darby Canine Kidney (MDCK) при добавлении вещества одномоментно с вирусом и за 2 часа до заражения вирусом монослоя клеток. Испытания противовирусной активности соединений I-V проведены в сравнении с римантадином.
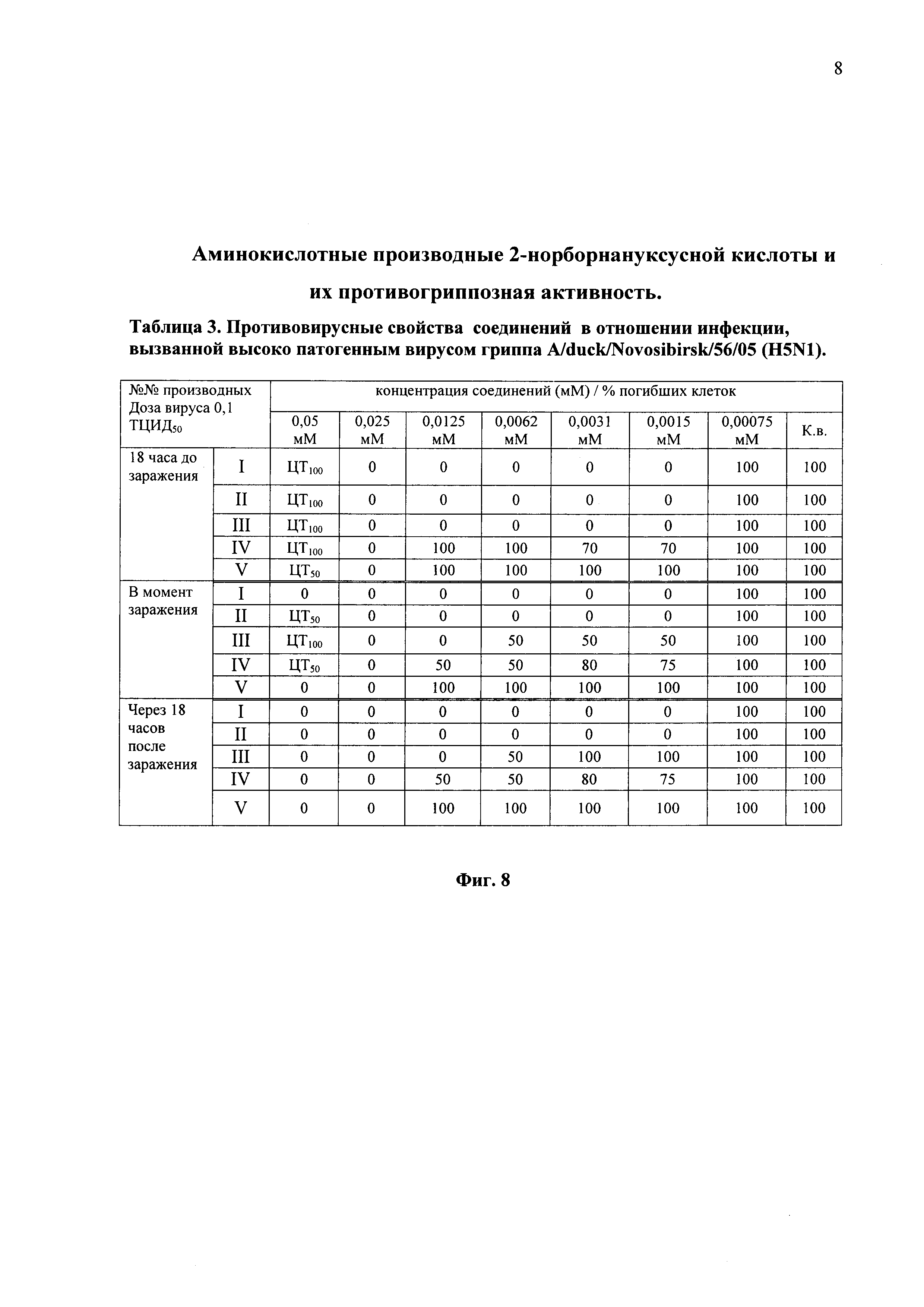
На фиг. 8 представлены в виде таблицы 3 данные противовирусных свойств соединений I-V в отношении инфекции, вызванной высокопатогенным вирусом гриппа A/duck/Novosibirsk/56/05 (Н5N1)на клеточной модели Vero-Е6. К.в. - Контроль вируса (без соединений).
Для получения соединений I-V могут быть использованы различные подходы. Один из способов получения соединений I-V - метод смешанных ангидридов, по следующей схеме: где NMM - N-метилморфолин, IBCF - изо-бутилхлорформиат, R - боковая группа аминокислоты, Е - остаток спирта в сложноэфирной группе. Образование пептидной связи между 2-норборнануксусной кислотой, содержащей карбоксильную группу, и эфирами аминокислот и пептидов с открытой аминогруппой проводили в одну стадию в условиях реакции смешанных ангидридов в эквимолярном соотношении. Для поглощения выделяющегося хлористого водорода использовался N-метилморфолин
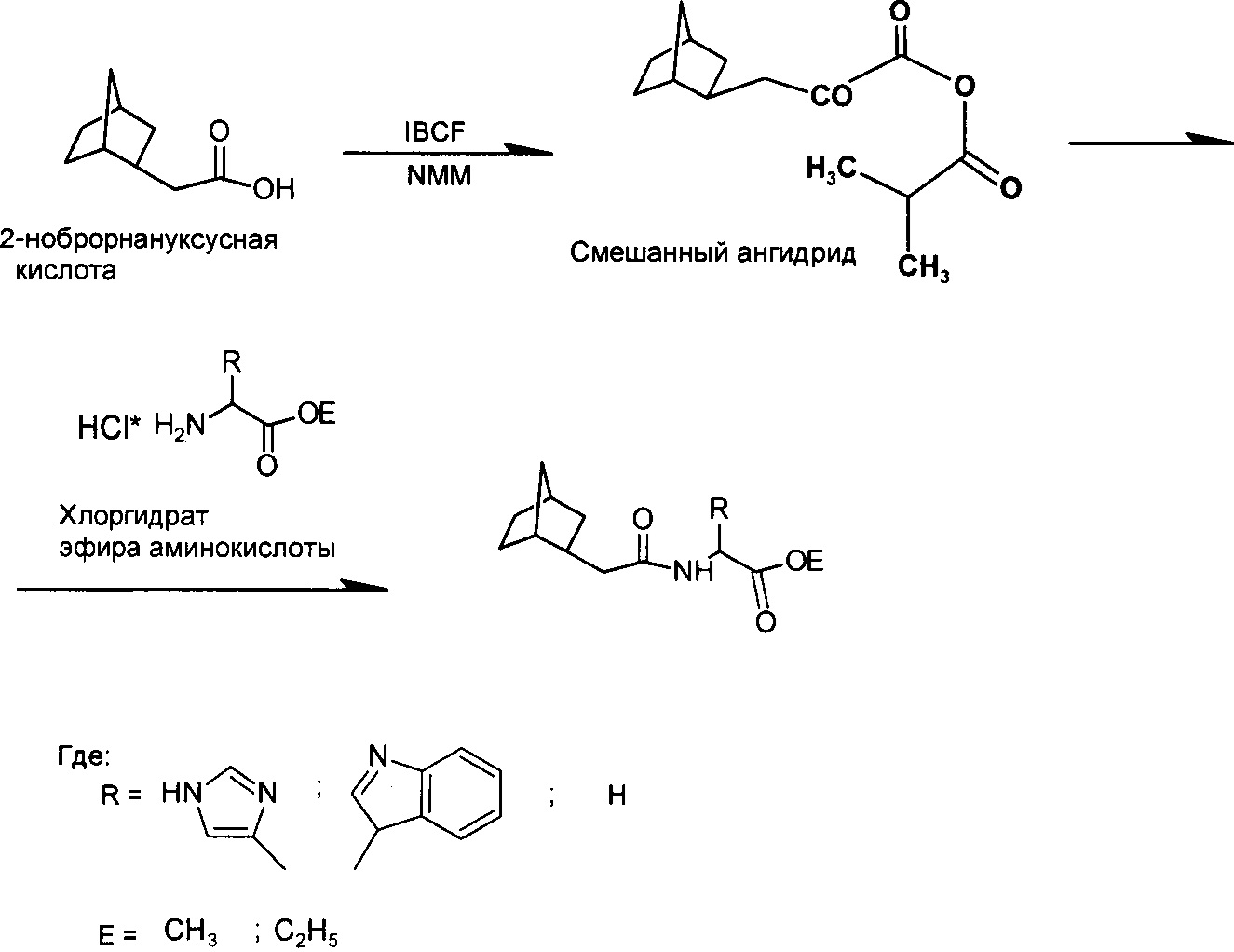
Однако предложенный метод синтеза не должен рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
В работе использовали 2-норборнанкарбоновую кислоту, N-метилморфолин (NMM) и L-аминокислоты фирмы Sigma-Aldrich (США); изо-бутилхлорформиат (IBCF) фирмы «Fluka» (Швейцария). Все используемые для конденсации и удаления защитных групп растворители предварительно сушили и перегоняли по стандартным методикам. Идентификация полученных соединений осуществлялась ТСХ на пластинах Merck-Kieselgel 60 F(254) в системах: метанол-хлороформ, 13:60 (А), втор-бутанол - 3%-ный аммиак, 100:44 (В), н-бутанол - уксусная кислота - вода - пиридин, 30:3:12:10 (С). Масс-спектры МАЛДИ получали на масс-спектрометре Bruker autoflex speed (Bruker Daltonics Inc., Германия), оснащенном твердотельным УФ-лазером с λ=355 нм и рефлектроном, в режиме регистрации положительно заряженных ионов. Для регистрации масс-спектров МАЛДИ использовали стальную мишень МТР 384 ground steel (Bruker Daltonics Inc., Германия). Для регистрации масс-спектров МАЛДИ образец смешивали с раствором матрицы CIN (синапиновая кислота, фирмы Sigma-Aldrich (США)) в соотношении 1:1, наносили на стальную мишень и высушивали. Инфракрасные спектры были получены на ИК Фурье спектрометре ИнфраЛЮМ ФТ-10.
Общую методику синтеза представленных соединений рассмотрим на примере получения соединения IV. Остальные соединения были получены аналогичным образом с использованием соответствующих исходных реагентов. Физико-химические константы и выход соединений представлены в таблице 1 (фиг 1).
Пример 1. Синтез соединения IV
Boc-Gly-His-OMe
Раствор 1 г (5,71 ммоль) Boc-Gly-OH и 0,63 мл (5,71 ммоль) NMM в 10,0 мл хлороформа охлаждают до минус 20°С и при перемешивании прибавляют 0,75 мл (5,71 ммоль) IBCF, а спустя 10 минут 1,38 г (5,71 ммоль) дихлоргидрата метилового эфира гистидина (2HCl*H-His-OMe) в 10,0 мл хлороформа с 1,25 мл (11,28 ммоль) NMM. Перемешивают 30 минут при минус 15°С, 1 час при 0°С и 2 часа при 20°С.
Растворитель удаляют в вакууме, остаток растворяют в 25,0 мл этилацетата и промывают последовательно 0,5 н NaHCO3 (2×15,0 мл), 10% лимонной кислотой (2×10,0 мл) и Н2О (1×5 мл), сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают маслообразный продукт, который при сушке в вакууме при 1 мм. рт. ст. вспенивается.
Выход 1,62 г (87%) (масло). [α]D+14°; Rf 0,91(A); Rf 0,86(В); Rf 0.76(C).
HCl*H-Gly-His-OMe
К раствору 0,228 г Boc-Gly-His-OMe в 4,0 мл этилацетата при 5°С прибавляют 5,0 мл 4н НСl в этилацетате. Через 15 минут внесли еще 3,0 мл 4н НСl в этилацетате. Реакционную смесь выдерживают в течение 1 часа при 20°С. Этилацетат удаляют в вакууме, остается маслянистый остаток.
Выход 0,165 г (89%) (масло), [α]D+12°; Rf 0.81(A); Rf 0.76(B); Rf 0.78(C); m/z: найдено [M+H]+:363,20; FW(C18H26N4O4) 362,42 Da.
Nor-Gly-His-OMe получают аналогично Boc-Gly-His-OMe. В качестве амино-компонента выступает хлоргидрат эфира дипептида HCl*H-Gly-His-OMe, а в качестве карбоксильной составляющей 2-норборненуксусная кислота. Выход 0,165 г (89%) (масло), [α]D+12°; Rf 0.81(A); Rf 0.76(B); Rf 0.78(C). Аналогичным образом были получены соединения I, II, III, и V. Масс-спектрометрические характеристики соединений I-V представлены на фиг. 2-6…
Пример 2. Определение противовирусной активности синтетических соединений в отношении вируса гриппа А.
В работе использовали штамм A/IIV-Orenburg/83/2012(H1N1)pdm09, выделенный из аутопсийного материала пациента с летальной пневмонией в декабре 2012 г. По антигенным свойствам штамм падобен эталонному штамму А/Калифорния/7/2009. Изучение противовирусной активности синтетические соединений проводили на 96-луночных панелях со сформировавшимся монослоем клеток культуры ткани MDCK. Для эксперимента использовали две схемы введения соединений в культуру клеток: одномоментно с инфицированием и за 2 часа до заражения вирусом в монослой клеток вносили римантадин (референс-препарат) и изучаемые синтетические соединения в концентрациях 0,05, 0,0375, 0,025, 0,0125, 0,005, 0,0025 мМ. Панели инкубировали 24 часа при 37°С, а затем останавливали реакцию фиксированием клеток 80% ацетоном на фосфатном буфере. Постановку метода клеточного иммуноферментного анализа (ИФА) проводили согласно методике, описанной ранее [16]. Процент ингибирования вирусной активности соединениями определяли по формуле (1):
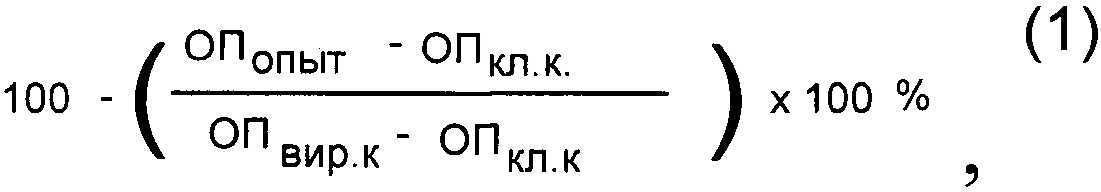
где ОПопыт - оптическая плотность опытной лунки (с веществом) при 492 н.м., ОП кл. к - ОП492 клеточного контроля, ОП вир. к. - ОП492 вирусного контроля
На фиг. 7 представлены средние значения результатов испытания противовирусной активности синтезированных соединений из параллельных опытов, проводимых в аналогичных условиях.
Результаты эксперимента показывают, что пандемический штамм вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09 в той или иной степени был чувствителен ко всем соединениям. Противовирусная активность обнаружена у всех пяти соединений. Однако 50%-ное и более подавление репродукции вируса отмечено для соединений III, IV, V.
В биологических испытаниях соединения I противовирусный эффект выражен незначительно. Причем при достижении концентрации в 0,05 Мм при одномоментном введении соединения с вирусом эффект достигает 39% подавления, но при введении соединения за 2 часа до заражения эффект практически теряется. Активность соединения II в одномоментном введении в культуру клеток вместе с вирусом несколько выше активности при введении его за 2 часа до заражения и составила менее 40%.
Соединение III высокоэффективно подавляло репродукции вируса гриппа уже при концентрации 0,025 мМ. Однако при переходе к большим концентрациям соединения проявлялся токсический эффект.
Соединения IV и V проявили наибольший противовирусный эффект, в обеих схемах введения. Более того, в рамках эксперимента не удалось достичь цитотоксического эффекта этих соединений. Соединение IV было несколько более активно, чем соединение V, 50%-ная ингибирующая доза 50 (ИД50) соединения IV составила 0,05 мМ или 3,8 мкг/мл.
Отсутствие ингибирующего эффекта римантадина гидрохлорида косвенно свидетельствует о резистентности данного штамма к препаратам адамантана.
Пример 3. Определение противовирусной активности синтетических соединений в отношении вируса гриппа A/duck/Novosibirsk/56/05 (H5N1). Изучение противовирусной активности синтезированных соединений проводили на панелях со сформировавшимся монослоем клеток Vero-Е6. Противовирусную активность проверяли в трех схемах введения соединений в культуру клеток: за 18 часов до заражения клеток, в момент заражения и через 18 часов после заражения культур клеток. Изначальная концентрация соединений составляла 10 мМ, которая наносилась в серии последовательных разведений 1/10……1/640. Таким образом, соединения вносили в концентрациях 0,5; 0,25; 0,125; 0,062; 0,031 0,0015 и 0,0075 мМ. В качестве контроля использовали инфицированную культуру клеток без добавления соединений [17].
Из данных таблицы 2 (фиг. 8) видно, что производное 2-норборнануксусной кислоты с остатком глицина (Nor-Gly-OEt (I) эффективно защищало монослой клеток от цитопатогенного действия вируса во всех схемах внесения соединения: ИД50<0,0015 мМ. Соединение II в эксперименте с вирусом A(H5N1) проявляло наибольшую противовирусную активность (ИД50<0,0015 мМ) из представленных соединений.
Соединение III также проявляло высокий эффект защиты клеток в схеме внесения до инфицирования ИД50 составило<0,0015 мМ, а для одновременного внесения вещества с вирусом и через 18 часов после заражения ИД50 составило 0,0062 мМ.
Соединения IV и V при биологическом испытании сильно потеряли в противовирусной активности по сравнению с соединениями II и III. Соединения IV и V были малоактивны в профилактической схеме введения (за 18 часов до заражения). В схемах одномоментного внесения соединения и вируса и при введении через 18 часов после заражения, активность составила для соединения IV ИД50=0,0125 мМ, а для соединения V ИД50<0,025 мМ.
Предлагаемые аминокислотные производные 2-норборнануксусной кислоты ингибируют репродукцию штаммов вируса гриппа A/H1N1pdm2009 и A/H5N1, резистентных к действию препаратов адамантанового ряда. Эти соединения могут быть применены для создания новых препаратов, против вируса гриппа А с использованием как в виде индивидуального лекарства, так и в составе композиций в качестве действующего вещества.
ЛИТЕРАТУРА
1. Н.А. Малышев, М.В. Базарова, Г.И. Кареткина, и др. Особенности пандемического гриппа A (H1N1) pdm09// Инфекционные болезни, 2013; №2; 12-17
2. WHO Guidelines on the use of vaccines and antivirals during influenza pandemics. WHO/ CDS/CSR/RMD/2004.8
3. Львов Д.К, Бурцева Е.И., Галегов Г.А. и др. Чувствительность эпидемических и пандемических штаммов вирусов гриппа к занамивиру (Релензе) в опытах in vitro // Вопр. вирусол., 2010; 55(6); 10-14
4. Смирнов B.C., Гаршинина А.В., Штро А.А. Протективная активность комбинации глутамил-триптофана и глицирризиновой кислоты при пероральном введении на модели экспериментальной летальной гриппозной инфекции у белых мышей, вызванной осельтамивирустойчивым штаммом вируса. //Вопр. вирусол., 2014; 59(5); 31-38
5. Miao Y., Fu R., Zhou H.X., et. al. Dynamic Short Hydrogen Bonds in Histidine Tetrad of Full-Length M2 Proton Channel Reveal Tetrameric Structural Heterogeneity and Functional Mechanism, //Structure, 2015; 23(12); 2300-2308.
6. Wei G, Pohorille A. M2 proton channel: toward a model of a primitive proton pump.//Orig Life Evol. Biosph., 2015; 45(2); 241-248
7. Chuang G.Y., Kozakov D., Brenke R. et. al. Binding hotspots and amantadine orientation in the influenza A virus M2 proton channel. //Biophys. J., 2009; 97(10); 2846-2853.
8. Shibnev V.A., Garaev T.M., Finogenova M.P, et. al. New adamantane derivatives capable of overcoming the resistance of influenza A (H1N1) pdm2009 and A (H3N2) for "rimantadine" Bull. Exp.Biol. Med., 2012; 153(2); 233-235
9. Wang J., Ma C, Jo К, V. Balannik et. al. Discovery of novel dual inhibitors of the wild-type and the most prevalent drug-resistant mutant, S3 IN, of the M2 proton channel from influenza A virus. //J Med. Chem., 2013; 56(7); 2804-2812.
10. Wang J., Ma C, Fiorin G., Carnevale V. et. al. Molecular Dynamics Simulation Directed Rational Design of Inhibitors Targeting Drug-Resistant Mutants of Influenza A Virus M2//J. Am. Chem. Soc.,2011; 133; 12834-12841.
11. Balannik V, Wang J, Ohigashi Y, Jing XH, Magavern E, et. al. Design and Pharmacological Characterization of Inhibitors of Amantadine-Resistant Mutants of the M2 Ion Channel of Influenza A Virus. //Biochemistry, 2009; 48; 11872-11882.
12. Griffin S.D., Beaks L.P., Clarke D.S., et. al. The p7 protein of hepatitis С virus forms an ion channel that is blocked by the antiviral drug, Amantadine. // FEBS Lett., 2003; 535; 34-38.
13. Машковский М.Д. Лекарственные средства, "Издательство Новая Волна", 2002, т. 2, с… 326.
14. Киселев О.И., Блинов В.М., Ильенко Ю.И. и др. Молекулярный механизм действия антивирусных препаратов адамантанового ряда. Вестн. Рос. Акад. Мед. Наук 1993 (3): с. 10-15.
15. Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия. М.: "Медицина", 2002, 654 с.
16. Ленева И.А., Фадеева Н.И., Федякина И.Т. и др. Применение иммуноферментной индикации вирусспецифических антигенов в изучении нового противовирусного препарата. //Хим.-фарм. журнал. 1994, №9, с. 4-15.
17. Дерябин П.Г., Львов Д.К., Исаева Е.И., и др. Спектр клеточных линий позвоночных, чувствительных к высокопатогенным вирусам гриппа А/крачка/Южная Африка/61 (H5N3) и А/крачка/Новосибирск/56/05 (H5N1) // Вопр. вирусол., 2007; 52(1); 45-47.