Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ОБУСЛОВЛЕННОГО НАРУШЕНИЕМ ОКИСЛИТЕЛЬНОГО СТРЕССА
Вид РИД
Изобретение
Изобретение относится к области медицины и химико-фармацевтической промышленности, а именно к созданию средства для лечения заболеваний, обусловленного окислительным стрессом.
Окислительный (оксидативный) стресс - это результат, как правило, в следствии воспаления и/или гипоксических обстоятельств, при котором происходит нарушение в обменных процессах организма человека, что провоцирует накопление свободных радикалов (активных агентов), которые вызывают повреждение клеток, а также запускают первичные механизмы повреждающего действия в клетках, что в свою очередь вызывает различные патологические состояния и заболевания.
В настоящее время ключевым звеном окислительного повреждения клетки считается митохондриальная дисфункция. В митохондриях человека содержатся белки, кодируемые митохондриальной ДНК (м-ДНК), основная роль которых - построение дыхательной цепи и обеспечение энергетических потребностей клетки. Хорошо известно, что в процессе старения происходит<накопление мутаций м-ДНК, что нарушает структуру и функции митохондрий, приводя к дисбалансу между производством свободных радикалов и защитными возможностями организма [Chunyan Guo et al. Oxidative stress, mitochondrial damage and neurodegenerative diseases / Neural Regeneration Research, 2013, V. 8, N. 21, pp. 2003-2014].
Помимо митохондриальной дисфункции, одним из механизмов развития окислительного повреждения клеток может быть нарушение обмена глутатиона. Соотношение восстановленного и окисленного глутатиона отражает восстановительно-окислительный потенциал клетки, причем уменьшение этого потенциала является еще одним пусковым механизмом развития окислительного стресса [Ondrej Zitka et al. Redox status expressed as GSH:GSSG ratio as a marker for oxidative stress in paediatric tumour patients / Oncology Letters, 2012, V. 4, N 6, pp. 1247-1253].
Еще одним пусковым механизмом окислительного стресса рассматривается накопление железа в базальных ганглиях при ряде нейродегенеративных заболеваний [Jinze Xu et al. Iron Accumulation with Age, Oxidative Stress and Functional Decline / PLoS ONE, 2008, V.3, N 8, pp. e2865 (l-8)].
Окислительный стресс является причиной или важной составляющей серьезных заболеваний, которые в настоящее время еще и могут называться, как митохондриальные заболевания, например, таких как болезнь Паркинсона, болезнь Альцгеймера, хорея Гентингтона [Васенина Е.Е. и др. Окислительный стресс в патогенезе нейродегенеративных заболеваний: возможности терапии / Нейропротективная терапия, 2013, №3-4, с. 39-46] и других.
Болезнь Паркинсона (БП) является одним из наиболее частых нейродегенеративных заболеваний, клинически характеризующихся прогрессирующими гипокинезией, мышечной ригидностью, тремором покоя. В основе БП лежит гибель дофаминергических нейронов черной субстанции, при этом в выживших клетках находят тельца Леви, а в полосатом теле снижается содержание дофамина [Jenner P. et al. Oxidative stress in Parkinson's disease / Annals of neurology, 2003, V. 53, N 3, pp. S26-S38].
Болезнь Альцгеймера (БА) - нейродегенеративное заболевание преимущественно позднего возраста, характеризующееся прогрессирующим когнитивным снижением. В основе заболевания лежит необратимая гибель клеток, особенно в коре головного мозга и гиппокампе. Ключевыми особенностями болезни являются накопление амилоидных бляшек и нейрофибриллярных клубков в тканях мозга. При БА окислительный стресс является одним из ключевых звеньев патогенеза. Именно окислительный стресс может приводить к нарушению метаболизма белка - предшественника амилоида [Дубинина Е.Е. и др. Окислительный стресс и его влияние на функциональную активность клеток при болезни Альцгеймера / Биомедицинская химия, 2015, Т. 61, №1, с. 57-69].
Болезнь Гентингтона (БГ) (или синдром Гентингтона, или хорея Гентингтона, или хорея Хантингтона) - является аутосомно-доминантно наследуемым заболеванием, связанное с нестабильной экспансией полиглутаминового участка на N-терминальном конце белка, именуемого хантингтином. БГ характеризуется гибелью нейронов и прогрессирующей атрофией подкорковых структур, прежде всего хвостатого ядра. Различные доказательства указывают на то, что ключевым последствием изменения структуры белка является дефект митохондриальных цепей, что в результате приводит к нарушению энергетического обеспечения клетки. Нарушение структуры митохондрий и дисфункция дыхательной цепи в свою очередь приводит к избыточной продукции свободных радикалов, что, вероятно, и вызывает повреждение клетки [Browne S.E. et al. Oxidative damage and metabolic dysfunction in Huntington's disease: selective vulnerability of the basal ganglia / Annals of neurology, 1997, V. 41, N. 5, pp. 646-653].
В литературе также имеются данные о том, что заболеваниями, обусловленными окислительным стрессом, также являются пигментный ретинит [Maria Miranda et al. Antioxidant therapy in retinitis pigmentosa / Novel Aspects of Neuroprotection, 2010: ISBN: 978-81-308-0394-4, 15 pages], митохондриальная энцефаломиопатия [Genki Hayashi et al. Oxidative Stress in Inherited Mitochondrial Diseases / HHS Public Access, 2015, V. 88, pp. 10-17], рассеянный склероз [Кротенко Н.В. и др. Окислительный стресс - характерная особенность патогенеза рассеянного склероза / Бюллетень сибирской медицины, 2008, №5, с. 208-214], инсульт [Луцкий М.А. и др. Формирование окислительного стресса, одного из звеньев сложного патогенеза социально значимых заболеваний нервной системы - инсульта и рассеянного склероза / Фундаментальные исследования, 2014, №10 (часть 5), с. 924-929], болезнь Крона [Iborra М. et al. Role of oxidative stress and antioxidant enzymes in Crohn's disease / Biochemical Society Transactions, 2011, V. 39, N. 4, pp. 1102-1106], неспецифический язвенный колит [Rana S.V. et al. Role of oxidative stress & antioxidant defence in ulcerative colitis patients from north India / Indian Journal of Medical Research, 2014, V. 139, N. 4, pp. 568-571], ревматоидный артрит [Celia Maria Quinonez-Flores et al. Oxidative Stress Relevance in the Pathogenesis of the Rheumatoid Arthritis: A Systematic Review / BioMed Research International, 2016, V. 2016, 14 pages], псориаз [Qiang Zhou et al. Oxidative stress in the pathogenesis of psoriasis / Free Radical Biology & Medicine, 2009, V. 47, pp. 891-905].
Из уровня техники [патент RU 2218918 С1, опубл. 20.12.2003] известно, что диалкиловые эфиры и моноалкиловые эфиры фумаровой кислоты в форме свободной кислоты или ее солей могут быть применены для лечения заболевания, обусловленного нарушением окислительного фосфорилирования и выбранного из группы, включающей синдром Паркинсона, болезнь Альцгеймера, хорею Хантингтона, пигментный ретинит и митохондриальную энцефаломиопатию.
Однако согласно приведенным в указанном документе данным стимулирующее действие различных производных фумаровой кислоты на ферментативную активность сукцинатдегидрогеназы сильно варьируется и не всегда является высоким. Некоторые производные фумаровой кислоты демонстрируют среднее или даже слабое действие. С чем это может быть связано, в документе не обсуждается.
Предлагаемое изобретение решает задачу расширения арсенала средств, эффективных для лечения заболеваний, обусловленных окислительным стрессом.
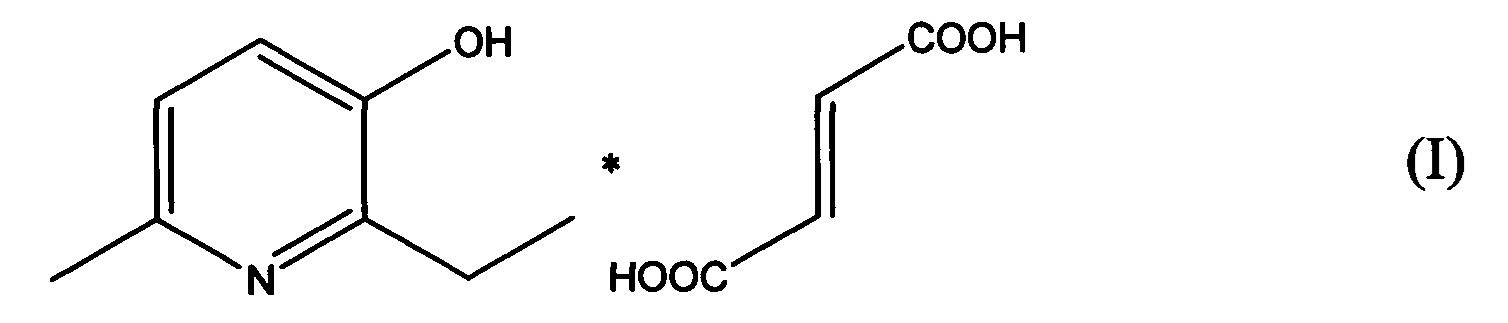
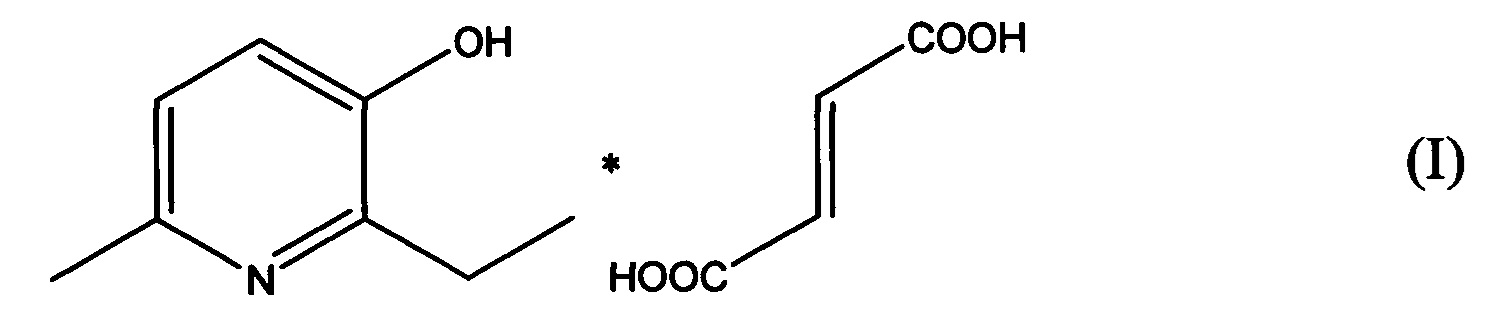
В качестве такого средства в настоящем изобретении предлагается использовать соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.
В документе [патент RU 2365582 С1, опубл. 27.08.2009] раскрывается соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой следующей формулы:
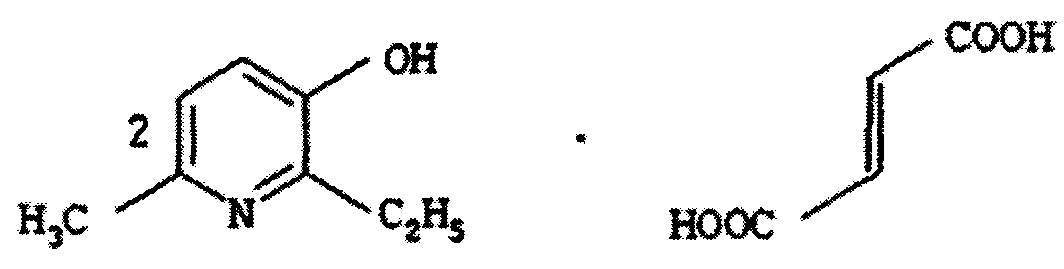 ,
,
которая обладает метаболической и кардиопротекторной активностью. Указанную соль получают взаимодействием 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой при их молярном соотношении 2:1 в среде растворителя (этанола).
Однако в данном документе не обсуждается и даже не упоминается возможность применения указанной соли для лечения заболеваний, обусловленных окислительным стрессом.
Технический результат настоящего изобретения заключается в создании нового эффективного средства для лечения заболеваний, обусловленных окислительным стрессом, и в повышении эффективности такого лечения.
Указанные задача и технический результат достигаются применением терапевтически эффективного количества соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I):
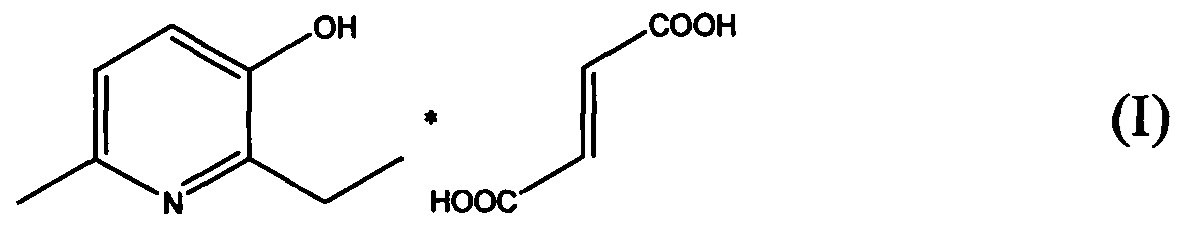
для лечения заболевания, обусловленного окислительным стрессом и выбранного из группы, включающей болезнь Паркинсона, болезнь Альцгеймера, хорею Хантингтона, пигментный ретинит, митохондриальную энцефаломиопатию, рассеянный склероз, инсульт, болезнь Крона, неспецифический язвенный коллит, ревматоидный артрит, псориаз.
Терапевтически эффективное количество активного агента, соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, предпочтительно составляет 100-300 мг.
Указанная соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой может быть введена пациенту, нуждающемуся в этом, как в виде лекарственной формы для перорального введения, так и в виде лекарственной формы для парентерального введения.
При этом такие лекарственные формы могут дополнительно включать фармацевтически приемлемые носители, наполнители или эксципиенты.
В качестве фармацевтически приемлемых носителей, наполнителей, эксципиентов могут быть использованы различные добавки, используемые при производстве готовых лекарственных форм, совместимые с активным агентом и с другими вспомогательными вещества и не оказывающие неблагоприятное воздействие на пациента, например, лубриканты, разбавители, связующие, стабилизаторы, дезинтегрирующие или суспендирующие агенты и др.
Помимо вышеотмеченного, дополнительные вспомогательные вещества могут обеспечивать контролируемое, пролонгированное, немедленное или модифицированное высвобождение активного агента.
Лекарственная форма для перорального введения может быть выбрана из таблетки, капсулы, порошка, гранул, драже, геля, желе, диспергируемой в ротовой полости формы, буккальной или подъязычной формы в виде пластинки или таблетки, раствора, сиропа или суспензии.
Таблетки и капсулы могут содержать стандартные наполнители, необходимые как для технологии их изготовления, так и для достижения необходимых качественных и количественных показателей, отвечающих требованиям соответствующей фармакопеи. Примерами наполнителей могут быть лактоза, маннит, крахмалы, модифицированные крахмалы, целлюлоза и ее производные, желатин, стеариновая кислота или ее соли, увлажнители, отдушки, красители и т.д.
Пероральные жидкие препараты могут быть изготовлены либо в виде растворов (водные или масляные суспензии, растворы, эмульсии, сиропы и др.), либо в виде сухих продуктов, которые перед непосредственным применением подлежат разведению водой или другими растворителями. Например, суспензии и растворы могут содержать эмульгирующие и суспендирующие агенты.
Лекарственная форма для парентерального введения может быть выбрана из раствора для инъекций, порошка для приготовления раствора для инъекций, геля, инфузионного раствора, депо формы. Такая форма должна изготавливаться в условиях стерильности и может содержать различные консерванты, буферирующие агенты, изотонические агенты.
Нижеприведенные примеры иллюстрируют настоящее изобретение.
Пример 1. Получение соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.
В отличие от технического решения, раскрытого в документе [патент RU 2365582 С1, опубл. 27.08.2009], в настоящем изобретении соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой получали при молярном соотношении исходных реагентов (2-этил-6-метил-3-гидроксипиридина и фумаровой кислоты), равном 1:1.
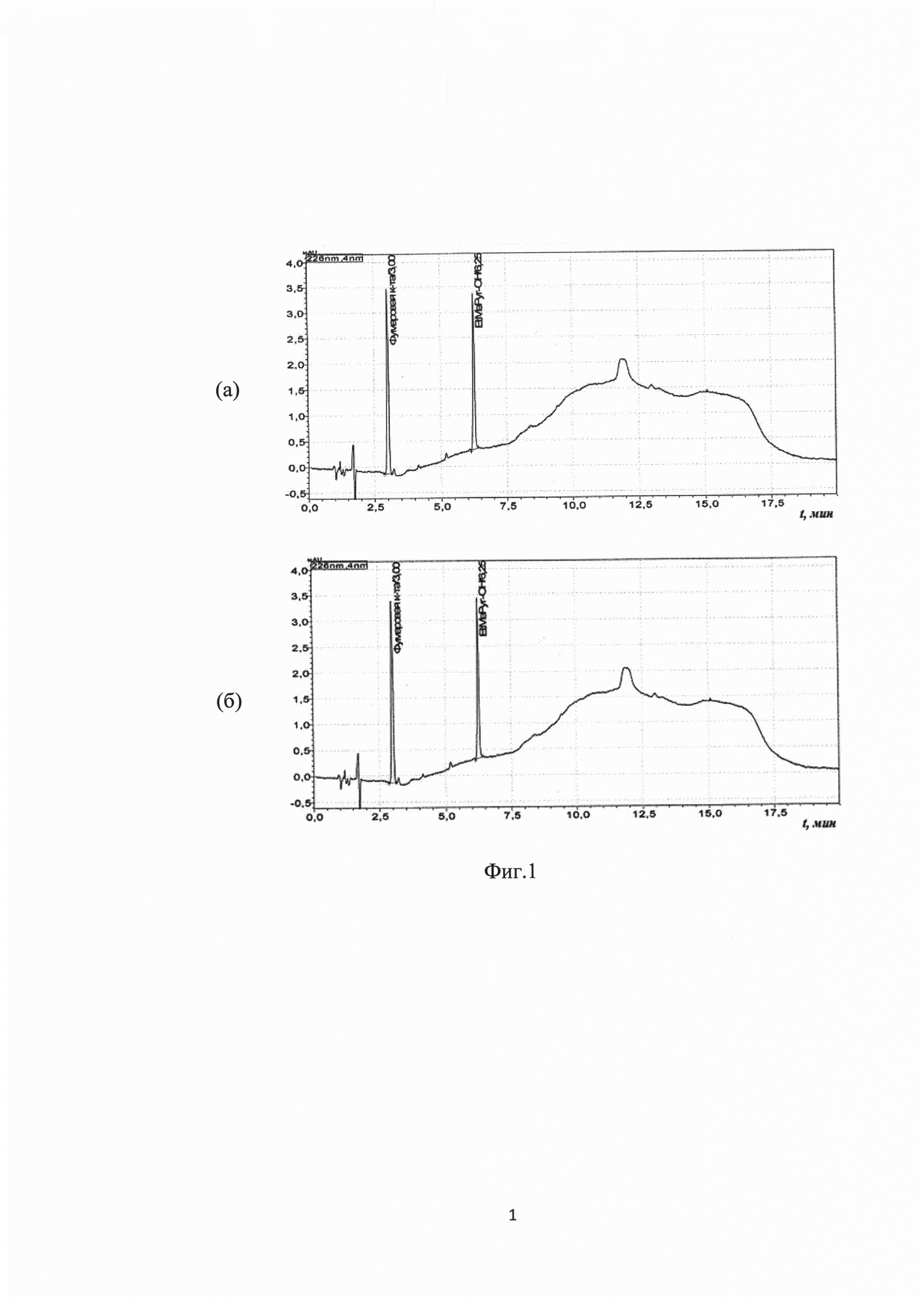
Способ А. В реакционную колбу объемом 250 мл загружали 50 мл изопропилового спирта и 15,4 г (0,133 моль) фумаровой кислоты. Суспензию кипятили при перемешивании 30 минут до полного растворения. Параллельно в 50 мл изопропилового спирта растворяли 18,2 г (0,133 моль) 2-этил-6-метил-3-гидроксипиридина при нагревании. Полученные растворы смешивали и кипятили при перемешивании в течение 1 часа. Полученный продукт кристаллизовали при температуре от 0 до +5°С в течение 12 часов. После фильтрации, промывки и сушки получили 32,5 г целевого продукта (соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I)) в виде белых кристаллов с температурой плавления 93-95°С. Выход 96,6%. Получение целевого продукта подтверждали высокоэффективной жидкостной хроматографией (ВЭЖХ) - хроматограмма водного раствора соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, полученной способом А, показана на фиг. 1 (a).
Способ Б. В реакционную колбу объемом 500 мл загружали 300 мл ацетона, 15,4 г (0,133 моль) фумаровой кислоты и 18,2 г (0,133 моль) 2-этил-6-метил-3-гидроксипиридина. Суспензию кипятили при перемешивании 2 часа, охлаждали до комнатной температуры и кристаллизовали при температуре от 0 до +5°С в течение 6 часов, после фильтрации, промывки и сушки получали 31,4 г целевого продукта (соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I)) в виде белых кристаллов с температурой плавления 94-97°С. Выход 93,3%. Получение целевого продукта подтверждали высокоэффективной жидкостной хроматографией (ВЭЖХ) - хроматограмма водного раствора соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, полученной способом Б, показана на фиг. 1 (б).
Далее, приведены примеры, подтверждающие антиоксидантное действие соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I) (ЭМГП фумарат), полученной в примере 1 (как способом А - ЭМГП фумаратА, так и способом Б - ЭМГП фумаратБ).
Пример 2. Оценка антиоксидантных свойств соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой in vitro и in vivo.
Оценку антиоксидантных свойств ЭМГП фумарата проводили в два этапа по методикам, описанным в [Гребенюк А.Н. и др. Оценка антиоксидантных свойств отечественного синтетического генистеина на моделях in vitro и in vivo / Экспериментальные исследования, 2013, Т. 2, №42, с. 83-87].
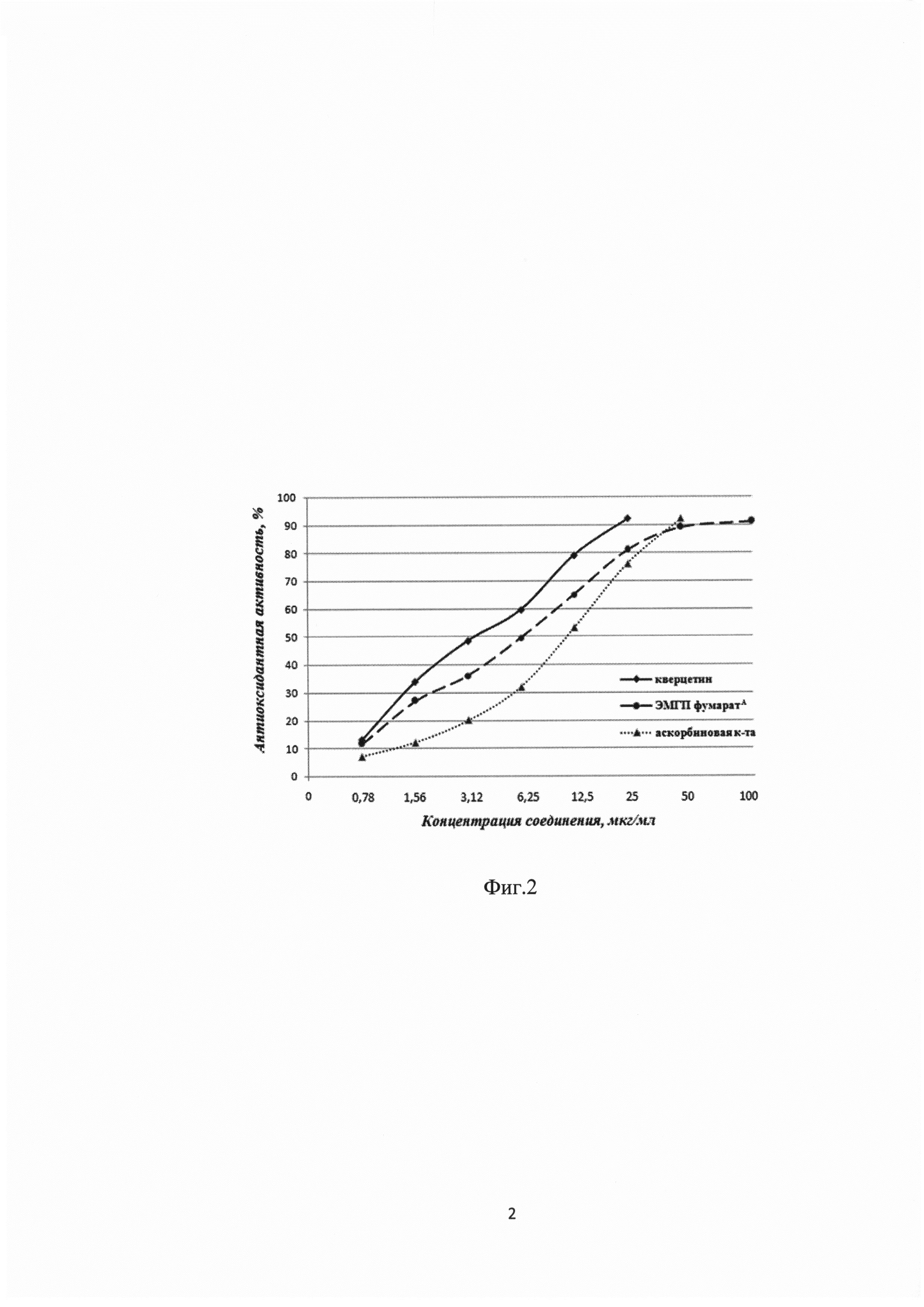
На первом этапе для исследования антиоксидантной активности (АОА) ЭМГП фумарата на модели in vitro использовали хемилюминесцентную реакцию рибофлавина в присутствии ионов двухвалентного железа и перекиси водорода [Путилина Ф.Е. Практикум по свободнорадикальному окислению / Учебно-методическое пособие. - Изд-во СПбГУ, 2006. - С. 82-83]. В измерительную кювету биохемилюминометра для создания модельной системы вносили 710 мкл калий-фосфатного буфера рН 9,0; 40 мкл 10 мМ рибофлавина; 100 мкл дистиллированной воды; 50 мкл 25 мМ FeSO4×7H2O. Инициировали процесс окисления введением 100 мкл 0,1% раствора перекиси водорода. В опытную систему вместо 100 мкл дистиллированной воды вносили 100 мкг ЭМГП фумарата, который растворяли в воде до исходной концентрации 1000 мкг/мл. Затем готовили ряд серийных разведений препарата в концентрациях от 0,78 до 100 мкг/мл. Измерение светосуммы осуществляли в течение 60 с при комнатной температуре. Величину АОА рассчитывали как отношение светосумм опытной и модельной систем в процентах. Графически определяли концентрацию соединения, которая уменьшала интенсивность хемилюминесценции модели на 50%.
Согласно проведенным исследованиям установлено, что среднеэффективная доза для ЭМГП фумаратаА и ЭМГП фумаратБ in vitro составляет 6,3 мкг/мл и 6,2 мкг/мл соответственно. Для сравнения величина этого показателя для кверцетина и аскорбиновой кислоты составляет 3,9 мкг/мл и 12,5 мкг/мл соответственно (по данным из [Гребенюк А.Н. и др. Оценка антиоксидантных свойств отечественного синтетического генистеина на моделях in vitro и in vivo / Экспериментальные исследования, 2013, Т. 2, №42, с. 83-87]). На фиг. 2 показана зависимость АОА ЭМГП фумаратаА, кверцетина и аскорбиновой кислоты от их концентраций (зависимость для ЭМГП фумаратБ не показана на фиг. 2, поскольку практически аналогична зависимости для ЭМГП фумаратаА).
Исследования, направленные на изучение антиоксидантных свойств ЭМГП фумарата in vivo выполнены на 52 белых беспородных крысах-самцах массой 160-220 г. При проведении исследования выполняли требования нормативно-правовых актов о порядке экспериментальной работы с использованием животных, в том числе по гуманному отношению к ним.
Перед введением ЭМГП фумарат предварительно растворяли в воде для инъекций. Растворы готовили непосредственно перед их введением крысам. Препарат в дозе 200 мг/кг вводили внутрибрюшинно. Объем вводимого животным раствора ЭМГП фумарата составлял 0,4 мл на 100 г массы тела животного. Особям контрольной группы тем же способом и в том же объеме вводили воду для инъекций.
Исследования показателей системы глутатиона и перекисного окисления липидов (ПОЛ) проводили через 1, 4, 24 и 72 ч после введения препарата. Кровь для исследований забирали у животных после декапитации, стабилизировали 4% раствором цитрата натрия, охлаждали и немедленно использовали в исследованиях. Эритроциты выделяли центрифугированием, затем гемолизировали 5 мМ ТРИС-НСl буфером с рН 7,6 в соотношении 1:9. Полученный гемолизат использовали для определения перечисленных ниже биохимических показателей.
Концентрацию восстановленного глутатиона (ВГ), малонового диальдегида (МДА), активность глутатион-редуктазы (ГР), глутатион-S-трансферазы (ГТ), глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) в гемолизате эритроцитов оценивали с использованием общепринятых методик [Арутюнян А.В. Методы оценки свободнорадикального окисления и антиоксидантной системы организма: методические рекомендации. - СПб.: Фолиант, 2000. - 104 с.]. Расчет активности ферментов производили на 1 г гемоглобина. Концентрацию гемоглобина определяли гемиглобинцианидным методом и выражали в г/л.
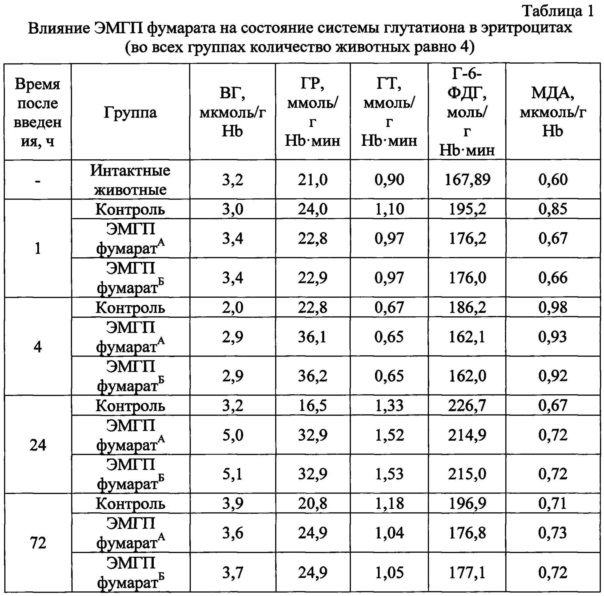
Статистическую обработку полученных результатов проводили на персональном компьютере с помощью пакета прикладных программ «Statistica 12,0». В каждой группе рассчитывали средние значения. Полученные результаты сведены в таблицу 1.
Показано, что в эритроцитах периферической крови крыс через 4 ч после введения животным ЭМГП фумаратаА и ЭМГП фумаратБ концентрация ВГ повышалась на 45%, а спустя 1 сутки значение этого показателя превосходило контрольные величины уже более чем на 55%. Также выявлено индуцирующее влияние ЭМГП фумарата на активность ферментов системы глутатиона, таких как ГР и ГТ. Так, через 4 ч после введения ЭМГП фумарата отмечалась тенденция к увеличению активности ГР более чем в 1,5 раза для, а через 24 ч - в 2 раза по сравнению с контролем. Отмечено также, что введение ЭМГП фумарата характеризовалось повышением активности ГТ через 24 ч в ~1,2 раза по сравнению с контрольным уровнем. Через 1 ч после введения ЭМГП фумарата в 1,3 раза по сравнению с контролем снижался уровень МДА. Таким образом, достоверно подтверждено наличие антиоксидантных свойств соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.
Пример 3. Влияние соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой на динамику окислительного стресса при воздействии активных форм кислорода (АФК).
В примере также для сравнения приведены результаты антиоксидантной активности диметилфумарата (ДМФ), который в соответствии с данными, приведенными в [патент RU 2218918 С1, опубл. 20.12.2003], проявил наиболее высокое стимулирующее действие на ферментативную активность сукцинатдегидрогеназы по сравнению с другими исследованными производными фумаровой кислоты. Полученные результаты сравнивали с соответствующими данными для этилметилгидроксипиридина сукцината (ЭМГП сукцинат) [Соловьева А.Г. и др. Влияние Мексидола на систему липопероксидации консервированной крови при воздействии активных форм кислорода в эксперименте in vitro / Биорадикалы и Антиоксиданты, 2016, Т. 3, №3, с. 98-100].
Эксперимент проводили на образцах крови. Каждый образец был разделен на 9 проб: проба 1 - контроль (исходная кровь); проба 2 - кровь, барботированная кислород-озоновой смесью (О3); проба 3 - кровь, подвергнутая воздействию О3 и ЭМГП фумаратаА; проба 4 - кровь, подвергнутая воздействию О3 и ЭМГП фумаратаБ; проба 5 - кровь, подвергнутая воздействию О3 и ДМФ; проба 6 - кровь, обработанная газовым потоком, содержащим синглетный кислород (СК); проба 7 - кровь, обработанная СК и ЭМГП фумаратомА; проба 8 - кровь, обработанная СК и ЭМГП фумаратомБ; проба 9 - кровь, обработанная СК и ДМФ.
Интенсивность перекисного окисления липидов (ПОЛ) определяли по уровню содержания вторичного продукта свободнорадикального окисления (СРО) - малонового диальдегида (МДА) в плазме и эритроцитах методом [Uchiyama М. et al. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test / Analytical Biochemistry, 1978, V. 86, р. 271]. Активность супероксиддисмутазы (СОД) определяли в гемолизате отмытых эритроцитов (1:10) по ингибированию образования продукта аутоокисления адреналина [Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы / Вопросы медицинской химии, 1999, Т. 45, №3, с. 109-116]. Концентрацию белка оценивали методом Лоури в модификации [Dawson J.M. et al. Lowry method of protein quantification Evidence for Photosensitivity / Analytical Biochemistry, 1984, V. 140, N. 2, pp. 391-393]. Полученные экспериментальные данные сведены в таблицу 2.
Приведенные данные о снижении ПОЛ при экспериментальном окислительном стрессе и повышении активности супероксиддисмутазы достоверно демонстрируют антиоксидантную эффективность этилметилгидроксипиридина фумарата. Причем исследуемое соединение характеризуется более высокими антиоксидантными свойствами по сравнению с диметилфумаратом и с этилметилгидроксипиридина сукцинатом.
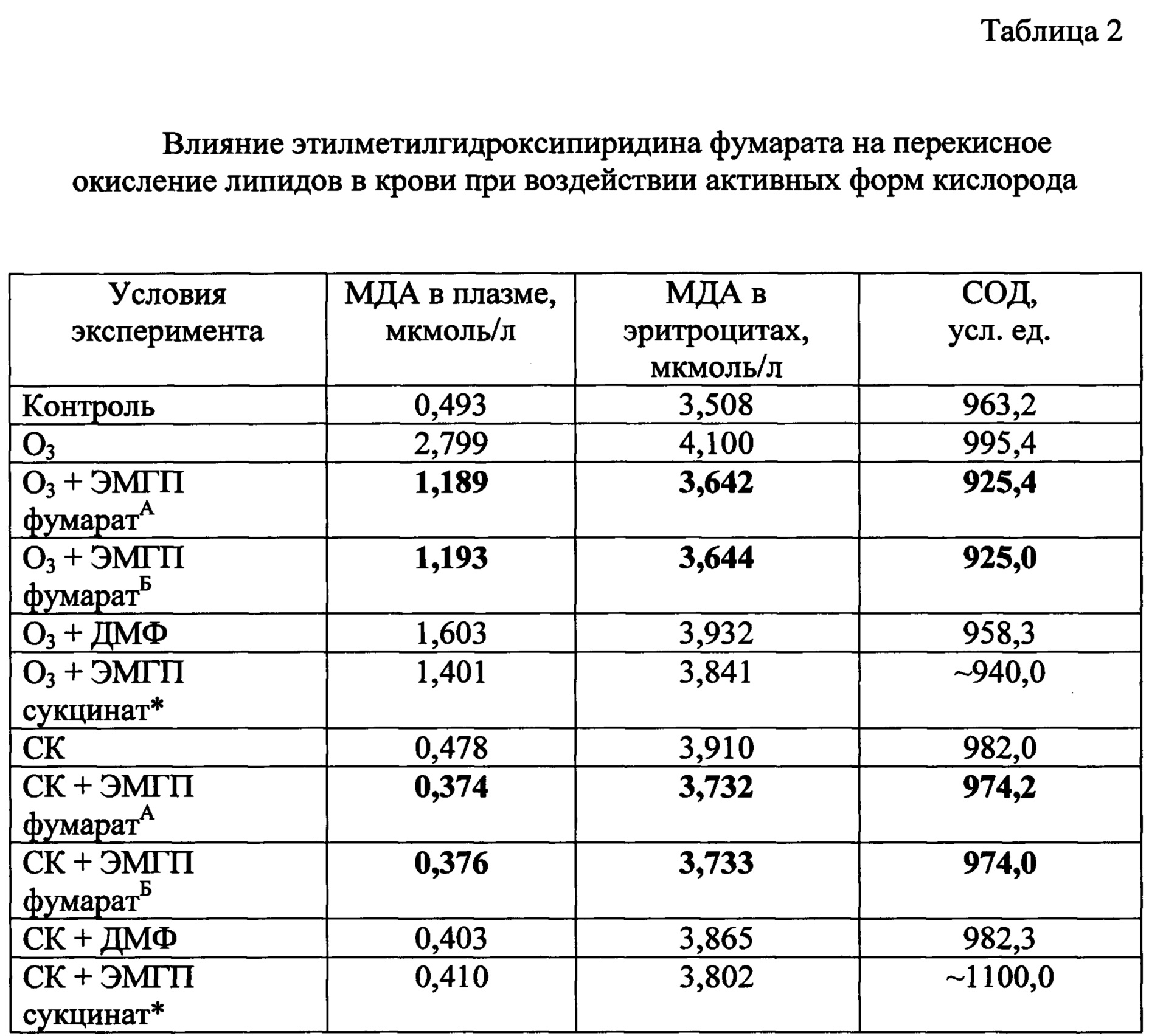
* значения показателей взяты из [Соловьева А.Г. и др. Влияние Мексидола на систему липопероксидации консервированной крови при воздействии активных форм кислорода в эксперименте in vitro / Биорадикалы и Антиоксиданты, 2016, Т. 3, №3, с. 98-100].