Результат интеллектуальной деятельности: СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИИ
Вид РИД
Изобретение
Введение
Согласно настоящему изобретению предложены соединения, которые представляют собой модуляторы сплайсинга гена SMN2 (от англ. "survival motor neuron" - выживание двигательных нейронов), их изготовление, фармацевтические композиции, включающие их, и их применение в качестве лекарств для лечения спинальной мышечной атрофии (СМА).
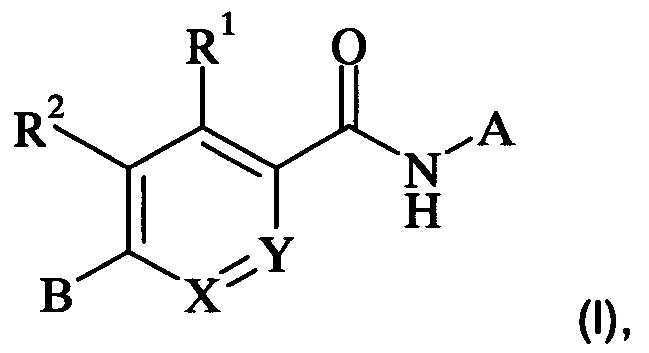
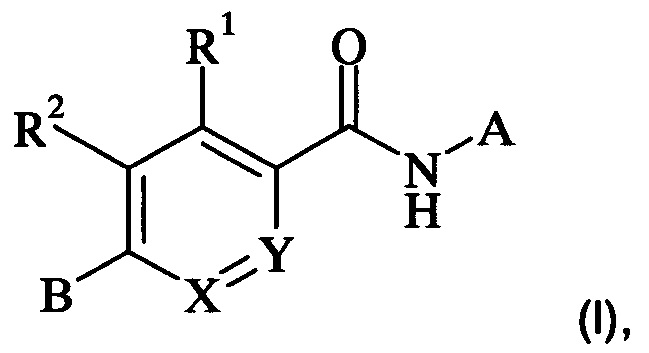
В частности, настоящее изобретение относится к соединениям формулы (I)
 ,
,
где А, В, X, Y, R1 и R2 являются такими, как описано в данном документе, и их фармацевтически приемлемым солям.
Уровень техники изобретения
Спинальная мышечная атрофия (СМА), в самом широком смысле, описывает группу наследственных и приобретенных заболеваний центральной нервной системы (ЦНС), характеризующихся прогрессирующей потерей двигательных нейронов в спинном мозге и стволе головного мозга, вызывающей мышечную слабость и атрофию мышц. Наиболее распространенная форма СМА вызвана мутациями в гене выживания двигательных нейронов (SMN) и обнаруживается с различной степенью тяжести как у детей, так и у взрослых (Crawford and Pardo, Neurobiol. Dis., 1996, 3:97).
Инфантильная СМА является самой тяжелой формой этого нейродегенеративного заболевания. Симптомы включают мышечную слабость, низкий мышечный тонус, слабый крик, слабость или склонность к падению, затруднения при сосании или глотании, накопление выделений в легких или горле, затруднения с кормлением и повышенную восприимчивость к инфекциям дыхательных путей. Ноги обычно слабее рук и не достигаются основные этапы развития ребенка, такие как поднятие головы или сидение прямо. В общем, чем раньше проявляются симптомы, тем короче продолжительность жизни. Вскоре после того, как клетки двигательных нейронов разрушаются, появляются симптомы. Тяжелые формы заболевания заканчиваются смертельным исходом и для всех форм не известны способы лечения. Течение СМА непосредственно связано со скоростью разрушения клеток двигательных нейронов и степенью тяжести возникающей в результате слабости. Младенцы с тяжелой формой СМА часто умирают от респираторного заболевания из-за слабости в мышцах, которые поддерживают дыхание. Дети с более легкими формами СМА живут намного дольше, хотя им может потребоваться расширенная медицинская поддержка, особенно детям с более тяжелой формой из многообразия форм этого заболевания. Клиническое многообразие заболеваний СМА подразделяют на следующие пять групп.
(a) СМА типа 0 (Внутриутробная СМА) является самой тяжелой формой заболевания и начинается до рождения. Обычно первым симптомом СМА типа 0 является пониженная подвижность плода, которая может быть замечена первый раз между 30 и 36 неделями беременности. После рождения эти новорожденные едва могут двигаться и испытывают трудности с глотанием и дыханием.
(b) СМА типа 1 (Младенческая СМА или болезнь Верднига-Гоффманна) проявляет симптомы между 0 и 6 месяцами. Эта форма СМА также является очень тяжелой. Пациенты никогда не достигают способности сидеть, и смерть обычно наступает в течение первых 2 лет при отсутствии вспомогательной искусственной вентиляции легких.
(c) СМА типа 2 (Промежуточная СМА) возникает в возрасте 7-18 месяцев. Пациенты достигают способности сидеть без помощи, но никогда не могут стоять или ходить без поддержки. Прогноз для этой группы главным образом зависит от степени поражения респираторных мышц.
(d) СМА типа 3 (Юношеская СМА или болезнь Кугельберга-Веландера) обычно диагностируется после 18 месяцев. Пациенты со СМА типа 3 способны в какой-то момент в процессе течения их заболевания самостоятельно ходить, но часто становятся прикованными к инвалидному креслу в юности или в зрелом возрасте.
(e) СМА типа 4 (Взрослая форма СМА). Слабость обычно начинается на последней стадии юношеского развития в языке, руках или ногах, затем прогрессирует в другие части тела. Течение взрослой формы СМА идет намного медленнее и оказывает небольшое или не оказывает влияния на ожидаемую продолжительность жизни.
Ген SMN был картирован в ходе анализа сцепления с комплексной областью на хромосоме 5q. У людей эта область содержит инвертированную дупликацию приблизительно 500 тысяч пар оснований (т.п.н. - тысяча пар нуклеотидов), что приводит к двум почти одинаковым копиям гена SMN. СМА возникает в результате инактивирующей мутации или делеции теломерной копии гена (SMN1) в обеих хромосомах, что приводит к потере функции гена SMN1. Однако у всех пациентов сохраняется центромерная копия гена (SMN2), и число копий гена SMN2 у пациентов со СМА обычно находится в обратной зависимости от тяжести заболевания; т.е. пациенты с менее тяжелой СМА имеют больше копий SMN2. Несмотря на это, SMN2 не способен полностью компенсировать потерю функции SMN1 вследствие альтернативного сплайсинга экзона 7, вызванного трансляционно молчащей С в Т мутацией в экзоне 7. В результате большая часть транскриптов, продуцируемых из SMN2, испытывает недостаток в экзоне 7 (SMN2 Δ7) и кодирует процессированный белок SMN, который имеет нарушенную функцию и быстро разрушается.
Предполагают, что белок SMN играет роль в процессинге и метаболизме рибонуклеиновой кислоты (РНК), обладая хорошо выраженной функцией опосредования сборки специфического класса РНК-белковых комплексов, называемых snRNPs (от англ. "small nuclear ribonucleoproteins" - малые ядерные рибонуклеопротеины). SMN может обладать другими функциями в двигательных нейронах, однако его роль в предотвращении выборочной дегенерации двигательных нейронах установлена не точно.
В большинстве случаев СМА диагностируют, основываясь на клинических симптомах и путем проведения теста на присутствие по меньшей мере одной копии гена SMN1. Однако приблизительно в 5% случаев СМА вызывается мутацией в генах, а не инактивацией SMN 1, некоторые из которых известны, а другие еще не определены. В некоторых случаях, когда проведение теста на ген SMN 1 невозможно или этот тест не показывает никакого нарушения, могут быть предписаны другие тесты, такие как электромиография (ЭМГ) или биопсия мышечной ткани.
В настоящее время медицинская помощь для пациентов со СМА ограничена поддерживающей терапией, включающей искусственную вентиляцию легких, лечебное питание и реабилитацию; не известно лекарство, которое устраняло бы первопричину заболевания. Современные способы лечения СМА включают предотвращение и лечение вторичных эффектов хронической потери двигательных единиц. Главный момент в лечении СМА типа 1 заключается в предотвращении и раннем лечении легочных проблем, которые являются причиной смерти в большинстве случаев. Несмотря на то, что некоторые младенцы, страдающие СМА, доживают до взрослого возраста, ожидаемая продолжительность жизни младенцев со СМА типа 1 составляет менее двух лет.
Разработано несколько моделей СМА на мышах. В частности, модель SMN дельта экзон 7 (SMN Δ7) (Le et al., Hum. Mol. Genet., 2005, 14:845) содержит как ген SMN2, так и несколько копий SMN2 Δ7 комплементарной дезоксирибонуклеиновой кислоты (кДНК) и повторяет многие из фенотипических особенностей СМА типа 1. Модель SMN Δ7 можно использовать как в исследованиях экспрессии SMN2, так и оценке двигательной функции и выживания. Мышиная модель с С/С-аллелем (Jackson Laboratory strain #008714, The Jackson Laboratory, Bar Harbor, ME) является моделью менее тяжелой формы заболевания СМА, в которой мыши имеют пониженные уровни как полноразмерного SMN2 (ПР SMN2) матричной РНК (мРНК), так и белка SMN. Фенотип мыши с С/С-аллелем имеет ген SMN2 и гибрид mSMN1 - ген SMN2, который подвергается альтернативному сплайсингу, но не имеет выраженной мышечной слабости. Мышиную модель с С/С-аллелем используют в исследованиях экспрессии SMN2.
Вследствие улучшенного понимания генетической основы и патофизиологии СМА были исследованы некоторые подходы к лечению, но ни один пока не дал положительных результатов при клинических испытаниях.
Замещение гена SMN1 при использовании вирусных векторов доставки и замещение клеток при использовании дифференцированных SMN1+/+ стволовых клеток показало эффективность на животных моделях СМА. Требуется проведение дальнейших исследований для определения безопасности и иммунного ответа и для удовлетворения требованию для начала лечения на неонатальной стадии, прежде чем эти подходы можно будет применять на людях.
Также коррекцию альтернативного сплайсинга SMN2 в культивируемых клетках достигали, используя синтетические нуклеиновые кислоты в качестве терапевтических средств: (i) антисмысловые олигонуклеотиды, которые целенаправленно воздействуют на элементы последовательности в SMN2 предшественника мРНК (пре-мРНК) и сдвигают направление реакции сплайсинга в сторону образования полноразмерного SMN2 мРНК (Passini et al., Sci. Transl. Med., 2011, 3:72ra18; и Hua et al., Nature, 2011, 478:123) и (ii) молекулы РНК, подвергнутые транс-сплайсингу, которые обеспечивают полнофункциональную последовательность РНК, которые замещают мутантный фрагмент в процессе сплайсинга и генерируют полноразмерный SMN1 мРНК (Coady and Lorson, J Neurosci., 2010, 30:126).
Другие подходы исследования включают поиск лекарственных средств, которые увеличивают уровни SMN, усиливают остаточную функцию SMN или компенсируют ее потерю. Было показано, что аминогликозиды увеличивают экспрессию стабилизированного белка SMN, продуцируемого из SMN2 Δ7 мРНК, путем промотирования трансляционного сквозного считывания аберрантного стоп-кодона, но они обладают низким проникновением в центральную нервную систему и являются токсичными после повторного дозирования. Было показано, что химиотерапевтические вещества, такие как акларубицин, увеличивают содержание белка SMN в клеточной культуре; однако профиль токсичности этих лекарственных средств препятствует их длительному использованию пациентами со СМА. Некоторые лекарственные средства, проходящие клинические испытания по поводу лечения СМА, включают активаторы транскрипции, такие как ингибиторы гистондеацетилазы (HDAC, от англ. "histone deacetylase") (например, бутираты, вальпроевая кислота и гидроксимочевина), и стабилизаторы мРНК (ингибитор декапирования мРНК RG3039 от Repligen), предназначенные для увеличения количества суммарной РНК, транскрибируемой из гена SMN2. Однако применение ингибиторов HDAC или стабилизаторов мРНК не затрагивает первопричину СМА и может приводить к глобальному увеличению транскрипции и экспрессии гена с возможными проблемами безопасности у людей.
В альтернативном подходе для исследования были выбраны нейропротективные вещества, такие как олесоксим. Такие подходы направлены не на SMN в лечении СМА, а наоборот на поиск возможности защитить SMN-дефицитные двигательные нейроны от нейродегенерации.
Система, предназначенная для распознавания соединений, которые увеличивают включение экзона 7 SMN в РНК, транскрибируемую из гена SMN2, и конкретные соединения бензоксазола и бензизоксазола, с помощью этой системы установленные, описаны в международной заявке на патент WO 2009/151546 А1. Система, предназначенная для распознавания соединений, которые вызывают рибосомный сдвиг рамки считывания, продуцируя стабилизированный белок SMN из SMN2 Δ7 мРНК, и конкретные соединения изоиндолинона, с помощью этой системы установленные, описаны в международной заявке на патент WO 2010/019236 A1.
Несмотря на прогресс, достигнутый в понимании генетической основы и патофизиологии СМА, остается потребность в определении соединений, которые изменят течение спинальной мышечной атрофии, одного из самых разрушительных неврологических заболеваний детского возраста.
Подробное описание изобретения
Если не указано иное, то все научно-технические термины, используемые в этом документе, имеют такие же значения, которые обычно понимает под ними средний специалист в области техники, к которой данное изобретение относится. Несмотря на то, что способы и вещества, подобные или эквивалентные тем, что описаны в этом документе, можно использовать на практике или проверяя изобретение, ниже описаны подходящие способы и вещества.
Все публикации, заявки на патенты, патенты и другие ссылочные материалы, упомянутые в этом документе, включены в него полностью путем ссылки на них.
Используемая в данной заявке номенклатура основывается на систематической номенклатуре ИЮПАК, если не указано иное.
Любая открытая валентность, встречающаяся на атоме углерода, кислорода, серы или азота в структурах данного документа, указывает на присутствие водорода, если не указано иное.
Определения, описанные в этом документе, используются в независимости от того, встречаются ли рассматриваемые термины отдельно или в комбинации. Предполагается, что определения, описанные в этом документе, можно прибавлять с образованием химически-релевантных сочетаний, таких как, например, "гетероциклоалкиларил", "галоалкилгетероарил", "арилалкилгетероциклоалкил" или "алкоксиалкил". Последний член сочетания является радикалом, который связан с остальной частью молекулы. Другие члены сочетания присоединены к связывающему радикалу в обратном порядке относительно литературной последовательности, например, сочетание арилалкилгетероциклоалкил относится к радикалу гетероциклоалкила, который замещен алкилом, который замещен арилом.
Термин "группировка" относится к атому или группе химически связанных атомов, которая присоединена к другому атому или молекуле с помощью одной или более химических связей, образуя часть молекулы. Например, переменные R1 и R2 формулы (I) относятся к группировкам, которые присоединены к основной структуре формулы I с помощью ковалентной связи.
При указании числа заместителей термин "один или более" относится к диапазону от одного заместителя до максимально возможного числа замещений, т.е. замены одного водорода вплоть до замены всех водородов заместителями.
Термин "возможный" или "возможно" означает, что впоследствии описанное событие или обстоятельство может происходить, но не требуется, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, при которых оно не происходит.
Термин "заместитель" обозначает атом или группу атомов, замещающую атом водорода в исходной молекуле.
Термин "замещенный" обозначает, что определенная группа несет один или более заместителей. Когда группа может иметь несколько заместителей и определен ряд возможных заместителей, тогда заместители выбирают независимо, и не обязательно они будут одинаковыми. Термин "незамещенный" означает, что определенная группа не имеет заместителей. Термин "возможно замещенный" означает, что определенная группа не замещена или замещена одним или более заместителями, независимо выбранными из группы возможных заместителей. При указании числа заместителей термин "один или более" означает от одного заместителя до максимально возможного числа замещений, т.е. замены одного водорода вплоть до замены всех водородов заместителями.
Термин "соединение(я) по данному изобретению" и "соединение(я) по настоящему изобретению" относится к соединениям формулы (I), как раскрыто в данном документе, и их стереоизомерам, таутомерам, сольватам и солям (например, фармацевтически приемлемым солям).
Когда соединения по изобретению представляют собой твердые вещества, квалифицированные специалисты в данной области техники понимают, что эти соединения и их сольваты и соли могут существовать в разных твердых формах, особенно разных кристаллических формах, все из которых, как предполагается, находятся в объеме настоящего изобретения и определенных формул.
Термин "фармацевтически приемлемые соли" обозначает соли, которые не биологически или иным образом не желательны. Фармацевтически приемлемые соли включают как соли присоединения кислоты, так и соли присоединения основания.
Термин "фармацевтически приемлемая соль присоединения кислоты" обозначает те фармацевтически приемлемые соли, что образованы с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота, и органическими кислотами, выбранными из алифатического, циклоалифатического, ароматического, аралифатического, гетероциклического, карбонового и сульфонового классов органических кислот, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота и салициловая кислота.
Особыми фармацевтически приемлемыми солями по настоящему изобретению являются соли, образованные с хлористоводородной кислотой, дающей гидрохлорид, дигидрохлорид или тригидрохлорид.
Стереохимические определения и обозначения, используемые в данном документе, как правило следуют из S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. При описании оптически активного соединения используют приставки D и L, или R и S, чтобы обозначить абсолютную конфигурацию молекулы относительно ее хирального центра(ов). Рассматриваемые заместители, присоединенные к хиральному центру, ранжируются в соответствии с правилом последовательности Кана-Ингольда-Прелога (Cahn et al. Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511). Приставки D и L или (+) и (-) используют для обозначения направления вращения плоско-поляризованного света соединением, (-) или L обозначает, что соединение является левовращающим. Соединение с приставкой (+) или D является правовращающим.
"Основность" соединения выражена в данном документе с помощью отрицательного десятичного логарифма константы кислотности сопряженной кислоты (pKa=-log Ka). Чем больше pKa сопряженной кислоты, тем сильнее основание (pKa+pKb=14). В данной заявке атом или функциональную группу обозначают "основной", если она подходит для акцептирования протона, и, если расчетное значение pKa ее сопряженной кислоты составляет по меньшей мере 7, в частности, если расчетное значение pKa ее сопряженной кислоты составляет по меньшей мере 7,8, особенно если расчетное значение pKa ее сопряженной кислоты составляет по меньшей мере 8. Значения pKa вычисляли с помощью компьютерного моделирования, как описано у F. Milletti et al., J. Chem. Inf. Model (2007) 47:2172-2181.
Термины "гало", "галоген" и "галид" используются в данном документе взаимозаменяемо и обозначают фтор, хлор, бром или йод. Особыми примерами галогена являются фтор и хлор, в особенности фтор.
Термин "алкил" обозначает одновалентную линейную или разветвленную насыщенную углеводородную группу от 1 до 7 атомов углерода. В особых воплощениях алкил имеет от 1 до 4 атомов углерода, и в особенных воплощениях - от 1 до 2 атомов углерода. Примеры алкила включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Особыми примерами алкила являются метил и этил.
Термин "алкокси" обозначает группу формулы -О-R', где R' представляет собой алкильную группу. Примеры алкокси группировок включают метокси, этокси, изопропокси и трет-бутокси. Особыми примерами алкокси являются метокси и этокси.
Термин "галоалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы заменен одинаковыми или разными атомами галогена, особенно атомами фтора. Примеры галоалкила включают монофтор-, дифтор- или трифтор-метил, -этил или -пропил, например, 3,3,3-трифторпропил, 2-фторэтил, 2,2,2-трифторэтил, фторметил или трифторметил. Термин "пергалоалкил" обозначает алкильную группу, где все атомы водорода алкильной группы заменены одинаковыми или разными атомами галогена. Особым примером галоалкила является трифторметил.
Термин "галоалкокси" обозначает алкокси группу, где по меньшей мере один из атомов водорода алкокси группы заменен одинаковыми или разными атомами галогена, особенно атомами фтора. Примеры галоалкоксила включают монофтор-, дифтор- или трифтор-метокси, -этокси или -пропокси, например, 3,3,3-трифторпропокси, 2-фторэтокси, 2,2,2-трифторэтокси, фторметокси или трифторметокси. Термин "пергалоалкокси" обозначает алкокси группу, где все атомы водорода алкокси группы заменены одинаковыми или разными атомами галогена. Особым примером галоалкокси является 2,2,2-трифторэтокси.
Термин "бициклическая кольцевая система" обозначает два кольца, которые конденсированы друг с другом через общую одинарную или двойную связь (аннелированная бициклическая кольцевая система), через последовательность трех или более общих атомов (мостиковая бициклическая кольцевая система) или через один общий атом (спиро бициклическая кольцевая система). Бициклические кольцевые системы могут быть насыщенными, частично ненасыщенными, ненасыщенными или ароматическими. Бициклические кольцевые системы могут содержать гетероатомы, выбранные из N, О и S.
Термин "циклоалкил" обозначает одновалентную насыщенную моноциклическую углеводородную группу от 3 до 7 кольцевых атомов углерода. Примерами циклоалкила являются циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Особым примером циклоалкила является циклопропил.
Термин "гетероциклоалкил" обозначает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему от 3 до 9 кольцевых атомов, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, О и S, остальные кольцевые атомы представляют собой углерод. В особых воплощениях гетероциклоалкил представляет собой одновалентную насыщенную моноциклическую кольцевую систему от 4 до 7 кольцевых атомов, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, О и S, остальные кольцевые атомы представляют собой углерод. Примерами моноциклического насыщенного гетероциклоалкила являются азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанил, гомопиперазинил или оксазепанил. Примерами бициклического насыщенного гетероциклоалкила являются 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-аза-бицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил или 3-тиа-9-аза-бицикло[3.3.1]нонил. Примерами частично ненасыщенного гетероциклоалкила являются дигидрофурил, имидазолинил, дигидрооксазолил, тетрагидропиридинил или дигидропиранил. Особыми примерами гетероциклоалкила являются насыщенные или частично ненасыщенные моно- или бициклические 4-9-членные гетероциклоалкилы, содержащие один или два кольцевых атома азота, остальные кольцевые атомы представляют собой углерод. Особыми примерами моноциклического насыщенного гетероциклоалкила являются пиперидинил и пиперазинил. Особым примером моноциклического частично ненасыщенного гетероциклоалкила является 1,2,3,6-тетрагидропиридин-4-ил. Особыми примерами бициклического насыщенного гетероциклоалкила являются гексагидропирроло[1,2-а]пиразин-2-ил, гексагидропирроло[3,4-с]пиррол-2-ил и 2,6-диазаспиро[3.3]гептан-2-ил. Самым особенным примером гетероциклоалкила является пиперазинил.
Термин "расположенный противоположно месту присоединения" обозначает положение атома в циклической кольцевой системе. Если точку присоединения моноциклического кольца к остальной части основы молекулы называют положением 1, тогда "расположенный противоположно месту присоединения" обозначает положение 3 для моноциклического 4-членного кольца, положения 3 или 4 для моноциклического 5-членного кольца, положение 4 для моноциклического 6-членного кольца и положения 4 или 5 для моноциклического 7-членного кольца. Для бициклических кольцевых систем "расположенный противоположно месту присоединения" обозначает кольцевой атом второго конденсированного кольца (включая атомы в голове моста).
Термин "ароматический" обозначает общепринятое представление об ароматичности, как определено в литературе, в частности ИЮПАК - Compendium of Chemical Terminology, 2nd, A.D. McNaught & A. Wilkinson (Eds). Blackwell Scientific Publications, Oxford (1997).
Термин "гетероарил" обозначает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему от 5 до 12 кольцевых атомов, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, О и S, остальные кольцевые атомы представляют собой углерод. Примеры гетероарильных группировок включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил. Особыми примерами гетероарила являются бициклические 9-членные гетероарилы, содержащие 2 или 3 гетероатома, выбранных из N или О. Особенными примерами гетероарила являются имидазо[1,2-а]пиразин-2-ил, имидазо[1,2-а]пиридин-6-ил и бензо[d]оксазол-6-ил. Самым особенным гетероарилом является имидазо[1,2-а]пиридин-6-ил.
Термин "алкилен" обозначает линейную насыщенную двухвалентную углеводородную группу от 2 до 7 атомов углерода или двухвалентную разветвленную насыщенную углеводородную группу от 3 до 7 атомов углерода. Примеры алкиленовых групп включают метилен, этилен, пропилен, 2-метилпропилен, бутилен, 2-этилбутилен, пентилен, гексилен. Особыми примерами алкилена являются метилен и этилен.
Термин "защитная группа" обозначает группу, которая избирательно блокирует реакционноспособный центр в соединении с несколькими функциональными группами таким образом, что химическую реакцию можно провести селективно по другому незащищенному реакционноспособному центру, в значении, традиционно связанным с ним в синтетической химии. Защитные группы можно удалить в подходящий момент. Примерными защитными группами являются аминозащитные группы, карбоксизащитные группы или гидроксизащитные группы.
Термин "аминозащитная группа" обозначает группы, предназначенные для защиты аминогруппы, и включает бензил, бензилоксикарбонил (карбобензилокси, CBZ), Fmoc (9-флуоренилметилоксикарбонил), п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, трет-бутоксикарбонил (ВОС) и трифторацетил. Особой аминозащитной группой является трет-бутоксикарбонил (ВОС). Дополнительные примеры этих групп находятся у Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapter 7; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981. Термин "защищенная аминогруппа" относится к аминогруппе, замещенной аминозащитными группами.
Термин "снятие защитных групп" или "удаление защитных групп" обозначает процесс, в ходе которого защитную группу удаляют после завершения селективной реакции. Реагенты, удаляющие защитные группы, включают кислоты, основания или водород, в частности карбонаты калия или натрия, гидроксид лития в спиртовых растворах, цинк в метаноле, уксусную кислоту, трифторуксусную кислоту, палладиевые катализаторы или трибромид бора. Особенным реагентом, удаляющим защитные группы, является хлористоводородная кислота.
Термин "активный фармацевтический ингредиент" (или "АФИ") обозначает соединение или молекулу в фармацевтической композиции, которое обладает особой биологической активностью.
Термин "фармацевтическая композиция" относится к препарату, который находится в такой форме, что позволяет биологической активности активного ингредиента, содержащегося в нем, быть эффективной, и который не содержит дополнительные компоненты, неприемлемо токсичные для субъекта, которому вводят композицию.
Термин "фармацевтически приемлемый" обозначает свойство вещества, которое полезно при получении фармацевтической композиции, которая является в целом безопасной, нетоксичной и не биологически, не иным образом нежелательной и является приемлемой для ветеринарии, а также фармацевтического использования человеком.
Термин "фармацевтически приемлемый эксципиент" обозначает любой ингредиент, не обладающий терапевтической активностью и являющийся нетоксичным, такой как разрыхлители, связующие вещества, наполнители, растворители, буферы, регулирующие тоничность вещества, стабилизаторы, антиоксиданты, поверхностно-активные вещества или смазывающие вещества, используемые при изготовлении фармацевтических продуктов.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтической композиции, помимо активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает, но не ограничивается этим, буфер, эксципиент, стабилизатор или консервант.
"Пациент" или "субъект" представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются этим, одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, кроме человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В конкретных воплощениях пациент или субъект представляет собой человека. В особом воплощении изобретения субъект представляет собой человека со спинальной мышечной атрофией (СМА). В другом конкретном воплощении субъект представляет собой человека со СМА, вызванной инактивирующей мутацией или делецией гена SMN1 в обеих хромосомах, что приводит к потере функции гена SMN1.
Термин "спинальная мышечная атрофия" (или СМА) относится к заболеванию, вызванному инактивирующей мутацией или делецией гена SMN1 в обеих хромосомах, что приводит к потере функции гена SMN1.
Симптомы СМА включают мышечную слабость, низкий мышечный тонус, слабый крик, слабый кашель, слабость или склонность к падению, затруднения при сосании или глотании, затрудненное дыхание, накопление выделений в легких или горле, сжатые кулаки с потной рукой, дрожание/вибрацию языка, голова часто наклонена на одну сторону, даже лежа, ноги обычно слабее рук, ноги часто принимают положение "лягушачьих лапок", затруднения с кормлением, повышенную восприимчивость к инфекциям дыхательных путей, дисфункцию кишечника/мочевого пузыря, вес меньше нормального, неспособность сидеть без поддержки, неспособность ходить, неспособность ползать и гипотонию, арефлексию и множественные врожденные контрактуры (артрогрипоз), связанные с потерей клеток передних рогов спинного мозга.
Термин "подвергающаяся лечению спинальная мышечная атрофия (СМА)" или "лечение спинальной мышечной атрофии (СМА)" включает один или более следующих эффектов: (i) снижение или облегчение тяжести СМА; (ii) замедление наступления СМА; (iii) ингибирование развития СМА; (iv) устранение госпитализации субъекта; (v) снижение длительности госпитализации субъекта; (vi) увеличение продолжительности жизни субъекта; (vii) повышение качества жизни субъекта; (viii) снижение числа симптомов, связанных со СМА; (ix) уменьшение или облегчение тяжести одного или более симптомов, связанных со СМА; (x) снижение продолжительности симптома, связанного со СМА; (xi) предотвращение повторения симптома, связанного со СМА; (xii) ингибирование развития или наступления симптома СМА; и/или (xiii) ингибирование прогрессирования симптома, связанного со СМА.
А именно, "лечение СМА" обозначает один или более следующих положительных эффектов: (i) снижение потери мышечной силы; (ii) увеличение мышечной силы; (iii) снижение атрофии мышц; (iv) уменьшение потери двигательной функции; (v) увеличение двигательных нейронов; (vii) сокращение потери двигательных нейронов; (viii) защита SMN-дефицитных двигательных нейронов от дегенерации; (ix) увеличение двигательной функции; (x) увеличение функции легких; и/или (xi) сокращение потери функции легких.
Подробно "лечение СМА" приводит к способности функционировать или помогает поддерживать функциональную способность младенца или ребенка ясельного возраста сидеть без поддержки или младенца, ребенка ясельного возраста, подростка или взрослого стоять без поддержки, ходить без поддержки, бегать без поддержки, дышать без поддержки, поворачиваться во время сна без поддержки или глотать без поддержки.
"Эффективное количество" агента, например, фармацевтической композиции, относится к количеству, достаточному, при дозах и в течение необходимого времени, чтобы достигнуть требуемого терапевтического или профилактического результата.
Термин "предотвращать" или "предотвращение" болезненного состояния означает, что клинические симптомы болезненного состояния не развиваются у субъекта, который может подвергаться или быть предрасположенным к болезненному состоянию, но еще не испытывает или не проявляет симптомы болезненного состояния.
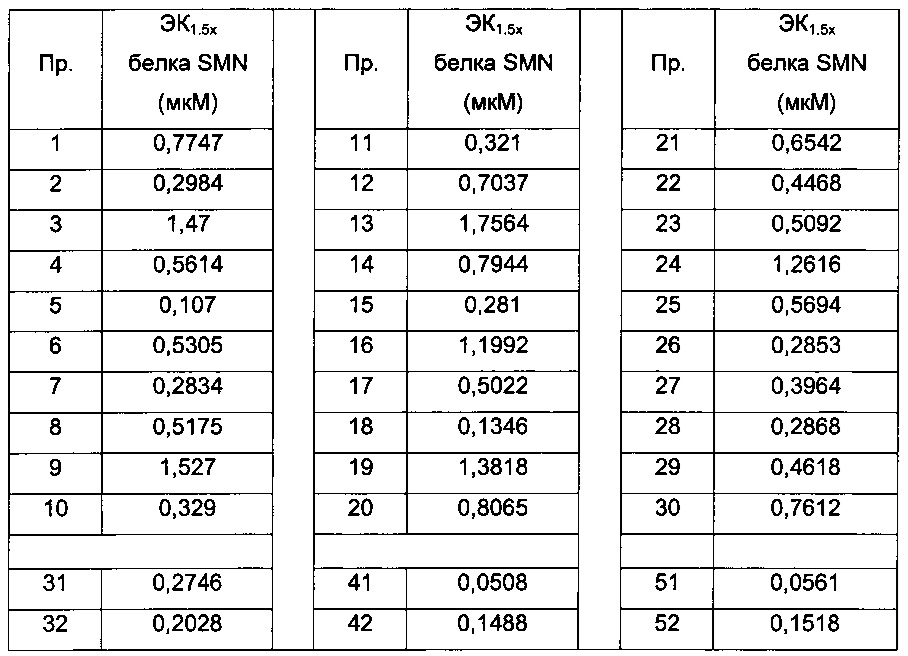
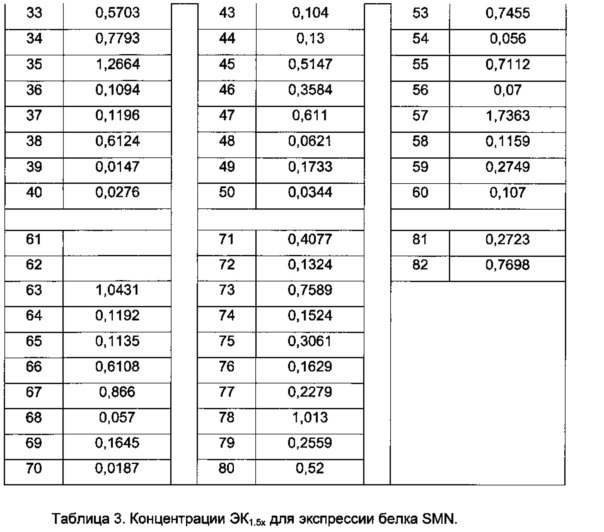
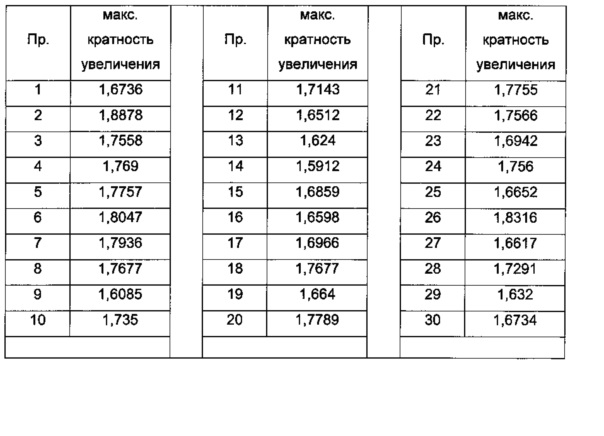
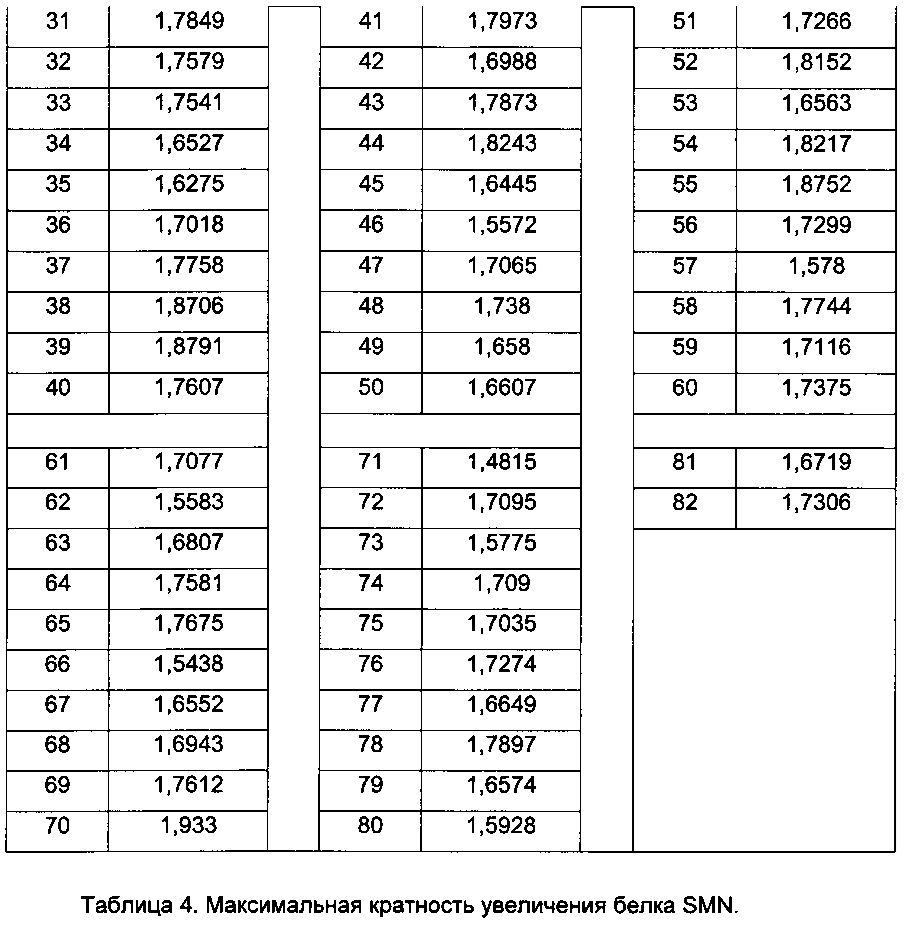
Термин "концентрация ЭК1.5х для продуцирования полноразмерного минигена SMN2 мРНК" (или "ЭК1.5х минигена") определяется как концентрация исследуемого соединения, при которой происходит эффективное увеличение количества полноразмерного минигена SMN2 мРНК до уровня в 1,5 раза больше, чем уровень в клетках, обработанных инертным веществом.
Термин "концентрация ЭК1.5х для экспрессии белка SMN" (или "ЭК1.5х белка SMN") определяется как концентрация исследуемого соединения, при которой происходит эффективное продуцирование количества белка SMN в фибробластах пациента со СМА в 1,5 раза больше по сравнению с количеством, продуцируемым в контрольных клетках, обработанных инертным веществом.
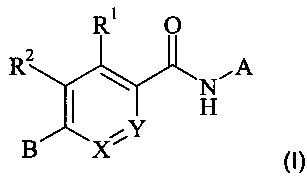
Подробно настоящее изобретение относится к соединениям формулы (I)
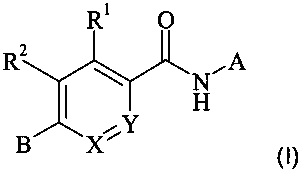 ,
,
где
X представляет собой N или CR3;
Y представляет собой N или CR4; при условии, что оба X и Y не представляют собой N;
А представляет собой бициклический 9-членный гетероарил, содержащий два или три гетероатома, независимо выбранных из N или О, где А возможно замещен одним, двумя или тремя R5;
В представляет собой насыщенный или частично ненасыщенный моно- или бициклический 4-9-членный гетероциклоалкил, содержащий один или два кольцевых атома азота, остальные кольцевые атомы представляют собой углерод, где В возможно замещен одним, двумя или тремя R6;
R1 представляет собой водород, галоген, С1-7-алкил, С1-7-галоалкил, C1-7-алкокси или С1-7-галоалкокси;
R2 представляет собой водород, галоген, С1-7-алкил, С1-7-галоалкил, C1-7-алкокси или С1-7-галоалкокси;
R3 представляет собой водород, галоген, С1-7-алкил, С1-7-галоалкил, C1-7-алкокси или С1-7-галоалкокси;
R4 представляет собой водород, галоген, C1-7-алкил, С1-7-галоалкил, C1-7-алкокси или С1-7-галоалкокси;
каждый R5 независимо выбран из галогена, циано, С1-7-алкила, С1-7-галоалкила или С3-7-циклоалкила;
каждый R6 независимо выбран из С1-7-алкила, или два R6 вместе образуют С2-7-алкилен;
и их фармацевтически приемлемым солям.
Особыми воплощениями настоящего изобретения являются соединения формулы (I) и их фармацевтически приемлемые соли.
Кроме того, следует понимать, что каждое воплощение, относящееся к определенным А, В, X, Y, R1, R2, R3, R4, R5 или R6, как раскрыто в данном документе, можно объединить с любым другим воплощением, относящимся к другим А, В, X, Y, R1, R2, R3, R4, R5 или R6, как раскрыто в данном документе.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из группы имидазо[1,2-а]пиразин-2-ила, имидазо[1,2-а]пиридинила и бензо[d]оксазолила, которые возможно замещены одним, двумя или тремя R5.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из группы имидазо[1,2-а]пиразин-2-ила, имидазо[1,2-а]пиридин-6-ила и бензо[d]оксазол-6-ила, которые возможно замещены одним, двумя или тремя R5.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из группы имидазо[1,2-а]пиразин-2-ила, замещенного двумя C1-7-алкилами, имидазо[1,2-а]пиридин-6-ила, замещенного одним или двумя C1-7-алкилами, имидазо[1,2-а]пиридин-6-ила, замещенного одним C1-7-алкилом и одним галогеном, имидазо[1,2-а]пиридин-6-ила, замещенного одним C1-7-алкилом и одним C1-7-галоалкилом, бензо[d]оксазол-6-ила, замещенного одним C1-7-алкилом, и бензо[d]оксазол-6-ила, замещенного одним C1-7-алкилом и одним галогеном.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А представляет собой имидазо[1,2-а]пиридинил, который возможно замещен одним или двумя R5.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А представляет собой имидазо[1,2-а]пиридин-6-ил, замещенный одним C1-7-алкилом и одним галогеном.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из 2-метилбензо[d]оксазол-6-ила, 4-фтор-2-метилбензо[d]оксазол-6-ила, 6,8-диметилимидазо[1,2-а]пиразин-2-ила, 2-метилимидазо[1,2-а]пиридин-6-ила, 2,7-диметилимидазо[1,2-а]пиридин-6-ила, 2,8-диметилимидазо[1,2-а]пиридин-6-ила, 2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ила, 8-фтор-2-метилимидазо[1,2-а]пиридин-6-ила и 8-хлор-2-метилимидазо[1,2-а]пиридин-6-ила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из 8-фтор-2-метилимидазо[1,2-а]пиридин-6-ила и 8-хлор-2-метилимидазо[1,2-а]пиридин-6-ила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R5 независимо выбран из галогена, C1-7-алкила или C1-7-галоалкила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R5 независимо выбран из метила, фтора, хлора и трифторметила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А замещен двумя R5, где один R5 представляет собой метил, и другой R5 представляет собой фтор или хлор.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где А выбран из группы
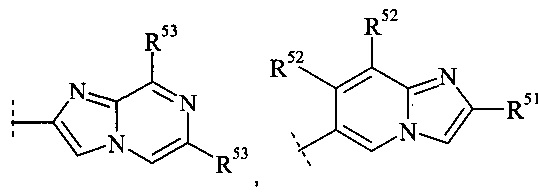 и
и 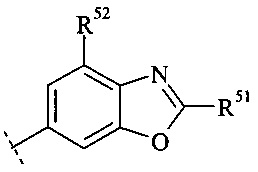 ,
,
где R51, R52 и R53 независимо выбраны из группы водорода, галогена, циано, С1-7-алкила, C1-7-галоалкила и С3-7-циклоалкила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R51, R52 и R53 независимо выбраны из группы водорода, метила, фтора, хлора и трифторметила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R51 выбран из водорода и С1-7-алкила.
Особое воплощение настоящего изобретения относится к соединениям формулы (I), где R51 выбран из водорода и C1-2-алкила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R52 независимо выбран из водорода, галогена, циано, C1-7-алкила, C1-7-галоалкила и С3-7 циклоалкила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R52 независимо выбран из водорода, галогена, циано, C1-2-алкила, C1-2-галоалкила и циклопропила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R52 независимо выбран из водорода и фтора.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R53 независимо выбран из водорода, хлора, C1-7-алкила, C1-7-галоалкила и С3-7 циклоалкила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R53 независимо выбран из водорода, хлора, C1-2-алкила, C1-2-галоалкила и циклопропила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В, как определено в данном документе, дополнительно отличается тем, что один кольцевой атом азота является основным.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В, как определено в данном документе, дополнительно отличается тем, что его один, два или три возможных заместителя R6 присоединены к и/или непосредственно рядом с основными кольцевыми атомами азота.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В выбран из 1,2,3,6-тетрагидропиридинила, 2,6-диазаспиро[3.3]гептанила, гексагидропирроло[3,4-с]пирролила, гексагидропирроло[1,2-а]пиразинила, пиперазинила и пиперидинила, где каждый возможно замещен одним, двумя или тремя R6.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В выбран из 1,2,3,6-тетрагидропиридин-4-ила, 2,6-диазаспиро[3.3]гептан-2-ила, гексагидропирроло[3,4-с]пиррол-2-ила, гексагидропирроло[1,2-а]пиразин-2-ила, пиперазин-1-ила и пиперидин-4-ила, где каждый возможно замещен одним, двумя или тремя R6.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В выбран из 1,2,3,6-тетрагидропиридин-4-ила и пиперазин-1-ила, где каждый возможно замещен одним, двумя или тремя R6.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В представляет собой пиперазин-1-ил, возможно замещенный одним, двумя или тремя R6.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В выбран из пиперазин-1-ила, 3-метил-пиперазин-1-ила и 3,3-диметилпиперазин-1-ила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R6 представляет собой C1-7 алкил.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R6 независимо выбран из метила и этила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где каждый R6 независимо выбран из метила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где В выбран из группы
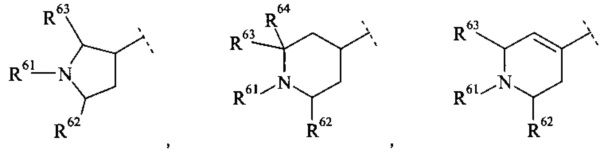 ,
,
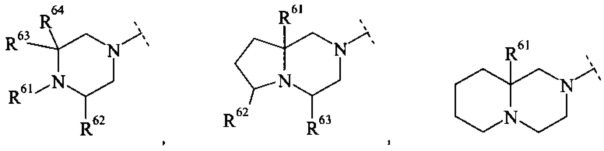 ,
,
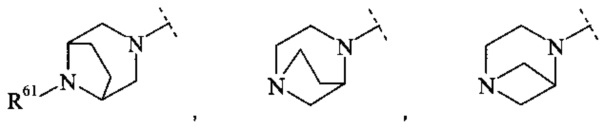 ,
,
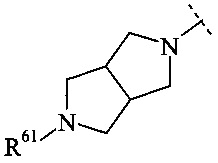 и
и 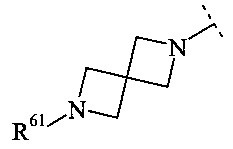 ,
,
где R61, R62, R63 и R64 независимо выбраны из водорода или С1-7-алкила, или где два из R61, R62 и R63 вместе образуют С2-7-алкилен.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R61, R62, R63 и R64 независимо выбраны из водорода, метила и этила.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где X представляет собой CR3 и Y представляет собой CR4, или X представляет собой N и Y представляет собой CR4, или X представляет собой CR3 и Y представляет собой N.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где X представляет собой CR3, и Y представляет собой CR4.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где X представляет собой N, и Y представляет собой CR4.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где X представляет собой CR3, и Y представляет собой N.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R1 представляет собой водород, галоген, C1-7-алкокси или C1-7-галоалкокси.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R1 представляет собой водород, фтор, метокси, этокси или трифторэтокси.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R1 представляет собой водород.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R2 представляет собой водород, галоген или C1-7-алкил.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R2 представляет собой водород, фтор или метил.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R2 представляет собой водород.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R3 представляет собой водород или галоген.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R3 представляет собой водород или фтор.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R3 представляет собой водород.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R4 представляет собой водород, галоген или С1-7-алкокси.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R4 представляет собой водород или галоген.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R4 представляет собой водород, фтор, метокси, этокси или трифторэтокси.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I), где R4 представляет собой водород или фтор.
Особые соединения формулы (I) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметил-имидазо[1,2-а]пиразин-2-ил)-4-((S)-3-метил-пиперазин-1-ил)-бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(4-метилпиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-этилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(4-метилпиперазин-1-ил)пиколинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(пиперазин-1-ил)пиколинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
6-гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(2,6-диазаспиро[3.3]гептан-2-ил)никотинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид:
рац-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
(S)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)никотинамид;
N-(4-фтор-2-метил-бензоксазол-6-ил)-6-пиперазин-1-ил-никотинамид;
рац-N-(4-фтор-2-метил-бензоксазол-6-ил)-6-(3-метил-пиперазин-1-ил)-никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-2-фтор-N-(4-фтор-2-метил-бензоксазол-6-ил)-4-(S)-гексагидропирроло[1,2-а]пиразин-2-ил-бензамид;
(R)-2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(2,8-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-2,3-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2,5-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-5-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-3-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2,6-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(S)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(R)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(2,7-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-фтор-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-фтор-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2,6-дифтор-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(1,2,3,6-тетрагидропиридин-4-ил)пиколинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(пиперазин-1-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-метил-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-метил-6-(пиперазин-1-ил)никотинамид;
4-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(пиперазин-1-ил)никотинамид;
4-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотинамид;
2-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-a]пиридин-6-ил)-6-(пиперазин-1-ил)-2-(2,2,2-трифторэтокси)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метоксиникотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперидин-4-ил)бензамид;
рац-6-(3,4-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
и их фармацевтически приемлемые соли.
Особые соединения формулы (I) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметил-имидазо[1,2-а]пиразин-2-ил)-4-((S)-3-метил-пиперазин-1-ил)-бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(4-метилпиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-этилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(4-метилпиперазин-1-ил)пиколинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(пиперазин-1-ил)пиколинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
6-гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамида гидрохлорид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(2,6-диазаспиро[3.3]гептан-2-ил)никотинамида гидрохлорид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
(S)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)никотинамид;
N-(4-фтор-2-метил-бензоксазол-6-ил)-6-пиперазин-1-ил-никотинамид;
рац-N-(4-фтор-2-метил-бензоксазол-6-ил)-6-(3-метил-пиперазин-1-ил)-никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-2-фтор-N-(4-фтор-2-метил-бензоксазол-6-ил)-4-(S)-гексагидропирроло[1,2-а]пиразин-2-ил-бензамид;
(R)-2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамида гидрохлорид;
рац-N-(2,8-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамида дигидрохлорид;
рац-2-фтор-N-(2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамида дигидрохлорид;
рац-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида дигидрохлорид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамида дигидрохлорид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамида дигидрохлорид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамида дигидрохлорид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамида дигидрохлорид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамида гидрохлорид;
рац-2,3-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида гидрохлорид;
рац-2,5-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида гидрохлорид;
рац-5-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамида гидрохлорид;
рац-3-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамида гидрохлорид;
рац-2,6-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида гидрохлорид;
(S)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида гидрохлорид;
(R)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамида гидрохлорид;
рац-N-(2,7-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамида дигидрохлорид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-фтор-6-(3-метилпиперазин-1-ил)никотинамида гидрохлорид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамида дигидрохлорид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамида дигидрохлорид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-фтор-5-(3-метилпиперазин-1-ил)пиколинамида дигидрохлорид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2,6-дифтор-4-(3-метилпиперазин-1-ил)бензамида тригидрохлорид;
2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамида гидрохлорид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамида гидрохлорид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамида дигидрохлорид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(1,2,3,6-тетрагидропиридин-4-ил)пиколинамида дигидрохлорид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(пиперазин-1-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-метил-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-метил-6-(пиперазин-1-ил)никотинамид;
4-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(пиперазин-1-ил)никотинамид;
4-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотинамид;
2-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-2-(2,2,2-трифторэтокси)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метоксиникотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамида гидрохлорид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамида дигидрохлорид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперидин-4-ил)бензамида гидрохлорид;
рац-6-(3,4-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
и их фармацевтически приемлемые соли.
Особые соединения формулы (I) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
рац-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-3-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2,6-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(S)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(R)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-фтор-5-(3-метилпиперазин-1-ил)пиколинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
4-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
4-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
2-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I')
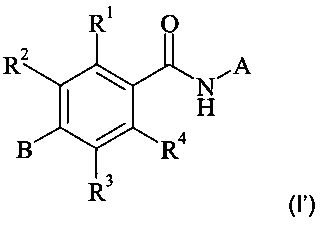 ,
,
где А, В, R1, R2, R3 и R4 являются такими, как описано в данном документе.
Особые соединения формулы (I') по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметил-имидазо[1,2-а]пиразин-2-ил)-4-((S)-3-метил-пиперазин-1-ил)-бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(4-метилпиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)бензамид;
(S)-2-фтор-N-(4-фтор-2-метил-бензоксазол-6-ил)-4-(S)-гексагидропирроло[1,2-а]пиразин-2-ил-бензамид;
(R)-2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(2,8-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-2,3-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2,5-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2,6-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(S)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(R)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(2,7-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2,6-дифтор-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-метил-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперидин-4-ил)бензамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I'')
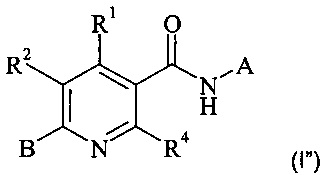 ,
,
где А, В, R1, R2 и R4 являются такими, как описано в данном документе.
Особые соединения формулы (I'') по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-этилпиперазин-1-ил)никотинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
6-гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(2,6-диазаспиро[3.3]гептан-2-ил)никотинамид;
N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
(S)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)никотинамид;
N-(4-фтор-2-метил-бензоксазол-6-ил)-6-пиперазин-1-ил-никотинамид;
рац-N-(4-фтор-2-метил-бензоксазол-6-ил)-6-(3-метил-пиперазин-1-ил)-никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-5-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-фтор-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(пиперазин-1-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-метил-6-(пиперазин-1-ил)никотинамид;
4-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(пиперазин-1-ил)никотинамид;
4-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотинамид;
2-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-2-(2,2,2-трифторэтокси)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метоксиникотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
рац-6-(3,4-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I''')
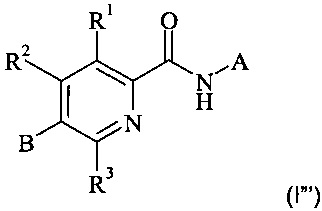 ,
,
где А, В, R1, R2 и R3 являются такими, как описано в данном документе.
Особые соединения формулы (I''') по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(4-метилпиперазин-1-ил)пиколинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(пиперазин-1-ил)пиколинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-3-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-фтор-5-(3-метилпиперазин-1-ил)пиколинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(1,2,3,6-тетрагидропиридин-4-ил)пиколинамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (Ia)
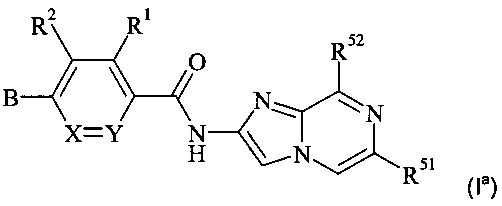 ,
,
где В, X, Y, R1, R2, R51 и R52 являются такими, как описано в данном документе.
Особые соединения формулы (Ia) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметил-имидазо[1,2-а]пиразин-2-ил)-4-((S)-3-метил-пиперазин-1-ил)-бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(4-метилпиперазин-1-ил)бензамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-6-(4-этилпиперазин-1-ил)никотинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(4-метилпиперазин-1-ил)пиколинамид;
рац-N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-5-(пиперазин-1-ил)пиколинамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (Ib)
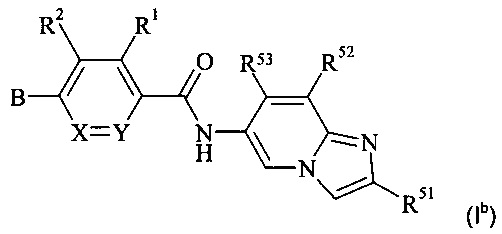 ,
,
где В, X, Y, R1, R2, R51, R52 и R53 являются такими, как описано в данном документе.
Особые соединения формулы (Ib) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
6-гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(2,6-диазаспиро[3.3]гептан-2-ил)никотинамид;
рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
(S)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
6-(3,5-диметилпиперазин-1-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)никотинамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(2,8-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-2,3-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-2,5-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-5-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-3-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-2,6-дифтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(S)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
(R)-2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(2,7-диметилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-фтор-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-фтор-4-(3-метилпиперазин-1-ил)бензамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-фтор-5-(3-метилпиперазин-1-ил)пиколинамид;
рац-N-(8-хлор-2-метилимидазо[1,2-а]пиридин-6-ил)-2,6-дифтор-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамид;
2-фтор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-5-(1,2,3,6-тетрагидропиридин-4-ил)пиколинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(пиперазин-1-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-3-метил-4-(пиперазин-1-ил)бензамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-5-метил-6-(пиперазин-1-ил)никотинамид;
4-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(пиперазин-1-ил)никотинамид;
4-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотинамид;
2-этокси-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперазин-1-ил)-2-(2,2,2-трифторэтокси)никотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
6-(3,3-диметилпиперазин-1-ил)-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метоксиникотинамид;
рац-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-метокси-6-(3-метилпиперазин-1-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамид;
N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамид;
N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид;
2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперидин-4-ил)бензамид;
рац-6-(3,4-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамид;
и их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения относится к соединениям формулы (Ic)
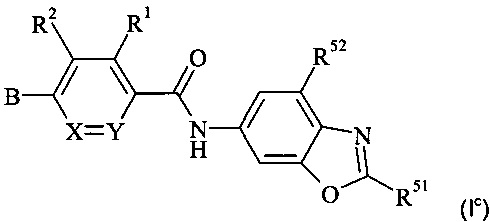 ,
,
где В, X, Y, R1, R2, R51 и R52 являются такими, как описано в данном документе.
Особые соединения формулы (Ic) по настоящему изобретению представляют собой соединения, выбранные из группы, включающей:
6-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(4-метилпиперазин-1-ил)никотинамид;
(S)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-6-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)никотинамид;
N-(4-фтор-2-метил-бензоксазол-6-ил)-6-пиперазин-1-ил-никотинамид;
рац-N-(4-фтор-2-метил-бензоксазол-6-ил)-6-(3-метил-пиперазин-1-ил)-никотинамид;
N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
рац-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
4-(3,5-диметилпиперазин-1-ил)-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)бензамид;
(S)-2-фтор-N-(4-фтор-2-метил-бензоксазол-6-ил)-4-(S)-гексагидропирроло[1,2-а]пиразин-2-ил-бензамид;
(R)-2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензамид;
рац-2-фтор-N-(2-метилбензо[d]оксазол-6-ил)-4-(3-метилпиперазин-1-ил)бензамид;
2-фтор-N-(4-фтор-2-метилбензо[d]оксазол-6-ил)-4-(пиперазин-1-ил)бензамид;
и их фармацевтически приемлемые соли.
Способы получения
Соединения формулы (I) и их фармацевтически приемлемые соли, как определено выше, получают следующими стандартными способами, известными в данной области техники.
В конкретном воплощении изобретение дополнительно относится к способу получения соединений формулы (I) и их фармацевтически приемлемых солей, как определено выше, согласно которому:
а) осуществляют реакцию аминирования Бухвальда-Хартвига соединения формулы (II)
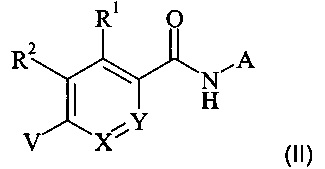
с соединением формулы В-Н в присутствии катализатора (например, трис(дибензилиден-ацетон)дипалладия (0) (Pd2(dba)3)) и лиганда (например, 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (BINAP)), и основания (например, карбоната цезия), и растворителя (например, толуола), где водород Н соединения формулы В-Н связан с кольцевым атомом азота В, V представляет собой хлор или бром, и А, В, X, Y, R1 и R2 являются такими, как определено выше; или
b) осуществляют реакцию нуклеофильного ароматического замещения между соединением формулы (II) и соединением формулы В-Н при нагревании (например, Т = 120°С - 200°С) в растворителе (например, диметилсульфоксиде (ДМСО), N-метилпирролидоне (NMP) или диметилформамиде (ДМФА)), где водород Н соединения формулы В-Н связан с кольцевым атомом азота В, V представляет собой фтор, если X представляет собой CR3, или V представляет собой хлор, если X представляет собой N, и А, В, X, Y, R1, R2 и R3 являются такими, как определено выше; или
c) осуществляют реакцию сочетания Сузуки соединения формулы (II) с соединением формулы 3Г-В-пинВ в присутствии основания (например, K2CO3) и катализатора (например, PdCl2), затем удаляют 3Г, где пинВ представляет собой пинаколборанил (4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил), который связан с кольцевым атомом углерода В, 3Г представляет собой аминозащитную группу, такую как трет-бутоксикарбонил (ВОС), V представляет собой фтор или хлор, и где А, В, X, Y, R1 и R2 являются такими, как определено выше; или
d) осуществляют реакцию амидирования соединения формулы (III)
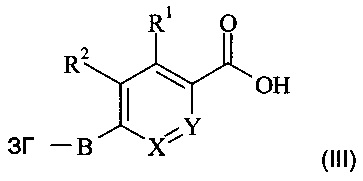
с соединением формулы A-NH2 в присутствии третичного амина (например, N,N-диизопропилэтиламина (ДИПЭА) или триэтиламина (ТЭА)) и связующего реагента (например, 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфата метанаминия (HATU) или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторбората (TBTU)), возможно затем удаляют 3Г, где 3Г представляет собой возможную аминозащитную группу, такую как трет-бутоксикарбонил (3Г), и где А, В, X, Y, R1 и R2 являются такими, как определено выше.
В частности, соединения формулы (I) и их фармацевтически приемлемые соли можно получить согласно способам, описанным в примерах данного документа.
Фармацевтические композиции
Согласно другому воплощению предложены фармацевтические композиции или лекарственные средства, содержащие соединения по изобретению и терапевтически инертный носитель, разбавитель или фармацевтически приемлемый эксципиент, а также способы применения соединений по изобретению при получении таких композиций и лекарственных средств.
Композиции готовят, дозируют и вводят способом в соответствии с надлежащей медицинской практикой. Рассматриваемые в этой связи факторы включают конкретное заболевание, подвергаемое лечению, конкретного млекопитающего, подвергаемого лечению, клиническое состояние отдельного пациента, причину заболевания, место доставки агента, способ введения, планирование введения и другие факторы, известные практикующим врачам.
Соединения по изобретению можно вводить любыми подходящими способами, включая пероральное, местное (включая буккальное и подъязычное), ректальное, вагинальное, трансдермальное, парентеральное, подкожное, внутрибрюшинное, внутрилегочное, внутрикожное, интратекальное и эпидуральное, и интраназальное, и, при необходимости для местного лечения, внутриочаговое введение. Парентеральные вливания включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Соединения по настоящему изобретению можно вводить в любой удобной форме введения, например, в форме таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пластырей и т.п. Такие композиции могут содержать компоненты обычные для фармацевтических препаратов, например, разбавители, носители, pH модификаторы, консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, корригирующие вещества, антиоксиданты и дополнительные активные агенты. Также они могут содержать еще другие терапевтически ценные вещества.
Обычный препарат получают, смешивая соединение по настоящему изобретению и носитель или эксципиент. Подходящие носители и эксципиенты хорошо известны квалифицированным специалистам в данном области техники и описаны подробно, например, у Ansel, Howard С., et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems (2004) Lippincott, Williams & Wilkins, Philadelphia; Gennaro A.R. et al., Remington: The Science and Practice of Pharmacy (2000) Lippincott, Williams & Wilkins, Philadelphia; и Rowe R.C, Handbook of Pharmaceutical Excipients (2005) Pharmaceutical Press, Chicago. Препараты также могут включать один или более буферов, стабилизаторов, поверхностно-активных веществ, смачивающих веществ, смазывающих веществ, эмульгаторов, суспендирующих веществ, консервантов, антиоксидантов, кроющих веществ, скользящих веществ, вспомогательных веществ, красителей, подсластителей, ароматизаторов, вкусовых веществ, разбавителей и других известных добавок, обеспечивающих превосходное представление лекарственного средства (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или помогающих в изготовлении фармацевтического продукта (т.е. лекарства).
Доза, в которой соединения по изобретению могут быть введены, может изменяться в широких пределах и конечно будет согласована с индивидуальными потребностями в каждом конкретном случае. В общем в случае перорального введения подходящей должна быть суточная доза приблизительно 0,01 до 1000 мг на человека соединения общей формулы (I), хотя вышеприведенный верхний предел также может быть увеличен при необходимости.
Примером подходящей лекарственной формы для перорального применения является таблетка, содержащая приблизительно 100 мг до 500 мг соединения по изобретению, смешанного с приблизительно 30 до 90 мг безводной лактозы, приблизительно 5 до 40 мг кроскармеллозы натрия, приблизительно 5 до 30 мг поливинилпирролидона (ПВП) K30 и приблизительно 1 до 10 мг стеарата магния. Порошкообразные ингредиенты сначала смешивают вместе и затем смешивают с раствором ПВП. Полученную в результате композицию можно сушить, гранулировать, смешивать со стеаратом магния и прессовать в форме таблетки, используя традиционное оборудование.
Пример аэрозольного препарата можно получить, растворяя соединение по изобретению, например, 10 до 100 мг, в подходящем буферном растворе, например, фосфатном буфере, добавляя регулирующее тоничность вещество, например, соль, такую как хлорид натрия, при желании. Раствор можно фильтровать, например, используя 0,2 мкм фильтр, чтобы удалить примеси и загрязнения.
Применение
Как описано выше, соединения формулы (I) и их фармацевтически приемлемые соли обладают ценными фармакологическими свойствами и, как обнаружено, усиливают включение экзона 7 SMN1 и/или SMN2 в мРНК, транскрибируемую из гена SMN1 и/или SMN2, тем самым увеличивая экспрессию белка SMN в человеке, нуждающемся в этом.
Соединения по настоящему изобретению можно использовать, либо отдельно, либо в сочетании с другими лекарствами, в лечении или предотвращении заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1. Эти заболевания включают, но не ограничиваются этим, спинальную мышечную атрофию (СМА).
Конкретное воплощение настоящего изобретения относится к фармацевтическим композициям, содержащим соединения формулы (I), как определено выше, или их фармацевтически приемлемые соли, как определено выше, и один или более фармацевтически приемлемых эксципиентов.
Конкретное воплощение настоящего изобретения относится к фармацевтическим композициям, содержащим соединения формулы (I) или их фармацевтически приемлемые соли, как определено выше, и один или более фармацевтически приемлемых эксципиентов, для лечения или предотвращения заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно для лечения или предотвращения спинальной мышечной атрофии (СМА).
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I) или их фармацевтически приемлемым солям, как определено выше, для применения в качестве терапевтически активных веществ, особенно для применения в качестве терапевтически активных веществ в лечении или предотвращении заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно в лечении или предотвращении спинальной мышечной атрофии (СМА).
Конкретное воплощение настоящего изобретения относится к соединениям формулы (I) или их фармацевтически приемлемым солям, как определено выше, для применения в лечении или предотвращении заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно для применения в лечении или предотвращении спинальной мышечной атрофии (СМА).
Конкретное воплощение настоящего изобретения относится к способу лечения или предотвращения заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно лечения или предотвращения спинальной мышечной атрофии (СМА), согласно которому вводят соединения формулы (I) или их фармацевтически приемлемые соли, как определено выше, субъекту.
Конкретное воплощение настоящего изобретения относится к применению соединений формулы (I) или их фармацевтически приемлемых солей, как определено выше, в лечении или предотвращении заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно в лечении или предотвращении спинальной мышечной атрофии (СМА).
Конкретное воплощение настоящего изобретения относится к применению соединений формулы (I) или их фармацевтически приемлемых солей, как определено выше, в получении лекарственных средств для лечения или предотвращения заболеваний, вызванных инактивирующей мутацией или делецией в гене SMN1 и/или связанных с потерей или нарушением функции гена SMN1, особенно для лечения или предотвращения спинальной мышечной атрофии (СМА). Такие лекарственные средства содержат соединения формулы (I) или их фармацевтически приемлемые соли, как определено выше.
Примеры
Лучше понять изобретение можно со ссылкой на следующие примеры. Однако не следует понимать, что они ограничивают объем изобретения.
Получение промежуточных соединений
Пример А.1
Получение N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-фторбензамида
К смеси 6,8-диметилимидазо[1,2-а]пиразин-2-амина тригидрохлорида (пример В.1) (134 мг, 494 мкмоль) и N-этилдиизопропиламина (320 мг, 420 мкл, 2,47 ммоль) в диоксане (2,0 мл) добавляли по каплям раствор 4-фторбензоилхлорида (80 мг, 60,3 мкл, 494 мкмоль) в диоксане (0,5 мл) при комнатной температуре. Смесь перемешивали в течение 1 часа. Растворитель удаляли в вакууме. Твердое вещество переносили в воду и суспензию перемешивали в течение 15 минут. Твердое вещество отфильтровывали и сушили, получая 125 мг (89%) указанного в заголовке соединения в виде твердого вещества белого оттенка. МС (m/e): 285,4 (М+Н+).
По аналогии с примером А.1 примеры А.2-А.7 из следующей таблицы получали из производных ацилхлорида и амина:
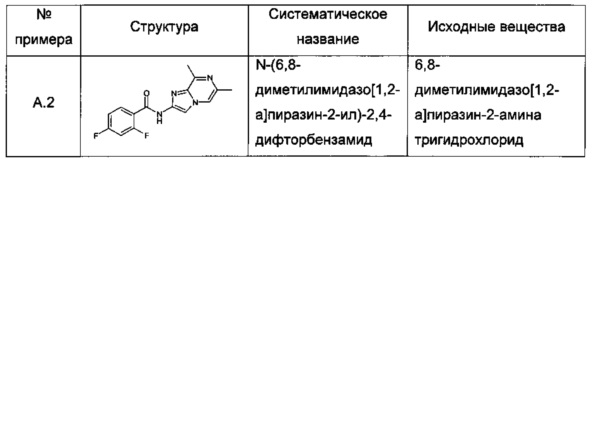
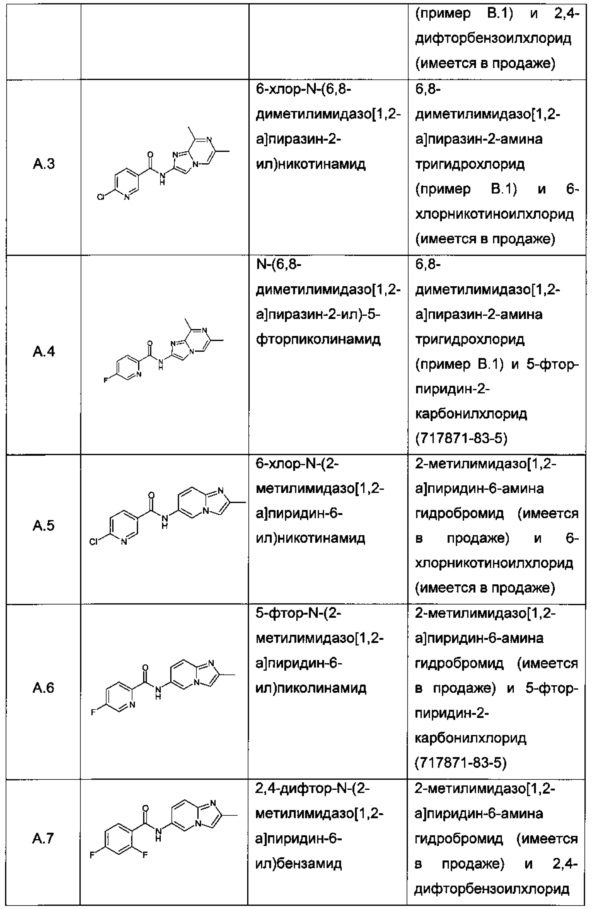

Пример А.8
Получение 6-хлор-N-(2-метил-8-трифторметил-имидазо[1,2-а]пиридин-6-ил)-никотинамида
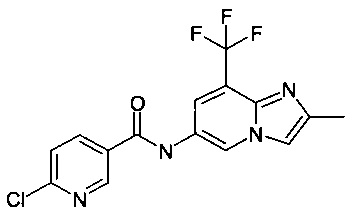
К раствору 6-хлорникотиновой кислоты (332 мг, 2,11 ммоль) в ДМФА (4 мл) в атмосфере аргона при комнатной температуре добавляли HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат) (1,2 г, 3,16 ммоль) и N,N-диизопропилэтиламин (1,4 мл, 8,42 ммоль). После 5 минут перемешивания добавляли 2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-амина гидрохлорид (пример В.2) (530 мг, 2,11 ммоль). Смесь перемешивали при комнатной температуре в течение двух дней. Растворитель удаляли в вакууме. Остаток переносили в водный гидрокарбонат. Водный слой экстрагировали 3 раза этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенную смесь очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из дихлорметана и метанола (0 до 5%), получая указанное в заголовке соединение.
По аналогии с примером А.8 примеры А.9-А.10 из следующей таблицы получали из производных кислоты и амина:
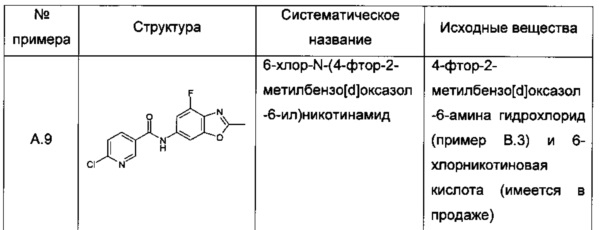
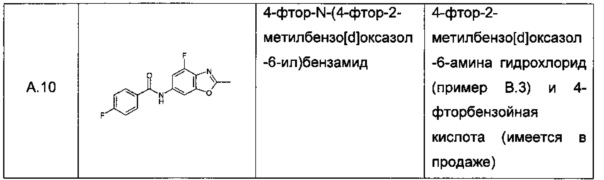
Пример В.1
Получение 6,8-диметилимидазо[1,2-а]пиразин-2-амина тригидрохлорида
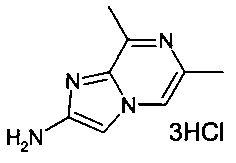
a) стадия 1: Этил 6,8-диметилимидазо[1,2-а]пиразин-2-карбоксилата гидробромид
К раствору 3,5-диметилпиразин-2-амина (200 мг, 1,62 ммоль) в диметиловом эфире (ДМЭ) (6,00 мл) добавляли этил 3-бром-2-оксопропионат (380 мг, 245 мкл, 1,95 ммоль) при 0°С. Смесь перемешивали в течение 2 часов при комнатной температуре. Суспензию фильтровали и промывали диметоксиэтаном. Фильтрат переносили в этанол (4 мл) и нагревали с обратным холодильником в течение 1,5 часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали этанолом, получая 323 мг (66,3%) указанного в заголовке соединения в виде светло-желтого твердого вещества. МС (m/e): 220,1 (М+Н+).
b) стадия 2: 6,8-диметилимидазо[1,2-а]пиразин-2-карбоновой кислоты гидрохлорид
К раствору этил 6,8-диметилимидазо[1,2-а]пиразин-2-карбоксилата гидробромида (300 мг, 0,999 ммоль) в этаноле (6 мл) и воде (3 мл) в атмосфере азота при комнатной температуре добавляли 2 М гидроксид натрия (1,05 мл, 2,1 ммоль). Реакционную смесь перемешивали при 90°С в течение 2 часов. Смесь охлаждали до комнатной температуры и подкисляли 1 мл раствора HCl (2 М). Полученную в результате суспензию охлаждали до 0°С, фильтровали, промывали холодным диэтиловым эфиром и сушили, получая 128 мг (56,3%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС (m/e): 192,1 (М+Н+).
c) стадия 3: трет-бутил 6,8-диметилимидазо[1,2-а]пиразин-2-илкарбамат
К суспензии 6,8-диметилимидазо[1,2-а]пиразин-2-карбоновой кислоты гидрохлорида (5 г, 22,0 ммоль) в трет-бутаноле (50,9 мл) в атмосфере азота при комнатной температуре добавляли триэтиламин (9,17 мл, 65,9 ммоль). После перемешивания в течение 10 минут добавляли дифенилфосфорилазид (4,85 мл, 22,0 ммоль). Реакционную смесь перемешивали при 85°С в течение ночи. Растворитель удаляли в вакууме. Остаток переносили в водный гидрокарбонат. Водный слой экстрагировали 3 раза этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное оранжевое масло очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 60%), получая 3,57 г (выход: 62,0%) указанного в заголовке соединения в виде белой пены. МС (m/e): 263,5 (М+Н+).
d) стадия 4: 6,8-диметилимидазо[1,2-а]пиразин-2-амина тригидрохлорид
К желтому раствору трет-бутил 6,8-диметилимидазо[1,2-а]пиразин-2-илкарбамата (3,57 г, 13,6 ммоль) в метаноле (35,7 мл) в атмосфере азота при комнатной температуре добавляли по каплям хлороводород (34,0 мл, 136 ммоль, 4M в диоксане). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь выпаривали, получая 3,66 г (99%) указанного в заголовке соединения в виде желтого твердого вещества. МС (m/e): 163,2 (М+Н+).
Пример В.2
Получение 2-метил-8-трифторметил-имидазо[1,2-а]пиридин-6-иламина гидрохлорида
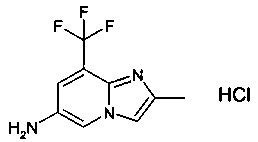
a) стадия 1: 6-бром-2-метил-8-(трифторметил)имидазо[1,2-а]пиридин
В 30 мл закрывающемся химическом сосуде объединяли 5-бром-3-(трифторметил)пиридин-2-амин (CAS:79456-34-1) (2,5 г, 10,4 ммоль) с 1-хлорпропан-2-оном (1,04 мл, 12,4 ммоль) в ацетонитриле (25 мл) и нагревали при 130°С в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры, гасили 100 мл насыщенного водного раствора гидрокарбоната натрия. Реакционную смесь экстрагировали этилацетатом и водой. Органические слои сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный остаток очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 25%), получая 1,2 г (выход: 41,5%) указанного в заголовке соединения в виде розового твердого вещества.
b) стадия 2: N-(дифенилметилен)-2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-амин
В 250 мл грушевидной колбе объединяли 6-бром-2-метил-8-(трифторметил)имидазо[1,2-а]пиридин (2,79 г, 10,0 ммоль), рац-2,2'-бис(дифенилфосфино)-1,1'-бинафталин (623 мг, 1,00 ммоль), ацетат палладия (II) (224 мг, 1,00 ммоль), карбонат цезия (8,14 г, 25,0 ммоль) и дифенилметанимин (2,48 г, 2,3 мл, 13,0 ммоль) с тетрагидрофураном (ТГФ) (70 мл), получая оранжевую суспензию. Реакционную смесь нагревали до 70°С и перемешивали в течение 23 часов. Реакционную смесь экстрагировали этилацетатом и водой. Органические слои сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный остаток очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 25%), получая 2,33 г (выход: 61,0%) указанного в заголовке соединения в виде желтого масла. МС (m/e): 380,5 (М+Н+).
c) стадия 3: 2-Метил-8-трифторметил-имидазо[1,2-а]пиридин-6-иламина гидрохлорид
К раствору N-(дифенилметилен)-2-метил-8-(трифторметил)имидазо[1,2-а]пиридин-6-амина (2,3 г, 6,06 ммоль) в диоксане (20 мл) добавляли 1 н. HCl (7,58 мл, 7,58 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель удаляли в вакууме. Остаток растирали в порошок в ацетонитриле. Белое твердое вещество отфильтровывали, промывали ацетонитрилом и сушили, получая 1,08 г (71%) ожидаемого соединения в виде белого твердого вещества. МС (m/e): 216,5 (М+Н+).
Пример В.3
Получение 4-фтор-2-метилбензо[d]оксазол-6-амина гидрохлорида
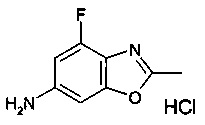
a) стадия 1: 6-Бром-4-фтор-2-метил-бензоксазол
К раствору 4'-бром-2',6'-дифторацетанилида (4,0 г, 15,6 ммоль, CAS: 658072-14-1) в N-метил-2-пирролидиноне (25 мл) добавляли карбонат цезия (10,3 г, 31,6 ммоль) и смесь нагревали до 150°С в течение 1 часа. Затем реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный остаток очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (20% до 50%), получая 1,5 г (42%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС (m/e): 273,1 (M+H+MeCN).
b) стадия 2: 4-фтор-2-метилбензо[d]оксазол-6-амина гидрохлорид
По аналогии со способом, описанным для синтеза примера В.2 (стадии: 2-3), указанное в заголовке соединение получали из 6-бром-4-фтор-2-метил-бензоксазола. МС (m/e): 216,5 (М+Н+).
Пример В.4
Получение 8-фтор-2-метил-имидазо[1,2-а]пиридин-6-иламина гидрохлорида
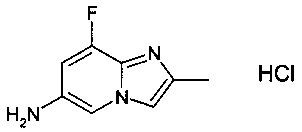
По аналогии со способом, описанным для синтеза примера В.2 (стадии: 1-3), указанное в заголовке соединение получали из 5-бром-3-фтор-пиридин-2-иламина (CAS: 748812-37-5). МС (m/e): 166,2 (М+Н+).
Пример В.5
Получение 8-хлор-2-метилимидазо[1,2-а]пиридин-6-амина гидрохлорида
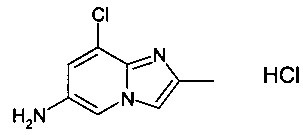
По аналогии со способом, описанным для синтеза примера В.2 (стадии: 1-3), указанное в заголовке соединение получали из 5-бром-3-хлор-пиридин-2-иламина (CAS: 38185-55-6). МС (m/e): 182,1 (М+Н+).
Пример С.1
Получение (S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензойной кислоты
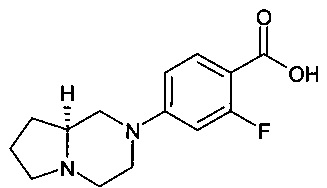
a) стадия 1: (S)-метил 2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензоат
Толуол (1,5 мл) добавляли к смеси метил 4-бром-2-фторбензоата (200 мг, 832 мкмоль) и (S)-октагидропирроло[1,2-а]пиразина (130 мг, 999 мкмоль). Смесь перемешивали до полного растворения. Затем добавляли карбонат цезия (407 мг, 1,25 ммоль). Потом добавляли Pd2(dba)3 (22,9 мг, 25,0 мкмоль) и BINAP (46,7 мг, 74,9 мкмоль). Реакционную смесь интенсивно перемешивали в течение 24 часов при 110°С. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду и этилацетат. Слои разделяли. Водный слой экстрагировали дважды этилацетатом. Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенное оранжевое масло очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 80%), получая 121 мг (выход: 52,2%) указанного в заголовке соединения в виде желтого масла. МС (m/e): 279,5 (М+Н+).
b) стадия 2: (S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензойная кислота
К раствору (S)-метил 2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензоата (100 мг, 359 мкмоль) в тетрагидрофуране (513 мкл), метаноле (256 мкл) и воде (256 мкл) добавляли моногидрат гидроксида лития (45,2 мг, 1,08 ммоль). Смесь перемешивали при комнатной температуре в течение 6 часов. Смесь выпаривали. Добавляли 2 н HCl по каплям до pH 3-4. Добавляли дихлорметан и водный слой экстрагировали 3 раза дихлорметаном. Добавляли 5 н NaOH к водной фазе до достижения pH 6. Раствор выпаривали. Остаток суспендировали в дихлорметане и метаноле, фильтровали и выпаривали, получая 82 мг (86,4%) указанного в заголовке соединения в виде бесцветного масла. МС (m/e): 265,5 (М+Н+).
Пример С.2
Получение (R)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензойной кислоты
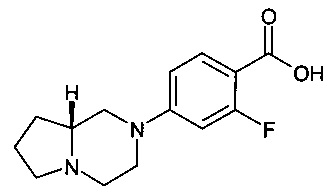
По аналогии со способом, описанным для синтеза примера С.1 (стадии: 1-2), указанное в заголовке соединение получали из 4-бром-2-фторбензоата и (R)-октагидропирроло[1,2-а]пиразина.
Пример С.3
Получение рац-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2-фторбензойной кислоты
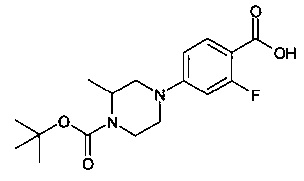
a) стадия 1: рац-трет-бутил 4-(4-(этоксикарбонил)-3-фторфенил)-2-метилпиперазин-1-карбоксилат
Раствор этил 2,4-дифторбензоата (200 мг, 1,07 ммоль) и 2-метилпиперазина (538 мг, 5,37 ммоль) в ДМА (2 мл) нагревали до 100°С в микроволновом аппарате в течение 15 минут. Добавляли этилацетат и воду. Слои разделяли и водный слой экстрагировали дважды этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Раствор этого неочищенного вещества и триэтиламина (131 мг, 180 мкл, 1,29 ммоль) в дихлорметане (2,00 мл) охлаждали до 0°С. Добавляли по каплям ди-трет-бутилдикарбонат (352 мг, 1,61 ммоль) в дихлорметане (0,5 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду. Слои разделяли. Водный слой экстрагировали дважды дихлорметаном. Объединенные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 20), получая 155 мг (34%) указанного в заголовке соединения в виде светло-желтого масла.
b) стадия 2: рац-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2-фторбензойная кислота
По аналогии со способом, описанным для синтеза примера С.1 (стадия: 2), указанное в заголовке соединение получали из рац-трет-бутил 4-(4-(этоксикарбонил)-3-фторфенил)-2-метилпиперазин-1-карбоксилата.
Пример С.4
Получение трет-бутилового эфира рац-4-(6-карбокси-пиридин-3-ил)-2-метил-пиперазин-1 карбоновой кислоты
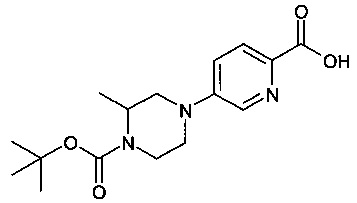
Раствор 5-фторпиколиновой кислоты (0,47 г, 3,33 ммоль) и N1 Boc 2-метилпиперазина (1,00 г, 5,00 ммоль) в ДМА (2,00 мл) нагревали до 160°С в микроволновом аппарате в течение 1 часа. Растворитель выпаривали в высоком вакууме. Остаток переносили в воду и подкисляли до pH 3. Водную фазу экстрагировали 3 раза этилацетатом, сушили и концентрировали. Неочищенный продукт очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 20), получая 1,17 г (100%) указанного в заголовке соединения.
Пример С.5
Получение рац-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2,3-дифторбензойной кислоты
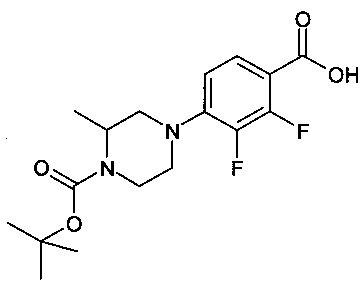
По аналогии со способом, описанным для синтеза примера С.3 (стадии: 1-2), указанное в заголовке соединение получали из этилового эфира 2,3,4-трифтор-бензойной кислоты и рац-2-метилпиперазина.
Пример С.6
Получение трет-бутилового эфира рац-4-(4-карбокси-2,5-дифтор-фенил)-2-метил-пиперазин-1-карбоновой кислоты
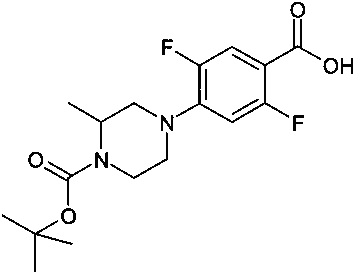
По аналогии со способом, описанным для синтеза примера С.3 (стадии: 1-2), указанное в заголовке соединение получали из метилового эфира 2,4,5-трифтор-бензойной кислоты и рац-2-метилпиперазина.
Пример С.7
Получение рац-6-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-5-фторникотиновой кислоты
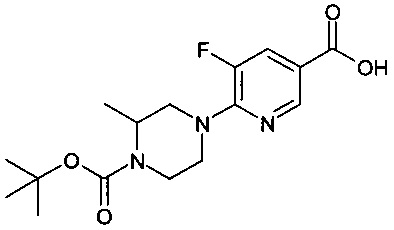
По аналогии со способом, описанным для синтеза примера С.3 (стадии: 1-2), указанное в заголовке соединение получали из метилового эфира 6-хлор-5-фтор-никотиновой кислоты и рац-2-метилпиперазина.
Пример С.8
Получение рац-5-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-3-фторпиколиновой кислоты
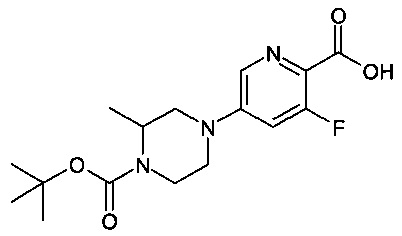
По аналогии со способом, описанным для синтеза примера С.3 (стадии: 1-2), указанное в заголовке соединение получали из метилового эфира 3,5-дифтор-пиридин-2-карбоновой кислоты и рац-2-метилпиперазина.
Пример С.9
Получение рац-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2,6-дифторбензойной кислоты
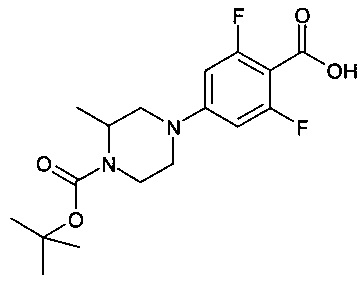
По аналогии со способом, описанным для синтеза примера С.3 (стадии: 1-2), указанное в заголовке соединение получали из метилового эфира 2,4,6-трифтор-бензойной кислоты и рац-2-метилпиперазина.
Пример С.10
Получение (S)-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2-фторбензойной кислоты
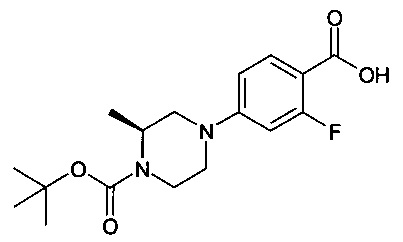
По аналогии со способом, описанным для синтеза примера С.1 (стадии: 1-2), указанное в заголовке соединение получали из метил 4-бром-2-фторбензоата и (S)-трет-бутил 2-метилпиперазин-1-карбоксилата.
Пример С.11
Получение (R)-4-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2-фторбензойной кислоты
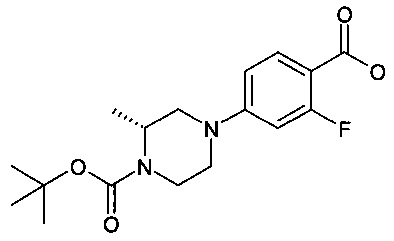
По аналогии со способом, описанным для синтеза примера С.1 (стадии: 1-2), указанное в заголовке соединение получали из метил 4-бром-2-фторбензоата и (R)-трет-бутил 2-метилпиперазин-1-карбоксилата.
Пример С.12
Получение 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-2-фторбензойной кислоты
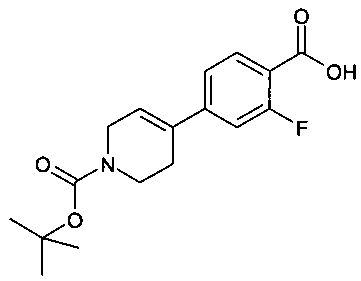
a) стадия 1: трет-бутил 4-(3-фтор-4-(метоксикарбонил)фенил)-5,6-дигидропиридин-1(2Н)-карбоксилат
К раствору метил 4-бром-2-фторбензоата (94 мг, 395 мкмоль) в диоксане (2 мл) добавляли трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат (179,3 мг, 580 мкмоль), тетракис-(трифенилфосфин)палладий (22,8 мг, 19,8 мкмоль, экв.: 0,05) и фосфат калия (170,1 мг, 801 мкмоль). В инертной атмосфере смесь нагревали при 100°С в течение 18 часов. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Полученное в результате коричневое масло очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 20), получая 121 мг (91%) указанного в заголовке соединения в виде светло-желтого масла. МС (т/е): 280,4 (М+Н-56).
b) стадия 2: 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-2-фторбензойная кислота
По аналогии со способом, описанным для синтеза примера С.1 (стадия: 2), указанное в заголовке соединение получали из трет-бутил 4-(3-фтор-4-(метоксикарбонил)фенил)-5,6-дигидропиридин-1(2Н)-карбоксилата.
Пример С.13
Получение 6-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)никотиновой кислоты
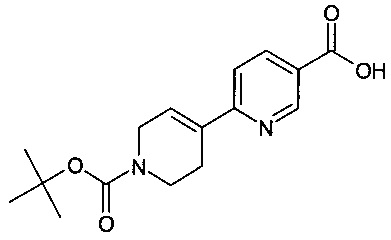
К раствору 6-хлорникотиновой кислоты (200 мг, 1,26 ммоль) в безводном ДМФА (2,5 мл) в атмосфере азота при комнатной температуре добавляли трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат (466 мг, 1,51 ммоль), тетракис(трифенилфосфин)палладий (0) (147 мг, 126 мкмоль) и безводный карбонат калия (521 мг, 3,77 ммоль). Реакционную смесь дегазировали азотом в течение 10 минут. Смесь затем перемешивали при 125°С в условиях микроволнового излучения в течение 45 минут. Смесь разбавляли ДМФА. Добавляли воду к суспензии и смесь охлаждали до 0°С. Медленно добавляли 1 н HCl до pH 3-4. Суспензию фильтровали и твердое вещество промывали водой и затем этилацетатом, получая 158 мг (41,3%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 305,5 (М+Н+).
Пример С.14
Получение 5-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)пиколиновой кислоты
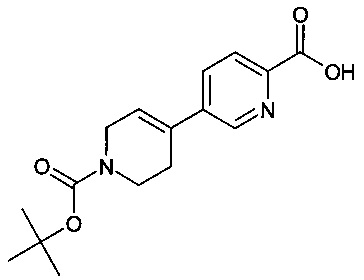
a) стадия 1: метил 5-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)пиколинат
К раствору метил 5-бромпиколината (205 мг, 930 мкмоль) в ДМФА (2 мл) в атмосфере азота при комнатной температуре добавляли трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат (300 мг, 970 мкмоль), затем 2 М водн. карбонат натрия (650 мкл, 1,3 ммоль). Реакционную смесь дегазировали аргоном в течение 10 минут. Под конец добавляли аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия (II) дихлорметана (30,5 мг, 41,7 мкмоль) и смесь потом перемешивали при 60°С в условиях микроволнового излучения в течение 10 минут, и затем при 70°С в течение 70 минут. Добавляли этилацетат и воду к реакционной смеси. Оба слоя разделяли и водный слой экстрагировали два раза этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное коричневое масло очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 20), получая 202 мг (68%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 319,5 (М+Н-56).
b) стадия 2: 4-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)-2-фторбензойная кислота
По аналогии со способом, описанным для синтеза примера С.1 (стадия: 2), указанное в заголовке соединение получали из метил 5-(1-(трет-бутоксикарбонил)-1,2,3,6-тетрагидропиридин-4-ил)пиколината.
Пример С.15
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-метоксиникотиновой кислоты
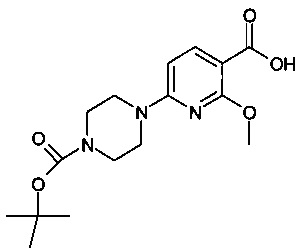
a) Стадия 1: трет-бутил 4-(6-фтор-5-(метоксикарбонил)пиридин-2-ил)пиперазин-1-карбоксилат
К ледяному раствору метил 2,6-дифторникотината (2,0 г, 11,6 ммоль, CAS 11767-02-0) и триэтиламина (1,6 мл, 11,6 ммоль) в ДМФА (10 мл) добавляли по каплям раствор трет-бутил пиперазин-1-карбоксилата (2,2 г, 11,6 ммоль) в ДМФА (5 мл). Реакционную смесь перемешивали в течение 0,5 часа при 0°С, после чего разбавляли этилацетатом, промывали водой, солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 10 до 20%), получая 2,7 г (68%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 340,2 (М+Н).
b) Стадия 2: трет-бутил 4-(6-метокси-5-(метоксикарбонил)пиридин-2-ил)пиперазин-1-карбоксилат
К раствору трет-бутил 4-(6-фтор-5-(метоксикарбонил)пиридин-2-ил)пиперазин-1-карбоксилата (0,40 г, 1,2 ммоль) в метаноле (5 мл) добавляли трет-бутилат калия (0,13 г, 1,2 ммоль) и смесь нагревали с обратным холодильником. Через 4 часа реакционную смесь разбавляли дихлорметаном, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 0,4 г (92%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 352,4 (М+Н).
c) Стадия 3: 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-метоксиникотиновая кислота
К раствору трет-бутил 4-(6-метокси-5-(метоксикарбонил)пиридин-2-ил)пиперазин-1-карбоксилата (0,38 г, 1,1 ммоль) в метаноле (5 мл) добавляли 6 н гидроксид натрия (0,36 мл, 2,2 ммоль) и реакционную смесь нагревали до 80°С в течение 16 часов. Реакционную смесь концентрировали досуха, добавляли 5% водную лимонную кислоту и полученный в результате осадок отделяли фильтрованием, получая 0,31 г (86%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 338,3 (М+Н).
Пример С.16
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-фторникотиновой кислоты
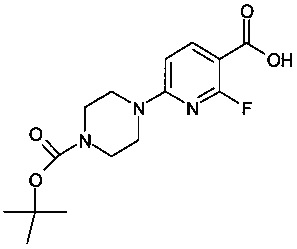
К суспензии трет-бутил 4-(6-фтор-5-(метоксикарбонил)пиридин-2-ил)пиперазин-1-карбоксилата (0,1 г, 0,3 ммоль) примера С.15 (стадия 1) в трет-бутаноле (2 мл) добавляли 6 н гидроксид натрия (0,1 мл, 0,6 ммоль) и смесь нагревали до 100°С в течение 3 часов. Реакционную смесь концентрировали досуха, добавляли 5% водную лимонную кислоту и полученный в результате осадок отделяли фильтрованием, получая 0,08 г (87%) указанного в заголовке соединения в виде белого твердого вещества. МС (m/e): 326,4 (М+Н).
Пример С.17
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-фторникотиновой кислоты
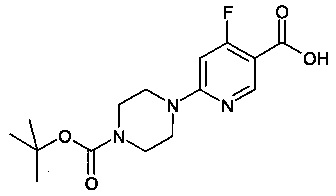
a) Стадия 1: трет-бутил 4-(4-фторпиридин-2-ил)пиперазин-1-карбоксилат
По аналогии со способом, описанным для синтеза примера С.1 (стадия 1), указанное в заголовке соединение получали из 2-хлор-4-фторпиридина и трет-бутил пиперазин-1-карбоксилата. МС (m/e): 282,5 (М+Н).
b) Стадия 2: трет-бутил 4-(4-фтор-5-йодпиридин-2-ил)пиперазин-1-карбоксилат
К раствору трет-бутил 4-(4-фторпиридин-2-ил)пиперазин-1-карбоксилата (67 мг, 0,2 ммоль) в ДМФА (0,5 мл) добавляли N-йод-сукцинамид (82 мг, 0,4 ммоль) и смесь перемешивали в течение 24 часов. Затем реакционную смесь разбавляли водой, экстрагировали этилацетатом, органическую фазу промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 30%), получая 73 мг (75%) указанного в заголовке соединения в виде светло-желтого твердого вещества. МС (m/e): 408,5 (М+Н).
c) Стадия 3: 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-фторникотиновая кислота
К ледяной суспензии трет-бутил 4-(4-фтор-5-йодпиридин-2-ил)пиперазин-1-карбоксилата (63 мг, 0,2 ммоль) в тетрагидрофуране (0,2 мл) в атмосфере аргона добавляли комплекс изопропилмагнийхлорида с хлоридом лития (0,13 мл, 1,3 М в ТГФ, 0,2 ммоль). Смесь нагревали до температуры окружающей среды и перемешивали в течение 45 минут перед тем, как барботировать реакционную смесь углекислым газом. Через 1 час смесь разбавляли водой, экстрагировали этилацетатом, потом водный слой подкисляли 5% водным раствором лимонной кислоты и повторно экстрагировали этилацетатом. Затем этилацетат промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 29 мг (58%) указанного в заголовке соединения в виде пены белого оттенка. МС (m/e): 326,5 (М+Н).
Пример С.18
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-метоксиникотиновой кислоты
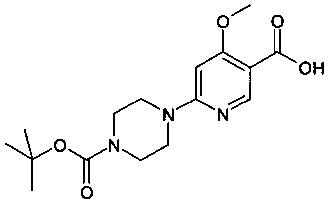
По аналогии со способом, описанным для синтеза примера С.17 (стадии: 1-3), указанное в заголовке соединение получали из 2-хлор-4-метоксипиридина. МС (m/e): 338,6 (М+Н).
Пример С.19
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-этоксиникотиновой кислоты
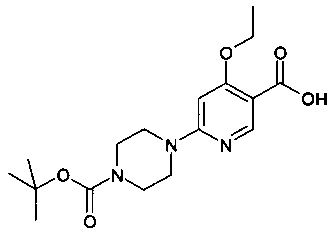
По аналогии со способом, описанным для синтеза примера С.17 (стадии: 1-3), указанное в заголовке соединение получали из 2-хлор-4-этоксипиридина. МС (m/e): 352,5 (М+Н).
Пример С.20
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотиновой кислоты
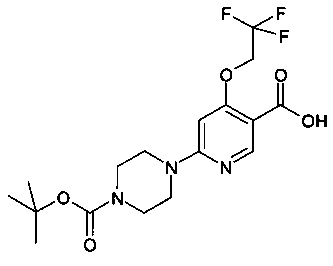
a) Стадия 1: 2-хлор-4-(2,2,2-трифторэтокси)пиридин
К раствору 2-хлор-4-нитропиридина (0,5 г, 3,2 ммоль) в тетрагидрофуране (20 мл) добавляли 2,2,2-трифторэтанол (0,25 мл, 3,5 ммоль) и трет-бутилат калия (0,4 г, 3,5 ммоль). Реакционную смесь перемешивали при 60°С в течение ночи в закрытом сосуде. Реакционную смесь концентрировали досуха, остаток повторно растворяли в этилацетате, промывали гидрокарбонатом натрия, солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали с помощью флэш колоночной хроматографии на силикагеле (элюент: гептан/этилацетат 0 до 30%), получая 0,6 г (91%) указанного в заголовке соединения в виде бесцветной жидкости. МС (m/e): 212,2 (М+Н).
b) 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-4-(2,2,2-трифторэтокси)никотиновая кислота
По аналогии со способом, описанным для синтеза примера С.17 (стадии: 1-3), указанное в заголовке соединение получали из 2-хлор-4-(2,2,2-трифторэтокси)пиридина. МС (m/e): 406,6 (М+Н).
Пример С.21
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-этоксиникотиновой кислоты
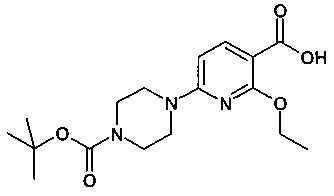
По аналогии со способом, описанным для синтеза примера С.15 (стадии: 1-3), за исключением того, что этанол использовали вместо метанола в качестве растворителя на стадии 2, получали указанное в заголовке соединение. МС (m/e): 352,5 (М+Н).
Пример С.22
Получение 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-(2,2,2-трифторэтокси)никотиновой кислоты
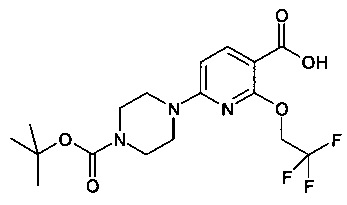
По аналогии со способом, описанным для синтеза примера С.15 (стадии: 1-3), за исключением того, что 2,2,2-трифторэтанол использовали вместо метанола в качестве растворителя на стадии 2, получали указанное в заголовке соединение. МС (m/e): 404,7 (М-Н).
Пример С.23
Получение рац-6-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-2-метоксиникотиновой кислоты
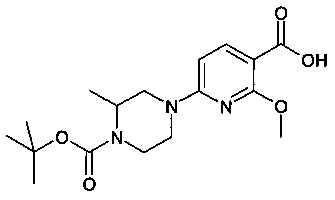
По аналогии со способом, описанным для синтеза примера С.15 (стадии: 1-3), указанное в заголовке соединение получали из рац-трет-бутил 2-метилпиперазин-1-карбоксилата и метил 2,6-дифторникотината. МС (m/e): 350,5 (М-Н).
Пример С.24
Получение 6-(4-(трет-бутоксикарбонил)-3,3-диметилпиперазин-1-ил)-2-метоксиникотиновой кислоты
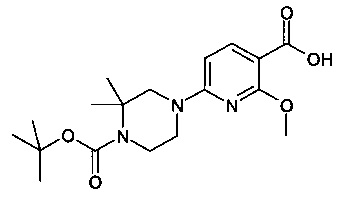
По аналогии со способом, описанным для синтеза примера С.15 (стадии: 1-3), указанное в заголовке соединение получали из трет-бутилового эфира 2,2-диметил-пиперазин-1-карбоновой кислоты и метил 2,6-дифторникотината. МС (m/e): 364,5 (М-Н).
Пример С.25
Получение рац-6-(4-(трет-бутоксикарбонил)-3-метилпиперазин-1-ил)-4-метоксиникотиновой кислоты
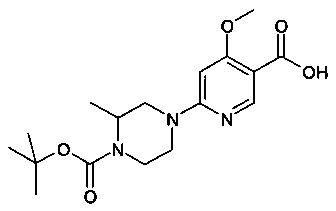
По аналогии со способом, описанным для синтеза примера С.18, указанное в заголовке соединение получали из рац-трет-бутил 2-метилпиперазин-1-карбоксилата и 2-хлор-4-метоксипиридина. МС (m/e): 352,5 (М+Н).
Описание примеров:
Пример 1
Получение N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-(пиперазин-1-ил)бензамида
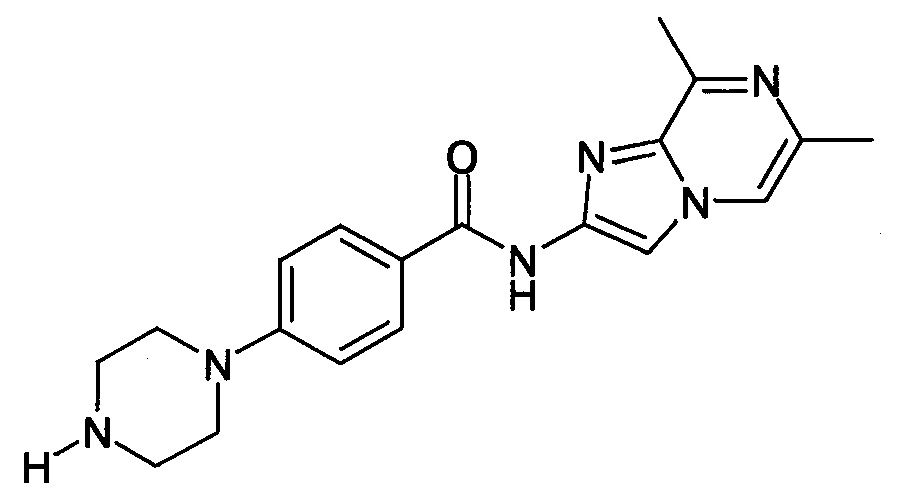
К раствору N-(6,8-диметилимидазо[1,2-а]пиразин-2-ил)-4-фторбензамида (пример А.1) (20 мг, 70,4 мкмоль) в N,N-диметилацетамиде (200 мкл) в атмосфере азота при комнатной температуре добавляли пиперазин (60,6 мг, 704 мкмоль). Реакционную смесь подвергали микроволновому излучению при 160°С в течение 90 минут. Смесь охлаждали до комнатной температуры. Полученный в результате осадок отфильтровывали, промывали диэтиловым эфиром и сушили, получая 4 мг (16,2%) указанного в заголовке соединения в виде твердого вещества белого оттенка. МС (m/e): 351,4 (М+Н+).
По аналогии с примером 1 соединения 2-30 из следующей таблицы получали в ходе взаимодействия галогензамещенного амидного производного с аминозамещенным производным при указанной температуре:
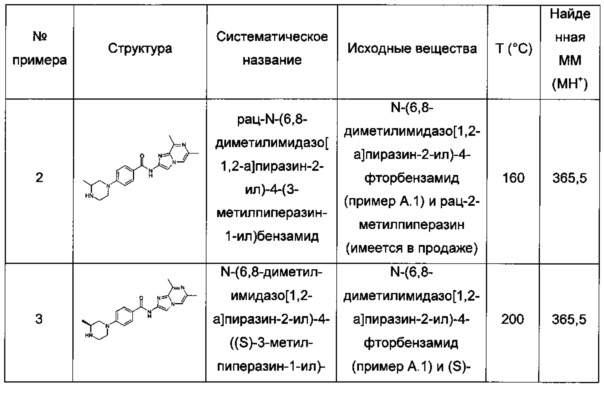
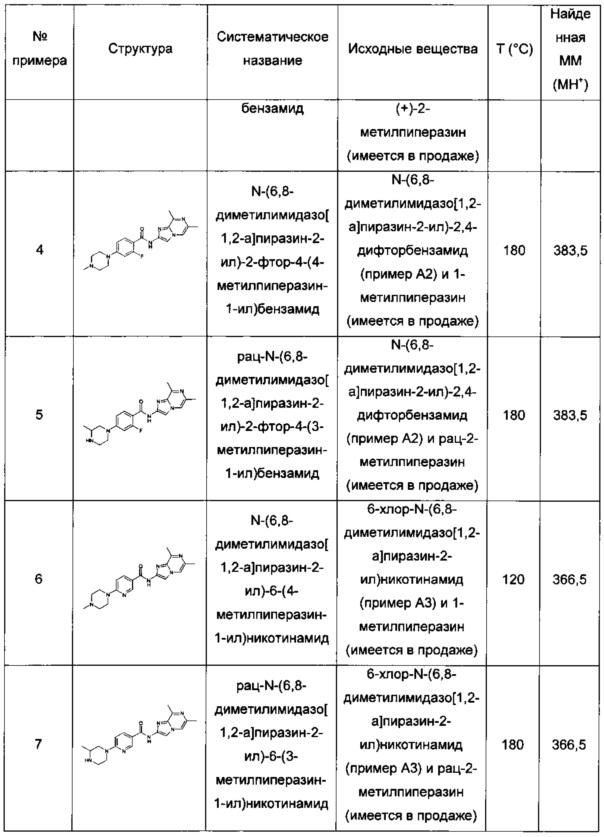
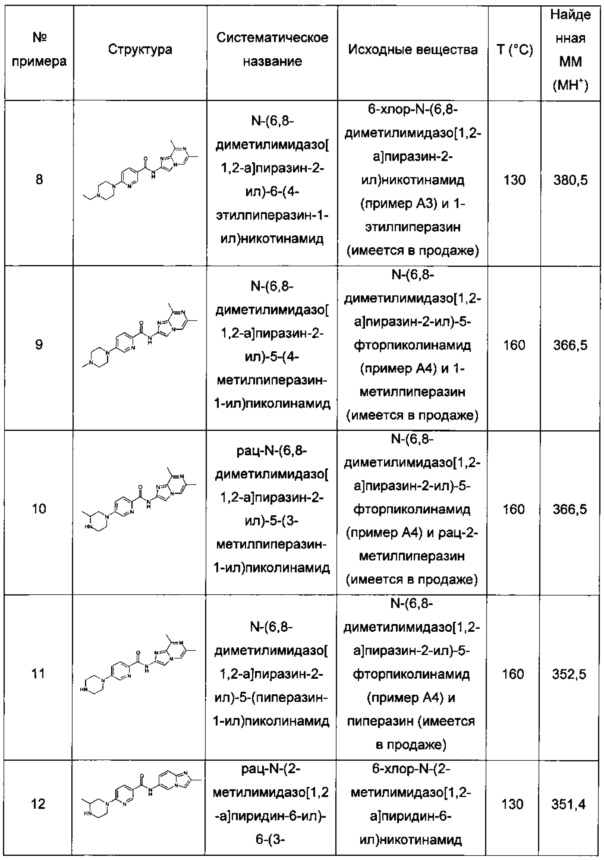
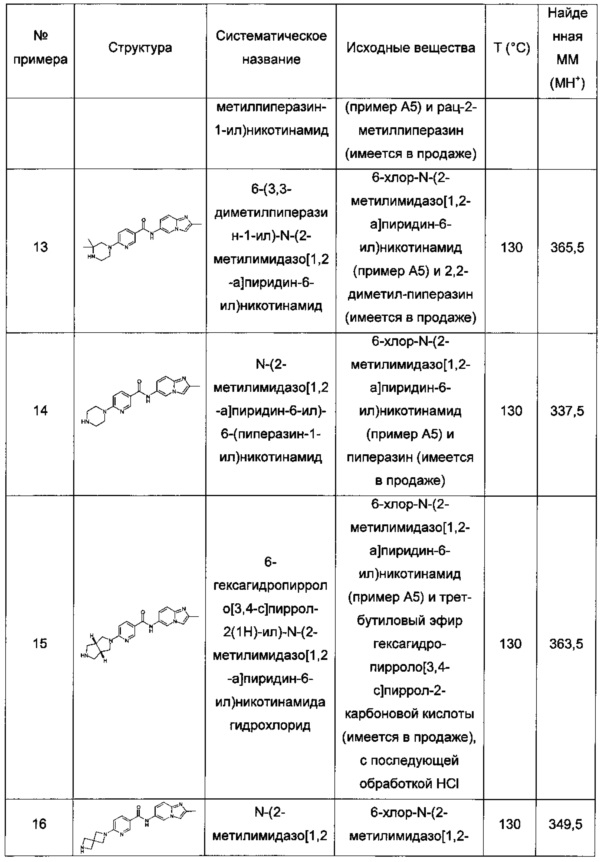
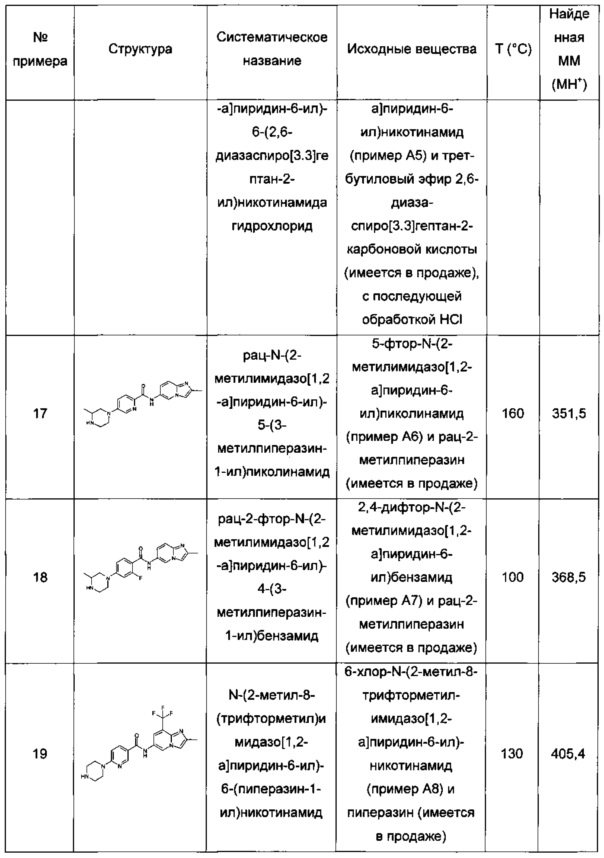
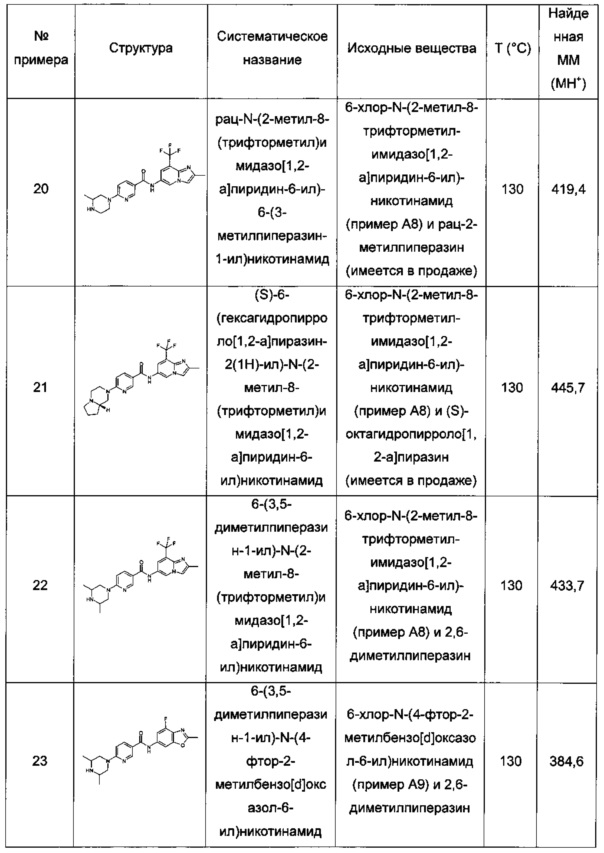
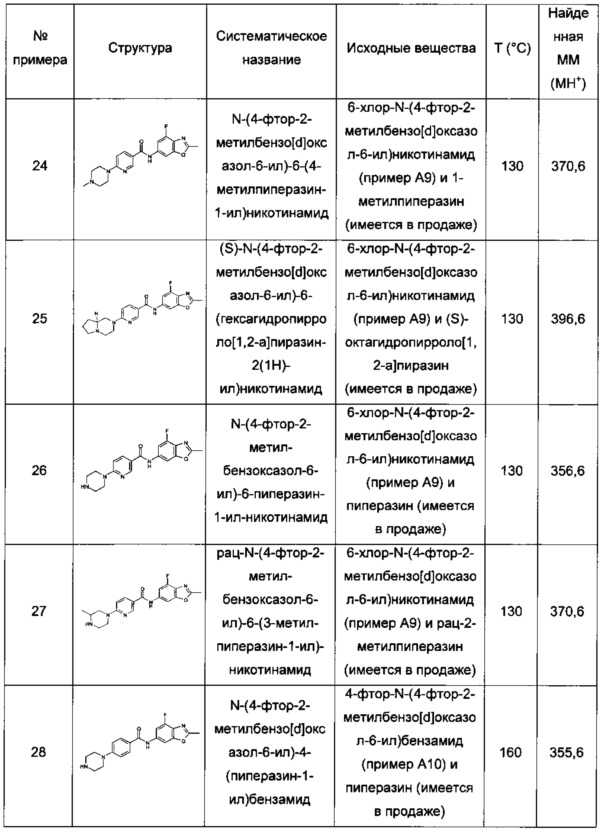
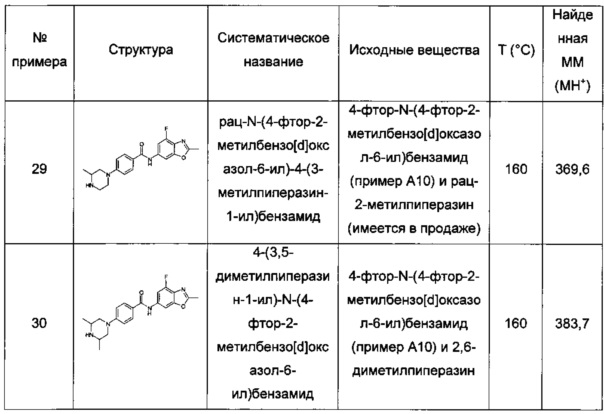
Пример 31
(S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)бензамид
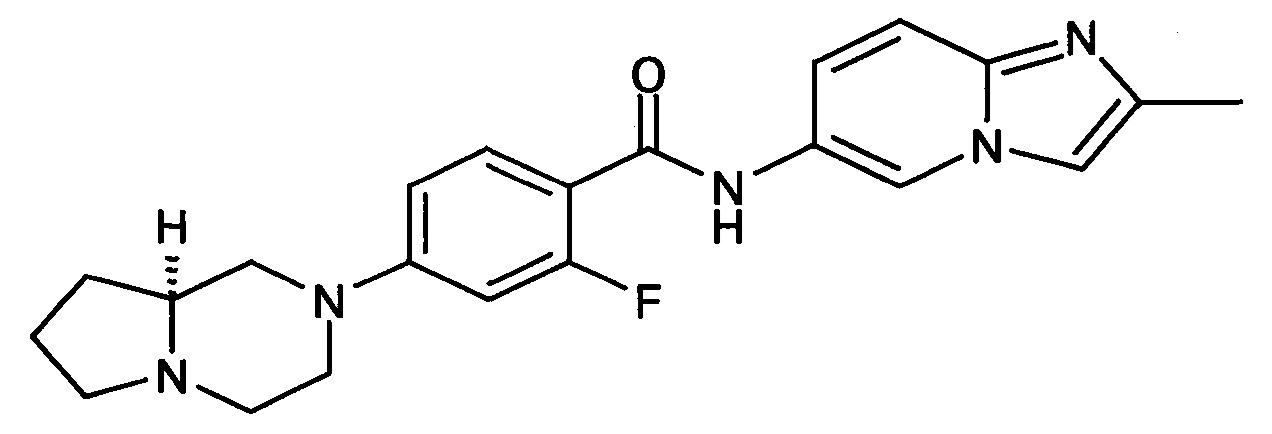
К раствору (S)-2-фтор-4-(гексагидропирроло[1,2-а]пиразин-2(1Н)-ил)бензойной кислоты (пример С.1) (80 мг, 303 мкмоль) в N,N-диметилформамиде (800 мкл) в атмосфере азота при комнатной температуре добавляли HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат) (173 мг, 454 мкмоль) и N-этилдиизопропиламин (156 мг, 206 мкл, 1,21 ммоль). После 5 минут перемешивания при комнатной температуре добавляли 2-метилимидазо[1,2-а]пиридин-6-амина гидробромид (имеется в продаже) (69,0 мг, 303 мкмоль). Смесь встряхивали при 60°С в течение 5,5 часов и затем при комнатной температуре в течение двух дней. Растворитель удаляли в вакууме. Остаток переносили в насыщенный водный раствор гидрокарбоната. Добавляли этилацетат. Полученный в результате осадок отфильтровывали, промывали этилацетатом и сушили. Твердое вещество перемешивали в этилацетате, отфильтровывали, промывали холодным этилацетатом и н-гексаном и сушили, получая 11 мг (9%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС (m/e): 394,6 (М+Н).
По аналогии с примером 31 соединения 32-35 из следующей таблицы получали из производных кислоты и амина:
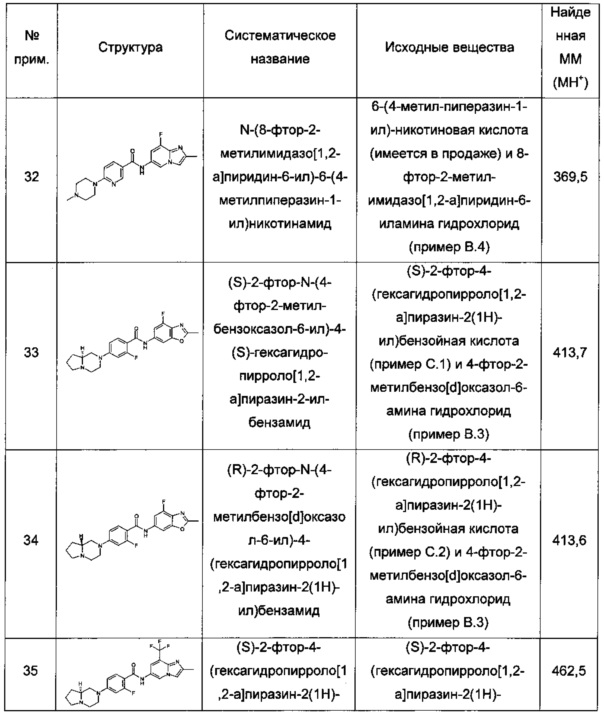
Пример 36
Получение N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперазин-1-ил)бензамида гидрохлорида
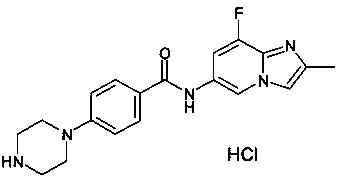
К раствору 4-(4-(трет-бутоксикарбонил)пиперазин-1-ил)бензойной кислоты (имеется в продаже) (109 мг, 357 мкмоль) в N,N-диметилформамиде (1,00 мл) в атмосфере азота при комнатной температуре добавляли HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат) (204 мг, 536 мкмоль) и N-этилдиизопропиламин (185 мг, 243 мкл, 1,43 ммоль). Через 5 минут перемешивания при комнатной температуре добавляли 8-фтор-2-метил-имидазо[1,2-а]пиридин-6-иламина гидрохлорид (пример В.4) (72 мг, 357 мкмоль). Смесь перемешивали при комнатной температуре в течение 21 часа и затем при 60°С в течение 2 часов. Растворитель удаляли в вакууме. Остаток переносили в насыщенный водный раствор гидрокарбоната и экстрагировали три раза этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 0 до 10%), получая 78 мг трет-бутил 4-(4-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)фенил)пиперазин-1-карбоксилата. К суспензии этого соединения (40 мг, 88,2 мкмоль) в метаноле (400 мкл) добавляли 4 М HCl в диоксане (221 мкл, 882 мкмоль). Светло-желтую суспензию перемешивали при комнатной температуре в течение 17 часов. Твердое вещество отфильтровывали, промывали эфиром и гексаном и сушили, получая 25 мг (72,7%) указанного в заголовке соединения в виде светло-желтого твердого вещества. МС (m/e): 354,5 (М+Н).
По аналогии с примером 36 соединения 37-63 из следующей таблицы получали из производных кислоты и амина с последующей обработкой HCl или трифторуксусной кислотой (ТФК).
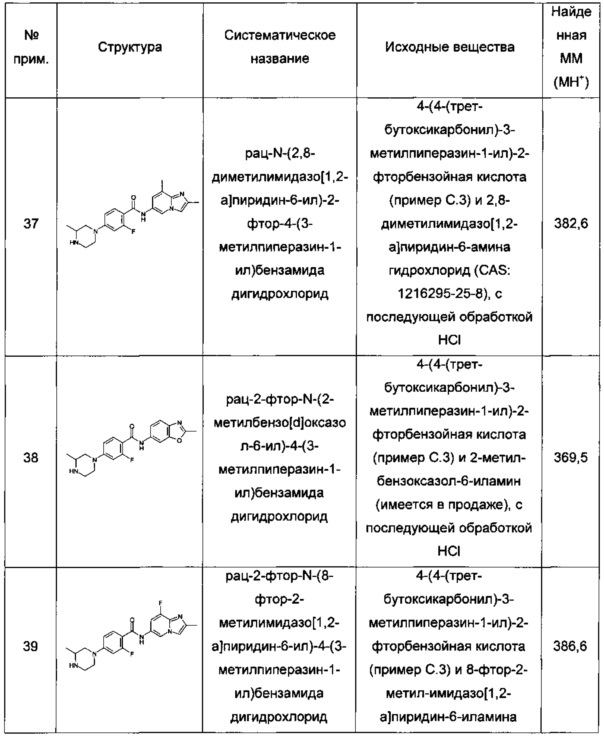
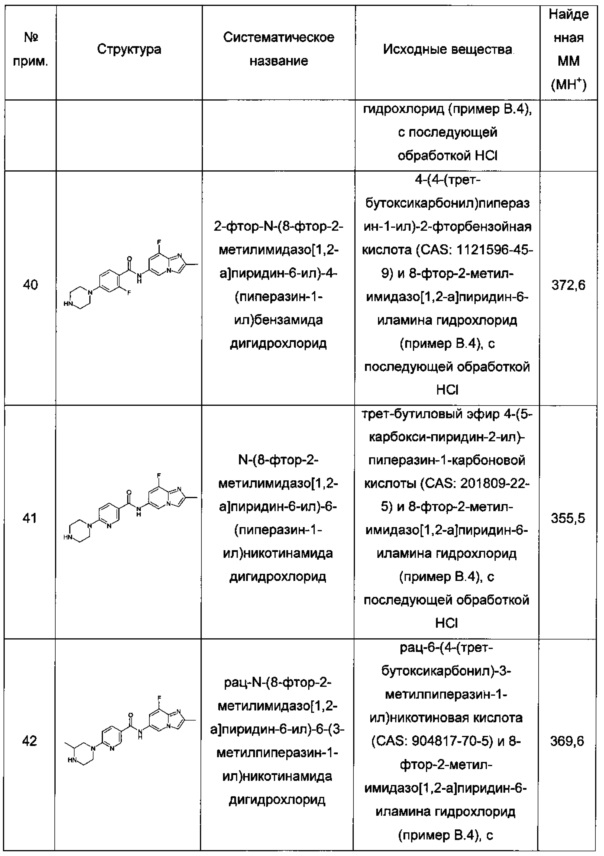
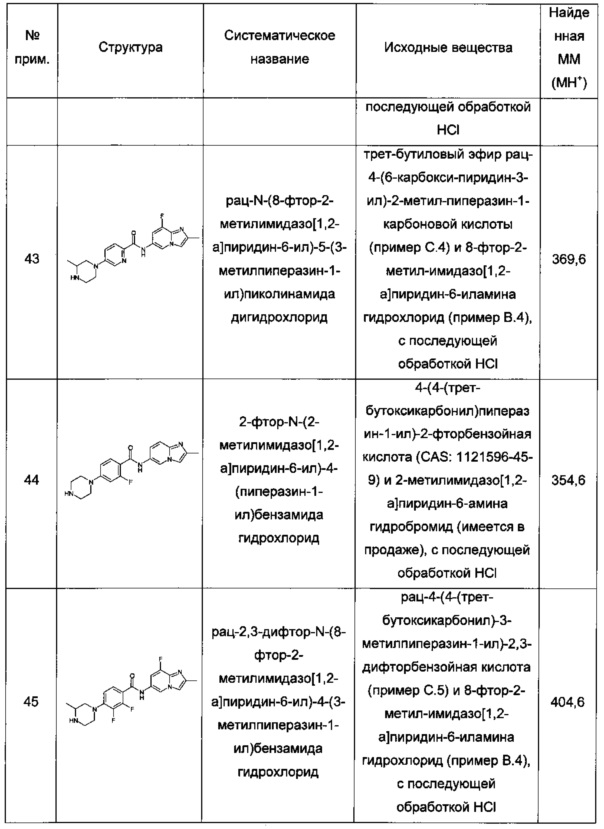
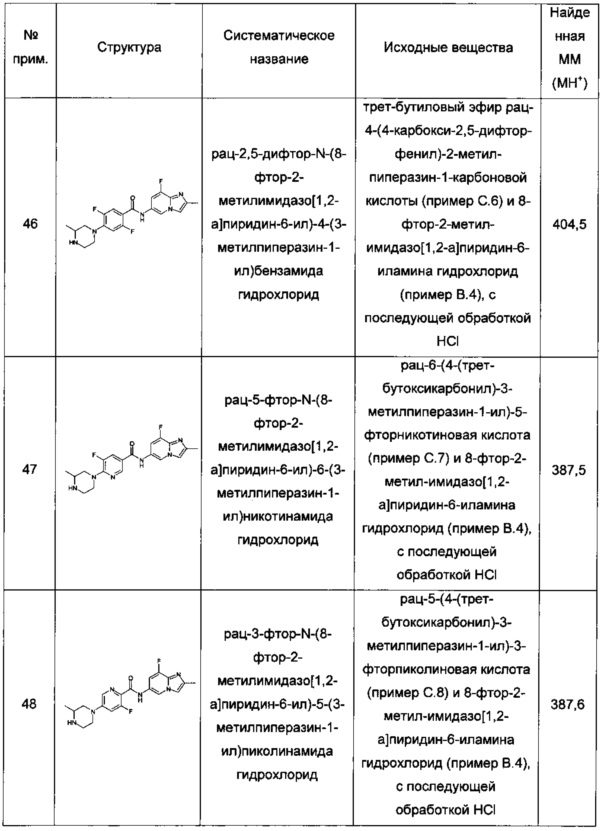
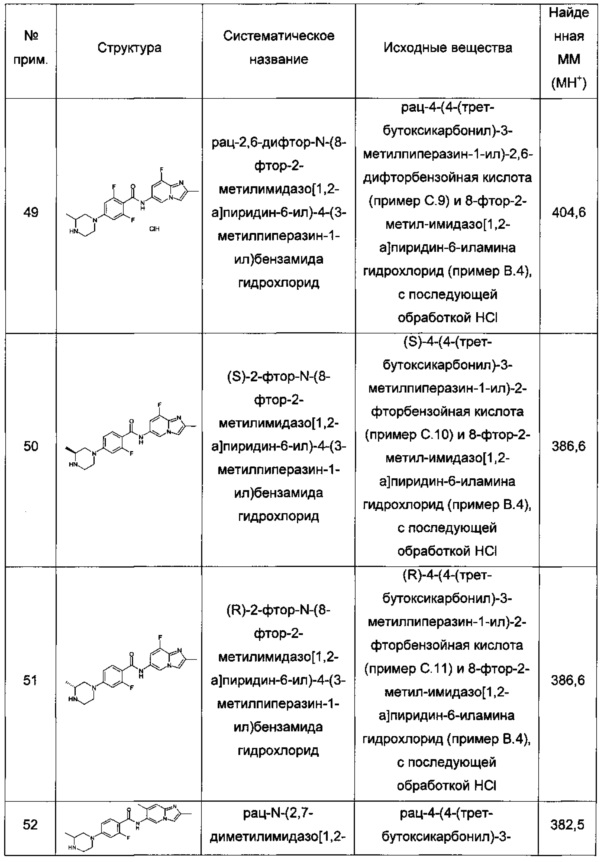
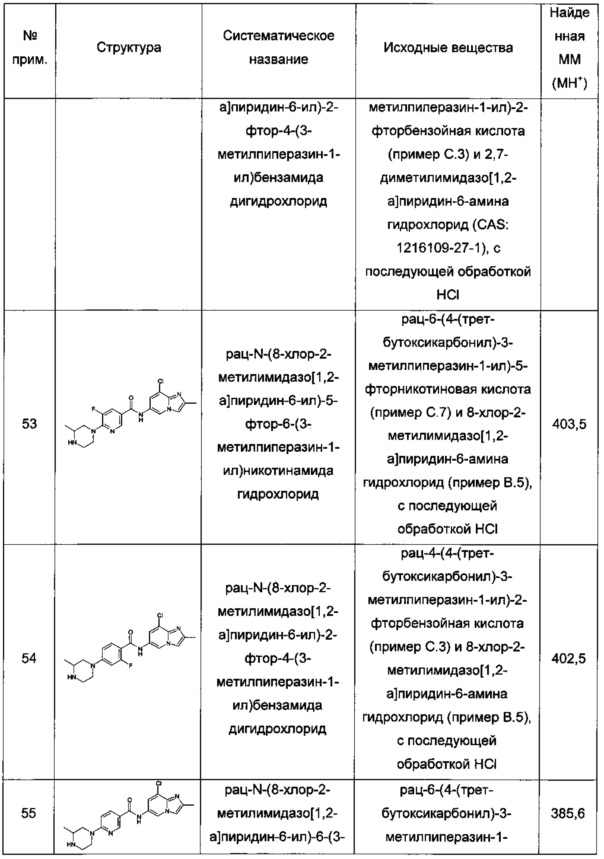
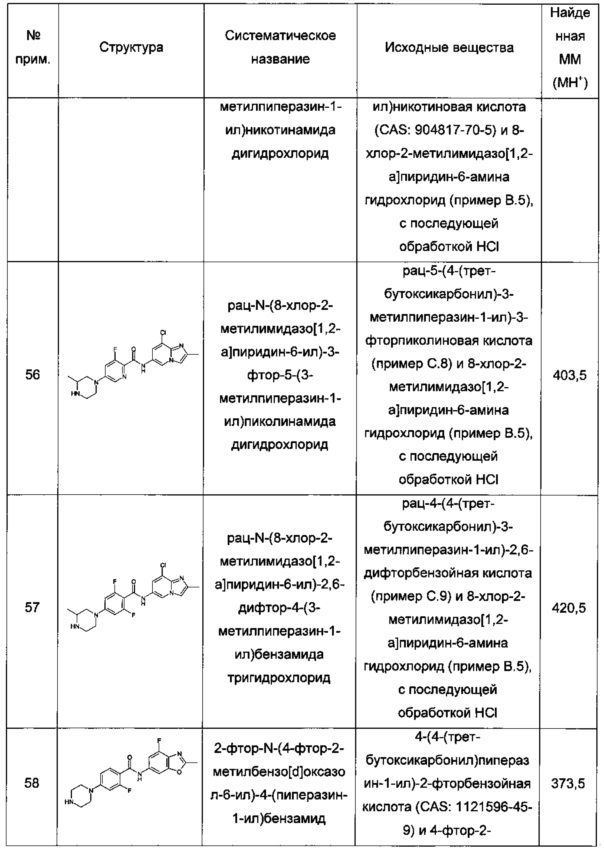
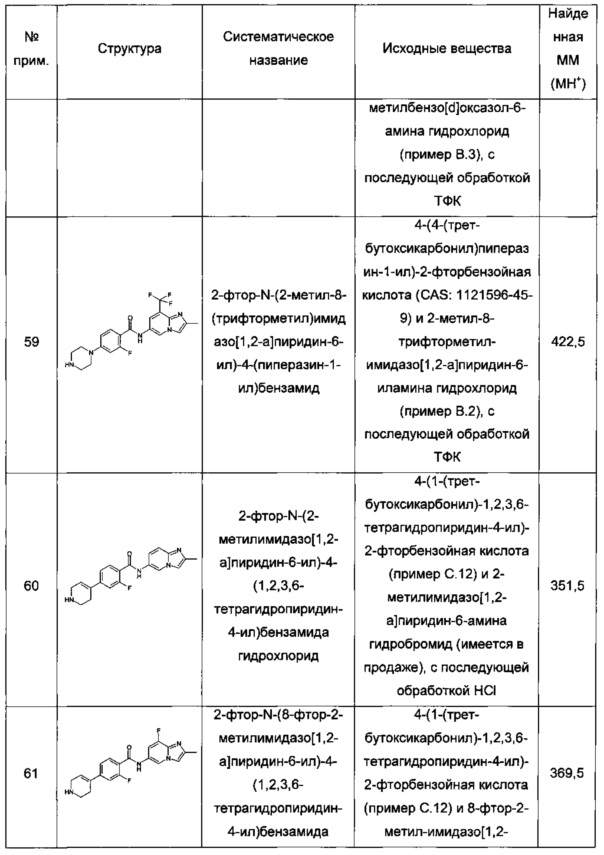
Пример 64
Получение N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-2-метокси-6-(пиперазин-1-ил)никотинамида
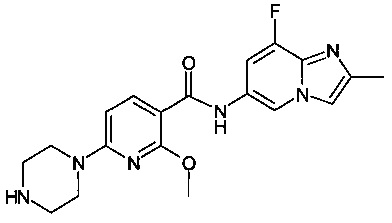
К раствору 6-(4-(трет-бутоксикарбонил)пиперазин-1-ил)-2-метоксиникотиновой кислоты (пример С.15) (100 мг, 296 мкмоль) и 8-фтор-2-метил-имидазо[1,2-а]пиридин-6-иламина гидрохлорида (пример В.4) (60 мг, 296 мкмоль) в N,N-диметилформамиде (1,00 мл) в атмосфере аргона при комнатной температуре добавляли O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (114 мг, 536 мкмоль) и триэтиламин (124 мкл, 0,89 ммоль). Смесь перемешивали при 55°С в течение 16 часов и затем при 90°С в течение 3 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетат сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенное масло очищали на силикагеле (элюент: гептан/этилацетат 50 до 100%), получая 76 мг трет-бутил 4-(5-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)-6-метоксипиридин-2-ил)пиперазин-1-карбоксилата. Это соединение затем растворяли в 4 М HCl в диоксане (2 мл) и смесь перемешивали в течение 0,5 часа. Смесь выпаривали досуха в вакууме, остаток растворяли в насыщенном гидрокарбонате натрия и повторно экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, сушили, получая 39 мг (63%) указанного в заголовке соединения в виде твердого вещества белого оттенка. МС (m/e): 385,4 (М+Н).
По аналогии с примером 64 соединения 65-76 из следующей таблицы получали из производных кислоты и амина с последующей обработкой HCl.
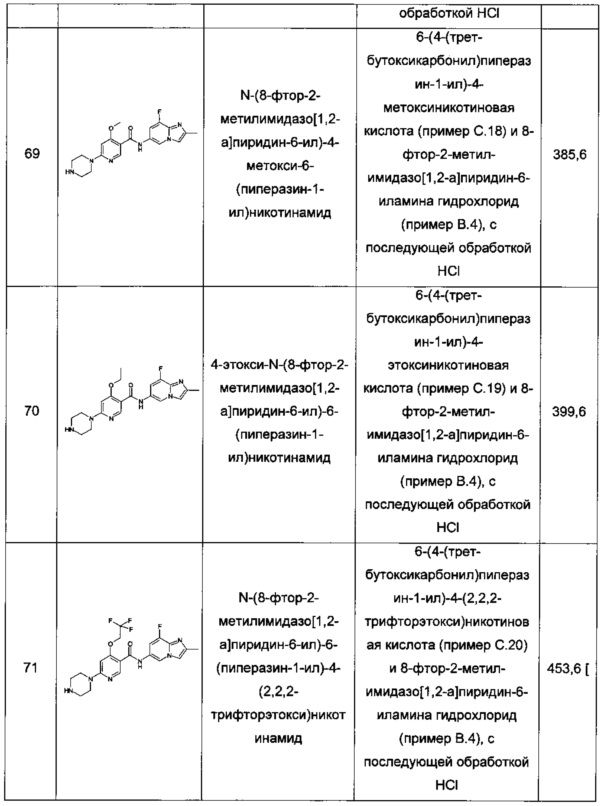
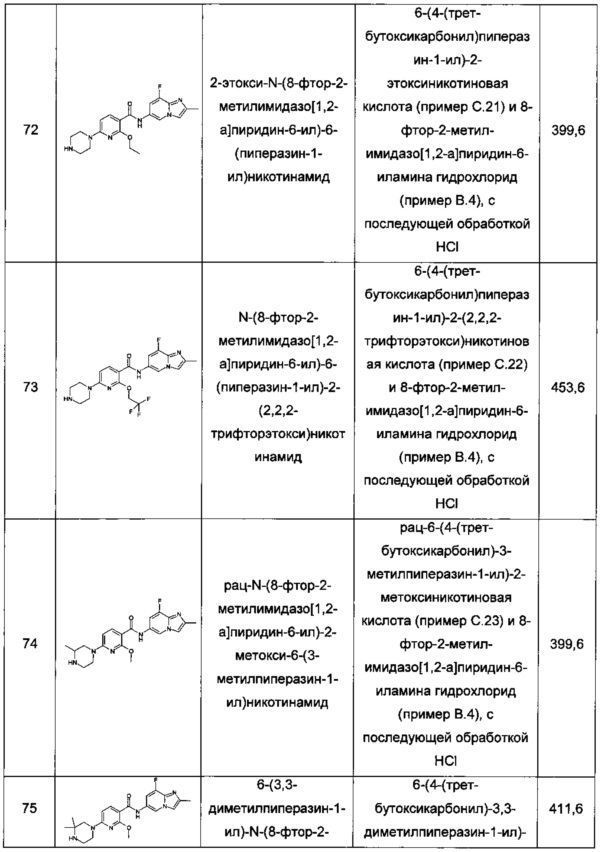
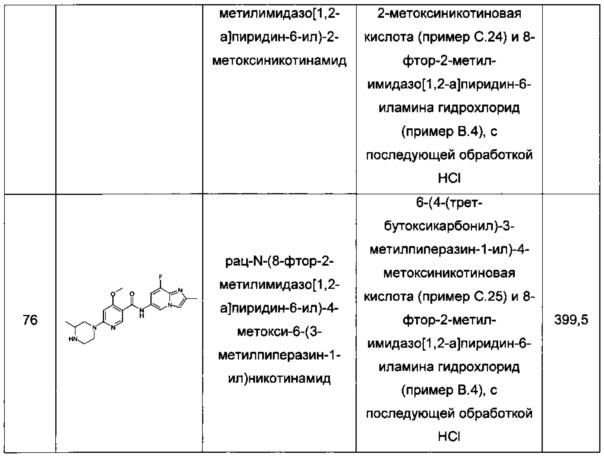
Пример 77
Получение N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамида гидрохлорида
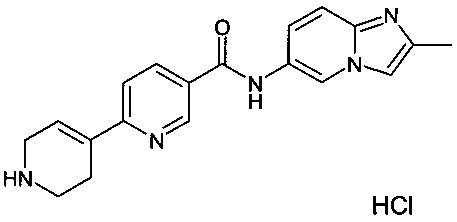
a) стадия 1: трет-бутил 4-(5-(2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)пиридин-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат
К раствору 6-хлор-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамида (пример А5) (100 мг, 349 мкмоль) в смеси 1,2-диметоксиэтана (1,25 мл), этанола (625 мкл) и воды (1,25 мл) в атмосфере азота при комнатной температуре добавляли трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилат (129 мг, 419 мкмоль), K2CO3 (122 мг, 875 мкмоль) и PdCl2(Ph3P)2 (25,2 мг, 35,9 мкмоль, экв.: 0,103). Реакционную смесь нагревали на масляной бане при 100°С в течение 40 минут. После охлаждения до комнатной температуры растворитель удаляли при пониженном давлении. Остаток растворяли в дихлорметане и промывали солевым раствором. Водную фазу экстрагировали три раза метиленхлоридом и объединенную органическую фазу сушили с Na2SO4, фильтровали и концентрировали досуха, получая 285 мг темно-коричневого твердого вещества. Это твердое вещество суспендировали в этилацетате, отфильтровывали и сушили, получая 86 мг (56,9%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС (m/e): 434,5 (М+Н+).
b) стадия 2: N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамида гидрохлорид
К раствору трет-бутил 4-(5-(2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)пиридин-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилата (20 мг, 46,1 мкмоль) в метаноле (200 мкл) в атмосфере азота при комнатной температуре добавляли по каплям хлороводород (4M в диоксане) (115 мкл, 461 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученный в результате осадок отфильтровывали, промывали диэтиловым эфиром и сушили, получая 12,6 мг (73,8%) ожидаемого соединения в виде серого твердого вещества. МС (m/e): 334,5 (М+Н+).
Пример 78
Получение N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамида
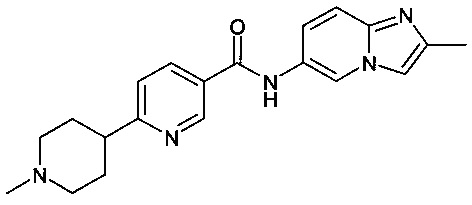
a) стадия 1: трет-бутил 4-(5-(2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)пиридин-2-ил)пиперидин-1-карбоксилат
К раствору трет-бутил 4-(5-(2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)пиридин-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилата (пример 77, стадия 1) (123 мг, 284 мкмоль) в метаноле (7 мл) и тетрагидрофуране (3,5 мл) в атмосфере азота при комнатной температуре добавляли палладий на активированном угле (54,3 мг, 51,0 мкмоль). Реакционную смесь перемешивали в атмосфере водорода в течение ночи. Реакционную смесь продували аргоном, фильтровали и растворитель выпаривали. Неочищенное масло очищали с помощью флэш колоночной хроматографии на силикагеле, элюируя градиентом, полученным из н-гептана и этилацетата (0 до 100%), и этилацетата и метанола (0 до 15%), получая 86 мг (69,6%) указанного в заголовке соединения в виде твердого вещества белого оттенка. МС (m/e): 436,6 (М+Н).
b) стадия 2: N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамид
К суспензии трет-бутил 4-(5-(2-метилимидазо[1,2-а]пиридин-6-илкарбамоил)пиридин-2-ил)пиперидин-1-карбоксилата (17 мг, 39,0 мкмоль) в метаноле (170 мкл) добавляли 4 М HCl в диоксане (97,6 мкл, 390 мкмоль). Светло-желтый раствор перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, получая 14 мг (87,8%) указанного в заголовке соединения в виде серого твердого вещества. МС (m/e): 336,3 (М+Н).
c) стадия 3: N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамид
К суспензии N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамида (25 мг, 74,5 мкмоль) в 1,2-дихлорэтане (250 мкл) в атмосфере азота при 5-10°С добавляли триацетоксиборгидрид натрия (26,3 мг, 112 мкмоль), затем по каплям (в течение 5 минут) раствор формальдегида (37% в воде) (18,1 мг, 16,6 мкл, 224 мкмоль). Температуру поддерживали при 5-10°С и реакционную смесь перемешивали в течение 40 минут. Реакционную смесь гасили 2 н. водным раствором карбоната натрия. Полученный в результате осадок перемешивали при комнатной температуре в течение 30 минут, отфильтровывали, промывали и сушили, получая 17 мг (65,3%) указанного в заголовке соединения в виде твердого вещества белого оттенка. МС (m/e): 350,5 (М+Н+).
Пример 79
Получение N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамида дигидрохлорида
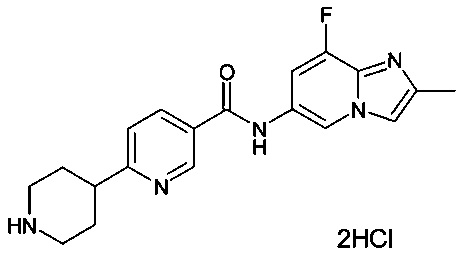
К раствору N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1,2,3,6-тетрагидропиридин-4-ил)никотинамида дигидрохлорида (пример 62) (30 мг, 70,7 мкмоль) в метаноле (1,7 мл) и тетрагидрофуране (850 мкл) в атмосфере азота при комнатной температуре добавляли палладий на активированном угле (20 мг, 18,8 мкмоль, экв.: 0,266). Реакционную смесь перемешивали в атмосфере водорода в течение 4 часов. Реакционную смесь продували аргоном, фильтровали и растворитель выпаривали, получая 28 мг (92,9%) указанного в заголовке соединения в виде желтого твердого вещества. МС (m/e): 354,5 (М+Н+).
Пример 80
Получение N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(1-метилпиперидин-4-ил)никотинамида
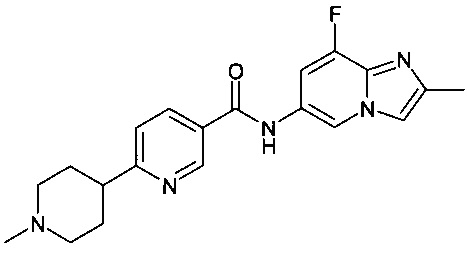
По аналогии со способом, описанным для синтеза примера 78 (стадии: 3), указанное в заголовке соединение получали из N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-6-(пиперидин-4-ил)никотинамида дигидрохлорида (пример 79). МС (m/e): 368,5 (М+Н+).
Пример 81
Получение 2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(пиперидин-4-ил)бензамида гидрохлорида
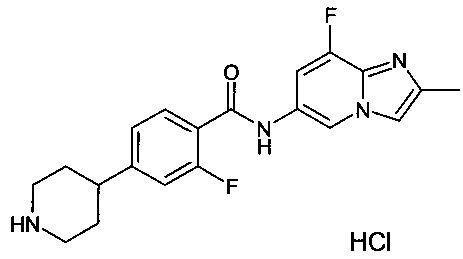
По аналогии со способом, описанным для синтеза примера 79, указанное в заголовке соединение получали из 2-фтор-N-(8-фтор-2-метилимидазо[1,2-а]пиридин-6-ил)-4-(1,2,3,6-тетрагидропиридин-4-ил)бензамида (пример 61). МС (m/e): 371,5 (М+Н+).
Пример 82
Получение рац-6-(3,4-диметилпиперазин-1-ил)-N-(2-метилимидазо[1,2-а]пиридин-6-ил)никотинамида
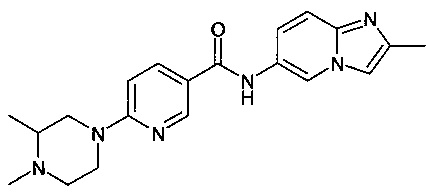
По аналогии со способом, описанным для синтеза примера 78 (стадия 3), указанное в заголовке соединение получали из рац-N-(2-метилимидазо[1,2-а]пиридин-6-ил)-6-(3-метилпиперазин-1-ил)никотинамида (пример 12). МС (m/e): 365,6 (М+Н+).
Биологические анализы
Для более подробного описания и помощи в понимании настоящего описания предлагаются следующие неограничивающие биологические примеры, которые более полно иллюстрируют объем описания и не должны рассматриваться в качестве конкретного ограничения объема изобретения. Для квалифицированного специалиста в данной области техники очевидно, что такие варианты настоящего описания, которые могут быть известны в настоящее время или будут разработаны позже, находятся в объеме настоящего описания и прилагаемых пунктах формулы изобретения. Эти примеры иллюстрируют исследование конкретных соединений, описанных в данном документе, in vitro (вне организма) и/или in vivo (в организме) и демонстрируют применимость соединений в лечении СМА путем усиления включения экзона 7 SMN2 в мРНК, транскрибируемую из гена SMN2. Соединения формулы (I) усиливают включение экзона 7 SMN2 в мРНК, транскрибируемую из гена SMN2, и увеличивают уровни белка SMN, продуцируемого из гена SMN2, и таким образом их можно применять в лечении СМА у человека, нуждающегося в таком лечении. Эти примеры дополнительно иллюстрируют исследование конкретных соединений, описанных в данном документе, in vitro и/или in vivo и демонстрируют применимость соединений в усилении включения экзона 7 SMNI в мРНК, транскрибируемую из гена SMN1. Таким образом, соединения формулы (I) также усиливают включение экзона 7 SMN1 в мРНК, транскрибируемую из гена SMN1, и увеличивают уровни белка SMN, продуцируемого из гена SMN1.
Пример D.1
Исследование методом количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-колПЦР) сплайсинга минигена SMN2 мРНК в культивируемых клетках
Исследование на основе количественной ПЦР с обратной транскрипцией (ОТ-колПЦР) используют для количественного определения уровня полноразмерного минигена SMN2 (называемого в данном документе термином "ПР SMN2мини") мРНК, содержащего экзон 7 SMN2 в клеточной линии HEK293H, стабильно трансфицированной с помощью указанного минигена и обработанной исследуемым соединением.
Конструкцию минигена SMN2-A получали, как описано в международной заявке на патент WO 2009/151546 A1, страница 145 абзац [00400] - страница 147 абзац [00412] (включая Фигуру 1 и Фигуру 3 там же).
Клетки HEK293H, стабильно трансфицированные с помощью конструкции минигена SMN2-A (10,000 клеток/лунка), высевают в 200 мкл среды для культивирования клеток (DMEM плюс 10% эмбриональная бычья сыворотка (ЭБС) с 200 мкг/мл гигромицином) в 96-луночные плоскодонные планшеты и планшет сразу же начинают вращать для обеспечения надлежащего диспергирования клеток и образования равномерного монослоя клеток. Клетки срастаются в течение 6 часов. Исследуемые соединения последовательно разбавляют в 3,16 раз 100% ДМСО, чтобы получить концентрационную кривую по 7 точкам. Раствор исследуемого соединения (1 мкл, 200х в ДМСО) добавляют в каждую содержащую клетки лунку и планшет инкубируют в течение 24 часов в инкубаторе для культивирования клеток (37°С, 5% CO2, 100% относительная влажность). Проводят по 2 эксперимента для каждой концентрации исследуемого соединения. Затем клетки лизируют в буфере для лизиса Cells-To-Ct и лизат хранят при -80°С.
Полноразмерный миниген SMN2-A и GAPDH (от англ. "glyceraldehyde 3-phosphate dehydrogenase" - глицеральдегид-3-фосфатдегидрогеназа) мРНК количественно определяют, используя праймеры и зонды, приведенные в таблице 1. Праймер SMN прямой А (идентификационный номер последовательности SEQ ID NO.1) осуществляет гибридизацию нуклеотидной последовательности в экзоне 7 (от нуклеотида 22 до нуклеотида 40), праймер SMN обратный A (SEQ ID NO.2) осуществляет гибридизацию нуклеотидной последовательности в кодирующей последовательности люциферазы светлячков, SMN зонд A (SEQ ID NO.3) осуществляет гибридизацию нуклеотидной последовательности в экзоне 7 (от нуклеотида 50 до нуклеотида 54) и в экзоне 8 (от нуклеотида 1 до нуклеотида 21). Сочетание этих трех олигонуклеотидов детектирует только SMN1 или минигены SMN2 (ОТ-колПЦР) и не будет детектировать эндогенные гены SMN1 или SMN2.
SMN прямой и обратный праймеры используют при конечных концентрациях 0,4 мкМ. SMN зонд используют при конечной концентрации 0,15 мкМ. GAPDH праймеры используют при конечных концентрациях 0,2 мкМ и зонд - при 0,15 мкМ.
Смесь SMN2-миниген GAPDH (15 мкл общего объема) получают, смешивая 7,5 мкл 2х буфера для ОТ-ПЦР, 0,4 мкл 25х смеси ферментов для ОТ-ПЦР, 0,75 мкл 20х смеси GAPDH праймер-зонд, 4,0075 мкл воды, 2 мкл разбавленного в 10 раз клеточного лизата, 0,06 мкл 100 мкМ SMN прямого праймера, 0,06 мкл 100 мкМ SMN обратного праймера и 0,225 мкл 100 мкМ SMN зонда.
ПЦР проводят при следующих температурах в течение указанного времени: стадия 1: 48°С (15 минут); стадия 2: 95°С (10 минут); стадия 3: 95°С (15 секунд); стадия 4: 60°С (1 минута); затем повторяют стадии 3 и 4 в совокупности в течение 40 циклов.
Каждая реакционная смесь содержит как наборы минигена SMN2-A, так и GAPDH праймеров/зондов (мультиплексный метод), что позволяет проводить одновременное измерение уровней двух транскриптов.
Увеличение содержания ПР SMN2мини мРНК относительно количества в клетках, обработанных наполнителем для контроля, определяют из данных ПЦР в реальном времени, используя модифицированный способ ΔΔCt (как описано у Livak and Schmittgen, Methods, 2001, 25:402-8). Эффективность амплификации Е рассчитывают из наклона кривой амплификации ПР SMN2мини и GAPDH для каждого в отдельности. Затем рассчитывают относительное содержание ПР SMN2мини и GAPDH мРНК по формуле (1+E)-Ct, где Ct представляет собой пороговое значение для каждого ампликона. Относительное содержание ПР SMN2мини мРНК нормируют относительно содержания GAPDH мРНК. Затем нормированное содержание ПР SMN2мини мРНК в образцах, обработанных исследуемым соединением, делят на нормированное содержание ПР SMN2мини мРНК в клетках, обработанных наполнителем, чтобы определить уровень ПР SMN2мини мРНК относительно контрольной группы, обработанной наполнителем.
В таблице 2 приведены концентрации ЭК1.5х для продуцирования полноразмерного минигена SMN2 мРНК, которые получены из данных по 7 концентрациям, полученным в соответствии с вышеприведенным способом для конкретных соединений по настоящему изобретению.
Особые соединения по настоящему изобретению показывают концентрацию ЭК1.5х для продуцирования полноразмерного минигена SMN2 мРНК ≤1 мкМ.
Особенные соединения по настоящему изобретению показывают концентрацию ЭК1.5х для продуцирования полноразмерного минигена SMN2 мРНК ≤0,1 мкМ.
Самые особенные соединения по настоящему изобретению показывают концентрацию ЭК1.5х для продуцирования полноразмерного минигена SMN2 мРНК ≤0,02 мкМ.
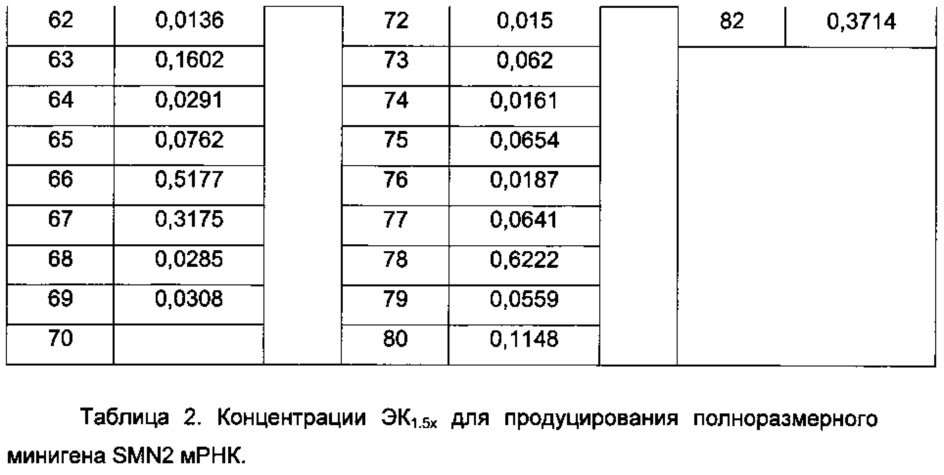
Пример D.2
Исследование белка SMN в культивируемых клетках Исследование SMN с помощью гомогенной флуоресценции с временным разрешением (HTRF, от англ. "homogeneous time resolved fluorescence") используют для количественного определения уровня белка SMN в фибробластах пациента со СМА, обработанных исследуемыми соединениями.
Клетки размораживают и культивируют в DMEM - 10% ЭБС в течение 72 часов. Клетки трипсинизируют, считают и повторно суспендируют до концентрации 25,000 клеток/мл в DMEM - 10% ЭБС. Суспензии клеток высевают в количестве 5,000 клеток на лунку в 96-луночном титрационном микропланшете и инкубируют в течение 3-5 часов. Исследуемые соединения последовательно разбавляют в 3,16 раз 100% ДМСО, чтобы получить концентрационную кривую по 7 точкам. По 1 мкл раствора исследуемого соединения переносят в содержащие клетки лунки и клетки инкубируют в течение 48 часов в инкубаторе для культивирования клеток (37°С, 5% CO2, 100% относительная влажность). Для каждой концентрации исследуемого соединения используют по три образца. Через 48 часов надосадочную жидкость удаляют из лунок и добавляют в лунки по 25 мкл лизирующего буфера для РИПА, содержащего ингибиторы протеаз, и инкубируют, встряхивая, при комнатной температуре в течение 1 часа. Добавляют 25 мкл разбавителя и затем по 35 мкл полученного в результате лизата переносят в 384-луночный планшет, в котором каждая лунка содержит по 5 мкл раствора антител (разбавление 1:100 анти-SMN d2 и анти-SMN криптата в буфере для растворения SMN). Планшет центрифугируют в течение 1 минуты для того, чтобы раствор мог достичь дна лунок, затем инкубируют в течение ночи при комнатной температуре. Измеряют флуоресценцию для каждой лунки планшета при 665 нм и 620 нм на планшет-ридере EnVision multilabel (Perkin-Elmer).
Рассчитывают нормированный флуоресцентный сигнал для каждого образца, холостой пробы и контрольной лунки с наполнителем путем деления сигнала при 665 нм на сигнал при 620 нм. Нормирование сигнала учитывает возможное гашение флуоресценции из-за влияния матрицы лизата. Рассчитывают значение ΔF (измерение содержания белка SMN в процентном значении) для каждой лунки с образцом путем вычитания нормированной средней флуоресценции для контрольных лунок с холостой пробой из нормированной флуоресценции для каждой лунки с образцом, затем деления этой разности на нормированную среднюю флуоресценцию для контрольных лунок с холостой пробой и умножения полученного в результате значения на 100. Значение ΔF для каждой лунки с образцом представляет собой относительное содержание белка SMN в образцах, обработанных исследуемым соединением. Значение ΔF для каждой лунки с образцом делят на значение ΔF для контрольных лунок с наполнителем, чтобы вычислить кратность увеличения содержания белка SMN относительно контрольной пробы с наполнителем. В таблице 3 приведены концентрации ЭК1.5x для экспрессии белка SMN, которые получены из данных по 7 концентрациям, полученным в соответствии с вышеприведенным способом для конкретных соединений по настоящему изобретению.
Особые соединения по настоящему изобретению показывают концентрацию ЭК1.5х для экспрессии белка SMN ≤2 мкМ.
Особенные соединения по настоящему изобретению показывают концентрацию ЭК1.5х для экспрессии белка SMN ≤0,3 мкМ.
Самые особенные соединения по настоящему изобретению показывают концентрацию ЭК1.5х для экспрессии белка SMN ≤0,1 мкМ.
В таблице 4 приведены значения максимальной кратности увеличения белка SMN, которые получены из данных по 7 концентрациям, полученным в соответствии с вышеприведенным способом для конкретных соединений по настоящему изобретению.
Особые соединения по настоящему изобретению показывают максимальную кратность увеличения >1,4.
Особенные соединения по настоящему изобретению показывают максимальную кратность увеличения >1,7.
Самые особенные соединения по настоящему изобретению показывают максимальную кратность увеличения >1,8.