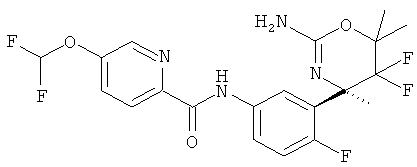
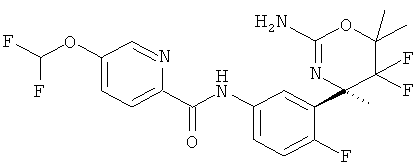
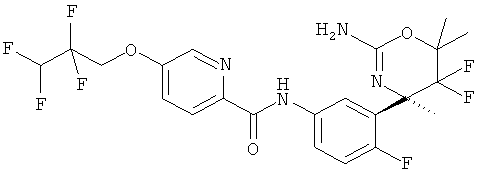
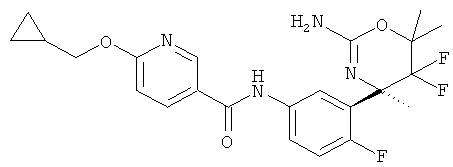
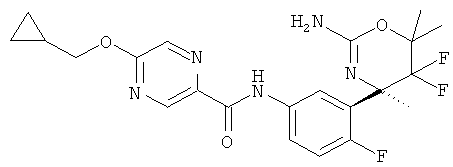
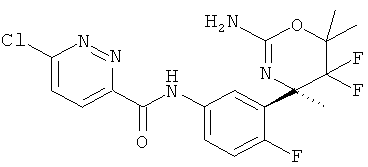
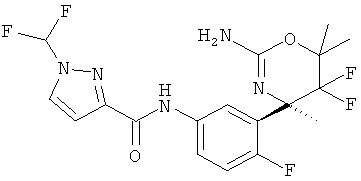
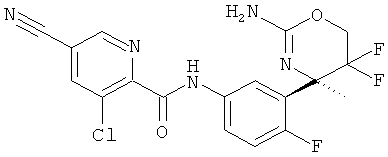
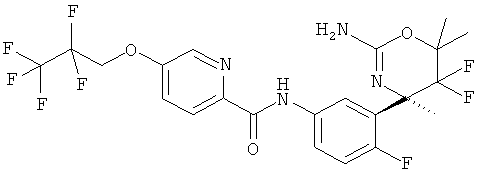
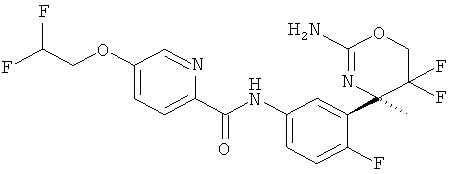
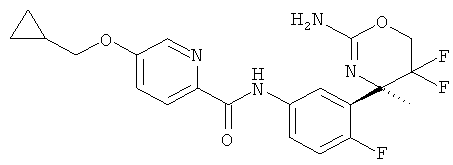
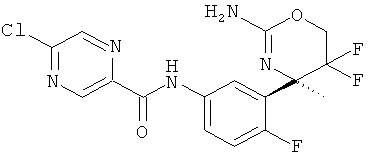
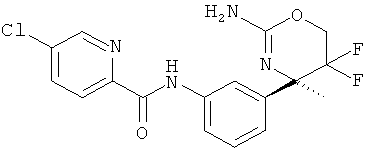
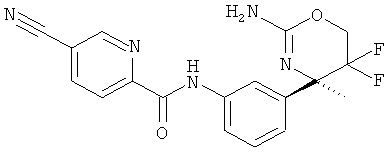
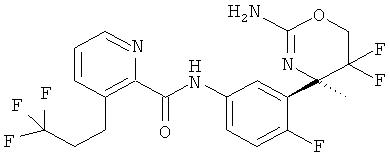
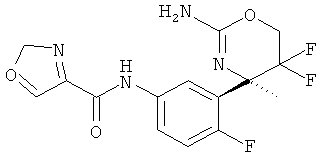
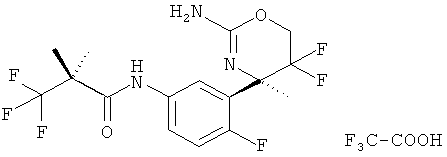
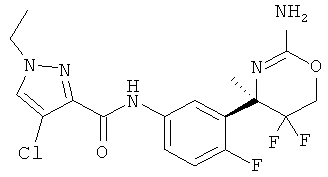
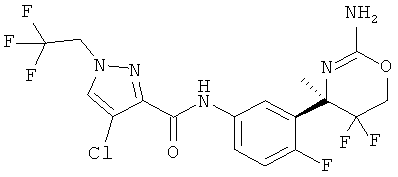
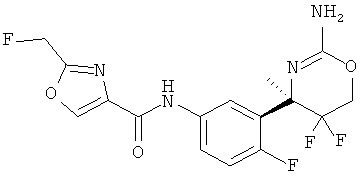
Результат интеллектуальной деятельности: 2-АМИНО-5,5-ДИФТОР-5,6-ДИГИДРО-4Н-ОКСАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ 1 И(ИЛИ) ВАСЕ 2
Вид РИД
Изобретение
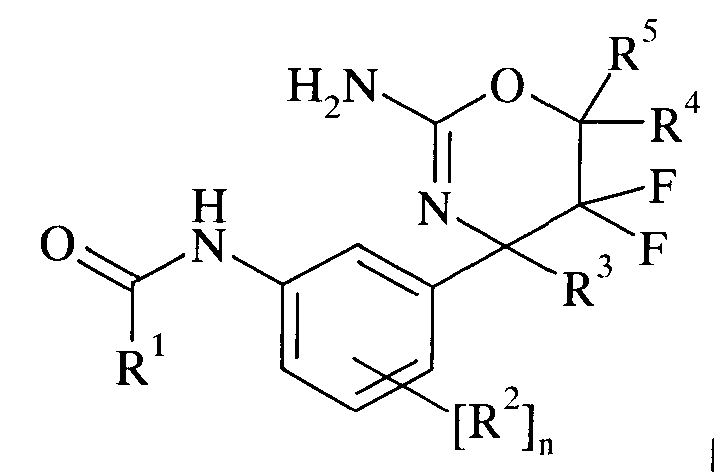
Настоящее изобретение относится к производным 2-Амино-5,5-дифтор-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-фенил]-амида, обладающим свойствами ингибиторов ВАСЕ1 и/или ВАСЕ2, к их получению, к содержащим их фармацевтическим композициям и к их применению в качестве терапевтически активных веществ.
|
Настоящее изобретение относится к соединениям формулы I,
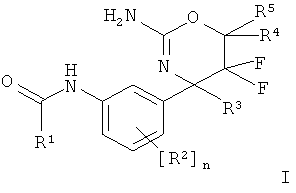
где заместители и переменные являются такими, как описано ниже и в формуле изобретения, или к их фармацевтически приемлемым солям.
Настоящие соединения обладают ингибиторной активностью в отношении Asp2 (β-секретазы, ВАСЕ1 или мемапсина-2) и, следовательно, могут применяться при терапевтическом и/или профилактическом лечении заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоидов и/или олигомеров β-амилоидов и/или β-амилоидных бляшек и других отложений, в частности, болезни Альцгеймера. И/или настоящие соединения обладают ингибиторной активностью в отношении ВАСЕ2 и, следовательно, могут применяться при терапевтическом и/или профилактическом лечении заболеваний и расстройств, таких как диабет типа 2 и другие метаболические расстройства.
Предшествующий уровень техники
Болезнь Альцгеймера (AD) представляет собой нейродегенеративное расстройство центральной нервной системы и ведущей причиной прогрессирующей деменции у пожилого населения. Ее клиническими симптомами являются ухудшение памяти, познавательной способности, временной и пространственной ориентации, суждения и мышления, а также тяжелые эмоциональные нарушения. В настоящее время нет доступных способов лечения, которые могут предупреждать это заболевание или его прогрессирование, либо вызывать стабильную реверсию его клинических симптомов. AD стала значительной проблемой здравоохранения во всех обществах с высокой средней продолжительностью жизни, а также значительным экономическим бременем для их систем здравоохранения.
AD характеризуется двумя основными патологиями в центральной нервной системе (ЦНС), возникновением амилоидных бляшек и нейрофибриллярных клубков (Hardy et al., The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics, Science. 2002 Jul 19; 297(5580):353-6, Selkoe, Cell biology of the amyloid beta-protein precursor and the mechanism of Alzheimer's disease, Annu Rev Cell Biol. 1994; 10:373-403). Обе патологии также обычно наблюдают у пациентов с синдромом Дауна (трисомией 21), у которых также развиваются AD-подобные симптомы в раннем возрасте. Нейрофибриллярные клубки представляют собой внутриклеточные агрегаты ассоциированного с микротрубочками белка tau (МАРТ). Амилоидные бляшки возникают во внеклеточном пространстве, их основными компонентами являются Аβ-пептиды. Последние представляют собой группу протеолитических фрагментов, образованных от белка-предшественника β-амилоида (АРР) в результате серии стадий протеолитического расщепления. Идентифицировано несколько форм АРР, из которых наиболее распространенными являются белки длиной 695, 751 и 770 аминокислот. Все они имеют происхождение от одного гена посредством дифференциального сплайсинга. Аβ-пептиды образованы из одного и того же домена АРР, но отличаются их N- и С-концами, где основные виды молекул имеют длину 40 и 42 аминокислоты. Существует несколько научных доказательств, которые позволяют с большой вероятностью предположить, что Аβ-пептиды являются существенными молекулами в патогенезе AD: 1) амилоидные бляшки, образованные из Аβ-пептидов, составляют неизменную часть патологии AD; 2) Аβ-пептиды токсичны для нейронов; 3) при семейной болезни Альцгеймера (FAD) мутации в генах этого заболевания АРР, PSN1, PSN2 приводят к повышенным уровням Аβ-пептидов и раннему амилоидозу головного мозга; 4) у трансгенных мышей, которые экспрессируют такие гены FAD, развивается патология, которая имеет много сходств с заболеванием у человека. Аβ-пептиды продуцируются из АРР посредством последовательного действия двух протеолитических ферментов, называемых β- и γ-секретазой. β-Секретаза сначала расщепляет во внеклеточном домене АРР примерно 28 аминокислот снаружи от трансмембранного домена (ТМ) с образованием С-концевого фрагмента АРР, содержащего ТМ и цитоплазматический домен (CTFβ). CTFβ является субстратом для γ-секретазы, которая расщепляет в нескольких соседних положениях внутри ТМ с образованием Аβ пептидов и цитоплазматического фрагмента. γ-Секретаза представляет собой комплекс по меньшей мере 4 различных белков, ее каталитической субъединицей весьма вероятно является белок пресенилин (PSEN1, PSEN2). β-Секретаза (ВАСЕ1, Asp2; ВАСЕ обозначает β-сайт АРР-расщепляющего фермента) представляет собой аспартилпротеазу, которая заякорена в мембране посредством трансмембранного домена (Vassar et al., Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE, Science. 1999 Oct 22; 286(5440):735). Она экспрессируется во многих тканях организма человека, но ее уровень особенно высок в ЦНС. Генетическое разрушение гена ВАСЕ1 у мышей четко показало, что его активность существенна для процессинга АРР, который приводит к образованию Аβ-пептидов, в отсутствие ВАСЕ1 Аβ-пептиды не продуцируются (Luo et al., Mice deficient in ВАСЕ1, the Alzheimer's beta-secretase, have normal phenotype and abolished beta-amyloid generation, Nat Neurosci. 2001 Mar; 4(3):231-2, Roberds et al., BACE knockout mice are healthy despite lacking the primary beta-secretase activity in brain: implications for Alzheimer's disease therapeutics, Hum Mol Genet. 2001 Jun 1; 10(12): 1317-24). Мыши, у которых генно-инженерным путем получена экспрессия гена АРР человека и у которых образуются обширные амилоидные бляшки и патологии, подобные болезни Альцгеймера, при старении, этого не происходит, когда активность β-секретазы снижена в результате генетического разрушения одного из аллелей ВАСЕ1 (McConlogue et al., Partial reduction of ВАСЕ1 has dramatic effects on Alzheimer plaque and synaptic pathology in АРР Transgenic Mice. J Biol Chem. 2007 Sep 7; 282(36):26326). Следовательно, предполагают, что ингибиторы активности ВАСЕ1 могут быть полезными агентами для терапевтического вмешательства в болезнь Альцгеймера (AD).
Диабет типа 2 (T2D) вызван устойчивостью к инсулину и неадекватной секрецией инсулина из β-клеток поджелудочной железы, приводящей к слабому контролю глюкозы в крови и гипергликемии (М Prentki & CJ Nolan, "Islet beta-cell failure in type 2 diabetes." J. Clin. Investig. 2006, 116(7), 1802-1812). Пациенты с T2D обладают повышенным риском микрососудистого и макрососудистого заболевания и ряда родственных осложнений, включающих диабетическую нефропатию, ретинопатию и сердечно-сосудистое заболевание. В 2000 г. по оценкам 171 млн человек страдал этим состоянием, причем ожидают, что эта цифра удвоится к 2030 г. (S Wild, G Roglic, A Green, R.Sicree & Н King, "Global prevalence of diabetes", Diabetes Care 2004, 27(5), 1047-1053), что делает это заболевание значительной проблемой здравоохранения. Рост распространенности T2D связан с все возрастающим сидячим образом жизни и приемом высококалорийных продуктов питания населения всего мира (Р Zimmet, KGMM Alberti & J Shaw, "Global and societal implications of the diabetes epidemic" Nature 2001, 414, 782-787).
Недостаточность β-клеток и вследствие этого резкое снижение секреции инсулина и гипергликемия отмечает начало T2D. Большинство современных терапий не предотвращает потерю массы β-клеток, характеризующую выраженный T2D. Однако недавние разработки аналогов GLP-1, гастрина и других агентов показывают, что сохранения и пролиферации β-клеток можно достичь, что приведет к улучшенной толерантности к глюкозе и замедлению прогрессирования до выраженного T2D (LL Baggio & DJ Drucker, "Therapeutic approaches to preserve islet mass in type 2 diabetes", Annu. Rev. Med. 2006, 57, 265-281).
Tmem27 идентифицирован как белок, стимулирующий пролиферацию бета-клеток (Р Akpinar, S Kuwajima, J Krutzfeldt, M Stoffel, "Tmem27: A cleaved and shed plasma membrane protein that stimulates pancreatic p cell proliferation", Cell Metab. 2005, 2, 385-397) и секрецию инсулина (К Fukui, Q Yang, Y Cao, N Takahashi et al., "The HNF-1 target Collectrin controls insulin exocytosis by SNARE complex formation", Cell Metab. 2005, 2, 373-384). Tmem27 представляет собой 42 кДа мембранный гликопротеин, который претерпевает конститутивный шеддинг с поверхности β-клеток в результате расщепления полноразмерного клеточного Tmem27. Гиперэкспрессия Tmem27 у трансгенных мышей увеличивает массу β-клеток и улучшает толерантность к глюкозе в модели диабета алиментарного ожирения DIO. Кроме того, нокаут Tmem27 посредством siRNA в анализе пролиферации β-клеток грызунов (например, с использованием клеток INS1e) снижает скорость пролиферации, что указывает на роль Tmem27 в контроле массы β-клеток.
В таком же анализе пролиферации ингибиторы ВАСЕ2 также увеличивают пролиферацию. Однако ингибирование ВАСЕ2 в сочетании с нокаутом Tmem27 siRNA приводит в результате к низким скоростям пролиферации. Поэтому сделан вывод, что ВАСЕ2 является протеазой, ответственной за расщепление Tmem27. Кроме того, in vitro ВАСЕ2 расщепляет пептид, основанный на последовательности Tmem27. Близкородственная протеаза ВАСЕ1 не расщепляет этот пептид, и селективное ингибирование только ВАСЕ1 не повышает пролиферацию β-клеток.
Близким гомологом ВАСЕ2 является мембраносвязанная аспартилпротеаза, и она совместно локализована с Tmem27 в β-клетках поджелудочной железы человека (G Finzi, F Franzi, С Placidi, F Acquati et al., "ВАСЕ2 is stored in secretory granules of mouse and rat pancreatic beta cells", Ultrastruct Pathol. 2008, 32(6), 246-251). Также известно, что она способна к расщеплению АРР (I Hussain, D Powell, D Hewlett, G Chapman et al., "ASP1 (BACE2) cleaves the amyloid precursor protein at the β-secretase site" Mol Cell Neurosci. 2000, 16, 609-619), IL-1R2 (P Kuhn, E Marjaux, A Imhof, В De Strooper et al., "Regulated intramembrane proteolysis of the interleukin-1 receptor II by alpha-, beta-, and gamma-secretase" J. Biol. Chem. 2007, 282(16), 11982-11995) и АСЕ2. Способность к расщеплению АСЕ2 указывает на возможную роль BACE2 в контроле гипертензии.
Ингибирование BACE2, следовательно, предложено в качестве терапии T2D с потенциалом сохранения и восстановления массы β-клеток и стимуляции секреции инсулина у преддиабетических и диабетических пациентов. Следовательно, цель настоящего изобретения состоит в разработке селективных ингибиторов BACE2. Такие соединения полезны в качестве терапевтически активных веществ, в частности, при лечении и/или предупреждении заболеваний, которые связаны с ингибированием BACE2.
Кроме того, образование или образование и отложение β-амилоидных пептидов в неврологической ткани или вокруг нее (например, в головном мозге) ингибируется настоящими соединениями, то есть ингибированием продуцирования Аβ из АРР или фрагмента АРР.
В WO 2007/049532 и WO 2008/133274 описаны производные аминодигидротиазина в качестве ингибиторов ВАСЕ1, и в WO 2008/133273 описаны фармацевтические композиции ингибиторов ВАСЕ1.
Ингибиторы ВАСЕ1 и/или BACE2 можно, кроме того, применять для лечения приведенных ниже заболеваний: IBM (миозита с включенными тельцами) (Vattemi G. et al., Lancet. 2001 Dec 8; 358(9297): 1962-4), синдрома Дауна (Barbiero L. et al, Exp Neurol. 2003 Aug; 182(2):335-45), болезни Вильсона (Sugimoto I. et al., J Biol Chem. 2007 Nov 30; 282(48):34896-903), болезни Уиппла (Desnues В. et al., Clin Vaccine Immunol. 2006 Feb; 13(2):170-8), спинально-церебеллярной атаксии 1 и спинально-церебеллярной атаксии 7 (Gatchel J.R. et al., Proc Natl Acad Sci USA 2008 Jan 29; 105(4): 1291-6), дерматомиозита (Greenberg S.A. et al., Ann Neurol. 2005 May; 57(5):664-78 и Greenberg S.A. et al., Neurol 2005 May; 57(5):664-78), саркомы Капоши (Lagos D. et al, Blood, 2007 Feb 15; 109(4): 1550-8), мультиформной глиобластомы (Е-МЕХР-2576, http://www.ebi.ac.uk/microarray-as/aer/result?queryFor=PhysicalArrayDesign&aAccession=A-MEXP-258), ревматоидного артрита (Ungethuem U. etal, GSE2053), бокового амиотрофического склероза (Koistinen H. etal., Muscle Nerve. 2006 Oct; 34(4):444-50 и Li Q.X. etal, Aging Cell. 2006 Apr; 5(2): 153-65), болезни Гентингтона (Kirn Y.J. et al., Neurobiol Dis. 2006 May; 22(2):346-56. Epub 2006 Jan 19 и Hodges A. et al„ Hum Mol Genet. 2006 Mar 15;15(6):965-77. Epub 2006 Feb 8), множественной миеломы (Kihara Y. et al, Proc Natl Acad Sci USA. 2009 Dec 22; 106(51):21807-12), злокачественной меланомы (Talantov D. et al, Clin Cancer Res. 2005 Oct 15; 11(20):7234-42), синдрома Шегрена (Basset С.et al., Scand J Immunol. 2000 Mar; 51(3):307-11), системной красной волчанки (Grewal P.K. et al, Mol Cell Biol. 2006, Jul; 26(13):4970-81), макрофагического миофасцита, ювенильного идиопатического артрита, гранулематозного артрита, рака молочной железы (Hedlund M. et al, Cancer Res. 2008 Jan 15; 68(2):388-94 и Kondoh К. et al.. Breast Cancer Res Treat. 2003 Mar; 78(1):37-44), желудочно-кишечных заболеваний (Hoffmeister A. et al, JOP. 2009 Sep 4; 10(5):501-6), аутоиммунных/воспалительных заболеваний (Woodard-Grice A.V. et al„ J Biol Chem. 2008 Sep 26; 283(39):26364-73. Epub 2008 Jul 23), ревматоидного артрита (Toegel S. et al, Osteoarthritis Cartilage. 2010 Feb; 18(2):240-8. Epub 2009 Sep 22), воспалительных реакций (Lichtenthaler S.F. et al., J Biol Chem. 2003 Dec 5; 278(49):48713-9. Epub 2003 Sep 24), артериального тромбоза (Merten M. et al., Z Kardiol. 2004 Nov; 93(11):855-63), сердечно-сосудистых заболеваний, таких как инфаркт миокарда и удар (Maugeri N. et al., Srp Arh Celok Lek. 2010 Jan; 138 Supp 11:50-2) и болезни Грейвса (Kiljanski J. etal, Thyroid. 2005 Jul; 15(7):645-52).
Объектами настоящего изобретения являются новые соединения формулы I, их получение, лекарственные средства на основе соединения в соответствии с изобретением и их получение, а также применение соединений формулы I при контроле или предупреждении заболеваний, таких как болезнь Альцгеймера и диабет типа 2, кроме того, применение соединений формулы I при лечении бокового амиотрофического склероза (ALS), артериального тромбоза, аутоиммунных/воспалительных заболеваний, рака, такого как рак молочной железы, сердечно-сосудистых заболеваний, таких как инфаркт миокарда и удар, дерматомиозита, синдрома Дауна, желудочно-кишечных заболеваний, мультиформной глиобластомы, болезни Грейвса, болезни Гентингтона, миозита с включенными тельцами (IBM), воспалительных реакций, саркомы Капоши, болезни Костманна, системной красной волчанки, макрофагического миофасцита, ювенильного идиопатического артрита, гранулематозного артрита, злокачественной меланомы, множественной миеломы, ревматоидного артрита, синдрома Шегрена, спинально-церебеллярной атаксии 1, спинально-церебеллярной атаксии 7, болезни Уиппла и болезни Вильсона. Новые соединения формулы I обладают улучшенными фармакологическими свойствами.
Подробное описание изобретения
Объектом настоящего изобретения является соединение формулы 1 и его фармацевтически приемлемые соли, получение вышеупомянутых соединений, содержащие их лекарственные средства и их получение, а также применение вышеупомянутых соединений при терапевтическом и/или профилактическом лечении заболеваний и расстройств, которые связаны с ингибированием активности ВАСЕ1 и/или ВАСЕ2, таких как болезнь Альцгеймера и диабет типа 2. Кроме того, образование или образование и отложение β-амилоидных бляшек в неврологической ткани или вокруг нее (например, в головном мозге) ингибируется настоящими соединениями, то есть ингибированием продуцирования Аβ из АРР или фрагмента АРР.
Приведенные ниже определения общих терминов, используемых в настоящем описании, применяют независимо от того, встречаются ли обсуждаемые термины одни или в комбинации с другими группами.
Если не указано иное, приведенные ниже термины, используемые в данной заявке, включая описание и формулу изобретения, имеют приведенные ниже определения. Необходимо отметить, что, как используют в описании и прилагаемой формуле изобретения, формы единственного числа включают множественные объекты ссылки, если контекстом явно не продиктовано иное.
"Необязательный" или "необязательно" означает, что нижеописанное событие или обстоятельство может необязательно произойти, и что описание включает случаи, где это событие или обстоятельство происходит, и случаи, где оно не происходит.
Термин "низший алкил", отдельно или в комбинации с другими группами, означает углеводородный радикал, который может быть нормальным или разветвленным, с одиночным или множественным разветвлением, где алкильная группа, как правило, включает от 1 до 6 атомов углерода, например, метил (Me), этил (Et), пропил, изопропил (i-пропил), н-бутил, i-бутил (изобутил), 2-бутил (втор-бутил), t-бутил (трет-бутил) и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода. Наиболее предпочтителен метил.
Термин "низший цианоалкил", отдельно или в комбинации с другими группами, относится к низшему алкилу, как определено в данной заявке, который замещен одним или множественными циано, предпочтительно 1-5 циано, более предпочтительно 1 циано. Примерами являются цианометил и тому подобное.
Термин "низший галогеноалкил", отдельно или в комбинации с другими группами, относится к низшему алкилу, как определено в данной заявке, который замещен одним или множественными атомами галогена, предпочтительно 1-5 атомами галогена, более предпочтительно 1-3 атомами галогена, наиболее предпочтительно 1 атомом галогена или 3 атомами галогена. Примерами являются трифторметил, хлорметил, фторметил и тому подобное.
Термин "циклоалкил-низший алкил", отдельно или в комбинации с другими группами, относится к низшему алкилу, как определено в данной заявке, который замещен одним циклоалкилом, как определено в данной заявке. Примерами являются циклопропилметил, циклопропилэтил и тому подобное.
Термин "низший алкокси-низший алкил", отдельно или в комбинации с другими группами, относится к низшему алкилу, как определено в данной заявке, который замещен одним или множественными низшими алкокси, как определено в данной заявке. Примерами являются МеО-Ме, 1MeO-Et, 2MeO-Et, 1МеО-2Et-пропил и тому подобное.
Термин "низший алкил, замещенный", отдельно или в комбинации с другими группами, означает низший алкил, как определено в данной заявке, который замещен одним или множественными заместителями, предпочтительно 1-5 заместителями, где заместитель индивидуально выбран из группы, которая указана для каждого конкретного "низшего алкила, замещенного", например, циано, атом галогена, гидрокси и низший алкокси.
Термин "низший алкенил" означает одновалентную нормальную или разветвленную углеводородную группу из атомов углерода в количестве от 2 до 7, в частности, от 2 до 4 атомов углерода, по меньшей мере с одной двойной связью. Примеры алкенила включают этенил, пропенил, проп-2-енил, изопропенил, н-бутенил, i-бутенил и t-бутенил. Конкретным является этенил.
Термин "низший алкенил, замещенный", отдельно или в комбинации с другими группами, означает низший алкенил, как определено в данной заявке, который замещен одним или множественными заместителями, предпочтительно 1-4 заместителями, где заместитель индивидуально выбран из группы, которая указана для каждого конкретного "низшего алкенила, замещенного", например, циано, низший цианоалкил, атом галогена, низший галогеноалкокси, низший галогеноалкил, гетероарил, низший алкокси, низший алкокси-низший алкил и низший алкил.
Термин "циклоалкил-низший алкенил", отдельно или в комбинации с другими группами, относится к низшему алкенилу, как определено в данной заявке, который замещен одним циклоалкилом, как определено в данной заявке. Примерами являются циклопропилэтенил, циклопропилпропенил и тому подобное.
Термин "низший алкинил" означает одновалентную нормальную или разветвленную углеводородную группу из атомов углерода в количестве от 2 до 7, в частности, от 2 до 4 атомов углерода, и содержащую одну, две или три тройные связи. Примеры алкинила включают этинил, пропинил, проп-2-инил, изопропинил, н-бутинил и изобутинил.
Термин "циклоалкил-низший алкинил", отдельно или в комбинации с другими группами, относится к низшему алкинилу, как определено в данной заявке, который замещен одним циклоалкилом, как определено в данной заявке. Примерами являются циклопропилэтинил, циклопропилпропинил и тому подобное.
Термин "циано", отдельно или в комбинации с другими группами, относится к N=C-(NC-).
Термин "амидо", отдельно или в комбинации с другими группами, относится к -С(=O)-NH2.
Термин "нитро", отдельно или в комбинации с другими группами, относится к -NO2.
Термин "гидрокси", отдельно или в комбинации с другими группами, относится к -ОН.
Термин "атом галогена", отдельно или в комбинации с другими группами, означает хлор (Cl), йод (I), фтор (F) и бром (Br). Предпочтительным "атомом галогена" является Cl и F.
Термин "арил", отдельно или в комбинации с другими группами, относится к ароматической карбоциклической группе, содержащей от 6 до 14, предпочтительно от 6 до 10 атомов углерода и имеющей по меньшей мере одно ароматическое кольцо или множественные конденсированные кольца, в которых по меньшей мере одно кольцо является ароматическим. Примеры "арила" включают бензил, дифенил, инданил, нафтил, фенил (Ph) и тому подобное. Предпочтительным "арилом" является фенил.
Выражение "арил, замещенный", отдельно или в комбинации с другими группами, относится к арилу, который замещен одним или множественными заместителями, предпочтительно 1-4 заместителями, где возможно замещение при каждом кольцевом атоме индивидуально, где заместитель индивидуально выбран из группы, которая указана для каждого конкретного "арила, замещенного", например, из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила. Примерами являются галогеноарил, хлорфенил, фторфенил, низший алкиларил, метилфенил, низший алкоксиарил, метоксифенил и тому подобное.
Термин "гетероарил", отдельно или в комбинации с другими группами, относится к ароматической карбоциклической группе, имеющей одно 4-8-членное кольцо или множественные конденсированные кольца, содержащие от 6 до 14, более предпочтительно от 6 до 10, кольцевых атомов и содержащие 1, 2 или 3 гетероатома, индивидуально выбранные из N, О и S, в частности, N и О, где в этой группе по меньшей мере одно гетероциклическое кольцо является ароматическим. Примеры "гетероарила" включают бензофурил, бензоимидазолил, бензооксазинил, бензотиазинил, бензотиазолил, бензотиенил, бензотриазолил, фурил, имидазолил, индазолил, индолил, изохинолинил, изотиазолил, изоксазолил, оксазолил, пиразинил, пиразолил (пиразил), пиразоло[1,5-а]пиридинил, пиридазинил, пиридинил, пиримидинил, пирролил, хинолинил, тетразолил, тиазолил, тиенил, триазолил и тому подобное. Предпочтительны 1H-пиразолил, фурил, изоксазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиридинил-N-оксид и пиримидинил. Более предпочтительными гетероарилами являются пиридинил, пиразолил, пиразинил и пиримидинил. Наиболее предпочтительны пиридин-2-ил, пиразин-2-ил, 1Н-пиразол-3-ил и пиримидин-2-ил.
Выражение "гетероарил, замещенный", отдельно или в комбинации с другими группами, относится к гетероарилу, который замещен одним или множественными заместителями, предпочтительно 1-4 заместителями, где возможно замещение при каждом кольцевом атоме индивидуально, где заместитель индивидуально выбран из группы, которая указана для каждого конкретного "гетероарила, замещенного", то есть, например, из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила. Предпочтительным "гетероарилом, замещенным" является гетероарил, замещенный 1-2 заместителями, индивидуально выбранными из циано, атома галогена, низшего галогеноалкокси, низшего галогеноалкила и низшего алкила. Более предпочтительны (2,2,2-трифторэтокси)-пиридин-2-ил, 3,5-дихлорпиридин-2-ил, 3,5-дифторпиридин-2-ил, 3-хлор-5-фторпиридин-2-ил, 3-хлор-5-трифторметилпиридин-2-ил, 3-хлорпиридин-2-ил, 3-фторпиридин-2-ил, 3-трифторметилпиридин-2-ил, 4-хлор-1-метил-1 Н-пиразол-3-ил, 5-хлор-3-фторпиридин-2-ил, 5-хлор-3-метилпиридин-2-ил, 5-хлорпиридин-2-ил, 5-хлорпиримидин-2-ил, 5-цианопиридин-2-ил, 5-фторпиридин-2-ил, 5-трифторметилпиразин-2-ил и 5-трифторметилпиримидин-2-ил.
Термин "низший алкокси", отдельно или в комбинации с другими группами, означает радикал -O-низший алкил, который может быть нормальным или разветвленным, с одиночным или множественным разветвлением, где алкильная группа, как правило, содержит от 1 до 6 атомов углерода, например, метокси (ОМе, МеО), этокси (OEt), пропокси, изопропокси (i-пропокси), н-бутокси, i-бутокси (изобутокси), 2-бутокси (втор-бутокси), t-бутокси (трет-бутокси), изопентилокси (i-пентилокси) и тому подобное. Предпочтительными группами "низший алкокси" являются группы с 1-4 атомами углерода. Наиболее предпочтителен метокси.
Термин "низший галогеноалкокси", отдельно или в комбинации с другими группами, относится к низшему алкокси, как определено в данной заявке, который замещен одним или множественными атомами галогена. Предпочтительными "низшими галогеноалкокси" являются низший фторалкокси, фторэтокси и галогеноэтокси, наиболее предпочтителен 2,2,2-трифторэтокси.
Термин "циклоалкил-низший алкокси", отдельно или в комбинации с другими группами, относится к низшему алкокси, как определено в данной заявке, который замещен одним циклоалкилом, как определено в данной заявке. Примерами являются циклопропилэтокси, циклопропилметокси и тому подобное.
Термин "циклоалкил", отдельно или в комбинации с другими группами, означает одновалентную насыщенную моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 10, в частности, одновалентную насыщенную моноциклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 8. Бициклический означает состоящий из двух насыщенных карбоциклов, имеющих два общих атома углерода, то есть мостик, разделяющий два кольца, представляет собой либо простую связь, либо цепь из одного или двух атомов углерода. Конкретные циклоалкильные группы являются моноциклическими. Примерами моноциклического циклоалкила являются циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Примерами бициклического циклоалкила являются бицикло[2.2.1]гептанил, бицикло[2.2.2]октанил или адамантанил. Конкретным является циклопропил.
Выражение "циклоалкил, замещенный", отдельно или в комбинации с другими группами, относится к циклоалкилу, как определено в данной заявке, который замещен одним или множественными заместителями, предпочтительно 1-4 заместителями, где возможно замещение при каждом кольцевом атоме индивидуально, где заместитель индивидуально выбран из группы, которая указана для каждого конкретного "циклоалкила, замещенного", то есть, например, из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила.
Термин "фармацевтически приемлемые соли" относится к солям, которые пригодны для применения в контакте с тканями людей и животных. Примерами подходящих солей с неорганическими и органическими кислотами являются, но не ограничены ими, уксусная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, соляная кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, азотная кислота, фосфорная кислота, пара-толуолсульфоновая кислота, янтарная кислота, серная кислота, сернистая кислота, винная кислота, трифторуксусная кислота и тому подобное. Предпочтительны муравьиная кислота, трифторуксусная кислота и соляная кислота. Наиболее предпочтительна соляная кислота.
Термины "фармацевтически приемлемый носитель" и "фармацевтически приемлемое вспомогательное вещество" относятся к носителям и вспомогательным веществам, таким как разбавители или эксципиенты, которые совместимы с другими ингредиентами препарата.
Термин "фармацевтическая композиция" охватывает препарат, содержащий указанные ингредиенты в предопределенных количествах или долях, а также любой препарат, который является результатом, прямо или косвенно, объединения указанных ингредиентов в указанных количествах. Предпочтительно он охватывает препарат, содержащий один или более чем один активный ингредиент, и необязательный носитель, включающий инертные ингредиенты, а также любой препарат, который является результатом, прямо или косвенно, объединения, комплексообразования или агрегации любых двух или более чем двух ингредиентов, либо диссоциации одного или более чем одного ингредиента, либо других типов реакций или взаимодействий одного или более чем одного из ингредиентов.
Термин "половинная максимальная ингибиторная концентрация" (IC50) означает концентрацию конкретного соединения, необходимую для получения 50% ингибирования биологического процесса in vitro. Значения IC50 можно логарифмически преобразовать в значения pIC50(-log IC50), в которых более высокие значения указывают на экспоненциально более высокую эффективность. Значение IC50 не является абсолютной величиной, а зависит от экспериментальных условий, например, используемых концентраций. Значение IC50 можно преобразовать в абсолютную константу ингибирования (Ki), используя уравнение Ченга-Прусоффа (Biochem. Pharmacol. (1973) 22:3099). Термин "константа ингибирования" (Ki) означает абсолютное сродство связывания конкретного ингибитора с рецептором. Ее измеряют, используя анализы конкурентного связывания, и она равна концентрации, где конкретный ингибитор занимает 50% рецепторов, если отсутствует конкурирующий лиганд (например, радиолиганд). Значения Ki можно логарифмически преобразовать в значения pKi (-log Ki), в которых более высокие значения указывают на экспоненциально более высокую эффективность.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения болезненного состояния является достаточным, чтобы осуществить такое лечение болезненного состояния. "Терапевтически эффективное количество" варьирует в зависимости от соединения, болезненного состояния, подлежащего лечению, тяжести заболевания, подлежащего лечению, возраста и относительного состояния здоровья субъекта, пути и формы введения, мнения лечащего врача или ветеринара и от других факторов.
Термин "как определено в данной заявке" и "как описано в данной заявке", когда он относится к переменной, включает посредством ссылки как широкое определение этой переменной, так и предпочтительные, более предпочтительные и наиболее предпочтительные определения, если они есть.
Термины "обработка", "приведение в контакт" и "взаимодействие", когда они относятся к химической реакции, означают добавление или смешивание двух или более чем двух реагентов в соответствующих условиях с получением указанного и/или желаемого продукта. Должно быть понятно, что реакция, которая дает указанный и/или желаемый продукт, может необязательно являться результатом объединения двух реагентов, которые были первоначально добавлены, то есть может быть одно или более чем одно промежуточное соединение, которые образуются в смеси, что, в конце концов, приводит к образованию указанного и/или желаемого продукта.
Когда в химической структуре присутствует хиральный атом углерода, подразумевают, что все стереоизомеры, связанные с этим хиральным атомом углерода, включены в структуру.
В изобретении также предложены фармацевтические композиции, способы применения и способы получения вышеупомянутых соединений.
Все отдельные формы осуществления можно объединять.
Одну форму осуществления составляет соединение формулы I,

где
R1 выбран из группы, состоящей из
i) арила,
ii) арила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
iii) гетероарила и
iv) гетероарила, замещенного 1-4 заместителями, индивидуально выбранными из амидо, циано, низшего цианоалкила, циклоалкила, циклоалкил-низшего алкенила, циклоалкил-низшего алкинила, циклоалкил-низшего алкила, циклоалкил-низшего алкокси, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила, низшего алкенила, низшего алкинила, низшего алкила и нитро;
v) низшего алкила,
vi) низшего алкила, замещенного 1-5 заместителями, индивидуально выбранными из циано, атома галогена, гидрокси и низшего алкокси;
vii) низшего алкенила,
viii) низшего алкенила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, гетероарила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
ix) циклоалкила,
х) циклоалкила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
R2 выбран из группы, состоящей из
i) атома водорода,
ii) атома галогена и
iii) низшего алкила;
R3 представляет собой низший алкил;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
R5 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
n равно 0, 1 или 2;
или его фармацевтически приемлемые соли.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где
R1 выбран из группы, состоящей из
i) гетероарила и
ii) гетероарила, замещенного 1-4 заместителями, индивидуально выбранными из амидо, циано, низшего цианоалкила, циклоалкила, циклоалкил-низшего алкенила, циклоалкил-низшего алкинила, циклоалкил-низшего алкила, циклоалкил-низшего алкокси, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила, низшего алкенила, низшего алкинила, низшего алкила и нитро;
iii) низшего алкила,
iv) низшего алкила, замещенного 1-5 заместителями, индивидуально выбранными из циано, атома галогена, гидрокси и низшего алкокси;
v) низшего алкенила,
vi) низшего алкенила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, гетероарила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
vii) циклоалкила,
viii) циклоалкила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
R2 выбран из группы, состоящей из
i) атома водорода,
ii) атома галогена и
iii) низшего алкила;
R3 представляет собой низший алкил;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
R5 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
n равно 0, 1 или 2;
или его фармацевтически приемлемые соли.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где
R1 выбран из группы, состоящей из
i) гетероарила и
ii) гетероарила, замещенного 1-4 заместителями, индивидуально выбранными из амидо, циано, низшего цианоалкила, циклоалкила, циклоалкил-низшего алкенила, циклоалкил-низшего алкинила, циклоалкил-низшего алкила, циклоалкил-низшего алкокси, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила, низшего алкенила, низшего алкинила, низшего алкила и нитро;
iii) низшего алкила,
iv) низшего алкила, замещенного 1-5 заместителями, индивидуально выбранными из циано, атома галогена, гидрокси и низшего алкокси;
v) низшего алкенила,
vi) низшего алкенила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, гетероарила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
vii) циклоалкила,
viii) циклоалкила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
R2 выбран из группы, состоящей из
i) атома водорода,
ii) атома галогена и
iii) низшего алкила;
R3 представляет собой низший алкил;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
R5 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
n равно 0, 1 или 2;
или его фармацевтически приемлемым солям.
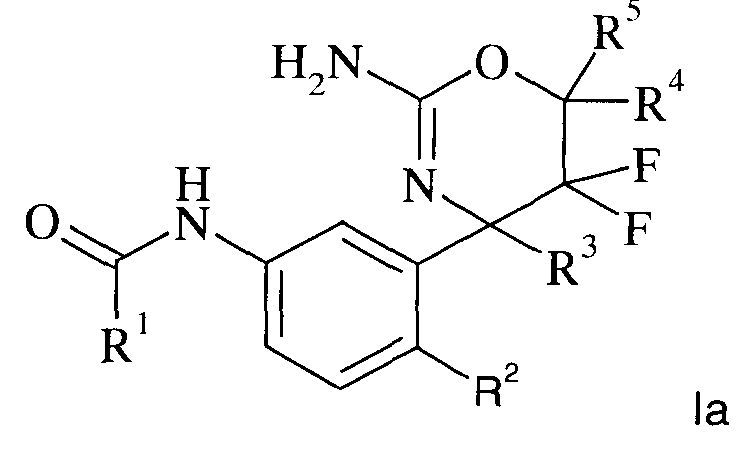
Определенная форма осуществления изобретения относится к соединению формулы la, как описано в данной заявке
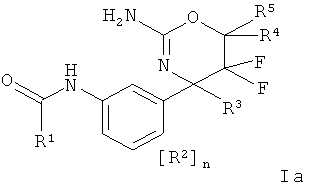
где
R1 выбран из группы, состоящей из
i) арила,
ii) арила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила,
iii) гетероарила и
iv) гетероарила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила;
R2 выбран из группы, состоящей из
i) атома водорода,
ii) атома галогена и
iii) низшего алкила;
R3 представляет собой низший алкил;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
R5 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
или его фармацевтически приемлемым солям.
Определенная форма осуществления изобретения относится к соединению формулы Ia, как описано в данной заявке, где
R1 выбран из группы, состоящей из
i) гетероарила и
ii) гетероарила, замещенного 1-4 заместителями, индивидуально выбранными из циано, низшего цианоалкила, атома галогена, низшего галогеноалкокси, низшего галогеноалкила, низшего алкокси, низший алкокси-низшего алкила и низшего алкила;
R2 выбран из группы, состоящей из
i) атома водорода,
ii) атома галогена и
iii) низшего алкила;
R3 представляет собой низший алкил;
R4 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
R5 выбран из группы, состоящей из
i) атома водорода и
ii) низшего алкила;
или его фармацевтически приемлемым солям.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 выбран из группы, состоящей из
i) 1Н-пиразолила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из циклоалкила, атома галогена, низшего галогеноалкила, низшего алкила,
ii) циклоалкила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из атома галогена и низшего галогеноалкила,
iii) низшего алкенила, необязательно замещенного гетероарилом,
iv) низшего алкила, необязательно замещенного 1-5 заместителями, индивидуально выбранными из атома галогена и гидрокси,
v) фурила, необязательно замещенного нитро,
vi) изоксазолила, необязательно замещенного 1-2 низшими алкилами,
vii) оксазолила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из циклоалкила, низшего галогеноалкила и низшего алкила,
viii) пиразинила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из циклоалкил-низшего алкокси, атома галогена, низшего галогеноалкила и низшего алкила,
ix) пиразолила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из атома галогена и низшего алкила,
х) пиридазинила, необязательно замещенного 1-2 атомами галогена,
xi) пиридинила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из амидо, циано, циклоалкил-низшего алкокси, циклоалкил-низшего алкинила, атома галогена, низшего галогеноалкила, низшего алкила и низшего галогеноалкокси; и
xii) пиримидинила, необязательно замещенного 1-2 заместителями, индивидуально выбранными из атома галогена и низшего галогеноалкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 выбран из группы, состоящей из
i) пиридинила,
ii) пиразолила,
iii) пиразинила,
iv) пиримидинила и
v) пиридинила, замещенного 1-2 заместителями, индивидуально выбранными из циано, атома галогена и низшего галогеноалкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 выбран из группы, состоящей из (2,2,2-трифторэтокси)-пиридин-2-ила, (циклопропилметокси)пиразин-2-ила, (трифторметил)пиразин-2-ила, 1-(дифторметил)-1Н-пиразол-3-ила, 1-(трифторметил)циклопроп-1-ила, 1-фурилэтенила, 1-метил-1Н-пиразол-3-ила, 2-(хлорметил)оксазол-4-ила, 2-(фторметил)оксазол-4-ила, 2,2,2-трифтор-1-гидрокси-1-метил-2-этила, 2,2-дифторциклопроп-1-ила, 2,5-диметилоксазол-4-ила, 2-этилоксазол-4-ила, 2-метил-5-(трифторметил)оксазол-4-ила, 2-метилоксазол-4-ила, 3-(2,2,2-трифторэтокси)-пиридин-2-ила, 3,5-дихлорпиразин-2-ила, 3,5-дихлорпиридин-2-ила, 3,5-дифторпиридин-2-ила, 3-хлор-5-цианопиридин-2-ила, 3-хлор-5-фторпиридин-2-ила, 3-хлор-5-трифторметилпиридин-2-ила, 3-хлорпиридин-2-ила, 3-фторпиридин-2-ила, 3-трифторметилпиридин-2-ила, 4-хлор-1-(2,2,2-трифторэтил)-1Н-пиразол-3-ила, 4-хлор-1-(2,2-дифторэтил)-1Н-пиразол-3-ила, 4-хлор-1-дифторметил-1Н-пиразол-3-ила, 4-хлор-1-этил-1Н-пиразол-3-ила, 4-хлор-1Н-пиразол-5-ила, 4-хлор-1-метил-1Н-пиразол-3-ила, 4-хлор-3-циклопропил-1Н-пиразол-5-ила, 4-метил-1Н-пиразол-5-ила, 4-метилизоксазол-3-ила, 5-(2,2,2-трифторэтокси)-пиридин-2-ила, 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-ила, 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-ила, 5-(2,2-дифторэтокси)-пиридин-2-ила, 5-(циклопропилэтинил)-пиридин-2-ила, 5-(циклопропилметокси)пиразин-2-ила, 5-(дифторметокси)-пиридин-2-ила, 5-(фторметокси)-пиридин-2-ила, 5-(трифторметил)-пиридин-2-ила, 5-амидопиридин-2-ила, 5-хлор-3-фторпиридин-2-ила, 5-хлор-3-метилпиридин-2-ила, 5-хлорпиразин-2-ила, 5-хлорпиридин-2-ила, 5-хлорпиримидин-2-ила, 5-цианопиридин-1-оксид-2-ила, 5-цианопиридин-2-ила, 5-циклопропилоксазол-4-ила, 5-этилоксазол-4-ила, 5-фторметоксипиридин-2-ила, 5-фторпиридин-2-ила, 5-изопропилоксазол-4-ила, 5-метилпиразин-2-ила, 5-нитро-фур-2-ила, 5-трифторметилпиразин-2-ила, 5-трифторметилпиримидин-2-ила, 6-(циклопропилметокси)-пиридин-3-ила, 6-хлорпиридазин-3-ила, фур-2-ила, метила, оксазолила и пиридин-2-ила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 выбран из группы, состоящей из 5-хлорпиридин-2-ила, 3-хлор-5-трифторметилпиридин-2-ила, 3-хлор-5-фторпиридин-2-ила, 3,5-дихлорпиридин-2-ила, 5-цианопиридин-2-ила, 5-хлор-3-фторпиридин-2-ила, 5-хлорпиридин-2-ила и 3-хлор-5-трифторметил-пиридин-2-ила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из циклоалкила, атома галогена, низшего галогеноалкила, низшего алкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, в частности, 1Н-пиразол-3-ил и 1Н-пиразол-5-ил.
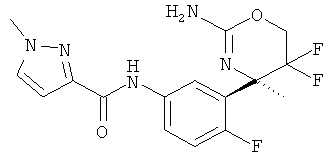
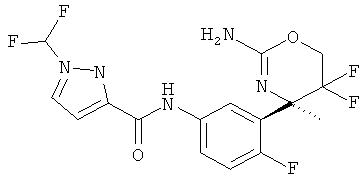
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1 Н-пиразолил, замещенный дифторметилом, в частности, 1-(дифторметил)-1Н-пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный метилом, в частности, 1-метил-1H-пиразол-3-ил и 4-метил-1H-пиразол-5-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный хлором, в частности, 4-хлор-1Н-пиразол-5-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный хлором и циклоалкилом, в частности, 4-хлор-3-циклопропил-1Н-пиразол-5-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный хлором и дифторэтилом, в частности, 4-хлор-1-(2,2-дифторэтил)-1Н-пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный хлором и дифторметилом, в частности, 4-хлор-1-(дифторметил)-1Н-пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой 1Н-пиразолил, замещенный хлором и трифторэтилом, в частности, 4-хлор-1-(2,2,2-трифторэтил)-1Н-пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой циклоалкил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из атома галогена и низшего галогеноалкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой циклоалкил, в частности, циклопропил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой циклоалкил, замещенный фтором, в частности, 2,2-дифторциклопроп-1-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой циклоалкил, замещенный трифторметилом, в частности, 1-(трифторметил)циклопроп-1-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкенил, необязательно замещенный гетероарилом.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкенил, в частности, этенил.
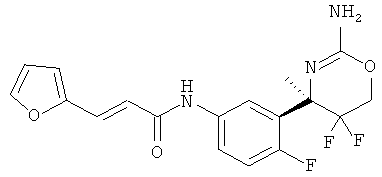
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкенил, замещенный гетероарилом, в частности, 1-фурилэтенил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкил, необязательно замещенный 1-5 заместителями, индивидуально выбранными из атома галогена и гидрокси.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкил, в частности, метил и изопропил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой низший алкил, замещенный фтором и гидрокси, в частности, 2,2,2-трифтор-1-гидрокси-1-метил-2-этил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой фурил, необязательно замещенный нитро.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой фурил, в частности, фур-2-ил.
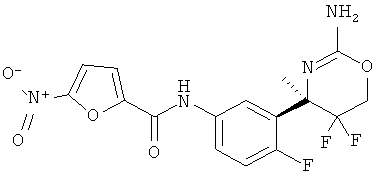
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой фурил, замещенный нитро, в частности, 5-нитрофур-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой изоксазолил, необязательно замещенный 1-2 низшими алкилами.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой изоксазолил, в частности, изоксазол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой изоксазолил, замещенный низшим алкилом, в частности, 4-метилизоксазол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из циклоалкила, низшего галогеноалкила и низшего алкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, в частности, оксазол-4-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, замещенный низшим алкилом, в частности, 2-этилоксазол-4-ил, 5-этилоксазол-4-ил, 5-изопропилоксазол-4-ил, 2,5-диметилоксазол-4-ил и 2-метилоксазол-4-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, замещенный низшим галогеноалкилом, в частности, 2-(хлорметил)оксазол-4-ил и 2-(фторметил)оксазол-4-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, замещенный низшим галогеноалкилом и низшим алкилом, в частности, 2-метил-5-(трифторметил)оксазол-4-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой оксазолил, замещенный циклоалкилом, в частности, 5-циклопропилоксазол-4-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из циклоалкил-низшего алкокси, атома галогена, низшего галогеноалкила и низшего алкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, в частности, пиразин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, замещенный атомом галогена, в частности, 6-хлорпиразин-2-ил и 3,5-дихлорпиразин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, замещенный низшим галогеноалкилом, в частности, 5-трифторметилпиразин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, замещенный низшим алкилом, в частности, 5-метилпиразин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразинил, замещенный циклоалкил-низшим алкокси, в частности, 5-(циклопропилметокси)пиразин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразолил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из атома галогена и низшего алкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразолил, в частности, пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиразолил, замещенный атомом галогена и низшим алкилом, в частности, 4-хлор-1-метил-1Н-пиразол-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридазинил, необязательно замещенный 1-2 атомами галогена.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридазинил, в частности, пиридазин-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридазинил, замещенный атомом галогена, в частности, 6-хлорпиридазин-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из амидо, циано, циклоалкил-низшего алкокси, циклоалкил-низшего алкинила, атома галогена, низшего галогеноалкила, низшего алкила и низшего галогеноалкокси.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, в частности, пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный амидо, в частности, 5-амидопиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный циано, в частности, 5-цианопиридин-2-ил.
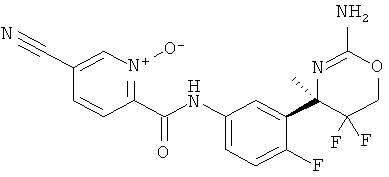
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой N-оксид пиридинила, замещенный циано, в частности, 5-цианопиридин-1-оксид-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный атомом галогена.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный хлором, в частности, 5-хлорпиридин-2-ил, 3,5-дихлорпиридин-2-ил и 3-хлорпиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный фтором, в частности, 5-фторпиридин-2-ил, 3,5-дифторпиридин-2-ил и 3-фторпиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный атомом галогена и низшим галогеноалкилом, в частности, 3-хлор-5-трифторметилпиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный атомом галогена и циано, в частности, 3-хлор-5-цианопиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный атомом галогена и низшим алкилом, в частности, 5-хлор-3-метилпиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный низшим галогеноалкокси.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный трифторэтокси, в частности, 3-(2,2,2-трифторэтокси)-пиридин-2-ил и 5-(2,2,2-трифторэтокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный дифторэтокси, в частности, 5-(2,2-дифторэтокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный тетрафторпропокси, в частности, 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный пентафторпропокси, в частности, 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный дифторметокси, в частности, 5-(дифторметокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный фторметокси, в частности, 5-(фторметокси)-пиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный циклоалкил-низшим алкокси, в частности, 6-(циклопропилметокси)-пиридин-3-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиридинил, замещенный низшим галогеноалкилом, в частности, 3-трифторметилпиридин-2-ил и 5-трифторметилпиридин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиримидинил, необязательно замещенный 1-2 заместителями, индивидуально выбранными из атома галогена и низшего галогеноалкила.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиримидинил, в частности, пиримидин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиримидинил, замещенный атомом галогена, в частности, 6-хлорпиримидин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R1 представляет собой пиримидинил, замещенный низшим галогеноалкилом, в частности, 5-трифторметилпиримидин-2-ил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где n равно 1.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где n равно 0.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где n равно 2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R2 представляет собой атом водорода.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R2 представляет собой атом галогена.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R2 представляет собой фтор.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R2 представляет собой хлор.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R3 представляет собой низший алкил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R3 представляет собой метил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R4 представляет собой атом водорода.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R4 представляет собой низший алкил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R4 представляет собой метил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R5 представляет собой атом водорода.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R5 представляет собой низший алкил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, где R5 представляет собой метил.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, выбранному из группы, состоящей из
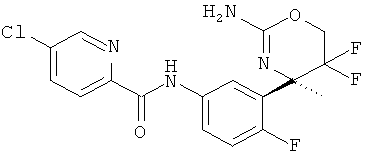
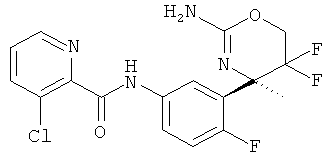
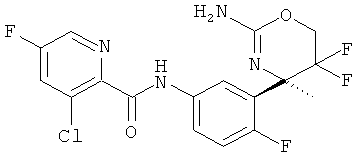
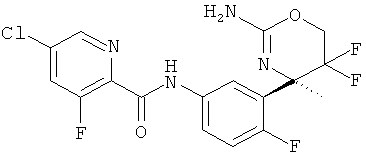
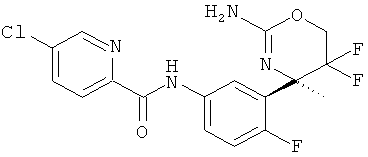
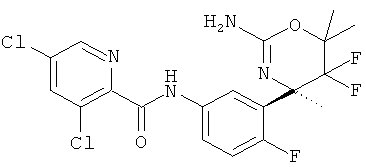
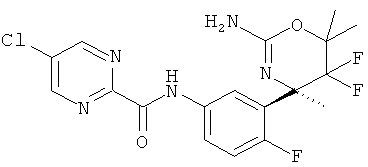
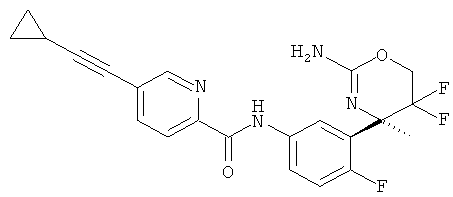
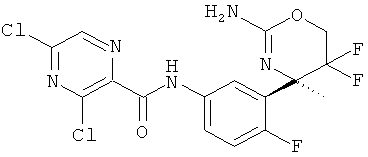
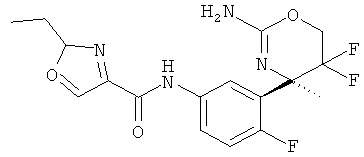
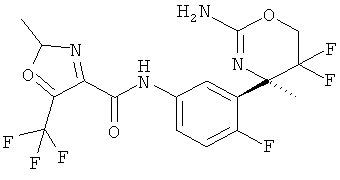
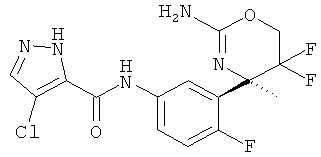
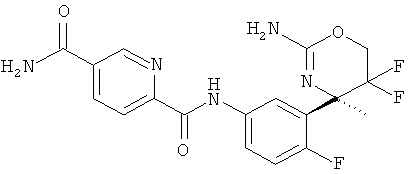
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3,5-Дифторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
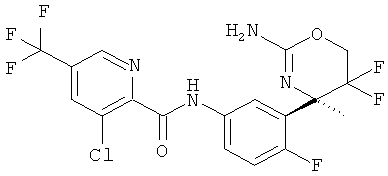
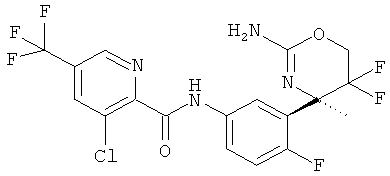
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
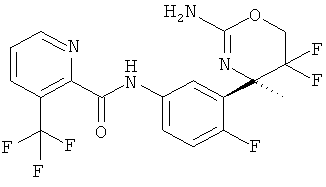
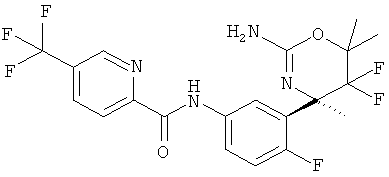
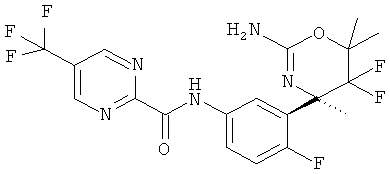
3-Трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
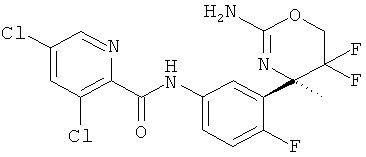
3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
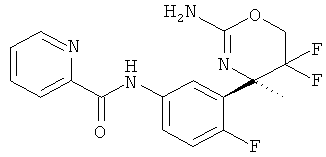
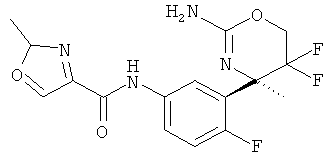
Пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
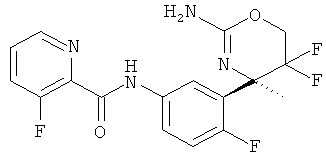
3-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
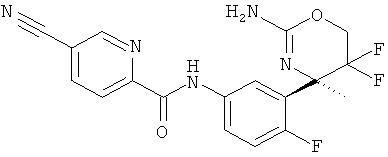
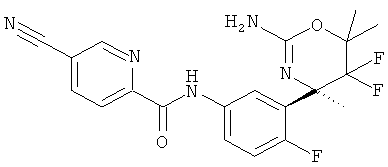
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорида,
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
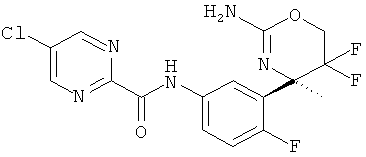
5-Хлорпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
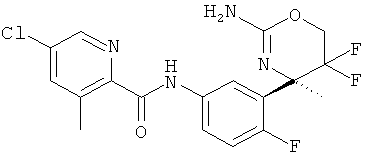
5-Хлор-3-метилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
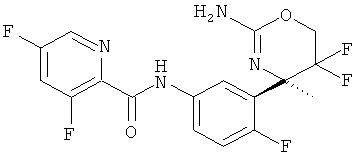
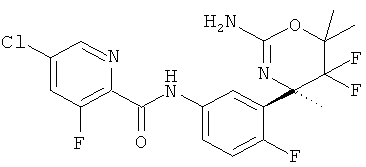
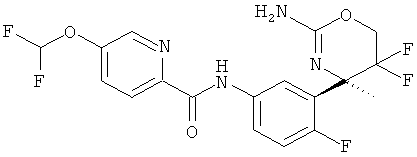
5-Хлор-3-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
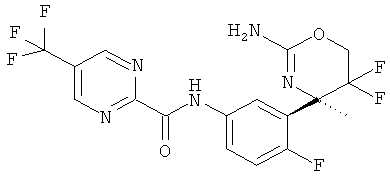
5-Трифторметилпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
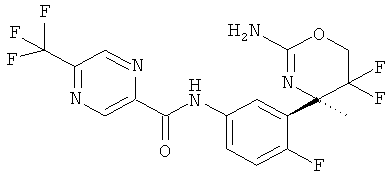
5-Трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
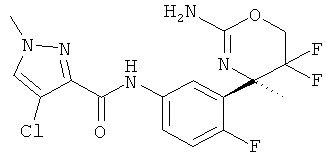
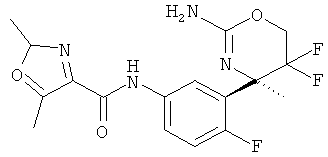
4-Хлор-1-метил-1 Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-илметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-илметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3-хлор-5-цианопиколинамида гидрохлорида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3-хлор-5-цианопиколинамида,
(Р)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3,5-дихлорпиколинамида гидрохлорида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3,5-дихлорпиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-хлор-3-фторпиколинамида,
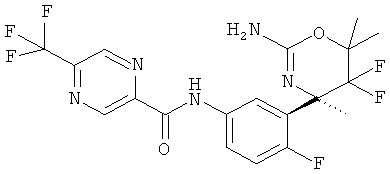
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(трифторметил)пиколинамида,
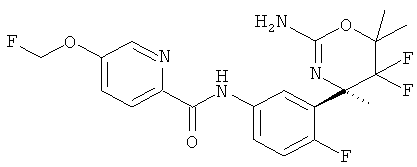
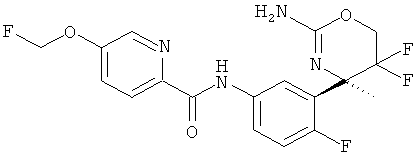
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(фторметокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(дифторметокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(2,2-дифторэтокси)пиколинамида,
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
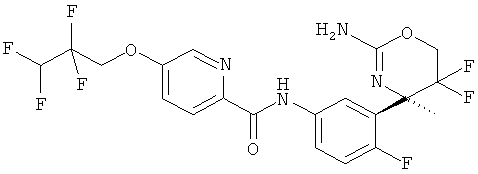
5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорида,
5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-6-(циклопропилметокси)никотинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-хлорпиримидин-2-карбоксамида,
5-Трифторметилпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-метилпиразин-2-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(трифторметил)пиразин-2-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(циклопропилметокси)пиразин-2-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-6-хлорпиридазин-3-карбоксамида гидрохлорида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-6-хлорпиридазин-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-1-(дифторметил)-1Н-пиразол-3-карбоксамида,
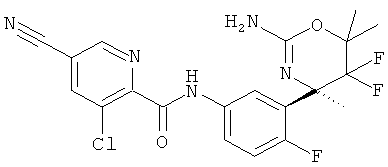
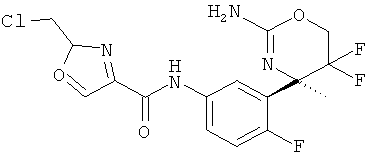
3-Хлор-5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(S)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(циклопропилэтинил)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(дифторметокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(фторметокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(2,2,3,3-тетрафторпропокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(2,2,3,3,3-пентафторпропокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(2,2-дифторэтокси)пиколинамида,
(S)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-(циклопропилметокси)пиразин-2-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-хлорпиразин-2-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3,5-дихлорпиразин-2-карбоксамида,
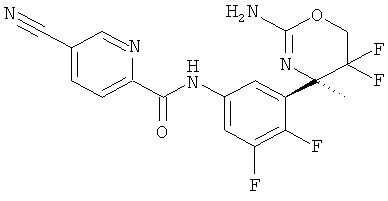
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4,5-дифторфенил)-5-цианопиколинамида,
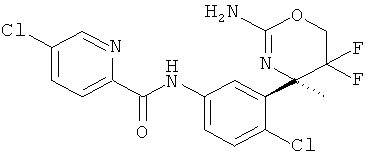
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-хлорфенил)-5-хлорпиколинамида,
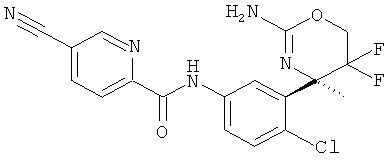
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-хлорфенил)-5-цианопиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)фенил)-5-хлорпиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)фенил)-5-цианопиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3-(2,2,2-трифторэтокси)пиколинамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)оксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2-этилоксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2-(хлорметил)оксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2-метилоксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2,5-диметилоксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2-метил-5-(трифторметил)оксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-метилизоксазол-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-изопропилоксазол-4-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-1 -метил-1Н-пиразол-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-1-(дифторметил)-1Н-пиразол-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-хлор-1Н-пиразол-5-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-метил-1Н-пиразол-5-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-хлор-3-циклопропил-1Н-пиразол-5-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-хлор-1-(2,2-дифторэтил)-1Н-пиразол-3-карбоксамида,
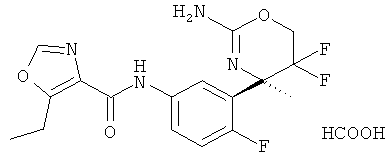
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-этилоксазол-4-карбоксамида формиата,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-5-циклопропилоксазол-4-карбоксамида формиата,
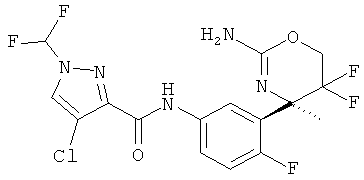
4-Хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(R)-N2-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)пиридин-2,5-дикарбоксамида,
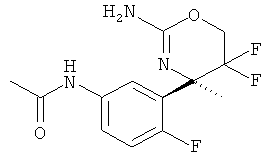
N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-ацетамида,
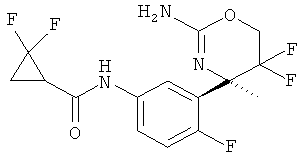
N-(3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2,2-дифторциклопропанкарбоксамида,
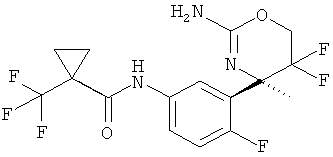
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-1-(трифторметил)циклопропанкарбоксамида,
(R)-N-(3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-3,3,3-трифтор-2-гидрокси-2-метилпропанамида 2,2,2-трифторацетата,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-хлор-1-этил-1Н-пиразол-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-4-хлор-1-(2,2,2-трифторэтил)-1Н-пиразол-3-карбоксамида,
(R)-N-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенил)-2-(фторметил)оксазол-4-карбоксамида формиата,
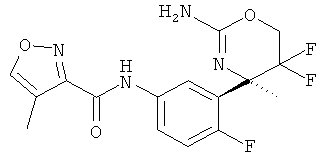
Фуран-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Нитрофуран-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
(R)-N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-3-фуран-2-ил-акриламида и
(R)-2-(3-(2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-1,3-оксазин-4-ил)-4-фторфенилкарбамоил)-5-цианопиридин 1-оксида
или его фармацевтически приемлемой соли.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, выбранному из группы, состоящей из
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
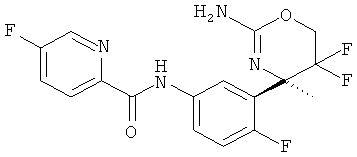
6-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3,5-Дифторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
Пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлорпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
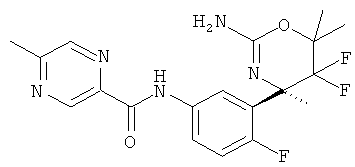
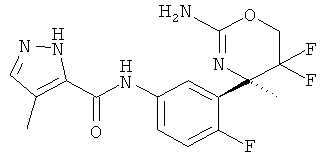
5-Хлор-3-метилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлор-3-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Трифторметилпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
4-Хлор-1-метил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида и
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, выбранному из группы, состоящей из
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3-Хлор-5-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлор-3-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида,
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида и
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, выбранному из группы, состоящей из 5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида и 5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорида.
Определенная форма осуществления изобретения относится к способу синтеза соединения формулы I, как описано в данной заявке, который включает взаимодействие соединения формулы II с соединением формулы III.
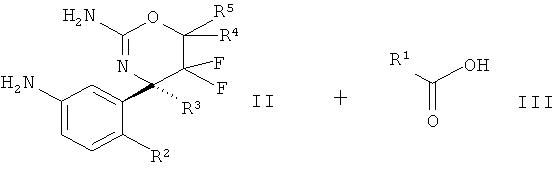
где R1, R2, R3, R4, R5 являются такими, как определено в данной заявке.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, во всех случаях полученному способом, как определено выше.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве терапевтически активного вещества.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве ингибитора активности ВАСЕ1 и/или ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве ингибитора активности ВАСЕ1.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве ингибитора активности ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве ингибитора активности ВАСЕ1 и ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и других отложений, в частности, болезни Альцгеймера.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения болезни Альцгеймера.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения диабета, в частности, диабета типа 2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения в качестве терапевтически активного вещества для терапевтического и/или профилактического лечения бокового амиотрофического склероза (ALS), артериального тромбоза, аутоиммунных/воспалительных заболеваний, рака, такого как рак молочной железы, сердечно-сосудистых заболеваний, таких как инфаркт миокарда и удар, дерматомиозита, синдрома Дауна, желудочно-кишечных заболеваний, мультиформной глиобластомы, болезни Грейвса, болезни Гентингтона, миозита с включенными тельцами (IBM), воспалительных реакций, саркомы Капоши, болезни Костманна, системной красной волчанки, макрофагического миофасцита, ювенильного идиопатического артрита, гранулематозного артрита, злокачественной меланомы, множественной миеломы, ревматоидного артрита, синдрома Шегрена, спинально-церебеллярной атаксии 1, спинально-церебеллярной атаксии 7, болезни Уиппла или болезни Вильсона.
Определенная форма осуществления изобретения относится к фармацевтической композиции, содержащей соединение формулы I, как описано в данной заявке, и фармацевтически приемлемый носитель и/или фармацевтически приемлемое вспомогательное вещество.
Определенная форма осуществления изобретения относится к применению соединения формулы I, как описано в данной заявке, для получения лекарственного средства для применения при ингибировании активности ВАСЕ1 и/или ВАСЕ2.
Определенная форма осуществления изобретения относится к применению соединения формулы I, как описано в данной заявке, для получения лекарственного средства для применения при ингибировании активности ВАСЕ1.
Определенная форма осуществления изобретения относится к применению соединения формулы I, как описано в данной заявке, для получения лекарственного средства для применения при ингибировании активности ВАСЕ2.
Определенная форма осуществления изобретения относится к применению соединения формулы I, как описано в данной заявке, для получения лекарственного средства для применения при ингибировании активности ВАСЕ1 и ВАСЕ2.
Определенная форма осуществления изобретения относится к применению соединения формулы I, как описано в данной заявке, для получения лекарственного средства для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и других отложений, в частности, болезни Альцгеймера.
Определенная форма осуществления изобретения терапевтического и/или профилактического лечения болезни Альцгеймера.
Определенная форма осуществления изобретения терапевтического и/или профилактического лечения диабета, в частности, диабета типа 2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при ингибировании активности ВАСЕ1 и/или ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при ингибировании активности ВАСЕ1.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при ингибировании активности ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при ингибировании активности ВАСЕ1 и ВАСЕ2.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при терапевтическом и/или профилактическом лечении заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и других отложений, в частности, болезни Альцгеймера.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при терапевтическом и/или профилактическом лечении болезни Альцгеймера.
Определенная форма осуществления изобретения относится к соединению формулы I, как описано в данной заявке, для применения при терапевтическом и/или профилактическом лечении диабета, в частности, диабета типа 2.
Определенная форма осуществления изобретения относится к способу применения при ингибировании активности ВАСЕ1 и/или ВАСЕ2, в частности, для терапевтического и/или профилактического лечения заболеваний и расстройств, характеризующихся повышенными уровнями β-амилоида и/или олигомеров β-амилоида и/или β-амилоидных бляшек и других отложений, болезни Альцгеймера, диабета или диабета типа 2, где этот способ включает введение соединения формулы I, как описано в данной заявке, человеку или животному.
Кроме того, изобретение включает все оптические изомеры, то есть диастереоизомеры, диастереомерные смеси, рацемические смеси, все их соответствующие энантиомеры и/или таутомеры, а также их сольваты.
Специалисту в данной области техники понятно, что соединения формулы I могут существовать в таутомерных формах, например, в приведенной ниже таутомерной форме:
Все таутомерные формы включены в настоящее изобретение. Соединения формулы I могут содержать один или более чем один асимметрический центр и, следовательно, могут существовать в виде рацематов, рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Дополнительные асимметрические центры могут присутствовать в зависимости от природы различных заместителей на молекуле. Если такой асимметрический центр независимо образует два оптических изомера, подразумевают, что все возможные оптические изомеры и диастереомеры в виде смесей и в виде чистых или частично очищенных соединений включены в данное изобретение. Подразумевают, что настоящее изобретение охватывает все такие изомерные формы этих соединений. Независимые синтезы этих диастереомеров или их хроматографические разделения могут быть достигнуты, как известно в данной области техники, путем соответствующей модификации методологии, раскрытой в данной заявке. Их абсолютная стереохимия может быть определена с помощью рентгенокристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые являются дериватизированными при необходимости реагентом, содержащим асимметрический центр известной абсолютной конфигурации. При желании рацемические смеси соединений могут быть разделены таким образом, что выделяют индивидуальные энантиомеры. Это разделение можно осуществить способами, хорошо известными в данной области техники, такими как сочетание рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционная кристаллизация и хроматография. Предпочтительными примерами изомеров соединения формулы I является соединение формулы Ib или соединение формулы Ic, где остатки имеют значение, которое описано в любой из форм осуществления. Предпочтительно соединение формулы Ic.
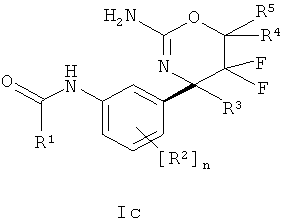
В формах осуществления, где предложены оптически чистые энантиомеры, оптически чистый энантиомер означает, что соединение содержит >90% желаемого изомера по массе, предпочтительно >95% желаемого изомера по массе или более предпочтительно >99% желаемого изомера по массе, где процент по массе основан на суммарной массе изомера(ов) соединения. Хирально чистые или хирально обогащенные соединения могут быть получены путем хирально-селективного синтеза или путем разделения энантиомеров. Разделение энантиомеров можно осуществить на конечном продукте или альтернативно на подходящем промежуточном соединении.
Соединения формулы 1 могут быть получены в соответствии с приведенными ниже схемами. Исходное вещество имеется в продаже или может быть получено в соответствии с известными способами. Любые определенные выше остатки и переменные продолжают иметь определенное выше значение, если не указано иное.
Сульфинилимины общей формулы VI могут быть получены по аналогии с Т.Р. Tang & J.A. Ellman, J. Org. Chem. 1999, 64, 12, путем конденсации арилкетона IV и сульфонамида V, например, алкилсульфинамида, наиболее предпочтительно (R)-(+)-трет-бутилсульфинамида, в присутствии кислоты Льюиса, такой как, например, алкоксид титана(IV), более предпочтительно этоксид титана(IV), в растворителе, таком как простой эфир, например, диэтиловый эфир или более предпочтительно ТГФ.
Преобразование сульфинилимина VI в сульфинамидоэфир VII протекает стереоселективно с помощью хиральной направляющей замещающей группы, как описано Tang & Ellman. Сульфинилимин VI можно подвергать взаимодействию в реакции Реформатского с енолятом цинка, образованным, например, алкилбромдифторацетатом, предпочтительно этилбромдифторацетатом, активированным порошком цинка, при температуре от температуры окружающей среды до повышенной, предпочтительно при 23-60°С, в растворителе, таком как простой эфир, например, диэтиловый эфир или более предпочтительно ТГФ.
Спирт VIII может быть получен путем восстановления этилового эфира VII гидридом щелочного металла, предпочтительно боргидридом лития или алюмогидридом лития, в растворителе, таком как простой эфир, например, диэтиловый эфир или более предпочтительно ТГФ.
Гидролиз хиральной направляющей замещающей группы в сульфинамидоспирте VIII с получением аминоспирта IX можно осуществить с минеральной кислотой, например, серной кислотой или предпочтительно соляной кислотой в растворителе, таком как простой эфир, например, диэтиловый эфир, ТГФ или более предпочтительно 1,4-диоксан.
Дифтораминооксазины X могут быть получены путем взаимодействия аминоспирта IX с цианогенбромидом в растворителе, таком как спирт, предпочтительно этанол.
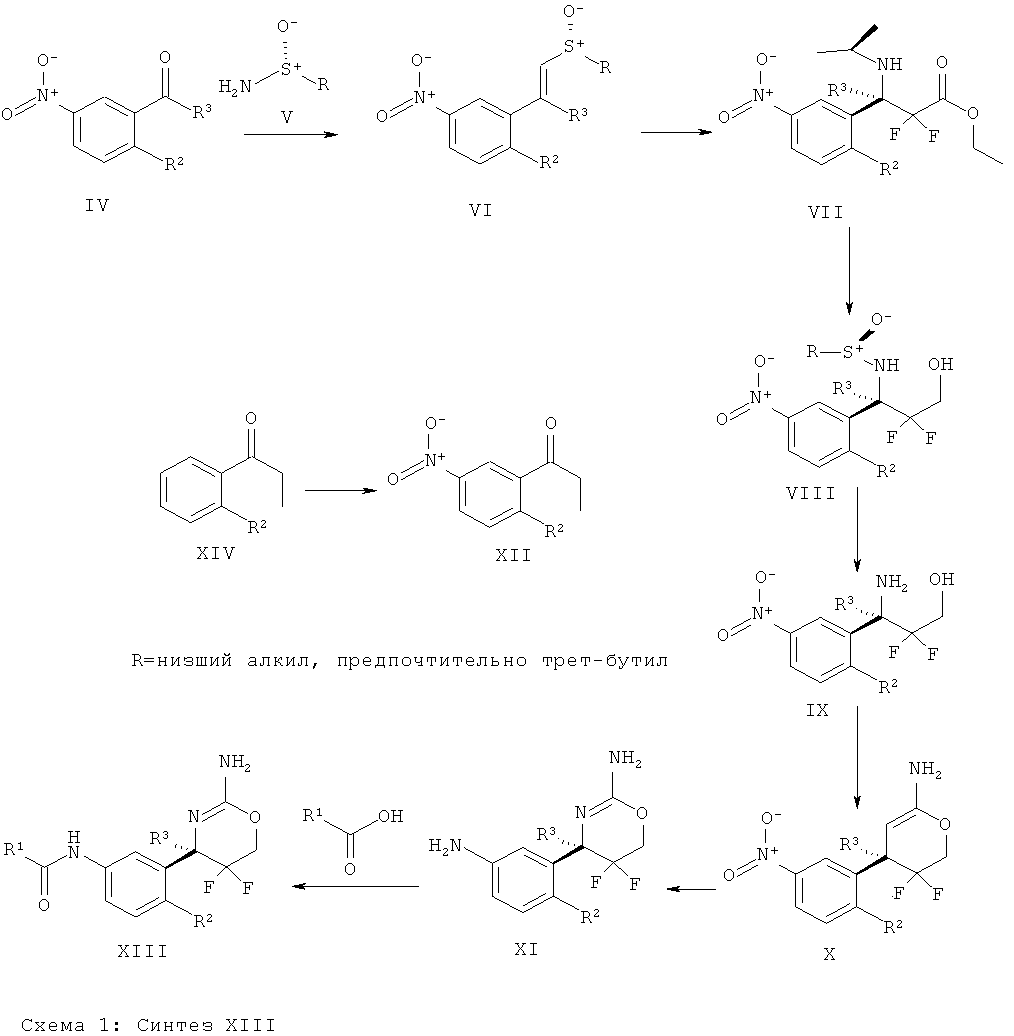
Восстановление нитрогруппы в аминооксазине Х до анилина XI можно осуществить путем гидрогенизации, используя катализаторы, такие как Pd/C, в протонных растворителях, таких как спирты, предпочтительно этанол или метанол.
Селективное амидное сочетание анилина XI и карбоновой кислоты с получением амида XIII можно осуществить с гидратом 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида (DMTMM) в растворителе, таком как метанол.
Анилины формулы XI', где R2' имеет значение атома галогена или низшего алкила, можно далее преобразовать в йодо-производные формулы XIII' с помощью систем доноров йодония, используя йодиды в качестве источника йодида, такие как, например, йодид аммония, вместе с сильным окисляющим агентом, таким как, например, пероксид водорода, в полярном растворителе, таком как, например, уксусная кислота, и как описано N. Narender et al. в Tetrahedron Letters 48 (2007) 6124-6128.
Другой типичный метод получения соединений формулы I проиллюстрирован на Схеме 3.
Сульфинилимины общей формулы XVI могут быть получены по аналогии с приведенным выше описанием для получения сульфинилиминов общей формулы VI.
Преобразование сульфинилимина XVI в сульфинамидоэфир XVII протекает аналогично описанному выше для получения сульфинамидоэфира VII.
Спирт общей формулы XIX, где R4 и R5 представляют собой атом водорода, может быть получен, опять же, аналогично описанному выше для спирта VIII. Спирты общей формулы XVIII, где R4 и R5 представляют собой C1-7-алкил, могут быть получены путем взаимодействия сульфинамидоэфира XVII с избытком металлорганического реагента, несущего соответствующие C1-7-алкильные группы, такого как соединение, представляющее собой галогенид C1-7-алкиллития или C1-7-алкилмагния, в эфирных растворителях, таких как диэтиловый эфир или ТГФ, при температурах от -78°С до температуры окружающей среды.
Гидролиз хиральной направляющей замещающей группы в сульфинамидоспиртах общей формулы XVIII протекает аналогично описанному выше для сульфинамидоэфира VIII с получением в данном случае аминоспирта XIX.
Аминооксазины общей формулы XX могут быть, опять же, получены, как описано выше, путем взаимодействия аминоспирта XIX с цианогенбромидом в растворителе, таком как спирт, предпочтительно этанол.
Защиту аминогруппы в соединениях общей формулы XX с получением арилбромидов общей формулы XXI можно осуществить с триарилметилхлоридами, такими как трифенилметилхлорид (Тr-Cl), пара-метоксифенилдифенилметилхлорид (MMTr-Cl), ди(пара-метоксифенил)фенилметилхлорид (DMTr-Cl) или три(пара-метоксифенил)метилхлорид (TMTr-Cl), предпочтительно DMTr-Cl, в основных условиях, например, в присутствии амина, такого как триэтиламин или диизопропилэтиламин, в хлорированном растворителе, таком как дихлорметан или хлороформ, при температурах от 0°С до температуры окружающей среды.
Арилбромиды общей формулы XXI можно подвергать взаимодействию с эквивалентами аммиака, такими как бензофенонимин, в присутствии подходящего катализатора, представляющего собой переходный металл, такого как бис(дибензилиденацетон)палладий (0) ((dba)2Pd) или трис(дибензилиденацетон)дипалладий (0) ((dba)3Pd2)), и подходящего лиганда, такого как рац-2,2'-бис(дифенилфосфино)-1,1'-динафтил (рац-BINAP), 2-дициклогексилфосфино-2',4',6'-триизопропилдифенил (X-PHOS) или 2-ди-трет-бутилфосфино-2',4',6'-триизопропилдифенил (f-Bu X-phos), в присутствии основания, такого как трет-бутоксид натрия, фосфат калия или карбонат цезия, в подходящем растворителе, таком как толуол или 1,4-диоксан, в инертной атмосфере, такой как азот или аргон, при температурах от 80 до 110°С, с получением соединений общей формулы XXII.
Альтернативно взаимодействие арилбромидов общей формулы XXI с гексаметилдисилазидом лития в присутствии подходящего катализатора, представляющего собой переходный металл, и подходящего лиганда, как упомянуто выше, следуя протоколу, который, например, описан J.F. Hartwing et al. в Organic Letters 3(17), 2729-32 (2001), может привести в результате к амину общей формулы XI.
Удаление защиты обеих аминогрупп в соединениях общей формулы XXII может быть достигнуто однореакторным методом, сначала путем их взаимодействия с сильной органической кислотой, такой как трифторуксусная кислота, в хлорированных растворителях, таких как дихлорметан или хлороформ, в безводных условиях при температурах от 0°С до температуры окружающей среды с отщеплением Р1-группы, затем путем добавления воды для отщепления бензофенонимина и взаимодействия при температуре окружающей среды с получением диаминов общей формулы XI, которые могут быть преобразованы в соединения общей формулы I, как описано выше.
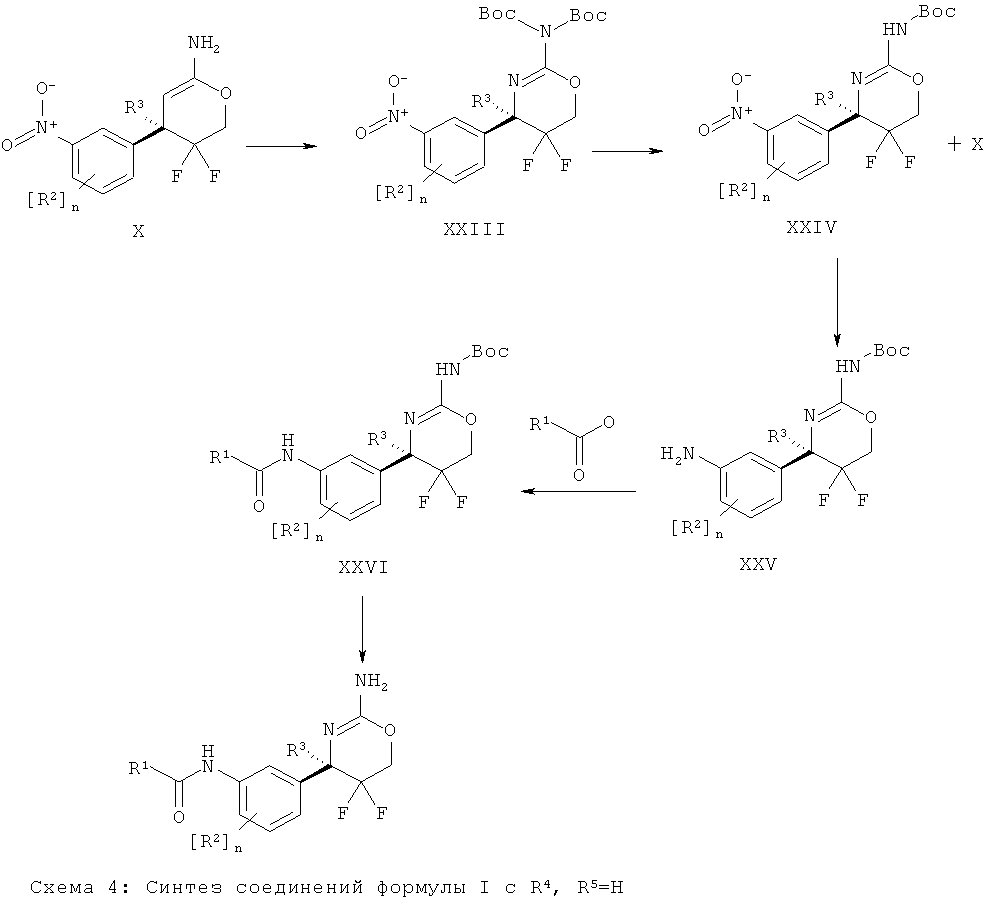
Схема 4: Синтез соединений формулы 1 с R4, R5=Н
Защиту аминогруппы в соединениях общей формулы Х с получением нитроарильных производных общей формулы XXIII, где R2 имеет значение атома водорода, фтора, хлора или низшего алкила, можно осуществить с ди-трет-бутилдикарбонатом в основных условиях, например, в присутствии амина, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, при температурах от 0°С до температуры окружающей среды и в присутствии 4-диметиламинопиридина в качестве катализатора.
Селективное отщепление одной из трет-бутоксикарбонильных групп в соединениях общей формулы XXIII можно осуществить с помощью кислоты, такой как трифторуксусная кислота, с получением соединений общей формулы XXIV вместе с небольшими количествами соединений общей формулы X.
Восстановление нитрогруппы в аминооксазине XXIV до анилина XXV можно осуществить путем гидрогенизации, используя катализаторы, такие как Pd/C, в протонных растворителях, таких как спирты, предпочтительно этанол или метанол.
Амидное сочетание анилина XXV и карбоновой кислоты с получением амидов общей формулы XXVI можно осуществить в растворителе, таком как метанол, с гидратом 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида (DMTMM) или с другими агентами конденсации, такими как O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), в присутствии амина, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как ацетонитрил или N,N-диметилформамид, при температурах от 0°С до температуры окружающей среды.
Отщепление защитной трет-бутоксикарбонильной группы в соединениях общей формулы XXVI с получением соединений общей формулы 1 можно осуществить с помощью кислоты, такой как трифторуксусная кислота, в инертных растворителях, таких как дихлорметан, при температурах от 0°С до температуры окружающей среды.
Соответствующие фармацевтически приемлемые соли с кислотами могут быть получены стандартными способами, известными специалистам в данной области техники, например, путем растворения соединения формулы 1 в подходящем растворителе, таком как диоксан или ТГФ, и добавления соответствующего количества соответствующей кислоты. Продукты можно обычно выделить фильтрованием или хроматографией. Преобразование соединения формулы 1 в фармацевтически приемлемую соль с основанием можно осуществить путем обработки такого соединения таким основанием. Одним из возможных способов образования такой соли является, например, добавление 1/n эквивалентов основной соли, такой как, например, М(ОН)n, где М = катион металла или аммония, n=число гидроксидных анионов, к раствору соединения в подходящем растворителе (например, в этаноле, в смеси этанол-вода, в смеси тетрагидрофуран-вода) и удаление растворителя выпариванием или лиофилизацией.
Если их получение не описано в примерах, соединения формулы I, а также все промежуточные продукты могут быть получены в соответствии с аналогичными способами или в соответствии со способами, описанными в данной заявке. Исходные вещества имеются в продаже, известны на уровне техники или могут быть получены способами, известными в данной области техники, или по аналогии с ними.
Понятно, что соединения общей формулы I в данном изобретении могут быть дериватизированы при функциональных группах с получением производных, которые способны к обратному преобразованию в исходное соединение in vivo.
Фармакологические тесты
Соединения формулы 1 и их фармацевтически приемлемые соли обладают ценными фармакологическими свойствами. Обнаружено, что соединения по настоящему изобретению связаны с ингибированием активности ВАСЕ1 и/или ВАСЕ2. Эти соединения были исследованы в соответствии с тестом, приведенным в данной заявке ниже.
Клеточный анализ снижения Аβ:
Клетки НЕК293 человека, которые стабильно трансфицированы вектором, экспрессирующим кДНК гена АРР wt (дикого типа) (АРР695), использовали для оценки эффективности соединений в клеточном анализе. Клетки высевали в 96-луночные микротитрационные планшеты в среде для клеточных культур (Iscove, с добавлением 10% (об./об.) фетальной бычьей сыворотки, глутамина, пенициллина/стрептомицина) примерно до 80% конфлюентности, и соединения добавляли в 10х концентрации в 1/10 объема среды без ФБС, содержащей 8% ДМСО (конечную концентрацию ДМСО поддерживали при 0,8% об./об.). После 18-20 ч инкубации при 37°С и 5% CO2 в увлажненном термостате супернатант культуры собирали для определения концентраций Аβ40. 96-луночные планшеты для ELISA (например, Nunc MaxiSorb) покрывали моноклональным антителом, которое специфично распознает С-конец Аβ40 (Brockhaus et al., NeuroReport 9, 1481-1486; 1998). После блокирования сайтов неспецифического связывания, например, 1% БСА, и отмывки супернатанты культуры добавляли в соответствующих разведениях вместе с идентифицирующим антителом Аβ, сшитым с пероксидазой хрена (например, антителом 4G8, Senetek, Maryand Heights, МО), и инкубировали в течение 5-7 ч. Затем лунки микротитрационного планшета интенсивно промывали физиологическим раствором, забуференным Трисом, содержащим 0,05% Твин 20, и анализ проявляли тетраметилбензидином/H2O2 в лимонно-кислотном буфере. После остановки реакции одним объемом 1 н. H2SO4 реакцию измеряли в считывающем устройстве для планшетов ELISA при длине волны 450 нм. Концентрации Аβ в супернатантах культуры вычисляли на основании стандартной кривой, полученной с известными количествами чистого пептида Аβ.
Анализ ингибирования ВАСЕ путем измерения расщепления клеточного ТМЕМ27:
В данном анализе используют принцип ингибирования расщепления ТМЕМ27 человека эндогенным клеточным ВАСЕ2 в крысиной клеточной линии INS1e и шеддинга с клеточной поверхности в культуральной среде с последующим обнаружением в анализе ELISA. Ингибирование ВАСЕ2 дозозависимо предотвращает это расщепление и шеддинг.
Стабильная клеточная линия "INS-TMEM27" представляет собой клеточную линию, имеющую происхождение от INS1e, с индуцибельной доксициклин-зависимой экспрессией (используя систему TetOn) полноразмерного hТМЕМ27. На протяжении всего эксперимента клетки культивируют в среде RPMI1640 с добавлением пенициллина/стрептомицина Glutamax (Invitrogen), 10% фетальной бычьей сыворотки, 100 мМ пирувата, 5 мМ бета-меркаптоэтанола, 100 мкг/мл G418 и 100 мкг/мл гигромицина и выращивают в адгезивной культуре при 37°С в стандартном CO2-инкубаторе для клеточных культур.
Клетки INS-TMEM27 высевают в 96-луночные планшеты. После 2 суток в культуре добавляют ингибитор ВАСЕ2 в диапазоне концентраций, который требуется для анализа, и еще через два часа добавляют доксициклин до конечной концентрации 500 нг/мл. Клетки инкубируют еще в течение 46 часов, и супернатант собирают для обнаружения шеддинга ТМЕМ27.
Анализ ELISA (с использованием пары антител мышь против ТМЕМ27 человека, вызванных против внеклеточного домена ТМЕМ27) используют для обнаружения ТМЕМ27 в культуральной среде. EC50 для ингибирования ВАСЕ2 вычисляют, используя результат ELISA для каждой концентрации ингибитора с помощью программы соответствия стандартной кривой, такой как XLFit для программы электронных таблиц Excel.
Таблица 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1: Значения IC50 избранных примеров
Анализ ингибирования CYP
Ингибирование цитохромов Р450 (CYP) 2C9, 2D6 и 3А4 анализировали, используя CYP-селективные реакции метаболизма субстрата микросом печени человека. Готовили инкубации по 50 мкл, содержащие (конечные концентрации) 0,2 мг/мл объединенных микросом печени человека, 5 мкМ субстрата (диклофенак для CYP2C9 [4'-гидроксилаза], декстрометорфан для CYP2D6 [O-деметилаза] или мидазолам для CYP3A4 [1'-гидроксилаза]), 0,25 мкл ДМСО, содержащего тестируемый ингибитор, и NADPH регенерирующая система. Концентрации тестируемого ингибитора 50, 16,7, 5,6, 1,9, 0,6 и 0,2 мкМ оценивали в одном повторе. Инкубации подогревали до 37°С в течение 10 минут, после чего инициировали добавлением NADPH регенерирующей системы. Инкубации гасили через 5 минут (20 минут для декстрометорфана) добавлением 50 мкл холодного ацетонитрила, содержащего 20 нг/мл 4-ОН-диклофенак-13С6, 20 нг/мл декстрорфан-DS и 20 нг/мл 1-ОН-мидазолам-D4. Погашенные инкубаты хранили при -20°С в течение по меньшей мере 1 часа, после чего центрифугировали (20000× g, 20 минут). Супернатанты выделяли и разводили 1:1 водой, после чего анализировали, используя систему впрыска образца RapidFire и масс-спектрометр API4000. Площади пиков для стандарта субстрата, метаболита и стабильно меченого метаболита определяли, используя МС/МС. Отношения площадей пиков между метаболитом, образовавшимся в результате ферментативной реакции, и внутренним стандартом использовали при последующих вычислениях. Процентное содержание контрольной (ДМСО) активности вычисляли для каждого инкубата, и значения IC50 оценивали с помощью нелинейной регрессии. Сульфафеназол, хинидин или кетоконазол тестировали в каждом эксперименте по ингибированию CYP2C9, CYP2D6 или CYP3A4 соответственно, чтобы гарантировать чувствительность и воспроизводимость анализа (Validated assays for human cytochrome P450 activities, R.L.Walsky and R.S.Obach, Drug Metabolism and Disposition 32: 647-660, 2004, и S.Fowler and H.Zhang, The AAPS Journal, Vol.10, No. 2, 410-424, 2008.)
PatchXpress анализ ингибирования hERG
Подробный способ количественного определения ингибирования канала hERG с помощью автоматизированной системы пэтч-кламп PatchXpress® 7000A (Molecular Devices, Sunnyvale, CA) описан Guo et al. (Guo L, Guthrie H, Automated electrophysiology in the preclinical evaluation of drugs for potential QT prolongation. Journal of Pharmacological & Toxicological Methods, (2005) 52(1): 123-35). Кратко, клетки яичника китайского хомячка (СНО), трансфицированные геном специфических калиевых каналов сердца человека (hERG), культивировали в среде Ex-cell 302 с добавлением 10% фетальной бычьей сыворотки, 2 мМ глутамина и 0,25 мг/мл генетицина и поддерживали в CO2 инкубаторе при 37°С. Для электрофизиологии пэтч-кламп внешний буфер содержал (в мМ): 150 NaCl, 10 Hepes, 4 KCl, 1.2 CaCl2, 1 MgCl2, pH 7,4, доведенный HCl, а внутренний регистрирующий раствор содержал (в мМ): 140 KCl, 6 EGTA, 5 Hepes, MgCl2, 5 АТФ-Na2, pH 7,2, доведенный КОН. Как только клетку загружали в регистрационную камеру и формировали герметичное закрытие Giga Ohm с двухмерными стеклянными электродами (Sealchip™), конфигурация целой клетки была достигнута путем разрушения клеточной мембраны. Затем мембранный потенциал фиксировали при -80 мВ, и канал hERG активировали 1-секундным импульсом деполяризации, подаваемым при 0,1 Гц, ток hERG измеряли в течение 500 мс-реполяризационного импульса до -40 мВ. После того, как был получен приемлемый ток hERG, клетку сначала подвергали воздействию 0,3% ДМСО в качестве контроля-носителя, а затем тестируемого соединения в трех возрастающих, полнологарифмических интервалах концентрации и, наконец, Е-4031 при 1 мкМ (в качестве положительного контроля) для полного блокирования тока hERG. Каждое тестируемое соединение тестировали на трех или более чем трех клетках и при концентрациях вплоть до 30 мкМ или определяли предел растворимости на сканере растворимости BD Gentest™. Ингибирование тока hERG при каждой концентрации нормализовали по ингибированию, зарегистрированному на контроле носителя, и приводили в соответствие с уравнением Хилла для определения IC20 и/или IC50.
Анализы кинетики флуоресцентного субстрата катепсина D и катепсина Е
Общий принцип анализа
Флуоресцентные анализы MR121, описанные ниже, основаны на том факте, что MR121 образует не флуоресцентный комплекс основного состояния с триптофаном. В растворе его образование происходит при миллимолярных концентрациях триптофана. Этот механизм можно использовать для разработки общего биохимического анализа для протеаз. Пептид-субстрат метят по N-концу триптофаном и по С-концу флуорофором MR121 (для катепсина D использовали 10-аминокислотный пептид WTSVLMAAPC-MR121; для катепсина Е использовали MR121-CKLVFFAEDW). В отсутствие протеазной активности субстраты остаются интактными, и флуоресценция MR121 снижается высокой локальной концентрацией Trp. Если субстраты расщепляются ферментами, регистрируют флуоресценцию MR121.
Метод анализа
Кинетические анализы флуоресцентного субстрата катепсина D и катепсина Е проводили при комнатной температуре в 384-луночных микротитрационных планшетах (черных планшетах с прозрачным плоским дном, с не связывающей поверхностью от фирмы Corning) в конечном объеме 51 мкл. Тестируемые соединения серийно разводили в ДМСО (15 концентраций, стадии разведения 1/3), и 1 мкл разведенных соединений смешивали в течение 10 мин с 40 мкл катепсина D (из печени человека, Calbiochem), разведенного в аналитическом буфере (100 мМ ацетат натрия, 0,05% БСА, рН 5,5; конечная концентрация: 200 нМ), или с 40 мкл рекомбинантного человеческого катепсина Е (R&D Systems), разведенного в аналитическом буфере (100 мМ ацетат натрия, 0,05% БСА, рН 4,5; конечная концентрация: 0,01 нМ). После добавления 10 мкл субстрата катепсина D WTSVLMAAPC-MR121, разведенного в аналитическом буфере катепсина D (конечная концентрация: 300 нМ) или 10 мкл субстрата катепсина Е MR121-CKLVFFAEDW, разведенного в аналитическом буфере катепсина Е (конечная концентрация: 300 нМ), планшеты сильно встряхивали в течение 2 минут. За ферментативной реакцией следили с помощью считывающего устройства для планшетов Vision (Perkin Elmer) (длина волны возбуждения: 630 нм; испускания: 695 нм) в течение по меньшей мере 30 минут при измерении кинетики, обнаруживающем возрастание флуоресценции MR121 в течение периода реакции. Вычисляли наклон в линейном диапазоне кинетики, и IC50 тестируемых соединений определяли, используя уравнение с четырьмя параметрами для приведения в соответствие с кривой.
Анализ р-gp (Р-гликопротеина)
Клеточные линии и носители, используемые в экспериментах по транспорту Клеточная линия LLC-PK1 (АТСС #CL-101) представляет собой линию эпителиальных клеток почек свиньи. Клеточные линии, трансфицированные MDR1 (белком множественной лекарственной устойчивости человека 1), были получены от Dr. A. Schinkel, The Netherlands Cancer Institute (Amsterdam, The Netherlands). Все клеточные линии культивировали на проницаемых вкладышах (Costar, площадь поверхности 0,33 см2, размер пор 3,0 мкм, низкая плотность) при 4,5·105 клеток/см2. Измерения транспорта осуществляли на сутки 4 после посева. Плотность клеточного монослоя контролировали посредством проницаемости внеклеточного маркера lucifer yellow (10 мкМ). Подробное описание этого способа приведено Schwab et al. (Schwab D, Schrag P, Portmann R, Ruhmann S. Operation procedure: LLC-PK1 cell lines, parental and transfected with human (MDR1) or mouse (mdr1a) Pglycoprotein to study transcellular transport by P-glycoprotein. Report No. 1008708. July 01, 2002. и Schwab D, Schrag P, Portmann R. Validation report on in vitro P-glycoprotein transport of 16 reference compounds in LLC-PK1 cells (parental) and MDR1 or mdr1a (Mouse multidrug resistance protein 1a) transfected LLC-PK1 cells and correlation to in vivo brain penetration in mice. Report No. 1008771. August 21, 2002). Эксперименты, показывающие лучшую проницаемость lucifer yellow, чем 1%/ч, отбрасывали.
Эксперименты по транспорту in vitro
Двунаправленный трансцеллюлярный транспорт с использованием клеток LLC-PK1 и L-MDR1 LLC-PK1, экзогенно экспрессирующих MDR1 человека
Способ, используемый для экспериментов по транспорту, описан Schwab et al. (см. выше). Эксперименты проводили на автоматизированной системе TECAN подачи жидкостей. Кратко, среду удаляли из всех отсеков, и среду акцепторной стороны заменяли культуральной средой. Измерения трансцеллюлярного транспорта инициировали добавлением субстрата вместе с внеклеточным маркером lucifer yellow на донорную сторону. Ингибиторы добавляли на обе стороны (1 мкМ элакридар). Эксперименты по транспорту проводили как в базолатерально-апикальном направлении, так и в апикально-базолатеральном направлении с 3 лунками для каждого. Планшеты инкубировали при 37°С и 5% CO2 в инкубаторе Liconic. Образцы брали с донорной и с противоположной (акцепторной) стороны после 2 часов инкубации. Концентрации субстрата в обоих отсеках определяли с помощью сцинтилляционного счета (дигоксин) или с помощью ЖХ-МС/МС. Внеклеточный маркер (lucifer yellow) количественно определяли, используя считывающее устройство Spectrafluor plus при 430/535 нм (Ex/Em). В каждом эксперименте 3 различных вкладыша использовали для каждого условия и вычисляли среднее.
Анализ данных
Двунаправленный трансцеллюлярный транспорт с использованием клеток LLC-PK1 и L-MDR1
Для трансцеллюлярного транспорта использовали приведенное ниже уравнение для оценки данных:
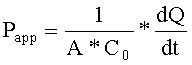
где Papp, А, С0 и dQ/dt представляют собой кажущуюся проницаемость, площадь фильтрующей поверхности, исходную концентрацию и количество, транспортируемое за период времени, соответственно. Значения Papp вычисляли на основе одной временной точки (2 ч).
Отношения транспорта к эффлюксу (ER) вычисляли следующим образом:
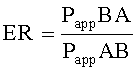
где PappBA представляет собой значение проницаемости в базолатерально-апикальном направлении, и PappAB представляет собой значение проницаемости в апикально-базолатеральном направлении. Papp не скорректировано по оттоку внеклеточного маркера lucifer yellow, и его использовали для оценки количества клеточных монослоев.
Результаты
|
Фармацевтические композиции
Соединения формулы I и фармацевтически приемлемые соли можно применять в качестве терапевтически активных веществ, например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение можно, однако, также осуществлять ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Соединения формулы I и их фармацевтически приемлемые соли можно обрабатывать фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и тому подобное можно использовать, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и твердые полиолы и тому подобное. В зависимости от природы активного вещества, однако, в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Фармацевтические препараты могут, кроме того, содержать фармацевтически приемлемые вспомогательные вещества, такие как консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать еще другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединения формулы 1 или их фармацевтически приемлемые соли и терапевтически инертный носитель, также являются объектом настоящего изобретения, как и способ их получения, который включает приведение одного или более чем одного соединения формулы 1 и/или его фармацевтически приемлемой соли и, если желательно, одного или более чем одного другого терапевтически ценного вещества в форму галенова препарата для введения вместе с одним или более чем одним терапевтически инертным носителем.
Дозировка может варьировать в широких пределах и, конечно, ее следует регулировать по индивидуальным потребностям в каждом конкретном случае. В случае перорального введения дозировка для взрослых может варьировать от примерно 0,01 мг до примерно 1000 мг в сутки соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточную дозировку можно вводить в виде однократной дозы или в разделенных дозах и, кроме того, верхний предел может быть также превышен, когда находят, что это показано.
Приведенные ниже примеры иллюстрируют настоящее изобретение без его ограничения, но служат исключительно как репрезентативные. Фармацевтические препараты обычно содержат примерно 1-500 мг, предпочтительно 1-100 мг соединения формулы I. Примерами композиций в соответствии с изобретением являются:
Пример А
Таблетки приведенной ниже композиции готовят обычным способом:
|
Методика получения
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с дистиллированной водой.
2. Высушивают гранулы при 50°С.
3. Пропускают гранулы через подходящее оборудование для измельчения.
4. Добавляют ингредиент 5 и смешивают в течение трех минут; прессуют на подходящем прессе.
Пример В-1
Готовят капсулы приведенной ниже композиции:
|
Методика получения
1. Смешивают ингредиенты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и смешивают в течение 3 минут.
3. Заполняют в подходящую капсулу.
Соединение формулы I, лактозу и кукурузный крахмал сначала смешивают в смесителе, а затем в измельчающем аппарате. Смесь возвращают в смеситель; добавляют к ней тальк и тщательно смешивают. Смесь заполняют с помощью аппарата в подходящие капсулы, например, в твердые желатиновые капсулы.
Пример В-2
Готовят мягкие желатиновые капсулы приведенной ниже композиции (см. табл. 5).
|
|
Таблица 6: возможная композиция мягкой желатиновой капсулы
Методика получения
Соединение формулы I растворяют в теплом расплаве других ингредиентов, и смесь заполняют в мягкие желатиновые капсулы подходящего размера. Заполненные мягкие желатиновые капсулы обрабатывают в соответствии с обычными методами.
Пример С
Готовят суппозитории приведенной ниже композиции:
|
Таблица 7: возможная композиция суппозитория
Методика получения
суппозиторную массу плавят в стеклянном или стальном сосуде, тщательно смешивают и охлаждают до 4°С. После этого к ней добавляют тонкоизмельченное соединение формулы I и перемешивают до тех пор, пока оно полностью не диспергируется. Смесь заливают в формы для суппозиториев подходящего размера, оставляют до охлаждения; затем суппозитории извлекают из форм и упаковывают индивидуально в вощеную бумагу или металлическую фольгу.
Пример D
Готовят инъекционные растворы приведенной ниже композиции:
|
Методика получения
Соединение формулы I растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (части). Доводят рН до 5,0 уксусной кислотой. Объем доводят до 1,0 мл добавлением остального количества воды. Раствор фильтруют, заполняют во флаконы, используя подходящий допустимый избыток, и стерилизуют.
Пример Е
Готовят пакеты-саше приведенной ниже композиции:
|
|
Методика получения
Соединение формулы I смешивают с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы и гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния, добавляют добавки корригентов и заполняют в пакеты-саше.
Экспериментальный раздел
Приведенные ниже примеры приведены для иллюстрации изобретения. Их не следует рассматривать как ограничивающие объем изобретения, но исключительно как репрезентативные.
Синтез промежуточного соединения 1-(2-фтор-5-нитрофенил)-пропан-1-она XII-1
К раствору 1-(2-фторфенил)-пропан-1-она (99 ммоль) в концентрированной серной кислоте (80 мл), охлажденному до -30°С, медленно добавляли дымящуюся азотную кислоту (8 мл) в течение 20 мин, и раствор перемешивали при -30°С в течение 15 мин. Эту смесь медленно наливали в перемешанную смесь 200 мл воды и 400 г льда. Водную фазу экстрагировали этилацетатом, органический слой снова экстрагировали водой и 1 М раствором NaHCO3. Органический слой высушивали над Na2SO4, выпаривали, и остаток подвергали хроматографии на силикагеле, используя смесь гептана и этилацетата в качестве элюента, с получением 16,5 г чистого нитро-промежуточного соединения XII-1. МС (ИЭР): m/z=198,1 [М+Н]+.
Синтез промежуточного соединения 1-(2,3-дифтор-5-нитрофенил)-этанона XII-2
В инертной атмосфере азота 1-(2,3-дифторфенил)-этанон (5,0 г (32 ммоль)) добавляли по каплям к серной кислоте (95-97%, 20 мл), охлажденной до 0°С, с такой скоростью, чтобы поддерживать температуру ниже 5°С. Затем реакционную смесь охлаждали до -15°С, и раствор азотной кислоты (3,22 мл, 46,4 ммоль) в серной кислоте (95-97%, 4,6 мл) добавляли по каплям при -15°С. После перемешивания при -10°С в течение 45 минут смесь наливали на лед. Добавляли этилацетат, затем органический слой отделяли, промывали водой, высушивали над сульфатом натрия и выпаривали при пониженном давлении. В результате очистки сырого светло-желтого масла (5,64 г) хроматографией на силикагеле, используя градиент гептан/этилацетат=от 100:0 до 0:100, получили 1-(2,3-дифтор-5-нитрофенил)-этанон (1,83 г, 28% теоретического) в виде светло-желтого масла вместе со смесью 1-(2,3-дифтор-5-нитрофенил)-этанона и 1-(2,3-дифтор-6-нитрофенил)-этанона.
Общий метод А: Синтез промежуточных сульфинилиминов VI и XVI
К раствору (R)-(+)-трет-бутилсульфинамида (89,8 ммоль) в ТГФ (400 мл) последовательно добавляли кетон (98,7 ммоль) и этоксид титана(IV) (178,4 ммоль), и раствор перемешивали при температуре образования флегмы в течение 3-18 ч. Смесь охлаждали до 22°С, обрабатывали рассолом (400 мл); суспензию перемешивали в течение 10 мин и фильтровали через дикалит. Слои разделяли, водный слой экстрагировали этилацетатом, объединенные органические слои промывали водой, высушивали и выпаривали. Остаток подвергали хроматографии на силикагеле, используя смесь гептана и этилацетата в качестве элюента, с получением чистых сульфиниминов VI или XVI.
Промежуточное соединение VI-2 (R2=F; R3=Me): Начиная с 1-(2-фтор-5-нитрофенил)-этанона (89,7 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [1-(2-фтор-5-нитрофенил)-(Е)-этилиден]-амид (21,56 г) был получен в виде бледно-желтого твердого вещества. МС (ISP): m/z=287,0 [М+Н]+
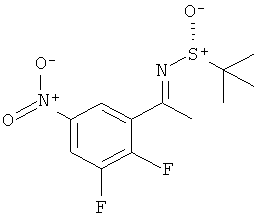
Промежуточное соединение VI-3 (R2a и R2b=F; R3=Me): Начиная с 1-(2,3-дифтор-5-нитрофенил)-этанона (19,9 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [1-(2,3-дифтор-5-нитрофенил)-(Е)-этилиден]-амид (5,27 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=305,1 [М+Н]+.
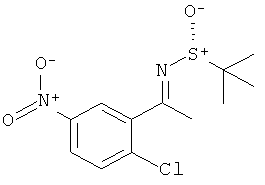
Промежуточное соединение VI-4 (R2=Cl; R3=Me): Начиная с 1-(2-хлор-5-нитрофенил)-этанона (75,2 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [1-(2-хлор-5-нитрофенил)-эт-(Е)-илиден]-амид (16,26 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=303,1 [М+Н]+.
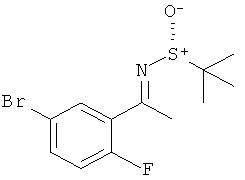
Промежуточное соединение VI-1 (R2=F; R3=Me): Начиная с 1-(5-бром-2-фторфенил)-этанона (241 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [1-(5-бром-2-фторфенил)-(Е)-этилиден]-амид (63,6 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=320,0 [М+Н]+ и 322,0 [М+2+Н]+.
Общий метод В: Синтез промежуточных сульфинамидодифторэфиров VII и XVII
В сухом аппарате суспензию свежеактивированного порошка цинка (1,28 г, 19,6 ммоль) в сухом диэтиловом эфире (45 мл) нагревали в инертной атмосфере до образования флегмы. Раствор сульфинилимина VI или XVI (3,14 г, 9,81 ммоль) и этил-2-бром-2,2-дифторацетата (3,98 г, 2,52 мл, 19,6 ммоль) в сухом диэтиловом эфире (25 мл) добавляли по каплям в течение периода 15 минут, в то время как внутренняя температура повышалась с 34°С до 35°С, и образование флегмы увеличивалось. Суспензию держали при образовании флегмы еще в течение 5 ч, охлаждали до 23°С, фильтровали через целлит и промывали этилацетатом. Фильтрат наливали в 300 мл насыщенного раствора NH4Cl и экстрагировали этилацетатом (2×300 мл). Объединенные органические слои высушивали над Na2SO4 и выпаривали с получением 4,59 г сырого продукта в виде коричневого масла, которое очищали флэш-хроматографией (силикагель, 70 г) с гептаном/этилацетатом 8:1 с получением сульфинамидодифторэфиров VII или XVII.
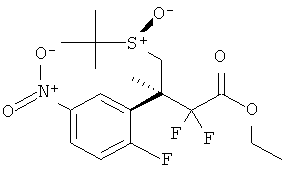
Промежуточное соединение VII-1 (R2=F; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [1 -(2-фтор-5-нитрофенил)-(Е)-этилиден]-амида (промежуточного соединения VI-1) (5,73 г, 20 ммоль), продукт (R)-2,2-дифтор-3-(2-фтор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этиловый эфир (3,1 г) был получен в виде оранжевого масла. MC(ISP):m/z=411,2[M+H]+.
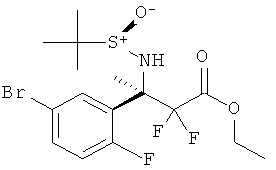
Промежугочное соединение XVII-1 (R2=F; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [1-(5-бром-2-фторфенил)-(Е)-этилиден]-амида (промежуточного соединения XVI-1) (9,8 ммоль), продукт (R)-3-(5-бром-2-фторфенил)-2,2-дифтор-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этиловый эфир (3,08 г) был получен в виде оранжевого масла. МС (ISP): m/z=444,1 [М+Н]+ и 446,1 [М+2+Н]+.
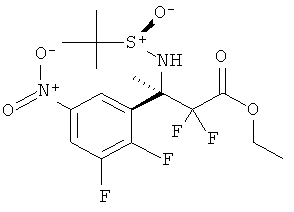
Промежуточное соединение VII-2 (R2a и R2b=F; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [1-(2,3-дифтор-5-нитрофенил)-(Е)-этилиден]-амида (промежуточного соединения VI-3) (1,64 ммоль), продукт (R)-2,2-дифтор-3-(2,3-дифтор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этиловый эфир (340 мг) был получен в виде светло-желтого масла. МС (ISP):m/z=429,1 [М+Н]+.
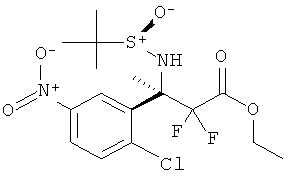
Промежуточное соединение VII-3 (R2=Cl; R3=Me): Начиная с (R)-2-метил-пропан-2-сульфиновой кислоты [1-(2-хлор-5-нитро-фенил)-эт-(Е)-илиден]-амида (6.6 моль), продукт (R)-2,2-дифтор-3-(2-хлор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этиловый эфир (1,69 г) был получен в виде оранжевого масла. МС (ISP): m/z=427,0 [M+H]+.
Общий метод С1: Синтез промежуточных соединений сульфинамидоспиртов VIII и XVIII (R4 и R5=Н)
Раствор сульфинамидодифторэфиров VII или XVII (4,4 ммоль) в сухом ТГФ (24 мл), охлажденный до 0°С, обрабатывали боргидридом лития (9,0 ммоль), и перемешивание продолжали при 0°С в течение 15 мин. Затем реакционной смеси давали нагреться до комнатной температуры и перемешивали дополнительно в течение 2-18 ч. Реакционную смесь гасили добавлением воды, объем реакционной смеси снижали в вакууме и разбавляли этилацетатом. Органическую фазу промывали рассолом, высушивали над Na2SO4 и выпаривали с получением остатка, который подвергали хроматографии на силикагеле, используя смесь н-гептана и этилацетата в качестве элюента, с получением промежуточных аминоэфиров VIII или XVIII.
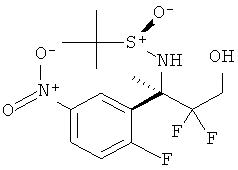
Промежуточное соединение VIII-1 (R2=F; R3=Me): Начиная с (R)-2,2-дифтор-3-(2-фтор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (промежуточного соединения VI-1) (3,78 г, 9,2 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2-фтор-5-нитрофенил)-3-гидрокси-1-метил-пропил]-амид (2,9 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=369,0 [М+Н]+
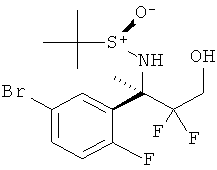
Промежуточное соединение XVIII-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с (R)-3-(5-бром-2-фторфенил)-2,2-дифтор-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (промежуточного соединения XVII-1) (5,95 г, 13 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [(R)-1-(5-бром-2-фторфенил)-2,2-дифтор-3-гидрокси-1-метилпропил]-амид (5,3 г) был получен в виде желтого масла. МС (ISP): m/z=402,2 [М+Н]+ и 404,2 [М+2+Н]+.
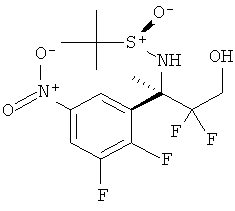
Промежуточное соединение VIII-2 (R2a и R2b=F; R3=Me): Начиная с (R)-2,2-дифтор-3-(2,3-дифтор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (промежуточного соединения VI 1-2) (0,8 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2,3-дифтор-5-нитрофенил)-3-гидрокси-1-метилпропил]-амид (179 мг) был получен в виде беловатого твердого вещества. МС (ISP): m/z=387,1 [М+Н]+.
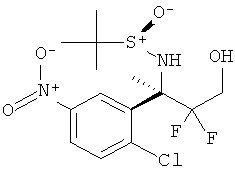
Промежуточное соединение VIII-3 (R2=Cl; R3=Me): Начиная с (R)-2,2-дифтор-3-(2-хлор-5-нитрофенил)-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (2,34 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2-хлор-5-нитрофенил)-3-гидрокси-1-метилпропил]-амид (721 мг) был получен в виде беловатого твердого вещества. МС (ISP): m/z=385,0 [М+Н]+.
Общий метод С2: Синтез промежуточных соединений сульфинамидоспиртов XVIII (R4 и R5=низший алкил)
Раствор (R)-3-(5-бром-2-фторфенил)-2,2-дифтор-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (промежуточного соединения XVII-1) (1,55 г, 3,5 ммоль) в сухом ТГФ (60 мл) охлаждали до -78°С, затем добавляли по каплям раствор алкилмагния галогенида (в данном случае, например, метилмагния бромида (3 М в диэтиловом эфире, 11,6 мл, 34,9 ммоль)), и перемешивание продолжали при -78°С в течение 4 ч с последующим подогреванием до 23°С и перемешиванием еще в течение 18 ч. Реакционную смесь наливали в насыщенный раствор NH4Cl, экстрагировали этилацетатом, органический слой промывали рассолом и высушивали над Na2SO4, фильтровали, и растворитель полностью выпаривали с получением продукта (1,29 г, 86%) в виде светло-желтого масла.
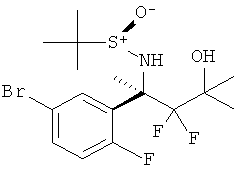
Промежуточное соединение XVIII-2 (R2=F; R3, R4 и R5=Me): Начиная с (R)-3-(5-бром-2-фторфенил)-2,2-дифтор-3-((R)-2-метилпропан-2-сульфиниламино)-масляной кислоты этилового эфира (промежуточного соединения XVII-1) (1,55 г, 3,5 ммоль), продукт (R)-2-метилпропан-2-сульфиновой кислоты [(R)-1-(5-бром-2-фторфенил)-2,2-дифтор-3-гидрокси-1,3-диметилбутил]-амид (1,29 г) был получен в виде светло-желтого масла. МС (ISN): m/z=427,9 [М+Н]+ и 429,9 [М+2+Н]+.
Общий метод D: Синтез промежуточных аминоспиртов IX и XIX
Раствор сульфинамидоспиртов VIII или XVIII (10,3 ммоль) в метаноле или ТГФ (30-60 мл) обрабатывали раствором HCl в 1,4-диоксане (4 М, 10-13 мл), и перемешивание продолжали при 23°С в течение 2-18 ч. Смесь распределяли между этилацетатом и водным 2 М раствором Na2CO3, органический слой высушивали над Na2SO4, фильтровали и выпаривали с получением остатка, который подвергали хроматографии на силикагеле, используя смесь н-гептана и этилацетата в качестве элюента, с получением чистых аминоспиртов IX или XIX.
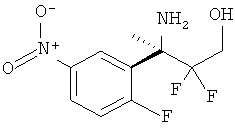
Промежуточное соединение IX-1 (R2=F; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2-фтор-5-нитрофенил)-3-гидрокси-1-метилпропил]-амида (промежуточного соединения С1) (3,79 г, 10,3 ммоль), продукт (R)-3-амино-2,2-дифтор-3-(2-фтор-5-нитрофенил)-бутан-1-ол (2,5 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=265,1 [М+Н]+.
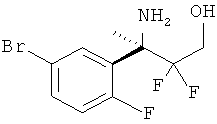
Промежуточное соединение XIX-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с [(R)-1-(5-бром-2-фторфенил)-2,2-дифтор-3-гидрокси-1-метилпропил]-амида (промежуточного соединения XVIII-1) (7,1 г, 17,7 ммоль), продукт (R)-3-амино-3-(5-бром-2-фторфенил)-2,2-дифторбутан-1-ол (4,75 г) был получен в виде светло-коричневого масла. МС (ISP): m/z=298,2 [М+Н]+ и 300,2 [М+2+Н]+.
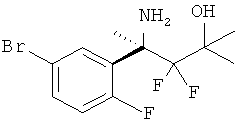
Промежуточное соединение XIX-2 (R2=F; R3, R4 и R5=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [(R)-1-(5-бром-2-фторфенил)-2,2-дифтор-3-гидрокси-1,3-диметилбутил]-амида (промежуточного соединения XVIII-2) (2,9 г, 6,7 ммоль), продукт (R)-4-амино-4-(5-бром-2-фторфенил)-3,3-дифтор-2-метилпентан-2-ол (1,44 г) был получен в виде белого твердого вещества. МС (ISP): m/z=326,2 [М+Н]+ и 328,2 [М+2+Н]+.
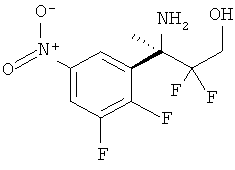
Промежуточное соединение IX-2 (R2a и R2b=F; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2,3-дифтор-5-нитрофенил)-3-гидрокси-1-метилпропил]-амида, продукт (R)-3-амино-3-(2,3-дифтор-5-нитрофенил)-2,2-дифторбутан-1-ол (116 мг) был получен в виде светло-желтого масла. МС (ISP): m/z=283,1 [М+Н]+
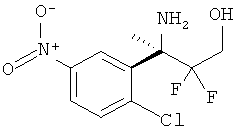
Промежуточное соединение IX-3 (R2=Cl; R3=Me): Начиная с (R)-2-метилпропан-2-сульфиновой кислоты [(R)-2,2-дифтор-1-(2-хлор-5-нитрофенил)-3-гидрокси-1-метилпропил]-амида (1,87 ммоль), продукт (R)-3-амино-3-(2-хлор-5-нитрофенил)-2,2-дифторбутан-1-ол (455 мг) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=281,1 [М+Н]+.
Общий метод Е: Синтез промежуточных аминооксазинов Х и XX
К раствору аминоспиртов IX или XIX (8,4 ммоль) в этаноле (40 мл) при 23°С добавляли в атмосфере аргона цианогенбромид (1,33 г, 12,6 ммоль), и светло-желтый реакционный раствор перемешивали в герметично закрытой пробирке в течение 24 часов при 85°С. Охлаждали до 23°С, к реакционной смеси добавляли некоторое количество льда с последующей экстракцией ДХМ/водой/насыщенным раствором NaHCO3 (pH 8). Органический слой высушивали над Na2SO4, фильтровали и выпаривали с получением сырого продукта, который либо использовали в следующей стадии без дополнительной очистки, либо очищали хроматографией на силикагеле, используя смесь н-гептана и этилацетата в качестве элюента, с получением чистого аминооксазина Х или XX.
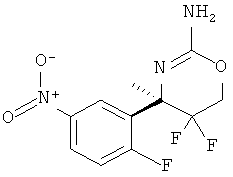
Промежуточное соединение Х-1 (R2=F; R3=Me): Начиная с (R)-3-амино-2,2-дифтор-3-(2-фтор-5-нитрофенил)-бутан-1-ола (промежуточного соединения D1) (1,5 г, 5,7 ммоль), продукт (R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (1,3 г) был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=290,2 [М+Н]+
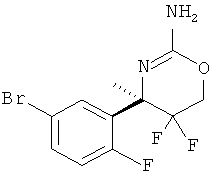
Промежуточное соединение ХХ-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с (R)-3-амино-3-(5-бром-2-фторфенил)-2,2-дифторбутан-1-ола (промежуточного соединения Х1Х-1) (2,5 г, 8,4 ммоль), продукт (R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (2,36 г) был получен в виде светло-желтого масла. МС (ISP): m/z=323,1 [М+Н]+ и 325,1 [М+2+Н]+.
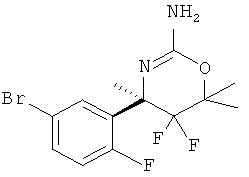
Промежуточное соединение ХХ-2 (R2=F; R3, R4 и R5=Me): Начиная с (R)-4-амино-4-(5-бром-2-фторфенил)-3,3-дифтор-2-метилпентан-2-ола (промежуточного соединения XIX-2) (0,76 г, 2,3 ммоль), продукт (R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (0,77 г) был получен в виде бесцветного масла. МС (ISP): m/z=351,1 [М+Н]+ и 353,1 [М+2+Н]+.
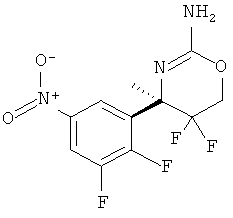
Промежуточное соединение Х-2 (R2a и R2b=F; R3=Me): Начиная с (R)-3-амино-3-(2,3-дифтор-5-нитрофенил)-2,2-дифторбутан-1-ола (0,41 ммоль) (промежуточного соединения IX-2), продукт (R)-5,5-дифтор-4-(2,3-дифтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (100 мг) был получен в виде светло-желтого масла. МС (ISP): m/z=308,1 [М+Н]+
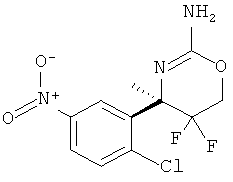
Промежуточное соединение Х-3 (R2=Cl; R3=Me): Начиная с (R)-3-амино-3-(2-хлор-5-нитрофенил)-2,2-дифтор-бутан-1-ола (1,60 ммоль), продукт (R)-4-(2-хлор-5-нитрофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (400 мг) был получен в виде бесцветной смолы. МС (ISP): m/z=306,1 [М+Н]+.
Общий метод F: Синтез промежуточных DМТr-защищеных аминооксазинов XXI
К раствору аминооксазина XX (2,4 ммоль) и триэтиламина (0,66 мл; 4,8 ммоль) в дихлорметане (25 мл) при 0°С добавляли 4,4'-диметокситритилхлорид (DMTr-Cl) (0,89 г; 2,6 ммоль), и зеленую реакционную смесь перемешивали при 23°С в течение 2 часов. В результате экстракции водой, затем высушивания органического слоя над Na2SO4, фильтрования и выпаривания получили сырой продукт, который очищали колоночной хроматографией на силикагеле с н-гептаном и этилацетатом с получением чистого DMTr-защищенного аминооксазина XXI.
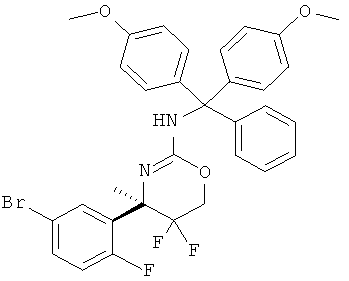
Промежуточное соединение XXI-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с (R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения ХХ-1) (0,77 г, 2,4 ммоль), продукт [бис-(4-метоксифенил)-фенилметил]-[(R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-амин (1,11 г) был получен в виде белой пены. МС (ISP): m/z=625,3 [М+Н]+ и 627,4 [M+2+H]+.
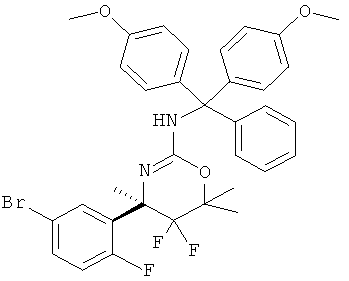
Промежуточное соединение XXI-2 (R2=F; R3, R4 и R5=Me): Начиная с (R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения ХХ-2) (0,77 г, 2,2 ммоль), продукт [бис-(4-метоксифенил)-фенилметил]-[(R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-амин (1,10 г) был получен в виде белой пены. МС (ISP): m/z=653,3 [М+Н]+ и 655,3 [М+2+Н]+.
Общий метод G1: Синтез промежуточных диаминов XI (из нитросоединений X)
К раствору нитросоединения Х (4,47 ммоль) в этаноле (35 мл) добавляли при 23°С в инертной атмосфере палладий на углероде (10% Pd/C, 238 мг, 5 моль%), и смесь перемешивали в атмосфере водорода (баллон) при 23°С в течение 1 ч. Катализатор отфильтровывали и дважды промывали этанолом. Растворитель удаляли при пониженном давлении с получением промежуточного диамина XI в виде сырого продукта, который использовали без дополнительной очистки.
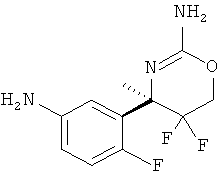
Промежуточное соединение XI-1 (R2=F; R3=Me): Начиная с (R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения Х-1) (1,29 г, 4,47 ммоль), продукт (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (1,14 г) был получен в виде бесцветной пены. МС (ISP): m/z=260,1 [М+Н]+.
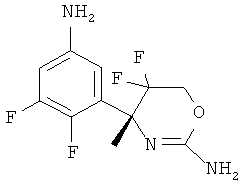
Промежуточное соединение XI-2 (R2a и R2b=F; R3=Me): Начиная с (R)-5,5-дифтор-4-(2,3-дифтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения Х-2) (0,33 ммоль), продукт (R)-4-(5-амино-2,3-дифторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (57 мг) был получен в виде желтой смолы. МС (ISP): m/z=278,1 [М+Н]+.
Синтез промежуточного соединения Xl-3 (R2=Cl: R3=Me)
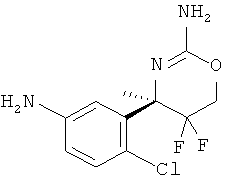
В инертной атмосфере аргона раствор (R)-4-(2-хлор-5-нитрофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения Х-3) (50 мг, 0,16 ммоль) в тетрагидрофуране (1 мл) обрабатывали при 0°С никелем Ренея (50% в воде, 0,07 мл). Смесь перемешивали в атмосфере водорода при 0°С в течение 15 минут. Катализатор отфильтровывали, и фильтрат выпаривали при пониженном давлении с получением (R)-4-(5-амино-2-хлорфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (42 мг, 93% теоретического) в виде желтого масла, которое использовали без дополнительной очистки. МС (ISP): m/z=276,1 [М+Н]+.
Синтез промежуточного соединения Xl-4 (R2=Н: R3=Me)
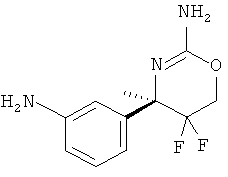
Начиная с (R)-4-(2-хлор-5-нитрофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения Х-3) (0,33 ммоль) и следуя общему методу G1, продукт (R)-4-(3-аминофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (65 мг) был получен в виде пены. МС (ISP): m/z=242,3 [М+Н]+.
Общий метод G2: Синтез промежуточных диаминов XI (из бензофенониминов XXII)
К раствору промежуточного соединения бензофенонимина XXII (1,6 ммоль) в метиленхлориде (24 мл) при 23°С добавляли трифторуксусную кислоту (ТФУ) (6 мл), причем смесь немедленно преобразовывалась в оранжевый раствор. Через 1 час масс-спектроскопия показала отсутствие какой-либо тритильной группы, но присутствие бензофенонимина. Тогда добавляли 1 М HCl (10 мл) и 1,4-диоксан (40 мл), и смесь энергично перемешивали при 23°С в течение 1-18 ч. Смесь наливали на 1 М раствор Na2CO3, экстрагировали метиленхлоридом, промывали органический слой рассолом и высушивали над Na2SO4. В результате удаления растворителя в вакууме осталось зеленое масло, которое очищали хроматографией на SiO2-NH2 от метиленхлорида до метиленхлорида/метанола 19:1 с получением чистого промежуточного диамина XI.
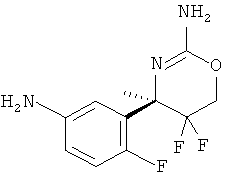
Промежуточное соединение XI-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с {(R)-4-[5-(бензгидрилиденамино)-2-фторфенил]-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-[бис-(4-метоксифенил)-фенилметил]-амина (промежуточного соединения XXII-1) (1,15 г, 1,6 ммоль), продукт (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (0,34 г) был получен в виде беловатой пены. МС (ISP): m/z=260,1 [М+Н]+
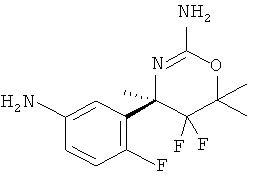
Промежуточное соединение XI-2 (R2=F; R3, R4 и R5=Me): Начиная с {(R)-4-[5-(бензгидрилиденамино)-2-фторфенил]-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-[бис-(4-метоксифенил)-фенилметил]-амина (промежуточного соединения XXII-2) (1,29 г, 1,7 ммоль), продукт (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин (0,365 г) был получен в виде беловатой пены. МС (ISP): m/z=288,0 [М+Н]+.
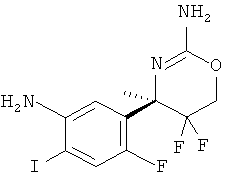
Промежуточное соединение XI-3 (R2a=F; Rb=I; R3=Me; R4 и R5=Н):
Раствор (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) (500 мг, 1,9 ммоль) и йодида аммония (308 мг, 2,1 ммоль) в уксусной кислоте (9,6 мл) обрабатывали при комнатной температуре водным раствором пероксида водорода (35%, 0,19 мл, 2,1 ммоль). После перемешивания в течение ночи 50% исходного вещества осталось. Добавляли еще один эквивалент йодида аммония и пероксида водорода, и перемешивание продолжали при комнатной температуре в течение ночи. Для выделения продукта реакции реакционную смесь фильтровали, фильтрат обрабатывали тиосульфатом натрия, затем экстрагировали этилацетатом (3x). Объединенные органические слои промывали насыщенным раствором гидрокарбоната натрия, затем высушивали над сульфатом натрия и выпаривали при пониженном давлении. С целью удаления остаточной уксусной кислоты сырой продукт растворяли в дихлорметане и снова экстрагировали насыщенным раствором гидрокарбоната натрия. Сырой продукт очищали хроматографией на флэш-колонке Isolate NH2, используя градиент гептан/этилацетат=от 100/0 до 0/100 в качестве элюента. (R)-4-(5-амино-2-фтор-4-йодофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламин был получен в виде желтого твердого вещества (415 мг, 56% теоретического). МС (ISP): m/z=386,0 [М+Н]+.
Общий метод Н: Синтез промежуточных бензофенониминов XXII
В атмосфере аргона в герметично закрытой пробирке к раствору DMTr-защищенного аминооксазина XXI (1,8 ммоль) в толуоле (20 мл) добавляли трет-бутоксид натрия (507 мг, 5,3 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилдифенил (f-Bu X-phos) (75 мг, 10 моль%) и трис(дибензилиденацетон)дипалладий (0) ((dba)3Pd2·CHCl3) (55 мг, 3 моль%). Наконец, добавляли бензофенонимин (0,59 мл, 3,5 ммоль) через шприц. Пробирку герметично закрывали в атмосфере аргона, и смесь перемешивали при 105°С в течение 2-18 ч. Коричневый раствор экстрагировали этилацетатом и водой. Органический слой промывали рассолом, высушивали над Na2SO4, фильтровали и выпаривали с получением коричневого остатка, который очищали колоночной хроматографией на силикагеле с н-гептаном и этилацетатом с получением чистых промежуточных бензофенониминов XXII.
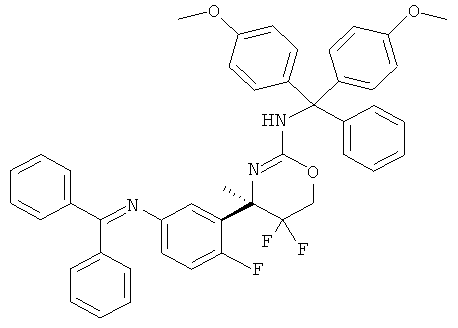
Промежуточное соединение XXI1-1 (R2=F; R3=Me; R4 и R5=H): Начиная с [бис-(4-метоксифенил)-фенилметил]-[(R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-амина (промежуточного соединения XXI-1) (1,1 г, 1,8 ммоль), продукт {(R)-4-[5-(бензгидрилиденамино)-2-фторфенил]-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-[бис-(4-метоксифенил)-фенилметил]-амин (1,15 г) был получен в виде светло-коричневой пены. МС (ISP): m/z=726,4 [М+Н]+.
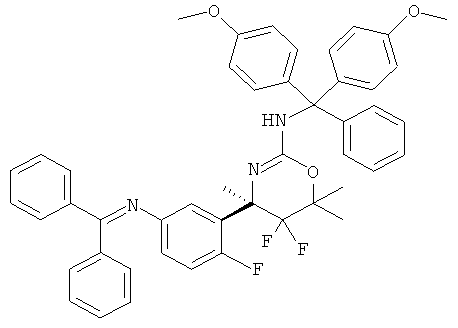
Промежуточное соединение XXII-2 (R2=F; R3, R4 и R5=Me): Начиная с [бис-(4-метоксифенил)-фенилметил]-[(R)-4-(5-бром-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-амина (промежуточного соединения XXI-2) (1,1 г, 1,7 ммоль), продукт {(R)-4-[5-(бензгидрилиденамино)-2-фторфенил]-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-[бис-(4-метоксифенил)-фенилметил]-амин (1,29 г) был получен в виде светло-коричневой пены. МС (ISP): m/z=754,5 [М+Н]+.
Общий метод I: Синтез амидов 1
К раствору карбоновой кислоты (0,23 ммоль) в метаноле (5 мл) при 0°С добавляли гидрат 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида (DMTMM) (80 мг, 0,27 ммоль). Бесцветный раствор перемешивали при 0°С в течение 30 мин, затем добавляли по каплям раствор промежуточного диамина XI (0,21 ммоль) в метаноле (5 мл) при 0°С через шприц. Реакционную смесь перемешивали при 23°С в течение 18-60 ч. Наливали в 1 М раствор Na2CO3, экстрагировали метиленхлоридом, промывали органический слой рассолом и высушивали над Na2SO4. В результате удаления растворителя в вакууме осталось светло-коричневое масло, которое очищали колоночной хроматографией на силикагеле с 0-10% метанолом в метиленхлориде с получением чистых амидов I.
Общий метод J: Синтез промежуточных ди-Вос-защищенных аминооксазинов XXIII
Раствор аминооксазина Х (8,7 ммоль) в тетрагидрофуране (87 мл) обрабатывали триэтиламином (3,16 мл, 22,7 ммоль). Раствор перемешивали в течение 5 минут, затем добавляли ди-трет-бутилдикарбонат (3,99 г, 18,3 ммоль) с последующим добавлением 4-диметиламинопиридина (0,32 г, 2,61 ммоль). Смесь перемешивали при комнатной температуре, и за ходом реакции следили с помощью тонкослойной хроматографии (гептан:этилацетат=1:1). Через 2 часа реакционную смесь выпаривали при пониженном давлении. В результате очистки сырого продукта флэш-хроматографией на силикагеле, используя градиент гептана и этилацетата в качестве элюента, получили ди-защищенный аминооксазин XXIII.
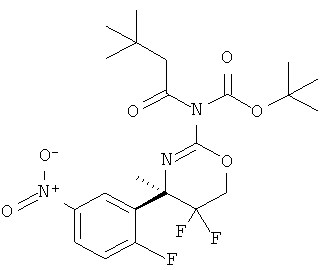
Промежуточное соединение XXIII-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с (R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения Х-1) (2,52 г, 8,7 ммоль), продукт [(R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-дикарбаминовой кислоты бис-трет-бутиловый эфир (3,48 г) был получен в виде белого кристаллического твердого вещества. МС (ISP): m/z=490,2 [М+Н]+, 334,2 [М-Вос-трет-бутил+Н]+.
Общий метод К: Синтез промежуточных Вос-защищенных аминооксазинов XXIV
Раствор аминооксазина XXXIII (4,5 ммоль) в дихлорметане (9 мл) охлаждали до 0°С и обрабатывали по каплям трифторуксусной кислотой (0,69 мл, 9 ммоль). Раствор перемешивали при 0°С в течение ночи. Реакционную смесь подогревали до комнатной температуры. С целью завершения преобразования реакционную смесь снова охлаждали до 0°С, добавляли еще один эквивалент трифторуксусной кислоты, и смесь оставляли нагреваться до комнатной температуры. Через 4 часа раствор наливали в насыщенный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Объединенные органические слои высушивали над сульфатом натрия и выпаривали. В результате очистки сырого продукта флэш-хроматографией на силикагеле, используя градиент гептана и этилацетата в качестве элюента, получили аминооксазин XXIV вместе с исходным веществом и аминооксазином X.
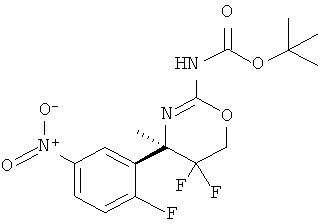
Промежуточное соединение XXIV-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с [(R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-дикарбаминовой кислоты бис-трет-бутилового эфира (промежуточного соединения XXIII-1) (2,2 г, 4,5 ммоль), продукт [(R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-карбаминовой кислоты mpem-бутиловый эфир (0,96 г) был получен в виде белой пены. МС (ISP): m/z=388,1 [М-Н]-.
Общий метод L: Синтез промежуточных диаминов XXV (из нитросоединений XXIV)
К раствору нитросоединения XXIV (3,42 ммоль) (промежуточного соединения XXIII-1) в смеси этанола (33 мл) и тетрагидрофурана (33 мл) добавляли при 23°С в инертной атмосфере палладий на углероде (133 мг, 1,25 ммоль). Смесь откачивали и продували водородом три раза, затем перемешивали в течение ночи. После завершения смесь фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией, используя градиент гептана и этилацетата в качестве элюента, с получением Вос-защищенного диамина XXV.
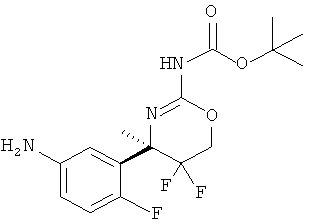
Промежуточное соединение XXV-1 (R2=F; R3=Me; R4 и R5=Н): Начиная с [(R)-5,5-дифтор-4-(2-фтор-5-нитрофенил)-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-карбаминовой кислоты трет-бутилового эфира (1,33 г, 3,42 ммоль), продукт [(R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-карбаминовой кислоты трет-бутиловый эфир (0,83 г) был получен в виде белой пены. МС (ISP): m/z=358,0 [М-Н]-.
Приведенные ниже примеры имеют основную группу. В зависимости от условий реакции и очистки они были выделены либо в форме свободного основания, либо в виде соли, либо как в форме свободного основания, так и в солевой форме.
Пример 1
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-хлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного масла. МС (ISP): m/z=399,2 [М+Н]+.
Пример 2
5-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-фторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного масла. МС (ISP): m/z=383,2 [М+Н]+.
Пример 3
3-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-хлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=399,1 [М+Н]+.
Пример 4
3,5-Дифторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3,5-дифторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=401,2[М+Н]+.
Пример 5
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде светло-желтого масла. МС (ISP): m/z=467,2 [М+Н]+.
Пример 6
3-Трифторметил-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фтор-фенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-трифторметилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=433,2 [М+Н]+.
Пример 7
3-Хлор-5-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-хлор-5-фторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=417,2 [М+Н]+.
Пример 8
3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3,5-дихлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=433,2 [М+Н]+.
Пример 9
Пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и пиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=365,2 [М+Н]+
Пример 10
3-Фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фтор-фенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-фторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=383,2 [М+Н]+.
Пример 11
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 11а) 5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=390,2 [М+Н]+. После растворения в этаноле с последующей обработкой соляной кислотой (1 н.) и выпаривания остаток снова растворяли в воде и выпаривали. 5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид был получен в виде белого твердого вещества.
Пример 12
5-Хлорпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-Хлорпиримидин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=400,0 [М+Н]+.
Пример 13
5-Хлор-3-метилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-хлор-3-метилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP):m/z=413,3[M+H]+.
Пример 14
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=463,2 [М+Н]+.
Пример 15
5-Хлор-3-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-хлор-3-фторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=463,2 [М+Н]+.
Пример 16
5-Трифторметилпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 6-трифторметилпиримидин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного масла. МС (ISP): m/z=434,2 [М+Н]+.
Пример 17
5-Трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-трифторметилпиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного масла. МС (ISP): m/z=434,2 [М+Н]+.
Пример 18
4-Хлор-1-метил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-хлор-1-метил-1Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного аморфного вещества. МС (ISP): m/z=402,3 [М+Н]+.
Пример 19
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-хлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=427,2 [М+Н]+.
Пример 20
3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 20а) 3-Хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=495,1 [М+Н]+. После обработки соединения, указанного в заголовке, соляной кислотой в диоксане (4 н.), выпаривания и растирания в диэтиловом эфире 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид был получен в виде белого твердого вещества.
Пример 21
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде беловатой пены. МС (ISP): m/z=418,2 [М+Н]+
Пример 22
3-Хлор-5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 22а) 3-Хлор-5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 3-хлор-5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили 3-хлор-5-цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид, после обработки которого соляной кислотой в диоксане (4 н.), выпаривания и растирания в диэтиловом эфире получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=452,1 [М+Н]+.
Пример 23
3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 23 а) 3,5-Дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 3,5-дихлорпиридин-2-карбоновой кислоты, следуя методу I, получили 3,5-дихлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид, после обработки которого соляной кислотой в диоксане (4 н.), выпаривания и растирания в диэтиловом эфире получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=461,2 [М+Н]+, 463,1 [М+2+Н]+.
Пример 24
5-Хлор-3-фторпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,б-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-хлор-3-фторпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=445,2 [М+Н]+, 447,2 [М+2+Н]+.
Пример 25
5-Трифторметилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-трифторметилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=461,2 [М+Н]+.
Пример 26
5-Фторметоксипиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-фторметоксипиридин-2-карбоновой кислоты (CASH 74321-03-9, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=441,3 [М+Н]+.
Пример 27
5-Дифторметоксипиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-дифторметоксипиридин-2-карбоновой кислоты (CASH 74323-34-2, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=459,2 [М+Н]+.
Пример 28
5-(2,2-Дифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-(2,2-дифторэтокси)-пиридин-2-карбоновой кислоты (CAS 1097730-45-4, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=473,1 [М+Н]+.
Пример 29
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=491,2 [М+Н]+.
5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновая кислота была получена, как описано ниже:
а) 5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты метиловый эфир
В атмосфере азота раствор 5-гидроксипиридин-2-карбоновой кислоты метилового эфира (200 мг, 1,31 ммоль) в N,N-диметилформамиде (2 мл) обрабатывали при комнатной температуре гидридом натрия (55% дисперсия в масле, 64 мг). После того, как образование газа прекратилось, суспензию охлаждали до 0°С и добавляли трифторметансульфоновой кислоты 2,2,2-трифторэтиловый эфир (364 мг, 1,57 ммоль). После перемешивания при комнатной температуре в течение 2 часов примерно 50% исходного вещества осталось. Добавляли еще 364 мг трифторметансульфоновой кислоты 2,2,2-трифторэтилового эфира, и через 30 минут реакция была завершена. Для выделения продукта реакции реакционную смесь обрабатывали насыщенным раствором карбоната натрия, затем экстрагировали этилацетатом (3x). Объединенные органические слои промывали рассолом, высушивали над сульфатом натрия и выпаривали при пониженном давлении. Сырой продукт очищали хроматографией на силикагеле, используя смесь 3:1 гептана и этилацетата в качестве элюента. 5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты метиловый эфир был получен в виде белого твердого вещества (216 мг, 70% теоретического). МС (ISP): m/z=236,3 [М+Н]+.
б) 5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновая кислота
В атмосфере азота раствор 5-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты метилового эфира (216 мг, 0,92 ммоль) в метаноле (1 мл) обрабатывали раствором моногидрата гидроксида лития (78 мг, 1,84 ммоль) в метаноле (0,1 мл). После перемешивания в течение 2 часов реакционную смесь выпаривали при пониженном давлении. Остаток обрабатывали соляной кислотой (1 н.), твердое вещество фильтровали, затем промывали водой, наконец, высушивали в высоком вакууме. 5-(2,2,2-Трифторэтокси)-пиридин-2-карбоновая кислота была получена в виде белого твердого вещества (125 мг, 61% теоретического).
Пример 30
5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 30а) 5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-карбоновой кислоты, следуя методу I, получили 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид, после обработки которого соляной кислотой в диоксане (4 н.), выпаривания и растирания с диэтиловым эфиром получили соединение, указанное в заголовке, в виде беловатого твердого вещества. МС (ISP): m/z=523,3 [М+Н]+
5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновая кислота была получена, как описано ниже:
а) 5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты метиловый эфир
Раствор 6-гидроксипиридин-2-карбоновой кислоты метилового эфира (2,0 г, 13,1 ммоль) в ацетоне (40 мл) обрабатывали карбонатом калия (5,415 г, 39,2 ммоль) и трифторметансульфоновой кислоты 2,2,3,3-тетрафторпропиловым эфиром. После 4 ч перемешивания при комнатной температуре суспензию разбавляли диэтиловым эфиром. После фильтрования раствор выпаривали, и желтое твердое вещество очищали хроматографией на силикагеле, используя градиент гептан/этилацетат=от 100:0 до 30:70 в качестве элюента. 5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты метиловый эфир был получен в виде светло-желтого твердого вещества (3,49 г, 76% теоретического). МС (ISP): m/z=468,1 [M+H]+.
б) 5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновая кислота
Способом, аналогичным описанному в примере 29б), в результате гидролиза 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-карбоновой кислоты метилового эфира гидроксидом лития получили соединение, указанное в заголовке, в виде светло-желтого твердого вещества (выход 94% теоретического). МС (ISP): m/z=253 [M]+.
Пример 31
N-[3-((R)-2-Амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-6-циклопропилметоксиникотинамид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 6-циклопропилметоксиникотиновой кислоты (CAS 1019546-29-2, WO 2008130320), следуя методу I, получили соединение, указанное в заголовке, в виде светло-желтого твердого вещества. МС (ISP): m/z=463,2 [М+Н]+.
Пример 32
5-Хлорпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-хлорпиримидин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=428,2 [М+Н]+.
Пример 33
5-Трифторметилпиримидин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-трифторметилпиримидин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=462,2 [М+Н]+.
Пример 34
5-Метилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-метилпиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=408,3 [М+Н]+.
Пример 35
5-Трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 35 а) 5-Трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-трифторметилпиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде светло-желтой пены. После обработки соляной кислотой в диоксане (4 н.), выпаривания и растирания с диэтиловым эфиром 5-трифторметилпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид был получен в виде светло-желтого твердого вещества. МС (ISP): m/z=462,2 [М+Н]+.
Пример 36
5-Циклопропилметоксипиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-циклопропилметоксипиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=464,3 [М+Н]+.
5-Циклопропилметоксипиразин-2-карбоновая кислота была получена, как описано ниже:
Раствор 5-хлорпиразин-2-карбоновой кислоты (1,5 г, 9,46 ммоль) в сухом диметилсульфоксиде (5 мл) обрабатывали циклопропилметанолом (1,15 мл, 14,1 ммоль) и порошкообразным гидроксидом калия (2,12 г, 37,8 ммоль). Смесь облучали в сосуде для микроволновой печи при 80°С в течение 45 минут. С целью завершения преобразования облучение продолжали еще 45 минут при 80°С. Для выделения продукта реакции реакционную смесь гасили раствором лимонной кислоты (10%), затем экстрагировали этилацетатом (5×30 мл), а затем смесью 20:80 метанола и дихлорметана (200 мл). Объединенные органические слои высушивали над сульфатом натрия, выпаривали при пониженном давлении и, наконец, лиофилизировали для удаления остаточного диметилсульфоксида. В результате дополнительной очистки флэш-хроматографией на силикагеле получили 5-циклопропилметоксипиразин-2-карбоновую кислоту в виде беловатого твердого вещества (1,83 г, 27% теоретического). МС (ISP): m/z=195 [М+Н]+.
Пример 37
6-Хлорпиридазин-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид и пример 37а)
6-Хлорпиридазин-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида гидрохлорид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 6-Хлорпиридазин-3-карбоновой кислоты, следуя методу I, получили 6-хлорпиридазин-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид, после обработки которого соляной кислотой в диоксане (4 н.), выпаривания и растирания с диэтиловым эфиром получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=428,2 [М+Н]+.
Пример 38
1-Дифторметил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 1-дифторметил-1Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=432,2.
Пример 39
3-Хлор-5-цианопиридин-2-карбоновой кислоты 13-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-хлор-5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=424,1 [М+Н]+.
Пример 40
5-Циклопропилэтинилпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-циклопропилэтинилпиридин-2-карбоновой кислоты (CAS1174322-62-3, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=429,3 [М+Н]+.
Пример 41
5-Дифторметоксипиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-дифторметоксипиридин-2-карбоновой кислоты (CAS1174323-34-2, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=431,3 [M+H]+.
Пример 42
5-Фторметоксипиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-фторметоксипиридин-2-карбоновой кислоты (CASH 74321-03-9, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного масла. МС (ISP): m/z=413,3 [М+Н]+.
Пример 43
5-(2,2,3,3-Тетрафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-(2,2,3,3-тетрафторпропокси)-пиридин-2-карбоновой кислоты [пример 30а), б)], следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=495,2 [М+Н]+.
Пример 44
5-(2,2,3,3,3-Пентафторпропокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фтор-фенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=513,1 [М+Н]+.
5-(2,2,3,3,3-Пентафторпропокси)-пиридин-2-карбоновая кислота была получена, как описано ниже:
а) Способом, аналогичным описанному в примере 30а), в результате алкилирования 5-гидроксипиридин-2-карбоновой кислоты метилового эфира карбонатом калия и трифторметансульфоновой кислоты 2,2,3,3,3-пентафторпропиловым эфиром получили 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-карбоновой кислоты метиловый эфир в виде светло-желтого масла. МС (ISP): m/z=285 [М]+.
б) Способом, аналогичным описанному в примере 30б), в результате гидролиза 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-карбоновой кислоты метилового эфира гидроксидом лития получили 5-(2,2,3,3,3-пентафторпропокси)-пиридин-2-карбоновую кислоту в виде белого твердого вещества. МС (ISP): m/z=271 [М+Н]+.
Пример 45
5-(2,2-Дифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-(2,2-дифторэтокси)-пиридин-2-карбоновой кислоты (CAS1097730-45-4, WO 2009091016), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=445,2 [М+Н]+.
Пример 46
5-Циклопропилметоксипиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-циклопропилметоксипиразин-2-карбоновой кислоты (пример 36), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=436,2 [М+Н]+.
Пример 47
5-Хлорпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-Хлорпиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=400,1 [М+Н]+.
Пример 48
3,5-Дихлорпиразин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3,5-дихлорпиразин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=434,1 [М+Н]+, 436,1 [М+2+Н]+.
Пример 49
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4,5-дифторфенил]-амид
В результате конденсации (R)-4-(5-амино-2,3-дифторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-2) и 5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде светло-желтого твердого вещества. МС (ISP): m/z=408,3 [М+Н]+.
Пример 50
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-хлорфенил]-амид
В результате конденсации (R)-4-(5-амино-2-хлорфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-3) и 5-хлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде беловатого твердого вещества. МС (ISP): m/z=415,2 [М+Н]+, 417,1 [М+2+Н]+.
Пример 51
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-хлорфенил]-амид
В результате конденсации (R)-4-(5-амино-2-хлорфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-3) и 5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде беловатого твердого вещества. МС (ISP): m/z=406,3 [М+Н]+.
Пример 52
5-Хлорпиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-фенил]-амид
В результате конденсации (R)-4-(3-аминофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-4) и 5-хлорпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде беловатого твердого вещества. МС (ISP): m/z=381,2 [М+Н]+.
Пример 53
5-Цианопиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-фенил]-амид
В результате конденсации (R)-4-(3-аминофенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-4) и 5-цианопиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде беловатого твердого вещества. МС (ISP): m/z=372,1 [М+Н]+.
Пример 54
3-(2,2,2-Трифторэтокси)-пиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 3-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке. МС (ISP): m/z=463,1 [М+Н]+.
3-(2,2,2-Трифторэтокси)-пиридин-2-карбоновая кислота была получена, как описано ниже:
а) К раствору 3-гидроксипиридин-2-карбоновой кислоты метилового эфира (200 мг, 1,3 ммоль) в N,N-диметилформамиде (2,0 мл) добавляли при 22°С гидрид натрия (55% в масле, 64 мг), и перемешивание продолжали до тех пор, пока не прекратилось выделение газа. Суспензию охлаждали до 0°С и обрабатывали трифторэтилтрифторметансульфонатом (728 мг), и перемешивание продолжали при 22°С в течение 2 часов. Смесь распределяли между насыщенным раствором гидрокарбоната натрия и этилацетатом, и органический слой высушивали и выпаривали. Остаток очищали хроматографией на силикагеле, используя н-гептан и этилацетат (3:1) в качестве элюента, с получением 3-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты метилового эфира в виде бледно-зеленого масла. Масса (вычисленная) C9H8F3NO3[235, 16]; (обнаружено) [M+H]+=236.
б) Раствор 3-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты метилового эфира (216 мг, 0,9 ммоль) в метаноле (1 мл) обрабатывали раствором гидроксида лития (78 мг, 3,3 ммоль) в воде (0,1 мл), и перемешивание продолжали при 22°С в течение 2 часов. Раствор выпаривали, и остаток растирали с 1 н. водной соляной кислотой. Суспензию фильтровали, остаток промывали водой и высушивали с получением 3-(2,2,2-трифторэтокси)-пиридин-2-карбоновой кислоты в виде бесцветного твердого вещества. Масса (вычисленная) C8H6F3NO3 [221, 14]; (обнаружено) [М-Н]-=220.
Пример 55
Оксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и оксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=353,3 [М-Н]+.
Пример 56
2-Этилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2-этилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде коричневого масла. МС (ISP): m/z=383,3 [М+Н]+.
Пример 57
2-Хлорметилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2-хлорметилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного вязкого масла. МС (ISP): m/z=403,3 [М+Н]+.
Пример 58
2-Метилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2-метилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=369,1 [М+Н]+.
Пример 59
2,5-Диметилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2,5-диметилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=383,2 [М+Н]+.
Пример 60
2-Метил-5-трифторметилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2-метил-5-трифторметилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветной пены. МС (ISP): m/z=437,1 [М+Н]+.
Пример 61
4-Метилизоксазол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-метилизоксазол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=369,2 [М+Н]+.
Пример 62
5-Изопропилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-изопропилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=397,2 [М+Н]+.
Пример 63
1-Метил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 1-метил-1Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=368,1 [М+Н]+.
Пример 64
1-Дифторметил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 1-дифторметил-1Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=404,3 [М+Н]+.
Пример 65
4-Хлор-2Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-хлор-2Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке. МС (ISP): m/z=388,1 [M+H]+.
Пример 66
4-Метил-2Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-метил-2Н-пиразол-3-карбоновой кислоты (CAS82231-51-4; В. Pelcman et al., WO 2006032851), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=368,1 [М+Н]+.
Пример 67
4-Хлор-5-циклопропил-2Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-хлор-5-циклопропил-2Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белой пены. МС (ISP): m/z=428,3 [М+Н]+.
4-хлор-5-циклопропил-2Н-пиразол-3-карбоновая кислота была получена, как описано ниже:
а) К раствору 5-циклопропил-2Н-пиразол-3-карбоновой кислоты этилового эфира (202 мг) в N,N-диметилформамиде (4 мл) добавляли при 0°С N-хлорсукцинимид (199 мг), и перемешивание продолжали при 22°С в течение 15 часов. Для выделения продукта реакции смесь распределяли между водой и этилацетатом, органический слой высушивали, выпаривали, и остаток очищали хроматографией на силикагеле, используя смесь 8:1 н-гептана и этилацетата в качестве элюента, с получением 4-хлор-5-циклопропил-2Н-пиразол-3-карбоновой кислоты этилового эфира (215 мг) в виде бледно-желтой жидкости. МС (ISP): m/z=215,2[М+Н]+.
б) К раствору 4-хлор-5-циклопропил-2Н-пиразол-3-карбоновой кислоты этилового эфира (210 мг) в диоксане (4 мл) добавляли при 22°С раствор гидроксида натрия (3,0 М, 0,65 мл), и перемешивание продолжали при 22°С в течение 15 часов и при 60°С в течение 3 часов. Для выделения продукта реакции смесь распределяли между водной соляной кислотой (1,0 М) и этилацетатом, органический слой высушивали и выпаривали с получением соединения, указанного в заголовке (161 мг), в виде бледно-желтого твердого вещества. МС (ISP): m/z=184,8 [М-Н]-.
Пример 68
4-Хлор-1-(2,2-дифтор-этил)-1Н-пиразоле-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-хлор-1-(2,2-дифторэтил)-1Н-пиразол-3-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке. МС (ISP): m/z=452,1 [M+H]+.
Пример 69
5-Этилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида формиат
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-этил-оксазол-4-карбоновой кислоты (CAS898227-93-5), следуя методу I, получили соединение, указанное в заголовке, после очистки на препаративной ВЭЖХ в виде бесцветной пены. МС (ISP): m/z=383,1 [М+Н]+.
Пример 70
5-Циклопропилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида формиат
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-циклопропилоксазол-4-карбоновой кислоты (CAS917828-31-0), следуя методу I, получили соединение, указанное в заголовке, после очистки на препаративной ВЭЖХ в виде бесцветной пены. МС (ISP): m/z=395,1 [М+Н]+.
Пример 71
4-Хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-хлор-1-дифторметил-1Н-пиразоле-3-карбоновой кислоты (CAS917828-31-0), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=438.1 [М+Н]+.
4-хлор-1-дифторметил-1Н-пиразол-3-карбоновая кислота была получена, как описано ниже:
а) 1-Дифторметил-1Н-пиразол-3-карбоновой кислоты метиловый эфир
Раствор 1-дифторметил-1Н-пиразол-3-карбоновой кислоты (CAS925179-02-8) (500 мг, 3,1 ммоль) в метаноле (18 мл) охлаждали до 0°С и обрабатывали серной кислотой (98%, 0,2 мл, 3,1 ммоль). Смесь нагревали до образования флегмы в течение 2 часов. Для выделения продукта реакции раствор охлаждали и концентрировали при пониженном давлении. Остаток распределяли между этилацетатом (25 мл) и водой (30 мл). Органический слой отделяли, промывали водой до тех пор, пока водная фаза не показала нейтральный рН. После высушивания над сульфатом натрия органический слой выпаривали при пониженном давлении. 1-Дифторметил-1Н-пиразол-3-карбоновой кислоты метиловый эфир был получен в виде бесцветной жидкости (535 мг, 99% теоретического), достаточно чистой для использования в следующей стадии без дополнительной очистки. МС (ISP): m/z=177,1 [М+Н]+.
б) 4-хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты метиловый эфир
Смесь 1-дифторметил-1Н-пиразол-3-карбоновой кислоты метилового эфира (535 мг, 3 ммоль) и N-хлорсукцинимида (1,22 г, 9,1 ммоль) в N,N-диметилформамиде (5 мл) нагревали при 50°С в течение ночи. Реакционную смесь охлаждали, наливали в воду (20 мл), затем экстрагировали этилацетатом. Органический слой отделяли, промывали водой, высушивали над сульфатом натрия, наконец, выпаривали при пониженном давлении. Желтоватое сырое вещество очищали хроматографией на силикагеле, используя смесь 3:1 циклогексана и этилацетата в качестве элюента. 4-Хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты метиловый эфир был получен в виде белого твердого вещества (540 мг, 84% теоретического). МС (ISP): m/z=209,9 [М]+.
в) 4-Хлор-1-дифторметил-1Н-пиразол-3-карбоновая кислота
Раствор 4-хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты метилового эфира (540 мг, 2,6 ммоль) в тетрагидрофуране (18 мл) обрабатывали при комнатной температуре раствором гидроксида лития (135 мг, 5,6 ммоль) в смеси 1:1 воды и метанола (12 мл). Через 1 час реакция была завершена, и растворители выпаривали при пониженном давлении. Остаток растворяли в воде (10 мл) и подкисляли соляной кислотой (2 М). В результате экстракции этилацетатом, высушивания органического слоя над сульфатом натрия и выпаривания при пониженном давлении получили белое твердое вещество (555 мг), которое растирали с пентаном (10 мл). Твердое вещество фильтровали, промывали пентаном и высушивали. После высушивания при пониженном давлении 4-хлор-1-дифторметил-1Н-пиразол-3-карбоновая кислота была получена в виде белого твердого вещества (477 мг, 95% теоретического). МС (ISP): m/z=195,0 [М-Н]-.
Пример 72
Пиридин-2,5-дикарбоновой кислоты 5-амид 2-{[3-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид}
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-карбамоилпиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=408,3 [М+Н]+.
Пример 73
N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-ацетамид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и уксусной кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=302,3 [М+Н]+.
Пример 74
(RS)-2,2-Дифторциклопропанкарбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и (RS)-2,2-дифторциклопропанкарбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=364,2 [М+Н]+.
Пример 75
1-Трифторметилциклопропанкарбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 1-трифторметилциклопропанкарбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде бесцветного твердого вещества. МС (ISP): m/z=396,1 [М+Н]+.
Пример 76
(R)-N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-3,3,3-трифтор-2-гидрокси-2-метилпропионамида 2,2,2-трифторацетат
а) {(R)-5,5-Дифтор-4-[2-фтор-5-((R)-3,3,3-трифтор-2-гидрокси-2-метилпропиониламино)-фенил]-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-карбаминовой кислоты трет-бутиловый эфир
Раствор (R)-3,3,3-трифтор-2-гидрокси-2-метилпропионовой кислоты (CAS44864-47-3) (20 мг, 0,125 ммоль) в N,N-диметилформамиде (1 мл), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU) (66 мг, 0,167 ммоль) и диизопропилэтиламина (35 мг, 0,267 ммоль) перемешивали при комнатной температуре в течение 45 минут. Затем добавляли [(R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил]-карбаминовой кислоты трет-бутиловый эфир (30 мг, 0,063 ммоль) (промежуточное соединение XXV-1), и перемешивание продолжали при комнатной температуре в течение ночи. Для выделения продукта реакции в неполную реакционную смесь добавляли муравьиную кислоту, смесь делили на две части и непосредственно впрыскивали на препаративную колонку ВЭЖХ, используя градиент: вода (+0,1% муравьиной кислоты)/ацетонитрил=от 90:10 до 5:95 в качестве элюента. {(R)-5,5-дифтор-4-[2-фтор-5-((R)-3,3,3-трифтор-2-гидрокси-2-метилпропиониламино)-фенил]-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-карбаминовой кислоты трет-бутиловый эфир был получен в виде бесцветного аморфного твердого вещества (8 мг, 25% теоретического). МС (ISP): m/z=500,2 [М+Н]+.
б) (R)-N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-3,3,3-трифтор-2-гидрокси-2-метилпропионамида 2,2,2-трифторацетат
Раствор {(R)-5,5-дифтор-4-[2-фтор-5-((R)-3,3,3-трифтор-2-гидрокси-2-метилпропиониламино)-фенил]-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-ил}-карбаминовой кислоты трет-бутилового эфира (8 мг, 0,016 ммоль) в 2,2,2-трифторуксусной кислоте перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь выпаривали при пониженном давлении и держали в высоком вакууме в течение ночи с получением соединения, указанного в заголовке, в виде желтого масла при количественном выходе. МС (ISP): m/z=400,1 [М+Н]+.
Пример 77
4-Хлор-1-этил-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-Хлор-1-этил-1Н-пиразол-3-карбоновой кислоты (CAS512810-20-7), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=416,3 [М+Н]+.
Пример 78
4-Хлор-1-(2,2,2-трифторэтил)-1Н-пиразол-3-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 4-Хлор-1-(2,2,2-трифтор-этил)-1Н-пиразол-3-карбоновой кислоты (CAS 1006448-63-0), следуя методу I, получили соединение, указанное в заголовке, в виде белого твердого вещества. МС (ISP): m/z=470,2 [М+Н]+.
Пример 79
2-Фторметилоксазол-4-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амида формиат
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 2-фторметилоксазол-4-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, после очистки препаративной ВЭЖХ в виде белого твердого вещества. МС (ISP): m/z=387,1 [М+Н]+.
2-Фторметилоксазол-4-карбоновая кислота была получена, как описано ниже:
а) 2-Фторметилоксазол-4-карбоновой кислоты метиловый эфир
Раствор метил-2-(хлорметил)оксазол-4-карбоксилата (CAS208465-72-9) (150 мг, 0,85 ммоль) в ацетонитриле (4,27 мл) обрабатывали тетра-н-бутиламмония фторидом (2,56 мл, 2,56 ммоль). Голубой раствор становился оранжевым и был оставлен на ночь при перемешивании при комнатной температуре. Для выделения продукта реакции реакционную смесь наливали в воду и экстрагировали два раза этилацетатом. Объединенные органические слои промывали рассолом, высушивали над сульфатом натрия и концентрировали при пониженном давлении. Сырое вещество очищали хроматографией на флэш-колонке NH2, используя градиент гептан/этилацетат=от 100/0 до 50/50 в качестве элюента. 2-Фторметил-оксазол-4-карбоновой кислоты метиловый эфир был получен в виде белого твердого вещества (64 мг, 47% теоретического). МС (ISP): m/z=160,1 [М+Н]+.
б) 2-Фторметилоксазол-4-карбоновая кислота
Способом, аналогичным описанному в примере 71в), в результате гидролиза 2-фторметилоксазол-4-карбоновой кислоты метилового эфира гидроксидом лития получили соединение, указанное в заголовке, в виде белого твердого вещества (70% теоретического). МС (ISP): m/z=144,1 [М-Н]+.
Пример 80
Фуран-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и фуран-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, после очистки препаративной ВЭЖХ. МС (ISP): m/z=354,4 [М+Н]+.
Пример 81
5-Нитрофуран-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-нитрофуран-2-карбоновой кислоты (CAS645-12-5), следуя методу I, получили соединение, указанное в заголовке, после очистки препаративной ВЭЖХ. МС (ISP): m/z=399,3 [М+Н]+.
Пример 82
(Е)-N-[3-((R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-3-фуран-2-илакриламид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и (R)-3-фуран-2-илакриловой кислоты, следуя методу I, получили соединение, указанное в заголовке, после очистки препаративной ВЭЖХ. МС (ISP): m/z=380,1 [М+Н]+.
Пример 83
5-Циано-1-оксипиридин-2-карбоновой кислоты [3-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-4-фторфенил]-амид
В результате конденсации (R)-4-(5-амино-2-фторфенил)-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-2-иламина (промежуточного соединения XI-1) и 5-циано-1-оксипиридин-2-карбоновой кислоты, следуя методу I, получили соединение, указанное в заголовке, в виде светло-желтого твердого вещества. МС (ISP): m/z=406,2 [М+Н]+.
5-Циано-1-оксипиридин-2-карбоновая кислота была получена, как описано ниже:
Суспензию 6-цианопиридин-2-карбоновой кислоты (100 мг, 0,68 ммоль) в ацетонитриле (1,5 мл) охлаждали до 0°С, затем обрабатывали гидропероксидом мочевины (133 мг, 1,42 ммоль) и ангидридом трифторуксусной кислоты (289 мг, 1,38 ммоль) в течение 64 часов при 0-4°С. Для выделения продукта реакции реакционную смесь наливали в раствор тиосульфата натрия (10% в воде, 10 мл) и перемешивали в течение 10 минут. После разбавления водой смесь фильтровали, и остаток промывали водой. Объединенные водные слои снова фильтровали, затем три раза экстрагировали дихлорметаном. Объединенные органические слои высушивали над сульфатом натрия и выпаривали с получением 6-цианопиридин-2-карбоновой кислоты в виде беловатого твердого вещества (42 мг, 38% теоретического). Дополнительная экстракция водного слоя смесью 9:1 дихлорметана и этанола дала после высушивания над сульфатом натрия и выпаривания еще одну чистую фракцию соединения, указанного в заголовке, в виде белого твердого вещества (11 мг, 10% теоретического). МС (ISP): m/z=165,2 [М+Н]+.