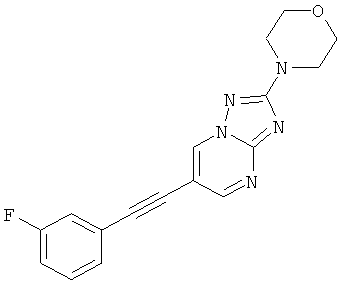
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ЭТИНИЛА
Вид РИД
Изобретение
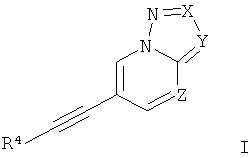
Настоящее изобретение относится к производным этинила формулы
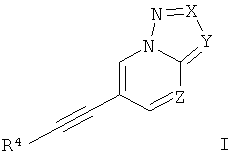
где
Х представляет собой N или C-R1;
Y представляет собой N или C-R2;
Z представляет собой СН или N;
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R1 представляет собой водород, низший алкил, низший алкокси, гидрокси, низший гидроксиалкил, низший циклоалкил или представляет собой гетероциклоалкил, возможно замещенный гидрокси или алкокси;
R2 представляет собой водород, CN, низший алкил или гетероциклоалкил;
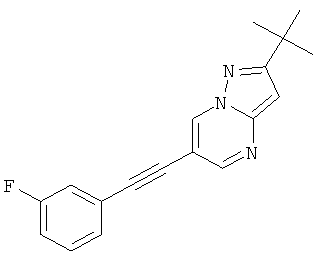
R и R' независимо друг от друга представляют собой водород или низший алкил;
или к их фармацевтически приемлемой соли или кислотно-аддитивной соли, к рацемической смеси, или к ей соответствующему энантиомеру и/или оптическому изомеру и/или стереоизомеру.
Было неожиданно обнаружено, что соединения общей формулы I являются позитивными аллостерическими модуляторами (РАМ, от positive allosteric modulators) метаботропного глутаматного рецептора подтипа 5 (mGIuR5, от metabotropic glutamate receptor subtype 5).
В центральной нервной системе (ЦНС) передача стимулов происходит через взаимодействие нейромедиатора, посылаемого нейроном, с нейрорецептором.
Глутамат является главным возбуждающим нейромедиатором в головном мозге и играет решающую роль в ряде функций центральной нервной системы (ЦНС). Рецепторы, зависящие от глутаматных стимулов, делят на две основные группы. Первую основную группу, а именно группу ионотропных рецепторов, образуют контролируемые лигандом ионные каналы. Метаботропные глутаматные рецепторы (mGluR) принадлежат ко второй основной группе и, кроме того, принадлежат семейству рецепторов, связанных с G-белками.
В настоящее время известно восемь разных типов этих рецепторов mGluR, и некоторые из них еще разделены на подтипы. На основании гомологии их последовательностей, механизмов передачи сигналов и селективности к агонистам эти восемь рецепторов могут быть подразделены на три подгруппы:
mGIuR1 и mGluR5 принадлежат к группе I, mGluR2 и mGluR3 принадлежат к группе II и mGluR4, mGluR6, mGluR7 и mGluR8 принадлежат к группе III.
Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, могут быть использованы для лечения или предотвращения острых и/или хронических неврологических нарушений, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти, туберозный склероз, а также хроническая и острая боль.
Другие состояния, которые можно лечить при этом, представляют собой ограниченную функцию мозга, вызванную операциями шунтирования или трансплантациями, недостаточное мозговое кровоснабжение, травмы спинного мозга, травмы головы, гипоксию, вызванную беременностью, остановку сердца и гипогликемию. Кроме того, состояниями, которые можно лечить, являются ишемия, хорея Хантингтона, боковой амиотрофический склероз (ALS, от amyotrophic lateral sclerosis), слабоумие, вызванное СПИДом, травмы глаз, ретинопатия, идиопатический паркинсонизм или лекарственный паркинсонизм, а также состояния, которые ведут к глутамат-недостаточным функциям, таким, например, как спазмы мышц, конвульсии, мигрени, недержание мочи, никотиновая зависимость, опиатная зависимость, тревога, рвота, дискинезия и депрессии.
Заболеваниями, которые полностью или частично опосредованы mGluR5, являются, например, острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Хантингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия, боль и наркотическая зависимость (Expert Opin. Ther. Patents (2002), 12(12), 1845-1852 doi: 10.1517/13543776.12.12.1845/
Новый способ разработки селективных модуляторов состоит в определении соединений, которые действуют посредством аллостерического механизма, модулирую рецептор путем связывания с сайтом, отличающимся от высоко консервативного ортостерического сайта связывания. Недавно появились позитивные аллостерические модуляторы mGluR5 в качестве новых фармацевтических объектов, предлагающих эту привлекательную альтернативу. Позитивные аллостерические модуляторы описаны, например в WO 008/151184, WO 2006/048771, WO 2006/129199 и WO 2005/044797 и в Molecular Pharmacology (1991), 40, 333-336; The Journal of Pharmacology and Experimental Therapeutics (2005) 313(1), 199-206.
Позитивные аллостерические модуляторы представляют собой соединения, которые непосредственно сами не активируют рецепторы, а заметно усиливают агонист-стимулируемые отклики, увеличивают активность и максимум эффективности. Связывание этих соединений увеличивает сродство глутамат-сайта агониста на его внеклеточном N-концевом участке связывания. Таким образом, позитивная аллостерическая модуляция представляет собой привлекательный механизм увеличения активации соответствующего физиологического рецептора. Существует дефицит селективных позитивных аллостерических модуляторов рецептора mGIuR5. Традиционные модуляторы рецептора mGIuR5 обычно не имеют достаточной растворимости в воде и показывают низкую биодоступность при пероральном введении. Следовательно, остается необходимость в соединениях, которые преодолевают эти недостатки и которые по существу представляют собой селективные позитивные аллостерические модуляторы рецептора mGIuR5.
Соединения формулы I отличаются ценными терапевтическими свойствами. Они могут быть использованы при лечении или предотвращении расстройств, связанных с позитивными аллостерическими модуляторами рецептора mGIuR5.
Наиболее предпочтительными показаниями для соединений, которые представляют собой позитивные аллостерические модуляторы, являются шизофрения и нарушение когнитивной деятельности.
Настоящее изобретение относится к соединениям формулы I и к их фармацевтически приемлемым солям, к этим соединениям в качестве фармацевтически активных веществ, к способам их изготовления, а также к применению при лечении или предотвращении заболеваний, связанных с позитивными аллостерическими модуляторами рецептора mGIuR5, таких как шизофрения и нарушение когнитивной деятельности, и к фармацевтическим композициям, содержащим соединения формулы I.
Следующие определения общих терминов, используемых в настоящем описании, применяются независимо от того, появляются ли рассматриваемые термины отдельно или в сочетании.
Как используется здесь, термин «низший алкил» обозначает насыщенную, т.е. алифатическую углеводородную группу, включающую неразветвленную или разветвленную углеродную цепь с 1-4 атомами углерода. Примерами «алкила» являются метил, этил, н-пропил, изопропил и трет-бутил.
Термин «алкокси» обозначает группу -O-R', где R' представляет собой низший алкил, как определено выше.
Термин «этинил» обозначает группу -C≡C-.
Термин «низший гидроксиалкил» обозначает низшие алкильные группы, как определено выше, где по меньшей мере один атом водорода замещен гидрокси.
Термин «низший циклоалкил» обозначает насыщенное углеродное кольцо, содержащее от 3 до 7 углеродных кольцевых атомов, например циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин «гетероцикпоалкил» обозначает насыщенное углеродное кольцо, где один или более чем один углеродный атом замещен кислородом или азотом, предпочтительно гетероатом представляет собой О. Примерами таких колец являются тетрагидропиран-2, 3 или 4-ил, пирролидинил, имидазолидинил, пиразолидинил, пиперидинил, пиперазинил или морфолинил.
Термин «6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота» включает следующие ароматические кольца: фенил, 2, 3- или 4-пиридинил или пиримидинил.
Термин «фармацевтически приемлемая соль» или «фармацевтически приемлемая кислотно-аддитивная соль» охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и подобные.
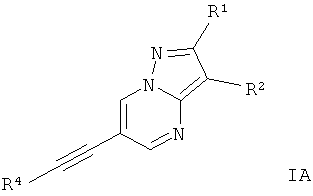
Воплощением изобретения являются соединения формулы I, где Х представляет собой C-R1, и Y представляет собой C-R2, и Z представляет собой N,

где
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R1 представляет собой водород, низший алкил, низший алкокси, гидрокси, низший гидроксиалкил, низший цикпоалкил или представляет собой гетероциклоалкил, возможно замещенный гидрокси или алкокси;
R2 представляет собой водород, CN, низший алкил или гетероциклоалкил;
R и R' независимо друг от друга представляют собой водород или низший алкил;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или ей соответствующий энантиомер и/или оптический изомер и/или стереоизомер.
Следующие соединения относятся к этим соединениям формулы IA:
6-Фенилэтинил-пиразоло[1,5-а]пиримидин,
2-Метил-6-фенилэтинил-пиразоло[1,5-а]пиримидин,
6-(2-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин,
6-(3-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин,
6-(4-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин,
2-Метил-6-пиридин-4-илэтинил-пиразоло[1,5-а]пиримидин,
2-Метил-6-п-толилэтинил-пиразоло[1,5-а]пиримидин,
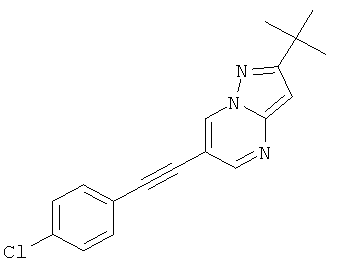
6-(4-Хлор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-(2-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-(3-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин,
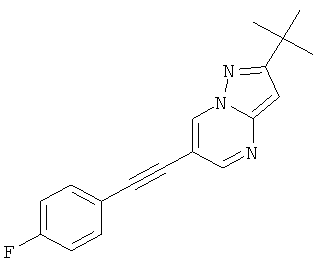
2-трет-Бутил-6-(4-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-пиридин-3-илэтинил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-пиридин-4-илэтинил-пиразоло[1,5-а]пиримидин,
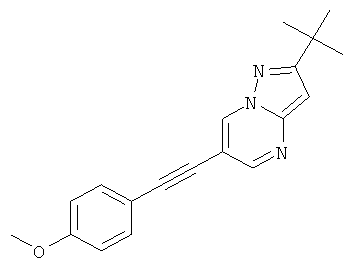
2-трет-Бутил-6-(4-метокси-фенилэтинил)-пиразоло[1,5-а]пиримидин,
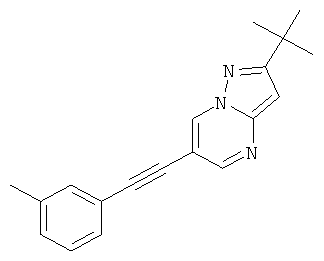
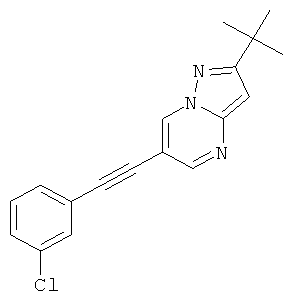
2-трет-Бутил-6-м-толилэтинил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-(3-метокси-фенилэтинил)-пиразоло[1,5-а]пиримидин,
2-Циклобутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-п-толилэтинил-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-(4-хлор-фенилэтинил)-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-(6-хлор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин,
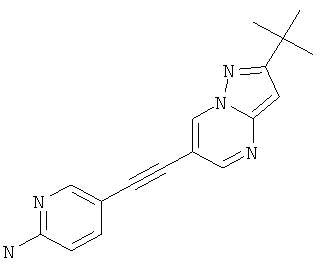
5-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-пиридин-2-иламин,
2-трет-Бутил-6-(5-хлор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин,
2-трет-Бутил-6-пиримидин-5-илэтинил-пиразоло[1,5-а]пиримидин,
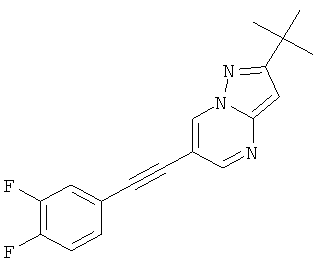
2-трет-Бутил-6-(3,4-дифтор-фенилэтинил)-пиразоло[1,5-а]пиримидин,
6-Фенилэтинил-2-(тетрагидро-пиран-4-ил)-пиразоло[1,5-а]пиримидин,
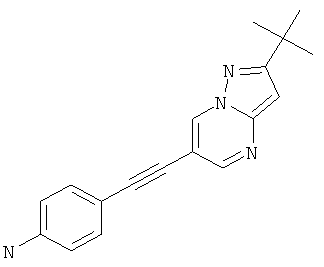
4-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин,
2-(6-Фенилэтинил-пиразоло[1,5-а]пиримидин-2-ил)-пропан-2-ол,
2-трет-Бутил-6-(5-фтор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин,
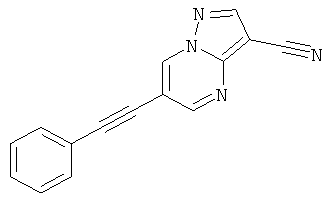
6-Фенилэтинил-пиразоло[1,5-а]пиримидин-3-карбонитрил,
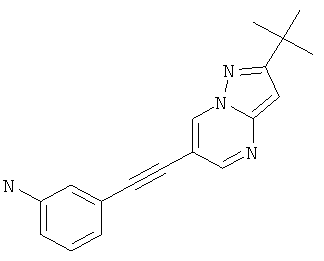
3-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин,
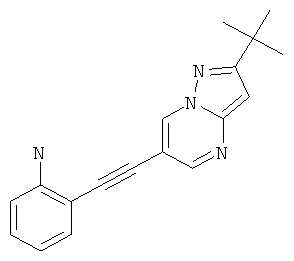
2-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин,
2-трет-Бутил-6-(2,5-дифтор-фенилэтинил)-пиразоло[1,5-а]пиримидин или
2-Изопропил-6-фенилэтинил-пиразоло[1,5-а]пиримидин.
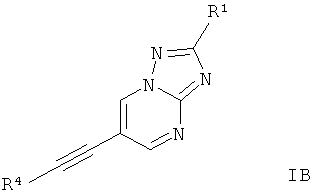
Дополнительным предпочтительным воплощением изобретения являются соединения формулы 1Б, где Х представляет собой C-R1, Y представляет собой N, и Z представляет собой СН,
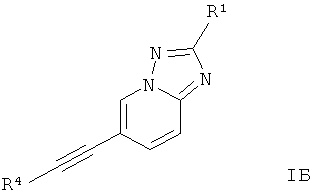
где
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R1 представляет собой водород, низший алкил, низший алкокси, гидрокси, низший гидроксиалкил, низший циклоалкил или представляет собой гетероциклоалкил, возможно замещенный гидрокси или алкокси;
R и R' независимо друг от друга представляют собой водород или низший алкил;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или ей соответствующий энантиомер и/или оптический изомер и/или стереоизомер.
Следующее соединение охватывает формула IБ:
6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин,
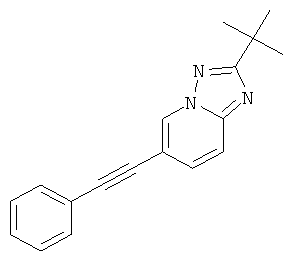
2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин или
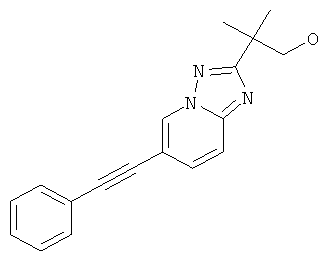
2-Метил-2-(6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-пропан-1-ол.
Дополнительным предпочтительным воплощением изобретения являются соединения формулы I, где Х представляет собой C-R1, и Y и Z представляют собой N,

где
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R1 представляет собой водород, низший алкил, низший алкокси, гидрокси, низший гидроксиалкил, низший циклоалкил или представляет собой гетероциклоалкил, возможно замещенный гидрокси или алкокси;
R и R' независимо друг от друга представляют собой водород или низший алкил;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или ей соответствующий энантиомер и/или оптический изомер и/или стереоизомер.
Следующее соединение охватывает формула IB:
6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин,
2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин,
2-трет-Бутил-6-(2,5-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин,
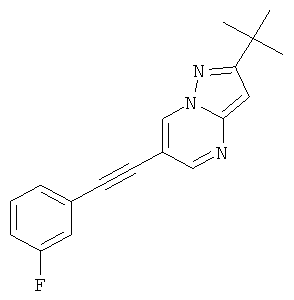
2-трет-Бутил-6-(3-фтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин,
2-трет-Бутил-6-(3,4-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин,
2-трет-Бутил-6-(5-хлор-пиридин-3-илэтинил)-[1,2,4]триазоло[1,5-а]пиримидин,
2-Морфолин-4-ил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин,
2-Морфолин-4-ил-6-м-толилэтинил-[1,2,4]триазоло[1,5-а]пиримидин,
6-(3-Фтор-фенилэтинил)-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидин,
6-(3-Хлор-фенилэтинил)-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидин или
6-Фенилэтинил-2-пирролидин-1-ил-[1,2,4]триазоло[1,5-а]пиримидин.
Дополнительным предпочтительным воплощением изобретения являются соединения формулы I, где Х представляет собой C-R1, Y представляет собой C-R2, и Z представляет собой СН,
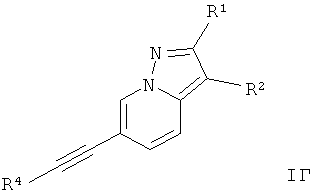
где
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R1 представляет собой водород, низший алкил, низший алкокси, гидрокси, низший гидроксиалкил, низший цикпоалкил или представляет собой гетероциклоалкил, возможно замещенный гидрокси или алкокси;
R2 представляет собой водород, CN, низший алкил или гетероциклоалкил;
R и R' независимо друг от друга представляют собой водород или низший алкил;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или ей соответствующий энантиомер и/или оптический изомер и/или стереоизомер.
Следующее соединение охватывает формула 1Г:
6-Фенилэтинил-пиразоло[1,5-а]пиридин или
2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиридин.
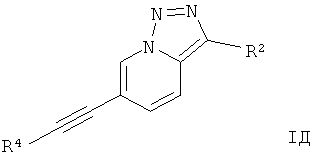
Дополнительным предпочтительным воплощением изобретения являются соединения формулы I, где Х представляет собой N, Y представляет собой C-R2, и Z представляет собой СН,
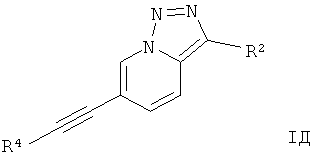
где
R4 представляет собой 6-членный ароматический заместитель, содержащий 0, 1 или 2 атома азота, возможно замещенный 1-3 группами, выбранными из галогена, низшего алкила, низшего алкокси или NRR';
R2 представляет собой водород, CN, низший алкил или гетероциклоалкил;
R и R' независимо друг от друга представляют собой водород или низший алкил;
или их фармацевтически приемлемая кислотно-аддитивная соль, рацемическая смесь, или ей соответствующий энантиомер и/или оптический изомер и/или стереоизомер.
Следующее соединение охватывает формула IД:
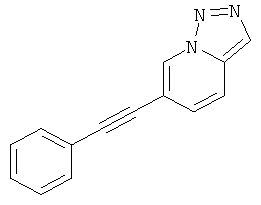
6-Фенилэтинил-[1,2,3]триазоло[1,5-а]пиридин.
Получение соединений формулы I по настоящему изобретению можно осуществлять последовательными или сходящимися синтетическими процессами. Синтезы соединений по изобретению показаны на следующих схемах 1-6. Навыки необходимые для проведения реакций и очистки полученных в результате продуктов известны квалифицированному специалисту в данной области. Заместители и индексы, используемые в следующем описании способов, имеют значения, приведенные выше.
Соединения формулы 1 могут быть изготовлены способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Соответствующие реакционные условия для отдельных стадий реакций известны квалифицированному специалисту в данной области. Последовательность реакций не ограничивается той, что изображена на схемах, однако в зависимости от исходных веществ и их соответствующей реакционной способности последовательность стадий реакций может быть легко изменена. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, или способами, описанными в ссылках, приведенных в описании или в примерах, или способами, известными в данной области.
Настоящие соединения формулы 1 и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например вариантами способов, описанных ниже, согласно которым
а) подвергают взаимодействию соединение формулы 2

с подходящим арил-ацетиленом формулы 3

до соединения формулы 1

где заместители описаны выше, или
б) подвергают взаимодействию соединение формулы 4
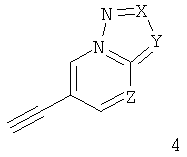
с соединением формулы 5
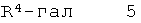
что дает соединение формулы I

где заместители описаны выше, и гал представляет собой галоген, выбранный из Cl, Br или I,
в) подвергают взаимодействию соединение формулы 6

с подходящим арил-ацетиленом формулы 3

до соединения формулы 1

где заместители описаны выше, и
при желании переводят полученные соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Кроме того, получение соединений формулы 1 описано более подробно на схемах 1-10 и в примерах 1-51.
Схема 1
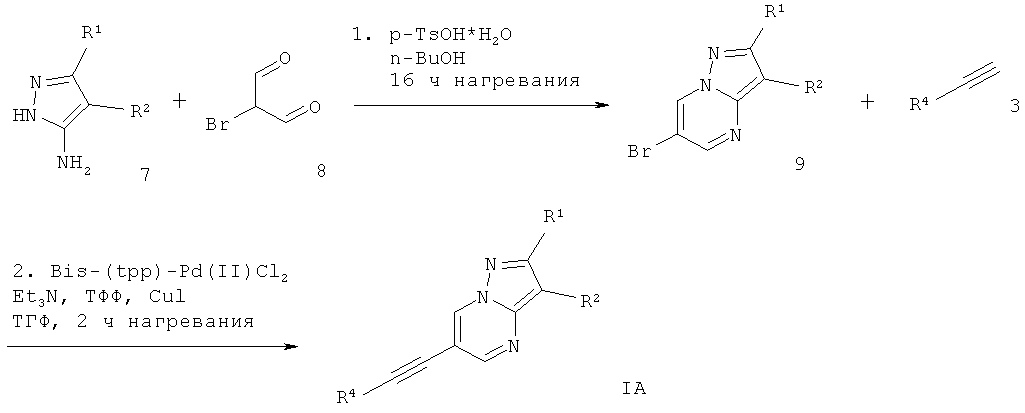
6-Этинил-пиразоло[1,5-а]пиримидин формулы IA может быть получен в ходе конденсации соответствующе замещенного 2Н-пиразол-3-иламина 7 и броммалонового альдегида 8 с моногидратом пара-толуолсульфоновой кислоты в растворителе, подобном н-бутанолу, что дает соответствующее производное 6-бром-пиразоло[1,5-а]пиримидина 9. Сочетание Соногашира производного 6-бром-пиразоло[1,5-а]пиримидина 9 с соответствующе замещенным арил-ацетиленом 3 дает требуемый 6-этинил-пиразоло[1,5-а]пиримидин формулы IA (схема 1).
Схема 2
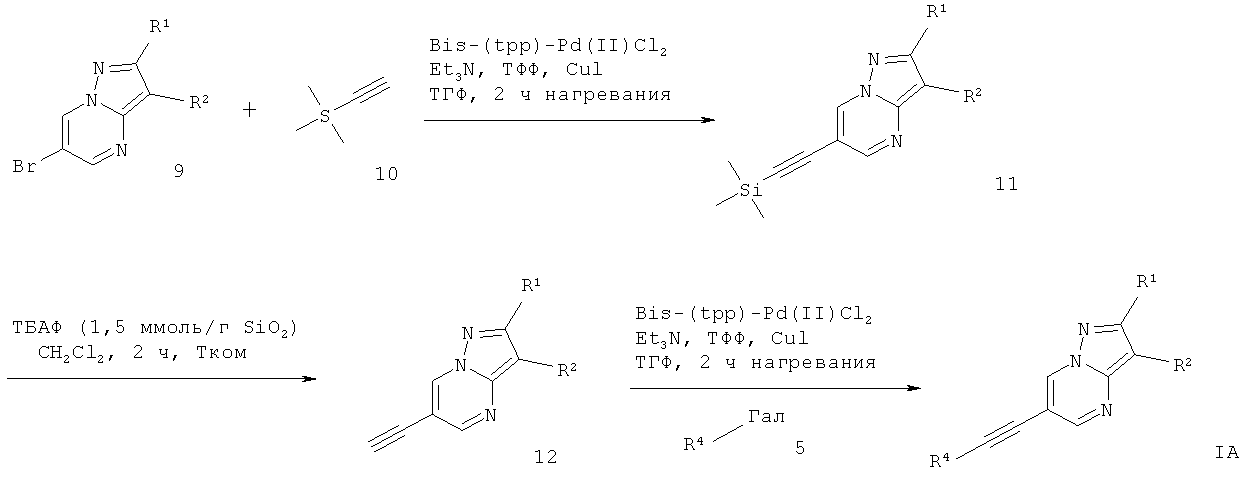
Альтернативно, промежуточное соединение 9 может взаимодействовать в ходе сочетания Соногашира с триметилсилил-ацетиленом 10, что дает производное 6-триметилсиланилэтинил-пиразоло[1,5-а]пиримидина 11. Депротонирование силил-группы с фторидом тетрабутиламмония (1,5 ммоль на силикагеле) в растворителе, подобном дихлорметану, дает соответствующее производное этинила 12. Сочетание Соногашира 12 с соответствующе замещенным арил-галогенидом дает требуемый 6-этинил-пиразоло[1,5-а]пиримидин формулы IА (схема 2). Эту реакционную последовательность альтернативно можно применять, соединяя производное триметилсиланила 11 с соответствующе замещенным арил-галогенидом в условиях реакции Соногашира с одновременным добавлением фторида тетрабутиламмония, который осуществляет депротонирование силила в реакционной смеси.
Схема 3

6-Этинил-[1,2,4]триазоло[1,5-а]пиридин формулы IБ может быть получен сочетанием Соногашира арил-ацетилена 3 с 2-амино-5-йодпиридином 13, что дает соответствующее производное 5-этинил-пиридин-2-иламина 14. Реакция 14 с (1,1-диметокси-алкил)-диметил-амином 15 в присутствии кислотного катализатора, подобного трифторуксусной кислоте, и растворителя, такого как этанол, дает соответствующий амидин 16, который обрабатывают гидрохлоридом гидроксиламина в растворителе, таком как i-PrOH : ТГФ (5:1 об/об), что дает требуемый N-гидроксиамидин 17. Проводят циклизацию этого соединения с трифторуксусным ангидридом в растворителе, таком как ТГФ, что дает требуемый 6-этинил-[1,2,4]триазоло[1,5-а]пиридин формулы IБ (схема 3).
Схема 4
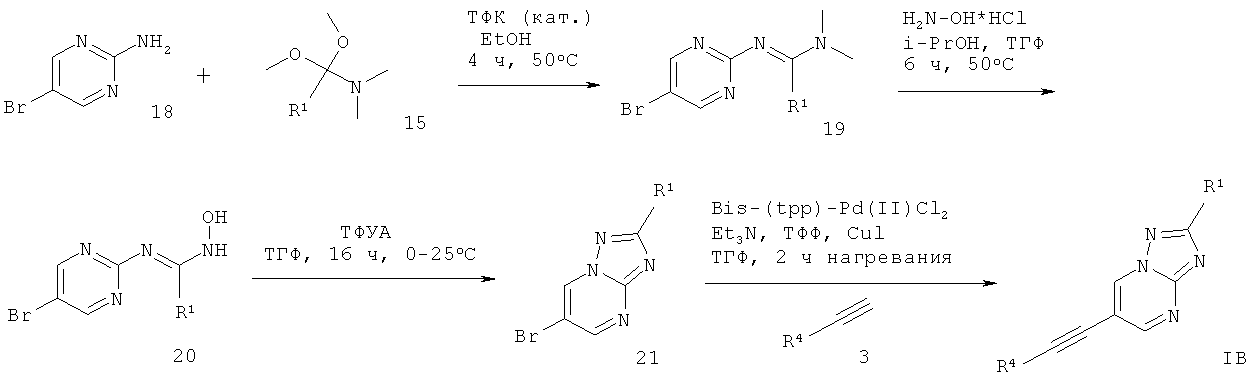
6-Этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы IB может быть получен подобным образом в ходе взаимодействия 2-амино-5-бромпиримидина 18 с (1,1-диметокси-алкил)-диметил-амином 15 в присутствии кислотного катализатора, подобного трифторуксусной кислоте, и растворителя, такого как этанол, что дает соответствующий амидин 19, который обрабатывают гидрохлоридом гидроксиламина в растворителе, таком как i-PrOH : ТГФ (5:1 об/об), что дает N-гидроксиамидин 20. Проводят циклизацию этого соединения с трифторуксусным ангидридом в растворителе, таком как ТГФ, что дает требуемый 6-этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы IB (схема 4).
Схема 5
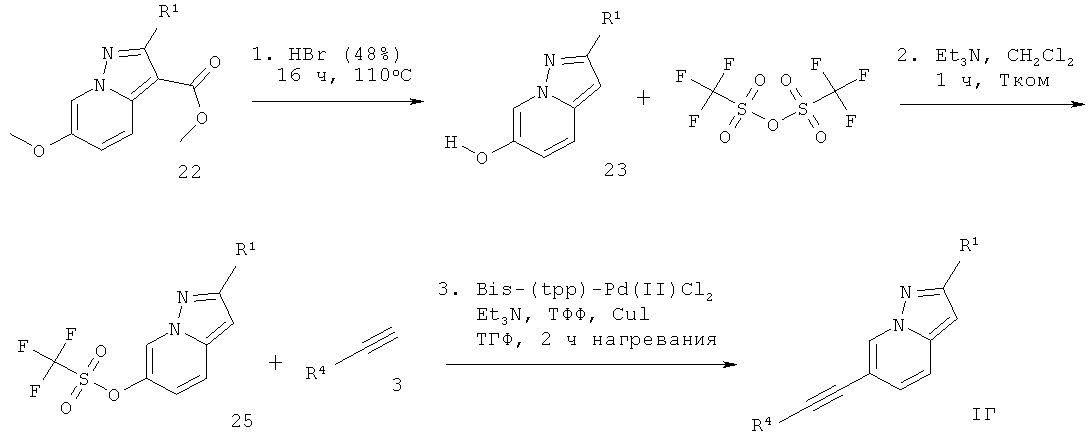
6-Этинил-пиразоло[1,5-а]пиридин формулы 1Г может быть получен в ходе декарбоксилирования соответствующе замещенного эфира 6-метокси-пиразоло[1,5-а]пиридин-3-карбоновой кислоты 22 с бромистоводородной кислотой, что дает соответствующее производное пиразоло[1,5-а]пиридин-6-ола 23, которое превращают в производное трифлата 25, используя трифторметансульфоновый ангидрид 24 и основание, такое как триэтиламин, в растворителе, таком как дихлорметан. Сочетание Соногашира 25 с арил-ацетиленом формулы 3 дает требуемый 6-этинил-пиразоло[1,5-а]пиридин формулы IГ (схема 5).
Схема 6

6-Этинил-[1,2,3]триазоло[1,5-а]пиридин формулы IД может быть получен в ходе взаимодействия соответствующе замещенного 5-галопиридин-альдегида или кетона 26 с гидразином в растворителе, таком как метанол, с последующим окислением с окислителем, таким как диоксид марганца, что дает соответствующее производное 6-бром-[1,2,3]триазоло[1,5-а]пиридина 27. Сочетание Соногашира 27 с арил-ацетиленом 3 дает требуемый 6-этинил-[1,2,3]триазоло[1,5-а]пиридин формулы IД (схема 6).
Схема 7
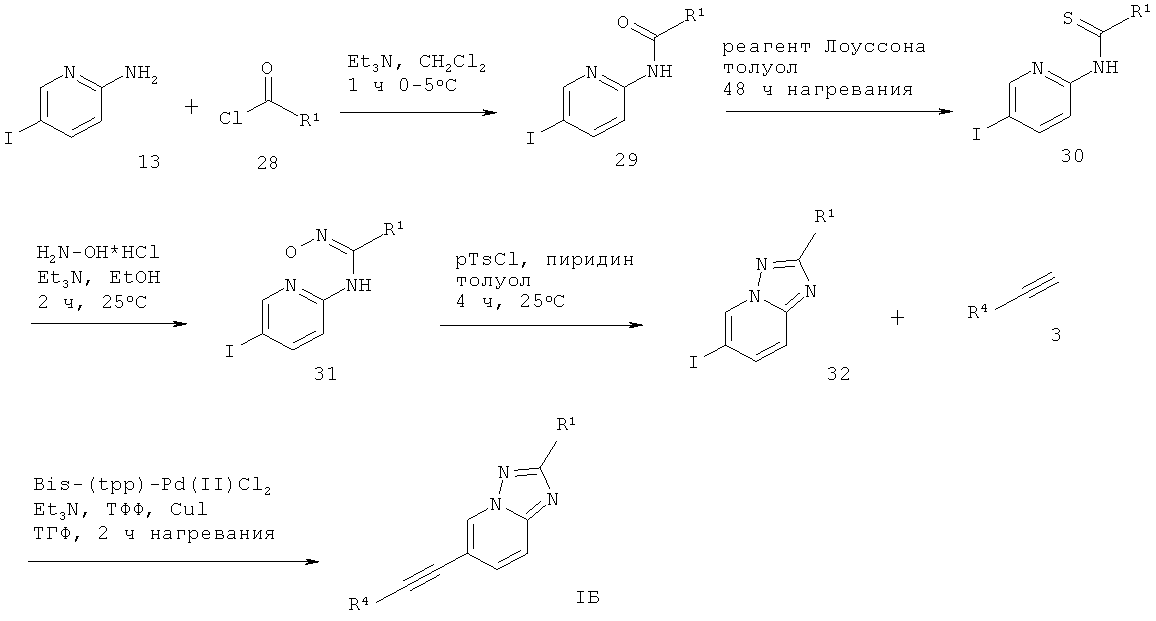
6-Этинил-[1,2,4]триазоло[1,5-а]пиридин формулы IБ может быть получен по реакции 2-амино-5-йодпиридина 13 с соответствующе замещенным хлорангидридом 28 в присутствии основания, такого как Et3N, в растворителе, подобном дихлорметану, что дает соответствующий N-(5-йод-пиридин-2-ил)-амид 29. Реакция 29 с реагентом Лоуссона в растворителе, подобном толуолу, дает соответствующий тиоамид 30. Взаимодействие 30 с гидрохлоридом гидроксиламина и основанием, таким как Et3N, в растворителе, подобном ЕtOH, дает соответствующий гидроксиамидин 31, который обрабатывают p-TsCl и пиридином в растворителе, подобном толуолу, что дает требуемый 6-йод-[1,2,4]триазоло[1,5-а]пиридин 32. Сочетание Соногашира 27 с соответствующе замещенным арил-ацетиленом 3 дает требуемый 6-этинил-[1,2,4]триазоло[1,5-а]пиридин формулы IБ (схема 7).
Схема 8

6-Этинил-пиразоло[1,5-а]пиридин формулы 1Г может быть получен в ходе образования 1-амино-3-бром-пиридиния 2,4-динитро-фенолята 35 из 3-бромпиридина 33 и 0-(2,4-динитро-фенил)-гидроксиламина 34 в растворителе, подобном ацетонитрилу. Взаимодействие производного пиридиния 35 с соответствующе замещенным метиловым эфиром пропиоловой кислоты 36 и основанием, таким как K2CO3, в растворителе, подобном ДМФА, дает соответствующий эфир 6-бром-пиразоло[1,5-а]пиридин-3-карбоновой кислоты 37, который декарбоксилируют с бромистоводородной кислотой, получая соответствующее производное 6-бром-пиразоло[1,5-а]пиридина 38. Сочетание Соногашира 38 с соответствующе замещенным арил-ацетиленом 3 дает требуемый 6-этинил-пиразоло[1,5-а]пиридин формулы IГ (схема 8).
Схема 9

6-Этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы 1 В может быть получен в ходе конденсации соответствующе замещенного 1H-1,2,4-триазол-5-амина 39 с 2-броммалоновым альдегидом 40 в AcOH, что дает соответствующий 6-бром-[1,2,4]триазоло[1,5-а]пиримидин 21. Сочетание Соногашира 21 с соответствующе замещенным арил-ацетиленом 3 дает требуемый 6-этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы 1 В (схема 9).
Схема 10
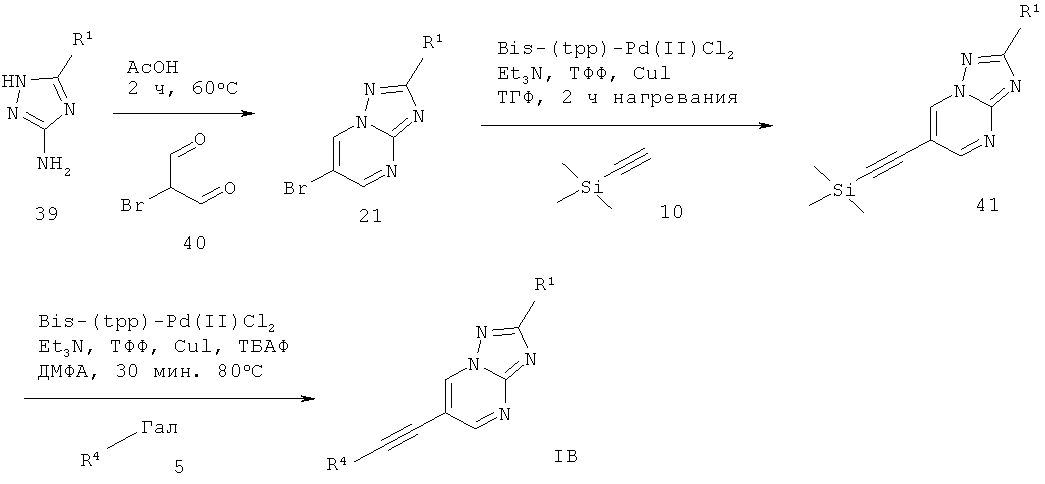
6-Этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы IB также может быть получен в ходе конденсации соответствующе замещенного Щ-1,2,4-триазол-5-амина 39 с 2-броммалоновым альдегидом 40 в AcOH, что дает соответствующий 6-бром-[1,2,4]триазоло[1,5-а]пиримидин 21. Сочетание Соногашира 21 с триметилсилил-ацетиленом 10 дает соответствующий 6-триметилсиланилэтинил-[1,2,4]триазоло[1,5-а]пиримидин 41. Сочетание Соногашира с отщеплением в реакционной смеси силильной группы 41 с соответствующе замещенным арил-галогенидом 5 дает требуемый 6-этинил-[1,2,4]триазоло[1,5-а]пиримидин формулы 1 В (схема 10).
Предпочтительно соединение формулы I, как описано здесь, а также его фармацевтически приемлемую соль применяют при лечении или предотвращении психоза, эпилепсии, шизофрении, болезни Альцгеймера, когнитивных расстройств и нарушений памяти, хронической и острой боли, ограниченной функции мозга, вызванной операциями шунтирования или трансплантациями, недостаточного мозгового кровоснабжения, травм спинного мозга, травм головы, гипоксии, вызванной беременностью, остановки сердца и гипогликемии, ишемии, хореи Хантингтона, бокового амиотрофического склероза (ALS), слабоумия, вызванного СПИДом, травм глаз, ретинопатии, идиопатического паркинсонизма или лекарственного паркинсонизма, спазм мышц, конвульсий, мигрени, недержания мочи, гастроэзофагеальной рефлюксной болезни, повреждения печени или печеночной недостаточности, вызванной либо лекарствами, либо болезнью, синдрома ломкой Х-хромосомы, синдрома Дауна, аутизма, никотиновой зависимости, опиатной зависимости, тревоги, рвоты, дискинезии, расстройств пищевого поведения, а именно булимии или нервной анорексии, и депрессий, особенно при лечении и предотвращении острых и/или хронических неврологических нарушений, тревоги, лечении хронической и острой боли, недержания мочи и ожирения.
Предпочтительными показаниями являются шизофрения и когнитивные расстройства.
Кроме того, настоящее изобретение относится к применению соединения формулы I, как описано здесь, а также его фармацевтически приемлемой соли для изготовления лекарства, предпочтительно для лечения и предотвращения вышеупомянутых расстройств.
Биологические анализ и данные:
Анализ внутриклеточной мобилизации Ca2+
Получали линию моноклональных клеток HEK-293, стабильно трансфицированных с кДНК, кодирующей рецептор mGlu5a человека; для работы с позитивными аллостерическими модуляторами mGlu5 отбирали клеточную линию с низкими уровнями экспрессии рецепторов и низкой конститутивной рецепторной активностью, что позволяло дифференцировать агонистическую активность в сравнении с ПАМ. Клетки культивировали в соответствии со стандартными протоколами (Freshney, 2000) в модифицированной по способу Дульбекко среде Игла с высоким содержанием глюкозы с добавлением 1 мМ глутамина, 10% (об/об) термоинактивированной бычьей телячьей сыворотки, пенициллина / стрептомицина, 50 мкг/мл гигромицина и 15 мкг/мл бластицидина (все клеточные культуры, реагенты и антибиотики получали от Invitrogen, Базель, Щвейцария).
Приблизительно за 24 часа до эксперимента 5×104 клетки/лунка высеивали на покрытые поли-D-лизином черные / с прозрачным дном 96-луночные планшеты. Клетки загружали с 2,5 мкМ Fluo - 4АМ в загрузочный буфер (1×HBSS, 20 мМ HEPES) в течение 1 часа при 37°С и промывали пять раз загрузочным буфером. Клетки переносили в Functional Drug Screening System 7000 (Hamamatsu, Париж, Франция) и добавляли 11 с половиной логарифмически последовательно разведенных растворов исследуемого соединения при 37°С, и клетки инкубировали в течение 10-30 минут с регистрацией флуоресценции в режиме реального времени. После этой стадии предварительной инкубации агонист L-глутамата добавляли в клетки при концентрации, соответствующей EC20 (обычно около 80 мкМ), с регистрацией флуоресценции в режиме реального времени, чтобы учесть суточные колебания в реакционной способности клеток, EC20 глутамата определяли непосредственно перед каждым экспериментом в ходе записи полной кривой доза - эффект глутамата.
Отклики измеряли как увеличение пика при флуоресценции за минусом основного (т.е. флуоресценция без добавления L-глутамата), приведенного к максимальному стимулирующему эффекту, полученному с насыщенными концентрациями L-глутамата. Графики строили с % максимального стимулирующего эффекта, используя XLfit, программу вычерчивания кривых, которая итерационно наносит данные, используя алгоритм Левенберга-Марквардта. Используемое уравнение анализа конкуренции одиночных сайтов представляло собой y=A+((B-A)/(1+((x/C)D))), где у представляет собой % максимального стимулирующего эффекта, А представляет собой минимальное значение y, В представляет собой максимальное значение y, С представляет собой ЕС50, x представляет собой log 10 концентрации конкурирующего соединения и D представляет собой наклон кривой (коэффициент Хилла). Из этих кривых рассчитывали EC50 (концентрация, при которой достигалась полумаксимальная стимуляция), коэффициент Хилла, а также максимальный отклик в % от максимального стимулирующего эффекта, полученного с насыщенными концентрациями L-глутамата.
Положительные сигналы, полученные в ходе предварительной инкубации с исследуемыми соединениями ПАМ (т.е. до применения EC20 концентрации L-глутамата), свидетельствовали об агонистической активности, отсутствие таких сигналов показывало нехватку агонистических активностей. Уменьшение сигнала наблюдалось после добавления EC20 концентрации L-глутамата, что свидетельствовало об ингибирующей активности исследуемого соединения.
В списке примеров ниже показаны соответствующие результаты для соединений, которые все имеют с EC50<500 нМ.
|
|
|
|
|
|
|
|
|
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в качестве лекарств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть ректальное введение, например в форме суппозиториев, или парентеральное, например в форме растворов для инъекций.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть переработаны с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; однако в зависимости от природы активного вещества носители обычно не требуется для мягких желатиновых капсул. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., могут быть использованы для водных инъекционных растворов водорастворимых солей соединений формулы (I), но, как правило, не являются необходимыми. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, ароматизаторы, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически ценные вещества.
Как упоминалось ранее, лекарства, содержащие соединение формулы (I) или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, также являются предметом настоящего изобретения, как и способ получения таких лекарств, при котором одно или более соединений формулы 1 или их фармацевтически приемлемых солей и, при желании, одно или более других терапевтически ценных веществ превращают в галеновую лекарственную форму вместе с одним или более чем одним терапевтически инертным носителем.
Как уже упоминалось ранее, применение соединений формулы (I) для получения лекарств, полезных при предотвращении и/или лечении вышеизложенных заболеваний также является предметом настоящего изобретения.
Дозировка может варьировать в широких пределах и, конечно, должна быть подобрана по индивидуальным потребностям в каждом конкретном случае. В общем, эффективная дозировка для перорального или парентерального введения находится в интервале 0,01-20 мг/кг/день, при дозировке 0,1-10 мг/кг/день, являющейся предпочтительной для всех описанных показаний. Суточная дозировка для взрослого человека весом 70 кг, соответственно, находится в интервале 0,7-1400 мг в день, предпочтительно между 7 и 700 мг в день.
Получение фармацевтических композиций, содержащих соединения по изобретению:
Таблетки следующего состава получают обычным способом:
|
Экспериментальный раздел:
Пример 1
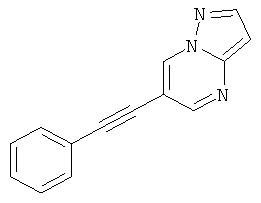
6-Фенилэтинил-пиразоло[1,5-а]пиримидин
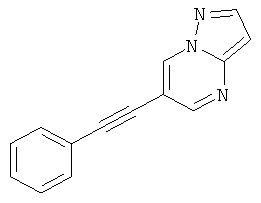
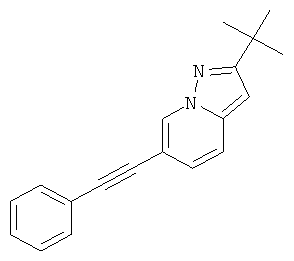
Бис-(трифенилфосфин)-палладия (II) дихлорид (27 мг, 0,04 ммоль) растворяли в 1 мл ТГФ. 6-Бром-пиразоло[1,5-а]пиримидин (150 мг, 0,76 ммоль) и фенилацетилен (130 мкл, 1,21 ммоль) добавляли при комнатной температуре. Триэтиламин (310 мкл, 2,3 ммоль), трифенилфосфин (6 мг, 0,023 ммоль) и иодид меди (I) (4 мг, 0,023 ммоль) добавляли и смесь перешивали в течение 2 часов при 65°С. Реакционную смесь охлаждали и экстрагировали насыщенным раствором NaHCO3 и два раза небольшим объемом дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии, непосредственно загружая дихлорметановые слои в колонку с силикагелем и элюируя гептаном : этилацетатом 100:0→50:50. Требуемое соединение получали в виде желтого твердого вещества (150 мг, 90%), MS: m/e=220,3 (M+H+).
Пример 2
2-Метил-6-фенилэтинил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, белое твердое вещество, MS: m/e=234,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и фенилацетилен.
Пример 3
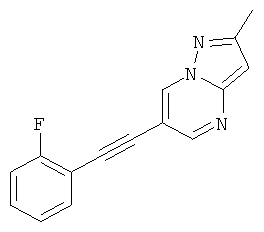
6-(2-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=252,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 1-этинил-2-фтор-бензола.
Пример 4
6-(3-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=252,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 1-этинил-3-фтор-бензола.
Пример 5
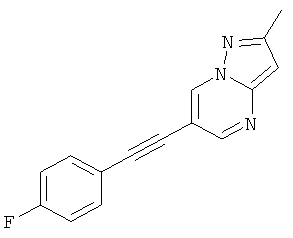
6-(4-Фтор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин
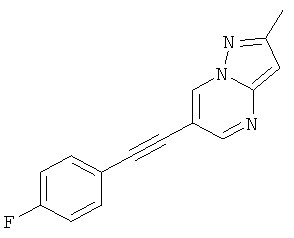
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=252,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 1-этинил-4-фтор-бензола.
Пример 6
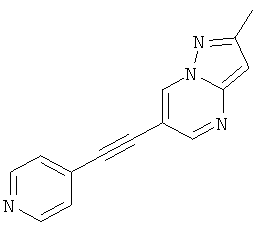
2-Метил-6-пиридин-4-илэтинил-пиразоло[1,5-а]пиримидин
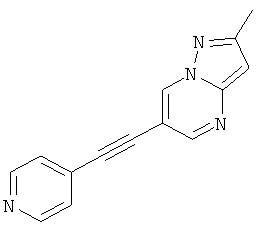
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=235,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 4-этинилпиридина.
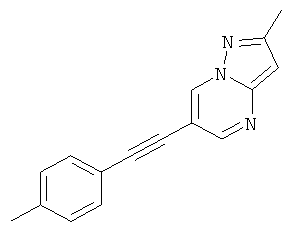
Пример 7
2-Метил-6-п-толилэтинил-пиразоло[1,5-а]пиримидин
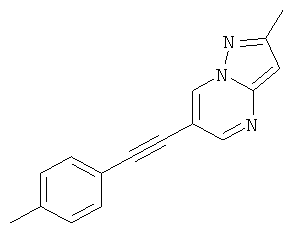
Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=248,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 4-этинилтолуола.
Пример 8
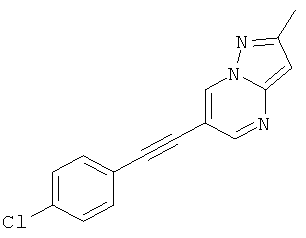
6-(4-Хлор-фенилэтинил)-2-метил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=268,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-метилпиразоло[1,5-а]пиримидина и 1-хлор-4-этинилбензола.
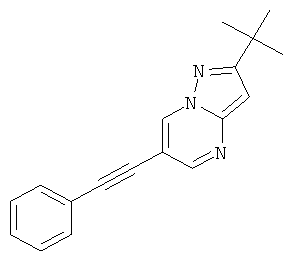
Пример 9
2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин
Стадия 1: 6-Бром-2-трет-бутил-пиразоло[1,5-а]пиримидин
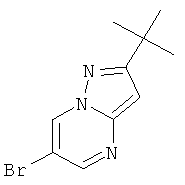
3-трет-Бутил-1H-пиразол-5-амин (9 г, 64,7 ммоль) растворяли в BuOH (100 мл). 2-Броммалоновый альдегид (9,76 г, 64,7 ммоль) и p-TsOH*H2O (615 мг, 3,23 ммоль) добавляли при комнатной температуре. Смесь перемешивали в течение 16 часов при 100°С. Реакционную смесь выпаривали досуха и остаток очищали с помощью флэш-хроматографии на силикагеле (120 г, 0% до 40% EtOAc в гептане) и кристаллизации с небольшим объемом диизопропилового эфира. Кристаллы промывали диизопропиловым эфиром и высушивали в течение 1 часа при 50°С и <20 мбар. Требуемое соединение получали в виде светло-желтого твердого вещества (9,5 г, выход 58%), MS: m/e=256,1/254,1 (M+H+).
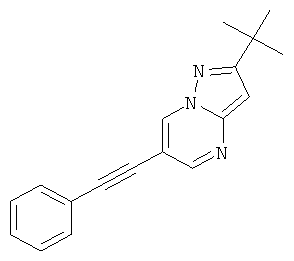
Стадия 2: 2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=276,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и фенилацетилена.
Пример 10
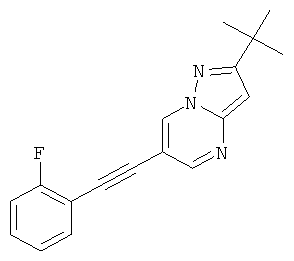
2-трет-Бутил-6-(2-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=294,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-2-фтор-бензола.
Пример 11
2-трет-Бутил-6-(3-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин
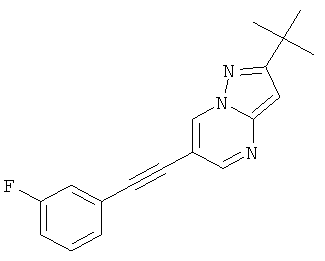
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=294,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-3-фтор-бензола.
Пример 12
2-трет-Бутил-6-(4-фтор-фенилэтинил)-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=294,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-4-фтор-бензола.
Пример 13
2-трет-Бутил-6-пиридин-3-илэтинил-пиразоло[1,5-а]пиримидин
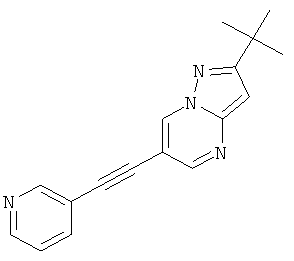
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=277,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 3-этинилпиридина.
Пример 14
2-трет-Бутил-6-пиридин-4-илэтинил-пиразоло[1,5-а]пиримидин
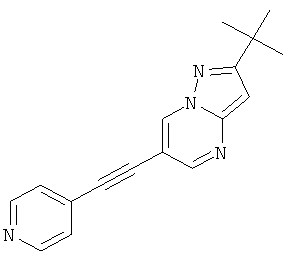
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=277,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 4-этинилпиридина.
Пример 15
2-трет-Бутил-6-(4-метокси-фенилэтинил)-пиразоло[1,5-а]пиримидин
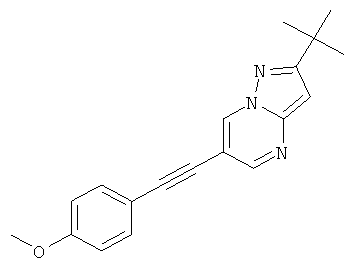
Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=306,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-4-метоксибензола.
Пример 16
2-трет-Бутил-6-м-толилэтинил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=290,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-3-метилбензола.
Пример 17
2-трет-Бутил-6-(3-метокси-фенилэтинил)-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=306,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-3-метоксибензола.
Пример 18
2-Циклобутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин

Стадия 1: 6-Бром-2-циклобутил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=254,0/252,1 (M+H+), может быть получено в соответствии с общим методом примера 9, стадия 1, из 5-циклобутил-1H-пиразол-3-иламина и 2-броммалонового альдегида.
Стадия 2: 2-Циклобутил-6-фенилэтинил-пиразоло[1,5-а]пиримидин
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=274,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-циклобутил-пиразоло[1,5-а]пиримидина (пример 18, стадия 1) и фенилацетилена.
Пример 19
2-трет-Бутил-6-п-толилэтинил-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=290,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-4-метилбензола.
Пример 20
2-трет-Бутил-6-(4-хлор-фенилэтинил)-пиразоло[1,5-а]пиримидин
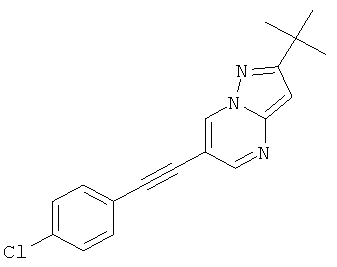
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=310,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 1-этинил-4-хлорбензола.
Пример 21
2-трет-Бутил-6-(6-хлор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин

Стадия 1: 2-трет-Бутил-6-триметилсиланилэтинил-пиразоло[1,5-а]пиримидин
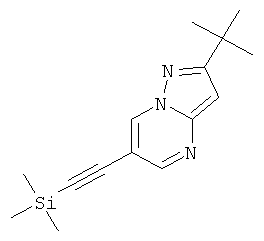
Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=272,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и триметилсилилацетилена.
Стадия 2: 2-трет-Бутил-6-этинил-пиразоло[1,5-а]пиримидин

2-трет-Бутил-6-триметилсиланилэтинил-пиразоло[1,5-а]пиримидин (пример 21, стадия 1) (2,4 г, 8,85 ммоль) растворяли в дихлорметане (10 мл) и фторид тетрабутиламмония на силикагеле (7,1 г, 10,6 ммоль, 1,5 ммоль/г) добавляли при комнатной температуре. Смесь перемешивали в течение 2 часов при комнатной температуре и очищали с помощью флэш-хроматографии, непосредственно загружая смесь в 70 г силикагелевую колонку и элюируя гептаном: этилацетатом 100:0→40:60. Требуемое соединение получали в виде светло-желтого твердого вещества (1,45 г, выход 83%), MS: m/e=200,2 (M+H+).
Стадия 3: 2-трет-Бутил-6-(6-хлор-пиридин-3-илэтинил)-пиразоло[1,5-a]пиримидин
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=311,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 2-хлор-5-йодпиридина.
Пример 22
5-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-пиридин-2-иламин

Указанное в заголовке соединение, твердое вещество белого оттенка, MS: m/e=292,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 5-йодпиридин-2-амина.
Пример 23
2-трет-Бутил-6-(5-хлор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин
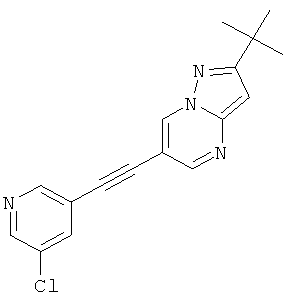
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=311,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 3-бром-5-хлорпиридина.
Пример 24
2-трет-Бутил-6-пиримидин-5-илэтинил-пиразоло[1,5-а]пиримидин
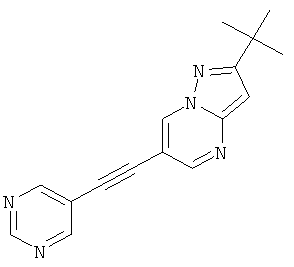
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=278,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 3-бромпиримидина.
Пример 25
2-трет-Бутил-6-(3,4-дифтор-фенилэтинил)-пиразоло[1,5-а]пиримидин
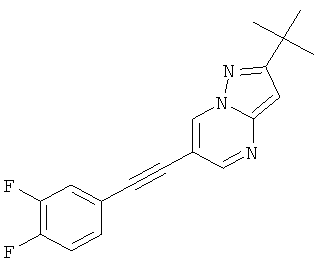
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=312,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 1,2-дифтор-4-йодбензола.
Пример 26
6-Фенилэтинил-2-(тетрагидро-пиран-4-ил)-пиразоло[1,5-а]пиримидин

Стадия 1: 5-(Тетрагидро-пиран-4-ил)-2H-пиразол-3-иламин

Указанное в заголовке соединение может быть получено в соответствии с общим методом, описанным в заявке на патент WO 2008001070 (пример 114).
Стадия 2: 6-Бром-2-(тетрагидро-пиран-4-ил)-пиразоло[1,5-a]пиримидин
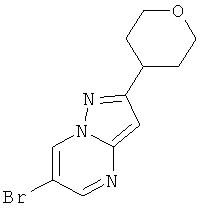
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=284,0 (M+H+), может быть получено в соответствии с общим методом примера 9, стадия 1, из 5-(тетрагидро-пиран-4-ил)-2H-пиразол-3-иламина (пример 26, стадия 1) и 2-броммалонового альдегида.
Стадия 3: 6-Фенилэтинил-2-(тетрагидро-пиран-4-ил)-пиразоло[1,5-а]пиримидин
Указанное в заголовке соединение, серое твердое вещество, MS: m/e=304,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-(тетрагидро-пиран-4-ил)-пиразоло[1,5-а]пиримидина (пример 26, стадия 2) и фенилацетилена.
Пример 27
4-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин

Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=291,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 4-этиниланилина.
Пример 28
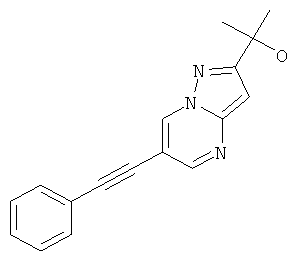
2-(6-Фенилэтинил-пиразоло[1,5-а]пиримидин-2-ил)-пропан-2-ол
Стадия 1: Метиловый эфир 6-бром-пиразоло[1,5-а]пиримидин-2-карбоновой кислоты
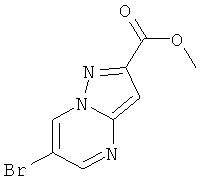
Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=256,0/254,1 (M+H+), может быть получено в соответствии с общим методом примера 9, стадия 1, из метил 5-амино-1H-пиразол-3-карбоксилата и 2-броммалонового альдегида.
Стадия 2: Метиловый эфир 6-фенилэтинил-пиразоло[1,5-а]пиримидин-2-карбоновой кислоты
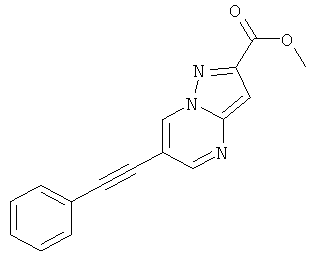
Указанное в заголовке соединение, серое твердое вещество, MS: m/e=278,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из метилового эфира 6-бром-пиразоло[1,5-а]пиримидин-2-карбоновой кислоты (пример 28, стадия 1) и фенилацетилена.
Стадия 3: 2-(6-Фенилэтинил-пиразоло[1,5-а]пиримидин-2-ил)-пропан-2-ол
Метиловый эфир 6-фенилэтинил-пиразоло[1,5-а]пиримидин-2-карбоновой кислоты (пример 28, стадия 2) (60 мг, 0,22 ммоль) растворяли в 5 мл ТГФ и охлаждали до 0-5°С. Раствор метилмагний хлорида (150 мкл, 0,45 ммоль, 3 н в ТГФ) добавляли по каплям при 0-5°С. Реакционную смесь перемешивали в течение 30 минут при 0-5°С. Добавляли воду и смесь экстрагировали два раза этилацетатом. Органические экстракты высушивали с сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (гептан : EtOAc 100:0→70:30) и суспендировали в Et2O. Требуемое соединение получали в виде светло-коричневого твердого вещества (7 мг, выход 12%), MS: m/e=278,1 (M+H+).
Пример 29
2-трет-Бутил-6-(5-фтор-пиридин-3-илэтинил)-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=295,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 3-бром-5-фторбензола.
Пример 30
6-Фенилэтинил-пиразоло[1,5-а]пиримидин-3-карбонитрил

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=245,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-пиразоло[1,5-а]пиримидин-3-карбонитрила и фенилацетилена.
Пример 31
6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин
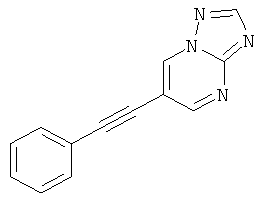
Стадия 1: 5-Фенилэтинил-пиридин-2-иламин
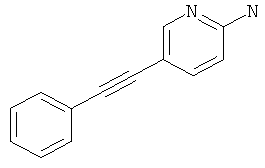
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=195,2 (М+Н+), может быть получено в соответствии с общим методом примера 1 из 2-амино-5-йодпиридина и фенилацетилена.
Стадия 2: 6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=220,3 (M+H+), может быть получено в соответствии с общим методом, описанным в заявке на патент WO 2007059257 (страница 109, стадии А, В и С), исходя из 5-фенилэтинил-пиридин-2-иламина (пример 31, стадия 1).
Пример 32
6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин
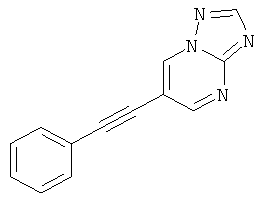
Стадия 1: 6-Бром-[1,2,4]триазоло[1,5-а]пиримидин
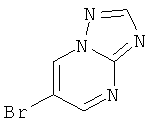
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=201,0/199,2 (M+H+), может быть получено в соответствии с общим методом, описанным в заявке на патент WO 2007059257 (страница 109, стадии А, В и С), исходя из 2-амино-5-бромпиримидина.
Стадия 2: 6-Фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=221,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-[1,2,4]триазоло[1,5-a]пиримидина (пример 32, стадия 1) и фенилацетилена.
Пример 33
6-Фенилэтинил-пиразоло[1,5-а]пиридин

Стадия 1: Пиразоло[1,5-а]пиридин-6-ол
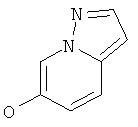
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=135,1 (M+H+), может быть получено в соответствии с общим методом, описанным в ЕР 1972628.
Стадия 2: Пиразоло[1,5-а]пиридин-6-иловый эфир трифтор-метансульфоновой кислоты

Пиразоло[1,5-а]пиридин-6-ол (пример 22, стадия 1) (200 мг, 1,49 ммоль) растворяли в дихлорметане (10 мл), и триэтиламин (200 мкл, 1,49 ммоль) и ангидрид трифторметансульфоновой кислоты (250 мкл, 1,49 ммоль) добавляли при 0-5°С. Смесь перемешивали в течение 1 часа при комнатной температуре и затем экстрагировали насыщенным раствором NaHCO3 и два раза дихлорметаном. Органические слои экстрагировали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали досуха. Требуемое соединение получали в виде белого твердого вещества (400 мг, количественный), MS: m/e=267,0 (М+Н+).
Стадия 3: 6-Фенилэтинил-пиразоло[1,5-а]пиридин
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=219,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из пиразоло[1,5-а]пиридин-6-илового эфира трифтор-метансульфоновой кислоты (пример 33, стадия 2) и фенилацетилена.
Пример 34
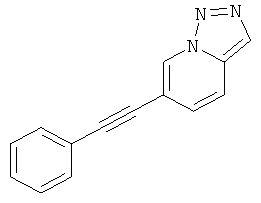
6-Фенилэтинил-[1,2,3]триазоло[1,5-а]пиридин
Стадия 1: 6-Бром-[1,2,3] триазоло[1,5-а]пиридин
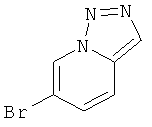
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=200,1/198,0 (M+H+), может быть получено в соответствии с общим методом, описанным у В. Abarca et al. / Tetrahedron 64 (2008) 3794-3801.
Стадия 2: 6-Фенилэтинил-[1,2,3]триазоло[1,5-а]пиридин
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=220,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-[1,2,3]триазоло[1,5-а]пиридина (пример 34, стадия 1) и фенилацетилена.
Пример 35
3-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=291,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 3-этиниланилина.
Пример 36
2-(2-трет-Бутил-пиразоло[1,5-а]пиримидин-6-илэтинил)-фениламин

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=291,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиримидина (пример 9, стадия 1) и 2-этиниланилина.
Пример 37
2-трет-Бутил-6-(2,5-дифтор-фенилэтинил)-пиразоло[1,5-а]пиримидин

Указанное в заголовке соединение, белое твердое вещество, MS: m/e=312,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-этинил-пиразоло[1,5-а]пиримидина (пример 21, стадия 2) и 1,4-дифтор-2-йодбензола.
Пример 38
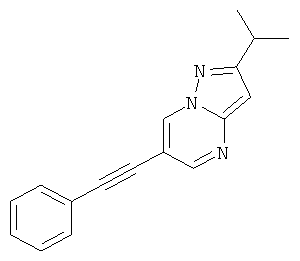
2-Изопропил-6-фенилэтинил-пиразоло[1,5-а]пиримидин
Стадия 1: 6-Бром-2-изопропил-пиразоло[1,5-а]пиримидин
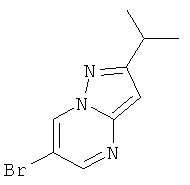
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=240,2/242,2 (M+H+), может быть получено в соответствии с общим методом примера 1, стадия 1, из 5-изопропил-2H-пиразол-3-иламина.
Стадия 2: 2-Изопропил-6-фенилэтинил-пиразоло[1,5-а]пиримидин
Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=245,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-изопропил-пиразоло[1,5-а]пиримидина (пример 38, стадия 1) и фенилацетилена.
Пример 39
2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин

Стадия 1: N-(5-Йод-пиридин-2-ил)-2,2-диметил-пропионамид

5-Йодпиридин-2-амин (5 г, 22,7 ммоль) растворяли в 50 мл дихлорметана и Et3N (6,3 мл, 45,5 ммоль, 2 эквив.) добавляли при комнатной температуре. Смесь охлаждали до 0-5°С и пивалоилхлорид (3,4 мл, 27,3 ммоль, 1,2 эквив.) добавляли по каплям. Реакционную смесь перемешивали в течение 1 часа при 0-5°С. Добавляли насыщенный раствор NaHCO3 и смесь экстрагировали дихлорметаном. Органические экстракты высушивали с сульфатом натрия, фильтровали и выпаривали досуха. Требуемый N-(5-йодпиридин-2-ил)пиваламид (7,34 г, выход 99,8%) получали в виде коричневого масла, MS: m/e=305,0 (M+H+).
Стадия 2: N-(5-Йод-пиридин-2-ил)-2,2-диметил-тиопропионамид
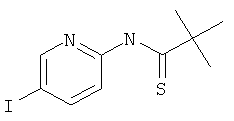
N-(5-Йод-пиридин-2-ил)-2,2-диметил-пропионамид (пример 39, стадия 1) (5,8 г, 19,1 ммоль) растворяли в 30 мл толуола и реагент Лоуссона (7,7 г, 19,1 ммоль, 1 эквив.) добавляли при комнатной температуре. Реакционную смесь перемешивали в течение 48 часов при 110°С. Неочищенный продукт очищали с помощью флэш-хроматографии, непосредственно загружая охлажденную толуольную реакционную смесь в 300 г силикагелевую колонку и элюируя гептаном : этилацетатом 100:0→80:20. Требуемый N-(5-йод-пиридин-2-ил)-2,2-диметил-тиопропионамид получали в виде желтого масла (5,1 г, выход 75%), MS: m/e=321,0 (M+H+).
Стадия 3: N-Гидрокси-N'-(5-йод-пиридин-2-ил)-2,2-диметил-пропионамид
 .
.
N-(5-Йод-пиридин-2-ил)-2,2-диметил-тиопропионамид (пример 39, стадия 2) (5,1 г, 15,9 ммоль) растворяли в 50 мл EtOH и Et3N (2,9 мл, 20,7 ммоль, 1,3 эквив.) и гидрохлорид гидроксиламина (1,3 г, 19,1 ммоль, 1,2 эквив.) добавляли при комнатной температуре. Смесь перемешивали в течение 2 часов при комнатной температуре. Суспензию разбавляли 100 мл воды и фильтровали. Кристаллы промывали водой и высушивали в течение 2 часов при 50°С и <10 мбар. Требуемый N-гидрокси-N'-(5-йод-пиридин-2-ил)-2,2-диметил-пропионамид (4,35 г, выход 86%) получали в виде белого твердого вещества, MS: m/e=319,9 (M+H+).
Стадия 4: 2-трет-Бутил-6-йод-[1,2,4]триазоло[1,5-а]пиридин

N-Гидрокси-N'-(5-йод-пиридин-2-ил)-2,2-диметил-пропионамид (пример 39, стадия 3) (2,8 г, 8,77 ммоль) суспендировали в 15 мл толуола и пиридина (2,8 мл, 35,1 ммоль, 4 эквив.). Смесь охлаждали до 0-5°С и добавляли п-толуолсульфонилхлорид (6,7 г, 35,1 ммоль, 4 эквив.). Реакционную смесь перемешивали в течение 1 часа при 0-5°С и 4 часов при комнатной температуре. Реакционную смесь экстрагировали насыщенным раствором NaHCO3 и два раза небольшим объемом дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии, непосредственно загружая дихлорметановые слои в 20 г силикагелевую колонку и элюируя гептаном: этилацетатом 100:0→0:100. Требуемый 2-трет-бутил-6-йод-[1,2,4]триазоло[1,5-a]пиридин (2 г, выход 76%) получали в виде светло-желтого масла, MS: m/e=302,1 (M+H+).
Стадия 5: 2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=276,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-трет-бутил-6-йод-[1,2,4]триазоло[1,5-а]пиридина (пример 39. стадия 4) и фенилацетилена.
Пример 40
2-Метил-2-(6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-пропан-1-ол

Стадия 1: 3-Ацетокси-2,2-диметил-пропионовая кислота

Раствор 3-гидрокси-2,2-диметил-пропионовой кислоты (1,5 г, 12,69 ммоль) в 5 мл ацетилхлорида нагревали при 80°С в атмосфере азота в течение 2 часов. Избыток ацетилхлорида выпаривали при пониженном давлении. Полученный в результате остаток растворяли в дихлорметане и промывали водой. Органический слой отделяли, высушивали и выпаривали, чтобы получить требуемую 3-ацетокси-2,2-диметил-пропионовую кислоту (1,65 г, выход 81%) в виде бесцветной жидкости.
Стадия 2: 2-Хлоркарбонил-2-метил-пропиловый эфир уксусной кислоты
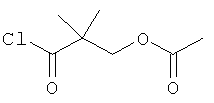
К раствору 3-ацетокси-2,2-диметил-пропионовой кислоты (пример 40, стадия 1) (2,2 г, 13,75 ммоль) в CH2Cl2 (25 мл) добавляли оксалилхлорид (2,62 мл, 27,50 ммоль) и 2-4 капли ДМФА и перемешивали при 25°С в течение 3 часов. Растворитель выпаривали и полученный в результате 2-хлоркарбонил-2-метил-пропиловый эфир уксусной кислоты (2,4 г) непосредственно использовали на следующей стадии без очистки.
Стадия 3: 2-(5-Йод-пиридин-2-илкарбамоил)-2-метил-пропиловый эфир уксусной кислоты
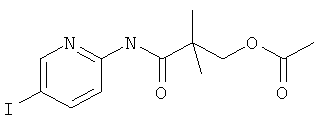
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=363,2 (M+H+), может быть получено в соответствии с общим методом примера 39, стадия 1, из 2-амино-5-йодпиридина и 2-хлоркарбонил-2-метил-пропилового эфира уксусной кислоты (пример 40, стадия 2).
Стадия 4: 2-(5-Йод-пиридин-2-илтиокарбамоил)-2-метил-пропиловый эфир уксусной кислоты

Указанное в заголовке соединение, MS: m/e=379,4 (M+H+), может быть получено в соответствии с общим методом примера 39, стадия 2, из 2-(5-йод-пиридин-2-илкарбамоил)-2-метил-пропилового эфира уксусной кислоты (пример 40, стадия 3).
Стадия 5: 2-[N-гидрокси-N'-(5-йод-пиридин-2-ил)-карбамимидоил]-2-метил-пропиловый эфир уксусной кислоты
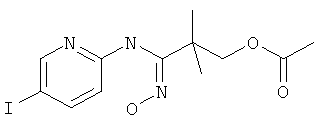
Указанное в заголовке соединение, MS: m/e=378,0 (M+H+), может быть получено в соответствии с общим методом примера 39, стадия 3, из 2-(5-йод-пиридин-2-илтиокарбамоил)-2-метил-пропилового эфира уксусной кислоты (пример 40, стадия 4).
Стадия 6: 2-(6-Йод-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-2-метил-пропиловый эфир уксусной кислоты
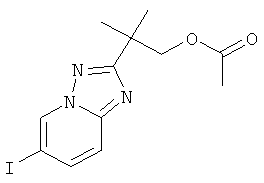
Указанное в заголовке соединение, белое твердое вещество, MS: m/e=360,0 (M+H+), может быть получено в соответствии с общим методом примера 39, стадия 4, из 2-[N-гидрокси-N'-(5-йод-пиридин-2-ил)-карбамимидоил]-2-метил-пропилового эфира уксусной кислоты (пример 40, стадия 5).
Стадия 7: 2-(6-Йод-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-2-метил-пропан-1-ол

Раствор 2-(6-йод-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-2-метил-пропилового эфира уксусной кислоты (пример 40, стадия 6) (750 мг, 2,09 ммоль) и K2CO3 (576 мг, 4,18 ммоль, 2 эквив.) в МеОН (8 мл) перемешивали при 25°С в течение 2 часов. Растворитель выпаривали и полученный в результате неочищенный продукт очищали с помощью колоночной хроматографии. Требуемый 2-(6-йод-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-2-метил-пропан-1-ол (662 мг, выход 91%) получали в виде белого твердого вещества, MS: m/e=318,0 (M+H+).
Стадия 8: 2-Метил-2-(6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-пропан-1-ол

Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=292,0 (M+H+), может быть получено в соответствии с общим методом примера 1 из 2-(6-йод-[1,2,4]триазоло[1,5-а]пиридин-2-ил)-2-метил-пропан-1-ола (пример 40, стадия 7) и фенилацетилена.
Пример 41
2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиридин
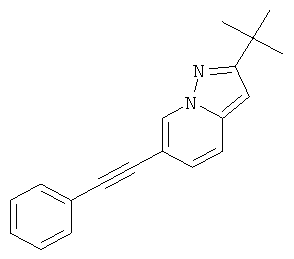
Стадия 1: 1-Амино-3-бром-пиридиния 2,4-динитро-фенолят

К раствору 3-бромпиридина (2,3 г, 15,0 ммоль) в ацетонитриле (4 мл) добавляли O-(2,4-динитро-фенил)-гидроксиламин (3,0 г, 15,0 ммоль, 1 эквив.) и реакционную смесь перемешивали при 40°С в течение 16 часов. Затем растворитель выпаривали, полученный в результате остаток растирали с эфиром и высушивали, чтобы получить требуемый 1-амино-3-бром-пиридиния 2,4-динитро-фенолят (4,5 г, выход 85%) в виде коричневого твердого вещества.
Стадия 2: Метиловый эфир 6-бром-2-трет-бутил-пиразоло[1,5-а]пиридин-3-карбоновой кислоты
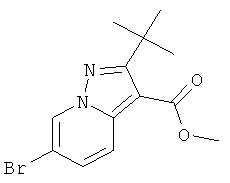
К раствору 1-амино-3-бром-пиридиния 2,4-динитро-фенолята (пример 41, стадия 1) (1,98 г, 14,16 ммоль) в ДМФА (20 мл) добавляли метиловый эфир 4,4-деметил-пент-2-иновой кислоты (CAS 20607-85-6) (5 г, 14,16 ммоль, 1 эквив.) и K2CO3 (3,9 г, 28,3 ммоль, 2 эквив.) и перемешивали при 25°С при продувке воздухом. ДМФА полностью выпаривали, остаток растворяли в этилацетате и промывали водой (100 мл). Органический экстракт высушивали с сульфатом натрия, фильтровали и выпаривали досуха. Полученный в результате неочищенный продукт вместе с нежелательным региоизомером метиловым эфиром 4-бром-2-трет-бутил-пиразоло[1,5-а]пиридин-3-карбоновой кислоты очищали с помощью колоночной хроматографии. Требуемый метиловый эфир 6-бром-2-трет-бутил-пиразоло[1,5-а]пиридин-3-карбоновой кислоты (1,04 г, выход 24%) получали в виде белого твердого вещества, MS: m/e=312,2 (M+H+).
Стадия 3: 6-Бром-2-трет-бутил-пиразоло[1,5-а]пиридин
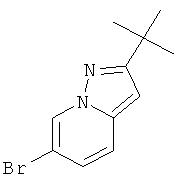
Раствор метилового эфира 6-бром-2-трет-бутил-пиразоло[1,5-а]пиридин-3-карбоновой кислоты (пример 41, стадия 2) (1,1 g, 3,53 ммоль) в H2SO4 (5 мл) и H2O (5 мл) нагревали при 80°С в течение 36 часов. Реакционную смесь нейтрализовали 2 н гидроксидом натрия и экстрагировали этилацетатом (4×60 мл). Органические экстракты высушивали с сульфатом натрия, фильтровали и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии (гептан: EtOAc 95:5→90:10). Требуемый 6-бром-2-трет-бутил-пиразоло[1,5-а]пиридин (370 мг, выход 38%) получали в виде белого твердого вещества, MS: m/e=254,2 (M+H+).
Стадия 4: 2-трет-Бутил-6-фенилэтинил-пиразоло[1,5-а]пиридин

Указанное в заголовке соединение, белое твердое вещество, MS: m/e=275,4 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-пиразоло[1,5-а]пиридина (пример 41, стадия 3) и фенилацетилена.
Пример 42
2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин
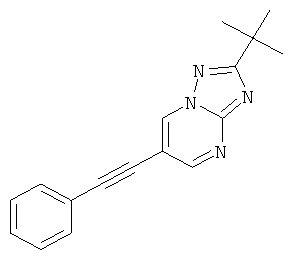
Стадия 1: 6-Бром-2-трет-бутил-[1,2,4]триазоло[1,5-а]пиримидин
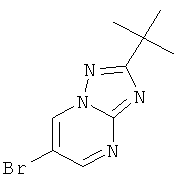
3-трет-Бутил-1H-1,2,4-триазол-5-амин (CAS 202403-45-0) (35%, 13 г, 32,5 ммоль) растворяли в уксусной кислоте (50 мл) и добавляли 2-броммалоновый альдегид (7,35 г, 48,7 ммоль, 1,5 эквив.). Реакционную смесь перемешивали в течение 3 часов при 60°С. Реакционную смесь выпаривали, нейтрализовали насыщенным 2 н раствором NaHCO3 и экстрагировали два раза дихлорметаном. Органические экстракты высушивали с сульфатом натрия, фильтровали и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на 70 г силикагеля (гептан: EtOAc 100:0→50:50). Требуемый 6-бром-2-трет-бутил-[1,2,4]триазоло[1,5-а]пиримидин (6,83 г, выход 83%) получали в виде белого твердого вещества, MS: m/e=255,0/257,1 (M+H+).
Стадия 2: 2-трет-Бутил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=277,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-[1,2,4]триазоло[1,5-а]пиримидина (пример 42, стадия 1) и фенилацетилена.
Пример 43
2-трет-Бутил-6-(2,5-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин
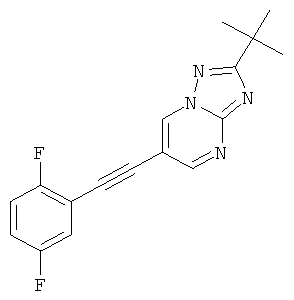
Стадия 1: 2-трет-Бутил-6-триметилсиланилэтинил-[1,2,4]триазоло[1,5-а]пиримидин
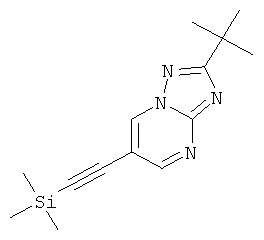
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=273,3 (M+1H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-[1,2,4]триазоло[1,5-а]пиримидина (пример 42, стадия 1) и этинил-триметил-силана.
Стадия 2: 2-трет-Бутил-6-(2,5-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин

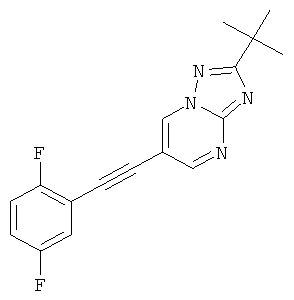
2-трет-Бутил-6-триметилсиланилэтинил-[1,2,4]триазоло[1,5-а]пиримидин (пример 43, стадия 1) (100 мг, 0,37 ммоль) растворяли в ДМФА (1 мл). 1,4-Дифтор-2-йодбензол (176 мг, 0,73 ммоль, 2 эквив.), Et3N (150 мкл, 1,1 ммоль, 3 эквив.), бис-(трифенилфосфин)-палладия (II) дихлорид (13 мг, 0,02 ммоль, 0,05 эквив.), трифенилфосфин (3 мг, 0,011 ммоль, 0,03 эквив.) и иодид меди (I) (2 мг, 0,011 ммоль, 0,03 эквив.) добавляли в атмосфере азота и смесь нагревали до 80°С. 1 М ТБАФ в ТГФ (440 мкл, 0,44 ммоль, 1,2 эквив.) добавляли по каплям в течение 20 минут при 80°С. Реакционную смесь перемешивали в течение 5 минут при 80°С. Реакционную смесь выпаривали и экстрагировали насыщенным раствором NaHCO3 и два раза небольшим объемом дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии, непосредственно загружая дихлорметановые слои в 20 г силикагелевую колонку и элюируя гептаном : этилацетатом 100:0→50:50. Требуемый 2-трет-бутил-6-(2,5-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин (73 мг, выход 64%) получали в виде светло-желтого твердого вещества, MS: m/e=313,1 (M+Н+).
Пример 44
2-трет-Бутил-6-(3-фтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин
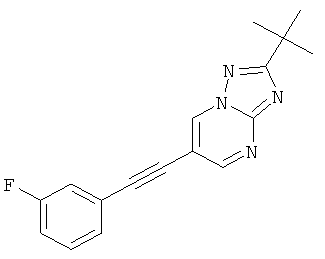
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=295,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-трет-бутил-[1,2,4]триазоло[1,5-а]пиримидина (пример 42, стадия 1) и этинил-3-фторбензола.
Пример 45
2-трет-Бутил-6-(3,4-дифтор-фенилэтинил)-[1,2,4]триазоло[1,5-а]пиримидин
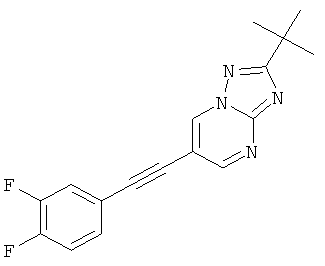
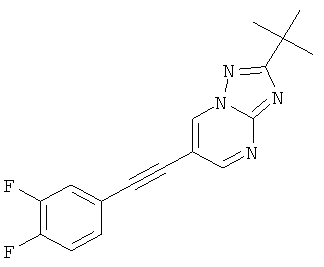
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=313,1 (M+H+), может быть получено в соответствии с общим методом примера 43, стадия 2, из 2-трет-бутил-6-триметилсиланилэтинил-[1,2,4]триазоло[1,5-а]пиримидина (пример 43, стадия 1) и 3,4-дифтор-4-йодбензола.
Пример 46
2-трет-Бутил-6-(5-хлор-пиридин-3-илэтинил)-[1,2,4]триазоло[1,5-а]пиримидин
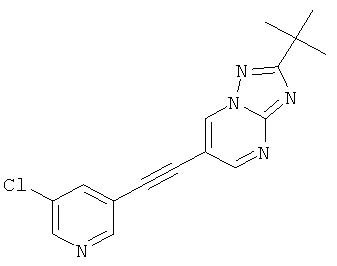
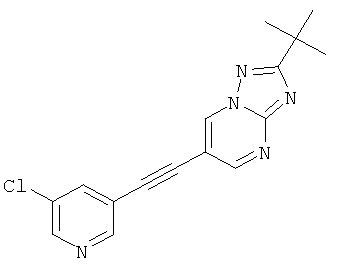
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=312,2/314,1 (M+H+), может быть получено в соответствии с общим методом примера 43, стадия 2, из 2-трет-бутил-6-триметилсиланилэтинил-[1,2,4]триазоло[1,5-а]пиримидина (пример 43, стадия 1) и 3-хлор-5-йодпиридина.
Пример 47
2-Морфолин-4-ил-6-фенилэтинил-[1,2,4]триазоло[1,5-а]пиримидин
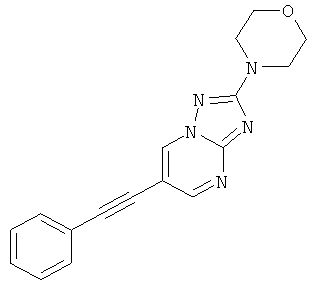
Стадия 1: 6-Бром-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидин
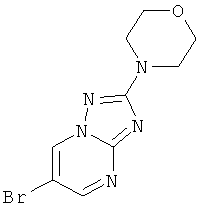
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=284,2/286,1 (M+H+), может быть получено в соответствии с общим методом примера 42, стадия 1, из 5-морфолин-4-ил-2H-[1,2,4]триазол-3-иламина (CAS 51420-46-3) и 2-броммалонового альдегида.
Стадия 2: 2-МорФолин-4-ил-6-Фенилэтинил[1,2,4]триазоло[1,5-а]пиримидин
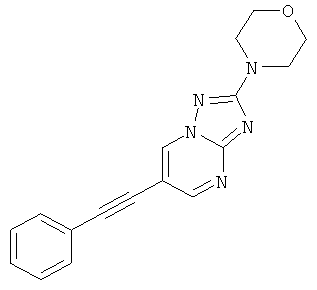
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=306,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидина (пример 47, стадия 1) и фенилацетилена.
Пример 48
2-Морфолин-4-ил-6-м-толилэтинил-[1,2,4]триазоло[1,5-а]пиримидин

Указанное в заголовке соединение, коричневое твердое вещество, MS: m/e=320,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидина (пример 47, стадия 1) и этинил-3-метилбензола.
Пример 49
6-(3-Фтор-фенилэтинил)-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=324,3 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидина (пример 47, стадия 1) и этинил-3-фторбензола.
Пример 50
6-(3-Хлор-фенилэтинил)-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидин
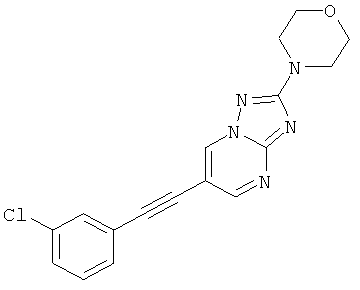
Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=340,0/342,1 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-морфолин-4-ил-[1,2,4]триазоло[1,5-а]пиримидина (пример 47, стадия 1) и этинил-3-хлорбензола.
Пример 51
6-Фенилэтинил-2-пирролидин-1-ил-[1,2,4]триазоло[1,5-а]пиримидин

Стадия 1: 6-Бром-2-пирролидин-1-ил-[1,2,4]триазоло[1,5-а]пиримидин
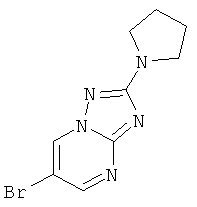
Указанное в заголовке соединение, светло-красное твердое вещество, MS: m/e=268,1/270,1 (M+H+), может быть получено в соответствии с общим методом примера 42, стадия 1, из 5-пирролидин-1-ил-1H-[1,2,4]триазол-3-иламина (CAS 154956-89-5) и 2-броммалонового альдегида.
Стадия 2: 6-Фенилэтинил-2-пирролидин-1-ил-[1,2,4]триазоло[1,5-а]пиримидин

Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=290,2 (M+H+), может быть получено в соответствии с общим методом примера 1 из 6-бром-2-пирролидин-1-ил-[1,2,4]триазоло[1,5-а]пиримидина (пример 51, стадия 1) и фенилацетилена.