Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка заявляет приоритет согласно заявке на патент США № 61/868933, поданной 22 августа 2013, которая включена в данное описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
В одном аспекте, данное изобретение относится к способу получения соединения с противораковой активностью, например, соединения, которое ингибирует активность киназы CHK1.
УРОВЕНЬ ТЕХНИКИ
Протеинкиназы представляют собой энзимы киназы, фосфорилирующие другие белки. Фосфорилирование этих белков обычно производит функциональное изменение в белке. Большинство киназ действуют на серин и треонин или тирозин, а некоторые киназы действуют на все три белка. Посредством этих функциональных изменений киназы могут регулировать множество клеточных путей. Ингибиторы протеинкиназы представляют собой соединения, которые ингибируют эти протеинкиназы, и, таким образом, могут быть применены для влияния на клеточные пути.
Киназа контрольной точки 1 ("CHK1") представляет собой серин/треониновую киназу. CHK1 регулирует ход клеточного цикла и является основным фактором ответа на повреждения ДНК в клетке. Ингибиторы CHK1, как было показано, сенсибилизируют опухолевые клетки к различным генотоксическим средствам, таким как химиотерапия и облучение. (Tse, Archie N., et al., "Targeting Checkpoint Kinase 1 in Cancer Therapeutics." Clin. Cancer Res. 13(7) (2007) 1955-1960). Было замечено, что многие опухоли испытывают дефицит контрольной точки G1 пути повреждения ДНК, что приводит к зависимости от контрольных точек S и G2 для репарации при повреждении ДНК и выживания. (Janetka, James W., et al., "Inhibitors of checkpoint kinases: From discovery to the clinic." Drug Discovery & Development Vol. 10, No. 4 (2007) 473-486).
Контрольные точки S и G2 регулируются с помощью CHK1. Ингибирование CHK1, как было показано, отменяет контрольные точки S и G, тем самым ухудшая репарацию ДНК и приводит к повышенной гибели клеток опухоли. Тем не менее, доброкачественные клетки имеют функционирующую контрольную точку G, что позволяет осуществить репарацию ДНК и выжить.
Киназа контрольной точки 2 ("CHK2") также представляет собой серин/треониновую киназу. Функции CHK2 играют центральную роль в индукции остановки клеточного цикла и апоптоза при повреждении ДНК. (Ahn, Jinwoo, et al., "The CHK2 protein kinase." DNA Repair 3 (2004) 1039-1047). CHK2 активируется в ответ на генотоксические повреждения и распространяет сигнал контрольной точки по нескольким путям, которые в конечном итоге приводят к остановке клеточного цикла на G1, S и G2/M фазах, активации репарации ДНК и апоптозу клеток. (Bartek, Jiri, et al., "CHK2 Kinase - A Busy Messenger." Nature Reviews Molecular Cell Biology. Vol. 2(12) (2001) 877-886). Раковые клетки часто испытывают недостаток одной или более контрольных точек целостности генома, таким образом, что ингибирование CHK2 может сделать опухолевые клетки избирательно более чувствительными к противораковой терапии, такой как γ-излучение или повреждающие ДНК лекарственные средства.
Нормальные клетки все равно могут активировать другие контрольные точки и восстанавливаться, а раковые клетки, лишенные контрольных точек, могут иметь больше шансов погибнуть. Было продемонстрировано, что ингибитор CHK2 на основе пептидов подавляет контрольную точку G2 и сенсибилизирует p53-дефектные клетки рака по отношению к ДНК повреждающим средствам. (Pommier, Yves, et al., "Targeting CHK2 Kinase: Molecular Interaction Maps and Therapeutic Rationale." Current Pharmaceutical Design. Vol. 11, No. 22 (2005) 2855-2872).
Известны ингибиторы CHK1 и/или CHK2, смотри, например, международную публикацию WO 2009/089352, WO2009/089359 и WO2009/140320.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
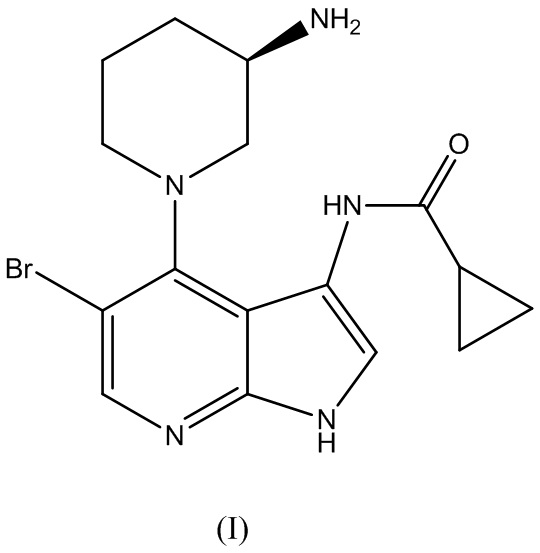
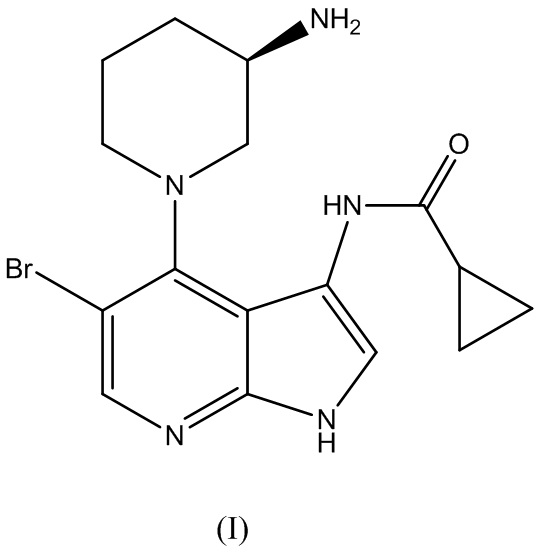
Аспект изобретения относится к способу получения (R)-5-бромо-4-(3-(амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина Формулы (I):
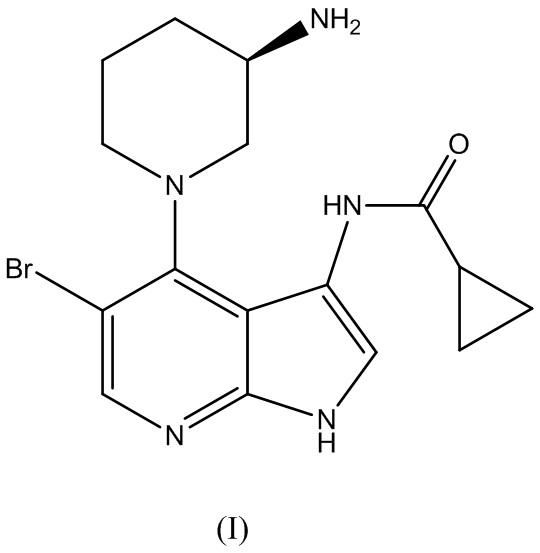
и его фармацевтически приемлемых солей. (R)-5-бромо-4-(3-( амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридин Формулы (I) может быть применим в качестве ингибитора CHK1.
ПОДРОБНОЕ ОПИСАНИЕ ПРИМЕРОВ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Будут сделаны подробные ссылки на некоторые варианты реализации изобретения, примеры которых проиллюстрированы на прилагаемых структурах и формулах. В то время как изобретение будет описано в сочетании с перечисленными вариантами реализации, должно быть понятно, что они не предназначены для ограничения изобретения этими вариантами реализации. Изобретение предназначено для того, чтобы охватить все альтернативы, модификации и эквиваленты, которые могут быть включены в объем данного изобретения. Специалисту в данной области техники будут очевидны многочисленные способы и материалы, аналогичные или эквивалентные описанным в данном документе, которые могут быть применены в практике данного изобретения. Данное изобретение ни в коей мере не ограничивается описанными способами и материалами. В случае, когда одно или более из включенных литературных, патентных и аналогичных материалов отличаются от или противоречат этой заявке, в том числе, но не ограничиваясь ими, определенные термины, применение терминов, описанные технологии или подобное, данная заявка имеет преимущественную силу.
ОПРЕДЕЛЕНИЯ
Слова "включать", "включающий", "содержать", "содержащий" и "содержит" при применении в этом описании и в последующей формуле изобретения предназначены для определения присутствия заявленных признаков, целых чисел, компонентов или этапов, но они не исключают присутствие или добавление одного или нескольких других признаков, целых чисел, компонентов, этапов или их групп.
Термин “около” при применении в сочетании с часами, температурами обозначает ± 5 часов, например, ± 1 час. Термин “около” при применении в сочетании с часами, температурами обозначает ± 5 градусов цельсия, например, ± 1 градус цельсия. Термин “около” при применении в сочетании с процентными содержаниями или другими величинами, температурами обозначает ± 10%, например, ± 5% процентного содержания или величин, к которым они относятся.
Термины "лечить" или "лечение" относятся к терапевтическим, профилактическим, паллиативным или превентивным мерам. Для целей настоящего изобретения, полезные или желательные клинические результаты включают, но без ограничения ими, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е. неухудшение) состояния заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (либо частичную, либо полную), либо обнаруживаемую, либо необнаруживаемую. "Лечение" может также означать продление выживаемости по сравнению с ожидаемой выживаемостью, при условии неполучения лечения. Те, которые нуждаются в лечении, включают тех, которые уже имеют состояние или расстройство, а также тех, кто склонны иметь состояние или нарушение, или тех, у которых состояние или заболевание должно быть предотвращено.
Выражения "терапевтически эффективное количество" или "эффективное количество" означает количество соединения Формулы I, которое при введении в организм млекопитающего, нуждающегося в подобном лечении, достаточное для (i) лечения или предупреждения конкретного заболевания, состояния или расстройства, (ii) ослабления, облегчения или устранения одного или более симптомов конкретного заболевания, состояния или расстройство или (iii) предотвращения или задержки начала одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в данном документе. Количество соединения, которое будет соответствовать такому количеству, будет варьировать в зависимости от таких факторов, как конкретное соединение, болезненное состояние и его тяжесть, характеристика (например, масса) млекопитающего, нуждающегося в лечении, но тем не менее может быть установленным порядком определено специалистом в данной области техники.
Термины "рак" и "раковый" относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется аномальным или нерегулируемым ростом клеток. "Опухоль" содержит одну или более раковых клеток. Примеры рака включают, но без ограничения ими, карциному, лимфому, бластому, саркому и лейкемию или лимфолейкозы. Более конкретные примеры подобных злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких (в том числе мелкоклеточный рак легких, немелкоклеточный рак легких ("NSCLC"), аденокарциному легких и плоскоклеточный рак легких), рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта или рак желудка, в том числе опухоль желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карцинома эндометрия или матки, карцинома слюнных желез, почек или ренальный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени, рак анального канала, карцинома полового члена, рак кожи, в том числе меланома, а также рак головы и шеи.
Выражение "фармацевтически приемлемый" означает, что вещество или композиция являются совместимыми химически и/или токсикологически с другими ингредиентами, содержащимися в препарате, и/или с млекопитающим, которое подлежит лечению ими.
Выражение "фармацевтически приемлемая соль," как применяют в данном документе, относится к фармацевтически приемлемым органическим или неорганическим солям соединения по изобретению.
Соединения по данному изобретению также содержат другие соли подобных соединений, которые не обязательно являются фармацевтически приемлемыми солями и которые могут быть применимы в качестве интермедиатов при получении и/или очистке соединений по данному изобретению и/или для разделения энантиомеров соединений по данному изобретению.
Термин "млекопитающее" означает теплокровное животное, которое имеет риск развития описанного в настоящем документе заболевания, и включает, но без ограничения ими, морских свинок, собак, кошек, крыс, мышей, хомяков и приматов, в том числе человека.
Термин "хиральный" относится к молекулам, которые имеют свойство не-наложимости зеркального партнера, в то время как термин "ахиральные" относится к молекулам, которые совмещаются с их зеркальным партнером.
Термин "стереоизомеры" относится к соединениям, которые имеют одинаковую химическую конституцию, но отличаются расположением атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности и его молекулы не являются зеркальными отражениями друг друга. Диастереомеры обладают различными физическими свойствами, например, температурами плавления, кипения, спектральными свойствами и реакционными способностями. Смеси диастереомеров возможно разделить с помощью высокочувствительных аналитических процедур, таких как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерам соединения, которые не являются зеркальными отражениями друг друга.
Стереохимические определения и условные обозначения, применяемые в данном документе, как правило, следуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения Формул I-VII, описанные в данном документе, могут содержать асимметричные или хиральные центры, и, следовательно, существуют в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений Формул I-VII, описанные в данном документе, в том числе, но без ограничения ими, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, например, в виде рацемических смесей, образуют часть данного изобретения. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью вращать плоскость плоскополяризованного света. В описании оптически активного соединения префиксы D и L или R и S, применяют для обозначения абсолютной конфигурации молекулы около ее хирального центра(ов). Префиксы d и l или (+) и (-) используют для обозначения знака вращения плоскополяризованного света соединением, причем (-) или 1 означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. В случае данной химической структуры эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными отражениями друг друга. Специфический стереоизомер может также упоминаться как энантиомер, а смесь подобных изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 относится к рацемической смеси или рацемату, которые могут существовать там, где не было стереоселективности и стереоспецифичности в химической реакции или способе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных веществ, лишенной оптической активности.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам различных энергий, которые являются взаимопревращаемыми посредством низкого энергетического барьера. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращение посредством миграции протона, такой как кето-енольная и имин-енаминовая изомеризация. Таутомеры валентности включают взаимопревращения при реорганизации некоторых из связывающих электронов.
Выражение "фармацевтически приемлемая соль" как применяют в данном документе, относится к фармацевтически приемлемым органическим или неорганическим солям соединения Формул I-VII, описанного в данном документе,. Примеры солей включают, но не ограничиваясь ими, сульфатную, цитратную, ацетатную, оксалатную, хлоридную, бромидную, йодидную, нитратную, бисульфатную, фосфатную, кислую фосфатную, изоникотинатную, молочную, салицилатную, кислую лимонную, винную, олеатную, таннатную, пантотенатную, виннокислую, аскорбатную, янтарную, малеатную, гентизинатную, фумаратную, глюконатную, глюкуронатную, сахаратную, формиатную, бензоатную, глутаматную, метансульфонатную "мезилатную", этансульфонатную, этандисульфонатную, бензолсульфонатную, p-толуолсульфонатную и памоатную (т.е. 1,1'-метилен-бис(2-гидрокси-3-нафтоатную)) соли. Фармацевтически приемлемая соль может содержать включения другой молекулы, такой как ацетат ион, сукцинат ион или другой противоион. Противоион может быть органической или неорганической функциональной группой, которая стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. Случаи, в которых несколько заряженных атомов являются частью фармацевтически приемлемой соли, могут иметь несколько противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов.
При условии, что соединение Формул I-VII, описанное в данном документе, представляет собой основание, желаемая фармацевтически приемлемая соль может быть получена с помощью любого подходящего способа, доступного в данной области техники, например, обработкой свободного основания неорганической кислотой, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобное, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или циннамовая кислота, сульфоновая кислота, такая как бензолсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота или этансульфоновая кислота или подобное.
При условии, что соединение Формул I-VII, описанные в данном документе, представляет собой кислоту, желаемая фармацевтически приемлемая соль может быть получена с помощью любого подходящего способа, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксидом щелочного металла, гидроксидом щелочноземельного металла или подобными. Иллюстративные примеры подходящих солей включают, но без ограничения ими, органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиак, первичные, вторичные, третичные амины и циклические амины, такие как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
"Сольват" относится к ассоциации или комплексу одной или более молекул растворителя и соединения Формул I-VII, описанного в данном документе. Примеры растворителей, которые образуют сольваты, включают, но без ограничения ими, воду, 1-пропанол, 2-пропанол, 1-пентанол, этанол, метанол, ДМСО, этилацетат, этилформиат, уксусную кислоту, толуол, анизол, пиридин, 1,3-диизопропилбензол, 2-метилтетрагидрофуран, тетрагидрофуран, диоксан, циклопентиловый метиловый эфир, метил трет-бутиловый эфир, дихлорметан, 1,2-дихлорэтан, метилциклогексан, ацетонитрил, валеронитрил и этаноламин. Термин "гидрат" относится к комплексу, где молекулой растворителя является вода.
ИНГИБИТОРЫ CHK1/2
Способ в соответствии с изобретением может быть применим при получении (R)-5-бромо-4-(3-(амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина Формулы (I) и его фармацевтического состава, который ингибирует CHK1 и/или CHK2, таким образом, как, например, описано в WO2009/140320. Данное соединение является потенциально применимым при лечении заболеваний, состояний и/или расстройств, модулируемых с помощью CHK1 и/или CHK2.
ПОЛУЧЕНИЕ СОЕДИНЕНИЙ
Соединения, описанные в данном документе, могут содержать асимметричные или хиральные центры, и, следовательно, существуют в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений Формул I-VII, описанные в данном документе, в том числе, но без ограничения ими, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, например, в виде рацемических смесей, образуют часть данного изобретения. Кроме этого, данное изобретение охватывает все геометрические и позиционные изомеры. В структурах, показанных в данном документе, при условии, что стереохимия конкретного хирального атома не указана, предполагаются все стереоизомеры, и они предусмотрены в качестве соединений по изобретению. В случае, когда стереохимия указана жирным клином или пунктирной линией, представляющих конкретную конфигурацию, таким образом указывают и определяют этот стереоизомер.
Соединения, описанные в данном документе, могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобное, и подразумевается, что изобретение включает и сольватированные, и несольватированные формы.
Соединения, описанные в данном документе, могут также существовать в различных таутомерных формах, и все подобные формы включены в объем изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам различных энергий, которые являются взаимопревращаемыми посредством низкого энергетического барьера. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращение посредством миграции протона, такой как кето-енольная и имин-енаминовая изомеризация. Таутомеры валентности включают взаимопревращения при реорганизации некоторых из связывающих электронов.
Данное изобретение также охватывает изотопно-меченные соединения по данному изобретению, которые являются идентичными соединениям, перечисленным в данном документе, не считая того факта, что один или более атомов замещены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно обнаруживаемого в природе. Все изотопы любого конкретного атома или элемента, как показано, предусмотрены в пределах объема соединений по изобретению и их применений. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I. Некоторые изотопно-меченные соединения по данному изобретению (например, соединения, меченные 3H и 14C) являются применимыми для анализов распределения соединения и/или субстрата в тканях. Тритиевые (3H) изотопы и изотопы углерод-14 (14C) являются применимыми ввиду легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е., 2H), может давать некоторые терапевтические преимущества благодаря большей метаболической стабильности (например, увеличенному времени полураспада in vivo или уменьшенным количествам требуемой дозы) и, следовательно, могут быть предпочтительными при некоторых обстоятельствах. Позитронно-активные изотопы, такие как 15O, 13N, 11C и 18F являются применимыми в случае исследований с помощью позитронно-эмиссионной томографии (ПЭТ) для изучения заполнения рецепторов субстратом. Изотопно-меченные соединения по данному изобретению обычно можно получить с помощью процедур, аналогичных описанным в Примерах в данном документе ниже, замещением изотопно-немеченного реагента изотопно-меченным реагентом.
Исходные материалы и реагенты для получения соединений, в соответствии с изобретением, обычно доступны из коммерческих источников, таких как Sigma-Aldrich Chemicals (Милуоки, Висконсин), или их легко получить с применением способов, хорошо известных специалистам в данной области техники (например, получить с помощью способов, в общих чертах описанных в Louis F. Fieser и Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N.Y. (1967-1999 ed.) или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая приложения (также доступные в автоматизированной базе данных Beilstein).
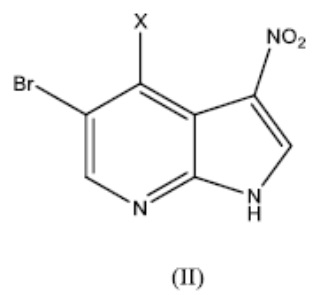
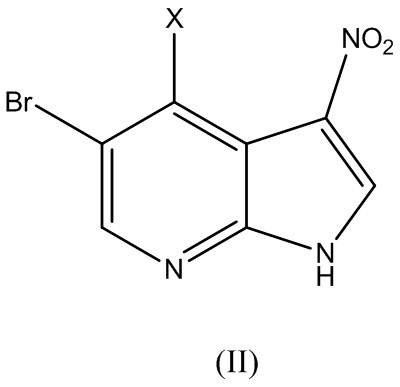
Как уже упоминалось выше, в одном аспекте, изобретение относится к способу получения (R)-5-бромо-4-(3-амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина Формулы (I):

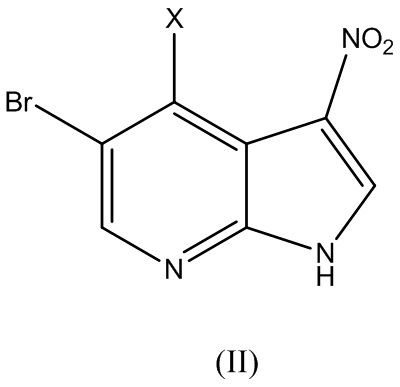
включающий этап вступления в реакцию соединения Формулы (II):
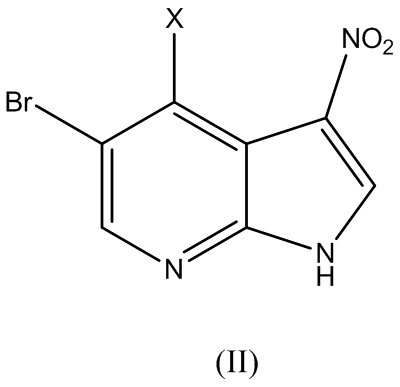
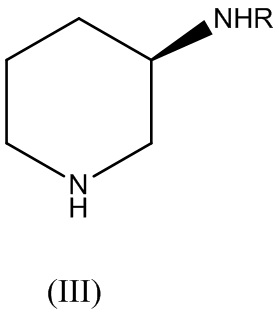
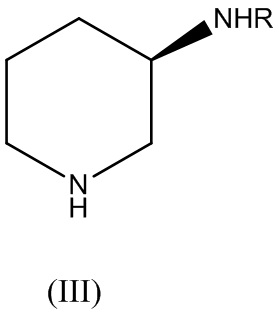
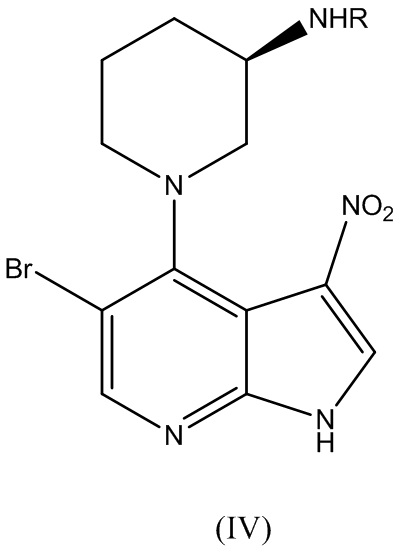
где X представляет собой галоген, с соединением Формулы (III):

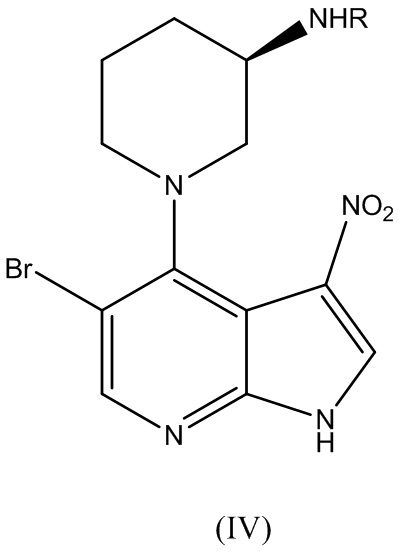
где R представляет собой аминозащитную группу, с получением соединения Формулы (IV):
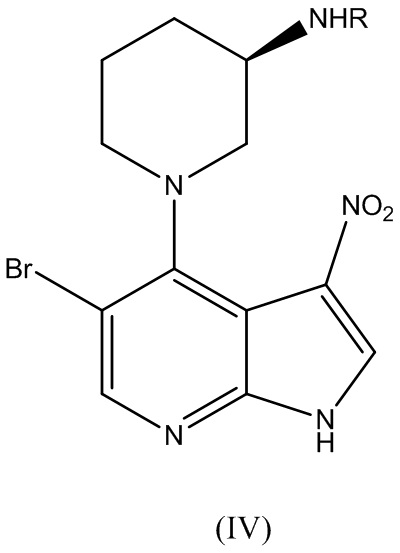 .
.
В варианте реализации изобретения соединение Формулы (II) вступает в реакцию с от около 1,0 до около 3,0 эквивалентов соединения Формулы (III). В одном варианте реализации изобретения реакцию между соединением Формулы (II) и Формулы (III) осуществляют при температуре выше комнатной температуры. В одном варианте реализации изобретения реакцию осуществляют при температуре выше 50ºC. В одном варианте реализации изобретения реакцию осуществляют при около 85ºC.
В варианте реализации изобретения X представляет собой I, Cl, F или Br. В варианте реализации изобретения X представляет собой Cl, F или Br. В варианте реализации изобретения X представляет собой I. В варианте реализации изобретения X представляет собой F. В варианте реализации изобретения X представляет собой Cl. В варианте реализации изобретения X представляет собой Br.
В варианте реализации изобретения соединение Формулы (II) представляет собой соединение Формулы (II-a):
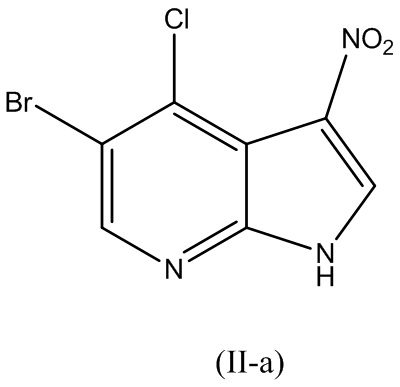
В варианте реализации изобретения соединение Формулы (II) представляет собой соединение Формулы (II-b):
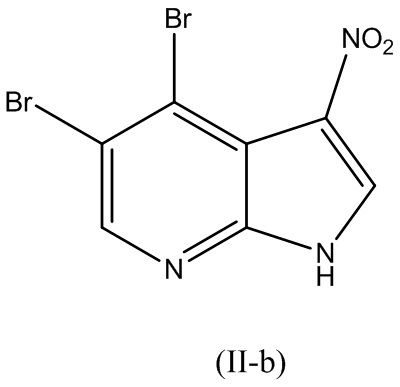
В варианте реализации изобретения соединение Формулы (II) представляет собой соединение Формулы (II-c):
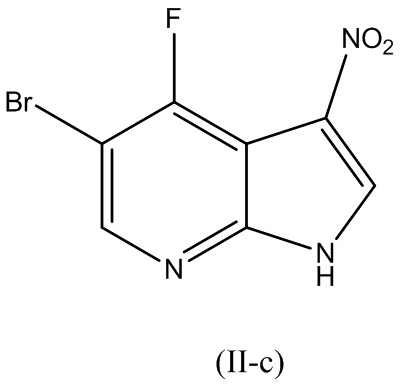
В варианте реализации изобретения реакция соединения Формулы (II) с соединением Формулы (III), описанным выше, осуществляют в органическом растворителе или смеси растворителей. В варианте реализации изобретения органический растворитель выбирают из группы, состоящей из спиртов, диметилсульфоксида (ДМСО), диметилформамида (ДМФ), диметилацетамида (ДМА), N-метил-2-пирролидона (NMP), сульфолана, ацетонитрила и пропионитрила. В варианте реализации изобретения спирт выбирают из группы, состоящей из 2-метил-2-бутанола, 1-бутанола, 2-бутанола, 2-метил-2-пропанола, 1-пропанола и 2-пропанола. В варианте реализации изобретения спирт представляет собой 2-метил-2-бутанол.
В варианте реализации изобретения реакция соединения (II) с соединением (III), описанным выше, осуществляют с основанием, выбранным из группы, состоящей из N-метилморфолина, 1,4-диазабицикло[2.2.2]октана (DABCO), триэтиламина, N,N-диизопропилэтиламина (DIEA), тетраметилэтилендиамина (TMEDA), карбоната натрия, карбоната калия, карбоната цезия и фосфата калия. В варианте реализации изобретения основание представляет собой N-метилморфолин.
В варианте реализации изобретения аминозащитную группу R выбирают из группы, состоящей из: трифенилметила (тритил), трет-бутилоксикарбонила (Boc), карбоксибензила (Cbz), трифторацетила и ацетила.
В варианте реализации изобретения способ по изобретению дополнительно включает этап, на котором соединение Формулы (IV):
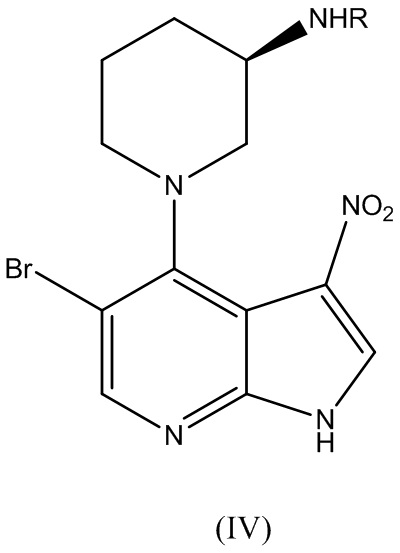
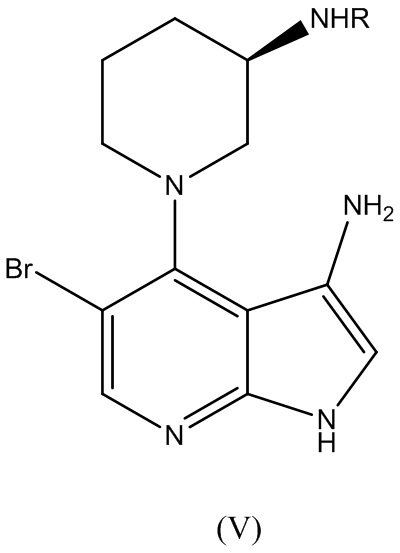
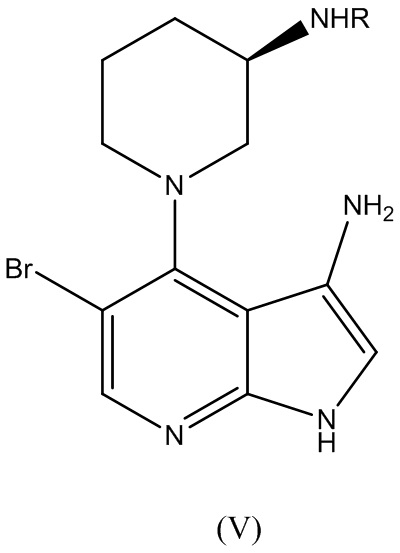
где R представляет собой аминозащитную группу, подвергают нитровосстановлению для получения соединения Формулы (V):
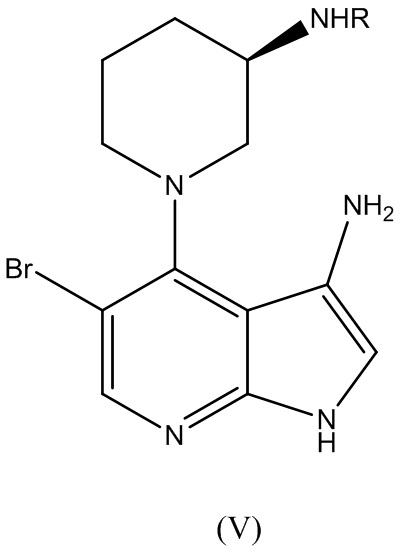
В варианте реализации изобретения этап нитровосстановления осуществляют с применением водорода, сульфида или борана в качестве восстановителя. В варианте реализации изобретения гидрирование осуществляют с платиновым или никелевым катализатором Ренея. В варианте реализации изобретения катализатор применяют в сочетании с модификатором, выбранным из группы, состоящей из ванадия, железа и меди. В варианте реализации изобретения этап гидрирование осуществляют с основанием, выбранным из группы, состоящей из N-метилморфолина, 1,4-диазабицикло[2.2.2]октана (DABCO), триэтиламина, N,N-диизопропилэтиламина (DIEA), тетраметилэтилендиамина (TMEDA). В варианте реализации изобретения этап гидрирования осуществляют в растворителе, выбранном из 2-метил-2-бутанола, 1-бутанола, 2-бутанола, 2-метил-2-пропанола, 1-пропанола, 2-пропанола, 2-метилтетрагидрофурана и тетрагидрофурана. В варианте реализации изобретения этап гидрирования осуществляют при 5 бар водорода.
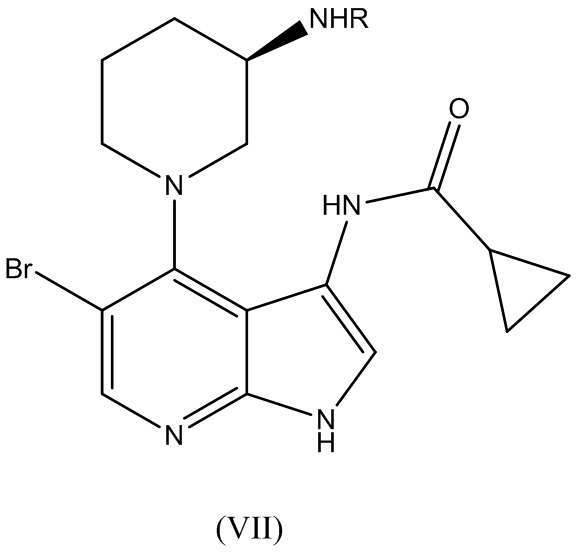
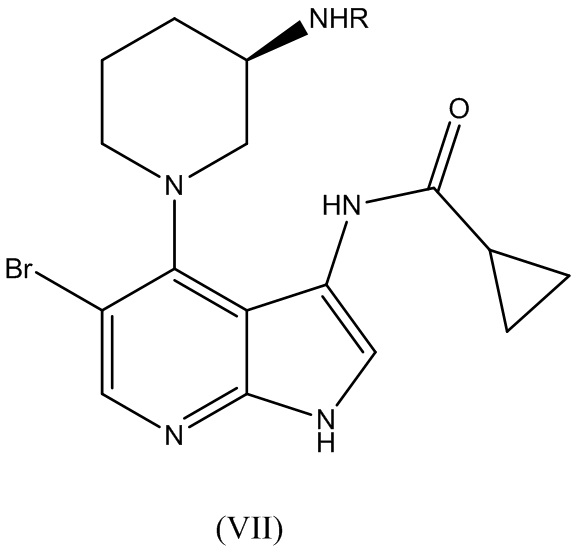
В варианте реализации изобретения способ по изобретению дополнительно включает этап вступления в реакцию соединения Формулы (V):

с соединением Формулы (VI):
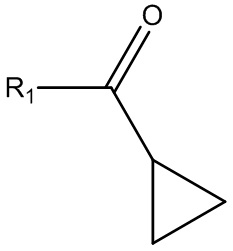
(VI)
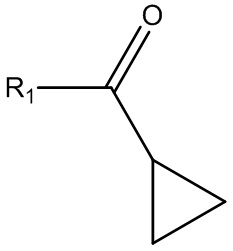
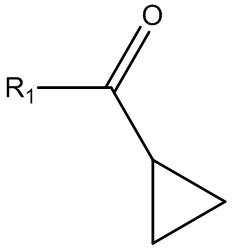
где R1 выбирают из группы, состоящей из хлора, фтора, брома и OR2, где R2 выбирают из группы, состоящей из циклопропилкарбонила, изобутилкарбонила, изопропилкарбонила, этилкарбонила, метилкарбонила, 2-пиридила, N-сукцинимидила и т.д. для получения соединения Формулы (VII):

В варианте реализации изобретения способ по изобретению дополнительно включает этап удаления защитной группы R в соединении Формулы (VII):

для получения (R)-5-бромо-4-(3-(амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина Формулы (I):

В варианте реализации изобретения аминозащитная группа R представляет собой трет-бутилоксикарбонил (Boc). В этом случае, снятие их защитной группы может быть осуществлено в кислой среде с применением серной кислоты, соляной кислоты или трифторуксусной кислоты. Форма свободного основания может быть получена с помощью обработки соли неорганическим основанием, таким как гидроксид натрия, гидроксид калия или фосфат калия, или органическим основанием, таким как пиперизин, пиперидин, пирролидин, 1,4-диазабицикло[2.2.2]октан (DABCO), триэтиламин, N,N-диизопропилэтиламин (DIEA) или тетраметилэтилендиамин (TMEDA). В варианте реализации изобретения основание представляет собой пиперазин.
Специалисту в данной области техники будет понятно, что условия и реактивы схем 2, 3, 4 и 5 из заявки WO2009140320, содержание которой включено посредством ссылки, также могут быть применены к вышеуказанному способу при получении соединения Формулы (I).
СПОСОБЫ РАЗДЕЛЕНИЯ
В способах получения соединений Формул I-VII, описанные в данном документе, разделение продуктов реакции друг от друга и/или от исходных соединений может быть полезным. Желаемые продукты каждого этапа или серий этапов разделяют и/или очищают (в дальнейшем в этом документе разделяют) до желаемой степи гомогенности с помощью технологий, обычных для данной области техники. Обычно подобные разделения включают многостадийное извлечение, кристаллизацию из растворителя или смеси растворителей, перегонку, сублимацию или хроматографию. Хроматография может включать любое количество способов, в том числе, например: с обращенной и нормальной фазой; эксклюзионную хроматографию; ионнообменную хроматографию; способы и устройства жидкостной хроматографии высокого, среднего и низкого давления; аналитическую мелкомасштабную хроматографию; хроматографию с псевдодвижущимся слоем (SMB) и препаративную тонкослойную или толстослойную хроматографию, а также технологии мелкомасштабной тонкослойной и флеш-хроматографии.
Другой класс способов разделения включает обработку смеси реагентом, селективно связывающимся с или иным образом позволяющим отделить желаемый продукт, непрореагировавший исходный материал, побочный продукт реакции или подобное. Подобные реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ионообменные среды или подобное. Альтернативно, реагенты могут представлять собой кислоты в случае основного материала, основания в случае кислого материала, связывающие реагенты, такие как антитела, связывающие белки, селективные хелаторы, такие как краун эфиры, реагенты для ионной экстракции жидкость/жидкость (LIX) или подобное.
Выбор соответствующих способов разделения зависит от природы включаемых материалов. Например, точка кипения и молекулярная масса в перегонке и сублимации, присутствие или отсутствие полярных функциональных групп в хроматографии, стабильность материалов в кислой и щелочной среде в многостадийном извлечении и тому подобное. Специалист в данной области техники будет применять наиболее подходящие для достижения желаемого разделения технологии.
Диастереомерные смеси могут быть разделены на их отдельные диастереомеры на основе их физико-химических различий с помощью способов, хорошо известных специалистам в данной области техники, таких как хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь с помощью реакции с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереоизомеров в соответствующие чистые энантиомеры. Кроме того, некоторые соединения Формул I-VII, описанные в данном документе, могут представлять собой атропоизомеры (например, замещенные биарилы) и считают, что они являются частью этого изобретения. Энантиомеры также могут быть разделены с помощью применения хиральной колонки ВЭЖХ.
Отдельный стереоизомер, например, энантиомер, практически не содержащий его стереоизомер, может быть получен с помощью разделения рацемической смеси с применением такого способа, как образование диастереомеров с применением оптически активных средств для разделения (Eliel, E. and Wilen, S. "Stereochemistry of Organic Compounds," John Wiley & Sons, Inc., New York, 1994; Lochmuller, C. H., (1975) J. Chromatogr., 113(3):283-302). Рацемические смеси хиральных соединений Формул I-VII, описанных в данном документе, могут быть разделены и выделены с помощью подходящего способа, в том числе: (1) образования ионных, диастереомерных солей с хиральными соединениями и разделение с помощью фракционной кристаллизации или других способов; (2) образования диастереомерных соединений с хиральными дериватизирующими реагентами, разделения диастереомеров и превращения в чистые стереоизомеры; и (3) разделения практически чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. Смотри: "Drug Stereochemistry, Analytical Methods and Pharmacology," Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993).
По способу (1), диастереомерные соли могут быть образованы с помощью реакции энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, α-метил-β-фенилэтиламин (амфетамин) и подобное с асимметричными соединениями, несущими кислотную функциональность, такими как карбоновая кислота и сульфоновая кислота. Диастереомерные соли могут быть индуцированы для разделения с помощью фракционной кристаллизации или ионной хроматографии. Для разделения оптических изомеров аминосоединений добавление хиральной карбоновой или сульфоновой кислот, таких как камфорсульфокислота, винная кислота, миндальная кислота или молочная кислота, может приводить к образованию диастереомерных солей.
Альтернативно, по способу (2), субстрат, который нужно выделить, реагирует с одним энантиомером хирального соединения для образования диастереомерной пары (E. and Wilen, S. "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., 1994, p. 322). Диастереомерные соединения могут быть образованы с помощью вступления в реакцию асимметричных соединения с энантиомерно чистыми хиральными дериватирующими реагентами, такими как производные ментола, с последующим разделением на диастереомеры и гидролизом для получения чистого или обогащенного энантиомера. Способ определения оптической чистоты включает получение хиральных сложных эфиров, таких как ментоловые сложные эфиры, например, (-) ментоловый эфир хлормуравьиной кислоты в присутствии основания или эфира Мошера, α-метокси-α-(трифторметил)фенилацетата (Jacob III. J. Org. Chem., (1982) 47:4165), рацемической смеси, и анализ спектра ЯМР 1H на присутствие двух атропоизомерных энантиомеров или диастереомеров. Стабильные диастереомеры атропоизомерных соединений могут быть разделены и выделены с помощью прямой- и обращенно-фазовой хроматографией, следуя способам разделения атропоизомерных нафтилизохинолинов (WO 96/15111). С помощью способа (3), рацемическая смесь двух энантиомеров могут быть разделены с помощью хроматографии с применением хиральной неподвижной фазы ("Chiral Liquid Chromatography" (1989) W. J. Lough, Ed., Chapman and Hall, New York; Okamoto, J. Chromatogr., (1990) 513:375-378). Обогащенные или очищенные энантиомеры могут быть различимы с помощью способов, применяемых для различения других хиральных молекул с асимметричными атомами углерода, такими как оптическое вращение и круговой дихроизм.
ВВЕДЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Соединение Формулы (I) может быть введено любым удобным путем, соответствующим состоянию, которое подвергается лечению. Подходящие пути введения включают пероральный, парентеральный (в том числе подкожный, внутримышечный, внутривенный, внутриартериальный, интрадермальный, интратекальный и эпидуральный), трансдермальный, ректальный, назальный, местный (в том числе буккальный и сублингвальный), вагинальный, интраперитонеальный, внутрилегочный и интраназальный.
Соединение может быть введен в любой удобной для введения форме, например, таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пластырей и т.п. Подобные композиции могут содержать обычно применяемые в случае фармацевтических препаратов компоненты, например, разбавители, носители, модификаторы рН, подслащивающие вещества, объемообразующие средства и дополнительные активные средства. Если требуется парентеральное введение, композиции должны быть стерильными и в форме раствора или суспензии, подходящей для инъекции или инфузии.
Обычный состав получают с помощью смешивания соединения Формулы (I) и носителя или вспомогательного вещества. Подходящие носители и вспомогательные вещества хорошо известны специалистам в данной области техники и детально описаны в, например, Ansel, Howard C., et al., Ansel’s Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; и Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. Составы могут также содержать один или более буферов, стабилизаторов, поверхностно-активных веществ, увлажнителей, смазывающих веществ, эмульгаторов, суспендирующих средств, консервантов, антиоксидантов, веществ, придающих непрозрачность, веществ, придающих сыпучесть, технологических добавок, красителей, подслащивающих веществ, ароматизаторов, веществ, придающих вкус, разбавителей и других добавок, обеспечивающих привлекательную форму лекарственного средства (т.е. соединения Формулы (I) или его фармацевтической композиции) или облегчающие изготовление фармацевтического продукта (т.е. лекарственного средства).
Один вариант реализации изобретения включает фармацевтическую композицию, содержащую соединение Формулы (I) или его фармацевтически приемлемую соль. Другой вариант реализации изобретения включает фармацевтическую композицию, содержащую соединение Формулы (I) или его фармацевтически приемлемую соль, вместе с фармацевтически приемлемым носителем или вспомогательным веществом.
СПОСОБЫ ЛЕЧЕНИЯ СОЕДИНЕНИЯМИ ФОРМУЛЫ I
Соединение Формулы (I) может быть применимо для лечения или предотвращения заболевания или состояния с помощью введения одного или более соединений Формулы (I) или его фармацевтически приемлемой соли. В одном варианте реализации изобретения пациента-человека лечат соединением Формулы (I) или его фармацевтически приемлемой солью и фармацевтически приемлемым носителем, адъювантом или наполнителем в количество для детектируемого ингибирования активности CHK1.
Способ предотвращения или лечения заболевания или расстройства, модулируемого с помощью CHK1 и/или CHK2, может включать введение млекопитающему, нуждающемуся в подобном лечении, эффективного количества соединения Формулы (I).
В другом варианте реализации изобретения способ лечения гиперпролиферативного заболевания у млекопитающего, включающий введение терапевтически эффективного количества соединения Формулы (I) или его фармацевтически приемлемой соли, которое обеспечивают млекопитающему.
В другом варианте реализации изобретения способ лечения или предотвращения рака, в том числе идентифицированных ниже состояний, у млекопитающего, нуждающегося в таком лечении, причем способ включает введение упоминаемому млекопитающему терапевтически эффективного количества соединения Формулы (I) или его фармацевтически приемлемой соли.
В некоторых вариантах реализации изобретения ингибитор CHK1 Формулы (I) (т.е., соединение Формулы (I)) вводят в комбинации с поражающим ДНК средством. Обычно, поражающее ДНК средство будет введено перед ингибитором CHK1 Формулы (I). Поражающие ДНК средства включают Gemzar® (гемцитабин), Camptosar® (ириноцетан или CPT-11), Temodar® (темозоломид), Xeloda® (капецитабин), Hycamtin® (топотекан), цисплатин, Eloxatin® (оксалиплатин), Paraplatin® (карбоплатин), камптотецин, ara-C (цитарабин), 5-FU (фторурацил), Cytoxan® (циклофосфамид), Etopophos® или Vepesid® (фосфат этопозида), Vumon® (тенипозид), Adriamycin PFS® или Adriamycin RDF® (доксорубицин), даунорубицин, Alimta® (пометрексед) и облучение В некоторых вариантах реализации изобретения поражающее ДНК средство выбирают из группы, состоящей из гемцитабина, ириноцетана, темозоломида, капецитабина, камптотецина, цисплатина, ara-C и 5-FU. В некоторых вариантах реализации изобретения поражающее ДНК средство выбирают из гемцитабина, ириноцетана, темозоломида и капецитабина. В некоторых вариантах реализации изобретения поражающее ДНК средство выбирают из гемцитабина, ириноцетана, цисплатина, оксалиплатина, карбоплатина и цитарабина. В некоторых вариантах реализации изобретения поражающее ДНК средство выбирают из гемцитабина и ириноцетана. Поражающее ДНК средство вводят в его утвержденной или рекомендованной дозе.
Ввиду способности ингибитора CHK1 усиливать активность многих противораковых средств, ожидается, что с помощью композиций и способов, описанных в данном документе, может быть вылечен широкий диапазон типов опухолей. Эти состояния включают, но без ограничения ими: кардиальные: саркому (ангиосаркому, фибросаркому, рабдомиосаркому, липосаркому), миксому, рабдомиому, фиброму, липому и тератому; легочные: бронхогенную карциному (плоскоклеточный рак, недифференцированный мелкоклеточный, недифференцированный крупноклеточный, аденокарциному), альвеолярную (бронхиолярную) карциному, бронхиальную аденому, саркому, лимфому, хондроматозную гамартому, мезотелиому; желудочно-кишечные: пищевода (плоскоклеточный рак, аденокарциному, леймиосаркому, лимфому), желудка (карциному, лимфому, лейомиосаркому), поджелудочной железы (протоковую аденокарциному, инсулиному, глюкагоному, гастриному, карциноидные опухоли, випому), тонкой кишки (аденокарциному, лимфому, карциноидные опухоли, саркому Капоши, лейомиому, гемангиому, липому, нейрофиброму, фиброму), толстой кишки (аденокарциному, трубчатую аденому, аденому ворсинок, гамартому, лейомиому); мочеполового тракта: почек (аденокарциному, опухоль Вильмса [нефробластому], лимфому, лейкемию), мочевого пузыря и мочеиспускательного канала (плоскоклеточный рак, переходно-клеточный рак, аденокарциному), предстательной железы (аденокарциному, саркому), яичек (семиному, тератому, эмбриональный рак, тератокарциному, хориокарциному, саркому, интерстициальную карциному, фиброму, фиброаденому, аденоматоидные опухоли, липому); печени: гепатому (гепатоцеллюлярную карциному), холангиокарциному, злокачественную опухоль печени, ангиосаркому, гепатоцеллюлярную аденому, гемангиому; кости: остеогенную саркому (остеосаркому), фибросаркому, злокачественную фиброзную гистиоцитому, хондросаркому, саркому Юинга, злокачественную лимфому (ретикулосаркому), множественную миелому, злокачественную гигантоклеточную опухолевую хордому, остеохондрому (костно-хрящевой экзостоз), доброкачественную хондрому, хондробластому, хондромиксофиброму, остеоид-остеому и гигантоклеточные опухоли; нервной системы: черепа (остеому, гемангиому, гранулему, ксантому, деформирующий остит), оболочек головного мозга (менингиому, менингиосаркому, глиоматоз), мозга (астроцитому, медуллобластому, глиому, эпендимому, герминому [пинеалому], мультиформную глиобластому, олигодендроглиому, шванному, ретинобластому, врожденные опухоли), нейрофиброму спинного мозга, менингиому, глиому, саркому); гинекологические: матки (рак эндометрия), шейки матки (рак шейки матки, предопухолевую дисплазию шейки матки), яичников (карциному яичника [серозную цистаденокарциному, муцинозную цистаденокарциному, карциному неуточненной локализации], зернистые-оболочковые опухоли, опухоли из клеток Сертоли-Лейдига, дисгерминому, злокачественную тератому), вульвы (плоскоклеточный рак, внутриэпителиальную карциному, аденокарциному, фибросаркому, меланому), влагалища (светлоклеточную карциному, плоскоклеточную карциному, гроздевидную саркому (эмбриональную рабдомиосаркому], фаллопиевых труб (карциному); гематологические: крови (миелоидный лейкоз [острый и хронический], острый лимфобластный лейкоз, хронический лимфолейкоз, миелопролиферативные заболевания, множественную миелому, миелодиспластический синдром), ходжкинскую лимфому, неходжкинскую лимфому [злокачественную лимфому]; кожи: злокачественную меланому, базально-клеточную карциному, плоскоклеточный рак, саркому Капоши, диспластический невус, липому, ангиому, фиброму кожи, келоидные рубцы, псориаз; молочной железы: инвазивные карциномы молочной железы (инвазивную карциному эпителия протоков и инвазивную очаговую карциному) и т.д.; и надпочечников: нейробластому. Термин гиперпролиферативное заболевание включает идентифицированные выше состояния. Термин "раковая клетка", как предлагают в данном документе, включает клетку, пострадавшую от любого из идентифицированных выше состояний.
В некоторых вариантах реализации изобретения в данном документе, рак выбирают из колоректального рака (в том числе мутаций Ras), мелкоклеточного рака легких, немелкоклеточного рака легких, глиомы, рака яичников, метастатического рака молочной железы, рака поджелудочной железы, гепатобилиарного рака (в том числе гепатоцеллюлярного рака, рака желчных протоков и холангиокарциномы), рака желудка, рака яичек, плоскоклеточного рака головы и шеи, лейкемии (в том числе острого миелоидного лейкоза, острого лимфобластного лейкоза, хронического миелолейкоза и хронического лимфолейкоза), лимфомы (в том числе мантийноклеточной лимфомы, ходжкинской лимфомы и неходжкинской лимфомы) и рака простаты.
В некоторых вариантах реализации изобретения в данном документе рак представляет собой солидную опухоль.
В некоторых вариантах реализации изобретения в данном документе рак выбирают из рака поджелудочной железы, рака яичников и колоректального рака.
В некоторых вариантах реализации изобретения в данном документе рак выбирают из колоректального рака (в том числе мутаций Ras), мелкоклеточного рака легких, немелкоклеточного рака легких и глиомы. В некоторых вариантах реализации изобретения ингибитор CHK1 вводят в комбинации с поражающим ДНК средством. В дополнительном варианте реализации изобретения поражающее ДНК средство представляет собой ириноцетан.
В некоторых вариантах реализации изобретения в данном документе, рак выбирают из немелкоклеточного рака легких, рака яичников, метастатического рака молочной железы, рака поджелудочной железы, гепатобилиарного рака (в том числе гепатоцеллюлярного рака, рака желчных протоков и холангиокарциномы) и рака желудка. В некоторых вариантах реализации изобретения ингибитор CHK1 вводят в комбинации с поражающим ДНК средством. В дополнительном варианте реализации изобретения поражающее ДНК средство представляет собой гемцитабин.
В некоторых вариантах реализации изобретения в данном документе, рак выбирают из колоректального рака (в том числе мутаций Ras), мелкоклеточного рака легких, немелкоклеточного рака легких, рака яичников, гепатобилиарного рака (в том числе гепатоцеллюлярного рака, рака желчных протоков и холангиокарциномы), рака желудка, рака яичек и плоскоклеточного рака головы и шеи. В некоторых вариантах реализации изобретения ингибитор CHK1 вводят в комбинации с поражающим ДНК средством. В дополнительном варианте реализации изобретения поражающее ДНК средство выбирают из группы, состоящей из цисплатина, оксалиплатина и карбоплатина.
В некоторых вариантах реализации изобретения в данном документе, рак выбирают из лейкемии (в том числе острого миелоидного лейкоза, острого лимфобластного лейкоза, хронического миелолейкоза и хронического лимфолейкоза), лимфомы (в том числе мантийноклеточной лимфомы, ходжкинской лимфомы и неходжкинской лимфомы) и рака простаты. В некоторых вариантах реализации изобретения ингибитор CHK1 вводят в комбинации с поражающим ДНК средством. В дополнительном варианте реализации изобретения поражающее ДНК средство представляет собой цитарабин.
Другой вариант реализации изобретения в данном документе предлагает применение соединения Формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения рака.
В другом варианте реализации изобретения способ лечения или предотвращения заболевания или расстройства, модулируемого с помощью CHK1 и/или CHK2, включающий введение млекопитающему, нуждающемуся в подобном лечении, эффективного количества соединения Формулы (I) или его фармацевтически приемлемой соли.
В другом варианте реализации изобретения способ предотвращения или лечения рака, включающий введение млекопитающему, нуждающемуся в подобном лечении, эффективного количества соединения Формулы (I), отдельно или в комбинации с одним или более дополнительными соединениями, имеющими противораковые свойства.
Ингибиторы CHK1, как ожидается, усиливают активность широкого диапазона противораковых средств (или поражающих ДНК средств), когда такое средство(а) запускают CHK1-зависимую контрольную точку клеточного цикла.
Соединение Формулы (I) может быть применимо в комбинации для лечения гиперпролиферативного заболевания у млекопитающего, причем указанная композиция содержит терапевтически эффективное количество соединения Формулы (I) или его фармацевтически приемлемой соли, в комбинации с противоопухолевым средством, выбранным из митотических ингибиторов, алкилирующих средств, антиметаболитов, антисмысловых ДНК или РНК, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов сигнальной трансдукции, ингибиторов клеточного цикла, ингибиторов ферментов, модуляторов рецепторов ретиноидов, ингибиторов протеасомы, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза, антиандрогенов, целевых антител, ингибиторов HMG-CoA редуктазы и ингибиторов пренил-белковой трансферазы.
Соединение Формулы (I) может быть применимо в способе для лечения гиперпролиферативного растройства у млекопитающего, включающем введение указанному млекопитающему терапевтически эффективного количества соединения Формулы (I) или его фармацевтически приемлемой соли, в комбинации с противоопухолевым средством, выбранным из митотических ингибиторов, алкилирующих средств, антиметаболитов, антисмысловых ДНК или РНК, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов сигнальной трансдукции, ингибиторов клеточного цикла, ингибиторов ферментов, модуляторов рецепторов ретиноидов, ингибиторов протеасомы, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза, антиандрогенов, целевых антител, ингибиторов HMG-CoA редуктазы и ингибиторов пренил-белковой трансферазы.
Другой вариант реализации изобретения предлагает соединения Формулы (I) для применения в терапии. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
Другой вариант реализации изобретения предлагает соединения Формулы (I) для применения в лечении гиперпролиферативного заболевания. В дополнительном варианте реализации изобретения гиперпролиферативное заболевание представляет собой рак, в том числе идентифицированные выше состояния. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
Соединения Формулы (I) может быть применимо в фармацевтической композиции для ингибирования аномального роста клеток у млекопитающего, композиция которого содержит количество соединения Формулы (I) или стереоизомера или его фармацевтически приемлемой соли, в комбинации с количеством химиотерапевтического препарата, причем количества соединения, стереоизомера или соли и химиотерапевтического препарата вместе являются эффективными при ингибировании аномального роста клеток. Многие химиотерапевтические препараты известны в данной области техники. В некоторых вариантах реализации изобретения химиотерапевтический препарат выбирают из митотических ингибиторов, алкилирующих средств, антиметаболитов, антисмысловых ДНК или РНК, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов сигнальной трансдукции, ингибиторов клеточного цикла, ингибиторов ферментов, модуляторов рецепторов ретиноидов, ингибиторов протеасомы, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза, антиандрогенов, целевых антител, ингибиторов HMG-CoA редуктазы и ингибиторов пренил-белковой трансферазы.
Соединение Формулы I может быть применим в способе для ингибирования аномального роста клеток у млекопитающего или лечении гиперпролиферативного расстройства, при котором способ включает введение млекопитающему количества соединения Формулы I или его фармацевтически приемлемой соли, в комбинации с облучающей терапией, причем количества соединения или соли, в комбинации с облучающей терапией являются эффективными при ингибировании аномального роста клеток или лечении гиперпролиферативного расстройства у млекопитающего. Технологии введения облучающей терапии известны в данном уровне техники и эти технологии могут быть применимы в комбинированной терапии, описанной в данном документе. Введение соединения Формулы I в этой комбинированной терапии может быть определено таким образом, как это описано в данном документе.
Как полагают, соединение Формулы I может позволить аномальным клеткам быть более чувствительными к лечению с помощью облучения для целей уничтожения и/или ингибирования роста подобных клеток. Соответственно, соединение Формулы I может быть применимо в способе сенсибилизации аномальных клеток у млекопитающего для лечения с помощью облучения, чей способ включает введение млекопитающему количества соединения Формулы I или стереоизомера, или его фармацевтически приемлемой соли, количество которого является эффективным при сенсибилизации аномальных клеток для лечения облучением. Количество соединения, стереоизомера или соли, которое может быть применимо в этом способе, может быть определено в соответствии со способами для установления эффективных количеств подобных соединений, как описано в данном документе, или с помощью способов, известных специалистам в данной области техники.
Другой вариант реализации изобретения предлагает применение соединения Формулы I или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения гиперпролиферативных заболеваний. В дополнительном варианте реализации изобретения гиперпролиферативное заболевание может быть раком, в том числе идентифицированными выше состояниями. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
Другой вариант реализации изобретения предлагает применение соединения Формулы I в производстве лекарственного средства, предлагают для применения в качестве ингибитора CHK1 и/или CHK2 при лечении пациента, проходящего терапию рака, в том числе идентифицированные выше состояний. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
Другой вариант реализации изобретения предлагает применение соединения Формулы I в лечении гиперпролиферативного заболевания. В дополнительном варианте реализации изобретения гиперпролиферативное заболевание представляет собой рак, в том числе идентифицированные выше состояния. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
Другой вариант реализации изобретения предлагает применение соединения Формулы I в производстве лекарственного средства для применения в качестве ингибитора CHK1 и/или CHK2 при лечении пациента, проходящего терапию рака. В дополнительном варианте реализации изобретения применение также включает применение поражающего ДНК средства.
В другом варианте реализации изобретения предлагают фармацевтическую композицию, содержащую соединение Формулы I для применения в лечении гиперпролиферативного заболевания.
В другом варианте реализации изобретения предлагают фармацевтическую композицию, содержащую соединение Формулы I для применения в лечении рака.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Соединение Формулы (I), описанное в данном документе, и его фармацевтически приемлемые соли могут быть применены отдельно или в комбинации с другими терапевтическими средствами для лечения. Соединение Формулы (I) может быть применимо в комбинации с одним или более дополнительными лекарственными средствами, например, противовоспалительным соединением, которое работает по иному механизму действия. Второе соединение состава фармацевтической композиции или режим дозирования предпочтительно имеет дополнительные такие действия по отношению к соединению Формулы I, что они не будут негативно влиять друг на друга. Подобные молекулы являются подходящими для того. чтобы присутствовать в комбинации в количествах, которые являются эффективными в предназначенных целях. Соединения могут быть введены вместе в единой фармацевтической композиции или отдельно и, при условии, что вводят отдельно, это может происходить одновременно или последовательно в любом порядке. Подобное последовательное введение может быть близким по времени или удаленным во времени.
ПРИМЕРЫ
Для того, чтобы проиллюстрировать изобретение, предлагают следующий пример. Тем не менее, следует понимать, что этот пример не ограничивает изобретение и только означает предложение способа практического применения изобретения. Специалисту в данной области техники будет понятно, что описанные химические реакции, могут быть легко адаптированы к альтернативным способам получения соединения по этому изобретению, которые считаются входящими в объем по этому изобретению.
В описанных ниже примерах, если не указано иное, все температуры приведены в градусах Цельсия (°C). Реагенты приобретали у коммерческих поставщиков, таких как Sigma-Aldrich Chemical Company, и применяли без дополнительной очистки, если не указано иное.
Пример 1: Получение (R)-5-бромо-4-(3-амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина:

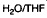
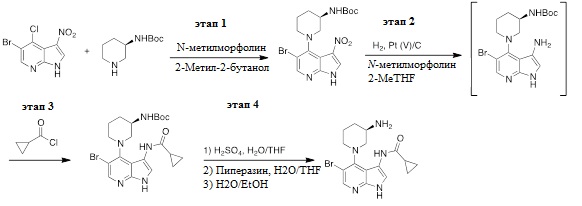
Этап 1: Получение (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридина:
В заполненный инертной атмосферой 10 л реактор с рубашкой, оборудованный механической мешалкой, азотным/вакуумным коллектором, термопарой и конденсатором, загружали 2-метил-2-бутанол (3,30 л), 5-бромо-4-хлоро-3-нитро-1H-пирроло[2,3-b]пиридин (330 г, 1,00 экв.), (R)-трет-бутилпиперидин-3-илкарбамат (456 г, 2,00 экв.) и N-метилморфолин (115 г, 1,00 экв.). Реакционную смесь перемешивали при 85°C в течение 48 ч. и охлаждали до 20°C. Смесь затем промывали с помощью 15 масс. % водного раствора уксусной кислоты (3,30 кг.) и воды (3,30 кг.). Большая часть 2-метил-2-бутанола перегоняли под вакуумом при 50°C. Чтобы довести смесь обратно до ее первоначального объема добавляли ацетонитрил. Непрерывную перегонку проводили до того момента, пока не добавляли в общем 10,3 кг ацетонитрила. Воду (3,20 кг.) медленно загружают в суспензию в течение примерно 1 ч. при 55 °C. Дисперсию медленно охлаждали до 20°C за 4 ч. Получаемое твердое вещество собирали с помощью фильтрации и промывали с помощью 1:1 (об./об.) смеси ацетонитрила и воды (1,60 л). Продукт высушивали в вакуумной печи в атмосфере азота при 70°C для обеспечения 358 г (69% выхода) (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридина в виде желтого твердого вещества. ЯМР 1H (600 МГц, ДМСО-d6): δ 13,12 (с, 1H), 8,60 (с, 1H), 8,39 (с, 1H), 6,80 (д, J = 6,8 Гц, 1H), 3,49 (м, 1H), 3,34 (м, 2H), 3,22 (т, J = 11,2 Гц, 1H), 3,00 (т, J = 10,2 Гц, 1H), 1,88 (дд, J = 12,3, 2,8 Гц, 1H), 1,74 (м, 2H), 1,38 (м, 1H), 1,34 (с, 9H). 13C ЯМР (150 МГц, ДМСО-d6): δ 154,8, 148,9, 148,2, 147,9, 130,6, 128,5, 113,8, 109,6, 77,6, 54,7, 48,9, 47,3, 30,0, 28,1 (3C), 24,2. HRMS–ESI (м/з): [M + H]+ рассч. для C17H23BrN5O4, 440,0928; обнаружено, 440,0912.
Этапы 2 и 3: Получение (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина:
В заполненный инертной атмосферой 1 л реактор с рубашкой загружали (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридин (75,0 г, 1,00 экв.), 1% Pt + 2% V/C (11,3 г, 15 масс. %), N-метилморфолин (29,3 г, 1,70 экв.) и 2-MeTHF (750 мл). Реакционную смесь перемешивали при 50ºC при 5 бар водорода в течение минимум 2 ч. Циклопропанкарбонилхлорид (26,7 г, 1,50 экв.) загружали в реактор за 10 мин при 15ºC. Реакционную смесь перемешивали при 25ºC в течение 1 ч. и отфильтровывали сквозь целит. Фильтрпрессную лепешку промывали с помощью 2-MeTHF (150 мл). Фильтрат промывали с помощью 15 масс. % водного раствора хлорида аммония (450 мл) и воды (450 мл) и затем перегоняли в вакууме до 1/3 его первоначального объема. Чтобы довести смесь обратно до ее первоначального объема добавляли толуол. Непрерывную вакуумную перегонку проводили при 55ºC при добавлении толуола, до тех пор, пока 2-MeTHF составлял ниже 2 масс. %. Получаемое твердое вещество выделяли с помощью фильтрации, промывали с помощью толуол и высушивали в вакуумной печи при 40ºC в течение ночи для получения 69,8 г (69% скорректированного выхода) (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина (1:1 толуол сольват) в виде белесоватого твердого вещества. ЯМР 1H (600 МГц, THF-d8, 4ºC): δ 10,76 (с, 1H), 9,72 (с, 1H), 8,15 (с, 1H), 7,90 (д, J = 2,4 Гц, 1H), 7,18–7,08 (м, 5H), 6,41 (д, J = 7,8 Гц, 1H), 3,82 (м, 1H), 3,60 (м, 1H), 3,44 (т, J = 10,6 Гц, 1H), 3,30 (дд, J = 10,6, 3,9 Гц, 1H), 3,03 (д, J = 10,9 Гц, 1H), 2,29 (с, 3H), 2,08 (м, 1H), 1,89 (м, 2H), 1,66 (м, 1H), 1,37 (с, 9H), 1,36 (м, 1H), 0,95–0,80 (м, 4H). 13C ЯМР (150 МГц, THF-d8, 4ºC): δ 170,0, 155,8, 149,0, 147,8, 147,6, 138,4, 129,6 (2C), 128,9 (2C), 126,0, 116,6, 115,6, 111,9, 108,8, 78,5, 55,8, 50,2, 49,1, 31,8, 28,6 (3C), 26,3, 21,5, 15,8, 7,70, 7,56. HRMS–ESI (м/з): [M + H]+ рассч. для C21H29BrN5O3, 478,1448; обнаружено, 478,1431.
Этап 4: Получение (R)-5-бромо-4-(3-амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина:
В заполненный инертной атмосферой 1 л реактор с рубашкой, оборудованный механической мешалкой, азотным/вакуумным коллектором, термопарой и конденсатором, загружали (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридин (1:1 толуол сольват) (30,0 г, 1,00 экв.), тетрагидрофуран (180 мл, 6,00 мл/г), после чего 4,5 M серную кислоту (36,1 мл, 3,00 экв.). Реакционную смесь перемешивали при 50 ± 5°C в течение 2 ч. и затем охлаждали до 20°C. Водный раствор пиперазина (42,4 г растворяли в 190 мл воды) добавляли медленно при 25°C с последующий добавлением 15,0 мл насыщенного солевого раствора. Нижний водный слой удаляли. Получаемый раствор перемешивали при 20°C в течение 5 мин. Добавляли воду (22,0 мл). Продолжительную дистилляцию проводили при 50°C с помощью регулирования скорости подачи этанола в соответствии со скоростью перегонки до того момента, пока не добавляли в общем 260 мл этанола. Воду (340 мл) добавляли при 50°C за 1 ч. Получаемое твердое вещество выделяли с помощью фильтрации, промывали с помощью 20% этанола в воде(2 × 60 мл) и высушивали в вакуумной печи при 50ºC в течение ночи для получения 16,4 г (78% скорректированного выхода) (R)-5-бромо-4-(3-амино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридина в виде светложелтого твердого вещества. (Примечание: Спектры протона (1H) и углерода-13 (13C) продукта в виде свободного основания являются очень широкими. Таким образом, приведенные ниже спектры являются спектрами свободного основания, превращенного в соль бис-HCl.) ЯМР 1H (300 МГц, ДМСО-d6): δ 11,98 (уш., 1H), 9,78 (с, 1H), 8,44 (уш., 3H), 8,25 (с, 1H), 7,45 (д, J = 2,4 Гц, 1H), 3,57 (м, 1H), 3,43 (м, 1H), 3,41 (м, 1H), 3,28 (м, 1H), 3,14 (м, 1H), 2,15 (м, 1H), 1,90 (пента, J = 6,5 Гц, 1H), 1,81 (м, 1H), 1,72 (м, 1H), 1,52 (м, 1H), 0,83 (м, 4H). 13C ЯМР (75 МГц, ДМСО-d6): δ 172,9, 149,5, 145,9, 145,1, 121,9, 114,2, 113,1, 107,8, 53,8, 51,1, 47,5, 28,6, 24,37, 14,7, 7,55, 7,45. HRMS–ESI (м/з): [M + H]+ рассч. для C16H21BrN5O, 378,0924; обнаружено, 378,0912.
Пример 2:
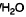
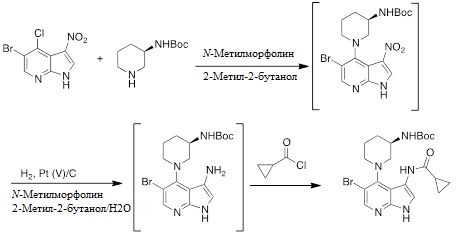
Альтернативно, соединение (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-(циклопропанкарбоксамидо)-1H-пирроло[2,3-b]пиридин может быть получено из 5-бромо-4-хлоро-3-нитро-1H-пирроло[2,3-b]пиридина и (R)-трет-бутилпиперидин-3-илкарбамата посредством прямого способа без выделения (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридина. Изменения в существующей процедуре показаны ниже: Раствор (R)-5-бромо-4-(3-(трет-бутоксикарбониламино)пиперидин-1-ил)-3-нитро-1H-пирроло[2,3-b]пиридина гидрируют непосредственно в 2-метил-2-бутаноле после водных промывок с помощью 15 масс. % водного раствора уксусной кислоты (10,0 г/г) и воды (10,0 г/г). Концентрацию раствора в 2-метил-2-бутаноле определяли с помощью анализа массы на основе ВЭЖХ.