Результат интеллектуальной деятельности: МИКРОФЛЮИДНОЕ УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ ВЛИЯНИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ НА КЛЕТКИ МЛЕКОПИТАЮЩИХ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биохимии и может быть использовано для исследования влияния различных химических веществ на клетки млекопитающих в условиях in vitro, в частности, может применяться для проведения стандартизованных однотипных одномоментных независимых доклинических исследований гепатотоксичности и/или биотрансформации лекарственных средств. Микрофлюидное устройство может применяться в лабораториях, проводящих тестирование и разработку фармацевтических препаратов и косметической продукции.
Уровень техники
Согласно национальным нормативным документам, доклинические исследования токсичности лекарственных средств проводятся с использованием лабораторных животных. В то же время известно, что ответ различных организмов на воздействие ксенобитиков характеризуется видовой специфичностью, определяющей, в том числе, и степень токсичности вещества для организма. В связи с этим ряд разрабатываемых лекарственных субстанций и средств являются не токсичными для лабораторных животных, но оказываются токсичны для человека. На сегодняшний день все активнее развиваются методики оценки видоспецифичной для человека токсичности лекарственных средств и их комбинаций в исследованиях in vitro с использованием в качестве объекта клеточных моделей органов и тканей человека.
Для облегчения вывода из организма лекарственные вещества, как правило, превращаются в более гидрофильные вещества. Эта биотрансформация лекарственных веществ может влиять на биологическую активность ксенобиотика: в результате превращения может произойти как инактивация, так и повышение токсичности исходного соединения.
Биотрансформация включает в себя множество путей, условно их делят на метаболизм 1-й и 2-й фазы. В 1-й фазе происходит образование функциональных групп, которые позволяют образовывать конъюгаты на 2-й фазе. Практически всегда биотрансформация катализируется ферментами и чаще всего это происходит в печени.
Многие реакции биотрансформации лекарственных средств могут быть индуцированы или ингибированы другими препаратами при их совместном приеме. Это может приводить к уменьшению или увеличению концентрации препарата и его метаболитов (включая активные или токсические метаболиты) в плазме крови. Знание особенностей биотрансформации препарата позволяет избежать клинические последствия в виде неэффективности лекарственных средств и их избыточной токсичности.
Биотрансформация большинства лекарственных соединений протекает в печени под действием цитохромов Р450. Цитохромы Р450 - это ферменты, связанные с мембраной, которые в основном локализуются в эндоплазматическом ретикулуме, но могут быть также расположены в других органеллах, например, в митохондриях. Цитохромы Р450 содержат атом железа в порфириновом комплексе и катализируют реакции окисления и, при определенных условиях, могут катализировать также восстановление субстрата. Изучение вклада различных изоформ цитохрома Р450 в общий метаболизм лекарственного средства позволяет, в частности, определить форму выведения препарата из организма: в неизмененном виде или по одному из метаболических путей. Помимо этого, знание путей биотрансформации позволяет оценить влияние особенностей метаболизма пациента.
Результаты исследований, проведенных на лабораторных животных, также, как и в случае оценки токсичности, не могут быть в полной мере экстраполированы на человека в связи со значительными межвидовыми отличиями функционирования изоферментов цитохрома Р-450 [Seri В. et al. Cell types, lineage, and architecture of the germinal zone in the adult dentate gyrus. // J. Comp. Neurol. 2004. Vol. 478, No 4. P. 359-378]. С другой стороны, исследования не могут проводиться исключительно на добровольцах, так как сопряжены с риском для здоровья человека и являются высокозатратными. В этой связи все большее применение находят экспериментальные исследования процессов биотрансформации ксенобиотиков в печени человека in vitro с использованием в качестве объекта наблюдения срезов или клеток печени, а также отдельных субклеточных структур. Клеточные линии гепатоцитов, а также клеточные модели печени человека считаются перспективными объектами при изучении острой токсичности лекарственных средств в лабораторных тестах in vitro на доклиническом этапе.
Из уровня техники известен прибор ONIX производства CellASIC [Lee P. et al. Automated live cell imaging of cell migration across a microfluidic-controlled chemoattractant gradient. // Nat Meth. 2015. Vol. 12. No 11], предназначенный для проведения доклинических исследований фармакологических препаратов на клеточных моделях. В данном приборе клетки культивируются в двух 96-луночных планшетах. Недостатками прибора является отсутствие возможности длительного культивирования клеток и отсутствие замкнутого режима.
Из патента US 9273276 известно фармакокинетическое устройство для культивирования клеток, которое может быть использовано для тестирования лекарственных препаратов. Устройство содержит, в одном из вариантов осуществления изобретения, первое микромасштабное устройство культивирования и инструмент управления. Первое микромасштабное устройство культивирования включает несколько микромасштабных резервуаров с геометрией, симулирующей множество взаимодействий in vivo с культуральной средой, при этом каждый резервуар снабжен входным и выходным отверстиями для протекания через него культуральной среды, сами резервуары соединены микроканалом.
Недостатком данного решения является наличие единственного контура для культивирования клеток на одном устройстве, что затрудняет проведение масштабных исследований и приводит к увеличению стоимости каждого исследования в отдельности.
Из патента РФ №2517046 известно устройство «орган-на-чипе», которое может быть использовано для культивирования, исследования и тестирования тестовых соединений на тканях, органоидах и нишах стволовых клеток в формате миниатюризированной интегральной схемы. Устройство содержит резервуары для подачи среды; секции роста органов с полостями для органов; резервуары для сброса среды. Полость для органов посредством микрожидкостных каналов соединена с резервуаром для подачи среды и резервуаром для сброса среды. Посредством заявленного автономного устройства осуществляют культивирование клеток и органоидов, путем загрузки суспензии клеток или среза ткани в полости для органов, герметизации данных полостей, а также тестирование тестовых соединений на клетках и органоидах с последующей их микроскопической оценкой и определением параметров среды датчиками. Такое соединение «полости для органов» с резервуаром для сброса среды, объединенного с контролируемым датчиками устройством, обеспечивает долговременное культивирование клеток и возможность перемещения данного устройства без отсоединения жидкостных каналов от внешнего резервуара для сброса, что обеспечивает автономность функционирования устройства и расширение круга его использования в клеточных технологиях.
Однако конструкция данного устройства не обладает замкнутым контуром среды для культивирования органов, что не позволяет проводить изучение биотрансформации лекарственных средств, а также проводить сопоставление результатов изучения токсичности, полученных с использованием других методов.
Наиболее близким к предлагаемому изобретению является микрофлюидный чип, известный из патента RU 2584598 и предназначенный для испытаний лекарственных препаратов, создания клеточных моделей тканей и органов млекопитающих и моделирования межорганных взаимодействий. Чип содержит пластину из поликарбоната, на которой отлит слой полидиметилсилоксана с размещенной в нем микрофлюидной системой. Микрофлюидная система включает микрожидкостный контур, состоящий из объединенных микрожидкостными каналами шести ячеек для одновременного культивирования клеточных моделей тканей и органов млекопитающих. Изобретение обеспечивает более аутентичное поведение клеточных моделей органов при культивировании, а, следовательно, и получение более достоверных результатов при тестировании воздействия различных препаратов на жизнеспособность моделей.
Необходимо отметить, что применение известного микрофлюидного чипа при проведении рутинных исследований, таких как изучение гепатотоксичности или биотрансформации лекарственных препаратов, представляется затруднительным: наличие одного контура для культивирования клеток приводит к большим затратам времени на тестирование лекарственных препаратов. При этом известный микрофлюидный чип не обладает возможностью масштабирования, что обусловлено целым рядом факторов, связанных как с технологией изготовления самого чипа, так и с методологией проведения исследований с его помощью.
Раскрытие изобретения
Технология изготовления известных микрофлюидных чипов предполагает, как правило, приклеивание предметного стекла к слою ПДМС, поэтому необходимым является наличие достаточно толстых стенок у микроканалов и других элементов микрофлюидной системы в целях обеспечения герметичности в местах примыкания слоя ПДМС к предметному стеклу. Кроме того, для реализации условий микроциркуляции необходимо соблюдение требований к общей длине микрофлюидного контура, а также к характерным размерам его элементов. С другой стороны, поскольку исследования, как правило, проводятся с использованием стандартного оптического микроскопа, то размеры микрофлюидного чипа не должны превышать размеров стандартного предметного стекла. Следовательно, простое уменьшение габаритов известных микрофлюидных устройств и размещение нескольких его экземпляров в ограниченном пространстве чипа (то есть стандартное масштабирование известного решения) приведет к нарушению требований к реализации условий микроциркуляции, нарушению технологии изготовления, а также ко взаимному влиянию микрофлюидных контуров, размещенных на одном чипе. Поэтому разработка устройства, обладающего несколькими замкнутыми контурами для культивирования и при этом, обеспечивающего исследование ответного воздействия на клетки или клеточные модели различных химических веществ в условиях, приближенных к in vivo, является нетривиальной задачей. Следует также отметить, что в рамках решения задачи исследования влияния химических веществ на клеточную модель органа или ткани для обеспечения статистической достоверности минимально необходимо проведение четырех испытаний. Таким образом, размещение четырех контуров на чипе позволило бы выполнять статистически достоверное исследование с использованием одного чипа.
Задача настоящего изобретения заключалась в разработке микрофлюидного устройства для исследования влияния различных веществ на клетки или клеточные модели, включая исследование безопасности лекарственных препаратов, в частности, их гепатотоксичности и/или биотрансформации, характеризующегося топологией размещения микрофлюидных элементов, обеспечивающей, с одной стороны, размещение максимального количества контуров (не менее четырех) на ограниченной площади, а с другой стороны - максимальное соответствие условий in vitro условиям in vivo в процессе проведения исследований с обеспечением надежности устройства в процессе его работы и технологичности при его изготовлении.
Техническим результатом является сокращение временных затрат на проведение исследований при реализации in vitro условий культивирования, максимально приближенных к физиологическим.
Указанный технический результат может быть получен при выполнении микрофлюидного устройства в виде биочипа, в котором реализуются независимое культивирование не менее четырех клеточных моделей с имитацией микроциркуляции. При этом размеры чипа соответствуют размерам стандартного предметного стекла, что позволяет проводить исследования клеточных моделей тканей и органов оптическими методами без необходимости их изъятия.
Поставленная задача решается тем, что микрофлюидное устройство для исследования влияния химических веществ на клетки млекопитающих представляет собой чип с размещенной в нем микрофлюидной системой, при этом микрофлюидная система выполнена в виде четырех однотипных независимых замкнутых контуров для циркуляции питательной среды, каждый из которых включает объединенные микрожидкостными каналами микронасос для обеспечения движения питательной среды в контуре, клеточную ячейку для культивирования клеточных моделей тканей и органов млекопитающих, демпфирующий элемент для гашения скачков давления и скорости движения питательной среды в контуре и технологическое отверстие для доступа к питательной среде в контуре.
В предпочтительном варианте реализации изобретения чип имеет трехслойную структуру, выполненную из оптически прозрачного материала. Верхний слой чипа может быть образован пластиной из поликарбоната, на нижней стороне которой размещен слой полидиметилсилоксана, а нижний слой может быть образован стандартным предметным стеклом, при этом микрофлюидная система расположена в слое полидиметилсилоксана с обеспечением герметизации каналов посредством предметного стекла. Пластина из поликарбоната может быть выполнена толщиной от 5 до 10 мм, слой полидиметилсилоксана - толщиной от 1 до 2 мм, а предметное стекло - толщиной от 0,16 до 1 мм.
Демпфирующий элемент может представлять собой демпфирующую камеру с эластичной мембраной, сообщающейся сверху со сквозным отверстием, выполненным в пластине из поликарбоната, а снизу - с демпфирующей камерой. Предпочтительно мембрана демпфирующего элемента выполнена из полидиметилсилоксана толщиной от 0,1 до 0,6 мм и диаметром от 1 до 10 мм.
В одном из вариантов выполнения изобретения пары соседних микрофлюидных контуров обладают взаимной центральной симметрией с расположением всех центров симметрии на одной прямой.
Микронасос может представлять собой рабочую камеру, ограниченную с двух сторон нормально закрытыми клапанами, при этом рабочая камера и нормально закрытые клапаны выполнены в виде уширений микрожидкостного канала в форме цилиндра, закрытого сверху эластичной мембраной, а каждый клапан снабжен размещенной на мембране перемычкой, выполненной с возможностью перекрытия канала. Предпочтительно мембраны рабочей камеры и клапанов выполнены из полидиметилсилоксана толщиной от 0,1 до 0,6 мм и диаметром от 1 до 10 мм.
Клеточная ячейка может быть выполнена в форме цилиндра высотой от 1 до 2 мм и диаметром от 2 до 10 мм.
Микрофлюидное устройство выполнено с габаритными размерами, не превышающими 70-80 мм × 20-30 мм. Замкнутый контур выполнен длиной, выбранной из диапазона от 36 до 76 мм.
В предпочтительном варианте выполнения микрожидкостные каналы выполнены прямоугольного сечения с высотой от 0,1 мм до 1 мм и шириной от 0,1 до 1 мм, в месте соединения с демпфером имеют округлое расширение с радиусом кривизны от 0,5 до 1 мм, а в месте соединения с клеточной ячейкой имеют округлое расширение с радиусом кривизны от 0,1 до 2,1 мм.
Технологическое отверстие может быть выполнено диаметром от 1 до 10 мм.
Краткое описание чертежей
Изобретение поясняется чертежами и графиками.
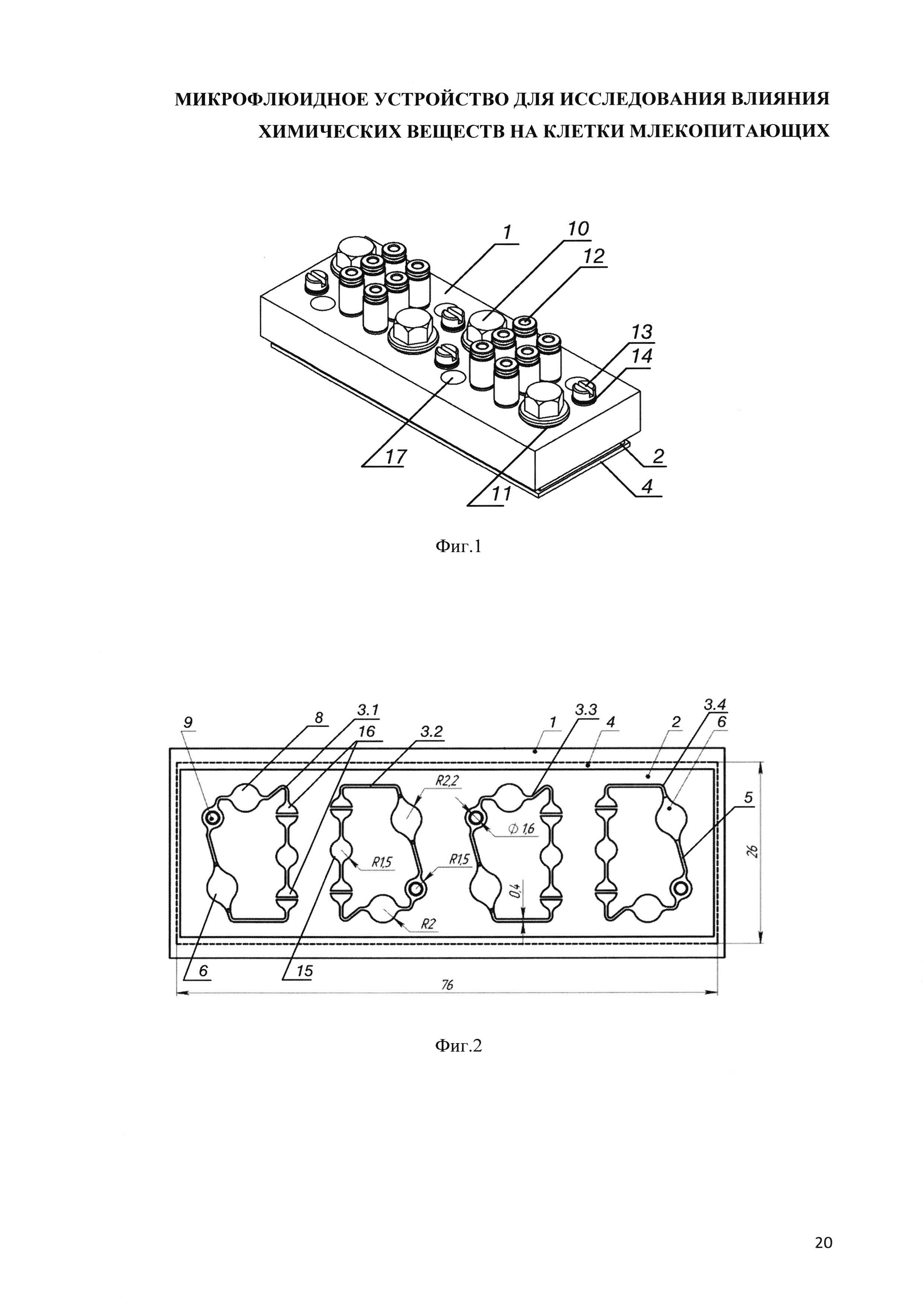
На фиг. 1 представлен общий вид микрофлюидного устройства.
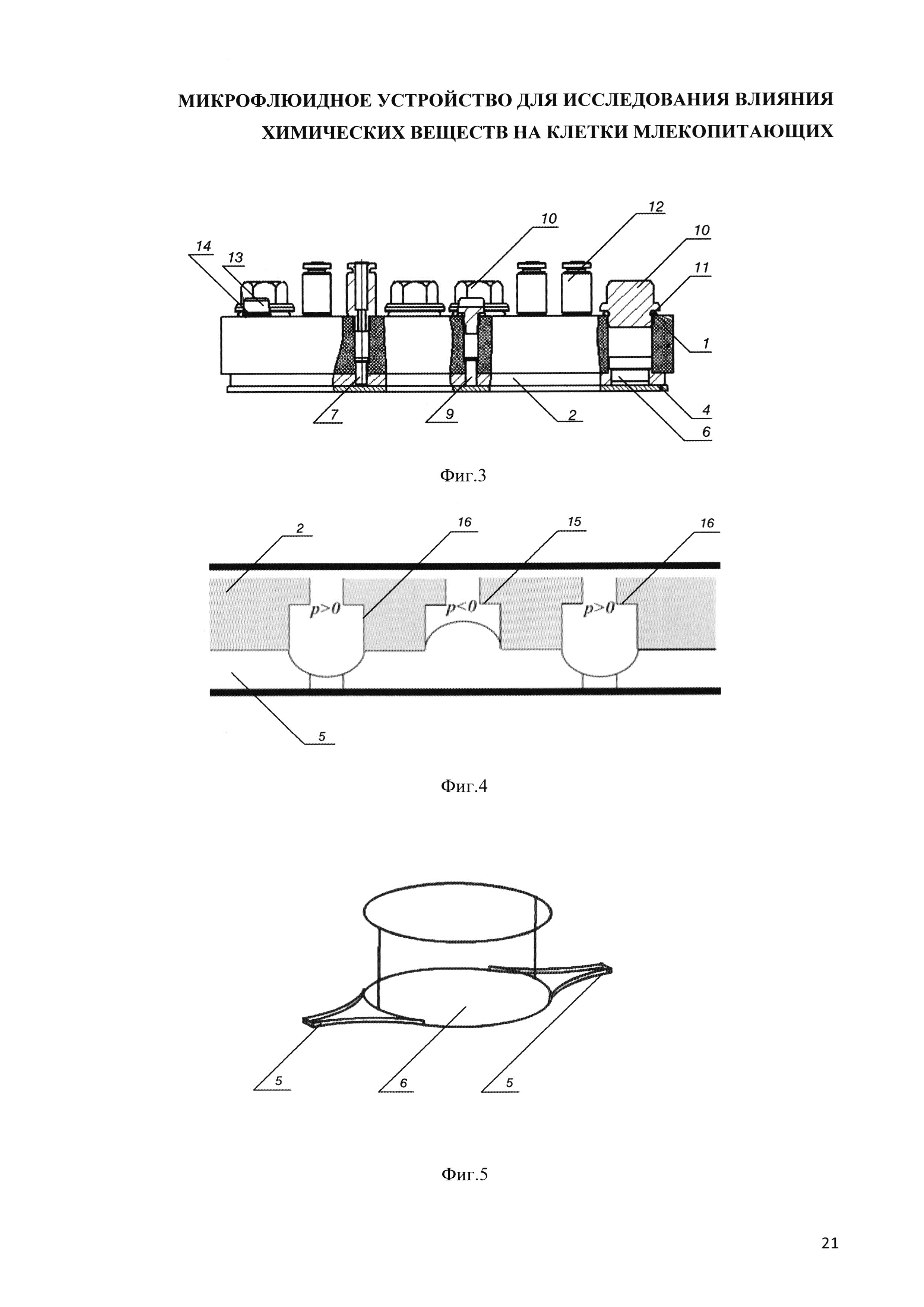
На фиг. 2. представлено схематичное изображение заявляемого устройства, вид снизу.
На фиг. 3 представлено схематичное изображение заявляемого устройства вид сбоку.
На фиг. 4 - схематичное изображение насоса, вид сбоку.
На фиг. 5 - общий вид клеточной ячейки.
На фиг. 6 - макет разработанного устройства, общий вид.
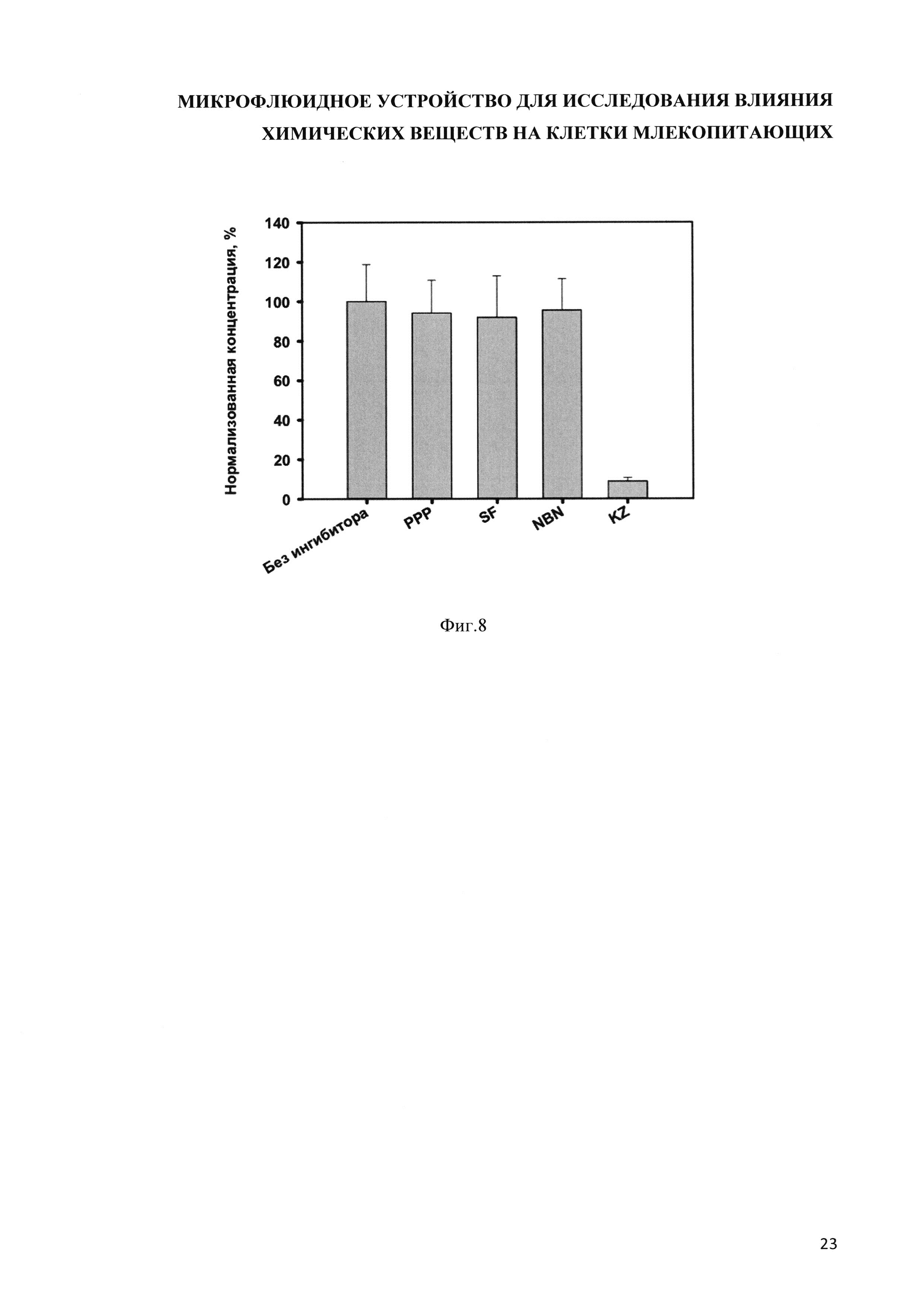
На фиг. 7 представлена диаграмма, иллюстрирующая влияние специфических ингибиторов цитохромов на биотрансформацию циклофосфамида (по вертикальной оси отложены значения концентраций метаболита циклофосфамида, N-дехлорэтил-циклофосфамида, при добавлении ингибиторов, нормализованные относительно значения концентрации N-дехлорэтил-циклофосфамида, измеренного в отсутствии ингибиторов).
Позициями на чертежах обозначены: 1 - пластина из поликарбоната (основа), 2 - слой полидиметилсилоксана (ПДМС), 3.1 - первый замкнутый контур для циркуляции питательной среды, 3.2 - второй замкнутый контур для циркуляции питательной среды, 3.3 - третий замкнутый контур для циркуляции питательной среды, 3.4 - четвертый замкнутый контур для циркуляции питательной среды, 4 - предметное стекло, 5 - микрофлюидный канал (микроканал), 6 - клеточная ячейка для культивирования клеточных моделей тканей и органов млекопитающих, 7 - микронасос, 8 - демпфирующий элемент, 9 - технологическое отверстие, 10 - пробка клеточной ячейки, 11 - уплотнительное кольцо пробки, 12 - фитинг для подключения пневматических трубок, 13 - заглушка технологического отверстия, 14 - уплотнительное кольцо заглушки, 15 - рабочая камера микронасоса, 16 - нормально закрытый клапан микронасоса, 17 - отверстие в пластине из поликарбоната, сообщающееся с демпфирующим элементом.
Осуществление изобретения
Конструкция микрофлюидного устройства (чипа) представляет собой по меньшей мере, трехслойную структуру, выполненную из оптически прозрачного материала (см. фиг. 1, 3). Ниже представлено описание заявляемого устройства с указанием конкретных параметров его элементов, которые не ограничивают настоящее изобретение, а предназначены лишь для лучшего понимания его сущности. В частности, верхний слой устройства может быть образован пластиной 1, выполненной, например, из поликарбоната толщиной 10 мм, на нижней стороне которой размещен слой из газопроницаемого эластичного органического материала, например, полимерного оптически прозрачного полидиметилсилоксана (ПДМС) 2 толщиной 2 мм, содержащего, по меньшей мере, четыре независимых однотипных замкнутых контура 3 для циркуляции питательной среды, а также нижний слой, образованный стандартным предметным стеклом 4 толщиной 1 мм, формирующим нижнюю стенку контуров. Каждый из замкнутых контуров содержит (см. фиг. 2) расположенные по направлению циркуляции питательной среды и объединенные системой микрофлюидных (микрожидкостных) каналов 5 клеточную ячейку 6 для культивирования клеток или клеточных моделей тканей и органов млекопитающих, микронасос 7, обеспечивающий непрерывную перфузию питательной среды, демпфирующий элемент 8 в виде гибкой эластичной мембраны, которая обеспечивает плавное изменение давления в клеточной ячейке и технологическое отверстие 9 для заполнения контура и вывода из него воздуха и излишков культуральной среды. Микрофлюидные каналы, соединяющие элементы каждого контура, выполнены прямоугольного сечения (например, с высотой 0.1 мм и шириной 0.4 мм). Применение каналов постоянного сечения позволило обеспечить приемлемую технологичность формы для литья слоя ПДМС при сохранении условий культивирования клеток, приближенных к физиологическим, при наличии микроциркуляции. Минимальная длина замкнутого контура составляет 36 мм, максимальная длина - 76 мм.
Клеточная ячейка 6 каждого контура сверху герметизирована пробкой 10 с уплотнительным кольцом 11, расположенной в сквозном отверстии, выполненном в слое поликарбоната пластины 1 над клеточной ячейкой и закрепленной в ней с помощью резьбового соединения. В одном из вариантов исполнения, диаметр сквозного отверстия в слое поликарбоната соответствует диаметру клеточной ячейки. В пластине 1 из поликарбоната также выполнены резьбовые отверстия для фитингов 12 (например, с метрической резьбой М3), которые могут представлять собой пружинную цангу с уплотнительным кольцом. Фитинги 12 обеспечивают герметичное соединение насосов 7 микрофлюидного чипа с микробиореактором (например, «Гомункулус») с помощью воздушных трубок (для приведения в действие микронасосов). Технологическое отверстие 9 выполнено в виде расширения микроканала 5 в форме круга диаметром, например, 2 мм, сообщающимся со сквозным отверстием в пластине 1 из поликарбоната, выполненным такого же диаметра и снабженного резьбой для установки заглушки 13 с уплотнительным кольцом 14.
Каждая клеточная ячейка 6 выполнена цилиндрической формы (см. фиг. 5), при этом боковые стенки ячейки образованы слоем ПДМС, а дно ячейки образовано предметным стеклом, герметизирующим микроканалы 5. Микрофлюидные каналы в местах соединения с клеточной ячейкой образуют уширения, при этом проекции границ каналов в месте уширения на плоскость предметного стекла имеют форму расходящихся кривых с радиусом кривизны, например, 2,1 мм (с целью устранения неоднородностей и обеспечения более равномерного распределения поля скоростей по площади ячейки), а проекция клеточной ячейки представляет собой окружность, например, с диаметром 4,2 мм, при этом продольная ось каналов проходит через центр окружности. Высота ячейки выбрана из условия обеспечения величин касательных напряжений на клеточной модели ткани или органа в пределах физиологических значений, и может составлять 2 мм. Допустимая величина отклонения от указанных параметров в данной конкретной реализации может составлять не более чем 10%.
Микронасос 7, интегрированный в замкнутый контур, является перистальтическим и представляет собой, например, для описываемого варианта исполнения, рабочую камеру 15, ограниченную с двух сторон нормально закрытыми клапанами 16 (см. фиг. 4). При этом рабочая камера и нормально закрытые клапаны выполнены в виде уширений микроканала в форме цилиндра высотой 1 мм, образующего в проекции на плоскость предметного стекла круг диаметром 3 мм, и закрытых сверху эластичной мембраной из ПДМС толщиной 0,53 мм и диаметром 3 мм. При этом каждый клапан снабжен перемычкой шириной 0,4 мм и высотой 0,1 мм, размещенной на мембране, обеспечивающей возможность перекрытия микроканала. При подаче на клапан воздуха под давлением ниже атмосферного - клапан открывается, при подаче воздуха под давлением выше атмосферного - клапан герметично закрывается. Преимуществами данных клапанов является высокая технологичность изготовления, обусловленная использованием только одного слоя ПДМС. Положение трех мембран каждого микронасоса контролируется устройством управления пневматически, посредством воздушных трубок, подключенных к соответствующим фитингам 12. Переключение повышенного и пониженного давления на клапанах и мембране рабочей камеры микронасоса в определенной последовательности обеспечивает циркуляцию жидкости (питательной среды) по микроканалам 5 через ячейки 6 в определенном направлении и с определенной скоростью.
Перистальтический насос 7 создает резкие пульсации тока жидкости с частотой, равной частоте работы клапанов, которые оказывают пагубное воздействие на культивируемые клетки человека. Для того, чтобы минимизировать ударное воздействие микронасоса на клеточные модели, в каждом замкнутом независимом контуре 3 МФУ расположен демпфирующий элемент 8 в виде интегрированной в контур мембраны (например, диаметром 4 мм), расположенной на расстоянии не менее 5 мм от перистальтического насоса и представляющей собой истонченный слой ПДМС, который снизу сообщается с питательной средой, протекающей в микроканале, а сверху - с атмосферой посредством отверстия 17, выполненного в пластине 1 из поликарбоната, что позволяет гасить резкие скачки давления и скорости жидкости в микроканалах и не создавать стрессовую ситуацию для клеток в клеточной ячейке. При этом микроканал непосредственно под мембраной выполнен с расширением, повторяющим форму мембраны. Толщина мембраны демпфера может варьироваться от 0,2 мм до 0,4 мм. Данный диапазон удовлетворяет требованиям к работе демпфера и возможности его изготовления. Если мембрана будет тоньше, она будет рваться при изготовлении, если мембрана будет толще, она перестанет сглаживать поток. При этом отверстие 17 выполнено диаметром не менее 5 мм, что обеспечивает необходимую для подвижности демпфера воздушную полость. Такая конструкция проста в реализации, надежна и не будет приводить к контаминации. Микроканалы в месте соединения с демпфером имеют округлое расширение с радиусом кривизны от 0,5 до 1 мм, обеспечивающее ламинарное движение среды через демпфирующий элемент.
Расположение замкнутых контуров в слое ПДМС выбрано из условия максимального удаления контуров друг от друга и от края предметного стекла, что предотвращает образование тонких частей из ПДМС при работе устройства (в противном случае слой ПДМС при всех четырех работающих контурах будет подвергаться большим механическим растяжениям на небольшой площади) и отклеивание ПДМС от стекла по периметру. Исключается взаимное влияние контуров друг на друга, что обеспечивает одновременную независимую работу всех контуров. При этом общий размер микрофлюидного устройства, как правило, не превышает 70-80 мм × 20-30 мм. В одном из вариантов выполнения устройства замкнутые контуры для циркуляции питательной среды расположены в один ряд вдоль протяженной стороны устройства, при этом пары соседних контуров обладают взаимной центральной симметрией с расположением всех центров симметрии на одной прямой (вторая пара контуров взаимно ориентирована аналогично первой паре). При этом технологическое отверстие и клеточная ячейка первого контура 3.1 расположены ближе к краю чипа с его короткой стороны (на расстоянии 2 мм от края), а микронасос расположен на максимальном удалении от края. Демпфирующий элемент расположен между микронасосом и технологическим отверстием и приближен к краю чипа с его длинной стороны на расстояние 2 мм. Второй контур 3.2 повернут относительно первого на 180° по направлению циркуляции питательной среды таким образом, что интегрированный в него микронасос расположен напротив микронасоса первого контура. Последовательное расположение микрофлюидных элементов в третьем контуре 3.3 аналогично их расположению в первом контуре, а расположение элементов в четвертом контуре 3.4 - аналогично второму.
Радиусы кривизны микроканалов, соединяющих элементы одного контура, выбраны исходя из решения задачи оптимизации с условием обеспечения минимального гидравлического сопротивления микрофлюидных элементов при сохранении возможности размещения не менее четырех замкнутых контуров в ограниченном пространстве чипа. В одном из вариантов выполнения устройства микроканал, соединяющий микронасос 7 и клеточную ячейку 6, выполнен с двумя изгибами - на 90° и на 120°; микроканал, соединяющий клеточную ячейку 6 и технологическое отверстие 9 выполнен с изгибом 120°; микроканал, соединяющий технологическое отверстие 9 и демпфер 8 выполнен с изгибом 120°, а канал, соединяющий демпфер 8 с микронасосом 7, выполнен с двумя изгибами - на 135° и на 45°.
Клеточные модели, загружаемые в клеточные ячейки 6 для тестирования лекарственных средств, могут быть представлены сфероидами, состоящими из клеток одного или множества типов, являющихся первичной культурой или клеточной линией, либо монослоем клеток различного происхождения.
Заявляемое МФУ может быть изготовлено методом «мягкой литографии» (А flexible method for rapid-prototyping of PDMS microfluidic chips using direct-writing for generation of polymer-master-structures L. Gutzweiler, F. Stumpf, L. Riegger, P. Koltay, R. Zengerle and L. Tanguy) посредством литья полидиметилсилоксана в формы. Шаблон для литья может быть изготовлен фотолитографически или механической обработкой. Для формирования закрытых структур поверхность ПДМС активируют с помощью низкотемпературной плазмы и прижимают к чистой стеклянной поверхности.
Заполнение контуров питательной средой осуществляют с помощью специальной пробки и шприца, которые с помощью резьбового соединения устанавливают в ячейку. Забор питательной среды может быть осуществлен посредством микродозатора со сменными пластиковыми наконечниками.
Таким образом, процессы, воспроизводимые в заявляемом устройстве, с помощью реализации топологии контуров с клеточными ячейками и микронасосами, приближены к естественным процессам, протекающим в организме человека. При этом микрофлюидное устройство позволяет культивировать клеточные модели в течение не менее 72 часов, а также проводить исследования клеточных моделей оптическими методами без необходимости их изъятия, с возможностью забора образцов культуральной среды и внесения веществ через отдельный порт (технологическое отверстие). Предлагаемое решение позволяет проводить тестирование максимального количества препаратов при различных условиях, что дает возможность сократить временные затраты на проведение тестирования, а также уменьшить стоимость проводимых исследований при сохранении высокого уровня достоверности и информативности результатов исследований.
Пример конкретного выполнения
Был изготовлен макет микрофлюидного устройства (см. фиг. 6), представляющего собой слой полидиметилсилоксана толщиной 2 мм и размерами 25×75 мм, отлитый на слое поликарбоната марки Makrolon 2099 фирмы Bayer толщиной 10 мм с образованием четырех замкнутых контуров с микрофлюидными элементами (клеточная ячейка, микронасос, демпфер и технологическое отверстие), соединенными микрожидкостными каналами, и герметизированных предметным стеклом толщиной 1 мм. Микрофлюидные каналы имели высоту 0,1 мм и ширину 0,4 мм. Клеточные ячейки были выбраны высотой 2 мм и диаметром 4,4 мм. Рабочая камера микронасоса была выполнена высотой 0,1 мм и закрыта сверху мембраной из ПДМС толщиной 0,44 мм и диаметром 3 мм. Клапаны микронасоса, выполненные в виде уширения микроканала, также были закрыты сверху эластичной мембраной из ПДМС толщиной 0,53 мм и диаметром 3 мм с перемычкой шириной 0,4 мм и высотой 0,1 мм, перекрывающей микроканал. В качестве демпфирующего элемента использовалась мембрана толщиной 0,35 мм и диаметром 4 мм. Технологическое отверстие выполнено сквозным с диаметром 2 мм, содержащим резьбу М3 глубиной 4 мм.
Пластины из поликарбоната для макетов МФУ были изготовлены на фрезерном станке с ЧПУ, заглушки и пробки изготавливались точением на токарном станке с последующей фрезеровкой шлицов. В качестве мастер-шаблона использовали алюминиевую пластину, в которой фрезерованием получали выступающие относительно плоскости пластины каналы будущего МФУ. Сборка МФУ осуществлялась заполнением заливочной формы полидиметилсилоксаном с центрифугированием. Предварительно собранные формы для заливки заготовки МФУ, помещались на ротор центрифуги. Далее экспериментальным способом были подобранны параметры центрифугирования, а именно температура центрифугирования и количество оборотов вращения ротора центрифуги в минуту. Подбором количества оборотов вращения ротора - 200 об/мин, удалось добиться наиболее качественного и полного заполнения заливочной формы, избежать возникновения пузырей в толще полидиметилсилоксана. Для усиления адгезии слоя ПДМС на поверхности поликарбоната использовали праймер-грунт Primer PR-1200 фирмы Dow Corning.
В качестве исследуемой клеточной модели была выбрана клеточная модель печени человека (КМПЧ) в виде сфероидов, состоящих из 5000 дифференцированных клеток гепатокарциномы человека линии HepaRG.
Для получения сфероидов на подготовительной стадии исследований осуществляли культивирование клеток линии HepaRG в полной питательной среде (ППС), содержащей Williams' Medium Е (Gibco, США), 2 мМ L-глутамина (Gibco, США), 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США), 5 мкг/мл рекомбинантного инсулина человека (Gibco, США), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (Gibco, США). При достижении культуры клеток линии HepaRG конфлюэнтного монослоя, осуществляли дифференцировку клеток в ППС с добавлением 2% диметилсульфоксида (ДМСО) в течение 14 дней. После завершения дифференцировки в культуре клеток HepaRG с помощью фазово-контрастной микроскопии наблюдали образование трабекул, окруженных холангиоцитами. Затем клеточную суспензию переносили в планшет Perfecta3DTM Hanging Drop Plates, который позволяет методом висячей капли формировать сфероид, и культивировали в CO2 - инкубаторе в течение 3 дней. Образовавшиеся сфероиды, состоящие из дифференцированных клеток HepaRG, переносили в 96-луночный планшет и культивировали в бессывороточной питательной среде (БПС) в течение 2 дней в CO2-инкубаторе для завершения формирования трехмерных образований.
Далее осуществляли исследование гепатотоксичности и биотрансформации лекарственного средства при воздействии на полученные клеточные модели. В качестве тестируемого лекарственного средства использовали раствор циклофосфамида в бессывороточной питательной среде в концентрациях 1,2; 2,5; 5; 10; 20; 40; 60; 80; 100 мМ (экспериментальные образцы). Для контроля наличия возможных систематических ошибок при формировании образцов КМПЧ использовали ячейки с контрольным образцом - КМПЧ, не обработанные тестируемым лекарственным веществом.
Для получения статистически достоверных результатов проводили по четыре идентичных эксперимента - по одному в каждом контуре микрофлюидного чипа, при этом для каждой концентрации циклофосфамида, а также для проведения контрольного теста и получения фоновых значений использовали по одному микрофлюидному устройству.
В качестве бессывороточной питательной среды использовали среду, содержащую William's Е (Gibco, США), 2 мМ L-глутамина (Gibco, США), 1 мг/мл альбумина сыворотки крови человека (Sigma, США), питательной добавки, состоящей из инсулина, трансферрина и селена (5.5 мкг/мл инсулина, Gibco, США), несущественных аминокислот (Gibco, США), 50 мкМ гидрокортизона гемисукцината (Sigma, США), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (Gibco, США).
Для исследования гепатотоксичности в каждую из четырех ячеек для культивирования клеток микрофлюидного устройства вносили по 10 образцов КМПЧ (что соответствовало 50 тыс. клеток HepaRG), затем из ячеек отбирали питательную среду и вносили по 125 мкл экспериментального образца раствора циклофосфамида в одной из указанных выше концентраций. Затем микрофлюидное устройство подключали к микробиореактору «Гомункулус», включали режим циркуляции среды и помещали МФУ в CO2-инкубатор, где осуществляли инкубирование КМПЧ с лекарственным средством в течение 48 ч при режиме работы МБР 5 Гц ±10 кПа. Аналогичные действия осуществляли с контрольным образцом КМПЧ, при этом вместо экспериментального образца раствора циклофосфамида использовали БПС. Затем выполняли цитотоксический тест с нейтральным красным (НК-тест) и с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромидом (МТТ-тест).
Для проведения теста с НК из ячеек МФУ микродозатором со сменными пластиковыми наконечниками отбирали питательную среду, образцы КМПЧ, а также ячейки без клеток (фон) промывали дважды фосфатно-солевым буфером (ФСБ) в объеме 250 мкл, затем инкубировали с 33 мкг/мл НК, растворенного в полной питательной среде, не содержащей эмбриональную сыворотку, в течение 3 ч в СО2-инкубаторе. После чего, образцы КМПЧ промывали раствором ФСБ в объеме 250 мкл. Образовавшиеся кристаллы растворяли в 130 мкл десорбирующего раствора (1% раствор ледяной уксусной кислоты, 50% EtOH, 49% Н2О) в течение 20 мин в темноте с использованием шейкера. Затем переносили по 100 мкл образовавшегося раствора в 96-ти луночный планшет. Оптическую плотность раствора измеряли при длине волны 540 нм на микропланшетном спектрофотометре BioRad X-mark (BioRad, США). Оценку жизнеспособности КМПЧ производили по формуле: жизнеспособность, % = 100% * (оптическая плотность экспериментального образца - оптическая плотность десорбирующего раствора) / (оптическая плотность контрольного образца - оптическая плотность десорбирующего раствора). Основным критерием при оценке жизнеспособности клеток являлось изменение сигнала оптической плотности раствора в зависимости от накопившегося в живых клетках красителя за время инкубации. Все полученные значения оптической плотности раствора после инкубации с контрольными образцами КМПЧ находились в диапазоне от 0.205 до 1.645 опт. ед, а растворителя от 0.043 до 0.059 опт. ед.
Для проведения МТТ-теста из ячеек МФУ отбирали питательную среду, образцы КМПЧ, а также ячейки без клеток (фон) промывали дважды ФСБ в объеме 250 мкл, затем инкубировали с 0.5 мг/мл МТТ, растворенного в БПС, в течение 3 ч в СО2-инкубаторе. После чего, образцы КМПЧ промывали раствором ФСБ в объеме 250 мкл. Образовавшиеся кристаллы формазана растворяли в 130 мкл ДМСО (десорбирующий раствор) в течение 20 мин в темноте с использованием шейкера. Переносили по 100 мкл раствора в 96-ти луночный планшет. Оптическую плотность раствора измеряли при длине волны 570 нм на микропланшетном спектрофотометре BioRad X-mark (BioRad, США). Оценку жизнеспособности производили по формуле: жизнеспособность, % = 100% * (оптическая плотность экспериментального образца - оптическая плотность десорбирующего раствора) / (оптическая плотность контрольного образца - оптическая плотность десорбирующего раствора).
С помощью программного обеспечения Prism® вычислили значение log ЕС50 и HillSlope по значениям кривой зависимости жизнеспособности КМПЧ от концентрации циклофосфамида. Значение IC50 циклофосфамида для образцов КМПЧ составило 11,2 мкМ при оценке тестом с НК и 10 мкМ для МТТ-теста.
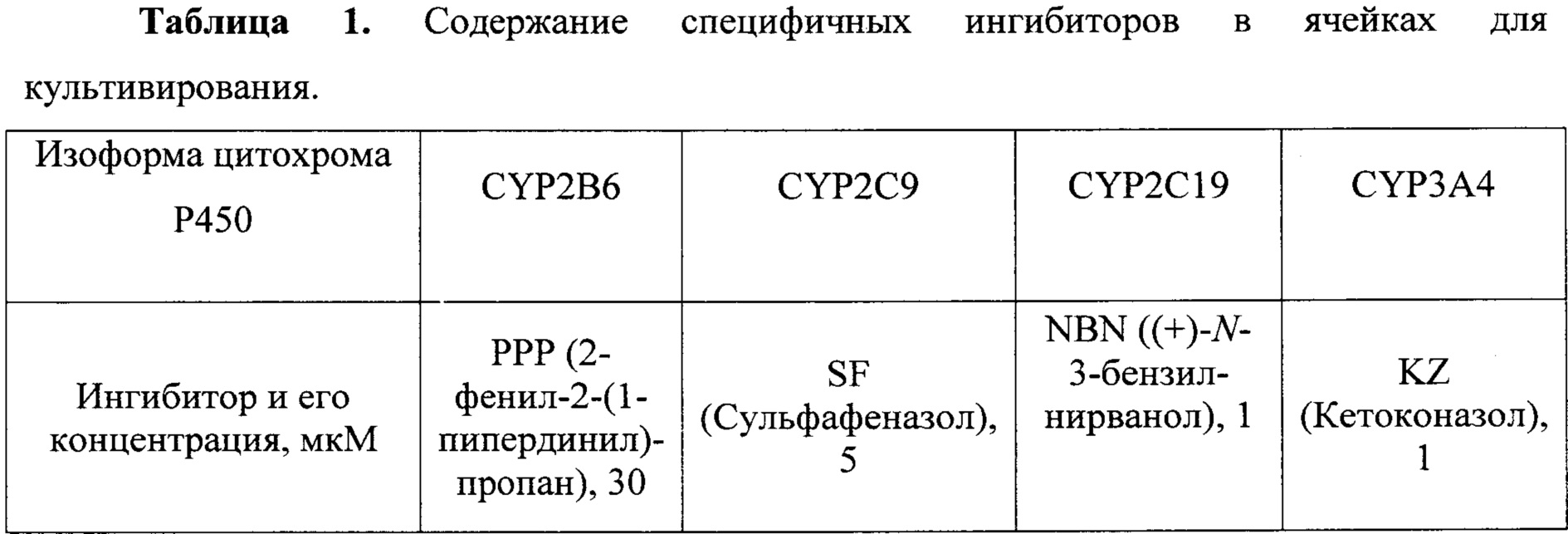
Для проведения исследования биотрансформации циклофосфамида в каждую из четырех ячеек для культивирования клеток микрофлюидного устройства вносили по 100 образцов КМПЧ, затем из ячеек отбирали питательную среду и вносили по 125 мкл среды, содержащей специфичные ингибиторы изоформ цитохрома Р450 в одной из концентраций, указанных в таблице 1, и 1 мкМ тестируемого вещества (циклофосфамида). В качестве контрольного образца использовали 1 мкМ тестируемого вещества в отсутствие ингибиторов. Микрофлюидное устройство подключали к микробиореактору «Гомункулус» и проводили культивирование в течение 24 ч при частоте работы клапанов 5 Гц и давлении ±10 кПа, затем из каждой ячейки отбирали 100 мкл среды, и добавляли 35 мкл охлажденного до -20°С ацетонитрила и проводили хроматомасс-спектрометрический анализ для определения концентрации исходных веществ и их метаболитов.
Хромато-масс-спектрометрический анализ. Разделение полученных образцов среды проводили на ВЭЖХ колонке ZORBAX Eclipse Plus C18 4,6 мм × 150 мм, 5 мкм (Agilent, США) при скорости потока 1 мл/мин и Т=40°С и градиентном режиме: 0-3 мин - 100% фазы А (0,425 об. % муравьиной кислоты в 5% растворе ацетонитрила в воде), 3-11 мин - линейный градиент от 100 до 60% фазы А, 11-13 мин - линейный градиент от 60 до 0% фазы А, 13-15 мин - 0% фазы А, 15-18 мин - линейный градиент от 0 до 100% фазы Б, 18-21 мин - 100% фазы Б (0,425 об. % муравьиной кислоты в ацетонитриле). Детекцию продуктов биотрансформации проводили на хроматомасс-спектрометре LCMS 8030 (Shimadzu, Япония).
Было показано, что в биотрансформации циклофосфамида участвует цитохром 3А4, так как при использовании его специфического ингибитора кетоконазола, было снижено образование основного метаболита N-дехлорэтил-циклофосфамида (см. фиг. 8).
Таким образом, для изучения токсичности и биотрансформации циклофосфамида было использовано 22 и 5 ед. описываемого микрофлюидного устройства, соответственно. Для проведения того же объема исследований с использованием устройств, описанных в патентах US 9273276 и RU 2584598, потребовалось бы 80 и 20 ед., соответственно, что существенно увеличило бы время проведения анализа. Кроме того, реализация испытаний на базе описанной микрофлюидной системы обеспечило сохранение условий, максимально приближенных к физиологическим, за счет наличия постоянной и равномерной ламинарной микроциркуляции культуральной среды в каждом замкнутом микрофлюидном контуре.