Результат интеллектуальной деятельности: Применение белкового экстракта в качестве антипролиферативного и цитотоксического средства
Вид РИД
Изобретение
Изобретение относится к области медицины и ветеринарии, в частности, к новому средству природного происхождения, оказывающему антипролиферативное действие.
Современная медицина располагает достаточно обширным арсеналом лекарственных препаратов для химиотерапии опухолей. В основном химиотерапевтические средства представлены группами алкилирующих антинеопластических препаратов, антиметаболитов, противоопухолевых антибиотиков, противоопухолевых гормональных препаратов, иммуномодуляторов и некоторых других с иным механизмом действия. Большинство указанных противоопухолевых препаратов очень токсичны, и поэтому схемы и продолжительность химиотерапии выбирают с учетом проявления побочных эффектов, что отражается на эффективности лечения в целом.
Известны природные противоопухолевые препараты растительного происхождения (алкалоиды барвинка розового (винбластин, винкристин); алкалоиды тисового дерева (таксаны) (паклитаксел, доцетаксел); подофиллотоксины, выделяемые из подофилла щитовидного (этопозид, тенипозид) и алкалоиды безвременника великолепного (демекольцин (колхамин), колхицин)) и бактериального происхождения (рубромицин и др.), которые имеют ограниченное применение также из-за высокой токсичности и узкого терапевтического спектра действия (лечение некоторых разновидностей опухолей, преимущественно с экзофитным ростом).
Следовательно, существует необходимость в новых, высокоэффективных противоопухолевых препаратах природного происхождения, которые имели бы широкий спектр действия и были бы менее токсичными.
Гельминты - общее название паразитических червей, обитающих в организме человека, других животных и растений, вызывающих гельминтозы.
К гельминтам относят представителей ленточных червей, или цестод, сосальщиков, или трематод (обе эти группы относятся к плоским червям) и круглых червей, или нематод.
К числу последних относятся и трихинеллы (в частности, Trichinella spiralis). Т. spiralis вызывает остро и хронически протекающее антропозоонозное инвазионное заболевание - трихинеллез. Взрослые трихинеллы паразитируют в тонком отделе кишечника животных и человека, а личинки - в поперечнополосатых мышцах этих же организмов.
Во время паразитирования гельминты продуцируют и высвобождают различные продукты метаболизма. Секреторно-экскреторные продукты жизнедеятельности гельминтов являются для организма хозяина неестественными веществами в его физиологически процессах.
Известно, что возбудители инвазий могут оказывать модулирующее влияние на течение многих заболеваний самой различной этиологии (например, Vasilev S. et al. (2015).
Molinari J.A., Ebersole J.L. (1977) заражали перорально мышей (B6D2F1/J) 200 личинками Т. spiralis за 176 суток до подкожной прививки 5×105 жизнеспособных клеток меланомы В-16. Антинеопластический эффект при хронической нематодной инвазии оценивали при ежедневном наблюдении за развитием и прогрессированием неопластических узелков. Ни у одной мыши, зараженной трихинеллами, не развились детектируемые опухолевые узелки, в то время как контрольные мыши (без заражения трихинеллами) пали в течение 60 суток.
Pocock D., Meerovitch Е. (1982) прививали мышам-самцам C57BL/6 с хроническим трихинеллезом и незараженным мышам-самцам такого же возраста клетки меланомы В16. Рост опухолей подавлялся у зараженных мышей (был более продолжительным период начала активного роста опухолей, и их размер был меньше). Кроме того, когда количество опухолевых клеток в инокулюме было меньше, чем это необходимо для 100% появления опухолей (ниже чем 1×104 клеток), то у достоверно большего количества мышей опухоли не развивались в течение 2 месяцев.
Kang Y.L. с соавторами (2013) предприняли попытки использовать паразитов в качестве кандидатов для живых вакцинных векторов против солидных опухолей. В этом направлении исследовали влияние заражения Т. spiralis на солидные опухоли. После заражения мышей C57BL/6 личинками Т. spiralis им прививали подкожно и внутривенно клетки B16-F10 для оценки роста опухолей и метастазирования. Рост опухолей и количество метастазов в легких было достоверно ниже у мышей, зараженных Т. spiralis, по сравнению с контрольными мышами. По мнению авторов, заражение Т. spiralis приводит к подавлению роста опухолей и метастазов посредством сложной модуляции профиля цитокинов, включая CXCL9, CXCL10 и CXCL13.
Также имеются работы по испытанию продуктов метаболизма Т. spiralis в отношении роста и выживаемости опухолевых клеток, в частности, наиболее близкие аналоги приводятся ниже.
Так, Vasilev S. с соавторами (2015) исследовали влияние не только хронической инвазии Т. spiralis, но экскреторно-секреторных антигенов мышечных личинок (ES L1) на рост злокачественной опухоли на модели мышиной меланомы in vivo и in vitro. Результаты авторов подтвердили, что при хронической инвазии Т. spiralis происходит замедление прогрессирования роста опухолей, приводя к достоверному снижению размера опухолей. Отмечали также повышенный апоптоз опухолевых клеток in vivo. Антиген ES L1 снижал выживаемость и несколько, но не достоверно, повышал апоптоз клеток меланомы in vitro. По мнению авторов, полученные результаты показывают, что высокая противоопухолевая активность трихинелл базируется не на некрозе и апоптозе, а других механизмах.
Wang X.L. c соавторами (2009) использовали мышиную модель карциномы кардиального отдела желудка (клеточная линия MFC), асцитную гепатому (клеточная линия Н22) и саркому для оценки противоопухолевого действия Т. spiralis in vivo. Мышей заражали пероральным введением 400 жизнеспособных личинок Т. spiralis на мышь за 7 суток до прививки различных линий опухолевых клеток. Кроме того, мышам других групп с опухолями вводили внутривенно неочищенный экстракт взрослых трихинелл и молодых личинок в дозах 17,5; 35,0 или 70,0 мг/кг массы тела. Экстракт готовили, как описано Fu B.Q. et al. (2005). Вкратце, взрослых гельминтов и личинок гомогенизировали и центрифугировали при 10000g в течение 5 минут. Супернатант концентрировали и хранили при -20°C. В результате в обоих случаях наблюдали дозозависимое подавление роста опухолей. Также антипролиферативную активность вышеуказанного необработанного экстракта Т. spiralis оценивали in vitro в концентрациях 0,035; 0,070 или 0,140 мг/мл на моделях MFC, Н22, S180, линии клеток хронического миелоидного лейкоза (K562) и клеточной линии гепатомы (Н7402) с использованием окрашивания метилтиазолием и отмечали ингибирование роста клеток. Было сделано заключение, что Т. spiralis содержит противоопухолевый активный агент.
Wang X.L. с соавторами (2013) показали, что заражение Т. spiralis придает высокую устойчивость к росту опухолевых клеток. В данном исследовании конструировали библиотеку к ДНК на фаге Т7 для экспрессии генов, кодированных Т. spiralis. Затем скринировали белки-кандидаты на линии клеток хронического миелоидного лейкоза (К562) и линии клеток гепатомы человека (Н7402) с использованием созданной библиотеки. Идентифицировали белок, кодированный геном А200711. Для тестирования противоопухолевых эффектов А200711 регистрировали изменения в пролиферации и апоптозе клеток после того, как рекомбинантный pEGFP-N1-A200711 трансфектировали в клетки Н7402. Результаты показали, что экспрессированный ген-мишень успешно индуцировал апоптоз в клетках А200711 по данным окрашивания Hoechst-PI и МТТ-теста.
Кроме того, основные исследования с Т. spiralis на предшествующем уровне проводились в условиях in vivo, и авторы связывают противоопухолевую активность с воздействием и стимуляцией иммунной системы. Имеющиеся работы по испытанию in vitro ограничены применением сложного способа получения экстракта и испытанием на ограниченном ряде моделей опухолевых клеток.
Целью изобретения является получение белковых экстрактов из тканей гельминтов, в частности, из личинок Т. spiralis, оценка их антипролиферативного действия на моделях опухолевых клеток различных линий и обеспечение их возможного применения в дальнейшем в качестве эффективного противоопухолевого средства.
Сущность изобретения заключается в том, что средство, обладающее антипролиферативной активностью, представляет белковый экстракт гельминтов, в частности, экстракт Trichinella spiralis. Необходимо отметить, что условия получения экстракта из гомогената гельминтов, в том числе, личинок Т. spiralis, зависят от используемого биологического материала, и существенными признаками получения белковых экстрактов является экстракция фосфатно-солевым буфером с pH=7,2.
Экстракт оказывает выраженное антипролиферативное и цитостатическое действие на моделях опухолевых клеток человека in vitro. Как уже указывалось выше, экстракт трихинелл получен более простым способом и испытан на линиях опухолей человека, на которых ранее исследования не проводились.
За счет природного происхождения предлагаемое антипролиферативное средство может быть менее токсичным при наличии высокой противоопухолевой эффективности широкого спектра действия.
Примеры конкретного исполнения
Пример 1. Приготовление белкового экстракта Т. spiralis.
Для приготовления полного белкового экстракта трихинелл необходимо получить достаточный объем личинок Т. spiralis (мышечная стадия). Для этого белых беспородных крыс экспериментально заражали лабораторными инвазионными личинками в дозе 10 личинок/г массы животного общепринятым методом per os, а после 45 суток зараженных крыс подвергали эвтаназии и тушки измельчали в фарш. Затем из фарша выделяли личинок трихинелл пептолизом в искусственном желудочном соке, приготовленном из расчета 10 мл концентрированной соляной кислоты (33%) и 3 г свиного пепсина (протеолитическая активность ≥400 ед/мг) на 1 л воды. Один литр искусственного желудочного сока необходим для пептолиза 40-60 г фарша. Пептолиз проводили в аппарате GASTROS-2M (Санкт-Петербург) в автоматическом режиме. Выделенных в процессе пептолиза живых личинок Т. spiralis отмывали дистиллированной водой, замораживали и сохраняли при минус 20°C до получения необходимого объема - 8 см3. Полный белковый экстракт готовили следующим образом: личинок трихинелл измельчали вручную в замороженном состоянии, затем оттаивали, замораживали вновь при минус 20°C и снова измельчали вручную в замороженном состоянии. Эту процедуру проводили 4 раза до получения однородной массы - гомогената. Для контроля измельчения использовали микроскопию при увеличении ×32. Экстрагирование гомогената проводили на магнитной мешалке в течение 16 часов при 4°C в фосфатно-солевом буфере pH=7,2 в соотношении 1:5. По окончании экстрагирования полученную суспензию центрифугировали при 18000 об/мин в течение часа при 4°C, осадок удаляли, супернатант использовали в качестве полного белкового экстракта трихинелл после очистки от низкомолекулярных соединений путем диализа.
Пример 2. Оценка влияния белкового экстракта Т. spiralis на культуру опухолевых клеток молочной железы человека (MCF-7) в зависимости от концентрации и продолжительности воздействия экстракта.
Целью настоящего опыта была оценка влияния белкового экстракта Т. spiralis на пролиферацию опухолевых клеток молочной железы человека в зависимости от концентрации и продолжительности воздействия.
Материалы и методы
Клетки-мишени. Исследования проводили на перевиваемой клеточной линии MCF-7 (аденокарценома молочной железы человека). Перед проведением эксперимента клетки инкубировали по стандартной методике в культуральных флаконах (CORNING, Flask, 25 cm2, США) в ростовой среде DMEM GlutaMAX (Gibco) с добавлением 10% FBS и антибиотика/антимикотика (Gibco, ×100) в условиях повышенной влажности CO2-инкубатора (New Brunswick, Galaxy 170R), при T=37°C в атмосфере 5% CO2.
Исследуемый белковый экстракт. В исследованиях использовали образец белкового экстракта в фосфатно-солевом буфере без консерванта, не стерильный, концентрация белка 45,48 мг/мл. До проведения эксперимента исследуемый образец хранили при температуре -70°C.
Описание исследования. В эксперименте были протестированы следующие концентрации экстракта Т. spiralis: 25 мкг/мл, 50 мкг/мл, 100 мкг/мл, 250 мкг/мл, 500 мкг/мл, 1 мг/мл и 2 мг/мл. Разведения готовили на ростовой среде DMEM GlutaMAX (DGIBCO) с 10% FBS и антибиотиком.
Для проведения эксперимента клетки MCF-7 инкубировали по стандартной методике до получения субконфлуэнтного монослоя. В стадии активного роста клеточный монослой диспергировали раствором трипсин/версена, полученные клетки ресуспендировали в ростовой среде DMEM GlutaMAX (Gibco) с 10% FBS и антибиотиком. Свежеприготовленную суспензию клеток высевали в 24-луночные планшеты (SARSTEDT, Германия) по 30×103 клеток в лунку и культивировали сутки в условиях CO2-инкубатора. Затем из лунок полностью удаляли среду и в экспериментальные лунки вносили ростовую среду с исследуемыми концентрациями экстракта Т. spiralis, по три повтора на каждую исследуемую дозу. При тестировании образца экстракта Т. spiralis в качестве контроля оставляли клетки на полной ростовой среде без исследуемого образца.
Оценку и расчет эффективности импытуемого белкового продукта проводили, как описано в примере 2.
Результаты
В ходе эксперимента проводили ежедневный визуальный контроль за ростом и морфологией растущих колоний клеток.
Визуальный контроль через 24 часа после внесения исследуемого образца.
В планшете с белковым экстрактом Т. spiralis в контрольных лунках детрита нет. Много митозов. Морфологические отклонения отсутствуют. Во всех исследуемых лунках клетки сопоставимы с контролем, как по плотности и размеру пролиферирующих колоний, так и по морфологическим признакам.
Визуальный контроль через 48 часов после внесения исследуемого образца.
В планшете с образцом белкового экстракта Т. spiralis клетки сопоставимы с контролем, как по морфологическим признакам, так и по плотности и размеру пролиферирующих колоний.
Визуальный контроль и подсчет клеток через 72 часа после внесения исследуемого образца.
В планшете в контрольных лунках наблюдали активную пролиферацию клеток; сформирован плотный монослой; детрита нет. В опытной группе с белковым экстрактом Т. spiralis в концентрациях от 25 мкг/мл до 250 мкг/мл плотность клеточного монослоя сопоставима с контрольными лунками. При 500 мкг/мл и 1 мг/мл отмечено снижение тотального количества клеток, а при максимальной концентрации белкового экстракта Т. spiralis 2 мг/мл, помимо значительного уменьшения размеров и количества клеточных колоний, наблюдали морфологические изменения в клетках: в цитоплазме появилась многочисленная зернистость в виде мелкой черной дроби.
На данный срок исследований после визуального исследования клетки снимали, подсчитали в камере Горяева, а затем клетки из планшета с белковым экстрактом Т. spiralis пересевали в новый 24-луночный планшет для дальнейшего исследования. Для пересева готовили свежие разведения образцов белкового экстракта гельминтов.
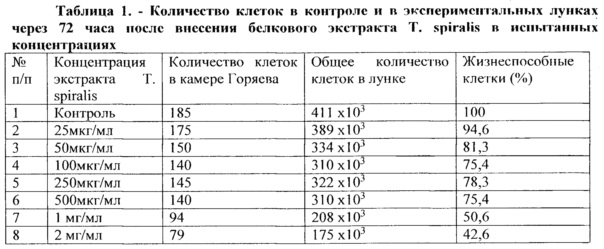
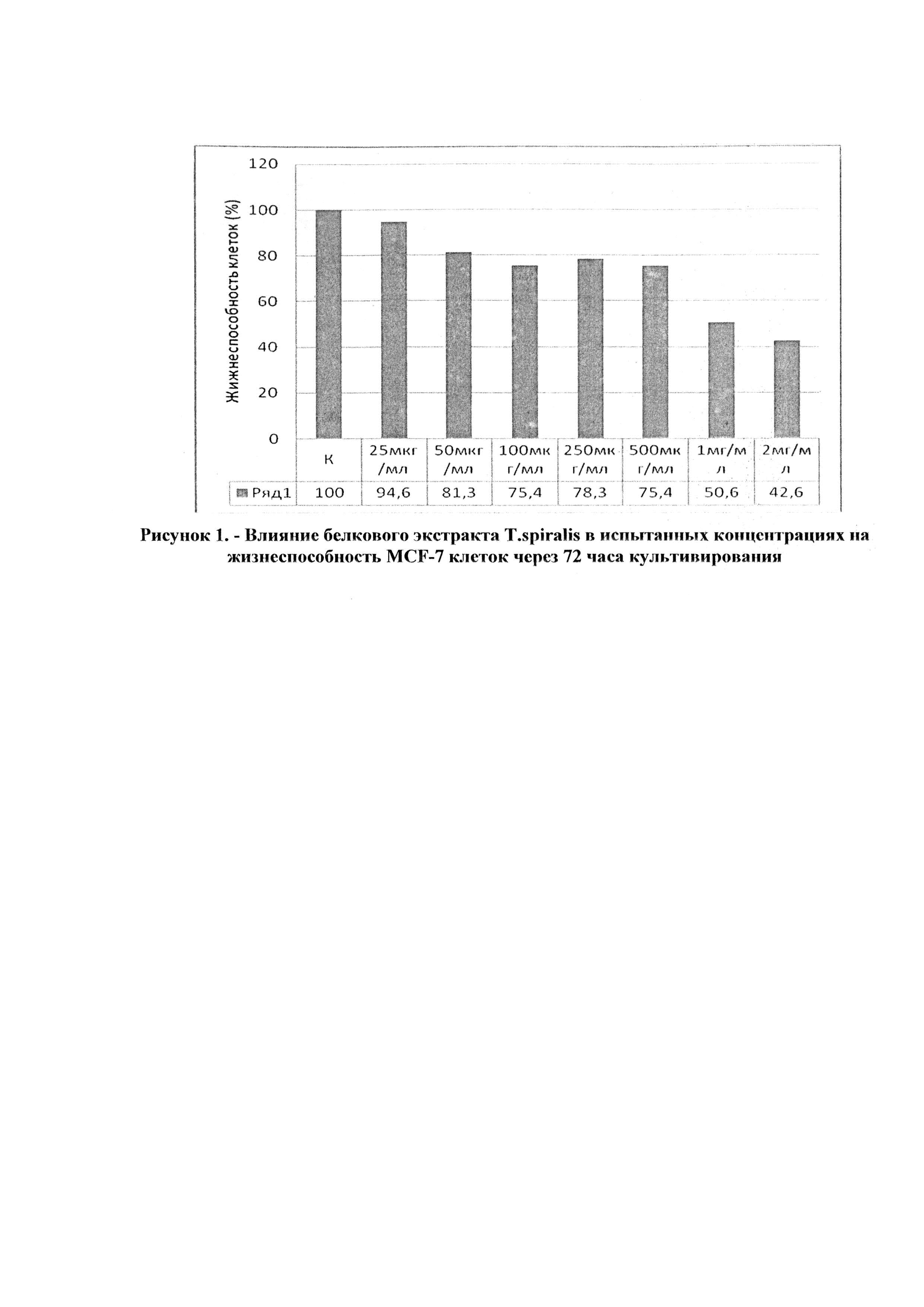
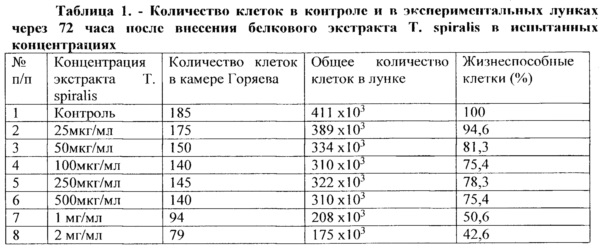
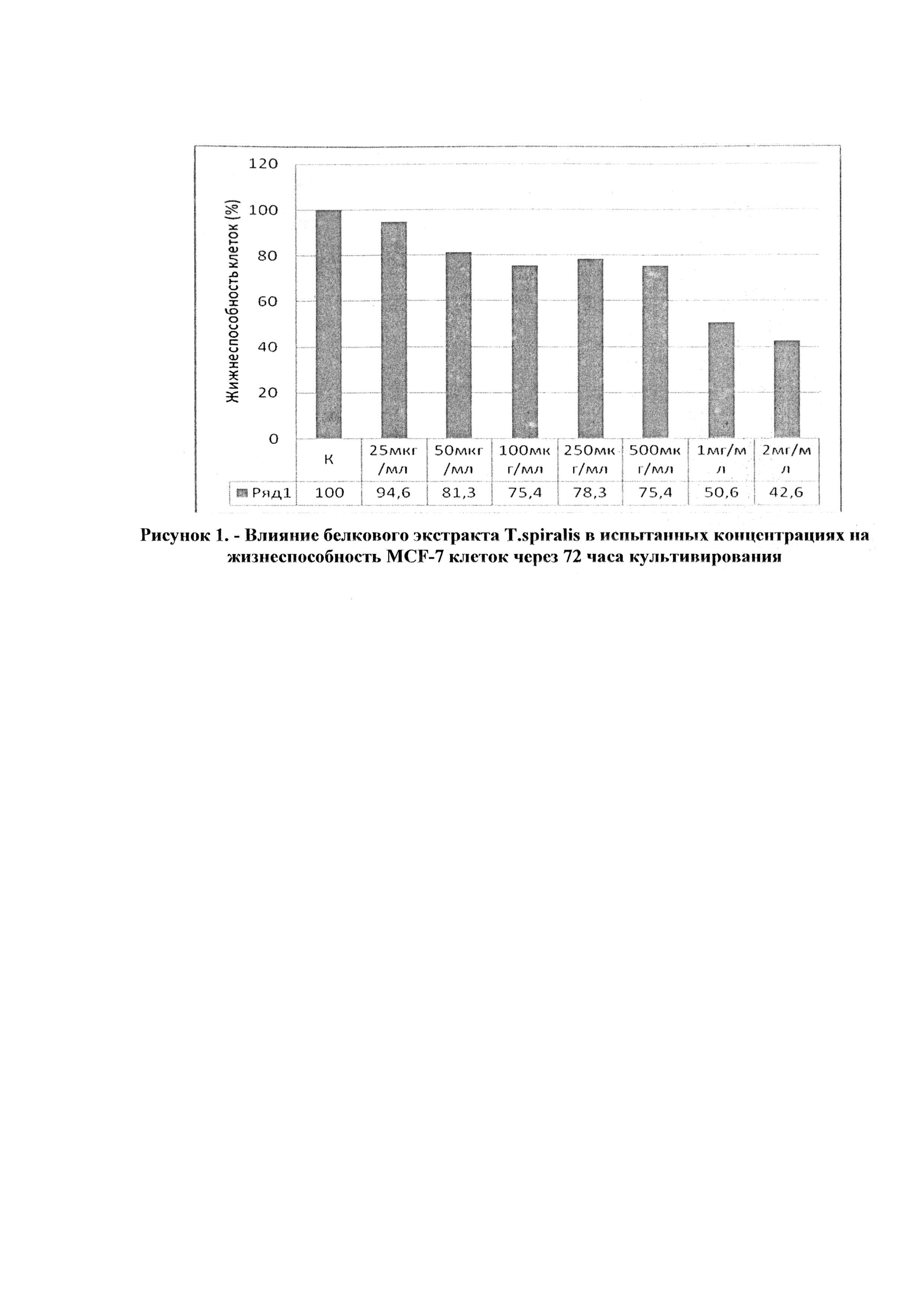
В таблице 1 представлены результаты подсчета общего количества клеток в камере Горяева и относительного количества жизнеспособных клеток в экспериментах с разными концентрациями исследуемого белкового экстракта Т. spiralis.
На основании данных, представленных в таблице 1, построен график зависимости жизнеспособности опухолевых клеток от концентрации исследуемого экстракта Т. spiralis (рисунок 1).
По данным рисунка 1 хорошо видно, что экстракт Т. spiralis в максимальных дозах 1 мг/мл и 2 мг/мл снижал количество жизнеспособных клеток в 2 и 2,3 раза, соответственно. На основании этого, а также, проанализировав результаты визуальных наблюдений, можно заключить, что белковый экстракт трихинелл в концентрациях 1 мг/мл и 2 мг/мл ингибирует пролиферативную активность MCF-7 клеток через 72 часа культивирования.
Визуальный контроль на 6 сутки после внесения исследуемого образца белкового экстракта Т. spiralis.
В планшете в контрольных лунках был сформирован субконфлюэнтный монослой; детрит отсутствовал (рисунок 2); при максимальной концентрации 2 мг/мл испытуемого образца экстракта наблюдалась 100% гибель клеток (рисунок 3).
Кроме того, в лунках с экстрактом Т. spiralis в концентрации 1 мг/мл также наблюдали заметное снижение пролиферативной активности MCF-7 клеток, плотность клеток была ниже по сравнению с контрольными лунками; появились цитоплазматические включения в виде темной зернистости. В остальных экспериментальных лунках морфологических изменений не отмечено. Клетки сопоставимы с контролем.
Визуальный контроль и подсчет клеток на 7 сутки внесения исследуемого образца белкового экстракта Т. spiralis.
В планшете во всех контрольных лунках отмечена активная пролиферация MCF-7 клеток; в лунках сформирован плотный монослой (рисунок 4).
При концентрации экстракта 500 мкг/мл наблюдали заметное снижение пролиферативной активности опухолевых клеток (рисунок 5); такое же ингибирующее действие препарата, но в большей степени, проявлялось в концентрации 1 мг/мл (рисунок 6).
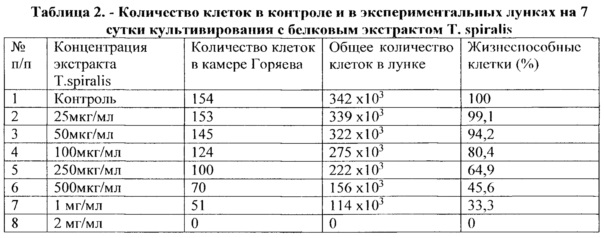
После визуального наблюдения во всех контрольных и экспериментальных лунках клетки снимали трипсин/версеном и их количество подсчитали в камере Горяева; результаты по общему количеству клеток и относительному количеству жизнеспособных клеток в эксперименте представлены в таблице 2.
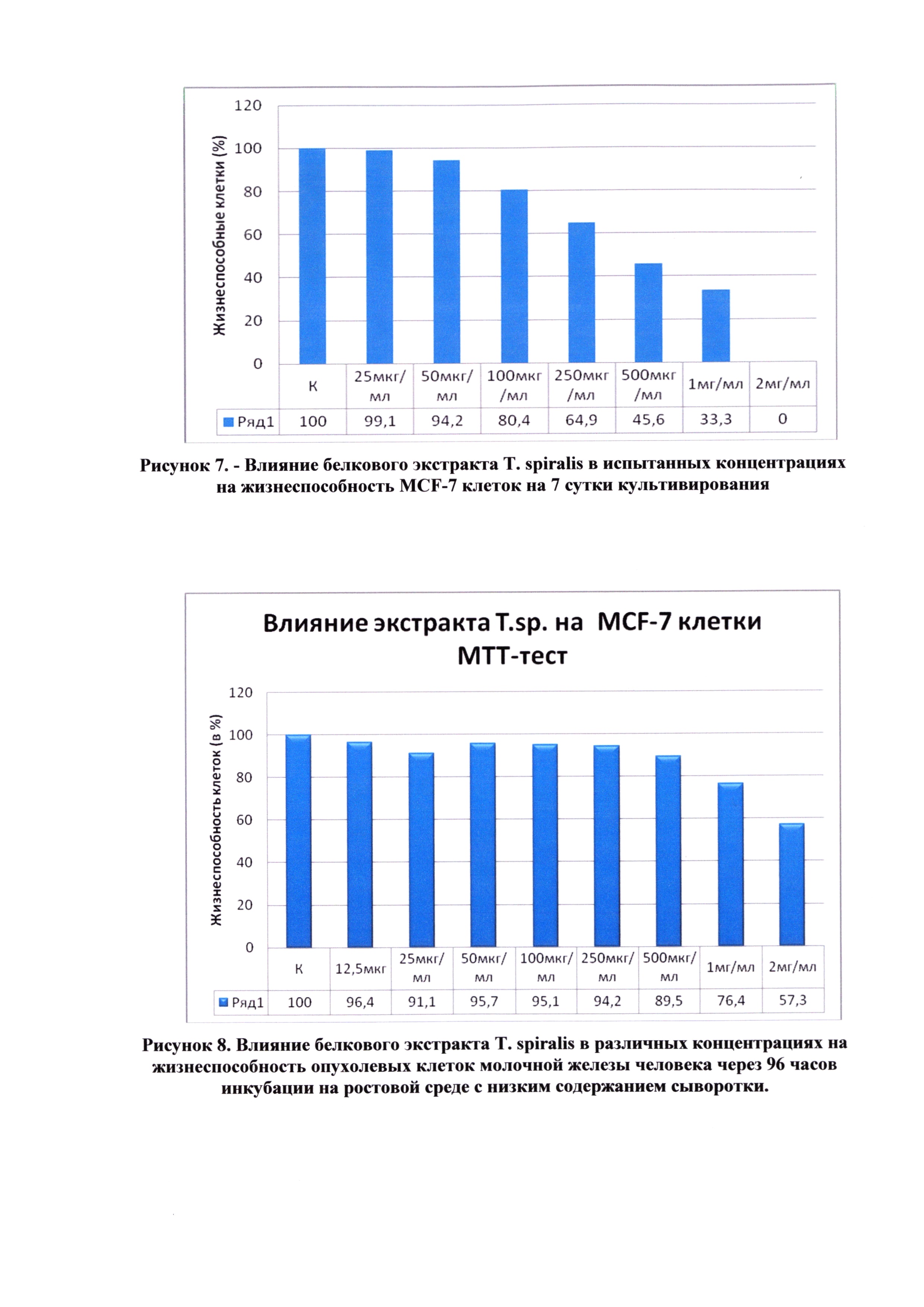
Из данных, представленных в таблице 2, следует, что количество жизнеспособных MCF-7 клеток снижалось пропорционально увеличению концентрации исследуемого экстракта трихинелл, что говорит о дозозависимом действии экстракта Т. spiralis на культуру опухолевых клеток на исследованной нами модели in vitro.
Используя данные таблицы 2, построен график зависимости жизнеспособности клеток от концентраций белкового экстракта трихинелл (рисунок 7).
Выводы. Обобщая результаты, полученные в данном эксперименте, можно заключить:
1. Исследуемый белковый экстракт Т. spiralis через 72 часа культивирования подавлял пролиферативную активность MCF-7 клеток в максимальных дозах 1 мг/мл и 2 мг/мл.
2. Цитотоксическое действие белкового экстракта Т. spiralis проявлялось в максимально испытанной дозе 2 мг/мл, вызывая тотальную гибель MCF-7 клеток на 6 сутки культивирования.
3. Цитостатическое белкового экстракта Т. spiralis на культуру MCF-7 клеток проявлялось к 7 суткам культивирования при концентрациях от 100 мкг/мл до 1 мг/мл и носило дозозависимый характер.
Пример 3. Оценка влияния белкового экстракта Т. spiralis на культуру опухолевых клеток молочной железы человека (MCF-7), инкубированной на ростовой среде с низким содержанием сыворотки, с использованием МТТ-теста.
Целью настоящего опыта была оценка влияния белкового экстракта Т. spiralis на пролиферацию опухолевых клеток молочной железы человека в более жестких условиях, на среде с более низким содержанием сыворотки, и с оценкой МТТ-тестом.
Материалы и методы
Клетки-мишени. Исследования проводили на перевиваемой клеточной линии MCF-7 (аденокарценома молочной железы человека). Перед проведением эксперимента, клетки инкубировали по стандартной методике в культуральных флаконах (CORNING, Flask, 25 cm2, США) в ростовой среде DMEM GlutaMAX (Gibco) с добавлением 10% FBS и антибиотика/антимикотика (Gibco, ×100) в условиях повышенной влажности CO2-инкубатора (New Brunswick, Galaxy 170R), при T=37°C в атмосфере 5% CO2.
Исследуемый белковый экстракт. Исследовали образец белкового экстракта Т. spiralis в фосфатно-солевом буфере без консерванта, не стерильный, концентрация стокового раствора - 40,5 мг/мл. До проведения эксперимента исследуемый образец хранили при температуре -70°C.
Описание исследования. Перед экспериментом раствор тщательно перемешали и стерилизовали фильтрацией через миллипоровый фильтр 0,22 микрона. Белковый экстракт трихинелл исследовали в следующих концентрациях: 12,5 мкг/мл, 25 мкг/мл, 50 мкг/мл, 100 мкг/мл, 250 мкг/мл, 500 мкг/мл, 1 мг/мл и 2 мг/мл. Разведения готовили на среде DMEM GlutaMAX (DGIBCO) с 2% эмбриональной телячьей сыворотки (FBS) и антибиотиком.
Клетки MCF-7 культивировали в CO2-инкубаторе (New Brunswick, Galaxy 170R) в условиях повышенной влажности при T=37°C и 5% CO2, в культуральных флаконах (CORNING, Flask, 25 cm2, США) в ростовой среде DMEM (Gibco, Англия) с добавлением 10% эмбриональной телячьей сыворотки (FBS, Gibco) и антибиотика/антимикотика (Gibco, ×100) стандартной концентрации. В стадии активного роста клетки снимали раствором трипсин/версена (Sigma, США) и высевали в 96-луночные планшеты (SARSTEDT, Германия) по 7×103 клеток на лунку в объеме 100 мкл. Планшеты инкубировали 16-18 часов. Затем из лунок удаляли детрит и дважды промывали раствором Хенкса (ПанЭко, Россия). После промывки, в контрольные лунки вносили ростовую среду с 2% FBS, а в опытные - исследуемые белковый экстракт в указанных концентрациях, приготовленный на ростовой среде с 2% FBS. Конечный объем среды в опытных и контрольных лунках составлял 200 мкл. Исследуемый экстракт вносили вертикальными рядами (в 8 повторностях) в следующей последовательности: 12,5 мкг/мл, 25 мкг/мл, 50 мкг/мл, 100 мкг/мл, 250 мкг/мл, 500 мкг/мл, 1 мг/мл и 2 мг/мл.
Жизнеспособность клеток MCF-7 оценивали с помощью колориметрического метода (Mosmann, 1983), МТТ-тестом, через 96 часов после внесения исследуемого экстракта. МТТ-тест основан на способности живых клеток превращать растворимый бромид 3-(4,5-диметилтиазол-2)-2,5-тетразолия (МТТ, желтого цвета) в нерастворимые пурпурно-синие кристаллы МТТ-формазана (МТТ-Ф). Мертвые клетки такой способностью не обладают. Интенсивность превращения МТТ в МТТ-Ф отражает общий уровень дегидрогеназной активности в клетках.
Насыщенный раствор МТТ готовили в концентрации 5 мг/мл в изотоническом буферном растворе, не содержащем фенолового красного, а затем фильтровали через миллипоровый фильтр 0,22 микрона. Через 96 часов инкубации, для проведения МТТ-теста, в лунки со средой (200 мкл) вносили по 20 мкл насыщенного раствора МТТ (Sigma, США) и инкубировали 4 часа при 37°C. После этого удаляли супернатант и вносили в каждую лунку по 100 мкл DMSO (Sigma, США) для растворения внутриклеточных кристаллов МТТ-Ф. Затем пипетировали до получения гомогенного окрашивания. Оптический сигнал измеряли на планшетном спектрофотометре (MULTISKAN ЕХ) в режиме ABS, используя фильтр 545 нм в качестве основного и 630 нм - в качестве корректирующего.
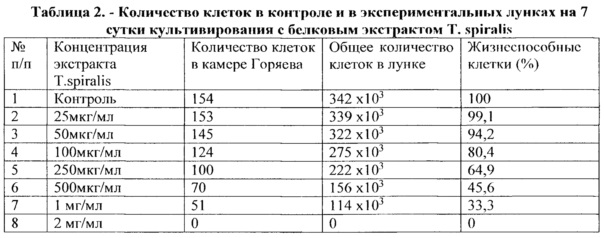
Уровень пролиферативной активности (жизнеспособность клеток) оценивали сравнением значений оптических плотностей в опыте и в контроле. Для построения графика среднеарифметическое значение оптической плотности в контроле принимали за 100%, а жизнеспособность клеток в эксперименте рассчитывали из среднеарифметического значения оптических плотностей, выраженных в процентах относительно контроля.
Результаты
Через 24 и 48 часов культивирования не обнаружено морфологических различий между клетками в контрольных и экспериментальных лунках. Во всех лунках клетки имела место одинаковая степень распластанности, детрита в среде нет. На 3 сутки наблюдали заметное снижение количества клеток в эксперименте при концентрации белкового экстракта 2 мг/мл и 1 мг/мл. Появились округлившиеся клетки в экспериментальных лунках с максимальной концентрацией экстракта.
Через 96 часов культивирования наблюдали ярко выраженное подавление пролиферативной активности MCF-7 клеток в экспериментальных лунках с концентрацией 2 мг/мл. Так же, отмечено снижение пролиферативной активности опухолевых клеток в эксперименте при 1 мг/мл, но в сравнении с 2 мг/мл, его действие проявлялось в меньшей степени. При этом в контрольных лунках и во всех остальных экспериментальных лунках сформирован монослой, детрит в среде и морфологические изменения клеток отсутствовали.
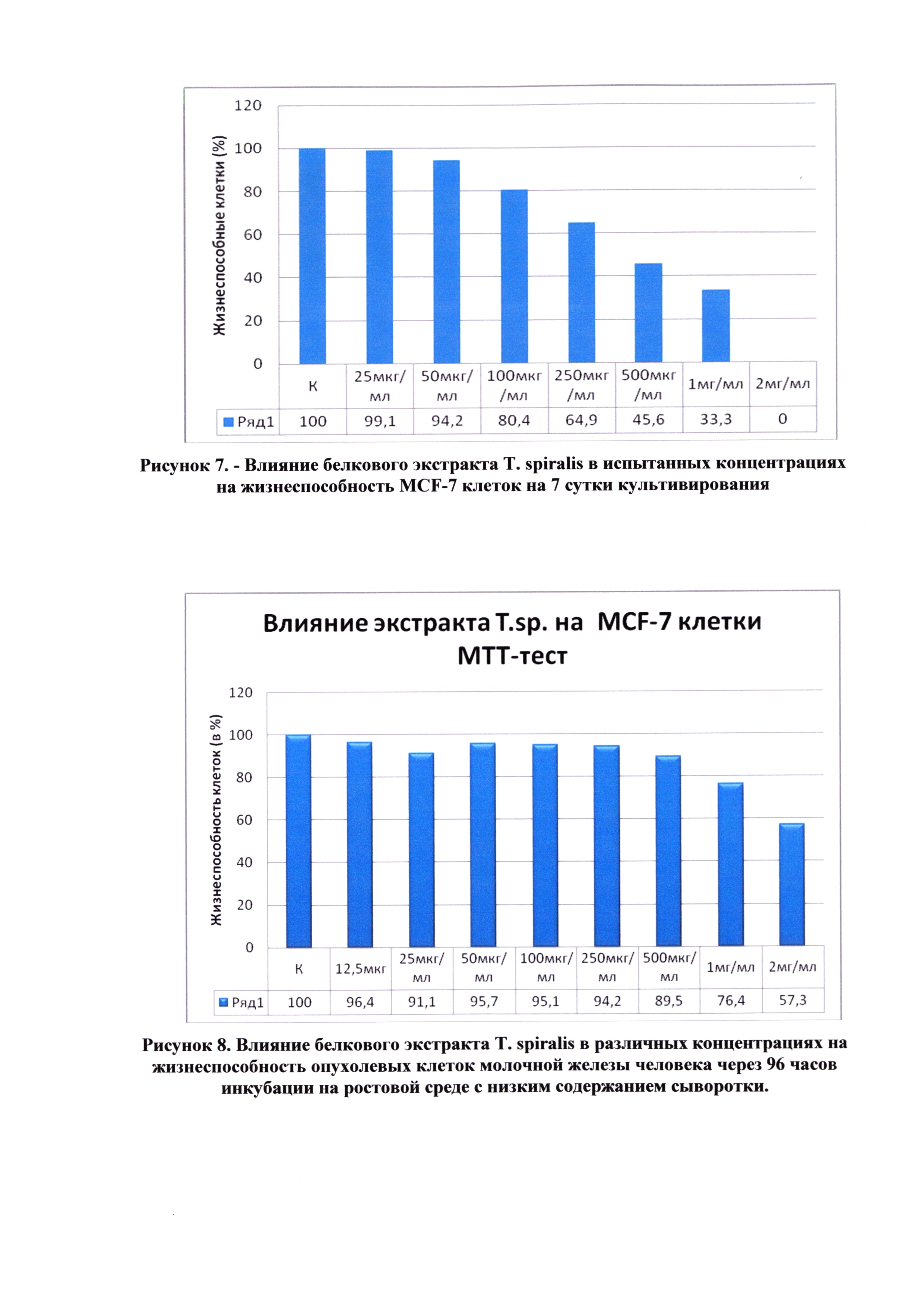
На рисунке 8 представлены результаты МТТ-теста через 96 часов культивирования.
Выводы. На основании полученных экспериментальных данных можно заключить, что исследуемый экстракт T. spiralis оказывает цитостатическое действие на опухолевые клетки молочной железы человека в максимальных дозах 1 мг/мл и 2 мг/мл через 96 часов инкубации.
Пример 4. Оценка влияния белкового экстракта Т. spiralis на культуру опухолевых клеток лимфомы Беркитта (Raji) на модели in vitro.
Целью настоящего опыта была оценка влияния белкового экстракта Т. spiralis на пролиферацию опухолевых клеток лимфомы Беркитта.
Материалы и методы
Клетки-мишени. Исследования проводили на перевиваемой линии В-клеток лимфомы Беркитта. Перед проведением эксперимента, суспензионную культуру клеток инкубировали по стандартной методике в культуральных флаконах (CORNING, Flask, 25 cm2, США) в ростовой среде RPMI 1640 (ПанЭко) с добавлением 10% фетальной телячьей сыворотки (FBS) и антибиотика гентамицина в условиях повышенной влажности CO2-инкубатора (Binder, Germany), при T=37°C в атмосфере 5% CO2.
Исследуемый белковый экстракт. Исследовали образец Т. spiralis - экстракт белка в фосфатно-солевом буфере без консерванта, не стерильный, концентрация стокового раствора - 45,0 мг/мл. До проведения эксперимента исследуемый образец хранили при температуре -70°C.
Описание исследования
Перед экспериментом раствор тщательно перемешали и стерилизовали фильтрацией через миллипоровый фильтр 0,45 микрон. В работе протестированы следующие концентрации экстракта Т. spiralis: 137,5 мкг/мл, 275 мкг/мл, 550 мкг/мл, 1,1 мг/мл и 2,2 мг/мл. Последовательные разведения экстракта Т. spiralis готовили на фосфатно-солевом буфере. Далее клетки ресуспендировали в стерильных условиях ламинара и переносили в 12-ти луночный планшет (SARSTEDT, Германия) в среду культивации RPMI 1640 с 10% FBS в количестве 100000 клеток на лунку (объем среды в 1 лунке 1,2 мл). Затем в каждую лунку добавляли по 0,2 мл приготовленных разведений экстракта Т. spiralis, получая, таким образом, в каждом случае необходимую концентрацию препарата Т. spiralis. В контрольную лунку вносили 0,2 мл фосфатно-солевого буфера. Конечный объем среды в опытных и контрольной лунке составлял 1,4 мл.
Затем проводили ежедневный подсчет общего количества клеток, отобранных из культуральной среды после ресуспендирования в стерильных условиях. Подсчет проводили в цитометрической камере с сеткой Горяева под микроскопом Leica DM 2000 (Germany) без предварительного разведения и при помощи гематологического анализатора Abacus Junior Vet как обычную пробу крови, принимая значение White Blood Cell (WBC) за клетки лимфомы Беркитта. Сравнительный анализ полученных данных показал корреляцию и схожесть результатов подсчета в цитометрической камере с сеткой Горяева и при подсчете с помощью гематологического анализатора. Весь эксперимент продолжался в течение 163 часов с ежесуточным забором 50 мкл среды с суспензией клеток для подсчета (в течение всего этого времени культивационная среда сохранялась без введения в нее дополнительных веществ).
Результаты
Динамика прироста числа опухолевых клеток в контроле характеризовалась посуточным приростом их количества в 1,5-2 раза вплоть до 91 часа исследования (до 4 суток). При добавлении экстракта Т. spiralis в максимальной исследуемой дозе 2,2 мг/мл уже с первых суток исследования имело место подавление пролиферации клеток по сравнению с контролем. При этом эффект сохранялся до 4 суток исследования и выражался снижением общего числа опухолевых лимфобластов в 1,3-1,7 раза по сравнению с контролем.
Выводы. Белковый экстракт Т. spiralis оказал цитостатическое (антипролиферативное) действие на клетки лимфомы Беркитта (Raji) in vitro (модель с высоким репродуктивным потенциалом) при внесении в среду в концентрации 2,2 мг/мл.
Литература
1. Fu B.Q., Liu M.Y., Kapel С.М. Cloning and analysis of a novel cDNA from Trichinella spiralis encoding a protein with an FYVE zinc finger domain // Vet. Parasitol. - 132 - P. 27-30.
2. Kang Y.J., Jo Jo, Cho M.K. et al. Thrichinella spiralis infection reduces tumor growth and metastasis of B16-F10 melanoma cells // Vet. Parasitol. - 2013. - V. 196(1-2). - P. 106-113.
3. Molinari J.A., Ebersole J.L. Antineoplastic effects of long-term Trichinella spiralis infection on B-16 melanoma // Int. Arch. Allergy Appl. Immunol. - 1977. - V. 55(1-4). - P. 444-448.
4. Pocock D., Meerovitch E. The anti-neoplastic effect of trichinelosis in syngeneic murine model // Parasitology. - 1982. - V. 84(Pt. 3). - P. 463-473.
5. Vasilev S., Ilic N., Gruden-Movsesijan A. et al. Necrosis and apoptosis in Trichinella spiralis-mediated tumour reduction // Cent. Eur. J. Immunology. - 2015. - V. 40(1). - P. 42-53.
6. Wang X.L., Fu B.Q., Yang S.J. et al. Trichinella spiralis - a potential antitumor agent // Vet. Parasitol. - 2009. - V. 159(3-4). - P. 249-252.
7. Wang X.L., Liu M.Y., Sun S.M. et al. An anti-tumor protein produced by Trichinella spiralis induces apoptosis in human hepatoma H7402 cells // Vet. Parasitol. - 2013. - V. 194(2-4). - P. 186-188.