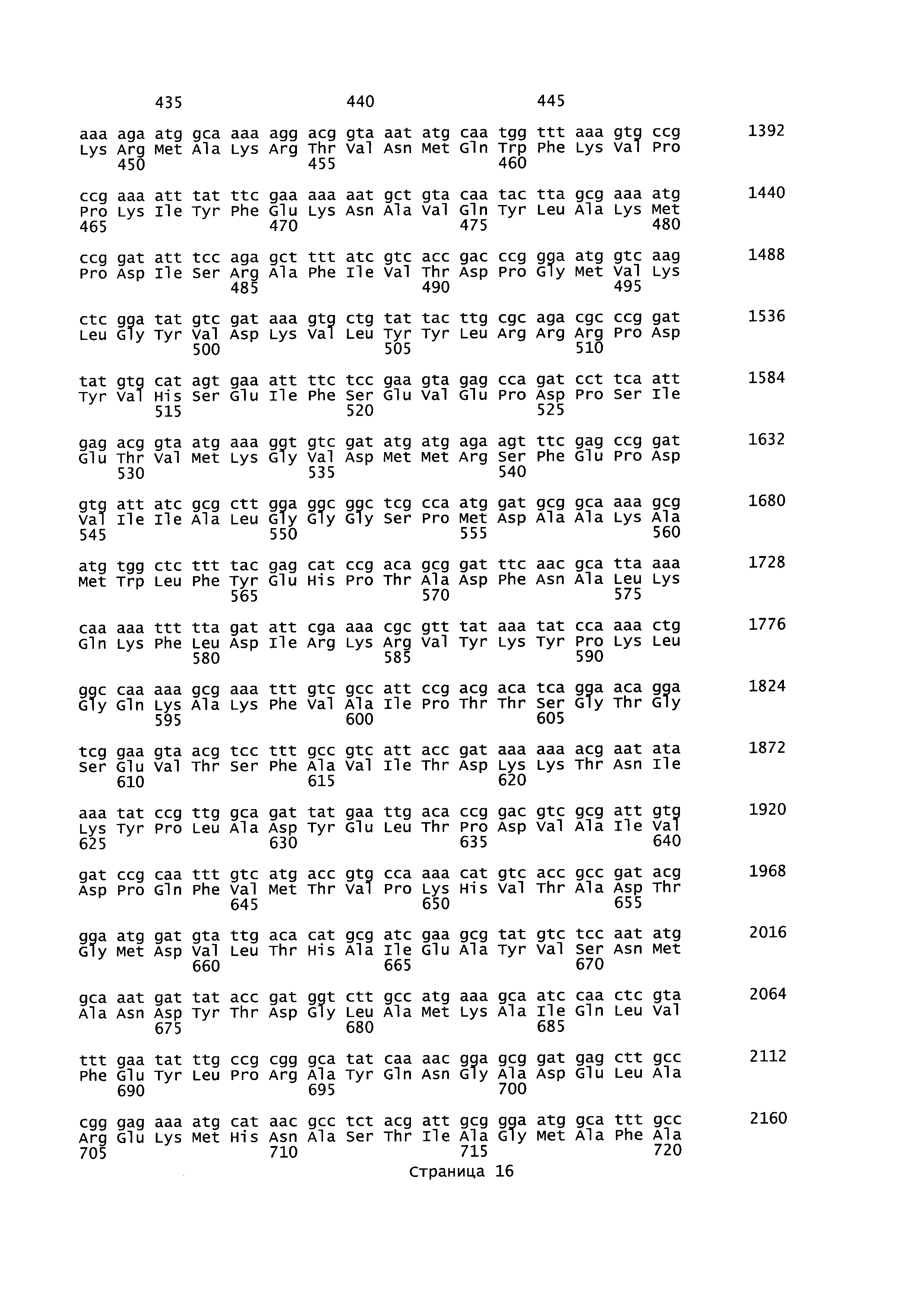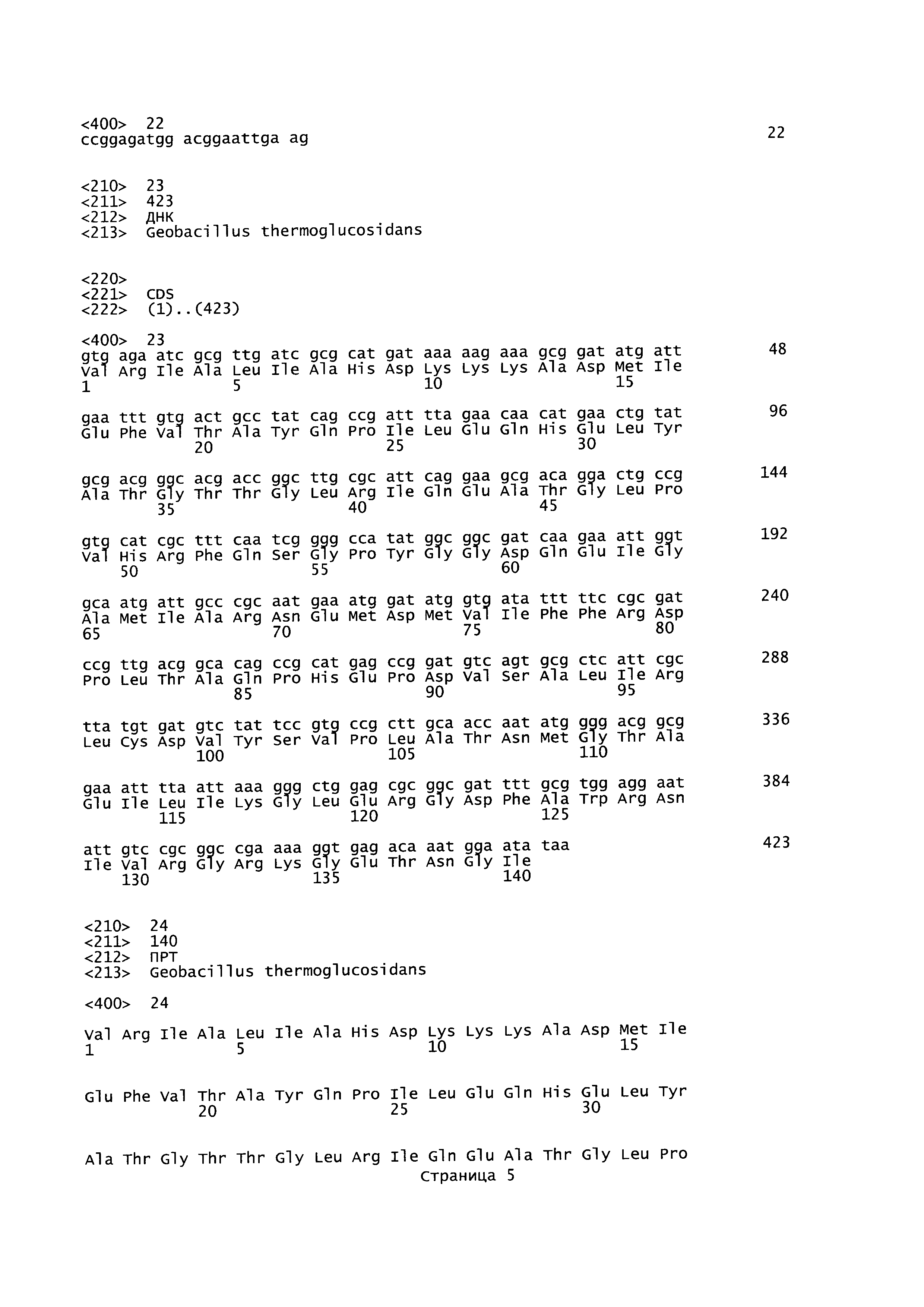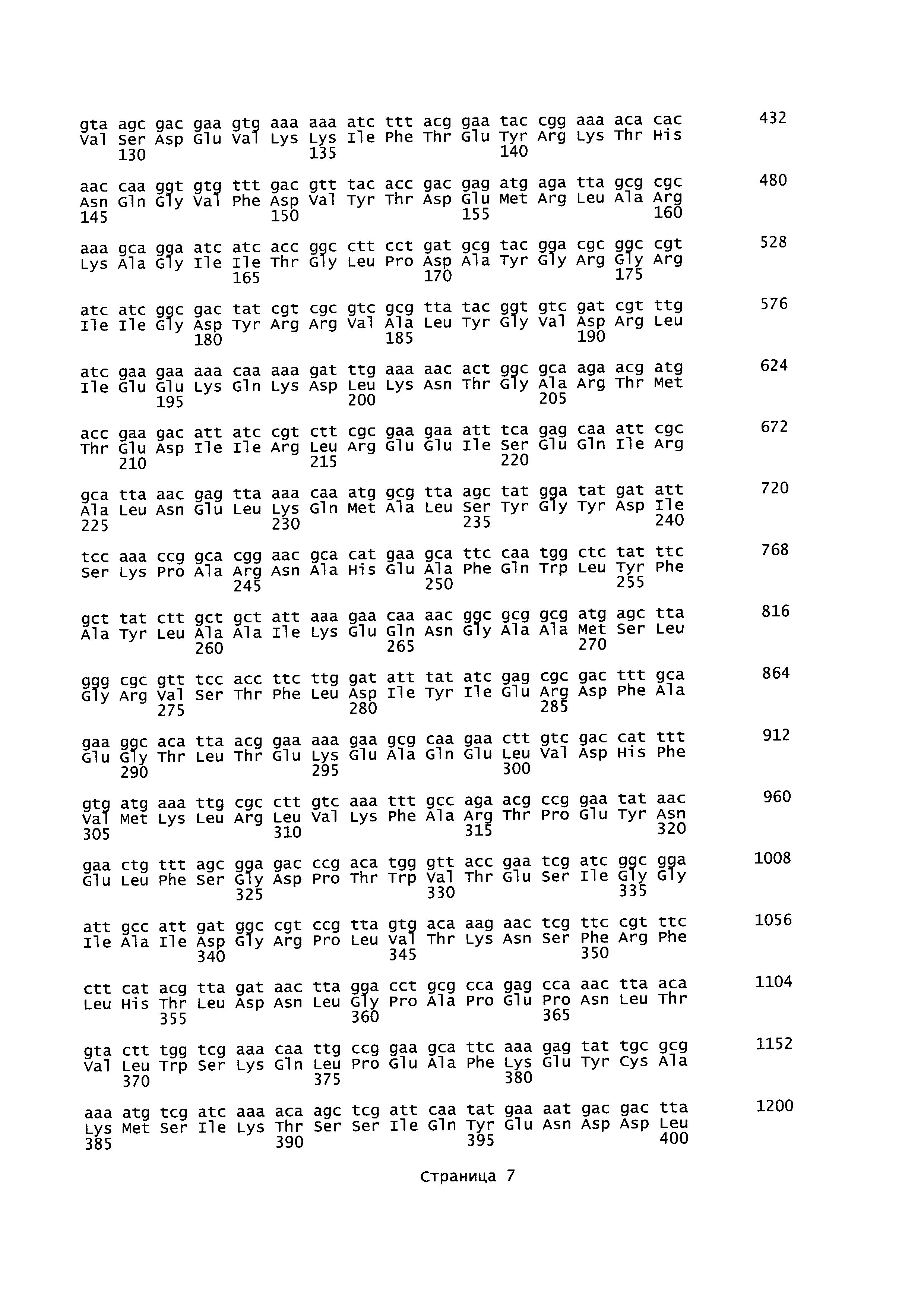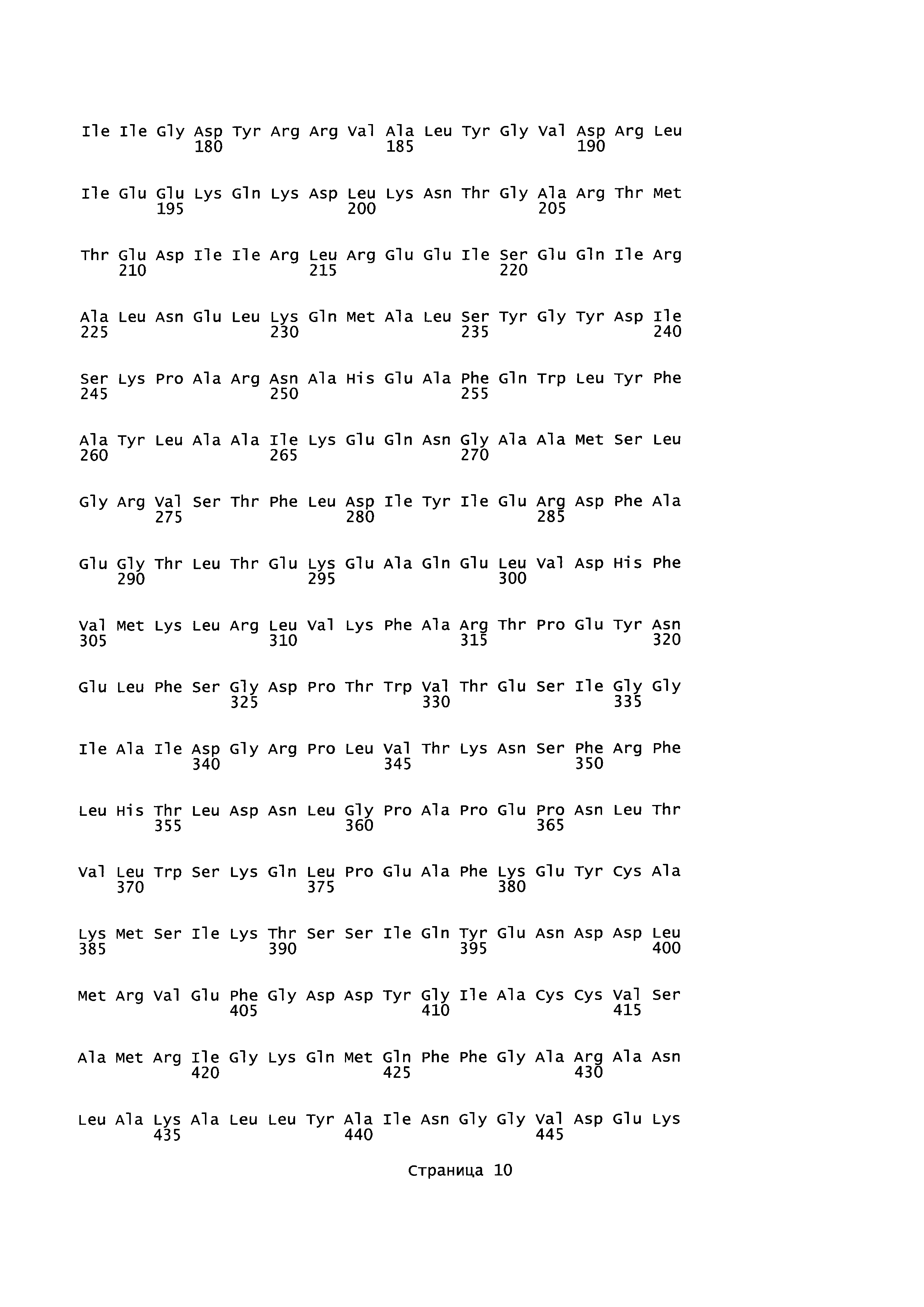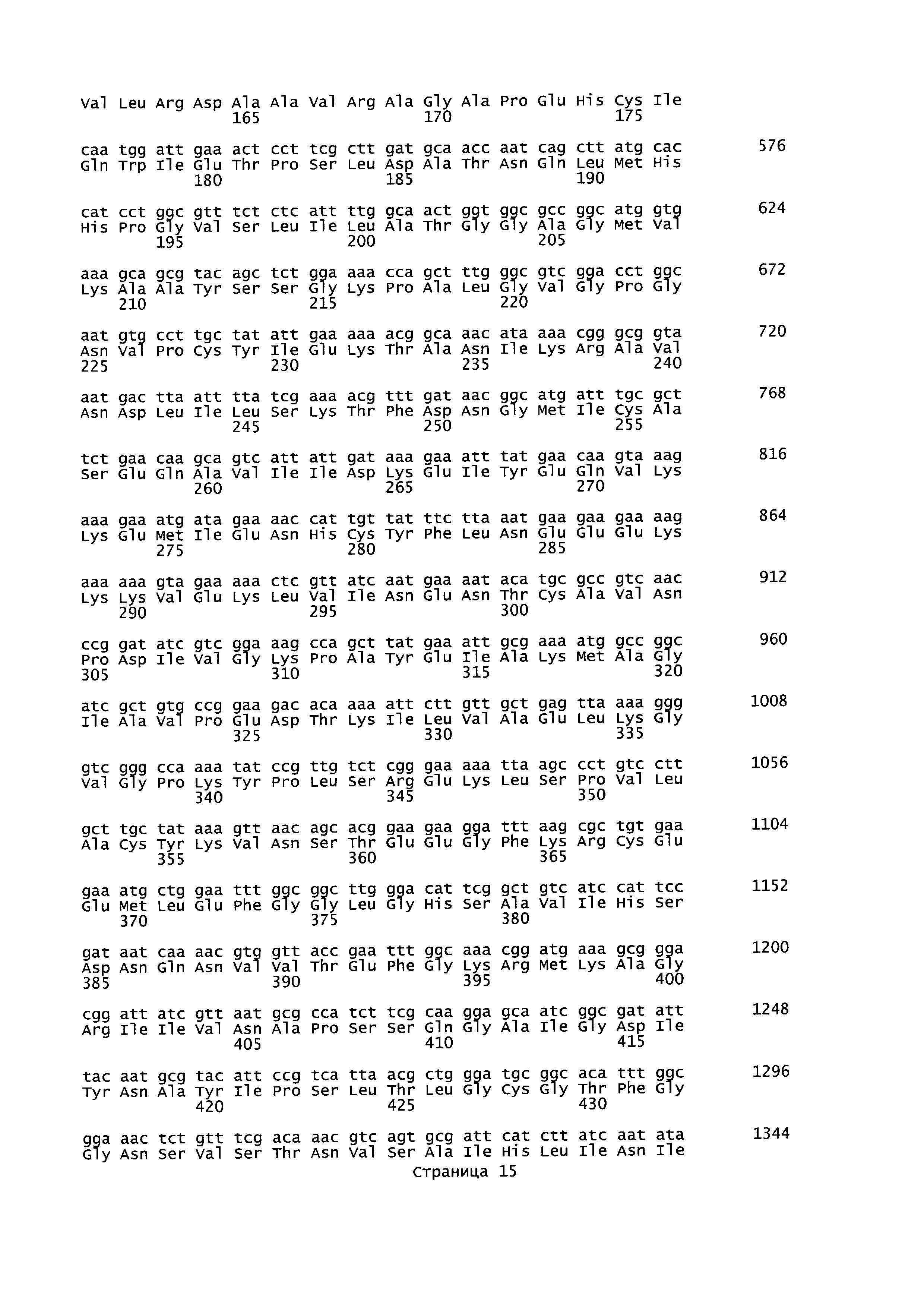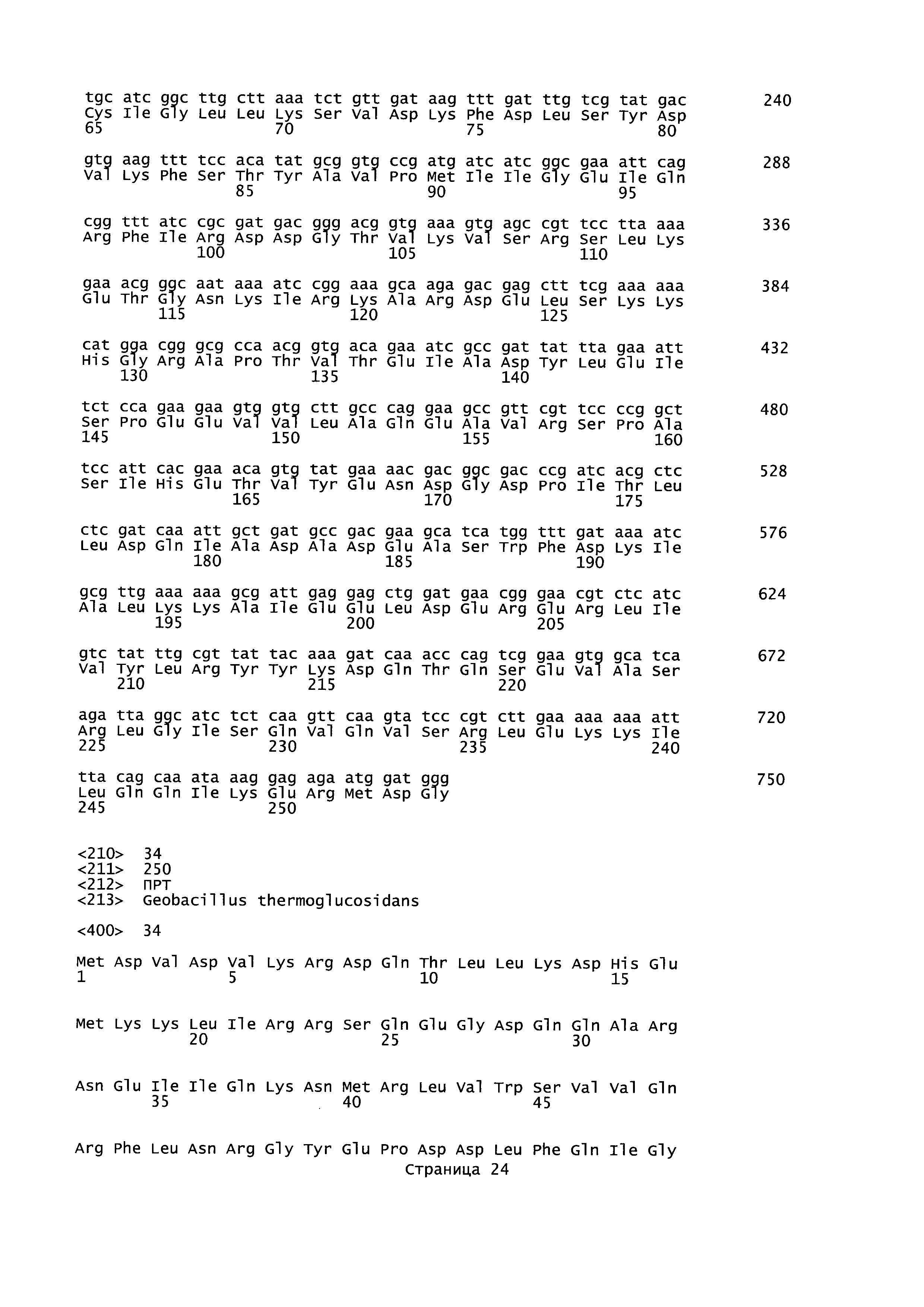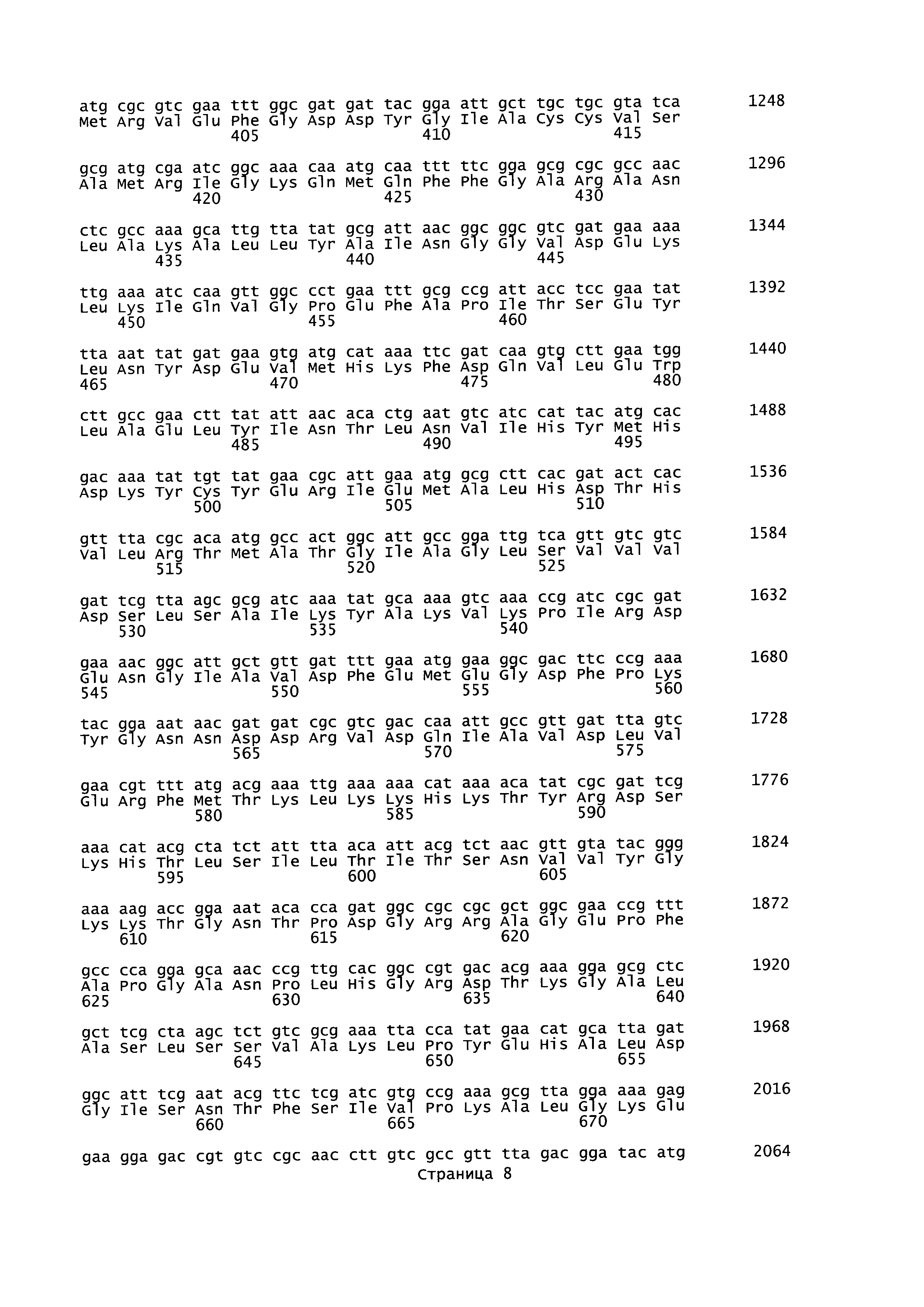Результат интеллектуальной деятельности: Генетическая модификация продуцирующих (S)-молочную кислоту термофильных бактерий
Вид РИД
Изобретение
Настоящее изобретение относится к модифицированию термофильной бактериальной клетки для гомомолочного продуцирования энантиомерно чистой (S)-молочной кислоты, к генетически модифицированной клетке и к способу продуцирования энантиомерно чистой (S)-молочной кислоты.
Молочная кислота и ее соли, известные как лактаты, являются коммерческими продуктами, полезными в различных областях, включая медицину, биоразлагаемые полимеры и пищевую промышленность. Термофильные бактерии, такие как Geobacillus, которые являются факультативными анаэробами, представляются идеальными организмами для промышленного производства молочной кислоты. Они способны расти при температурах от 37 до 75°C, с оптимумом при 55-65°C (Nazina et al., 2001, Int. J. Syst. Evol. Microbiol. 51:433-446), и обеспечивают возможность анаэробной промышленной ферментации при температурах выше 50°C. Такая высокая температура имеет ряд преимуществ при ферментировании в промышленном масштабе: меньший риск инфицирования и, таким образом, более высокая энантиомерная чистота, более быстрые реакции, более низкие затраты на охлаждение и так далее. Факультативно-анаэробная природа Geobacilli делает возможным ферментирование в анаэробных условиях или по меньшей мере при низком парциальном давлении кислорода, что является желательным для промышленного масштаба, поскольку это допускает возможность использования относительно недорогих оборудования и технологии. Кроме того, у этих бактерий менее жесткие требования к питательным веществам, чем у молочнокислых бактерий, таких как вид Lactobacillus, что также допускает относительно недорогие промышленные процессы.
Известно, что виды Geobacillus, которые являются факультативными анаэробами, продуцируют молочную кислоту при росте в анаэробных условиях или по меньшей мере при низком парциальном давлении кислорода. Примерами являются G. caldotenax, G. caldoxylosilyticus, G. debilis, G. kaustophilus, G. pallidus, G. stearothermophilus, G. tepidimans, G. thermodenitrificans, G. thermoglucosidans, G. thermoleovorans, G. toebii, G. tropicalis.
G. thermoglucosidans может продуцировать молочную кислоту из ксилозы, арабинозы, глюкозы, фруктозы, сахарозы и целлобиозы (Green et al., 2003, WO 03/008601). Для промышленного применения наиболее подходящим является источник питания, содержащий сахарозу, глюкозу, ксилозу или арабинозу или их смеси. Способность одновременно утилизировать глюкозу и ксилозу (Green et al., 2003, WO 03/008601) является важным преимуществом G. thermoglucosidans при использовании ферментируемых Сахаров, полученных из лигноцеллюлозного сырья.
Одним из недостатков известных видов Geobacillus, которые являются факультативными анаэробами, является тот факт, что они ферментируются с образованием смеси кислот, продуцируя молочную кислоту, этанол, уксусную кислоту и муравьиную кислоту в качестве основных продуктов ферментации. В данной заявке термин «органические кислоты» также предусматривает включение их соответствующих солей.
Другой недостаток заключается в том, что большинство видов не продуцируют энантиомерно чистую молочную кислоту. Хиральная чистота является важным аспектом для производства полимеров полимолочной кислоты. Таким образом, для промышленных применений существенным является производство энантриомерно чистой (S)-молочной кислоты. Однако на сегодняшний день доступна только ограниченная информация по энантиомерной чистоте молочной кислоты, продуцируемой видами Geobacillus. Следует иметь в виду, что другими терминами для (S)-молочной кислоты являются L-молочная кислота или L(+)-молочная кислота. В данной заявке эти термины используют взаимозаменяемо. Аналогичным образом, взаимозаменяемо используют термины (R)-молочная кислота, D-молочная кислота и D(-)-молочная кислота.
Payton & Hartley показывают, что G. stearothermophilus PSII имеет профиль ферментации с образованием смеси кислот, продуцируя (S)-молочную кислоту, уксусную кислоту и этанол при выращивании на глюкозе в условиях качалочной колбы без регулирования рН (Payton & Hartley, 1985, FEMS Microbiol. Lett. 26: 333-336). Хиральная чистота не упоминается. В более поздних исследованиях показано, что PSII и его производные являются нетипичными для G. stearothermophilus и, по-видимому, ближе связаны с G. caldotenax (Amartey et al., 1991, Biotechnol. Lett. 13: 621-626; Green et al., 2001, WO 01/49865). Низкий выход делает этот штамм непригодным для промышленного использования.
Danner et al. показывают продуцирование штаммами G. stearothermophilus IFA6 и IFA9 (S)-молочной кислоты из сахарозы и глюкозы (Danner et al., 1998, Appl. Biochem. Biotechnol. 70-72: 895-903). Штамм IFA6 продуцирует из глюкозы значительные количества этанола, уксусной кислоты и муравьиной кислоты в качестве побочных продуктов, тогда как штамм IFA9 их не продуцирует. Сообщалось о хиральной чистоте от 99,22 до 99,85% для IFA6 и 99,4% для IFA9 при их выращивании на глюкозе (Danner et al., 1998, Appl. Biochem. Biotechnol. 70-72: 895-903). Условия культивирования основывались на использовании обогащенной среды, содержащей дрожжевой экстракт и казеиновый пептон, что не является желательным для промышленного производства. По сравнению со штаммом IFA6, штамм IFA9 имеет пониженную продуктивность при более высоких концентрациях продукта, что делает его менее подходящим для промышленного производства. Кроме того, штамм IFA6 демонстрировал низкий выход, что также делает его непригодным для промышленного производства.
Rao & Satyanarayana демонстрируют продуцирование молочной кислоты бактерией G. thermoleovorans, но не комментируют ни выход, ни хиральную чистоту (Rao & Satyanarayana, 2009, Appl. Biochem. Biotechnol. 159: 464-477).
Green et al. раскрывают продуцирование (S)-молочной кислоты штаммом G. thermoglucosidans LN-9 с хиральной чистотой 99,2% и выходом 0,7 г/г в условиях качалочной колбы без регулирования рН (Green et al., 2003, WO 03/008601). Низкий выход делает его непригодным для промышленных применений.
Atkinson et al. демонстрируют продуцирование молочной кислоты штаммом G. thermoglucosidans NCIMB 11955 из ксилозы или глюкозы со значительными количествами этанола, уксусной кислоты и муравьиной кислоты в качестве побочных продуктов (Atkinson et al., 2006, WO 2006/117536). Выход на глюкозе составлял 0,64 г/г, что является слишком низким для промышленного применения. Хиральная чистота не раскрыта.
Tang et al. демонстрируют продуцирование (S)-молочной кислоты штаммом G. thermoglucosidans M10EXG. В микроаэробных условиях основным продуктом являлась молочная кислота с уксусной кислотой, этанолом и муравьиной кислотой в качестве существенных побочных продуктов. В анаэробных условиях основным продуктом являлась муравьиная кислота с молочной кислотой, уксусной кислотой и этанолом в качестве основных побочных продуктов. Описанные выходы являются слишком низкими для промышленного применения. Сообщалось, что хиральная чистота (S)-молочной кислоты составляла более 99% (Tang et al., 2009, Biotechnol. Lett. 102: 1377-1386).
G. thermoglucosidans описывают как термофильный вид Bacillus (Suzuki et al., 1983, Syst. Appl. Microbiol. 4:487-495; Nazina et al., 2001, Int. J. Syst. Evol. Microbiol. 51:433-446; Coorevits et al., 2012, Int. Syst. Evol. Microbiol. 62:14770-1485). Ранее G. thermoglucosidans был известен как Bacillus thermoglucosidasius (Suzuki et al., 1983, Syst. Appl. Microbiol. 4: 487-495), который был переименован как G. thermoglucosidasius группой Nazina et al. в 2001 (Nazina et al., 2001, Int. J. Syst. Evol. Microbiol. 51:433-446) и позднее переименован как G. thermoglucosidans группой Coorevits et al. (Coorevits et al., 2012, Int. Syst. Evol. Microbiol. 62: 14770-1485). Типовой штамм был выделен из почвы (Suzuki et al., 1976, Appl. Environ. Microbiol. 31: 807-812). Хотя первоначально он был описан как строгий аэроб, в более поздних исследованиях описывается его факультативно-анаэробный рост и продуцирование (S)-молочной кислоты (Green et al., 2003, WO 03/008601; Fong et al., 2006, Extremophiles 10:363-372). Интервал температур составляет от 42 до 69°C с оптимумом при 62°C (Suzuki et al., 1983, Syst. Appl. Microbiol. 4:487-495). Была описана генетическая модификация штаммов G. thermoglucosidans для продуцирования этанола (Green et al., 2001, WO 01/49865; Atkinson et al., 2008, WO 08/038019). Она включает описание генетических средств для G. thermoglucosidans DSM 2542т и способа нарушения гена L-лактатдегидрогеназы (Idh) (Atkinson et al., 2006, WO 2006/117536 и 2008, WO 2008/038019). Метаболические пути и потоки метаболитов для клеток, растущих на ксилозе и глюкозе, были описаны для G. thermoglucosidans M10EXG (Tang et al. 2009, Biotechnol. Lett. 102:1377-1386).
В своей лаборатории авторы наблюдали, что хиральная чистота кислоты, продуцируемой штаммом G. thermoglucosidans DSM 2542, может варьировать в зависимости от состава среды и/или источника сахаров. Авторами была обнаружена хиральная чистота (S)-молочной кислоты от 89 до более 99%.
Однако для гибкости при выборе субстрата и состава среды существует потребность в производном, которое продуцирует энантриомерно чистую (S)-молочную кислоту при всех подходящих промышленных условиях.
Из вышеизложенного можно сделать вывод, что известные штаммы Geobacillus ферментируются с образованием смеси кислот и не демонстрируют гомомолочного продуцирования энантиомерно чистой молочной кислоты.
Существует очевидная потребность в возможности использовать для гомомолочного продуцирования энантиомерно чистой молочной кислоты бактериальные штаммы (например штаммы Geobacillus), которые имеют привлекательные характеристики для промышленного применения, такие как низкие потребности в питательных веществах, широкие возможности потребления Сахаров, способность продуцировать ферменты, катализирующие гидролиз углеводов, высокая скорость роста, высокая продуктивность, устойчивость к осмотическому стрессу и генетическая доступность.
Задача настоящего изобретения заключается в том, чтобы создать термофильную бактериальную клетку, которая представляет собой факультативный анаэроб и продуцирует (S)-молочную кислоту посредством гомомолочной ферментации.
Задача настоящего изобретения также заключается в том, чтобы создать термофильную бактериальную клетку, которая представляет собой факультативный анаэроб и продуцирует энантиомерно чистую (S)-молочную кислоту.
Выход и хиральная чистота (S)-молочной кислоты в производстве молочной кислоты посредством видов Geobacillus, которые представляют собой факультативные анаэробы, могут варьировать в зависимости от штамма и условий культивирования. Таким образом, существует потребность в улучшенном Geobacillus, который модифицирован для продуцирования хирально чистой (S)-молочной кислоты по гомомолочному типу.
Существует несколько возможностей, которые могут иметь результатом образование хиральной примеси, как описано в литературе. (R)-молочная кислота может быть образована из пирувата под действием D-лактатдегидрогеназы, она может быть образована из (S)-молочной кислоты под действием лактатрацемазы, либо она может быть образована посредством метилглиоксального метаболического пути.
Метилглиоксальсинтаза (Е.С.4.2.99.11) катализирует превращение дигидроксиацетон-фосфата в метилглиоксаль и ортофосфат на первой стадии метилглиоксального шунта. Затем метилглиоксаль может быть превращен посредством двух различных метаболических путей в (S)- или (R)-молочную кислоту. Таким образом, метилглиоксальный шунт может представлять собой источник хирального загрязнения при продуцировании как (S)-, так и (R)-молочной кислоты. У Escherichia coli нарушение гена mgsA, кодирующего метилглиоксальсинтазу, улучшало хиральную чистоту продуцирования как (S)-, так и (R)-молочной кислоты (Grabar et al., 2006, Biotechnol. Lett. 28: 1527-1535). У грамположительных бактерий мало известно об активности метилглиоксального метаболического пути. У мезофильной Bacillus subtilis ген mgsA располагается в опероне вместе с генами, кодирующими первые два фермента в биосинтезе бациллитиола (Gaballa et al., 2010, Proc. Natl. Acad. Sci. USA 107: 6482-6486; Helmann, 2011, Antioxidants & Redox signaling 15: 123-133). Недавно Chandrangsu et al. продемонстрировали, что бациллитиол вовлечен в детоксикацию метилглиоксаля (Chandrangsu et al., 2014, Mol. Microbiol. 91: 706-715). В зависящем от бациллитиола метилглиоксальном метаболическом пути для превращения метилглиоксаля в (R)-молочную кислоту задействованы глиоксалаза I (GlxA) и глиоксалаза II (FlxB) (Chandrangsu et al., 2014). Кроме того, метилглиоксаль может быть превращен в (R)-молочную кислоту под действием YdeA, YraA и YfkM, предсказанных гомологов глиоксалазы III (Chandrangsu et al., 2014, Mol. Microbiol. 91: 706-715).
В последовательности генома G. thermoglucosidans авторы смогли обнаружить предсказанный ген D-лактатдегидрогеназы, но не очевидный ген лактатрацемазы. Для обоих метаболических путей превращения метилглиоксаля в (R)-молочную кислоту, как определено у В. subtilis (Chandrangsu et al., 2014, Mol. Microbiol. 91: 706-715), ближайшие гомологи у G. thermoglucosidans имеют очень низкую идентичность аминокислотных последовательностей (46% для YwbC; 34% для YurT; для YdeA гомолог не обнаружен; 30% для YraA; и 35% для YfkM). Напротив, MgsA В. subtilis имеет гомолог G. thermoglucosidans с идентичностью аминокислотных последовательностей 72%. Основываясь на информации о геноме, можно было бы ожидать, что продуцирование (R)-молочной кислоты вызывается активностью D-лактатдегидрогеназы, а не лактатрацемазы или метилглиоксального пути. Неожиданно авторы смогли нарушить продуцирование (R)-лактата путем нарушения гена mgsA, предсказанного как кодирующего метилглиоксальсинтазу.
Виды Geobacillus, которые являются факультативными анаэробами, демонстируют ферментации с образованием смеси кислот с молочной кислотой, этанолом, уксусной кислотой и муравьиной кислотой в качестве основных продуктов. Нарушение генов, кодирующих незаменимые ферменты в продуцировании побочных продуктов, является общим подходом для улучшения продуцирования целевого продукта. Однако эффекты нарушения конкретного гена могут иметь различные побочные эффекты в зависимости от полного метаболизма хозяина. Одиночные мутации в pfIA Escherichia coli, кодирующем фермент, активирующий пируват-формиат-лиазу, и adhE, кодирующем бифункциональный комплекс ацетальдегид-СоА/алкогольдегидрогеназа, имеют результатом улучшенное продуцирование молочной кислоты с сопутствующим повышенным образованием побочного продукта пирувата, остаточное продуцирование уксусной кислоты и этанола и сильно сниженный выход биомассы (pflA-), либо улучшенное продуцирование молочной кислоты с уксусной кислотой в качестве основного продукта ферментации (adhE-) (Zhu & Shimizu, 2005, Metab. Eng. 7: 104-115). В некоторых штаммах Е. coli был нарушен локус focA-pflAB для исключения продуцирования муравьиной кислоты (Zhou et al., 2003, Appl. Environ. Microbiol. 69: 2237-2244; Liu et al., 2011, Appl. Biochem. Biotechnol. 164: 162-169). Недавно была продемонстрирована важность focA, кодирующего белок формиатного канала, в накоплении молочной кислоты в среде (Beyer et al., 2013, J. Bacteriol. 195: 1428-1435), поэтому это будет вносить вклад в фенотипы штаммов Е. coli, имеющих делеции focA-pflAB. У зеленых водорослей Chlamydomonas reinhardtii нокауты генов, кодирующих пируват-формиат-лиазу и алкогольдегидрогеназу, улучшали ферментирование молочной кислоты, но также повышали внеклеточные концентрации глицерина и уксусной кислоты (Catalanotti et al., 2012, Plant Cell 24: 692-707).
У G. thermoglucosidans гены pflBA ориентированы конвергентно к гену adhE. По практическим соображениям авторы решили нарушать pfIA, pfIB и adhE посредством делеции pflBA и части adhE в ходе одной модификации. Неожиданно авторы смогли почти устранить образование побочных продуктов в виде этанола, уксусной кислоты и муравьиной кислоты, не воздействуя на другие побочные продукты и не воздействуя на ход ферментирования молочной кислоты. Например, в настоящей заявке то, что образование побочного продукта почти устранено, означает, что в результате ферментирования полученной методами генной инженерии клетки, как раскрыто в данном описании, количество по массе побочных продуктов (таких как этанол, уксусная кислота и муравьиная кислота) по отношению к общему количеству продуцированной молочной кислоты составляет не более 10% (масс/масс.) и, в частности, не более 5%, 4%, 3% или 2% (масс/масс). Количество молочной кислоты и побочных продуктов может быть определено способами, известными в данной области техники, например путем дериватизации и анализа посредством газо-жидкостной хроматографии (ГЖХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ).
Дефектная споруляция является желательным свойством для промышленного применения видов Bacillus. Согласно директиве 2009/41/ЕС Европейского парламента и Совета ЕС от 6 мая 2009 г. по ограничению использования генетически модифицированных микроорганизмов, ограниченное использование генетически модифицированных микроорганизмов следует классифицировать в зависимости от риска, который они представляют для здоровья человека и для окружающей среды. Наличие фенотипа с дефектной споруляцией для видов Bacillus представляется средством минимизации риска их распространения в окружающей среде. Известны различные способы получения фенотипов с дефектной споруляцией, включая селекцию спонтанных производных с дефектной споруляцией (Green et al., 2001, WO01/ 49865) или направленное нарушение пути споруляции, например посредством нарушения spo0A (Gonzy- et al., 1992, J. Mol. Biol. 244: 967-979; Atkinson et al., 2010, WO 2010/052499) или sigF (Fleming et al., 1995, Appl. Environ. Microbiol. 61: 3775-3780; Wang et al., 2005, J. Appl. Microbiol. 98: 761-767;
et al., 1992, J. Mol. Biol. 244: 967-979; Atkinson et al., 2010, WO 2010/052499) или sigF (Fleming et al., 1995, Appl. Environ. Microbiol. 61: 3775-3780; Wang et al., 2005, J. Appl. Microbiol. 98: 761-767;  et al., 2010, Appl. Environ. Microbiol. 76: 4085-4088).
et al., 2010, Appl. Environ. Microbiol. 76: 4085-4088).
Таким образом, в первом аспекте настоящего изобретения раскрывается полученная генно-инженерным путем термофильная бактериальная клетка, которая является факультативным анаэробом и продуцирует (S)-молочную кислоту, в которой эндогенный ген метилглиоксальсинтазы mgsA инактивирован или делетирован.
Эндогенные гены представляют собой гены, которые присутствуют в микроорганизме. Совершенно очевидно, что у бактерии, как она раскрыта в данном описании изобретения, в которой ген инактивирован или делетирован, этот ген изначально должен присутствовать. В отсутствие указания об обратном, в настоящей заявке любая ссылка на ген означает эндогенный ген. Гены, которые введены в микроорганизм, не являются эндогенными генами.
В другом аспекте предложена полученная генно-инженерным путем бактериальная клетка, представляющая собой факультативный анаэроб, которая является гомомолочной и продуцирует (S)-молочную кислоту в энантиомерно чистой форме.
В настоящем изобретении гомомолочную ферментацию определяют как продуцирование молочной кислоты из источников углеводов с образованием не более 15% (масс/масс), предпочтительно не более 10% (масс/масс), и более предпочтительно не более 5%, 4%, 3% или 2% (масс/масс.) побочных продуктов, таких как муравьиная кислота, уксусная кислота и этанол. Это процентное содержание относится к общей массе побочных продуктов относительно общей массы молочной кислоты (включая (S)-молочную кислоту и любую (R)-молочную кислоту, которая может присутствовать). Количество молочной кислоты и этанола, уксусной кислоты и муравьиной кислоты может быть определено способами, известными в данной области техники, например дериватизацией и анализом посредством газо-жидкостной хроматографии (ГЖХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ).
В некоторых воплощениях образовавшееся количество по меньшей мере одного из муравьиной кислоты, этанола и уксусной кислоты составляет не более 10% (масс/масс), исходя из общей массы муравьиной кислоты, этанола или уксусной кислоты, относительно общей массы продуцированной молочной кислоты, в частности, не более 6%, 1%, 0,25% или 0,1% (масс/масс). Другими словами, количество муравьиной кислоты, образовавшейся в ходе гомомолочного ферментирования, может составлять, например, не более 10% (масс/масс.) и, более конкретно, не более 6%, 1%, 0,25% или 0,1% (масс/масс.) относительно общего количества по массе молочной кислоты. Аналогичным образом, количество этанола может составлять не более 10%, 6%, 1%, 0,25% или 0,1% (масс/масс), и количество уксусной кислоты может составлять не более 10%, 6%, 1%, 0,25% или 0,1% (масс/масс).
В данном описании изобретения mgsA относится к гену метилглиоксальсинтазы, последовательность которого представлена в SEQ ID NO: 23 для Geobacillus thermoglucosidans. Кодируемая аминокислотная последовательность представлена в SEQ ID NO:24. Нуклеотидные области, фланкирующие mgsA, могут быть идентифицированы посредством PCR (полимеразная цепная реакция) праймеров с SEQ ID NO: 11, 12, 15 и 16.
Другой аспект изобретения относится к полученной генно-инженерным путем термофильной бактериальной клетке, где в дополнение к гену mgsA также инактивирован или делетирован эндогенный ген А и/или В пируват-формиат-лиазы.
В предпочтительном воплощении ген пируват-формиат-лиазы инактивирован посредством инактивации или делеции локуса пируват-формиат-лиаза/алкогольдегидрогеназа pflBA-adhE. Альтернативно ген А и/или В пируватлиазы и гены adhE алкогольдегидрогеназы могут быть инактивированы или делетированы на раздельных стадиях. Нуклеотидные области, фланкирующие pflBA-adhE, могут быть идентифицированы посредством PCR праймеров с SEQ ID NO: 19-21.
В данном описании изобретения как pflBA обозначают гены А и В пируват-формиатлиазы, кодирующие фермент, активирующий пируват-формиат-лиазу, и пируват-формиат-лиазу, соответственно.
plfA относится к гену А пируват-формиат-лиазы (кодирующему фермент, активирующий пируват-формиат-лиазу), последовательность которого для Geobacillus thermoglucosidans представлена в SEQ ID NO: 27. Кодируемая аминокислотная последовательность представлена в SEQ ID NO: 28. plfB относится к гену В пируват-формиат-лиазы (кодирующему пируват-формиат-лиазу), последовательность которого представлена в SEQ ID NO: 25. Кодируемая аминокислотная последовательность представлена в SEQ ID NO: 26. В настоящем изобретении adhE относится к гену Е алкогольдегидрогеназы, кодирующему бифункциональный комплекс ацетальдегид-СоА/алкогольдегидрогеназа, последовательность которого для Geobacillus thermoglucosidans представлена в SEQ ID NO: 29. Кодируемая аминокислотная последовательность представлена в SEQ ID NO: 30.
В еще одном воплощении согласно настоящему изобретению в полученной генно-инженерным путем клетке также инактивирован или делетирован эндогенный ген фосфотрансацетилазы (pta). Нуклеотидная последовательность pta для Geobacillus thermoglucosidans представлена в SEQ ID NO. 31. Кодируемая аминокислотная последовательность представлена в SEQ ID NO. 32. Инактивация или делеция pta (который кодирует фосфотрансацетилазу) дополнительно минимизирует остаточное продуцирование ацетата, ассоциированное с активностью эндогенного pta. Полученный штамм (с инактивированным или делетированным pta) является ауксотрофным по уксусной кислоте. Соответственно, при ферментировании этой полученной генно-инженерным путем клетки в питательную среду следует добавлять уксусную кислоту.
В еще одном воплощении согласно настоящему изобретению полученная генно-инженерным путем термофильная бактериальная клетка дополнительно является дефектной по споруляции за счет инактивации или делеции эндогенного гена споруляции.
В другом воплощении инактивированный или делетированный ген споруляции представляет собой sigF.
sigF относится к гену споруляции, нуклеотидная последовательность которого для Geobacillus thermoglucosidans представлена в SEQ ID NO: 33. Кодируемая аминокислотная последовательность представлена в SEQ ID NO: 34. Нуклеотидные последовательности, фланкирующие SigF, могут быть идентифицированы посредством PCR праймеров с SEQ ID NO: 3-6.
В другом воплощении согласно настоящему изобретению (S)-молочная кислота продуцируется в клетке по изобретению с энантиомерной чистотой по меньшей мере 98%, более предпочтительно по меньшей мере 99%, 99,5%, 99,8% или 99,9%.
В еще одном воплощении настоящего изобретении в клетке один или более генов mgsA, pflBA-adhE или sigF инактивированы или делетированы посредством гомологичной рекомбинации.
В еще одном воплощении полученная генно-инженерным путем термофильная бактериальная клетка по настоящему изобретению представляет собой грамположительную бактериальную клетку. Предпочтительно клетка принадлежит к роду Bacillus.
В еще одном воплощении полученная генно-инженерным путем термофильная бактериальная клетка по настоящему изобретению представляет собой грамположительную бактериальную клетку. Предпочтительно клетка принадлежит к роду Geobacillus.
В еще одном воплощении полученная генно-инженерным путем термофильная бактериальная клетка по настоящему изобретению представляет собой Geobacillus thermoglucosidans.
Задача настоящего изобретения также заключается в создании штамма Geobacillus, который представляет собой факультативный анаэроб и продуцирует (S)-молочную кислоту посредством гомомолочного ферментирования.
Хиральная чистота является важным аспектом для производства полимеров полимолочной кислоты. Поэтому необходимо продуцирование энантиомерно чистой (S)-молочной кислоты для промышленных применений.
Таким образом, в одном аспекте настоящего изобретения раскрыт способ генетического модифицирования средствами генной инженерии умеренно термофильных видов Geobacillus, которые являются факультативными анаэробами и гомомолочными.
В другом аспекте изобретения предложен способ продуцирования энантиомерно чистой молочной кислоты. Способ включает стадии культивирования термофильной бактериальной клетки по настоящему изобретению с использованием подходящего ферментируемого углеродсодержащего источника питания и выделения (S)-молочной кислоты.
В одном аспекте изобретения предложен способ продуцирования энантиомерно чистой молочной кислоты, где углеродсодержащий источник питания содержит ксилозу, глюкозу или сахарозу.
Культивирование предпочтительно осуществляют при температуре от 50°C до 70°C, более предпочтительно от 55 до 65°C.
В контексте изобретения инактивация или делеция гена может представлять собой модификацию гена, кодирующего целевой полипептид, подлежащий продуцированию клеткой, и/или гена, кодирующего полипептид, вовлеченный в продуцирование клеткой первичного или вторичного метаболита. В принципе это может быть осуществлено посредством снижения клеточных уровней кодируемого белка. Снижение клеточных уровней может быть осуществлено, например, посредством направленной инактивации гена, кодирующего представляющий интерес фермент. Ген может быть удален полностью. Однако, в качестве альтернативы, к снижению активности кодируемого белка также может приводить делеция части гена. Альтернативно или дополнительно, могут быть модифицированы или удалены нуклеотидные последовательности, ответственные за регуляцию или экспрессию генов, такие как промоторы, энхансеры, сайты инициации трансляции и тому подобные. Другим путем влияния на активность представляющего интерес белка может быть, при необходимости, модификация транспортных сигналов, или введение антисмысловой РНК.
Предпочтительной является хромосомная модификация, поскольку она гарантирует стабильное распределение функциональности гена во всех клетках-потомках. Делеция целевой функциональности в хромосоме может быть осуществлена посредством негомологичной, а также гомологичной рекомбинации. Гомологичная рекомбинация является предпочтительной, поскольку она открывает возможность вводить, удалять или одновременно вводить и удалять функциональность.
Когда планируется гомологичная рекомбинация, трансформирующая ДНК дополнительно содержит последовательность ДНК, которая является гомологичной геномной целевой последовательности конкретной клетки, подлежащей конструированию. Специалисту будет понятно, что для получения гомологичной рекомбинации не требуется 100% идентичности. Также будет достаточным процент идентичности 80%, предпочтительно 90%, более предпочтительно 95%, 98% или 99%. Как правило, представляющая интерес последовательность ДНК для вставки в хромосому посредством гомологичной рекомбинации фланкируется гомологичными последовательностями с длиной, достаточной для осуществления гомологичной рекомбинации. Такая длина может составлять по меньшей мере примерно 200 п.о., например от примерно 200 до примерно 1500 п.о., предпочтительно от примерно 500 до примерно 1000 п.о.
Для цели настоящего изобретения степень идентичности между двумя аминокислотными последовательностями относится к проценту аминокислот, которые являются идентичными между двумя последовательностями. Степень идентичности определяют, используя алгоритм BLAST, который описан в Altschul, et al., J. Mol. Biol. 215: 403-410 (1990). Программное обеспечение для выполнения анализов BLAST является доступным от Национального центра биотехнологической информации (http://мacc.ww.ncbi.nlm.nih.gov/). Стандартные настройки для параметров алгоритма Blastp представляют собой: порог ожидания 10, длина «слова» 3, максимальные совпадения в диапазоне запроса 0, матрица BLOSUM62, штраф на пропуск 11 и штраф на длину пропуска 1, Compositional adjustments at Conditional compositional score matrix adjustment.
Для цели настоящего изобретения степень идентичности между двумя нуклеотидными последовательностями относится к проценту нуклеотидов, которые являются идентичными между двумя последовательностями. Степень идентичности определяют, используя алгоритм BLAST, который описан в Altschul, et al., J. Mol. Biol. 215: 403-410 (1990). Компьютерная программа для выполнения анализов BLAST является доступным от Национального центра биотехнологической информации (http://мacc.ww.ncbi.nlm.nih.gov/). Стандартные настройки для параметров алгоритма Blastp представляют собой: порог ожидания 10, длина «слова» 28, максимальные совпадения в диапазоне запроса 0, мера совпадения/несовпадения 1, -2, штраф за пропуск at Linear.
Как упоминается выше, ни одной из последовательностей, идентифицирующих указанные выше гены в Geobacillus thermoglucosidans, не требуется 100% идентичности для того, чтобы модифицировать представляющий интерес ген посредством генной инженерии. Кроме того, в родственных термофильных бактериальных клетках из других видов гены могут отличаться от этих последовательностей. Однако, при использовании гена Geobacillus thermoglucosidans последовательности, гомологичные этим генам, которые имеют аналогичную функциональность, легко могут быть идентифицированы специалистом в данной области техники и соответствующие праймеры могут быть получены для осуществления гомологичной рекомбинации в этих штаммах. Таким образом, даже если в конкретном штамме существуют отклонения от последовательностей указанных выше идентифицированных генов, гомологичные гены легко могут быть идентифицированы. Их нуклеотидные последовательности могут быть определены с применением технологий, известных в данной области техники, и, при необходимости, может быть определен новый набор праймеров, идентичных или комплементарных последовательностям, фланкирующим ген.
Клетки по настоящему изобретению могут быть получены, используя технологии, известные в данной области техники. В частности, способы введения ДНК в термофильные бактерии посредством электропорации были описаны Van Kranenburg et al., 2007, WO 2007/085433 и Cripps et al. 2009, Metab. Eng. 11:398-408.
Трансформация этих видов Bacillus электропорацией может быть достигнута посредством пропускания высоковольтного разряда через суспензию, содержащую умеренно термофильный вид Bacillus, который является факультативным анаэробным и гомомолочным, и подходящую трансформирующую ДНК, содержащую желаемую функциональность, и/или последовательности ДНК, гомологичные геномным последовательностям конкретных Bacilli.
(S)-Молочная кислота может быть получена ферментированием полученной генно-инженерным путем термофильной бактериальной клетки, как она раскрыта в данном описании, в присутствии источника углевода (например глюкозы и/или ксилозы) посредством способов, известных в данной области техники. Во время ферментирования молочную кислоту, выделяемую микроорганизмами, обычно нейтрализуют, используя основание, например основные соли щелочных или щелочно-земельных металлов, такие как гидроксиды, карбонаты и/или гидрокарбонаты натрия, калия, магния и/или кальция. В общем предпочтительными являются магниевые основания, например гидроксид магния, карбонат магния и/или гидрокарбонат магния. Таким образом, в некоторых аспектах настоящее изобретение относится, в частности, к способу продуцирования энантиомерно чистой (S)-молочной кислоты, где указанный способ включает культивирование термофильной бактериальной клетки, как она определена в данном описании изобретения, в присутствии магниевого основания (например по меньшей мере одного, выбранного из гидроксида магния, карбоната магния и гидрокарбоната магния), используя подходящий ферментируемый углеродсодержащий источник питания, и выделение (S)-молочной кислоты.
После ферментирования (S)-молочную кислоту (или ее соль) отделяют от ферментационного бульона посредством любого из многих общепринятых известных способов выделения молочной кислоты и/или лактата из водных растворов. Для повышения эффективности выделения перед его началом могут быть удалены частицы субстрата или микроорганизмы (биомасса).
Указанное выделение можно проводить посредством центрифугирования, фильтрования, флокуляции, флотации или мембранного фильтрования. Оно раскрыто, например, в WO 01/38283, где описан непрерывный процесс получения молочной кислоты посредством ферментирования. Хотя обсуждение ферментирования в данном описании изобретения в общем относится к периодическому процессу, части процесса или весь процесс в целом можно осуществлять непрерывно.
После выделения (S)-молочной кислоты (или ее соли) из ферментационного бульона продукт может быть подвергнут одной или более стадиям очистки, такой как экстрагирование, дистилляция, кристаллизация, электродиализ, фильтрование, обработка активированным углем, ионный обмен и так далее. Различные остаточные потоки могут быть использованы повторно, возможно после обработки, в ферментационном сосуде или на любой ранее выполняемой стадии очистки.
Примеры
Материалы и методы
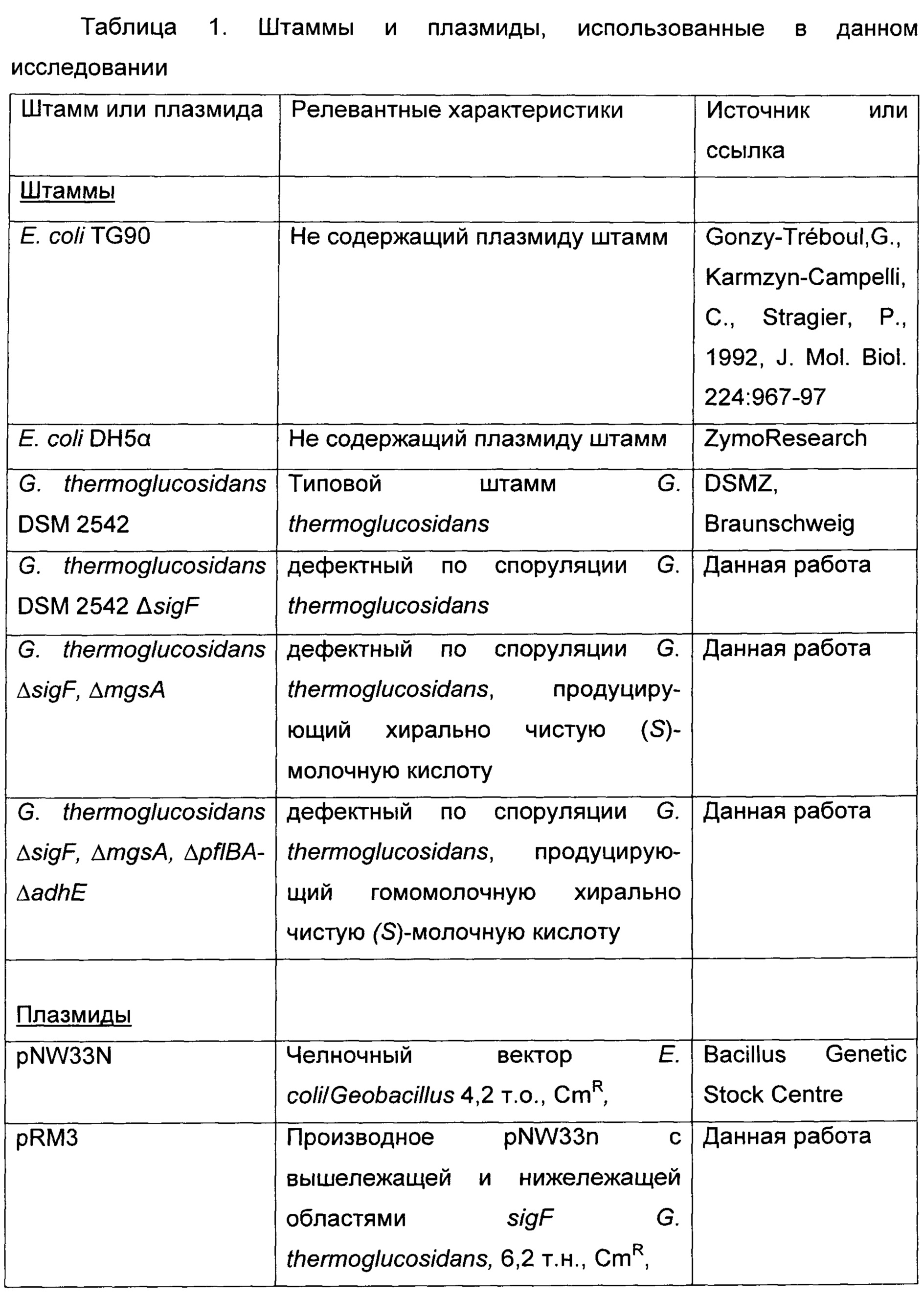
Штаммы и плазмиды
Штаммы и плазмиды, использованные в данном исследовании, перечислены в Таблице 1.
Escherichia coli культивировали обычным образом в бульоне LB (Sambrook & Russell, 2001, Molecular Cloning, a laboratory manual. 3rd edition. Cold Spring Harbor Laboratory Press, New York) при 37°C в аэробных условиях. При необходимости использовали хлорамфеникол и/или ампициллин в концентрациях 20 мг/л и 100 мг/л, соответственно.
G. thermoglucosidans выращивали обычным образом в среде TGP при 52°C, 55°C или 60°C в аэробных условиях, если не указано иначе. Среда TGP (Taylor et al., 2008, Plasmid 60: 45-52) содержала 17 г/л триптона, 3 г/л соевого пептона, 5 г/л NaCl, 2,5 г/л K2HPO4 при рН 7,0 и добавки 4 мл/л глицерина и 4 г/л пирувата натрия после автоклавирования. Для чашек с TGP использовали 10 г/л агара. При необходимости среду дополняли хлорамфениколом (8 мкг/мл).

Методы ДНК манипулирования
Стандартные процедуры манипулирования с ДНК выполняли, как описано у Sambrook and Russell (Sambrook & Russell, 2001, Molecular Cloning, a laboratory manual. 3rd edition. Cold Spring Harbor Laboratory Press, New York).
Конструирование производных pNW33N осуществляли в E.coli.
Крупномасштабное выделение плазмидной ДНК Е. coli из 100 мл культуры выполняли, используя Jetstar 2.0 Plasmid Maxiprep Kit® (Genomed), следуя инструкциям изготовителя. Маломасштабное выделение плазмидной ДНК Е. coli из 1 мл культуры выполняли, используя набор Nucleospin Plasmid Quick Pure® (Macherey-Nagel), следуя инструкциям изготовителя.
Компетентные клетки Е. coli получали, используя хлорид кальция, и трансформировали тепловым шоком, как описано в Sambrook and Russell (Sambrook & Russell, 2001, Molecular Cloning, a laboratory manual. 3rd edition. Cold Spring Harbor Laboratory Press, New York).
Полимеразные цепные реакции (PCR) для целей клонирования выполняли с высокоточной полимеразой Pwo (Roche), следуя инструкциям изготовителя.
Для PCR-анализа колоний колонии протыкали зубочисткой и небольшое количество клеточного материала переносили в пробирку для PCR-реакции. Клетки разрушали путем инкубирования в течение 1 минуты при 1000 Вт в микроволновой печи. Смеси для PCR-реакции 50 мкл или 25 мкл с полимеразой rTaq (Amersham Biosciences) получали, как рекомендовано изготовителем, и добавляли в реакционные пробирки с разрушенными клетками.
Электропорация G. thermoglucosidans
G. thermoglucosidans трансформировали путем электропорации на основе протокола, описанного Cripps et al. (Cripps, et al., 2009, Metab. Eng. 11:398-408). G. thermoglucosidans выращивали в течение ночи при 55°C и 1 мл использовали для инокулирования в 50 мл предварительно нагретой среды TGP в 250 мл конической колбе с лопастной мешалкой. Клетки инкубировали при 60°C (180 об./мин) до ОП600 приблизительно 1,0. Колбу охлаждали на льду в течение 10 мин и клетки осаждали путем центрифугирования (4°C). Затем клетки промывали четыре раза охлажденным на льду буфером для электропорации (0,5 М сорбит, 0,5 М маннит, 10% (об./об.) глицерин). Объемы со стадий промывания составляли 50 мл, 25 мл, 10 мл и 10 мл. Конечный осадок ресуспендировали в 1,3 мл охлажденного на льду буфера для электропорации и аликвоты по 60 мкл электрокомпетентных клеток хранили при -80°C или использовали непосредственно для электропорации.
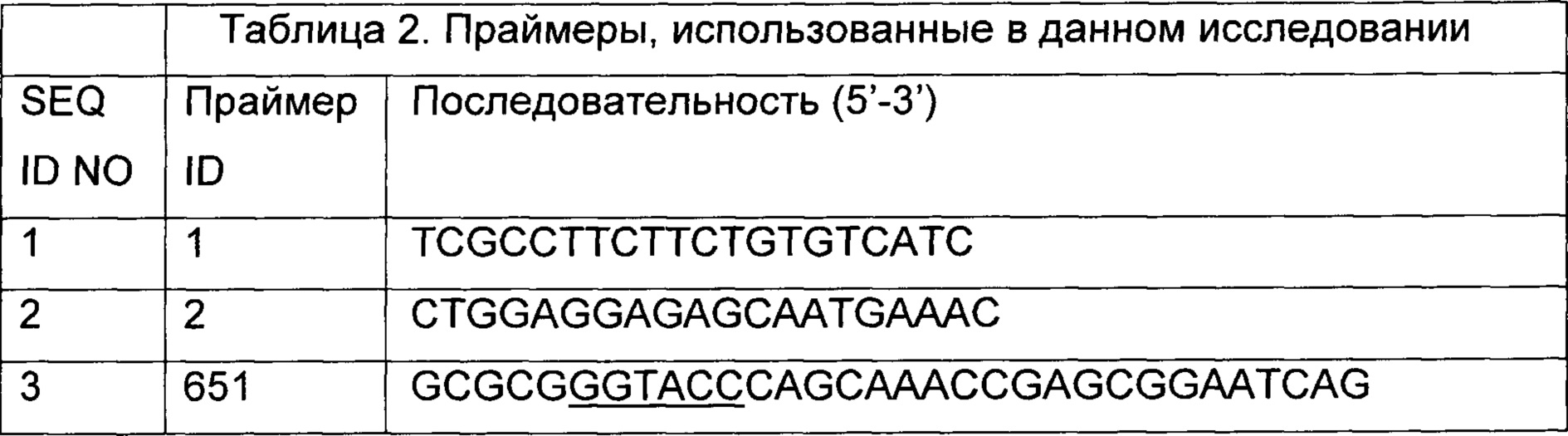
Аликвоту 60 мкл электрокомпетентных клеток (размороженных) смешивали с 1-2 мкг плазмидной ДНК и затем переносили в охлажденную кювету для электропорации (ширина зазора 0,1 см). Условия электропорации с использованием импульсного электропоратора Bio-Rad Gene Pulser были следующие: 2,5 кВ, 10 мкФ и 600 Ом. После электропорации клетки переносили в 1 мл предварительно нагретой (52°C) TGP в 50 мл пластиковой пробирке и восстанавливали при 52°C, 180 об./мин в течение двух часов. Восстановленную клеточную суспензию осаждали и почти 150 мкл супернатанта отбрасывали. Осадок ресуспендировали в оставшемся супернатанте. Объемы 1/10 и 9/10 высевали на чашки с TGP, содержащие 8 мкг/л хлорамфеникола. Чашки инкубировали при 52°C в течение 24-48 часов. Колонии, которые появились на чашках, переносили на чашку со свежей TGP, содержащей 8 мкг/л хлорамфеникола, и инкубировали при 55°C в течение ночи. Выросшие колонии тестировали на присутствие плазмиды посредством PCR для отбора колоний, используя праймеры 1 и 2 (Таблица 2).
Интеграция
Челночный вектор pNW33n Geobacillus-E.coli использовали в качестве вектора для интеграции в G. thermoglucosidans, как описано ранее (Cripps et al., 2009 Metab. Eng. 11: 398-408). 20 мл TGP, содержащей 8 мкг/мл хлорамфеникола, инокулировали трансформированными штаммами из исходной культуры в глицерине. После роста в течение ночи при 55°C, 180 об./мин, подходящие разбавления высевали на чашки с TGP, содержащей 8 мкг/мл хлорамфеникола. Затем эти чашки инкубировали при 68°C в течение 24 часов. Делали посев штрихом одиночных колоний на свежую чашку (инкубировали при 52°C) и проводили на этих колониях PCR для отбора колоний с идентификацией колонии посредством одиночного кроссинговера. Подходящие комбинации праймеров использовали для идентификации одиночных кроссинговеров посредством вышележащего и нижележащего фрагмента (Таблица 2; комбинации праймеров 655-170 и 656-571 для интеграции pRM3; комбинации праймеров 754-170 и 991-571 для интеграции pJS43; комбинации праймеров 744-170 и 808-571 для интеграции pRM12, соответственно). Затем выделяли хромосомную ДНК положительных колоний, используя набор для очистки ДНК грамположительных микробов Masterpure Gram Positive DNA Purification Kit (Epicentre Biotechnologies) и для подтверждения результатов PCR для отбора колоний PCR, описанную выше, повторяли на выделенной хромосомной ДНК. Одиночный кроссинговер посредством вышележащей фланкирующей области и одиночный кроссинговер посредством нижележащей фланкирующей области отбирали для второй стадии рекомбинации.
Для получения двойного кроссинговера первичные интегранты субкультивировали несколько раз в TGP без хлорамфеникола. Подходящие разведения (10-4, 10-5, 10-6) высевали на чашки с TGP. Выделенные колонии переносили на чашку с TGP с 8 мкг/мл хлорамфеникола и чашку без него. Мутанты двойного кроссинговера являются чувствительными к хлорамфениколу. PCR-анализ с использованием подходящих комбинаций праймеров (Таблица 2; комбинации праймеров 655-656 для ΔsigF, 754-991 для ΔmgsA и 744-808 для ΔpflBA-ΔadhE) использовали для отделения дикого типа от делеционных мутантов и для подтверждения отсутствия плазмиды. Все модификации подтверждали секвенированием PCR продуктов.

Ферментирование
Среда ТММ была модифицирована от Fong et al. (Fong et al., 2006) и содержала на литр: 60 г/л глюкозы; 30 г/л ксилозы; 8,37 г MOPS (3-(N-морфолино)пропансульфоновая кислота), 0,23 г K2HPO4; 0,51 г NH4Cl; 0,50 г NaCl; 1,47 г Na2SO4; 0,08 г NaHCO3; 0,25 г KCl; 1,87 г MgCl2⋅6H2O; 0,41 г CaCl2⋅2H2O; 16,0 мг MnCl2⋅4H2O; 1,0 мг ZnSO4⋅7H2O; 2,0 мг H3BO3; 0,1 мг CuSO4⋅5H2O; 0,1 мг Na2MoO4⋅2H2O; 1,0 мг CoCl2⋅6H2O; 7,0 мг FeSO4⋅7H2O; 0,1 мг тиамина; 0,1 мг рибофлавина; 0,5 мг никотиновой кислоты; 0,1 мг пантотеновой кислоты; 0,5 мг пиридоксамина, HCl; 0,5 мг пиридоксаля, HCl; 0,1 мг D-биотина; 0,1 мг фолиевой кислоты; 0,1 мг пара-аминобензойной кислоты; 0,1 мг кобаламина. рН доводили до рН 7,2. Глюкозу, ксилозу, металлы и витамины стерилизовали фильтрованием. Среду автоклавировали. ТММ1, ТММ2.5, и ТММ5 были дополнены 1 г/л, 2,5 г/л, и 5 г/л дрожжевого экстракта (Oxoid), соответственно.
Среда STMM отличалась от среды ТММ концентрациями K2HPO4 (1,00 г/л), NH4Cl (2,50 г/л), NaCl (5,00 г/л), и CaCl2⋅2H2O (50 мг/л) и была дополнена D,L-метионином (68,5 мг/л) и бетаином (0,14 г/л).
100 мл предварительной культуры в ТММ5 или STMM5 использовали для инокулирования (10% об./об.) 400 мл ТММ1, или ТММ2.5, или STMM2.5, или STMM5, соответственно, в 0,75 л ферментаторе Multifors (Infors), оборудованном холодильником (охлажденном водой из-под крана до приблизительно 15°C). рН поддерживали при рН 7,2 путем добавления стерильного 2,5 М KOH, стерильного 75 г/л Мг(ОН)2 или стерильного 75 г/л Са(ОН)2. Температура составляла 60°C.Скорость мешалки составляла 300 об/мин.
Из ферментатора отбирали образцы для измерения (R)- и (S)-молочной кислоты и возможных побочных продуктов. Образцы центрифугировали и оставшийся дебрис удаляли посредством фильтрования, используя фильтр Millex® GP 0,22 мкм (Millipore). Фильтрат хранили при -21°C до дальнейшего анализа.
Сахара измеряли посредством ВЭЖХ, используя колонку Thermo CarboPac SA-10 (Dionex). Органические кислоты (молочную кислоту, уксусную кислоту, муравьиную кислоту, янтарную кислоту, фумаровую кислоту, пировиноградную кислоту) и этанол измеряли, используя дериватизацию и газо-жидкостную хроматографию (ГЖХ). (R)- и (S)-лактаты метилировали до метил-лактата и измеряли посредством анализа свободного пространства на хиральной колонке.
Пример 1
Продуцирование энантриомерно чистой молочной кислоты G. thermoglucosidans
Конструировали интеграционную плазмиду pRM3 для делеции гена sigF в G. thermoglucosidans. Вышележащую и нижележащую фланкирующие области гена sigF создавали посредством PCR, используя геномную ДНК из DSM 2542 в качестве матрицы и комбинации праймеров 653 и 654 (Таблица 2) для получения вышележащего фрагмента и праймеры 651 и 652 (Таблица 2) для получения нижележащего фрагмента. Сначала клонировали нижележащий фрагмент в виде фрагмента KpnI-SaII в pNW33n, обработанную теми же ферментами. Затем клонировали вышележащий фрагмент в виде фрагмента SaII-HindIII в эту конструкцию, обработанную теми же ферментами, имея результатом плазмиду pRM3. Конструирование pRM3 выполняли в Е. coli TG90. Целостность последовательности pRM3 подтверждали посредством секвенирования ДНК.
Плазмиду pRM3 электропорировали в G. thermoglucosidans DSM 2542. Выбирали одну колонию трансформанта и использовали для получения мутантов с одиночным кроссинговером, как описано в разделе «Материалы и методы». Для дальнейшей работы отбирали две колонии, одну с одиночным кроссинговером посредством вышележащей фланкирующей области и одну с одиночным кроссинговером посредством нижележащей фланкирующей области.
Мутант с двойным кроссинговером получали посредством процедуры, описанной в разделе «Материалы и методы». Шестьдесят колоний, полученных после субкультивирования интегрантов с одиночным кроссинговером в TGP без хлорамфеникола, переносили на TGP чашки с хлорамфениколом и без хлорамфеникола. Пятнадцать колоний были чувствительными к хлорамфениколу. Двенадцать колоний имели целевую модификацию и три вернулись к дикому типу. Выбрали одну колонию и обозначили ее как G. thermoglucosidans DSM 2542 ΔsigF. Делецию подтвердили секвенированием.
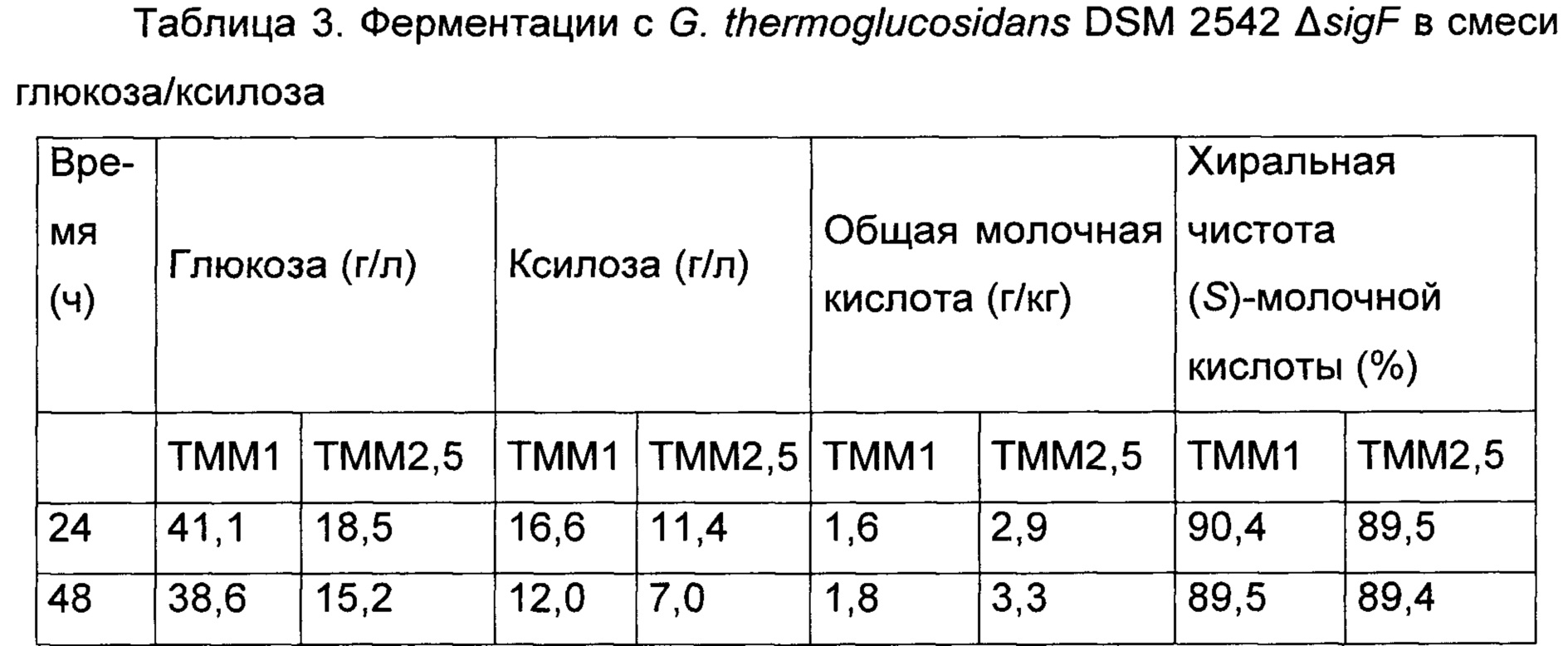
G. thermoglucosidans DSM 2542 ΔsigF оценивали в ходе ферментации с регулированием рН (KOH), используя ТММ1 и ТММ2.5. Ферментации анализировали. Результаты представлены в Таблице 3. G. thermoglucosidans DSM 2542 ΔsigF потреблял ксилозу и глюкозу одновременно. Хиральная чистота продуцированной (S)-молочной кислоты намного ниже технических требований для хирально чистой молочной кислоты.
Конструировали плазмиду pJS43 с делецией 267 п.о. гена mgsA (423 п.о.) в G. thermoglucosidans. Вышележащую и нижележащую фланкирующие области гена mgsA создавали посредством PCR, используя геномную ДНК DSM 2542 в качестве матрицы и комбинации праймеров 750 и 999 для получения нижележащего фрагмента mgsA и праймеры 1000 и 753 для получения вышележащего фрагмента mgsA. Полученные два PCR-продукта использовали потом в качестве матрицы в PCR с перекрыванием, используя комбинацию праймеров 750 и 753 для их слияния. Продукт клонировали в виде фрагмента BamHI-PstI в плазмиду pNW33n, обработанную BamHI и Pstl, имея результатом плазмиду pJS43. Конструирование pJS43 выполняли в Е. coli TG90. Целостность нуклеотидной последовательности pJS43 подтверждали секвенированием.
Плазмиду pJS43 электропорировали в G. thermoglucosidans DSM 2542 ΔsigF. Выбирали одну колонию трансформанта и использовали для получения мутантов с одиночным кроссинговером, как описано в разделе «Материалы и методы». Один интегрант с одиночным кроссинговером выбирали для дальнейшей работы.
Мутант с двойным кроссинговером получали посредством процедуры, описанной в разделе «Материалы и методы». Шестьдесят колоний, полученных после субкультивирования интегранта с одиночным кроссинговером в TGP без хлорамфеникола, переносили на TGP чашки с хлорамфениколом и без хлорамфеникола. Все колонии показывали чувствительность к хлорамфениколу. Двадцать пять колоний анализировали. Четыре колонии имели целевую модификацию, и двадцать одна вернулась к дикому типу. Отбирали одну колонию и обозначали ее как G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA. Делецию подтверждали секвенированием.
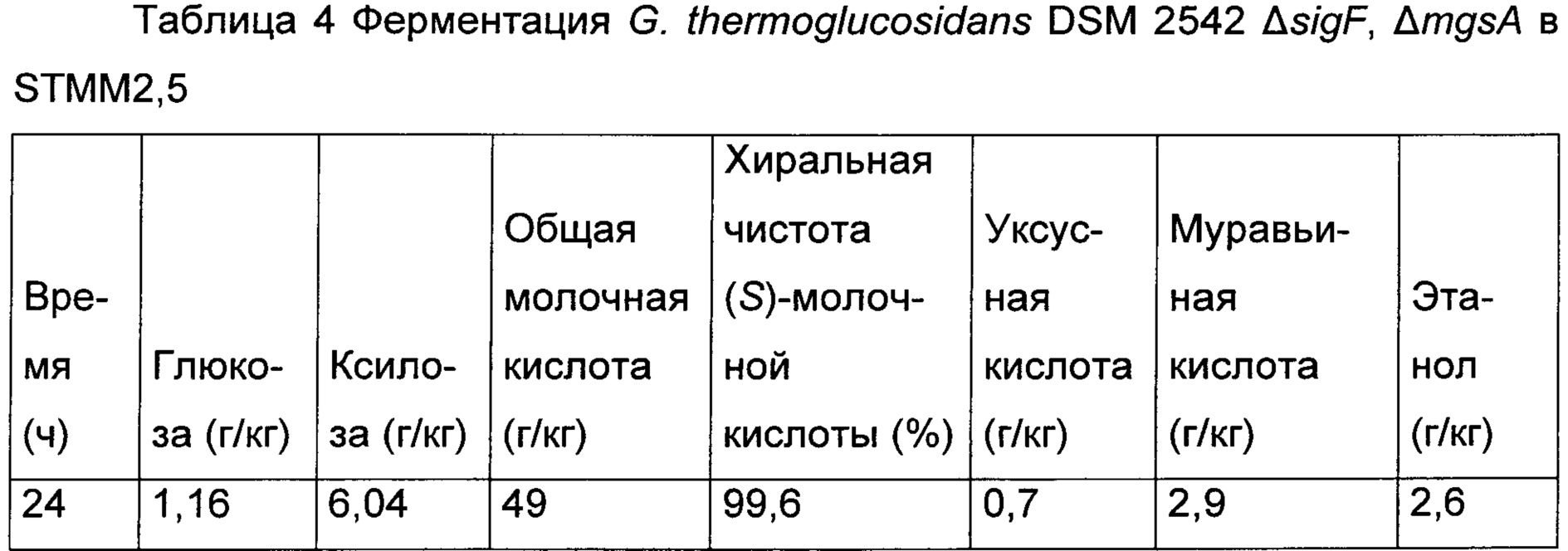
G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA оценивали в ферментации с регулируемым рН (Mg(ОН)2), используя STMM2,5. Ферментацию анализировали. Результаты представлены в Таблице 4. G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA потреблял ксилозу и глюкозу одновременно.
Хиральная чистота продуцированной (S)-молочной кислоты составляла 99,6%, что считается хирально чистой. Эти данные ясно показывают, что, несмотря на очевидную неполноту метилглиоксального пути у G. thermoglucosidans, нарушение mgsA имеет результатом способность продуцировать хирально чистую (S)-молочную кислоту.
Пример 2
Продуцирование энантриомерно чистой гомомолочной кислоты G. thermoglucosidans
G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA еще продуцировал значительные количества муравьиной кислоты и этанола, тогда как уксусная кислота представляла собой минорный побочный продукт (Таблица 4). Хотя известно, что мутации pfIA и/или pfIB и adhE влияют на продуцирование муравьиной кислоты и этанола во многих бактериях, побочные эффекты нарушения этих генов непредсказуемы.
Конструировали плазмиду pRM12 для делеции генов pfIB, pfIA и adhE (частично) в G. thermoglucosidans. Вышележащую фланкирующую область pflBA и нижележащую фланкирующую область конвергентно ориентированного adhE создавали посредством PCR, используя геномную ДНК из DSM 2542 в качестве матрицы и комбинации праймеров 739 и 805 для получения вышележащего фрагмента pflBA и праймеры 806 и 807 для получения вышележащего фрагмента adhE. Полученные два PCR-продукта затем использовали в качестве матрицы в PCR с перекрыванием, используя комбинацию праймеров 739 и 807 для их слияния. Продукт клонировали в виде фрагмента BamHI-PstI в плазмиду pNW33n, обработанную BamHI и PstI, имея результатом плазмиду pRM12. Конструирование pRM12 выполняли в Е. coli DH5a. Целостность нуклеотидной последовательности pRM12 подтверждали секвенированием.
Плазмиду pRM12 электропорировали в G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA. Выбирали одну колонию трансформанта и использовали для получения мутантов с одиночным кроссинговером, как описано в разделе «Материалы и методы». Выбирали две колонии для дальнейшей работы, одну с одиночным кроссинговером посредством вышележащей фланкирующей области pflBA и одну с одиночным кроссинговером посредством вышележащей фланкирующей области adhE.
Мутант с двойным кроссинговером получали посредством процедуры, описанной в разделе «Материалы и методы». Сто двенадцать колоний, полученных после субкультивирования интегрантов с одиночным кроссинговером в TGP без хлорамфеникола, переносили на TGP чашки с хлорамфениколом и без хлорамфеникола. Две колонии были чувствительными к хлорамфениколу. Одна имела целевую модификацию, а другая вернулась к дикому типу. Эту одну колонию обозначили как G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA, ΔpflBA-ΔadhE. Делецию подтверждали секвенированием.
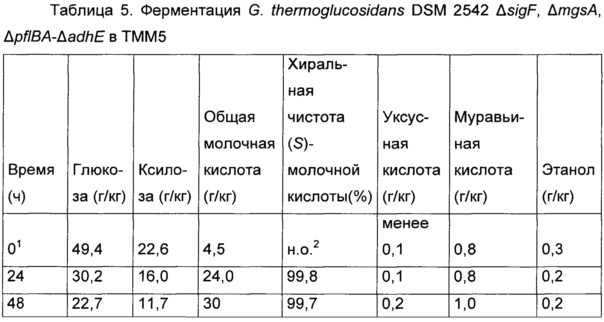
1Отбор образца после инокуляции
2н.о. = не определено: концентрация молочной кислоты слишком низкая для определения хиральной чистоты
G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA, ΔpflBA-ΔadhE оценивали по ферментациям с регулированием рН (Са(ОН)2), используя среду STMM, содержащую 5,0 г/л дрожжевого экстракта, 60 г/л глюкозы и 30 г/л ксилозы. Ферментацию анализировали в трех временных точках. Результаты представлены в Таблице 5. G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA, ΔpflBA-ΔadhE потреблял ксилозу и глюкозу одновременно. Хиральная чистота (S)-молочной кислоты, продуцированной G. thermoglucosidans DSM 2542 ΔsigF, ΔmgsA, ΔpflBA-ΔadhE, составляла 99,7% или выше. Продуцирование уксусной кислоты и муравьиной кислоты составляло 6,7 мг на грамм молочной кислоты. Продуцирование этанола не могли определить. Эти данные ясно демонстрируют, что нарушения генов комплекса пируват-формиат-лиазы и алкогольдегидрогеназы значительно снижало продуцирование этанола, муравьиной кислоты и уксусной кислоты, имея результатом гомомолочную ферментацию хирально чистой (S)-молочной кислоты.