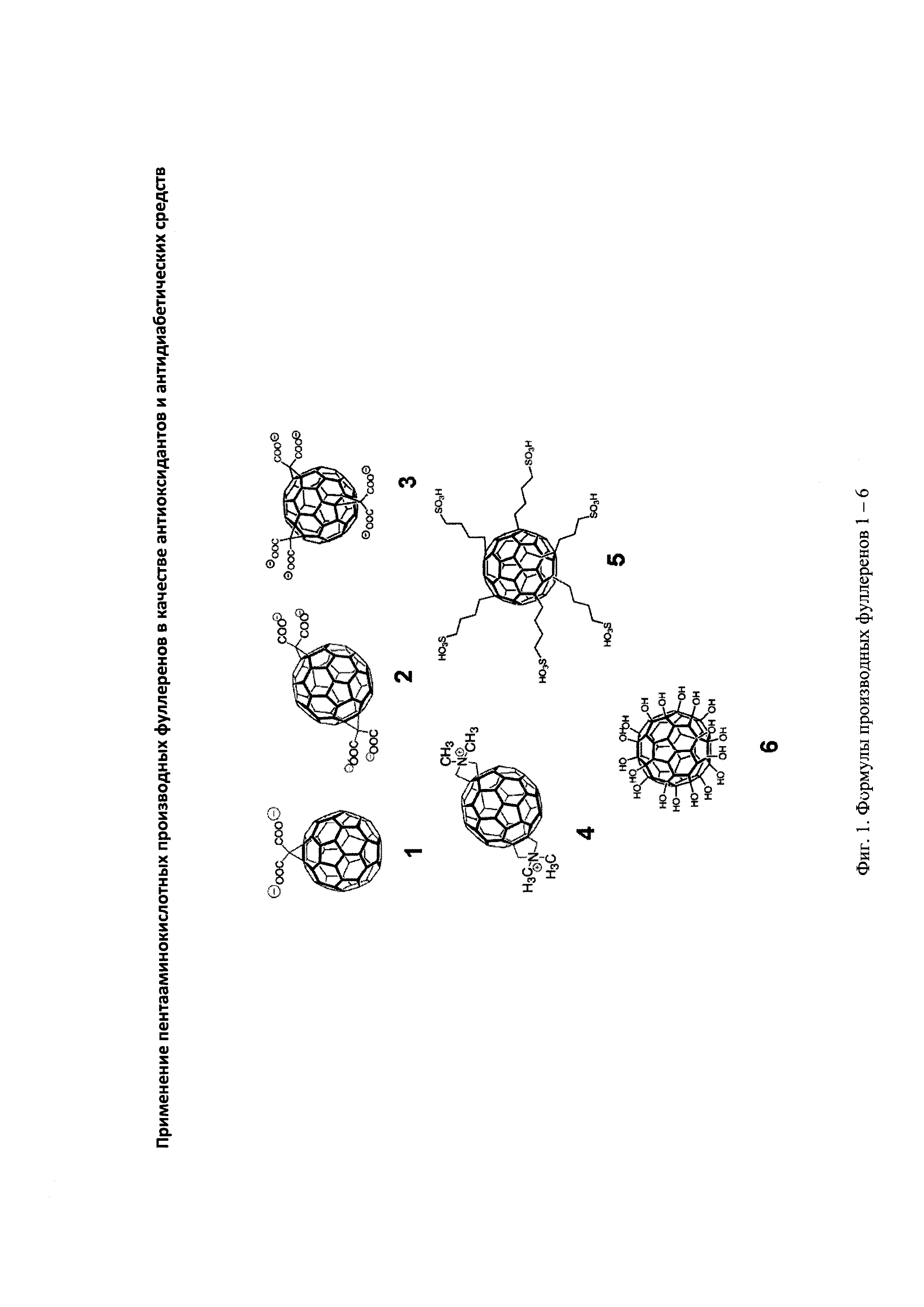
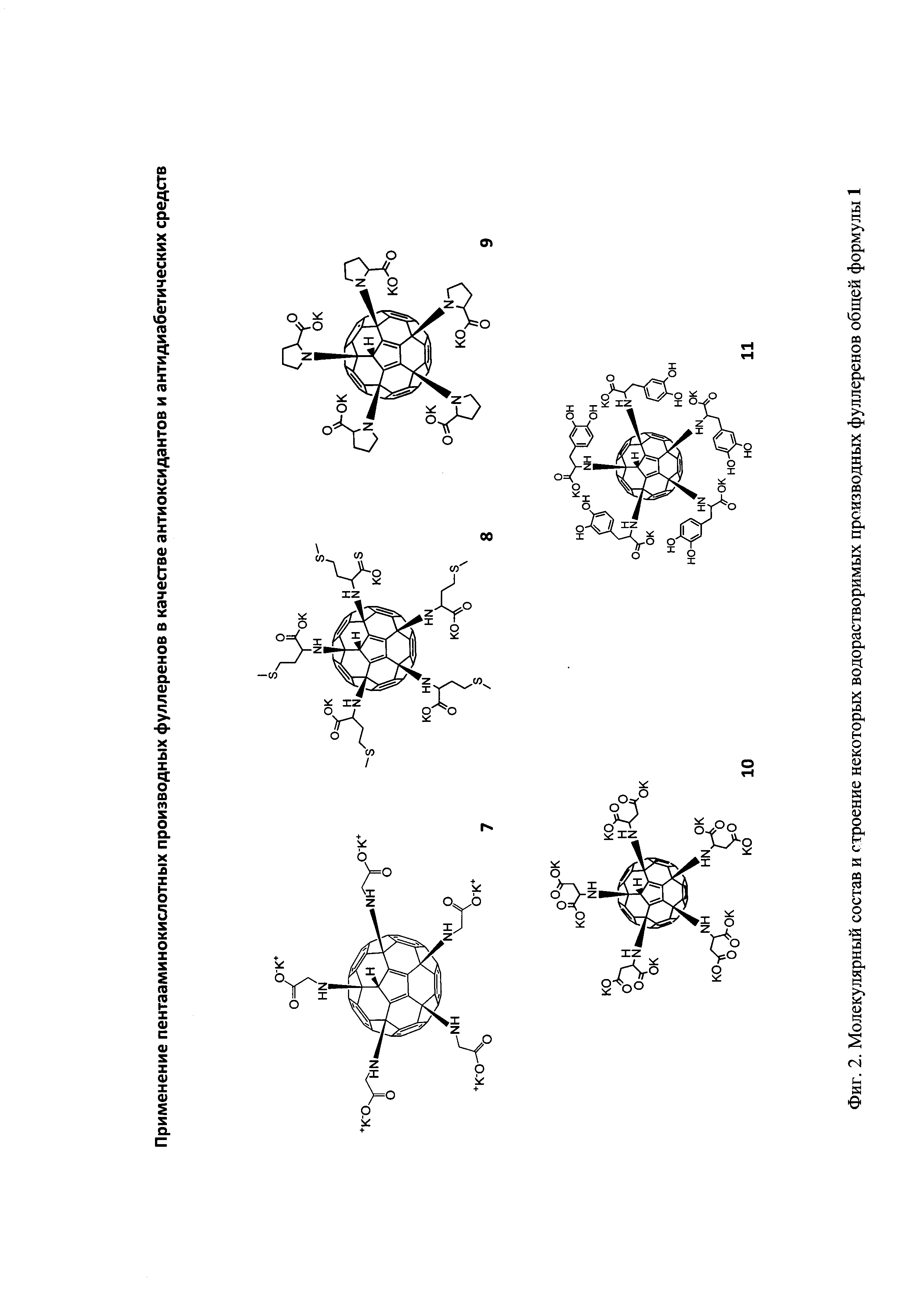
Результат интеллектуальной деятельности: Применение пентааминокислотных производных фуллеренов в качестве антиоксидантов и антидиабетических средств
Вид РИД
Изобретение
Изобретение относится к химической и фармацевтической отраслям промышленности и касается противодиабетических средств и композиций на основе аминокислотных производных фуллерена C60. Изобретение может найти применение в биомедицинских исследованиях и в производстве новых лекарственных препаратов, предназначенных для лечения диабета II типа.
Важнейшей социально-значимой задачей является разработка новых соединений и создание лекарственных препаратов на их основе, обладающих устойчивой и выраженной способностью предотвращать возникновение и/или подавлять развитие диабета II типа.
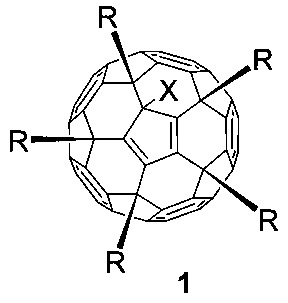
Эта задача решается в данном изобретении применением пентааминокислотных производных фуллерена C60 общей формулы 1 в качестве соединений, эффективно подавляющих развитие диабета II типа на экспериментальной модели патологии:
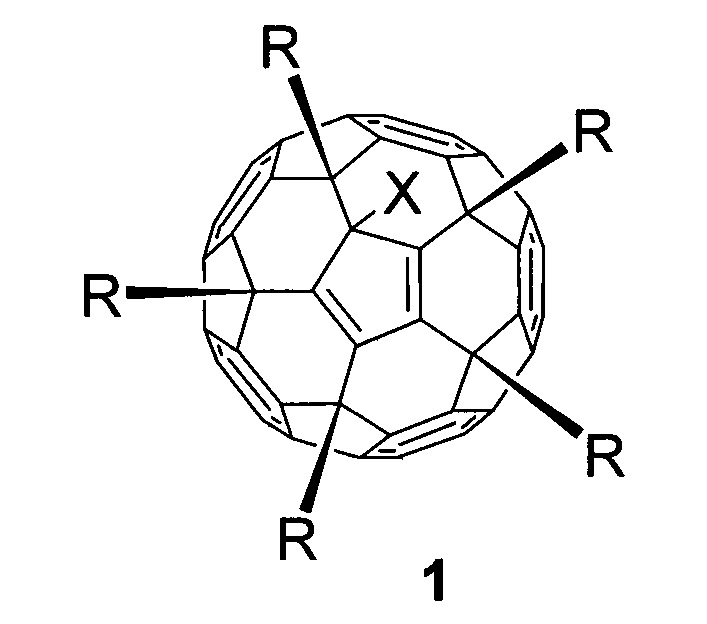
где в общей формуле 1 X означает:
- атом хлора (-Cl), присоединенный к углеродному каркасу, или
- атом водорода (-H);
где в общей формуле 1 заместитель R соответствует:
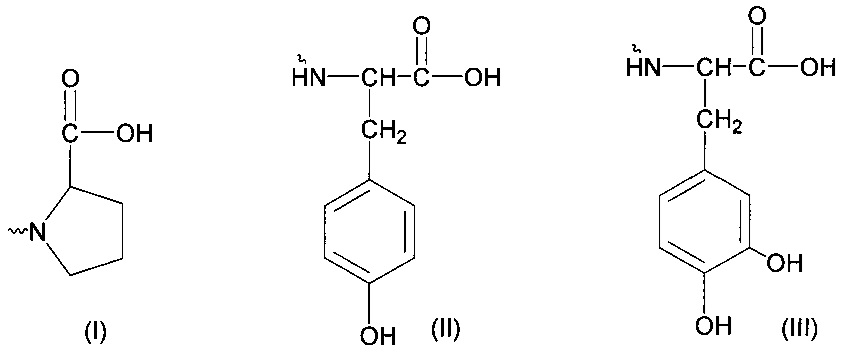
- остаткам основных природных аминокислот формулы -NHCH(R1)COOH, где заместитель R1 может представлять собой Н- (глицин), СН3- (аланин), -СН2ОН (серин), -СН2СООН (аспарагиновая кислота), -(CH2)3NHC(=NH)NH2 (аргинин), -СН(СН3)2 (валин), -СН(ОН)СН3 (треонин), -(СН2)2СООН (глутаминовая кислота), -СН2СН(СН3)2 (лейцин), -CH2SH (цистеин), -(CH2)4NH2 (лизин), -СН(С2Н5)СН3 (изолейцин), -CH2CONH2 (аспарагин), -(CH2)2CONH2 (глутамин), -(CH2)2SCH3 (метионин), -CH2Ph (фенилаланин).
- остаткам пролина (I), тирозина (II) и дигидрокситирозина (III):
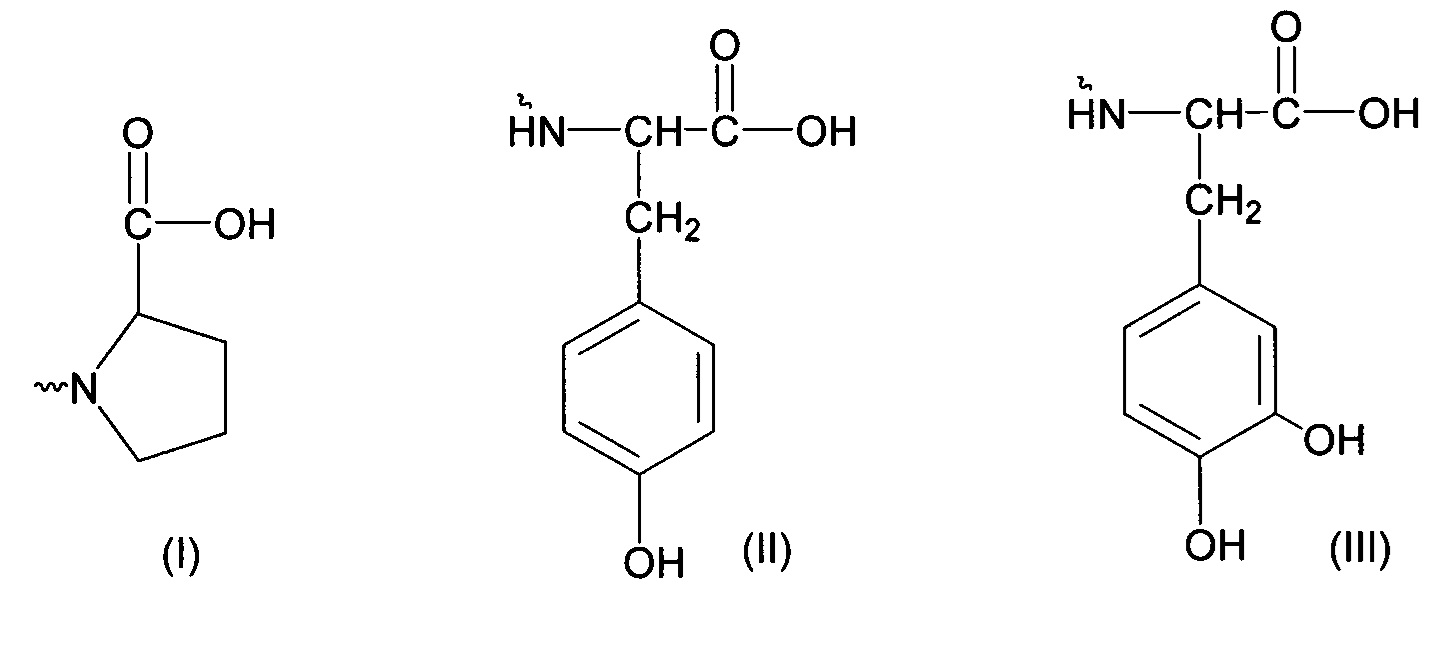
Структуры соединений общей формулы 1 и метод их получения были описаны нами ранее [1-2].
Производные фуллеренов общей формулы 1 отличаются высокой растворимостью в водных и физиологических средах, низкой токсичностью, простотой получения и низкой стоимостью. Кроме того, соединения общей формулы 1 являются амфифильными, так как имеют в своей структуре гидрофобные и гидрофильные фрагменты, что обеспечивает легкость их проникновения через клеточные мембраны. Это является важным преимуществом указанных производных по сравнению с большинством ранее описанных соединений, в которых каркас фуллерена в той или иной степени равномерно покрыт заряженными группами.
В настоящее время получены многочисленные данные относительно биологической активности фуллереновых производных, которые могут быть использованы при разработке новых классов эффективных лекарственных препаратов, в том числе и для лечения социально значимых заболеваний. Одним из важных свойств фуллереновых производных является их способность выступать в качестве средств доставки к органам-мишеням заболеваний [3-5]. Установлена и хорошо изучена антиоксидантная, антирадикальная и радиопротекторная активность фуллеренов [6-7]. Показано, что они обладают противоопухолевой [8-9] и противовирусной [10] активностью.
Однако, способность фуллереновых производных влиять на развитие диабета II типа никогда ранее не наблюдалась.
Согласно консенсусу по диабетической нейропатии (1994), выделено 4 патофизиологических механизма развития диабета 2 типа и его осложнений, которые определяют патогенетические принципы его лечения [11]. В частности, особое значение имеют:
- увеличение образования свободных радикалов, ослабление антиоксидантной защиты [12]. Экспериментально показано, что развитие диабета и его осложнений можно предупредить или замедлить с помощью антиоксидантной терапии [13]. Накопленные к настоящему времени данные позволяют рассматривать антиоксиданты как весьма перспективные соединения, способные оказывать протективное действие как на функцию β-клеток и секрецию инсулина, так и на механизмы развития ангионейроптий и других осложнений диабета. Поэтому выявление антиоксидантных свойств производных фуллеренов представляется важным в связи с оценкой их антидиабетической эффективности;
- наработка конечных стабильных продуктов гликозилирования (AGE), их аутоокисление и взаимодействие с клеточными рецепторами [14]. Редуцирующие сахара (глюкоза, глюкозо-6-фосфат, фруктоза), обладающие альдегидными группами, взаимодействуют со свободными аминогруппами, в том числе белков, образуя обратимые основания Шиффа. В результате модифицируются структура и функции белков, что вызывает устойчивые повреждения клетки. [15];
- активация сорбитолового (полиольного) метаболического пути. Альдозоредуктаза - первый фермент полиольного метаболического пути, катализирует восстановление глюкозы в сорбитол. Сорбитол метаболизируется до фруктозы с участием сорбитолдегидрогеназы, увеличивая соотношение NADH/NAD+. В этих условиях медленно метаболизируемый и медленно диффундирующий через клеточные мембраны сорбитол накапливается в клетке, приводя к нарушению клеточного гомеостаза и развитию многих осложнений сахарного диабета [16]. Сорбитолдегидрогеназа (СДГ) катализирует метаболизм сорбитола. Ингибирование СДГ снижает скорость накопления сорбитола в клетках и уменьшает риск повреждения клеток. В то же время, как было установлено в экспериментальных исследованиях, проведенных на собаках и крысах, ингибиторы альдозоредуктазы тормозят дегенерацию перицитов при ретинопатии, возникающей в ответ на богатую галактозой диету [17]. При этом отмечалась пропорциональная зависимость положительного терапевтического эффекта от дозы ингибиторов альдозоредуктазы. Значение активации сорбитолового пути как причины диабетических осложнений была продемонстрирована на трансгенных мышах со сверхэкспрессией гена альдозоредуктазы. Было установлено, что применение ингибиторов этого фермента предотвращало развитие нейропатии, нефропатии, ретинопатии и формирование катаракты у данных животных.
Для оценки потенциальной способности использования производных фуллеренов общей формулы 1 в качестве противодиабетических средств актуальным является исследование их способности ингибировать образование свободных радикалов и процессы окисления липидов (таблица 1), изучение их свойств как ингибиторов альдозоредуктазы и сорбитолдегидрогеназы, а также их антидиабетического действия на экспериментальных моделях патологии in-vivo.
При стимулированной диабетической гипергликемии у экспериментальных животных степень развития диабета 2-го типа можно контролировать по изменению веса тела животных и печени, с помощью гистологического и гистохимического исследования печени и поджелудочной железы, по общему гематологическому анализу (содержание в плазме крови общего белка, альбумина, креатинина, триглицеридов, холестерина, билирубина, щелочной фофсатазы, ACT и АЛТ).
Полученные результаты иллюстрируются приведенными далее примерами по антиоксидантной активности водорастворимых производных фуллеренов 1-5 общей формулы 1 (Фигура 1, таблица 1), их способности выступать в качестве ингибиторов сорбитолдегидрогеназы и альдозоредуктазы (таблица 2), а также эффективно подавлять развитие различных диагностических показателей, характерных для диабета II типа у экспериментальных животных (таблицы 3-8, фигуры 2-3).

Данные эксперимента приведены по пяти измерениям.
*р<0,05; **р<0,01; **р<0,01;
Концентрация производных фуллеренов во всех экспериментах составляла 10-5 М.
Контроль - образцы в отсутствие соединений
S - светосумма - параметр, отражающий содержание свободных радикалов в образце по данным хемилюминесцентного анализа (в процентах к контрольному образцу).
МДА - содержание малонового диальдегида - конечного продукта перекисного окисления липидов (в процентах к контрольному образцу).
Как видно из таблицы 1, соединения 1-5 проявляют эффективное антиоксидантное действие, снижая в концентрации 10-5 М, содержание активных радикалов в образце до 21% (соединение 5) и концентрацию малонового диальдегида - до 22% (5) (по сравнению с контролем)
Эти же соединения в концентрации 10-4 М заметным образом ингибируют активность ферментов-мишеней СД2: альдозоредуктазы и сорбитолдегидрогеназы (таблица 2)
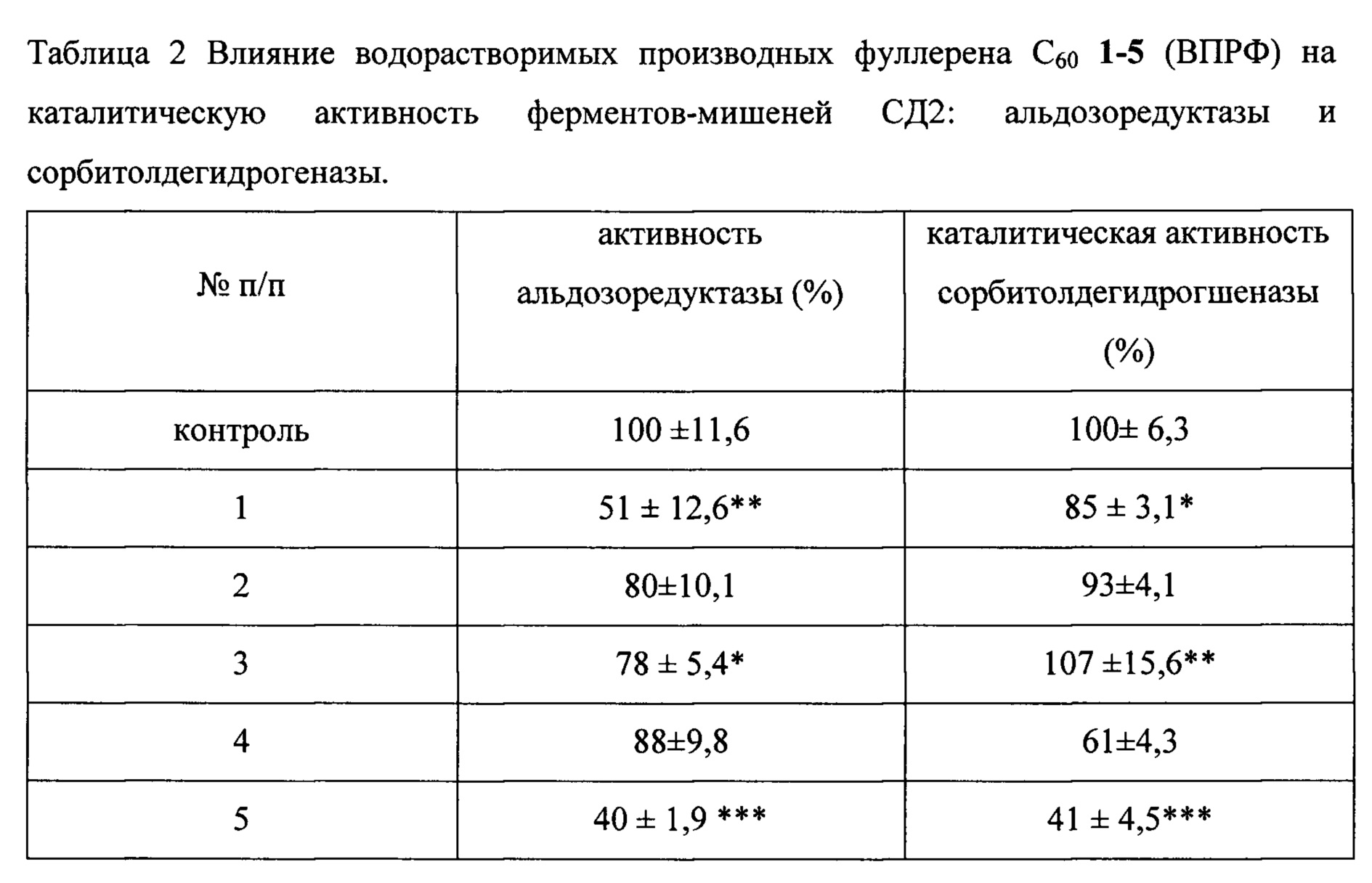
Данные эксперимента приведены по пяти измерениям.
*р<0,05; **р<0,01; **р<0,01;
Концентрация производных фуллеренов во всех экспериментах составляла 10-4 М.
Контроль - образцы, не содержащие производные фуллерена
Содержание белка в гомогенате печени составляло 14 мг/мл и в крови мышей 13 мг/мл
Каталитическая активность альдозоредуктазы и сорбитолдегидрогеназы в % по отношению к контролю
Как видно из таблиц 1 и 2, соединением-лидером по антидиабетическому действию на молекулярные мишени заболевания является соединение 5, снижающее уровень содержания свободных радикалов на 79%, концентрацию МДА - на 78% и активность альдозоредуктазы на 60%, а сорбитолдегидрогеназы - на 59%. Исходя из этих данных, было испытано влияние соединения 5 как соединения-лидера на морфофункциональное состояние организма млекопитающих при экспериментальном диабете II типа. Исследование проведено на белых крысах - самцах линии Вистар, в возрасте 6 мес, весом 250-300 г. Животные содержались в стандартных условиях вивария при двенадцатичасовом световом режиме, температуре воздуха (22,0±2,0)°C и свободном доступе к воде и корму.
В соответствии с задачами исследования было сформировано три группы животных:
1. Интактные животные (n=20);
2. Группа животных с модельным сахарным диабетом II типа (n=20);
3. Экспериментальная группа (n=20).
Животные первой группы служили интактным контролем. У крыс второй группы, послужившей контролем, диабет второго типа инициировался путем внутримышечного введения протамина сульфата в дозе 15 мг/кг дважды в день в течение 2 недель по методу [18]. У животных третьей группы так же был смоделирован диабет, но после возникновения устойчивой гипергликемии внутрибрюшинно вводился водный раствор производного фуллерена 5 в дозировке 3 мг/кг. Через 14 суток после введения производного фуллерена 5 животные всех групп подвергались эвтаназии.
Осуществлялся контроль веса тела животных, проводилось гистологическое и гистохимическое исследование печени и поджелудочной железы, а также общий гематологический анализ, в плазме крови определялись общий белок, альбумин, креатинин, триглицериды, холестерин, билирубин, щелочная фофсатаза, ACT и АЛТ.
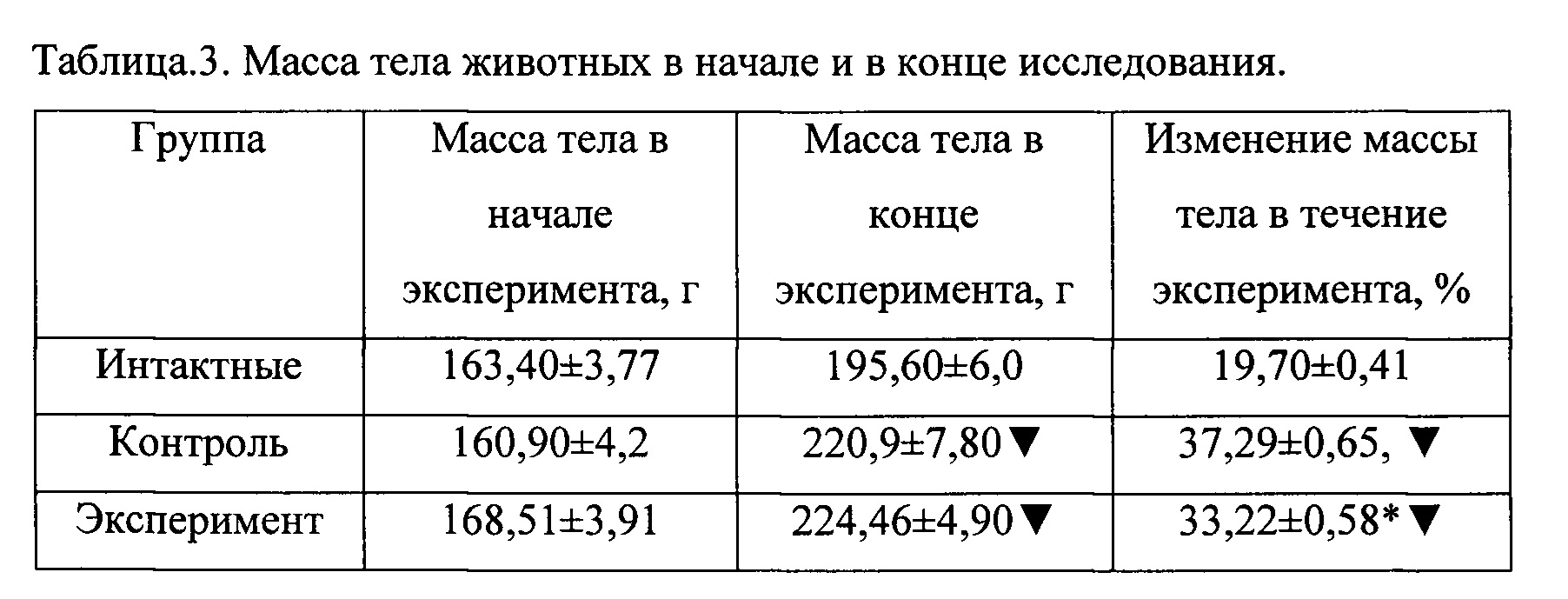
При анализе массы тела установлено, что к концу эксперимента масса тела животных всех групп повышается. При этом масса тела как контрольной так и экспериментальной групп животных относительно показателей интактных животных увеличилась достоверно (таблица 3).
Здесь и далее: * - Р≤0,05 - достоверность отличий между показателями животных экспериментальной и контрольной группы;  - Р≤0,05 достоверность отличий от показателей интактных животных.
- Р≤0,05 достоверность отличий от показателей интактных животных.
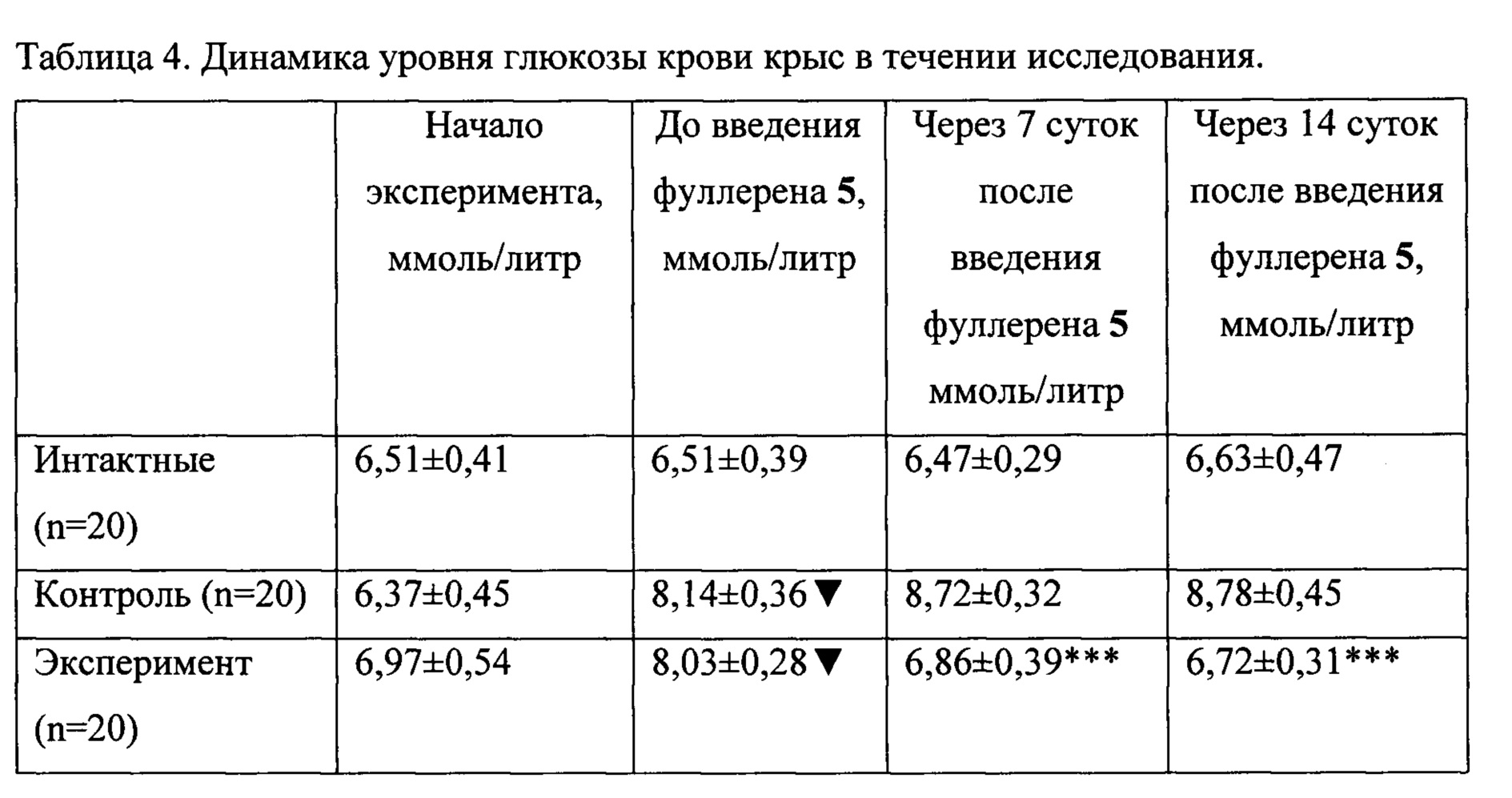
В ходе исследования устойчивая гипергликемия была сформирована у крыс контрольной и экспериментальной группы к третьей неделе эксперимента. Через 7 суток после введения производного фуллерена 5 происходит снижение уровня глюкозы в плазме крови у крыс экспериментальной группы практически до уровня интактных животных. На 14 сутки после применения фуллерена такая картина сохранилась (таблица 4).
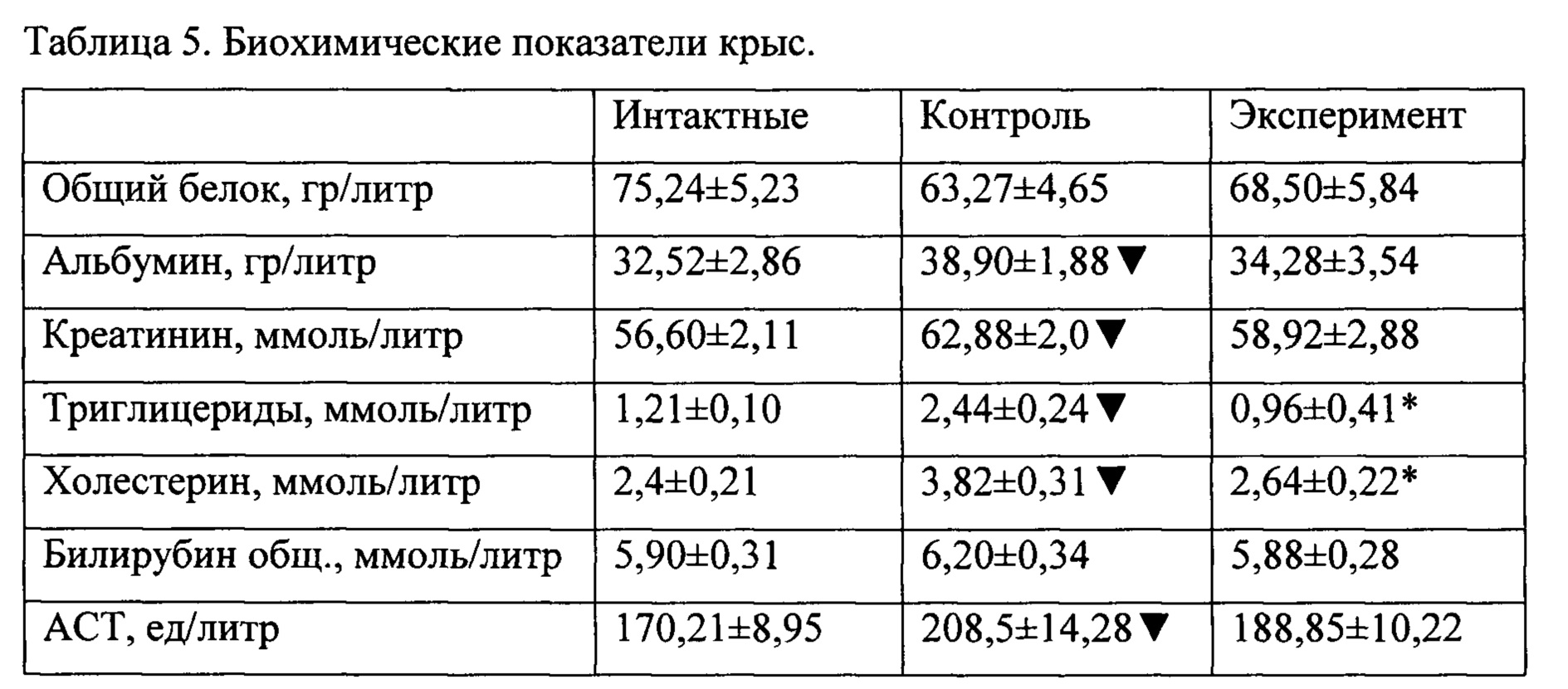
При анализе результатов биохимических исследований установлено, что для контрольной группы характерными являются типичные для диабета II типа изменения - повышение уровня альбумина, креатинина, триглицеридов, холестерина, АЛТ и ACT. В то же время исследованные показатели экспериментальной группы не отличались от показателей интактных животных (таблица 5).
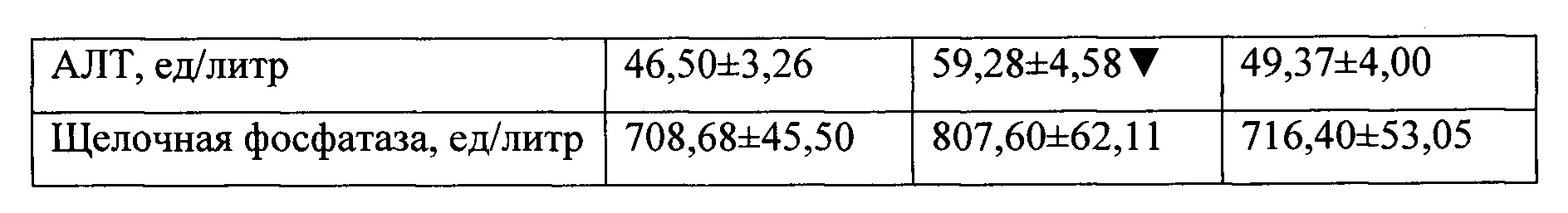
При гематологическом исследовании установлено, что при экспериментальном диабете происходит существенное снижение гематокрита, количества эритроцитов и гемоглобина относительно показателей интактных животных. В крови животных экспериментальной группы количество эритроцитов не отличается от показателей интактных крыс, но уровень гемоглобина и гематокрит ниже, хотя и в границах возрастной нормы. При этом все исследованные гематологические параметры выше, чем в контроле (Таблица 6).

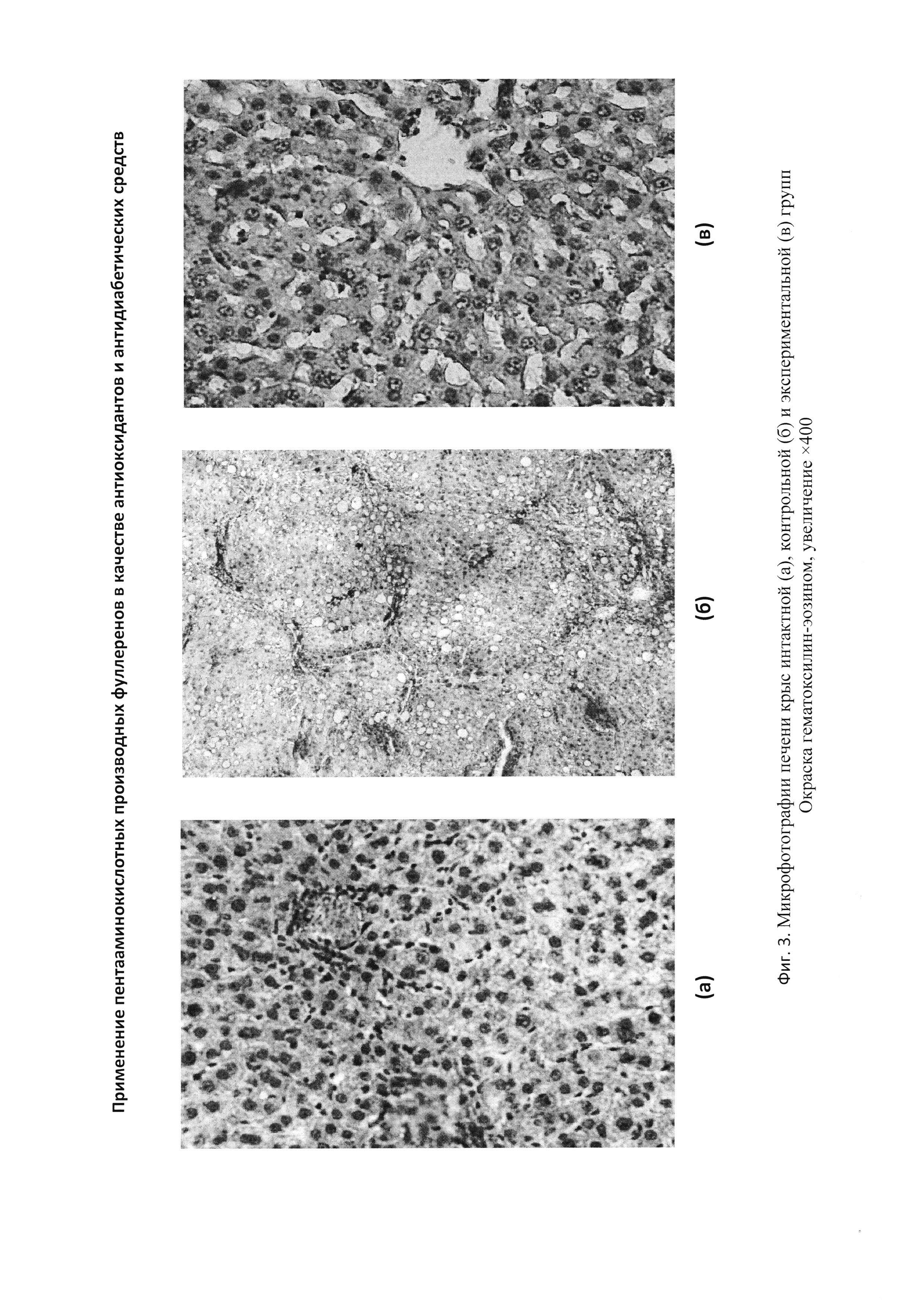
При анализе морфологического состояния печени крыс контрольной группы, в отличие от интактных крыс (Фигура 2-а) отмечаются нарушение балочного строения долек печени, белковой и жировой дистрофии гепатоцитов, их некроза, а также лимфоцитарных инфильтратов (Фигура 2-б). В дегенерирующих гепатоцитах отмечается кариопикноз. Границы ядер и самих гепатоцитов выражены нечетко.
В печени крыс экспериментальной группы балочное строение печени сохраняется, цитоплазма гепатоцитов оксифильна умеренно, вакуолизирована незначительно. Границы ядер и клеток четко различимы. На незначительной части микропрепаратов отмечается умеренное скопление лимфоидных клеток у крупных сосудов (Фигура 2-в).
В результате гистохимических исследований установлено, что в печени крыс с экспериментальным диабетом происходит истощение запасов гликогена, в то время как в печени крыс экспериментальной группы количество гликогена в гепатоцитах не отличалось от содержания этого вещества в клетках печени интактных животных (таблица 7).
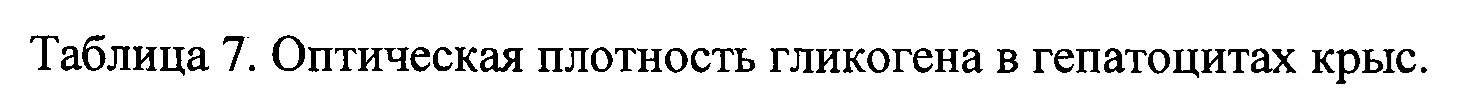
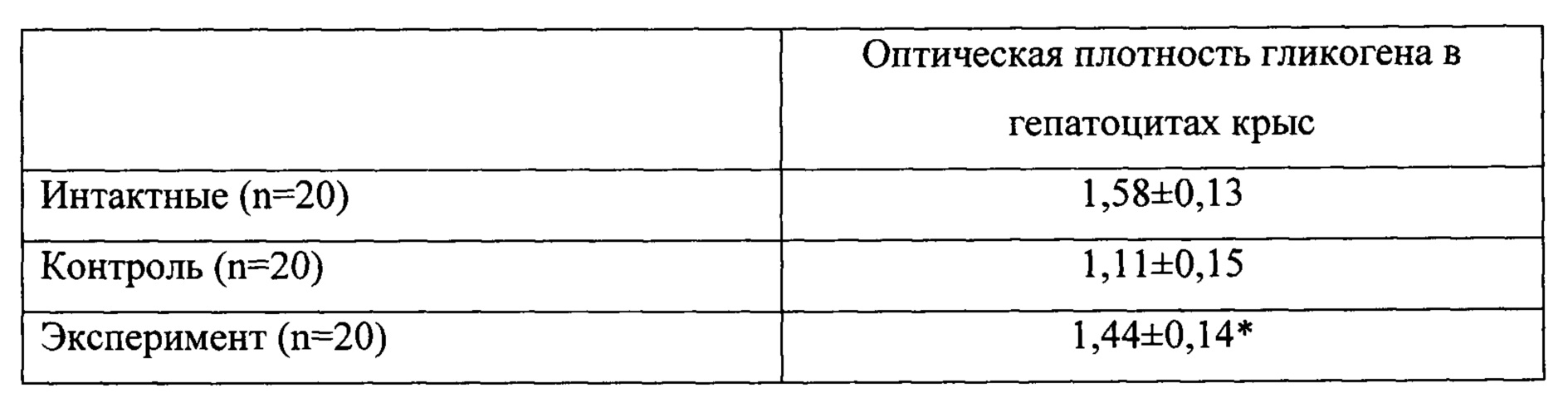
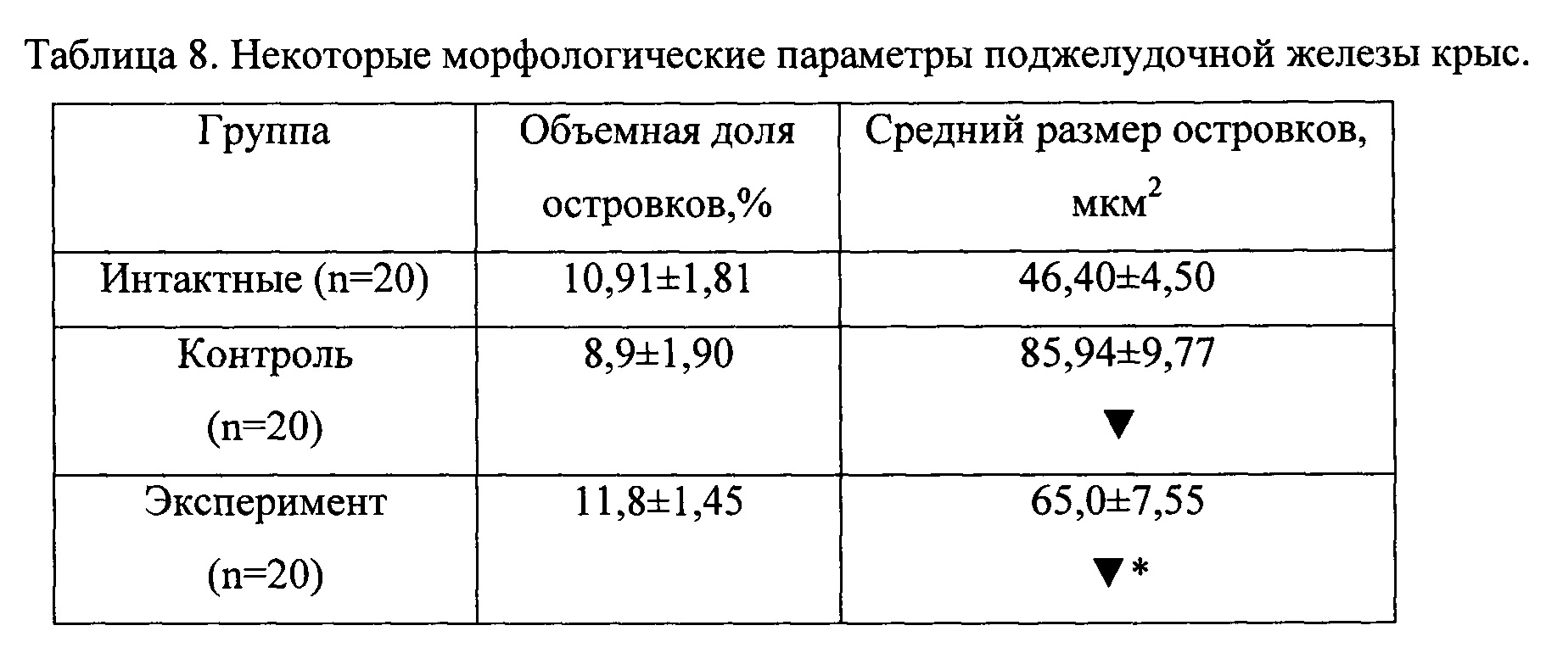
Обнаружено, что в поджелудочной железе животных как контрольной, так и экспериментальной группы происходит увеличение среднего размера островков, при этом показатели экспериментальных животных значительно ниже таковых в контроле (таблица 8). Увеличение размеров островков свидетельствует о развитии структурной адаптации железы к возрастающей нагрузке.
Гистологическое строение поджелудочной железы интактных животных соответствовало норме.
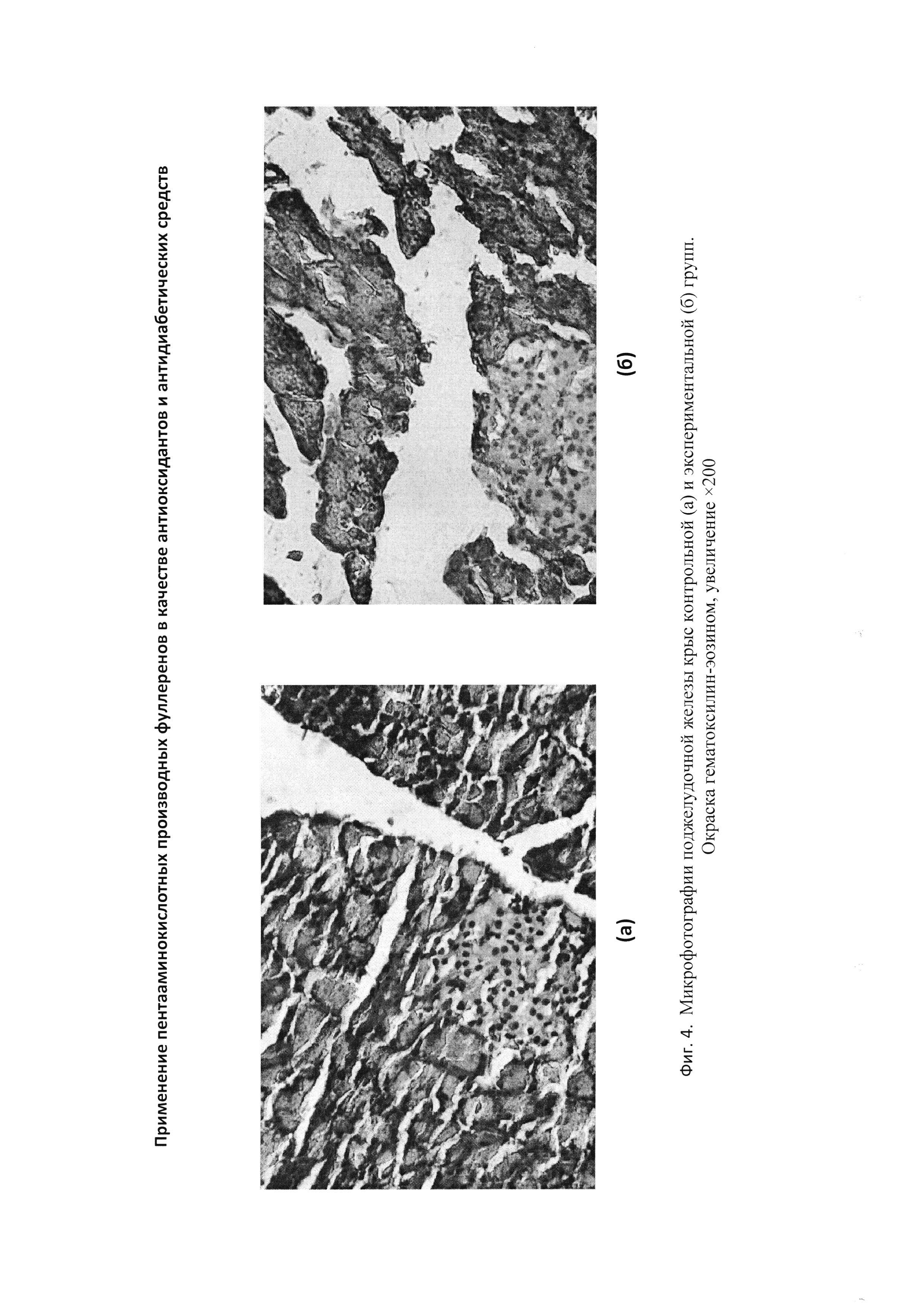
При патоморфологическом анализе поджелудочной железы крыс контрольной группы установлено, что цитоархитектоника железы достаточно существенно нарушена (фигура 3-а). В островках Лангерганса лентовидной или округлой формы обнаруживаются существенные структурные изменения, свидетельствующие об усилении катаболических процессов. Была отмечена дискомплексация клеток островков, отмечается кариопикноз, кариорексис, вакуолизация и распад клеток. Кроме того, отмечаются очаги микронекрозов.
Морфологическая картина поджелудочной железы крыс экспериментальной группы в целом соответствует норме. Большинство островков Лангерганса округлой формы, очагов микронекроза не наблюдается, структура ядер и клеток не изменяется (фигура 3-б).
Таким образом, на примере производного фуллерена 5 показано, что применение соединения общей формулой 1 при экспериментальном диабете II типа приводит к нормализации комплекса морфологических и функциональных показателей (уровень глюкозы крови, ряд важнейших биохимических параметров, строение печени и поджелудочной железы), что свидетельствует о его выраженном антидиабетическом действии при смоделированной патологии.
Приведенные данные однозначно свидетельствуют о том, что производные фуллеренов общей формулы 1 могут эффективно подавлять развитие диабета II типа у экспериментальных животных.
Заявляемое изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Исследование антиоксидантной активности производных фуллеренов по регистрации уровня свободных радикалов методом хемилюминесценции.
Антирадикальную активность производных фуллеренов 1-5 определяли в гомогенате головного мозга мышей методом хемилюминесценции (ХЛ) по изменению люминесценции люминола (5-амино-2,3-дигидро-1,4-фталазиндиона), опосредованной взаимодействием хромофора со свободными радикалами, образование которых инициируется третбутилгидропероксидом (ТБГП) [19]. Люминол в присутствии активных форм кислорода окисляется и генерирует электронно-возбужденные карбонильные хромофоры с высоким квантовым выходом [20]. Содержание свободных радикалов в гомогенате головного мозга мышей оценивали по изменению светосуммы: площади под кинетической кривой изменения интенсивности свечения люминола при взаимодействии его с активными формами кислорода.
Площадь определяли как значение интеграла под кинетической кривой зависимости интенсивности люминесценции люминола от времени (S):

где S - площадь под кривой ХЛ, Ai - текущее значение интенсивности ХЛ в момент времени t.
Эта площадь пропорциональна концентрации свободных радикалов, взаимодействовавших с люминолом за все время свечения. При добавлении в данную модельную систему веществ, обладающих антирадикальной активностью, количество свободных радикалов уменьшается, соответственно снижается интенсивность люминесценции люминола, что приводит к уменьшению светосуммы [21]. Опытная проба содержала 5⋅10-5 М люминола и гомогенат головного мозга мышей с концентрацией белка 1 мг/мл, 10-5 М водорастворимых производных фуллерена C60 (ВРПФ), 0.073 М ТБГП. Объем пробы доводили до 2 мл буфером трис-HCl (pH=7.4, 0.1M). Контрольная проба не содержала водорастворимых производных фуллеренов (ВРПФ). Кинетику изменения ХЛ регистрировали на хемилюминометре в течение 15 мин. Измерения проводили при постоянном термостатировании (38°C) и барботировании пробы воздухом. Концентрацию белка определяли по методу Лоури [22].
Пример 2. Исследование антиоксидантной активности водорастворимых производных фуллеренов по их влиянию на интенсивность перекисного окисления липидов по накоплению малонового диальдегида
Антиоксидантные свойства производных фуллеренов 1-5 оценивались по изменению содержания малонового диальдегида (МДА) - конечного продукта окисления полиненасыщенных жирных кислот [23] при длине волны 532 нм в гомогенате головного мозга мышей в присутствие изучаемых соединений по следующей методике:
гомогенат головного мозга мышей готовили в K-Na-фосфатном буферном растворе (0,1 М; pH=7,2) в соотношении 1:7 (1 г мозга мышей ÷ мл K-Na-фосфатного буфера), который разливали в центрифужные пробирки в объеме 1 мл. В качестве контроля использовали гомогенат головного мозга мышей в K-Na-фосфатном буфере без добавления исследуемых соединений. В опытные образцы, содержащие гомогенат головного мозга мышей, добавляли растворы ВРПФ и доводили объем пробы K-Na-фосфатным буфером до 2 мл. Пробы помещали в термостат при 37°C для инкубирования образцов. Реакцию перекисного окисления липидов останавливали добавлением 17% раствора ТХУ через 60 минут. Далее пробы центрифугировали 10 мин при 4000 об/мин на центрифуге К-23. К 2 мл супернатанта добавляли 1 мл 0,8%-ного раствора тиобарбитуровой кислоты. Образцы термостатировали в течение 30 мин при 100°C, после чего пробы охлаждали до комнатной температуры и регистрировали оптическую плотность при длине волны 532 нм. Содержание малонового диальдегида рассчитывали по формуле
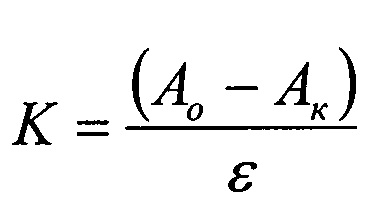
где К - концентрация МДА; Ao - оптическая плотность опытного образца; Ак - оптическая плотность контрольного раствора; ε - молярный коэффициент экстинкции, равный 1.56×105 М-1 см-1 (таблица 1).
Пример 3. Влияние водорастворимых пентааминокислотных производных фуллерена C60 на каталитическую активность альдозоредуктазы в гомогенате печени мышей
Активность альдозоредуктазы определяли по методике, описанной в работе [24].
Согласно методике каталитическую активность альдозоредуктазы в присутствии водорастворимых производных фуллерена (1-5) анализировали спектрофотометрически путем измерения уменьшения поглощения НАДФН при 340 нм.
Печень мышей гомогенизировали в натрий фосфатном буфере (pH 6,2) с использованием гомогенизатора в соотношении 1:10 (1 г печени на 10 мл буфера).
Гомогенат центрифугировали при 9000 об/мин в течение 30 минут на центрифуге Ohaus FC5515R с охлаждением при 4°C. Затем отбирали супернатант, содержащий фермент альдозоредуктазу. В кювету добавляли 0,3 мл супернатанта печени, 0,2 мл DL-глицеральдегида (Сисх=5*10-3М) и 0,2 мл исследуемого вещества. Контрольная проба не содержала исследуемых соединений. Объем реакционной смеси доводили до 1 мл натрий-фосфатным буфером (pH 6,2). Реакцию инициировали добавлением 0,2 мл НАДФН (Сисх=5*10-4М). Активность альдозоредуктазы анализировали спектрофотометрически путем измерения уменьшения поглощения НАДФН при 340 нм. Разницу в оптической плотности регистрировали в течение 5 минут.
Концентрацию белка в супернатанте печени мышей определяли по методу Лоури.
Активность фермента рассчитывали по формуле
A=(D1-D2)/(T×6,22×[мг белка])
D1 - оптическая плотность образца в начале эксперимента
D2 - оптическая плотность образца через время Т
Т - время эксперимента, мин
6,22 - коэффициент миллимолярной экстинкции НАДН при 340 нм
[мг белка] - содержание белка в пробе
Активность альдозоредуктазы в отсутствии ингибитора считали за 100% (таблица 2).
Пример 4. Влияние водорастворимых пентааминокислотных производных фуллерена на каталитическую активность сорбитолдегидрогеназы в сыворотке крови мышей.
Определение активности сорбитолдегидрогеназы в присутствии ВПРФ проводили по методу Севела-Товарека [25].
Суть метода заключается в превращении D-сорбитола под действием фермента сыворотки - сорбитолдегидрогеназы - в присутствии НАД во фруктозу (схема 1)
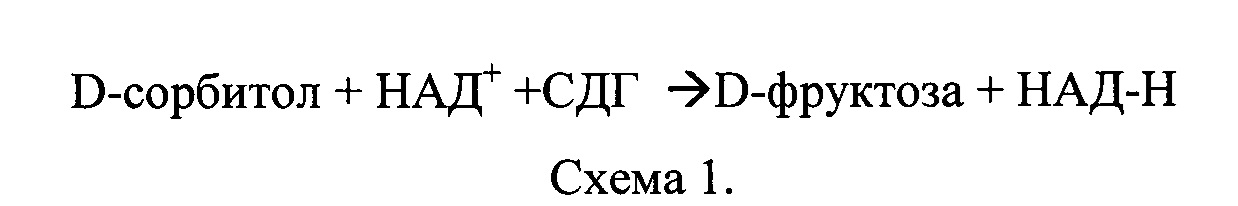
При взаимодействии фруктозы с резорцином образуется розово-красное окрашивание, интенсивность которого пропорциональна содержанию фруктозы. Забор крови производили от предварительно наркотизированной эфиром мыши посредством ее декапитации. Полученные образцы выдерживали 25-30 мин в термостате при 37°C. Образовавшийся сгусток отделяли от стенок стеклянной палочкой. После этого кровь в этой же пробирке центрифугировали 10-15 мин при 2500-3000 об/мин на центрифуге К-23. Полученную сыворотку переносили в чистую пробирку. Сыворотку разбавляли в 5 раз 0,05 М трис-буфером. В центрифужные пробирки вносили 0,1 мл 0,5 М раствора D-сорбитола и 0,2 мл сыворотки крови, добавляли в пробы исследуемое ВПРФ и 0,05 М трис-буфер. Прогревали пробы 5 мин при 37°C, затем добавляли 0,2 мл 0,006 моль/л раствора НАД, предварительно прогретого при 37°C. В контрольные пробы вносили 0,4 мл 10% ТХУ для остановки реакции. Пробы инкубировали в термостате 30 мин при 37°C. Инкубацию прерывали добавлением 0,4 мл 10% раствора трихлоруксусной кислоты. Центрифугировали 15 минут при 2000 g на центрифуге СМ-50 (Latvia, Riga). В чистые пробирки вносили по 0,5 мл супернатанта, 0,5 мл раствора 0,1% резорцина, 1,5 мл 30%-ного раствора HCl, перемешивали и помещали на водяную баню при 80°C на 8 мин, затем охлаждали. Оптическую плотность образцов определяли на спектрофотометре «Specord М-40» при λ=500 нм. Расчет активности фермента производили по калибровочному графику, определяя содержание фруктозы в пробе по оптической плотности (таблица 2).
Пример 5.
Исследование влияния производного фуллерена 5 на морфофункциональное состояние организма млекопитающих при экспериментальном диабете II типа.
Исследование проведено на белых крысах самцах линии Вистар, в возрасте 6 мес, весом 250-300 г. Животные содержались в стандартных условиях вивария при двенадцатичасовом световом режиме, температуре воздуха (22,0±2,0)°C и свободном доступе к воде и корму.
В соответствии с задачами исследования было сформировано три группы животных:
1) интактные животные (n=20);
2) группа животных с модельным сахарным диабетом II типа (n=20);
3) экспериментальная группа (n=20).
Животные первой группы служили интактным контролем. У крыс второй группы, послужившей контролем, диабет второго типа моделировался путем внутримышечного введения протамина сульфата в дозе 15 мг/кг дважды в день в течение 2 недель по методу [18]. У животных третьей группы так же был смоделирован диабет, но после возникновения устойчивой гипергликемии внутрибрюшинно вводился водный раствор ВПРФ общей формулы 1 в дозировке 3 мг/кг. Через 14 суток после введения фуллеренового производного животные всех групп подвергались эвтаназии.
Осуществлялось взвешивание тела животных и печени, для гистологического и гистохимического исследования отбиралась печень и поджелудочная железа, проводился общий гематологический анализ, в плазме крови определялись общий белок, альбумин, креатинин, триглицериды, холестерин, билирубин, щелочная фофсатаза, ACT и АЛТ.
Гликоген в печени определялся гистохимически методом ШИК по Мак-Манусу. Количественная оценка результатов гистохимической реакции производилась путем определения оптической плотности продукта реакции [26]. Морфологические и морфометрические исследования проводились при помощи комплекса визуализации на базе микроскопа Nicon Eclipse 80i и программ обработки изображений, также «Морфовидеотест 4.0» и «Image Scope Video 1.0». Измерения проводили в микрометрах после предварительной геометрической калибровки по оцифрованной с тем же увеличением шкале объект-микрометра.
При анализе массы тела установлено, что к концу эксперимента масса тела животных всех групп повышается. При этом масса тела животных как контрольной, так и экспериментальной группы относительно показателей интактных животных увеличилась достоверно (таблица 3).
В ходе исследования устойчивая гипергликемия была сформирована у крыс контрольной и экспериментальной группы к третьей неделе эксперимента. Через 7 суток после введения ВПРФ 5 происходит снижение уровня глюкозы плазмы крови крыс экспериментальной группы практически до уровня интактных животных. На 14 сутки после применения производного фуллерена 5 такая картина сохранилась (таблица 4).
При анализе результатов биохимических исследований установлено, что для контрольной группы характерными являются типичные для диабета II типа изменения - повышение уровня альбумина, креатинина, триглицеридов, холестерина, АЛТ и ACT. В то же время исследованные показатели экспериментальной группы на отличались от показателей интактных животных (таблица 5).
При гематологическом исследовании установлено, что при экспериментальном диабете происходит существенное снижение гематокрита, количества эритроцитов и гемоглобина относительно показателей интактных животных. В крови животных экспериментальной группы количество эритроцитов не отличается от показателей интактных крыс, но уровень гемоглобина и гематокрит ниже, хотя и в границах возрастной нормы. При этом все исследованные гематологические параметры выше, чем в контроле (Таблица 6).
Морфологическая картина печени интактных животных соответствует норме (Фигура 2-а)
При анализе морфологического состояния печени крыс контрольной группы отмечаются нарушение балочного строения долек печени, белковой и жировой дистрофии гепатоцитов, их некроза, а также лимфоцитарных инфильтратов. В дегенерирующих гепатоцитах отмечается кариопикноз. В части клеток ядро отсутствует (Фигура 2-б). Границы ядер и самих гепатоцитов выражены нечетко.
В печени крыс экспериментальной группы балочное строение печени сохраняется, цитоплазма гепатоцитов оксифильна умеренно, вакуолизирована незначительно. Границы ядер и клеток четко различимы. На незначительной части микропрепаратов отмечается умеренное скопление лимфоидных клеток у крупных сосудов (Фигура 2-в).
В результате гистохимических исследований установлено, что в печени крыс с экспериментальным диабетом происходит истощение запасов гликогена, в то время как в печени крыс экспериментальной группы количество гликогена в гепатоцитах не отличалось от содержания этого вещества в клетках печени интактных животных (таблица 7).
Обнаружено, что в поджелудочной железе животных как контрольной, так и экспериментальной группы происходит увеличение среднего размера островков, при этом показатели экспериментальных животных значительно ниже таковых в контроле (таблица 8).
Увеличение размеров островков свидетельствует о развитии структурной адаптации железы к возрастающей нагрузке.
Гистологические строение поджелудочной железы интактных животных соответствовало норме.
При патоморфологическом анализе поджелудочной железы крыс контрольной группы установлено, что цитоархитектоника железы достаточно существенно нарушена. В островках Лангерганса лентовидной или округлой формы обнаруживаются существенные структурные изменения, свидетельствующие об усилении катаболических процессов (Фигура 3-а).
Морфологическая картина поджелудочной железы крыс экспериментальной группы в целом соответствует норме. Большинство островков Лангерганса округлой формы, очагов микронекроза не наблюдается, структура ядер и клеток не изменяется (Фигура 3-б).
Таким образом, применение производного фуллерена общей формулой 1 при экспериментальном диабете II типа приводит к нормализации комплекса морфологических и функциональных показателей (уровень глюкозы крови, ряд важнейших биохимических параметров, строение печени и поджелудочной железы), что свидетельствует о его выраженном антидиабетическом действии при смоделированной патологии.
Литература
1. П.А. Трошин, А.Б. Корнев, Е.А. Хакина, В.Ф. Разумов. Аминофуллерены и способ их получения. // Заявка на изобретение №2010127788 от 07.07.2019, РФ.
2. А.В. Kornev, Е.A. Khakina, S.I. Troyanov, A.A. Kushch, D.G. Deryabin, A.S. Peregudov, A. Vasilchenko, V.М. Martynenko, P.A. Troshin, Facile preparation of amine and amino acid adducts of [60]fullerene using chlorofullerene C60Cl6 as a precursor. // Chem. Comm., 2012, 48, 5461-5463.
3. Labuzek K, Gorki K, Jaroszek H, Jarzabek K, Gabryel B, Okopien B. Highly organized nanostructures for brain drug delivery - new hope or just a fad? // CNS Neurol Disord Drug Targets, 2013, 12, 1271-1285.
4. Medrek M.,  F., Mazurek A.P. Endohedral complexes of fullerene C60 with small convalent molecules (H2O, NH3, H2, 2H2, 3H2, 4H2, O2, O3) in the context of potential drug transporter system // Acta Pol. Pharm., 2013, 70, №4, 659-665.
F., Mazurek A.P. Endohedral complexes of fullerene C60 with small convalent molecules (H2O, NH3, H2, 2H2, 3H2, 4H2, O2, O3) in the context of potential drug transporter system // Acta Pol. Pharm., 2013, 70, №4, 659-665.
5. Dellinger A., Zhou Z., Connor J., Madhankumar A.B., Pamujula S., Sayes C.М., Kepley C.L. Application of fullerenes in nanomedicine: an update. // Nanomedcine (Lond), 2013, Jul, 8(7), 1191-1208.
6. Johnston H.J., Hutchison G., Christensen F.M., Peters S., Hankin S., Stone V. A review of the in vivo and in vitro toxicity of silver and gold particulates: particle attributes and biological mechanisms responsible for the observed toxicity. // Crit Rev Toxicol., 2010, 40(4), P. 328-346.
7. Cai X., Hao J., Zhang X., Yu В., Ren J., Luo C., Li Q., Huang Q., Shi X., Li W., Liu J. The polyhydroxylated fullerene derivative C60(OH)24 protects mice from ionizing-radiation-induced immune and mitochondrial dysfunction. // Toxicol Appl Pharmacol., 2010, 243(1), P. 27-34.
8. J.J. Yin, F. Lao, J. Meng, P.P. Fu, Y. Zhao, G. Xing, X. Gao, B. Sun, P.C. Wang, Ch. Chen, X.J. Liang. Inhibition of tumor growth by endohedral metallofullerenol nanoparticles optimized as reactive oxygen species scavenger // Mol. Pharmacol, 2008, 74, P. 11132-1140.
9. N. Yumita, Y. Iwase, T. Imaizumi, A. Sakurazawa, Y. Kaya, K. Nishi, T. Ikeda, S.-I. Umemura, F.-S. Chen and Y. Momose. Sonodynamically-Induced Anticancer Effects by Functionalized Fullerenes. // Anticancer Res., 2013, 33, P. 3145-3151.
10. Rud, Yu, Buchatskyy, L., Prylutskyy, Yu., Marchenko, O., Senenko, A.,  , Christina, Ritter, Uwe. Using C60 fullerenes for photodynamic inactivation of mosquito iridescent viruses. // Journal of enzyme inhibition and medicinal chemistry, Vol. 27, 2012, 4, S. 614-617.
, Christina, Ritter, Uwe. Using C60 fullerenes for photodynamic inactivation of mosquito iridescent viruses. // Journal of enzyme inhibition and medicinal chemistry, Vol. 27, 2012, 4, S. 614-617.
11. Brownlee M. The pathobiology of diabetic complications: A unifying mechanism // Diabetes, 2005, 1615.
12. Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. From type 2 diabetes to antioxidant activity: a systematic review of the safety and efficacy of common and cassia cinnamon bark. Can J Physiol Pharmacol. 2007, 85(9), 837-847.
13. Бондарь И.А., Климентов B.B. Антиоксиданты в лечении и профилактике сахарного диабета. // Сахарный диабет. 2001, 1, 47-52.
14. Заводник И.Б., Дремза И.К., Лапшина Е.А., Чещевик В.Т. Сахарный диабет: метаболические эффекты и окислительный стресс // Биологические мембраны. 2011, 28, 2, 83-94.
15. Ulrich P., Cerami A. Protein glycation, diabetes, and aging. // Recent Prog. Horm. Res., 2001, 56, 1-21.
16. Балаболкин М.И., Креминская В.М. Патогенез диабетической невропатии. // Журнал неврологии и психиатрии им. С.С. Корсакова, 2000, 10, 57-64.
17. 11. Engerman R.L., Kern T.S., Larson М.Е. Nerve conduction and aldose reductase inhibition during 5 years of diabetes or galactosaemia in dogs. // Diabetologia. 1994. T. 37. №2. C. 141-144.
18. Ульянов A.M., Тарасов Ю.А. Инсулярная система животных при хроническом дефиците гепарина. // Вопросы медицинской химии, 2000, 46, 149-154.
19. Фархутдинов, Р.Р., В.А. Лиховских. Хемилюминесцентные методы исследования свободно-радикального окисления в биологии и медицине. Уфа: БГМУ, 1995, с. 90.
20. Васильев Р. Ф. Хемилюминесценция в растворах. Успехи физ. наук. 1966, 89, (3), 409-436.
21. Владимиров, Ю.А., Е.В. Проскурнина. Свободные радикалы и клеточная хемилюминесценция // Успехи биологической химии. 2009, 49, 341-388.
22. Lowry, О.Н., N.J. Rosebrough, A.L. Farr, R.J. Randall. Protein measurement with the Folin phenol reagent, Biol. Chem. 1951, 193, 265-269.
23. Slater T.F. Oxygen Radicals in Biological Systems. // Methods Enzymol., 1984, 105, 273-292.
24. Motaal A.A. et al. Aldose reductase inhibition of a saponin-rich fraction and new furostanol saponin derivatives from Balanites aegyptiaca // Phytomedicine. 2015,. 22 (9), 829-836.
25. Алексеев В.В. Медицинские лабораторные технологии. Руководство по клинической лабораторной диагностике. / под ред. А.И. Карпищенко. Москва, 2013. Вып. ГЭОТАР - Мед. 792 с.
26. Ирьянов Ю.М., Сиантьева Т.А., Горбач Е.Н., Ирьянова Т.Ю. Переносной аппаратно-программный комплекс и возможности его применения в гистологических исследованиях. // Гений ортопедии, 2004, 3, 96-98.