Результат интеллектуальной деятельности: Способ биосинтеза нуклеазы бактерий Serratia marcescens
Вид РИД
Изобретение
Изобретение относится к прикладной микробиологии, биотехнологии и микробиологической промышленности, более точно - к способу получения нуклеазы, синтезируемой бактериями Serratia marcescens.
На дату подачи заявки в мире существует проблема получения нуклеазы бактерий Serratia marcescens в промышленных масштабах для использования в указанных выше областях. Данная проблема, в первую очередь связана с тем, что не разработаны условия биосинтеза нуклеазы бактериями Serratia marcescens в промышленных масштабах. Отсутствие таких условий, в свою очередь, затрудняет получение нуклеазы бактерий Serratia marcescens в количествах, достаточных для ее широкого применения.
Так, предполагаемое изобретение может быть использовано для получения в производственных масштабах нуклеазы бактерий Serratia marcescens, которая является действующим веществом в составе комбинированного антирабического препарата, т.е. препарата против бешенства [патент на изобретение РФ №2420309 «Препарат против бешенства»] [1], антивирусного препарата контактного действия [патент на изобретение РФ №2423136 «Антивирусный препарат контактного действия на основе "Бетадина" и эндонуклеазы»] [2], антимикробного препарата [патент на изобретение РФ №2337139 «Антимикробный препарат»] [3].
Также нуклеазу бактерий Serratia marcescens применяют в молекулярной биологии в качестве реактива под названием Бензоназа или супернуклеаза и в сельском хозяйстве в качестве основного компонента в составе средства «Эндоглюкин» для профилактики и лечения вирусных заболеваний пчел и стимуляции развития пчелиных семей [Handbook of ELISPOT. Methods and Protocols (Справочник no ELISPOT. Методы и протоколы) I Ed. A. Kalyuzhny. N.Y.: Humana Press, 2005. 336 p.] [4], [патент на изобретение РФ №2038776 «Средство «Эндоглюкин» для профилактики и лечения вирусных заболеваний пчел и стимуляции развития пчелиных семей»] [5].
Кроме этого нуклеазу бактерий Serratia marcescens можно применить в качестве стимулятора роста при получении биомассы бактерий [патент на изобретение РФ №2007450 «Способ получения биомассы бактерий»] [6], а также в медицине и косметологии для профилактики и коррекции изменений кожи [патент на изобретение РФ №2258530 «Способ профилактики и коррекции изменений кожи»] [7].
Из области техники известно, что нуклеаза бактерий Serratia marcescens - это фермент, продукт структурного гена пис, исходно найденного в геноме бактерий Serratia marcescens и позднее клонированного и экспрессированного в клетках бактерий Serratia marcescens и E.coli. [Ball Т.К., Sauragger P.N., Benedik M.J. The extracellular nuclease gene of Serratia marcescens and its secretion from Escherichia coli (Ген внеклеточной нуклеазы Serratia marcescens и ее секреция из Escherichia coli)//Gene. - 1987. - V. 57. - Р. 183-192] [8]. Также известно, что нуклеаза бактерий Serratia marcescens - это природный биологический катализатор белковой природы, присутствие которого в окружающей среде ускоряет гидролиз фосфодиэфирных связей ДНК и РНК в 1016 раз по сравнению с их спонтанным разрушением, чем обусловлено применение данного фермента. Общеизвестно, что бактерии Serratia marcescens относятся к факультативно анаэробным микроорганизмам, то есть могут расти как в отсутствие, так и в присутствии воздуха. Однако если культивировать эти бактерии при высокой степени аэрации среды, то повышается биосинтез нуклеазы бактерий Serratia marcescens [Юсупова Д.В. Нуклеодеполимеразная активность бактерий в связи с некоторыми особенностями их физиологии. Под ред М.И. Беляева. Изд. Казанского универститета, 1978 г. С. 81] [9].
Из области техники известно, что высокой степени аэрации и насыщения кислородом питательной среды можно достичь ее аэрированием, например, путем интенсивного перемешивания при глубинном культивировании микроорганизмов. За счет изменения температуры с 28°С до 30-35°С интенсивность аэрации при аэрировании среды можно дополнительно увеличить в 1,23-1,28 раза [П.И. Николаев. Аэрация при культивировании микроорганизмов. //В кн. Промышленная микробиология. Под ред. Н.С. Егорова. Изд. «Высшая школа», Москва, 1989 г. С. 139] [10], [Н.С. Егоров «Основы учения об антибиотиках». Изд. «Высшая школа», Москва, 1969. С. 108-112] [11].
Из области техники известно, что повышенного биосинтеза нуклеазы бактерий Serratia marcescens можно достичь добавлением к бактериальной культуре индукторов биосинтеза, которыми служат вещества, например, подавляющие репликацию ДНК, в частности, митомицин С [Юсупова Д.В., Соколова Р.Б., Порфирьева О.В., Пономарева А.З. Индукция синтеза внеклеточной эндонуклеазы Serratia marcescens агентами, подавляющими репликацию ДНК// Микробиология, 1991, Т. 60, вып. 2, Стр. 279-284] [12], [Ball Т., Wasmuth С., Braunagel С., Benedik М. Expression of Serratia marcescens extracellular proteins requires rec А (Экспрессия внеклеточных белков Serratia marcescens требует rec A)// Journal of Bacteriology, 1990, p. 324-349][13].
Заявленное техническое решение направлено на решение проблемы повышения интенсивности биосинтеза нуклеазы бактериями Serratia marcescens в условиях, которые могут быть использованы для ее эффективного промышленного микробиологического производства.
Из исследованного заявителем уровня техники известно, что для повышения интенсивности биосинтеза биологически активных веществ, в том числе ферментов, в том числе нуклеазы бактерий Serratia marcescens, специально подбирают условия роста культуры: например, состав питательной среды, например, температуру, например, время культивирования, например, интенсивность аэрации (-это скорость, с которой кислород вступает в реакцию [11]), например, применение индукторов.
Из исследованного уровня техники заявителем выявлен ряд технических решений с использованием для культивирования бактерий Serratia marcescens, например, различных питательных сред.
Так, заявителем выявлено изобретение по патенту РФ №2026348 «Штамм бактерий Serratia marcescens - продуцент хитиназы» [14]. Сущностью известного технического решения является применение штамма бактерий Serratia marcescens ВКПМ В-3273 в качестве продуцента хитиназы.
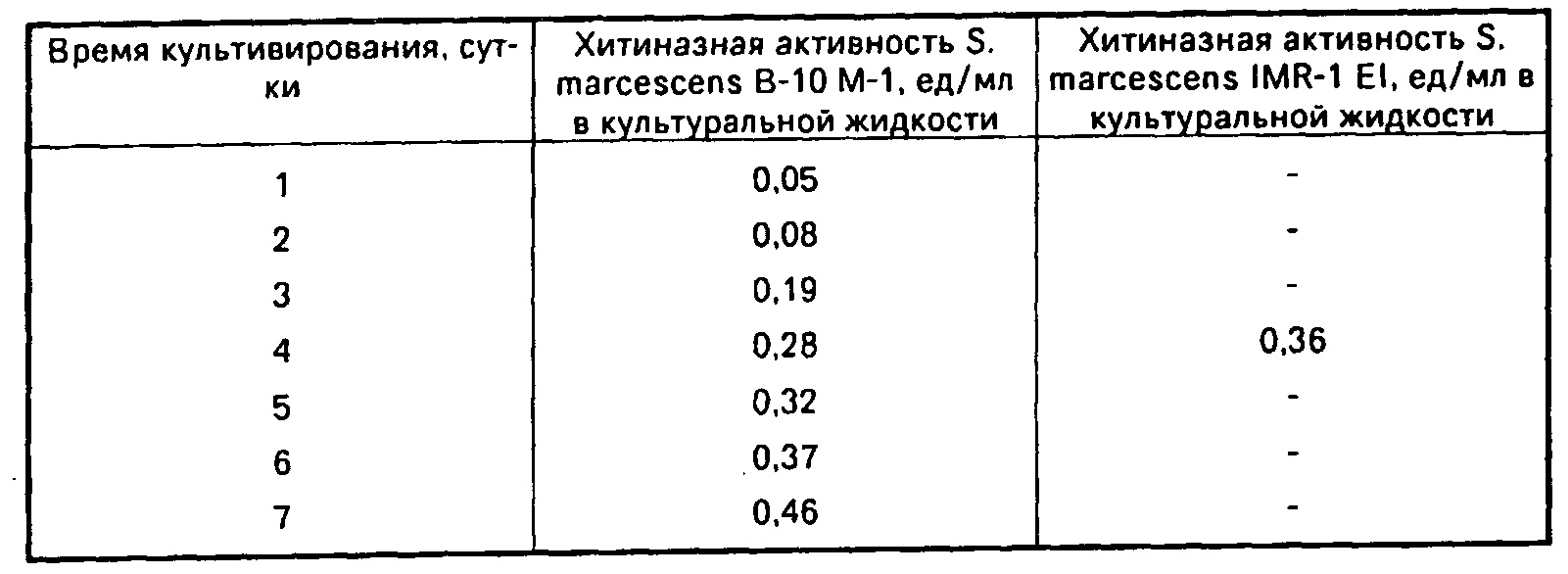
В известном техническом решении для культивирования штамма В-10 М-1 (ВКПМ В-3237) с целью биосинтеза хитиназы используют многокомпонентную среду, включающую (г/л): хитин порошкообразный - 10-30, дрожжевой экстракт - 5,0, сульфат аммония - 0,1, сульфат магния - 0,3, буферную смесь одно- и двузамещенных фосфатов калия - 1,5, воду - 1,0 л.
Недостатком известного технического решения является то, что среда включает дорогостоящий порошкообразный хитин. Кроме того, данная среда не универсальна и подобрана для биосинтеза бактериями Serratia marcescens фермента хитиназы.
Заявителем выявлено изобретение по патенту РФ №2241744 «Способ культивирования бактерий Serratia marcescens, продуцента хитиназы» [15]. Сущностью является способ культивирования бактерий Serratia marcescens, продуцента хитиназы, включающий выращивание бактерий на питательной среде, содержащей питательные факторы, буферные соли и воду при температуре 28-30°С и рН 8,0-8,4 с аэрацией, отличающийся тем, что в качестве питательных факторов используют дрожжи Saccharomyces cerevisiae в концентрации 50-150 г/л, а культивирование проводят в течение 3-5 суток.
По известному техническому решению разработана среда для биосинтеза хитиназы бактериями Serratia marcescens, включающая (г/л): дрожжи Saccharomyces cerevisiae - 50-150, буферную смесь одно- и двузамещенных фосфатов калия - 1,5 и воду - 1,0 л.
Недостатком известного технического решения является то, что среда не является универсальной и подобрана для биосинтеза бактериями Serratia marcescens фермента хитиназы.
Заявителем выявлено изобретение по Авт. Св. СССР №230052, 1967 г. [16]. Сущностью является то, что для биосинтеза нуклеазы бактерий Serratia marcescens штамма 41 используют среду, включающую (г/л): глюкозу - 2,0, сернокислый аммоний - 2,0, двузамещенный фосфат калия - 1,0, литий сернокислый - 0,004, железо сернокислое - 0,002, хлористый натрий - 0,002, кислотный гидролизат казеина - 0,05, дрожжевой экстракт - 0,05 и воду - 1,0 л.
Недостатком известного технического решения является низкая активность нуклеазы при культивировании бактерий Serratia marcescens на этой среде.
Заявителем выявлено изобретение по Авт. Св. СССР №340691, 1970 г. «Питательная среда для выращивания Serratia marcescens 44 - продуцента нуклеазы» [17]. Сущностью является питательная среда для выращивания Serratia marcescens 44 - продуцента нуклеазы, содержащая воду и хлористый натрий в количестве 0,5 г, характеризующаяся тем, что с целью увеличения выхода и активности фермента, продуцируемого Serratia marcescens, питательная среда дополнительно содержит глицерин, цитрат аммония, двузамещенный фосфорнокислый калий, сернокислый магний, сернокислое железо, гидролизат казеина, дрожжевой аутолизат.
Более подробно - для биосинтеза нуклеазы бактерий Serratia marcescens штамма 44 в известном техническом решении используют среду, включающую (г/л): глицерин - 5,0, цитрат аммоний - 5,0, двузамещенный фосфат калия - 10,0, магний сернокислый - 0,5, железо сернокислое - 0,05, хлористый натрий - 0,5, гидролизат казеина - 1,0, дрожжевой аутолизат - 3,0 и воду - 1,0 л.
Недостатком известного технического решения является относительно низкая активность нуклеазы при культивировании бактерий Serratia marcescens на данной среде.
Заявителем выявлены технические решения, направленные на повышение биосинтеза нуклеазы бактериями Serratia marcescens штаммов 24, Bu211 АТСС9986, W1050 с использованием различных питательных сред.
Так, выявлено изобретение, направленное на повышение биосинтеза нуклеазы бактериями Serratia marcescens штамма 24 по Авт. Св. СССР №992568 «Питательная среда для выращивания Serratia marcescens 24 - продуцента нуклеазы» [18].
Сущностью является питательная среда для выращивания Serratia marcescens 24 - продуцента нуклеазы, содержащая источник углерода, азота, физиологически активных веществ, а также хлористый натрий и дистилированную воду, характеризующаяся тем, что с целью увеличения нуклеазной активности продуцента, в качестве источника углерода, азота, физиологически активных веществ среда содержит галактозу, овсяную муку и бактериологический пептон при следующем соотношении компонентов: овсяная мука - 2,0-8,0, галактоза - 2,5-10,0, хлористый натрий - 2,5-7,5, бактериологический пептон - 5,0-15,0 и воду 1,0 л.
Выявлено техническое решение, направленное на повышение биосинтеза нуклеазы бактериями Serratia marcescens штамма Bu211 АТСС9986 [12]. Сущностью в отношении питательной среды является питательная среда, включающая (г/л): NaCl - 0,5, цитрат аммония - 5,0, сульфат железа - 0,025, сульфат магния -0,5, двузамещенный фосфат калия - 10,0, глицерин - 5,0, гидролизат казеина - 1,0, дрожжевой аутолизат - 3,0 и воду 1,0 л.
Выявлено техническое решение, направленное на исследование биосинтеза нуклеазы бактериями Serratia marcescens штамма W1050 [Старшинова Н.В., Филимонова М.Н. Особенности биосинтеза нуклеазы и роста Serratia marcescens в присутствии 2-(пара-аминобензолсульфамидо) -тиазола.// Микробиология, 2005, Т. 74, №2. - С. 1-5.] [19]. Сущностью известного технического решения в отношении питательной среды является среда, состоящая из (г/л): NaCl - 4,7, NH4Cl - 1,1, Na2SO4 - 0,4, MgCl2 - 0,95, K2HPO4⋅3Н2О - 2,8, глюкозы - 5,0, гидролизата казеина - 1,0, дрожжевого экстракта - 3,0 и воды 1,0 л.
Недостатком описанных выше технических решений [12, 18, 19] является сложность реализации технологии промышленного приготовления питательных сред, так как каждая из них содержит компоненты, которые требуют раздельной стерилизации: например, сахара или дрожжевой аутолизат или соли железа [Практикум по микробиологии, под ред. Н.С.Егорова, Изд. Московского университета, стр. 52-53, 1976 г.] [20]. В коммерческих масштабах такие питательные среды не производятся. Следовательно, данные среды нельзя купить. Они требуют специального приготовления, в результате чего являются дорогостоящими и плохо стандартизируемыми по сравнению с универсальными, широко используемыми средами, которые доступны в виде коммерческих продуктов. Таким образом, применение этих питательных сред в производственных масштабах нецелесообразно, а известные технические решения [12, 18, 19] не подходят для биосинтеза нуклеазы бактериями Serratia marcescens в условиях промышленного микробиологического производства в силу указанных выше причин.
Из исследованного уровня техники заявителем выявлено техническое решение [13]. Сущностью известного технического решения в отношении питательной среды является среда LB, которую используют для культивирования бактерий Serratia marcescens штаммов Sm6(NucB::Tn5), Sm6, Jm101(pNuc4-R), TT392(pNuc4-R) и W1050, различающихся, в частности, интенсивностью биосинтеза нуклеазы. Состав среды LB включает (г/л): триптон - 10,0, хлорид натрия - 10,0, дрожжевой экстракт - 5,0 и воду 1,0 л.
Известное техническое решение лишено недостатков описанных выше технических решений [12, 14-19] в отношении выбора питательной среды, в связи с чем указанную среду LB используют в заявленном техническом решении.
Из исследованного уровня техники заявителем выявлен ряд технических решений с использованием для культивирования бактерий Serratia marcescens различных температурных условий и различной интенсивности аэрации.
Так, в известном техническом решении [13] описано культивирование бактерий Serratia marcescens, например, штаммов Sm6, или TT392(pNuc4-R), или W1050, которое проводят в стационарных условиях без аэрирования при температуре 30°С.
Недостатком известного технического решения в отношении интенсивности аэрации является низкая степень аэрации среды, обусловленная отсутствием аэрирования, что ведет к низкому уровню биосинтеза нуклеазы бактериями Serratia marcescens.
Для интенсификация биосинтеза нуклеазы бактерий Serratia marcescens степень аэрации среды в условиях известного технического решения (без аэрирования) может быть повышена только максимально возможным увеличением площади соприкосновения бактериальной культуры с воздухом, что является существенным препятствием к широкому применению технического решения и ограничивает его применение лабораторными масштабами.
Из исследованного уровня техники заявителем выявлены технические решения [12, 17, 19], сущностью которых в отношении интенсивности аэрации среды, а также различных температурных условий среды является культивирование бактерий Serratia marcescens, например, штаммов 44 или Bu211 АТСС9986 или W1050 глубинным способом при повышенной степени аэрации среды и при температуре, например, 28°С, или 30°С, или 37°С.
Известные технические решения [12, 17, 19] лишены недостатка технического решения [13] и используются заявителем в заявленном техническом решении в отношении интенсивности аэрации среды, а именно применяется глубинное культивирование с аэрированием при различных температурных условий.
Из исследованного уровня техники заявителем выявлен ряд технических решений с использованием для культивирования бактерий Serratia marcescens индуктора биосинтеза нуклеазы, например, митомицина С [Юсупова Д.В., Соколова Р.Б., Пономарева А.З. Влияние митомицина на биосинтез внеклеточной эндонуклеазы Serratia marcescens // Антибиотики и химиотерапия, 1990, Т. 35, №2, С. 13-15] [21], [13].
Так, в известном техническом решении [21] глубинное культивирование бактерий Serratia marcescens штамма Bu211 АТСС9986 на модифицированной среде Бантинг при 28°С при повышенной степени аэрации среды проводят 24 ч в присутствии митомицина С, который добавляют в количестве 0,02-10 мг/л культуральной жидкости через 1-6 ч роста культуры или одновременно с посевным материалом.
Наилучшего результата в рамках известного технического решения, а именно - интенсификация биосинтеза нуклеазы бактериями Serratia marcescens в 48-55 раз по сравнению с биосинтезом в отсутствии митомицина С - достигают добавлением в конце экспоненциальной фазы роста 0,5-1 мг митомицина С на 1 л культуральной жидкости.
Наихудший результат, а именно - полное подавление биосинтеза нуклеазы бактериями Serratia marcescens - получают добавлением вместе с посевным материалом 10 мг митомицина С на 1 л питательной среды.
Недостатком известного технического решения [21] в отношении использования индуктора - митомицина С является:
- более широкий диапазон количеств вносимого вещества по сравнению с заявленным техническим решением, а именно 0,02-10 мг/л;
- более широкий диапазон сроков его добавления по сравнению с заявленным техническим решением, а именно - от момента внесения посевного материала до конца экспоненциальной фазы роста культуры.
Известное техническое решение было использовано в заявленном техническом решении частично, а именно - в отношении использования в качестве индуктора митомицина С, после соответствующей проверки, результаты которой представлены в Примерах 2, 4, 5.
Наиболее близким по совокупности совпадающих признаков и назначению к заявленному техническому решению, выбранному заявителем в качестве прототипа, является известное техническое решение [13]. Сущностью прототипа является то, что бактерии Serratia marcescens штаммов Sm6 или W1050 или не родственного им штамма ТТ392 (pNuc4-R) культивируют в стационарных условиях без аэрирования при 30°С на среде LB до середины экспоненциальной фазы. Далее, т.е. в середине экспоненциальной фазы, к культурам бактерий Serratia marcescens добавляют индуктор - митомицин С в количестве 0,1 мг/л культуральной жидкости и продолжают культивирование в течение ночи или до перехода культуры к стационарному росту. В условиях известного технического решения под действием митомицина С происходит увеличение биосинтеза нуклеазы бактериями Serratia marcescens штаммов W1050 или Sm6 или ТТ392 (pNuc4-R), соответственно, в 3, или в 4, или в 6 раз по сравнению с биосинтезом в отсутствии индуктора.
Недостатками прототипа является:
- заниженный прирост биосинтеза нуклеазы бактерий Serratia marcescens под действием митомицина С по сравнению с заявленным техническим решением;
- культивирование бактерий в стационарных условиях без аэрирования, в результате чего для достижения повышенного биосинтеза нуклеазы бактериями Serratia marcescens площадь соприкосновения бактериальной культуры с воздухом должна быть увеличена как можно больше, что является существенным препятствием к широкому применению известного технического решения и ограничивает его применение лабораторными масштабами.
Задачей заявленного технического решения является устранение недостатков прототипа, а именно - разработка способа биосинтеза нуклеазы бактериями Serratia marcescens, позволяющего достичь увеличения биосинтеза нуклеазы бактерий Serratia marcescens под действием митомицина С с подбором определяющих условий роста культуры.
Техническим результатом является заявленный способ биосинтеза нуклеазы бактерий Serratia marcescens в присутствии митомицина С с применением аэрирования среды при глубинном культивировании при повышении температуры, что приводит к многократному увеличению биосинтеза нуклеазы Serratia marcescens по сравнению с прототипом.
Задача решается и технический результат достигается с помощью заявленного технического решения, сущностью которого является способ биосинтеза нуклеазы бактерий Serratia marcescens, заключающийся в том, что в период экспоненциального роста бактерий Serratia marcescens на среде LB добавляют митомицин С в количестве 0,01-1,0 мг/л культуральной жидкости, характеризующийся тем, что культивирование проводят 6-22 часа с митомицином С в условиях повышенной степени аэрации среды в диапазоне 340-870 мг O2/л/час, что достигается ее аэрированием при глубинном культивировании при повышении температуры до 37°С.
Заявленное техническое решение поясняется Фиг. 1 - Фиг. 5, в которых отражен скрининг ключевых условий культивирования.
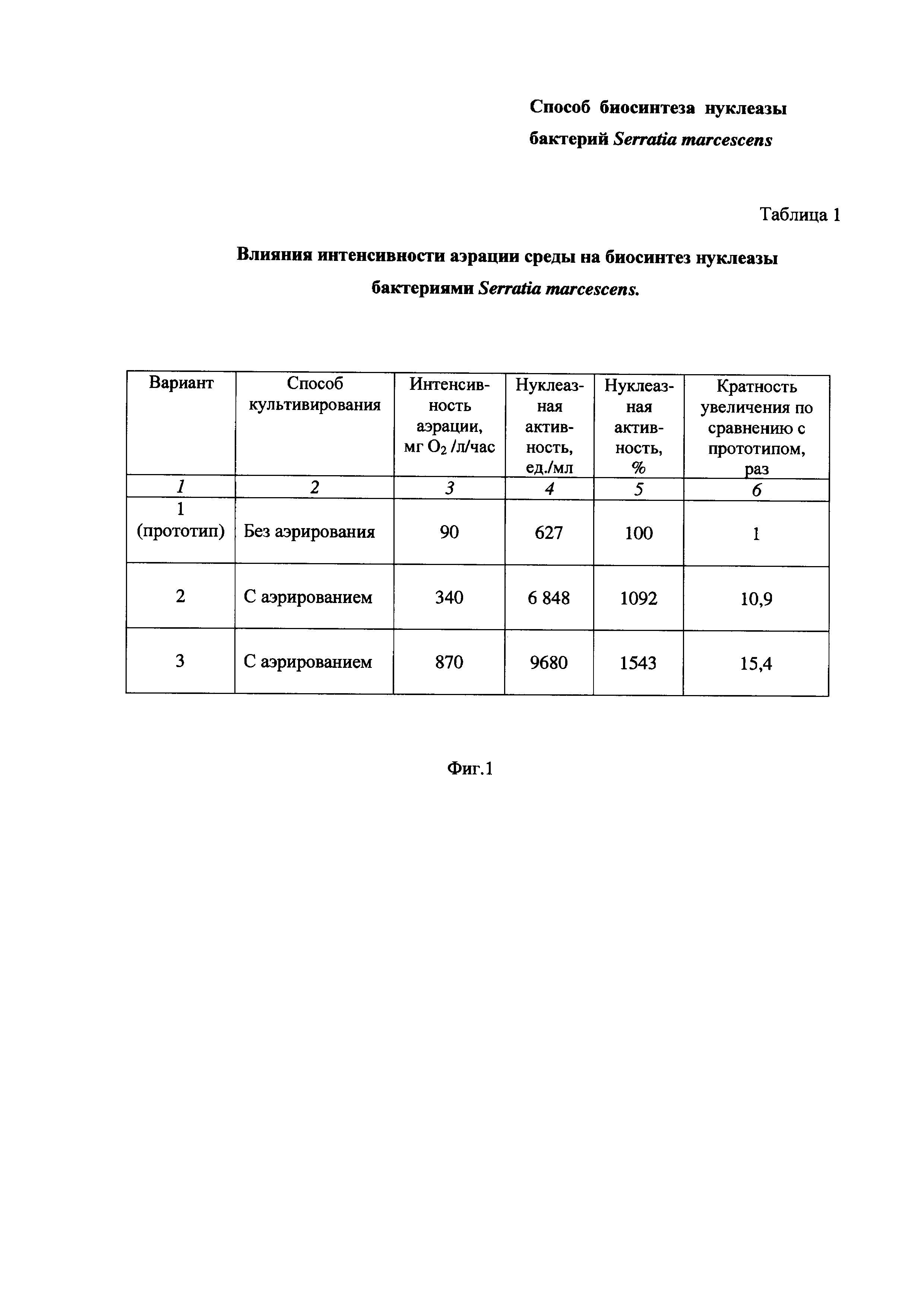
На Фиг. 1 приведена Таблица 1, в которой показано влияние интенсивности аэрации среды на биосинтез нуклеазы бактерий Serratia marcescens.
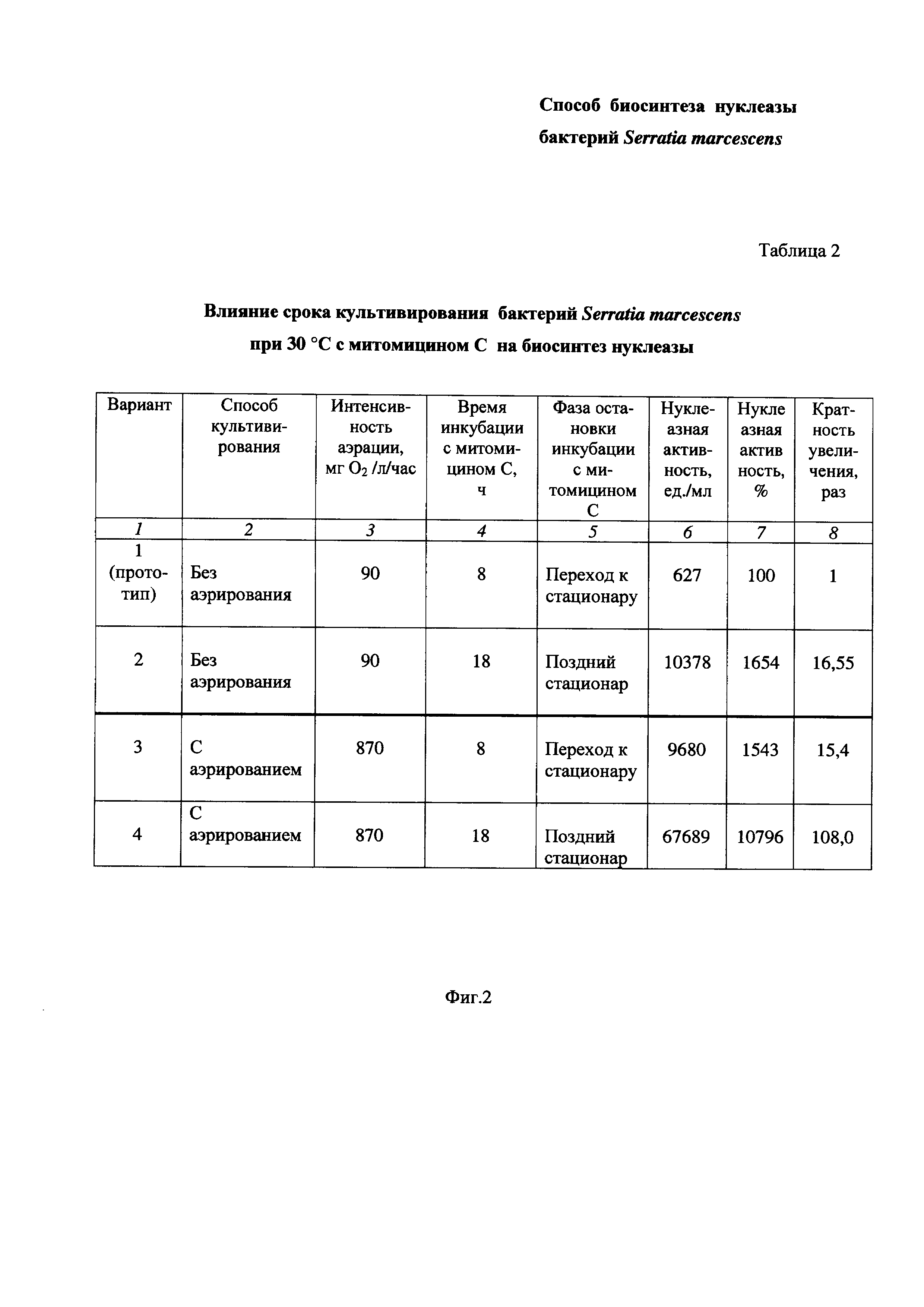
На Фиг. 2 приведена Таблица 2, в которой показано влияние срока культивирования бактерий Serratia marcescens при 30°С с митомицином С на биосинтез нуклеазы.
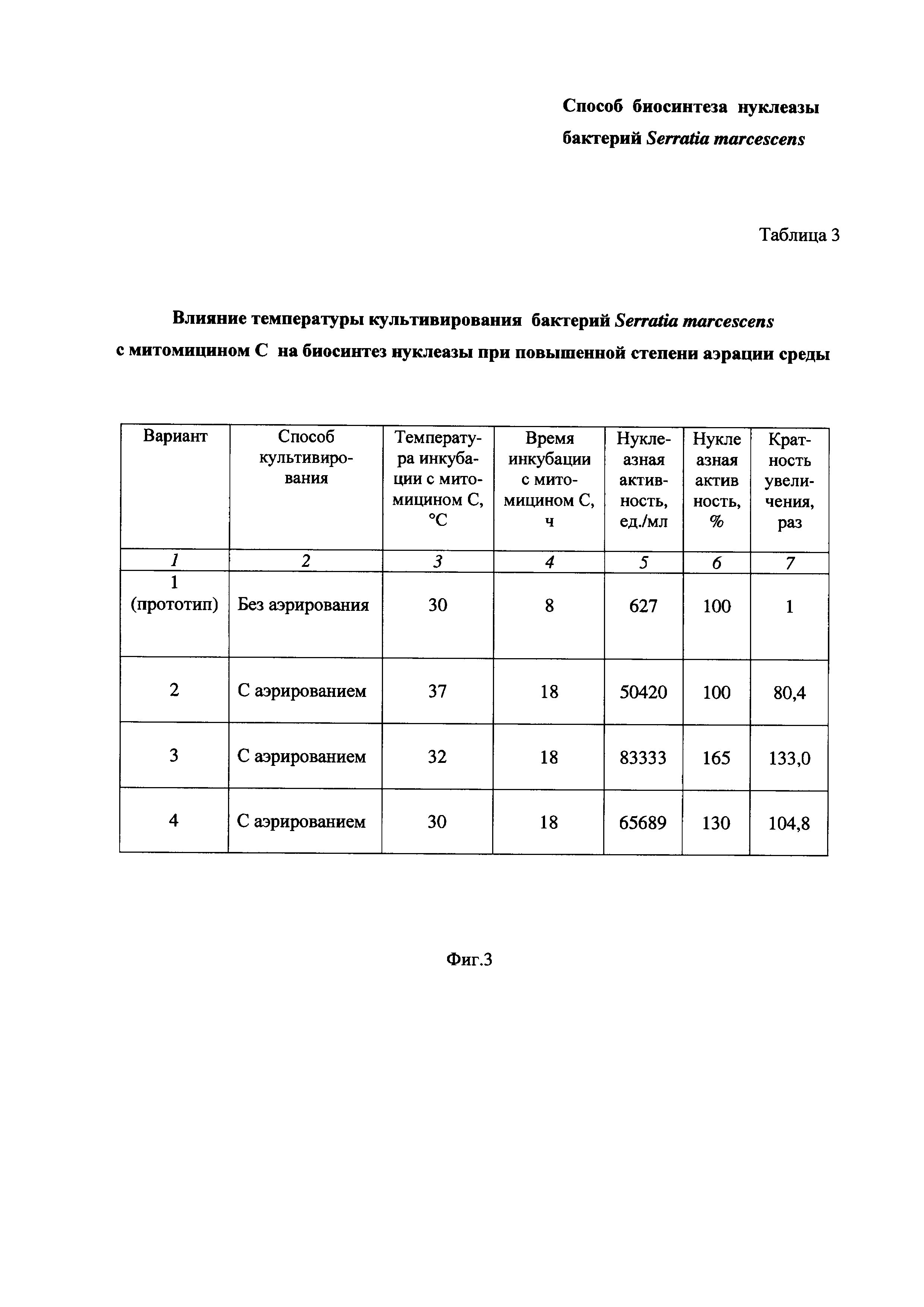
На Фиг. 3 приведена Таблица 3, в которой показано влияние температуры культивирования бактерий Serratia marcescens с митомицином С на биосинтез нуклеазы при повышенной степени аэрации среды.
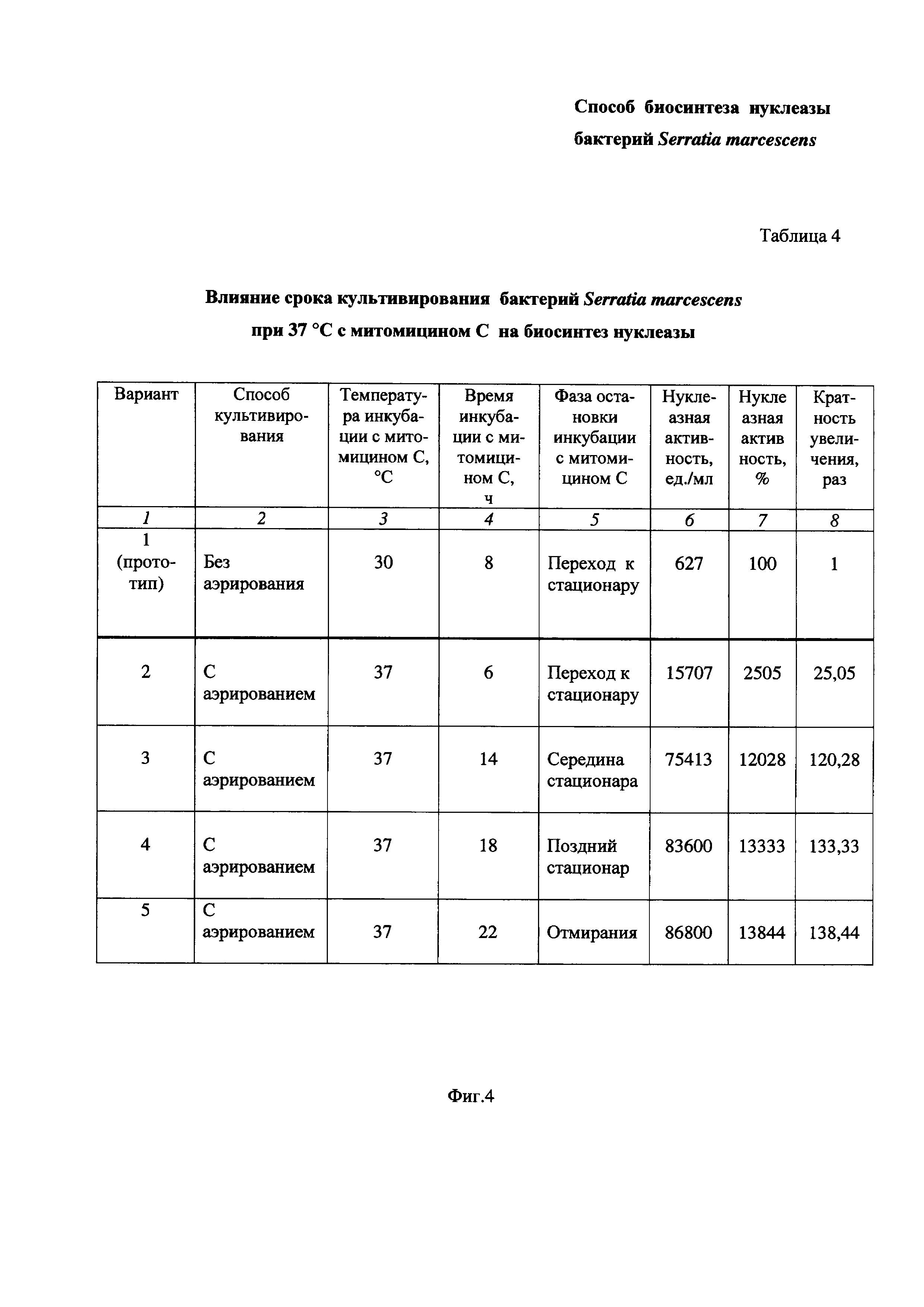
На Фиг. 4 приведена Таблица 4, в которой показано влияние срока культивирования бактерий Serratia marcescens при 37°С с митомицином С на биосинтез нуклеазы.
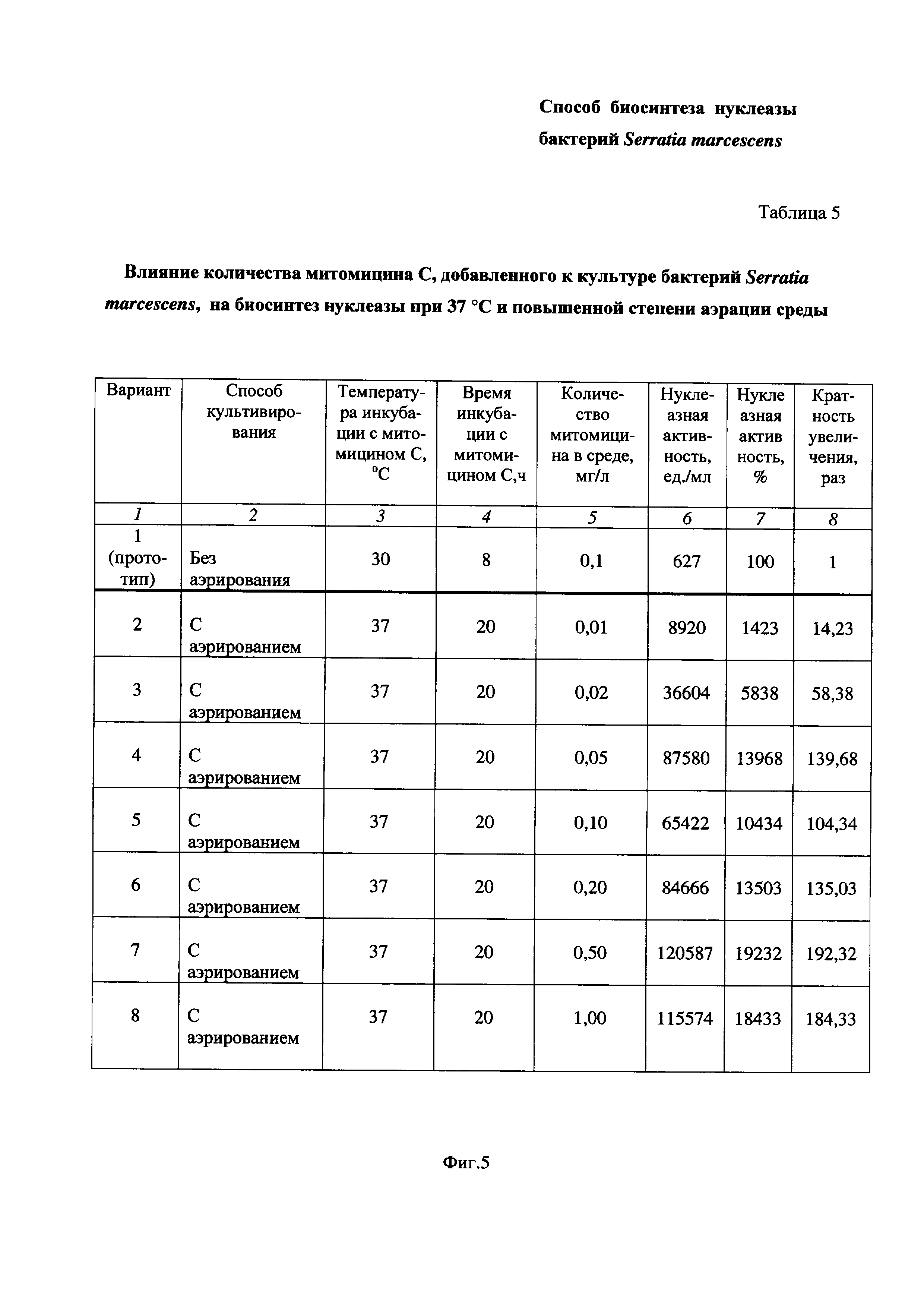
На Фиг. 5 приведена Таблица 5, в которой показано влияние количества митомицина С, добавленного к культуре бактерий Serratia marcescens, на биосинтез нуклеазы при 37°С и повышенной степени аэрации среды.
Заявленное техническое решение осуществляют следующим образом.
Культивирование бактерий Serratia marcescens, например штамма W1128, проводят в конических колбах на питательной среде LB без аэрирования при 30°С (по прототипу) или с аэрированием перемешиванием на качалках при 190-200 об/мин в диапазоне температур от 30°С до 37°С, предварительно засевая питательную среду посевным материалом до оптической плотности 0,05 Ед. и добавляя в период экспоненциального роста культуры митомицин С в количестве 0,01-1,0 мг/л культуральной жидкости.
Среда LB включает (г/л): триптон - 10, хлорид натрия - 10, дрожжевой экстракт - 5 и воду 1 л.
Митомицин С фирмы «Alfa Aesar» (Германия) перед добавлением в культуральную жидкость до количеств, требуемых условиями опыта, предварительно растворяют в диметилсульфоксиде (ДМСО; ПанЭко, Москва, Россия) до 1 г/л.
Посевным материалом служит инокулят бактерий Serratia marcescens, например, штамма W1128, из Немецкой коллекции микроорганизмов и культур клеток Института Лейбница (Регистрационный номер DSM-12485; Leibniz- Intitut DSMZ-Deutscher Sammlung von Mikroorganizmen und Zelkulturen GmbH) [https://www.dsmz.de/catalogues/details/culture/DSM-12485.html?tx_dsmzresources_pi5%5BreturnPid%5D=304].
Для получения посевного материала бактерии Serratia marcescens выращивают 17-24 ч в конических колбах на среде LB при 37°С с аэрированием перемешиванием при 200 об/мин.
Интенсивность аэрации выражают скоростью окисления раствора сульфита (мг O2/л/час) и оценивают на основании данных, представленных в [11].
Нуклеазную активность в среде определяют общеизвестным методом кислоторастворимых фракций [22].
Интенсивность роста оценивают по изменению оптической плотности бактериальной суспензии, определяемой нефелометрически на КФК-2 при 590 нм. Количество биомассы выражают в единицах светорассеяния в кювете толщиной 3,55 мм [19].
Рост культуры бактерий представляют последовательностью фаз:
- лаг-фаза (приспособительная);
- лог-фаза (экспоненциальная);
- стационарная фаза (стационар);
- фаза отмирания.
Заявленное техническое решение поясняется следующими примерами конкретного осуществления.
Пример 1. Определение влияния интенсивности аэрации среды на биосинтез нуклеазы бактериями Serratia marcescens (Таблица 1 на Фиг. 1).
Питательную среду LB в конических колбах засевают посевным материалом бактерий Serratia marcescens, подготовленным, как описано выше, до плотности 0,05 Ед.
Культивирование бактерий Serratia marcescens проводят при 30°С без аэрирования (Таблица 1 на Фиг. 1, Вариант 1, по прототипу) или с аэрированием перемешиванием при 190-200 об/мин при соотношении объемов питательной среды и колбы 1:5 (Вариант 2) или 1:10 (Вариант 3), соответственно.
В середине экспоненциального роста культуры добавляют митомицин С в количестве 0,1 мг/л культуральной жидкости и продолжают культивировать бактерии Serratia marcescens в описанных условиях 8 ч до перехода культуры к стационарной фазе. Затем культуральную жидкость отделяют от биомассы центрифугированием при 5°С и 12000 об/мин. В супернатанте определяют нуклеазную активность.
Результаты приведены в Таблице 1 на Фиг. 1.
Таблица 1 состоит из шести столбцов:
- в столбце 1 приведены номера вариантов опытов - Вариант 1 (прототип), Вариант 2 и Вариант 3 (заявленное техническое решение);
- в столбце 2 приведены способы культивирования - без аэрирования (Вариант 1) и с аэрированием (Вариант 2, Вариант 3);
- в столбце 3 приведена интенсивность аэрации, равная:
 90 мг O2/л/час - Вариант 1 (прототип),
90 мг O2/л/час - Вариант 1 (прототип),
 340 мг О2/л/час - Вариант 2,
340 мг О2/л/час - Вариант 2,
 870 мг О2/л/час - Вариант 3.
870 мг О2/л/час - Вариант 3.
- в столбцах 4 и 5 приведены значения нуклеазной активности в ед./мл и в %, соответственно;
- в столбце 6 приведена кратность увеличения нуклеазной активности заявленного технического решения по Варианту 2 и Варианту 3 по сравнению с прототипом по Варианту 1.
Как видно из результатов Таблицы 1 (Фиг. 1), повышение степени аэрации питательной среды, достигаемой ее интенсивным перемешиванием (столбец 3), приводит к увеличению биосинтеза нуклеазы бактерий Serratia marcescens по сравнению с прототипом, о чем свидетельствует повышение нуклеазной активности (столбцы 4, 5).
Так, при увеличении интенсивности аэрации с 90 до 340 мг O2/л/час (в 3,8 раза) нуклеазная активность возросла в 10,9 (Вариант 2) (столбец 6).
При увеличении интенсивности аэрации с 90 до 870 мг O2/л/час (в 9,7 раза) нуклеазная активность возросла в 15,4 (Вариант 3) (столбец 6).
Таким образом, из вышеизложенного можно сделать вывод, что повышение интенсивности аэрации в заявленном техническом решении приводит к заметному увеличению биосинтеза нуклеазы бактериями Serratia marcescens, что подтверждается повышением нуклеазной активности в культуральной жидкости более чем в 10 раз.
Пример 2. Определение влияния срока культивирования бактерий Serratia marcescens при 30°С с митомицином С на биосинтез нуклеазы при разной степени аэрации среды (Таблица 2 на Фиг. 2).
Питательную среду LB в конических колбах засевают посевным материалом бактерий Serratia marcescens, как описано в Примере 1.
Культивирование бактерий Serratia marcescens проводят при 30°С без аэрирования (Таблица 2 на Фиг. 2, Вариант 1 - по прототипу и Вариант 2), что соответствует интенсивности аэрации 90 мг O2/л/час, или с аэрированием перемешиванием при 190-200 об/мин при соотношении объемов питательной среды и колбы 1:10 (Вариант 3 и Вариант 4), что соответствует интенсивности аэрации 870 мг O2 /л/час.
В середине экспоненциального роста культуры добавляют митомицин С в количестве 0,1 мг/л культуральной жидкости и продолжают культивировать бактерии Serratia marcescens в описанных условиях 8 ч до перехода культуры к стационарной фазе (Вариант 1 и Вариант 3) или 18 ч до фазы позднего стационара (Вариант 2 и Вариант 4). Затем определяют нуклеазную активность, как описано в Примере 1.
Результаты приведены в Таблице 2 на Фиг. 2.
Таблица 2 состоит из восьми столбцов:
- в столбце 1 приведены номера вариантов опытов - Вариант 1 (прототип), Вариант 2, Вариант 3 и Вариант 4 (заявленное техническое решение);
- в столбце 2 приведены способы культивирования - без аэрирования (Вариант 1, Вариант 2) и с аэрированием (Вариант 3 и Вариант 4);
- в столбце 3 приведена интенсивность аэрации, равная:
 90 мг O2/л/час - Вариант 1 (прототип) и Вариант 2,
90 мг O2/л/час - Вариант 1 (прототип) и Вариант 2,
 870 мг O2/л/час - Вариант 3 и Вариант 4.
870 мг O2/л/час - Вариант 3 и Вариант 4.
- в столбцах 4 и 5 приведено время инкубации с митомицином и фазы остановки инкубации, соответственно:
 8 час.(фаза перехода культуры к стационарной фазе) - Вариант 1 (прототип) и Вариант 3,
8 час.(фаза перехода культуры к стационарной фазе) - Вариант 1 (прототип) и Вариант 3,
 18 час.(фаза позднего стационара) - Вариант 2 и Вариант 4.
18 час.(фаза позднего стационара) - Вариант 2 и Вариант 4.
- в столбцах 6 и 7 приведены значения нуклеазной активности в ед./мл и в %, соответственно;
- в столбце 8 приведена кратность увеличения нуклеазной активности по Варианту 2, Варианту 3 и Варианту 4 по сравнению с прототипом по Варианту 1.
Как видно из результатов Таблицы 2 (Фиг. 2), увеличение срока культивирования бактерий Serratia marcescens с митомицином С (столбцы 4, 5) с 8 ч (от момента перехода культуры к стационарной фазе) до 18 ч (фаза позднего стационара) приводит к увеличению биосинтеза нуклеазы бактерий Serratia marcescens по сравнению с прототипом, о чем свидетельствует повышение нуклеазной активности (столбцы 6, 7).
Так, увеличение времени инкубации с 8 до 18 часов при пониженной интенсивности аэрации, соответствующей 90 мг O2/л/час, повышает биосинтез нуклеазы в 16,55 раза (столбец 8).
Увеличение времени инкубации с 8 до 18 часов при повышенной интенсивности аэрации, соответствующей 870 мг O2/л/час, повышает биосинтез нуклеазы в 7 раз, а по сравнению с прототипом в 108 раз (столбец 8).
Таким образом, из вышеизложенного можно сделать вывод, что увеличение времени инкубации при повышенной интенсивности аэрации в заявленном техническом решении приводит к заметному увеличению биосинтеза нуклеазы бактериями Serratia marcescens, что подтверждается повышением нуклеазной активности по сравнению с прототипом более чем в 100 раз.
Пример 3. Определение влияния температуры культивирования бактерий Serratia marcescens с митомицином С на биосинтез нуклеазы при повышенной степени аэрации среды (Таблица 3 на Фиг. 3).
Определение влияния температуры культивирования проводят в интервале температур, соответствующих физиологическим значениям (т.е. значениям температуры жизнедеятельности бактерий).
Питательную среду LB в конических колбах засевают посевным материалом бактерий Serratia marcescens, как описано в Примере 1. В середине экспоненциального роста культуры при 37°С в условиях повышенной степени аэрации среды (перемешивание при 190-200 об/мин и соотношении объемов питательной среды и колбы 1:10) добавляют митомицин С в количестве 0,1 мг/л культуральной жидкости и затем бактериальную суспензию делят на 3 части. Каждую часть помещают в стерильную коническую колбу и продолжают культивировать бактерии Serratia marcescens до фазы позднего стационара (18 ч) в описанных условиях аэрации при 37°С, 32°С и 30°С (Вариант 2-4). Затем определяют активность нуклеазы, как описано в Примере 1.
Результаты приведены в Таблице 3 на Фиг. 3.
Таблица 3 состоит из семи столбцов:
- в столбце 1 приведены номера вариантов опытов - Вариант 1 (прототип), Вариант 2, Вариант 3 и Вариант 4 (заявленное техническое решение);
- в столбце 2 приведены способы культивирования - без аэрирования (Вариант 1 по прототипу) и с аэрированием (Вариант 2, Вариант 3 и Вариант 4);
- в столбце 3 приведена температура инкубации, равная:
 30°С - Вариант 1 (прототип) и Вариант 2,
30°С - Вариант 1 (прототип) и Вариант 2,
 32°С - Вариант 3,
32°С - Вариант 3,
 37°С - Вариант 4.
37°С - Вариант 4.
- в столбце 4 приведено время инкубации - 8 час. у прототипа (Вариант 1) и 18 час. у заявленного технического решения (Вариант 2, Вариант 3 и Вариант 4);
- в столбцах 5 и 6 приведены значения нуклеазной активности в ед./мл и в %, соответственно;
- в столбце 7 приведена кратность увеличения нуклеазной активности заявленного технического решения по Варианту 2, Варианту 3 и Варианту 4 по сравнению с прототипом по Варианту 1.
Как видно из результатов Таблицы 3 (Фиг. 3), изменение температуры культивирования бактерий Serratia marcescens с митомицином С (столбец 3) заметно влияет на нуклеазную активность (столбцы 5, 6, 7).
Так, при температуре 37°С нуклеазная активность заявленного технического решения больше, чем у прототипа, в 80,4 раза (Вариант 2).
При температуре 32°С нуклеазная активность заявленного технического решения больше, чем у прототипа, в 133,0 раза (Вариант 3).
При температуре 30°С нуклеазная активность заявленного технического решения больше, чем у прототипа, в 104,8 раза (Вариант 4).
Таким образом, по результатам проведенного эксперимента (Пример 3, Таблица 3 на Фиг. 3) установлено, что изменение температуры культивирования бактерий в интервале температур, соответствующих физиологическим значениям, но не ниже 30°С, с аэрированием среды, приводит к дополнительному повышению биосинтеза нуклеазы, что подтверждается увеличением нуклеазной активности по сравнению с прототипом более, чем в 80 раз. При этом наибольшую нуклеазную активность наблюдают при температуре 32°С (в 133,0 раза больше, чем у прототипа).
Пример 4. Определение влияния срока культивирования бактерий Serratia marcescens с митомицином С при 37°С на биосинтез нуклеазы при повышенной степени аэрации среды (Таблица 4 на Фиг. 4).
Питательную среду LB в конических колбах засевают посевным материалом бактерий Serratia marcescens, как описано в Примере 1 и проводят культивирование бактерий, как описано в Примере 3. В середине экспоненциального роста культуры добавляют митомицин С в количестве 0,1 мг/л культуральной жидкости и затем делят бактериальную суспензию на 4 части. Каждую часть помещают в стерильную коническую колбу и продолжают культивировать бактерии Serratia marcescens при 37°С в условиях повышенной степени аэрации среды (перемешивание при 190-200 об/мин, соотношении объемов питательной среды и колбы 1:10) до фазы перехода к стационару или до середины стационарной фазы или до фазы позднего стационара или фазы отмирания, соответственно 6, или 14, или 18, или 22 часа (Таблица 4 на Фиг. 4, Варианты 2-5). Затем в каждом варианте опыта определяют активность нуклеазы, как описано в Примере 1. Полученные результаты сравнивают с результатом, полученным в условиях прототипа (Вариант 1).
Результаты приведены в Таблице 4 на Фиг. 4.
Таблица 4 состоит из восьми столбцов:
- в столбце 1 приведены номера вариантов опытов - Вариант 1 (прототип), Вариант 2, Вариант 3, Вариант 4 и Вариант 5 (заявленное техническое решение);
- в столбце 2 приведены способы культивирования - без аэрирования (Вариант 1 по прототипу) и с аэрированием (Вариант 2, Вариант 3, Вариант 4 и Вариант 5);
- в столбце 3 приведена температура инкубации, равная:
 30°С - Вариант 1 (прототип),
30°С - Вариант 1 (прототип),
 37°С - Вариант 2, Вариант 3, Вариант 4 и Вариант 5.
37°С - Вариант 2, Вариант 3, Вариант 4 и Вариант 5.
- в столбцах 4 и 5 приведено время инкубации и, соответственно, фазы остановки инкубации:
 8 час.(фаза перехода к стационару) - Вариант 1 (по прототипу),
8 час.(фаза перехода к стационару) - Вариант 1 (по прототипу),
 6 час.(фаза перехода к стационару) - Вариант 2,
6 час.(фаза перехода к стационару) - Вариант 2,
 14 час.(фаза середины стационара) - Вариант 3,
14 час.(фаза середины стационара) - Вариант 3,
 18 час.(фаза позднего стационара) - Вариант 4,
18 час.(фаза позднего стационара) - Вариант 4,
 22 час (фаза отмирания) - Вариант 5.
22 час (фаза отмирания) - Вариант 5.
- в столбцах 6 и 7 приведены значения нуклеазной активности в ед./мл и в %, соответственно;
- в столбце 7 приведена кратность увеличения нуклеазной активности заявленного технического решения по Варианту 2, Варианту 3, Варианту 4 и Варианту 5 по сравнению с прототипом по Варианту 1.
Как видно из результатов Таблицы 4 (Фиг. 4), при культивировании бактерий Serratia marcescens при 37°С увеличение времени инкубации (столбцы 4,5) приводит к повышению биосинтеза нуклеазы (столбцы 6, 7, 8).
Так, при времени инкубации 6 час (фаза перехода к стационару) нуклеазная активность заявленного технического решения больше, чем у прототипа, в 25,05 раз (Вариант 2).
При времени инкубации 14 час (фаза середины стационара) нуклеазная активность заявленного технического решения больше, чем при фазе перехода к стационару, в 5 раз, и больше, чем у прототипа, в 120,28 раз (Вариант 3).
При времени инкубации 18 час (фаза позднего стационара) нуклеазная активность заявленного технического решения больше, чем при фазе перехода к стационару, в 5 раз, и больше, чем у прототипа, в 133,33 раза (Вариант 4).
При времени инкубации 22 час (фаза отмирания) нуклеазная активность заявленного технического решения больше, чем при фазе перехода к стационару, в 5.5 раза, и больше, чем у прототипа, в 138,44 раз (Вариант 5).
Таким образом, из вышеизложенного можно сделать вывод, что в заявленном техническом решении увеличение времени инкубации с митомицином С от фазы перехода культуры к стационару до фазы отмирания приводит к увеличению биосинтеза нуклеазы бактериями Serratia marcescens. Это подтверждается повышением нуклеазной активности в 5-5,5 раз от фазы перехода к стационару (6 час) до фазы отмирания (22 час) и примерно в 120-138 раз по сравнению с прототипом (8 час без аэрирования).
Пример 5. Определение влияния количества митомицина С, добавленного к культуре бактерий Serratia marcescens, на биосинтез нуклеазы при 37°С и повышенной степени аэрации среды (Таблица 5 на Фиг. 5).
Питательную среду LB в конических колбах засевают посевным материалом бактерий Serratia marcescens, как описано в Примере 1 и проводят культивирование, как описано в Примере 3. В середине экспоненциального роста культуры бактериальную суспензию делят на части. Каждую часть помещают в стерильную коническую колбу, куда затем добавляют митомицин С из расчета 0,01- или 0,02- или 0,05- или 0,10- или 0,20-, или 0,50-, или 1,00 мг/л культуральной жидкости, соответственно (Таблица 5 на Фиг. 5, Вариант 2 - Вариант 8), и продолжают культивировать бактерии Serratia marcescens 20 ч (до фазы отмирания) при 37°С и повышенной степени аэрации среды (перемешивание при 190-200 об/мин, соотношение объемов колбы и среды 10:1). Затем определяют ферментативную активность, как описано в Примере 1. Вариант 1 соответствует культивированию бактерий Serratia marcescens в условиях прототипа, что описано в Примере 1.
Результаты приведены в Таблице 5 на Фиг. 5.
Таблица 5 состоит из восьми столбцов:
- в столбце 1 приведены номера вариантов опытов - Вариант 1 (прототип), Вариант 2 - Вариант 8 (заявленное техническое решение);
- в столбце 2 приведены способы культивирования - без аэрирования (Вариант 1 по прототипу) и с аэрированием (Вариант 2 - Вариант 8);
- в столбце 3 приведена температура инкубации, равная:
 30°С - Вариант 1 (прототип),
30°С - Вариант 1 (прототип),
 37°С - Вариант 2 - Вариант 8.
37°С - Вариант 2 - Вариант 8.
- в столбце 4 приведено время инкубации:
 8 час. - Вариант 1 (по прототипу),
8 час. - Вариант 1 (по прототипу),
 20 час. - Вариант 2 - Вариант 8.
20 час. - Вариант 2 - Вариант 8.
- в столбце 5 приведено количество митомицина в среде, мг/л:
 0,1 - Вариант 1 по прототипу,
0,1 - Вариант 1 по прототипу,
 0,01 - Вариант 2,
0,01 - Вариант 2,
 0,02 - Вариант 3,
0,02 - Вариант 3,
 0,05 - Вариант 4,
0,05 - Вариант 4,
 0,10 - Вариант 5,
0,10 - Вариант 5,
 0,20 - Вариант 6,
0,20 - Вариант 6,
 0,50 - Вариант 7,
0,50 - Вариант 7,
 1,00 - Вариант 8.
1,00 - Вариант 8.
- в столбцах 6 и 7 приведены значения нуклеазной активности в ед./мл и в %, соответственно;
- в столбце 7 приведена кратность увеличения нуклеазной активности заявленного технического решения по Варианту 2 - Варианту 8 по сравнению с прототипом по Варианту 1.
Как видно из результатов Таблицы 5 (Фиг. 5), при всех исследованных количествах митомицина С, добавляемого к бактериям Serratia marcescens в середине экспоненциального роста при 37°С и повышенной степени аэрации среды наблюдается увеличение биосинтеза нуклеазы по сравнению с прототипом.
Так, при добавлении митомицина С в количестве 0,01-1,00 мг/л культуральной жидкости (Вариант 2 - Вариант 8) биосинтез нуклеазы по сравнению с прототипом увеличивается в 14,23 - 192,32 раза. При этом максимальная нуклеазная активность наблюдается при 0,50 мг/л - кратность увеличения по сравнению с прототипом составляет 192,32 раза.
Следовательно, из вышеизложенного в Примере 5 и Таблице 5 на Фиг. 5 можно сделать вывод, что увеличение количества митомицина до 0,01-1,00 мг/л в заявленном техническом решении приводит к увеличению биосинтеза нуклеазы бактериями Serratia marcescens, что подтверждается повышением нуклеазной активности по сравнению с прототипом более чем в 14 раз.
Таким образом, анализ данных, приведенных в Таблицах 1-5 (Фиг. 1 - Фиг. 5), позволяет сделать следующие выводы:
- аэрирование среды, увеличивающее интенсивность аэрации в 3.8-9.7 раза по сравнению с условиями прототипа, приводит к увеличению нуклеазной активности в среде в 10,9-15,4 раза (Фиг. 1, Таблица 1, Варианты 1-3);
- увеличение сроков инкубации культуры с митомицином С до позднего стационара приводит к повышению биосинтеза нуклеазы в 16,5 раз в случае культивирования без аэрирования среды (Фиг. 2, Таблица 2, Варианты 1-2) и почти в 7 раз при интенсивной аэрации, соответствующей 870 мг O2/л/час (Фиг. 2, Таблица 2, Варианты 3-4);
- изменение интенсивности аэрации в результате изменения температуры культивирования бактерий с аэрированием среды приводит к дополнительному повышению биосинтеза нуклеазы, например в 1,2 раза при 32°С (Фиг. 3, Таблица 3, Варианты 3-4);
- при 37°С, также как и при 30°С, продление сроков культивирования бактерий с митомицином С от перехода к стационарной фазе (Фиг. 4, Таблица 4, Вариант 2) до позднего стационара (Фиг. 4, Таблица 4, Вариант 4) или фазы отмирания (Фиг. 4, Таблица 4, Вариант 5) увеличивает нуклеазную активность в среде в 5-5,5 раза.
- добавление к культуре бактерий Serratia marcescens митомицина С в количестве 0,01-1,0 мг/л культуральной жидкости (Фиг. 5, Таблица 5, Варианты 2-8) в фазе экспоненциального роста приводит к повышению биосинтеза нуклеазы в 14-192 раза по сравнению с прототипом (Фиг. 5, Таблица 5, Вариант 1).
В целом из вышеизложенного можно сделать вывод, что заявителем решена поставленная задача и достигнут заявленный технический результат, а именно - разработан способ биосинтеза нуклеазы бактерий Serratia marcescens, основанный на глубинном культивировании с аэрированием среды, соответствующей скорости поглощения средой кислорода в количестве 340-870 мг/л/час, при этом культивирование проводят в присутствии митомицина С в течение 6-22 часов, при температуре до 37°С, что приводит к многократному увеличению биосинтеза нуклеазы Serratia marcescens по сравнению с прототипом.
Изменение условий культивирования по сравнению с условиями прототипа (Фиг. 1, Таблица 1, Вариант 1) позволяет увеличить степень аэрации питательной среды в 3,8-9,7 раза за счет проведения глубинного культивирования с непрерывным перемешиванием среды (Фиг. 1, Таблица 1, Варианты 2 и 3).
В конечном итоге, заявленное техническое решение приводит к увеличению количества синтезированной нуклеазы не менее, чем в 10 раз по сравнению с прототипом (Фиг. 1, Таблица 1, Вариант 1 - прототип и Вариант 2 - заявленное техническое решение), что, в свою очередь, позволяет многократно сократить объем исходного сырья, энергетических и трудовых ресурсов и в совокупности дает возможность его применения для получения нуклеазы бактерий Seratia marcescens в производственных масштабах.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. из исследованного уровня техники заявителем не выявлено технических решений, имеющих заявленную совокупность признаков.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в анализируемой области техники. Заявленное техническое решение позволяет решить, казалось бы, недостижимую проблему - обеспечить увеличение интенсивности биосинтеза нуклеазы бактерий Seratia marcescens не менее, чем в десять раз.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. может быть реализовано посредством использования известных компонентов с применением стандартного оборудования и известных приемов.
Перечень использованных источников
[1] Иванов А.В., Хисматуллина Н.А., Чернов А.Н., Юсупов Р.Х., Миронов А.Н., Гулюкин A.M., Филимонова М.Н. Препарат против бешенства // Патент РФ №2420309.
[2] Филимонова М.Н., Рассохина, И.А., Зайнутдинова Э.Ф., Нигматуллина Л.Ш. Антивирусный препарат контактного действия на основе "Бетадина" и эндонуклеазы // Патент РФ №2423136.
[3] Филимонова М.Н., Ершова Е.В., Сафин Ю.И., Тойменцева А.А., Шабаева Ю.Д., Сусарова А.Н., Валеев А.Р., Угрюмова В.С., Равилов А.З., Каримуллина И.Г., Фаткуллова А. А., Шишко А. А., Каримов М. 3. Антимикробный препарат // Патент РФ №2337139.
[4] Handbook of ELISPOT. Methods and Protocols / Ed. A. Kalyuzhny. N.Y.: Humana Press, 2005. 336 p.
[5] Детиненко Л.Д., Клименко В.П., Подгорный В.Ф., Аликин Ю.С., Масычева В.И., Гробов О.Ф., Батуев Ю.М. Средство «Эндоглюкин» для профилактики и лечения вирусных заболеваний пчел и стимуляции развития пчелиных семей // Патент РФ №2038776.
[6] Колпаков А.И., Горская Е.М.Дуприянова Ф.Г.,Лещинская И.Б., Бондаренко В.М. Способ получения биомассы бактерий // Патент РФ №2007450.
[7] Генкин Д. Д., Тец В. В. Способ профилактики и коррекции изменений кожи. // Патент РФ №2258530.
[8] Ball Т.К., Saurugger P.N., Benedik M.J. The extracellular nuclease gene of Serratia marcescens and its secretion from Escherichia coli // Gene. - 1987. - V. 57. - P. 183-192.
[9] Юсупова Д.В. В кн. Нуклеодеполимеразная активность бактерий в связи с некоторыми особенностями их физиологии. Под. ред М.И. Беляева. Изд. Казанского универститета, Казань, 1978 г. С. 81.
[10] П.И. Николаев. Аэрация при культивировании микроорганизмов. В кн. Промышленная микробиология. Под ред. Н.С. Егорова. Изд. «Высшая школа», Москва, 1989 г. С. 139.
[11] Н.С.Егоров «Основы учения об антибиотиках». Изд. «Высшая школа», Москва, 1969. С. 108-112.
[12] Юсупова Д.В., Соколова Р.Б., Порфирьева О.В., Пономарева А.З. Индукция синтеза внеклеточной эндонуклеазы Serratia marcescens агентами, подавляющими репликацию ДНК // Микробиология, 1991, Т.60, вып. 2, Стр. 279-284.
[13] Ball Т., Wasmuth С., Braunagel С., Benedik M. Expression of Serratia marcescens extracellular proteins requires rec A. Journal of Bacteriology, 1990, p. 324-349.
[14] Панфилова З.И., Дужак А.Б., Салганик Р.И. Штамм бактерий Serratia marcescens - продуцент хитиназыю // Патент РФ №2026348.
[15] Дужак А.Б., Панфилова З.И., Васюнина Е.А. Способ культивирования бактерий Serratia marcescens, продуцент хитиназы //Патент РФ 2241744.
[16] Авт. Св. СССР №230052, 1967 г.
[17] Беляева М.И., Юсупова Д.В., Гарейшина А. // Авт. Св. СССР №340691, Питательная среда для выращивания Serratia marcescens 44 - продуцента нуклеазы. 1970 г.
[18] Юсупова Д.В., Соколова Р.Б., Виестуре З.А. Питательная среда для выращивания Serratia marcescens 24 - продуцента нуклеазы. // Авт. Св. СССР 992568.
[19] Старшинова Н.В., Филимонова М. Н. Особенности биосинтеза нуклеазы и роста Serratia marcescens в присутствии 2-(пара-аминобензолсульфамидо) - тиазола // Микробиология. - 2005. - Т. 74, №2. - С. 1-5.
[20] Практикум по микробиологии, под ред. Н.С. Егорова, Изд. Московского университета, стр. 52-53, 1976 г.
[21] Юсупова Д.В., Соколова Р.Б., Пономарева А.З. Влияние митомицина на биосинтез внеклеточной эндонуклеазы Serratia marcescens// Антибиотики и химиотерапия, 1990, Т. 35, №2, С. 13-15.
[22] Лещинская И.Б., Балабан Н.П., Егорова Г.С., Таняшин В.И., Третьяк Т.М. Получение и характеристика высокоочищенного препарата Serratia marcescens //Биохимия, 1974, Т. 39, №1, С. 116-122.
Способ биосинтеза нуклеазы бактерий Serratia marcescens, заключающийся в том, что в период экспоненциального роста бактерий Serratia marcescens на среде LB добавляют митомицин С в количестве 0,01-1,0 мг/л культуральной жидкости, отличающийся тем, что культивирование проводят 6-22 часа с митомицином С в условиях повышенной степени аэрации среды в диапазоне 340-870 мг О/л/час, что достигается ее аэрированием при глубинном культивировании при повышении температуры до 37°C.